SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
|
|
|
- Miloslav Dostál
- před 6 lety
- Počet zobrazení:
Transkript
1 SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU Eligard 45 mg prášok a rozpúšťadlo na injekčný roztok 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Jedna injekčná striekačka naplnená práškom na injekčný roztok obsahuje 45 mg leuprorelíniumacetátu, čo zodpovedá 41,7 mg leuprorelínu. Úplný zoznam pomocných látok, pozri časť LIEKOVÁ FORMA Prášok a rozpúšťadlo na injekčný roztok. Prášok (injekčná striekačka B): Striekačka naplnená bielym až sivobielym práškom. Rozpúšťadlo (injekčná striekačka A): Striekačka naplnená čírym, bezfarebným až svetložltým roztokom. 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikácie Eligard 45 mg je indikovaný na liečbu pokročilého hormonálne závislého karcinómu prostaty a na liečbu vysoko rizikového lokálneho a lokálne pokročilého karcinómu prostaty v kombinácii s rádioterapiou. 4.2 Dávkovanie a spôsob podávania Dávkovanie Dospelí muži Eligard 45 mg sa má podávať pod dohľadom zdravotníckeho pracovníka odborne kvalifikovaného na sledovanie odpovede na liečbu. Eligard 45 mg sa podáva ako jednorazová podkožná injekcia každých 6 mesiacov. Injektovaný roztok vytvára pevný liekový depot a zabezpečuje kontinuálne uvoľňovanie leuprorelíniumacetátu počas šesťmesačného obdobia. Zvyčajne platí, že terapia pokročilého karcinómu prostaty Eligardom 45 mg je dlhodobá a liečba sa nemá ukončiť, ak dôjde k remisii alebo zlepšeniu. Eligard 45 mg je možné použiť, ako neoadjuvantnú alebo adjuvantnú liečbu v kombinácii s rádioterapiou u vysoko rizikového lokalizovaného a lokálne pokročilého karcinómu prostaty. 1
2 Odozva na liečbu Eligardom 45 mg sa má sledovať prostredníctvom klinických parametrov a meraním hladiny špecifického prostatického antigénu (PSA) v sére. Klinické skúšania ukázali, že u väčšiny pacientov bez orchiektómie hladiny testosterónu vzrástli počas prvých 3 dní liečby a v priebehu ďalších 3 4 týždňov liečby klesli pod úroveň hladín kastrátov. Po dosiahnutí úrovne kastrátov sa tieto hodnoty udržali počas celej dĺžky trvania liečby (< 1.0 % výkyvy hladiny testosterónu). Ak nie je reakcia pacienta úplne optimálna, má sa overiť, či sa dosiahli hladiny sérového testosterónu alebo pretrvávajú na úrovni kastrátov. Keďže následkom nesprávnej prípravy, rekonštitúcie alebo podania môže byť nedostačujúca účinnosť, v prípade podozrenia na chybu alebo v prípade zistenia chyby pri podaní je potrebné sledovať hladiny testosterónu (pozri časť 4.4). U pacientov s metastatickým kastračne rezistentným karcinómom prostaty, ktorí neboli chirurgicky kastrovaní, sú liečení agonistom GnRH, napríklad leuprorelínom, a sú vhodní na liečbu inhibítormi androgénnej biosyntézy alebo inhibítormi androgénnych receptorov, sa môže pokračovať v liečbe agonistom GnRH. Pediatrická populácia Bezpečnosť a účinnosť u detí vo veku 0 až 18 rokov neboli doteraz stanovené (pozri tiež časť 4.3). Špecifické skupiny pacientov Neboli vykonané žiadne klinické skúšania u pacientov s poruchou funkcie obličiek alebo pečene. Spôsob podávania Eligard 45 mg majú pripravovať, rekonštituovať a podávať len zdravotnícki pracovníci, ktorí sú oboznámení s postupom. Pozri časť 6.6: Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom. Liek nesmie byť podaný, ak nie je pripravený správne. Obsah dvoch naplnených sterilných injekčných striekačiek musí byť zmiešaný bezprostredne pred podaním Eligardu 45 mg formou podkožnej injekcie. Ako vyplýva z údajov zo štúdií na zvieratách, je nutné, aby sa injekcia nepodávala intraarteriálne alebo intravenózne. Tak ako aj pri iných liekoch podávaných podkožnou injekciou, miesta vpichu sa majú pravidelne meniť. 4.3 Kontraindikácie Eligard 45 mg je kontraindikovaný u žien a pediatrickej populácie. Precitlivenosť na leuprorelíniumacetát na iné agonisty GnRH alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. U pacientov, ktorí v minulosti podstúpili orchiektómiu (tak ako iné agonisty GnRH, ani Eligard 45 mg nespôsobuje ďalší pokles sérového testosterónu v prípade chirurgickej kastrácie). Ako monoterapia u pacientov s karcinómom prostaty s tlakom na miechu alebo preukázanými metastázami v chrbtici (pozri tiež časť 4.4). 4.4 Osobitné upozornenia a opatrenia pri používaní Správna rekonštitúcia: V dôsledku nesprávnej rekonštitúcie lieku môže dôjsť k nedostatočnému klinickému účinku. Pozri časť 4.2 a časť 6.6 pre návod na prípravu a podanie lieku a pre sledovanie hladiny testosterónu v prípade podozrenia na chybu alebo zistenia chyby pri zaobchádzaní s liekom. 2
3 Androgénová deprivačná liečba môže predlžovať QT interval: Pred začiatkom liečby Eligardom 45 mg má lekár zvážiť pomer prínosu a rizika, vrátane rizika Torsade de pointes, u pacientov s rizikovými faktory na predĺženie QT intervalu v anamnéze a u pacientov súbežne užívajúcich lieky, ktoré môžu predlžovať QT interval (pozri časť 4.5). Kardiovaskulárne ochorenia: U mužov bolo v súvislosti s používaním agonistov GnRH hlásené zvýšené riziko vzniku infarktu myokardu, náhlej srdcovej smrti a mŕtvice. Na základe hlásenej miery pravdepodobnosti sa riziko výskytu zdá byť nízke a pri rozhodovaní o liečbe pacientov s karcinómom prostaty sa má hodnotiť dôkladne súčasne s kardiovaskulárnymi rizikovými faktormi. U pacientov užívajúcich agonisty GnRH sa majú sledovať príznaky a prejavy naznačujúce rozvoj kardiovaskulárnych ochorení a pacienti majú byť manažovaní v súlade so súčasnými klinickými odporúčaniami. Prechodné zvýšenie testosterónu: Leuprorelíniumacetát, rovnako ako iné agonisty GnRH, spôsobuje počas prvého týždňa liečby prechodné zvýšenie sérových koncentrácií testosterónu, dihydrotestosterónu a kyslej fosfatázy. Pacienti môžu pociťovať zhoršenie existujúcich symptómov alebo objavenie sa nových symptómov, vrátane bolesti v kostiach, neuropatie, hematúrie či obštrukcie močovodu alebo vývodu močového mechúra (pozri časť 4.8). Tieto symptómy zvyčajne ustúpia počas pokračovania v liečbe. Má sa zvážiť dodatočné podávanie príslušného antiandrogénu tri dni pred začiatkom liečby leuprorelínom a počas prvých dvoch až troch týždňov liečby. Bolo hlásené, že takýto postup predchádza následkom úvodného zvýšenia hladiny sérového testosterónu. Terapia Eligardom 45 mg po chirurgickej kastrácii nevedie u mužských pacientov k ďalšiemu zníženiu hladín sérového testosterónu. Hustota kostí: Lekárska literatúra uvádza zníženú hustotu kostí u mužov s orchiektómiou alebo u mužov liečených agonistom GnRH (pozri časť 4.8). Antiandrogénová terapia významne zvyšuje riziko fraktúr z dôvodu osteoporózy. Pre tento jav sú dostupné len obmedzené údaje. Fraktúry z dôvodu osteoporózy boli pozorované u 5 % pacientov po 22 mesiacoch farmakologickej androgénovej deprivačnej liečby a u 4 % pacientov po 5 až 10 rokoch liečby. Riziko fraktúr z dôvodu osteoporózy je zvyčajne vyššie ako riziko patologických fraktúr. Okrem dlhotrvajúcej testosterónovej nedostatočnosti vplývajú na rozvoj osteoporózy aj vyšší vek, fajčenie, užívanie alkoholických nápojov, obezita a nedostatočná fyzická aktivita. Apoplexia hypofýzy: Počas sledovania lieku po jeho uvedení na trh bola v zriedkavých prípadoch hlásená apoplexia hypofýzy (klinický syndróm súvisiaci s infarktom hypofýzy), vyskytujúca sa prevažne v priebehu 2 týždňov a v niektorých prípadoch počas prvej hodiny po prvom podaní agonistov GnRH. V týchto prípadoch sa apoplexia hypofýzy prejavila ako prudké bolesti hlavy, vracanie, poruchy videnia, oftalmoplégia, zmenami psychického stavu a v niektorých prípadoch kardiovaskulárnym kolapsom. Vyžaduje sa neodkladná lekárska starostlivosť. Hyperglykémia a diabetes: Hyperglykémia a zvýšené riziko vzniku diabetu boli hlásené u mužov, ktorí dostávali agonisty GnRH. Hyperglykémia môže byť prejavom rozvoja diabetes mellitus alebo zhoršenia kontroly glykémie u pacientov s diabetom. U pacientov liečených agonistami GnRH sa majú pravidelne sledovať hladiny glukózy a / alebo glykovaného hemoglobínu (HbA1c) v krvi a postupovať v súlade so súčasnými odporúčaniami pre liečbu hyperglykémie alebo diabetu. Kŕče: Po uvedení lieku na trh boli zaznamenané hlásenia o výskyte kŕčov u pacientov liečených leuprorelíniumacetátom, u ktorých boli alebo neboli predispozičné faktory v anamnéze. Pri výskyte kŕčov sa má postupovať podľa aktuálnej klinickej praxe. Iné prípady: Pri liečbe agonistami GnRH boli pozorované prípady obštrukcie močovodu a kompresie miechy, ktoré sa môžu podieľať na paralýze s fatálnymi komplikáciami alebo bez nich. Ak sa objavia komplikácie, ako kompresia miechy alebo porucha funkcie obličiek, má sa začať s ich štandardnou liečbou. 3
4 Pacienti s vertebrálnymi metastázami a/alebo metastázami v mozgu rovnako ako pacienti s obštrukciou močových ciest majú byť dôkladne sledovaní počas prvých týždňov liečby. 4.5 Liekové a iné interakcie S Eligardom 45 mg sa neuskutočnili žiadne farmakokinetické interakčné skúšania. Neexistujú žiadne hlásenia o interakcii leuprorelíniumacetátu s inými liekmi. Pre súvislosť androgénovej deprivačnej liečby s predĺžením QT intervalu sa má dôkladne zvážiť súbežné používanie Eligardu 45 mg s liekmi, o ktorých je známe, že predlžujú QT interval alebo liekmi, ktoré môžu vyvolať Torsade de pointes, ako antiarytmiká triedy I A (napr. chinidín, disopyramid), triedy III (napr. amiodarón, sotalol, dofetilid, ibutilid), metadón, moxifloxacín, antipsychotiká a ďalšie (pozri časť 4.4). 4.6 Fertilita, gravidita a laktácia Neaplikovateľné, keďže Eligard 45 mg je kontraindikovaný u žien. 4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje Neuskutočnili sa žiadne klinické skúšania o účinkoch Eligardu 45 mg na schopnosť viesť vozidlá a obsluhovať stroje. Schopnosť viesť vozidlá a obsluhovať stroje môže byť narušená pre únavu, závraty a poruchy videnia, čo sú možné vedľajšie účinky liečby alebo následky základného ochorenia. 4.8 Nežiaduce účinky Vedľajšie účinky pozorované počas liečby Eligardom sú väčšinou spôsobené špecifickým farmakologickým pôsobením liečiva leuprorelín, ktoré spôsobuje najmä zvýšenie a zníženie hladín určitých hormónov. Veľmi často hlásenými vedľajšími účinkami sú návaly tepla, nauzea, malátnosť, únava a dočasné lokálne podráždenie v mieste vpichu. Slabé alebo stredne silné návaly tepla sa vyskytujú približne u 58 % pacientov. Prehľad nežiaducich účinkov zoradených do tabuľky Počas klinických skúšaní s Eligardom boli u pacientov s pokročilým karcinómom prostaty pozorované nasledujúce nežiaduce účinky. Nežiaduce účinky sú klasifikované podľa frekvencie výskytu ako veľmi ( 1/10), ( 1/100 až <1/10), ( 1/1 000 až <1/100), zriedkavé ( 1/ až <1/1 000) a veľmi zriedkavé (<1/10 000), neznáme (z dostupných údajov). Tabuľka č. 1: Nežiaduce účinky v klinických skúšaniach s Eligardom Infekcie a nákazy Poruchy metabolizmu a výživy Psychické poruchy Poruchy nervového systému zápal sliznice nosohltana infekcia močovej sústavy, lokálne infekcie kože zhoršenie diabetes mellitus abnormálne sny, depresia, zníženie pohlavnej túžby závrat, bolesť hlavy, hypoestézia, insomnia, poruchy vnímania chuti, poruchy čuchu, vertigo zriedkavé abnormálne mimovoľné pohyby Poruchy srdca a srdcovej činnosti neznáme predĺženie QT intervalu (pozri časti 4.4 a 4.5) Poruchy ciev veľmi návaly tepla hypertenzia, hypotenzia 4
5 zriedkavé Poruchy dýchacej sústavy, hrudníka a mediastína neznáme Poruchy gastrointestinálneho traktu zriedkavé Poruchy kože a podkožného tkaniva veľmi zriedkavé Poruchy kostrovej a svalovej sústavy a spojivového tkaniva Poruchy obličiek a močových ciest Poruchy reprodukčného systému a prsníkov zriedkavé Celkové poruchy a reakcie v mieste podania veľmi zriedkavé veľmi zriedkavé Poruchy krvi a lymfatického systému Laboratórne a funkčné vyšetrenia synkopa, kolaps rinorea, dyspnoe intersticiálne ochorenie pľúc nauzea, hnačky, gastroenteritída/kolitída zápcha, sucho v ústach, vracanie, dyspepsia flatulencia, eruktácia ekchymóza, erytém pruritus, nočné potenie lepkavosť, zvýšené potenie alopécia, kožné vyrážky artralgia, bolesť končatín, myalgia, zimnica, slabosť bolesť chrbta, svalové kŕče znížená frekvencia močenia, ťažkosti s močením, dyzúria, noktúria, oligúria spazmus močového mechúra, hematúria, zvýšená frekvencia močenia, retencia moču citlivosť prsníkov, atrofia semenníkov, bolesť v semenníkoch, neplodnosť, hypertrofia prsníkov, erektilná dysfunkcia, zmenšená veľkosť penisu gynekomastia, impotencia, porucha semenníkov bolesť v prsníkoch únava, pálenie v mieste vpichu, parestézia v mieste vpichu malátnosť, bolesť v mieste vpichu, hematóm v mieste vpichu, štípanie v mieste vpichu, svrbenie v mieste vpichu, zatvrdnutie v mieste vpichu, letargia, bolesť, pyrexia ulcerácia v mieste vpichu nekróza v mieste vpichu hematologické zmeny, anémia zvýšená kreatinín-fosfokináza v krvi, predĺžený čas koagulácie zvýšená alanín-aminotransferáza, zvýšené triacylglyceridy v krvi, predĺžený protrombínový čas, zvýšená hmotnosť Ďalšie nežiaduce účinky zvyčajne hlásené v spojitosti s podávaním liečiva leuprorelíniumacetát zahŕňajú periférny edém, embóliu pľúc, palpitácie, bolesť svalov, zmenu v citlivosti kože, svalovú slabosť, triašku, kožný výsev (raš), amnéziu a poruchy videnia. Atrofia svalov bola pozorovaná pri dlhodobom podávaní liekov tejto skupiny. Zriedkavo bol po podaní krátkodobo alebo dlhodobo účinných agonistov GnRH pozorovaný infarkt v mieste apoplexie hypofýzy. Zriedkavo sa pozorovala trombocytopénia a leukopénia. Pozorovali sa zmeny v glukózovej tolerancii. 5
6 Po podaní analógu agonistu GnRH boli hlásené kŕče (pozri časť 4.4). Lokálne nežiaduce účinky hlásené po podaní injekcie Eligardu sú typické reakcie, často sa vyskytujúce pri rovnakých typoch podkožne injektovaných liekov. Zvyčajne sú tieto lokálne nežiaduce účinky po podaní podkožnej injekcie mierne a majú krátke trvanie. Anafylaktické/anafylaktoidné reakcie boli zriedkavo hlásené po podaní analógu agonistu GnRH. Zmeny v hustote kostí Znížená hustota kostí bola v odbornej literatúre hlásená u mužov po orchiektómii alebo u mužov, ktorí boli liečení agonistami GnRH. Je možné predpokladať, že dlhodobá liečba leuprorelíniumacetátom môže vykazovať nárast príznakov osteoporózy. Podrobnejšie informácie týkajúce sa zvýšeného rizika fraktúr z dôvodu osteoporózy (pozri časť 4.4). Exacerbácia prejavov a príznakov ochorenia Liečba leuprorelínom môže počas prvých týždňov liečby spôsobiť exacerbáciu prejavov a príznakov ochorenia. Ak dôjde k zhoršeniu stavu, napríklad metastáz v chrbtici a/alebo obštrukcii močovej sústavy či hematúrii, môžu nastať neurologické komplikácie, akými sú slabosť a/alebo parestézia dolných končatín alebo zhoršenie symptómov močovej sústavy. Hlásenie podozrení na nežiaduce reakcie Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na Štátny ústav pre kontrolu liečiv, Sekcia klinického skúšania liekov a farmakovigilancie, Kvetná ul. 11, SK Bratislava 26, Tel: , Fax: , neziaduce.ucinky@sukl.sk. Tlačivo na hlásenie nežiaduceho účinku je na webovej stránke v časti Lieky/Bezpečnosť liečiv. Formulár na elektronické podávanie hlásení: Predávkovanie Možnosť zneužitia a úmyselné predávkovanie sú v prípade Eligardu 45 mg málo pravdepodobné. Z klinickej praxe neboli hlásené prípady predávkovania leuprorelínom alebo jeho zneužitia, ak však dôjde k nadmernej expozícii, odporúča sa pozorovanie pacienta a podporná symptomatická liečba. 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1 Farmakodynamické vlastnosti Farmakoterapeutická skupina: Analógy hormónu uvoľňujúceho gonadotropín ATC kód: L02A E02 Leuprorelíniumacetát je syntetický, nonapeptidový analóg prirodzene sa vyskytujúceho gonadotropínuvoľňujúceho hormónu (GnRH), ktorý pri kontinuálnom podávaní inhibuje sekréciu gonadotropínov a potláča testikulárnu steroidogenézu u mužov. Po prerušení terapie liekom je tento účinok reverzibilný. Hoci má agonista väčší účinok ako prirodzený hormón, čas obnovenia hladín testosterónu môže byť u pacientov rôzny. Podávanie leuprorelíniumacetátu vyvoláva počiatočné zvýšenie cirkulujúcich hladín luteinizačného hormónu (LH) a folikulostimulačného hormónu (FSH), čo vedie k prechodnému zvýšeniu hladín gonádových steroidov, testosterónu a dihydrotestosterónu u mužov. Kontinuálne podávanie leuprorelíniumacetátu vedie k zníženiu hladín LH a FSH. U mužov sa hladina testosterónu zníži pod hranicu kastrátov ( 50 ng/dl). K tomuto poklesu dôjde v priebehu 3 až 4 týždňov po začatí liečby. Priemerné hladiny testosterónu sú po 6 mesiacoch 10,4 (± 0,53) ng/dl, čo je porovnateľné s hladinami po bilaterálnej orchiektómii. S výnimkou jedného pacienta dosiahli všetci pacienti, ktorí v pivotnom klinickom skúšaní dostali plnú dávku 45 mg leuprorelínu, hladiny kastrátov do 4 týždňov. U prevažnej 6
7 väčšiny pacientov boli pozorované hodnoty hladiny testosterónu pod 20 ng/dl, aj keď celkový prínos týchto nízkych hladín ešte nebol stanovený. Hodnoty PSA poklesli v priebehu 6 mesiacov o 97 %. Dlhodobé skúšania preukázali, že pokračovanie v liečbe udržuje testosterón pod úrovňou kastrátov až 7 rokov, resp. pravdepodobne neobmedzene. Počas programu klinických skúšaní nebola priamo meraná veľkosť tumorov, ale zistila sa nepriama prospešná odozva na liečbu, čo dokazuje 97 % pokles priemerného PSA pri užívaní Eligardu 45 mg. Vo fáze III randomizovaného klinického skúšania zahŕňajúceho 970 pacientov s lokálne pokročilým karcinómom prostaty (najmä pacientov T2c - T4 a niekoľko pacientov T1c až T2b s patologickým ochorením regionálnych uzlín), z ktorých 483 bolo zaradených do skupiny s krátkodobou androgénnou deprivačnou terapiou (6 mesiacov) v kombinácii s rádioterapiou a 487 do dlhodobej liečby (3 roky), analýza non-inferiority porovnávala krátkodobú konkomitantnú a adjuvantnú hormonálnu liečbu agonistom GnRH (triptorelín alebo goserelín) voči dlhodobej liečbe. Celková 5 ročná mortalita bola 19,0 % v krátkodobej skupine a 15,2 % v dlhodobej skupine. Pozorovaný pomer rizík 1,42 s horným jednostranným 95,71 % intervalom spoľahlivosti 1,79 alebo obojstranným 95,71 % intervalom spoľahlivosti 1,09; 1,85 (p = 0,65 pre non-inferioritu), ukazujú, že kombinácia rádioterapie so šesť-mesačnou androgénnou depriváciou poskytuje kratšie prežívanie v porovnaní s rádioterapiou spolu s 3 roky trvajúcou androgénnou depriváciou. Celkové prežívanie po 5 rokoch dlhodobej liečby je 84,8 % a prežívanie po krátkodobej liečbe je 81,0 %. Celková kvalita života pri použití dotazníka QLQ-C30 sa významne nelíšila medzi týmito dvoma skupinami (P = 0,37). Výsledky sú dominantné pre skupinu pacientov s lokálne pokročilými nádormi. Dôkazy pre indikáciu u vysoko rizikového lokalizovaného karcinómu prostaty sú založené na publikovaných štúdiách rádioterapie kombinovanej s analógmi GnRH, vrátane leuprorelíniumacetátu. Boli analyzované klinické dáta z 5 publikovaných skúšaní (EORTC 22863, RTOG 85-31, RTOG 92-02, RTOG 8610 a D'Amico a kolektív, JAMA, 2004), ktoré všetky preukazujú prínos kombinácie analógov GnRH a rádioterapie. Pre indikácie lokálne pokročilého karcinómu prostaty a vysoko rizikového lokalizovaného karcinómu prostaty nebolo možné v publikovaných štúdiách jasne rozlíšiť príslušné skúšané skupiny. Klinické údaje ukázali, že rádioterapia a následná 3-ročná androgénna deprivácia je vhodnejšia ako rádioterapia s následnou 6-mesačnou androgénnou depriváciou. Podľa štandardných liečebných postupov, je pre pacientov T3 - T4 liečených rádioterapiou odporúčaná dĺžka liečby formou androgénnej deprivácie 2-3 roky. 5.2 Farmakokinetické vlastnosti Absorpcia: U pacientov s pokročilým karcinómom prostaty stúpajú priemerné sérové koncentrácie leuprorelínu po úvodnej injekcii na 82 ng/ml do 4,4 hod. (C max ) po podaní injekcie. Sérové hladiny zostávali relatívne konštantné (0,2 2 ng/ml) po počiatočnom zvýšení, ktoré nasleduje po každej injekcii (plató fáza od dní po každej dávke). Nie sú žiadne dôkazy o akumulácii po opakovanom podávaní. Distribúcia: Priemerný rovnovážny objem distribúcie leuprorelínu po intravenóznom bolusovom podaní bol u zdravých mužských dobrovoľníkov 27 litrov. Väzba in vitro na proteíny ľudskej plazmy sa pohybovala od 43 % do 49 %. Eliminácia: U zdravých mužských dobrovoľníkov bolus 1 mg leuprorelíniumacetátu podaný intravenózne ukázal, že priemerný systémový klírens je 8,34 l/h s konečným polčasom eliminácie približne 3 hodiny na základe dvojkompartmentového modelu. Neboli vykonané žiadne skúšania zamerané na exkréciu Eligardu. Neboli vykonané skúšania zamerané na metabolizmus Eligardu. 5.3 Predklinické údaje o bezpečnosti 7
8 Predklinické skúšania s leuprorelíniumacetátom odhalili u oboch pohlaví účinky na reprodukčný systém, ktoré sa očakávali na základe známych farmakologických vlastností. Ukázalo sa, že tieto účinky sú reverzibilné po ukončení liečby a náležitom období regenerácie. Leuprorelíniumacetát nevykázal teratogenitu. Embryotoxicita/letalita bola pozorovaná u králikov v súlade s farmakologickými účinkami leuprorelíniumacetátu na reprodukčný systém. Štúdie karcinogenity sa vykonali u potkanov a myší počas 24 mesiacov. U potkanov bol po podkožnom podaní dávok od 0,6 do 4 mg/kg/deň pozorovaný vyšší výskyt apoplexie hypofýzy v závislosti od dávky. Takýto účinok nebol pozorovaný u myší. Leuprorelíniumacetát a príbuzný jednomesačný liek Eligard 7,5 mg nevykázali mutagénny potenciál v sérii skúšaní in vitro a in vivo. 6. FARMACEUTICKÉ INFORMÁCIE 6.1 Zoznam pomocných látok Rozpúšťadlo (injekčná striekačka A): polyglaktín (85:15) N - metylpyrolidón Prášok (injekčná striekačka B): Žiadne 6.2 Inkompatibility Leuprorelín prítomný v injekčnej striekačke B sa smie zmiešať len s rozpúšťadlom v injekčnej striekačke A, nesmie sa zmiešať s inými liekmi. 6.3 Čas použiteľnosti 2 roky Keď už liek vyberiete z chladničky, môže byť skladovaný v pôvodnom balení pri izbovej teplote (do 25 C) počas štyroch týždňov. Prášok a rozpúšťadlo na injekčný roztok sa má zmiešať a podať pacientovi ihneď po prvom otvorení vaničky. Po rekonštitúcii: ihneď použite, keďže viskozita roztoku sa časom zvyšuje. 6.4 Špeciálne upozornenia na uchovávanie Uchovávajte v chladničke (2ºC - 8ºC); v pôvodnom obale na ochranu pred vlhkosťou. Liek musí mať pred podaním izbovú teplotu. Vyberte ho z chladničky približne 30 minút pred jeho použitím. Keď už liek vyberiete z chladničky, môže byť skladovaný v pôvodnom balení pri izbovej teplote (do 25 C) počas štyroch týždňov. 6.5 Druh obalu a obsah balenia Dve naplnené injekčné striekačky, jedna z cyklického olefínového kopolyméru obsahujúca prášok (injekčná striekačka B) a jedna z polypropylénu obsahujúca roztok (injekčná striekačka A). Obe injekčné striekačky tvoria spolu zmiešavací systém. Injekčná striekačka A má hrot piestu z termoplastovej gumy a je uzavretá polyetylénovým alebo polypropylénovým Luer-Lok viečkom. Hrot viečka injekčnej striekačky a dva hroty piestov injekčnej striekačky B sú z chlorobutylovej gumy. Dostupné sú nasledujúce veľkosti balenia: 8
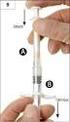
9 Balenie vo vaničke obsahuje dve zatavené vaničky v papierovom obale. Jedna vanička obsahuje naplnenú polypropylénovú injekčnú striekačku A, dlhý piest na injekčnú striekačku B a vrecko s vysušovadlom. Druhá vanička obsahuje naplnenú injekčnú striekačku B z cyklického olefínového kopolyméru, sterilnú ihlu s priemerom 18G a vrecko s vysušovadlom. Balenie obsahujúce súpravu s 2 x 2 naplnenými injekčnými striekačkami (1x injekčná striekačka A; 1x injekčná striekačka B). Na trh nemusia byť uvedené všetky veľkosti balenia. 6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom Vyberte liek z chladničky približne 30 minút pred jeho použitím a nechajte ho tak zohriať na izbovú teplotu. Prosím, najskôr pripravte pacienta na podanie injekcie, potom pripravte liek podľa nasledujúcich pokynov. Ak sa pri príprave lieku nepoužije správny postup, liek sa nemá podať, pretože v dôsledku nesprávnej rekonštitúcie lieku môže dôjsť k nedostatočnému klinickému účinku. Krok 1: Otvorte obidve vaničky (odtrhnite fóliu v rohu, kde je možné rozoznať malú bublinu) a vysypte obsah na čistú podložku (2 vaničky obsahujúce injekčnú striekačku A (obr. 1.1) a injekčnú striekačku B (obr. 1.2)). Vrecká s vysušovadlom vyhoďte. Krok 2: Z injekčnej striekačky B vytiahnite krátky modrý piest spolu so sivou gumenou zátkou; piest musí zostať neodskrutkovaný na zátke a vyhoďte ho (obr. 2.). Nezačnite s miešaním, pokiaľ sú v striekačke dve sivé zátky. Krok 3: Na sivú gumenú zátku, ktorá zostala v injekčnej striekačke B, jemne naskrutkujte dlhý biely piest (obr. 3). 9
10 Krok 4: Z injekčnej striekačky B odstráňte sivú gumenú zátku a striekačku položte (obr. 4). Krok 5: Striekačku A podržte vertikálne, aby jej obsah nemohol vytiecť, a odskrutkujte z nej priesvitné viečko (obr. 5). Krok 6: Konce injekčných striekačiek spojte tak, že ich k sebe jemne pritlačíte a priskrutkujete napevno (obr. 6a a 6b). Nepriťahujte príliš silno. Krok 7: Otočte spojené striekačky, tak aby bola striekačka B naspodku a držte ich vertikálne, Tekutý obsah striekačky A vstreknite do striekačky B, ktorá obsahuje prášok (leuprorelíniumacetát) (obr. 7). 10
11 Krok 8: Striekačky dajte do horizontálnej polohy. Liek dôkladne premiešavajte opatrným striedavým tlačením na piesty injekčných striekačiek (celkovo asi 60-krát, čo trvá asi 60 sekúnd), aby vznikol homogénny, viskózny roztok (obr. 8). Spojenými striekačkami netočte (mohlo by dôjsť k čiastočnému odskrutkovaniu a vytečeniu obsahu). Dôkladným premiešaním vznikne viskózny roztok, ktorý môže byť vo farebnej škále od bezfarebnej, po bielu až svetložltú (prípadne s bielym až svetložltým tieňovaním). Upozornenie: Po zmiešaní okamžite pokračujte v ďalšej fáze prípravy, pretože liek sa stáva časom viskóznejší. Liek po zmiešaní neuchovávajte v chladničke. Poznámka: Liek sa musí premiešať uvedeným spôsobom. Správne premiešanie NEDOSIAHNETE pretrepávaním. Krok 9: Injekčné striekačky dajte opäť do vertikálnej polohy, tak aby bola striekačka B naspodku. Injekčné striekačky musia zostať bezpečne spojené. Presuňte všetok premiešaný liek do injekčnej striekačky B (krátka, široká striekačka) zatlačením na piest striekačky A a jemným vyťahovaním piesta striekačky B (obr. 9). 11
12 Krok 10: Odskrutkujte striekačku A za stáleho tlaku na piest striekačky A (obr. 10). Zabezpečte, aby žiaden obsah nevytiekol, inak by ihla po nasadení dobre netesnila. Poznámka: V tekutine môže zostať jedna veľká bublina alebo niekoľko malých vzduchových bublín, čo je prijateľné. Prosím, neodstraňujte vzduchové bubliny v tejto fáze prípravy, lebo môže dôjsť k strate obsahu. Krok 11: Striekačku B držte kolmo nahor a pridržte biely piest, aby ste zabránili úniku lieku. Otvorte balenie ihly s ochranným krytom tak, že roztrhnete vonkajší papierový obal a ihlu vyberte. Nasaďte ju na koniec striekačky B a jemne pootočte v smere hodinových ručičiek, približne tri štvrtiny obrátky, pokým nebude ihla upevnená (obr. 11). Nepriťahujte príliš silno. Môže to spôsobiť prasknutie konektora ihly a následne únik lieku počas injekčného podania. Ak konektor ihly praskne, ak sa zdá, že je poškodený alebo ak liek vyteká, liek sa nemá použiť. Poškodená ihla sa nemá vymieňať/nahrádzať a liek sa nemá injekčne podať. Celý liek sa má bezpečne zlikvidovať. V prípade poškodenia konektora ihly sa má použiť ako náhrada nový liek. 12
13 Krok 12: Pred podaním injekcie odstráňte ochranné viečko ihly (obr. 12). Upozornenie: Neaktivujte ochranný (bezpečnostný) mechanizmus ihly pred podaním injekcie. Krok 13: Pred podaním injekcie, odstráňte niektoré veľké vzduchové bubliny zo striekačky B. Liek podajte subkutánne. Prosím, ubezpečte sa, že ste podali celý obsah striekačky B. Krok 14: Po podaní injekcie použite niektorý z nižšie uvedených spôsobov na aktiváciu ochranného krytu ihly. 1. Uzavretie o rovný povrch Pritlačte ohyb ochranného (bezpečnostného) krytu o rovný povrch (obr. 14.1a a b) aby ste zakryli ihlu a zafixovali ochranný kryt. Správne zafixovaná poloha sa dá overiť počuteľným kliknutím a dotykom, keď bude hrot ihly úplne zakrytý ochranným (bezpečnostným) krytom (obr. 14.1b). 13
14 2. Uzavretie palcom Pritlačte palec na ohyb ochranného krytu a posuňte smerom k hrotu ihly (obr. 14.2a a b), aby ste zakryli ihlu a zafixovali ochranný kryt. Správne zafixovaná poloha sa dá overiť počuteľným kliknutím a dotykom, keď bude hrot ihly úplne zakrytý ochranným (bezpečnostným) krytom (14.2b). Krok 15: Po uzavretí bezpečnostného krytu ihlu a striekačku ihneď vyhoďte do príslušného kontajnera na ostré predmety. 7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII Astellas Pharma s.r.o. Sokolovská 100/ Praha Česká republika 8. REGISTRAČNÉ ČÍSLO Reg. č.: 56/0473/07-S 14
15 9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE Dátum prvej registrácie: 23. novembra 2007 Dátum posledného predĺženia registrácie: 09. augusta DÁTUM REVÍZIE TEXTU 09/
Príloha III. Úpravy súhrnu charakteristických vlastností lieku, označenie na obale a písomná informácia je výsledkom postupu preskúmania.
 Príloha III Úprava príslušným častí súhrnu charakteristických vlastností lieku a písomnej informácii pre používateľa Poznámka: Úpravy súhrnu charakteristických vlastností lieku, označenie na obale a písomná
Príloha III Úprava príslušným častí súhrnu charakteristických vlastností lieku a písomnej informácii pre používateľa Poznámka: Úpravy súhrnu charakteristických vlastností lieku, označenie na obale a písomná
PRÍLOHA III DODATKY K SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNEJ INFORMÁCII PRE POUŽÍVATEĽOV
 PRÍLOHA III DODATKY K SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNEJ INFORMÁCII PRE POUŽÍVATEĽOV Tieto zmeny v SPC a písomnej informácii pre používateľov sú platné v čase Rozhodnutia Komisie. Po
PRÍLOHA III DODATKY K SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNEJ INFORMÁCII PRE POUŽÍVATEĽOV Tieto zmeny v SPC a písomnej informácii pre používateľov sú platné v čase Rozhodnutia Komisie. Po
ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV
 ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV 25 PRÍLOHY K DOPLNENIU RELEVANTNÝCH SEKCII SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU LIEKOV OBSAHUJÚCICH
ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV 25 PRÍLOHY K DOPLNENIU RELEVANTNÝCH SEKCII SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU LIEKOV OBSAHUJÚCICH
(tolkapón) tablety DENNÍK PACIENTA. Pomôže vám dodržiavať pravidelné vyšetrenia funkcie pečene počas prvého roku užívania
 (tolkapón) tablety DENNÍK PACIENTA Pomôže vám dodržiavať pravidelné vyšetrenia funkcie pečene po prvého roku užívania INFORMÁCIE O PACIENTOVI 03 PRED UŽITÍM TASMARU SI, PROSÍM, PREČÍTAJTE NASLEDOVNÉ INFORMÁCIE
(tolkapón) tablety DENNÍK PACIENTA Pomôže vám dodržiavať pravidelné vyšetrenia funkcie pečene po prvého roku užívania INFORMÁCIE O PACIENTOVI 03 PRED UŽITÍM TASMARU SI, PROSÍM, PREČÍTAJTE NASLEDOVNÉ INFORMÁCIE
NÁZOV, FARMACEUTICKÁ FORMA, MNOŽSTVO ÚČINNÝCH LÁTOK V LIEKU, SPÔSOB PODÁVANIA, UCHÁDZAČ, DRŽITEĽ ROZHODNUTIA O REGISTRÁCII V ČLENSKÝCH ŠTÁTOCH
 PRÍLOHA I NÁZOV, FARMACEUTICKÁ FORMA, MNOŽSTVO ÚČINNÝCH LÁTOK V LIEKU, SPÔSOB PODÁVANIA, UCHÁDZAČ, DRŽITEĽ ROZHODNUTIA O REGISTRÁCII V ČLENSKÝCH ŠTÁTOCH 1 LIEKY OBSAHUJÚCE JÓDKAZEÍN/TIAMÍN S UDELENÝM POVOLENÍM
PRÍLOHA I NÁZOV, FARMACEUTICKÁ FORMA, MNOŽSTVO ÚČINNÝCH LÁTOK V LIEKU, SPÔSOB PODÁVANIA, UCHÁDZAČ, DRŽITEĽ ROZHODNUTIA O REGISTRÁCII V ČLENSKÝCH ŠTÁTOCH 1 LIEKY OBSAHUJÚCE JÓDKAZEÍN/TIAMÍN S UDELENÝM POVOLENÍM
Informácie o liečbe Gilenyou (fingolimod), ktoré je dôležité si pamätať
 Informácie o liečbe Gilenyou (fingolimod), ktoré je dôležité si pamätať Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že
Informácie o liečbe Gilenyou (fingolimod), ktoré je dôležité si pamätať Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls77487/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s
Sp.zn. sukls77487/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls77487/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s
Sp.zn. sukls77487/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls77487/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
Sp.zn. sukls77487/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční
Príloha III. Úprava relevantných častí Súhrnu charakteristických vlastností lieku a Písomnej informácie pre používateľa
 Príloha III Úprava relevantných častí Súhrnu charakteristických vlastností lieku a Písomnej informácie pre používateľa Poznámka: Tento súhrn charakteristických vlastností lieku, označenia obalov a písomnej
Príloha III Úprava relevantných častí Súhrnu charakteristických vlastností lieku a Písomnej informácie pre používateľa Poznámka: Tento súhrn charakteristických vlastností lieku, označenia obalov a písomnej
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
(REF: ARV-HA-3 / REF: ARV-HA-1)
 Hyaluronát sodný 2% (REF: ARV-HA-3 / REF: ARV-HA-1) OBSAH, ref. ARV-HA-3 OBSAH, ref. ARV-HA-1 3 ArthroVisc injekčné striekačky 1 ArthroVisc injekčná striekačka 3 zarážky prsta 1 zarážka prsta Ver.4.X /
Hyaluronát sodný 2% (REF: ARV-HA-3 / REF: ARV-HA-1) OBSAH, ref. ARV-HA-3 OBSAH, ref. ARV-HA-1 3 ArthroVisc injekčné striekačky 1 ArthroVisc injekčná striekačka 3 zarážky prsta 1 zarážka prsta Ver.4.X /
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU ELIGARD 22,5 mg Prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem
1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU ELIGARD 22,5 mg Prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem
Choďte menej v noci, užívajte si viac cez deň
 Novinka pre pacientov s LUTS/BPH Choďte menej v noci, užívajte si viac cez deň Novinka v liečbe LUTS/BPH Negatívne vplyvy noktúrie Lekári považujú noktúriu za jeden z najviac obťažujúcich symptómov LUTS/BPH.
Novinka pre pacientov s LUTS/BPH Choďte menej v noci, užívajte si viac cez deň Novinka v liečbe LUTS/BPH Negatívne vplyvy noktúrie Lekári považujú noktúriu za jeden z najviac obťažujúcich symptómov LUTS/BPH.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
Jedna předplněná injekční stříkačka s práškem pro injekční roztok obsahuje leuprorelini acetas 22,5 mg, což odpovídá leuprorelinum 20,87 mg.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční
Jedna předplněná injekční stříkačka s práškem pro injekční roztok obsahuje leuprorelini acetas 22,5 mg, což odpovídá leuprorelinum 20,87 mg.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls220020/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
Sp.zn. sukls220020/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls211633/2014 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg Prášek a rozpouštědlo pro injekční roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
Sp.zn. sukls211633/2014 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg Prášek a rozpouštědlo pro injekční roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls173618/2014 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg Prášek a rozpouštědlo pro injekční roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
Sp.zn. sukls173618/2014 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg Prášek a rozpouštědlo pro injekční roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls155572/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg Prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční
Sp.zn. sukls155572/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg Prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční
Karcinóm prostaty. MUDr. Martina Jandzíková Praktický lekár pre dospelých Žilina, Košická 2,
 Karcinóm prostaty MUDr. Martina Jandzíková Praktický lekár pre dospelých Žilina, Košická 2, 010 01 Prevalencia V štátoch EU je ročne diagnostikovaných 85 000 nových prípadov karcinómu prostaty (KP) U mužov
Karcinóm prostaty MUDr. Martina Jandzíková Praktický lekár pre dospelých Žilina, Košická 2, 010 01 Prevalencia V štátoch EU je ročne diagnostikovaných 85 000 nových prípadov karcinómu prostaty (KP) U mužov
Protokol o začatí a kontrole liečby závažnej osteoporózy liekom
 Zdravotná poisťovňa: Kód zdravotnej poisťovne: Protokol o začatí a kontrole liečby závažnej osteoporózy liekom Liečba začatie liečby pokračova liečby ukonče liečby Meno, priezvisko a špecializácia navrhujúceho
Zdravotná poisťovňa: Kód zdravotnej poisťovne: Protokol o začatí a kontrole liečby závažnej osteoporózy liekom Liečba začatie liečby pokračova liečby ukonče liečby Meno, priezvisko a špecializácia navrhujúceho
Jedna předplněná injekční stříkačka s práškem pro přípravu injekčního roztoku obsahuje 7,5 mg leuprorelini acetas, což odpovídá 6,96 mg leuprorelinum.
 sp. zn. sukls155452/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg Prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční
sp. zn. sukls155452/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg Prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční
Lieky a pacienti s bolesťou
 Dozadu Na začiatok Ďalej Lieky a pacienti s bolesťou Kúpite si občas v lekárni lieky na bolesť alebo vám ich pravidelne predpisuje lekár? Čítajte ďalej a zistite, či pri liečbe občasnej alebo chronickej
Dozadu Na začiatok Ďalej Lieky a pacienti s bolesťou Kúpite si občas v lekárni lieky na bolesť alebo vám ich pravidelne predpisuje lekár? Čítajte ďalej a zistite, či pri liečbe občasnej alebo chronickej
ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV
 ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV 41 ZMENY, KTORÉ MAJÚ BYŤ ZAHRNUTÉ DO PRÍSLUŠNÝCH ČASTÍ SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV 41 ZMENY, KTORÉ MAJÚ BYŤ ZAHRNUTÉ DO PRÍSLUŠNÝCH ČASTÍ SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 Príloha č. 2 k notifikácii o zmene, ev. č.: 2017/01968-Z1B Schválený text k rozhodnutiu o prevode, ev. č.: 2017/01969-TR 1. NÁZOV LIEKU Capsagamma 53 mg/100 g krém SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
Príloha č. 2 k notifikácii o zmene, ev. č.: 2017/01968-Z1B Schválený text k rozhodnutiu o prevode, ev. č.: 2017/01969-TR 1. NÁZOV LIEKU Capsagamma 53 mg/100 g krém SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
MAGNOSOLV V TEHOTENSTVE
 V TEHOTENSTVE Tehotenstvo predstavuje stav nedostatku horčíka v organizme hladina horčíka v sére klesá asi o 10% (1) Dôsledkom manifestného nedostatku horčíka môže byť zvýšené riziko potratu - predčasný
V TEHOTENSTVE Tehotenstvo predstavuje stav nedostatku horčíka v organizme hladina horčíka v sére klesá asi o 10% (1) Dôsledkom manifestného nedostatku horčíka môže byť zvýšené riziko potratu - predčasný
Protokol o začatí, kontrole a zmene liečby psoriatickej artritídy
 Zdravotná poisťovňa: Všeobecná zdravotná poisťovňa Kód zdravotnej poisťovne: 25 Protokol o začatí, kontrole a zmene liečby psoriatickej artritídy Liečba: začatie liečby pokračovanie liečby zmena biologickej
Zdravotná poisťovňa: Všeobecná zdravotná poisťovňa Kód zdravotnej poisťovne: 25 Protokol o začatí, kontrole a zmene liečby psoriatickej artritídy Liečba: začatie liečby pokračovanie liečby zmena biologickej
Biologické aktivity magnézia (2) Zastúpenie magnézia v organizme (2) Štvrtý najčastejší katión v ľudskom organizme
 Biologické aktivity magnézia (2) Štvrtý najčastejší katión v ľudskom organizme Druhý najčastejší katión v intracelulárnom priestore Podieľa sa na metabolizme enzýmov, elektrolytov a energetickom metabolizme
Biologické aktivity magnézia (2) Štvrtý najčastejší katión v ľudskom organizme Druhý najčastejší katión v intracelulárnom priestore Podieľa sa na metabolizme enzýmov, elektrolytov a energetickom metabolizme
Výprava do kosti: Najčastejším ochorením kostí na svete je osteoporóza.
 Výprava do kosti: Kosť je živé tkanivo. Ako mnohé ďalšie tkanivá v tele, aj kostra sa počas života potrebuje neustále obnovovať. Celá kostra dospelého človeka sa kompletne obnoví v priebehu 7 10 rokov.
Výprava do kosti: Kosť je živé tkanivo. Ako mnohé ďalšie tkanivá v tele, aj kostra sa počas života potrebuje neustále obnovovať. Celá kostra dospelého človeka sa kompletne obnoví v priebehu 7 10 rokov.
Postupy pri aplikácii pandemickej vakcíny
 Postupy pri aplikácii pandemickej vakcíny Praktická realizácia očkovacieho výkonu v ambulantnej praxi lekára patrí k štandardným výkonom v rámci poskytovania liečebno-preventívnej starostlivosti. Dôležité
Postupy pri aplikácii pandemickej vakcíny Praktická realizácia očkovacieho výkonu v ambulantnej praxi lekára patrí k štandardným výkonom v rámci poskytovania liečebno-preventívnej starostlivosti. Dôležité
VETERINÁRNA AMBULANCIA
 VETERINÁRNA AMBULANCIA ŽDIARSKA 21, KOŠICE, 04012 www.veterinar-jazero.sk Vakcinácia spoločenských zvierat MVDr. René Mandelík, PhD. MVDr. Michal Moško Vakcinácia spoločenských zvierat (psy, mačky, králiky,
VETERINÁRNA AMBULANCIA ŽDIARSKA 21, KOŠICE, 04012 www.veterinar-jazero.sk Vakcinácia spoločenských zvierat MVDr. René Mandelík, PhD. MVDr. Michal Moško Vakcinácia spoločenských zvierat (psy, mačky, králiky,
Urinfekt test infekcie močových ciest
 Urinfekt test infekcie močových ciest Urinfekt test infekcie močových ciest (IMC) patria spolu s respiračnými infekciami k najčastejším zápalovým ochoreniam, ktoré sa vyskytujú v priebehu celého života
Urinfekt test infekcie močových ciest Urinfekt test infekcie močových ciest (IMC) patria spolu s respiračnými infekciami k najčastejším zápalovým ochoreniam, ktoré sa vyskytujú v priebehu celého života
Náhla cievna mozgová príhoda
 Náhla cievna mozgová príhoda Náhla cievna mozgová príhoda Náhla cievna mozgová príhoda predstavuje 3. najčastejšiu príčinu úmrtí Je akútnym prejavom cievneho ochorenia mozgu (COM) alebo KVS. Vyžaduje neodkladnú
Náhla cievna mozgová príhoda Náhla cievna mozgová príhoda Náhla cievna mozgová príhoda predstavuje 3. najčastejšiu príčinu úmrtí Je akútnym prejavom cievneho ochorenia mozgu (COM) alebo KVS. Vyžaduje neodkladnú
Parikalcitol alebo cinakalcet s vitamínom D v liečbe sekundárnej hyperparatyreózy u dialyzovaných? Výsledky štúdie IMPACT SHPT
 Parikalcitol alebo cinakalcet s vitamínom D v liečbe sekundárnej hyperparatyreózy u dialyzovaných? Výsledky štúdie IMPACT SHPT Adrián Okša LF SZU Bratislava CKD MBD Biochemické zmeny P, Ca 1,25(OH)D PTH
Parikalcitol alebo cinakalcet s vitamínom D v liečbe sekundárnej hyperparatyreózy u dialyzovaných? Výsledky štúdie IMPACT SHPT Adrián Okša LF SZU Bratislava CKD MBD Biochemické zmeny P, Ca 1,25(OH)D PTH
Bílé až téměř bílé válcovité tyčinky (přibližné rozměry: průměr 1,5 mm, délka 13 mm, hmotnost 44 mg), z biologicky degradovatelné polymerní matrice.
 Sp.zn.sukls85858/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Reseligo 10,8 mg implantát v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden implantát obsahuje goserelinum
Sp.zn.sukls85858/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Reseligo 10,8 mg implantát v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden implantát obsahuje goserelinum
EDÍCIA ZDRAVOTNÍCKA ŠTATISTIKA. Ambulantná starostlivosť o deti a dorast v SR 2005
 EDÍCIA ZDRAVOTNÍCKA ŠTATISTIKA Ambulantná starostlivosť o deti a dorast v SR 2005 Ročník 2006 ZŠ-26/2006 Obsah Úvod... 7 Dojčené deti... 9 Dojčené deti v Slovenskej republike (graf)... 9 Vyšetrenia (ošetrenia)
EDÍCIA ZDRAVOTNÍCKA ŠTATISTIKA Ambulantná starostlivosť o deti a dorast v SR 2005 Ročník 2006 ZŠ-26/2006 Obsah Úvod... 7 Dojčené deti... 9 Dojčené deti v Slovenskej republike (graf)... 9 Vyšetrenia (ošetrenia)
STAROSTLIVOSŤ O PACIENTA S ASTHMOU BRONCHIALE V AMBULANCII PRAKTICKÉHO LEKÁRA. MUDr. Iveta Vaverková ambulancia praktického lekára Bratislava
 STAROSTLIVOSŤ O PACIENTA S ASTHMOU BRONCHIALE V AMBULANCII PRAKTICKÉHO LEKÁRA MUDr. Iveta Vaverková ambulancia praktického lekára Bratislava ASTHMA BRONCHIALE Chronická zápalová choroba dýchacích ciest
STAROSTLIVOSŤ O PACIENTA S ASTHMOU BRONCHIALE V AMBULANCII PRAKTICKÉHO LEKÁRA MUDr. Iveta Vaverková ambulancia praktického lekára Bratislava ASTHMA BRONCHIALE Chronická zápalová choroba dýchacích ciest
(Text s významom pre EHP)
 29.9.2015 L 252/49 VYKONÁVACIE ROZHODNUTIE KOMISIE (EÚ) 2015/1735 z 24. septembra 2015 o presnom umiestnení všeobecného varovania a informačného odkazu na tabaku na vlastnoručné zhotovenie cigariet predávanom
29.9.2015 L 252/49 VYKONÁVACIE ROZHODNUTIE KOMISIE (EÚ) 2015/1735 z 24. septembra 2015 o presnom umiestnení všeobecného varovania a informačného odkazu na tabaku na vlastnoručné zhotovenie cigariet predávanom
M.H., ZÁLESIE - BioBran 1000 Vek Bol BioBran užívaný ako podpora liečby ochorenia? O aký druh ochorenia išlo?
 V priebehu mesiaca Marec 2009 sme oslovili zákazníkov, ktorí si zakúpili BioBran v roku 2008 prostredníctvom www.imunotop.sk Formou dotazníka sme im položili nasledujúce otázky. Vďaka ich súhlasu s uverejnením
V priebehu mesiaca Marec 2009 sme oslovili zákazníkov, ktorí si zakúpili BioBran v roku 2008 prostredníctvom www.imunotop.sk Formou dotazníka sme im položili nasledujúce otázky. Vďaka ich súhlasu s uverejnením
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA. LUCRIN DEPOT 3,75 mg. (leuprorelini acetas) Prášok a disperzné prostredie na injekčnú suspenziu
 Príloha č. 2 k rozhodnutiu o zmene v registrácii, ev. č. 0869/2005 Príloha č. 2 k rozhodnutiu o predĺžení registrácie, ev.č. 0607/2005 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA LUCRIN DEPOT 3,75 mg (leuprorelini
Príloha č. 2 k rozhodnutiu o zmene v registrácii, ev. č. 0869/2005 Príloha č. 2 k rozhodnutiu o predĺžení registrácie, ev.č. 0607/2005 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA LUCRIN DEPOT 3,75 mg (leuprorelini
Činnosť dermatovenerologických ambulancií v SR 2015
 Štatistické prehľady Činnosť dermatovenerologických ambulancií v SR 2015 Prehľad informuje o výsledkoch štatistického zisťovania na základe ročného výkazu o činnosti dermatovenerologickej ambulancie A
Štatistické prehľady Činnosť dermatovenerologických ambulancií v SR 2015 Prehľad informuje o výsledkoch štatistického zisťovania na základe ročného výkazu o činnosti dermatovenerologickej ambulancie A
Plán riadenia rizík (RMP)
 Plán riadenia rizík (RMP) PharmDr. M. Verčinská, PhD. RNDr. T. Magálová Tematický kurz SARAP Bratislava, 7.04.2017 Obsah Legislatíva Základné pojmy Cieľ a štruktúra RMP Bezpečnostná špecifikácia Opatrenia
Plán riadenia rizík (RMP) PharmDr. M. Verčinská, PhD. RNDr. T. Magálová Tematický kurz SARAP Bratislava, 7.04.2017 Obsah Legislatíva Základné pojmy Cieľ a štruktúra RMP Bezpečnostná špecifikácia Opatrenia
KORELACIA STU PAJU CEJ HLADINY ALBUMINU A NAPLNENIA TERAPEUTICKEHO CIELA PRI PARENTERALNEJ NUTRIČNEJ PODPORE
 KORELACIA STU PAJU CEJ HLADINY ALBUMINU A NAPLNENIA TERAPEUTICKEHO CIELA PRI PARENTERALNEJ NUTRIČNEJ PODPORE MUDr. Andrea Škripeková 9.9.2017 Brno úvod problém parenterálnej výživy (PV) u pacientov s pokročilým
KORELACIA STU PAJU CEJ HLADINY ALBUMINU A NAPLNENIA TERAPEUTICKEHO CIELA PRI PARENTERALNEJ NUTRIČNEJ PODPORE MUDr. Andrea Škripeková 9.9.2017 Brno úvod problém parenterálnej výživy (PV) u pacientov s pokročilým
Návod na inštaláciu. Súprava 2-cestných ventilov pre konvektor tepelného čerpadla EKVKHPC
 Súprava -cestných ventilov pre konvektor tepelného čerpadla Súprava -cestných ventilov pre konvektor tepelného čerpadla Pred inštaláciou si dôkladne prečítajte tento návod. Nezahoďte ho. Uschovajte si
Súprava -cestných ventilov pre konvektor tepelného čerpadla Súprava -cestných ventilov pre konvektor tepelného čerpadla Pred inštaláciou si dôkladne prečítajte tento návod. Nezahoďte ho. Uschovajte si
Zavádzanie centrálneho venózneho katétra. spracovala: Lucia Staroňová
 Zavádzanie centrálneho venózneho katétra spracovala: Lucia Staroňová Definícia Zavedenie centrálneho venózneho katétra (CVK ) je invazívny lekársky výkon, ktorý je súčasťou diagnosticko - terapeutického
Zavádzanie centrálneho venózneho katétra spracovala: Lucia Staroňová Definícia Zavedenie centrálneho venózneho katétra (CVK ) je invazívny lekársky výkon, ktorý je súčasťou diagnosticko - terapeutického
Analýza rizík a kontrolné opatrenia
 Analýza rizík a kontrolné opatrenia Monika Karácsonyová Karol Munka 2. workshop k projektu SK0135 30.3.2011 VÚVH Bratislava Analýza rizík systematický proces využívania dostupných informácií na identifikovanie
Analýza rizík a kontrolné opatrenia Monika Karácsonyová Karol Munka 2. workshop k projektu SK0135 30.3.2011 VÚVH Bratislava Analýza rizík systematický proces využívania dostupných informácií na identifikovanie
Zákon č. 595/2003 Z. z. Dodatočné daňové priznanie k dani z príjmov právnickej osoby za rok 2015
 Dodatočné daňové priznanie k dani z príjmov právnickej osoby za rok 2015 1 povinnosť podať daňové priznanie (DP): podľa 15(1) daňového poriadku má každý, komu táto povinnosť vyplýva zo ZDP alebo ten, koho
Dodatočné daňové priznanie k dani z príjmov právnickej osoby za rok 2015 1 povinnosť podať daňové priznanie (DP): podľa 15(1) daňového poriadku má každý, komu táto povinnosť vyplýva zo ZDP alebo ten, koho
M R2454 SK
 M32 1993R2454 SK 01.01.2013 017.001 959 M32 1993R2454 SK 01.01.2013 017.001 960 M32 1993R2454 SK 01.01.2013 017.001 961 1993R2454 SK 01.01.2013 017.001 965 M32 VYSVETLIVKY K TLAČIVÁM ŽIADOSTÍ O ZJEDNODUŠENÉ
M32 1993R2454 SK 01.01.2013 017.001 959 M32 1993R2454 SK 01.01.2013 017.001 960 M32 1993R2454 SK 01.01.2013 017.001 961 1993R2454 SK 01.01.2013 017.001 965 M32 VYSVETLIVKY K TLAČIVÁM ŽIADOSTÍ O ZJEDNODUŠENÉ
Príčiny vzniku zápalu
 Príčiny vzniku zápalu Zápal vyvolávajú najčastejšie baktérie (E. Coli), ktoré sú prirodzenou flórou v črevnom trakte. Príčin, pre ktoré zápal vznikne, je viacero. V útlom veku je to najčastejšie vrodená
Príčiny vzniku zápalu Zápal vyvolávajú najčastejšie baktérie (E. Coli), ktoré sú prirodzenou flórou v črevnom trakte. Príčin, pre ktoré zápal vznikne, je viacero. V útlom veku je to najčastejšie vrodená
24 HODINOVÉ MONITOROVANIE KRVNÉHO TLAKU V AMBULANTNEJ PRAXI. MUDr. Mária Galčíková
 24 HODINOVÉ MONITOROVANIE KRVNÉHO TLAKU V AMBULANTNEJ PRAXI MUDr. Mária Galčíková TK METODIKY MERANIA AMBULANTNÉ MONITOROVANIE TK ZÁVER Page 2 CYKLICKÉ ZMENY HODNÔT TK 1-DŇOVÉ PRIBLIŽNE 3,5 DŇOVÉ 7 DŇOVÉ
24 HODINOVÉ MONITOROVANIE KRVNÉHO TLAKU V AMBULANTNEJ PRAXI MUDr. Mária Galčíková TK METODIKY MERANIA AMBULANTNÉ MONITOROVANIE TK ZÁVER Page 2 CYKLICKÉ ZMENY HODNÔT TK 1-DŇOVÉ PRIBLIŽNE 3,5 DŇOVÉ 7 DŇOVÉ
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU. Jedna obalená tableta obsahuje 12,5 mg sodnej soli tianeptínu (čo zodpovedá 11,87 mg tianeptínu).
 Príloha č. 1 k notifikácii o zmene, ev.č.: 2015/02247-Z1B SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU COAXIL obalené tablety 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Jedna obalená tableta
Príloha č. 1 k notifikácii o zmene, ev.č.: 2015/02247-Z1B SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU COAXIL obalené tablety 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Jedna obalená tableta
Podpora kognitívnych funkcií v rámci asistovaného samoliečenia
 Podpora kognitívnych funkcií v rámci asistovaného samoliečenia Peter Stanko ADC Solutions, spol. s r. o. Prezentácia bola pripravená v spolupráci so spoločnosťou EGIS SLOVAKIA Dispenzačná starostlivosť
Podpora kognitívnych funkcií v rámci asistovaného samoliečenia Peter Stanko ADC Solutions, spol. s r. o. Prezentácia bola pripravená v spolupráci so spoločnosťou EGIS SLOVAKIA Dispenzačná starostlivosť
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 Príloha č. 2 k notifikácii o zmene, ev. č.: 2015/01588 - Z1B SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU ERDOMED 300 mg tvrdé kapsuly 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Každá kapsula
Príloha č. 2 k notifikácii o zmene, ev. č.: 2015/01588 - Z1B SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU ERDOMED 300 mg tvrdé kapsuly 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Každá kapsula
Úvodná strana IS ZASIELKY Prvky úvodnej stránky:
 IS ZASIELKY 2.0 Obsah Úvodná strana IS ZASIELKY... 3 Prvky úvodnej stránky:... 3 IMPORT Údajov... 4 Zápis zásielky... 5 Miesto určenia... 5 Poznámka... 5 1. Miesto určenia Zápis zásielky... 6 2. Skupina
IS ZASIELKY 2.0 Obsah Úvodná strana IS ZASIELKY... 3 Prvky úvodnej stránky:... 3 IMPORT Údajov... 4 Zápis zásielky... 5 Miesto určenia... 5 Poznámka... 5 1. Miesto určenia Zápis zásielky... 6 2. Skupina
Správa z výsledkov štúdie PISA 2006 v rakúskych waldorfských školách
 Správa z výsledkov štúdie PISA 2006 v rakúskych waldorfských školách poznámka: PISA je program pre medzinárodné hodnotenie študentov a označuje najväčšiu medzinárodnú štúdiu, zisťujúcu a porovnávajúcu
Správa z výsledkov štúdie PISA 2006 v rakúskych waldorfských školách poznámka: PISA je program pre medzinárodné hodnotenie študentov a označuje najväčšiu medzinárodnú štúdiu, zisťujúcu a porovnávajúcu
Zabezpečenie pitného režimu
 IS 35 2016 Vydanie č.: 1/2016 Platné od: 15.03.2016 Strana 1 z 6 Výtlačok č.: Zabezpečenie pitného režimu Vypracoval Kontroloval Schválil Meno a priezvisko Viktor NAĎ Mgr. Marián Kudrík Mgr. Miroslav Tóth
IS 35 2016 Vydanie č.: 1/2016 Platné od: 15.03.2016 Strana 1 z 6 Výtlačok č.: Zabezpečenie pitného režimu Vypracoval Kontroloval Schválil Meno a priezvisko Viktor NAĎ Mgr. Marián Kudrík Mgr. Miroslav Tóth
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA INFUSIO GLUCOSI 5 IMUNA. Infúzny intravenózny roztok.
 Príloha č. 2a k notifikácii zmeny, ev. č. 2106/6944 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA INFUSIO GLUCOSI 5 IMUNA Infúzny intravenózny roztok. Držiteľ rozhodnutia o registrácii Imuna Pharm, a.s. Jarková 17
Príloha č. 2a k notifikácii zmeny, ev. č. 2106/6944 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA INFUSIO GLUCOSI 5 IMUNA Infúzny intravenózny roztok. Držiteľ rozhodnutia o registrácii Imuna Pharm, a.s. Jarková 17
ELEKTROKONVULZÍVNA TERAPIA PRÍRUČKA PRE PACIENTOV
 ELEKTROKONVULZÍVNA TERAPIA PRÍRUČKA PRE PACIENTOV 1 2 Milí pacienti, v súčasnosti absolvuje elektrokonvulzívnu liečbu ročne približne 1 milión ľudí na celom svete. Jej účinnosť je veľmi vysoká a pri niektorých
ELEKTROKONVULZÍVNA TERAPIA PRÍRUČKA PRE PACIENTOV 1 2 Milí pacienti, v súčasnosti absolvuje elektrokonvulzívnu liečbu ročne približne 1 milión ľudí na celom svete. Jej účinnosť je veľmi vysoká a pri niektorých
Vybrané rizikové faktory kardiovaskulárnej morbidity a mortality u hemodialyzovaných pacientov. Bc. Ivona Piecková Banská Bystrica
 Vybrané rizikové faktory kardiovaskulárnej morbidity a mortality u hemodialyzovaných pacientov Bc. Ivona Piecková Banská Bystrica Kardiovaskulárne ochorenia (KVO) - rizikové faktory riziko úmrtia z kardiálnej
Vybrané rizikové faktory kardiovaskulárnej morbidity a mortality u hemodialyzovaných pacientov Bc. Ivona Piecková Banská Bystrica Kardiovaskulárne ochorenia (KVO) - rizikové faktory riziko úmrtia z kardiálnej
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 Schválený text k rozhodnutiu o zmene, ev.č.: 2013/07585-ZME 1. NÁZOV LIEKU Igantibe 200 IU/ml, injekčný roztok SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Liečivo:
Schválený text k rozhodnutiu o zmene, ev.č.: 2013/07585-ZME 1. NÁZOV LIEKU Igantibe 200 IU/ml, injekčný roztok SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Liečivo:
ŠPECIALIZAČNÝ ŠTUDIJNÝ PROGRAM ANESTEZIOLÓGIA A INTENZÍVNA MEDICÍNA
 Anestéziológia a intenzívna medicína 1. kurz 7. 9. 11. 9. 2015 ŠPECIALIZAČNÝ ŠTUDIJNÝ PROGRAM ANESTEZIOLÓGIA A INTENZÍVNA MEDICÍNA Dĺžka trvania: 5 rokov Univerzita Komenského v Bratislave Lekárska fakulta
Anestéziológia a intenzívna medicína 1. kurz 7. 9. 11. 9. 2015 ŠPECIALIZAČNÝ ŠTUDIJNÝ PROGRAM ANESTEZIOLÓGIA A INTENZÍVNA MEDICÍNA Dĺžka trvania: 5 rokov Univerzita Komenského v Bratislave Lekárska fakulta
PRÍLOHA I SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 PRÍLOHA I SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV VETERINÁRNEHO LIEKU Nobivac Myxo- RHD lyofilizát a rozpúšťadlo na injekčnú suspenziu pre králikov. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Jedna
PRÍLOHA I SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV VETERINÁRNEHO LIEKU Nobivac Myxo- RHD lyofilizát a rozpúšťadlo na injekčnú suspenziu pre králikov. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Jedna
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls205958/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-FLUTAMIDE Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje flutamidum 250 mg. Pomocné
sp.zn. sukls205958/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-FLUTAMIDE Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje flutamidum 250 mg. Pomocné
Tematický celok Obsahový štandard Výkonový štandard Prierezová téma
 Tematický celok Obsahový štandard Výkonový štandard Prierezová téma Vnútorná stavba tela stavovcov orgán a orgánová sústava, orgánové sústavy stavovcov, sústava krycia, oporná, pohybová, tráviaca, dýchacie,
Tematický celok Obsahový štandard Výkonový štandard Prierezová téma Vnútorná stavba tela stavovcov orgán a orgánová sústava, orgánové sústavy stavovcov, sústava krycia, oporná, pohybová, tráviaca, dýchacie,
Vplyv konzumácie ovocia a zeleniny na výskyt metabolického syndrómu u klientov poradne zdravia
 Regionálny úrad verejného zdravotníctva so sídlom v Košiciach, Odbor podpory zdravia Vplyv konzumácie ovocia a zeleniny na výskyt metabolického syndrómu u klientov poradne zdravia Seminár pre MTP pracovníkov,
Regionálny úrad verejného zdravotníctva so sídlom v Košiciach, Odbor podpory zdravia Vplyv konzumácie ovocia a zeleniny na výskyt metabolického syndrómu u klientov poradne zdravia Seminár pre MTP pracovníkov,
HODNOTENIE ZÁŤAŽE OBYVATEĽSTVA SLOVENSKEJ REPUBLIKY DUSIČNANMI
 Priemyselná toxikológia 06, Piešťany, 23. - 25. V. 2006 HODNOTENIE ZÁŤAŽE OBYVATEĽSTVA SLOVENSKEJ REPUBLIKY DUSIČNANMI NO 3 Šalgovičová Danka Výskumný ústav potravinársky, Bratislava Úvod Dusičnany patria
Priemyselná toxikológia 06, Piešťany, 23. - 25. V. 2006 HODNOTENIE ZÁŤAŽE OBYVATEĽSTVA SLOVENSKEJ REPUBLIKY DUSIČNANMI NO 3 Šalgovičová Danka Výskumný ústav potravinársky, Bratislava Úvod Dusičnany patria
Astronomická fotografia -- kuchárka pre digitálnu fotografiu
 Astronomická fotografia -- kuchárka pre digitálnu fotografiu Peter Delinčák, sekcia astronomickej fotografie SAS Úvodom S príchodom digitálnych fotoaparátov sa otvorili nové možnosti pre astronomickú fotografiu.
Astronomická fotografia -- kuchárka pre digitálnu fotografiu Peter Delinčák, sekcia astronomickej fotografie SAS Úvodom S príchodom digitálnych fotoaparátov sa otvorili nové možnosti pre astronomickú fotografiu.
ONLINE POBOČKA. pre zamestnávateľov MANUÁL
 @ ONLINE POBOČKA pre zamestnávateľov @ MANUÁL Obsah Čo je online pobočka 3 Ako podať dávku 5 - Podanie mesačného výkazu 6 Postup: Už mám vytvorenú dávku 6 Postup: Nemám vytvorenú dávku 8 - Podanie hromadného
@ ONLINE POBOČKA pre zamestnávateľov @ MANUÁL Obsah Čo je online pobočka 3 Ako podať dávku 5 - Podanie mesačného výkazu 6 Postup: Už mám vytvorenú dávku 6 Postup: Nemám vytvorenú dávku 8 - Podanie hromadného
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU Menopur 600 I.U. 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Jedna injekčná liekovka s práškom obsahuje vysoko čistený menotropín (vysoko čistený ľudský
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU Menopur 600 I.U. 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Jedna injekčná liekovka s práškom obsahuje vysoko čistený menotropín (vysoko čistený ľudský
Hlavným rizikovým faktorom glaukómu je zvýšený vnútroočný tlak (IOT) (asi 2% populácie vo veku rokov a 8% nad 70 rokov má zvýšený IOT).
 Glaukóm je skupina ochorení, ktorá môže spôsobiť stratu zraku bez varovných príznakov. Vyše 3 MILIÓNOV Američanov má glaukóm. Len polovica z nich to VIE. DIIAGNÓZA JE PRVÝM KROKOM ZÁCHRANY VÁŠHO ZRAKU
Glaukóm je skupina ochorení, ktorá môže spôsobiť stratu zraku bez varovných príznakov. Vyše 3 MILIÓNOV Američanov má glaukóm. Len polovica z nich to VIE. DIIAGNÓZA JE PRVÝM KROKOM ZÁCHRANY VÁŠHO ZRAKU
Všeobecne záväzné nariadenie Mesta Trenčianske Teplice č. x/2016 o používaní pyrotechnických výrobkov na území mesta Trenčianske Teplice
 Dôvodová správa S účinnosťou k 2.12.2015 došlo k zmene zákona č. 58/2014 Z. z. o výbušninách, výbušných predmetoch a munícii a o zmene a doplnení niektorých zákonov v znení neskorších predpisov, ktorý
Dôvodová správa S účinnosťou k 2.12.2015 došlo k zmene zákona č. 58/2014 Z. z. o výbušninách, výbušných predmetoch a munícii a o zmene a doplnení niektorých zákonov v znení neskorších predpisov, ktorý
Prepojenie výsledkov hodnotenia hydrologického sucha v povrchových a podzemných vodách vo vybraných úsekoch tokov Orava a Kysuca
 Prepojenie výsledkov hodnotenia hydrologického sucha v povrchových a podzemných vodách vo vybraných úsekoch tokov Orava a Kysuca Lotta Blaškovičová, Martin Belan, Katarína Melová, Ľudovít Molnár, Valéria
Prepojenie výsledkov hodnotenia hydrologického sucha v povrchových a podzemných vodách vo vybraných úsekoch tokov Orava a Kysuca Lotta Blaškovičová, Martin Belan, Katarína Melová, Ľudovít Molnár, Valéria
EDUKÁCIA PRIMÁRNYCH OPATROVATEĽOV PACIENTOV V PALIATÍVNEJ STAROSTLIVOSTI
 EDUKÁCIA PRIMÁRNYCH OPATROVATEĽOV PACIENTOV V PALIATÍVNEJ STAROSTLIVOSTI Radka Šerfelová, Martina Lepiešová Centrum paliatívnej starostlivosti Bjørnstjerne Bjørnsona Ústav ošetrovateľstva JLF UK v Martine
EDUKÁCIA PRIMÁRNYCH OPATROVATEĽOV PACIENTOV V PALIATÍVNEJ STAROSTLIVOSTI Radka Šerfelová, Martina Lepiešová Centrum paliatívnej starostlivosti Bjørnstjerne Bjørnsona Ústav ošetrovateľstva JLF UK v Martine
Ponuka a cenník nadštandardných preventívnych programov
 Medicínsko-diagnostické centrum UNICENTRUM BOJNICE UNIPHARMA - 1. slovenská lekárnická akciová spoločnosť Ponuka a cenník nadštandardných preventívnych programov platná od 1. decembra 2016 Kontakt: Tel.:
Medicínsko-diagnostické centrum UNICENTRUM BOJNICE UNIPHARMA - 1. slovenská lekárnická akciová spoločnosť Ponuka a cenník nadštandardných preventívnych programov platná od 1. decembra 2016 Kontakt: Tel.:
Brožúra poistných fondov
 Brožúra poistných fondov NÁZOV POISTNÉHO FONDU: NOVIS ETF Akciový Poistný Fond NÁZOV TVORCU: NOVIS Poisťovňa, a.s Brožúra poistných fondov je účinná od 1. januára 2018 O aký produkt ide? TYP: Interný fond
Brožúra poistných fondov NÁZOV POISTNÉHO FONDU: NOVIS ETF Akciový Poistný Fond NÁZOV TVORCU: NOVIS Poisťovňa, a.s Brožúra poistných fondov je účinná od 1. januára 2018 O aký produkt ide? TYP: Interný fond
Autizmus, tráviace funkcie a vplyv probiotík
 Autizmus, tráviace funkcie a vplyv probiotík K. Babinská, S. Lakatošová, A. Tomova, V. Husárová, A. Pivovarčiová, J. Bakoš, A. Harinek, L. Slobodníková, V. Piačková, A. Gvozdjáková, M. Bucová, A. Čorejová,
Autizmus, tráviace funkcie a vplyv probiotík K. Babinská, S. Lakatošová, A. Tomova, V. Husárová, A. Pivovarčiová, J. Bakoš, A. Harinek, L. Slobodníková, V. Piačková, A. Gvozdjáková, M. Bucová, A. Čorejová,
POWLI Fig. A Copyright 2014 VARO
 POWLI421 1 7 6 2 3 4 5 Fig. A Copyright 2014 VARO www.varo.com POWLI421 Fig 1 Copyright 2014 VARO www.varo.com LED BATERKA 1,5 W POWLI421 POWLI421 SK 1 POPIS (OBR. A) 1. Otočná hlava 2. Hlavný vypínač
POWLI421 1 7 6 2 3 4 5 Fig. A Copyright 2014 VARO www.varo.com POWLI421 Fig 1 Copyright 2014 VARO www.varo.com LED BATERKA 1,5 W POWLI421 POWLI421 SK 1 POPIS (OBR. A) 1. Otočná hlava 2. Hlavný vypínač
Odpočet daňovej straty po Ing. Mgr. Martin Tužinský, PhD.
 Odpočet daňovej straty po 1.1.2014 Ing. Mgr. Martin Tužinský, PhD. Odpočet daňovej straty Možnosť a pravidlá odpočítania daňovej straty od základu dane z príjmov v nasledujúcich zdaňovacích obdobiach sú
Odpočet daňovej straty po 1.1.2014 Ing. Mgr. Martin Tužinský, PhD. Odpočet daňovej straty Možnosť a pravidlá odpočítania daňovej straty od základu dane z príjmov v nasledujúcich zdaňovacích obdobiach sú
Finančné riaditeľstvo Slovenskej republiky
 Finančné riaditeľstvo Slovenskej republiky Informácia k odpočtu daňovej straty v tabuľke D tlačiva daňového priznania k dani z príjmov právnickej osoby Daňovník - právnická osoba so zdaňovacím obdobím
Finančné riaditeľstvo Slovenskej republiky Informácia k odpočtu daňovej straty v tabuľke D tlačiva daňového priznania k dani z príjmov právnickej osoby Daňovník - právnická osoba so zdaňovacím obdobím
HYPERVISKOZITA EJAKULÁTU:
 HYPERVISKOZITA EJAKULÁTU: PRÍČINY A DÔSLEDKY ZUZANA VÁCZY, LADISLAV BOBÁK, MONIKA GDOVINOVÁ LABORATÓRIUM PRE DIAGNOSTIKU INFERTILITY A BANKA SPERMIÍ ZDRUŽENÁ TKANIVOVÁ BANKA UNLP KOŠICE 2. ročník semináře
HYPERVISKOZITA EJAKULÁTU: PRÍČINY A DÔSLEDKY ZUZANA VÁCZY, LADISLAV BOBÁK, MONIKA GDOVINOVÁ LABORATÓRIUM PRE DIAGNOSTIKU INFERTILITY A BANKA SPERMIÍ ZDRUŽENÁ TKANIVOVÁ BANKA UNLP KOŠICE 2. ročník semináře
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, SÍLA LÉČIVÉHO PŘÍPRAVKU, ZPŮSOB PODÁNÍ, ŽADATEL A DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH
 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, SÍLA LÉČIVÉHO PŘÍPRAVKU, ZPŮSOB PODÁNÍ, ŽADATEL A DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH Členský stát Dánsko Německo Irsko Itálie Španělsko Držitel rozhodnutí
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, SÍLA LÉČIVÉHO PŘÍPRAVKU, ZPŮSOB PODÁNÍ, ŽADATEL A DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH Členský stát Dánsko Německo Irsko Itálie Španělsko Držitel rozhodnutí
Miera relapsov u IBD pacientov v hlbokej remisii po vysadení anti-tnfα liečby: prospektívna otvorená štúdia
 Miera relapsov u IBD pacientov v hlbokej remisii po vysadení anti-tnfα liečby: prospektívna otvorená štúdia HLAVATÝ T., KRAJČOVIČOVÁ A., LETKOVSKÝ J., ŠTURDÍK I., KOLLER T., TÓTH J., HUORKA M. Gastroenterologické
Miera relapsov u IBD pacientov v hlbokej remisii po vysadení anti-tnfα liečby: prospektívna otvorená štúdia HLAVATÝ T., KRAJČOVIČOVÁ A., LETKOVSKÝ J., ŠTURDÍK I., KOLLER T., TÓTH J., HUORKA M. Gastroenterologické
Sledovanie nadčasov, vyšetrenia zamestnanca a sprievodu
 Sledovanie nadčasov, vyšetrenia zamestnanca a sprievodu a) sledovanie nadčasov všeobecne za celú firmu alebo osobitne u každého zamestnanca V menu Firma Nastavenia na karte Upozornenia je možné hromadne
Sledovanie nadčasov, vyšetrenia zamestnanca a sprievodu a) sledovanie nadčasov všeobecne za celú firmu alebo osobitne u každého zamestnanca V menu Firma Nastavenia na karte Upozornenia je možné hromadne
Liečba imunoglobulínom
 Liečba imunoglobulínom www. imunodeficit.sk 1 O substitučnej liečbe Imunoglobulíny sú protilátky, vytvárané bunkami imunitného systému. Protilátky pomáhajú telu napádať a zabíjať cudzorodé látky. Pri väčšine
Liečba imunoglobulínom www. imunodeficit.sk 1 O substitučnej liečbe Imunoglobulíny sú protilátky, vytvárané bunkami imunitného systému. Protilátky pomáhajú telu napádať a zabíjať cudzorodé látky. Pri väčšine
Externé zariadenia Používateľská príručka
 Externé zariadenia Používateľská príručka Copyright 2009 Hewlett-Packard Development Company, L.P. Informácie obsiahnuté v tomto dokumente sa môžu zmeniť bez predchádzajúceho upozornenia. Jediné záruky
Externé zariadenia Používateľská príručka Copyright 2009 Hewlett-Packard Development Company, L.P. Informácie obsiahnuté v tomto dokumente sa môžu zmeniť bez predchádzajúceho upozornenia. Jediné záruky
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls109411/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Lutrate Depot 3,75 mg Prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 injekční
Sp.zn. sukls109411/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Lutrate Depot 3,75 mg Prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 injekční
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 Príloha č. 1 k notifikácii o zmene, ev. č.: 2014/00763-Z1A SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU Gyno-Pevaryl 50 vaginálne guľôčky Gyno-Pevaryl 150 vaginálne guľôčky Gyno-Pevaryl 150
Príloha č. 1 k notifikácii o zmene, ev. č.: 2014/00763-Z1A SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU Gyno-Pevaryl 50 vaginálne guľôčky Gyno-Pevaryl 150 vaginálne guľôčky Gyno-Pevaryl 150
Rozbor ochorení a úmrtnosti na onkologické ochorenia v APLD v Kysaku. MUDr. Jarmila Platová
 Rozbor ochorení a úmrtnosti na onkologické ochorenia v APLD v Kysaku. MUDr. Jarmila Platová SH ž- nar.1937 zh.nádor tela maternice - zistené 1981 SJ m- nar.1943 zh.nádor testis zistené 1985 KM -ž- nar.1937
Rozbor ochorení a úmrtnosti na onkologické ochorenia v APLD v Kysaku. MUDr. Jarmila Platová SH ž- nar.1937 zh.nádor tela maternice - zistené 1981 SJ m- nar.1943 zh.nádor testis zistené 1985 KM -ž- nar.1937
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Goserelini acetas v 1 předplněné injekční stříkačce (odpovídá goserelinum 10,8 mg).
 1. NÁZEV PŘÍPRAVKU ZOLADEX DEPOT 10,8 mg implantát v předplněné injekční stříkačce SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Goserelini acetas v 1 předplněné injekční stříkačce (odpovídá
1. NÁZEV PŘÍPRAVKU ZOLADEX DEPOT 10,8 mg implantát v předplněné injekční stříkačce SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Goserelini acetas v 1 předplněné injekční stříkačce (odpovídá
