Praktická cvičení z buněčné biologie
|
|
|
- Barbora Dostálová
- před 8 lety
- Počet zobrazení:
Transkript
1 Praktická cvičení z buněčné biologie pro posluchače Přírodovědecké fakulty UP Renata Fialová, Pavla Válová Olomouc 2004
2 ZÁKLADY MIKROSKOPOVÁNÍ 1. Nastavení mikroskopu k pozorování a zaostření objektu Na začátku mikroskopování si nastavíme základní části mikroskopu (viz schéma mikroskopu). Dodržujeme při tom sled jednotlivých úkonů, a to: nastavení osvětlení, úpravu rozestupu okulárů, kontrolu čistoty optiky a nakonec vložení a pozorování preparátu. 1. Do optické osy mikroskopu nastavíme nejméně zvětšující objektiv na doraz. Aperturní clonu kondenzoru úplně otevřeme a nastavíme intenzitu světla pomocí regulátoru osvětlení asi na ½. (Plné intenzity světla užíváme jen výjimečně zkracuje životnost žárovky a škodí zraku!) 2. Upravíme si rozestup okulárů. 3. Zkontrolujeme čistotu optiky; otáčíme okuláry a případný prach z čoček kondenzoru a okulárů odstraňujeme odmaštěným štětečkem nebo pomocí balónku, ne foukáním! 4. Zaostření a centrování objektu: na stolek položíme preparát a pozorovaný objekt umístíme na střed kondenzoru. Stolek je posunutý nahoru na doraz. Při pohledu do okuláru zaostřujeme na objekt pomalým posunováním stolku pomocí makrošroubu směrem dolů, doostříme mikrošroubem. Vyrovnáme světlost obrazového pole regulátorem osvětlení a obrysovou ostrost obrazu pomocí kondenzorové clony. Pozorovaný detail umístíme doprostřed zorného pole (centrujeme). Je-li třeba, vyměníme objektiv za silnější pomocí revolverového měniče objektivů. Při normální tloušťce krycího skla přitom nehýbáme stolkem. (Pozor - silně zvětšující objektivy jsou těsně u krycího skla při neopatrné manipulaci hrozí nebezpečí poškození čoček objektivů a preparátu!) 5. Vyrovnání dioptrické vady oka: mikrošroubem zaostříme na určitý detail objektu jen s pravým okulárem. Poté objekt pozorujeme pouze levým okulárem a pokud pozorovaný detail nevidíme stejně ostře, doostříme pomocí dioptrického kroužku na levém okuláru (bez použití makro- a mikrošroubu). 2
3 2. Vlastnosti obrazu pozorovaného mikroskopem Objektiv tvoří skutečný, zvětšený a převrácený obraz objektu v přední ohniskové rovině okuláru. Tento obraz pozorujeme okulárem jako lupou. Výsledný obraz, který pozorujeme v mikroskopu, je tedy neskutečný (zdánlivý), převrácený a ještě více zvětšený. Postup: Objektivem 4x pozorujeme trvalý preparát s číselnou řadu (12345) a vytištěným písmenem á. Číselná řada a písmeno mají v zorném poli obrácenou polohu než ve skutečnosti. Při pohybu preparátem se obrazy pohybují opačným směrem. Praktický význam: Co vidíme v zorném poli vpravo, je v preparátu vlevo; co vidíme nahoře, je v preparátu dole a naopak. Řídíme se tím při hledání objektu v preparátu. 3
4 3. Ohyb a interference světla ovlivňující rozlišení, vliv apertury objektivu Protože světlo má vlnovou podstatu, není v mikroskopu obrazem předmětového bodu bod, ale rozptylový či ohybový světelný kroužek (viz obr.). Jsou-li dva objekty tak blízko sebe, že se jejich rozptylové kroužky zčásti překrývají, nebudou rozlišeny a budou zobrazeny jako objekt jeden. Postup: 1. Objektivem 4x a poté 10x zaostříme ptačí pírko v preparátu. Hodně přicloníme aperturní clonu. 2. Vyjmeme pravý okulár a tubusem pozorujeme horní ohniskovou rovinu objektivu. Uprostřed vidíme světelný obraz otvoru clony (= obraz maxima nultého řádu viz obr. k úkolu 3). Okolo něj je řada vedlejších obrazů (maxima 1. až n-tého řádu) otvoru, které se částečně překrývají. Směrem do stran jsou stále méně světelné a méně zbarvené. 3. Odstraníme peříčko ze světelného toku posunem preparátu. Vedlejší obrazy zmizí, zůstává jen střední obraz otvoru clony. Střední obraz vzniká podle geometrických zákonů optiky, vedlejší obrazy jsou výsledkem ohybu světla ve štěrbinách mezi strukturami peříčka napodobujícími mřížku. Rozdělení světelných intenzit a poloha jednotlivých vedlejších obrazů jsou podmíněny interferencí. Praktický význam: Biologický objekt je v podstatě složen z velkého množství velmi drobných struktur s maličkými štěrbinami či otvůrky, ve kterých se procházející světlo ohýbá a dochází zde k interferenci. Tato skutečnost má rozhodující vliv na rozlišovací schopnost objektivu a na obrysovou ostrost (kontrast) obrazu. Čím víc maxim projde objektivem, tím více se jich může zužitkovat pro vytvoření obrazu, a tím bude obraz kvalitnější. Vedlejší maxima jsou od nultého vychýlená do stran a projdou tedy jen do objektivu s větším otvorovým úhlem. Protože numerická apertura (A; apertura = lat. otvor) je dána vztahem: A = n. sin α/ 2 (n = index lomu prostředí mezi objektivem a preparátem, α = vstupní úhel paprsků do objektivu), mají objektivy tím lepší rozlišovací schopnost, čím je hodnota jejich A větší. 4
5 4. Význam clonění při mikroskopování Clony a vlákno žárovky mají být centrovány doprostřed zorného pole. Cloněním ovlivňujeme tři vlastnosti mikroskopického obrazu, které určují jeho kvalitu: kontrast, hloubku ostrosti a rozlišení podrobností. Cloněním se nemá regulovat světelnost (jas), kterou regulujeme snížením proudu v lampě (regulátorem osvětlení) nebo pomocí matných filtrů. Nejlepšího rozlišení dosáhneme, pokud apertura objektivu bude stejná s aperturou kondenzoru (A obj = A kond). Pro každý objektiv upravujeme aperturu kondenzoru zvlášť. Postup pro nastavení správné apertury kondenzoru pro jednotlivé objektivy: 1. Objektivem 4x a poté 10x zaostříme objekt v trvalém preparátu. Aperturní clonu úplně uzavřeme. 2. Vyjmeme pravý okulár a tubusem pozorujeme osvětlenou zadní čočku objektivu. Pohybujeme páčkou kondenzorové clony a pozorujeme pohybující se okraj clony v zadní čočce objektivu. 3. Clonu otevřeme tak, aby se její okraj kryl s okrajem zadní čočky objektivu. Tím je dosaženo stejné apertury objektivu (10x) s kondenzorem a je splněna podmínka nejlepšího rozlišení. 4. Nasadíme zpět okulár a pozorujeme buňky při A obj. = A kond. Intenzitu osvětlení upravíme regulátorem osvětlení. Nyní zkusíme pohybovat páčkou kondenzorové clony a pozorujeme buňky při různém zaclonění. V praxi cloníme vždy o trochu víc než A obj = A kond (otevření clony nejčastěji na %), abychom získali kontrastnější obraz. Nemá se ale překročit mez, kdy průměr otvoru clonky odpovídá 1/3 průměru zadní čočky objektivu. Při větším clonění vznikají optické artefakty (např. světlé lemy kolem struktur, které jsou výsledkem výsledem ohybu světla, a jsou zobrazeny nečistoty v různých výškách média). Nadměrné přiclonění způsobuje zúžení světelného kužele vytvořeného kondenzorem; to snižuje číselnou aperturu kondenzoru i objektivu, a tím se zhoršuje rozlišovací schopnost, hloubka ostrosti se přitom zvětšuje. Je nutno počítat s tím, že čím víc přicloníme, tím víc artefaktů uvidíme (zvýšíme hloubku ostrosti a kontrast, takže mohou být zobrazeny i nečistoty ležící nad a pod pozorovaným objektem). Mezi artefakty patří různé nečistoty, krystalky barviva, vlákna papíru, vaty, otisky prstů, poškození vyvolaná preparací pletiva, tkáně a buněk Nedostatečné přiclonění způsobuje přesvětlení objektu, čímž se zmenšuje kontrast obrazu a zmenšuje hloubka ostrosti. Přesvětlený objekt může být pro pozorovatele neviditelný. Kvalitní obraz je vždy kompromisem mezi kontrastem, rozlišením a hloubkou ostrosti. Parametry kvalitního mikroskopického obrazu: Zorné pole je jasné, rovnoměrně osvětlené. Zobrazené objekty mají ostré struktury a jsou dobře rozlišitelné. Preparát neobsahuje artefakty. 5
6 Nejčastější chyby v mikroskopování: Nedodržení sledu jednotlivých úkonů. Preparát položený krycím sklem dolů. Použití nejdříve silně zvětšujícího objektivu. Nesprávné osvětlení a clonění. Necentrování objektu v zorném poli. Neproostřování pozorovaného objektu pomocí mikrošroubu. (Lidské oko při pozorování akomoduje, optická soustava mikroskopu akomodovat neumí!) 6
7 5. Měření velikosti mikroskopických objektů - měření délky a šířky Pomůcky: objektivové měřítko (objektivní mikrometr, OB měřítko) okulárové měřítko (okulárový mikrometr, OK měřítko) Objektivní mikrometr = broušená skleněná destička velikosti podložního skla, na níž je vyryto nebo fotografickou cestou naneseno měřítko v celkové délce nejčastěji 1 mm, dělené na 100 dílků. Jeden dílek odpovídá délce 10 µm. Okulárový mikrometr = sklíčko s měřítkem (1 cm dělený na 100 dílků nebo 0,5 cm dělený na 50 dílků) vložené v okuláru v rovině, kde vzniká obraz pozorovaného předmětu (tj. v místě okulárové clony). Při jeho použití místo běžného okuláru vidíme obraz předmětu a měřítko současně. Okulárové měřítko je očíslované (objektivové není). Postup měření: 1. Okulárem s měřítkem zaostříme objektivové měřítko. Obě měřítka srovnáme do rovnoběžné polohy otočením okuláru a posunem objektivového měřítka. Hledáme, která ryska OK měřítka se přesně kryje s některou ryskou OB měřítka, nejlépe v levé třetině pole. Podobně určíme shodu rysek v pravé třetině pole. Vypočítáme mikrometrický koeficient k: počet dílků OB měřítka * 10 k = odpovídající počet dílků OK měřítka [µm] Mikrometrický koeficient udává, kolika mikrometrům odpovídá jeden dílek OK měřítka pro daný objektiv. 2. OB měřítko vyměníme za preparát a určíme, kolika dílkům OK měřítka odpovídá délka a šířka objektu (např. buňky). Zjištěný údaj násobíme mikrometrickým koeficientem pro použitý objektiv. Mikrometrický koeficient platí jen pro určitý objektiv, okulár a danou délkou tubusu. Mění-li se některá z těchto složek, musí se koeficient vypočítat znovu. Je výhodné napsat si vypočítané koeficienty pro všechny objektivy do tabulky, kterou máme k dispozici, kdykoliv mikroskopujeme. 7
8 6. Práce s imerzním objektivem Při zaostřeném objektu preparátu objektivem 40x posuneme pozorovaný detail doprostřed zorného pole. Objektiv 40x posuneme doleva na poloviční vzdálenost k objektivu 100x, na povrch krycího skla do optické osy mikroskopu dáme kapku imerzního oleje (n = 1,5), zasuneme objektiv 100x (nehýbáme stolkem!) a mírným kývavým pohybem spojíme kapku oleje s čočkou objektivu. Obraz doostříme mikrošroubem. Upravíme kontrast obrazu clonou a intenzitu osvětlení regulátorem osvětlení. Užíváme tenkých krycích skel (0,17 mm a tenčích). Olej používáme pokud možno bez bublinek! Nemícháme oleje různých značek a firem dohromady. Pro fluorescenci - používání speciálního imerzního oleje bez autofluorescence. Funkce irisové clonky na kvalitnějším imerzním objektivu 100x (viz fluorescenční mikroskop BX60): při používání pozorování ve světlém poli - clona úplně otevřená, při fluorescenci - clona otevřená jen zčásti podle intenzity fluorescence. Úplný imerzní systém imerzní olej mezi krycím sklem a čelní čočkou objektivu + mezi čočkou kondenzoru a podložním sklem. Po skončení mikroskopování očistíme čočku objektivu (příp. kondenzoru) od oleje nejdříve na sucho, pak navlhčeným hadříkem ve směsi éter : etanol (7 : 3); podobně čistíme trvalý preparát. 8
9 7. Základní charakteristiky používaného školního mikroskopu Typ: školní mikroskop CHK-2; CX21 Olympus Objektivy achromatické (korekce barevné vady pro červené a modré světlo) pracovní vzdálenost rozlišení E A4x A* = 0,10 29 mm 3,4 µm E A10x A = 0,25 6,3 mm 1,3 µm E A20x A = 0,40 E A40x A = 0,65 (s pružinou) 0,53 mm 0,52 µm E A100x oil A = 1,25 (s pružinou) 0,2 mm 0,26 µm Okuláry CHWK 10x-T (číslo pole 18)**, možnost použití mikrometru průměr zorného pole***: 4,5 mm (obj. 4x) 1,8 mm (obj. 10x) 0,45 mm (obj. 40x) 0,18 mm (obj. 100x) Dioptrické nastavení levého okuláru v rozmezí plus minus 5D. Vzdálenost mezi pupilami nastavitelná v rozmezí mm. Kondenzor A (apertura) = 1,25 (s imerzí) Mechanická délka tubusu 160 mm (u firem Olympus, Nikon) Binokulární tubus skloněný o 45, otočný o 360, zvětšovací faktor 1 Stolek s křížovým posuvem Šroub pro jemné zaostření (mikrošroub), pravý s měřítkem: jedna otočka o 360 = 0,22 mm, jeden dílek měřítka = 1,1 µm Osvětlení: vestavěný iluminátor, halogenová žárovka 6 V 20 WHAL (Philips 7388) Nastavitelná intenzita světla (v noze stativu) kroužek regulátoru osvětlení Hmotnost 4,2 kg Příkon max. 20 VA *A = numerická apertura ** Číslo pole: číselná hodnota (v mm), která udává průměr obrazu otvoru clony pole v zorném poli okuláru. *** Průměr zorného pole (P): aktuální velikost zorného pole v mm (P = číslo pole okuláru / zvětšení objektivu) Zvětšení mikroskopu (M) M = M obj. M ok. k t (k t = zvětšovací faktor tubusu - u našeho mikroskopu = 1) Údaj o zvětšení je nutné napsat u každého nákresu (nebo mikrofotografie), psát nejlépe v rozepsané podobě (příklad: Z = obj. 10x, ok. 10x). Uvědomit si rozdíl mezi primárním (přímým) zvětšením a sekundárním (celkovým) zvětšením (u mikrofotografie). Užitečné zvětšení mikroskopu Pro objekty se středním kontrastem se užitečné zvětšení přibližně rovná 500 x apertura objektivu; u vysoce kontrastních objektů až 1000 x A obj. 9
10 blok 1 TÉMA: I Z O L A C E B U N Ě K; P O Č Í T Á N Í B U N Ě K Při izolaci konkrétního typu buněk je nezbytné ve vhodném médiu (pufru) šetrně dezintegrovat pletivo (tkáň) do určitého stupně (homogenizace). Homogenizaci je možno provést mechanicky nebo chemicky. Z mechanických postupů je možné uvést rozvolnění nebo roztrhání tkáně (pletiva) preparačními jehlami, roztlačení krycím sklem, seškrabání z povrchu orgánu skalpelem, odtržení buněk od pokožky (obtisky) po částečném zaschnutí, "kartáčování" místa řezu jemným štětcem, apod. Chemické postupy (macerace) umožňují pomocí maceračních roztoků různého chemického složení rozložení objektů na jednotlivé žádané prvky (např. buňky). U rostlin se často používá HCl, případně směs etanol:hcl; u živočichů pak 20% HNO 3 nebo směs voda:etanol (3:1), 30 až 40% roztok KOH aj. Pro potřeby tkáňových kultur se nejčastěji používají metody využívající kombinaci chemických a fyzikálních metod např. živočišné tkáně se nejdříve disociují vodnými roztoky proteolytických enzymů (trypsin, kolagenázy) a poté tzv. chelatačními činidly, která vyvazují z roztoků ionty Ca 2+ ; disociační roztoky rozruší postupně mezibuněčnou hmotu a mezibuněčné spoje. Pokud nedojde k samovolné disociaci na jednotlivé buňky, následuje jemné mechanické protřepání vzniklé buněčné suspenze, popřípadě se použije otáčení pístu v homogenizační zkumavce. V dalších krocích se provádí separace buněčných typů ze získaného homogenátu, a to sedimentací nebo opakovanou centrifugací, kdy využíváme rozdílů ve fyzikálních vlastnostech buněk (hmotnost, velikost). K separaci různých typů buněk se rovněž využívá jejich rozdílné přilnavosti k různě upraveným plastikovým nebo skleněným povrchům, popřípadě vazby určitých typů buněk na specifickou protilátku, předem navázanou na mikročástice. Využití suspenze: izolace buněčných složek k morfologickému a biochemickému výzkumu buněčných organel a makromolekul kultivace buněk diagnostické účely Úkoly: 1. Nesterilní izolace mikrospor; příprava buněčné suspenze Při izolaci konkrétního typu buněk je nezbytné ve vhodném médiu (pufru) šetrně dezintegrovat pletivo (tkáň) do určitého stupně (homogenizace). Homogenizaci je možno provést mechanicky (např. roztrhání jehlami) nebo chemicky (působení vodných roztoků proteolytických enzymů). V dalších krocích lze ze získaného homogenátu opakovanou centrifugací separovat jeho složky (buňky daného typu) podle jejich hmotnosti a velikosti. Materiál: poupata petúnie (Petunia hybrida) Chemikálie: destilovaná voda, 4 % sacharóza 10
11 Přístroje a pomůcky: preparační jehly, pinzeta, centrifugační kyvety se stojánkem, kádinky, skleněná tyčinka, uhelon o pórech 230 µm a 57 µm, pipety, mikropipety, Pasteurova pipeta, centrifuga Postup: 1) Vypreparujte prašníky z 5 poupat. 2) Vložte je do kádinky s 1 ml 4 % roztoku sacharózy a rozdrťte pomocí skleněné tyčinky. 3) Přefiltrujte přes uhelon s průměrem pórů 230 µm do kádinky (uhelon před použitím navlhčete destilovanou vodou). 4) Poté znovu filtrujte přes uhelon s póry 57 µm do centrifugační kyvety (fixem kyvetu označte svým jménem!). 5) Doplňte do objemu 4 ml 4 % roztokem sacharózy. 6) Připravenou suspenzi centrifugujte 3 minuty (100 g). Dbejte na vyvážení centrifugy! 7) Supernatant opatrně slijte a sediment doplňte 4 % roztokem sacharózy do objemu 6 ml. 8) Centrifugaci opakujte. 9) Sediment nesuspendujte (=rozpusťte) v 0,5 ml 4 % sacharózy. 10) Připravenou suspenzi použijte ke stanovení hustoty mikrospor. 2. Stanovení hustoty suspenze Hustota buněk je udána jejich počtem v objemové jednotce. Při počítání buněk tedy stanovujeme jejich počet na jednotku objemu. Počítání buněk lze provádět automaticky např. pomocí průtokového cytometru, kdy je laserový paprsek soustředěn na proud buněk v suspenzi a světlo rozptýlené a emitované pohybujícími se buňkami je snímáno detektorem a konvertováno do podoby vhodné pro elektronickou analýzu. V některých případech je užitečné buňky spočítat ručně s využitím vhodné počítací komůrky a mikroskopu. Komůrku o známém objemu vyplníme buněčnou suspenzí, buňky v ní spočítáme a získaný údaj přepočítáme na objemovou jednotku dané suspenze (většinou na 1 ml). Metoda se prakticky užívá především v hematologii (počítání erytrocytů a leukocytů) a mikrobiologii (určování počtu např. kvasinek, spor, prvoků, jednobuněčných řas). Příkladem často používané používané počítací komůrky je Bűrkerova komůrka. Jde o upravenou tlustou skleněnou desku (podložní sklo) s 2 počítacími sítěmi a počítacími prostory o hloubce 0,1 mm. Přikrývá se výhradně speciálním krycím sklem. Dno komůrky je rozděleno na čtvercová políčka velká a malá. Malý čtverec má plochu 1/400 mm 2 a objem prostoru nad ním je 1/4000 mm 3. Velký čtverec má plochu 1/25 mm 2 a objem prostoru nad ním je 1/250 mm 3. 11
12 Pro stanovení počtu buněk (n) v 1 mm 3 suspenze obecně platí: n = p/y. v. h. z p = celkový počet spočítaných buněk y = počet čtverců, v nichž byly buňky počítány v = převrácená hodnota plochy použitého čtverce h = převrácená hodnota hloubky komůrky z = použité ředění suspenze Aktivně se pohybující buňky (prvoci) musí být před počítáním usmrceny vhodnou fixací. Příliš hustou suspenzi buněk je třeba před hodnocením vhodně ředit tak, aby v jednom čtverci bylo max. 10 buněk. Naopak je-li hustota buněk příliš malá provádíme zahušťování suspenze (tj. sediment buněk po odstředění resuspendujeme v menším objemu). Materiál: homogenní suspenze mikrospor Pomůcky: Bűrkerova počítací komůrka, mikropipeta, světelný mikroskop, kalkulačka Postup: 1) Na čistou a suchou Bűrkerovu komůrku položte krycí sklíčko. 2) Připravenou suspenzi homogenizujte dobrým protřepáním. Napipetujte kapku (10 µl) suspenze ze strany na hranu krycího skla. 3) Komůrku obraťte a stejným způsobem naplňte i druhé počítací pole. Naplněnou komůrku nechte asi 2 minuty v klidu, aby se buňky usadily. 4) Komůrku založte do mikroskopu a zaostřete na počítací mřížku. 5) Prohlížíme při středním zvětšení s přicloněným kondenzorem (přivřená aperturní clona kondenzoru) metodou meandrovitého posunu preparátu a provádíme vlastní počítání. Pro počítání mikrospor využijte v e l k ý c h č t v e r c ů o ploše 1/25 mm 2 a objemu 1/250 mm 3. Abychom nepočítali buňky ležící na rozhraní sousedních čtverců dvakrát, počítáme zásadně jen ty, které leží nebo se dotýkají pouze 2 vybraných sousedních stran čtverce (např. horní a levé). A) Z připravené suspenze vyhodnoťte 2 v z o r k y (tj. 2 kapky); pro každý hodnocený vzorek spočítejte buňky n e j m é n ě v 10 č t v e r c í c h. Po ukončení počítání obě části komůrky oddělte, opatrně opláchněte vodou a vytřete dosucha. B) Suspenzi vhodně nařeďte, znovu vyhodnoťte. Oba výsledky porovnejte. 12
13 Výsledky stanovení hustoty suspenze mikrospor A) neředěná suspenze čtverec č celkem hustota suspenze I. vzorek počet buněk II.vzorek počet buněk n = p/y. v. h. z B) ředěná suspenze čtverec č celkem hustota suspenze I. vzorek počet buněk II.vzorek počet buněk n = p/y. v. h. z 13
14 Schéma počítací mřížky Bűrkerovy komůrky 14
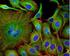
15 blok 2 TÉMA: FLUORESCENČNÍ MIKROSKOPIE PRINCIP, APLIKACE V BUNĚČNÉ BIOLOGII Fluorescenční mikroskopie je založena na jevu zvaném fluorescence, kdy některé látky po dopadu světla o kratší vlnové délce emitují světlo o delší vlnové délce. Rozlišujeme autofluorescenci resp. primární fluorescenci a sekundární fluorescenci. Autofluorescence je schopnost některých přirozeně se vyskytujících látek (např. vitamin A, alkaloidy, chlorofyl) fluoreskovat po ozáření ultrafialovým světlem. Sekundární fluorescence je fluorescence barviva navázaného na zkoumané (buněčné) struktury. Fluorescenční barviva (fluorochromy) jsou látky vyrobené uměle nebo izolované z jiného biologického materiálu, které mají schopnost se vázat k určitým buněčným strukturám. Pro správné použití fluorochromů je nezbytná znalost jejich základních parametrů: afinity, excitační a emisní vlnová délky. Princip fluorescenční mikroskopie Na vzorek dopadá světlo v intervalu vlnových délek způsobujících excitaci, ale k vytvoření obrazu je použita jen část světla vzniklého fluorescencí. Základní části fluorescenčního mikroskopu jsou: - zdroj UV záření - vysokotlaká rtuťová výbojka - excitační (budící) filtry - ze světelného zdroje selektivně vymezují záření o určité vlnové délce vhodné ke vzbuzení fluorescence - bariérové (zábranné) filtry - filtrují světlo vnikající do okuláru resp. selektují vlnovou délku vzhledem k optimální emisi použitého fluorochromu Systém filtrů, který vybírá vlnové délky procházející systémem, je podstatnou součástí fluorescenčního mikroskopu. Absorpce a emise světla je charakteristická pro konkrétní látku (fluorochrom). Ve fluorescenční mikroskopii je tedy mimořádně důležitá volba vhodných optických filtrů pro danou aplikaci. V našem případě máme k dispozici mikroskop Olympus BX60 s 2 hranoly (soustavami filtrů) označenými WU a WB. Transmisní křivky hranolů hranol excitace emise WU nm od 420 nm WB nm od 515 nm Příklady využití fluorescenční mikroskopie při studiu buňky - kontrastování buněčných struktur - rozlišení živých a mrtvých buněk - vizualizace buněk např. průkaz patogenních bakterií v pletivu nebo v tkáni - detekce apoptózy, studium buněčného cyklu 15
16 Aplikace fluorescenční mikroskopie K nejčastěji využívaným metodám v biologii a medicíně patří tzv. imunofluorescence, založená na fluorescenčním značení protilátek, které specificky detekují přítomnost antigenů nebo průběh určité reakce. Využití imunofluorescenčních technik v klinické praxi - identifikace buněk B a T v krvi - průkaz specifických protilátek přítomných v séru - průkaz imunoglobulinů ve tkáních - rychlá identifikace mikroorganismů ve tkáních a kulturách - průkaz nádorově specifických antigenů v neoplazmatických tkáních - identifikace transplantačních antigenů v různých tkáních - lokalizace hormonů a enzymů - kvantitativní stanovení proteinů a protilátek v tělních tekutinách Příklady primární fluorescence v rostlinných buňkách a pletivech zdroj excitace emise chlorofyl modrá ( nm, do 550) červená (max 685 nm) kutin (kutikula) UV (365 nm) bílo-modrá svěrací buňky fialová (450 nm) zelená (520 nm) lignin (sekundární buněčné stěny elementů xylému) UV (365 nm) modrá ( nm) zelená ( nm) protoligniny fialová ( nm) modrá (nad 470 nm) suberin UV (365 nm) žlutá při ph 9,1 sporopolenin UV (365 nm) žlutočervená Fluorescenční parametry některých fluorochromů fluorochrom exitace emise nm hranol fluoresceindiacetát (FDA) 495 nm 520 nm IB calcein/am 495 nm 520 nm IB 4, 6 - diamidino phenylindole HCl (DAPI ) 372 nm 456 nm U acridine Orange 490 nm 530 nm, 640 nm fluorescein-isothiocyanate (FITC) 490 nm 520 nm IB B, IB 16
17 Úkoly: 1. Primární fluorescence struktur v příčném řezu řapíkem materiál: čerstvý řapík jabloně (Malus sp.) postup: 1) Žiletkou nařežeme několik tenkých příčných řezů řapíkem a připravíme vodní preparát. 2) Pozorujeme pod světelným mikroskopem - zorientujeme se v řezu, schematicky zakreslíme. 3) Poté pozorujeme pod fluorescenčním mikroskopem - použijeme filtry WB i WU. Zjistíme lokalizaci a charakter (barva, intenzita) autofluorescenčního signálu, zaznamenáme do protokolu. 2. Sekundární fluorescence struktur pokožky cibule kuchyňské po působení DAPI ( 4, 6 diamino-2-phenylindole) materiál: pokožka vnitřní suknice cibule kuchyňské (Allium cepa) chemikálie: pracovní roztok fluorochromu DAPI (konc. 1µg/ml ) parametry: specifická vazba na A-T oblasti dvoušroubovice DNA; excitační vlnová délka = 372 nm; emisní = 456 nm postup: 1) Preparovanou pokožku dáme na podložní sklo a zakápneme pracovním roztokem DAPI. Necháme inkubovat cca 2 minuty a poté přikryjeme krycím sklem. 2) Pozorujeme pod fluorescenčním mikroskopem. Zjistíme lokalizaci fluorescenčního signálu v pletivech a v buňkách, jeho charakter (barva, intenzita) - pro filtr WU i WB. Zaznamenáme do protokolu. 17
18 Výsledky pozorování Materiál řapík (intaktní) Použitý hranol WB Lokalizace, barva a charakter fluorescenčního signálu WU epidermis (DAPI barvení) WU WB 18
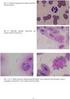
19 blok 3 TÉMA: TESTY ŽIVOTASCHOPNOSTI BUNĚK. VLIV NÍZKÝCH TEPLOT NA BUŇKU. KRYOPREZERVACE. Rozlišení živých a mrtvých buněk Životnost buněk patří k základním sledovaným parametrům při práci s buňkami. Při kultivaci buněk pro různé účely (např. při hodnocení cytotoxického účinku určité látky nebo vlivu určitého faktoru na buňku) je důležité nejen monitorovat růst populace, ale také spolehlivě rozlišit živé a mrtvé buňky v kultuře. Stanovení životnosti je prováděno také u buněk, které byly skladovány zamražením (kryoprezervace) před jejich dalším použitím ve výzkumu nebo v klinické praxi. Existuje mnoho konkrétních metod, které je možno pro stanovení viability buněk použít. Některé metody testování životnosti buněk jsou založeny na předpokladu, že každá živá buňka je schopna se množit tedy každá živá buňka z hodnocené vhodně naředěné suspenze dá na vhodném kultivačním médiu vznik jedné kolonii buněk (počítání narostlých kolonií). Další skupina metod vychází z předpokladu plně zachované membránové a funkční integrity živé buňky. Životnost buněk je hodnocena po působení barviv klasických (např. trypanová modř, metylenová modř) nebo fluorescenčních (např. PI - propidium jodid). Testy tohoto typu jsou založeny na předpokladu, že použité barvivo neproniká do buňky s intaktními membránami a aktivním metabolismem. Buňky s narušenou plazmatickou membránou či metabolismem se nejsou schopny bránit proti pronikání barviva resp. nejsou schopny jej metabolizovat a zabránit jeho akumulaci uvnitř buňky (intenzívní změna zbarvení buňky). Detekce funkčního metabolismu buňky je dalším možným přístupem při zjišťování životnosti buněk. U tohoto typu testů živá buňka s fungujícím enzymatickým vybavením přeměňuje podanou látku na derivát, který je pak nějakým způsobem zjišťován nebo kvantifikován (např. kolorimetricky nebo měřením fluorescence). Jako příklad může sloužit přeměna nepolárního fluorescein diacetátu (FDA), který snadno pronikne přes plazmatickou membránu na vysoce polární produkt - fluorescein, který se v buňce hromadí a oproti FDA má schopnost fluoreskovat. 1. Stanovení životaschopnosti buněk barvením metylenovou modří Test vychází z předpokladu selektivní propustnosti plazmatické membrány živé buňky. Metylenová modř do živých buněk neproniká, zatímco do mrtvé buňky s porušenou plazmatickou membránou se toto barvivo dostává snadno a uvnitř buňky se hromadí. Hodnocení: buňky nezbarvené nebo velmi slabě obarvené jsou živé; intenzivně modře zbarvené jsou mrtvé. Procento zbarvených buněk odpovídá podílu mrtvých buněk v suspenzi. Úkol: Zjistěte procentuální viabilitu buněk v (kontrolní) suspenzi kvasinek Materiál: kvasinková suspenze (Saccharomyces cerevisiae - kvasinka pivní) Chemikálie: alespoň 14 dní starý roztok metylenové modře (0,01 % ve vodě) Pomůcky a přístroje: pipeta, potřeby pro mikroskopování ; světelný mikroskop 19
20 Postup: 1) Na podložním skle smísíme kapku suspenze (suspenzi před použitím zhomogenizujeme protřepáním!) s kapkou barviva. 2) Inkubujeme cca 2 min a pak přikryjeme krycím sklem. 3) Pod mikroskopem počítáme zbarvené a nezbarvené kvasinkové buňky v 10 různých zorných polích (použijte objektiv 40x ; popř. 100x + imerzní olej). Stanovíme % životaschopných buněk. 2. Testování vlivu nízkých teplot na životaschopnost kvasinek Nízká teplota - teploty blízké bodu mrazu (chladový šok) a pod bodem mrazu (mrazový šok) způsobují - reverzibilní nebo irreverzibilní poškození buněk. Rostlinné buňky, zvláště ty s nízkým obsahem vody, jsou vůči nízké teplotě obecně odolnější než živočišné. Většina buněk živočichů je v přírodních podmínkách mrazovým šokem nevratně poškozována, neboť mrazové krystaly naruší strukturu buněk. Poškození buněk nastává při zmrazování i při rozmrazování (účinky obou mechanismů se zpravidla sčítají). Důležitý je obsah vody v buňkách (čím méně vody, tím je mrazová rezistence větší), i na rychlosti odvodu tepla při zmrazení a na rychlosti při rozmrazení. Zmrazování je často používanou metodou umožňující dlouhodobou konzervaci buněk a tkání (kryokonzervace). Zmrazovací režimy jsou voleny podle konkrétního typu materiálu. Využívá se jednak pomalé zamrazování spočívající v postupném řízeném zchlazování materiálu výkonným automaticky řízeným chladícím agregátem. Dochází k postupné dehydrataci buněk, kdy se led tvoří jen v extracelulárním prostoru. Při rychlém hlubokém zmrazení buňky vložíme do tekutého dusíku (-196 o C) nebo hélia (-269 o C). Nastává tzv. vitrifikace buněčné vody, při níž jsou vzniklé ledové krystaly velké jen několik nanometrů a nepoškozují obsah buňky. K náhradě části buněčné vody při hlubokém zmrazování je často nutné přidat vyšší - potenciálně toxickou - koncentraci ochranných médií tzv. kryoprotektiv (např. glycerol, dimetylsulfoxid, polyetylenglykol, manitol, sacharóza), abychom snížili mrazové poškození buněk. Vzorek zůstává v ideálním případě celý v amorfním stavu. Některé buňky (hlavně mikroorganismy) je možno po zmrazení částečně dehydratovat odsublimováním vody ve vakuu (mrazová sublimace neboli lyofilizace) a uchovávat je tak v životaschopném stavu po řadu let (sbírkové kultury). Využití zmrazovacích postupů: zmrazování spermií (tzv. genofondové banky pro umělé inseminace a oplodnění in vitro) tkáňové banky (zmrazené transplantáty kostních, chrupavkovitých, epiteliálních tkání, celá embrya) uchovávání genofondu ohrožených a vzácných organismů a modelových organismů Před dalším použitím takto uchovávaných buněk je nutno otestovat jejich vitalitu. 20
21 2. 1. Stanovení procentuální viability buněk kvasinkové suspenze po hlubokém zmrazení Materiál: kvasinková suspenze Chemikálie: metylenová modř (0,01 % ve vodě), tekutý dusík Pomůcky a přístroje: pipeta, kryozkumavky, potřeby pro mikroskopování; světelný mikroskop, vodní lázeň Postup: 1) Do kryozkumavky napipetujeme 0,5 ml suspenze, uzavřeme a označíme fixem. 2) Kryozkumavku vložíme do nádoby s tekutým dusíkem (-196 O C) na 20 minut. 3) Poté zkumavku přeneseme do vodní lázně 30 o C a inkubujeme cca 5 min. 4)Testujeme životnost buněk barvením metylenovou modří jako u kontrolní suspenze Stanovení procentuální viability buněk kvasinkové suspenze po zmrazení Materiál: kvasinková suspenze Chemikálie: metylenová modř (0,01 % ve vodě) Pomůcky a přístroje: pipeta, kryozkumavky, potřeby pro mikroskopování; světelný mikroskop, vodní lázeň Postup: 1) Kryozkumavku s 0,5 ml suspenze necháme zmrznout v mrazáku (-18 O C). 2) Po pozvolném rozmrznutí na vodní lázni 3) Poté zkumavku přeneseme do vodní lázně 30 o C otestujeme životaschopnost buněk pomocí metylenové modře. Počty zbarvených a nezbarvených buněk zaznamenáváme do tabulky a vypočítáme % vitalitu buněk v jednotlivých suspenzích. Vlastní výsledky konfrontujeme s výsledky kolegů a okomentujeme zda zmrazení resp. hlub. zmrazení ovlivňuje životaschopnost buněk kvasinek vůbec. 21
22 Výsledky hodnocení životaschopnosti buněk suspenze kontrolní zmrazená -18 o C hlubokozmrazená o C zorné pole počet buněk zbarvených bezbarvých % životaschopnost 22
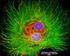
23 blok 4 TÉMA: ŽIVOČIŠNÁ BUŇKA, BUNĚČNÉ JÁDRO. Úkoly: 1. Intaktní živočišná buňka Materiál: stěr buněk lidské bukální sliznice Chemikálie: fyziologický roztok Pomůcky a přístroje : sterilní špejle, mikroskopické potřeby; světelný mikroskop Postup: 1) Provedení stěru: Po vypláchnutí úst zlehka setřeme suchou sterilní špejlí (popř. špachtlí) povrch vnitřní strany bukální sliznice dutiny ústní a materiál ihned naneseme na suché podložní sklo. Na okraji skla rydlem označíme polohu stěru (materiál je bezbarvý). 2) Na čerstvý stěr přikápněte kapku fyziologického roztoku a přikryjte krycím sklem. 3) Pod mikroskopem vyhledejte ploché velmi často preparací deformované buňky dlaždicovitého epitelu s relativně velkými jádry. Při pozorování tohoto bezbarvého materiálu je nutno silně přiclonit! Vybrané nepoškozené epitelové buňky pozorujte větším zvětšením, zakreslete a popište. Výsledek pozorování vyjádřete také slovně. 2. Buněčné jádro Buněčné jádro je obligátní typickou strukturou eukaryotní buňky umožňující uchování a využití genetické informace. Mikroskopický resp. morfologický obraz jádra závisí na pozici buňky v buněčném cyklu. V interfázi můžeme jádro zastihnout v podobě většinou kompaktního oddílu, který je ohraničen vlastní membránou a který je dále složitě vnitřně strukturován. Nejpodstatnější složkou jádra je chromatin, což je komplex deoxyribonukleové kyseliny, histonů a dalších nehistonových proteinů. V době mitózy jsou po vhodném obarvení materiálu patrné chromozómy, které přestavují kondenzovanou formu chromatinu umožňující přesné rozdělení genetické informace do jader dceřinných Jádro epitelové buňky kontrastované DAPI DAPI (4, 6 diamino-2-phenylindole) je fluorescenční barvivo, které se specificky váže na DNA tak, že interkaluje v dvoušroubovici a to přednostně v oblastech bohatých na AT. Buněčné jádro je strukturou, která obsahuje velké množství DNA a na ni navázané DAPI tak jaderné struktury zviditelní. Materiál: stěr buněk lidské bukální sliznice Chemikálie: fluorochrom DAPI (4, 6 diamino-2-phenylindole) - pracovní roztok (konc. 1µg/ml) Pomůcky a přístroje: mikroskopické potřeby, mikropipeta, fluorescenční mikroskop (hranol WU) 23
24 Postup: 1) Příprava stěru viz výše. 2) Na čerstvý stěr přikápneme pomocí mikropipety kapku pracovního roztoku DAPI a přikryjeme krycím sklem. 3) Pozorujeme pod fluorescenčním mikroskopem s použitím hranolu WU. Hodnotíme přítomnost jader, jejich tvar, relativní velikost (v poměru k velikosti buňky) a jejich strukturu (homogenní-heterogenní). Výsledek pozorování zaznamenáme do protokolu Jádro epitelové buňky barvené Feulgenovou reakcí Feulgenova reakce je klasickou histochemickou metodou k důkazu DNA v jádře, popř. mimo něj. Princip: při mírné hydrolýze kyselinou chlorovodíkovou se z řetězců DNA odštěpují purinové báze a v místě jejich odštěpení se na podjednotkách cukru (deoxyribózy) uvolňují aldehydické skupiny, které redukují Schiffovo činidlo (kys. fuchsinsiřičitá) a dávají s ním červenofialové zbarvení. Materiál: stěr buněk lidské bukální sliznice Chemikálie: fixační směs (etanol - metanol 1 :1), 1N HCl, Schiffovo reagens, dest. voda Pomůcky a přístroje: kyvety na barvení, vodní lázeň, mikroskopické potřeby; světelný mikroskop Postup: 1) Příprava stěru viz výše.!! pozn. po celou dobu manipulace s preparátem dbáme na správnou orientaci skla!! 2) Zaschlý stěr epiteliálních buněk fixujeme 25 min ve fixační směsi, poté opláchneme destilovanou vodou (střičkou). 3) Hydrolyzujeme 10 min v 1N HCl při 60 o C a po vyjmutí z lázně sklo opět opláchneme vodou. 4) Barvíme 30 min v Schiffově reagens. 5) Opláchneme vodou, stěr přikryjeme krycím sklem a pozorujeme pod mikroskopem. Zakreslete buňku s obarveným jádrem a slovně zhodnoťte výsledek. Pokuste se určit počet jadérek v obarvených jádrech a vysvětlete, proč se jadérka nezbarvila. 24
25 2. 3. Jádra buněk meristémů kořenových špiček zástupců r. Allium Vývoj rostlinného těla je umožněn dělením, růstem a diferenciací buněk. Buněčné dělení probíhá u rostlin v tzv. meristémech dělivých pletivech. Meristémy se nacházejí mimo jiné na vrcholu stonku a kořene (apikální meristémy zajišťující primární růst). Apikální kořenový meristém je po nabarvení vhodným materiálem pro demonstraci mitotického jádra (různé fáze mitózy) Pozorování jader na čerstvých roztlakových preparátech po barvení podle Feulgena Materiál: kořenové špičky A. cepa (cibule kuchyňská) a A. schoenoprasum (česnek pažitka) obarvené podle Feulgena Chemikálie: 45 % kyselina octová Pomůcky a přístroje: mikroskopické potřeby; světelný mikroskop Postup přípravy roztlakového preparátu: 1) Kořínek umístíme na podložní sklíčko a žiletkou odpreparujeme tmavěji zbarvenou špičku. 2) Zakápneme 45 % kyselinou octovou a macerujeme asi 2 minuty. 3) Přikryjeme krycím sklíčkem a zlehka roztlačíme. Pozn.: Trvanlivost preparátů uzavřených v samotné kyselině octové je vzhledem k jejímu rychlému vypařování značně omezená. Prohlédneme celý roztlak pod mikroskopem. Pozorujeme intenzívně zbarvená kompaktní interfázní jádra. Ověříme přítomnost jader v mitóze (chromozómy). Slovně zhodnoťte kvalitu preparátu a výsledky pozorování Pozorování jader na trvalých roztlakových preparátech Materiál: trvalé preparáty meristémů kořenových špiček vybraných druhů r. Allium Pod mikroskopem prohlédneme celý roztlak. Pozorujeme intenzívně fialově probarvená kompaktní interfázní jádra a jádra v různých fázích mitózy. Určete počet jadérek v interfázních jádrech. Vyhledejte kompletní metafázi a pokuste se určit počet chromozómů daného druhu. V protokolu slovně zhodnoťte výsledky pozorování. 25
26 Blok 5 Téma: BIOMEMBRÁNA. PLAZMATICKÁ MEMBRÁNA. OSMÓZA. Úkoly: 1. Autoagregace fosfolipidů Složitější molekulární útvary (nadmolekulární soustavy) mohou vznikat ze svých složek v souladu s termodynamickými zákony samosestavováním (autoorganizací). Autoagregační pochody probíhají u anorganických i organických sloučenin, mimo buňku i uvnitř buněk. Uplatňují se při nich zejména: vodíkové vazby, iontové a hydrofobní intrakce. Základem membránových struktur všech buněk je bimolekulární vrstva lipidů typu lecitinů. Lecitiny (viz schema) jsou amfifilní fosfolipidy, jejichž molekuly obsahují hydrofobní (koncové -CH 3 skupiny) i hydrofilní (glycerol, kys. fosforečná a cholin) skupiny. Vykazují povrchovou aktivitu ve styku s polární tekutinou (vodou), kdy se sestavují v pravidelné struktury - poměrně stabilní molekulární dvojvrstvu o tloušťce cca 5 nm. K této dvojvrstvě se paralelně velmi rychle přiřazují další dvojvrstvy, od sebe odděleny mezivrstvou vodních molekul až vznikne nadmolekulární struktura (tzv. myelinový útvar) pozorovatelná mikroskopem. Chemikálie: lecitin, 0,1 % vodný roztok KOH (popř. voda) Pomůcky a přístroje: kapátko, jehla, mikroskopické potřeby; světelný mikroskop. Postup: 1) Malé množství (cca 1/2 mm 3 ) lecitinu přeneseme pomocí jehly na podložní sklo a rozmázneme do tenké vrstvy. Zlehka přikryjeme krycím sklem. 2) Pod mikroskopem při malém zvětšení vyhledáme okraj lecitinového materiálu (jeví se černě). 3) Necháme preparát na stolku mikroskopu a na hranu krycího sklíčka přikápneme kapku KOH. 4) Sledujeme rozhraní suchého a mokrého lecitinu a právě zde pozorujeme vzniku váčkovitých útvarů. Celý proces autoorganizace probíhá poměrně rychle! Vzniklé váčkovité tzv. myelinové útvary (mnohovrstevné fosfolipidové váčky) schematicky zakreslíme. 26
27 2. Plazmatická membrána erytrocytů Povrchová membrána erytrocytu má typické složení i strukturu plazmatické membrány. Erytrocytární membrána je pro svou jednoduchost, relativní dostupnost a snadnou izolaci vhodným modelovým objektem pro studium vlastností biomembrán Indukovaná hemolýza V přítomnosti tritonu (nebo jiného detergentu = látka snižující povrchové napětí) ztrácí bimolekulární film fosfolipidů v plazmatické membráně stabilitu a rozpadá se na kulovité micely. U erytrocytů, které jsou na působení podobných látek zvláště citlivé, nastává chemická hemolýza a jejich obsah se vylévá do prostředí. Materiál: suspenze savčích erytrocytů Chemikálie: fyziologický roztok, 2% triton (detergent) Pomůcky: mikroskopické potřeby; světelný mikroskop Postup: 1) Ke kapce fyziologického roztoku na podložním skle přidáme malou kapku suspenze erytrocytů (do růžového zbarvení), promícháme a přikryjeme krycím sklem. 2) Pozorujeme postupně malým a velkým zvětšením plovoucí intaktní erytrocyty typického tvaru. 2) Aniž bychom sundávali preparát ze stolku mikroskopu, kápneme na hranu krycího skla roztok tritonu. 3) Prohlédneme preparát velkým zvětšením postupně od středu k hraně, u níž je kapka tritonu, a najdeme hranici, u níž probíhá rozpad krvinek. Pozorujeme jeden vybraný erytrocyt až do jeho rozpadu (rozplynutí). Při správném zaclonění vidíme v místě erytrocytu po určitou dobu ještě jeho bezbarvý "stín" ze zbytků buněčných struktur, zejména cytoskeletu. Výsledek pozorování popíšeme. pozn. Podobný rozpad erytrocytů lze pozorovat po jejich převedení do hypotonického roztoku. V tomto případě jde ovšem o osmotickou hemolýzu, kdy plazmatická membrána není porušena, ale praská mechanicky při zvětšování objemu buňky, která nasává vodu Plazmorhiza erytrocytů Polopropustnou membránou mohou volně procházet malé molekuly (rozpouštědlo), větší molekuly membránou neprojdou (osmotické jevy). Polopropustný charakter má i povrchová membrána erytrocytu. Koncentrace osmoticky aktivních látek v okolí buňky může být vyšší (hypertonie), nižší (hypotonie) nebo stejná (isotonie) jako koncentrace těchto látek v cytoplazmě. 27
28 V hypertonickém roztoku nastává u krvinky tzv. plasmorhiza tj. pozorujeme svrašťování buněk. Plasmorhizované svraštělé krvinky tvoří typické ježkovité formy tzv. echinocyty. Materiál: suspenze savčích erytrocytů Chemikálie: 1 M CaCl 2 Pomůcky: mikroskopické potřeby; světelný mikroskop Postup: 1) Ke kapce suspenze erytrocytů na podložním skle přidáme kapku 1M CaCl 2, promícháme a přikryjeme krycím sklem. 2) Pozorujeme pod mikroskopem (objektiv 40x; 100x + imerzní olej!). Změnu tvaru erytrocytů zakreslíme a popíšeme Indukovaná fúze erytrocytů Plazmatická membrána odděluje jednotlivé buňky resp. zabraňuje jejich spontánnímu spojování fúzím. U specializovaných buněčných typů probíhají geneticky naprogramované fúze buněk (tzv. fyziologické fúze) např. fúze gamet při oplození. Spojení buněk lze navodit také experimentálně, a to narušením stability plazmatické membrány pomocí virů (Sendai virus), působením chemických látek tzv. fúzogenů (např. PEG) nebo působením elektrického pole. Materiál: suspenze erytrocytů Chemikálie: fyziologický roztok, 30 % polyetylenglykol (PEG) v 0,01M CaCl 2 Pomůcky: mikroskopické potřeby; světelný mikroskop; vodní lázeň; mikropipety Postup: 1) K 100 µl suspenze krvinek přidáme 1 ml roztoku PEG, lehce protřepeme a necháme 20 min inkubovat ve vodní lázni při 30 C. 2) Kapku suspenze (30µl) přeneseme na podložní sklo, zlehka přikryjeme krycím sklem. Pozorujeme pod mikroskopem masy shluklých erytrocytů. 3) Zředíme fyziologickým roztokem a hledáme polyerytrocyty. Polyerytrocyty schematicky zakreslíme. 3. Traubeho model osmotické soustavy Traubeho měchýřek je anorganickým (chemickým) modelem osmózy. Krystaly ferokyanidu draselného se rozpouští a reakcí s ionty mědi tvoří semipermeabilní membránu ferokyanidu měďnatého, která má tvar měchýřku. Koncentrovaný roztok uvnitř měchýřku nasává osmoticky vodu z roztoku Cu SO 4, zvětšuje se až praskne, vylije se z něj roztok ferokyanidu draselného, který při styku s Cu SO 4 okamžitě reaguje tj. formuje se nová membrána. 28
29 Interakcí dvou jednoduchých soustav (roztoků anorganických látek) vzniká komplexnější soustava (osmotická soustava) s jinou strukturou a vlastnostmi: membrána - semipermeabilita - osmóza - měchýřky - jejich růst, pohyby a tvarové změny. Chemikálie: 2% vodný roztok Cu SO 4, krystalický ferokyanid draselný K 4 Fe (CN) 6 Pomůcky a přístroje: zkumavka, stojánek, pinzeta; světelný mikroskop Postup: a) Zkumavku naplníme do poloviny roztokem síranu měďnatého a přidáme několik krystalů ferokyanidu draselného. Makroskopicky pozorujeme růst měchýřků. Zakreslíme stav ve zkumavce po několika minutách. b) Na podložní sklíčko do kapky roztoku síranu měďnatého přidáme několik krystalů ferokyanidu draselného. Pozorujeme pod mikroskopem (bez krycího sklíčka!) při malém zvětšení (4x). Sledujeme vznik ferokyanidu meďnatého v podobě semipermeabilní membrány resp. dynamiku tvorby měchýřků. 29
30 Doporučená literatura Alberts, B. a kol.: Základy buněčné biologie. Espero Publishing,Ústí n. L., Bózner, A. a kol.: Cytológia. Osveta, Martin Hejtmánek, M. a kol.: Praktická cvičení z biologie. Skripta LF UP Olomouc Hejtmánek, M.: Úvod do světelné mikroskopie. Skripta UP Olomouc Chira E.: Fluorescenční metódy v šlachtení. 1. vyd. Bratislava, Príroda, Janisch, R.: Moderní poznatky lékařské biologie VI. Imunofluorescenční techniky ve výzkumu buňky a medicíně. Skripta LF Masarykovy Univerzity, Brno Knoz, J., Opravilová, V. : Základy mikroskopické techniky. Skripta MU Brno Nečas, O. a kol.: Obecná biologie pro lékařské fakulty. Most, H & H Paleček, J.: Biologie buňky. I. Základy mikroskopické cytologie. Skripta UK Praha Ruzin, S.E.: Plant microtechnique and microscopy. New York, Oxford, Oxford University Press Nebesářová, J.: Elektronová mikroskopie pro biology ( 30
Ž i v o t n o s t (= životaschopnost = vitalita = viabilita)
 Ž i v o t n o s t (= životaschopnost = vitalita = viabilita) počet živých buněk. 100 = ---------------------------------------- [%] počet všech buněk V y u ž i t í : při kultivaci buněk pro různé účely
Ž i v o t n o s t (= životaschopnost = vitalita = viabilita) počet živých buněk. 100 = ---------------------------------------- [%] počet všech buněk V y u ž i t í : při kultivaci buněk pro různé účely
Základní pojmy a vztahy: Vlnová délka (λ): vzdálenost dvou nejbližších bodů vlnění kmitajících ve stejné fázi
 LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 1. SVĚTELNÁ MIKROSKOPIE A PREPARÁTY V MIKROSKOPII TEORETICKÝ ÚVOD: Mikroskopie je základní metoda, která nám umožňuje pozorovat velmi malé biologické objekty. Díky
LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 1. SVĚTELNÁ MIKROSKOPIE A PREPARÁTY V MIKROSKOPII TEORETICKÝ ÚVOD: Mikroskopie je základní metoda, která nám umožňuje pozorovat velmi malé biologické objekty. Díky
Životaschopnost. (= vitalita = viabilita) počet živých buněk. 100 = [%] počet všech buněk
![Životaschopnost. (= vitalita = viabilita) počet živých buněk. 100 = [%] počet všech buněk Životaschopnost. (= vitalita = viabilita) počet živých buněk. 100 = [%] počet všech buněk](/thumbs/94/120369223.jpg) Životaschopnost (= vitalita = viabilita) počet živých buněk. 100 = ---------------------------------------- [%] počet všech buněk Využití: při kultivaci buněk pro různé účely (hodnocení cytotoxického účinku,
Životaschopnost (= vitalita = viabilita) počet živých buněk. 100 = ---------------------------------------- [%] počet všech buněk Využití: při kultivaci buněk pro různé účely (hodnocení cytotoxického účinku,
LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 3. TESTY ŽIVOTASCHOPNOSTI A POČÍTÁNÍ BUNĚK
 LRR/BUBCV CVIČEÍ Z BUĚČÉ BILGIE 3. TESTY ŽIVTASCHPSTI A PČÍTÁÍ BUĚK TERETICKÝ ÚVD: Při práci s buňkami je jedním ze základních sledovaných parametrů stanovení jejich životaschopnosti (viability). Tímto
LRR/BUBCV CVIČEÍ Z BUĚČÉ BILGIE 3. TESTY ŽIVTASCHPSTI A PČÍTÁÍ BUĚK TERETICKÝ ÚVD: Při práci s buňkami je jedním ze základních sledovaných parametrů stanovení jejich životaschopnosti (viability). Tímto
Téma: Testy životaschopnosti a Počítání buněk
 LRR/BUBV vičení z buněčné biologie Úloha č. 3 Téma: Testy životaschopnosti a Počítání Úvod: Při práci s buňkami je jedním ze základních sledovaných parametrů stanovení jejich životaschopnosti (viability).
LRR/BUBV vičení z buněčné biologie Úloha č. 3 Téma: Testy životaschopnosti a Počítání Úvod: Při práci s buňkami je jedním ze základních sledovaných parametrů stanovení jejich životaschopnosti (viability).
Fluorescenční mikroskopie
 Luminiscence jev, kdy látka vysílá do prostoru světlo chemická reakce chemiluminiscence (např. světluška) světlo fotoluminiscence fluorescence (emisní záření jen krátkou dobu po skončení exitačního záření)
Luminiscence jev, kdy látka vysílá do prostoru světlo chemická reakce chemiluminiscence (např. světluška) světlo fotoluminiscence fluorescence (emisní záření jen krátkou dobu po skončení exitačního záření)
F l u o r e s c e n c e
 F l u o r e s c e n c e Fluorescenční mikroskopie Luminiscence jev, kdy látka vysílá do prostoru světlo chemická reakce chemiluminiscence světlo fotoluminiscence Vyvolávající záření exitační fluorescence
F l u o r e s c e n c e Fluorescenční mikroskopie Luminiscence jev, kdy látka vysílá do prostoru světlo chemická reakce chemiluminiscence světlo fotoluminiscence Vyvolávající záření exitační fluorescence
LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 2. PLASMATICKÁ MEMBRÁNA
 LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 2. PLASMATICKÁ MEMBRÁNA TEORETICKÝ ÚVOD: Cytoplasmatická membrána je lipidová dvouvrstva o tloušťce asi 5 nm oddělující buňku od okolního prostředí. Nejvíce jsou v
LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 2. PLASMATICKÁ MEMBRÁNA TEORETICKÝ ÚVOD: Cytoplasmatická membrána je lipidová dvouvrstva o tloušťce asi 5 nm oddělující buňku od okolního prostředí. Nejvíce jsou v
Typy světelných mikroskopů
 Typy světelných mikroskopů Johann a Zacharias Jansenové (16. stol.) Systém dvou čoček délka 1,2 m 17. stol. Typy světelných mikroskopů Jednočočkový mikroskop 17. stol. Typy světelných mikroskopů Italský
Typy světelných mikroskopů Johann a Zacharias Jansenové (16. stol.) Systém dvou čoček délka 1,2 m 17. stol. Typy světelných mikroskopů Jednočočkový mikroskop 17. stol. Typy světelných mikroskopů Italský
Téma: Světelná mikroskopie a preparáty v mikroskopii
 LRR/BUBCV Cvičení z buněčné biologie Úloha č. 1 Téma: Světelná mikroskopie a preparáty v mikroskopii Úvod: Mikroskopie je základní metoda, která nám umoţňuje pozorovat velmi malé biologické objekty. Díky
LRR/BUBCV Cvičení z buněčné biologie Úloha č. 1 Téma: Světelná mikroskopie a preparáty v mikroskopii Úvod: Mikroskopie je základní metoda, která nám umoţňuje pozorovat velmi malé biologické objekty. Díky
Praktické cvičení č. 1.
 Praktické cvičení č. 1. Cvičení 1. 1. Všeobecné pokyny ke cvičení, zápočtu a zkoušce Bezpečnost práce 2. Mikroskopie - mikroskop a mikroskopická technika - převzetí pracovních pomůcek - pozorování trvalého
Praktické cvičení č. 1. Cvičení 1. 1. Všeobecné pokyny ke cvičení, zápočtu a zkoušce Bezpečnost práce 2. Mikroskopie - mikroskop a mikroskopická technika - převzetí pracovních pomůcek - pozorování trvalého
Mikroskop ECLIPSE E200 STUDENTSKÝ NÁVOD K POUŽITÍ. určeno pro studenty ČZU v Praze
 Mikroskop ECLIPSE E200 STUDENTSKÝ NÁVOD K POUŽITÍ určeno pro studenty ČZU v Praze Mikroskop Nikon Eclipse E200 Světelný mikroskop značky Nikon (Eclipse E200) používaný v botanické cvičebně zvětšuje při
Mikroskop ECLIPSE E200 STUDENTSKÝ NÁVOD K POUŽITÍ určeno pro studenty ČZU v Praze Mikroskop Nikon Eclipse E200 Světelný mikroskop značky Nikon (Eclipse E200) používaný v botanické cvičebně zvětšuje při
Zoologická mikrotechnika - FLUORESCENČNÍ MIKROSKOPIE
 Fluorescence Fluorescence je jev, kdy látka absorbuje ultrafialové záření nebo viditelné světlo s krátkou vlnovou délkou a emituje viditelné světlo s delší vlnovou délkou než má světlo absorbované Emitace
Fluorescence Fluorescence je jev, kdy látka absorbuje ultrafialové záření nebo viditelné světlo s krátkou vlnovou délkou a emituje viditelné světlo s delší vlnovou délkou než má světlo absorbované Emitace
Základy mikroskopování
 Gymnázium a Střední odborná škola pedagogická, Čáslav, Masarykova 248 M o d e r n í b i o l o g i e reg. č.: CZ.1.07/1.1.32/02.0048 TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM
Gymnázium a Střední odborná škola pedagogická, Čáslav, Masarykova 248 M o d e r n í b i o l o g i e reg. č.: CZ.1.07/1.1.32/02.0048 TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM
Přímé stanovení celkového počtu buněk kvasinek pomocí Bürkerovy komůrky Provedení vitálního testu
 Přímé stanovení celkového počtu buněk kvasinek pomocí Bürkerovy komůrky Provedení vitálního testu Otázky k zamyšlení: Bude se jednat o přímé nebo nepřímé stanovení počtu buněk? Stanovujeme počet živých
Přímé stanovení celkového počtu buněk kvasinek pomocí Bürkerovy komůrky Provedení vitálního testu Otázky k zamyšlení: Bude se jednat o přímé nebo nepřímé stanovení počtu buněk? Stanovujeme počet živých
Základy světelné mikroskopie
 Základy světelné mikroskopie Kotrba, Babůrek, Knejzlík: Návody ke cvičením z biologie, VŠCHT Praha, 2006. zvětšuje max. 2000 max. 1 000 000 cca 0,2 mm stovky nm až desetiny nm rozlišovací mez = nejmenší
Základy světelné mikroskopie Kotrba, Babůrek, Knejzlík: Návody ke cvičením z biologie, VŠCHT Praha, 2006. zvětšuje max. 2000 max. 1 000 000 cca 0,2 mm stovky nm až desetiny nm rozlišovací mez = nejmenší
LABORATORNÍ CVIČENÍ Z BIOLOGIE. Téma: STAVBA A FUNKCE MIKROSKOPU, PŘÍPRAVA DOČASNÝCH PREPARÁTŮ
 LABORATORNÍ CVIČENÍ Z BIOLOGIE Téma: STAVBA A FUNKCE MIKROSKOPU, PŘÍPRAVA DOČASNÝCH PREPARÁTŮ Úloha č.1.: Seznámení se stavbou optického mikroskopu a zásadami práce s mikroskopem ÚKOLY: a) teoretické:
LABORATORNÍ CVIČENÍ Z BIOLOGIE Téma: STAVBA A FUNKCE MIKROSKOPU, PŘÍPRAVA DOČASNÝCH PREPARÁTŮ Úloha č.1.: Seznámení se stavbou optického mikroskopu a zásadami práce s mikroskopem ÚKOLY: a) teoretické:
Protokol č. 7 Pozorování živých a mrtvých buněk kvasinek Vitální test
 Protokol č. 7 Pozorování živých a mrtvých buněk kvasinek Vitální test Cíl cvičení: Bude se jednat o přímé nebo nepřímé stanovení počtu buněk? Stanovujeme počet živých nebo mrtvých buněk? Jak odlišíme živé
Protokol č. 7 Pozorování živých a mrtvých buněk kvasinek Vitální test Cíl cvičení: Bude se jednat o přímé nebo nepřímé stanovení počtu buněk? Stanovujeme počet živých nebo mrtvých buněk? Jak odlišíme živé
M I K R O S K O P I E
 Inovace předmětu KBB/MIK SVĚTELNÁ A ELEKTRONOVÁ M I K R O S K O P I E Rozvoj a internacionalizace chemických a biologických studijních programů na Univerzitě Palackého v Olomouci CZ.1.07/2.2.00/28.0066
Inovace předmětu KBB/MIK SVĚTELNÁ A ELEKTRONOVÁ M I K R O S K O P I E Rozvoj a internacionalizace chemických a biologických studijních programů na Univerzitě Palackého v Olomouci CZ.1.07/2.2.00/28.0066
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í LABORATORNÍ PRÁCE Č. 34 MIKROSKOPIE
 LABORATORNÍ PRÁCE Č. 34 MIKROSKOPIE PRINCIP V chemické laboratoři se používá k některým stanovením tzv. mikrokrystaloskopie. Jedná se o použití optického mikroskopu při kvalitativních důkazech látek na
LABORATORNÍ PRÁCE Č. 34 MIKROSKOPIE PRINCIP V chemické laboratoři se používá k některým stanovením tzv. mikrokrystaloskopie. Jedná se o použití optického mikroskopu při kvalitativních důkazech látek na
TEORETICKÝ ÚVOD. Počítání buněk
 Jméno: Obor: Datum provedení: TEORETICKÝ ÚVOD Počítání buněk Jednou z nezbytných dovedností při práci s biologickým materiálemk je stanovení počtu buněk ve vzorku. V současné době se v praxi k počítání
Jméno: Obor: Datum provedení: TEORETICKÝ ÚVOD Počítání buněk Jednou z nezbytných dovedností při práci s biologickým materiálemk je stanovení počtu buněk ve vzorku. V současné době se v praxi k počítání
Cvičení 4: CHEMICKÉ SLOŽENÍ BUŇKY, PROKARYOTA Jméno: PROKARYOTA PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU ROZTĚR BAKTERIÍ
 Cvičení 4: CHEMICKÉ SLOŽENÍ BUŇKY, PROKARYOTA Jméno: Skupina: PROKARYOTA PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU ROZTĚR BAKTERIÍ Praktický úkol: bakterie (koky, tyčky) vyžíhejte bakteriologickou kličku
Cvičení 4: CHEMICKÉ SLOŽENÍ BUŇKY, PROKARYOTA Jméno: Skupina: PROKARYOTA PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU ROZTĚR BAKTERIÍ Praktický úkol: bakterie (koky, tyčky) vyžíhejte bakteriologickou kličku
UNIVERZITA PALACKÉHO PŘÍRODOVĚDECKÁ FAKULTA. Katedra buněčné biologie a genetiky
 UNIVERZITA PALACKÉHO PŘÍRODOVĚDECKÁ FAKULTA Katedra buněčné biologie a genetiky N Á V O D Y a P R A C O V N Í L I S T Y pro Praktikum z buněčné biologie (KBB/BBC) Olomouc 2019 Praktikum z buněčné biologie
UNIVERZITA PALACKÉHO PŘÍRODOVĚDECKÁ FAKULTA Katedra buněčné biologie a genetiky N Á V O D Y a P R A C O V N Í L I S T Y pro Praktikum z buněčné biologie (KBB/BBC) Olomouc 2019 Praktikum z buněčné biologie
UNIVERZITA PALACKÉHO PŘÍRODOVĚDECKÁ FAKULTA. Katedra buněčné biologie a genetiky
 UNIVERZITA PALACKÉHO PŘÍRODOVĚDECKÁ FAKULTA Katedra buněčné biologie a genetiky N Á V O D Y a P R A C O V N Í L I S T Y pro Praktikum z buněčné biologie (KBB/BBC) Olomouc 2016 Praktikum z buněčné biologie
UNIVERZITA PALACKÉHO PŘÍRODOVĚDECKÁ FAKULTA Katedra buněčné biologie a genetiky N Á V O D Y a P R A C O V N Í L I S T Y pro Praktikum z buněčné biologie (KBB/BBC) Olomouc 2016 Praktikum z buněčné biologie
Cvičení 5: VYŠETŘENÍ KRVE Jméno: PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU - KREVNÍ NÁTĚR
 Cvičení 5: VYŠETŘENÍ KRVE Jméno: Skupina: PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU - KREVNÍ NÁTĚR Praktický úkol: 1. K jedné straně podložního skla kápněte malou kapku savčí krve. 2. Před kapku přiložte
Cvičení 5: VYŠETŘENÍ KRVE Jméno: Skupina: PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU - KREVNÍ NÁTĚR Praktický úkol: 1. K jedné straně podložního skla kápněte malou kapku savčí krve. 2. Před kapku přiložte
Vitální barvení, rostlinná buňka, buněčné organely
 Vitální barvení, rostlinná buňka, buněčné organely Vitální barvení používá se u nativních preparátů a rozumíme tím zvýšení kontrastu určitých buněčných složek v živých buňkách, nebo tkáních pomocí barvení
Vitální barvení, rostlinná buňka, buněčné organely Vitální barvení používá se u nativních preparátů a rozumíme tím zvýšení kontrastu určitých buněčných složek v živých buňkách, nebo tkáních pomocí barvení
1. Teorie mikroskopových metod
 1. Teorie mikroskopových metod A) Mezi první mikroskopové metody patřilo barvení biologických preparátů vhodnými barvivy, což způsobilo ovlivnění amplitudy světla prošlého preparátem, který pak byl snadno
1. Teorie mikroskopových metod A) Mezi první mikroskopové metody patřilo barvení biologických preparátů vhodnými barvivy, což způsobilo ovlivnění amplitudy světla prošlého preparátem, který pak byl snadno
vede sice ke zvýšení kontrastu, zároveň se ale snižuje rozlišení a ostrost obrazu (Obr. 46).
 4. cvičení Metody zvýšení kontrastu obrazu (1. část) 1. Přivření kondenzorové clony nebo snížení kondenzoru vede sice ke zvýšení kontrastu, zároveň se ale snižuje rozlišení a ostrost obrazu (Obr. 46).
4. cvičení Metody zvýšení kontrastu obrazu (1. část) 1. Přivření kondenzorové clony nebo snížení kondenzoru vede sice ke zvýšení kontrastu, zároveň se ale snižuje rozlišení a ostrost obrazu (Obr. 46).
UNIVERZITA PALACKÉHO PŘÍRODOVĚDECKÁ FAKULTA. Katedra buněčné biologie a genetiky
 UNIVERZITA PALACKÉHO PŘÍRODOVĚDECKÁ FAKULTA Katedra buněčné biologie a genetiky N Á V O D Y a P R A C O V N Í L I S T Y pro Praktikum z buněčné biologie (KBB/BBC) Olomouc 2015 Praktikum z buněčné biologie
UNIVERZITA PALACKÉHO PŘÍRODOVĚDECKÁ FAKULTA Katedra buněčné biologie a genetiky N Á V O D Y a P R A C O V N Í L I S T Y pro Praktikum z buněčné biologie (KBB/BBC) Olomouc 2015 Praktikum z buněčné biologie
TRVALÝ PREPARÁT. Zhotovení roztěru
 TRVALÝ PREPARÁT Zhotovení trvalého preparátu zahrnuje usmrcení, fixování a barvení objektu. Podle způsobu zpracování rozeznáváme preparáty celkové (obsahují celý organismus), nátěrové, roztěrové, roztlakové,
TRVALÝ PREPARÁT Zhotovení trvalého preparátu zahrnuje usmrcení, fixování a barvení objektu. Podle způsobu zpracování rozeznáváme preparáty celkové (obsahují celý organismus), nátěrové, roztěrové, roztlakové,
Metoda Live/Dead aneb využití fluorescenční mikroskopie v bioaugmentační praxi. Juraj Grígel Inovativní sanační technologie ve výzkumu a praxi
 Metoda Live/Dead aneb využití fluorescenční mikroskopie v bioaugmentační praxi Juraj Grígel Inovativní sanační technologie ve výzkumu a praxi Co je to vlastně ta fluorescence? Některé látky (fluorofory)
Metoda Live/Dead aneb využití fluorescenční mikroskopie v bioaugmentační praxi Juraj Grígel Inovativní sanační technologie ve výzkumu a praxi Co je to vlastně ta fluorescence? Některé látky (fluorofory)
Fluorescenční mikroskopie
 Fluorescenční mikroskopie Pokročilé biofyzikální metody v experimentální biologii Ctirad Hofr 1 VYUŽITÍ FLUORESCENCE, PŘÍMÁ FLUORESCENCE, PŘÍMÁ A NEPŘÍMA IMUNOFLUORESCENCE, BIOTIN-AVIDINOVÁ METODA IMUNOFLUORESCENCE
Fluorescenční mikroskopie Pokročilé biofyzikální metody v experimentální biologii Ctirad Hofr 1 VYUŽITÍ FLUORESCENCE, PŘÍMÁ FLUORESCENCE, PŘÍMÁ A NEPŘÍMA IMUNOFLUORESCENCE, BIOTIN-AVIDINOVÁ METODA IMUNOFLUORESCENCE
Viková, M. : MIKROSKOPIE II Mikroskopie II M. Viková
 II Mikroskopie II M. Viková LCAM DTM FT TU Liberec, martina.vikova@tul.cz Osvětlovac tlovací soustava I Výsledkem Köhlerova nastavení je rovnoměrné a maximální osvětlení průhledného preparátu, ležícího
II Mikroskopie II M. Viková LCAM DTM FT TU Liberec, martina.vikova@tul.cz Osvětlovac tlovací soustava I Výsledkem Köhlerova nastavení je rovnoměrné a maximální osvětlení průhledného preparátu, ležícího
Technická specifikace předmětu veřejné zakázky
 předmětu veřejné zakázky Příloha č. 1c Zadavatel požaduje, aby předmět veřejné zakázky, resp. přístroje odpovídající jednotlivým částem veřejné zakázky splňovaly minimálně níže uvedené parametry. Část
předmětu veřejné zakázky Příloha č. 1c Zadavatel požaduje, aby předmět veřejné zakázky, resp. přístroje odpovídající jednotlivým částem veřejné zakázky splňovaly minimálně níže uvedené parametry. Část
FLUORESCENČNÍ MIKROSKOP
 FLUORESCENČNÍ MIKROSKOP na gymnáziu Pierra de Coubertina v Táboře Pavla Trčková, kabinet Biologie, GPdC Tábor Co je fluorescence Fluorescence je jev spočívající v tom, že některé látky (fluorofory) po
FLUORESCENČNÍ MIKROSKOP na gymnáziu Pierra de Coubertina v Táboře Pavla Trčková, kabinet Biologie, GPdC Tábor Co je fluorescence Fluorescence je jev spočívající v tom, že některé látky (fluorofory) po
MIKROSKOPIE JAKO NÁSTROJ STUDIA MIKROORGANISMŮ
 Mikroskopické techniky MIKROSKOPIE JAKO NÁSTROJ STUDIA MIKROORGANISMŮ Slouží k vizualizaci mikroorganismů Antoni van Leeuwenhoek (1632-1723) Čočka zvětšující 300x Různé druhy mikroskopů, které se liší
Mikroskopické techniky MIKROSKOPIE JAKO NÁSTROJ STUDIA MIKROORGANISMŮ Slouží k vizualizaci mikroorganismů Antoni van Leeuwenhoek (1632-1723) Čočka zvětšující 300x Různé druhy mikroskopů, které se liší
BUNĚČNÁ STĚNA - struktura a role v rostlinné buňce
 BUNĚČNÁ STĚNA - struktura a role v rostlinné buňce Buněčná stěna O buněčné stěně: Buněčná stěna je nedílnou součástí každé rostlinné buňky a je jednou z charakteristických struktur odlišujících buňku rostlinnou
BUNĚČNÁ STĚNA - struktura a role v rostlinné buňce Buněčná stěna O buněčné stěně: Buněčná stěna je nedílnou součástí každé rostlinné buňky a je jednou z charakteristických struktur odlišujících buňku rostlinnou
MTI Cvičení č. 2 Pasážování buněk / Jana Horáková
 MTI Cvičení č. 2 Pasážování buněk 15.11./16.11.2016 Jana Horáková Doporučená literatura M. Vejražka: Buněčné kultury http://bioprojekty.lf1.cuni.cz/3381/sylabyprednasek/textova-verze-prednasek/bunecnekultury-vejrazka.pdf
MTI Cvičení č. 2 Pasážování buněk 15.11./16.11.2016 Jana Horáková Doporučená literatura M. Vejražka: Buněčné kultury http://bioprojekty.lf1.cuni.cz/3381/sylabyprednasek/textova-verze-prednasek/bunecnekultury-vejrazka.pdf
SBÍRKA ŘEŠENÝCH FYZIKÁLNÍCH ÚLOH
 SBÍRKA ŘEŠENÝCH FYZIKÁLNÍCH ÚLOH MECHANIKA MOLEKULOVÁ FYZIKA A TERMIKA ELEKTŘINA A MAGNETISMUS KMITÁNÍ A VLNĚNÍ OPTIKA FYZIKA MIKROSVĚTA ODRAZ A LOM SVĚTLA 1) Index lomu vody je 1,33. Jakou rychlost má
SBÍRKA ŘEŠENÝCH FYZIKÁLNÍCH ÚLOH MECHANIKA MOLEKULOVÁ FYZIKA A TERMIKA ELEKTŘINA A MAGNETISMUS KMITÁNÍ A VLNĚNÍ OPTIKA FYZIKA MIKROSVĚTA ODRAZ A LOM SVĚTLA 1) Index lomu vody je 1,33. Jakou rychlost má
Název: POZOROVÁNÍ PLASTIDŮ,VAKUOL, BUNĚČNÉ STĚNY Autor: Paed.Dr.Ludmila Pipková
 Název: POZOROVÁNÍ PLASTIDŮ,VAKUOL, BUNĚČNÉ STĚNY Autor: Paed.Dr.Ludmila Pipková Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět: biologie Mezipředmětové vztahy: ekologie Ročník: 2.a 3.
Název: POZOROVÁNÍ PLASTIDŮ,VAKUOL, BUNĚČNÉ STĚNY Autor: Paed.Dr.Ludmila Pipková Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět: biologie Mezipředmětové vztahy: ekologie Ročník: 2.a 3.
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost.
 Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Šablona III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Šablona III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
Prezentace navazuje na základní znalosti z biochemie (lipidy, proteiny, sacharidy) Dynamický fluidní model membrány 2008/11
 RNDr. Ivana Fellnerová, Ph.D. Katedra zoologie PřF UP Olomouc Prezentace navazuje na základní znalosti z biochemie (lipidy, proteiny, sacharidy) Rozšiřuje přednášky: Stavba cytoplazmatické membrány Membránový
RNDr. Ivana Fellnerová, Ph.D. Katedra zoologie PřF UP Olomouc Prezentace navazuje na základní znalosti z biochemie (lipidy, proteiny, sacharidy) Rozšiřuje přednášky: Stavba cytoplazmatické membrány Membránový
Hodnocení pekařského droždí
 Hodnocení pekařského droždí Čistá mikrobiální kultura kvasinek Saccharomyces Cerevisiae Hanzen Vyrábí se aerobní fermentací melasové zápary Díky kvasným schopnostem zajišťují kvasinky nakynutí těsta ovlivňují
Hodnocení pekařského droždí Čistá mikrobiální kultura kvasinek Saccharomyces Cerevisiae Hanzen Vyrábí se aerobní fermentací melasové zápary Díky kvasným schopnostem zajišťují kvasinky nakynutí těsta ovlivňují
Příloha C. zadávací dokumentace pro podlimitní veřejnou zakázku Mikroskopy pro LF MU 2013. TECHNICKÉ PODMÍNKY (technická specifikace)
 Příloha C zadávací dokumentace pro podlimitní veřejnou zakázku Mikroskopy pro LF MU 2013 TECHNICKÉ PODMÍNKY (technická specifikace) 1. část VZ: Laboratorní mikroskop s digitální kamerou a PC Položka č.1
Příloha C zadávací dokumentace pro podlimitní veřejnou zakázku Mikroskopy pro LF MU 2013 TECHNICKÉ PODMÍNKY (technická specifikace) 1. část VZ: Laboratorní mikroskop s digitální kamerou a PC Položka č.1
LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 4. BUNĚČNÉ JÁDRO A BUNĚČNÉ KULTURY
 LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 4. BUNĚČNÉ JÁDRO A BUNĚČNÉ KULTURY TEORETICKÝ ÚVOD: Buněčné jádro Buněčné jádro je organelou eukaryotické buňky. Je v něm uložena většina genetické informace buňky.
LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 4. BUNĚČNÉ JÁDRO A BUNĚČNÉ KULTURY TEORETICKÝ ÚVOD: Buněčné jádro Buněčné jádro je organelou eukaryotické buňky. Je v něm uložena většina genetické informace buňky.
POČÍTÁNÍ BUNĚK. Část mřížky Bürkerovy komůrky. Výška prostoru, v němž jsou buňky nad mřížkou počítány, je 0,1 µm
 POČÍTÁNÍ BUNĚK Potřeba spočítat množství buněk vzniká při řešení mnoha biologických otázek. Mnohé z nich mívají rovněž klinický význam (zejména v hematologii je zjišťování počtů krvinek každodenním rutinním
POČÍTÁNÍ BUNĚK Potřeba spočítat množství buněk vzniká při řešení mnoha biologických otázek. Mnohé z nich mívají rovněž klinický význam (zejména v hematologii je zjišťování počtů krvinek každodenním rutinním
Geometrická optika. Optické přístroje a soustavy. převážně jsou založeny na vzájemné interakci světelného pole s látkou nebo s jiným fyzikálním polem
 Optické přístroje a soustav Geometrická optika převážně jsou založen na vzájemné interakci světelného pole s látkou nebo s jiným fzikálním polem Důsledkem této t to interakce je: změna fzikáln lních vlastností
Optické přístroje a soustav Geometrická optika převážně jsou založen na vzájemné interakci světelného pole s látkou nebo s jiným fzikálním polem Důsledkem této t to interakce je: změna fzikáln lních vlastností
PRÁCE S MIKROSKOPEM Praktická příprava mikroskopického preparátu
 PRÁCE S MIKROSKOPEM 1. Praktická příprava mikroskopického preparátu 2. a) Z objektu, jehož část, chceme pozorovat pomocí mikroskopu, musíme nejprve vytvořit mikroskopický preparát. Obr. č. 1 b) Pozorovaný
PRÁCE S MIKROSKOPEM 1. Praktická příprava mikroskopického preparátu 2. a) Z objektu, jehož část, chceme pozorovat pomocí mikroskopu, musíme nejprve vytvořit mikroskopický preparát. Obr. č. 1 b) Pozorovaný
MOLEKULÁRNÍ METODY V EKOLOGII MIKROORGANIZMŮ
 MOLEKULÁRNÍ METODY V EKOLOGII MIKROORGANIZMŮ (EKO/MMEM) ÚPRAVA PŘÍRODNÍCH VZORKŮ A STANOVENÍ MIKROBIÁLNÍ ABUNDANCE (DAPI) Pro přímé stanovení celkových počtů mikrobiálních buněk (buněčné abundance) ve
MOLEKULÁRNÍ METODY V EKOLOGII MIKROORGANIZMŮ (EKO/MMEM) ÚPRAVA PŘÍRODNÍCH VZORKŮ A STANOVENÍ MIKROBIÁLNÍ ABUNDANCE (DAPI) Pro přímé stanovení celkových počtů mikrobiálních buněk (buněčné abundance) ve
Protokol ke cvičení z Biologie vodních živočichů
 Katedra zoologie a Ornitologická laboratoř Protokol ke cvičení z Biologie vodních živočichů Jméno : Obor,ročník : Datum : Úvod Cílem tohoto cvičení je praktická ukázka fixace a preparace vodních bezobratlých
Katedra zoologie a Ornitologická laboratoř Protokol ke cvičení z Biologie vodních živočichů Jméno : Obor,ročník : Datum : Úvod Cílem tohoto cvičení je praktická ukázka fixace a preparace vodních bezobratlých
MITÓZA V BUŇKÁCH KOŘÍNKU CIBULE
 Cvičení 6: BUNĚČNÝ CYKLUS, MITÓZA Jméno: Skupina: MITÓZA V BUŇKÁCH KOŘÍNKU CIBULE Trvalý preparát: kořínek cibule obarvený v acetorceinu V buňkách kořínku cibule jsou viditelné různé mitotické figury.
Cvičení 6: BUNĚČNÝ CYKLUS, MITÓZA Jméno: Skupina: MITÓZA V BUŇKÁCH KOŘÍNKU CIBULE Trvalý preparát: kořínek cibule obarvený v acetorceinu V buňkách kořínku cibule jsou viditelné různé mitotické figury.
příjmení a jméno: den a hodina cvičení: datum:
 příjmení a jméno: den a hodina cvičení: datum: obr. 1: lokalizace nejčastějších parazitů skotu obr. 2: propagační stadia parazitů skotu 1 obr. 3: lokalizace nejčastějších parazitů malých přežvýkavců obr.
příjmení a jméno: den a hodina cvičení: datum: obr. 1: lokalizace nejčastějších parazitů skotu obr. 2: propagační stadia parazitů skotu 1 obr. 3: lokalizace nejčastějších parazitů malých přežvýkavců obr.
Prokaryota x Eukaryota. Vibrio cholerae
 Živočišná buňka Prokaryota x Eukaryota Vibrio cholerae Dělení živočišných buněk: buňky jednobuněčných organismů (volně žijící samostatné jednotky) buňky mnohobuněčných větší morfologické i funkční celky
Živočišná buňka Prokaryota x Eukaryota Vibrio cholerae Dělení živočišných buněk: buňky jednobuněčných organismů (volně žijící samostatné jednotky) buňky mnohobuněčných větší morfologické i funkční celky
VAKUOLY - voda v rostlinné buňce
 VAKUOLY - voda v rostlinné buňce Úvod: O vakuole: Vakuola je membránová struktura, která je součástí většiny rostlinných buněk. Může zaujímat 30-90% objemu buňky. Vakuola plní v rostlinné buňce mnoho důležitých
VAKUOLY - voda v rostlinné buňce Úvod: O vakuole: Vakuola je membránová struktura, která je součástí většiny rostlinných buněk. Může zaujímat 30-90% objemu buňky. Vakuola plní v rostlinné buňce mnoho důležitých
LABORATORNÍ PRÁCE Č.
 Úkol A: Pozorování parenchymu suknice cibule kuchyňské Pomůcky: cibule kuchyňská, pomůcky k mikroskopování a) Rozřízněte cibuli, vyjměte jeden vnitřní zdužnatělý list. b) Z vnitřní strany listu sejměte
Úkol A: Pozorování parenchymu suknice cibule kuchyňské Pomůcky: cibule kuchyňská, pomůcky k mikroskopování a) Rozřízněte cibuli, vyjměte jeden vnitřní zdužnatělý list. b) Z vnitřní strany listu sejměte
Základní pojmy. Je násobkem zvětšení objektivu a okuláru
 Vznik obrazu v mikroskopu Mikroskop se skládá z mechanické části (podstavec, stojan a stolek s křížovým posunem), osvětlovací části (zdroj světla, kondenzor, clona) a optické části (objektivy a okuláry).
Vznik obrazu v mikroskopu Mikroskop se skládá z mechanické části (podstavec, stojan a stolek s křížovým posunem), osvětlovací části (zdroj světla, kondenzor, clona) a optické části (objektivy a okuláry).
Izolace genomové DNA ze savčích buněk, stanovení koncentrace DNA pomocí absorpční spektrofotometrie
 Izolace genomové DNA ze savčích buněk, stanovení koncentrace DNA pomocí absorpční spektrofotometrie IZOLACE GENOMOVÉ DNA Deoxyribonukleová kyselina (DNA) představuje základní genetický materiál většiny
Izolace genomové DNA ze savčích buněk, stanovení koncentrace DNA pomocí absorpční spektrofotometrie IZOLACE GENOMOVÉ DNA Deoxyribonukleová kyselina (DNA) představuje základní genetický materiál většiny
RNDr. Ivana Fellnerová, Ph.D. Katedra zoologie PřF UP Olomouc 2008/11. *Ivana FELLNEROVÁ, PřF UP Olomouc*
 RNDr. Ivana Fellnerová, Ph.D. Katedra zoologie PřF UP Olomouc 2008/11 Prezentace navazuje na základní znalosti z biochemie (lipidy, proteiny, sacharidy) Rozšiřuje přednášky: Stavba cytoplazmatické membrány
RNDr. Ivana Fellnerová, Ph.D. Katedra zoologie PřF UP Olomouc 2008/11 Prezentace navazuje na základní znalosti z biochemie (lipidy, proteiny, sacharidy) Rozšiřuje přednášky: Stavba cytoplazmatické membrány
POSTUPY PRÁCE. 1.1 Stanovení počtu erytrocytů
 POSTUPY PRÁCE 1.1 Stanovení počtu erytrocytů Potřeby: banička, Hayemův roztok, mikropipety 25 l a 4 950 l, kapátka, podložní sklíčko, Bürkerova komůrka, krev, emetní miska, čtverečky buničité vaty. Postup
POSTUPY PRÁCE 1.1 Stanovení počtu erytrocytů Potřeby: banička, Hayemův roztok, mikropipety 25 l a 4 950 l, kapátka, podložní sklíčko, Bürkerova komůrka, krev, emetní miska, čtverečky buničité vaty. Postup
http://www.accessexcellence.org/ab/gg/chromosome.html
 3. cvičení Buněčný cyklus Mitóza Modifikace mitózy 1 DNA, chromosom genetická informace organismu chromosom = strukturní podoba DNA během dělení (mitózy) řetězec DNA (chromonema) histony další enzymatické
3. cvičení Buněčný cyklus Mitóza Modifikace mitózy 1 DNA, chromosom genetická informace organismu chromosom = strukturní podoba DNA během dělení (mitózy) řetězec DNA (chromonema) histony další enzymatické
BIOLOGICKÁ MEMBRÁNA Prokaryontní Eukaryontní KOMPARTMENTŮ
 BIOMEMRÁNA BIOLOGICKÁ MEMBRÁNA - všechny buňky na povrchu plazmatickou membránu - Prokaryontní buňky (viry, bakterie, sinice) - Eukaryontní buňky vnitřní členění do soustavy membrán KOMPARTMENTŮ - za
BIOMEMRÁNA BIOLOGICKÁ MEMBRÁNA - všechny buňky na povrchu plazmatickou membránu - Prokaryontní buňky (viry, bakterie, sinice) - Eukaryontní buňky vnitřní členění do soustavy membrán KOMPARTMENTŮ - za
BUŇKA ZÁKLADNÍ JEDNOTKA ORGANISMŮ
 BUŇKA ZÁKLADNÍ JEDNOTKA ORGANISMŮ SPOLEČNÉ ZNAKY ŽIVÉHO - schopnost získávat energii z živin pro své životní potřeby - síla aktivně odpovídat na změny prostředí - možnost růstu, diferenciace a reprodukce
BUŇKA ZÁKLADNÍ JEDNOTKA ORGANISMŮ SPOLEČNÉ ZNAKY ŽIVÉHO - schopnost získávat energii z živin pro své životní potřeby - síla aktivně odpovídat na změny prostředí - možnost růstu, diferenciace a reprodukce
POHLAVNÍ CHROMATINOVÝ ZNAK U ČLOVĚKA - SEX CHROMATIN
 POHLAVNÍ CHROMATINOVÝ ZNAK U ČLOVĚKA - SEX CHROMATIN (Barvení a pozorování Barrova tělíska v jádrech buněk ústní sliznice. Procentuální zastoupení pohlavního chromatinu v buňkách žen a mužů. Fluorescenční
POHLAVNÍ CHROMATINOVÝ ZNAK U ČLOVĚKA - SEX CHROMATIN (Barvení a pozorování Barrova tělíska v jádrech buněk ústní sliznice. Procentuální zastoupení pohlavního chromatinu v buňkách žen a mužů. Fluorescenční
PARAZITÉ Z BLÍZKA LARVY MOTOLIC (PRACOVNÍ LIST)
 PARAZITÉ Z BLÍZKA LARVY MOTOLIC (PRACOVNÍ LIST) Mgr. Kateřina Mikešová, UK v Praze, PřF, katedra učitelství a didaktiky biologie Jméno studenta: Třída: Datum: Motolice jsou výhradně endoparazité obratlovců,
PARAZITÉ Z BLÍZKA LARVY MOTOLIC (PRACOVNÍ LIST) Mgr. Kateřina Mikešová, UK v Praze, PřF, katedra učitelství a didaktiky biologie Jméno studenta: Třída: Datum: Motolice jsou výhradně endoparazité obratlovců,
FYZIOLOGIE ROSTLIN Laboratorní práce č. 3
 Téma: Vodní režim rostlin FYZIOLOGIE ROSTLIN Laboratorní práce č. 3 Pozn: Úkoly 1-3 vyhodnoťte po 24 hodinách až týdnu. Prodiskutujte výsledky nejprve teoreticky, poté srovnejte s výsledkem skutečným.
Téma: Vodní režim rostlin FYZIOLOGIE ROSTLIN Laboratorní práce č. 3 Pozn: Úkoly 1-3 vyhodnoťte po 24 hodinách až týdnu. Prodiskutujte výsledky nejprve teoreticky, poté srovnejte s výsledkem skutečným.
Stavba dřeva. Základy cytologie. přednáška
 Základy cytologie přednáška Buňka definice, charakteristika strana 2 2 Buňky základní strukturální a funkční jednotky živých organismů Základní charakteristiky buněk rozmanitost (diverzita) - např. rostlinná
Základy cytologie přednáška Buňka definice, charakteristika strana 2 2 Buňky základní strukturální a funkční jednotky živých organismů Základní charakteristiky buněk rozmanitost (diverzita) - např. rostlinná
Fotografický aparát. Fotografický aparát. Fotografický aparát. Fotografický aparát. Fotografický aparát. Fotografický aparát
 Michal Veselý, 00 Základní části fotografického aparátu tedy jsou: tělo přístroje objektiv Pochopení funkce běžných objektivů usnadní zjednodušená představa, že objektiv jako celek se chová stejně jako
Michal Veselý, 00 Základní části fotografického aparátu tedy jsou: tělo přístroje objektiv Pochopení funkce běžných objektivů usnadní zjednodušená představa, že objektiv jako celek se chová stejně jako
Základní pojmy Zobrazení zrcadlem, Zobrazení čočkou Lidské oko, Optické přístroje
 Optické zobrazování Základní pojmy Zobrazení zrcadlem, Zobrazení čočkou Lidské oko, Optické přístroje Základní pojmy Optické zobrazování - pomocí paprskové (geometrické) optiky - využívá model světelného
Optické zobrazování Základní pojmy Zobrazení zrcadlem, Zobrazení čočkou Lidské oko, Optické přístroje Základní pojmy Optické zobrazování - pomocí paprskové (geometrické) optiky - využívá model světelného
Mitóza a buněčný cyklus
 Mitóza a buněčný cyklus Něco o chromosomech - Chromosom = 1 molekula DNA + navázané proteiny -V diploidní buňce jsou od každého chromosomu 2 kopie (= homologní chromosomy) - Homologní chromosomy nesou
Mitóza a buněčný cyklus Něco o chromosomech - Chromosom = 1 molekula DNA + navázané proteiny -V diploidní buňce jsou od každého chromosomu 2 kopie (= homologní chromosomy) - Homologní chromosomy nesou
1/II. Cvičení 2: ŽIVOČIŠNÁ BUŇKA, PROTOZOA Jméno: TVAR BUNĚK NERVOVÁ BUŇKA
 Cvičení 2: ŽIVOČIŠNÁ BUŇKA, PROTOZOA Jméno: Skupina: TVAR BUNĚK NERVOVÁ BUŇKA Trvalý preparát: mícha Vyhledejte nervové buňky (neurony) ve ventrálních rozích šedé hmoty míšní. Pozorujte při zvětšení, zakreslete
Cvičení 2: ŽIVOČIŠNÁ BUŇKA, PROTOZOA Jméno: Skupina: TVAR BUNĚK NERVOVÁ BUŇKA Trvalý preparát: mícha Vyhledejte nervové buňky (neurony) ve ventrálních rozích šedé hmoty míšní. Pozorujte při zvětšení, zakreslete
VLNOVÁ OPTIKA. Mgr. Jan Ptáčník - GJVJ - Fyzika - Optika - 3. ročník
 VLNOVÁ OPTIKA Mgr. Jan Ptáčník - GJVJ - Fyzika - Optika - 3. ročník Vlnová optika Světlo lze chápat také jako elektromagnetické vlnění. Průkopníkem této teorie byl Christian Huyghens. Některé jevy se dají
VLNOVÁ OPTIKA Mgr. Jan Ptáčník - GJVJ - Fyzika - Optika - 3. ročník Vlnová optika Světlo lze chápat také jako elektromagnetické vlnění. Průkopníkem této teorie byl Christian Huyghens. Některé jevy se dají
Buňka. základní stavební jednotka organismů
 Buňka základní stavební jednotka organismů Buňka Buňka je základní stavební a funkční jednotka těl organizmů. Toto se netýká virů (z lat. virus jed, je drobný vnitrobuněčný cizopasník nacházející se na
Buňka základní stavební jednotka organismů Buňka Buňka je základní stavební a funkční jednotka těl organizmů. Toto se netýká virů (z lat. virus jed, je drobný vnitrobuněčný cizopasník nacházející se na
Principy a instrumentace
 Průtoková cytometrie Principy a instrumentace Ing. Antonín Hlaváček Úvod Průtoková cytometrie je moderní laboratorní metoda měření a analýza fyzikálních -chemických vlastností buňky během průchodu laserovým
Průtoková cytometrie Principy a instrumentace Ing. Antonín Hlaváček Úvod Průtoková cytometrie je moderní laboratorní metoda měření a analýza fyzikálních -chemických vlastností buňky během průchodu laserovým
Optická konfokální mikroskopie a mikrospektroskopie. Pavel Matějka
 Optická konfokální mikroskopie a Pavel Matějka 1. Konfokální mikroskopie 1. Princip metody - konfokalita 2. Instrumentace metody zobrazování 3. Analýza obrazu 2. Konfokální 1. Luminiscenční 2. Ramanova
Optická konfokální mikroskopie a Pavel Matějka 1. Konfokální mikroskopie 1. Princip metody - konfokalita 2. Instrumentace metody zobrazování 3. Analýza obrazu 2. Konfokální 1. Luminiscenční 2. Ramanova
Buňka. Buňka (cellula) základní stavební a funkční jednotka organismů, schopná samostatné existence. Cytologie nauka o buňkách
 Buňka Historie 1655 - Robert Hooke (1635 1703) - použil jednoduchý mikroskop k popisu pórů v řezu korku. Nazval je, podle podoby k buňkám včelích plástů, buňky. 18. - 19. St. - vznik buněčné biologie jako
Buňka Historie 1655 - Robert Hooke (1635 1703) - použil jednoduchý mikroskop k popisu pórů v řezu korku. Nazval je, podle podoby k buňkám včelích plástů, buňky. 18. - 19. St. - vznik buněčné biologie jako
příloha C zadávací dokumentace pro veřejnou zakázku malého rozsahu Mikroskopy pro LF MU TECHNICKÉ PODMÍNKY (technická specifikace)
 příloha C zadávací dokumentace pro veřejnou zakázku malého rozsahu Mikroskopy pro LF MU TECHNICKÉ PODMÍNKY (technická specifikace) Část 1 Stereomikroskop s digitální kamerou : - Konstrukce optiky CMO (Common
příloha C zadávací dokumentace pro veřejnou zakázku malého rozsahu Mikroskopy pro LF MU TECHNICKÉ PODMÍNKY (technická specifikace) Část 1 Stereomikroskop s digitální kamerou : - Konstrukce optiky CMO (Common
5.3.5 Ohyb světla na překážkách
 5.3.5 Ohyb světla na překážkách Předpoklady: 3xxx Světlo i zvuk jsou vlnění, ale přesto jsou mezi nimi obrovské rozdíly. Slyšíme i to, co se děje za rohem x Co se děje za rohem nevidíme. Proč? Vlnění se
5.3.5 Ohyb světla na překážkách Předpoklady: 3xxx Světlo i zvuk jsou vlnění, ale přesto jsou mezi nimi obrovské rozdíly. Slyšíme i to, co se děje za rohem x Co se děje za rohem nevidíme. Proč? Vlnění se
Cvičeníč. 4: Chromozómy, karyotyp a mitóza. Mgr. Zbyněk Houdek
 Cvičeníč. 4: Chromozómy, karyotyp a mitóza Mgr. Zbyněk Houdek Chromozomy Geny jsou u eukaryotických organizmů z převážnéčásti umístěny právě na chromozómech v b. jádře. Jejich velikost a tvar jsou rozmanité,
Cvičeníč. 4: Chromozómy, karyotyp a mitóza Mgr. Zbyněk Houdek Chromozomy Geny jsou u eukaryotických organizmů z převážnéčásti umístěny právě na chromozómech v b. jádře. Jejich velikost a tvar jsou rozmanité,
Název práce: Rostlinná buňka a látky v ní obsažené. Odstavce Vzdělávací cíl, Pomůcky a Inovace viz následující strana
 Datum: 30. 12. 2012 Projekt: Využití ICT techniky především v uměleckém vzdělávání Registrační číslo: CZ.1.07/1.5.00/34.1013 Číslo DUM: VY_32_INOVACE_270 Škola: Akademie - VOŠ, Gymn. a SOŠUP Světlá nad
Datum: 30. 12. 2012 Projekt: Využití ICT techniky především v uměleckém vzdělávání Registrační číslo: CZ.1.07/1.5.00/34.1013 Číslo DUM: VY_32_INOVACE_270 Škola: Akademie - VOŠ, Gymn. a SOŠUP Světlá nad
MIKROBIOLOGIE. Grampozitivní kokovitá bakterie STAPHYLOCOCCUS AUREUS bakteriální kmen dle ATCC 1260 (CCM 888).
 MIKROBIOLOGIE Veškeré testy jsou prováděny s těmito bakteriálními kmeny: Gramnegativní tyčinkovitá bakterie ESCHERICHIA COLI bakteriální kmen dle ATCC 9637 (CCM 2024). Grampozitivní kokovitá bakterie STAPHYLOCOCCUS
MIKROBIOLOGIE Veškeré testy jsou prováděny s těmito bakteriálními kmeny: Gramnegativní tyčinkovitá bakterie ESCHERICHIA COLI bakteriální kmen dle ATCC 9637 (CCM 2024). Grampozitivní kokovitá bakterie STAPHYLOCOCCUS
prokaryotní Znaky prokaryoty
 prokaryotní buňka Znaky prokaryoty Základní stavební jednotka bakterií a sinic Mikroskopická velikost viditelné pouze v optickém mikroskopu Buňka neobsahuje organely Obsahuje pouze 1 biomembránu cytoplazmatickou
prokaryotní buňka Znaky prokaryoty Základní stavební jednotka bakterií a sinic Mikroskopická velikost viditelné pouze v optickém mikroskopu Buňka neobsahuje organely Obsahuje pouze 1 biomembránu cytoplazmatickou
N Laboratoř hydrobiologie a mikrobiologie
 ÚSTAV TECHNOLOGIE VODY A PROSTŘEDÍ N217019 - Laboratoř hydrobiologie a mikrobiologie Název úlohy: Mikrobiologie a hydrobiologie: Klasické metody barvení Vypracováno v rámci projektu: Inovace a restrukturalizace
ÚSTAV TECHNOLOGIE VODY A PROSTŘEDÍ N217019 - Laboratoř hydrobiologie a mikrobiologie Název úlohy: Mikrobiologie a hydrobiologie: Klasické metody barvení Vypracováno v rámci projektu: Inovace a restrukturalizace
Rostlinná buňka příprava mikroskopického preparátu (laboratorní práce)
 Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.128/02.0055 Rostlinná buňka příprava mikroskopického preparátu (laboratorní práce) Označení: EU-Inovace-Př-6-02 Předmět: přírodopis
Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.128/02.0055 Rostlinná buňka příprava mikroskopického preparátu (laboratorní práce) Označení: EU-Inovace-Př-6-02 Předmět: přírodopis
2) Připravte si 3 sady po šesti zkumavkách. Do všech zkumavek pipetujte 0.2 ml roztoku BAPNA o různé koncentraci podle tabulky.
 CVIČENÍ Z ENZYMOLOGIE 1) Stanovení Michaelisovy konstanty trypsinu pomocí chromogenního substrátu. Aktivita trypsinu se určí změřením rychlosti hydrolýzy chromogenního substrátu BAPNA (Nα-benzoyl-L-arginin-p-nitroanilid)
CVIČENÍ Z ENZYMOLOGIE 1) Stanovení Michaelisovy konstanty trypsinu pomocí chromogenního substrátu. Aktivita trypsinu se určí změřením rychlosti hydrolýzy chromogenního substrátu BAPNA (Nα-benzoyl-L-arginin-p-nitroanilid)
ZÁKLADNÍ ČÁSTI SPEKTRÁLNÍCH PŘÍSTROJŮ
 ZÁKLADNÍ ČÁSTI SPEKTRÁLNÍCH PŘÍSTROJŮ (c) -2008, ACH/IM BLOKOVÉ SCHÉMA: (a) emisní metody (b) absorpční metody (c) luminiscenční metody U (b) monochromátor často umístěn před kyvetou se vzorkem. Části
ZÁKLADNÍ ČÁSTI SPEKTRÁLNÍCH PŘÍSTROJŮ (c) -2008, ACH/IM BLOKOVÉ SCHÉMA: (a) emisní metody (b) absorpční metody (c) luminiscenční metody U (b) monochromátor často umístěn před kyvetou se vzorkem. Části
Protokol 04. pšeničná bílkovina. masné výrobky. zkrácená verze
 1 Popis vzorku Podle protokolu č. 04 lze vyšetřit vzorky různých druhů masných výrobků na přítomnost pšeničné bílkoviny. 2 Detekční limit vyšetření Přítomnost pšeničné bílkoviny lze spolehlivě prokázat,
1 Popis vzorku Podle protokolu č. 04 lze vyšetřit vzorky různých druhů masných výrobků na přítomnost pšeničné bílkoviny. 2 Detekční limit vyšetření Přítomnost pšeničné bílkoviny lze spolehlivě prokázat,
Modul IB. Histochemie. CBO Odd. histologie a embryologie. MUDr. Martin Špaček
 Modul IB Histochemie CBO Odd. histologie a embryologie MUDr. Martin Špaček Histochemie Histologická metoda užívaná k průkazu různých látek přímo v tkáních a buňkách Histochemie Katalytická histochemie
Modul IB Histochemie CBO Odd. histologie a embryologie MUDr. Martin Špaček Histochemie Histologická metoda užívaná k průkazu různých látek přímo v tkáních a buňkách Histochemie Katalytická histochemie
Buňka cytologie. Buňka. Autor: Katka www.nasprtej.cz Téma: buňka stavba Ročník: 1.
 Buňka cytologie Buňka - Základní, stavební a funkční jednotka organismu - Je univerzální - Všechny organismy jsou tvořeny z buněk - Nejmenší životaschopná existence - Objev v 17. stol. R. Hooke Tvar: rozmanitý,
Buňka cytologie Buňka - Základní, stavební a funkční jednotka organismu - Je univerzální - Všechny organismy jsou tvořeny z buněk - Nejmenší životaschopná existence - Objev v 17. stol. R. Hooke Tvar: rozmanitý,
Fluorescence (luminiscence)
 Fluorescence (luminiscence) Patří mezi luminiscenční metody fotoluminiscence. Luminiscence efekt, kdy excitované molekuly či atomy vyzařují světlo při přechodu z excitovaného do základního stavu. Podle
Fluorescence (luminiscence) Patří mezi luminiscenční metody fotoluminiscence. Luminiscence efekt, kdy excitované molekuly či atomy vyzařují světlo při přechodu z excitovaného do základního stavu. Podle
Laboratorní práce č. 3: Měření vlnové délky světla
 Přírodní vědy moderně a interaktivně SEMINÁŘ FYZIKY Laboratorní práce č. 3: Měření vlnové délky světla G Gymnázium Hranice Přírodní vědy moderně a interaktivně SEMINÁŘ FYZIKY Gymnázium G Hranice Test
Přírodní vědy moderně a interaktivně SEMINÁŘ FYZIKY Laboratorní práce č. 3: Měření vlnové délky světla G Gymnázium Hranice Přírodní vědy moderně a interaktivně SEMINÁŘ FYZIKY Gymnázium G Hranice Test
Buňka. Kristýna Obhlídalová 7.A
 Buňka Kristýna Obhlídalová 7.A Buňka Buňky jsou nejmenší a nejjednodušší útvary schopné samostatného života. Buňka je základní stavební a funkční jednotkou živých organismů. Zatímco některé organismy jsou
Buňka Kristýna Obhlídalová 7.A Buňka Buňky jsou nejmenší a nejjednodušší útvary schopné samostatného života. Buňka je základní stavební a funkční jednotkou živých organismů. Zatímco některé organismy jsou
Chromoprobe Multiprobe - T System
 Návod k použití REF: PMP 009/PMP 008/ PMP 007 Chromoprobe Multiprobe - T System Pouze pro profesionální použití Fluorescenční In Situ Hybridizace (FISH) je technika, která umožňuje detekci DNA sekvencí
Návod k použití REF: PMP 009/PMP 008/ PMP 007 Chromoprobe Multiprobe - T System Pouze pro profesionální použití Fluorescenční In Situ Hybridizace (FISH) je technika, která umožňuje detekci DNA sekvencí
Viková, M. : MIKROSKOPIE I Mikroskopie I M. Viková
 Mikroskopie I M. Viková LCAM DTM FT TU Liberec, martina.vikova@tul.cz MIKROSVĚT nano Poměry velikostí mikro 9 10 10 8 10 7 10 6 10 5 10 4 10 3 size m 2 9 7 5 3 4 8 1 micela virus světlo 6 písek molekula
Mikroskopie I M. Viková LCAM DTM FT TU Liberec, martina.vikova@tul.cz MIKROSVĚT nano Poměry velikostí mikro 9 10 10 8 10 7 10 6 10 5 10 4 10 3 size m 2 9 7 5 3 4 8 1 micela virus světlo 6 písek molekula
Využití a princip fluorescenční mikroskopie
 Využití a princip fluorescenční mikroskopie fyzikálně chemický děj Fluorescence typem luminiscence (elektroluminiscence, fotoluminiscence, radioluminiscence a chemiluminiscenci) patří mezi fotoluminiscenční
Využití a princip fluorescenční mikroskopie fyzikálně chemický děj Fluorescence typem luminiscence (elektroluminiscence, fotoluminiscence, radioluminiscence a chemiluminiscenci) patří mezi fotoluminiscenční
Fluorescenční vyšetření rostlinných surovin. 10. cvičení
 Fluorescenční vyšetření rostlinných surovin 10. cvičení Cíl cvičení práce s fluorescenčním mikroskopem detekce vybraných rostlinných surovin Princip nepřímé dvojstupňové IHC s použitím fluorochromu Fluorescenční
Fluorescenční vyšetření rostlinných surovin 10. cvičení Cíl cvičení práce s fluorescenčním mikroskopem detekce vybraných rostlinných surovin Princip nepřímé dvojstupňové IHC s použitím fluorochromu Fluorescenční
ROSTLINNÁ BUŇKA A JEJÍ ČÁSTI
 Gymnázium a Střední odborná škola pedagogická, Čáslav, Masarykova 248 M o d e r n í b i o l o g i e reg. č.: CZ.1.07/1.1.32/02.0048 TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM
Gymnázium a Střední odborná škola pedagogická, Čáslav, Masarykova 248 M o d e r n í b i o l o g i e reg. č.: CZ.1.07/1.1.32/02.0048 TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM
Laboratorní cvičení z obecné mikrobiologie
 MIKROSKOPY Mikroskopická technika je neodmyslitelnou součástí praktické mikrobiologie a mikroskop patří k základnímu vybavení každé laboratoře. 1. Popis zařízení Mikroskop je vlastně soustava čoček o jedné
MIKROSKOPY Mikroskopická technika je neodmyslitelnou součástí praktické mikrobiologie a mikroskop patří k základnímu vybavení každé laboratoře. 1. Popis zařízení Mikroskop je vlastně soustava čoček o jedné
Praktická cvičení z biologie na gymnáziu
 Modulární systém dalšího vzdělávání pedagogických pracovníků JmK v přírodních vědách a informatice CZ.1.07/1.3.10/02.0024 Praktická cvičení z biologie na gymnáziu Mgr. Jana Sítařová 1.Téma: Bezpečnost
Modulární systém dalšího vzdělávání pedagogických pracovníků JmK v přírodních vědách a informatice CZ.1.07/1.3.10/02.0024 Praktická cvičení z biologie na gymnáziu Mgr. Jana Sítařová 1.Téma: Bezpečnost
Typy molekul, látek a jejich vazeb v organismech
 Typy molekul, látek a jejich vazeb v organismech Typy molekul, látek a jejich vazeb v organismech Organismy se skládají z molekul rozličných látek Jednotlivé látky si organismus vytváří sám z jiných látek,
Typy molekul, látek a jejich vazeb v organismech Typy molekul, látek a jejich vazeb v organismech Organismy se skládají z molekul rozličných látek Jednotlivé látky si organismus vytváří sám z jiných látek,
ROSTLINNÁ FYZIOLOGIE OSMOTICKÉ JEVY
 Gymnázium a Střední odborná škola pedagogická, Čáslav, Masarykova 248 M o d e r n í b i o l o g i e reg. č.: CZ.1.07/1.1.32/02.0048 TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM
Gymnázium a Střední odborná škola pedagogická, Čáslav, Masarykova 248 M o d e r n í b i o l o g i e reg. č.: CZ.1.07/1.1.32/02.0048 TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM
