SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
|
|
|
- Vlastimil Marek
- před 8 lety
- Počet zobrazení:
Transkript
1 Príloha č.1 k rozhodnutiu o zmene v registrácii, ev.č. 2009/01546 SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU Menopur 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Jedna injekčná liekovka s práškom obsahuje vysoko čistený menotropín (vysoko čistený humánny menopauzálny gonadotropín, HP-hMG) zodpovedajúci aktivite 75 I.U. FSH (folikuly stimulujúci hormón) a 75 I.U. LH (luteinizačný hormón). V Menopure sa nachádza ľudský choriový gonadotropín (hcg), prirodzene sa vyskytujúci hormón v moči postmenopauzálnych ţien, ktorý prispieva k celkovej aktivite LH. Úplný zoznam pomocných látok, pozri časť LIEKOVÁ FORMA Prášok a rozpúšťadlo na injekčný roztok. Vzhľad prášku: biely aţ takmer biely lyofilizovaný prášok (koláč). Vzhľad rozpúšťadla: číry bezfarebný roztok. 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikácie Menopur sa pouţíva na liečbu neplodnosti v nasledujúcich klinických indikáciách: U ţien Anovulácia, vrátane syndrómu polycystických ovárií (PCOD) u ţien, ktoré nereagujú na liečbu s klomiféniumcitrátom. Kontrolovaná ovariálna hyperstimulácia na vyvolanie rastu viacerých folikulov pri metódach asistovanej reprodukcie (ART) (napr. in vitro fertilizácia/prenos embrya (IVF/ET), prenos gamét do vajcovodu (GIFT) a intracytoplazmatická injekcia spermie (ICSI)). Stimulácia rastu folikulov u ţien s hypogonadotropným hypogonadizmom. U muţov Nedostatočná spermatogenéza spôsobená hypogonadotropným hypogonadizmom (v kombinácii s humánnym choriovým gonadotropínom, hcg). 4.2 Dávkovanie a spôsob podávania Liečba Menopurom sa má uskutočniť pod dohľadom lekára so skúsenosťami s liečbou porúch fertility. Spôsob podávania
2 Menopur je určený na subkutánne (s.c.) alebo intramuskulárne (i.m.) injekčné podanie po rozpustení prášku v priloţenom rozpúšťadle. Prášok sa má rozpustiť bezprostredne pred pouţitím. Aby sa zabránilo podávaniu veľkých objemov, v priloţenom rozpúšťadle moţno rozpustiť aţ 3 injekčné liekovky s práškom. Treba sa vyhnúť prudkému pretrepávaniu. Roztok sa nemôţe pouţiť, ak obsahuje čiastočky alebo nie je číry. Dávkovanie Dávkovací reţim uvedený niţšie je rovnaký pre subkutánne a intramuskulárne podanie. Pretoţe existujú veľké inter- a intraindividuálne rozdiely v odpovedi ovárií na exogénne gonadotropíny, nie je moţné zostaviť jednotnú dávkovaciu schému. Dávkovanie sa má určiť individuálne v závislosti od odpovede ovárií. Menopur sa môţe podávať samostatne alebo v kombinácii s agonistom alebo antagonistom gonadotropín uvoľňujúceho hormónu (GnRH). Odporúčania ohľadom dávkovania a dĺţky liečby sa môţu meniť v závislosti od aktuálneho liečebného postupu. Ženy s anovuláciou (vrátane hypogonadotropného hypogonadizmu a PCOD): Cieľom liečby Menopurom je vývoj jedného Graafovho folikulu, z ktorého sa po podaní ľudského choriového gonadotropínu (hcg) uvoľní vajíčko. Liečba Menopurom sa má začať počas prvých 7 dní menštruačného cyklu. U pacientok s hypogonadotropným hypogonadizmom moţno začať liečbu kedykoľvek, nakoľko majú amenoreu a nízku endogénnu sekréciu estrogénov. Odporúčaná počiatočná dávka Menopuru je I.U. denne a má trvať najmenej 7 dní. Na základe klinického monitorovania (vrátane samotného ultrazvukového vyšetrenia ovárií alebo spolu s meraním hladín estradiolu) následné dávkovanie sa má upraviť podľa individuálnej odpovede pacientky. Úprava dávkovania sa nemá robiť častejšie ako kaţdých 7 dní. Odporúčanú dávku moţno zvyšovať postupne o 37,5 I.U. na jednu úpravu dávky a nesmie presiahnuť 75 I.U. Maximálna denná dávka nemôţe byť vyššia ako 225 I.U. Ak pacientka po 4 týţdňoch na liečbu primerane neodpovedá, cyklus sa má ukončiť a pacientke sa má odporučiť liečba s vyššou počiatočnou dávkou ako v ukončenom cykle. Ak sa dostaví optimálna odpoveď, je potrebné podať jednu injekciu aţ I.U. hcg jeden deň po podaní poslednej injekcie Menopuru. Pacientke sa odporučí pohlavný styk v deň podania hcg injekcie a v nasledujúci deň. Prípadne moţno vykonať vnútromaternicovú insemináciu. Ak sa dostaví nadmerná reakcia na Menopur, liečba sa má ukončiť a hcg nepodať (pozri časť 4.4). Pacientka má pouţívať bariérové kontraceptívne metódy alebo sa vyhýbať pohlavnému styku do začiatku ďalšej menštruácie. Ženy, ktoré podstupujú kontrolovanú ovariálnu hyperstimuláciu na indukciu viacpočetného vývoja folikulov pri metódach asistovanej reprodukcie (ART): V súlade s klinickým hodnotením Menopuru, ktoré zahŕňa zníţenie reaktibility GnRH agonistami, liečba Menopurom sa má začať pribliţne 2 týţdne po začatí liečby agonistom. Odporúčaná počiatočná dávka Menopuru je I.U. denne počas najmenej prvých 5 dní liečby. Na základe klinického monitorovania (vrátane samotného ultrazvukového vyšetrenia ovárií alebo spolu s meraním hladín estradiolu) následné dávkovanie sa má upraviť podľa individuálnej odpovede pacientky a nesmie presiahnuť 150 I.U. na jednu úpravu dávky. Maximálna denná dávka nemá byť vyššia ako 450 I.U. a vo väčšine prípadov sa neodporúča liečba dlhšia ako 20 dní. Ak liečebný postup nezahŕňa zníţenie reaktibility GnRH agonistom, liečba Menopurom sa má začať na 2. alebo 3. deň menštruačného cyklu. Odporúča sa pouţívať rozsah dávok a reţim podávania uvedený vyššie pre liečbu so zníţením reaktibility GnRH agonistami. Keď vhodný počet folikulov dosiahne správnu veľkosť, podá sa jednorazová injekcia do I.U. hcg na vyvolanie záverečného dozretia folikulu ako prípravy na získanie vajíčka. Pacientky sa majú pozorne sledovať najmenej 2 týţdne po podaní hcg. Ak sa dostaví nadmerná reakcia na Menopur, 2
3 liečba sa má ukončiť a hcg nepodať (pozri časť 4.4). Pacientka má pouţívať bariérové kontraceptívne metódy alebo sa vyhýbať pohlavnému styku do začiatku ďalšej menštruácie. Sterilita u mužov: Najskôr sa podáva hcg, kým sa nedosiahne normálna hladina testosterónu v krvi. Potom sa podáva Menopur v odporúčaných dávkach 75 I.U. alebo 150 I.U. trikrát týţdenne v kombinácii s hcg. Liečba má pokračovať 3-4 mesiace, aţ pokiaľ sa nedosiahne zlepšenie spermatogenézy. Súčasné klinické údaje ukazujú, ţe na dosiahnutie spermatogenézy môţe byť nevyhnutná liečba aţ 18 mesiacov alebo dlhšia Kontraindikácie Menopur je kontraindikovaný u ţien v nasledujúcich prípadoch: - nádory hypofýzy alebo hypotalamu - karcinóm vaječníkov, maternice alebo prsníkov - gravidita a laktácia - gynekologické krvácanie neznámej etiológie - precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok lieku (pozri časť 6.1) - cysty ovárií alebo zväčšenie ovárií nezapríčinené syndrómom polycystických ovárií V nasledujúcich prípadoch je pozitívny výsledok liečby málo pravdepodobný, a preto sa Menopur nemá podávať: - primárne zlyhanie ovárií - malformácia pohlavných orgánov nezlučiteľná s graviditou - fibroidné nádory maternice nezlučiteľné s graviditou Menopur je kontraindikovaný u muţov s diagnózou: - nádory hypofýzy a hypotalamu - nádory semenníkov - karcinóm prostaty - precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok lieku (pozri časť 6.1) Menopur sa nemá podávať, ak nemoţno dosiahnuť účinnú odpoveď, ako v prípade: - primárnej testikulárnej insuficiencie 4. 4 Osobitné upozornenia a opatrenia pri používaní Menopur je veľmi účinná gonadotropná látka, ktorá môţe spôsobiť mierne aţ závaţné neţiaduce reakcie a môţe sa podávať len pod vedením lekára, ktorý má skúsenosti s problémami a liečbou neplodnosti. Liečba gonadotropínmi si vyţaduje určitý časový záväzok od lekára a ošetrujúceho zdravotníckeho personálu a nutnosť pravidelného monitorovania reakcie ovárií ultrazvukom alebo vhodnejšie spolu s meraním hladín estradiolu v sére. Pacientky môţu odpovedať na podanie menotropínu rozdielne. U niektorých pacientok je odpoveď na menotropín nedostatočná. Pri liečbe sa má pouţiť najniţšia účinná dávka, v závislosti od reakcie pacientky. Prvá injekcia Menopuru sa má podať pod priamym dohľadom lekára. Pred začiatkom liečby je potrebné posúdiť neplodnosť páru a zváţiť moţné kontraindikácie gravidity. Pacientky sa majú vyšetriť hlavne na hypotyreoidizmus, adrenokortikálnu deficienciu, hyperprolaktinémiu a nádory hypofýzy alebo hypotalamu a v prípade ich potvrdenia sa im má poskytnúť vhodná špecifická liečba. U pacientok, ktoré sa podrobujú stimulácii rastu folikulov, či uţ v rámci liečby anovulačnej neplodnosti alebo ART metód, môţe dôjsť k zväčšeniu ovárií alebo hyperstimulácii. Dodrţiavanie odporúčaných dávok Menopuru a reţimu podávania ako aj dôsledné monitorovanie liečby 3
4 minimalizujú výskyt takýchto udalostí. Presná interpretácia ukazovateľov vývoja a dozrievania folikulov si vyţaduje lekára so skúsenosťami v interpretácii príslušných testov. Syndróm ovariálnej hyperstimulácie (OHSS) OHSS je ochorenie odlišné od nekomplikovaného zväčšenia ovárií. OHSS je syndróm, ktorý môţe nadobudnúť vysoký stupeň závaţnosti. Prejavuje sa nápadným zväčšením ovárií, vysokými hodnotami pohlavných steroidov v sére a zvýšenou permeabilitou ciev, čo môţe mať za následok hromadenie tekutín v peritoneálnych, pleurálnych a zriedkavo aj v perikardiálnych dutinách. V závaţných prípadoch OHSS moţno pozorovať nasledujúce symptómy: bolesti brucha, distenziu brucha, závaţné zväčšenie ovárií, zvýšenie telesnej hmotnosti, dyspnoe, oligúriu a gastrointestinálne symptómy, vrátane nauzey, vracania a hnačky. Klinické vyšetrenie môţe odhaliť hypovolémiu, hemokoncentráciu, nerovnováhu elektrolytov, ascites, hemoperitoneum, pleurálnu efúziu, hydrotorax, akútnu bolesť v oblasti pľúc a trombembolické príhody. Nadmerná odpoveď vaječníkov na liečbu gonadotropínmi zriedkavo spôsobuje OHSS, pokiaľ nie je na vyvolanie ovulácie podaný hcg. Preto je potrebné v prípadoch ovariálnej hyperstimulácie hcg nepodať a odporučiť pacientke, aby aspoň 4 dni nemala pohlavný styk alebo pouţívala bariérové kontraceptívne metódy. OHSS môţe rýchlo progredovať (za 24 hodín aţ niekoľko dní) a stať sa z lekárskeho hľadiska závaţným, preto sa pacientky majú sledovať najmenej dva týţdne po podaní hcg. Dodrţiavanie odporúčaných dávok Menopuru a reţimu podávania ako aj dôsledné monitorovanie liečby minimalizujú výskyt ovariálnej hyperstimulácie a viacpočetnej gravidity (pozri časti 4.2 a 4.8). Pri ART sa môţe zníţiť výskyt hyperstimulácie aspiráciou všetkých folikulov pred ovuláciou. OHSS môţe byť závaţnejší a protrahovaný v prípade gravidity. Vo väčšine prípadov sa OHSS objaví po prerušení hormonálnej liečby a dosahuje maximum 7-10 dní po liečbe. Zvyčajne OHSS vymizne spontánne so začiatkom menštruácie. V závaţných prípadoch OHSS je potrebné ukončiť liečbu gonadotropínmi, ak ešte pokračuje, pacientku hospitalizovať a začať so špecifickou liečbou OHSS. Syndróm sa vyskytuje s vyššou incidenciou u pacientok so syndrómom polycystických ovárií. Viacpočetná gravidita Viacpočetná gravidita, zvlášť pri vyššom počte plodov, prináša so sebou zvýšené riziko vedľajších materských a perinatálnych následkov. U pacientok podrobujúcich sa indukcii ovulácie gonadotropínmi sa zvyšuje incidencia viacpočetnej gravidity v porovnaní s prirodzeným počatím. Vo väčšine prípadov sa jedná o dvojičky. Na minimalizovanie rizika viacpočetnej gravidity sa odporúča dôsledné monitorovanie odpovede ovárií. U pacientok podrobujúcich sa liečbe ART súvisí riziko viacpočetnej gravidity hlavne s počtom umiestnených embryí, ich kvalitou a vekom pacientky. Pred začiatkom liečby má byť pacientka informovaná o potenciálnom riziku viacpočetnej gravidity. Ukončenie gravidity Incidencia spontánneho potratu alebo umelého prerušenia gravidity je vyššia u pacientok podstupujúcich stimuláciu rastu folikulov na indukciu ovulácie alebo ART v porovnaní s normálnou populáciou. Mimomaternicová gravidita Ţeny s anamnézou ochorenia vajcovodov predstavujú rizikovú skupinu z hľadiska mimomaternicovej gravidity, či uţ ide o spontánne počatie alebo po liečbe neplodnosti. Hlásená bola prevalencia mimomaternicovej gravidity po IVF 2 aţ 5% v porovnaní s 1 aţ 1,5% v beţnej populácii. 4
5 Nádory reprodukčných orgánov U ţien podstupujúcich viacnásobné liečebné cykly pri liečbe neplodnosti boli hlásené nádory ovárií a iných reprodukčných orgánov, benígne a malígne. Dosiaľ nie je zrejmé, či liečba gonadotropínmi zvyšuje základné riziko týchto nádorov u neplodných ţien. Kongenitálne malformácie Prevalencia kongenitálnych malformácií po ART môţe byť mierne zvýšená oproti prirodzenému počatiu. Môţe to byť spôsobené rozdielmi v charakteristikách rodičov (napr. vek matky, charakter spermií) a viacpočetnými graviditami. Trombembolické príhody U ţien so všeobecnými rizikovými faktormi pre trombembolické príhody, ako sú osobná alebo rodinná anamnéza, závaţná obezita (Body Mass Index >30 kg/m 2 ) alebo trombofília môţe byť počas alebo po liečbe gonadotropínmi zvýšené riziko cievnych alebo arteriálnych trombembolických príhod. U týchto ţien sa musí zváţiť prínos liečby gonadotropínmi oproti riziku liečby. Je potrebné poznamenať, ţe samotná gravidita tieţ zvyšuje riziko trombembolických príhod. Liečba u mužov Zvýšené hladiny endogénneho FSH naznačujú primárne testikulárne zlyhanie. Títo pacienti nereagujú na liečbu Menopurom/hCG. Na zhodnotenie odpovede sa odporúča vyšetrenie spermií 4 aţ 6 mesiacov po začiatku liečby Liekové a iné interakcie Nevykonali sa ţiadne interakčné štúdie s pouţitím Menopuru u ľudí. Hoci nie sú klinické skúsenosti, predpokladá sa, ţe súbeţné podávanie Menopuru a klomiféniumcitrátu môţe zosilniť folikulárnu odpoveď. Pouţitie GnRH agonistu na desenzibilizáciu hypofýzy môţe vyţadovať vyššie dávky Menopuru na dosiahnutie adekvátnej reakcie folikulov Gravidita a laktácia Pouţívanie Menopuru počas gravidity alebo počas laktácie je kontraindikované (pozri časť 4.3). Doteraz sa nezaznamenalo ţiadne teratogénne riziko pri klinickom pouţití gonadotropínov na ovariálnu hyperstimuláciu. Údaje o účinku lieku v gravidite sú nedostatočné. Skúšky na zvieratách nepreukázali teratogénne účinky Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje Neuskutočnili sa ţiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Avšak je nepravdepodobné, ţe Menopur ovplyvňuje schopnosť pacienta viesť vozidlá a obsluhovať stroje Nežiaduce účinky Najčastejšie hlásené neţiaduce účinky pri liečbe Menopurom počas klinických skúšok sú bolesti brucha, bolesti hlavy, bolesť a reakcie v mieste podania injekcie s mierou výskytu do 10 %. V tabuľke niţšie sú uvedené najvýznamnejšie neţiaduce reakcie u ţien liečených Menopurom počas klinických skúšok. Neţiaduce účinky sú rozdelené podľa triedy orgánových systémov a frekvencie. Trieda orgánových systémov Časté ( 1/100 až < 1/10) Poruchy gastrointestinálneho traktu Celkové poruchy a reakcie v mieste podania Bolesti brucha, nauzea, zväčšenie brucha Reakcie v mieste podania injekcie, bolesť v mieste podania injekcie 5
6 Poruchy nervového systému Poruchy reprodukčného systému a prsníkov Bolesť hlavy OHSS, pelvická bolesť V klinických skúškach s Menopurom boli hlásené gastrointestinálne symptómy súvisiace s OHSS, ako sú distenzia brucha a diskomfort, nauzea, vracanie a hnačka. Ako zriedkavé komplikácie OHSS sa môţu objaviť trombembolické príhody a torzia ovárií. Po injekcii Menopuru boli hlásené vo veľmi zriedkavých prípadoch alergické reakcie, lokalizované alebo celkové, vrátane anafylaktickej reakcie. U muţov sa počas liečby gonadotropínmi môţu vyskytnúť gynekomastia, akné a zvýšenie telesnej hmotnosti. Taktieţ sa môţu vyskytnúť reakcie v mieste podania injekcie a hypersenzitivita Predávkovanie Účinky predávkovania nie sú známe, napriek tomu je moţné očakávať výskyt syndrómu ovariálnej hyperstimulácie (pozri časť 4.4). 5. FARMAKOLOGICKÉ VLASTNOSTI 5. 1 Farmakodynamické vlastnosti Farmakoterapeutická skupina: Hormóny (liečivá s hormonálnou aktivitou) ATC kód: G03G A02 ľudský menopauzálny gonadotropín Menopur sa vyrába z moču postmenopuazálnych ţien. V Menopure sa nachádza ľudský choriový gonadotropín (hcg), prirodzene sa vyskytujúci hormón v moči postmenopauzálnych ţien, ktorý prispieva k celkovej aktivite luteinizačného hormónu (LH). Menotropín, ktorý obsahuje aktivitu FSH a LH, indukuje rast a vývoj folikulov v ováriách a tieţ tvorbu gonádových steroidov u ţien, u ktorých sa nejedná o primárne zlyhanie ovárií. FSH ovplyvňuje hlavne vývoj a rast folikulov v počiatočnej fáze vývoja folikulov, pričom LH je dôleţitý pre ovariálnu steroidogenézu a zúčastňuje sa fyziologických dejov, ktoré vedú k vývoju predovulačného folikulu. Folikulárny rast môţe byť stimulovaný FSH za úplnej neprítomnosti LH, avšak vedie k abnormálnemu vývoju folikulov spojeného s nízkou hladinou estradiolu a neschopnosťou luteinizácie na normálne ovulačné stimuly. Vzhľadom k tomu, ţe aktivita LH zvyšuje steroidogenézu, sú hladiny estradiolu v IVF/ICSI cykloch so zníţením reaktibility pri liečbe Menopurom vyššie ako pri rekombinantných FSH liekoch. Treba to vziať do úvahy pri monitorovaní odpovede pacientky meraním hladín estradiolu. Rozdiel v hladinách estradiolu sa nezistil, keď sa na indukciu ovulácie pouţili nízke dávky u pacientok s anovuláciou. V semenníkoch vyvoláva FSH zrenie Sertoliho buniek. To spôsobuje predovšetkým dozrievanie spermatických kanálikov a vývoj spermií. Potrebnou podmienkou je vysoká koncentrácia androgénov v semenníkoch, ktorá sa dosiahne predchádzajúcou liečbou hcg Farmakokinetické vlastnosti Farmakokinetický profil FSH v Menopure je zrejmý. Po 7 dňoch opakovaného podávania 150 I.U. Menopuru zdravým dobrovoľníčkam pri zníţení reaktibility maximálna koncentrácia FSH v plazme bola (korigovaná o východiskovú hodnotu) (priemerná hodnota ± SD) 8,9 ± 3,5 I.U./l po subkutánnom podaní a 8,5 ± 3,2 I.U./l po intramuskulárnom podaní. Maximálna koncentrácia FSH sa dosiahla v priebehu 7 hodín pri obidvoch spôsoboch podania. Polčas eliminácie FSH po opakovanom podaní bol (priemerná hodnota ± SD) 30±11 hodín po subkutánnom podaní a 27±9 hodín po intramuskulárnom podaní. Hoci závislosti koncentrácie samotného LH od času poukazujú na zvýšenie 6
7 koncentrácie LH po dávke Menopuru, dostupné údaje boli veľmi rozptýlené, aby sa mohli pouţiť na vyhodnotenie farmakokinetických parametrov. Menotropín sa vylučuje najmä obličkami. Farmakokinetika Menopuru u pacientov s poruchami funkcie obličiek a pečene sa neskúmala Predklinické údaje o bezpečnosti Vzhľadom na rozsiahle klinické skúsenosti s menotropínom, existuje obmedzené mnoţstvo predklinických štúdií bezpečnosti s Menopurom. 6. FARMACEUTICKÉ INFORMÁCIE 6. 1 Zoznam pomocných látok Prášok: monohydrát laktózy polysorbát 20 hydroxid sodný kyselina chlorovodíková Rozpúšťadlo: chlorid sodný kyselina chlorovodíková na úpravu ph voda na injekciu 6. 2 Inkompatibility Menopur sa nesmie podávať v jednej injekcii s inými liekmi, okrem urofolitropínu (FSH) Bravelle (Ferring). Štúdie ukázali, ţe súbeţné podávanie Menopuru s Bravelle neovplyvňuje významným spôsobom očakávanú bioaktivitu Čas použiteľnosti Prášok: 3 roky Rozpúšťadlo: 3 roky Na okamţité a jednorazové pouţitie po nariedení Špeciálne upozornenia na uchovávanie Uchovávajte pri teplote do +25 o C. Neuchovávajte v mrazničke. Uchovávajte v pôvodnom obale Druh obalu a obsah balenia Prášok: 2 ml bezfarebná sklená (sklo typ I) injekčná liekovka uzavretá gumovou zátkou s viečkom. Rozpúšťadlo: 1 ml bezfarebná sklená (sklo typ I) ampulka. Veľkosť balenia: 5 injekčných liekoviek s práškom a 5 ampuliek rozpúšťadla 10 injekčných liekoviek s práškom a 10 ampuliek rozpúšťadla 7
8 6. 6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom Prášok sa smie rozpustiť len v priloţenom rozpúšťadle. Nasaďte ihlu na riedenie k injekčnej striekačke. Odoberte celý obsah rozpúšťadla z ampulky a vstreknite ho do injekčnej liekovky s práškom. Prášok sa má rýchlo rozpustiť na číry roztok. Ak sa prášok okamţite nerozpustí, opatrne otáčajte ampulkou medzi dlaňami dovtedy, aţ kým roztok nebude číry. Vyhýbajte sa silnému pretrepávaniu roztoku. Ak je to potrebné, roztok sa môţe znova natiahnuť do injekčnej striekačky a vstreknúť do ďalšej injekčnej liekovky s práškom, aţ kým sa nedosiahne predpísaná dávka. V jednej ampulke s rozpúšťadlom sa môţu rozpustiť aţ 3 injekčné liekovky s práškom. Po dosiahnutí predpísanej dávky odoberte pripravený roztok z liekovky do injekčnej striekačky, ihlu vymeňte za hypodermickú ihlu a okamţite podajte. Roztok sa nesmie pouţiť, ak obsahuje čiastočky alebo nie je číry. Všetky nepouţité lieky alebo odpad vzniknutý z liekov majú byť zlikvidované v súlade s miestnymi poţiadavkami. 7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII Ferring GmbH Wittland Kiel Nemecko 8. REGISTRAČNÉ ČÍSLO 56/0228/01-S 9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE / 10. DÁTUM REVÍZIE TEXTU máj
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU Menopur 600 I.U. 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Jedna injekčná liekovka s práškom obsahuje vysoko čistený menotropín (vysoko čistený ľudský
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU Menopur 600 I.U. 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Jedna injekčná liekovka s práškom obsahuje vysoko čistený menotropín (vysoko čistený ľudský
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV. Menopur 600 I.U. menotropinum HP prášok a rozpúšťadlo na injekčný roztok
 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Menopur 600 I.U. menotropinum HP prášok a rozpúšťadlo na injekčný roztok Pozorne si prečítajte celú písomnú informáciu skôr, ako začnete používať tento liek. - Túto
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Menopur 600 I.U. menotropinum HP prášok a rozpúšťadlo na injekčný roztok Pozorne si prečítajte celú písomnú informáciu skôr, ako začnete používať tento liek. - Túto
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV. Bravelle 75 I.U. prášok a rozpúšťadlo na injekčný roztok urofollitropinum
 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Bravelle 75 I.U. prášok a rozpúšťadlo na injekčný roztok urofollitropinum Pozorne si prečítajte celú písomnú informáciu skôr, ako začnete užívať Váš liek. - Túto písomnú
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Bravelle 75 I.U. prášok a rozpúšťadlo na injekčný roztok urofollitropinum Pozorne si prečítajte celú písomnú informáciu skôr, ako začnete užívať Váš liek. - Túto písomnú
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls83935/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU (SPC)
 Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls83935/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU (SPC) 1. NÁZEV PŘÍPRAVKU MENOPUR 75 IU Prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls83935/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU (SPC) 1. NÁZEV PŘÍPRAVKU MENOPUR 75 IU Prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ
PRÍLOHA III DODATKY K SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNEJ INFORMÁCII PRE POUŽÍVATEĽOV
 PRÍLOHA III DODATKY K SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNEJ INFORMÁCII PRE POUŽÍVATEĽOV Tieto zmeny v SPC a písomnej informácii pre používateľov sú platné v čase Rozhodnutia Komisie. Po
PRÍLOHA III DODATKY K SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNEJ INFORMÁCII PRE POUŽÍVATEĽOV Tieto zmeny v SPC a písomnej informácii pre používateľov sú platné v čase Rozhodnutia Komisie. Po
Príloha III. Úpravy súhrnu charakteristických vlastností lieku, označenie na obale a písomná informácia je výsledkom postupu preskúmania.
 Príloha III Úprava príslušným častí súhrnu charakteristických vlastností lieku a písomnej informácii pre používateľa Poznámka: Úpravy súhrnu charakteristických vlastností lieku, označenie na obale a písomná
Príloha III Úprava príslušným častí súhrnu charakteristických vlastností lieku a písomnej informácii pre používateľa Poznámka: Úpravy súhrnu charakteristických vlastností lieku, označenie na obale a písomná
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls83793/2011 a sukls83810/2011
 Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls83793/2011 a sukls83810/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU (SPC) 1. NÁZEV PŘÍPRAVKU MENOPUR 600 IU, Prášek pro přípravu injekčního roztoku s rozpouštědlem
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls83793/2011 a sukls83810/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU (SPC) 1. NÁZEV PŘÍPRAVKU MENOPUR 600 IU, Prášek pro přípravu injekčního roztoku s rozpouštědlem
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls242308/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Menogon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Menotropinum (lidský menopauzální gonadotropin, hmg) odpovídající follitropinum 75 IU
sp.zn.: sukls242308/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Menogon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Menotropinum (lidský menopauzální gonadotropin, hmg) odpovídající follitropinum 75 IU
SOUHRN ÚDAJŮ O PŘÍPRAVKU (SPC)
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls277444/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU (SPC) 1. NÁZEV PŘÍPRAVKU MENOPUR 75 IU Prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls277444/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU (SPC) 1. NÁZEV PŘÍPRAVKU MENOPUR 75 IU Prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls98107/2008 a příloha k sp.zn.sukls8143/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BRAVELLE 75 IU, prášek a rozpouštědlo pro injekční
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls98107/2008 a příloha k sp.zn.sukls8143/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BRAVELLE 75 IU, prášek a rozpouštědlo pro injekční
Příloha č. 2 k rozhodnutí o převodu registrace sp. zn. sukls83935/2011
 Příloha č. 2 k rozhodnutí o převodu registrace sp. zn. sukls83935/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE MENOGON Prášek pro přípravu injekčního roztoku z rozpouštědlem (Menotropinum) Přečtěte
Příloha č. 2 k rozhodnutí o převodu registrace sp. zn. sukls83935/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE MENOGON Prášek pro přípravu injekčního roztoku z rozpouštědlem (Menotropinum) Přečtěte
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls158971/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bravelle 75 IU, prášek a rozpouštědlo pro injekční roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička s práškem obsahuje 82,5
Sp.zn.sukls158971/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bravelle 75 IU, prášek a rozpouštědlo pro injekční roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička s práškem obsahuje 82,5
NÁZOV, FARMACEUTICKÁ FORMA, MNOŽSTVO ÚČINNÝCH LÁTOK V LIEKU, SPÔSOB PODÁVANIA, UCHÁDZAČ, DRŽITEĽ ROZHODNUTIA O REGISTRÁCII V ČLENSKÝCH ŠTÁTOCH
 PRÍLOHA I NÁZOV, FARMACEUTICKÁ FORMA, MNOŽSTVO ÚČINNÝCH LÁTOK V LIEKU, SPÔSOB PODÁVANIA, UCHÁDZAČ, DRŽITEĽ ROZHODNUTIA O REGISTRÁCII V ČLENSKÝCH ŠTÁTOCH 1 LIEKY OBSAHUJÚCE JÓDKAZEÍN/TIAMÍN S UDELENÝM POVOLENÍM
PRÍLOHA I NÁZOV, FARMACEUTICKÁ FORMA, MNOŽSTVO ÚČINNÝCH LÁTOK V LIEKU, SPÔSOB PODÁVANIA, UCHÁDZAČ, DRŽITEĽ ROZHODNUTIA O REGISTRÁCII V ČLENSKÝCH ŠTÁTOCH 1 LIEKY OBSAHUJÚCE JÓDKAZEÍN/TIAMÍN S UDELENÝM POVOLENÍM
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls29016/2015, sukls29017/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENOPUR 600 IU MENOPUR 1200 IU Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ MENOPUR
sp.zn. sukls29016/2015, sukls29017/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENOPUR 600 IU MENOPUR 1200 IU Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ MENOPUR
Príloha III. Úprava relevantných častí Súhrnu charakteristických vlastností lieku a Písomnej informácie pre používateľa
 Príloha III Úprava relevantných častí Súhrnu charakteristických vlastností lieku a Písomnej informácie pre používateľa Poznámka: Tento súhrn charakteristických vlastností lieku, označenia obalov a písomnej
Príloha III Úprava relevantných častí Súhrnu charakteristických vlastností lieku a Písomnej informácie pre používateľa Poznámka: Tento súhrn charakteristických vlastností lieku, označenia obalov a písomnej
SOUHRN ÚDAJŮ O PŘÍPRAVKU (SPC)
 sp. zn. sukls40928/2013 a sukls40929/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU (SPC) 1. NÁZEV PŘÍPRAVKU MENOPUR 600 IU, Prášek a rozpouštědlo pro injekční roztok MENOPUR 1200 IU, Prášek a rozpouštědlo pro injekční
sp. zn. sukls40928/2013 a sukls40929/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU (SPC) 1. NÁZEV PŘÍPRAVKU MENOPUR 600 IU, Prášek a rozpouštědlo pro injekční roztok MENOPUR 1200 IU, Prášek a rozpouštědlo pro injekční
Příbalová informace: informace pro uživatele. Menogon Prášek a rozpouštědlo pro injekční roztok (Menotropinum)
 sp.zn.: sukls242308/2011 Příbalová informace: informace pro uživatele Menogon Prášek a rozpouštědlo pro injekční roztok (Menotropinum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp.zn.: sukls242308/2011 Příbalová informace: informace pro uživatele Menogon Prášek a rozpouštědlo pro injekční roztok (Menotropinum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV
 ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV 25 PRÍLOHY K DOPLNENIU RELEVANTNÝCH SEKCII SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU LIEKOV OBSAHUJÚCICH
ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV 25 PRÍLOHY K DOPLNENIU RELEVANTNÝCH SEKCII SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU LIEKOV OBSAHUJÚCICH
MAGNOSOLV V TEHOTENSTVE
 V TEHOTENSTVE Tehotenstvo predstavuje stav nedostatku horčíka v organizme hladina horčíka v sére klesá asi o 10% (1) Dôsledkom manifestného nedostatku horčíka môže byť zvýšené riziko potratu - predčasný
V TEHOTENSTVE Tehotenstvo predstavuje stav nedostatku horčíka v organizme hladina horčíka v sére klesá asi o 10% (1) Dôsledkom manifestného nedostatku horčíka môže byť zvýšené riziko potratu - predčasný
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. Název přípravku FOSTIMON 75 m.j. FOSTIMON 150 m.j. 2. Složení kvalitativní a kvantitativní FOSTIMON 75 m.j. - Urofollitropinum (Follitropinum) 75 m.j. v jedné lahvičce FOSTIMON
Souhrn údajů o přípravku 1. Název přípravku FOSTIMON 75 m.j. FOSTIMON 150 m.j. 2. Složení kvalitativní a kvantitativní FOSTIMON 75 m.j. - Urofollitropinum (Follitropinum) 75 m.j. v jedné lahvičce FOSTIMON
Lieky a pacienti s bolesťou
 Dozadu Na začiatok Ďalej Lieky a pacienti s bolesťou Kúpite si občas v lekárni lieky na bolesť alebo vám ich pravidelne predpisuje lekár? Čítajte ďalej a zistite, či pri liečbe občasnej alebo chronickej
Dozadu Na začiatok Ďalej Lieky a pacienti s bolesťou Kúpite si občas v lekárni lieky na bolesť alebo vám ich pravidelne predpisuje lekár? Čítajte ďalej a zistite, či pri liečbe občasnej alebo chronickej
Informácie o liečbe Gilenyou (fingolimod), ktoré je dôležité si pamätať
 Informácie o liečbe Gilenyou (fingolimod), ktoré je dôležité si pamätať Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že
Informácie o liečbe Gilenyou (fingolimod), ktoré je dôležité si pamätať Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že
(tolkapón) tablety DENNÍK PACIENTA. Pomôže vám dodržiavať pravidelné vyšetrenia funkcie pečene počas prvého roku užívania
 (tolkapón) tablety DENNÍK PACIENTA Pomôže vám dodržiavať pravidelné vyšetrenia funkcie pečene po prvého roku užívania INFORMÁCIE O PACIENTOVI 03 PRED UŽITÍM TASMARU SI, PROSÍM, PREČÍTAJTE NASLEDOVNÉ INFORMÁCIE
(tolkapón) tablety DENNÍK PACIENTA Pomôže vám dodržiavať pravidelné vyšetrenia funkcie pečene po prvého roku užívania INFORMÁCIE O PACIENTOVI 03 PRED UŽITÍM TASMARU SI, PROSÍM, PREČÍTAJTE NASLEDOVNÉ INFORMÁCIE
ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV
 ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV 41 ZMENY, KTORÉ MAJÚ BYŤ ZAHRNUTÉ DO PRÍSLUŠNÝCH ČASTÍ SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV 41 ZMENY, KTORÉ MAJÚ BYŤ ZAHRNUTÉ DO PRÍSLUŠNÝCH ČASTÍ SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
(REF: ARV-HA-3 / REF: ARV-HA-1)
 Hyaluronát sodný 2% (REF: ARV-HA-3 / REF: ARV-HA-1) OBSAH, ref. ARV-HA-3 OBSAH, ref. ARV-HA-1 3 ArthroVisc injekčné striekačky 1 ArthroVisc injekčná striekačka 3 zarážky prsta 1 zarážka prsta Ver.4.X /
Hyaluronát sodný 2% (REF: ARV-HA-3 / REF: ARV-HA-1) OBSAH, ref. ARV-HA-3 OBSAH, ref. ARV-HA-1 3 ArthroVisc injekčné striekačky 1 ArthroVisc injekčná striekačka 3 zarážky prsta 1 zarážka prsta Ver.4.X /
Léčba přípravkem Ovitrelle by měla být prováděna pod dohledem lékaře se zkušenostmi s léčbou poruch plodnosti.
 1. NÁZEV PŘÍPRAVKU Ovitrelle 250 mikrogramů, injekční roztok v předplněném peru 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedno předplněné pero obsahuje 250 mikrogramů choriogonadotropinum alfa* (což odpovídá
1. NÁZEV PŘÍPRAVKU Ovitrelle 250 mikrogramů, injekční roztok v předplněném peru 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedno předplněné pero obsahuje 250 mikrogramů choriogonadotropinum alfa* (což odpovídá
Biologické aktivity magnézia (2) Zastúpenie magnézia v organizme (2) Štvrtý najčastejší katión v ľudskom organizme
 Biologické aktivity magnézia (2) Štvrtý najčastejší katión v ľudskom organizme Druhý najčastejší katión v intracelulárnom priestore Podieľa sa na metabolizme enzýmov, elektrolytov a energetickom metabolizme
Biologické aktivity magnézia (2) Štvrtý najčastejší katión v ľudskom organizme Druhý najčastejší katión v intracelulárnom priestore Podieľa sa na metabolizme enzýmov, elektrolytov a energetickom metabolizme
Page 1 of 113 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Page 1 of 113 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Page 2 of 113 1. NÁZEV PŘÍPRAVKU Pergoveris 150 IU/75 IU, prášek a rozpouštědlo pro injekční roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční
Page 1 of 113 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Page 2 of 113 1. NÁZEV PŘÍPRAVKU Pergoveris 150 IU/75 IU, prášek a rozpouštědlo pro injekční roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pregnyl 500 Pregnyl 1 500 Pregnyl 5 000 prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Pregnyl se skládá z lyofilizovaného
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pregnyl 500 Pregnyl 1 500 Pregnyl 5 000 prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Pregnyl se skládá z lyofilizovaného
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls190941/2013, sukls190955/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky,
Sp.zn.sukls190941/2013, sukls190955/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky,
Postupy pri aplikácii pandemickej vakcíny
 Postupy pri aplikácii pandemickej vakcíny Praktická realizácia očkovacieho výkonu v ambulantnej praxi lekára patrí k štandardným výkonom v rámci poskytovania liečebno-preventívnej starostlivosti. Dôležité
Postupy pri aplikácii pandemickej vakcíny Praktická realizácia očkovacieho výkonu v ambulantnej praxi lekára patrí k štandardným výkonom v rámci poskytovania liečebno-preventívnej starostlivosti. Dôležité
1. NÁZEV PŘÍPRAVKU. Orgalutran 0,25 mg/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 1. NÁZEV PŘÍPRAVKU Orgalutran 0,25 mg/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Předplněná injekční stříkačka obsahuje 0,25 mg ganirelixum v 0,5 ml vodného roztoku. Léčivá látka ganirelixum
1. NÁZEV PŘÍPRAVKU Orgalutran 0,25 mg/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Předplněná injekční stříkačka obsahuje 0,25 mg ganirelixum v 0,5 ml vodného roztoku. Léčivá látka ganirelixum
Protokol o začatí a kontrole liečby závažnej osteoporózy liekom
 Zdravotná poisťovňa: Kód zdravotnej poisťovne: Protokol o začatí a kontrole liečby závažnej osteoporózy liekom Liečba začatie liečby pokračova liečby ukonče liečby Meno, priezvisko a špecializácia navrhujúceho
Zdravotná poisťovňa: Kód zdravotnej poisťovne: Protokol o začatí a kontrole liečby závažnej osteoporózy liekom Liečba začatie liečby pokračova liečby ukonče liečby Meno, priezvisko a špecializácia navrhujúceho
Preimplantačná genetická diagnostika. Černáková I. ISCARE, a.s., Bratislava
 Preimplantačná genetická diagnostika Černáková I. ISCARE, a.s., Bratislava História PGD 1978 Narodenie 1. IVF dieťaťa 1990 Narodenie 1. dieťaťa po PGD Určenie pohlavia preimplantačného embrya 1993 Určenie
Preimplantačná genetická diagnostika Černáková I. ISCARE, a.s., Bratislava História PGD 1978 Narodenie 1. IVF dieťaťa 1990 Narodenie 1. dieťaťa po PGD Určenie pohlavia preimplantačného embrya 1993 Určenie
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls31232/2008, sukls31347/2008
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls31232/2008, sukls31347/2008 Příbalová informace Rp. Informace pro použití, čtěte pozorně! MERIONAL 75 m.j. MERIONAL 150 m.j. (Menotropinum)
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls31232/2008, sukls31347/2008 Příbalová informace Rp. Informace pro použití, čtěte pozorně! MERIONAL 75 m.j. MERIONAL 150 m.j. (Menotropinum)
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Puregon 50 IU/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 50 IU rekombinantního folikulostimulačního
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Puregon 50 IU/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 50 IU rekombinantního folikulostimulačního
Reprodukčné vlastnosti HZ a ich hodnotenie
 Reprodukčné vlastnosti HZ a ich hodnotenie Biologický význam plodnosti zachovanie druhu prenos dedičných vlastností na potomstvo pri mechanizmoch evolúcie Pohlavné rozmnožovanie zložitý, hormonálne riadený
Reprodukčné vlastnosti HZ a ich hodnotenie Biologický význam plodnosti zachovanie druhu prenos dedičných vlastností na potomstvo pri mechanizmoch evolúcie Pohlavné rozmnožovanie zložitý, hormonálne riadený
Protokol o začatí, kontrole a zmene liečby psoriatickej artritídy
 Zdravotná poisťovňa: Všeobecná zdravotná poisťovňa Kód zdravotnej poisťovne: 25 Protokol o začatí, kontrole a zmene liečby psoriatickej artritídy Liečba: začatie liečby pokračovanie liečby zmena biologickej
Zdravotná poisťovňa: Všeobecná zdravotná poisťovňa Kód zdravotnej poisťovne: 25 Protokol o začatí, kontrole a zmene liečby psoriatickej artritídy Liečba: začatie liečby pokračovanie liečby zmena biologickej
Příbalová informace: informace pro uživatele MENOPUR 75 IU. (Menotropinum) Prášek pro přípravu injekčního roztoku s rozpouštědlem
 Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls277444/2012 Příbalová informace: informace pro uživatele MENOPUR 75 IU (Menotropinum) Prášek pro přípravu injekčního roztoku s rozpouštědlem Přečtěte
Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls277444/2012 Příbalová informace: informace pro uživatele MENOPUR 75 IU (Menotropinum) Prášek pro přípravu injekčního roztoku s rozpouštědlem Přečtěte
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU GONAL-f 75 IU (5,5 mikrogramů), prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU GONAL-f 75 IU (5,5 mikrogramů), prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 Príloha č. 1 k notifikácii o zmene v registrácii, ev.č. 2009/00843 Príloha č. 1 k notifikácii o zmene v registrácii, ev.č. 2009/00844 SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU Zomacton 4
Príloha č. 1 k notifikácii o zmene v registrácii, ev.č. 2009/00843 Príloha č. 1 k notifikácii o zmene v registrácii, ev.č. 2009/00844 SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU Zomacton 4
U dospělých mužů: Poruchy spermatogeneze u hypogonadotropního hypogonadismu.
 1. NÁZEV PŘÍPRAVKU Puregon 150 IU/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 150 IU rekombinantního folikulostimulačního hormonu (FSH) v 0,5 ml vodného
1. NÁZEV PŘÍPRAVKU Puregon 150 IU/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 150 IU rekombinantního folikulostimulačního hormonu (FSH) v 0,5 ml vodného
Jedna předplněná injekční stříkačka obsahuje 100 mikrogramů corifollitropinum alfa* v 0,5 ml injekčního roztoku.
 1. NÁZEV PŘÍPRAVKU Elonva 100 mikrogramů injekční roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka obsahuje 100 mikrogramů corifollitropinum alfa* v 0,5 ml injekčního
1. NÁZEV PŘÍPRAVKU Elonva 100 mikrogramů injekční roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka obsahuje 100 mikrogramů corifollitropinum alfa* v 0,5 ml injekčního
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 Príloha č. 2 k notifikácii o zmene, ev. č.: 2017/01968-Z1B Schválený text k rozhodnutiu o prevode, ev. č.: 2017/01969-TR 1. NÁZOV LIEKU Capsagamma 53 mg/100 g krém SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
Príloha č. 2 k notifikácii o zmene, ev. č.: 2017/01968-Z1B Schválený text k rozhodnutiu o prevode, ev. č.: 2017/01969-TR 1. NÁZOV LIEKU Capsagamma 53 mg/100 g krém SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU. Pomocná látka so známym účinkom: 1 vaginálna tableta obsahuje približne 760 mg monohydrátu laktózy.
 Schválený text k notifikácii o zmene, ev. č.: 2015/05944-Z1A SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU Lutinus 100 mg vaginálne tablety 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE 1 vaginálna
Schválený text k notifikácii o zmene, ev. č.: 2015/05944-Z1A SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU Lutinus 100 mg vaginálne tablety 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE 1 vaginálna
U mužů: Poruchy spermatogeneze u hypogonadotropního hypogonadismu.
 1. NÁZEV PŘÍPRAVKU Puregon 75 IU/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 75 IU rekombinantního folikulostimulačního hormonu (FSH) v 0,5 ml vodného
1. NÁZEV PŘÍPRAVKU Puregon 75 IU/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 75 IU rekombinantního folikulostimulačního hormonu (FSH) v 0,5 ml vodného
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Bemfola 75 IU/0,125 ml injekční roztok v předplněném peru 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje follitropinum alfa* 600
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Bemfola 75 IU/0,125 ml injekční roztok v předplněném peru 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje follitropinum alfa* 600
Injekční roztok (injekce). Čirý a bezbarvý roztok. Kontejnery s náplní jsou určeny k použití společně s injekčním perem.
 1. NÁZEV PŘÍPRAVKU Fertavid 150 IU/0,18 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden kontejner obsahuje čistou (netto) celkovou dávku 150 IU rekombinantní folikuly stimulující hormon
1. NÁZEV PŘÍPRAVKU Fertavid 150 IU/0,18 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden kontejner obsahuje čistou (netto) celkovou dávku 150 IU rekombinantní folikuly stimulující hormon
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV PRÍPRAVKU DECAPEPTYL DEPOT 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE LIEKU 1 injekčná striekačka so 172 mg retardovaných mikrokapsúl obsahuje 4,12 mg triptorelinum
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV PRÍPRAVKU DECAPEPTYL DEPOT 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE LIEKU 1 injekčná striekačka so 172 mg retardovaných mikrokapsúl obsahuje 4,12 mg triptorelinum
(Nelegislatívne akty) NARIADENIA
 18.4.2013 Úradný vestník Európskej únie L 108/1 II (Nelegislatívne akty) NARIADENIA NARIADENIE KOMISIE (EÚ) č. 348/2013 zo 17. apríla 2013, ktorým sa mení a dopĺňa príloha XIV k nariadeniu Európskeho parlamentu
18.4.2013 Úradný vestník Európskej únie L 108/1 II (Nelegislatívne akty) NARIADENIA NARIADENIE KOMISIE (EÚ) č. 348/2013 zo 17. apríla 2013, ktorým sa mení a dopĺňa príloha XIV k nariadeniu Európskeho parlamentu
Souhrn údajů o přípravku
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls31232/2008, sukls31347/2008 Souhrn údajů o přípravku 1. Název přípravku MERIONAL 75 m.j. MERIONAL 150 m.j. 2. Složení kvalitativní a kvantitativní
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls31232/2008, sukls31347/2008 Souhrn údajů o přípravku 1. Název přípravku MERIONAL 75 m.j. MERIONAL 150 m.j. 2. Složení kvalitativní a kvantitativní
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Gynekológia a pôrodníctvo
 1. 1. Traumatizmus plodu počas pôrodu 2. Krvácanie počas pôrodu 3. Prekancerózy krčka maternice Gynekológia a pôrodníctvo 2. 1. Oplodnenie a ďalší vývin plodového vajca 2. Spontánny pôrod záhlavím 3. Dysmenorrhoe,
1. 1. Traumatizmus plodu počas pôrodu 2. Krvácanie počas pôrodu 3. Prekancerózy krčka maternice Gynekológia a pôrodníctvo 2. 1. Oplodnenie a ďalší vývin plodového vajca 2. Spontánny pôrod záhlavím 3. Dysmenorrhoe,
NOVÉ NARIADENIE EÚ O OCHRANE OSOBNÝCH ÚDAJOV v kontexte kybernetickej bezpečnosti. Brno, 31. mája 2017
 NOVÉ NARIADENIE EÚ O OCHRANE OSOBNÝCH ÚDAJOV v kontexte kybernetickej bezpečnosti Brno, 31. mája 2017 Nariadenie Európskeho parlamentu a rady (EÚ) 2016/679 Z 27. apríla 2016 o ochrane fyzických osôb pri
NOVÉ NARIADENIE EÚ O OCHRANE OSOBNÝCH ÚDAJOV v kontexte kybernetickej bezpečnosti Brno, 31. mája 2017 Nariadenie Európskeho parlamentu a rady (EÚ) 2016/679 Z 27. apríla 2016 o ochrane fyzických osôb pri
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 Schválený text k rozhodnutiu o zmene, ev.č.: 2013/07585-ZME 1. NÁZOV LIEKU Igantibe 200 IU/ml, injekčný roztok SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Liečivo:
Schválený text k rozhodnutiu o zmene, ev.č.: 2013/07585-ZME 1. NÁZOV LIEKU Igantibe 200 IU/ml, injekčný roztok SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Liečivo:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Puregon 50 IU/0,5 ml injekční roztok Puregon 75 IU/0,5 ml injekční roztok Puregon 100 IU/0,5 ml injekční roztok Puregon 150 IU/0,5 ml injekční roztok
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Puregon 50 IU/0,5 ml injekční roztok Puregon 75 IU/0,5 ml injekční roztok Puregon 100 IU/0,5 ml injekční roztok Puregon 150 IU/0,5 ml injekční roztok
DECAPEPTYL DEPOT ( Triptorelín acetát )
 Písomná informácia pre používateľa čítajte pozorne! DECAPEPTYL DEPOT ( Triptorelín acetát ) Prášok a disperzné prostredie na injekčnú suspenziu Držiteľ rozhodnutia o registrácii: Ferring GmbH, Spolková
Písomná informácia pre používateľa čítajte pozorne! DECAPEPTYL DEPOT ( Triptorelín acetát ) Prášok a disperzné prostredie na injekčnú suspenziu Držiteľ rozhodnutia o registrácii: Ferring GmbH, Spolková
a) Pelvická zápalová choroba b) Diagnostika a diferenciálna diagnostika gravidity GE c) Popôrodné krvácanie
 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. a) Pelvická zápalová choroba b) Diagnostika a diferenciálna diagnostika gravidity GE c) Popôrodné krvácanie a) Puberta fyziológia, patológia b) Štandardné vyšetrovacie metódy
1. 2. 3. 4. 5. 6. 7. 8. 9. 10. a) Pelvická zápalová choroba b) Diagnostika a diferenciálna diagnostika gravidity GE c) Popôrodné krvácanie a) Puberta fyziológia, patológia b) Štandardné vyšetrovacie metódy
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Analýza rizík a kontrolné opatrenia
 Analýza rizík a kontrolné opatrenia Monika Karácsonyová Karol Munka 2. workshop k projektu SK0135 30.3.2011 VÚVH Bratislava Analýza rizík systematický proces využívania dostupných informácií na identifikovanie
Analýza rizík a kontrolné opatrenia Monika Karácsonyová Karol Munka 2. workshop k projektu SK0135 30.3.2011 VÚVH Bratislava Analýza rizík systematický proces využívania dostupných informácií na identifikovanie
1. NÁZEV PŘÍPRAVKU. Puregon 150 IU/0,18 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 1. NÁZEV PŘÍPRAVKU Puregon 150 IU/0,18 ml injekční roztok Puregon 300 IU/0,36 ml injekční roztok Puregon 600 IU/0,72 ml injekční roztok Puregon 900 IU/1,08 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ
1. NÁZEV PŘÍPRAVKU Puregon 150 IU/0,18 ml injekční roztok Puregon 300 IU/0,36 ml injekční roztok Puregon 600 IU/0,72 ml injekční roztok Puregon 900 IU/1,08 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls47313/2018, sukls47383/2018 a sp.zn.sukls68143/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pregnyl 1 500 IU prášek a rozpouštědlo pro injekční roztok Pregnyl 5 000 IU prášek a rozpouštědlo
sp.zn.sukls47313/2018, sukls47383/2018 a sp.zn.sukls68143/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pregnyl 1 500 IU prášek a rozpouštědlo pro injekční roztok Pregnyl 5 000 IU prášek a rozpouštědlo
U mužů: Poruchy spermatogeneze u hypogonadotropního hypogonadismu.
 1. NÁZEV PŘÍPRAVKU Fertavid 150 IU/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 150 IU rekombinantního folikulostimulačního hormonu (FSH) v 0,5 ml vodného
1. NÁZEV PŘÍPRAVKU Fertavid 150 IU/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 150 IU rekombinantního folikulostimulačního hormonu (FSH) v 0,5 ml vodného
Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn. sukls98107/2008 a příloha k sp.zn.sukls8143/2008
 Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn. sukls98107/2008 a příloha k sp.zn.sukls8143/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE BRAVELLE 75IU, prášek a rozpouštědlo pro injekční
Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn. sukls98107/2008 a příloha k sp.zn.sukls8143/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE BRAVELLE 75IU, prášek a rozpouštědlo pro injekční
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Podlimitná zákazka Verejný obstarávateľ
 Finančné limity platné a účinné po 1. marci 2015 Podlimitná zákazka Verejný obstarávateľ BEŽNE DOSTUPNÉ NA TRHU 1 000 eur < 134 000 eur b) bod 3. alebo c)] Stavebné práce 1 000 eur < 5 186 000 eur b) bod.
Finančné limity platné a účinné po 1. marci 2015 Podlimitná zákazka Verejný obstarávateľ BEŽNE DOSTUPNÉ NA TRHU 1 000 eur < 134 000 eur b) bod 3. alebo c)] Stavebné práce 1 000 eur < 5 186 000 eur b) bod.
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU HUMAN ALBUMIN GRIFOLS 5%, infúzny roztok. 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE LIEKU Human Albumin Grifols 5% je roztok, ktorý obsahuje 50 g/l
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU HUMAN ALBUMIN GRIFOLS 5%, infúzny roztok. 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE LIEKU Human Albumin Grifols 5% je roztok, ktorý obsahuje 50 g/l
Léčba přípravkem Puregon má být zahájena pod dohledem lékaře, který má zkušenost s léčbou infertility.
 1. NÁZEV PŘÍPRAVKU Puregon 900 IU/1,08 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden kontejner obsahuje čistou (netto) celkovou dávku 900 IU rekombinantní folikuly stimulující hormon
1. NÁZEV PŘÍPRAVKU Puregon 900 IU/1,08 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden kontejner obsahuje čistou (netto) celkovou dávku 900 IU rekombinantní folikuly stimulující hormon
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE MENOPUR 600 IU. Prášek pro přípravu injekčního roztoku s rozpouštědlem (Menotropinum)
 Příloha č. 1 ke sdělení sp. zn. sukls58640/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE MENOPUR 600 IU Prášek pro přípravu injekčního roztoku s rozpouštědlem (Menotropinum) Přečtěte si pozorně celou
Příloha č. 1 ke sdělení sp. zn. sukls58640/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE MENOPUR 600 IU Prášek pro přípravu injekčního roztoku s rozpouštědlem (Menotropinum) Přečtěte si pozorně celou
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
STAROSTLIVOSŤ O PACIENTA S ASTHMOU BRONCHIALE V AMBULANCII PRAKTICKÉHO LEKÁRA. MUDr. Iveta Vaverková ambulancia praktického lekára Bratislava
 STAROSTLIVOSŤ O PACIENTA S ASTHMOU BRONCHIALE V AMBULANCII PRAKTICKÉHO LEKÁRA MUDr. Iveta Vaverková ambulancia praktického lekára Bratislava ASTHMA BRONCHIALE Chronická zápalová choroba dýchacích ciest
STAROSTLIVOSŤ O PACIENTA S ASTHMOU BRONCHIALE V AMBULANCII PRAKTICKÉHO LEKÁRA MUDr. Iveta Vaverková ambulancia praktického lekára Bratislava ASTHMA BRONCHIALE Chronická zápalová choroba dýchacích ciest
Vývoj cien energií vo vybraných krajinách V4
 Vývoj cien energií vo vybraných krajinách V4 Ceny energií majú v krajinách V4 stále výrazný proinflačný vplyv. Je to výsledok významných váh energií a ich podielu na celkovom spotrebnom koši v kombinácii
Vývoj cien energií vo vybraných krajinách V4 Ceny energií majú v krajinách V4 stále výrazný proinflačný vplyv. Je to výsledok významných váh energií a ich podielu na celkovom spotrebnom koši v kombinácii
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Fertavid 150 IU/0,18 ml injekční roztok follitropinum beta
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Fertavid 150 IU/0,18 ml injekční roztok follitropinum beta Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Fertavid 150 IU/0,18 ml injekční roztok follitropinum beta Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Elonva 100 mikrogramů injekční roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka obsahuje corifollitropinum alfa
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Elonva 100 mikrogramů injekční roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka obsahuje corifollitropinum alfa
Hlavným rizikovým faktorom glaukómu je zvýšený vnútroočný tlak (IOT) (asi 2% populácie vo veku rokov a 8% nad 70 rokov má zvýšený IOT).
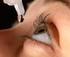 Glaukóm je skupina ochorení, ktorá môže spôsobiť stratu zraku bez varovných príznakov. Vyše 3 MILIÓNOV Američanov má glaukóm. Len polovica z nich to VIE. DIIAGNÓZA JE PRVÝM KROKOM ZÁCHRANY VÁŠHO ZRAKU
Glaukóm je skupina ochorení, ktorá môže spôsobiť stratu zraku bez varovných príznakov. Vyše 3 MILIÓNOV Američanov má glaukóm. Len polovica z nich to VIE. DIIAGNÓZA JE PRVÝM KROKOM ZÁCHRANY VÁŠHO ZRAKU
Urinfekt test infekcie močových ciest
 Urinfekt test infekcie močových ciest Urinfekt test infekcie močových ciest (IMC) patria spolu s respiračnými infekciami k najčastejším zápalovým ochoreniam, ktoré sa vyskytujú v priebehu celého života
Urinfekt test infekcie močových ciest Urinfekt test infekcie močových ciest (IMC) patria spolu s respiračnými infekciami k najčastejším zápalovým ochoreniam, ktoré sa vyskytujú v priebehu celého života
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA INFUSIO GLUCOSI 5 IMUNA. Infúzny intravenózny roztok.
 Príloha č. 2a k notifikácii zmeny, ev. č. 2106/6944 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA INFUSIO GLUCOSI 5 IMUNA Infúzny intravenózny roztok. Držiteľ rozhodnutia o registrácii Imuna Pharm, a.s. Jarková 17
Príloha č. 2a k notifikácii zmeny, ev. č. 2106/6944 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA INFUSIO GLUCOSI 5 IMUNA Infúzny intravenózny roztok. Držiteľ rozhodnutia o registrácii Imuna Pharm, a.s. Jarková 17
Projekt MEDPED FH na Slovensku Prieskum liečby a kontroly pacientov s Familiárnou hypercholesterolémiou
 Projekt MEDPED FH na Slovensku Prieskum liečby a kontroly pacientov s Familiárnou hypercholesterolémiou Vohnout B, Bálinth K, Bugáňová I, Fábryová L, Kadurová M, Klabník A, Kozárová M, Sirotiaková J, Rašlová
Projekt MEDPED FH na Slovensku Prieskum liečby a kontroly pacientov s Familiárnou hypercholesterolémiou Vohnout B, Bálinth K, Bugáňová I, Fábryová L, Kadurová M, Klabník A, Kozárová M, Sirotiaková J, Rašlová
Příbalová informace: informace pro uživatele. Bravelle 75 IU, prášek a rozpouštědlo pro injekční roztok (urofollitropinum)
 Sp.zn.sukls158971/2016 Příbalová informace: informace pro uživatele Bravelle 75 IU, prášek a rozpouštědlo pro injekční roztok (urofollitropinum) Přečtěte si pozorně celou příbalovou informaci dříve, než
Sp.zn.sukls158971/2016 Příbalová informace: informace pro uživatele Bravelle 75 IU, prášek a rozpouštědlo pro injekční roztok (urofollitropinum) Přečtěte si pozorně celou příbalovou informaci dříve, než
Jedna předplněná injekční stříkačka obsahuje 100 mikrogramů corifollitropinum alfa* v 0,5 ml injekčního roztoku.
 1. NÁZEV PŘÍPRAVKU Elonva 100 mikrogramů injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka obsahuje 100 mikrogramů corifollitropinum alfa* v 0,5 ml injekčního
1. NÁZEV PŘÍPRAVKU Elonva 100 mikrogramů injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka obsahuje 100 mikrogramů corifollitropinum alfa* v 0,5 ml injekčního
Podpora kognitívnych funkcií v rámci asistovaného samoliečenia
 Podpora kognitívnych funkcií v rámci asistovaného samoliečenia Peter Stanko ADC Solutions, spol. s r. o. Prezentácia bola pripravená v spolupráci so spoločnosťou EGIS SLOVAKIA Dispenzačná starostlivosť
Podpora kognitívnych funkcií v rámci asistovaného samoliečenia Peter Stanko ADC Solutions, spol. s r. o. Prezentácia bola pripravená v spolupráci so spoločnosťou EGIS SLOVAKIA Dispenzačná starostlivosť
Téma : Špecifiká marketingu finančných služieb
 Téma : Špecifiká marketingu finančných služieb Marketing predstavuje komplex činností, ktorý zahrňuje všetky činnosti od nápadu až po uvedenie produktu na trh. Cieľom marketingu je potom predať: správny
Téma : Špecifiká marketingu finančných služieb Marketing predstavuje komplex činností, ktorý zahrňuje všetky činnosti od nápadu až po uvedenie produktu na trh. Cieľom marketingu je potom predať: správny
PRÍLOHA I SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 PRÍLOHA I SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1 1. NÁZOV VETERINÁRNEHO LIEKU Eurican Herpes 205 lyofilizát a riedidlo na prípravu emulzie na injekčné použitie. 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
PRÍLOHA I SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1 1. NÁZOV VETERINÁRNEHO LIEKU Eurican Herpes 205 lyofilizát a riedidlo na prípravu emulzie na injekčné použitie. 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV. Zomacton 4 mg Somatropinum Prášok a rozpúšťadlo na injekčný roztok
 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Zomacton 4 mg Somatropinum Prášok a rozpúšťadlo na injekčný roztok Pozorne si prečítajte celú písomnú informáciu skôr, ako začnete používať Váš liek. - Túto písomnú
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Zomacton 4 mg Somatropinum Prášok a rozpúšťadlo na injekčný roztok Pozorne si prečítajte celú písomnú informáciu skôr, ako začnete používať Váš liek. - Túto písomnú
Příbalová informace: informace pro uživatele MENOPUR 1200 IU. Prášek a rozpouštědlo pro injekční roztok (Menotropinum)
 sp. zn. sukls56780/2014 Příbalová informace: informace pro uživatele MENOPUR 1200 IU Prášek a rozpouštědlo pro injekční roztok (Menotropinum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp. zn. sukls56780/2014 Příbalová informace: informace pro uživatele MENOPUR 1200 IU Prášek a rozpouštědlo pro injekční roztok (Menotropinum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PRÍLOHA I SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 PRÍLOHA I SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV VETERINÁRNEHO LIEKU Nobivac Myxo- RHD lyofilizát a rozpúšťadlo na injekčnú suspenziu pre králikov. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Jedna
PRÍLOHA I SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV VETERINÁRNEHO LIEKU Nobivac Myxo- RHD lyofilizát a rozpúšťadlo na injekčnú suspenziu pre králikov. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Jedna
VETERINÁRNA AMBULANCIA
 VETERINÁRNA AMBULANCIA ŽDIARSKA 21, KOŠICE, 04012 www.veterinar-jazero.sk Vakcinácia spoločenských zvierat MVDr. René Mandelík, PhD. MVDr. Michal Moško Vakcinácia spoločenských zvierat (psy, mačky, králiky,
VETERINÁRNA AMBULANCIA ŽDIARSKA 21, KOŠICE, 04012 www.veterinar-jazero.sk Vakcinácia spoločenských zvierat MVDr. René Mandelík, PhD. MVDr. Michal Moško Vakcinácia spoločenských zvierat (psy, mačky, králiky,
Činnosť kardiologických ambulancií v SR 2016
 Štatistické prehľady Činnosť kardiologických ambulancií v SR 2016 Prehľad prináša výsledky štatistického zisťovania na základe ročného výkazu o činnosti kardiologickej A (MZ SR) 17-01 za rok 2016 realizovaného
Štatistické prehľady Činnosť kardiologických ambulancií v SR 2016 Prehľad prináša výsledky štatistického zisťovania na základe ročného výkazu o činnosti kardiologickej A (MZ SR) 17-01 za rok 2016 realizovaného
Činnosť dermatovenerologických ambulancií v SR 2015
 Štatistické prehľady Činnosť dermatovenerologických ambulancií v SR 2015 Prehľad informuje o výsledkoch štatistického zisťovania na základe ročného výkazu o činnosti dermatovenerologickej ambulancie A
Štatistické prehľady Činnosť dermatovenerologických ambulancií v SR 2015 Prehľad informuje o výsledkoch štatistického zisťovania na základe ročného výkazu o činnosti dermatovenerologickej ambulancie A
OŠETROVATEĽSKÝ PROCES PhDr. Andrea Krkošková
 OŠETROVATEĽSKÝ PROCES PhDr. Andrea Krkošková Ošetrovateľský proces Zákon NR SR č. 311/2002 Zb.definuje ošetrovateľský proces ako systematickú, racionálnu, individualizovanú metódu - plánovania, poskytovania
OŠETROVATEĽSKÝ PROCES PhDr. Andrea Krkošková Ošetrovateľský proces Zákon NR SR č. 311/2002 Zb.definuje ošetrovateľský proces ako systematickú, racionálnu, individualizovanú metódu - plánovania, poskytovania
Telesný vývoj detí a mládeže v SR Výsledky VII. celoštátneho prieskumu v roku 2011
 Telesný vývoj detí a mládeže v SR Výsledky VII. celoštátneho prieskumu v roku 2011 Základným znakom každého živého organizmu je jeho telesný rast a vývin. Telesný rast je definovaný ako rast organizmu
Telesný vývoj detí a mládeže v SR Výsledky VII. celoštátneho prieskumu v roku 2011 Základným znakom každého živého organizmu je jeho telesný rast a vývin. Telesný rast je definovaný ako rast organizmu
Akútny uzáver dýchacích ciest. ETC apríl 2008, vodiči
 Akútny uzáver dýchacích ciest ETC apríl 2008, vodiči Bitka pri Kadeši, 1270 pred Kristom. Abu Simbel, Egypt (Wien Klin Wochenschr 1997) Zakloniť hlavu Vyčistiť ústa Nadvihnúť bradu Dýchacie cesty Horné
Akútny uzáver dýchacích ciest ETC apríl 2008, vodiči Bitka pri Kadeši, 1270 pred Kristom. Abu Simbel, Egypt (Wien Klin Wochenschr 1997) Zakloniť hlavu Vyčistiť ústa Nadvihnúť bradu Dýchacie cesty Horné
Vysoké školy na Slovensku Prieskum verejnej mienky
 Vysoké školy na Slovensku 201 Prieskum verejnej mienky PRIESKUM VÁCLAV FORST Marketing Research Consultant Metodológia Zber dát bol realizovaný formou internetového dotazníka (CAWI) prostredníctvom internetového
Vysoké školy na Slovensku 201 Prieskum verejnej mienky PRIESKUM VÁCLAV FORST Marketing Research Consultant Metodológia Zber dát bol realizovaný formou internetového dotazníka (CAWI) prostredníctvom internetového
GYN. REPRODUKCE. - kryptorchizmus a anorchie u chlapců - některé případy předčasné puberty - testikulární disgeneze - předčasná menopauza
 GYN. REPRODUKCE NÁZEV : AMH = Anti-Müllerian hormon POUŽITÍ : Anti-Müllerian hormon (AMH) je dimerní glykoprotein, složený ze dvou monomerů o molekulové hmotnosti 72 kda. AMH patří do rodiny transformujícího
GYN. REPRODUKCE NÁZEV : AMH = Anti-Müllerian hormon POUŽITÍ : Anti-Müllerian hormon (AMH) je dimerní glykoprotein, složený ze dvou monomerů o molekulové hmotnosti 72 kda. AMH patří do rodiny transformujícího
Choďte menej v noci, užívajte si viac cez deň
 Novinka pre pacientov s LUTS/BPH Choďte menej v noci, užívajte si viac cez deň Novinka v liečbe LUTS/BPH Negatívne vplyvy noktúrie Lekári považujú noktúriu za jeden z najviac obťažujúcich symptómov LUTS/BPH.
Novinka pre pacientov s LUTS/BPH Choďte menej v noci, užívajte si viac cez deň Novinka v liečbe LUTS/BPH Negatívne vplyvy noktúrie Lekári považujú noktúriu za jeden z najviac obťažujúcich symptómov LUTS/BPH.
M R2454 SK
 M32 1993R2454 SK 01.01.2013 017.001 959 M32 1993R2454 SK 01.01.2013 017.001 960 M32 1993R2454 SK 01.01.2013 017.001 961 1993R2454 SK 01.01.2013 017.001 965 M32 VYSVETLIVKY K TLAČIVÁM ŽIADOSTÍ O ZJEDNODUŠENÉ
M32 1993R2454 SK 01.01.2013 017.001 959 M32 1993R2454 SK 01.01.2013 017.001 960 M32 1993R2454 SK 01.01.2013 017.001 961 1993R2454 SK 01.01.2013 017.001 965 M32 VYSVETLIVKY K TLAČIVÁM ŽIADOSTÍ O ZJEDNODUŠENÉ
Plán riadenia rizík (RMP)
 Plán riadenia rizík (RMP) PharmDr. M. Verčinská, PhD. RNDr. T. Magálová Tematický kurz SARAP Bratislava, 7.04.2017 Obsah Legislatíva Základné pojmy Cieľ a štruktúra RMP Bezpečnostná špecifikácia Opatrenia
Plán riadenia rizík (RMP) PharmDr. M. Verčinská, PhD. RNDr. T. Magálová Tematický kurz SARAP Bratislava, 7.04.2017 Obsah Legislatíva Základné pojmy Cieľ a štruktúra RMP Bezpečnostná špecifikácia Opatrenia
GYN. REPRODUKCE. - kryptorchizmus a anorchie u chlapců - některé případy předčasné puberty - testikulární disgeneze - předčasná menopauza
 GYN. REPRODUKCE NÁZEV : AMH = Anti-Müllerian hormon POUŽITÍ : Anti-Müllerian hormon (AMH) je dimerní glykoprotein, složený ze dvou monomerů o molekulové hmotnosti 72 kda. AMH patří do rodiny transformujícího
GYN. REPRODUKCE NÁZEV : AMH = Anti-Müllerian hormon POUŽITÍ : Anti-Müllerian hormon (AMH) je dimerní glykoprotein, složený ze dvou monomerů o molekulové hmotnosti 72 kda. AMH patří do rodiny transformujícího
Karcinóm prostaty. MUDr. Martina Jandzíková Praktický lekár pre dospelých Žilina, Košická 2,
 Karcinóm prostaty MUDr. Martina Jandzíková Praktický lekár pre dospelých Žilina, Košická 2, 010 01 Prevalencia V štátoch EU je ročne diagnostikovaných 85 000 nových prípadov karcinómu prostaty (KP) U mužov
Karcinóm prostaty MUDr. Martina Jandzíková Praktický lekár pre dospelých Žilina, Košická 2, 010 01 Prevalencia V štátoch EU je ročne diagnostikovaných 85 000 nových prípadov karcinómu prostaty (KP) U mužov
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls18672/2008, sukls18673/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls18672/2008, sukls18673/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DECAPEPTYL 0,1 mg DECAPEPTYL 0,5 mg (triptorelin acetát) Injekční
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls18672/2008, sukls18673/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DECAPEPTYL 0,1 mg DECAPEPTYL 0,5 mg (triptorelin acetát) Injekční
