ZÁKLADY CHEMICKÝCH TECHNOLOGIÍ organická část
|
|
|
- Peter Pokorný
- před 8 lety
- Počet zobrazení:
Transkript
1 ZÁKLADY CHEMICKÝCH TECHNOLOGIÍ organická část Literatura: Surovinová základna výroby organických látek (skripta) Základní pochody průmyslové organické syntézy (skripta) ULLMANN (encyklopedie průmyslové chemie) ESO (teze přednášek) Obsah: - Úvod (systémovost chemické technologie) - Surovinové zdroje organických výrob - obnovitelné - neobnovitelné - Petrochemikálie - Principy a design nejfrekventovanějších dělicích operací - Elektrofilní substituce aromatů, technické aspekty sulfonace sulfatace, chemická rovnováha - Hydrogenační a dehydrogenační katalytické procesy, charakteristika katalyzátorů, posouvání rovnovážného složení reakční směsi
2 CHEMICKÁ TECHNOLOGIE Volba způsobu výroby chemických látek nebo inovace stávajících výrob vyžaduje znalosti z řady disciplin: anorganické a organické chemie, fyzikální chemie, chemického a materiálového inženýrství, energetiky, ekonomie, politologie,... Organická výroba je značně variabilní, z jedné hlavní suroviny ropy se vyrábí tisíce konečných produktů. Každý lze vyrobit několika způsoby. Optimální výrobní varianta zohledňuje i vnější vlivy. ŽIVOTNÍ PROSTŘEDÍ VÝROBEK meziprodukt technologie meziprodukt ENERGIE SUROVINY VÝROBA Zvládání složitých úloh vyžaduje SYSTÉMOVÝ PŘÍSTUP Systémový přístup - způsob myšlení, řešení problémů nebo jednání v němž jsou jevy chápány komplexně v jejich vnitřních i vnějších souvislostech - nemá speciální metody nebo aparát, přebírá a kombinuje metody různých vědních disciplin, nemá svůj vlastní předmět zkoumání Nesystémový přístup - jevy jsou posuzovány nahodile, živelně, subjektivně, podle libosti, - mechanistický přístup (vlastnosti celku odvozovány z vlastností částí, bez uvažování možných interakcí jeho částí)
3 Definice systému Za systém je považován objekt, v němž rozlišujeme části s určitými vlastnostmi a vztahy mezi nimi. Vůči okolí vystupuje systém jako celek. Části systému interagují navzájem i se systémem jako celkem. Části se označují jako prvky systému a vztahy mezi nimi se nazývají vazbami systému. Systémem v chemické technologii může být míněn PROCES. Prvky takového systému jsou jednotlivé aparáty reaktory, výměníky tepla, zásobníky, také rozvětvení potrubí. Vazbami systému jsou např. potrubní propojení, toky energií K znázornění systému je vhodné blokové schéma. Od technologa se očekává schopnost navrhovat a obhájit varianty. Detaily konkrétní technologie se nastudují z literatury první volba je ULLMANN (encyklopedie) a SciFinder (databáze). Vědomě nebo mimoděk se aplikuje systémové inženýrství. To trénuje univerzální metody zkoumání systému, hledání souvislostí a podobností, tedy toho, co je společné pro všechny obory (opak specializace). V předmětu ZCHT-organická část se budou diskutovat nejdůležitější vazby a prvky chemických výrob. Předmět nemá ambici být všeobecným základem organických chemických technologií.
4 ZÁKLADNÍ SYSTÉMOVÉ POJMY Zavádění systému = identifikace systému - na reálný systém (objekt) se zavede systém abstraktní, definování prvků systému, vnitřních a vnějších vazeb, objekt je určitým způsobem účelově zjednodušen, jsou vynechány ty prvky a vazby, které jsou z hlediska řešení problému nepodstatné, vytváří se blokové schéma (orientované grafy) Subsystém - vznikne tak, že ze systému jsou vypuštěny určité prvky a současně i vazby, které na tyto prvky navazují Dílčí systém - osahuje pouze prvky a vazby určité kvality Uzavřený a otevřený systém Okolí systému, vstup a výstup Hierarchická úroveň - její zavedení na systém umožňuje víceúrovňovou vertikální dekompozici na podsystémy nebo subsystémy (nižší rozlišovací úroveň odpovídá vyšší hierarchické úrovni) Model systému - pro stejné podněty vykazuje model i originální systém (objekt) stejnou reakci (odezvu) Simulace systému - experimentování na modelu systému Optimalizace systému cyklická optimalizace každého subsystému
5 PŘÍKLAD ČASTÉ OPTIMALIZAČNÍ ÚLOHY Při pořizování nového aparátu je potřebné vybrat nejvýhodnější variantu z hlediska celkových nákladů. Celkové náklady jsou zjednodušeně součtem provozních (nároky na energii, materiál, lidskou práci,.) a investičních (pořizovacích) nákladů. Jejich srovnatelnosti se dosáhne vztažením obou na stejný základ. Vyšší počáteční investice zpravidla sníží provozní náklady. Příklady - kvalitnější izolace vs. nižší ztráty tepla - větší výměník tepla vs. účinnější rekuperace tepla - vyšší pořizovací cena automobilu vs. nižší spotřeba paliva
6 SUROVINOVÁ ZÁKLADNA ORGANICKÝCH VÝROB - neobnovitelné zdroje (uhlí, ropa, zemní plyn) - obnovitelné, vznikají v současnosti, dominantně fotosyntézou (dřevo, rostlinný olej, sacharidy) 6CO 2 + 6H 2 O C 6 H 12 O 6 + 6O 2 H reakční = 2700 kj/mol JE SHODNÁ SE SUROVINAMI PRO ENERGETIKU => cena surovin silně reaguje na geopolitické události => relativní změny cen základních surovin mění ekonomiku jednotlivých výrobních postupů, vyvolávají potřebu měnit způsob výroby => v energetice se stále více uplatňují chemické procesy MASOVÉ ZROJE ENERGIE - jaderné reakce - oxidační chemické reakce C + O 2 CO 2 H reakční = kj/mol H 2 + 1/2 O 2 H 2 O H reakční = kj/mol CH 4 + 2O 2 CO 2 + 2H 2 O H reakční = kj/mol
7 Tabulka: Elementární složení bezvodých uhlíkatých surovin [ hm. % ] uhlík vodík kyslík síra Dřevo Olej Polysacharidy Hnědé uhlí* Černé uhlí* Ropa ,5 Zemní plyn *) odpopelněné uhlí
8 OBNOVITELNÉ UHLÍKATÉ SUROVINY POUŽITÍ - tradiční Potravinářské - díky chemii je dosahována vyšší zemědělské produkce i lepší využití této produkce Chemické dřevo delignifikace > buničina > papír hluboká delignifikace > celulóza > deriváty celulózy Konstrukční materiál POUŽITÍ - netradiční - v Evropě je akcentován mimoprodukční význam zemědělství => nesystémový přístup k zemědělství mnohoúrovňová regulace - orientace na maximální výkon vs. trvalá nadprodukce - zemědělská nadvýroba se uplatňuje mimo potravinářství, zejména v energetice - řepkový olej (triacylglycerol) + CH 3 OH glycerol + + methylester řepkových kyselin (palivo vznětových motorů) - polysacharidy (obilí) hydrolýza + kvašení > C 2 H 5 OH (dopování benzínu) - rychle rostoucí dřeviny (topol) nebo jednoleté rostliny (šťovík, sláma) slouží jako palivo v teplárnách a elektrárnách - obnovitelné energetické zdroje alternují s fosilními - největší rozvoj energetiky se čeká v bioenergetice
9 SLOŽENÍ DŘEVA (molekulární úroveň) polysacharidy = lineární polymery, řetězce spojené vodíkovými můstky = stěna buňky - celulóza (40 %), homoplysacharid celobiosy - hemicelulóza (25 %), heteropolysacharid - pentosany (listnáče) - hexosany (jehličnany) - uronové kyseliny - celulóza (PS 200) polyaromáty = trojrozměrný polymer, pojidlo buněk - lignin (30 %) - guajacylpropanové jednotky (jehličnany) - syringylpropanové jednotky (listnáče) doprovodné látky (5 %) = fyziologické funkce, nevýznamné obsahem - tuky (zásobní látky) - vosky (omezují odpar vody) - monoterpeny ( rozpouštědla ) - pryskyřičné kyseliny (ochrana) - třísloviny (chemická ochrana) -peptidy,.
10 SLOŽENÍ DŘEVA (nadmolekulární úroveň) velikost molekul - celobiosa (základní jednotka) = 1 nm - celulosa (polymer) = nm svazek cca 50 molekul celulosy = mikrofibrila - krystalické oblasti 3 x 12 nm (70% celulosy) - amorfní oblasti (30 % celulosy) dvojité, protisměrné šroubovice z fibril = buněčná stěna, její tloušťka - v rostlinné buňce cca 50 nm - v buňce dřeva cca nm (letní zimní) buňky jehličnanů jsou vláknité 30 x µm buňky listnáčů jsou z 50% vláknité 50 x µm a tkáňové (nevláknité) systém dřevo voda - volná voda - vázaná voda -fyzikálně - chemicky (ovlivňuje objem) Cílem chemického zpracování dřeva je získání jednotlivých buněk (buničiny). Toho se dosahuje rozpuštěním ligninu. Specifické (užitné) vlastnosti buničiny vyplývají z možnosti vytvářet vodíkové můstky. Použití - papír (vlákna + plnidla, klížidla, zjasňující prostředky) - vlákna (regenerovaná celulosa) viskozová, kordy - deriváty celulosy (nitro-, karboxymethyl-)
11 Termolýza dřeva Tabulka: Porovnání dvou termických procesů zpracovávajících dřevo KARBONIZACE RYCHLÁ PYROLÝZA Chemické děje Termodynamické řízení Kinetické řízení (složení (pararelní, následné, složení reakční směsi závisí reakční směsi závisí vratné reakce) na chemické rovnováze) na rychlosti reakcí) Reakční doba Dny, týdny Sekundy Teplota reakce Nízká ( o C) Vysoká ( o C) Produkty Dřevěné uhlí Uhlovodíky podobné ropě
12 NEOBNOVITELNÉ UHLÍKATÉ SUROVINY UHLÍ - V SOUČASNOSTI MALÝ VÝZNAM PRO CHEM. PRŮMYSL - ZÁSOBY ŘÁDOVĚ VYŠŠÍ NEŽ ROPY, V TOM JE POTENCIÁL KARBONIZACE = koksování V ČR cca 50 % vytěženého černého uhlí je karbonizováno Proces T cca 1000 o C, čas 20 hodin Produkty % koks - 15 % plyny (50% H 2, 25% CH 4, 15% CO,..) - 5 % reakční voda - 5% dehet - bazické látky (pyridin, chinolin, toluidin) - kyselé látky (fenol, kresol, xylenol,..) - neutrální látky (toluen, naftalen, anthracen) ZPLYN OVÁNÍ UHLÍ (rovnovážné/vratné reakce) - Produkce syntézního plynu (CO + H 2 ), T cca 1200 o C C + H 2 O CO + H 2 H = 131 kj/mol - Oxidační reakce C + O 2 CO 2 H = kj/mol C + ½ O CO H = kj/mol C + CO 2 2 CO H = domácí úkol Paroplynovým cyklem se zvýší η z 32% na 48%, plyn se snadno odsíří - Produkce topného plynu (CH 4 ), T cca 800 o C CO + 3 H 2 H 2 O + CH 4 H = kj/mol
13 ZEMNÍ PLYN - zásoby vystačí 2-3 x déle než ropa - dominantní složkou je metan, může obsahovat až % etanu a propanu, západosibiřský (v plynovodech ČR) z 99 % metan - ložiska až 10 MPa, vypere se H 2 S, suší se pomocí ethylenglykolu PARCIÁLNÍ OXIDACE T o C, při této teplotě nelze Q dodávat stěnou T je nutná k dosažení příznivé rovnováhy, energie se dodává reakcí s kyslíkem Vzniká: vodík, oxid uhelnatý, etin, eten, SPALOVÁNÍ (poloviční emise CO 2 oproti spalování uhlí) CH O 2 CO H 2 O H = kj/mol VÝROBA SYNTÉZNÍHO PLYNU H 2 O + CH 4 CO + 3 H 2 H = kj/mol - možné budoucí využití vysokoteplotních jaderných reaktorů - rychlost reakce je i při T 900 o C nízká, proto je užit katalyzátor - molární poměr CO : H 2 závisí na použití synt. plynu, upravuje se reakcí CO + H 2 O CO 2 + H 2 H = - 41 kj/mol
14 C1 CHEMIE transformace uhlí (zemního plynu) na organické látky hlavní rekce vycházejí ze syntézního plynu (xco + yh 2 ) METANOL (nejdůležitější komodita C1 chemie) CO 2 + 3H 2 CH 3 OH + H 2 O H = - 50 kj/mol CO + 2H 2 CH 3 OH H = - 91 kj/mol CO 2 + H 2 CO + H 2 O H = + 41 kj/mol CO + 3H 2 CH 4 + H 2 O H = -203 kj/mol Čtvrtá reakce je termodynamicky preferovaná. Díky katalyzátoru (Cu-ZnO-Cr 2 O 3 ), který zvyšuje rychlost prvních dvou reakcí, probíhá syntéza metanolu již při T 250 o C, p=5-10 MPa je řízena kineticky Tabulka: Rovnovážná konverze CO a CO 2 na metanol v závislosti na tlaku a teplotě. Složení vstupní směsi: 15% CO, 8% CO 2, 74% H 2, 3% CH 4. Teplota Konverze CO (%) Konverze CO 2 (%) Kocentrace CH 3 OH (%) ( o C) 5 MPa 10 MPa 30 MPa 5 MPa 10 MPa 30 MPa 5 MPa 10 MPa 30 MPa ,6 99,0 99,9 44,1 82,5 99,0 27,8 37,6 42, ,1 90,9 98,9 18,0 46,2 91,0 16,2 26,5 39, ,7 60,6 92,8 14,3 24,6 71,1 5,6 14,2 32, ,3 16,9 73,0 19,8 23,6 52,1 1,3 4,8 21, ,8-7,2 38,1 27,8 30,1 44,2 0,3 1,4 11,4 Záporná hodnota konverze CO představuje nárůst na úkor CO 2 Energie uchovaná v metanolu - 70% energie zemního plynu - 50% energie uhlí
15 Vliv tlaku na rovnováhu vratné reakce při níž jsou reaktanty v plynném skupenství a A + b B c C + d D A, B výchozí látky C, D produkty a, b, c, d koeficienty stechiometrické rovnice Rovnovážná konstanta vyjádřená pomocí parciálních tlaků za předpokladu, že složky se chovají jako ideální plyn. : p c C * p d D K p = p a A * p b B p A = p celk. * x A p celk. celkový tlak v rovnováze p A - parciální tlak látky A v rovn. x A - molový zlomek látky A v rovn. Rovnovážná konstanta definovaná pomocí rovnovážných molových zlomků: x c C * x d D K x = = K p p celk. n x a A * x b B n - rozdíl stechiometrických koeficientů na levé a na pravé straně stechiometrické rovnice n = (a + b) - (c + d)
16 POUŽITÍ METANOLU - přímé (do benzínu, palivové články) - konverze na benzinové uhlovodíky (účinnost 70%) CH 3 OH CH 3 O - CH 3 + H 2 O kat. zeolit CH 3 O - CH 3 H 2 O + 2 CH 2 - výroba HCHO CH 3 OH + ½ O 2 HCHO + H 2 O kat. stříbro - výroba kyseliny octové CH 3 OH + CO CH 3 COOH kat. rhodium UHLOVODÍKY (Fischer-Tropschova syntéza) n CO + 2n H 2 n H 2 O + ( CH 2 ) n H = kj/mol je-li nízký poměr H 2 /CO na Fe kat. vznikají olefiny, etanol, aceton je-li vysoký poměr H 2 /CO na Fe kat. vznikají bezkyslíkaté látky POUŽITÍ: motorová paliva na Ru kat. vysokomolekulární lineární alkany HYDROFORMILACE (synonima - oxosyntéza, oxonace) CH 3 CH = CH 2 + CO + H 2 CH 3 CH 2 CH 2 CHO H = kj/mol homogení kat. Co 2 (CO) 8 + H 2 HCo(CO) 4 silná kyselina nejsnadněji reagují α-olefiny vedlejší reakce vznik 2-methylpropanalu POUŽITÍ: - hydrogenace na 1-hydroxy alkoholy - aldolizace
17 FOSGEN (základní chemikálie, pro svou reaktivitu využívána v mnoha syntézách) CO + Cl 2 COCl 2 kat. aktivní uhlí POUŽITÍ: výroba monomérů COCl 2 + NH 2 R - NH 2 R(NH-COCl) 2 OCN R NCO diisokyanát -NCO + HO R - OH - NH COO R - základní vazba v polyuretanech 2 ROH + COCl 2 RO CO OR ester kys. uhličité = karbonát MOČOVINA CO 2(g) + 2NH 3(g) NH 2 COONH 4(l) H = kj/mol karbaminan amonný NH 2 COONH 4 NH 2 CO NH 2 + H 2 O
18 ROPA - nejvhodnější uhlíkatá surovina pro organickou syntézu - cca z 20% využita v chemii, z 80% v energetice (motorová paliva) - zásoby na cca 50 let, postupně se zvyšuje podíl méně kvalitních nalezišť (víc C na úkor H, více S, kovů V) - dopravní náklady: lodní<ropovod<železnice - složení - uhlovodíky alkany, cykloalkany (ne alkeny), aromaty -látky s heteroatomy (jejich obsah roste s T varu ) kyslíkaté cykloalkanové kyseliny (naftenové) sirné, dusíkaté heterocyklické látky
19 PRIMÁRNÍ ZPRACOVÁNÍ ROPY 1) Odsolení (gravitačně, elektrostaticky), vyprání vodou, Stabilizace (odstranění C 3 a C 4 podílů) 2) Atmosferická destilace ropy (kontinuální rektifikace) Destilace a rektifikace jsou metody dělení kapalných směsí založené na odlišném složení parní fáze nad kapalnou směsí. -světlé podíly -benzín do 160 o C C 5 C 10 (17%) -petrolej do 260 o C C 9 C 15 (17%) -plynový olej 360 o C C 14 - C 20 (17%) -destilační zbytek = mazut C 20 - C 200 (50%) 3) Vakuová destilace mazutu -destilát + bočné odtahy = mazací oleje, parafin, -destilační zbytek = asfalt (po částečném naoxidování vzniká kvalitní silniční asfalt)
20 MOTOROVÁ PALIVA (hlavní konzument ropy) Autobenzíny - směs se vzduchem v motoru zažehne svíčka - kvalitu udává oktanové číslo (odolnost vůči klepání motoru, to je důsledkem detonačního hoření) - OČ závisí na skladbě paliva a antidetonátorech žádoucí skladba isoalkany -aromáty (benzen je limitován) antidetonátory -kyslíkaté látky, OČ methanol = 120 OČ ethanol = 121, OČ MTBE = 115 roste-li energetická účinnost motoru (komresní poměr) musí růst i OČ benzínu - vztah k životnímu prostředí v EU jsou stanoveny maximální emise CO 2 (120 g/km) katalyzátor odstraní 95% CO, CH, 80% NO x vyžaduje stechiometrické spalování
21 Motorová nafta - při vysokém kompresním poměru dochází k vznícení paliva, - vhodné uhlovodíky C14 C20 - z korozních a ekologických důvodů je limitován obsah S Letecké palivo - žádoucí vyšší hustota, - nesmí tuhnout do 60 o C, - čadivost paliva snižuje vyšší poměr H/C (aromáty nevyhovují), vhodný petrolej
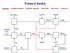
22 RAFINERSKÉ ZPRACOVÁNÍ ROPY Důvod: - jiná struktura spotřeby než vznikne primárním zprac. - potřeba zvyšování kvality paliv (OČ, odstranění S) ODSÍŘENÍ - katalytickou hydrgenolýzou vzniká H 2 S, také NH 3 a H 2 O kat. Co, Mo/nosič T = o C, p = 2-5 MPa - H 2 S se odstraní z H 2 a plynů po expanzi rafinátu vypráním kapalnými bazemi (ethanolamin), z nich se izoluje desorpcí, H 2 S se zpracuje Clausovým procesem KRAKOVÁNÍ přeměna těžkých podílů ropy (mazutu) na látky s nižší molekulovou hmotností tři postupy -termické -katalytické (na kyselých katalyzátorech) -hydrokrakování (na hydrogenolytických nebo bifunkčních katalyzátorech) 1. Termické (tepelné štěpení C-C vazeb) R-CH 2 - CH 2 - CH 3 R- CH 3 + CH 2 = CH 2 také probíhá dehydrgenace H = 70 kj/kmol
23 R-CH 2 - CH 2 - CH 3 R-CH= CH- CH 3 + H 2 olefiny polymerují, polymery dehydrogenují a vzniká koks T = 550 o C, reakční doba ovlivňuje hloubku krakování -lehké krakování (visbreaking) z mazutu 10% benzínu, 20%plynového oleje -hluboké krakování (koksování) z mazutu 5% (g), 20% benzín, 40% plynový olej, 30% koks 2. Katalytické (iontový mechanismus) + náboj na katalyzátoru polarizuje nepolární C-C vazbu a tím usnadní štěpení R-CH 2 - CH-CH 2 - CH 2 R R-CH=CH 2 + CH 3 -CH-R H=70kJ/kmol R-CH 2 - CH 2 - CH 2 -R + CH 3 -CH-R R-CH- CH 2 - CH 2 -R + CH 3 -CH 2 -R T cca 450 o C, katalyzátor alumosilikát produkt: 10% (g), 80% benzín + plynový olej, 10% koks problem zauhlování katalyzátoru je řešen spalováním C 3. Hydrokrakování (hydrogenolýza) R-CH 2 - CH 2 - CH 2 -R + H 2 R-CH 3 + CH 3 -CH 2 -R probíhá současně hydrogenace aromatů H = -35 kj/kmol
24 katalyzátory - bifunkční Pt,Pd/zeolit (odsířená surovina), na kyselé složce štěpení na olefin a ten je na Pt,Pd hydrogenován, T<400 oc, p = 5-20 MPa - hydrogenolytické Ni, Co, Mo, W- kromě Ni necitlivé na S, probíhá i desulfurace, T>400 oc Výhody: vznikají pouze alkany, nevzniká koks (úsady), 100% kapalné produkty, proces s H = -,proto není nutné dodávat energii REFORMOVÁNÍ BENZÍNU katalytický proces zvyšující obsah aromatů na úkor alkanů a cykloalkanů -reakční schéma zachycuje pouze typické reakce -podmínky determinovány pomalou dehydrocyklizací (teplota) a rovnováhou aromatizace (tlak) -bifunkční katal. Pt, Re/Al2O3, T = 500 oc, p = 3-4MPa -obsah aromatů v produktu cca 60%
25 PETROCHEMIE Zpracováním ropy jsou získávány základní petrochemikálie : C=C, C=C-C, nenasycené C 4, benzen, xyleny Vznikají - krakováním (termické, katalytické) = olefiny - reformováním benzínů = aromaty - pyrolýzou = olefiny, aromaty PYROLÝZA -nekatalyzované termické štěpení vazeb C-C a C-H poskytující molekuly termodynamicky stabilní při teplotě o C -řetězový radikálový mechanismus 1. Iniciace C 8 H 18 C 3 H 7 + C 5 H Propagace alkylradikály podléhají β štěpení C-C a C-H C 3 H 7 CH 3 + CH 2 = CH 2 C 5 H 11 CH 2 = CH 2 + CH 3 CH 2 CH 2 CH 3 CH 2 CH 2 CH 2 = CH 2 + CH 3 CH 3 CH 2 CH 2 H + CH 3 -CH= CH 2 C 8 H 18 + CH 3 CH 4 + C 8 H 17
26 3. Terminace vznikají vyšší olefiny nebo alkany CH 3 CH 2 CH 2 + CH 3 C 4 H 10 C H 4 + CH 3 - CH = CH 2 - neradikálové reakce C H 2 = CH CH = CH 2 + C H 2 = CH 2 benzen + 2H 2 Štěpné (radikálové) reakce jsou endotermní. Z hlediska rovnovážné konstanty je žádoucí vysoká teplota a nízký tlak. Snížení parciálního tlaku uhlovodíků se řeší ředěním reakční směsi H 2 O (g). Ta také regeneruje úsady. C + H 2 O CO + H 2 Terminační a neradikálové reakce jsou exotermní. Jejich omezení se dosáhne rychlým ochlazením reakční směsi. Reakční T = o C, p < 100 kpa Reakční doba < 1 s, čím nižší (0,1 s) tím větší výtěžky olefinů Surovina: od C 2 H 6 až po destilační zbytek vakuové destilace obvyklá -lehký benzín (není využitelný na reformování) -oleje z hyrokrakování (neobsahují aromáty) Složení produktů závisí jak na podmínkách tak na surovině, z primárního benzínu vzniká 30% etylenu, 15% propylenu, 5% butadienu, 5% benzenu, 15% aromatů Dělení produktů rektifikací od T = -140 o C až do T > 200 o C
27 VYUŽITÍ PETROCHEMIKÁLIÍ ETYLEN (100%) polymerace (50%) -vysokotlaká (nízkohustotní PE), p= MPa obsahuje i rozvětvené řetězce, proto PE není kompaktní - nízkotlaká (vysokohustotní PE), lineární polymer díky katalyzátoru (triethylaluminium +TiCl 4 ) oligomerace --- alfaolefiny C 4 C 24 nch 2 = CH 2 + (CH 3 CH 2 ) 3 Al trialkenylaluminium po snížení p 20-1 MPa a zvýšení T o C rozklad vinylchlorid (15%) - monomer (PVC), CH 2 = CH 2 + Cl 2 CH 2 Cl - CH 2 Cl CH 2 Cl - CH 2 Cl CH 2 = CHCl + HCl CH 2 = CH 2 + HCl + 0,5 O 2 CH 2 Cl - CH 2 Cl + H 2 O etylenoxid (20%)- hydratován na etylenglykol (nemrznoucí kapaliny, polyestery, neionogení tenzidy) CH 2 = CH 2 + 0,5 O 2 etylenoxid (oxiran) na Ag katalyzátoru, T = 260 o C, selektivita 75% etanol acetaldehyd styren (5%)
28 PROPYLEN (100%) C 3 řetězec dává více možností pro syntézu polymerace (35%) kyselina akrylová (20%) CH 2 = CH CH 3 CH 2 = CH CHO CH 2 = CH COOH estery k. akrylové = monomery akrylonitryl CH 2 = CH CH 3 + NH 3 + 1,5 O 2 CH 2 = CH CN + 3H 2 O monomer (PAN, ABS) propylenoxid (10%) CH 2 = CH CH 3 +HOCl CH 2 Cl-CHOH CH 3 propylenoxid epoxidové pryskyřice (tvrdidlo amin) pyrochlorace CH 2 = CH CH 3 + 7Cl 2 CCl 2 = CCl 2 + CCl 4 + 6HCl hydroformilace metatéza C 4 FRAKCE 1,3-butadien isobuten - monomer (kaučuky, ABS) --- antidetonátor MTBE, terc. butanol (CH 3 ) 2 C = CH 2 + CH 3 OH (CH 3 ) 2 CH CH 2 O CH 3 methyl-terc. butylether (MTBE)
29 AROMATICKÉ UHLOVODÍKY SLOŽENÍ HLAVNÍCH ZDROJŮ AROMÁTŮ benzen toluen xylen nearomáty benzín z reformingu 5% 18% 25% 40% pyrolyzní benzín 25% 20% 15% 25% benzol (z koksování) 75% 12% 8% 2% Izolace aromátů: -extrakcí (využívá se odlišné rozpustnosti aromátů a nearomátů v rozpouštědle = extrakčním činidle např. diethylenglykol) aromáty se z extr. činidla vydestilují, extr. činidlo se z organické fáze (např. benzinu) odstraní vodou (extrakcí) -destilací (pyrolyzního benzínu, benzolu) se zakoncentruje frakce benzen+toluen+xyleny a rektifikací rozdělí nebo se tato frakce podrobí hydrogenolýze alkylů, vzniká tak nejžádanější aromát-benzen, na úkor xylenu a toluenu, kterého je přebytek, žádaný je rovněž p-xylen (surovina pro výrobu kyseliny tereftalové) i o-xylen (ftalanhydrid)
30 BENZEN spolu s propylenem to je druhá nejvýznamnější petrochemikálie Styren benzen + etylen ethylbenzen styren + H 2 monomer (PS, kaučuky, ABS) Fenol (kumenový) benzen + propylen kumen kumenhydroperoxid fenol + aceton -hydrogenuje se na cyklohexanon cyklohexanon+ NH 2 OH oxim kaprolaktam polyamid -epoxidové a fenolformaldehydové pryskyřice Alkylarylsulfonany účinná složka běžného pracího prášku nitrobenzen, anilin TOLUEN Nitrotolueny - trinitrotoluen - diaminotolueny (na isokyanáty) Benzaldehyd, kyselina benzoová
31 SULFONACE A SULFATACE chemicky odlišné ale procesně blízké děje - sulfonací se na uhlíkový skelet molekuly zavádí sulfoskupina -SO 2 -OH - sulfatací se označuje reakce, jejímž produktem jsou estery kyseliny sírové (sulfáty) O-SO2-OH - sulfonací i sulfatací se vnášejí do organické molekuly silně polární skupiny, ty jsou hydrofilní zatímco nepolární část molekuly je lipofilní. Takové molekuly (tenzory) jsou schopny snižovat mezifázové napětí což umožňuje rozpouštět nerozpustné látky. PŘEHLED REAKCÍ - SULFATACE Estery kyseliny sírové se připravují dvěma způsoby - adicí H 2 SO 4 na dvojnou vazbu olefinů - reakcí sulfonačního činidla s alkoholy - v hlavním směru použití sulfátů tenzidy jsou žádány poloestery. - sekundární estery vznikající z olefinů jsou málo stabilní, proto jsou žádány primární, surovinou pro jejich výrobu jsou 1- alkoholy. - při sulfataci tuků a olejů H 2 SO 4 probíhají paralelní reakce: - částečná hydrolýza tuků na di- a monoacylgliceroly - sulfatace hydroxyskupin glycerolu a hydroxykyselin - adice kyseliny na dvojnou vazbu
32 SULFONACE ALKÉNŮ Provádí se především oxidem sírovým, vychází se z 1-alkenů a meziproduktem jsou sultony viz obrázek. Technicky významnou reakcí je také adice NaHSO3 na dvojnou vazbu. SULFONACE AROMATŮ Zásadně se liší zavádění sulfoskupiny v aromatické řadě (iontový mechanismus) a v alifatické (radikálový). Alifatické sulfoderiváty nejsou připravovány příliš selektivně. Nejvýznamnějším substrátem sulfonace je alkylbenzen. K elektrofilní substituci na aromatickém jádře lze použít všechny typy činidel: - kyselinu sírovou - oleum tj. roztok oxidu sírového v kyselině - oxid sírový - komplex oxidu sírového a lewisovské báze - kyselinu chlorsulfonovou
33 MECHANISMUS A KINETIKA SULFONACE AROMÁTŮ Sulfonace aromatů patří do skupiny elektrofilních substitucí, stejně jako chlorace, nitrace, Friedelova Craftsova acylace a alkylace. - Reaguje vždy částice s vyvinutým kladným nábojem s π elektronovým systémem aromatu. Tato rychlá reakce má následování v přeměně π komplexu na σ. - Dříve než byla ověřena vyšší hustota elektronů v určitých polohách benzenového jádra, měli (al)chemici roztříděné substituenty na ty, které dirigují substituci druhého substituentu do poloh 2- a 4- (substituenty I třídy) a na ty, které dirigují do polohy 3- (II. třídy). Substituenty II. třídy současně deaktivují substrát. Odlišné direktivní efekty substituentů jsou důsledkem uplatnění induktivního a konjugačního efektu. Záporný konjugační efekt vykazují především substituenty s dvojnou vazbou. Ty tvoří skupinu substituentů II. třídy. - Poměr 2- a 4- izomerů, které vzniknou při elektrofilní substituci monosubstituovaného benzenu, ovlivňují stérické faktory. Uplatňuje se jak objemnost substituentu benzenu, tak atakujícího iontu (činidla) viz obrázek.
34 Důsledkem těchto efektů je značně rozdílná reakční rychlost sulfonace aromatických sloučenin. Snadno se připravují monosulfonové kyseliny.
35 - Při reakci aromátů s kyselinou sírovou je atakujícím činidlem iont SO 2 OH +, jeho koncentrace klesá ředěním kyseliny reakční vodou. - 2 H 2 SO 4 HSO 4 + H 3 SO + 4 HSO H 2 O + SO 2 OH + Zvýšení obsahu vody nad rovnovážnou koncentraci vede k hydrolýze sulfokyseliny. Sulfonace kyselinou sírovou je vratná reakce, proto může probíhat izomerizace. - Uplatnění kinetických i termodynamických vlivů lze demonstrovat na sulfonaci naftalénu kyslinou sírovou. Poloha 1- je podstatně reaktivnější než poloha 2- naftalenu. Sulfonace do 1. stupně je vysoce selektivní. Sulfonace do 2. stupně je o 4-6 řádů pomalejší než do 1. Tabulka: Vliv reakční teploty na obsah 1- a 2- izomerů při totální sulfonaci naftalenu zachycuje tabulka. Reakční teplota Obsah 1-naftalensulfonové Doba potřebná ( o C) kyseliny (%)* V reakční směsi V rovnováze k dosažení rovnováhy (hod) > *Zbytek do 100% je kyselina 2-naftalensulfonová.
36 HYDROGENACE A DEHYDROGENACE Bezodpadové procesy, obvykle katalytické, nahrazují redukční nebo oxidační činidla. Zdroj vodíku? Vodíková ekonomika? PŘEHLED REAKCÍ ALKEN hydrogenace ALKAN H = -120 kj/mol (1xH 2 ) dehydrogenace rostlinný olej ethylbenzen styren ztužený tuk AROMÁT HYDROAROMÁT H = -214 kj/mol (3xH 2 ) anilin cyklohexylamin methylcyklohexan toluen (reformování/aromatizace benzínu) KARBONYLOVÁ SKUPINA ALKOHOL H = - 70 kj/mol (1xH 2 ) aldehydy z oxosyntézy primární alkoholy cyklohexanol cyklohexanon HYDROGENAČNÍ AMINACE sloučenina s karbonylem + amin (NH 3 ) imin + voda imin + H 2 amin HYDROGENOLÝZA C C, C O, C S, C N, N O hydrodealkylace toluenu, hydrorafinace - jako nežádoucí reakce může probíhat při každé hydrogenaci
37 SELEKTIVITA Má smysl všude, kde může probíhat více než jedna reakce. Poskytuje kvantitativní informaci o účinnosti přeměny reaktantu na určitý produkt. Tento termín nemá jednotný obsah, je proto potřebné vždy znát definici. Př.: C r(c) A r(b) B Sledovaným produktem je látka B, selektivitu pak lze vyjádřit několika způsoby: Je-li rychlost reakce konstantní jako např. v průtočném reaktoru S I = r(b) / [r(b) + r(c)] = r(b) / - r(a) S II = n(b) / [n o (A) - n(a)] = x A B / x A S III = m(b) / [m o (A) - m(a)] Jestliže se nezreagovaná látka A neizoluje a přechází do odpadu, může být selektivita vyjádřena shodně s výtěžkem. S IV = n(b) / n o (A) S V = m(b) / m o (A)
38 Selektivitu ovlivňuje - teplota - teplotní závislost reakční rychlosti se významně liší v závislosti na typu reakce a katalyzátoru, to je důsledek odlišné aktivační energie: hydrogenace kj/mol hydrogenolýza kj/mol dehydrogenace kj/mol (difúze 15 kj/mol) - katalyzátor - různé skupiny se redukují jiným mechanismem (jiným katalyzátorem) - rozpouštědlo, to často vytváří s reaktantem nevazebné interakce (vodíkové můstky, π π interakce), solvatovaná molekula substrátu má změněnou reaktivitu Jsou-li redukované skupiny stejné pak selektivní hydrogenace je problematická, úspěšná je jen někdy Př. - výrazně pevnější vazba dienu na Pd katalyzátoru oproti alkenu umožňuje selektivní hydrogenaci dien monoen - reaktivitu dvojné vazby také určují stérické vlivy linalool dihydrolinalool
39 ROVNOVÁHA HYDROGENACE DEHYDROGENACE Hydrogenace není limitována rovnováhou, běžně se dosahuje 100 % přeměny. - Dehydrogenace je rovnováhou často limitována. Protože to je endotermická reakce, rovnovážná konstanta s teplotou roste a dehydrogenace je umožněna teprve při teplotách podstatně vyšších oproti hydrogenaci překonání termodynamického limitu.. - Při vyšší teplotě se také více uplatňují vedlejší reakce, může docházet i k nevratným destrukcím reaktantů. Nežádoucím reakcím a nízké selektivitě je předcházeno použitím katalyzátorů. - Rovnováhu dehydrogenace lze posunout ve prospěch produktu částečným spalováním vznikajícího vodíku (tzv. oxidační dehydrogenace). Celkové tepelné zabarvení procesu se změní z endo- na exotermické. Příkladem je výroba formaldehydu na Ag katalyzátoru: CH 3 OH CH 2 O + H 2 H = 84 kj/mol H 2 + ½ O 2 ( ) H 2 O H = kj/mol Vzduch se přivádí v podstechiometrickém množství, dávkuje se tak, aby byla udržována reakční teplota (500 o C).
40 Existují však i procesy, jejichž podstatou je nekatalytické termické štěpení (dehydrogenace) - krakování a pyrolýza. Obrázek:Teplotní závislost stupně rovnovážné dehydrogenace pěti alkanů při atmosférickém tlaku. 1 etan 2 propan 3 butan, isobutan 4 hexan 5 - oktan Rovnováha ETHAN ETHEN ukazuje, že tento žádaný olefin (látka s největší výrobou na světě) lze připravit jen při teplotách blížících se 1000K. Rychlost reakce je při této teplotě vysoká, použití katalyzátorů proto pozbývá smyslu a vyrábí se pyrolýzou. Problematické je rychlé dosažení reakční teploty a rychlé zchlazení, tím se omezují bočné a následné reakce. Z následující tabulky jsou patrny rychlé změny v rovnovážném složení při dehydrogenaci methylcyklohexanu na toluen, ty jsou důsledkem silného tepelného zabarvení reakce a značné změny počtu molů (z 1 molu vznikají 4). Tabulka: Vliv teploty a tlaku na rovnováhu dehydrogenace Teplota Tlak (MPa) (oc) 0, Rovnovážná konverze methylcyklohexan toluen (mol %) ,9 41,5 0,1 0, ,0 93,9 1,5 0, ,0 99,6 18,6 0, ,0 99,9 1, ,0 70,7 100, ,0 100,0 95,0 99,3 13,2 49,0
41 KINETIKA HYDROGENACE DEHYDROGENACE Hydrogenace je vždy katalyzovaná, dehydrogenace rovněž s výjimkou termického krakování a pyrolýzy. Rychlost reakce určují KATALYZÁTORY, podle podmínek na nich probíhá hydrogenace nebo dehydrogenace. Katalyzátory jsou převážně pevné látky, tzn. že se do reakčního systému vnáší další fáze. Pevné katalyzátory jsou vysokopovrchové materiály m 2 /g Reakce probíhá na aktivních místech, která jsou na povrchu kat., transport reaktantů k aktivnímu místu bývá limitující. Reakční rychlost [mol/g kat. s] závisí na množství katalyzátoru a účinnosti jeho využití. Proto typ reaktoru a použitého katalyzátoru i jeho forma bývá jádrem technologie. Aktivita katalyzátoru závisí na aktivní složce a specifickém povrchu platinové kovy (nejaktivnější) > Ni, Co, Cu > ZnO, Cr 2 O 3, Fe 2 O 3 >CoS, MoS 3 Nosičové hydrogenační katalyzátory umožňují efektivní využití drahé aktivní složky Pt univerzální, hydrogenace probíhá za normálních podmínek Pd selektivní pro alkin alken, nehydrogenuje aromat. jádro Rh, Ru - nehydrogenují aromatické jádro Ni, Co levnější než Pt kovy, univerzální, katalyzují hydrogenolýzu Cu hydrogenuje karbonylové sloučeniny, NO 2, hydrogenolyzuje estery na alkoholy, málo aktivni pro C=C, vůbec ne aromaty Oxidické katalyzátory méně aktivní nežli kovy, to je výhoda při dehydrogenaci, která musí probíhat kvůli rovnováze při vyšší teplotě, kovy by katalyzovaly hydrogenolýzu reaktantů.
42 REAKČNÍ PODMÍNKY závisí na nich zda reakce probíhá v plynné fázi či v kapalné jsou to: teplota, tlak, vstupní složení reakční směsi, typ reaktoru teplota je určena kinetikou reakce, u dehydrogenace rovnováhou - vysoké H => reakce v (g) fázi neprobíhají izotermicky - termická stabilita katalyzátoru (oxidické jsou odolnější) parciální tlak reaktantů stejně jako teplota má vliv na rychlost i na rovnovážné složení - při hydrogenaci v (l) fázi bývá kritický transport H 2 k aktivnímu místu (vodík má vysokou Henryho konstantu) - při hydrogenaci v (g) fázi bývá kritický odvod tepla vstupní složení reakční směsi - u dehydrogenace v (g) fázi ředění inertem snižuje parciální tlak reaktantů a tím posouvá rovnováhu směrem k produktům - u reakcí v (l) fázi je významný vliv rozpouštědla - pokud vodík při hydrogenaci obsahuje inerty, při vyšší konverzi mohou tvořit difúzní odpor typ reaktoru zajišťuje odvod nebo přívod tepla, je žádoucí udržovat reakční teplotu na optimální hodnotě, zajišťuje rovnoměrné využití katalyzátoru, umožňuje dosažení vysoké selektivity,
43 PŘÍKLAD PROCESU Syntéza peroxidu vodíku anthrachinovým postupem
Ropa Kondenzované uhlovodíky
 Nejdůležitější surovina pro výrobu organických sloučenin Nejvýznamnější surovina světové ekonomiky Výroba energie Chemické zpracování - 15 % Cena a zásoby ropy (70-100 let) Ropné krize Nutnost hledání
Nejdůležitější surovina pro výrobu organických sloučenin Nejvýznamnější surovina světové ekonomiky Výroba energie Chemické zpracování - 15 % Cena a zásoby ropy (70-100 let) Ropné krize Nutnost hledání
zpracování těžkých frakcí na motorová paliva (mazut i vakuový zbytek)
 Ropa štěpné procesy zpracování těžkých frakcí na motorová paliva (mazut i vakuový zbytek) typy štěpných procesů: - termické krakování - katalytické krakování - hydrogenační krakování (hydrokrakování) podmínky
Ropa štěpné procesy zpracování těžkých frakcí na motorová paliva (mazut i vakuový zbytek) typy štěpných procesů: - termické krakování - katalytické krakování - hydrogenační krakování (hydrokrakování) podmínky
Gymnázium Vysoké Mýto nám. Vaňorného 163, Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto H 3 C Vymezení arenů V aromatickém cyklu dochází k průniku orbitalů kolmých k rovině cyklu. Vzniká tzv. delokalizovaná vazba π. Stabilita benzenu
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto H 3 C Vymezení arenů V aromatickém cyklu dochází k průniku orbitalů kolmých k rovině cyklu. Vzniká tzv. delokalizovaná vazba π. Stabilita benzenu
H H C C C C C C H CH 3 H C C H H H H H H
 Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115
 Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: Číslo šablony: CZ.1.07/1.5.00/34.0410 III/2 Inovace a zkvalitnění výuky prostřednictvím ICT. Název materiálu: Fosilní zdroje
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: Číslo šablony: CZ.1.07/1.5.00/34.0410 III/2 Inovace a zkvalitnění výuky prostřednictvím ICT. Název materiálu: Fosilní zdroje
UHLOVODÍKY ALKANY (...)
 UHLOVODÍKY ALKANY (...) alifatické nasycené uhlovodíky nerozvětvené i rozvětvené mezi atomy uhlíku pouze jednoduché vazby (σ vazby), mezi nimi úhel 109 28 název: kmen + an obecný vzorec C n H 2n + 2 tvoří
UHLOVODÍKY ALKANY (...) alifatické nasycené uhlovodíky nerozvětvené i rozvětvené mezi atomy uhlíku pouze jednoduché vazby (σ vazby), mezi nimi úhel 109 28 název: kmen + an obecný vzorec C n H 2n + 2 tvoří
Škola: Gymnázium, Brno, Slovanské náměstí 7 III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
OMEZOVÁNÍ NEGATIVNÍCH ENVIRONMENTÁLNÍCH DOPADŮ PŘI VÝROBĚ PALIV A PETROCHEMIKÁLIÍ. Seminář, Bratislava, 6.6.2013 Autor: J.LEDERER
 OMEZOVÁNÍ NEGATIVNÍCH ENVIRONMENTÁLNÍCH DOPADŮ PŘI VÝROBĚ PALIV A PETROCHEMIKÁLIÍ Seminář, Bratislava, 6.6.2013 Autor: J.LEDERER OBSAH - CESTY K REDUKCI NOVOTVORBY CO 2 NEOBNOVITELNÉ SUROVINY OMEZENÍ UHLÍKOVÝCH
OMEZOVÁNÍ NEGATIVNÍCH ENVIRONMENTÁLNÍCH DOPADŮ PŘI VÝROBĚ PALIV A PETROCHEMIKÁLIÍ Seminář, Bratislava, 6.6.2013 Autor: J.LEDERER OBSAH - CESTY K REDUKCI NOVOTVORBY CO 2 NEOBNOVITELNÉ SUROVINY OMEZENÍ UHLÍKOVÝCH
ANORGANICKÁ ORGANICKÁ
 EMIE ANORGANIKÁ ORGANIKÁ 1 EMIE ANORGANIKÁ Anorganické látky Oxidy: O, O 2.. V neživé přírodě.. alogenidy: Nal.. ydroxidy: NaO Uhličitany: ao 3... Kyseliny: l. ydrogenuhličitany: NaO 3. 2 EMIE ORGANIKÁ
EMIE ANORGANIKÁ ORGANIKÁ 1 EMIE ANORGANIKÁ Anorganické látky Oxidy: O, O 2.. V neživé přírodě.. alogenidy: Nal.. ydroxidy: NaO Uhličitany: ao 3... Kyseliny: l. ydrogenuhličitany: NaO 3. 2 EMIE ORGANIKÁ
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace
 Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Nerozvětvené (atomy C jsou spojeny maximálně s dvěma dalšími C) Rozvětvené (atomy C jsou spojeny s více než dvěma dalšími C)
 Otázka: Uhlovodíky Předmět: Chemie Přidal(a): Majdush Obsahují ve svých molekulách pouze atomy uhlíku a vodíku Nejjednodušší org. sloučeniny Uhlík je schopný řetězit se a vytvářet tak nejrůznější řetězce,
Otázka: Uhlovodíky Předmět: Chemie Přidal(a): Majdush Obsahují ve svých molekulách pouze atomy uhlíku a vodíku Nejjednodušší org. sloučeniny Uhlík je schopný řetězit se a vytvářet tak nejrůznější řetězce,
Základní škola a mateřská škola Hutisko Solanec. žák uvede základní druhy uhlovodíků, jejich použití a zdroje. Chemie - 9. ročník
 Základní škola a mateřská škola Hutisko Solanec Digitální učební materiál Anotace: Autor: Jazyk: Očekávaný výstup: Speciální vzdělávací potřeby: Klíčová slova: Druh učebního materiálu: Druh interaktivity:
Základní škola a mateřská škola Hutisko Solanec Digitální učební materiál Anotace: Autor: Jazyk: Očekávaný výstup: Speciální vzdělávací potřeby: Klíčová slova: Druh učebního materiálu: Druh interaktivity:
Paliva. nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování
 Paliva Paliva nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování Dělení paliv podle skupenství pevná uhlí, dřevo kapalná benzín,
Paliva Paliva nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování Dělení paliv podle skupenství pevná uhlí, dřevo kapalná benzín,
Zpracování ropy doc. Ing. Josef Blažek, CSc. 5. přednáška
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 5. přednáška Reformování a izomerace benzinů, výroba benzinových složek
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 5. přednáška Reformování a izomerace benzinů, výroba benzinových složek
EVROPSKÝ PARLAMENT C6-0267/2006. Společný postoj. Dokument ze zasedání 2003/0256(COD) 06/09/2006
 EVROPSKÝ PARLAMENT 2004 Dokument ze zasedání 2009 C6-0267/2006 2003/0256(COD) CS 06/09/2006 Společný postoj Společný postoj Rady k přijetí nařízení Evropského parlamentu a Rady o registraci, hodnocení,
EVROPSKÝ PARLAMENT 2004 Dokument ze zasedání 2009 C6-0267/2006 2003/0256(COD) CS 06/09/2006 Společný postoj Společný postoj Rady k přijetí nařízení Evropského parlamentu a Rady o registraci, hodnocení,
TVORBA UHLÍKATÝCH PRODUKTŮ PŘI I PYROLÝZE UHLOVODÍKŮ
 TVORBA UHLÍKATÝCH PRODUKTŮ PŘI I PYROLÝZE UHLOVODÍKŮ Martin Hrádel 5. ročník Školitel: Doc. Ing. Zdeněk Bělohlav, CSc. Obsah Úvod Mechanismus vzniku a vlastnosti uhlíkatých produktů Provozního sledování
TVORBA UHLÍKATÝCH PRODUKTŮ PŘI I PYROLÝZE UHLOVODÍKŮ Martin Hrádel 5. ročník Školitel: Doc. Ing. Zdeněk Bělohlav, CSc. Obsah Úvod Mechanismus vzniku a vlastnosti uhlíkatých produktů Provozního sledování
Škola: Gymnázium, Brno, Slovanské náměstí 7 III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 VY_32_INOVACE_C.3.01 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT
VY_32_INOVACE_C.3.01 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT
1)uhlovodík musí být cyklický, všechny atomy musí být v jedné rovině
 Otázka: Areny Předmět: Chemie Přidal(a): I. Prokopová 3 podmínky: 1)uhlovodík musí být cyklický, všechny atomy musí být v jedné rovině 2) musí existovat minimálně dvě možnosti uspořádání π elektronů 3)
Otázka: Areny Předmět: Chemie Přidal(a): I. Prokopová 3 podmínky: 1)uhlovodík musí být cyklický, všechny atomy musí být v jedné rovině 2) musí existovat minimálně dvě možnosti uspořádání π elektronů 3)
Přírodní zdroje uhlovodíků. a jejich zpracování
 Přírodní zdroje uhlovodíků a jejich zpracování 1 Rozdělení: Přírodní zdroje org. látek fosilní - zemní plyn, ropa, uhlí (vznikají geochemickými procesy miliony let) recentní (současné) - dřevo, rostlinné
Přírodní zdroje uhlovodíků a jejich zpracování 1 Rozdělení: Přírodní zdroje org. látek fosilní - zemní plyn, ropa, uhlí (vznikají geochemickými procesy miliony let) recentní (současné) - dřevo, rostlinné
HYDROXYDERIVÁTY. Alkoholy Fenoly Bc. Miroslava Wilczková
 HYDROXYDERIVÁTY Alkoholy Fenoly Bc. Miroslava Wilczková HYDROXYDERIVÁTY Alkoholy -OH skupina vázána na uhlíkový atom alifatického řetězce Fenoly -OH skupina vázána na uhlíku, který je součástí aromatického
HYDROXYDERIVÁTY Alkoholy Fenoly Bc. Miroslava Wilczková HYDROXYDERIVÁTY Alkoholy -OH skupina vázána na uhlíkový atom alifatického řetězce Fenoly -OH skupina vázána na uhlíku, který je součástí aromatického
Názvosloví Konformace Isomerie. Uhlíky: primární (1 o ) sekundární (2 o ) terciární (3 o ) kvartérní (4 o )
 ALKANY 1 Názvosloví Konformace Isomerie Uhlíky: primární (1 o ) sekundární (2 o ) terciární (3 o ) kvartérní (4 o ) 2 Alkany (resp. cykloalkany) jsou nejzákladnější organické sloučeniny složené pouze z
ALKANY 1 Názvosloví Konformace Isomerie Uhlíky: primární (1 o ) sekundární (2 o ) terciární (3 o ) kvartérní (4 o ) 2 Alkany (resp. cykloalkany) jsou nejzákladnější organické sloučeniny složené pouze z
www.zlinskedumy.cz Inovace výuky prostřednictvím šablon pro SŠ
 Název projektu Číslo projektu Název školy Autor Název šablony Název DUMu Inovace výuky prostřednictvím šablon pro SŠ CZ.1.07/1.5.00/34.0748 Gymnázium Jana Pivečky a Střední odborná škola Slavičín Mgr.
Název projektu Číslo projektu Název školy Autor Název šablony Název DUMu Inovace výuky prostřednictvím šablon pro SŠ CZ.1.07/1.5.00/34.0748 Gymnázium Jana Pivečky a Střední odborná škola Slavičín Mgr.
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115
 Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: CZ.1.07/1.5.00/34.0410 Číslo šablony: III/2 Inovace a zkvalitněni výuky prostřednictvím ICT. Název materiálu: Zpracování ropy
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: CZ.1.07/1.5.00/34.0410 Číslo šablony: III/2 Inovace a zkvalitněni výuky prostřednictvím ICT. Název materiálu: Zpracování ropy
Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch
 Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch Atom, složení a struktura Chemické prvky-názvosloví, slučivost Chemické sloučeniny, molekuly Chemická vazba
Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch Atom, složení a struktura Chemické prvky-názvosloví, slučivost Chemické sloučeniny, molekuly Chemická vazba
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: Číslo DUMu: VY_32_INOVACE_10_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné
 Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 12.02.2013 Číslo DUMu: VY_32_INOVACE_10_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Obecná
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 12.02.2013 Číslo DUMu: VY_32_INOVACE_10_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Obecná
ZŠ ÚnO, Bratří Čapků 1332
 Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
VLASTNOSTI ALKANŮ 2. RADIKÁLOVÁ SUBSTITUCE 3. ELIMINAČNÍ REAKCE VÝZNAMNÉ ALKANY. Substituční reakce. Sulfochlorace alkanů. Termolýza.
 Kromě CO 2 vznikají i saze roste svítivost Substituční reakce vazby: C C C H jsou nepolární => jsou radikálové S R...radikálová substituce 3 fáze... VLASTNOSTI ALKANŮ tady něco chybí... 2. RADIKÁLOVÁ SUBSTITUCE
Kromě CO 2 vznikají i saze roste svítivost Substituční reakce vazby: C C C H jsou nepolární => jsou radikálové S R...radikálová substituce 3 fáze... VLASTNOSTI ALKANŮ tady něco chybí... 2. RADIKÁLOVÁ SUBSTITUCE
OMEZOVÁNÍ NEGATIVNÍCH ENVIRONMENTÁLNÍCH DOPADŮ PŘI VÝROBĚ PALIV A PETROCHEMIKÁLIÍ. Most, Autor: Doc. Ing. J.LEDERER, CSc.
 OMEZOVÁNÍ NEGATIVNÍCH ENVIRONMENTÁLNÍCH DOPADŮ PŘI VÝROBĚ PALIV A PETROCHEMIKÁLIÍ Most, 29.11.2012 Autor: Doc. Ing. J.LEDERER, CSc. OBSAH - CESTY K REDUKCI NOVOTVORBY CO 2 NEOBNOVITELNÉ SUROVINY OMEZENÍ
OMEZOVÁNÍ NEGATIVNÍCH ENVIRONMENTÁLNÍCH DOPADŮ PŘI VÝROBĚ PALIV A PETROCHEMIKÁLIÍ Most, 29.11.2012 Autor: Doc. Ing. J.LEDERER, CSc. OBSAH - CESTY K REDUKCI NOVOTVORBY CO 2 NEOBNOVITELNÉ SUROVINY OMEZENÍ
Základní chemické pojmy
 MZ CHEMIE 2015 MO 1 Základní chemické pojmy Atom, molekula, prvek, protonové číslo. Sloučenina, chemicky čistá látka, směs, dělení směsí. Relativní atomová hmotnost, molekulová hmotnost, atomová hmotnostní
MZ CHEMIE 2015 MO 1 Základní chemické pojmy Atom, molekula, prvek, protonové číslo. Sloučenina, chemicky čistá látka, směs, dělení směsí. Relativní atomová hmotnost, molekulová hmotnost, atomová hmotnostní
VÝROBA A VYUŽITÍ AROMÁTŮ
 VÝROBA A VYUŽITÍ AROMÁTŮ AROMÁTY OBECNÉ INFORMACE VÝROBA V ČR OPTIMÁLNÍ VÝROBA VARIANTY HLAVNÍ DERIVÁTY SITUACE V PRODUKCI AROMÁTŮ V ZÁPADNÍ EVROPĚ TRH AROMÁTŮ V ZÁPADNÍ EVROPĚ MIL. T/ROK MLD. US$ Spotřeba
VÝROBA A VYUŽITÍ AROMÁTŮ AROMÁTY OBECNÉ INFORMACE VÝROBA V ČR OPTIMÁLNÍ VÝROBA VARIANTY HLAVNÍ DERIVÁTY SITUACE V PRODUKCI AROMÁTŮ V ZÁPADNÍ EVROPĚ TRH AROMÁTŮ V ZÁPADNÍ EVROPĚ MIL. T/ROK MLD. US$ Spotřeba
Inovace profesní přípravy budoucích učitelů chemie
 Inovace profesní přípravy budoucích učitelů chemie I n v e s t i c e d o r o z v o j e v z d ě l á v á n í CZ.1.07/2.2.00/15.0324 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem
Inovace profesní přípravy budoucích učitelů chemie I n v e s t i c e d o r o z v o j e v z d ě l á v á n í CZ.1.07/2.2.00/15.0324 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem
Autor: Tomáš Galbička Téma: Alkany a cykloalkany Ročník: 2.
 Alkany uhlovodíky s otevřeným řetězcem a pouze jednoduchými vazbami vazby sigma, největší výskyt elektronů na spojnici jader v názvu mají koncovku an Cykloalkany uhlovodíky s uzavřeným řetězcem a pouze
Alkany uhlovodíky s otevřeným řetězcem a pouze jednoduchými vazbami vazby sigma, největší výskyt elektronů na spojnici jader v názvu mají koncovku an Cykloalkany uhlovodíky s uzavřeným řetězcem a pouze
Zpracování ropy doc. Ing. Josef Blažek, CSc.
 ODBONÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PO VÝKON STÁTNÍ SPÁVY OCHANY OVZDUŠÍ V ČESKÉ EPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 2. přednáška Složení ropy, základní schémata zpracování ropy, odsolování a
ODBONÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PO VÝKON STÁTNÍ SPÁVY OCHANY OVZDUŠÍ V ČESKÉ EPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 2. přednáška Složení ropy, základní schémata zpracování ropy, odsolování a
CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N VÝROBA MTBE
 CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N409059 VÝROBA MTBE Fyzikální a chemické vlastnosti Suroviny Reakce Technologie Dvoustupňová výroba Jednostupňová výroba Charakteristiky technologií Zdroje
CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N409059 VÝROBA MTBE Fyzikální a chemické vlastnosti Suroviny Reakce Technologie Dvoustupňová výroba Jednostupňová výroba Charakteristiky technologií Zdroje
TERMICKÉ PROCESY PŘI VYUŽITÍ ALTERNATIVNÍCH SUROVIN. Most, 13.6.2013 Autor: Doc. Ing. J.LEDERER, CSc.
 TERMICKÉ PROCESY PŘI VYUŽITÍ ALTERNATIVNÍCH SUROVIN Most, 13.6.2013 Autor: Doc. Ing. J.LEDERER, CSc. OBSAH PRINCIPY POUŽÍVANÝCH TERMOCHEMICKÝCH PROCESŮ VELKOKAPACITNÍ REALIZACE TERMOCHEMICKÝCH PROCESŮ
TERMICKÉ PROCESY PŘI VYUŽITÍ ALTERNATIVNÍCH SUROVIN Most, 13.6.2013 Autor: Doc. Ing. J.LEDERER, CSc. OBSAH PRINCIPY POUŽÍVANÝCH TERMOCHEMICKÝCH PROCESŮ VELKOKAPACITNÍ REALIZACE TERMOCHEMICKÝCH PROCESŮ
Hydroxysloučeniny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Únor
 Hydroxysloučeniny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Únor 2011 Mgr. Alena Jirčáková Hydroxysloučeniny Dělení hydroxysloučenin: Deriváty
Hydroxysloučeniny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Únor 2011 Mgr. Alena Jirčáková Hydroxysloučeniny Dělení hydroxysloučenin: Deriváty
1. ročník Počet hodin
 SOUSTAVY LÁTEK A JEJICH SLOŽENÍ rozdělení přírodních látek a vlastnosti chemických látek soustavy látek a jejich složení STAVBA ATOMU historie pohledu na atom složení a struktura atomu stavba atomu VELIČINY
SOUSTAVY LÁTEK A JEJICH SLOŽENÍ rozdělení přírodních látek a vlastnosti chemických látek soustavy látek a jejich složení STAVBA ATOMU historie pohledu na atom složení a struktura atomu stavba atomu VELIČINY
ALKOHOLY, FENOLY A ETHERY. b. Jaké zdroje cukru znáte a jak se nazývají produkty jejich kvašení?
 ALKOLY, FENOLY A ETHERY Kvašení 1. S použitím literatury nebo internetu odpovězte na následující otázky: a. Jakým způsobem v přírodě vzniká etanol? Napište rovnici. b. Jaké zdroje cukru znáte a jak se
ALKOLY, FENOLY A ETHERY Kvašení 1. S použitím literatury nebo internetu odpovězte na následující otázky: a. Jakým způsobem v přírodě vzniká etanol? Napište rovnici. b. Jaké zdroje cukru znáte a jak se
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE. Ing. Stanislav HONUS
 NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE Ing. Stanislav HONUS ORGANICKÝ MATERIÁL Spalování Chemické přeměny Chem. přeměny ve vodním prostředí Pyrolýza Zplyňování Chemické Biologické Teplo
NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE Ing. Stanislav HONUS ORGANICKÝ MATERIÁL Spalování Chemické přeměny Chem. přeměny ve vodním prostředí Pyrolýza Zplyňování Chemické Biologické Teplo
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 16, 566 01 Vysoké Mýto Alkeny Vlastnosti dvojné vazby Hybridizace uhlíku vázaného dvojnou vazbou je sp. Valenční úhel který svírají vazby na uhlíkovém atomu je přibližně
Gymnázium Vysoké Mýto nám. Vaňorného 16, 566 01 Vysoké Mýto Alkeny Vlastnosti dvojné vazby Hybridizace uhlíku vázaného dvojnou vazbou je sp. Valenční úhel který svírají vazby na uhlíkovém atomu je přibližně
Organické látky. Organická geochemie a rozpuštěný organický uhlík
 Organická geochemie a rozpuštěný organický uhlík struktura, nomenklatura a funkční skupiny huminové látky a další přírodní OC reaktivita DOC/POC distribuce kyselost (acidita) Přírodní a znečišťující organické
Organická geochemie a rozpuštěný organický uhlík struktura, nomenklatura a funkční skupiny huminové látky a další přírodní OC reaktivita DOC/POC distribuce kyselost (acidita) Přírodní a znečišťující organické
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Alklany a cykloalkany Homologická řada alkanů Nerozvětvené alkany tvoří homologickou řadu obecného vzorce C n H 2n+2, kde n jsou malá celá čísla.
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Alklany a cykloalkany Homologická řada alkanů Nerozvětvené alkany tvoří homologickou řadu obecného vzorce C n H 2n+2, kde n jsou malá celá čísla.
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 KARBONYLOVÉ SLOUČENINY = látky, které obsahují karbonylovou skupinu Aldehydy mají skupinu C=O na konci řetězce, aldehydická skupina má potom tvar... Názvosloví aldehydů: V systematickém názvu je zakončení
KARBONYLOVÉ SLOUČENINY = látky, které obsahují karbonylovou skupinu Aldehydy mají skupinu C=O na konci řetězce, aldehydická skupina má potom tvar... Názvosloví aldehydů: V systematickém názvu je zakončení
Organická chemie (KATA) rychlý souhrn a opakování
 Organická chemie (KATA) rychlý souhrn a opakování Molekulové orbitaly hybridizace N a O Polarita vazby, induktivní efekt U kovalentní vazby mezi rozdílnými atomy, nebude elektronový pár oběma atomy sdílen
Organická chemie (KATA) rychlý souhrn a opakování Molekulové orbitaly hybridizace N a O Polarita vazby, induktivní efekt U kovalentní vazby mezi rozdílnými atomy, nebude elektronový pár oběma atomy sdílen
III/2 Inovace a zkvalitnění výuky prostřednictvím ICT. Test k ověření znalostí o ropě 2. verze
 Číslo projektu CZ.1.07/1.5.00/34.0514 Číslo a název šablony klíčové aktivity III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Tematická oblast Suroviny organické technologie, vy_32_inovace_ma_09_32
Číslo projektu CZ.1.07/1.5.00/34.0514 Číslo a název šablony klíčové aktivity III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Tematická oblast Suroviny organické technologie, vy_32_inovace_ma_09_32
Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška Rafinace pohonných hmot, zpracování sulfanu, výroba vodíku
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška Rafinace pohonných hmot, zpracování sulfanu, výroba vodíku
Alkany a cykloalkany
 Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Září 2010 Mgr. Alena Jirčáková Charakteristika alkanů: Malá reaktivita, odolné chemickým činidlům Nasycené
Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Září 2010 Mgr. Alena Jirčáková Charakteristika alkanů: Malá reaktivita, odolné chemickým činidlům Nasycené
Aromacké uhlovodíky reakce
 Aromacké uhlovodíky reakce Temacká oblast : Chemie organická chemie Datum vytvoření: 20. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Reakce výroby nesubstuovaných
Aromacké uhlovodíky reakce Temacká oblast : Chemie organická chemie Datum vytvoření: 20. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Reakce výroby nesubstuovaných
Reaktory pro systém plyn kapalina
 FCHT Reaktory pro systém plyn kapalina Lubomír Krabáč 1 Probublávané reaktory: příklady procesů oxidace organických látek kyslíkem, resp. vzduchem chlorace hydrogenace org. látek s homogenním katal. vyšších
FCHT Reaktory pro systém plyn kapalina Lubomír Krabáč 1 Probublávané reaktory: příklady procesů oxidace organických látek kyslíkem, resp. vzduchem chlorace hydrogenace org. látek s homogenním katal. vyšších
Herní otázky a jejich řešení:
 Herní otázky a jejich řešení: 1) Kde v přírodě můžeme najít methan? Methan je plyn, který je hlavní součástí zemního plynu, tvoří se také při přeměnách uhlí a dále vzniká mikrobiálním rozkladem celulosy
Herní otázky a jejich řešení: 1) Kde v přírodě můžeme najít methan? Methan je plyn, který je hlavní součástí zemního plynu, tvoří se také při přeměnách uhlí a dále vzniká mikrobiálním rozkladem celulosy
Kyslíkaté deriváty. 1) Hydroxyderiváty: a) Alkoholy b) Fenoly. řešení. Dle OH = hydroxylová skupina
 Kyslíkaté deriváty řešení 1) Hydroxyderiváty: a) Alkoholy b) Fenoly Dle = hydroxylová skupina 1 Hydroxyderiváty Alifatické alkoholy: náhrada 1 nebo více atomů H. hydroxylovou skupinou (na 1 atom C vázaná
Kyslíkaté deriváty řešení 1) Hydroxyderiváty: a) Alkoholy b) Fenoly Dle = hydroxylová skupina 1 Hydroxyderiváty Alifatické alkoholy: náhrada 1 nebo více atomů H. hydroxylovou skupinou (na 1 atom C vázaná
EU peníze středním školám digitální učební materiál
 EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší?
 16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší? 4) Urči typy konstituční izomerie. 5) Co je tautomerie
16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší? 4) Urči typy konstituční izomerie. 5) Co je tautomerie
Karboxylové kyseliny a jejich funkční deriváty
 Karboxylové kyseliny a jejich funkční deriváty Úvod Karboxylové kyseliny jsou nejdůležitější organické kyseliny. Jejich funkční skupina je karboxylová skupina a tento název je složen ze slov karbonyl a
Karboxylové kyseliny a jejich funkční deriváty Úvod Karboxylové kyseliny jsou nejdůležitější organické kyseliny. Jejich funkční skupina je karboxylová skupina a tento název je složen ze slov karbonyl a
Rozdělení uhlovodíků
 Rozdělení uhlovodíků 1/8 Alkany a cykloalkany Obecné vzorce: alkany C n H 2n+2, cykloalkany C n H 2n, kde n je přirozené číslo Homologický přírustek: - CH 2 - Alkany přímé ( n - alkany) rozvětvené Primární,
Rozdělení uhlovodíků 1/8 Alkany a cykloalkany Obecné vzorce: alkany C n H 2n+2, cykloalkany C n H 2n, kde n je přirozené číslo Homologický přírustek: - CH 2 - Alkany přímé ( n - alkany) rozvětvené Primární,
MATURITNÍ OTÁZKY Z CHEMIE
 MATURITNÍ OTÁZKY Z CHEMIE 1 Složení a struktura atomu Vývoj představ o složení a struktuře atomu, elektronový obal atomu, modely atomu, pojem orbital, typy orbitalů, jejich znázorňování a pravidla pro
MATURITNÍ OTÁZKY Z CHEMIE 1 Složení a struktura atomu Vývoj představ o složení a struktuře atomu, elektronový obal atomu, modely atomu, pojem orbital, typy orbitalů, jejich znázorňování a pravidla pro
Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/
 Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/34.0448 Číslo projektu Číslo materiálu Název školy Autor Tematický celek Ročník CZ.1.07/1.5.00/34.0448 ICT- PZC 2/11 Zdroje uhlovodíků Střední
Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/34.0448 Číslo projektu Číslo materiálu Název školy Autor Tematický celek Ročník CZ.1.07/1.5.00/34.0448 ICT- PZC 2/11 Zdroje uhlovodíků Střední
Zplyňování biomasy. Sesuvný generátor. Autotermní zplyňování Autotermní a alotermní zplyňování
 Zplyňování = termochemická přeměna uhlíkatého materiálu v pevném či kapalném skupenství na výhřevný energetický plyn pomocí zplyňovacích médií a tepla. Produktem je plyn obsahující výhřevné složky (H 2,
Zplyňování = termochemická přeměna uhlíkatého materiálu v pevném či kapalném skupenství na výhřevný energetický plyn pomocí zplyňovacích médií a tepla. Produktem je plyn obsahující výhřevné složky (H 2,
10 CHEMIE. 10.1 Charakteristika vyučovacího předmětu. 10.2 Vzdělávací obsah
 10 CHEMIE 10.1 Charakteristika vyučovacího předmětu Obsahové vymezení Vyučovací předmět Chemie zpracovává vzdělávací obsah oboru Chemie vzdělávací oblasti Člověk a příroda. Vzdělávání v předmětu chemie
10 CHEMIE 10.1 Charakteristika vyučovacího předmětu Obsahové vymezení Vyučovací předmět Chemie zpracovává vzdělávací obsah oboru Chemie vzdělávací oblasti Člověk a příroda. Vzdělávání v předmětu chemie
Kolik energie by se uvolnilo, kdyby spalování ethanolu probíhalo při teplotě o 20 vyšší? Je tato energie menší nebo větší než při teplotě 37 C?
 TERMOCHEMIE Reakční entalpie při izotermním průběhu reakce, rozsah reakce 1 Kolik tepla se uvolní (nebo spotřebuje) při výrobě 2,2 kg acetaldehydu C 2 H 5 OH(g) = CH 3 CHO(g) + H 2 (g) (a) při teplotě
TERMOCHEMIE Reakční entalpie při izotermním průběhu reakce, rozsah reakce 1 Kolik tepla se uvolní (nebo spotřebuje) při výrobě 2,2 kg acetaldehydu C 2 H 5 OH(g) = CH 3 CHO(g) + H 2 (g) (a) při teplotě
Jednou z nejdůležitějších skupin derivátů uhlovodíků jsou sloučeniny obsahující jednovazné hydroxylové skupiny OH, proto hydroxyderiváty:
 ALKOHOLY, FENOLY A ANALOGICKÉ SIRNÉ SLOUČENINY Jednou z nejdůležitějších skupin derivátů uhlovodíků jsou sloučeniny obsahující jednovazné hydroxylové skupiny OH, proto hydroxyderiváty: Obecný vzorec hydroxysloučenin
ALKOHOLY, FENOLY A ANALOGICKÉ SIRNÉ SLOUČENINY Jednou z nejdůležitějších skupin derivátů uhlovodíků jsou sloučeniny obsahující jednovazné hydroxylové skupiny OH, proto hydroxyderiváty: Obecný vzorec hydroxysloučenin
VII.6.4 Polykondenzace Lineární polymery. H. Schejbalová & I. Stibor, str I. Prokopová, str D. Lukáš 2013
 VII.6.4 Polykondenzace Lineární polymery H. Schejbalová & I. Stibor, str. 172. I. Prokopová, str. 157. D. Lukáš 2013 1 Vzdělávací záměr 1. Polykondenzace uvést obecný průběh stupňovité reakce 2. Příklady
VII.6.4 Polykondenzace Lineární polymery H. Schejbalová & I. Stibor, str. 172. I. Prokopová, str. 157. D. Lukáš 2013 1 Vzdělávací záměr 1. Polykondenzace uvést obecný průběh stupňovité reakce 2. Příklady
VY_32_INOVACE_29_HBENO5
 Alkany reakce Temacká oblast : Chemie organická chemie Datum vytvoření: 15. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Výroba alkanů. Reakvita alkanů, důležité
Alkany reakce Temacká oblast : Chemie organická chemie Datum vytvoření: 15. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Výroba alkanů. Reakvita alkanů, důležité
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
PROPEN - PŘEHLED VYUŽITÍ
 PRPEN - PŘEHLED VYUŽITÍ polymery propandioly propylenkarbonát isopropanolaminy C 4 aldehydy alkoholy kyseliny jejich estery CH methyloxiran (propylenoxid) hydroformylace hydrokarbonylace + 2 isopropylbenzen
PRPEN - PŘEHLED VYUŽITÍ polymery propandioly propylenkarbonát isopropanolaminy C 4 aldehydy alkoholy kyseliny jejich estery CH methyloxiran (propylenoxid) hydroformylace hydrokarbonylace + 2 isopropylbenzen
Požární pojmy ve stavebním zákoně
 1 - Hořlavé látky 2 - Výbušniny 3 - Tuhé hořlavé látky a jejich skladování 4 - Kapalné hořlavé látky a jejich skladování 5 - Plynné hořlavé látky a jejich skladování 6 - Hořlavé a nehořlavé stavební výrobky
1 - Hořlavé látky 2 - Výbušniny 3 - Tuhé hořlavé látky a jejich skladování 4 - Kapalné hořlavé látky a jejich skladování 5 - Plynné hořlavé látky a jejich skladování 6 - Hořlavé a nehořlavé stavební výrobky
1. PROCES A PODMÍNKY HOŘENÍ, HOŘLAVÉ LÁTKY
 1. PROCES A PODMÍNKY HOŘENÍ, HOŘLAVÉ LÁTKY V této kapitole se dozvíte: Jak lze definovat hoření? Jak lze vysvětlit proces hoření? Jaké jsou základní podmínky pro hoření? Co jsou hořlavé látky (hořlaviny)
1. PROCES A PODMÍNKY HOŘENÍ, HOŘLAVÉ LÁTKY V této kapitole se dozvíte: Jak lze definovat hoření? Jak lze vysvětlit proces hoření? Jaké jsou základní podmínky pro hoření? Co jsou hořlavé látky (hořlaviny)
CH 3 -CH 3 -> CH 3 -CH 2 -OH -> CH 3 -CHO -> CH 3 -COOH ethan ethanol ethanal kyselina octová
 KARBOXYLOVÉ KYSELINY Karboxylové kyseliny jsou sloučeniny, v jejichž molekule je karboxylová funkční skupina: Jsou nejvyššími organickými oxidačními produkty uhlovodíků: primární aldehydy uhlovodíky alkoholy
KARBOXYLOVÉ KYSELINY Karboxylové kyseliny jsou sloučeniny, v jejichž molekule je karboxylová funkční skupina: Jsou nejvyššími organickými oxidačními produkty uhlovodíků: primární aldehydy uhlovodíky alkoholy
Zpracování ropy doc. Ing. Josef Blažek, CSc. 6. přednáška
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 6. přednáška Vlastnosti a výroba minerálních olejů ZÁKLADOVÉ OLEJE Oleje:
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 6. přednáška Vlastnosti a výroba minerálních olejů ZÁKLADOVÉ OLEJE Oleje:
Přírodní zdroje uhlovodíků
 Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Říjen 2010 Mgr. Alena Jirčáková Zemní plyn - vznik: Výskyt často spolu s ropou (naftový zemní plyn) nebo
Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Říjen 2010 Mgr. Alena Jirčáková Zemní plyn - vznik: Výskyt často spolu s ropou (naftový zemní plyn) nebo
V. Soustavy s chemickou reakcí
 V. Soustavy s chemickou reakcí 1 5. Soustavy s chemickou reakcí 5.1 Základní pojmy 5.2 Rozdělení reakcí 5.3 Reakční kinetika 5.3.1 Podmínky pro zreagování dvou molekul 5.3.2 Mechanismy reakce 5.3.3 Rychlost
V. Soustavy s chemickou reakcí 1 5. Soustavy s chemickou reakcí 5.1 Základní pojmy 5.2 Rozdělení reakcí 5.3 Reakční kinetika 5.3.1 Podmínky pro zreagování dvou molekul 5.3.2 Mechanismy reakce 5.3.3 Rychlost
Průmysl dusíku. amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin. NaClO NaOH CO(NH 2 ) 2.
 Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
Zpracování ropy doc. Ing. Josef Blažek, CSc. 3. přednáška
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 3. přednáška Termické a katalytické krakování a hydrokrakování těžkých
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 3. přednáška Termické a katalytické krakování a hydrokrakování těžkých
2.4 AROMATICKÉ UHLOVODÍKY
 2.4 AROMATICKÉ UHLOVODÍKY Označení aromatické uhlovodíky sice historicky souvisí s charakteristickým zápachem mnohých z nich (např. benzen páchne po dehtu, toluen zapáchá jako toluánský balzám či benzaldehyd
2.4 AROMATICKÉ UHLOVODÍKY Označení aromatické uhlovodíky sice historicky souvisí s charakteristickým zápachem mnohých z nich (např. benzen páchne po dehtu, toluen zapáchá jako toluánský balzám či benzaldehyd
spalné teplo h spal = kj/kg složení: % C, % H, 2 3 % O, N,S hustota ρ (20 C) = kg/m 3
 4. Zpracování ropy 4.1 Ropa směs uhlovodíků (parafíny, nafteny, aromáty) kapalina hnědé až černé barvy složení: 84 87 % C, 11 14 % H, 2 3 % O, N,S hustota ρ (20 C) = 800 1000 kg/m 3 spalné teplo h spal
4. Zpracování ropy 4.1 Ropa směs uhlovodíků (parafíny, nafteny, aromáty) kapalina hnědé až černé barvy složení: 84 87 % C, 11 14 % H, 2 3 % O, N,S hustota ρ (20 C) = 800 1000 kg/m 3 spalné teplo h spal
Alkeny. Alkeny. Největšíprůmyslový význam majíethen (ethylen) a propen (propylen) jako suroviny pro další přeměny nebo pro polymerace
 Alkeny Dvojná vazba je tvořena jednou vazbou sigma a jednou vazbou pí. Dvojná vazba je kratší než vazba jednoduchá a všechny čtyři atomy vázané na dvojnou vazbu leží v jedné rovině. Fyzikální vlastnosti
Alkeny Dvojná vazba je tvořena jednou vazbou sigma a jednou vazbou pí. Dvojná vazba je kratší než vazba jednoduchá a všechny čtyři atomy vázané na dvojnou vazbu leží v jedné rovině. Fyzikální vlastnosti
Organická chemie pro biochemiky II část 14 14-1
 rganická chemie pro biochemiky II část 14 14-1 oxidace a redukce mají v organické chemii trochu jiný charakter než v chemii anorganické obvykle u jde o adici na systém s dvojnou vazbou či štěpení vazby
rganická chemie pro biochemiky II část 14 14-1 oxidace a redukce mají v organické chemii trochu jiný charakter než v chemii anorganické obvykle u jde o adici na systém s dvojnou vazbou či štěpení vazby
Učební osnovy pracovní
 2 týdně, povinný Chemické reakce II. Žák: používá s porozuměním pojmy oxidace, red. vysvětlí podstatu výroby kovů z rud nakreslí schéma elektrolýzy a galvanického článku, porovná oba děje, uvede příklady
2 týdně, povinný Chemické reakce II. Žák: používá s porozuměním pojmy oxidace, red. vysvětlí podstatu výroby kovů z rud nakreslí schéma elektrolýzy a galvanického článku, porovná oba děje, uvede příklady
Masarykova střední škola zemědělská a Vyšší odborná škola, Opava, příspěvková organizace
 Číslo projektu Číslo materiálu Název školy Autor Průřezové téma Tematický celek Ročník 1. CZ.1.07/1.5.00/34.0565 VY_32_INOVACE_359_Uhlovodíky Masarykova střední škola zemědělská a Vyšší odborná škola,
Číslo projektu Číslo materiálu Název školy Autor Průřezové téma Tematický celek Ročník 1. CZ.1.07/1.5.00/34.0565 VY_32_INOVACE_359_Uhlovodíky Masarykova střední škola zemědělská a Vyšší odborná škola,
Charakteristika Teorie kyselin a zásad. Příprava kyselin Vlastnosti + typické reakce. Významné kyseliny. Arrheniova teorie Teorie Brönsted-Lowryho
 Petra Ustohalová 1 harakteristika Teorie kyselin a zásad Arrheniova teorie Teorie Brönsted-Lowryho Příprava kyselin Vlastnosti + typické reakce Fyzikální a chemické Významné kyseliny 2 Látky, které ve
Petra Ustohalová 1 harakteristika Teorie kyselin a zásad Arrheniova teorie Teorie Brönsted-Lowryho Příprava kyselin Vlastnosti + typické reakce Fyzikální a chemické Významné kyseliny 2 Látky, které ve
Karbonylové sloučeniny
 Karbonylové sloučeniny více než 120 o 120 o C O C C d + d - C O C sp 2 C sp 2 R C O H R 1 C O R 2 1.aldehydy, ketony Nu E R C O R C O 2. karboxylové kyseliny a funkční deriváty O H 3. deriváty kys. uhličité
Karbonylové sloučeniny více než 120 o 120 o C O C C d + d - C O C sp 2 C sp 2 R C O H R 1 C O R 2 1.aldehydy, ketony Nu E R C O R C O 2. karboxylové kyseliny a funkční deriváty O H 3. deriváty kys. uhličité
Příklady k semináři z organické chemie OCH/SOCHA. Doc. RNDr. Jakub Stýskala, Ph.D.
 Příklady k semináři z organické chemie /SA Doc. RNDr. Jakub Stýskala, Ph.D. Příklady k procvičení 1. Které monochlorované deriváty vzniknou při radikálové chloraci následující sloučeniny. Který z nich
Příklady k semináři z organické chemie /SA Doc. RNDr. Jakub Stýskala, Ph.D. Příklady k procvičení 1. Které monochlorované deriváty vzniknou při radikálové chloraci následující sloučeniny. Který z nich
Energie v chemických reakcích
 Energie v chemických reakcích Energetická bilance reakce CH 4 + Cl 2 = CH 3 Cl + HCl rozštěpení vazeb vznik nových vazeb V chemických reakcích dochází ke změně vazeb mezi atomy. Vazebná energie uvolnění
Energie v chemických reakcích Energetická bilance reakce CH 4 + Cl 2 = CH 3 Cl + HCl rozštěpení vazeb vznik nových vazeb V chemických reakcích dochází ke změně vazeb mezi atomy. Vazebná energie uvolnění
Polymery lze rozdělit podle několika kritérií. Podle původu rozlišujeme polymery přírodní a syntetické. Přírodní polymery jsou:
 MAKROMOLEKULÁRNÍ LÁTKY (POLYMERY) Makromolekuly jsou molekulové systémy složené z velkého počtu atomů vázaných chemickými vazbami do dlouhých řetězců. Tyto řetězce tvoří pravidelně se opakující části,
MAKROMOLEKULÁRNÍ LÁTKY (POLYMERY) Makromolekuly jsou molekulové systémy složené z velkého počtu atomů vázaných chemickými vazbami do dlouhých řetězců. Tyto řetězce tvoří pravidelně se opakující části,
1. nitrosloučeniny R-NO 2 CH 3 -NO aminosloučeniny R-NH 2 CH 3 -NH 2
 DUSÍKATÉ DERIVÁTY UHLOVODÍKŮ Dusíkaté deriváty uhlovodíků obsahují ve svých molekulách atom dusíku vázaný přímo na atom uhlíku. Atom dusíku přitom bývá součástí funkční skupiny, podle níž dusíkaté deriváty
DUSÍKATÉ DERIVÁTY UHLOVODÍKŮ Dusíkaté deriváty uhlovodíků obsahují ve svých molekulách atom dusíku vázaný přímo na atom uhlíku. Atom dusíku přitom bývá součástí funkční skupiny, podle níž dusíkaté deriváty
Chemie NÁRODNÍ SROVNÁVACÍ ZKOUŠKY BŘEZNA 2017
 NÁRODNÍ SROVNÁVACÍ ZKOUŠKY Chemie T BŘEZNA 2017 D : 4. BŘEZNA 2017 : 212 : 30 M. M. : 29,0 : 26,7 M. : 8,8 % S : -9,7 M. : -4,3 : 14,7 Zopakujte si základní informace ke zkoušce: n Test obsahuje 30 úloh.
NÁRODNÍ SROVNÁVACÍ ZKOUŠKY Chemie T BŘEZNA 2017 D : 4. BŘEZNA 2017 : 212 : 30 M. M. : 29,0 : 26,7 M. : 8,8 % S : -9,7 M. : -4,3 : 14,7 Zopakujte si základní informace ke zkoušce: n Test obsahuje 30 úloh.
OCH/OC2. Karbonylové sloučeniny 1
 OCH/OC2 Karbonylové sloučeniny 1 1 Rozdělení Aldehyd Keton Karboxylová kyselina Acylhalogenid Ester Anhydrid Amid Azid Hydrazid Hydroxamová kyselina Lakton Laktam 2 Rozdělení Deriváty kyseliny uhličité
OCH/OC2 Karbonylové sloučeniny 1 1 Rozdělení Aldehyd Keton Karboxylová kyselina Acylhalogenid Ester Anhydrid Amid Azid Hydrazid Hydroxamová kyselina Lakton Laktam 2 Rozdělení Deriváty kyseliny uhličité
ČESKÉ RAFINÉRSKÉ, a.s.
 Bilance vodíku v ČESKÉ RAFINÉRSKÉ, a.s. APROCHEM 2010 Kouty nad Desnou 19 21.4.2010 Ing.Hugo Kittel, CSc., MBA www.ceskarafinerska.cz 1 Obsah Úvod do problému Zdroje vodíku pro rafinérie Využití vodíku
Bilance vodíku v ČESKÉ RAFINÉRSKÉ, a.s. APROCHEM 2010 Kouty nad Desnou 19 21.4.2010 Ing.Hugo Kittel, CSc., MBA www.ceskarafinerska.cz 1 Obsah Úvod do problému Zdroje vodíku pro rafinérie Využití vodíku
Úvod do studia organické chemie
 Úvod do studia organické chemie 1828... Wöhler... uměle připravil močovinu Organická chemie - chemie sloučenin uhlíku a vodíku, případně dalších prvků (O, N, X, P, S) Příčiny stability uhlíkových řetězců:
Úvod do studia organické chemie 1828... Wöhler... uměle připravil močovinu Organická chemie - chemie sloučenin uhlíku a vodíku, případně dalších prvků (O, N, X, P, S) Příčiny stability uhlíkových řetězců:
OBSAH 1 ÚVOD... 7. 1.1 Výrobek a materiál... 7 1.2 Přehled a klasifikace materiálů pro výrobu... 8 2 ZDROJE DŘEVA... 13
 OBSAH 1 ÚVOD................................................. 7 1.1 Výrobek a materiál........................................ 7 1.2 Přehled a klasifikace materiálů pro výrobu..................... 8 2
OBSAH 1 ÚVOD................................................. 7 1.1 Výrobek a materiál........................................ 7 1.2 Přehled a klasifikace materiálů pro výrobu..................... 8 2
PALIVA. Bc. Petra Váňová 2014
 PALIVA Bc. Petra Váňová 2014 Znáte odpověď? Která průmyslová paliva znáte? koks benzín líh svítiplyn nafta Znáte odpověď? Jaké jsou výhody plynných paliv oproti pevným? snadný transport nízká teplota vzplanutí
PALIVA Bc. Petra Váňová 2014 Znáte odpověď? Která průmyslová paliva znáte? koks benzín líh svítiplyn nafta Znáte odpověď? Jaké jsou výhody plynných paliv oproti pevným? snadný transport nízká teplota vzplanutí
Vzdělávací oblast: Člověk a příroda. Vyučovací předmět: Chemie. Třída: kvarta. Očekávané výstupy. Poznámky. Přesahy. Průřezová témata.
 Vzdělávací oblast: Člověk a příroda Vyučovací předmět: Chemie Třída: kvarta Očekávané výstupy Vysvětlí pojmy oxidace, redukce, oxidační činidlo, redukční činidlo Rozliší redoxní rovnice od neredoxních
Vzdělávací oblast: Člověk a příroda Vyučovací předmět: Chemie Třída: kvarta Očekávané výstupy Vysvětlí pojmy oxidace, redukce, oxidační činidlo, redukční činidlo Rozliší redoxní rovnice od neredoxních
16.UHLOVODÍKY A IZOMERIE ORGANICKÝCH SLOUČENIN IZOMERIE:
 16.UHLOVODÍKY A IZOMERIE ORGANICKÝCH SLOUČENIN IZOMERIE: 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem se liší? 4) Vyber správné
16.UHLOVODÍKY A IZOMERIE ORGANICKÝCH SLOUČENIN IZOMERIE: 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem se liší? 4) Vyber správné
Uhlovodíky -pracovní list
 Uhlovodíky -pracovní list VY_52_INOVACE_195 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 9 Uhlovodíky -pracovní list 1)Podle textu odpovězte na otázky Uhlík v uhlovodících má schopnost
Uhlovodíky -pracovní list VY_52_INOVACE_195 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 9 Uhlovodíky -pracovní list 1)Podle textu odpovězte na otázky Uhlík v uhlovodících má schopnost
Chemie - 3. ročník. přesahy, vazby, mezipředmětové vztahy průřezová témata. očekávané výstupy RVP. témata / učivo. očekávané výstupy ŠVP.
 očekávané výstupy RVP témata / učivo Chemie - 3. ročník Žák: očekávané výstupy ŠVP přesahy, vazby, mezipředmětové vztahy průřezová témata 1.1., 1.2., 1.3., 1.4., 2.1. 1. Látky přírodní nebo syntetické
očekávané výstupy RVP témata / učivo Chemie - 3. ročník Žák: očekávané výstupy ŠVP přesahy, vazby, mezipředmětové vztahy průřezová témata 1.1., 1.2., 1.3., 1.4., 2.1. 1. Látky přírodní nebo syntetické
EU peníze středním školám digitální učební materiál
 EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
HOŘENÍ A VÝBUCH. Ing. Hana Věžníková, Ph. D.
 HOŘENÍ A VÝBUCH Ing. Hana Věžníková, Ph. D. 1 HOŘENÍ A VÝBUCH Definice hoření Vysvětlení procesu hoření Základní podmínky pro hoření Co jsou hořlavé látky (hořlaviny) a jak je lze klasifikovat Chemické
HOŘENÍ A VÝBUCH Ing. Hana Věžníková, Ph. D. 1 HOŘENÍ A VÝBUCH Definice hoření Vysvětlení procesu hoření Základní podmínky pro hoření Co jsou hořlavé látky (hořlaviny) a jak je lze klasifikovat Chemické
2. KINETICKÁ ANALÝZA HOMOGENNÍCH REAKCÍ
 2. KINETICKÁ ANALÝZA HOMOGENNÍCH REAKCÍ Úloha 2-1 Řád reakce a rychlostní konstanta integrální metodou stupeň přeměny... 2 Úloha 2-2 Řád reakce a rychlostní konstanta integrální metodou... 2 Úloha 2-3
2. KINETICKÁ ANALÝZA HOMOGENNÍCH REAKCÍ Úloha 2-1 Řád reakce a rychlostní konstanta integrální metodou stupeň přeměny... 2 Úloha 2-2 Řád reakce a rychlostní konstanta integrální metodou... 2 Úloha 2-3
Ch - Uhlovodíky VARIACE
 Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukových materiálů je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE Tento dokument byl kompletně vytvořen, sestaven a vytištěn
Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukových materiálů je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE Tento dokument byl kompletně vytvořen, sestaven a vytištěn
