Cíl úlohy: Najít vhodné rozpouštědlo pro překrystalování zkoušené látky a samotná krystalizace.
|
|
|
- Olga Horáčková
- před 9 lety
- Počet zobrazení:
Transkript
1 Úloha A Krystalizace ejdůležitější metodou čištění tuhých látek je krystalizace. Zakládá se na rozdílné rozpustnosti zkoumané látky a její příměsí v určitém rozpouštědle za různých teplot. Při krystalizaci nasytíme vhodné rozpouštědlo za varu surovým produktem, většinou ještě za horka přefiltrujeme (zbavíme se nerozpuštěných nečistot) a necháme roztok ochladit. Látka vykrystalizuje zpravidla ve vyšší čistotě. rozpouštění krystalizace nečistota molekuly v krystalové mřížce molekuly látek Cíl úlohy: ajít vhodné rozpouštědlo pro překrystalování zkoušené látky a samotná krystalizace. PRACVÍ PSTUP: 1. Výběr vhodného rozpouštědla pro krystalizaci: Přibližně 0,1 g zkoušené látky ve zkumavce smícháme s 0,5 1 ml rozpouštědla při laboratorní teplotě (přidáváme po kapkách) a zahříváme postupně k varu na vodní (olejové) lázni. Rozpouštědlo není vhodné na krystalizaci: - pokud se látka rozpustí v 1 ml rozpouštědla za laboratorní teploty nebo při mírném zahřátí - pokud se látka nerozpustí za varu ani po přidání dalších 2 ml rozpouštědla - pokud se látka rozpustila při teplotě varu rozpouštědla, ale po ochlazení se krystaly nevytvoří, resp. se nevytvoří ani po silném podchlazení (led-sůl), protřepávání a škrabání tyčinkou po stěnách zkumavky pod hladinou roztoku. Rozpouštědlo je vhodné na krystalizaci: - pokud je látka ve vybraném rozpouštědle za varu dobře rozpustná a ochlazením roztoku se krystaly vyloučí. - pokud je látka dobře rozpustná při laboratorní teplotě v jednom rozpouštědle a v jiném jen minimálně, může se na krystalizaci tohoto vzorku použít směs těchto rozpouštědel. Rozpouštědla musí být vzájemně mísitelná. 2. Praktické provedení krystalizace Postup A: Zůstatek zkoumané látky zvážíme (příliš velké krystaly se rozetřou), přeneseme do baňky o objemu 50 ml a přidáme asi 10 ml vybraného rozpouštědla (v případě krystalizace z vody použijeme kádinku postavenou na vařiči s regulací). Přidáme varné kamínky a obsah baňky zahříváme pod zpětným chladičem na vodní (olejové) lázni za občasného promíchání do varu. ladina vody (oleje) v lázni musí být o něco nižší, než je hladina roztoku v baňce, aby se na jejich stěnách nevylučovala krystalizovaná látka z důvodu odpaření rozpouštědla. Pokud se látka v tomto množství rozpouštědla při teplotě varu nerozpouští, přidá se postupně přes chladič další odměřené množství rozpouštědla tak, aby vznikl nasycený roztok za varu. Z praktických důvodů se tání
2 doporučuje tento roztok ještě trochu naředit (přidat 1 2 ml rozpouštědla). a odbarvení a vyčištění roztoku (po jeho nepatrném ochlazení) se k němu přidá aktivní uhlí (asi 1/50 až 1/20 hmotnosti vzorku krystalizované látky). Krystalizační roztok nepatrně ochladíme z důvodu možného rizika vzkypění směsi po přídavku aktivního uhlí při teplotě varu! bsah baňky s aktivním uhlím povaříme asi 2-3 minuty. Potom jej přefiltrujeme za horka přes skládaný filtr do kádinky, ve které jej necháme pozvolna vychladnout. akonec filtrát ještě ochladíme v ledové lázni, abychom dosáhli vyloučení co nejvíce krystalované látky. V případě, že se nevylučuje z filtrátu tuhá látka, nádoba s filtrátem se ochladí v ledové lázni a stěny nádoby pod povrchem roztoku se třou skleněnou tyčinkou. V případě, že ani pak se krystaly nevyloučí, přidáme do filtrátu rozpouštědlo, ve kterém se zkoumaná látka nerozpouští. Vyloučené krystaly odsajeme na Büchnerově nálevce nebo skleněné fritě (zbytek v baňce vymyjeme prvním podílem filtrátu) a na filtru promyjeme vychlazeným rozpouštědlem a látku vysušíme na vzduchu na Petriho misce. Látku zvážíme a vypočítáme výtěžek krystalizace. Postup B: V případě, když je třeba látku krystalizovat ze směsi rozpouštědel, postupujeme následovně: K téměř vařícímu roztoku látky v co nejmenším možném množství rozpouštědla, ve kterém se látka dobře rozpouští, se postupně až do trvalého zákalu přidává horké rozpouštědlo, ve kterém se látka nerozpouští nebo jen málo rozpouští. Zákal se odstraní zahříváním a přidáním několika kapek prvního rozpouštědla. Dále postupujeme stejně jak ve výše uvedeném případě s přidáním aktivního uhlí a následnými laboratorními operacemi, jak je to popsané v předcházejícím odstavci. 3. Postup přípravy skládaného filtru.
3 Úloha B Chromatografie na tenké vrstvě (TLC) Jednou z nejrozšířenějších analytických metod je chromatografie, umožňující účinnou separaci látek nutnou pro spolehlivou identifikaci a kvantifikaci složek sledovaného vzorku. K rozdělení látek dochází na základě jejich různé pohyblivosti v systému dvou fází stacionární (zakotvené) a mobilní (pohyblivé). Různé látky se liší ve svých adsorpčních vlastnostech, v hodnotách rozdělovacích koeficientů, ve svých rozměrech, velikosti a druhu náboje, což lze využít v chromatografii k jejich rozdělení na vhodném chromatografickém zařízení. Stacionární fází může být pevná látka (papír, Si 2, Al 2 3 ) ale i kapalná fáze zakotvená na pevném nosiči. Mobilní fází pak bývá kapalina příp. plyn. Z hlediska provedení uspořádání chromatografického zařízení dělíme chromatografii na plošnou a sloupcovou, z hlediska určujícího mechanismu dělení látky mezi stacionární a mobilní fázi pak chromatografii adsorpční, rozdělovací, iontově výměnnou a další. Tenkovrstvá chromatografie (TLC, thin layer chromatography) využívá běžných principů adsorpční kapalinové chromatografie. Liší se pouze uspořádáním stacionární fáze do tenké vrstvy. Mobilní fáze je nasávána kapilárními silami tenké vrstvy. Vlastní chromatografický experiment se provádí na tenké vrstvě sorbentu (silikagel, oxid hlinitý, celulóza) o síle 0,1 až 0,5 mm naneseného na vhodné podložce (kovová nebo plastová fólie, skleněná deska). Sorbent může obsahovat několik procent pojiva: sádry v množství 5 až 10 %, škrobu, atd. Desky se často prodávají s příměsí fluorescenčního indikátoru. Vzorek se ve velmi malém množství (několik µl 0,1 až 5 % roztoku) mikropipetou nebo kapilárou nanáší na začátek vrstvy (asi 1,5 až 2 cm od spodního okraje) označované jako start společně se standardy. Po vysušení skvrn nanesených vzorků se vrstva vloží do vyvíjecí komory s vhodnou směsí rozpouštědel (mobilní fáze) tak, aby start byl nad hladinou. Připravená vrstva se vyvíjí v uzavřené komoře, jejíž atmosféra je nasycena parami mobilní fáze. Kapilárními silami vzlínající rozpouštědlo unáší jednotlivé složky vzorku různou rychlostí. Vyvíjení chromatogramu probíhá tak dlouho, dokud se čelo vzlínající směsi rozpouštědel nepřiblíží k okraji desky. Potom se vrstva vyjme, usuší a vhodným způsobem detekce se rozdělené složky lokalizují. K detekci se povětšině používají vrstvy upravené fluorescenční látkou, fluoreskující při ozáření UV zářením (254 nm). Stanovované látky velmi často tuto fluorescenci zhášejí, takže se pod UV lampou objevují na chromatogramu v podobě tmavých skvrn. Další způsoby detekce jsou založeny na postřiku chromatogramu vhodným činidlem, které se stanovovanou látkou vytváří barevnou sloučeninu (jod, Ag 3, apod.). Při vyhodnocování se měří vzdálenosti středu skvrny od startu a vzdálenost, kterou urazila mobilní fáze od startu. Stanovuje se tzv. retenční faktor (R f ) tj. poměr vzdálenosti středu skvrny sledované látky od startu a vzdálenosti čela od startu. U plošných chromatografií je však reprodukovatelnost sporná a proto se s tabelací R f nesetkáváme. odnoty R f se mohou pohybovat od 0 pro látky vyvíjecím činidlem za daných podmínek neunášené (zůstávají na startu) až po 1 pro látky zcela nezdržované stacionární fází a unášené s čelem. Tenkovrstvou chromatografií lze stanovovat širokou škálu organických sloučenin při vysoké citlivosti a nízké ekonomické náročnosti. Metoda je časově nenáročná, takže je velmi rozšířená v praxi. Vzhledem ke své univerzálnosti je vhodná i pro první orientaci ve složení neznámého vzorku.
4 čelo a b R f (látky D) = a b = 0,83 start neznámá směs standardy látek A B C D Příklad analýzy neznámé směsi pomocí standardů a tenkovrstvé chromatografie. Z vyvinuté TLC destičky je zřejmé, že neznámá směs obsahovala látku A a C. Cíl úlohy: ajít vhodnou vyvíjecí směs (rozpouštědlo) pro rozdělení standardů a určení složení neznámého zkoušeného vzorku a kvalitativní analýzu modelové směsi použijeme komerčně dostupné destičky pro tenkovrstvou chromatografii s chromatografickou vrstvou tvořenou silikagelem (Si 2 ). Složení vzorku určíme na základě porovnání se standardem (4 standardy). PRACVÍ PSTUP: 1. Připravíme si roztok zkoumaného vzorku (směs dvou látek) tak, že jej rozpustíme (naředíme) v 1 ml acetonu. Stejným způsobem připravíme roztoky standardů. 2. a TLC destičce pomocí pravítka a tužky jemně naznačíme start ve vzdálenosti asi 1,5 cm od spodního okraje. Vzdálenost mezi jednotlivými nanesenými vzorky a od okrajů destičky by měla být asi 0,5 až 1 cm. 3. Pomocí skleněné kapiláry naneseme zkoumaný vzorek a jednotlivé standardy (4) na TLC destičku tak, aby skvrny neměly větší průměr než 2-3 mm. Každý standard nanášíme novou čistou kapilárou. 4. Připravíme si chromatografickou komoru, v našich podmínkách nám poslouží kádinka přikrytá hodinovým sklíčkem nebo Petriho miskou, do které je vložen pruh filtračního papíru vložený při stěnách kádinky a sahající až po její vrch. 5. Do chromatografické komory vlijeme vybranou vyvíjecí směs tak, aby výška hladiny byla asi 0,5 cm ode dna nádoby.
5 6. Tenkou vrstvu s nanesenými skvrnami (vzorky) vložíme do chromatografické komory tak, aby start byl nad hladinou rozpouštědla. 7. Když vzlínající rozpouštědlo dosáhne vzdálenost asi 1 cm od horního okraje, TLC destičku vyndáme z komory, označíme čelo rozpouštědla tužkou (rozhraní mezi mokrou a suchou částí destičky) a TLC destičku necháme na vzduchu vysušit. 8. TLC destičku vložíme pod UV lampu (254 nm) a detekujeme skvrny, které jsou viditelné. Skvrny označíme tužkou a vypočítáme hodnoty retenčního faktoru R f. Je důležité, aby všechny 4 standardy byly rozseparovány. V případě, že nejsou, nebo jsou příliš blízko startu nebo cíle postup zopakujeme s použitím jiné vyvíjecí směsi (rozpouštědla, nebo jiného poměru). Z chromatogramu vizuálně zjistíme složení vzorku a potvrdíme identitu jednotlivých složek (2) zkoumaného vzorku se standardy porovnáním jejich R f hodnot. 9. Retenčního faktoru R f vypočítáme podle vzorce: R f = b a, kde: a = vzdálenost středu skvrny od startu v cm, nebo mm, b = vzdálenost čela rozpouštědla od startu v cm, nebo mm. Polarita vybraných rozpouštědel používaných pro TLC: nejméně polární (nepolární) hexan petrolether stoupající eluční síla dichlormethan ethylacetát aceton nejpolárnější methanol
6 Úloha C Destilace (frakční) za normálního tlaku Destilace je nejdůležitější metodou čištění kapalin. Destilací čistíme nebo oddělujeme kapalné látky na principu rozdílné teploty varu. Při jednoduché destilaci kapalinu zahříváme k varu a vznikající páry kondenzujeme v chladiči na destilát. Jednoduchou destilací jí nazýváme proto, že při ní se pohybuje pouze jedna fáze (páry). V případě, že část zkondenzovaných par se kontinuálně vrací do destilační baňky proti vystupujícím parám tzv. zpětný tok (reflux), mluvíme o opakované destilaci neboli rektifikaci. Při ní vzájemným kontaktem kapalné a parní fáze dochází k neustálému opakování vypařování a kondenzace. Rektifikace se provádí na rektifikačních kolonách. Pokud destilujeme kapalinu, která je směsí složek s různým bodem varu (nemá jednotné složení), nejdříve se destiluje látka s nižším bodem varu (vyšší tenzi par). V prvních podílech kondenzátu se hromadí těkavější složka. Pokud jsou teploty varu jednotlivých složek dostatečně vzdálené (30 40 C) a pokud nevznikají tzv. azeotropické směsi, tj. směsi, které mají stejné složení v kapalné i parní fázi, složení destilátu se v průběhu destilace nemění a směs vře při konstantní teplotě až do vydestilování téměř celého podílu těkavější složky. Při dalším zvyšování teploty destilace pak destiluje druhá složka, která měla vyšší teplotu varu než ta první. Výměnou předlohy ve vhodném čase můžeme tyto složky oddělit. Zachytáváme tzv. frakce a destilaci nazýváme jako frakční. Destilace směsi toluenu a cyklohexanu. Směs toluenu a cyklohexanu netvoří azeotropickou směs. Teplota varu cyklohexanu je 80,7 C a toluenu 110,6 C, to znamená, že rozdíl teplot varu je téměř 30 C. Destilací této směsi je možné získat jednotlivé složky. a to je však potřebné použít rektifikační kolony. Závislost teploty varu na složení směsi (a), závislosti teploty varu na objemu destilátu tzv. destilační křivka (b). Cíl úlohy: Provést destilaci směsi cyklohexanu a toluenu za atmosférického tlaku. Určit složení jednotlivých frakcí pomocí refraktometrického stanovení.
7 Refraktometrie K identifikaci kapalné látky a zkoušení její čistoty můžeme použít také refraktometrii. Index lomu (n) můžeme vyjádřit podle Snellova zákona (obr.). c 1 Index lomu n = c 1 c 2 = sin sin c 1 = rychlost světla v prostředí 1 c 2 c 2 = rychlost světla v prostředí 2 Index lomu stanovujeme refraktometrem. Standardním přístrojem pro organické laboratoře je tzv. Abbeův refraktometr. Index lomu kromě jiného závisí na koncentraci. Můžeme proto refraktometrii používat ke stanovení koncentrace roztoků nebo kontrole průběhu dělení, např. destilace. Index lomu binárních směsí závisí lineárně na koncentraci jednotlivých složek. PRACVÍ PSTUP: Do kulaté baňky nebo baňky s plochým dnem o objemu 250 ml odměříme 50 ml cyklohexanu a 50 ml toluenu a přidáme varné kamínky. Baňku připojíme na předem poskládanou aparaturu na destilaci za atmosférického tlaku. Pozvolna zahříváme na olejové lázni do varu. Destilát jímáme do odměrného válce. debíráme frakce o objemu 10 ml. Zaznamenáváme teplotu varu při každé výměně odměrného válce. Jednotlivé frakce přelijeme do připravených zkumavek a uzavřeme je hliníkovou fólií, abychom zabránili dalšímu odpařování. Dbáme na to, aby směs destilovala souvisle bez přerušování. To docílíme pozvolným zvyšováním teploty olejové lázně (zvyšováním nastavení teploty vařiče). debereme 9 frakcí, posledních 10 ml směsi nedestilujeme, vypneme ohřev a vyndáme aparaturu z rozehřáté olejové lázně. ikdy nedestilujeme do sucha!!! debrané frakce změříme na refraktometru a z přiložené kalibrační křivky (funkce) zjistíme složení jednotlivých frakcí. odnoty teplot varu a složení frakcí zapíšeme do tabulky. Zhotovíme graf závislosti teploty varu (y os) od složení frakcí destilátu (x os).
8 Kalibrační křivka (funkce) závislosti indexu lomu na koncentraci složek cyklohexanu a toluenu.
9 Úloha D Destilace za sníženého tlaku Mnohé organické látky nemůžeme destilovat při atmosférickém tlaku, protože se při teplotě bodu varu, případně i před dosažením této teploty, rozkládají. Destilace za sníženého tlaku (vakuová destilace) má ty výhody, že látka destiluje při nižší teplotě, kdy nedochází k jejímu rozkladu. Také se používá pro dělení látek o velmi vysoké teplotě varu, aby je vůbec bylo možné předestilovat. Používá se též pro separaci látek s malým rozdílem teplot varu, protože s klesajícím tlakem se tento rozdíl zvyšuje a separace je účinnější. Destilace za sníženého tlaku vyžaduje oproti jednoduché destilaci změny v aparatuře. a destilaci za sníženého tlaku se používají zásadně baňky s kulatým dnem resp. slzovitého nebo srdcovitého tvaru. Při destilaci docílíme sníženého tlaku tím, že destilační aparaturu připojíme na vhodný zdroj vakua. Zdrojem vakua jsou převážně vodní, membránové nebo olejové vývěvy. Vodní vývěva bývá nejčastěji skleněná a podtlak se dosahuje velkým průtokem vody v dýze. Při práci s vodní vývěvou musí být přívod vody úplně otevřený a po skončení práce se musí nejdřív do aparatury pustit vzduch a až potom se uzavírá přívod vody do vývěvy. Aparatura se vždy připojí k vývěvě přes pojistnou nádobu (např. promývačka). Cíl úlohy: Provést destilaci vybrané látky za sníženého tlaku. Určení teploty varu za daného tlaku. PRACVÍ PSTUP: Do kulaté baňky nebo hruškovité baňky o objemu 100 ml (Z 14) opatřené magnetickým míchadlem odměříme 40 ml vybrané kapalné látky. Baňku připojíme na předem poskládanou aparaturu na destilaci za sníženého tlaku. Použijeme destilační aparaturu límcovku s destilačním vemínkem na 3 frakce (3 baňky). Baňky, do kterých budeme jímat frakce, předem zvážíme. Všechny zábrusy aparatury na destilaci za sníženého tlaku namažeme silikonovou vazelínou nebo Ramsay tukem. Zapneme silnější míchání na magnetické míchačce a aparaturu připojíme přes pojistnou nádobu na vodní vývěvu. Změříme tlak v aparatuře (vyučující změří pomocí digitálního manometru). Z tlakově teplotního monografu zjistíme teplotu varu destilované látky při změřeném tlaku (vakuu) a pozvolna zahříváme na olejové lázni do varu. Destilát jímáme nejdřív do první baňky (předkap). Když se růst teploty v destilační aparatuře zastaví, přetočíme vemínkem a destilát jímáme do druhé baňky (hlavní podíl). Teplotu začátku destilace, při změně baňky zapisujeme. V případě, že teplota začne opět růst, přetočíme vemínkem a destilát jímáme do třetí baňky. Dbáme na to, aby směs destilovala souvisle bez přerušování. To docílíme pozvolným zvyšováním teploty olejové lázně (zvyšováním nastavení teploty vařiče). Destilaci zastavíme (vypneme zahřívání a sundáme olejovou lázeň) dříve než vydestiluje všechna kapalina z destilační baňky. ikdy nedestilujeme do sucha!!! Potom aparaturu zavzdušníme a můžeme vypnout vodu ve vývěvě. Jednotlivé frakce zvážíme a zapíšeme do tabulky společně s teplotami, při kterých destilovaly. Pozor - je třeba pečlivě dbát na to, aby se při vakuových destilacích používaly jenom kulaté baňky, neboť u baněk s rovným dnem je nebezpečí implose!!!
10 Tlakově teplotní nomograf.
11 Úloha E Separace kyselých a neutrálních sloučenin extrakcí Extrakce je jednou z nejdůležitějších metod pro separaci látek v chemii. Extrakce je proces, během kterého selektivně izolujeme (rozpouštíme) jednu nebo více složek směsi ve vhodném rozpouštědle. Extrahovat můžeme látky tuhé nebo kapalné. Extrakce látek z roztoků (ve většině případů vodných) je velmi důležitou a jednou ze základních operací v organické laboratoři. Extrakce je zejména efektivní v případě, pokud je jedna složka separované směsi chemicky převedena na její iontovou formu (sůl). Iontová forma je pak rozpustná ve vodní fázi a může být do ní vyextrahována. epolární organické látky zůstávají rozpuštěny v organické fázi. Separací fází můžeme tyto sloučeniny odseparovat. Iontové formy některých organických látek lze docílit jejich reakcemi s vodnými roztoky kyselin nebo zásad. Reakcí bazických organických aminů se zředěnými roztoky anorganických kyselin vznikají ve vodě rozpustné kationty (s kyselinou chlorovodíkovou např. hydrochloridy aminů) nebo reakcí organických kyselin s alkalickými hydroxidy zase ve vodě rozpustné anionty. Měřítkem průběhu acido-bazické reakce je relativní kyselost nebo zásaditost jednotlivých reaktantů a produktů. odnota pka je ve skutečnosti měřítkem síly kyselin. Silnější kyseliny mají nižší hodnoty pka a jejich konjugované zásady jsou podstatně slabší. pka = - log Ka Posun acido-bazické rovnováhy můžeme předpovědět na základě znalostí pka hodnot použitých kyselin. Silnější kyselina (menší hodnota pka) reaguje s konjugovanou bází slabší kyseliny (větší pka). apříklad reakcí kyseliny benzoové s hydroxidem sodným vzniká sodná sůl kyseliny benzoové a voda. odnota pka kyseliny benzoové je 4.2 a pka vzniklé vody je 16. Reakce je proto posunuta směrem vpravo. 2 pka = 4,2 pka = 16
12 Příklady hodnot pka některých látek. Kyselina Vzorec pka kyselina benzoová C 4,2 kyselina uhličitá 2 C 3 6,4 voda nitrofenol 2 7,1 4-terc-butylfenol 10,2 Dibenzalaceton --- Cíl úlohy: Separace neutrálních a kyselých látek s rozdílnou hodnotou pka pomocí extrakce. Směs pro separaci obsahuje 3 složky. PRACVÍ PSTUP: Směs látek A,B a C v terc-butylmetyletheru (25 ml) přelijeme do 100 ml dělící nálevky. 1. Krok: Přidáme 10 ml 5 % roztoku ac 3, dělící nálevku zazátkujeme, přetočíme s výpustním kohoutem šikmo nahoru a jemně protřepeme (2 3 sekundy). Kohoutem vypustíme vznikající oxid uhličitý a opět protřepeme. Tento proces opakujeme až do okamžiku, kdy se už žádný oxid uhličitý nevyvíjí. Poté směs můžeme protřepávat intenzivněji. Dělící nálevku uložíme do kruhu na stojanu a necháme fáze separovat. ddělíme vodnou vrstvu od organické a umístíme ji do 100 ml kádinky. Do organické fáze přidáme opět 10 ml 5 % roztoku ac 3 a protřepeme stejným způsobem. Fáze opět rozdělíme a vodnou přidáme do předchozí vodné a organickou protřepeme ještě jednou 10 ml 5 % roztoku ac 3. Provedeme celkem 3 třepání s roztokem ac 3. rganickou fázi pak protřepeme s 5 ml destilované vody a necháme oddělit. Pečlivě oddělíme fáze a vodnou připojíme k předchozím třem. Smíšené vodné fáze opatrně okyselíme 3 M roztokem kyseliny chlorovodíkové na p 3. Vypadlé krystaly odfiltrujeme na Büchnerově nálevce nebo skleněné fritě a vysušíme na Petriho misce. 2. Krok: rganickou fázi z 1. kroku nalijeme zpět do 100 ml dělící nálevky a přidáme 10 ml 2 % roztoku a. Dělící nálevku zazátkujeme, přetočíme s výpustním kohoutem šikmo nahoru a protřepeme (asi 15 sekund). Kohoutem vypustíme vznikající přetlak a opět protřepeme. Dělící nálevku uložíme do kruhu na stojanu a necháme fáze separovat. ddělíme vodnou vrstvu od organické a umístíme ji do 100 ml kádinky. Do organické fáze přidáme opět 10 ml 2 % roztoku a a protřepeme stejným způsobem. Fáze opět rozdělíme a vodnou přidáme do předchozí vodné a organickou protřepeme ještě jednou 10 ml 2 % roztoku a. Provedeme celkem 3 třepání s roztokem a. rganickou fázi pak protřepeme s 5 ml destilované vody a necháme oddělit. Pečlivě oddělíme fáze a vodnou připojíme k předchozím třem. Kádinku se smíšenými vodnými fázemi z 2. kroku položíme na vařič s regulací a ohřejeme na teplotu asi 60 C. Tato operace je potřebná na odstranění stop terc-butylmetyletheru, které by znemožnily následnou krystalizaci po
13 okyselení. Vyhřáté vodní fáze ochladíme v ledové lázni a okyselíme 3 M roztokem kyseliny chlorovodíkové na p 3. Vypadlé krystaly odfiltrujeme na Büchnerově nálevce nebo skleněné fritě a vysušíme na Petriho misce. 3. Krok: Zbylou organickou fázi vysušíme přídavkem bezvodého síranu sodného a necháme stát asi 5 minut. Po vysušení se filtrací přes skládaný papírový filtr zbavíme sušidla a surový produkt získáme zahuštěním (oddestilováním rozpouštědla) na rotační vakuové odparce. Čistý produkt získáme rekrystalizací z ethanolu. Diagram znázorňující separaci neutrálních a kyselých látek s rozdílnou hodnotou pka. Směs 3 látek (A, B a C) v terc-butylmetyletheru A B C 5 % roztok ac 3 EXTRAKCE 3 x vodná fáze organická fáze roztok Cl EXTRAKCE 3 x 2 % roztok a filtrát tuhá látka organická fáze vodná fáze FILTRACE Likvidace bezv. a 2 S 4 roztok tuhá látka DEKATACE 3 M roztok Cl tuhá látka filtrát FILTRACE Likvidace Likvidace tuhá látka odpařená kapalina DPAŘEÍ Likvidace
14 Úloha č. 1a Příprava isopentyl-acetátu ejzákladnější metodou přípravy esterů je Fischerova esterifikace katalyzovaná přídavkem minerální kyseliny. Isopentyl-acetát tj. isopentylester kyseliny octové je možné připravit z kyseliny octové a isopentylalkoholu vlivem kyseliny sírové za zvýšené teploty. 2 S 4 C M.h.: 60,05 C 5 12 M.h.: 88, S M.h.: 98,08 C M.h.: 130,18 PRACVÍ PSTUP: Do kulaté baňky o objemu 100 ml odměříme 0,45 molu kyseliny octové a 0,15 molu isopentylalkoholu. K této směsi pak po kapkách přidáme 0,04 molu koncentrované kyseliny sírové a varné kamínky. Reakční směs zahříváme do varu pod zpětným chladičem na olejové lázni 1 hodinu. Reakční směs potom ochladíme v ledové lázni a přeneseme do dělící nálevky. Směs protřepeme 2-krát ledovou vodou a 2-krát nasyceným roztokem hydrogenuhličitanu sodného. rganickou vrstvu vysušíme pevným bezvodým chloridem vápenatým nebo bezvodým síranem sodným. Po vysušení (stání několik minut) se filtrací přes buničitou vatu zbavíme sušidla a surový produkt předestilujeme za použití destilační aparatury (límcovky). Před destilací přidáme varné kamínky! Zachytáváme frakci vroucí při teplotě C. Změříme index lomu a stanovíme výtěžek.
15 Úloha č. 1b Příprava terc-butylchloridu Chloridy terciárních acyklických alkoholů se připravují působením koncentrované kyseliny chlorovodíkové na alkohol za laboratorní teploty. Cl Cl PRACVÍ PSTUP: C 4 10 M.h.: 74,12 Cl M.h.: 36,46 C 4 9 Cl M.h.:92,57 Do dělící nálevky o objemu 100 ml vneseme 0,2 molu terc-butylalkoholu a 50 ml koncentrované kyseliny chlorovodíkové. Pokud je terc-butylalkohol částečně zkrystalizovaný, rozpustíme ho předem mírným zahříváním na vodní lázni. Reakční směs protřepáváme v průběhu minut. Po každém protřepání uvolníme kohout dělící nálevky (asi v minutových intervalech)! Reakční směs necháme stát několik minut. Vzniklé vrstvy oddělíme. rganickou vrstvu promýváme 10 % roztokem hydrogenuhličitanu sodného do neutrální reakce. Surový produkt vysušíme pevným bezvodým chloridem vápenatým nebo bezvodým síranem sodným. Po vysušení (stání několik minut) se filtrací přes skládaný papírový filtr zbavíme sušidla a surový produkt předestilujeme za použití destilační aparatury (límcovky). Před destilací přidáme varné kamínky! Zachytáváme frakci vroucí při teplotě C. Změříme index lomu a stanovíme výtěžek.
16 Úloha č. 1d Příprava ethyl-formiátu Při esterifikaci kyseliny mravenčí nelze použít minerální kyselinu jako katalyzátor (rozklad C). V tomto případě není nutný přídavek katalyzátoru, protože kyselina mravenčí je relativně silná kyselina a působí sama jako katalyzátor. Rovnováha reakce se posouvá doprava pouze přídavkem bezvodého chloridu vápenatého, který slouží k vyvázání vznikající vody v průběhu reakce. CaCl 2 C 2 2 M.h.: 46,03 C 2 6 M.h.: 46,07 CaCl 2 M.h.: 110,98 C M.h.: 74,08 PRACVÍ PSTUP: Do kulaté baňky o objemu 100 ml se zábrusem Z 14 opatřené magnetickým míchadlem navážíme 5,0 g chloridu vápenatého a přidáme 0,55 molu kyseliny mravenčí a 0,4 molu ethanolu. Baňku připojíme na předem poskládanou aparaturu na destilaci za sníženého tlaku. Použijeme destilační aparaturu límcovku s destilačním vemínkem na 3 frakce (3 baňky). Směs zahříváme na olejové lázni za míchání na magnetické míchačce. Teplota oleje by se měla pohybovat v rozmezí C. Zahříváme 1,5-2 hodiny a jímáme destilující produkt. Destilát přelijeme do dělící nálevky a protřepáváme s 10 ml nasyceného roztoku hydrogenuhličitanu sodného a 2 x 10 ml vody. rganickou vrstvu vysušíme malým množstvím bezvodého síranu sodného nebo hořečnatého. Změříme index lomu a stanovíme výtěžek.
17 Úloha č. 1e Příprava isobutyl-propanoátu Isobutyl-propanoát tj. isobutylester kyseliny propanové je možné připravit z kyseliny propanové a isobutylalkoholu vlivem kyseliny sírové za zvýšené teploty. 2 S 4 C M.h.: 74,08 C 4 10 M.h.: 74, S M.h.: 98,08 C M.h.: 130,18 PRACVÍ PSTUP: Do kulaté baňky o objemu 100 ml odměříme 0,175 molu kyseliny propanové a 0,135 molu isobutylalkoholu. K roztoku po kapkách přidáme 0,04 molu koncentrované kyseliny sírové a poté vložíme varné kamínky. Reakční směs zahříváme do varu pod zpětným chladičem na olejové lázni 1 hodinu, následně ochladíme v ledové lázni a přeneseme do dělící nálevky. rganickou vrstvu protřepeme 2-krát ledovou vodou a 2-krát nasyceným roztokem hydrogenuhličitanu sodného a nakonec vysušíme pevným bezvodým chloridem vápenatým nebo bezvodým síranem sodným. Po vysušení (stání několik minut) se filtrací přes buničitou vatu zbavíme sušidla a surový produkt předestilujeme za použití destilační aparatury (límcovky). Před destilací přidáme varné kamínky! Teplota varu isobutyl-propanoátu je 137 C. Z destilátu změříme index lomu a stanovíme výtěžek.
18 Úloha č. 2a Příprava acetaminofenu Acetaminofen neboli paracetamol je dobře znám jako léčivo s analgetickým a antipyretickým účinkem. Acetaminofen se připravuje reakcí 4-aminofenolu s anhydridem kyseliny octové. 2 2 C 6 7 M.h.:109,13 PRACVÍ PSTUP: C M.h.:102,09 C M.h.:151,16 V Erlenmeyerově baňce o objemu 25 ml suspendujeme 0,04 molu 4-aminofenolu v 10 ml destilované vody a za intenzivního míchání pomalu přidáváme 0,044 molu anhydridu kyseliny octové. Po rozpuštění 4-aminofenolu reakční směs ochladíme v ledové lázni a necháme v ní stát několik minut. Vypadlé krystaly produktu odsajeme na Büchnerově nálevce nebo skleněné fritě a důkladně promyjeme vodou. Čistý paracetamol získáme rekrystalizací z vody za použití malého množství aktivního uhlí. Změříme teplotu tání a stanovíme výtěžek.
19 Úloha č. 2c Příprava antzschova esteru (diethylesteru kyseliny 1,4-dihydro-2,6- dimethylpyridin-3,5-dikarboxylové) Tato reakce je příkladem bezrozpouštědlové antzschovy syntézy. C 3 C C 3 C Dochází při ní k reakci aldehydu (formaldehydu, který se generuje in situ z hexamethylentetraminu MTA) se dvěma molekulami esteru β-ketokyseliny (acetoctanu ethylnatého) za vzniku alkylidenbisacetoctanu, který pak působením amoniaku kondenzuje za vzniku 1,4- dihydropyridinového cyklu, jenž lze následně oxidovat až na samotný pyridin např. zředěnou 3 a dále chemicky modifikovat. 1,4-Dihydropyridinový cyklus je základním strukturním fragmentem celé skupiny vazodilatačních látek, tzv. blokátorů vápníkových kanálů dihydropyridinového typu, které mají uplatnění např. v léčbě hypertenze a anginy pectoris. V organické syntéze se dihydropyridiny používají např. jako redukční činidla. C 3 C 4 zahřívání C M.h.: 130,14 PRACVÍ PSTUP: C M.h.: 140,19 C M.h.: 77,08 C M.h.: 253,29 Pracujeme v digestoři!!! Do kulaté baňky o objemu 50 ml s efektivním magnetickým míchadlem a zpětným chladičem navážíme 0,02 molu ethyl-acetocetátu, 0,008 molu hexamethylentetraminu a 0,01 molu octanu amonného a postupně zahříváme na olejové lázni s nastavenou teplotou plotýnky cca na 250 ºC. Velmi rychle lze během vzestupu teploty pozorovat změnu zbarvení směsi od bílé přes žlutou až k oranžové. Právě v této chvíli je nutné celou aparaturu z lázně vytáhnout a nechat ochladit, jinak dochází k rozkladu vzniklého esteru a nadměrnému vývinu amoniaku a formaldehydu. Po zchlazení na pokojovou teplotu se ztuhlá směs zfiltruje na skleněné fritě, důkladně promyje ethanolem a žluté krystalky se vysuší ve vakuu. Změříme teplotu tání a stanovíme výtěžek.
20 Úloha č. 3a - c Příprava benzilu Benzil se připravuje oxidací benzoinu pomocí vhodného oxidačního činidla. Metoda A (3a) Benzil je možné připravit reakcí benzoinu s koncentrovanou kyselinou dusičnou C C M.h.: 212,24 PRACVÍ PSTUP: 3 M.h.: 63,01 C M.h.: 210,23 Pracujeme v digestoři!!! Do kulaté baňky o objemu 100 ml umístíme 0,023 molu benzoinu a 25 ml koncentrované kyseliny dusičné. Reakční směs zahříváme na vroucí vodní lázni za občasného míchání až do okamžiku, kdy se žádné hnědé oxidy dusíku již nevyvíjejí (přibližně 1 hodinu). Vypneme zahřívání a obsah baňky nalijeme do 100 ml studené vody. Směs mícháme skleněnou tyčinkou dokud vyloučený olejovitý benzil úplně neztuhne. Produkt odsajeme na Büchnerově nálevce nebo skleněné fritě a důkladně promyjeme vodou. Čistý benzil získáme rekrystalizací z ethanolu resp. methanolu. Změříme teplotu tání a stanovíme výtěžek. Metoda B (3b) Benzil je možné taky připravit oxidací benzoinu síranem mědnatým v pyridinu. CuS pyridin C M.h.: 212,24 PRACVÍ PSTUP: Cu 10 9 S M.h.: 249,69 C M.h.: 210,23 Pracujeme v digestoři!!! Do kulaté baňky o objemu 100 ml umístíme 0,05 molu jemně rozetřeného pentahydrátu síranu měďnatého, 7,6 ml vody a 15 ml pyridinu a směs zahříváme pod zpětným chladičem v olejové lázni do rozpuštění. Potom přidáme 0,023 molu benzoinu a reakční
21 směs dál zahříváme do varu v olejové lázni 1 až 2 hodiny. Modrá barva roztoku se změní na zelenou a vylučuje se olejovitá vrstva produktu. Po ochlazení vylijeme obsah baňky do 200 ml studené vody a mícháme skleněnou tyčinkou, dokud vyloučený olejovitý benzil úplně neztuhne. Produkt odsajeme na Büchnerově nálevce nebo skleněné fritě, promyjeme zředěnou kyselinou chlorovodíkovou (5 %) a důkladně vodou. Čistý benzil získáme rekrystalizací z ethanolu resp. methanolu. Změříme teplotu tání a stanovíme výtěžek. Metoda C (3c) Tato metoda je jedna z nejekologičtějších oxidačních procesů ( green technologie ) vůbec. xidace benzoinu na benzil je založena na principu regenerace oxidačního činidla, tedy měďnatých kationtů dusičnanem amonným v kyselém prostředí. Při této metodě se proto používá pouze katalytické množství octanu měďnatého. C M.h.: 212,24 C M.h.: 210,23 (C 3 C) 2 Cu Cu 2+ Cu + C 4 6 Cu 4 M.h.: 181, M.h.: 80,04 PRACVÍ PSTUP: Pracujeme v digestoři!!! Do kulaté baňky o objemu 50 ml opatřené magnetickým míchadlem umístíme 0,01 molu benzoinu, 0,015 molu dusičnanu amonného, 6 ml kyseliny octové a 1 ml roztoku octanu měďnatého. Reakční směs mícháme (magneticky) a zahříváme pod zpětným chladičem na olejové lázni asi 1 hodinu. Vypneme zahřívání a obsah baňky nalijeme do 50 g směsi led-voda. Směs mícháme skleněnou tyčinkou pro navození krystalizace a homogenizaci vypadlého benzilu. Produkt odsajeme na Büchnerově nálevce nebo skleněné fritě a důkladně promyjeme vodou. Čistý benzil získáme rekrystalizací z ethanolu resp. methanolu. Změříme teplotu tání a stanovíme výtěžek.
22 Úloha č. 3d Benzoinová kondenzace příprava benzoinu katalyzovaná thiaminem Aromatické aldehydy podléhají za přítomnosti alkalického kyanidu kondenzaci za vzniku α-hydroxyketonů (benzoinů). Alkalický kyanid je možné nahradit netoxickým thiaminem, který katalyzuje obdobnou reakci. 2 S Cl a, C 3 C 2, 2 C 7 6 M.h.: 106,12 PRACVÍ PSTUP: C Cl 4 S M.h.: 300,81 C M.h.: 212,24 Do baňky o objemu 50 ml navážíme 0,5 g thiaminu hydrochloridu a k němu přidáme 1,0 ml vody. Po rozpuštění přidáme 5 ml ethanolu a promícháme. Směs ochladíme v ledové lázni a k tomuto roztoku přidáme 1 ml 3M roztoku hydroxidu sodného tak, aby teplota reakční směsi nepřevýšila 20 C. Barva roztoku se během přikapávání mění na intenzivně žlutou, po přidání celého množství se po promíchání ustálí na světle žlutou. Do reakční směsi přidáme 0,019 molu benzaldehydu a směs zahříváme na olejové lázni k mírnému varu pod zpětným chladičem 1,5 2 hodiny. Směs ochladíme v ledové lázni ke krystalizaci. Jestliže látka nekrystalizuje, inicializujeme krystalizaci třením skleněnou tyčinkou o dno baňky. Krystalizaci je též možno urychlit přidáním 1 ml vody. Vypadlé krystaly odsajeme na skleněné fritě a necháme vysušit. Změříme teplotu tání a stanovíme výtěžek.
23 Úloha č. 4a Příprava dibenzalacetonu Dibenzalaceton se připravuje bazicky katalyzovanou aldolovou kondenzací benzaldehydu s acetonem. a 2, C 3 C 2 C 7 6 M.h.: 106,12 C 3 6 M.h.: 58,08 a M.h.: 40,00 C M.h.: 234,29 PRACVÍ PSTUP: V kádince o objemu 150 ml rozpustíme 0,025 molu a ve 20 ml destilované vody a ochladíme na laboratorní teplotu. Za míchání přidáme 0,0567 molu benzaldehydu rozpuštěného ve 40 ml ethanolu. Pak za míchání pomalu přidáme pipetou 0,027 molu acetonu. ejprve vzniká žlutý roztok a několik minut po přidání celého množství acetonu vypadne hustá žlutá sraženina. Reakční směs mícháme ještě 20 minut a přidáme 40 ml vody. Promícháme a produkt odsajeme na Büchnerově nálevce nebo skleněné fritě, promyjeme 50 ml vody, aby se odstranil přebytečný a. Surový produkt přečistíme krystalizací z vroucího ethanolu. Látku rozpustíme ve vroucím ethanolu (asi 25 ml), za varu do roztoku přidáme 4 ml destilované vody a směs zchladíme nejprve studenou vodou a pak v ledové lázni. Vyloučené krystaly odsajeme na Büchnerově nálevce nebo skleněné fritě a promyjeme 80 % ethanolem vychlazeným v ledové lázni. echáme prosávat vzduchem a dosušíme na Petriho misce. Produkt je jasně žlutá krystalická látka. Změříme teplotu tání a stanovíme výtěžek.
24 Úloha č. 4b Příprava cyklohexanonoximu Cyklohexanonoxim se připravuje kondenzací cyklohexanu s hydroxylamonium chloridem v přítomnosti octanu sodného. 2.Cl C 3 Ca 2 C 6 10 M.h.: 98,14 Cl 4 M.h.: 69,49 C 2 3 a 2 M.h.: 82,03 C 6 11 M.h.: 113,16 PRACVÍ PSTUP: Do Erlenmayerovy baňky o objemu 100 ml navážíme 0,05 molu hydroxylamonium chloridu a 0,05 molu octanu sodného. Látky rozpustíme přidáním 15 ml vody. K tomuto roztoku přidáváme pozvolna 0,035 molu cyklohexanonu. Cyklohexanon přidáváme postupně (naráz max. 0,5 ml) za neustálého míchání tak, aby teplota reakční směsi nepřevýšila C, V případě dosáhnutí této teploty přerušíme přidávání cyklohexanonu a směs ochladíme ve vodní lázni. Po přidání celého množství cyklohexanonu necháme směs reagovat za míchání ještě 15 minut. Vykrystalizovaný surový produkt izolujeme filtrací přes skleněnou fritu a promyjeme malým množstvím vychlazené vody. Po krátkém prosátí na fritě přeneseme surový produkt do varné baňky, přidáme 8-10 ml ethanolu a zahříváme pod zpětným chladičem k varu. K horkému roztoku přidáme přes chladič postupně ml vody. Jestliže vznikne zákal, který se nerozpustí ani při varu, přidáme 1 ml ethanolu. Vzniklý roztok za horka přelijeme do kádinky (v případě mechanických nečistot za horka zfiltrujeme) a zchladíme v ledové lázni. Vyloučené krystaly odsajeme na skleněné fritě a promyjeme malým množstvím (asi 5 ml) vychlazeného 25 % ethanolu. echáme prosávat vzduchem a dosušíme na Petriho misce. Produkt je bílá krystalická látka. Změříme teplotu tání a stanovíme výtěžek.
25 Úloha č. 5 Příprava 2-nitrofenolu a 4-nitrofenolu Fenol můžeme nitrovat už zředěnou kyselnou dusičnou, přičemž vzniká směs 2-nitrofenolu a 4- nitrofenolu. Tuto směs je možné rozdělit pomocí destilace s vodní párou. 2-itrofenol neboli orthoisomer vydestiluje s vodní párou z reakční směsi v téměř čistém stavu a 4-nitrofenol neboli paraisomer zůstane v destilační baňce C 6 6 M.h.: 94,11 3 M.h.: 63,01 C M.h.: 139,11 C M.h.: 139,11 PRACVÍ PSTUP: Pracujeme v digestoři!!! Do kádinky o objemu 25 nebo 50 ml navážíme 0,05 molu fenolu 1 a zkapalníme zahřátím v teplé vodní lázni. Pak do ní přidáme 1 ml destilované vody pro zabránění zpětné krystalizace fenolu. Do kulaté baňky o objemu 100 ml opatřené magnetickým míchadlem a teploměrem odměříme 20 ml vody, ke které přidáme 7,5 ml koncentrované kyseliny dusičné. Do takto připravené zředěné kyseliny dusičné za míchání z kádinky pomalu přidáme malé množství fenolu (asi 1 ml). Reakční směs se zahřeje a ztmavne. Přidáváme pozvolna zbylý fenol takovou rychlostí, aby se teplota reakční směsi pohybovala v rozmezí C. Po přidání celého množství fenolu reakční směs mícháme ještě 5 min a obsah baňky ochladíme v ledové lázni. Vzniklou vychlazenou pryskyřičnatou hmotu zalijeme 50 ml ledové destilované vody. Vodu pak slijeme a promytí ještě jednou zopakujeme. Připravenou směs nitrofenolů podrobíme destilaci s vodní párou. Aparaturu na destilaci s vodní párou sestavíme podle nákresu. Do vyvíječe vodní páry (Erlenmeyerova baňka s nástavcem a pojistnou trubičkou) naléváme horkou vodu. Vyvíječ páry umístíme na vařič s regulací a připravenou směs nitrofenolů v reakční baňce probubláváme vodní párou. 2-itrofenol destiluje s vodní párou a kondenzuje v chladiči. V případě, že 2-nitrofenol ztuhne v chladiči uzavřeme přívod chladící vody do chladiče na dobu potřebnou k jeho roztání a pak ji opět otevřeme. Destilaci ukončíme, když už žádný 2-nitrofenol nedestiluje (destiluje pouze čistá voda). Destilát, který jsme jímali do kádinky, zchladíme v ledové lázni. Vypadlý produkt odsajeme na Büchnerově nálevce nebo skleněné fritě, promyjeme 50 ml vody. Surový 2-nitrofenol přečistíme krystalizací z 50 % ethanolu. Ke zbytku v destilační baňce přidáme aktivní uhlí, zahřejeme do varu a zfiltrujeme přes skládaný filtr. Po ochlazení vykrystalizuje z filtrátu 4-nitrofenol, který odsajeme na Büchnerově nálevce nebo skleněné fritě a promyjeme malým množstvím vody. 4-itrofenol rekrystalizujeme z 2 % kyseliny chlorovodíkové s přídavkem aktivního uhlí. Stanovíme teploty tání a výtěžek obou nitrofenolů. 1 Pozor fenol je žíravina!!!
26 Destilace s vodní párou Rovnovážný tlak par nad směsí dvou nemísitelných kapalin se rovná součtu rovnovážných tlaků par nad izolovanými fázemi (Daltonův zákon). Důsledkem toho je, že teplota varu směsi dvou vzájemně nemísitelných kapalin je nižší než teplota varu níževroucí složky. Tohoto jevu se využívá při destilaci s vodní párou. Protože jednou z kapalin je voda, destilace s vodní párou umožňuje za atmosférického tlaku oddělit výševroucí složku při teplotě nižší než 100 C. Tato destilace se provádí tak, že ke dnu destilační nádoby (baňky) se směsí látek s vodou se trubicí přivádí vodní pára. Pára vytvořená varem vody v tzv. vyvíječi vodní páry ohřívá a současně promíchává (probublává) obsah destilační baňky a unáší destilovanou látku do chladiče. Destilujeme tak dlouho, dokud je destilát heterogenní. Destilace s vodní párou se používá většinou k separaci a čištění látek s vysokou teplotou varu za atmosférického tlaku, které nejsou mísitelné s vodou.
27 Úloha č. 6a Cannizzarova reakce Aldehydy a ketony obsahující vodíky v α poloze vzhledem ke karbonylové skupině vlivem vodných alkalických bází podléhají aldolové kondenzaci. V případě, že aldehydy tyto vodíky neobsahují, reagují vlivem vodných alkalických bází tzv. disproporcionálně tj. polovina aldehydu se redukuje na příslušný alkohol a druhá polovina se oxiduje na karboxylovou kyselinu. Tato reakce se nazývá Cannizzarova reakce a probíhá specifickým mechanizmem. Příprava kyseliny 4-nitrobenzoové a 4-nitrobenzylalkoholu. 4-itrobenzaldehyd je aromatický aldehyd neobsahující vodíky v α poloze. Cannizzarova reakce 4- nitrobenzaldehydu probíhá v porovnání s nesubstituovaným benzaldehydem za mírných podmínek (laboratorní teplota). Vzniká směs alkalické soli kyseliny 4-nitrobenzoové a 4-nitrobenzylalkoholu. Směs těchto produktů lze rozdělit extrakcí, kdy se do organického rozpouštědla extrahuje pouze 4- nitrobenzylalkohol a sůl kyseliny 4-nitrobenzoové zůstává ve vodné fázi. Kyselinu pak z vodné fáze vysrážíme působením kyseliny chlorovodíkové. K C M.h.:151,12 K M.h.: 56,11 C M.h.:167,12 C M.h.:153,14 PRACVÍ PSTUP: Do kulaté baňky o objemu 100 ml opatřené magnetickým míchadlem umístíme 0,02 molu 4- nitrobenzaldehydu a 30 ml 30 % roztoku hydroxidu draselného. S roztokem hydroxidu draselného se snažíme smýt veškerý 4-nitrobenzaldehyd ze stěn reakční baňky. Reakční směs mícháme asi 30 minut a pak přidáme 40 ml destilované vody a 10 ml dichlormethanu. Směs přelijeme do dělící nálevky a oddělíme organickou a vodnou vrstvu. Vodnou vrstvu protřepeme s 10 ml dichlormethanu. Spojené organické fáze protřepeme s 20 ml destilované vody a vysušíme bezvodým síranem sodným. Po vysušení (stání několik minut) se filtrací přes skládaný papírový filtr zbavíme sušidla a surový produkt získáme zahuštěním (oddestilováním rozpouštědla) na rotační vakuové odparce na objem přibližne 10 ml. Do zahuštěného roztoku produktu přidáme 20 ml petroletheru a mícháme skleněnou tyčinkou pro navození krystalizace. Směs pak ochladíme v ledové lázni po dobu asi 5 minut a vykrystalizovaný 4-nitrobenzylalkohol odsajeme na Büchnerově nálevce nebo skleněné fritě a promyjeme malým množstvím petroletheru. K vodné vrstvě přidáme 30 ml 6M kyseliny chlorovodíkové a ochladíme v ledové lázni po dobu asi 5 minut. Vysráženou kyselinu 4-nitrobenzoovou odsajeme na Büchnerově nálevce nebo skleněné fritě a promyjeme malým množstvím ledové vody. Čistou kyselinu 4-nitrobenzoovou získáme rekrystalizací z methanolu (asi 30 ml). Změříme teplotu tání obou látek a stanovíme výtěžek.
28 Úloha č. 6b Diels-Alderova reakce maleinanhydridu s anthracenem Diels-Alderovy reakce jsou [4 + 2] cykloadice elektronově chudých alkenů nebo alkynů s elektronově bohatými dieny. avzdory skutečnosti, že anthracen je aromatický uhlovodík, jeho střední kruh může reagovat jako dien. Reaguje proto s maleinanhydridem jako dienofilem ve vroucím xylenu za vzniku adiční sloučeniny anhydridu kyseliny 9,10-dihydroanthracen-9,10- jantarové. xylen 140 C C M.h.: 178,23 PRACVÍ PSTUP: C M.h.: 98,06 C M.h.: 276,29 Pracujeme v digestoři!!! Do kulaté baňky o objemu 25 ml umístíme 0,003 molu anthracenu, 0,003 molu maleinanhydridu, 7 ml xylenu a varné kamínky. Reakční směs zahříváme do varu pod zpětným chladičem na olejové lázni asi 30 minut. Vypneme zahřívání a reakční směs ochladíme ve vodní lázni na laboratorní teplotu a pak v ledové lázni po dobu 5 minut. Vykrystalizovaný produkt odsajeme na Büchnerově nálevce nebo skleněné fritě a promyjeme malým množstvím vychlazeného xylenu. Čistý produkt tj. anhydrid kyseliny 9,10-dihydroanthracen-9,10- jantarové získáme rekrystalizací z xylenu. Změříme teplotu tání a stanovíme výtěžek.
29 Úloha č. 6c Příprava kyseliny 2-jodbenzoové Kyselina 2-jodbenzoová se připravuje diazotací kyseliny 2-aminobenzoové a následnou Sandmeyerovou reakcí s alkalickým jodidem. C a 2 C KI C 2 Cl, 2. Cl 2 I C Mol. Wt.: 137,14 C 7 5 Cl Mol. Wt.: 184,58 C 7 5 I 2 Mol. Wt.: 248,02 PRACVÍ PSTUP: Do kádinky o objemu 150 ml navážíme 0,015 molu kyseliny 2-aminobenzoové a k němu přidáme 22,0 ml vody a 8,0 ml 35 % kyseliny chlorovodíkové. Směs zahříváme, dokud nevznikne čirý roztok. Po rozpuštění roztok ochladíme v lázni z ledu a soli na teplotu 0 2 C. Při ochlazení můžou vypadávat krystalky. K této směsi přidáváme po malých částech roztok 0,015 molu dusitanu sodného rozpuštěného v 10 ml vody. Teplota reakční směsi nesmí přesáhnout 5 C. Vzniklý roztok necháme za chlazení stát 5 minut a poté pomalu přidáme roztok 0,015 molu jodidu draselného v 10 ml vody. Vznikne hnědá suspenze. Směs necháme bez chlazení stát 10 minut a poté ji ve vodní lázni pomalu zahřejeme na 40 C. Směs udržujeme při teplotě C po dobu 10 minut. Pak směs zahřejeme na C a opět udržujeme při této teplotě 10 minut. Vzniklou suspenzi ochladíme v ledové lázni, přidáme několik krystalků thiosíranu sodného, promícháme a vyloučené krystaly odsajeme na skleněné fritě a promyjeme ml vody. Po krátkém prosátí vzduchem přeneseme látku do baňky o objemu 50 ml, přidáme 20 ml ethanolu a zahřejeme k varu. Přidáme malé množství aktivního uhlí a po 5 minutách horký roztok přefiltrujeme. K filtrátu po částech a za míchání přidáme 25 ml vody a vychladíme v ledové lázni. Produkt odsajeme na skleněné fritě a promyjeme vodou. Produkt vysušíme, změříme teplotu tání a stanovíme výtěžek.
30 Úloha č. 7a Příprava luminolu test chemiluminiscence Příprava luminolu Luminol se připravuje dvoustupňovou reakcí z kyseliny 3-nitroftalové. Prvním krokem je cyklizace s hydrazinem za vysoké teploty. Ve druhém kroku se nitroskupina 3-nitroftalhydrazidu redukuje na aminoskupinu vlivem dithioničitanu sodného v alkalickém prostředí a 2 S 2 4 a, 2 C M.h.: 211, M.h.: 32,05 C M.h.: 207,14 a 2 4 S 2 M.h.: 174,11 C M.h.: 177,16 PRACVÍ PSTUP: Pracujeme v digestoři!!! 1. Krok: Předem si zahřejeme pískovou lázeň na 200 C. Do tlustostěnné zkumavky délky cm vneseme 0,0024 molu kyseliny 3-nitroftalové, 2 ml 1,2-propandiolu, 0,5 ml 20 % roztoku hydrazinu 2 a varné kamínky. Do zkumavky umístíme teploměr a spolu je umístíme do předehřáté (na 200 C) pískové lázně. Reakční směs zahříváme na 150 C (s teploměrem ve zkumavce) po dobu 15 minut. Potom zkumavku vyndáme z lázně a necháme zchladit na 100 C. Přidáme 3 ml horké destilované vody. Zkumavku pak chladíme v ledové lázni po dobu 5 minut. Vykrystalizovaný cyklický produkt odsajeme na Büchnerově nálevce nebo skleněné fritě a promyjeme 2 ml ledové vody. Připravený 3-nitroftalhydrazid použijeme v dalším kroku bez nutnosti rekrystalizace. 2. Krok: Do tlustostěnné zkoumavky délky cm vneseme připravený 3-nitroftalhydrazid a 3 ml 5 % roztoku a. Pak přidáme 0,0057 molu dithioničitanu sodného a směs zahříváme do varu po dobu 3 minut v pískové lázni. Potom zkumavku vyndáme z lázně a přidáme 1 ml koncentrované kyseliny octové a promícháme. Zkumavku pak chladíme v ledové lázni po dobu 5 minut. Vykrystalizovaný luminol odsajeme na Büchnerově nálevce nebo skleněné fritě a promyjeme 2 ml ledové vody. 2 Pozor hydrazin je toxický a karcinogenní!!!
31 Test chemiluminiscence Molekuly sloučenin absorbující energii mohou tuto energii předat jiným částicím při vzájemných kolizích nebo mohou emitovat luminiscenční záření. Podle způsobu přijetí energie rozdělujeme tento jev tzv. luminiscenci na tyto základní kategorie: - Fotoluminiscence - látka absorbovala energii ve formě světelných kvant, - Chemiluminiscence - energie byla látce dodána chemickou reakcí, - Bioluminiscence - energie byla dodána biologickými pochody, - Elektroluminiscence - energie byla dodána působením elektrického pole. Teorii fluorescenčních a fosforescenčních jevů popisuje zobecněný Jablonského diagram. S 2 Zářivé přechody: A - absorpce (~10-15 s) F - fluorescence ( s) P - fosforescence ( s) Excitovaný singletový stav VR S Vibrační energetické hladiny IC Excitovaný singletový stav VR F F DF ISC Excitovaný tripletový stav T 1 ezářivé přechody: A VR - vibrační relaxace ( s) IC - vnitřní konverze ( s) ISC - mezisystémová konverze RR - neradiační relaxace Q - zhášení DF - zpožděná fluorescence A Q RR RR P S Základní stav Schéma zářivých a nezářivých přechodů fotoluminiscentní molekuly - Jablonského diagram Většina exotermických reakcí uvolňuje energii ve formě tepla. V některých případech se uvolňuje energie ve formě světla. Takový proces se nazývá chemiluminiscence. Je to reverzní forma fotochemické reakce. Luminol poskytuje vlivem hydroxidu sodného dianion, který působením peroxidu vodíku katalyzované ionty železa přechází na dianion kyseliny 3-aminoftalové v excitovaném tripletovém stavu. Dianion v tripletovém stavu přechází mezisystémovou konverzí (ISC) na singletový, který vyzářením modro-bílého světla přejde na dianion kyseliny 3-aminoftalové v základním stavu. Celý proces je graficky znázorněn na schématu.
32 a 2 2 K 3 Fe(C) ISC h Rovněž můžeme proces luminiscence popsat energetickým diagramem. Vzniklý dianion kyseliny 3-aminoftalové v excitovaném tripletovém stavu T 1 může v přítomnosti vhodného zhášeče odevzdat svoji energii zhášeči, který se dostane do excitovaného tripletového stavu T 1. Ten pak přechází mezisystémovou konverzí (ISC) na singletový, který vyzářením světla o jiné vlnové délce než samotný luminol přejde na látku v základním stavu E n e r g i e LUM M extinovaný singletový stav A F ISC LUM M T 1 přenos energie Q LUM M T 1 - zhašeč ISC F LUM M extinovaný singletový stav zhášeče P LUM M základní stav základní stav zhášeče LUM M
LABORATORNÍ PRÁCE č.2
 LABORATORNÍ PRÁCE č.2 Téma: Dělení směsí II Úkol č.1: Destilace směsi manganistan draselný voda Teorie: Jedná se o jeden z nejdůležitějších způsobů oddělování složek kapalných směsí a jejich čištění. Složky
LABORATORNÍ PRÁCE č.2 Téma: Dělení směsí II Úkol č.1: Destilace směsi manganistan draselný voda Teorie: Jedná se o jeden z nejdůležitějších způsobů oddělování složek kapalných směsí a jejich čištění. Složky
RUŠENÁ KRYSTALIZACE A SUBLIMACE
 LABORATORNÍ PRÁCE Č. 5 RUŠENÁ KRYSTALIZACE A SUBLIMACE KRYSTALIZACE PRINCIP Krystalizace je důležitý postup při získávání čistých tuhých látek z jejich roztoků. Tuhá látka se rozpustí ve vhodném rozpouštědle.
LABORATORNÍ PRÁCE Č. 5 RUŠENÁ KRYSTALIZACE A SUBLIMACE KRYSTALIZACE PRINCIP Krystalizace je důležitý postup při získávání čistých tuhých látek z jejich roztoků. Tuhá látka se rozpustí ve vhodném rozpouštědle.
METODY ČIŠTĚNÍ ORGANICKÝCH LÁTEK
 METODY ČIŠTĚNÍ ORGANICKÝCH LÁTEK Chemické sloučeniny se připravují z jiných chemických sloučenin. Tento děj se nazývá chemická reakce, kdy z výchozích látek (reaktantů) vznikají nové látky (produkty).
METODY ČIŠTĚNÍ ORGANICKÝCH LÁTEK Chemické sloučeniny se připravují z jiných chemických sloučenin. Tento děj se nazývá chemická reakce, kdy z výchozích látek (reaktantů) vznikají nové látky (produkty).
Úloha č. 1 Příprava nifedipinu
 Úloha č. 1 Příprava nifedipinu Do kulaté baňky o objemu 50 ml předložíme 4 mmol 2-nitrobenzaldehydu, 9 mmol methylacetacetátu, 1,2 ml 25% NH 4 OH a 1 ml methanolu. Na baňku nasadíme zpětný chladič a umístíme
Úloha č. 1 Příprava nifedipinu Do kulaté baňky o objemu 50 ml předložíme 4 mmol 2-nitrobenzaldehydu, 9 mmol methylacetacetátu, 1,2 ml 25% NH 4 OH a 1 ml methanolu. Na baňku nasadíme zpětný chladič a umístíme
Laboratorní cvičení z kinetiky chemických reakcí
 Laboratorní cvičení z kinetiky chemických reakcí LABORATORNÍ CVIČENÍ 1. Téma: Ovlivňování průběhu reakce změnou koncentrace látek. podmínek průběhu reakce. Jednou z nich je změna koncentrace výchozích
Laboratorní cvičení z kinetiky chemických reakcí LABORATORNÍ CVIČENÍ 1. Téma: Ovlivňování průběhu reakce změnou koncentrace látek. podmínek průběhu reakce. Jednou z nich je změna koncentrace výchozích
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 10 Bílkoviny Pro potřeby projektu
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 10 Bílkoviny Pro potřeby projektu
C3070 Organická chemie - laboratorní cvičení molekulární biologie
 Seznam úloh předmětu: C3070 Organická chemie - laboratorní cvičení molekulární biologie 3) Nitrace fenolu 5) Ethylenacetal ethylesteru 3-oxobutanové kyseliny 10) Kyselina benzoová 11) Kyselina anthranilová
Seznam úloh předmětu: C3070 Organická chemie - laboratorní cvičení molekulární biologie 3) Nitrace fenolu 5) Ethylenacetal ethylesteru 3-oxobutanové kyseliny 10) Kyselina benzoová 11) Kyselina anthranilová
DĚLÍCÍ METODY. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: 28. 5. 2012. Ročník: osmý. Vzdělávací oblast: Člověk a příroda / Chemie / Směsi
 Autor: Mgr. Stanislava Bubíková DĚLÍCÍ METODY Datum (období) tvorby: 28. 5. 2012 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Směsi 1 Anotace: Žáci se seznámí s nejčastěji používanými separačními
Autor: Mgr. Stanislava Bubíková DĚLÍCÍ METODY Datum (období) tvorby: 28. 5. 2012 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Směsi 1 Anotace: Žáci se seznámí s nejčastěji používanými separačními
KARBOXYLOVÉ KYSELINY
 LABORATORNÍ PRÁCE Č. 28 KARBOXYLOVÉ KYSELINY PRINCIP Karboxylové kyseliny jsou látky, které ve své molekule obsahují jednu nebo více karboxylových skupin. Odvozují se od nich dva typy derivátů, substituční
LABORATORNÍ PRÁCE Č. 28 KARBOXYLOVÉ KYSELINY PRINCIP Karboxylové kyseliny jsou látky, které ve své molekule obsahují jednu nebo více karboxylových skupin. Odvozují se od nich dva typy derivátů, substituční
Inovace bakalářského studijního oboru Aplikovaná chemie CZ.1.07/2.2.00/15.0247
 Papírová a tenkovrstvá chromatografie Jednou z nejrozšířenějších analytických metod je bezesporu chromatografie, umožňující účinnou separaci látek nutnou pro spolehlivou identifikaci a kvantifikaci složek
Papírová a tenkovrstvá chromatografie Jednou z nejrozšířenějších analytických metod je bezesporu chromatografie, umožňující účinnou separaci látek nutnou pro spolehlivou identifikaci a kvantifikaci složek
UHLOVODÍKY A HALOGENDERIVÁTY
 LABORATORNÍ PRÁCE Č. 25 UHLOVODÍKY A HALOGENDERIVÁTY PRINCIP Uhlovodíky jsou nejjednodušší organické sloučeniny, jejichž molekuly jsou tvořeny pouze uhlíkem a vodíkem. Uhlovodíky klasifikujeme z několika
LABORATORNÍ PRÁCE Č. 25 UHLOVODÍKY A HALOGENDERIVÁTY PRINCIP Uhlovodíky jsou nejjednodušší organické sloučeniny, jejichž molekuly jsou tvořeny pouze uhlíkem a vodíkem. Uhlovodíky klasifikujeme z několika
 LEKCE 5 Krystalizace separace složek homogenních směsí - krystalizace druhy krystalizace: volná krystalizace rušená krystalizace frakční krystalizace krystalizace změnou složení rozpouštědla vykrývání
LEKCE 5 Krystalizace separace složek homogenních směsí - krystalizace druhy krystalizace: volná krystalizace rušená krystalizace frakční krystalizace krystalizace změnou složení rozpouštědla vykrývání
Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii
 Datum: Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii Tlak vzduchu: Teplota vzduchu: Laboratorní cvičení č. Oddělování složek směsí
Datum: Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii Tlak vzduchu: Teplota vzduchu: Laboratorní cvičení č. Oddělování složek směsí
Sešit pro laboratorní práci z chemie
 Sešit pro laboratorní práci z chemie téma: Příprava oxidu měďnatého autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační číslo
Sešit pro laboratorní práci z chemie téma: Příprava oxidu měďnatého autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační číslo
Oxidace benzaldehydu vzdušným kyslíkem a roztokem
 Úloha: Karbonylové sloučeniny a sacharidy, č. 2 Úkoly: Oxidace benzaldehydu Důkaz aldehydu Schiffovým činidlem Redukční vlastnosti karbonylových sloučenin a sacharidů (Reakce s Tollensovým a Fehlingovým
Úloha: Karbonylové sloučeniny a sacharidy, č. 2 Úkoly: Oxidace benzaldehydu Důkaz aldehydu Schiffovým činidlem Redukční vlastnosti karbonylových sloučenin a sacharidů (Reakce s Tollensovým a Fehlingovým
Obrázek 3: Zápis srážecí reakce
 VG STUDENT CHEMIE T É M A: SRÁŽENÍ, IZOLACE SRAŽENIN Vypracoval/a: Spolupracoval/a: Třída: Datum: ANOTACE: V této laboratorní práci se žáci seznámí s pojmem sraženina a srážení, provedou srážení jodidu
VG STUDENT CHEMIE T É M A: SRÁŽENÍ, IZOLACE SRAŽENIN Vypracoval/a: Spolupracoval/a: Třída: Datum: ANOTACE: V této laboratorní práci se žáci seznámí s pojmem sraženina a srážení, provedou srážení jodidu
OKRUH 7 Karboxylové kyseliny
 OKRUH 7 Karboxylové kyseliny Pro karboxylové kyseliny je charakteristická přítomnost jedné nebo více karboxylových skupin Monokarboxylové kyseliny Příprava kyseliny mravenčí z chloroformu a její důkaz
OKRUH 7 Karboxylové kyseliny Pro karboxylové kyseliny je charakteristická přítomnost jedné nebo více karboxylových skupin Monokarboxylové kyseliny Příprava kyseliny mravenčí z chloroformu a její důkaz
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í LABORATORNÍ PRÁCE Č. 6 PRÁCE S PLYNY
 LABORATORNÍ PRÁCE Č. 6 PRÁCE S PLYNY Mezi nejrozšířenější práce s plyny v laboratoři patří příprava a důkazy oxidu uhličitého CO 2, kyslíku O 2, vodíku H 2, oxidu siřičitého SO 2 a amoniaku NH 3. Reakcí
LABORATORNÍ PRÁCE Č. 6 PRÁCE S PLYNY Mezi nejrozšířenější práce s plyny v laboratoři patří příprava a důkazy oxidu uhličitého CO 2, kyslíku O 2, vodíku H 2, oxidu siřičitého SO 2 a amoniaku NH 3. Reakcí
Praktické ukázky analytických metod ve vinařství
 Praktické ukázky analytických metod ve vinařství Ing. Mojmír Baroň Stanovení v moštu Stanovení ph a veškerých titrovatelných kyselin Stanovení ph Princip: Hodnota ph je záporný dekadický logaritmus aktivity
Praktické ukázky analytických metod ve vinařství Ing. Mojmír Baroň Stanovení v moštu Stanovení ph a veškerých titrovatelných kyselin Stanovení ph Princip: Hodnota ph je záporný dekadický logaritmus aktivity
Návod k laboratornímu cvičení. Alkoholy
 Úkol č. 1: Ověřování fyzikálních vlastností alkoholů Návod k laboratornímu cvičení Alkoholy Pomůcky: 3 velké zkumavky - A,B,C, hodinové sklíčko, kapátko nebo skleněná tyčinka Chemikálie: etanol (F), etan-1,2-
Úkol č. 1: Ověřování fyzikálních vlastností alkoholů Návod k laboratornímu cvičení Alkoholy Pomůcky: 3 velké zkumavky - A,B,C, hodinové sklíčko, kapátko nebo skleněná tyčinka Chemikálie: etanol (F), etan-1,2-
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í LABORATORNÍ PRÁCE Č. 14 SRÁŽECÍ REAKCE
 LABORATORNÍ PRÁCE Č. 14 SRÁŽECÍ REAKCE PRINCIP Srážecí reakce je reakce, při níž se alespoň jeden z produktů vylučuje z reakční směsi ve formě tuhé fáze (sraženiny). A + (aq) + B - (aq) AB (s) (Reakce
LABORATORNÍ PRÁCE Č. 14 SRÁŽECÍ REAKCE PRINCIP Srážecí reakce je reakce, při níž se alespoň jeden z produktů vylučuje z reakční směsi ve formě tuhé fáze (sraženiny). A + (aq) + B - (aq) AB (s) (Reakce
ZŠ ÚnO, Bratří Čapků 1332
 Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
VÝROBA UHLIČITANU SODNÉHO TEXT PRO UČITELE
 VÝROBA UHLIČITANU SODNÉHO TEXT PRO UČITELE Mgr. Jana Prášilová prof. RNDr. Jiří Kameníček, CSc. Olomouc, 2013 Obsah 1. Téma v učebnicích používaných na gymnáziích 2. Teoretické poznatky k problematice
VÝROBA UHLIČITANU SODNÉHO TEXT PRO UČITELE Mgr. Jana Prášilová prof. RNDr. Jiří Kameníček, CSc. Olomouc, 2013 Obsah 1. Téma v učebnicích používaných na gymnáziích 2. Teoretické poznatky k problematice
RCOOR + H 2 O. Inovace bakalářského studijního oboru Aplikovaná chemie CZ.1.07/2.2.00/ Esterifikace
 Esterifikace Estery jsou funkční deriváty karboxylových kyselin. Připravují se reakcí karboxylových kyselin s alkoholy nebo s fenoly. RCOOH+ HOR RCOOR + H 2 O K přípravě esterů je vhodné použít vyšší alifatické
Esterifikace Estery jsou funkční deriváty karboxylových kyselin. Připravují se reakcí karboxylových kyselin s alkoholy nebo s fenoly. RCOOH+ HOR RCOOR + H 2 O K přípravě esterů je vhodné použít vyšší alifatické
téma: Halogeny-úvod autor: Ing. František Krejčí, CSc. cíl praktika: žáci si osvojí znalosti z chemie halogenů doba trvání: 2 h
 téma: Halogeny-úvod cíl praktika: žáci si osvojí znalosti z chemie halogenů pomůcky: psací potřeby popis aktivit: Žáci si osvojí problematiku halogenů, popíší jejich elektronovou konfiguraci a z ní vyvodí
téma: Halogeny-úvod cíl praktika: žáci si osvojí znalosti z chemie halogenů pomůcky: psací potřeby popis aktivit: Žáci si osvojí problematiku halogenů, popíší jejich elektronovou konfiguraci a z ní vyvodí
Jednotné pracovní postupy zkoušení krmiv STANOVENÍ OBSAHU DEKOCHINÁTU METODOU HPLC
 Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU DEKOCHINÁTU METODOU HPLC 1 Rozsah a účel Tato metoda specifikuje podmínky pro stanovení dekochinátu metodou vysokoúčinné kapalinové chromatografie
Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU DEKOCHINÁTU METODOU HPLC 1 Rozsah a účel Tato metoda specifikuje podmínky pro stanovení dekochinátu metodou vysokoúčinné kapalinové chromatografie
Sešit pro laboratorní práci z chemie
 Sešit pro laboratorní práci z chemie téma: Příprava roztoků a měření ph autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační
Sešit pro laboratorní práci z chemie téma: Příprava roztoků a měření ph autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 9 Lipidy Pro potřeby projektu
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 9 Lipidy Pro potřeby projektu
Jednotné pracovní postupy zkoušení krmiv STANOVENÍ OBSAHU VÁPNÍKU MANGANOMETRICKY
 Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU VÁPNÍKU MANGANOMETRICKY 1 Rozsah a účel Tato metoda specifikuje podmínky pro stanovení celkového obsahu vápníku v krmivech, krmných směsích a premixech.
Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU VÁPNÍKU MANGANOMETRICKY 1 Rozsah a účel Tato metoda specifikuje podmínky pro stanovení celkového obsahu vápníku v krmivech, krmných směsích a premixech.
T É M A: CHROMATOGRAFIE. Spolupracoval/a: ANOTACE: TEORIE:
 VG STUDENT CHEMIE T É M A: Vypracoval/a: Spolupracoval/a: CHROMATOGRAFIE Třída: Datum: ANOTACE: V této laboratorní práci se žáci seznámí s metodou TLC chromatografie a jejím využitím pro oddělování jednotlivých
VG STUDENT CHEMIE T É M A: Vypracoval/a: Spolupracoval/a: CHROMATOGRAFIE Třída: Datum: ANOTACE: V této laboratorní práci se žáci seznámí s metodou TLC chromatografie a jejím využitím pro oddělování jednotlivých
Termochemie. Úkol: A. Určete změnu teploty při rozpouštění hydroxidu sodného B. Určete reakční teplo reakce zinku s roztokem měďnaté soli
 1. Termochemie Úkol: Určete změnu teploty při rozpouštění hydroxidu sodného B. Určete reakční teplo reakce zinku s roztokem měďnaté soli Pomůcky : a) kádinky, teploměr, odměrný válec, váženka, váhy, kalorimetr,
1. Termochemie Úkol: Určete změnu teploty při rozpouštění hydroxidu sodného B. Určete reakční teplo reakce zinku s roztokem měďnaté soli Pomůcky : a) kádinky, teploměr, odměrný válec, váženka, váhy, kalorimetr,
NOVÉ NÁMĚTY PRO DEMONSTRAČNÍ POKUSY. Ondřej Maca, Tereza Kudrnová
 NOVÉ NÁMĚTY PRO DEMONSTRAČNÍ POKUSY Ondřej Maca, Tereza Kudrnová HUSTÝ DÝM 1) pro koho: 1. ročník čtyřletého gymnázia 2) zařazení do učiva: vlastnosti látek; halogeny; pentely 3) pomůcky: zkumavka se zátkou,
NOVÉ NÁMĚTY PRO DEMONSTRAČNÍ POKUSY Ondřej Maca, Tereza Kudrnová HUSTÝ DÝM 1) pro koho: 1. ročník čtyřletého gymnázia 2) zařazení do učiva: vlastnosti látek; halogeny; pentely 3) pomůcky: zkumavka se zátkou,
Směsi a čisté látky, metody dělení
 Směsi a čisté látky, metody dělení LÁTKY Chemicky čisté látky Sloučeniny Chemické prvky Homogenní Roztoky pevné kapalné plynné Směsi Heterogenní Suspenze Emulze Pěna Aerosol Chemicky čisté látky: prvky
Směsi a čisté látky, metody dělení LÁTKY Chemicky čisté látky Sloučeniny Chemické prvky Homogenní Roztoky pevné kapalné plynné Směsi Heterogenní Suspenze Emulze Pěna Aerosol Chemicky čisté látky: prvky
různorodé suspenze (pevná látka v kapalné) emulze (nemísitelné kapaliny) pěna (plynná l. v kapalné l.) mlha (kapalná l. v plynné l.
 Obsah: 6_Směsi... 2 7_Roztoky, složení roztoku... 3 8_PL_Složení roztoku - příklady... 4 9_Rozpustnost látky... 8 10_ PL_Rozpustnost ve vodě... 9 11_ Dělení směsí... 11 1 6_ Směsi - jsou látky složené
Obsah: 6_Směsi... 2 7_Roztoky, složení roztoku... 3 8_PL_Složení roztoku - příklady... 4 9_Rozpustnost látky... 8 10_ PL_Rozpustnost ve vodě... 9 11_ Dělení směsí... 11 1 6_ Směsi - jsou látky složené
CHEMIE Pracovní list č.3 žákovská verze Téma: Acidobazická titrace Mgr. Lenka Horutová Student a konkurenceschopnost
 www.projektsako.cz CHEMIE Pracovní list č.3 žákovská verze Téma: Acidobazická titrace Lektor: Projekt: Reg. číslo: Mgr. Lenka Horutová Student a konkurenceschopnost CZ.1.07/1.1.07/03.0075 Teorie: Základem
www.projektsako.cz CHEMIE Pracovní list č.3 žákovská verze Téma: Acidobazická titrace Lektor: Projekt: Reg. číslo: Mgr. Lenka Horutová Student a konkurenceschopnost CZ.1.07/1.1.07/03.0075 Teorie: Základem
Název: Acidobazické indikátory
 Název: Acidobazické indikátory Autor: Mgr. Jiří Vozka, Ph.D. Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, biologie, fyzika Ročník: 3. (1. ročník vyššího
Název: Acidobazické indikátory Autor: Mgr. Jiří Vozka, Ph.D. Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, biologie, fyzika Ročník: 3. (1. ročník vyššího
Návod k laboratornímu cvičení. Fenoly
 Návod k laboratornímu cvičení Fenoly Úkol č. 1: Příprava fenolátu sodného Pomůcky: váhy, kádinka, zkumavky Chemikálie: 10% roztok hydroxidu sodného NaOH (C), 5%roztok kyseliny chlorovodíkové HCl (C, X
Návod k laboratornímu cvičení Fenoly Úkol č. 1: Příprava fenolátu sodného Pomůcky: váhy, kádinka, zkumavky Chemikálie: 10% roztok hydroxidu sodného NaOH (C), 5%roztok kyseliny chlorovodíkové HCl (C, X
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 8 Sacharidy Pro potřeby projektu
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 8 Sacharidy Pro potřeby projektu
isolace analytu oddělení analytu od matrice (přečištění) zakoncentrování analytu stanovení analytu (analytů) ve vícesložkové směsi
 SEPARAČNÍ METODY Využití separačních metod isolace analytu oddělení analytu od matrice (přečištění) zakoncentrování analytu stanovení analytu (analytů) ve vícesložkové směsi Druhy separačních metod Srážení
SEPARAČNÍ METODY Využití separačních metod isolace analytu oddělení analytu od matrice (přečištění) zakoncentrování analytu stanovení analytu (analytů) ve vícesložkové směsi Druhy separačních metod Srážení
Jednotné pracovní postupy zkoušení krmiv STANOVENÍ OBSAHU MĚDI, ŽELEZA, MANGANU A ZINKU METODOU FAAS
 Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU MĚDI, ŽELEZA, MANGANU A ZINKU METODOU FAAS 1 Účel a rozsah Tato metoda specifikuje podmínky pro stanovení obsahu mědi, manganu, zinku a železa ve
Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU MĚDI, ŽELEZA, MANGANU A ZINKU METODOU FAAS 1 Účel a rozsah Tato metoda specifikuje podmínky pro stanovení obsahu mědi, manganu, zinku a železa ve
Sešit pro laboratorní práci z chemie
 Sešit pro laboratorní práci z chemie téma: Oddělování složek směsí autor: MVDr. Alexandra Gajová vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační číslo
Sešit pro laboratorní práci z chemie téma: Oddělování složek směsí autor: MVDr. Alexandra Gajová vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační číslo
Jednotné pracovní postupy zkoušení krmiv STANOVENÍ OBSAHU VITAMÍNU D METODOU LC/MS
 Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU VITAMÍNU D METODOU LC/MS 1 Účel a rozsah Tento postup specifikuje podmínky pro stanovení vitamínu D3 v krmivech metodou LC/MS. 2 Princip Zkušební
Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU VITAMÍNU D METODOU LC/MS 1 Účel a rozsah Tento postup specifikuje podmínky pro stanovení vitamínu D3 v krmivech metodou LC/MS. 2 Princip Zkušební
VÝŽIVA LIDSTVA Mléko a zdraví
 GYMNÁZIUM JANA OPLETALA LITOVEL Odborná práce přírodovědného kroužku VÝŽIVA LIDSTVA Mléko a zdraví Vypracovali: Martina Hubáčková, Petra Vašíčková, Pavla Kubíčková, Michaela Pavlovská, Jitka Tichá, Petra
GYMNÁZIUM JANA OPLETALA LITOVEL Odborná práce přírodovědného kroužku VÝŽIVA LIDSTVA Mléko a zdraví Vypracovali: Martina Hubáčková, Petra Vašíčková, Pavla Kubíčková, Michaela Pavlovská, Jitka Tichá, Petra
LP č. 6 - BÍLKOVINY. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: 28. 2. 2013. Ročník: devátý
 LP č. 6 - BÍLKOVINY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 28. 2. 2013 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci prakticky ověří
LP č. 6 - BÍLKOVINY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 28. 2. 2013 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci prakticky ověří
VY_52_INOVACE_O6 _ Krystalizace
 Základní škola a mateřská škola J. A. Komenského v Novém Strašecí Komenského nám. 209, 271 01 Nové Strašecí tel. 311 240 401, 311 240 400, email: zsnovstra@email.cz AUTOR: Hana Růžičková NÁZEV: VY_52_INOVACE_O6
Základní škola a mateřská škola J. A. Komenského v Novém Strašecí Komenského nám. 209, 271 01 Nové Strašecí tel. 311 240 401, 311 240 400, email: zsnovstra@email.cz AUTOR: Hana Růžičková NÁZEV: VY_52_INOVACE_O6
Oborový workshop pro ZŠ CHEMIE
 PRAKTICKÁ VÝUKA PŘÍRODOVĚDNÝCH PŘEDMĚTŮ NA ZŠ A SŠ CZ.1.07/1.1.30/02.0024 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Oborový workshop pro ZŠ CHEMIE
PRAKTICKÁ VÝUKA PŘÍRODOVĚDNÝCH PŘEDMĚTŮ NA ZŠ A SŠ CZ.1.07/1.1.30/02.0024 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Oborový workshop pro ZŠ CHEMIE
Stanovení izoelektrického bodu kaseinu
 Stanovení izoelektrického bodu kaseinu Shlukování koloidních částic do větších celků makroskopických rozměrů nazýváme koagulací. Ke koagulaci koloidních roztoků bílkovin dochází porušením solvatačního
Stanovení izoelektrického bodu kaseinu Shlukování koloidních částic do větších celků makroskopických rozměrů nazýváme koagulací. Ke koagulaci koloidních roztoků bílkovin dochází porušením solvatačního
Standardní operační postup
 Standardní operační postup CHOL_1 Stanovení cholesterolu v potravinách metodou HPLC V Brně dne 20. 3. 2011 Vypracoval: RNDr. Ivana Borkovcová, Ph.D. 1. Princip Po alkalické hydrolýze (saponifikaci, zmýdelnění)
Standardní operační postup CHOL_1 Stanovení cholesterolu v potravinách metodou HPLC V Brně dne 20. 3. 2011 Vypracoval: RNDr. Ivana Borkovcová, Ph.D. 1. Princip Po alkalické hydrolýze (saponifikaci, zmýdelnění)
Bakteriální bioluminiscenční test. Stanovení účinnosti čištění odpadních vod pomocí bakteriálního bioluminiscenčního testu
 Bakteriální bioluminiscenční test Stanovení účinnosti čištění odpadních vod pomocí bakteriálního bioluminiscenčního testu BBTT Cíl: Stanovit účinek odpadních vod na bakterie Vibrio fischeri. Principem
Bakteriální bioluminiscenční test Stanovení účinnosti čištění odpadních vod pomocí bakteriálního bioluminiscenčního testu BBTT Cíl: Stanovit účinek odpadních vod na bakterie Vibrio fischeri. Principem
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ
 SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
Ústřední komise Chemické olympiády. 42. ročník. KRAJSKÉ KOLO Kategorie D. SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut
 Ústřední komise Chemické olympiády 42. ročník 2005 2006 KRAJSKÉ KOLO Kategorie D SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut Institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy
Ústřední komise Chemické olympiády 42. ročník 2005 2006 KRAJSKÉ KOLO Kategorie D SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut Institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy
LABORATORNÍ STANOVENÍ SÍRANŮ VE VODNÉM ROZTOKU
 LABORATORNÍ STANOVENÍ SÍRANŮ VE VODNÉM ROZTOKU Cílem práce je stanovit koncentraci síranů v neznámém vzorku postupem A, B a C a porovnat jednotlivé metody mezi sebou. Protokol musí osahovat veškeré výpočty
LABORATORNÍ STANOVENÍ SÍRANŮ VE VODNÉM ROZTOKU Cílem práce je stanovit koncentraci síranů v neznámém vzorku postupem A, B a C a porovnat jednotlivé metody mezi sebou. Protokol musí osahovat veškeré výpočty
Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np:
 PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
2.07 Krystalizace. Projekt Trojlístek
 2. Vlastnosti látek a chemické reakce 2.07 Krystalizace. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je
2. Vlastnosti látek a chemické reakce 2.07 Krystalizace. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace
 Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Všeobecné lékařství 2014/15
 ÚSTAV LÉKAŘSKÉ BIOCHEMIE A LABORATORNÍ DIAGNOSTIKY 1. LF UK Úvod do práce v laboratoři Měření objemů, filtrace, centrifugace, rozpustnost, dělení směsí Praktické cvičení z lékařské biochemie Všeobecné
ÚSTAV LÉKAŘSKÉ BIOCHEMIE A LABORATORNÍ DIAGNOSTIKY 1. LF UK Úvod do práce v laboratoři Měření objemů, filtrace, centrifugace, rozpustnost, dělení směsí Praktické cvičení z lékařské biochemie Všeobecné
látka Obr. k úkolům 1 a 2 Obr. k úkolu 3
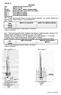 cvičení: A Téma: Základní vlastnosti organických látek Cíl: Teplota varu a tání Pomůcky: žákovská souprava, teploměr, skleněná trubička, Chemikálie: ethanol CH 3 CH 2 OH, aceton CH 3 COCH 3, naftalen Úkol
cvičení: A Téma: Základní vlastnosti organických látek Cíl: Teplota varu a tání Pomůcky: žákovská souprava, teploměr, skleněná trubička, Chemikálie: ethanol CH 3 CH 2 OH, aceton CH 3 COCH 3, naftalen Úkol
Stanovení křivky rozpustnosti fenol-voda. 3. laboratorní cvičení
 Stanovení křivky rozpustnosti fenol-voda 3. laboratorní cvičení Mgr. Sylvie Pavloková Letní semestr 2016/2017 Cíl pochopení základních principů fázové rovnováhy heterogenních soustav základní principy
Stanovení křivky rozpustnosti fenol-voda 3. laboratorní cvičení Mgr. Sylvie Pavloková Letní semestr 2016/2017 Cíl pochopení základních principů fázové rovnováhy heterogenních soustav základní principy
ZŠ ÚnO, Bratří Čapků 1332
 Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 1 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 1 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Příprava materiálu byla podpořena projektem OPPA č. CZ.2.17/3.1.00/33253
 Příprava materiálu byla podpořena projektem OPPA č. CZ.2.17/3.1.00/33253 Část 16 Iontová chromatografie Iontová chromatografie je speciální technika vyvinutá pro separaci anorganických iontů a organických
Příprava materiálu byla podpořena projektem OPPA č. CZ.2.17/3.1.00/33253 Část 16 Iontová chromatografie Iontová chromatografie je speciální technika vyvinutá pro separaci anorganických iontů a organických
Jednotné pracovní postupy zkoušení krmiv STANOVENÍ OBSAHU DRASLÍKU, SODÍKU, HOŘČÍKU A VÁPNÍKU METODOU FAAS/FAES
 Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU DRASLÍKU, SODÍKU, HOŘČÍKU A VÁPNÍKU METODOU FAAS/FAES 1 Účel a rozsah Tato metoda umožňuje stanovení draslíku, sodíku, hořčíku a vápníku v premixech
Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU DRASLÍKU, SODÍKU, HOŘČÍKU A VÁPNÍKU METODOU FAAS/FAES 1 Účel a rozsah Tato metoda umožňuje stanovení draslíku, sodíku, hořčíku a vápníku v premixech
ZÁKLADNÍ CHEMICKÉ VÝPOČTY
 ZÁKLADNÍ CHEMICKÉ VÝPOČTY Látkové množství - vyjadřování množství: jablka pivo chleba uhlí - (téměř každá míra má svojí jednotku) v chemii existuje univerzální veličina pro vyjádření množství látky LÁTKOVÉ
ZÁKLADNÍ CHEMICKÉ VÝPOČTY Látkové množství - vyjadřování množství: jablka pivo chleba uhlí - (téměř každá míra má svojí jednotku) v chemii existuje univerzální veličina pro vyjádření množství látky LÁTKOVÉ
kde p je celkový tlak par nad vroucí kapalinou, u atmosférické destilace shodný s atmosférickým tlakem,
 Destilace diferenciální bilance a posouzení vlivu aparaturních dílů na složení destilátu Úvod: Diferenciální destilace je nejjednodušší metodou dělení kapalných směsí destilací. Její výsledky závisí na
Destilace diferenciální bilance a posouzení vlivu aparaturních dílů na složení destilátu Úvod: Diferenciální destilace je nejjednodušší metodou dělení kapalných směsí destilací. Její výsledky závisí na
Jednotné pracovní postupy zkoušení krmiv STANOVENÍ OBSAHU BÍLKOVIN
 Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU BÍLKOVIN 1 Účel a rozsah Tato metoda specifikuje podmínky pro stanovení bílkovin v krmivech. Metoda je použitelná pro všechna krmiva organického původu.
Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU BÍLKOVIN 1 Účel a rozsah Tato metoda specifikuje podmínky pro stanovení bílkovin v krmivech. Metoda je použitelná pro všechna krmiva organického původu.
téma: Úvodní praktikum - Práce v laboratoři autor: Ing. Dagmar Kučerová
 téma: Úvodní praktikum - Práce v laboratoři cíl praktika: Žáci budou seznámeni s laboratorním řádem a poučeni o bezpečnosti práce. pomůcky: laboratorní řád popis aktivit: Žáci se seznámí se všemi body
téma: Úvodní praktikum - Práce v laboratoři cíl praktika: Žáci budou seznámeni s laboratorním řádem a poučeni o bezpečnosti práce. pomůcky: laboratorní řád popis aktivit: Žáci se seznámí se všemi body
13/sv. 6 CS (80/891/EHS)
 65 31980L0891 27.9.1980 ÚŘEDNÍ VĚSTNÍK EVROPSKÝCH SPOLEČENSTVÍ L 254/35 SMĚRNICE KOMISE ze dne 25. července 1980 o analytické metodě Společenství pro stanovení obsahu kyseliny erukové v olejích a tucích
65 31980L0891 27.9.1980 ÚŘEDNÍ VĚSTNÍK EVROPSKÝCH SPOLEČENSTVÍ L 254/35 SMĚRNICE KOMISE ze dne 25. července 1980 o analytické metodě Společenství pro stanovení obsahu kyseliny erukové v olejích a tucích
ÚPRAVA VODY V ENERGETICE. Ing. Jiří Tomčala
 ÚPRAVA VODY V ENERGETICE Ing. Jiří Tomčala Úvod Voda je v elektrárnách po palivu nejdůležitější surovinou Její množství v provozních systémech elektráren je mnohonásobně větší než množství spotřebovaného
ÚPRAVA VODY V ENERGETICE Ing. Jiří Tomčala Úvod Voda je v elektrárnách po palivu nejdůležitější surovinou Její množství v provozních systémech elektráren je mnohonásobně větší než množství spotřebovaného
STANOVENÍ CHLORIDŮ. Odměrné argentometrické stanovení chloridů podle Mohra
 STANOVENÍ CHLORIDŮ Odměrné argentometrické stanovení chloridů podle Mohra Cíl práce Stanovte titr odměrného standardního roztoku dusičnanu stříbrného titrací 5 ml standardního srovnávacího roztoku chloridu
STANOVENÍ CHLORIDŮ Odměrné argentometrické stanovení chloridů podle Mohra Cíl práce Stanovte titr odměrného standardního roztoku dusičnanu stříbrného titrací 5 ml standardního srovnávacího roztoku chloridu
KVALITATIVNÍ ELEMENTÁRNÍ ANALÝZA ORGANICKÝCH LÁTEK
 LABORATORNÍ PRÁCE Č. 24 KVALITATIVNÍ ELEMENTÁRNÍ ANALÝZA ORGANICKÝCH LÁTEK PRINCIP Organická kvalitativní elementární analýza zkoumá chemické složení organických látek, zabývá se identifikací jednotlivých
LABORATORNÍ PRÁCE Č. 24 KVALITATIVNÍ ELEMENTÁRNÍ ANALÝZA ORGANICKÝCH LÁTEK PRINCIP Organická kvalitativní elementární analýza zkoumá chemické složení organických látek, zabývá se identifikací jednotlivých
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115
 Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: CZ.1.07/1.5.00/34.0410 Číslo šablony: 19 Název materiálu: Ročník: Identifikace materiálu: Jméno autora: Předmět: Tématický celek:
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: CZ.1.07/1.5.00/34.0410 Číslo šablony: 19 Název materiálu: Ročník: Identifikace materiálu: Jméno autora: Předmět: Tématický celek:
Stanovení kritické micelární koncentrace
 Stanovení kritické micelární koncentrace TEORIE KONDUKTOMETRIE Měrná elektrická vodivost neboli konduktivita je fyzikální veličinou, která popisuje schopnost látek vést elektrický proud. Látky snadno vedoucí
Stanovení kritické micelární koncentrace TEORIE KONDUKTOMETRIE Měrná elektrická vodivost neboli konduktivita je fyzikální veličinou, která popisuje schopnost látek vést elektrický proud. Látky snadno vedoucí
Návod k laboratornímu cvičení. Oddělování složek směsí I
 Návod k laboratornímu cvičení Oddělování složek směsí I Úkol č. 1: Usazování Pomůcky: dělící nálevka, držák, svorka, stojan, kádinka Chemikálie: voda, potravinářské barvivo, olej 1. Dělící nálevku upevníme
Návod k laboratornímu cvičení Oddělování složek směsí I Úkol č. 1: Usazování Pomůcky: dělící nálevka, držák, svorka, stojan, kádinka Chemikálie: voda, potravinářské barvivo, olej 1. Dělící nálevku upevníme
krystalizace výpočty
 krystalizace výpočty krystalizace výpočty Základní pojmy: Tabulková rozpustnost: gramy rozpuštěné látky ve 100 gramech rozpouštědla při určité teplotě vyjadřuje složení nasyceného roztoku nasycený roztok
krystalizace výpočty krystalizace výpočty Základní pojmy: Tabulková rozpustnost: gramy rozpuštěné látky ve 100 gramech rozpouštědla při určité teplotě vyjadřuje složení nasyceného roztoku nasycený roztok
Vybrané úlohy z toxikologie
 ÚSTAV LÉKAŘSKÉ BIOCHEMIE A LABORATORNÍ DIAGNOSTIKY 1. LF UK Vybrané úlohy z toxikologie Praktické cvičení z lékařské biochemie Všeobecné lékařství Martin Vejražka 2018/19 Obsah 1. TENKOVRSTEVNÁ CHROMATOGRAFIE
ÚSTAV LÉKAŘSKÉ BIOCHEMIE A LABORATORNÍ DIAGNOSTIKY 1. LF UK Vybrané úlohy z toxikologie Praktické cvičení z lékařské biochemie Všeobecné lékařství Martin Vejražka 2018/19 Obsah 1. TENKOVRSTEVNÁ CHROMATOGRAFIE
LABORATOŘ ANALÝZY POTRAVIN A PŘÍRODNÍCH PRODUKTŮ
 LABORATOŘ ANALÝZY POTRAVIN A PŘÍRODNÍCH PRODUKTŮ Stanovení monosacharidů a oligosacharidů (metoda titrace po inverzi) Garant úlohy: Ing. Lucie Drábová, Ph.D. OBSAH Základní požadované znalosti pro vstupní
LABORATOŘ ANALÝZY POTRAVIN A PŘÍRODNÍCH PRODUKTŮ Stanovení monosacharidů a oligosacharidů (metoda titrace po inverzi) Garant úlohy: Ing. Lucie Drábová, Ph.D. OBSAH Základní požadované znalosti pro vstupní
Jednotné pracovní postupy zkoušení krmiv Stanovení obsahu celkového a volného tryptofanu metodou HPLC
 Strana 1 STANOVENÍ OBSAHU CELKOVÉHO A VOLNÉHO TRYPTOFANU METODOU HPLC 1 Rozsah a účel Metoda specifikuje podmínky pro stanovení obsahu celkového a volného tryptofanu v krmivech metodou vysokoúčinné kapalinové
Strana 1 STANOVENÍ OBSAHU CELKOVÉHO A VOLNÉHO TRYPTOFANU METODOU HPLC 1 Rozsah a účel Metoda specifikuje podmínky pro stanovení obsahu celkového a volného tryptofanu v krmivech metodou vysokoúčinné kapalinové
Jednotné pracovní postupy zkoušení krmiv STANOVENÍ OBSAHU KOBALTU METODOU ICP-MS
 Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU KOBALTU METODOU ICP-MS 1 Rozsah a účel Metoda specifikuje podmínky pro stanovení celkového obsahu kobaltu v krmivech metodou hmotnostní spektrometrie
Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU KOBALTU METODOU ICP-MS 1 Rozsah a účel Metoda specifikuje podmínky pro stanovení celkového obsahu kobaltu v krmivech metodou hmotnostní spektrometrie
1.Skupinové reakce: Kationty: dělíme je podle reakcí do tříd.
 Analytická chemie Zahrnuje metody chemické analýzy a to jak kvantitativní, tak kvalitativní. Dokazujeme a stanovujeme. Využití má v toxikologii, soudním lékařství, biochemii, vyhledávání drog atd. Metody,
Analytická chemie Zahrnuje metody chemické analýzy a to jak kvantitativní, tak kvalitativní. Dokazujeme a stanovujeme. Využití má v toxikologii, soudním lékařství, biochemii, vyhledávání drog atd. Metody,
Vodík, kyslík a jejich sloučeniny
 I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 8 Vodík, kyslík a jejich sloučeniny
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 8 Vodík, kyslík a jejich sloučeniny
ORGANICKÁ CHEMIE Laboratorní práce č. 3
 Téma: Hydroxyderiváty uhlovodíků ORGANICKÁ CHEMIE Laboratorní práce č. 3 Úkol 1: Dokažte přítomnost ethanolu ve víně. Ethanol bezbarvá kapalina, která je základní součástí alkoholických nápojů. Ethanol
Téma: Hydroxyderiváty uhlovodíků ORGANICKÁ CHEMIE Laboratorní práce č. 3 Úkol 1: Dokažte přítomnost ethanolu ve víně. Ethanol bezbarvá kapalina, která je základní součástí alkoholických nápojů. Ethanol
Analýza kofeinu v kávě pomocí kapalinové chromatografie
 Analýza kofeinu v kávě pomocí kapalinové chromatografie Kofein (obr.1) se jako přírodní alkaloid vyskytuje v mnoha rostlinách (např. fazolích, kakaových bobech, černém čaji apod.) avšak nejvíce je spojován
Analýza kofeinu v kávě pomocí kapalinové chromatografie Kofein (obr.1) se jako přírodní alkaloid vyskytuje v mnoha rostlinách (např. fazolích, kakaových bobech, černém čaji apod.) avšak nejvíce je spojován
Reakce organických látek
 Pavel Lauko 5.2.2002 DI I. roč. 3.sk. Reakce organických látek 1. Příprava methanu dekarboxylací octanu sodného Roztoky a materiál: octan sodný, natronové vápno, manganistan draselný, cyklohexan. Postup:
Pavel Lauko 5.2.2002 DI I. roč. 3.sk. Reakce organických látek 1. Příprava methanu dekarboxylací octanu sodného Roztoky a materiál: octan sodný, natronové vápno, manganistan draselný, cyklohexan. Postup:
L 54/116 CS Úřední věstník Evropské unie
 L 54/116 CS Úřední věstník Evropské unie 26.2.2009 8. Výsledky kruhových testů V rámci ES byly provedeny kruhové testy, při nichž až 13 laboratoří zkoušelo čtyři vzorky krmiva pro selata, včetně jednoho
L 54/116 CS Úřední věstník Evropské unie 26.2.2009 8. Výsledky kruhových testů V rámci ES byly provedeny kruhové testy, při nichž až 13 laboratoří zkoušelo čtyři vzorky krmiva pro selata, včetně jednoho
Součástí cvičení je krátký test.
 1 KVALITATIVNÍ ANORGANICKÁ ANALÝZA Laboratorní úloha č.1 KATIONTY TVOŘÍCÍ NEROZPUSTNÉ CHLORIDY A SÍRANY, KATION NH 4 + DOMÁCÍ PŘÍPRAVA 1. Prostudujte si dále uvedený návod 2. Prostudujte si text v Příloze
1 KVALITATIVNÍ ANORGANICKÁ ANALÝZA Laboratorní úloha č.1 KATIONTY TVOŘÍCÍ NEROZPUSTNÉ CHLORIDY A SÍRANY, KATION NH 4 + DOMÁCÍ PŘÍPRAVA 1. Prostudujte si dále uvedený návod 2. Prostudujte si text v Příloze
Ústřední komise Chemické olympiády. 56. ročník 2019/2020 ŠKOLNÍ KOLO. Kategorie A. Praktická část Zadání 40 bodů
 Ústřední komise Chemické olympiády 56. ročník 2019/2020 ŠKOLNÍ KOLO Kategorie A Praktická část Zadání 40 bodů PRAKTICKÁ ČÁST 40 BODŮ Autor Doc. Ing. Petr Exnar, CSc. Technická univerzita v Liberci Recenze
Ústřední komise Chemické olympiády 56. ročník 2019/2020 ŠKOLNÍ KOLO Kategorie A Praktická část Zadání 40 bodů PRAKTICKÁ ČÁST 40 BODŮ Autor Doc. Ing. Petr Exnar, CSc. Technická univerzita v Liberci Recenze
1. Izolaci polutantů 2. Zakoncentrování a přečištění izolované skupiny látek 3. Identifikaci jednotlivých látek 4. Stanovení identifikovaných složek
 Identifikace organických polutantů tenkovrstevnou chromatografií (Chromatografie) Úvod: Je mnohem snadnější zjistit kontaminaci složek ekosystému ionty a anorganickými sloučeninami, než odhalit kontaminaci
Identifikace organických polutantů tenkovrstevnou chromatografií (Chromatografie) Úvod: Je mnohem snadnější zjistit kontaminaci složek ekosystému ionty a anorganickými sloučeninami, než odhalit kontaminaci
Úloha č. 9 Stanovení hydroxidu a uhličitanu vedle sebe dle Winklera
 Úloha č. 9 Stanovení hydroxidu a uhličitanu vedle sebe dle Winklera Princip Jde o klasickou metodu kvantitativní chemické analýzy. Uhličitan vedle hydroxidu se stanoví ve dvou alikvotních podílech zásobního
Úloha č. 9 Stanovení hydroxidu a uhličitanu vedle sebe dle Winklera Princip Jde o klasickou metodu kvantitativní chemické analýzy. Uhličitan vedle hydroxidu se stanoví ve dvou alikvotních podílech zásobního
ODMĚRNÁ ANALÝZA - TITRACE
 LABORATORNÍ PRÁCE Č. 35 ODMĚRNÁ ANALÝZA - TITRACE PRINCIP Odměrnou analýzou (titrací) se stanovuje obsah určité složky ve vzorku. Podstatou odměrného stanovení je chemická reakce mezi odměrným roztokem
LABORATORNÍ PRÁCE Č. 35 ODMĚRNÁ ANALÝZA - TITRACE PRINCIP Odměrnou analýzou (titrací) se stanovuje obsah určité složky ve vzorku. Podstatou odměrného stanovení je chemická reakce mezi odměrným roztokem
některé pórovité látky s obrovským povrchem jsou schopny vázat (adsorbovat) do svých pórů velké množství vody, organických a anorganických látek
 ADSORPCE některé pórovité látky s obrovským povrchem jsou schopny vázat (adsorbovat) do svých pórů velké množství vody, organických a anorganických látek jsou to například aktivní uhlí (uměle vyrobená
ADSORPCE některé pórovité látky s obrovským povrchem jsou schopny vázat (adsorbovat) do svých pórů velké množství vody, organických a anorganických látek jsou to například aktivní uhlí (uměle vyrobená
Sešit pro laboratorní práci z chemie
 Sešit pro laboratorní práci z chemie téma: Důkaz C, H, N a halogenů v organických sloučeninách autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie
Sešit pro laboratorní práci z chemie téma: Důkaz C, H, N a halogenů v organických sloučeninách autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie
Laboratorní pomůcky, chemické nádobí
 Laboratorní pomůcky, chemické nádobí Laboratorní sklo: měkké (tyčinky, spojovací trubice, kapiláry) tvrdé označení SIMAX (většina varného a odměrného skla) Zahřívání skla: Tenkostěnné nádoby (kádinky,
Laboratorní pomůcky, chemické nádobí Laboratorní sklo: měkké (tyčinky, spojovací trubice, kapiláry) tvrdé označení SIMAX (většina varného a odměrného skla) Zahřívání skla: Tenkostěnné nádoby (kádinky,
CHROMATOGRAFIE ÚVOD Společný rys působením nemísících fází: jedna fáze je nepohyblivá (stacionární), druhá pohyblivá (mobilní).
 CHROMATOGRAFIE ÚOD Existují různé chromatografické metody, viz rozdělení metod níže. Společný rys chromatografických dělení: vzorek jako směs látek - složek se dělí na jednotlivé složky působením dvou
CHROMATOGRAFIE ÚOD Existují různé chromatografické metody, viz rozdělení metod níže. Společný rys chromatografických dělení: vzorek jako směs látek - složek se dělí na jednotlivé složky působením dvou
1.08 Tvrdost vody. Projekt Trojlístek
 1. Chemie a společnost 1.08. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je určena pro žáky 2. stupně ZŠ
1. Chemie a společnost 1.08. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je určena pro žáky 2. stupně ZŠ
Stanovení měrného tepla pevných látek
 61 Kapitola 10 Stanovení měrného tepla pevných látek 10.1 Úvod O teple se dá říci, že souvisí s energií neuspořádaného pohybu molekul. Úhrnná pohybová energie neuspořádaného pohybu molekul, pohybu postupného,
61 Kapitola 10 Stanovení měrného tepla pevných látek 10.1 Úvod O teple se dá říci, že souvisí s energií neuspořádaného pohybu molekul. Úhrnná pohybová energie neuspořádaného pohybu molekul, pohybu postupného,
EU peníze středním školám digitální učební materiál
 EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
Ústřední komise Chemické olympiády. 55. ročník 2018/2019 ŠKOLNÍ KOLO. Kategorie C ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ)
 Ústřední komise Chemické olympiády 55. ročník 2018/2019 ŠKOLNÍ KOLO Kategorie C ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ) PRAKTICKÁ ČÁST 40 BODŮ Autor RNDr. Jan Břížďala Gymnázium Třebíč RNDr. Jan Havlík, Ph.D.
Ústřední komise Chemické olympiády 55. ročník 2018/2019 ŠKOLNÍ KOLO Kategorie C ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ) PRAKTICKÁ ČÁST 40 BODŮ Autor RNDr. Jan Břížďala Gymnázium Třebíč RNDr. Jan Havlík, Ph.D.
