P o s t u p y b a r v e n í. c h r o m o z ó m ů
|
|
|
- Vendula Dvořáková
- před 7 lety
- Počet zobrazení:
Transkript
1 P o s t u p y b a r v e n í c h r o m o z ó m ů užité ve cvičení CCGSB Pavla Válová Jarmila Číhalíková Olomouc
2 Cvičení č. 1: M E T A F Á Z N Í C H R O M O Z Ó M Y Roztlakové preparáty kořenových špiček cibule, bobu a ředkvičky ÚKOLY: 1. Vytvořte dočasné roztlakové preparáty ve fruktózovém sirupu a v 45% kyselině octové z předem předpůsobených a nafixovaných kořenových špiček cibule (Allium cepa L.), bobu koňského (Vicia faba L.) a ředkvičky (Raphanus sativus L.), nabarvených pomocí Schiffova reagens. 2. Z kvalitních roztlakových preparátů s kořenovými špičkami roztlačenými v 45% kys. octové zhotovte za pomocí tekutého dusíku trvalý roztlakový preparát. 3. U karyotypů zkoumaných druhů rostlin zjistěte: - diploidní počet chromozómů (2n = ) - průměrnou velikost buňky a jádra (v µm) (pomocí okulárového měřítka) - velikost největšího chromozómu v analyzovaném karyotypu - typ největšího chromozómu podle poměru ramen - počet chromocenter v interfázních jádrech - uveďte, zda se jedná o homogenní nebo heterogenní karyotyp - určete skupinu chromozómů podle velikosti chromozómů v karyotypu ( L nebo S ) Zjištěné údaje zapište do tabulky na konci cvičení 1. Upozornění: Při práci s barvivy a roztoky užíváme ochranných rukavic a dbáme, abychom se chemikáliemi nepotřísnili. Barvivo Parafuchsin (= Pararosanilin), užívané při přípravě Schiffova reagens, je mutagen!!! Postup barvení chromozómů Schifovým reagens: A) Roztlakový preparát dočasný* 1. Předpůsobení kořenového meristému vybranou látkou 2. Fixace v Carnoyově fixáži I (3 : 1) hod. ** 3. Opláchnutí v dest. vodě (5 min) 4. Hydrolýza v 5M HCl při pokojové teplotě min 5. Opláchnutí v dest. vodě (5 min) 6. Barvení v Schiffově reagens min *** 7. Opláchnutí v dest. vodě 8. Macerace: v 45% kyselině octové min 9. Roztlak ve fruktózovém sirupu nebo častěji v 45% kys. octové Pozorování v mikroskopu. * Poznámka: Preparáty tohoto typu nejsou trvalé, dají se uchovávat pouze omezenou dobu v ledničce (měsíc). Jsou určeny k rychlému orientačnímu hodnocení. Nejsou vhodné k pořízení fotografie (malá hloubka ostrosti). ** Předpůsobení a fixace materiálu již dříve. Předpůsobení: cibule, bob, ředkvička nasycený roztok paradichlorbenzenu - 4 hod. *** Pokud jsou chromozómy (jádra) Schiffem málo zbarvená, je možné je dobarvit v kapce acetokarmínu (vhodné v případě ředkvičky). 2
3 B) Roztlakový preparát trvalý (přes tekutý dusík, případně suchý led) 1. Předpůsobení kořenového meristému vybranou směsí 2. Fixace v Carnoyově fixáži (3:1) hod. 3. Opláchnutí v dest. vodě (5 min) 4. Hydrolýza v 5M HCl při pokojové teplotě min 5. Opláchnutí v dest. vodě (5 min) 6. Barvení v Schiffově reagens min 7. Opláchnutí v dest. vodě 8. Macerace v 45% kyselině octové min 9. Roztlačení v kapce 45% kyseliny octové 10. Opatrné vložení preparátu do tekutého dusíku* (příp. položení na kostku suchého ledu) a nechat zmrazit (až roztlak zbělá a tekutý dusík kolem podložního skla přestane vřít) 11. Odstranění krycího skla širokým skalpelem (příp. žiletkou) 12. Dehydratace v 96% etanolu (2x po 5 min.) 13. Vysušení preparátu (možno použít fén) 14. Uzavření do uzavíracího media (Euparal možno přímo, DePeX - přes xylén) * POZOR: Pracujeme opatrně a s ochranným krytem na oči!!! Ukázka správného roztlaku (viz cvičení): Nabarvený kořenový meristém (u větších špiček bez čepičky) rozťukat od středu spirálovitým pohybem a potom roztlačit do stran Získat jednu vrstvu buněk Při roztlaku nepohnout krycím sklem Neušpinit povrch krycího skla 1 C Sch Sch nabarvený kořenový meristém C = cibule Sch = Schiffův roztok Roztlačené buňky pozorujeme mikroskopem při zvětšení cca 200 a 400x. Vhodné metafázní figury pozorujeme pod imerzním objektivem (100x) s použitím imerzního oleje při zvětšení cca 1 000x. Pokud při prohlídce v mikroskopu zjistíme, že je roztlak nedostatečný, je možno nadzvednout žiletkou růžek krycího skla a pod sklíčko dokápnout kapku 45% kyseliny octové a provést znovu důkladnější roztlak. Někdy je možno vyhlédnutou metafázi ještě dodatečně jemně roztlačit (rozťukat) pomocí preparační jehly při použití slabšího objektivu (10x). Nejlépe, pokud je metafáze na okraji roztlačeného pletiva a má kolem sebe dostatek prostoru. Nejkvalitnější karyotypy (figury) bývají po stranách roztlaku (ne uprostřed). (Správná příprava roztlakových preparátů viz také Dodatky na konci návodů - Nejčastější problémy při přípravě a hodnocení karyologických preparátů: Krahulcová, A. (1998): Karyologie cévnatých rostlin. Příručka praktického cvičení pro posluchače katedry botaniky Přírodovědecké fakulty UK Praha.) 3
4 Dobarvení chromozómů acetobarvivy: U rostlin, u nichž jsou chromozómy málo zabarveny Schiffovým reagens, provádíme dobarvení acetobarvivy. Postup: Ke kořenovému meristému na čistém podložním skle přidáme kapku barviva (acetokarmín, laktopropionový orcein), opatrně přiložíme krycí sklíčko tak, aby jedním rohem přesahovalo přes okraj podložního skla, a velmi jemně provedeme roztlak. Poté lehce nadzvedneme okraj krycího skla, aby barvivo proniklo k jednotlivým buňkám - toto několikrát opakujeme. Preparát můžeme mírně nahřát nad plamenem lihového kahanu, ale jen tak, aby se barvivo nevařilo. Celkem barvíme asi 5 min. Potom krycí sklo upravíme do správné polohy a opět provedeme mírný roztlak. Přebytečné barvivo odsajeme přiložením proužku čistého filtračního papíru (nesmíme znečistit povrch krycího skla!) a můžeme pozorovat mikroskopem. Pokud se nepodaří najít buňky s rozloženými chromozómy, které je možno počítat, je nutné postup opakovat s jinými špičkami. M e t a f á z n í c h r o m o z ó m y doplňkový materiál Popis dočasných preparátů na podložním skle: (fixkou na sklo) Ponechat volné místo na okrajích podložního skla, kam se nedostane objektiv mikroskopu (cca 0,5 cm). 1 fr C ko C = cibule B = bob Ř = ředkvička fr = fruktóza ko = kyselina octová 1 = pořadové číslo podložního skla Popis trvalých preparátů na podložním skle: (diamantem na sklo + po zalití do pryskyřice obtažení fixkou) 1 A.K. C + B A.K. iniciály jména C = cibule B = bob 4
5 Anatomická stavba růstového vrcholu kořene: Apikální meristém s vyznačením klidového centra, proximálního meristému a jednotlivých oblastí v kořenové čepičce. 1 - střední válec 2 - primární kůra 3 - meristém 4 - klidové centrum 5 - kalyptrogén 6 - sloupek 7 - periferní buňky čepičky Mikrofotografie roztlakových preparátů BOB KOŇSKÝ (Vicia faba L.) předpůsobení p-dichlorbenzenem, barvení Schiffem Bob koňský (Vicia faba L.) metafáze mitózy. Z: 400x. Úsečka 20 µm. Foto Pavla Válová. 5
6 Bob koňský (Vicia faba L.). Z: 1000x, imerze. Úsečka 10 µm. Foto Pavla Válová. Bob koňský (Vicia faba L.). Z: 1000x, imerze. Úsečka 10 µm. Foto Maroš Prčina. CIBULE KUCHYŇSKÁ (Allium cepa L.) předpůsobení p-dichlorbenzenem, barvení Schiffem Cibule kuchyňská (Allium cepa L.). Z: 200x. Úsečka 100 µm. Foto Pavla Válová. 6
7 Cibule kuchyňská (Allium cepa L.). Z: 1 000x, imerze. Úsečka 10 µm. Foto Pavla Válová. Cibule kuchyňská (Allium cepa L.). Předpůsobení p-dichlorbenzenem, barvení dle Feulgena (Schiffův roztok), roztlak v acetokarmínu. Šipky označují satelit. Z: 1 000x, imerze. Foto Pavla Válová. ŘEDKVIČKA (Raphanus sativum) Ředkvička (Raphanus sativum cv. Kvarta). chromocentra v interfázních jádrech. Barvení dle Feulgena (Schiffův roztok), dobarvení a roztlak v acetokarmínu. Z: 1 000x, imerze. Úsečka 20 µm. Foto Pavla Válová. 7
8 HADINEC (Echium sp.) Hadinec (Echium maculatum) příklad homogenního karyotypu. Chromozómy typu S. Z: 1 000x, imerze. Foto Pavla Válová. PRYSKYŘNÍK (Ranunculus sp.) Pryskyřník (Ranunculus sp.). 2n = <100; Z: 1 000x, imerze. Foto Pavla Válová. ČLOVĚK (Homo sapiens) Nakapávaný preparát lidských leukocytů. G-banding; 2n = 46. Z: 1 500x, imerze. Foto Lenka Kučerová. 8
9 Mitóza - tabulka k doplnění Počet chromozómů a jejich charakteristiky Rostlina 2 n Velikost nejdelšího chromozómu [μm] Ředkvička setá x (Raphanus sativus) Cibule kuchyňská (Allium cepa) Bob koňský (Vicia faba) Člověk (Homo sapiens) Typ chromozómu * x Velikost buňky [μm] * M = metacentrický; SM = submetacentrický; A = akrocentrický T = telocentrický; +S = se satelitem x Počet chromocenter v interfázi x Typ karyotypu (homogenní x heterogenní) Typ podle velikosti chromozómů ( L x S ) Cvičení č. 2: M E I O T I C K É C H R O M O Z Ó M Y Meiotické dělení v nezralých prašnících pažitky Charakteristika jednotlivých fází meiózy: I. dělení redukční (heterotypické) profáze I velké zvětšení objemu jádra leptotene - chromozómy se jeví jako dlouhá tenká vlákna, synizetický svazek seskupení chromozómů k jedné straně jádra (lepto = tenký, tene = nit) zygotene - párování homologních chromozómů, vznik synaptonemálního komplexu, podle nových již zde průběh crossing-overu (zygon = dvojitý) pachytene - homologní chromozómy formují bivalenty; jsou viditelná místa, kde proběhl crossing-over* (pachys = tlustý) diplotene - desynapse, terminalizace chiasmat (diplos = dvojitý) diakineze - chromozómy velmi zkrácené, vhodné pro stanovení počtu chromozómů (diakino = rozpojuji) * Podle novějších poznatků crossing-over nastává již v zygotenním stadiu a v pachytene již pozorujeme místa, kde k němu došlo. metafáze I, anafáze I, telofáze I a interkineze: chiasmata jsou lokalizována na ekvatoriální rovině, do dceřiných jader se separují jednotlivé celé chromozómy; v interkinezi nedochází k syntéze DNA a reduplikaci, chromozómy se rozvinují a formuje se jaderná blána. II. dělení ekvační (homeotypické) (podobné jako mitóza) profáze II: chromozómy jsou separovány od sebe tvoří kříž metafáze II, anafáze II, telofáze II: stejné jako somatické dělení, původní počet chromozómů (2n) je redukován na gametický počet (n). 9
10 Vytvoření meiotických preparátů Rostlinný materiál: nafixovaná poupata pažitky pobřežní (Allium schoenoprasum L.) (fixáž alkohol-octová 3 : 1, 24 h při 4 C, pak přenesení přes 96% etanol (2x po 15 min) do 70% etanolu a uchovávání v chladničce při 4 C) Z květního toulce rostliny odebereme poupě o velikosti cca 2,5 mm viz nákres níže. cca 2,5 mm Velikost poupěte změříme milimetrovým měřítkem nebo pod preparační lupou s okulárovým mikrometrem. Poupě položíme na podložní sklo, na okraj zapíšeme jeho velikost (fixou na sklo). Popis preparátů na podložním skle: 1 2,5 žak 3 žak = železitý acetokarmín LPO = laktopropionorcein 1 = pořadové číslo podložního skla 2,5 = délka poupěte v mm A) Postup barvení prašníků laktopropionovým orceinem: 1. Macerace celého poupěte ve směsi 5 M HCl : 96% etanol (1 : 1).. 10 min 2. Důkladné opláchnutí v destilované vodě 3. Odsátí přebytečné vody 4. Vypreparování prašníků a rozmačkání na podložním skle (použít zahnutou preparační jehlu) v kapce laktopropionového orceinu, lehce zahřát nad lihovým kahanem a nechat chvíli (2 min) barvit. 5. Položení krycího sklíčka, lehké přitlačení a odsátí přebytečného barviva proužkem čistého filtračního papíru (pozor na znečištění krycího sklíčka). 6. Možné orámování preparátu (např. lakem na nehty), aby barvivo nevysychalo. Pozorujeme pod mikroskopem při zvětšení cca 200 a 400x, případně s imerzí při zvětšení 1 000x. 10
11 B) Postup barvení prašníků železitým acetokarmínem: 1. Obsah prašníků vytlačíme pomocí jehel do kapky železitého acetokarmínu a zbytky prašníků odstraníme. 2. Lehce nahřejeme nad plamenem lihového kahanu a necháme asi 1 min barvit. 3. Přiložíme krycí sklo a opatrně roztlačíme. 4. Přebytečné barvivo odstraníme proužkem čistého filtračního papíru (pozor na znečištění krycího sklíčka). Pozorujeme pod mikroskopem při zvětšení cca 200x a 400x, případně s imerzí při zvětšení 1 000x. ÚKOLY: 1. Ve vytvořených roztlakových preparátech najděte stadium meiózy, v níž je vidět párování homologních chromozómů (profáze I diakineze) a spočítejte počet bivalentů; z tohoto počtu určete haploidní a diploidní počet chromozómů u pažitky. 2. Rozhodněte, zda párování homologních chromozómů v metafázi I probíhá pravidelně nebo nepravidelně (vznikají shluky, slepence, kroužky chromozómů). 3. Pomocí okulárového měřítka změřte velikost pylových mateřských buněk (PMC) ve stadiu diakineze a buněk tapeta. 4. Rozhodněte, který ze dvou použitých způsobů barvení meiotických preparátů je ke studiu párování homologních chromozómů vhodnější. Zjištěné údaje zapište do tabulky na konci cvičení 2. MIKROFOTO MEIOTICKÝCH CHROMOZÓMŮ skupina MBB C+D ( ) PAŽITKA POBŘEŽNÍ (Allium schoenoprasum L.) poupata o velikosti cca 2,5 mm Fixace Carnoy I (96% etanol : led. kys. octová v poměru 3 : 1), uchovávání v 70% etanolu Roztlakové preparáty, barvení železitým acetokarmínem Meióza I: profázei zygotene. Chromozómy v bivalentech tvaru dlouhých tlustých nití; viditelné jadérko (šipka kalózový obal pylové mateřské buňky (PMC) (šipka ). Z = 1 000x, imerze. Foto Pavla Válová. ). Tenký 11
12 Meióza I: profáze I diplotene. Chromozómy v bivalentech, tvorba chiazmat (šipka). Viditelné jadérko. Roztlačený protoplast bez kalózového obalu. Z = 1 000x, imerze. Foto Pavla Válová. Meióza I: profáze I diplotene. Roztlačený protoplast bez kalózového obalu. Z = 1 000x, imerze. Foto Pavla Válová. Z = 400x Z = 1 000x, imerze Meióza I: profáze I - diakineze. Chromozómy v bivalentech zrníčkovitého tvaru; vhodné stadium pro počítání chromozómů. Roztlačený protoplast bez kalózového obalu. Foto Pavla Válová. 12
13 Meióza I: profáze I diakineze. Roztlačený protoplast bez kalózového obalu. Z = 1 000x, imerze. Foto Pavla Válová. Meióza I: profáze I diakineze. Roztlačená PMC s kalózovým obalem (šipka). Z = 1 000x, imerze. Foto Pavla Válová. Kalózový obal pylové mateřské buňky (PMC) Meióza I: konec anafáze I. Jednotlivé celé chromozómy na pólech PMC. Z = 1 000x, imerze. Foto Pavla Válová. 13
14 Diáda, konec meiózy I. (bez kalózového obalu) Tvorba mezibuněčné přepážky mezi vytvořenými buňkami (sukcesivní - postupný - typ tvorby pylového zrna). Z = 1 000x, imerze. Foto Pavla Válová. Buňka tapeta v interfázi s velkým interfázním jádrem. Z = 1 000x, imerze. Foto Pavla Válová. Meióza - tabulka k doplnění Počet bivalentů v meióze I diakinezi a velikost PMC Rostlina Pažitka pobřežní (Allium schoenoprasum) Počet bivalentů v diakinezi 2 n Velikost PMC v diakinezi [μm] Velikost buňky tapeta [μm] Párování homologních chromozómů [pravidelné x nepravidelné] 14
15 ÚKOLY: Cvičení č. 4: Diferenciální barvení chromozómů, metody živočišné cytogenetiky a) Z předpůsobených a nafixovaných kořenových špiček bobu a cibule zhotovte trvalé preparáty technikou NOR-barvení. b) Zhotovte roztlakový preparát metafázních chromozómů z mozkových ganglií larvy drozofily. A) Metoda barvení organizátoru jadérka a jadérka v interfázním jádře, NOR banding PRACOVNÍ POSTUP: Materiál: kořenový meristém cibule kuchyňské (Allium cepa L.) a bobu koňského (Vicia faba L.) Předpůsobení: p-dichlorbenzen... 4 hod. Fixace: Carnoy I (3 : 1)* Hydrolýza: Roztlak: 5M HCl min., laboratorní teplota V kapce 45% kyseliny octové, krycí sklo odstraňte přes suchý led (tekutý dusík) a roztlak dehydratujte v 96% etanolu (2 x 5 min), poté dejte preparát sušit na vzduch. Barvení: Na roztlačené buňky pipetujte 10 l želatinového roztoku (1.) a 20 l 50% AgNO 3 roztoku (2.). Přikryjte krycím sklem a položte na topnou desku vyhřátou na 70 C. Asi po 2 min barvicí roztok zhnědne. Potom krycí sklo smyjte nad kádinkou** pomocí teplé destilované vody ve stříkačce. Preparát vysušte na vzduchu a uzavřete do Euparalu nebo DePeXu (přes xylén). 1. roztok 2% prášková potravinářská želatina s kyselinou mravenčí (1g želatiny rozpustit v 50 ml dest. vody a přidat 0,5 ml kyseliny mravenčí) 2. roztok - 50% vodný roztok AgNO 3 (0,5g AgNO 3 rozpustit v 1 ml dest. vody) Upozornění: Protože pracujeme s AgNO 3, což je jed, pracujeme v ochranných rukavicích a dbáme, abychom se roztokem nepotřísnili. Pozorování: Na uzavřeném preparátu pozorujte žlutě zbarvená interfázní jádra a uvnitř jádra tmavě hnědě (příp. černě) zbarvená jadérka. Na satelitních chromozómech se specificky barví organizátor jadérka chromozómy jsou žluté, NOR je vidět na největším chromozómu jako tmavý pruh. 1 B NOR A.K. B = bob C = cibule NOR = NOR-barvení A.K. iniciály jména 2 Ř NOR A.K. Ř = ředkvička NOR = NOR-barvení A.K. iniciály jména * Předpůsobení a fixace již předem; materiál uchovávaný v 70% etanolu. ** Roztok s AgNO 3 je jedovatý nevylévá se do odpadu, ale dává se zvlášť do nebezpečného odpadu k pozdější likvidaci. 15
16 NOR-banding u cibule. Buňky kořenové špičky cibule seté (Allium cepa) po barvení dusičnanem stříbrným. Z: 400x. Úsečka 50 µm. Preparát Dagmar Smitalová, foto Pavla Válová. NOR-banding u bobu. Buňky kořenové špičky bobu koňského (Vicia faba) po barvení dusičnanem stříbrným. Z: 400x. Úsečka 10 a 20 µm. Preparát a foto Pavla Válová. 16
17 B) Mitóza pozorovaná na neuroblastech drozofily rychlá roztlaková metoda Nejvhodnější buňky pro sledování mitózy u Dipter jsou neuroblasty z mozkového ganglionu larvy, kde jsou chromozómy dostatečně velké. Ganglion leží dorzálně od slinných žláz (viz obr. níže). Materiál: Barvení: larvy drozofily (Drosophila melanogaster Meig.) 3. instaru (tj. těsně před zakuklením, kdy vylézají na stěnu kultivační nádoby), pocházející z kultury s nadbytkem potravy; chov při 18 C) roztlak v kapce laktopropionorceinu PRACOVNÍ POSTUP: 1. Larvu položíme na podložní sklo do kapky fyziologického roztoku pod binokulární lupou. Jednou preparační jehlou přidržíme larvu za ústní část (tmavé chitinové háčky), druhou asi uprostřed těla. Tahem jehel oddělíme hlavovou část s mozkovými gangliony (viz obr. níže). 2. Odstraníme nežádoucí části (zbytek larvy, tukovou tkáň). 3. Mozková ganglia přeneseme na čisté podložní sklo a ihned zakápneme laktopropionovým orceinem (buňky nesmí vyschnout). Barvivo necháme působit asi 10 minut (můžeme lehce zahřát nad lihovým kahanem). 4. Přiložíme krycí sklo a jemným tlakem buňky ganglia roztlačíme. Preparát opatrně zahřejeme (barvivo nesmí vařit; teplotu podložního skla kontrolujeme hřbetem ruky). 5. Přebytečné barvivo odstraníme překrytím preparátu proužkem čistého filtračního papíru. Pozorování: Pozorujeme pod mikroskopem při větším zvětšení (400x a potom 1 000x s imerzí). Buňky mozku jsou velmi drobné (cca 5 µm). Pozorujeme nabarvená jádra a v některých i jádra v mitóze, případně v metafázi. Chromozómy jsou velmi drobné, na rozdíl od obrovských polyténních chromozómů celková délka metafázních chromozómů měří 7 µm! V dobře roztlačené buňce v metafázi je vidět 8 chromozómů (viz obrázky níže): 1. pár pohlavních chromozómů - chromozóm X - je tyčinkovitého tvaru, chromozóm Y má tvar J. Dva dlouhé chromozómy tvaru V představují 2. a 3. chromozómové páry, přičemž 2. chromozóm je poněkud kratší než 3. chromozóm. Párový chromozóm 4 je velmi malý a jeví se jako tečky. Na některých preparátech je možné vidět i jednotlivé chromatidy. 17
18 Roztržení larvy drozofily za pomocí dvou preparačních jehel Schéma rozložení orgánů u larvy drozofily (Drosophila melanogastrum Meig.) 1. Cefalofaryngeální skelet 2. Hltan 3. Tracheje - ústí 4. Kruhová žláza 5. Mozková ganglia 6. Jícen 7. Žaludeční oblast 8. Předžaludek 9. Přední Malphigiho trubice 10. Střední střevo 11. Tukové těleso 12. Vaječník 13. Zadní střevo 14. Tracheje 15. Zadní Malphigiho trubice 16. Anální otvor 17. Břišní ganglion 18. Slinná žláza 19. Semenný váček 20. Zadní otvor pro dýchání 18
19 Mitotická metafáze u D. melanogaster (sameček) 19
20 metafázní chromozómy Metafázní chromozómy v mozkových gangliích drozofily. Z: 1 000x (imerze). Úsečka 10 µm. Foto Pavla Válová. Pracovní postup: CVIČENÍ č. 3: I Z O L A C E C H R O M O Z Ó M Ů Materiál: kořenový meristém bobu (Vicia faba L.) Synchronizace: 2,5 mm HU* hod. Akumulace metafází: 2,5 µm APM*... 2 hod. Fixáž chromozómů: TRIS fixáž + 4% formaldehyd. 30 min, 5 C Promytí: TRIS pufr x 5 min Izolace chromozómů: 20 špiček na vzorek, homogenizace ot./18 s filtrace přes 50µm filtr Barvení: DAPI - pracovní roztok** Kápnutí 3 µl suspenze na podložní sklo. Pozorování ve fluorescenčním mikroskopu (s fluorescenční kostkou na DAPI WU). * HU = hydroxymočovina, APM = amiprophosmethyl ** viz. DODATKY v Skriptech Cvičení z cytotaxonomie a cytogenetiky : Příprava vybraných barviv a roztoků 20
21 DODATKY POSTUP FIXACE ROSTLINNÉHO PLETIVA (k barvení chromozómů) 1.den - odebrat (odstřihnout) alespoň 10 ks 1 cm dlouhých kořenových špiček (nejlépe ráno) - vložit do epruvetky s nasyceným roztokem paradichlorbenzenu (jedovatý!!!) na 4 hod. k předpůsobení (při použití 0,1% vodného roztoku kolchicinu (Jed!!!) doba působení 2-2,5 hod.) označit vzorek + datum fixace (bílý papír, obyčejná tužka) - 2x propláchnout destilovanou vodou po 15 min (pozor na záměnu kořínků) - nalít čerstvě připravený fixační roztok (Carnoy I, tj. FAE, alkohol-octová fixáž, 3 : 1 = 3 díly 96% etanolu a 1 díl led. kyseliny octové) Pozn.: nejlépe nalít trochu fixáže, vylít a zalít novou dávkou fixáže až po okraj (50x více než vzorek) - nechat přes noc v chladničce při 4 C 2.den - vylít fixáž (pozor na ztrátu kořínků) - 2x propláchnout 96% etanolem po 15 min působení (Pozn.: kyselina octová se musí dostat pryč z pletiva) - zalít 70% etanolem - uložit do chladničky (4 C) k dlouhodobému uchování (0,5 až 1 rok) POZOR: Při práci s fixáží používat ochranné gumové rukavice a ochranný kryt na oči! Sterilizace semen SAVO dezinfence 100 ml/1l (1 ml/10 ml vody). 3 min Propláchnout sterilní destilovanou vodou. 2-3% SAVO (chlornan sodný 5-7% akt. Cl) 0,02-0,03 l/1l tj. 80 ml/4l. tj. 20 ml/l Propláchnout sterilní destilovanou vodou. Sterilizace semen vojtěšky na embryogenezi (aseptická kultivace) - opláchnutí v 70% etanolu - 5% chloramin 30 min - propláchnutí sterilní destilovanou vodou 8x Nejčastější problémy při přípravě a hodnocení karyologických preparátů (Podle Krahulcová, A. (1998): Karyologie cévnatých rostlin. Příručka praktického cvičení pro posluchače katedry botaniky Přírodovědecké fakulty UK Praha.) V meristémech je málo nahromaděných metafází, intenzita buněčného dělení je nízká. Vyzkoušet různou dobu trvání předpůsobení, případně teplotu. Pokud máme možnost, vyzkoušíme i jinou chemikálii. V případě použití kolchicinu, který má velmi široký záběr (účinkuje na široké spektrum taxonů), pozor na jeho vhodnou koncentraci: pletiva vystavená příliš vysoké koncentraci kolchicinu mají jádra s chromozómy jakoby nabobtnalými a slepenými dohromady, tvořícími útvar podobný klubíčku. Tento stav se již nedá změnit a takové preparáty jsou zcela nepoužitelné. Příliš 21
22 dlouhá doba předpůsobení vede obvykle ke vzniku tzv. endomitóz, vznikajících rozdělením chromozómů bez současného rozdělení jádra. Takové buňky bývají v pletivu rozpoznatelné podle toho, že obsahují dvojnásobný počet chromozómů, sestávajících jen z jedné chromatidy (jsou oproti normálním chromozómům v ostatních buňkách o polovinu tenčí). Chyba může spočívat i v nesprávném odebírání pletiv, kde chybějí aktivně se dělící buňky. Optimální doba odběru (zvláště v terénu v teplých dnech) bývá ráno až časné dopoledne. Začátečníkům někdy činí potíže i rozpoznání aktivně rostoucích kořínků s meristematickou špičkou (kořínky nesmějí být ani příliš přerostlé, ani zaschlé). Buňky jsou na preparátu špatně rozprostřené, tvoří více překrývajících se vrstev. Opatrně prodloužit dobu macerace, případně zvýšit koncentraci HCl (pokud používáme maceraci za tepla). Preparát není čistý, pozorování ruší kousky vysráženého barviva. Tento problém nastává při použití laktopropionorceinu, pokud jsme dostatečně neodsáli přebytečnou vodu na podložním sklíčku před barvením a rozmáčknutím objektu. Zmíněný roztok barviva se při delším skladování rovněž postupně sráží a je třeba jej občas přefiltrovat. Krycí sklíčko praská. Pro pozorování preparátů imerzním objektivem (zvětšení 60x, 100x) volíme tenká krycí sklíčka (označená č. 0), která jsou ale poměrně křehká. Jejich praskání při roztlaku kořenových špiček můžeme omezit dokonalým vypráním objektů tak, aby na nich neulpívaly zbytky substrátu (zrnka písku, částečky půdy). Pozor na přílišný tlak na sklíčko při dodatečném rozmačkávání objektu! Buňky jsou potrhané, chromozómy rozházené mimo původní jádra. Zmírnit tlak při rozmačkávání tkání nebo zkrátit dobu macerace. Cytoplazma se přebarvuje. Objekty mohly být příliš dlouho uchovávané ve fixační směsi: tomu lze předejít jen nezbytnou dobou fixace a následovným skladováním materiálu v 70% etanolu až do dalšího zpracování. Někdy pomůže k projasnění cytoplazmy macerace za tepla (1M HCl při 60 C) místo jednodušší macerace za studena ve směsi HCl-etanol. Další možností je použití karmínu místo orceinu jako jaderného barviva (orcein barví chromozómy intenzivněji než karmín, ale obvykle častěji přebarvuje cytoplazmu). Chromozómy jsou málo intenzivně obarvené. Špatná barvitelnost chromozómů může být způsobena příliš dlouhým skladováním materiálu nebo nedokonalým vypráním vodou mezi předpůsobením, fixací, macerací a barvením. Chromozómy některých taxonomických skupin jsou skutečně obtížně barvitelné jak orceinem, tak karmínem. Lze pro ně vyzkoušet i jiná jaderná barviva a jiné postupy. Slabě obarvené nebo vůbec neobarvené struktury lze dobře studovat při použití mikroskopu s fázovým kontrastem. Chromozómy ve stádiu metafáze jsou uspořádány příliš blízko sebe nebo neleží v jedné vrstvě. Pokud jsme jinak s kvalitou preparátu spokojeni (chromozómy jsou dostatečně obarvené a s jasnými obrysy), můžeme si pomoci jemným roztlačením příslušné metafáze preparační jehlou přímo pod mikroskopem. K tomu jsou nejvhodnější metafáze umístěné na okraji roztlačeného pletiva, které mají kolem sebe dost prostoru. Metafázi si najdeme na preparátu pod méně zvětšujícím objektivem (obvykle 10x nebo 16x), prstem přidržíme roh krycího sklíčka a špičkou preparační jehly opatrně příslušné místo roztlačíme za současné kontroly v okulárech mikroskopu. Tlak musí být zpočátku velmi jemný, výsledek stále kontrolujeme mikroskopem. Tento postup vyžaduje zkušenost a cvik - pokud chromozómy rozmáčkneme příliš intenzivně, je zpočátku často velmi pěkná metafáze nenávratně zničená. V jedné metafázi je příliš mnoho chromozómů, nejsou všechny zároveň dobře zaostřené, obtížně se počítají. Je-li k dispozici kreslící zařízení, vypomůžeme si schematickým zakreslováním jednotlivých chromozómů při současném jemném proostřování. Můžeme vyzkoušet i počítání chromozómů v zárodečných buňkách (v pylových mateřských buňkách), které již prošly redukčním dělením a kde je chromozómový počet poloviční oproti buňkám somatickým. 22
23 Příprava trvalých preparátů metodou odstranění krycího sklíčka pomocí zamrazení: - roztlak objektu pomocí krycího sklíčka v kapce 45% kyselině octové - ponoření preparátu s roztlakem do tekutého dusíku (-196 C) nebo položení preparátu na povrch tuhého CO 2 (-70 C)* na tak dlouho, až v případě v případě použití tekutého dusíku se přestanou vytvářet páry dusíku (preparát přestane syčet ) nebo v případě použití tuhého CO 2 povrch krycího sklíčka zbělá - okamžité odstranění krycího sklíčka žiletkou - neprodlené přenesení preparátu do 96% etanolu na 5 min a pak do 100% (možno i 96%) etanolu na 10 min - vysušení preparátu na vzduchu - uzavření krycím sklíčkem do uzavírajícího média (Euparal, DePeX) Conger A.D., Fairchild L.M., A quick-freeze method for making smear slides permanent. Stain Technol. 28: * Pracujeme v ochranných rukavicích a v případě tekutého dusíku i s ochranným štítem na oči! Měření velikosti mikroskopických objektů - měření délky a šířky Mikroskopické objekty nemůžeme vhledem k jejich malým rozměrům měřit přímo, ale pouze zprostředkovaně. Při měření délky a šířky mikroskopických objektů používáme dvě měřítka: objektivové a okulárové. Objektivové měřítko (objektivní mikrometr) je broušená skleněná destička velikosti podložního skla, na níž je uprostřed v kruhové zóně vyryto nebo fotografickou cestou naneseno měřítko v celkové délce nejčastěji 1 mm, dělené na 100 dílků. Jeden dílek pak odpovídá délce 0,01 mm, tj. 10 µm. Okulárový mikrometr je sklíčko vložené v okuláru v rovině, kde vzniká obraz pozorovaného předmětu (tj. v místě okulárové clony), a opatřené úsečkou o celkové délce 1 cm rozdělené na 100 dílků (případně o úsečce 0,5 cm dělené na 50 dílků). Okulárové měřítko je na rozdíl od objektivového očíslované. Při jeho použití vidíme v okuláru obraz předmětu a měřítko současně. Ve srovnání s objektivovým měřítkem, kde jeden dílek má konkrétní absolutní hodnotu (10 µm), je okulárové měřítko relativní, protože skutečná délka jednoho dílku závisí na použitém objektivu a mění se s jeho zvětšením.. Mikrofotografie objektivového měřítka (1 mm) 23
24 Určení mikrometrických koeficientů (k) pro jednotlivé objektivy školního mikroskopu CHK-2: Pomůcky: objektivové měřítko (objektivní mikrometr) (OB měřítko) okulárové měřítko (okulárový mikrometr) (OK měřítko) vložený do okuláru na clonku, stupnicí dolů případně samostatný měřicí okulár 10x pro mikroskop CHK-2 s již vestavěným OK měřítkem Postup měření: 1. Na stolek mikroskopu vložíme místo preparátu objektivové měřítko. 2. Okulárem s měřítkem zaostříme objektivové měřítko. 3. Obě měřítka srovnáme do rovnoběžné polohy otočením okuláru a posunem objektivového měřítka na křížovém stolku tak, aby se vzájemně překrývaly. 4. Objektivní mikrometr posouváme až do okamžiku, kdy se jeho počáteční ryska kryje s počáteční ryskou OK měřítka. Hledáme pak, která další ryska OK měřítka se přesně kryje s některou ryskou OB měřítka a spočítáme, kolik dílků OK a OB stupnice se vzájemně rovná. 5. Vypočítáme mikrometrický koeficient (k) použitého objektivu podle vzorce: počet dílků OB měřítka. 10 k = [µm] odpovídající počet dílků OK měřítka Mikrometrický koeficient udává, kolika mikrometrům odpovídá jeden dílek OK měřítka pro daný objektiv. 6. Vypočítané hodnoty k pro jednotlivé objektivy školního mikroskopu zapíšeme do tabulky. Poznámka: Mikrometrický koeficient platí jen pro určitý objektiv, okulár a danou délkou tubusu. Mění-li se některá z těchto složek, musí se koeficient vypočítat znovu. Mikrometrický koeficient (k) pro objektivy školního mikroskopu CHK-2 Olympus: obj. 4x k = 25 [µm] obj. 10x... k = 10 obj. 20x k = 5 obj. 40x k = 2,5 obj. 100x (imerze)... k = 1 24
Inovace studia molekulární. a buněčné biologie
 Inovace studia molekulární I n v e s t i c e d o r o z v o j e v z d ě l á v á n í a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Tento projekt je spolufinancován Evropským sociálním fondem a státním
Inovace studia molekulární I n v e s t i c e d o r o z v o j e v z d ě l á v á n í a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Tento projekt je spolufinancován Evropským sociálním fondem a státním
MITÓZA V BUŇKÁCH KOŘENOVÉ ŠPIČKY CIBULE ( ALLIUM CEPA L.)
 MITÓZA V BUŇKÁCH KOŘENOVÉ ŠPIČKY CIBULE ( ALLIUM CEPA L.) (Základní technika barvení chromozomů. Fáze buněčného cyklu a mitózy podle nativního a trvalého preparátu. Výpočet mitotického indexu.) ÚVOD Sled
MITÓZA V BUŇKÁCH KOŘENOVÉ ŠPIČKY CIBULE ( ALLIUM CEPA L.) (Základní technika barvení chromozomů. Fáze buněčného cyklu a mitózy podle nativního a trvalého preparátu. Výpočet mitotického indexu.) ÚVOD Sled
Mitóza a buněčný cyklus
 Mitóza a buněčný cyklus Něco o chromosomech - Chromosom = 1 molekula DNA + navázané proteiny -V diploidní buňce jsou od každého chromosomu 2 kopie (= homologní chromosomy) - Homologní chromosomy nesou
Mitóza a buněčný cyklus Něco o chromosomech - Chromosom = 1 molekula DNA + navázané proteiny -V diploidní buňce jsou od každého chromosomu 2 kopie (= homologní chromosomy) - Homologní chromosomy nesou
Analýza buněčného cyklu cibule kuchyňské (Allium cepa)
 Analýza buněčného cyklu cibule kuchyňské (Allium cepa) Shrnutí Příprava roztlakových preparátů z kořínků cibule je klasická a jednoduchá metoda, která umožňuje demonstrovat fáze buněčného cyklu (interfázi,
Analýza buněčného cyklu cibule kuchyňské (Allium cepa) Shrnutí Příprava roztlakových preparátů z kořínků cibule je klasická a jednoduchá metoda, která umožňuje demonstrovat fáze buněčného cyklu (interfázi,
44 somatických chromozomů pohlavní hormony (X,Y) 46 chromozomů
 Buněčný cyklus MUDr.Kateřina Kapounková Inovace studijního oboru Regenerace a výţiva ve sportu (CZ.107/2.2.00/15.0209) 1 DNA,geny genom = soubor všech genů a všechna DNA buňky; kompletní genetický materiál
Buněčný cyklus MUDr.Kateřina Kapounková Inovace studijního oboru Regenerace a výţiva ve sportu (CZ.107/2.2.00/15.0209) 1 DNA,geny genom = soubor všech genů a všechna DNA buňky; kompletní genetický materiál
Cvičeníč. 4: Chromozómy, karyotyp a mitóza. Mgr. Zbyněk Houdek
 Cvičeníč. 4: Chromozómy, karyotyp a mitóza Mgr. Zbyněk Houdek Chromozomy Geny jsou u eukaryotických organizmů z převážnéčásti umístěny právě na chromozómech v b. jádře. Jejich velikost a tvar jsou rozmanité,
Cvičeníč. 4: Chromozómy, karyotyp a mitóza Mgr. Zbyněk Houdek Chromozomy Geny jsou u eukaryotických organizmů z převážnéčásti umístěny právě na chromozómech v b. jádře. Jejich velikost a tvar jsou rozmanité,
Karyokineze. Amitóza. Mitóza. Meióza. Dělení jádra. Předchází dělení buňky Dochází k rozdělení genetické informace u mateřské buňky.
 Karyokineze Dělení jádra Předchází dělení buňky Dochází k rozdělení genetické informace u mateřské buňky Druhy karyokineze Amitóza Mitóza Meióza Amitóza Přímé dělení jádra Genetická informace je rozdělena
Karyokineze Dělení jádra Předchází dělení buňky Dochází k rozdělení genetické informace u mateřské buňky Druhy karyokineze Amitóza Mitóza Meióza Amitóza Přímé dělení jádra Genetická informace je rozdělena
příjmení a jméno: den a hodina cvičení: datum:
 příjmení a jméno: den a hodina cvičení: datum: obr. 1: lokalizace nejčastějších parazitů skotu obr. 2: propagační stadia parazitů skotu 1 obr. 3: lokalizace nejčastějších parazitů malých přežvýkavců obr.
příjmení a jméno: den a hodina cvičení: datum: obr. 1: lokalizace nejčastějších parazitů skotu obr. 2: propagační stadia parazitů skotu 1 obr. 3: lokalizace nejčastějších parazitů malých přežvýkavců obr.
http://www.accessexcellence.org/ab/gg/chromosome.html
 3. cvičení Buněčný cyklus Mitóza Modifikace mitózy 1 DNA, chromosom genetická informace organismu chromosom = strukturní podoba DNA během dělení (mitózy) řetězec DNA (chromonema) histony další enzymatické
3. cvičení Buněčný cyklus Mitóza Modifikace mitózy 1 DNA, chromosom genetická informace organismu chromosom = strukturní podoba DNA během dělení (mitózy) řetězec DNA (chromonema) histony další enzymatické
Vitální barvení, rostlinná buňka, buněčné organely
 Vitální barvení, rostlinná buňka, buněčné organely Vitální barvení používá se u nativních preparátů a rozumíme tím zvýšení kontrastu určitých buněčných složek v živých buňkách, nebo tkáních pomocí barvení
Vitální barvení, rostlinná buňka, buněčné organely Vitální barvení používá se u nativních preparátů a rozumíme tím zvýšení kontrastu určitých buněčných složek v živých buňkách, nebo tkáních pomocí barvení
MITÓZA V BUŇKÁCH KOŘÍNKU CIBULE
 Cvičení 6: BUNĚČNÝ CYKLUS, MITÓZA Jméno: Skupina: MITÓZA V BUŇKÁCH KOŘÍNKU CIBULE Trvalý preparát: kořínek cibule obarvený v acetorceinu V buňkách kořínku cibule jsou viditelné různé mitotické figury.
Cvičení 6: BUNĚČNÝ CYKLUS, MITÓZA Jméno: Skupina: MITÓZA V BUŇKÁCH KOŘÍNKU CIBULE Trvalý preparát: kořínek cibule obarvený v acetorceinu V buňkách kořínku cibule jsou viditelné různé mitotické figury.
LABORATORNÍ PRÁCE Č.
 Úkol A: Pozorování parenchymu suknice cibule kuchyňské Pomůcky: cibule kuchyňská, pomůcky k mikroskopování a) Rozřízněte cibuli, vyjměte jeden vnitřní zdužnatělý list. b) Z vnitřní strany listu sejměte
Úkol A: Pozorování parenchymu suknice cibule kuchyňské Pomůcky: cibule kuchyňská, pomůcky k mikroskopování a) Rozřízněte cibuli, vyjměte jeden vnitřní zdužnatělý list. b) Z vnitřní strany listu sejměte
FYZIOLOGIE ROSTLIN Laboratorní práce č. 3
 Téma: Vodní režim rostlin FYZIOLOGIE ROSTLIN Laboratorní práce č. 3 Pozn: Úkoly 1-3 vyhodnoťte po 24 hodinách až týdnu. Prodiskutujte výsledky nejprve teoreticky, poté srovnejte s výsledkem skutečným.
Téma: Vodní režim rostlin FYZIOLOGIE ROSTLIN Laboratorní práce č. 3 Pozn: Úkoly 1-3 vyhodnoťte po 24 hodinách až týdnu. Prodiskutujte výsledky nejprve teoreticky, poté srovnejte s výsledkem skutečným.
Základní pojmy a vztahy: Vlnová délka (λ): vzdálenost dvou nejbližších bodů vlnění kmitajících ve stejné fázi
 LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 1. SVĚTELNÁ MIKROSKOPIE A PREPARÁTY V MIKROSKOPII TEORETICKÝ ÚVOD: Mikroskopie je základní metoda, která nám umožňuje pozorovat velmi malé biologické objekty. Díky
LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 1. SVĚTELNÁ MIKROSKOPIE A PREPARÁTY V MIKROSKOPII TEORETICKÝ ÚVOD: Mikroskopie je základní metoda, která nám umožňuje pozorovat velmi malé biologické objekty. Díky
POHLAVNÍ CHROMATINOVÝ ZNAK U ČLOVĚKA - SEX CHROMATIN
 POHLAVNÍ CHROMATINOVÝ ZNAK U ČLOVĚKA - SEX CHROMATIN (Barvení a pozorování Barrova tělíska v jádrech buněk ústní sliznice. Procentuální zastoupení pohlavního chromatinu v buňkách žen a mužů. Fluorescenční
POHLAVNÍ CHROMATINOVÝ ZNAK U ČLOVĚKA - SEX CHROMATIN (Barvení a pozorování Barrova tělíska v jádrech buněk ústní sliznice. Procentuální zastoupení pohlavního chromatinu v buňkách žen a mužů. Fluorescenční
DUM č. 2 v sadě. 37. Bi-2 Cytologie, molekulární biologie a genetika
 projekt GML Brno Docens DUM č. 2 v sadě 37. Bi-2 Cytologie, molekulární biologie a genetika Autor: Martin Krejčí Datum: 02.06.2014 Ročník: 6AF, 6BF Anotace DUMu: meióza-redukční dělení jádra, význam, princip,
projekt GML Brno Docens DUM č. 2 v sadě 37. Bi-2 Cytologie, molekulární biologie a genetika Autor: Martin Krejčí Datum: 02.06.2014 Ročník: 6AF, 6BF Anotace DUMu: meióza-redukční dělení jádra, význam, princip,
PARAZITÉ Z BLÍZKA LARVY MOTOLIC (PRACOVNÍ LIST)
 PARAZITÉ Z BLÍZKA LARVY MOTOLIC (PRACOVNÍ LIST) Mgr. Kateřina Mikešová, UK v Praze, PřF, katedra učitelství a didaktiky biologie Jméno studenta: Třída: Datum: Motolice jsou výhradně endoparazité obratlovců,
PARAZITÉ Z BLÍZKA LARVY MOTOLIC (PRACOVNÍ LIST) Mgr. Kateřina Mikešová, UK v Praze, PřF, katedra učitelství a didaktiky biologie Jméno studenta: Třída: Datum: Motolice jsou výhradně endoparazité obratlovců,
Mitóza, meióza a buněčný cyklus. Milan Dundr
 Mitóza, meióza a buněčný cyklus Milan Dundr Rozmnožování eukaryotických buněk Mitóza (mitosis) Mitóza dělení (nepřímé) tělních (somatických) buněk 1 jádro s2n (diploidním počtem) chromozómů (dvouchromatidových)
Mitóza, meióza a buněčný cyklus Milan Dundr Rozmnožování eukaryotických buněk Mitóza (mitosis) Mitóza dělení (nepřímé) tělních (somatických) buněk 1 jádro s2n (diploidním počtem) chromozómů (dvouchromatidových)
Protokol ke cvičení z Biologie vodních živočichů
 Katedra zoologie a Ornitologická laboratoř Protokol ke cvičení z Biologie vodních živočichů Jméno : Obor,ročník : Datum : Úvod Cílem tohoto cvičení je praktická ukázka fixace a preparace vodních bezobratlých
Katedra zoologie a Ornitologická laboratoř Protokol ke cvičení z Biologie vodních živočichů Jméno : Obor,ročník : Datum : Úvod Cílem tohoto cvičení je praktická ukázka fixace a preparace vodních bezobratlých
Praktické cvičení č. 1.
 Praktické cvičení č. 1. Cvičení 1. 1. Všeobecné pokyny ke cvičení, zápočtu a zkoušce Bezpečnost práce 2. Mikroskopie - mikroskop a mikroskopická technika - převzetí pracovních pomůcek - pozorování trvalého
Praktické cvičení č. 1. Cvičení 1. 1. Všeobecné pokyny ke cvičení, zápočtu a zkoušce Bezpečnost práce 2. Mikroskopie - mikroskop a mikroskopická technika - převzetí pracovních pomůcek - pozorování trvalého
Rozmnožování buněk Vertikální přenos GI. KBI / GENE Mgr. Zbyněk Houdek
 Rozmnožování buněk Vertikální přenos GI KBI / GENE Mgr. Zbyněk Houdek Buněčný cyklus Buňky vznikají z bb. a jedinou možnou cestou, jak vytvořit více bb. je jejich dělením. Vertikální přenos GI: B. (mateřská)
Rozmnožování buněk Vertikální přenos GI KBI / GENE Mgr. Zbyněk Houdek Buněčný cyklus Buňky vznikají z bb. a jedinou možnou cestou, jak vytvořit více bb. je jejich dělením. Vertikální přenos GI: B. (mateřská)
LABORATORNÍ CVIČENÍ Z BIOLOGIE. Téma: STAVBA A FUNKCE MIKROSKOPU, PŘÍPRAVA DOČASNÝCH PREPARÁTŮ
 LABORATORNÍ CVIČENÍ Z BIOLOGIE Téma: STAVBA A FUNKCE MIKROSKOPU, PŘÍPRAVA DOČASNÝCH PREPARÁTŮ Úloha č.1.: Seznámení se stavbou optického mikroskopu a zásadami práce s mikroskopem ÚKOLY: a) teoretické:
LABORATORNÍ CVIČENÍ Z BIOLOGIE Téma: STAVBA A FUNKCE MIKROSKOPU, PŘÍPRAVA DOČASNÝCH PREPARÁTŮ Úloha č.1.: Seznámení se stavbou optického mikroskopu a zásadami práce s mikroskopem ÚKOLY: a) teoretické:
PRÁCE S MIKROSKOPEM Praktická příprava mikroskopického preparátu
 PRÁCE S MIKROSKOPEM 1. Praktická příprava mikroskopického preparátu 2. a) Z objektu, jehož část, chceme pozorovat pomocí mikroskopu, musíme nejprve vytvořit mikroskopický preparát. Obr. č. 1 b) Pozorovaný
PRÁCE S MIKROSKOPEM 1. Praktická příprava mikroskopického preparátu 2. a) Z objektu, jehož část, chceme pozorovat pomocí mikroskopu, musíme nejprve vytvořit mikroskopický preparát. Obr. č. 1 b) Pozorovaný
PREPARACE BUNĚK SLINNÝCH ŽLAZ LARVA PAKOMÁRA
 PREPARACE BUNĚK SLINNÝCH ŽLAZ LARVA PAKOMÁRA Larva pakomára: - Fixace: Du Noyerova fixáž (96% alkohol a kyselina octová ledová, 3:1) - Barvení: ORCEIN larvy v orceinu cca 20-40 min, potom do PBS Na očistěné
PREPARACE BUNĚK SLINNÝCH ŽLAZ LARVA PAKOMÁRA Larva pakomára: - Fixace: Du Noyerova fixáž (96% alkohol a kyselina octová ledová, 3:1) - Barvení: ORCEIN larvy v orceinu cca 20-40 min, potom do PBS Na očistěné
Název: POZOROVÁNÍ PLASTIDŮ,VAKUOL, BUNĚČNÉ STĚNY Autor: Paed.Dr.Ludmila Pipková
 Název: POZOROVÁNÍ PLASTIDŮ,VAKUOL, BUNĚČNÉ STĚNY Autor: Paed.Dr.Ludmila Pipková Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět: biologie Mezipředmětové vztahy: ekologie Ročník: 2.a 3.
Název: POZOROVÁNÍ PLASTIDŮ,VAKUOL, BUNĚČNÉ STĚNY Autor: Paed.Dr.Ludmila Pipková Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět: biologie Mezipředmětové vztahy: ekologie Ročník: 2.a 3.
Sešit pro laboratorní práci z biologie
 Sešit pro laboratorní práci z biologie téma: Vegetativní orgány anatomie kořene autor: Mgr. Libor Kotas vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační
Sešit pro laboratorní práci z biologie téma: Vegetativní orgány anatomie kořene autor: Mgr. Libor Kotas vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační
Karyotyp člověka. Karyotyp soubor chromozomů v jádře buňky. Význam v genetickém poradenství ke stanovení změn ve struktuře a počtu chromozomů
 Karyotyp soubor chromozomů v jádře buňky Význam v genetickém poradenství ke stanovení změn ve struktuře a počtu chromozomů Historie: 20. léta 20. století přibližný počet chromozomů v buňce člověka 1956
Karyotyp soubor chromozomů v jádře buňky Význam v genetickém poradenství ke stanovení změn ve struktuře a počtu chromozomů Historie: 20. léta 20. století přibližný počet chromozomů v buňce člověka 1956
8 cyklinů (A, B, C, D, E, F, G a H) - v jednotlivých fázích buněčného cyklu jsou přítomny určité typy cyklinů
 Buněč ěčné dělení BUNĚČ ĚČNÝ CYKLUS ŘÍZENÍ BUNĚČ ĚČNÉHO CYKLU cykliny a na cyklinech závislé proteinkinázy (Cyclin-Dependent Protein Kinases; Cdk-proteinkinázy) - proteiny, které jsou součástí řídícího
Buněč ěčné dělení BUNĚČ ĚČNÝ CYKLUS ŘÍZENÍ BUNĚČ ĚČNÉHO CYKLU cykliny a na cyklinech závislé proteinkinázy (Cyclin-Dependent Protein Kinases; Cdk-proteinkinázy) - proteiny, které jsou součástí řídícího
- význam: ochranná funkce, dodává buňce tvar. jádro = karyon, je vyplněné karyoplazmou ( polotekutá tekutina )
 Otázka: Buňka a dělení buněk Předmět: Biologie Přidal(a): Štěpán Buňka - cytologie = nauka o buňce - rostlinná a živočišná buňka jsou eukaryotické buňky Stavba rostlinné (eukaryotické) buňky: buněčná stěna
Otázka: Buňka a dělení buněk Předmět: Biologie Přidal(a): Štěpán Buňka - cytologie = nauka o buňce - rostlinná a živočišná buňka jsou eukaryotické buňky Stavba rostlinné (eukaryotické) buňky: buněčná stěna
Protokol 04. pšeničná bílkovina. masné výrobky. zkrácená verze
 1 Popis vzorku Podle protokolu č. 04 lze vyšetřit vzorky různých druhů masných výrobků na přítomnost pšeničné bílkoviny. 2 Detekční limit vyšetření Přítomnost pšeničné bílkoviny lze spolehlivě prokázat,
1 Popis vzorku Podle protokolu č. 04 lze vyšetřit vzorky různých druhů masných výrobků na přítomnost pšeničné bílkoviny. 2 Detekční limit vyšetření Přítomnost pšeničné bílkoviny lze spolehlivě prokázat,
Buněčné dělení ŘÍZENÍ BUNĚČNÉHO CYKLU
 BUNĚČNÝ CYKLUS Buněčné dělení Cykliny a na cyklinech závislé proteinkinázy (Cyclin- Dependent Protein Kinases; Cdk-proteinkinázy) - proteiny, které jsou součástí řídícího systému buněčného cyklu 8 cyklinů
BUNĚČNÝ CYKLUS Buněčné dělení Cykliny a na cyklinech závislé proteinkinázy (Cyclin- Dependent Protein Kinases; Cdk-proteinkinázy) - proteiny, které jsou součástí řídícího systému buněčného cyklu 8 cyklinů
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 8 Sacharidy Pro potřeby projektu
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 8 Sacharidy Pro potřeby projektu
TRVALÝ PREPARÁT. Zhotovení roztěru
 TRVALÝ PREPARÁT Zhotovení trvalého preparátu zahrnuje usmrcení, fixování a barvení objektu. Podle způsobu zpracování rozeznáváme preparáty celkové (obsahují celý organismus), nátěrové, roztěrové, roztlakové,
TRVALÝ PREPARÁT Zhotovení trvalého preparátu zahrnuje usmrcení, fixování a barvení objektu. Podle způsobu zpracování rozeznáváme preparáty celkové (obsahují celý organismus), nátěrové, roztěrové, roztlakové,
1 Popis vzorku. 2 Detekční limit vyšetření. 3 Časová náročnost. 4 Zpracování vzorku. 4.1 Množství vzorku. 4.2 Odběr vzorků
 1 Popis vzorku Podle tohoto postupu se vyšetřují vzorky různých druhů masných výrobků. Pomocí histochemického barvení lze prokázat přítomnost škrobových zrn a na jejich základě vyslovit podezření o použití
1 Popis vzorku Podle tohoto postupu se vyšetřují vzorky různých druhů masných výrobků. Pomocí histochemického barvení lze prokázat přítomnost škrobových zrn a na jejich základě vyslovit podezření o použití
Cvičení 5: VYŠETŘENÍ KRVE Jméno: PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU - KREVNÍ NÁTĚR
 Cvičení 5: VYŠETŘENÍ KRVE Jméno: Skupina: PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU - KREVNÍ NÁTĚR Praktický úkol: 1. K jedné straně podložního skla kápněte malou kapku savčí krve. 2. Před kapku přiložte
Cvičení 5: VYŠETŘENÍ KRVE Jméno: Skupina: PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU - KREVNÍ NÁTĚR Praktický úkol: 1. K jedné straně podložního skla kápněte malou kapku savčí krve. 2. Před kapku přiložte
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í LABORATORNÍ PRÁCE Č. 34 MIKROSKOPIE
 LABORATORNÍ PRÁCE Č. 34 MIKROSKOPIE PRINCIP V chemické laboratoři se používá k některým stanovením tzv. mikrokrystaloskopie. Jedná se o použití optického mikroskopu při kvalitativních důkazech látek na
LABORATORNÍ PRÁCE Č. 34 MIKROSKOPIE PRINCIP V chemické laboratoři se používá k některým stanovením tzv. mikrokrystaloskopie. Jedná se o použití optického mikroskopu při kvalitativních důkazech látek na
MODULARIZACE VÝUKY EVOLUČNÍ A EKOLOGICKÉ BIOLOGIE CZ.1.07/2.2.00/
 MODULARIZACE VÝUKY EVOLUČNÍ A EKOLOGICKÉ BIOLOGIE CZ.1.07/2.2.00/15.0204 MODULARIZACE VÝUKY EVOLUČNÍ A EKOLOGICKÉ BIOLOGIE CZ.1.07/2.2.00/15.0204 analýza mikroskopické struktury chromozomů pojem chromozom
MODULARIZACE VÝUKY EVOLUČNÍ A EKOLOGICKÉ BIOLOGIE CZ.1.07/2.2.00/15.0204 MODULARIZACE VÝUKY EVOLUČNÍ A EKOLOGICKÉ BIOLOGIE CZ.1.07/2.2.00/15.0204 analýza mikroskopické struktury chromozomů pojem chromozom
Inovace studia molekulární a buněčné biologie
 Inovace studia molekulární a buněčné biologie I n v e s t i c e d o r o z v o j e v z d ě l á v á n í reg. č. CZ.1.07/2.2.00/07.0354 Tento projekt je spolufinancován Evropským sociálním fondem a státním
Inovace studia molekulární a buněčné biologie I n v e s t i c e d o r o z v o j e v z d ě l á v á n í reg. č. CZ.1.07/2.2.00/07.0354 Tento projekt je spolufinancován Evropským sociálním fondem a státním
Základy mikroskopování
 Gymnázium a Střední odborná škola pedagogická, Čáslav, Masarykova 248 M o d e r n í b i o l o g i e reg. č.: CZ.1.07/1.1.32/02.0048 TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM
Gymnázium a Střední odborná škola pedagogická, Čáslav, Masarykova 248 M o d e r n í b i o l o g i e reg. č.: CZ.1.07/1.1.32/02.0048 TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM
ROZMNOŽOVÁNÍ BUŇKY příručka pro učitele
 ROZMNOŽOVÁNÍ BUŇKY příručka pro učitele Obecné informace Téma Rozmnožování buňky je určeno na dvě až tři vyučovací hodiny. Toto téma je zpracováno jako jeden celek a záleží na vyučujícím, jak jej rozdělí.
ROZMNOŽOVÁNÍ BUŇKY příručka pro učitele Obecné informace Téma Rozmnožování buňky je určeno na dvě až tři vyučovací hodiny. Toto téma je zpracováno jako jeden celek a záleží na vyučujícím, jak jej rozdělí.
Z Buchanan et al. 2000
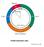 Průběh buněčného cyklu Z Buchanan et al. 2000 Změny v uspořádání mikrotubulů v průběhu buněčného cyklu A interfáze, kortikální mikrotubuly uspořádané v cytoplasmě pod plasmalemou B konec G2 fáze, mikrotubuly
Průběh buněčného cyklu Z Buchanan et al. 2000 Změny v uspořádání mikrotubulů v průběhu buněčného cyklu A interfáze, kortikální mikrotubuly uspořádané v cytoplasmě pod plasmalemou B konec G2 fáze, mikrotubuly
Název: VNITŘNÍ STAVBA KOŘENE
 Název: VNITŘNÍ STAVBA KOŘENE Autor: PaedDr. Ludmila Pipková Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět: biologie Mezipředmětové vztahy: ekologie Ročník: 2. a 3. (1. ročník vyššího
Název: VNITŘNÍ STAVBA KOŘENE Autor: PaedDr. Ludmila Pipková Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět: biologie Mezipředmětové vztahy: ekologie Ročník: 2. a 3. (1. ročník vyššího
Název práce: Rostlinná buňka a látky v ní obsažené. Odstavce Vzdělávací cíl, Pomůcky a Inovace viz následující strana
 Datum: 30. 12. 2012 Projekt: Využití ICT techniky především v uměleckém vzdělávání Registrační číslo: CZ.1.07/1.5.00/34.1013 Číslo DUM: VY_32_INOVACE_270 Škola: Akademie - VOŠ, Gymn. a SOŠUP Světlá nad
Datum: 30. 12. 2012 Projekt: Využití ICT techniky především v uměleckém vzdělávání Registrační číslo: CZ.1.07/1.5.00/34.1013 Číslo DUM: VY_32_INOVACE_270 Škola: Akademie - VOŠ, Gymn. a SOŠUP Světlá nad
Rostlinná buňka příprava mikroskopického preparátu (laboratorní práce)
 Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.128/02.0055 Rostlinná buňka příprava mikroskopického preparátu (laboratorní práce) Označení: EU-Inovace-Př-6-02 Předmět: přírodopis
Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.128/02.0055 Rostlinná buňka příprava mikroskopického preparátu (laboratorní práce) Označení: EU-Inovace-Př-6-02 Předmět: přírodopis
Cvičení 4: CHEMICKÉ SLOŽENÍ BUŇKY, PROKARYOTA Jméno: PROKARYOTA PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU ROZTĚR BAKTERIÍ
 Cvičení 4: CHEMICKÉ SLOŽENÍ BUŇKY, PROKARYOTA Jméno: Skupina: PROKARYOTA PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU ROZTĚR BAKTERIÍ Praktický úkol: bakterie (koky, tyčky) vyžíhejte bakteriologickou kličku
Cvičení 4: CHEMICKÉ SLOŽENÍ BUŇKY, PROKARYOTA Jméno: Skupina: PROKARYOTA PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU ROZTĚR BAKTERIÍ Praktický úkol: bakterie (koky, tyčky) vyžíhejte bakteriologickou kličku
Digitální učební materiál
 Digitální učební materiál Projekt CZ.1.07/1.5.00/34.0415 Inovujeme, inovujeme Šablona III/2 Inovace a zkvalitnění výuky prostřednictvím ICT (DUM) Tematická oblast Odborná biologie, část biologie organismus
Digitální učební materiál Projekt CZ.1.07/1.5.00/34.0415 Inovujeme, inovujeme Šablona III/2 Inovace a zkvalitnění výuky prostřednictvím ICT (DUM) Tematická oblast Odborná biologie, část biologie organismus
MEIÓZA. 1. Které fáze z meiotické profáze I jsou znázorněny na obrázcích?
 Cvičení 8: ROZMNOŽOVÁNÍ A VÝVOJ Jméno: Skupina: MEIÓZA Trvalý preparát: obarvené podélné řezy varlat brouka smrtníka obecného (Blaps mortisaga) Prohlédněte si několik řezů varlete a hledejte v semenotvorných
Cvičení 8: ROZMNOŽOVÁNÍ A VÝVOJ Jméno: Skupina: MEIÓZA Trvalý preparát: obarvené podélné řezy varlat brouka smrtníka obecného (Blaps mortisaga) Prohlédněte si několik řezů varlete a hledejte v semenotvorných
Laboratorní cvičení z kinetiky chemických reakcí
 Laboratorní cvičení z kinetiky chemických reakcí LABORATORNÍ CVIČENÍ 1. Téma: Ovlivňování průběhu reakce změnou koncentrace látek. podmínek průběhu reakce. Jednou z nich je změna koncentrace výchozích
Laboratorní cvičení z kinetiky chemických reakcí LABORATORNÍ CVIČENÍ 1. Téma: Ovlivňování průběhu reakce změnou koncentrace látek. podmínek průběhu reakce. Jednou z nich je změna koncentrace výchozích
Sada I 13 preparátů Kat. číslo 111.3118
 Sada I 13 preparátů Kat. číslo 111.3118 Strana 1 ze 21 Strana 2 ze 21 POKYNY PRO PRÁCI S MIKROPREPARÁTY 1. Preparát si vždy začněte prohlížet nejprve s nejslabším zvětšením nebo s nejmenším objektivem.
Sada I 13 preparátů Kat. číslo 111.3118 Strana 1 ze 21 Strana 2 ze 21 POKYNY PRO PRÁCI S MIKROPREPARÁTY 1. Preparát si vždy začněte prohlížet nejprve s nejslabším zvětšením nebo s nejmenším objektivem.
(cv03) Metody výroby mikroskopických preparátů z rostlinných pletiv
 Mikroskopické techniky rostlinných pletiv (cv03) Metody výroby mikroskopických preparátů z rostlinných pletiv Osnova této prezentace příprava vzorků měkčení vzorků mikrotomy výroba preparátů barvení řezů
Mikroskopické techniky rostlinných pletiv (cv03) Metody výroby mikroskopických preparátů z rostlinných pletiv Osnova této prezentace příprava vzorků měkčení vzorků mikrotomy výroba preparátů barvení řezů
Eukaryotická buňka. Stavba. - hlavní rozdíly:
 Eukaryotická buňka - hlavní rozdíly: rostlinná buňka živočišná buňka buňka hub buněčná stěna ano (celulóza) ne ano (chitin) vakuoly ano ne (prvoci ano) ano lysozomy ne ano ne zásobní látka škrob glykogen
Eukaryotická buňka - hlavní rozdíly: rostlinná buňka živočišná buňka buňka hub buněčná stěna ano (celulóza) ne ano (chitin) vakuoly ano ne (prvoci ano) ano lysozomy ne ano ne zásobní látka škrob glykogen
MIKROBIOLOGIE. Grampozitivní kokovitá bakterie STAPHYLOCOCCUS AUREUS bakteriální kmen dle ATCC 1260 (CCM 888).
 MIKROBIOLOGIE Veškeré testy jsou prováděny s těmito bakteriálními kmeny: Gramnegativní tyčinkovitá bakterie ESCHERICHIA COLI bakteriální kmen dle ATCC 9637 (CCM 2024). Grampozitivní kokovitá bakterie STAPHYLOCOCCUS
MIKROBIOLOGIE Veškeré testy jsou prováděny s těmito bakteriálními kmeny: Gramnegativní tyčinkovitá bakterie ESCHERICHIA COLI bakteriální kmen dle ATCC 9637 (CCM 2024). Grampozitivní kokovitá bakterie STAPHYLOCOCCUS
5.06 Teichmanovy krystaly (důkaz krve). Projekt Trojlístek
 5. Forenzní chemie (chemie v kriminalistice) 5.06 Teichmanovy krystaly (důkaz krve). Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2.
5. Forenzní chemie (chemie v kriminalistice) 5.06 Teichmanovy krystaly (důkaz krve). Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2.
BUNĚČNÁ STĚNA - struktura a role v rostlinné buňce
 BUNĚČNÁ STĚNA - struktura a role v rostlinné buňce Buněčná stěna O buněčné stěně: Buněčná stěna je nedílnou součástí každé rostlinné buňky a je jednou z charakteristických struktur odlišujících buňku rostlinnou
BUNĚČNÁ STĚNA - struktura a role v rostlinné buňce Buněčná stěna O buněčné stěně: Buněčná stěna je nedílnou součástí každé rostlinné buňky a je jednou z charakteristických struktur odlišujících buňku rostlinnou
S filtračními papíry a membránou je nutno manipulovat pinzetou s tupým koncem.
 Western Blotting Příprava blotovacího sendviče... 1 Blotování... 2 Kontrola přenesení proteinů na membránu... 2 Blokování membrány... 2 Aplikace protilátek... 2 Vizualizace... 3 Vyvolání filmu... 4 Chemikálie
Western Blotting Příprava blotovacího sendviče... 1 Blotování... 2 Kontrola přenesení proteinů na membránu... 2 Blokování membrány... 2 Aplikace protilátek... 2 Vizualizace... 3 Vyvolání filmu... 4 Chemikálie
Základy světelné mikroskopie
 Základy světelné mikroskopie Kotrba, Babůrek, Knejzlík: Návody ke cvičením z biologie, VŠCHT Praha, 2006. zvětšuje max. 2000 max. 1 000 000 cca 0,2 mm stovky nm až desetiny nm rozlišovací mez = nejmenší
Základy světelné mikroskopie Kotrba, Babůrek, Knejzlík: Návody ke cvičením z biologie, VŠCHT Praha, 2006. zvětšuje max. 2000 max. 1 000 000 cca 0,2 mm stovky nm až desetiny nm rozlišovací mez = nejmenší
(cv04) Metody výroby mikroskopických preparátů z rostlinných pletiv (2. část) Preparáty pro dokumentaci tvorby dřeva a lýka
 Mikroskopické techniky rostlinných pletiv (cv04) Metody výroby mikroskopických preparátů z rostlinných pletiv (2. část) Preparáty pro dokumentaci tvorby dřeva a lýka Osnova této prezentace Tvorba xylému
Mikroskopické techniky rostlinných pletiv (cv04) Metody výroby mikroskopických preparátů z rostlinných pletiv (2. část) Preparáty pro dokumentaci tvorby dřeva a lýka Osnova této prezentace Tvorba xylému
LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 4. BUNĚČNÉ JÁDRO A BUNĚČNÉ KULTURY
 LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 4. BUNĚČNÉ JÁDRO A BUNĚČNÉ KULTURY TEORETICKÝ ÚVOD: Buněčné jádro Buněčné jádro je organelou eukaryotické buňky. Je v něm uložena většina genetické informace buňky.
LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 4. BUNĚČNÉ JÁDRO A BUNĚČNÉ KULTURY TEORETICKÝ ÚVOD: Buněčné jádro Buněčné jádro je organelou eukaryotické buňky. Je v něm uložena většina genetické informace buňky.
1/II. Cvičení 2: ŽIVOČIŠNÁ BUŇKA, PROTOZOA Jméno: TVAR BUNĚK NERVOVÁ BUŇKA
 Cvičení 2: ŽIVOČIŠNÁ BUŇKA, PROTOZOA Jméno: Skupina: TVAR BUNĚK NERVOVÁ BUŇKA Trvalý preparát: mícha Vyhledejte nervové buňky (neurony) ve ventrálních rozích šedé hmoty míšní. Pozorujte při zvětšení, zakreslete
Cvičení 2: ŽIVOČIŠNÁ BUŇKA, PROTOZOA Jméno: Skupina: TVAR BUNĚK NERVOVÁ BUŇKA Trvalý preparát: mícha Vyhledejte nervové buňky (neurony) ve ventrálních rozích šedé hmoty míšní. Pozorujte při zvětšení, zakreslete
Základy buněčné biologie
 Maturitní otázka č. 8 Základy buněčné biologie vypracovalo přírodozpytné sympózium LP, AM & DK na konferenci v Praze, 1. Máje 2014 Buňka (cellula) je nejmenší známý útvar, který je schopný všech životních
Maturitní otázka č. 8 Základy buněčné biologie vypracovalo přírodozpytné sympózium LP, AM & DK na konferenci v Praze, 1. Máje 2014 Buňka (cellula) je nejmenší známý útvar, který je schopný všech životních
Návod k laboratornímu cvičení. Efektní pokusy
 Návod k laboratornímu cvičení Efektní pokusy Úkol č. 1: Chemikova zahrádka Pomůcky: skleněná vana, lžička na chemikálie. Chemikálie: vodní sklo, síran zinečnatý ZnSO 4 (X i ), síran železnatý FeSO 4, chlorid
Návod k laboratornímu cvičení Efektní pokusy Úkol č. 1: Chemikova zahrádka Pomůcky: skleněná vana, lžička na chemikálie. Chemikálie: vodní sklo, síran zinečnatý ZnSO 4 (X i ), síran železnatý FeSO 4, chlorid
LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 3. TESTY ŽIVOTASCHOPNOSTI A POČÍTÁNÍ BUNĚK
 LRR/BUBCV CVIČEÍ Z BUĚČÉ BILGIE 3. TESTY ŽIVTASCHPSTI A PČÍTÁÍ BUĚK TERETICKÝ ÚVD: Při práci s buňkami je jedním ze základních sledovaných parametrů stanovení jejich životaschopnosti (viability). Tímto
LRR/BUBCV CVIČEÍ Z BUĚČÉ BILGIE 3. TESTY ŽIVTASCHPSTI A PČÍTÁÍ BUĚK TERETICKÝ ÚVD: Při práci s buňkami je jedním ze základních sledovaných parametrů stanovení jejich životaschopnosti (viability). Tímto
vede sice ke zvýšení kontrastu, zároveň se ale snižuje rozlišení a ostrost obrazu (Obr. 46).
 4. cvičení Metody zvýšení kontrastu obrazu (1. část) 1. Přivření kondenzorové clony nebo snížení kondenzoru vede sice ke zvýšení kontrastu, zároveň se ale snižuje rozlišení a ostrost obrazu (Obr. 46).
4. cvičení Metody zvýšení kontrastu obrazu (1. část) 1. Přivření kondenzorové clony nebo snížení kondenzoru vede sice ke zvýšení kontrastu, zároveň se ale snižuje rozlišení a ostrost obrazu (Obr. 46).
2) Připravte si 3 sady po šesti zkumavkách. Do všech zkumavek pipetujte 0.2 ml roztoku BAPNA o různé koncentraci podle tabulky.
 CVIČENÍ Z ENZYMOLOGIE 1) Stanovení Michaelisovy konstanty trypsinu pomocí chromogenního substrátu. Aktivita trypsinu se určí změřením rychlosti hydrolýzy chromogenního substrátu BAPNA (Nα-benzoyl-L-arginin-p-nitroanilid)
CVIČENÍ Z ENZYMOLOGIE 1) Stanovení Michaelisovy konstanty trypsinu pomocí chromogenního substrátu. Aktivita trypsinu se určí změřením rychlosti hydrolýzy chromogenního substrátu BAPNA (Nα-benzoyl-L-arginin-p-nitroanilid)
DIGITÁLNÍ UČEBNÍ MATERIÁL
 DIGITÁLNÍ UČEBNÍ MATERIÁL škola Střední škola F. D. Roosevelta pro tělesně postižené, Brno, Křižíkova 11 číslo projektu číslo učeb. materiálu předmět, tematický celek CZ.1.07/1.5.00/34.1037 VY_32_ INOVACE_MAL_T-BIO_2_09
DIGITÁLNÍ UČEBNÍ MATERIÁL škola Střední škola F. D. Roosevelta pro tělesně postižené, Brno, Křižíkova 11 číslo projektu číslo učeb. materiálu předmět, tematický celek CZ.1.07/1.5.00/34.1037 VY_32_ INOVACE_MAL_T-BIO_2_09
Přímé stanovení celkového počtu buněk kvasinek pomocí Bürkerovy komůrky Provedení vitálního testu
 Přímé stanovení celkového počtu buněk kvasinek pomocí Bürkerovy komůrky Provedení vitálního testu Otázky k zamyšlení: Bude se jednat o přímé nebo nepřímé stanovení počtu buněk? Stanovujeme počet živých
Přímé stanovení celkového počtu buněk kvasinek pomocí Bürkerovy komůrky Provedení vitálního testu Otázky k zamyšlení: Bude se jednat o přímé nebo nepřímé stanovení počtu buněk? Stanovujeme počet živých
Laboratorní cvičení č. 5
 Laboratorní cvičení č. 5 SPEKTROFOTOMETRICKÁ MĚŘENÍ ÚKOL č. 11: Stanovení proteinové koncentrace metodou BCA s pomocí spektrometru Agilent 8453 s automatickým podavačem a průtočným systémem I přes časovou
Laboratorní cvičení č. 5 SPEKTROFOTOMETRICKÁ MĚŘENÍ ÚKOL č. 11: Stanovení proteinové koncentrace metodou BCA s pomocí spektrometru Agilent 8453 s automatickým podavačem a průtočným systémem I přes časovou
Propojení výuky oborů Molekulární a buněčné biologie a Ochrany a tvorby životního prostředí. Reg. č.: CZ.1.07/2.2.00/28.0032
 Propojení výuky oborů Molekulární a buněčné biologie a Ochrany a tvorby životního prostředí Reg. č.: CZ.1.07/2.2.00/28.0032 Charakteristika chromozomové výbavy 2n = 46,XY Karyotyp - Karyogram - Idiogram
Propojení výuky oborů Molekulární a buněčné biologie a Ochrany a tvorby životního prostředí Reg. č.: CZ.1.07/2.2.00/28.0032 Charakteristika chromozomové výbavy 2n = 46,XY Karyotyp - Karyogram - Idiogram
Příprava mikroskopických preparátů
 Nativní preparát, vitální barvení Příprava mikroskopických preparátů zhotovení - objekt uzavřeme do vhodného média mezi podložní a krycí sklo a prohlížíme uzavírací médium - tekuté nebo tuhnoucí, x mikroskopické
Nativní preparát, vitální barvení Příprava mikroskopických preparátů zhotovení - objekt uzavřeme do vhodného média mezi podložní a krycí sklo a prohlížíme uzavírací médium - tekuté nebo tuhnoucí, x mikroskopické
Propojení výuky oborů Molekulární a buněčné biologie a Ochrany a tvorby životního prostředí. Reg. č.: CZ.1.07/2.2.00/
 Propojení výuky oborů Molekulární a buněčné biologie a Ochrany a tvorby životního prostředí Reg. č.: CZ.1.07/2.2.00/28.0032 KBB/ZGEN Základy genetiky Dana Šafářová KBB/ZGEN Základy genetiky Rozsah: 2+1
Propojení výuky oborů Molekulární a buněčné biologie a Ochrany a tvorby životního prostředí Reg. č.: CZ.1.07/2.2.00/28.0032 KBB/ZGEN Základy genetiky Dana Šafářová KBB/ZGEN Základy genetiky Rozsah: 2+1
CHEMIE Pracovní list č.3 žákovská verze Téma: Acidobazická titrace Mgr. Lenka Horutová Student a konkurenceschopnost
 www.projektsako.cz CHEMIE Pracovní list č.3 žákovská verze Téma: Acidobazická titrace Lektor: Projekt: Reg. číslo: Mgr. Lenka Horutová Student a konkurenceschopnost CZ.1.07/1.1.07/03.0075 Teorie: Základem
www.projektsako.cz CHEMIE Pracovní list č.3 žákovská verze Téma: Acidobazická titrace Lektor: Projekt: Reg. číslo: Mgr. Lenka Horutová Student a konkurenceschopnost CZ.1.07/1.1.07/03.0075 Teorie: Základem
IZOLACE A IDENTIFIKACE PLÍSNÍ
 IZOLACE A IDENTIFIKACE PLÍSNÍ MARCELA PEJCHALOVÁ Univerzita Pardubice Fakulta chemicko-technologická Katedra biologických a biochemických věd Centralizovaný rozvojový projekt MŠMT č. C29: Integrovaný systém
IZOLACE A IDENTIFIKACE PLÍSNÍ MARCELA PEJCHALOVÁ Univerzita Pardubice Fakulta chemicko-technologická Katedra biologických a biochemických věd Centralizovaný rozvojový projekt MŠMT č. C29: Integrovaný systém
BIOLOGIE BA 1 419.0021
 BA 1 419.0021 BIOLOGIE 90021 1 2 BIOLOGIE Seznam použitého materiálu množství popis 1 Akvárium 1,5 l 1 Skleněné míchátko 1 Petriho miska ø 80 1 Pracovní listy 1 Lepící páska 1 Sbírka mikroskopických preparátů
BA 1 419.0021 BIOLOGIE 90021 1 2 BIOLOGIE Seznam použitého materiálu množství popis 1 Akvárium 1,5 l 1 Skleněné míchátko 1 Petriho miska ø 80 1 Pracovní listy 1 Lepící páska 1 Sbírka mikroskopických preparátů
Jehličnany (laboratorní práce)
 Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.128/02.0055 Jehličnany (laboratorní práce) Označení: EU-Inovace-Př-7-19 Předmět: přírodopis Cílová skupina: 7. třída Autor: Mgr. Miroslav
Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.128/02.0055 Jehličnany (laboratorní práce) Označení: EU-Inovace-Př-7-19 Předmět: přírodopis Cílová skupina: 7. třída Autor: Mgr. Miroslav
Návod k laboratornímu cvičení. Alkoholy
 Úkol č. 1: Ověřování fyzikálních vlastností alkoholů Návod k laboratornímu cvičení Alkoholy Pomůcky: 3 velké zkumavky - A,B,C, hodinové sklíčko, kapátko nebo skleněná tyčinka Chemikálie: etanol (F), etan-1,2-
Úkol č. 1: Ověřování fyzikálních vlastností alkoholů Návod k laboratornímu cvičení Alkoholy Pomůcky: 3 velké zkumavky - A,B,C, hodinové sklíčko, kapátko nebo skleněná tyčinka Chemikálie: etanol (F), etan-1,2-
SDS-PAGE elektroforéza
 SDS-PAGE elektroforéza Příprava gelu... 1 Recept na 0.75 mm gel (1 gel/2 gely)... 2 Recept na 1.5 mm gel (1 gel/2 gely)... 2 Příprava vzorku... 3 Elektroforéza... 3 Barvení gelů Blue Silver... 4 Chemikálie
SDS-PAGE elektroforéza Příprava gelu... 1 Recept na 0.75 mm gel (1 gel/2 gely)... 2 Recept na 1.5 mm gel (1 gel/2 gely)... 2 Příprava vzorku... 3 Elektroforéza... 3 Barvení gelů Blue Silver... 4 Chemikálie
N Laboratoř hydrobiologie a mikrobiologie
 ÚSTAV TECHNOLOGIE VODY A PROSTŘEDÍ N217019 - Laboratoř hydrobiologie a mikrobiologie Název úlohy: Mikrobiologie a hydrobiologie: Klasické metody barvení Vypracováno v rámci projektu: Inovace a restrukturalizace
ÚSTAV TECHNOLOGIE VODY A PROSTŘEDÍ N217019 - Laboratoř hydrobiologie a mikrobiologie Název úlohy: Mikrobiologie a hydrobiologie: Klasické metody barvení Vypracováno v rámci projektu: Inovace a restrukturalizace
Cyklus uhlíku: Aktivita Pěstujte rostliny. Protokoly experimentů pilotní školní rok 2007/2008
 Sklizeň rostlin Laboratorní průvodce Úloha Skliďte vypěstované rostliny kukuřice, určete jejich čerstvou a suchou hmotnost. Stanovte přírůstek biomasy pro každou variantu pěstování a porovnejte variaty
Sklizeň rostlin Laboratorní průvodce Úloha Skliďte vypěstované rostliny kukuřice, určete jejich čerstvou a suchou hmotnost. Stanovte přírůstek biomasy pro každou variantu pěstování a porovnejte variaty
histologie je nauka o mikroskopické skladbě organismu zkoumá skladbu těla živočišného i rostlinného, důležitá v humánní medicíně histologický preparát
 Histologické a (imuno)histochemické metody histologie je nauka o mikroskopické skladbě organismu zkoumá skladbu těla živočišného i rostlinného, důležitá v humánní medicíně histologický preparát zhotovený
Histologické a (imuno)histochemické metody histologie je nauka o mikroskopické skladbě organismu zkoumá skladbu těla živočišného i rostlinného, důležitá v humánní medicíně histologický preparát zhotovený
Tvorba trvalých mikroskopických preparátů
 Tvorba trvalých mikroskopických preparátů Tvorba demonstračních sbírek pro praktickou výuku biologických oborů FRVŠ G4/2198/2012 Lukáš Fusek, Robin Kundrata, Kateřina Sklenářová Tvorba trvalých mikroskopických
Tvorba trvalých mikroskopických preparátů Tvorba demonstračních sbírek pro praktickou výuku biologických oborů FRVŠ G4/2198/2012 Lukáš Fusek, Robin Kundrata, Kateřina Sklenářová Tvorba trvalých mikroskopických
Protokol č. 7 Pozorování živých a mrtvých buněk kvasinek Vitální test
 Protokol č. 7 Pozorování živých a mrtvých buněk kvasinek Vitální test Cíl cvičení: Bude se jednat o přímé nebo nepřímé stanovení počtu buněk? Stanovujeme počet živých nebo mrtvých buněk? Jak odlišíme živé
Protokol č. 7 Pozorování živých a mrtvých buněk kvasinek Vitální test Cíl cvičení: Bude se jednat o přímé nebo nepřímé stanovení počtu buněk? Stanovujeme počet živých nebo mrtvých buněk? Jak odlišíme živé
Hodnocení pekařského droždí
 Hodnocení pekařského droždí Čistá mikrobiální kultura kvasinek Saccharomyces Cerevisiae Hanzen Vyrábí se aerobní fermentací melasové zápary Díky kvasným schopnostem zajišťují kvasinky nakynutí těsta ovlivňují
Hodnocení pekařského droždí Čistá mikrobiální kultura kvasinek Saccharomyces Cerevisiae Hanzen Vyrábí se aerobní fermentací melasové zápary Díky kvasným schopnostem zajišťují kvasinky nakynutí těsta ovlivňují
Téma: Světelná mikroskopie a preparáty v mikroskopii
 LRR/BUBCV Cvičení z buněčné biologie Úloha č. 1 Téma: Světelná mikroskopie a preparáty v mikroskopii Úvod: Mikroskopie je základní metoda, která nám umoţňuje pozorovat velmi malé biologické objekty. Díky
LRR/BUBCV Cvičení z buněčné biologie Úloha č. 1 Téma: Světelná mikroskopie a preparáty v mikroskopii Úvod: Mikroskopie je základní metoda, která nám umoţňuje pozorovat velmi malé biologické objekty. Díky
VAKUOLY - voda v rostlinné buňce
 VAKUOLY - voda v rostlinné buňce Úvod: O vakuole: Vakuola je membránová struktura, která je součástí většiny rostlinných buněk. Může zaujímat 30-90% objemu buňky. Vakuola plní v rostlinné buňce mnoho důležitých
VAKUOLY - voda v rostlinné buňce Úvod: O vakuole: Vakuola je membránová struktura, která je součástí většiny rostlinných buněk. Může zaujímat 30-90% objemu buňky. Vakuola plní v rostlinné buňce mnoho důležitých
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost.
 Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Šablona III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Šablona III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
Mikroskopické preparační techniky pro analýzu rostlinných stonků
 Mikroskopické preparační techniky pro analýzu rostlinných stonků Cílem cvičení je demonstrace rychlé a efektivní mikroskopické preparační metody, která byla vyvinuta na základě letitých zkušeností v laboratořích
Mikroskopické preparační techniky pro analýzu rostlinných stonků Cílem cvičení je demonstrace rychlé a efektivní mikroskopické preparační metody, která byla vyvinuta na základě letitých zkušeností v laboratořích
Stavba dřeva. Základy cytologie. přednáška
 Základy cytologie přednáška Buňka definice, charakteristika strana 2 2 Buňky základní strukturální a funkční jednotky živých organismů Základní charakteristiky buněk rozmanitost (diverzita) - např. rostlinná
Základy cytologie přednáška Buňka definice, charakteristika strana 2 2 Buňky základní strukturální a funkční jednotky živých organismů Základní charakteristiky buněk rozmanitost (diverzita) - např. rostlinná
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 10 Bílkoviny Pro potřeby projektu
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 10 Bílkoviny Pro potřeby projektu
LABORATORNÍ POMŮCKY. Pro přípravu mikroskopického preparátu a vlastní mikroskopování jsou nutné tyto laboratorní pomůcky: 1.
 LABORATORNÍ POMŮCKY Pro přípravu mikroskopického preparátu a vlastní mikroskopování jsou nutné tyto laboratorní pomůcky: 1. KAPÁTKO Obr. č. 1 Kapátko slouží k nasátí malého množství vody či jiného roztoku
LABORATORNÍ POMŮCKY Pro přípravu mikroskopického preparátu a vlastní mikroskopování jsou nutné tyto laboratorní pomůcky: 1. KAPÁTKO Obr. č. 1 Kapátko slouží k nasátí malého množství vody či jiného roztoku
PRAKTICKÁ CVIČENÍ Z OBECNÉ GENETIKY
 PRAKTICKÁ CVIČENÍ Z OBECNÉ GENETIKY Mgr. Dana ŠAFÁŘOVÁ, Ph.D. RNDr. Pavla VÁLOVÁ RNDr. Lenka UVÍROVÁ Katedra buněčné biologie a genetiky, Přírodovědecká fakulta Univerzita Palackého v Olomouci Praktická
PRAKTICKÁ CVIČENÍ Z OBECNÉ GENETIKY Mgr. Dana ŠAFÁŘOVÁ, Ph.D. RNDr. Pavla VÁLOVÁ RNDr. Lenka UVÍROVÁ Katedra buněčné biologie a genetiky, Přírodovědecká fakulta Univerzita Palackého v Olomouci Praktická
Obrázky viz: http://www.ta3k.sk/bio/
 Rozmnožování krytosemenných rostlin Materiál a pomůcky: Květy různých rostlin (doporučuji vybírat velké květy např. tulipán a pozor na záměnu květu a květenství), ostrá žiletka, pinzeta, preparační jehla.
Rozmnožování krytosemenných rostlin Materiál a pomůcky: Květy různých rostlin (doporučuji vybírat velké květy např. tulipán a pozor na záměnu květu a květenství), ostrá žiletka, pinzeta, preparační jehla.
Sada Látky kolem nás Kat. číslo 104.0020
 Sada Kat. číslo 104.0020 Strana 1 z 68 Strana 2 z 68 Sada pomůcek Obsah Pokyny k uspořádání pokusu... 4 Plán uspořádání... 5 Přehled jednotlivých součástí... 6, 7 Přehled drobných součástí... 8, 9 Popisy
Sada Kat. číslo 104.0020 Strana 1 z 68 Strana 2 z 68 Sada pomůcek Obsah Pokyny k uspořádání pokusu... 4 Plán uspořádání... 5 Přehled jednotlivých součástí... 6, 7 Přehled drobných součástí... 8, 9 Popisy
Rozdíly mezi prokaryotní a eukaryotní buňkou. methanobacterium, halococcus,...
 Dělení buňky Biologie člení živé organizmy do dvou hlavních kategorií: prokaryotní a eukaryotní organizmy. Na základě srovnání 16S rrna se zjistilo, že na naší planetě jsou 3 hlavní nadříše buněčných forem:
Dělení buňky Biologie člení živé organizmy do dvou hlavních kategorií: prokaryotní a eukaryotní organizmy. Na základě srovnání 16S rrna se zjistilo, že na naší planetě jsou 3 hlavní nadříše buněčných forem:
Příprava krevního roztěru
 Příprava krevního roztěru Správně Příliš tlustý Moc krve Nerovnoměrný tah Třásla se ruka Krev se srážela Mastné sklíčko Barvení roztěrů Standardním barvením pro krevní nátěry je tzv. panoptické barvení
Příprava krevního roztěru Správně Příliš tlustý Moc krve Nerovnoměrný tah Třásla se ruka Krev se srážela Mastné sklíčko Barvení roztěrů Standardním barvením pro krevní nátěry je tzv. panoptické barvení
Cvičení č. 2: Pasážování buněk. 1) Teoretický základ
 Cvičení č. 2: Pasážování buněk 1) Teoretický základ Kultivace buněk in vitro (ve zkumavce) - Snaha o napodobení podmínek v organismu - Používání jednorázového spotřebního materiálu a speciálních chemikálií
Cvičení č. 2: Pasážování buněk 1) Teoretický základ Kultivace buněk in vitro (ve zkumavce) - Snaha o napodobení podmínek v organismu - Používání jednorázového spotřebního materiálu a speciálních chemikálií
3.02 Dělení směsí, aneb i separace může být legrace (filtrace). Projekt Trojlístek
 3. Separační metody 3.02 Dělení směsí, aneb i separace může být legrace (filtrace). Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2.
3. Separační metody 3.02 Dělení směsí, aneb i separace může být legrace (filtrace). Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2.
Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii
 Datum: Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii Tlak vzduchu: Teplota vzduchu: Laboratorní cvičení č. Oddělování složek směsí
Datum: Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii Tlak vzduchu: Teplota vzduchu: Laboratorní cvičení č. Oddělování složek směsí
LABORATORNÍ PRÁCE KLUB PAMPELIŠKA
 LABORATORNÍ PRÁCE KLUB PAMPELIŠKA Denisa Štohanzlová VII.C ZŠ POLNÁ, PODĚBRADOVA 79 2006/2007 Laboratorní práce č. 1 Jméno: Téma: Bludiště pro fazoli Pomůcky: nůžky, lepící lásku, lepidlo květináč, zem,
LABORATORNÍ PRÁCE KLUB PAMPELIŠKA Denisa Štohanzlová VII.C ZŠ POLNÁ, PODĚBRADOVA 79 2006/2007 Laboratorní práce č. 1 Jméno: Téma: Bludiště pro fazoli Pomůcky: nůžky, lepící lásku, lepidlo květináč, zem,
Vznik dřeva přednáška
 Vznik dřeva přednáška strana 2 2 Rostlinné tělo a růst strana 3 3 Růst - nejcharakterističtější projev živých organizmů - nevratné zvětšování hmoty či velikosti spojené s činností živé protoplazmy - u
Vznik dřeva přednáška strana 2 2 Rostlinné tělo a růst strana 3 3 Růst - nejcharakterističtější projev živých organizmů - nevratné zvětšování hmoty či velikosti spojené s činností živé protoplazmy - u
Příprava mikroskopických preparátů
 Nativní preparáty, preparát, vitální barvení Příprava mikroskopických preparátů zhotovení - objekt uzavřeme do vhodného média a prohlížíme mezi sklem podložním a krycím uzavírací médium - tekuté nebo tuhnoucí
Nativní preparáty, preparát, vitální barvení Příprava mikroskopických preparátů zhotovení - objekt uzavřeme do vhodného média a prohlížíme mezi sklem podložním a krycím uzavírací médium - tekuté nebo tuhnoucí
