První případ elektrické stimulační terapie dolního jícnového svěrače indikovaný v České republice k implantaci
|
|
|
- Matyáš Marek
- před 6 lety
- Počet zobrazení:
Transkript
1 Hereditárny Klinická a experimentální angioedém ako gastroenterologie: príčina bolestí brucha kazuistika doi: /amgh2017csgh.info04 První případ elektrické stimulační terapie dolního jícnového svěrače indikovaný v České republice k implantaci A first case of electrical stimulation therapy of lower esophageal sphincter indicated in the Czech Republic for implantation Š. Konečný 1, J. Dolina 1, Z. Beneš 2, A. Hep 1 1 Interní gastroenterologická klinika LF MU a FN Brno 2 Interní oddělení, Thomayerova nemocnice, Praha Souhrn: V našem sdělení popisujeme případ mladého 26letého muže trpícího refluxní symp tomatologií a nespecifickou dysmotilitou jícnu indikovaného k implantaci elektrické stimulační terapie dolního jícnového svěrače. Jedná se o první případ použití této nové chirurgické metody k léčbě refluxní nemoci jícnu v ČR. Pa cient podstoupil celou řadu vyšetření, která neprokázala další onemocnění kromě refluxní nemoci a poruchy peristaltiky jícnu. Byly vyčerpány možnosti konzervativní terapie bez výraznějšího efektu na potíže pa cienta. Následně byla provedena konzultace chirurgického pracoviště zabývajícího se implantací elektrického stimulátoru jícnu, dle jehož vyjádření byl pa cient vhodným kandidátem implantace zařízení EndoStim. Proto byla dne provedena laparoskopická dorzální hiatoplastika a implantace zařízení EndoStim prof. Guttem na Mem mingem Chirurgische Klinik v Německu, kde bylo již v minulosti provedeno 13 implantací zařízení EndoStim. Operace proběhla bez komplikací a pa cient byl v celkově dobrém stavu propuštěn domů. Na pooperační high-resolution jícnové manometrii byly zachyceny ojedinělé peristaltické vlny a určité zlepšení dysmotility. Pa cient je nyní bez medikace inhibitory protonové pumpy, subjektivně se cítí lépe a dle poslední MII-pH je bez objektivních známek refluxní nemoci. V pooperačním období se pouze jednou objevilo uvíznutí sousta se zvracením, jinak jsou potíže celkově zlepšeny. Nadále probíhá pravidelná úprava nastavení dle výsledku vyšetření k optimalizaci terapie. Klíčová slova: refluxní nemoc jícnu GERD reflux EndoStim Summary: We report a case of a young 26-year-old man suffering from reflux symptoms and nonspecific esophageal dysmotility who was indicated to implantation of electrical stimulation therapy of the lower esophageal sphincter. This is the first case of use of this new surgical method for the treatment of gastroesophageal reflux disease in the Czech Republic. The patient underwent a variety of diagnostic tests, which failed to reveal other diseases besides gastroesophageal reflux disease and esophageal motility disorder. We exhausted the possibilities of conservative therapies, all of which did not significantly improve the patient s condition. Subsequently, a consultation with a surgical department dealing with implantation of electrical stimulator of the esophagus resulted in the patient receiving approval for EndoStim implantation. Therefore, on October 14, 2015, Professor Gutt, Memmingem Chirurgische Klinik, Germany, with experience in implanting 13 EndoStim devices, performed laparoscopic hiatal hernia repair and implanted the EndoStim in the patient. The surgery was well executed without any complications and the patient was in generally good condition after the operation released home. High-resolution esophageal manometry after surgery captured rare peristaltic waves and some improvement in dysmotility. The patient is now without proton pump inhibitor medication and subjectively feels better, and according to the latest MII-pH results, is without objective signs of reflux disease. During the postoperative period, the patient only once experienced vomiting; otherwise, there was a significant improvement in overall symptoms. The patient is waiting for further examination and readjustment of therapy to optimize the outcome. Key words: gastroesophageal reflux disease GERD reflux EndoStim 156 Gastroent Hepatol 2017; 71(2):
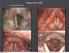
2 První případ elektrické stimulační terapie dolního jícnového Hereditárny svěrače indikovaný angioedém v České ako republice príčina bolestí k implantaci brucha Úvod Refluxní nemoc jícnu je široce rozšířené onemocnění, jehož základem je zpětný tok žaludečního obsahu do jícnu. Tento jev je normálním fyziologickým procesem a onemocnění se vyvíjí až při selhání fyziologických antirefluxních mechanizmů, které způsobuje symp tomatologii a/ nebo komplikace [1]. Mezi hlavní symp tomy patří pyróza a regurgitace a jejich výskyt 1 týdně udává až 20 % populace vyspělých zemí [2]. Hlavními léčebnými prostředky jsou dieta a režimová opatření, z medikace pak inhibitory protonové pumpy (IPP), prokinetika a antacida. V poslední době se kromě klasické chirurgické laparoskopické fundoplikace uplatňují také nové chirurgické a endoskopické metody, prozatím ovšem bez širšího uplatnění. Nejnovější metodou je EndoStim. Jedná se o chirurgickou metodu, při které je do oblasti dolního jícnového svěrače (LES lower esophageal sphincter) laparoskopicky implantován elektrický stimulátor podobný tradičním neurostimulátorům skládající se z programovatelného implantabilního Popis případu Mladý 26letý muž, který se v předchorobí léčil pouze pro alergii na prach a plísně a byl na terapii antihistaminikem a nazálním flutikasonem. Jeho potíže začaly na jaře roku 2013 po vypití předtréninkového nápoje pro body buildery, který ale byl připravený a volně skladovaný delší dobu před užitím, a následně se projevily jako zvracení, dyspepsie, nejdřív gastritida, pak enteritida s následným rozvojem refluxní symp tomatologie jako nauzea, pyróza, regurgitace, ructus, slinění, dysfagie, nechutenství, chrapot a nekardiální bolest na hrudi. Z dalších potíží bylo přítomné také neustále nutkání zvracet, dávení a slinění po jídle. Pociťoval uvíznutí tekutiny, ale ne sousta. Během potíží došlo k váhovému úbytku asi 20 kg z původní hmotnosti 93 kg. Pa cient podstoupil řadu vyšetření na vícero gastroenterologických pracovištích v ČR vč. gastroskopie s etážovou biopsií, kapslové endoskopie, endosonografie jícnu, CT mediastina, magnetické rezonance mozku, screeningu autoimunitních onemocnění až po vyšetření neurologem i revmatologem, vše bez nálezu hrubé papulzního generátoru, bipolární stimulační elektrody a externího bezdrátového programátoru (obr. 1). Samotná implantace probíhá klasickou laparoskopickou technikou v Trendelenburgově poloze. Provede se disekce pars flacida hepatogastrického ligamenta a paraezofageálního tuku k dosažení přístupu k pravé přední straně jícnu, dále se provede hiatoplastika, je-li přítomna hiátová hernie. Endoskopicky se identifikuje Z-linie a za transiluminace se umístí první elektroda 15 mm nad Z-linii do muscularis propria LES. Druhá elektroda je umístěna 10 mm inline distálně. Elektrody jsou uchyceny titanovými klipy a suturou za stálé endoskopické kontroly k prevenci perforace. Na závěr se provede kožní incize v levém mezogastriu k umístění pulzního generátoru v subkután ní kapse (obr. 2) [3]. Terapie je personalizovaná k individuálním potřebám konkrétního pa cienta. Standardně začíná 12 hod po operaci a aplikují se monofázické pulzy trvání 215 µs s amplitudou 5 ma a frekvencí 20 Hz. Den ně probíhá 12 period stimulace po 30 min. Dále lze indivi duálně upravit jednotlivé hodnoty dle potřeb pa cienta. Obr. 1. EndoStim programovatelný implantabilní pulzní generátor, bipolární stimulační elektrody a externí bezdrátový programátor. Fig. 1. EndoStim a programmable implantable pulse generator, a bipolar stimulation lead with two stitch electrodes, and an external wireless programmer. Gastroent Hepatol 2017; 71(2):
3 Hereditárny První případ angioedém elektrické stimulační ako príčina terapie bolestí dolního bruchajícnového svěrače indikovaný v České republice k implantaci bez známek ezofagitidy či jiné patologie, duodenum bio pticky se suspektní celiakií Marsh 1. Byla zahájena bezlepková dieta a plná antirefluxní terapie v kombinaci s prokinetikem. Pa cient následně užíval další medikaci, IPP, prokinetika, antacida, anti e metika, střevní eubio tika, kortikoidy, imunosupresiva i antidepresiva. Zkusil také rehabilitaci, jógu či akupunkturu, přechodně byl i na parenterální výživě a enterální výživě cestou nazojejunální sondy, vše bez významnějšího efektu. Pro neefektivitu zavedené terapie a režimových opatření byla provedena konzultace chirurgického pracoviště zabývajícího se implantací elektrického stimulátoru jícnu, dle jehož vyjádření byl pa cient vhodným kandidátem implantace zařízení Endo Stim. Po opakované konzultaci Vše obecné zdravotní pojišťovny byl výkon schválen a pa cientovi byla provedena laparoskopická dorzální hiatoplastika a implantace zařízení Endo Stim profesorem Guttem na Mem mingem Chirurgische Klinik v Nětologie. Dle dynamické scintigrafie jícnu byla nalezena suspektní hypomotilita jícnu ve střední až distální třetině, retence v jícnu cca 14 %, významné antiperistaltické vlny nebyly patrné. Evakuace žaludku byla ještě v mezích normy. Byla provedena také high-resolution manometrie (HRM), kde byla nalezena těžká nespecifická porucha motility jícnu v distálním a středním jícnu opožděné simultán ní vlny s minimální amplitudou a oblasti s absolutním výpadkem peristaltiky, v proximálním jícnu náznak propulzivní hypotenzní peristaltiky. Hypotenzní LES (3 m m Hg) a horní jícnový svěrač (obr. 3). Bylo provedeno vyšetření polykacího aktu, kde byla patrna antiperistaltika ve střední a dolní třetině jícnu. Byla také provedena multi kanálová intraluminální impedance a ph metrie jícnu (MII-pH) na terapii IPP, dle které bylo DeMeester skóre 12,31 a celkem 362 refluxních událostí, z toho 3 v oblasti elektrody Z1 (proximální část jícnu). Při endoskopii jícnu byla nalezena těžká inkompetence kardie, bledá sliznice, Obr. 2. Chirurgické umístění stimulační elektrody a pulzního generátoru s baterií. Fig. 2. The surgical placement of the stimulation electrode and the pulse generator with battery. mecku. Na této klinice bylo již v minulosti provedeno 13 implantací zařízení EndoStim. Operace proběhla bez komplikací a pa cient byl v celkově dobrém stavu propuštěn A Obr. 3. Záznam HRM před implantací zařízení EndoStim. Patrná hypomotilita (snížení peristaltických amplitud až vymizení peristaltiky v proximálních 2/3 jícnu (A)). Fig. 3. HRM record before implantation of the EndoStim device. Evident hypomotility (decrease of peristaltic amplitudes even absence of peristalsis in the proximal two thirds of the esophagus (A)). 158 Gastroent Hepatol 2017; 71(2):
4 První případ elektrické stimulační terapie dolního jícnového Hereditárny svěrače indikovaný angioedém v České ako republice príčina bolestí k implantaci brucha A B Obr. 4. Záznam HRM po implantaci zařízení EndoStim. Patrná pokračující hypomotilita, s výskytem již ojedinělé peristaltiky fyziologických norem (A). Mírný nárůst klidového tonu v oblasti LES (B). Fig. 4. HRM record after implantation of the EndoStim device. Ongoing hypomotility with sporadic appearance of physiological peristalsis (A). Slight increase in the basal tone of the LES (B). domů. Celkové náklady na operaci činily (z toho na zařízení EndoStim ). Dne bylo na našem pracovišti provedeno kontrolní vyšetření polykacího aktu, dle kterého nadále přetrvávala antiperistaltika v horní, střední i dolní třetině jícnu, v horní až střední třetině retence tuhého sousta a také HRM, kde již byly zachyceny ojedinělé peristaltické vlny a určité zlepšení dysmotility (obr. 4). Pa cient je nyní již bez trvalé medikace IPP a subjektivně se cítí lépe. V pooperačním období se pouze jednou objevilo uvíznutí sousta se zvracením, jinak jsou potíže celkově mírnější a pa cient operačního zákroku nelituje a podstoupil by ho znovu. Pa cient počátkem dubna absolvoval další kontrolu na klinice v Mem mingemu, kde byla zkontrolována i funkce stimulátoru a byla provedena změna polarity stimulátoru dle nynějších standardů. Poslední kontrola proběhla dne , kdy byla provedena také MII-pH s nálezem 45 refluxních epizod a DeMeester score 1,5, což je výsledek v rámci normy. Dle tohoto vyšetření je pa cient nyní bez objektivních známek refluxní nemoci. Nadále probíhá pravidelná úprava nastavení dle výsledku vyšetření k optimalizaci terapie. Diskuze Refluxní nemoc jícnu je široce rozšířené onemocnění a konzervativní terapie je u mnoha pacientů neúčinná. IPP pouze mění ph refluxátu z kyselého na slabě kyselý, ale nesnižují samotný počet refluxních epizod. Laparoskopická fundoplikace je léty prověřená metoda, která má ale množství pooperačních komplikací a není vhodná pro pa cienty s dysmotilitou jícnu. Ostatní nové endoskopické a chirurgické metody se snaží dosáhnout podobného efektu, prozatím ale bez větší úspěšnosti. Proto se zdá být EndoStim vhodnou metodou volby pro pa cienty s nedostatečným efektem konzervativní terapie a minimální hiátovou hernií a také pro pa cienty s dysmotilitou jícnu. Dosavadní studie [3 7] prokázaly dostatečný efekt na zvýšení tonu LES a vymizení potíží u pa cientů, kteří podstoupili implantaci elektrického stimulátoru LES. Byl také prokázán přetrvávající efekt na zvýšení tonu LES i po vypnutí přístroje [6]. Zároveň dané studie vykazují prakticky nulové závažné nežádoucí účinky a komplikace po operaci. V neposlední řadě může být výhodou i možnost individuálního nastavení jednotlivých stimulátorů přímo pro potřeby konkrétního pa cienta a event. i jejich kompletní vypnutí v případě potřeby. Nicméně u zde prezentovaného pa cienta zůstává nejasná primární příčina potíží a GERD se zdá být pouze následkem nespecifické hypomotilitní poruchy. Závěr Prozatímní výsledky klinických studií přinášejí slibné a nadějné informace. Ve všech studiích však byla vstupní kritéria značně přísná a je potřeba větších randomizovaných kontrolovaných studií k potvrzení efektivity léčby. Určitou limitací širšího rozšíření metody je i v současnosti značně vysoká cena Gastroent Hepatol 2017; 71(2):
5 Hereditárny První případ angioedém elektrické stimulační ako príčina terapie bolestí dolního bruchajícnového svěrače indikovaný v České republice k implantaci a v ČR nedostupnost chirurgického pracoviště schopného provést implantaci, i když tento problém se nezdá být až tak významný, protože proces učení by pro zkušeného chirurga provádějícího laparoskopické fundoplikace neměl být problematický. Literatura 1. Vakil N, van Zanten SV, Kahrilas P et al. The Montreal definition and clas sification of gastroesophageal reflux disease: a global evidence-based consensus. Am J Gastroenterol 2006; 101(8): El-Serag HB, Sweet S, Winchester CC et al. Update on the epidemiology of gastro-oesophageal reflux disease: a systematic review. Gut 2014; 63(6): doi: / gutjnl Rodríguez L, Rodriguez P, Gómez B et al. Electrical stimulation therapy of the lower esophageal sphincter is succes sful in treat ing GERD: final results of open- -label prospective trial. Surg Endosc 2013; 27(4): doi: / s Rodríguez L, Rodriguez P, Gómez B et al. Long-term results of electrical stimulation of the lower esophageal sphincter for the treatment of gastroesophageal reflux dis ease. Endoscopy 2013; 45(8): doi: / s Rodríguez L, Rodriguez P, Gómez B et al. Two-year results of intermittent electrical stimulation of the lower esophageal sphincter treatment of gastroesophageal reflux disease. Surgery 2015; 157(3): doi: / j.surg Rodríguez L, Rodriguez P, Gómez B et al. Electrical stimulation therapy of the lower esophageal sphincter is succes sful in treat ing GERD: long-term 3-year results. Surg Endosc 2016; 30(7): doi: / s Kappel le WF, Bredenoord AJ, Conchil lo JM et al. Electrical stimulation therapy of the lower esophageal sphincter for refractory gastro-oesophageal reflux disease interim results of an international multicentre trial. Aliment Pharmacol Ther 2015; 42(5): doi: / apt Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy. The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study. Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů. The Editorial Board declares that the manuscript met the ICMJE uniform requirements for bio medical papers. Doručeno/ Submitted: Přijato/ Accepted: MU Dr. Štefan Konečný Interní gastroenterologická klinika LF MU a FN Brno Jihlavská Brno konecny.stefan@fnbrno.cz Téma: Horní endoskopie Místo konání: Clarion Congress Hotel Ostrava Zkrácená 2703, Ostrava-Zábřeh Termín konání: , 8:30 hodin Akce se koná pod záštitou MUDr. Milana Leckéšiho předsedy představenstva společnosti AGEL a.s. Pořádá: Centrum péče o zažívací trakt Vítkovické nemocnice a.s. ve spolupráci s Endoskopickou sekcí ČGS a Vzdělávacím a výzkumným institutem AGEL o.p.s. Sekretariát: GUARANT International, spol. s r.o. Tel.: ole2017@guarant.cz Informace a registrace: Gastroent Hepatol 2017; 71(2):
6 Usmívám se i po 12 týdnech Léčba chronické hepatitidy C 1,2 HODNOTY SVR12* PŘI DOPORUČENÉM DÁVKOVÁNÍ U PACIENTŮ S GT1b ANALÝZA POOLOVANÝCH DAT 1,2 bez RBV 12 TÝDNŮ viekirax a exviera RBV = ribavirin *SVR byla primárním endpointem účinnosti definovaným jako stanovení vyléčení HCV ve studiích fáze 3 a byla stanovena jako nedetekovatelná HCV RNA 12 týdnů po ukončení léčby (SVR12)
7 Zkrácené informace o léčivém přípravku Viekirax 12,5 mg/75 mg/50 mg potahované tablety Složení: Jedna potahovaná tableta obsahuje ombitasvirum 12,5 mg, paritaprevirum 75 mg a ritonavirum 50 mg. Indikace: V kombinaci s dalšími léčivými přípravky k léčbě chronické hepatitidy C u dospělých. Dávkování a doba léčby: Doporučená dávka přípravku Viekirax je dvě tablety 12,5 mg / 75 mg / 50 mg jednou denně s jídlem. Viekirax je třeba užívat v kombinaci s dalšími léčivými přípravky určenými k léčbě HCV. Doba trvání kombinované terapie: pacienti s genotypem 1b bez cirhózy nebo s kompenzovanou cirhózou: Viekirax + Exviera (dasabuvir) 12 týdnů, 8 týdnů může být zváženo u dosud neléčených pacientů s infekcí genotypu 1b s minimální až středně těžkou fibrózou*; pacienti s genotypem 1a bez cirhózy: Viekirax + Exviera (dasabuvir) + ribavirin 12 týdnů; pacienti s genotypem 1a s kompenzovanou cirhózou: Viekirax + Exviera (dasabuvir) + ribavirin 24 týdnů, pacienti s genotypem 4 bez cirhózy nebo s kompenzovanou cirhózou: Viekirax + ribavirin 12 týdnů. Zvláštní populace: U pacientů s infekcí genotypem 1 HCV a po transplantaci jater se doporučuje podávat přípravek Viekirax a dasabuvir v kombinaci s ribavirinem po dobu 24 týdnů. Viekirax v kombinaci s ribavirinem je doporučen u infekce genotypu 4. Na počátku je vhodné podat nižší dávku ribavirinu. U pacientů s lehkou, středně těžkou či těžkou poruchou funkce ledvin nebo u pacientů v terminálním stádiu onemocnění ledvin na dialýze* není třeba dávku přípravku Viekirax upravovat. U pacientů vyžadujících léčbu ribavirinem se prosím podívejte do souhrnu údajů o přípravku pro ribavirin, kde naleznete informace týkající se použití u pacientů s poruchou funkce ledvin.* U pacientů s lehkou poruchou funkce jater (Child-Pugh A) není třeba dávku přípravku Viekirax upravovat. Viekirax se nedoporučuje u pacientů se středně těžkou poruchou funkce jater (Child-Pugh B). Přípravek Viekirax je kontraindikován u pacientů s těžkou poruchou funkce jater (Child-Pugh C). Pro další informace ohledně dávkování viz SPC. Kontraindikace: hypersenzitivita na léčivou látku nebo pomocné látky; těžká porucha funkce jater; použití léčivých přípravků s ethinylestradiolem; společně s přípravkem Viekirax se nesmí podávat léčivé přípravky, jejichž eliminace je vysoce závislá na CYP3A a jejichž zvýšené plasmatické hladiny jsou spojeny se závažnými nežádoucími účinky (např. alfuzosin, amiodaron, astemizol, terfenadin, cisaprid, kolchicin, ergotamin, kyselina fusidová, lovastatin, simvastatin, atorvastatin, midazolam p.o., triazolam, pimozid, kvetiapin, chinidin, salmeterol, sildenafil, tikagrelor. V případě společného podávání přípravku Viekirax s dasabuvirem nebo bez něho s přípravky, které jsou silnými nebo středně silnými enzymovými induktory (např. karbamazepin, fenobarbital, fenytoin, efavirenz, nevirapin, enzalutamid, mitotan, rifampicin, třezalka), se očekává snížení plasmatické koncentrace ombitasviru, paritapreviru a ritonaviru a snížení jejich terapeutického účinku a nesmí se podávat společně s přípravkem Viekirax. V případě společného podávání přípravku Viekirax s dasabuvirem nebo bez něho s přípravky, které jsou silnými inhibitory CYP3A4 (např. kobicistat, indinavir, lopinavir/ritonavir, sachinavir, tipranavir, itrakonazol, ketokonazol, posakonazol, klarithromycin, telithromycin, konivaptan aj), se očekává zvýšení plasmatické koncentrace paritapreviru a nesmí se proto podávat společně s přípravkem Viekirax. Těhotenství a kojení: Při užívání přípravku Viekirax s ribavirinem je třeba s extrémní opatrností dbát na to, aby pacientky a partnerky pacientů neotěhotněly. Účinnou formu antikoncepce je třeba používat 7 měsíců po ukončení léčby ribavirinem. Zvláštní upozornění: Monoterapie přípravkem Viekirax se nedoporučuje, musí se užívat v kombinaci s jinými léčivými přípravky určenými k léčbě infekce chronické hepatitidy C (dasabuvirem a/nebo ribavirinem). Účinnost přípravku Viekirax nebyla stanovena u pacientů s genotypy HCV 2, 3, 5 a 6. Během klinických hodnocení přípravku Viekirax a dasabuviru s ribavirinem či bez něho došlo u přibližně 1 % subjektů k přechodnému zvýšení ALT na více než pětinásobek horní meze běžných hodnot. Zvýšení ALT byla asymptomatická a docházelo k nim obvykle během prvních 4 týdnů léčby. Hladiny ALT při dalším podávání během přibližně dvou týdnů od zvýšení poklesly. Opatrnosti je třeba při podávání přípravku Viekirax s flutikasonem nebo jinými glukokortikoidy, které jsou metabolizovány CYP3A4. Použití se statiny: Očekává se, že Viekirax s dasabuvirem zvýší expozici rosuvastatinu více než 3násobně. Pokud je léčba rosuvastatinem během terapie nutná, maximální denní dávka rosuvastatinu nemá přesáhnout 5 mg. Nízké dávky ritonaviru, který je součástí fixní dávky kombinace v přípravku Viekirax, může u pacientů s koinfekcí HIV bez pokračující antiretrovirové terapie vyvolat rezistenci na inhibitory proteázy. Pacienti s koinfekcí HIV bez supresivní antiretrovirové terapie nemají být přípravkem Viekirax léčeni. Po uvedení přípravku na trh byly u pacientů léčených přípravkem Viekirax s dasabuvirem nebo bez něho a s ribavirinem či bez něho hlášeny případy jaterní dekompenzace a selhání jater, včetně transplantace jater nebo fatálního průběhu. U většiny pacientů s těmito závažnými projevy se již před zahájením terapie projevovaly příznaky pokročilé nebo dekompenzované cirhózy. Přestože je kvůli výchozímu pokročilému onemocnění jater obtížné zjistit příčinnou souvislost, potenciální riziko nelze vyloučit. U pacientů s cirhózou: monitorujte klinické známky a příznaky jaterní dekompenzace (například ascites, jaterní encefalopatii, krvácení z varixů); laboratorní jaterní testy včetně koncentrace přímého bilirubinu je třeba provést na počátku léčby, během prvních 4 týdnů od jejího zahájení a poté tak, jak to bude klinicky indikováno; u pacientů s projevy jaterní dekompenzace léčbu přerušte. Reaktivace viru hepatitidy typu B: Byly zaznamenány případy, některé z nich fatální, reaktivace viru hepatitidy typu B (HBV) během nebo po léčbě přímo působícími antivirotiky. Screening HBV má být u každého pacienta proveden ještě před zahájením léčby. Pacienti s koinfekcí HBV/HCV jsou vystaveni riziku reaktivace HBV, a proto mají být monitorováni a má jim být poskytnuta péče podle aktuálních standardních léčebných postupů.* Pro další informace viz SPC. Interakce: Viekirax se může podávat společně s dasabuvirem nebo bez něho. Při společném podávání tyto látky na sebe vzájemně působí, je proto třeba vzít v úvahu jejich interakční profil v kombinaci. Zvýšené pozornosti je třeba dbát při podání přípravku Viekirax společně s dasabuvirem nebo bez něho a s léčivými přípravky, které jsou primárně metabolizovány přes CYP3A, toto podání může mít za následek zvýšení plasmatické koncentrace těchto léčivých přípravků a tedy nutnou úpravu jejich dávkování. Jedná se zejména o cyklosporin, takrolimus, amlodipin, rilpivirin, alprazolam, blokátory kalciových kanálů (např. nifedipin, diltiazem, verapamil) a trazodon. Stejně je třeba přistupovat ke společnému podání kombinace Viekirax s dasabuvirem nebo bez něho a léčivých přípravků, které jsou substráty OATP1B1, OATP1B3, OATP2B1 nebo OCT1, tj. statiny (pravastatin, rosuvastatin), fexofenadin, repaglinid a antagonisté receptoru pro angiotenzin II (např. valsartan). Úprava dávky/klinické monitorování je třeba při společném podání kombinace Viekirax s dasabuvirem nebo bez něho a léčivých přípravků, které jsou substráty BCRP, tj. sulfasalazin, imatinib a rosuvastatin. Viekirax může zvýšit plasmatickou expozici léčivým přípravkům, které jsou citlivé na změnu aktivity P-gp ve střevě (jako např. digoxin, dabigatran-etexilát). Podávání přípravku Viekirax s dasabuvirem nebo bez něho společně s léčivými přípravky, které jsou primárně metabolizovány přes UGT1A1, má za následek zvýšení plasmatických koncentrací takových léčivých přípravků (furosemid); u léčiv s úzkým terapeutickým indexem (např. levothyroxin) se doporučuje rutinní klinické monitorování. Podávání přípravku Viekirax společně s dasabuvirem nebo bez něho může snížit expozici léčivých přípravků, které jsou metabolizovány přes CYP2C19 (např. omeprazol, lansoprazol, esomeprazol, s-mefenytoin), což může vyžadovat úpravu dávky/klinické monitorování. Je třeba dbát opatrnosti při společném podávání přípravku Viekirax s léčivými přípravky, které jsou současně inhibitory CYP3A4 i inhibitory mnohočetných transportérů (P-gp, BCRP a/nebo OATP1B1/ OATP1B3). Tyto léčivé přípravky mohou vykázat klinicky relevantní zvýšení expozice paritapreviru (např. ritonavir s atazanavirem, erytromycin, diltiazem nebo verapamil). Silné inhibitory P-gp, BCRP, OATP1B1 a/nebo OATP1B3 mohou zvýšit expozici paritapreviru. Nežádoucí účinky: Velmi časté nežádoucí účinky: insomnie, pruritus, únava, astenie. Časté: anemie. Během klinických studií se vyskytly laboratorní abnormality (zvýšení ALT v séru, zvýšení bilirubinu v séru). Uchovávání: žádné zvláštní podmínky uchovávání. Balení: PVC/PE/PCTFE blistr s Al fólií, balení obsahuje 56 tablet. Vícečetné balení obsahuje 4 balení po 14 tabletách. Držitel rozhodnutí o registraci: AbbVie Ltd., Maidenhead, Velká Británie. Registrační číslo: EU/1/14/982/001. Poslední revize textu: 02/2017. Přípravek je vázán na lékařský předpis a je hrazen z prostředků veřejného zdravotního pojištění. Seznamte se, prosím, s úplnou informací o přípravku dříve, než jej předepíšete. *Všimněte si, prosím, změn v informacích o léčivém přípravku. AbbVie, s.r.o., Metronom Business Center, Bucharova 2817/13, Praha 5 Nové Butovice. Tel.: , fax: , Zkrácené informace o léčivém přípravku EXVIERA 250 mg potahované tablety Složení: Jedna potahovaná tableta obsahuje dasabuvirum 250 mg. Indikace: V kombinaci s dalšími léčivými přípravky k léčbě chronické hepatitidy C u dospělých. Dávkování a doba léčby: Doporučená dávka dasabuviru je 250 mg (jedna tableta) dvakrát denně (ráno a večer). Exviera se nesmí podávat formou monoterapie, je třeba ho užívat v kombinaci s dalšími léčivými přípravky určenými k léčbě HCV. Doba trvání kombinované terapie: pacienti s genotypem 1b bez cirhózy nebo s kompenzovanou cirhózou: Exviera + Viekirax (ombitasvir/paritaprevir/ritonavir) 12 týdnů, 8 týdnů může být zváženo u dosud neléčených pacientů s infekcí genotypu 1b s minimální až středně těžkou fibrózou*; pacienti s genotypem 1a bez cirhózy: Exviera + Viekirax (ombitasvir/paritaprevir/ritonavir) + ribavirin 12 týdnů; pacienti s genotypem 1a s kompenzovanou cirhózou: Exviera + Viekirax (ombitasvir/paritaprevir/ritonavir) + ribavirin 24 týdnů. Zvláštní populace: U pacientů s infekcí genotypem 1 HCV a po transplantaci jater se doporučuje podávat přípravek Exviera a ombitasvir/ paritaprevir/ ritonavir v kombinaci s ribavirinem po dobu 24 týdnů. Na počátku je vhodné podat nižší dávku ribavirinu. U pacientů s lehkou, středně těžkou či těžkou poruchou funkce ledvin nebo u pacientů v terminálním stádiu onemocnění ledvin na dialýze* není třeba dávku přípravku Exviera upravovat. U pacientů vyžadujících léčbu ribavirinem se prosím podívejte do souhrnu údajů o přípravku pro ribavirin, kde naleznete informace týkající se použití u pacientů s poruchou funkce ledvin.* U pacientů s lehkou poruchou funkce jater (Child-Pugh A) není třeba dávku přípravku Exviera upravovat. Exviera se nedoporučuje u pacientů se středně těžkou poruchou funkce jater (Child-Pugh B). Exviera se nesmí používat u pacientů s těžkou poruchou funkce jater (Child- Pugh C). Pro další informace ohledně dávkování viz SPC. Kontraindikace: hypersenzitivita na léčivou látku nebo pomocné látky; použití léčivých přípravků s ethinylestradiolem; v případě společného podávání přípravku Exviera s přípravky, které jsou silnými nebo středně silnými enzymovými induktory (např. karbamazepin, fenytoin, fenobarbital, efavirenz, nevirapin, etravirin, enzalutamid, mitotan, rifampicin, třezalka), se očekává snížení plasmatické koncentrace dasabuviru a snížení jeho terapeutického účinku; tyto induktory jsou kontraindikovány. Léčivé přípravky, které jsou silnými inhibitory CYP2C8, mohou zvýšit koncentraci dasabuviru v plasmě a společně s přípravkem Exviera se nesmí podávat (gemfibrozil). Kontraindikace s ombitasvirem/paritaprevirem/ritonavirem viz SPC tohoto přípravku. Těhotenství a kojení: Při užívání přípravku Exviera s ribavirinem je třeba s extrémní opatrností dbát na to, aby pacientky a partnerky pacientů neotěhotněly. Účinnou formu antikoncepce je třeba používat 7 měsíců po ukončení léčby ribavirinem. Zvláštní upozornění: Byla stanovena bezpečnost a účinnost přípravku Exviera v kombinaci s ombitasvirem/paritaprevirem /ritonavirem a s ribavirinem či bez něho. Společné podávání přípravku Exviera s ostatními antivirotiky nebylo studováno, a proto je nelze doporučit. Během klinických hodnocení dasabuviru a ombitasviru/paritapreviru/ritonaviru s ribavirinem či bez něho došlo u přibližně 1 % subjektů k přechodnému zvýšení ALT na více než pětinásobek horní meze běžných hodnot. Zvýšení ALT byla asymptomatická a docházelo k nim obvykle během prvních 4 týdnů léčby. Hladiny ALT při dalším podávání během přibližně dvou týdnů od zvýšení poklesly. Použití se statiny: Očekává se, že dasabuvir s kombinací ombitasvir/paritaprevir/ritonavir zvýší expozici rosuvastatinu více než 3násobně. Pokud je léčba rosuvastatinem během terapie nutná, maximální denní dávka rosuvastatinu nemá přesáhnout 5 mg. Vzhledem k tomu, že Exviera se doporučuje v kombinaci s paritaprevirem/ombitasvirem/ritonavirem a že ritonavir může u pacientů s koinfekcí HIV bez pokračující antiretrovirové terapie vyvolat rezistenci na inhibitory proteázy, pacienti s koinfekcí HIV bez supresivní antiretrovirové terapie nemají být dasabuvirem léčeni. Při koinfekci HIV je třeba pečlivě zvažovat lékové interakce. Po uvedení přípravku na trh byly u pacientů léčených přípravkem Exviera s kombinací ombitasvir/paritaprevir/ritonavir s ribavirinem či bez něho hlášeny případy jaterní dekompenzace a selhání jater, včetně transplantace jater nebo fatálního průběhu. U většiny pacientů s těmito závažnými projevy se již před zahájením terapie projevovaly příznaky pokročilé nebo dekompenzované cirhózy. Přestože je kvůli výchozímu pokročilému onemocnění jater obtížné zjistit příčinnou souvislost, potenciální riziko nelze vyloučit. U pacientů s cirhózou: monitorujte klinické známky a příznaky jaterní dekompenzace (například ascites, jaterní encefalopatii, krvácení z varixů); laboratorní jaterní testy včetně koncentrace přímého bilirubinu je třeba provést na počátku léčby, během prvních 4 týdnů od jejího zahájení a poté tak, jak to bude klinicky indikováno; u pacientů s projevy jaterní dekompenzace léčbu přerušte. Reaktivace viru hepatitidy typu B: Byly zaznamenány případy, některé z nich fatální, reaktivace viru hepatitidy typu B (HBV) během nebo po léčbě přímo působícími antivirotiky. Screening HBV má být u každého pacienta proveden ještě před zahájením léčby. Pacienti s koinfekcí HBV/HCV jsou vystaveni riziku reaktivace HBV, a proto mají být monitorováni a má jim být poskytnuta péče podle aktuálních standardních léčebných postupů.* Pro další informace viz SPC. Interakce: Dasabuvir musí být vždy podáván společně s ombitasvirem/paritaprevirem/ritonavirem. Zvýšené pozornosti je třeba dbát při podání přípravku Exviera společně s léčivými přípravky, které jsou primárně metabolizovány přes CYP3A, toto podání může mít za následek zvýšení plasmatické koncentrace těchto léčivých přípravků a tedy nutnou úpravu jejich dávkování. Jedná se zejména o cyklosporin, takrolimus, amlodipin, rilpivirin, alprazolam a hydrokodon. Stejně je třeba přistupovat ke společnému podání přípravku Exviera a léčivých přípravků, které jsou substráty OATP1B1, OATP1B3, OATP2B1 nebo OCT1, tj. statiny (pravastatin, rosuvastatin). Úprava dávky/klinické monitorování je třeba při společném podání přípravku Exviera a léčivých přípravků, které jsou substráty BCRP, tj. sulfasalazin, imatinib a rosuvastatin. Exviera může zvýšit plasmatickou expozici léčivým přípravkům, které jsou citlivé na změnu aktivity P-gp ve střevě (jako např. digoxin, dabigatran-etexilát). Podávání přípravku Exviera společně s léčivými přípravky, které jsou primárně metabolizovány přes UGT1A1, má za následek zvýšení plasmatických koncentrací takových léčivých přípravků (furosemid); u léčiv s úzkým terapeutickým indexem (např. levothyroxin) se doporučuje rutinní klinické monitorování. Podávání přípravku Exviera může snížit expozici léčivých přípravků, které jsou metabolizovány přes CYP2C19 (např. omeprazol, lansoprazol, esomeprazol, s-mefenytoin), což může vyžadovat úpravu dávky/klinické monitorování. Mezi látky, které mohou zvyšovat expozici dasabuviru a mají být používány s opatrností, patří teriflunomid a deferasirox. Pacienti léčení antagonisty vitamínu K: Vhledem k tomu, že během léčby přípravkem Exviera s ombitasvirem/paritaprevirem/ritonavirem může dojít ke změně jaterních funkcí, je doporučeno pečlivé monitorování mezinárodního normalizovaného poměru (INR).* Nežádoucí účinky: Velmi časté nežádoucí účinky: insomnie, pruritus, únava, astenie. Časté: anemie. Během klinických studií se vyskytly laboratorní abnormality (zvýšení ALT v séru, zvýšení bilirubinu v séru). Uchovávání: žádné zvláštní podmínky uchovávání. Balení: PVC/PE/PCTFE blistr s Al fólií, balení obsahuje 56 tablet. Vícečetné balení obsahuje 4 balení po 14 tabletách. Držitel rozhodnutí o registraci: AbbVie Ltd., Maidenhead, Velká Británie. Registrační číslo: EU/1/14/983/001. Poslední revize textu: 02/2017. Přípravek je vázán na lékařský předpis a je hrazen z prostředků veřejného zdravotního pojištění. Seznamte se, prosím, s úplnou informací o přípravku dříve, než jej předepíšete. *Všimněte si, prosím, změn v informacích o léčivém přípravku.abbvie, s.r.o., Metronom Business Center, Bucharova 2817/13, Praha 5 Nové Butovice. Tel.: , fax: , Reference: 1. SPC Viekirax. 2. SPC Exviera. AbbVie s.r.o., Metronom Business Center, Bucharova 2817/13, Praha 5 Nové Butovice, tel.: , fax: , CZHCV170064
První případ elektrické stimulační terapie dolního jícnového svěrače indikovaný v ČR k implantaci
 Klinická Hereditárny a experimentální angioedém gastroenterologie: ako príčina bolestí kazuistika brucha doi: 10.14735/amgh2017csgh.info04 První případ elektrické stimulační terapie dolního jícnového svěrače
Klinická Hereditárny a experimentální angioedém gastroenterologie: ako príčina bolestí kazuistika brucha doi: 10.14735/amgh2017csgh.info04 První případ elektrické stimulační terapie dolního jícnového svěrače
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Jedna potahovaná tableta obsahuje atazanavirum 300 mg (jako atazanaviri sulfas) a cobicistatum 150 mg.
 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
Obecné aspekty lékových interakcí
 Obecné aspekty lékových interakcí výskyt, rozdělení, hlavní mechanismy a důsledky lékových interakcí PharmDr. Josef Suchopár 18. 6. 2014 Lékové interakce: skutečný problém nebo fáma? Velká Británie (Pirmohamed,
Obecné aspekty lékových interakcí výskyt, rozdělení, hlavní mechanismy a důsledky lékových interakcí PharmDr. Josef Suchopár 18. 6. 2014 Lékové interakce: skutečný problém nebo fáma? Velká Británie (Pirmohamed,
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
APTIVUS musí být předepisován lékaři se zkušenostmi s léčbou infekce virem HIV-1.
 1. NÁZEV PŘÍPRAVKU APTIVUS 100 mg/ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml perorálního roztoku obsahuje tipranavirum 100 mg. Úplný seznam pomocných látek viz bod 6.1. 3. LÉKOVÁ
1. NÁZEV PŘÍPRAVKU APTIVUS 100 mg/ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml perorálního roztoku obsahuje tipranavirum 100 mg. Úplný seznam pomocných látek viz bod 6.1. 3. LÉKOVÁ
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
Informace pro zdravotnické odborníky
 EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
KLACID 250 KLACID 500 Potahované tablety (Clarithromycinum)
 sp.zn.sukls58557/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE KLACID 250 KLACID 500 Potahované tablety (Clarithromycinum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn.sukls58557/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE KLACID 250 KLACID 500 Potahované tablety (Clarithromycinum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
LP Olysio, ATC skupina J05AE14
 Indikační omezení a kritéria LP Olysio, ATC skupina J05AE14 (kód SÚKL 0210009), má indikační omezení pro úhradu P : Simeprevir je hrazen v kombinaci s pegylovaným interferonem alfa a ribavirinem k léčbě
Indikační omezení a kritéria LP Olysio, ATC skupina J05AE14 (kód SÚKL 0210009), má indikační omezení pro úhradu P : Simeprevir je hrazen v kombinaci s pegylovaným interferonem alfa a ribavirinem k léčbě
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Mění se chirurgická léčba stenotického karcinomu rekta?
 Hereditárny Gastrointestinální angioedém onkologie: ako príčina původní bolestí prácebrucha doi: 0.4735/amgh06csgh.info6 Mění se chirurgická léčba stenotického karcinomu rekta? Are there any changes in
Hereditárny Gastrointestinální angioedém onkologie: ako príčina původní bolestí prácebrucha doi: 0.4735/amgh06csgh.info6 Mění se chirurgická léčba stenotického karcinomu rekta? Are there any changes in
Kdy indikovat jícnovou manometrii?
 Kdy indikovat jícnovou manometrii? Zuzana Vacková Klinika hepatogastroenterologie, IKEM 13.11.2015 Jícnová manometrie Co to je? funkční vyšetření hodnotící motilitu jícnu Jak se provádí? transnasálně zavedená
Kdy indikovat jícnovou manometrii? Zuzana Vacková Klinika hepatogastroenterologie, IKEM 13.11.2015 Jícnová manometrie Co to je? funkční vyšetření hodnotící motilitu jícnu Jak se provádí? transnasálně zavedená
Příloha IV. Vědecké závěry
 Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
Bezpečnostní průvodce použití přípravku REVOLADE (eltrombopag) při léčbě chronické trombocytopenie asociované s hepatitidou typu C (HCVaT)
 Bezpečnostní průvodce použití přípravku REVOLADE (eltrombopag) při léčbě chronické trombocytopenie asociované s hepatitidou typu C (HCVaT) Důležité bezpečnostní informace pro lékaře týkající se sledování
Bezpečnostní průvodce použití přípravku REVOLADE (eltrombopag) při léčbě chronické trombocytopenie asociované s hepatitidou typu C (HCVaT) Důležité bezpečnostní informace pro lékaře týkající se sledování
Od opia k melatoninu aneb Práce s nespavým pacientem
 Soubor pøednášek ze semináøe Od opia k melatoninu aneb Práce s nespavým pacientem Semináøe se konají na 14 místech ÈR v období únor duben 2009 1. Péèe o pacienta s nespavostí Diagnostika a nefarmakologická
Soubor pøednášek ze semináøe Od opia k melatoninu aneb Práce s nespavým pacientem Semináøe se konají na 14 místech ÈR v období únor duben 2009 1. Péèe o pacienta s nespavostí Diagnostika a nefarmakologická
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls18786/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls18786/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MOTILIUM 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Domperidonum 10 mg v jedné potahované
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls18786/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MOTILIUM 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Domperidonum 10 mg v jedné potahované
Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům
 15 September 2016 EMA/PRAC/603546/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC konaném
15 September 2016 EMA/PRAC/603546/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC konaném
Doporučené diagnostické a terapeutické postupy pro všeobecné praktické lékaře SUPPLEMENTUM
 Doporučené diagnostické a terapeutické postupy pro všeobecné praktické lékaře VIROVÁ HEPATITIDA C SUPPLEMENTUM prof. MUDr. Petr Urbánek, CSc. prof. MUDr. Petr Husa, CSc. MUDr. Jan Šperl, CSc. MUDr. Soňa
Doporučené diagnostické a terapeutické postupy pro všeobecné praktické lékaře VIROVÁ HEPATITIDA C SUPPLEMENTUM prof. MUDr. Petr Urbánek, CSc. prof. MUDr. Petr Husa, CSc. MUDr. Jan Šperl, CSc. MUDr. Soňa
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Anémie a horní dyspeptický syndrom (kazuistika)
 Anémie a horní dyspeptický syndrom (kazuistika) MUDr. Ľubica Cibičková, Ph.D. Tvorba a ověření e-learningového prostředí pro integraci výuky preklinických a klinických předmětů na LF UP a FZV UP Reg. č.:
Anémie a horní dyspeptický syndrom (kazuistika) MUDr. Ľubica Cibičková, Ph.D. Tvorba a ověření e-learningového prostředí pro integraci výuky preklinických a klinických předmětů na LF UP a FZV UP Reg. č.:
po 5 letech ... s excelentním kosmetickým výsledkem 2
 ... s excelentním kosmetickým výsledkem 2 pred lécbou 6. týden 12. týden po 1 roku po 3 letech po 5 letech Správný výber pro Vaše pacienty se superficiálními BCC - krátkodobá lécba s velice dobrým kosmetickým
... s excelentním kosmetickým výsledkem 2 pred lécbou 6. týden 12. týden po 1 roku po 3 letech po 5 letech Správný výber pro Vaše pacienty se superficiálními BCC - krátkodobá lécba s velice dobrým kosmetickým
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Jedna potahovaná tableta obsahuje daclatasvirum 90 mg ve formě daclatasviri dihydrochloridum.
 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
Úzkost u seniorů. Stres, úzkost a nespavost ve stáří. Úzkost a poruchy chování ve stáří. Sborník přednášek z Jarního sympozia 2011
 Úzkost u seniorů Stres, úzkost a nespavost ve stáří MUDr. Petr Hrubeš Hradec Králové Úzkost a poruchy chování ve stáří MUDr. Vanda Franková Dobřany Sborník přednášek z Jarního sympozia 2011 Moderní trendy
Úzkost u seniorů Stres, úzkost a nespavost ve stáří MUDr. Petr Hrubeš Hradec Králové Úzkost a poruchy chování ve stáří MUDr. Vanda Franková Dobřany Sborník přednášek z Jarního sympozia 2011 Moderní trendy
EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE
 EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE Příručka pro předepisujícího lékaře Pokyny pro zdravotnické pracovníky ohledně předepisování přípravku Cerdelga (eliglustat) Tento léčivý přípravek
EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE Příručka pro předepisujícího lékaře Pokyny pro zdravotnické pracovníky ohledně předepisování přípravku Cerdelga (eliglustat) Tento léčivý přípravek
Soňa Fraňková Klinika hepatogastroenterologie, Transplantcentrum IKEM
 Soňa Fraňková Klinika hepatogastroenterologie, Transplantcentrum IKEM 1971 Combes poprvé popsal membranózní glomerulonefritidu asociovanou s HBV infekcí (depozita imunokomplexů) Různé typy glomerulární
Soňa Fraňková Klinika hepatogastroenterologie, Transplantcentrum IKEM 1971 Combes poprvé popsal membranózní glomerulonefritidu asociovanou s HBV infekcí (depozita imunokomplexů) Různé typy glomerulární
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
INFORMACE PRO ZDRAVOTNÍKY O PŘÍPRAVKU BOSENTAN ACCORD
 EDUKAČNÍ MATERIÁLY INFORMACE PRO ZDRAVOTNÍKY O PŘÍPRAVKU BOSENTAN ACCORD Předtím, než předepíšete přípravek Bosentan Accord jakémukoli pacientovi, přečtěte si prosím pečlivě příslušný Souhrn údajů o přípravku.
EDUKAČNÍ MATERIÁLY INFORMACE PRO ZDRAVOTNÍKY O PŘÍPRAVKU BOSENTAN ACCORD Předtím, než předepíšete přípravek Bosentan Accord jakémukoli pacientovi, přečtěte si prosím pečlivě příslušný Souhrn údajů o přípravku.
Jedna potahovaná tableta obsahuje darunovirum 800 mg (jako darunaviri ethanolas) a cobicistatum 150 mg.
 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
Jedna potahovaná tableta obsahuje atazanavirum 300 mg (jako atazanaviri sulfas) a cobicistatum 150 mg.
 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Pradaxa 75 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje dabigatranum etexilatum 75 mg (ve formě dabigatrani
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Pradaxa 75 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje dabigatranum etexilatum 75 mg (ve formě dabigatrani
Jedna potahovaná tableta obsahuje daclatasvirum 30 mg ve formě daclatasviri dihydrochloridum.
 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE. KLACID SR 500 mg Tablety s řízeným uvolňováním (Clarithromycinum)
 sp.zn.sukls61390/2015 a sukls48116/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE KLACID SR 500 mg Tablety s řízeným uvolňováním (Clarithromycinum) Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn.sukls61390/2015 a sukls48116/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE KLACID SR 500 mg Tablety s řízeným uvolňováním (Clarithromycinum) Přečtěte si pozorně celou příbalovou informaci dříve,
Lékové interakce u diabetiků v České republice PharmDr. Josef Suchopár MUDr. Michal Prokeš Hradec Králové, 7.června 2008
 Lékové interakce u diabetiků v České republice PharmDr. Josef Suchopár MUDr. Michal Prokeš Hradec Králové, 7.června 2008 Obsah sdělení Úvod do problematiky, význam lékových interakcí Příklady interakcí
Lékové interakce u diabetiků v České republice PharmDr. Josef Suchopár MUDr. Michal Prokeš Hradec Králové, 7.června 2008 Obsah sdělení Úvod do problematiky, význam lékových interakcí Příklady interakcí
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Tybost 150 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje cobicistatum 150 mg. Pomocná látka se
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Tybost 150 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje cobicistatum 150 mg. Pomocná látka se
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls106353/2011
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls106353/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRVKU Lopacut 2 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls106353/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRVKU Lopacut 2 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje
Astma a alergie v roce 2010 a novinky pro rok 2011
 Dne 30. 11. 2010 od 17:30 hodin Restaurace Větruše Fibichova 392 Ústí nad Labem Moderuje: Doc. MUDr. Vít Petrů, CSc. 17:30 Úvodní slovo Doc. MUDr. Vít Petrů, CSc. 17:45 Astma kazuistiky a novinky v léčbě
Dne 30. 11. 2010 od 17:30 hodin Restaurace Větruše Fibichova 392 Ústí nad Labem Moderuje: Doc. MUDr. Vít Petrů, CSc. 17:30 Úvodní slovo Doc. MUDr. Vít Petrů, CSc. 17:45 Astma kazuistiky a novinky v léčbě
Příloha č.3 k rozhodnutí o změně registrace sp.zn.sukls98466/2010 a příloha k sp.zn.sukls164928/2009, sukls164929/2009
 Příloha č.3 k rozhodnutí o změně registrace sp.zn.sukls98466/2010 a příloha k sp.zn.sukls164928/2009, sukls164929/2009 1. NÁZEV PŘÍPRAVKU Kapidin 10 mg Kapidin 20 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU
Příloha č.3 k rozhodnutí o změně registrace sp.zn.sukls98466/2010 a příloha k sp.zn.sukls164928/2009, sukls164929/2009 1. NÁZEV PŘÍPRAVKU Kapidin 10 mg Kapidin 20 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU
V příbalové informaci naleznete:
 Příloha č. 2 k rozhodnutí o povolení souběžného dovozu sp. zn.:sukls131001/2011 PŘÍBALOVÁ INFORMACE SIMGAL 10 mg potahované tablety (simvastatinum) Přečtěte si pozorně celou příbalovou informaci dříve,
Příloha č. 2 k rozhodnutí o povolení souběžného dovozu sp. zn.:sukls131001/2011 PŘÍBALOVÁ INFORMACE SIMGAL 10 mg potahované tablety (simvastatinum) Přečtěte si pozorně celou příbalovou informaci dříve,
Registr Avastin Nemalobuněčný karcinom plic
 Registr Avastin Nemalobuněčný karcinom plic Formulář: Vstupní parametry Rok narození Věk Pohlaví Kouření o Kuřák o Bývalý kuřák o Nekuřák Hmotnost pacienta v době diagnózy (kg) Hmotnost pacienta v době
Registr Avastin Nemalobuněčný karcinom plic Formulář: Vstupní parametry Rok narození Věk Pohlaví Kouření o Kuřák o Bývalý kuřák o Nekuřák Hmotnost pacienta v době diagnózy (kg) Hmotnost pacienta v době
5 omylů (problémů) center BL dle revizí VZP a jak jim předcházet. Martin Bortlík Klinické a výzkumné centrum pro střevní záněty ISCARE, Praha
 5 omylů (problémů) center BL dle revizí VZP a jak jim předcházet Martin Bortlík Klinické a výzkumné centrum pro střevní záněty ISCARE, Praha Úvod Provádění revizí je zákonnou povinností ZP ( 4 zákona č.
5 omylů (problémů) center BL dle revizí VZP a jak jim předcházet Martin Bortlík Klinické a výzkumné centrum pro střevní záněty ISCARE, Praha Úvod Provádění revizí je zákonnou povinností ZP ( 4 zákona č.
Jedna potahovaná tableta obsahuje daclatasvirum 30 mg ve formě dihydrochloridu.
 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
1. NÁZEV PŘÍPRAVKU. Aptivus 100 mg/ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 1. NÁZEV PŘÍPRAVKU Aptivus 100 mg/ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml perorálního roztoku obsahuje tipranavirum 100 mg. Úplný seznam pomocných látek viz bod 6.1. 3. LÉKOVÁ
1. NÁZEV PŘÍPRAVKU Aptivus 100 mg/ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml perorálního roztoku obsahuje tipranavirum 100 mg. Úplný seznam pomocných látek viz bod 6.1. 3. LÉKOVÁ
Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg.
 Sp.zn.sukls97430/2013 1.NÁZEV LÉČIVÉHO PŘÍPRAVKU Tannex 2 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg. Pomocná látka se známým účinkem:
Sp.zn.sukls97430/2013 1.NÁZEV LÉČIVÉHO PŘÍPRAVKU Tannex 2 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg. Pomocná látka se známým účinkem:
Příbalová informace: informace pro uživatele. CORSIM 10 CORSIM 20 CORSIM 40 potahované tablety (simvastatinum)
 sp.zn.sukls30566/2015 Příbalová informace: informace pro uživatele CORSIM 10 CORSIM 20 CORSIM 40 potahované tablety (simvastatinum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn.sukls30566/2015 Příbalová informace: informace pro uživatele CORSIM 10 CORSIM 20 CORSIM 40 potahované tablety (simvastatinum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
CYP3A4 inhibice 25000% 19 276% 20000% 15000% 10000% 5000% 34% 261% 607% 840% prednisolon oxykodon alfentanyl midazolam tilidin
 CYP3A4 inhibice Jako cytochrom P-450 je označována rozsáhlá "rodina" hematoproteinových oxidáz, fylogeneticky velmi starých enzymů (jsou přítomny už u archebakterií), jejichž funkcí je oxidace substrátů
CYP3A4 inhibice Jako cytochrom P-450 je označována rozsáhlá "rodina" hematoproteinových oxidáz, fylogeneticky velmi starých enzymů (jsou přítomny už u archebakterií), jejichž funkcí je oxidace substrátů
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. ZOCOR 10 mg ZOCOR 20 mg ZOCOR FORTE 40 mg Potahované tablety Simvastatinum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ZOCOR 10 mg ZOCOR 20 mg ZOCOR FORTE 40 mg Potahované tablety Simvastatinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ZOCOR 10 mg ZOCOR 20 mg ZOCOR FORTE 40 mg Potahované tablety Simvastatinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
DABIGATRAN PREVENCE CÉVNÍ MOZKOVÉ PŘÍHODY
 1 DABIGATRAN PREVENCE CÉVNÍ MOZKOVÉ PŘÍHODY Vítková E., Krajíčková D. Komplexní cerebrovaskulární centrum Neurologická klinika LF UK a FN Hradec Králové 2 Atriální fibrilace riziko CMP AF výskyt u 0,5%
1 DABIGATRAN PREVENCE CÉVNÍ MOZKOVÉ PŘÍHODY Vítková E., Krajíčková D. Komplexní cerebrovaskulární centrum Neurologická klinika LF UK a FN Hradec Králové 2 Atriální fibrilace riziko CMP AF výskyt u 0,5%
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU ellaone 30 mg tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 30 mg ulipristali acetas. Pomocné látky se známým účinkem:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU ellaone 30 mg tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 30 mg ulipristali acetas. Pomocné látky se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
Edukační materiál. Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera
 Edukační materiál Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera Přípravek Strattera je indikován k léčbě hyperkinetické
Edukační materiál Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera Přípravek Strattera je indikován k léčbě hyperkinetické
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Atazanavir Krka 150 mg tvrdé tobolky Atazanavir Krka 200 mg tvrdé tobolky Atazanavir Krka 300 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Atazanavir Krka 150 mg tvrdé tobolky Atazanavir Krka 200 mg tvrdé tobolky Atazanavir Krka 300 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Emselex 7,5 mg, tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 7,5 mg darifenacinum (jako hydrobromid)
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Emselex 7,5 mg, tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 7,5 mg darifenacinum (jako hydrobromid)
Pomocná látka se známým účinkem: Jedna tableta obsahuje 160 mg laktózy.
 1. NÁZEV PŘÍPRAVKU INTELENCE 100 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje um 100 mg. Pomocná látka se známým účinkem: Jedna tableta obsahuje 160 mg laktózy. Úplný seznam
1. NÁZEV PŘÍPRAVKU INTELENCE 100 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje um 100 mg. Pomocná látka se známým účinkem: Jedna tableta obsahuje 160 mg laktózy. Úplný seznam
Kelapril 5mg 7x14tbl.
 Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Praxbind doporučení pro podávání (SPC)
 Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Familiární středomořská (Mediterranean) horečka (Fever)
 www.printo.it/pediatric-rheumatology/cz/intro Familiární středomořská (Mediterranean) horečka (Fever) Verze č 2016 2. DIAGNÓZA A LÉČBA 2.1 Jak se nemoc diagnostikuje? Obecně se uplatňuje následující postup:
www.printo.it/pediatric-rheumatology/cz/intro Familiární středomořská (Mediterranean) horečka (Fever) Verze č 2016 2. DIAGNÓZA A LÉČBA 2.1 Jak se nemoc diagnostikuje? Obecně se uplatňuje následující postup:
Jedna potahovaná tableta obsahuje 75 mg darunavirum (jako darunaviri ethanolas).
 1. NÁZEV PŘÍPRAVKU PREZISTA 75 mg potahované tablety PREZISTA 150 mg potahované tablety PREZISTA 300 mg potahované tablety PREZISTA 600 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ PREZISTA
1. NÁZEV PŘÍPRAVKU PREZISTA 75 mg potahované tablety PREZISTA 150 mg potahované tablety PREZISTA 300 mg potahované tablety PREZISTA 600 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ PREZISTA
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
B. PŘÍBALOVÁ INFORMACE
 B. PŘÍBALOVÁ INFORMACE PŘÍBALOVÁ INFORMACE PRO: Fungiconazol 200 mg tablety pro psy 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD
B. PŘÍBALOVÁ INFORMACE PŘÍBALOVÁ INFORMACE PRO: Fungiconazol 200 mg tablety pro psy 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 1. NÁZEV PŘÍPRAVKU Ramonna 1500 mikrogramů, tableta
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ramonna 1500 mikrogramů, tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje levonorgestrelum1500 mikrogramů. Pomocné látky se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ramonna 1500 mikrogramů, tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje levonorgestrelum1500 mikrogramů. Pomocné látky se známým účinkem:
Deprese u seniorů. Pohled geriatra na depresi u seniorů. Léčba deprese ve stáří zdroj uspokojení i frustrace lékaře
 Deprese u seniorů Pohled geriatra na depresi u seniorů Doc. MUDr. Iva Holmerová, Ph.D. Praha Léčba deprese ve stáří zdroj uspokojení i frustrace lékaře Prim. MUDr. Richard Krombholz Praha Sborník přednášek
Deprese u seniorů Pohled geriatra na depresi u seniorů Doc. MUDr. Iva Holmerová, Ph.D. Praha Léčba deprese ve stáří zdroj uspokojení i frustrace lékaře Prim. MUDr. Richard Krombholz Praha Sborník přednášek
PŘÍLOHA IV VĚDECKÉ ZÁVĚRY
 PŘÍLOHA IV VĚDECKÉ ZÁVĚRY Vědecké závěry Koinfekce virem hepatitidy B (HBV) a virem hepatitidy C (HCV) není vzhledem k podobnému způsobu přenosu neobvyklá. Je známo, že infekce HCV u pacientů s koinfekcí
PŘÍLOHA IV VĚDECKÉ ZÁVĚRY Vědecké závěry Koinfekce virem hepatitidy B (HBV) a virem hepatitidy C (HCV) není vzhledem k podobnému způsobu přenosu neobvyklá. Je známo, že infekce HCV u pacientů s koinfekcí
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU INVIRASE 500 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje saquinaviri mesilas v množství odpovídajícím
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU INVIRASE 500 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje saquinaviri mesilas v množství odpovídajícím
sp.zn. sukls275213/2012 a sp.zn. sukls10671/2012
 sp.zn. sukls275213/2012 a sp.zn. sukls10671/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MAALOX citron suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Algedratum 460 mg, což odpovídá 230mg aluminii
sp.zn. sukls275213/2012 a sp.zn. sukls10671/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MAALOX citron suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Algedratum 460 mg, což odpovídá 230mg aluminii
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls179784/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IMODIUM 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Loperamidi hydrochloridum 2 mg v jedné tobolce Úplný seznam pomocných látek viz bod
sp.zn.: sukls179784/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IMODIUM 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Loperamidi hydrochloridum 2 mg v jedné tobolce Úplný seznam pomocných látek viz bod
STANDARDNÍ DIAGNOSTICKÝ A TERAPEUTICKÝ POSTUP CHRONICKÉ INFEKCE VIREM HEPATITIDY C (HCV)
 STANDARDNÍ DIAGNOSTICKÝ A TERAPEUTICKÝ POSTUP CHRONICKÉ INFEKCE VIREM Pracovní skupina pro virové hepatitidy České hepatologické společnosti České lékařské společnosti Jana Evangelisty Purkyně Pracovní
STANDARDNÍ DIAGNOSTICKÝ A TERAPEUTICKÝ POSTUP CHRONICKÉ INFEKCE VIREM Pracovní skupina pro virové hepatitidy České hepatologické společnosti České lékařské společnosti Jana Evangelisty Purkyně Pracovní
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls2006/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL Rapide potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls2006/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL Rapide potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
Léčba vnějších genitálních a perianálních bradavic (condylomata acuminata)
 Léčba vnějších genitálních a perianálních bradavic (condylomata acuminata) Stimulace imunity tam, kde je potřeba Prokázaná účinnost Mechanismus účinku přípravku Aldara (1) Stimuluje vrozenou a buněčnou
Léčba vnějších genitálních a perianálních bradavic (condylomata acuminata) Stimulace imunity tam, kde je potřeba Prokázaná účinnost Mechanismus účinku přípravku Aldara (1) Stimuluje vrozenou a buněčnou
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Lopinavir/Ritonavir Mylan 100 mg/25 mg potahované tablety Lopinavir/Ritonavir Mylan 200 mg/50 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Lopinavir/Ritonavir Mylan 100 mg/25 mg potahované tablety Lopinavir/Ritonavir Mylan 200 mg/50 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Úloha specializované ambulance srdečního selhání v Kardiocentru IKEM. Markéta Hegarová Klinika kardiologie IKEM
 Úloha specializované ambulance srdečního selhání v Kardiocentru IKEM Markéta Hegarová Klinika kardiologie IKEM Epidemiologie srdečního selhání v ČR 250 000 pacientů s CHSS 125 000 pacientů se systolickou
Úloha specializované ambulance srdečního selhání v Kardiocentru IKEM Markéta Hegarová Klinika kardiologie IKEM Epidemiologie srdečního selhání v ČR 250 000 pacientů s CHSS 125 000 pacientů se systolickou
Neprůhledná modrobílá tobolka označená bílým a modrým potiskem, "BMS 100 mg" na jedné polovině a "3623" na druhé polovině tobolky.
 1. NÁZEV PŘÍPRAVKU REYATAZ 100 mg tvrdé tobolky REYATAZ 150 mg tvrdé tobolky REYATAZ 200 mg tvrdé tobolky REYATAZ 300 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ REYATAZ 100 mg tvrdé tobolky
1. NÁZEV PŘÍPRAVKU REYATAZ 100 mg tvrdé tobolky REYATAZ 150 mg tvrdé tobolky REYATAZ 200 mg tvrdé tobolky REYATAZ 300 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ REYATAZ 100 mg tvrdé tobolky
PARALEN 500 tablety. Doporučené dávkování paracetamolu; VĚK HMOTNOST Jednotlivá dávka Max. denní dávka 21-25 kg
 Příloha č. 2 k opravě sdělení sp.zn. sukls226519/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg.
Příloha č. 2 k opravě sdělení sp.zn. sukls226519/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Jeden sáček 1,5 g perorálního prášku obsahuje atazanavirum 50 mg (jako atazanaviri sulfas).
 1. NÁZEV PŘÍPRAVKU REYATAZ 50 mg perorální prášek 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček 1,5 g perorálního prášku obsahuje atazanavirum 50 mg (jako atazanaviri sulfas). Pomocné látky se známým
1. NÁZEV PŘÍPRAVKU REYATAZ 50 mg perorální prášek 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček 1,5 g perorálního prášku obsahuje atazanavirum 50 mg (jako atazanaviri sulfas). Pomocné látky se známým
Psychofarmaka a gravidita. MUDr. Zdeňka Vyhnánková
 Psychofarmaka a gravidita MUDr. Zdeňka Vyhnánková ZÁKLADNÍ PRAVIDLA PRO FARMAKOTERAPII V TĚHOTENSTVÍ nemoc většinou znamená větší riziko než léčba indikace by měla být podložená a ne alibistická většina
Psychofarmaka a gravidita MUDr. Zdeňka Vyhnánková ZÁKLADNÍ PRAVIDLA PRO FARMAKOTERAPII V TĚHOTENSTVÍ nemoc většinou znamená větší riziko než léčba indikace by měla být podložená a ne alibistická většina
Celkové shrnutí vědeckého hodnocení přípravku Atacand Plus a související názvy (viz Příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÝCH INFORMACÍ PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 14 Vědecké závěry Celkové
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÝCH INFORMACÍ PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 14 Vědecké závěry Celkové
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aptivus 250 mg měkké tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna měkká tobolka obsahuje tipranavirum 250 mg. Pomocné látky se známým účinkem:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aptivus 250 mg měkké tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna měkká tobolka obsahuje tipranavirum 250 mg. Pomocné látky se známým účinkem:
Perorální kladribin: bezpečnostní profil, monitorování pacientů a praktické zkušenosti.
 Perorální kladribin: bezpečnostní profil, monitorování pacientů a praktické zkušenosti. I V A N A K O V Á Ř O V Á C E N T R U M P R O D E M Y E L I N I Z A Č N Í O N E M O C N Ě N Í N E U R O L O G I C
Perorální kladribin: bezpečnostní profil, monitorování pacientů a praktické zkušenosti. I V A N A K O V Á Ř O V Á C E N T R U M P R O D E M Y E L I N I Z A Č N Í O N E M O C N Ě N Í N E U R O L O G I C
Pomocná látka se známým účinkem: jedna tobolka obsahuje 56 mg monohydrátu laktózy.
 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls114374/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls114374/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LOPERON cps 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Loperamidi hydrochloridum 2 mg v jedné
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls114374/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LOPERON cps 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Loperamidi hydrochloridum 2 mg v jedné
KLACID SR Tablety s řízeným uvolňováním (Clarithromycinum)
 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE KLACID SR Tablety s řízeným uvolňováním (Clarithromycinum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE KLACID SR Tablety s řízeným uvolňováním (Clarithromycinum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte
