EDUKAČNÍ MATERIÁLY. Exjade (deferasirox) Důležité informace pro lékaře předepisující přípravek Exjade
|
|
|
- Jitka Pospíšilová
- před 6 lety
- Počet zobrazení:
Transkript
1 EDUKAČNÍ MATERIÁLY Exjade (deferasirox) Důležité informace pro lékaře předepisující přípravek Exjade
2 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Jakékoli podezření na závažný nebo neočekávaný nežádoucí účinek a jiné skutečnosti závažné pro zdraví léčených osob musí být hlášeno Státnímu ústavu pro kontrolu léčiv. Podrobnosti o hlášení najdete na: Adresa pro zasílání je Státní ústav pro kontrolu léčiv, oddělení farmakovigilance, Šrobárova 48, Praha 10, , farmakovigilance@sukl.cz. Tato informace může být také hlášena společnosti Novartis na adresu: Novartis s.r.o., Gemini, budova B, Na Pankráci 1724/129, Praha 4 tel: , fax: , farmakovigilance.cz@novartis.com Dříve než přípravek Exjade předepíšete, přečtěte si pečlivě souhrn údajů o přípravku (SPC). Indikace 1,2 Chronické přetížení organismu železem po transfuzi Deferasirox je indikován v léčbě chronického přetížení železem v důsledku opakovaných krevních transfuzí ( 7 ml erytrocytární masy/kg/měsíc) u nemocných s beta-talasemií major ve věku 6 a více let. Deferasirox je také indikován k léčbě chronického přetížení organismu železem způsobeného transfuzemi krve, kde je léčba deferoxaminem kontraindikována nebo nevhodná u následujících skupin pacientů: u pediatrických pacientů s beta-talasemií major s chronickým přetížením železem způsobeným častými transfuzemi krve ( 7 ml/kg/měsíc erytrocytární masy) ve věku od 2 do 5 let u pediatrických a dospělých pacientů s beta-talasemií major s chronickým přetížením železem způsobeným málo častými transfuzemi krve (< 7 ml/kg/ měsíc erytrocytární masy) ve věku od 2 let u pediatrických a dospělých pacientů s jinými typy anemií ve věku od 2 let Talasemie nezávislá na podávání krevních transfuzí Deferasirox je indikován k léčbě chronického přetížení organismu železem u pacientů s talasemií nezávislou na podávání krevních transfuzí ve věku od 10 let v případech, kdy je léčba deferoxaminem kontraindikována nebo nevhodná. Kontraindikace 1 Deferasirox je kontraindikován u pacientů s hypersenzitivitou na léčivou látku nebo kteroukoliv pomocnou látku Deferasirox je kontraindikován v kombinaci s jinými terapeutickými chelátory železa, protože bezpečnost takových kombinací nebyla stanovena Deferasirox je kontraindikován u pacientů s clearance kreatininu (CrCl) < 60 ml/min. Podání deferasiroxu nebylo studováno u nemocných s poškozením ledvin a je kontraindikováno u nemocných se stanovenou CrCl < 60 ml/min. 2
3 Zahájení léčby deferasiroxem Vyšetření před zahájením terapie Vyšetření před léčbou 1,2 Test Před léčbou Sérový feritin Koncentrace železa v játrech (LIC) a Sérový kreatinin 2 CrCl a/nebo cystatin C v plazmě Proteinurie Sérové transaminázy (ALT a AST) Bilirubin Alkalická fosfatáza Vyšetření sluchu Vyšetření zraku Tělesná hmotnost, výška a pohlavní vývoj (pediatričtí pacienti) a U pacientů s talasemií nezávislou na podávání krevních transfuzí: Koncentrace železa v játrech (LIC) je preferovaná metoda stanovení přetížení železem a měla by být použita, kdykoli je to možné. U všech pacientů s talasemií nezávislou na podávání krevních transfuzí by se mělo během chelatační léčby dbát zvýšené opatrnosti, aby se minimalizovalo riziko nadměrné chelatace. 2 Konverze dávky mezi Exjade potahované tablety a dispergovatelné tablety Existují dvě lékové formy přípravku deferasirox: Exjade potahované tablety a Exjade dispergovatelné tablety, každá je k dispozici ve třech silách Potahované tablety: 90 mg, 180 mg a 360 mg Dispergovatelné tablety: 125 mg, 250 mg a 500 mg Obě lékové formy obsahují stejnou aktivní složku (deferasirox). Exjade potahované tablety jsou aplikační forma deferasiroxu s upravenou silou a vyšší biologickou dostupností v porovnání s dispergovatelnými tabletami Oba typy tablet lze odlišit podle jejich tvaru, barvy, velikosti a vzhledu obalů 3
4 Při přechodu pacientů z lékové formy deferasiroxu potahované tablety na dispergovatelné tablety musí dojít ke změně podání a k úpravě dávkování. Důležité rozdíly mezi Exjade potahovanými a dispergovatelnými tabletami Exjade potahované tablety Síla: 90 mg, 180 mg, 360 mg (oválné, modré tablety) Exjade dispergovatelné tablety Síla: 125 mg, 250 mg, 500 mg (kulaté, bílé tablety) Lze užívat nalačno nebo spolu s lehkým jídlem Tablety se polykají celé a zapíjí se dostatečným množstvím vody. Pacientům, kteří nejsou schopni polykat celé tablety, je možné potahované tablety rozdrtit a nasypat na měkké jídlo, např. jogurt nebo jablečné pyré (čisté jablko) Neobsahuje laktózu Je třeba užívat nalačno, nejméně 30 minut před jídlem Dispergovatelné tablety se užívají rozpuštěné ve vodě, pomerančovém nebo jablečném džusu. Dispergovatelné tablety se nesmějí kousat ani polykat celé Obsahuje laktózu 90 mg 180 mg 360 mg 125 mg 250 mg 500 mg Tablety nejsou zobrazeny ve skutečné velikosti. Tablety nejsou zobrazeny ve skutečné velikosti. Převedení z dispergovatelných tablet na potahované tablety dávka ve formě potahovaných tablet má být o 30 % nižší, než byla dávka ve formě dispergovatelných tablet, zaokrouhleno na počet celých tablet. Aby nedocházelo k chybám, musí lékařský předpis přípravku Exjade specifikovat typ přípravku (dispergovatelné tablety nebo potahované tablety) a vypočítanou dávku na den spolu se silou potahovaných nebo dispergovatelných tablet. Vzhledem k dostupnosti deferasiroxu ve formě potahované tablety nebudou v blízké budoucnosti dispergovatelné tablety v Evropské unii dostupné. 4
5 Konverze dávky mezi Exjade potahované tablety a dispergovatelné tablety Exjade potahované tablety Rozmezí dávky: 7 28 mg/kg/den; vypočítáno a zaokrouhleno na počet celých tablet Úprava dávky: zvýšení mg/kg/den Terapeutický rozsah dávek: 7 mg/kg/den 14 mg/kg/den (maximální doporučovaná dávka pro NTDT pacienty) 21 mg/kg/den 28 mg/kg/den (maximální doporučovaná dávka pro pacienty s chronickým přetížením železem v důsledku krevních transfuzí) Příklad výpočtu denní dávky pro pacienta s chronickým přetížením železem o hmotnosti 50 kg, kterému je podáváno 21 mg/kg/den: 21 mg/kg/den 50 kg = 1050 mg/den Tři (3) 360 mg tablety Exjade dispergovatelné tablety Rozmezí dávky: mg/kg/den; vypočítáno a zaokrouhleno na počet celých tablet Úprava dávky: zvýšení 5-10 mg/kg/den Terapeutický rozsah dávek: 10 mg/kg/den 20 mg/kg/den (maximální doporučovaná dávka pro NTDT pacienty) 30 mg/kg/den 40 mg/kg/den (maximální doporučovaná dávka pro pacienty s chronickým přetížením železem v důsledku krevních transfuzí) Příklad výpočtu denní dávky pro pacienta s chronickým přetížením železem o hmotnosti 50 kg, kterému je podáváno 30 mg/kg/den: 30 mg/kg/den 50 kg = 1500 mg/den Tři (3) 500 mg tablety 5
6 Dávkování přípravkem Exjade potahované tablety u pacientů s chronickým přetížením železem v důsledku krevních transfuzí Doporučená úvodní denní dávka: 14 mg/kg/den tělesné váhy 1 Dávky > 28 mg/kg/den se nedoporučují 1 Pravidelně monitorujte pacienty 1 Úvodní dávka přípravku Exjade a úprava dávkování u pacientů s chronickým přetížením železem v důsledku krevních transfuzí 1 ÚVODNÍ léčba ZVYŠOVÁNÍ DÁVKY k dosažení cílového stavu nezbytné a SNÍŽENÍ DÁVKY k zamezení nadměrné chelatace KONEC LÉČBY jakmile je dosaženo cílového stavu 14 mg/kg/den tělesné váhy (doporučená úvodní dávka) 20 jednotek (~ 100 ml/ kg) erytrocytární masy nebo SF >1000 μg/l 7 mg/kg/den tělesné váhy < 7 ml/kg/měsíc erytrocytární masy (~ < 2 jednotky/měsíc pro dospělého) Dávku navyšujte o 3,5 až 7 mg/kg/den až na dávku 28 mg/kg/den Dávku snižte o 3,5 až 7 mg/kg/den pokud je SF = µg/l Dávku navyšujte o 3,5 až 7 mg/kg/den až na dávku 28 mg/kg/den 21 mg/kg/den tělesné váhy >14 ml/kg/měsíc erytrocytární masy (~ < 4 jednotky/měsíc pro dospělého) U pacientů již úspěšně léčených deferoxaminem lze stanovit úvodní dávku přípravku Exjade potahované tablety jako numerickou třetinu dávky deferoxaminu Dávku navyšujte o 3,5 až 7 mg/kg/den až na dávku 28 mg/kg/den. Zvažte alternativní způsob léčby, pokud není dosaženo uspokojivé léčby při dávkách 28 mg/kg/den Dávku navyšujte o 3,5 až 7 mg/kg/den, pokud je dávka < 14 mg/ kg tělesné hmotnosti a není dosažena dostatečná účinnost Dávku snižte o 3,5 až 7 mg/kg/den pokud je SF trvale < 2500 μg/l a má tendenci se dále snižovat Dávku snižte o 3,5 až 7 mg/kg/den pokud je SF trvale < 2500 μg/l a má tendenci se dále snižovat SF [hladina sérového feritinu]; a Zvýšení dávky by se mělo uvažovat, pouze pokud pacient léčbu dobře toleruje. SF trvale < 500 μg/l Pediatrická populace s přetížením železem v důsledku krevních transfuzí 1 Doporučené dávkování pro dětské pacienty ve věku od 2 do 17 let s přetížením železem způsobeným transfuzemi je stejné jako pro dospělé. Při výpočtu dávky je nutné vzít v úvahu změnu tělesné hmotnosti dětských pacientů během růstu. U dětí s přetížením železem způsobeným transfuzemi mezi 2 a 5 lety věku je expozice nižší než u dospělých. Tato věková skupina může tedy vyžadovat vyšší dávkování, než je nutné u dospělých. Počáteční dávka však musí být stejná jako u dospělých s následnou individuální titrací. 6
7 Dávkování přípravkem Exjade potahované tablety u pacientů s talasemií nezávislou na podávání krevních transfuzí (NTDT) Doporučená úvodní denní dávka: 7 mg/kg/den tělesné hmotnosti 1 Dávky > 14 mg/kg/den se nedoporučují 1 U pacientů s NTDT se doporučuje jenom jeden cyklus chelatační léčby 1 Pravidelně monitorujte pacienty 1 Úvodní dávka a úprava dávkování přípravku Exjade (deferasirox) potahované tablety u pacientů s talasemií nezávislou na podávání krevních transfuzí s přetížením organismu železem 2 ÚVODNÍ léčba a ZVÝŠENÍ DÁVKY k dosažení cílového stavu, kde je to nezbytné a,b SNÍŽENÍ DÁVKY k zamezení nadměrné chelatace KONEC LÉČBY jakmile je dosaženo cílového stavu 7 mg/kg/den Navýšeni dávky o 3,5 až 7 mg/kg/den až do maximální dávky 14 mg/kg/den Sníženi dávky na 7 mg/kg/den nebo méně O znovuzahájení léčby u pacientů, u nichž došlo k opětovné akumulaci železa po dosažení přijatelné hladiny železa, nejsou dostupná žádná data, a proto se znovuzahájení léčby nedoporučuje. LIC 5 mg Fe/g dw nebo SF > 800 µg/l LIC 7 mg Fe/g dw nebo SF > 2000 µg/l LIC <7 mg Fe/g dw nebo SF 2000 µg/l Cílový stav LIC <3 mg Fe/g dw nebo SF < 300 µg/l dw [suchá hmotnost] SF [hladina sérového feritinu] a U pacientů s talasemií nezávislou na podávání krevních transfuzí se dávky vyšší než 14 mg/kg/den nedoporučují. U pacientů bez stanovené LIC a s hladinou sérového feritinu 2000 ug/l by dávka neměla překročit 7 mg/kg/den. b Zvýšení dávky by se mělo uvažovat, pouze pokud nemají parametry LIC a sérový feritin sestupný trend a pacient léčbu dobře toleruje. Pediatričtí pacienti s NTDT 1 U pediatrických pacientů s talasemií nezávislou na podávání krevních transfuzí by dávka neměla překročit 7 mg/kg/den. Aby se zamezilo nadměrné chelataci, měla by být u těchto pacientů s hladinou sérového feritinu 800 µg/l hodnocena LIC každé tři měsíce. 1 UPOZORNĚNÍ: Data o dětských pacientech s talasemií nezávislou na podávání krevních transfuzí jsou velmi omezena. Proto musí být léčba přípravkem Exjade pečlivě sledována, aby bylo možné zjistit nežádoucí účinky a sledovat zátěž železem. Před zahájením léčby přípravkem Exjade u silně železem přetížených dětí s talasemií nezávislou na podávání krevních transfuzí by si měl být lékař vědom skutečnosti, že důsledky dlouhodobé expozice u těchto pacientů nejsou v současné době známé. 1 7
8 Dávkování přípravkem Exjade dispergovatelné tablety u pacientů s chronickým přetížením železem v důsledku krevních transfuzí Doporučená úvodní denní dávka: 20 mg/kg/den tělesné váhy 1 Dávky > 40 mg/kg/den se nedoporučují 1 Pravidelně monitorujte pacienty 1 Úvodní dávka přípravku Exjade (deferasirox) dispergovatelné tablety a úprava dávkování u pacientů s chronickým přetížením železem v důsledku krevních transfuzí 2 ÚVODNÍ léčba ZVÝŠENÍ DÁVKY k dosažení cílového stavu nezbytné a SNÍŽENÍ DÁVKY k zamezení nadměrné chelatace KONEC LÉČBY jakmile je dosaženo cílového stavu 20 mg/kg/den tělesné váhy (doporučená úvodní dávka) 20 jednotek (~ 100 ml/kg) erytrocytární masy nebo SF >1000 μg/l 10 mg/kg/den tělesné váhy <7 ml/kg/měsíc erytrocytární masy (~ <2 jednotky/měsíc pro dospělého) 30 mg/kg/den tělesné váhy >14 ml/kg/měsíc erytrocytární masy (~ <4 jednotky/měsíc pro dospělého) U pacientů již úspěšně léčených deferoxaminem lze stanovit úvodní dávku přípravku Exjade dispergovatelné tablety jako numerickou polovinu dávky deferoxaminu. Dávku navyšujte o 5 až 10 mg/kg/den až na dávku 40 mg/kg/den Dávku navyšujte o 5 až 10 mg/ kg/den až na dávku 40 mg/ kg/den Dávku navyšujte o 5 až 10 mg/ kg/den až na dávku 40 mg/ kg/den Dávku navyšujte o 5 až 10 mg/kg/den, pokud je dávka <20 mg/ kg tělesné hmotnosti a není dosažena dostatečná účinnost Dávku snižte o 5 až 10 mg/kg/den pokud je SF = µg/l Dávku snižte o 5 až 10 mg/kg/den pokud je SF trvale < 2500 μg/l a má tendenci se dále snižovat Dávku snižte o 5 až 10 mg/kg/den pokud je SF trvale <2500 μg/l a má tendenci se dále snižovat SF [hladina sérového feritinu]; a Zvýšení dávky by se mělo uvažovat, pouze pokud pacient léčbu dobře toleruje. SF trvale < 500 μg/l Pediatrická populace s přetížením železem v důsledku krevních transfuzí 1 Doporučené dávkování pro dětské pacienty ve věku od 2 do 17 let s přetížením železem způsobeným transfuzemi je stejné jako pro dospělé. Při výpočtu dávky je nutné vzít v úvahu změnu tělesné hmotnosti dětských pacientů během růstu. U dětí s přetížením železem způsobeným transfuzemi mezi 2 a 5 lety věku je expozice nižší než u dospělých. Tato věková skupina může tedy vyžadovat vyšší dávkování, než je nutné u dospělých. Počáteční dávka však musí být stejná jako u dospělých s následnou individuální titrací. 8
9 Dávkování přípravkem Exjade dispergovatelné tablety u pacientů s talasemií nezávislou na podávání krevních transfuzí Doporučená úvodní denní dávka: 10 mg/kg/den tělesné hmotnosti 1 Dávky > 20 mg/kg/den se nedoporučují 1 U pacientů s NTDT se doporučuje jenom jeden cyklus chelatační léčby 1 Pravidelně monitorujte pacienty pro kontrolu správnosti léčby 1 Úvodní dávka a úprava dávkování přípravku Exjade (deferasirox) dispergovatelné tablety u pacientů s talasemií nezávislou na podávání krevních transfuzí s přetížením organismu železem 2 ÚVODNÍ léčba a ZVÝŠENÍ DÁVKY k dosažení cílového stavu, kde je to nezbytné a,b SNÍŽENÍ DÁVKY k zamezení nadměrné chelatace KONEC LÉČBY jakmile je dosaženo cílového stavu 10 mg/kg/den Navýšení dávky o 5 až 10 mg/kg/den až do maximální dávky 20 mg/kg/den pro dospělé pacienty a 10 mg/kg/ den pro pediatrické pacienty Snížení dávky na 10 mg/kg/den nebo méně Znovuzahájení léčby není doporučeno pro pacienty s NTDT LIC 5 mg Fe/g dw nebo SF > 800 µg/l LIC 7 mg Fe/g dw nebo SF > 2000 µg/l LIC < 7 mg Fe/g dw nebo SF 2000 µg/l Cílový stav LIC < 3 mg Fe/g dw nebo SF <300 µg/l dw [suché hmotnosti] SF [hladina sérového feritinu] a U pacientů s talasemií nezávislou na podávání krevních transfuzí se dávky vyšší než 20 mg/kg/den nedoporučují. U pacientů bez stanovené LIC a s hladinou sérového feritinu 2000 ug/l by dávka neměla překročit 10 mg/kg/den. b Zvýšení dávky by se mělo uvažovat, pouze pokud nemají parametry LIC a sérový feritin sestupný trend a pacient léčbu dobře toleruje. Pediatričtí pacienti s NTDT 1 U pediatrických pacientů s talasemií nezávislou na podávání krevních transfuzí by dávka neměla překročit 10 mg/kg. Aby se zamezilo nadměrné chelataci, měla by být u těchto pacientů s hladinou sérového feritinu 800 µg/l hodnocena LIC každé tři měsíce. 1 UPOZORNĚNÍ: Data o dětských pacientech s talasemií nezávislou na podávání krevních transfuzí jsou velmi omezena. Proto musí být léčba přípravkem Exjade pečlivě sledována, aby bylo možné zjistit nežádoucí účinky a sledovat zátěž železem. Před zahájením léčby přípravkem Exjade u silně železem přetížených dětí s talasemií nezávislou na podávání krevních transfuzí by si měl být lékař vědom skutečnosti, že důsledky dlouhodobé expozice u těchto pacientů nejsou v současné době známé. 1 9
10 Zvažte přerušení léčby deferasiroxem, 1,2 pokud: Parametr Podmínky přerušení léčby Sérový feritin Sérový kreatinin Proteinurie Tubulární markery Sérové transaminázy (ALT a AST) Metabolická acidóza SJS, TEN nebo jiná vážná kožní reakce (např. DRESS) Hypersenzitivní reakce Zrak a sluch Neobjasněná cytopenie Hladina sérového feritinu je trvale pod 500 µg/l (u potransfuzního přetížení železem) nebo pod 300 µg/l (u syndromů talasemie nezávislých na podávání krevních transfuzí) Dospělí a děti: po snížení dávky zůstává hladina sérového kreatininu > 33 % nad počáteční hodnotou nebo clearance kreatininu < 90 ml/min nutno pacienta předat do péče urologovi a zvážit biopsii Přetrvávající abnormální hodnoty pacienta nutno předat do péče nefrologa a zvážit biopsii Přetrvávající abnormální hodnoty pacienta nutno předat do péče nefrologa a zvážit biopsii (zvažte také snížení dávky) Přetrvávající a progresivní zvýšení jaterních enzymů Rozvoj metabolické acidózy Při podezření na vážnou kožní reakci musí být podávání přípravku okamžitě ukončeno a nesmí být znovu zahájeno Při výskytu hypresenzitivní reakce: Ukončete podávání přípravku a zahajte vhodnou léčbu. U pacientů, u nichž se objevila hypersenzitivní reakce, nesmí být léčba znovu zahájena vzhledem k riziku anafylaktického šoku Poruchy během léčby (snížení dávky či přerušení léčby) Rozvoj neobjasněné cytopenie DRESS [poléková reakce s eozinofilií a systémovými příznaky] TEN [toxická epidermální nekrolýza] SJS [Stevens-Johnson syndrom] 10
11 Doporučené sledování pacientů před a v průběhu lečby deferasiroxem 1,2 : Začátek léčby 1. měsíc po zahájení léčby deferasiroxem nebo změně dávky Měsíčně Každé 3 měsíce Ročně Sérový feritin Koncentrace železa v játrech (LIC) a Sérový kreatinin CrCl a/nebo cystatin C v plazmě Proteinurie 2x Týdně (také jednou týdně první měsíc léčby po změně dávky) Týdně (také jednou týdně první měsíc léčby po změně dávky) (pouze u pediatrických pacientů jestliže je SF 800µg/l) Sérové transaminázy, bilirubin,alkalická fosfatáza Tělesná hmotnost, výška a sexuální vývoj (pediatričtí pacienti) Vyšetření sluchu/ zraku (včetně fundoskopie) Každé 2 týdny a Pro pacienty s NTDT: Měřte přetížení organismu železem pomocí LIC. LIC je preferovaná metoda stanovení přetížení železem a má být použita, kdykoli je to možné. U všech pacientů se má během chelatační léčby dbát zvýšené opatrnosti, aby se minimalizovalo riziko nadměrné chelatace. 2 Výsledky testů sérového kreatininu, CrCl, cystatinu C v plazmě, proteinurie, SF a jaterních aminotransferáz, bilirubinu a alkalické fosfatázy je nutno zaznamenávat a pravidelně vyhodnocovat z hlediska vývoje. Výsledky by měly být rovněž uvedeny ve zdravotnické dokumentaci pacienta, spolu s výchozími hodnotami před léčbou pro všechny testy. 11
12 Renální bezpečnostní profil Nálezy z klinických studií Parametry hodnocené v klinických studiích 1,2 Do studií s přípravkem Exjade byli zařazováni pouze nemocní, kteří měli ve vztahu k věku a pohlaví normální hodnoty sérového kreatininu. Jednotlivé výchozí hodnoty sérového kreatininu před zahájením léčby byly propočítávány jako průměr dvou (u některých pacientů tří) hodnot. Průměrný koeficient variace těchto dvou až tří měření u jednotlivých pacientů byl přibližně 10%. 1 Tato variace je podkladem pro doporučení měřit sérový kreatinin před zahájením léčby deferasiroxem dvakrát. V průběhu léčby byl sérový kreatinin stanovován měsíčně. Při vzestupu sérového kreatininu byly prováděny níže popsané úpravy dávky. Výsledky z jednoročního sledování v základních studiích 1,2 V klinických studiích se zvýšení sérového kreatininu o > 33 % při 2 po sobě jdoucích měřeních (někdy nad horní hranici normálního rozmezí) vyskytlo asi u 36 % pacientů. Toto zvýšení bylo závislé na dávce. Asi u dvou třetin pacientů se hladiny vrátily pod úroveň 33 % bez úpravy dávkování. U zbývající třetiny zvýšení sérového kreatininu nereagovalo vždy na snížení dávky nebo na ukončení léčby. V některých případech byla po snížení dávky pozorována pouze stabilizace hodnot sérového kreatininu. Sledování sérového kreatininu a clearance kreatininu (CrCl) 1,2 Stanovení sérového kreatininu se doporučuje provést před započetím léčby dvakrát. Sérový kreatinin, clearance kreatininu (stanovená Cockcroft-Gaultovou nebo MDRD metodou u dospělých a Schwartzovou metodou u dětí) a/nebo plazmatické hladiny cystatinu C je nutno monitorovat před léčbou, každý týden v prvním měsíci po zahájení léčby nebo po změně dávky deferasiroxu a poté jednou měsíčně. Metody pro odhad CrCl 1,2 Metody pro odhad clearance kreatininu 1 Pro porovnání je uveden krátký přehled metod pro odhad clearance kreatininu u dospělých a dětí užívajících Exjade. Dospělí Jakmile je zvolena jedna metoda, neměla by se v průběhu sledování měnit za jinou. Vzorec Cockroftův-Gaultův 3. Cockroftův-Gaultův vzorec je běžně užívaný ukazatel pro aktuální clearance kreatininu. Tento vzorec užívá k predikci clearance kreatininu hodnotu kreatininu a pacientovu hmotnost. Vzorec určuje clearance kreatininu v ml/min. Clearance kreatinu* = (140 - věk) váha kg 72 a sérový kreatinin (v mg/dl) * U žen se získaná hodnota násobí konstantou 0,85. 12
13 CKD-EPI rovnice 4,5 V běžné praxi a z perspektivy veřejného zdraví bývá upředňostnována v Severní Americe, Evropě a Austrálii CKD-EPI rovnice. Míra glomerulární filtrace (GFR) = 141 min (Scr/κ,1)α max(scr/κ,1)-1,209 0,993 věk [u žen] [u lidí tmavé pleti], kde Scr je sérový kreatinin, κ je 0,7 u žen a 0,9 u mužů, α je u žen a u mužů, min znamená minimum Scr/κ nebo 1, a max znamená maximum Scr/κ nebo 1. Děti Schwartzův vzorec 6 Clearance kreatinu (ml/min) = konstanta b výška (cm) sérový kreatinin (v mg/dl) a CKD-EPI, Chronic Kidney Disease Epidemiology Collaboration. a Pokud je sérový kreatinin stanoven v mmol/l namísto v mg/dl, měla by konstanta byt 815 namísto 72. b Konstanta je 0,55 u dětí a dospívajících dívek nebo 0,70 u dospívajících chlapců. Renální bezpečnostní profil Sledování renálních funkcí a další postup 1,2 Exjade (deferasirox) potahované tablety: Snížení dávky o 7 mg/kg/den, pokud 1 Dospělí pacienti: Sérový kreatinin >33% nad průměrnou hodnotou před léčbou a CrCl <LLN (90 ml/min) při dvou po sobě jdoucích návštěvách. Pediatričtí pacienti: Sérový kreatinin buď vzestup nad věkově odpovídající ULN a/nebo pokles CrCl pod LLN (<90 ml/min) při dvou po sobě jdoucích návštěvách. Po úpravě dávky, přerušte léčbu, jestliže Sérový kreatinin zůstává >33% nad průměrnou hodnotou před léčbou a/nebo CrCl <LLN (<90 ml/min). Je-li to klinicky indikováno, monitorujte renální tubulární funkce (např. proteinurie, glykosurie u nediabetiků, nízká hladina sérového draslíku, fosfátů, hořčíku, fosfaturie, aminoacidurie, uráty) V případě abnormalit zvažte snížení dávky nebo přerušení léčby. Renální tubulopatie byla hlášena především u dětí a dospívajících s beta-talasemií léčených deferasiroxem. Pacienty je nutno předat do péče nefrologovi a případně zvážit biopsii ledvin pokud při snížení dávky nebo vysazení zůstává sérový kreatinin významně zvýšen a existují-li jiné abnormality (např. proteinurie, Fanconiho syndrom). Pacienti s předcházejícím onemocněním ledvin a pacienti, kteří užívají léky, které snižují renální funkce, mohou mít větší riziko komplikací. U pacientů, u kterých se vyvine průjem a zvracení, by měla být zajištěna dostatečná hydratace. 13
14 Jaterní bezpečnostní profil Stanovení funkce jater U pacientů léčených deferasiroxem bylo pozorováno zvýšení hodnot jaterních testů. U pacientů léčených deferasiroxem byly po jeho uvedení na trh hlášeny případy selhání jater, z nichž některé byly fatální. Většina hlášení jaterního selhání zahrnovala pacienty se závažnými onemocněními, včetně již dříve existující jaterní cirhózy. Úloha deferasiroxu, jako přispívajícího nebo zhoršujícího faktoru, však nemůže být vyloučena. Vyšetření funkce jater se doporučuje provést před zahájením léčby, pak jednou za měsíc nebo častěji, je-li klinicky indikováno Jestliže přetrvává nebo se zvyšuje hodnota jaterních enzymů, které nemá jinou zjevnou příčinu, přerušte léčbu Doporučení v případě poruchy funkce jater Nedoporučuje se podávat deferasirox pacientům s těžkou poruchou funkce jater (Child-Pugh třída C) U pacientů se středně závažnou poruchou funkce jater (Child-Pugh třída B) U těchto pacientů má být dávka výrazně snížena s následným postupným zvyšováním do výše 50 %, deferasirox musí být u těchto pacientů používán opatrně. Jaterní funkce všech pacientů musejí být monitorovány před léčbou, každé 2 týdny během prvního měsíce léčby a potom každý měsíc. Zvýšením aminotransferáz až do pětinásobku horní hranice normálu nebyla farmakokinetika deferasiroxu ovlivněna. Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků. 14
15 Literatura 1. Data on file. Novartis Pharmaceuticals Corp. 2. Exjade (deferasirox) dispersible tablets: EU Summary of Product Characteristics. Novartis; April Cockcroft DW, Gault MH. Nephron. 1976;16(1): Earley A, Miskulin D, Lamb EJ, Levey AS, Uhlig K. Ann Intern Med. 2012;156(11): Levey AS, Stevens LA, Schmid CH, et al; for the Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI). Ann Intern Med. 2009;150(9): Schwartz GJ, Brion LP, Spitzer A. Pediatr Clin North Am. 1987;34(3):
16
TALASEMIE NEZÁVISLÁ NA PODÁVÁNÍ KREVNÍCH TRANSFUZÍ (NTDT)
 TALASEMIE NEZÁVISLÁ NA PODÁVÁNÍ KREVNÍCH TRANSFUZÍ (NTDT) EXJADE (deferasirox) Doporučené dávkování a sledování pacientů s talasemií nezávislou na podávání krevních transfuzí s přetížením organismu železem
TALASEMIE NEZÁVISLÁ NA PODÁVÁNÍ KREVNÍCH TRANSFUZÍ (NTDT) EXJADE (deferasirox) Doporučené dávkování a sledování pacientů s talasemií nezávislou na podávání krevních transfuzí s přetížením organismu železem
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Informace pro zdravotnické odborníky
 EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE
 EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE Příručka pro předepisujícího lékaře Pokyny pro zdravotnické pracovníky ohledně předepisování přípravku Cerdelga (eliglustat) Tento léčivý přípravek
EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE Příručka pro předepisujícího lékaře Pokyny pro zdravotnické pracovníky ohledně předepisování přípravku Cerdelga (eliglustat) Tento léčivý přípravek
CZ PAR. QUETIAPINI FUMARAS Seroquel. UK/W/0004/pdWS/001 NL/W/0004/pdWS/001
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
Brožura pro léčbu přípravkem. Exjade (deferasirox)
 Brožura pro léčbu přípravkem Exjade (deferasirox) JMÉNO DATUM Obsah Brožura pro léčbu přípravkem Exjade (deferasirox) 5 Co je přípravek Exjade? 6 Proč vám byl předepsán přípravek Exjade? 6 Jak přípravek
Brožura pro léčbu přípravkem Exjade (deferasirox) JMÉNO DATUM Obsah Brožura pro léčbu přípravkem Exjade (deferasirox) 5 Co je přípravek Exjade? 6 Proč vám byl předepsán přípravek Exjade? 6 Jak přípravek
CZ PAR QUETIAPINUM. Seroquel. UK/W/0004/pdWS/001. NL/W/0004/pdWS/001
 CZ PAR Název (léčivá látka/ přípravek) Číslo procedury QUETIAPINUM Seroquel UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZVY PŘÍPRAVKŮ KLINICKÝCH STUDIÍ INN DRŽITELÉ PŘÍPRAVKŮ KLINICKÝCH STUDIÍ SCHVÁLENÉ
CZ PAR Název (léčivá látka/ přípravek) Číslo procedury QUETIAPINUM Seroquel UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZVY PŘÍPRAVKŮ KLINICKÝCH STUDIÍ INN DRŽITELÉ PŘÍPRAVKŮ KLINICKÝCH STUDIÍ SCHVÁLENÉ
EDUKAČNÍ MATERIÁLY. TRUVADA 200 mg / 245 mg POTAHOVANÉ TABLETY (EMTRICITABINUM/ TENOFOVIRUM DISOPROXILUM)
 EDUKAČNÍ MATERIÁLY TRUVADA 200 mg / 245 mg POTAHOVANÉ TABLETY (EMTRICITABINUM/ TENOFOVIRUM DISOPROXILUM) DŮLEŽITÉ BEZPEČNOSTNÍ INFORMACE PRO PŘEDEPISUJÍCÍ LÉKAŘE týkající se užívání přípravku Truvada k
EDUKAČNÍ MATERIÁLY TRUVADA 200 mg / 245 mg POTAHOVANÉ TABLETY (EMTRICITABINUM/ TENOFOVIRUM DISOPROXILUM) DŮLEŽITÉ BEZPEČNOSTNÍ INFORMACE PRO PŘEDEPISUJÍCÍ LÉKAŘE týkající se užívání přípravku Truvada k
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Hlášení těhotenství (formulář) RO-GNE: HLÁŠENÍ TĚHOTENSTVÍ
 Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Zároveň žádáme
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Zároveň žádáme
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Důležité bezpečnostní informace pro zdravotnické pracovníky
 Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Poznámka: Tyto úpravy souhrnu údajů o přípravku a
 PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku přijetí rozhodnutí Komisí. Poté,
PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku přijetí rozhodnutí Komisí. Poté,
CZ PAR. QUETIAPINI FUMARAS Seroquel. NL/W/0004/pdWS/002
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury NL/W/0004/pdWS/002 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA ZMĚNA V SmPC
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury NL/W/0004/pdWS/002 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA ZMĚNA V SmPC
INFLECTRA SCREENINGOVÝ LIST. a výběru pacientů pro všechny schválené indikace. Obsahuje pokyny ke správnému screeningu
 Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
Edukační materiál. Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera
 Edukační materiál Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera Přípravek Strattera je indikován k léčbě hyperkinetické
Edukační materiál Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera Přípravek Strattera je indikován k léčbě hyperkinetické
EDUKAČNÍ MATERIÁL. Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid)
 EDUKAČNÍ MATERIÁL Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid) Leflunopharm (leflunomid), jako chorobu modifikující antirevmatikum (Disease-Modifying
EDUKAČNÍ MATERIÁL Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid) Leflunopharm (leflunomid), jako chorobu modifikující antirevmatikum (Disease-Modifying
Edukační materiály. KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře
 Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Hlášení těhotenství (formulář)
 Hlášení těhotenství (formulář) OSOBA PODÁVAJÍCÍ HLÁŠENÍ Počáteční Následné sledování Jméno a příjmení: Upřesnění: Lékař (specializace) Lékárník pacient ostatní (upřesněte) Kontaktní adresa: Telefonní číslo:
Hlášení těhotenství (formulář) OSOBA PODÁVAJÍCÍ HLÁŠENÍ Počáteční Následné sledování Jméno a příjmení: Upřesnění: Lékař (specializace) Lékárník pacient ostatní (upřesněte) Kontaktní adresa: Telefonní číslo:
Iclusig (ponatinib) potahované tablety 15 mg, 30 mg a 45 mg* Důležité bezpečnostní informace pro zdravotnické pracovníky
 Edukační materiály Iclusig (ponatinib) potahované tablety 15 mg, 30 mg a 45 mg* Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Edukační materiály Iclusig (ponatinib) potahované tablety 15 mg, 30 mg a 45 mg* Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Kelapril 5mg 7x14tbl.
 Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
INFORMACE PRO ZDRAVOTNÍKY O PŘÍPRAVKU BOSENTAN ACCORD
 EDUKAČNÍ MATERIÁLY INFORMACE PRO ZDRAVOTNÍKY O PŘÍPRAVKU BOSENTAN ACCORD Předtím, než předepíšete přípravek Bosentan Accord jakémukoli pacientovi, přečtěte si prosím pečlivě příslušný Souhrn údajů o přípravku.
EDUKAČNÍ MATERIÁLY INFORMACE PRO ZDRAVOTNÍKY O PŘÍPRAVKU BOSENTAN ACCORD Předtím, než předepíšete přípravek Bosentan Accord jakémukoli pacientovi, přečtěte si prosím pečlivě příslušný Souhrn údajů o přípravku.
LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE
 LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE Léčba by měla být zahájena a sledována specialistou se zkušenostmi v léčbě revmatoidní artritidy a psoriatické artritidy. Lékař by měl poučit pacienty
LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE Léčba by měla být zahájena a sledována specialistou se zkušenostmi v léčbě revmatoidní artritidy a psoriatické artritidy. Lékař by měl poučit pacienty
Příloha IV. Vědecké závěry
 Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
Od opia k melatoninu aneb Práce s nespavým pacientem
 Soubor pøednášek ze semináøe Od opia k melatoninu aneb Práce s nespavým pacientem Semináøe se konají na 14 místech ÈR v období únor duben 2009 1. Péèe o pacienta s nespavostí Diagnostika a nefarmakologická
Soubor pøednášek ze semináøe Od opia k melatoninu aneb Práce s nespavým pacientem Semináøe se konají na 14 místech ÈR v období únor duben 2009 1. Péèe o pacienta s nespavostí Diagnostika a nefarmakologická
Praxbind doporučení pro podávání (SPC)
 Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
EDUKAČNÍ MATERIÁLY. Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce
 EDUKAČNÍ MATERIÁLY Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERIÁLY Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Mirena (levonorgestrel) Jaydess (levonorgestrel) Kyleena (levonorgestrel)
 EDUKAČNÍ MATERIÁLY Rozdíly mezi přípravky Mirena (levonorgestrel) Jaydess (levonorgestrel) Kyleena (levonorgestrel) Léčivý přípravek Jaydess podléhá dalšímu sledování. To umožní rychlé získání nových informací
EDUKAČNÍ MATERIÁLY Rozdíly mezi přípravky Mirena (levonorgestrel) Jaydess (levonorgestrel) Kyleena (levonorgestrel) Léčivý přípravek Jaydess podléhá dalšímu sledování. To umožní rychlé získání nových informací
Příloha III. Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH)
 Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH) Se souhlasem Evropské lékové agentury (EMA) a její
Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH) Se souhlasem Evropské lékové agentury (EMA) a její
Celkové shrnutí vědeckého hodnocení přípravku Atacand Plus a související názvy (viz Příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÝCH INFORMACÍ PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 14 Vědecké závěry Celkové
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÝCH INFORMACÍ PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 14 Vědecké závěry Celkové
EDUKAČNÍ MATERIÁLY. GILENYA (fingolimod)
 EDUKAČNÍ MATERIÁLY GILENYA (fingolimod) Souhrn doporučení pro předepisující lékaře Jakékoli podezření na závažný nebo neočekávaný nežádoucí účinek a jiné skutečnosti závažné pro zdraví léčených osob musí
EDUKAČNÍ MATERIÁLY GILENYA (fingolimod) Souhrn doporučení pro předepisující lékaře Jakékoli podezření na závažný nebo neočekávaný nežádoucí účinek a jiné skutečnosti závažné pro zdraví léčených osob musí
Hemlibra (emicizumab) Subkutánní injekce. Návod pro zdravotnické pracovníky
 EDUKAČNÍ MATERIÁLY Hemlibra (emicizumab) Subkutánní injekce Návod pro zdravotnické pracovníky Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERIÁLY Hemlibra (emicizumab) Subkutánní injekce Návod pro zdravotnické pracovníky Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Sp.zn.sukls88807/2015
 Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin. Informace pro lékaře EU
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Listopad 2016 Informace pro lékaře EU Tento léčivý přípravek podléhá dalšímu
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Listopad 2016 Informace pro lékaře EU Tento léčivý přípravek podléhá dalšímu
Nebido EDUKAČNÍ MATERIÁL. Jak úspěšně aplikovat přípravek. (testosterone undecanoate)
 EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
Zvažte oddálení podání regadenosonu u pacientů s nekontrolovanou hypertenzí.
 CAVE! Informační dopis pro zdravotníky Rapiscan (regadenoson) - Nové důležité doporučení pro minimalizaci rizika cévní mozkové příhody a prodloužení křečí vyvolaných přípravkem Rapiscan po podání aminofylinu.
CAVE! Informační dopis pro zdravotníky Rapiscan (regadenoson) - Nové důležité doporučení pro minimalizaci rizika cévní mozkové příhody a prodloužení křečí vyvolaných přípravkem Rapiscan po podání aminofylinu.
FARMAKOKINETIKA PODÁNÍ LÉČIVA (JEDNORÁZOVÉ, OPAKOVANÉ) Pavel Jeřábek
 FARMAKOKINETIKA PODÁNÍ LÉČIVA (JEDNORÁZOVÉ, OPAKOVANÉ) Pavel Jeřábek METABOLIZACE ZPŮSOBY APLIKACE Sublingvální nitroglycerin ph ionizace, lipofilita, ochrana před prvním průchodem játry, rychlá resorpce
FARMAKOKINETIKA PODÁNÍ LÉČIVA (JEDNORÁZOVÉ, OPAKOVANÉ) Pavel Jeřábek METABOLIZACE ZPŮSOBY APLIKACE Sublingvální nitroglycerin ph ionizace, lipofilita, ochrana před prvním průchodem játry, rychlá resorpce
Pokyny pro podávání přípravku a sledování pacienta
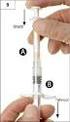 Pokyny pro podávání přípravku a sledování pacienta Informace pro lékaře a zdravotní sestry Červenec 2011 2 Úvod Tato příručka je určena předepisujícím lékařům a zdravotním sestrám a poskytuje praktický
Pokyny pro podávání přípravku a sledování pacienta Informace pro lékaře a zdravotní sestry Červenec 2011 2 Úvod Tato příručka je určena předepisujícím lékařům a zdravotním sestrám a poskytuje praktický
Jaké příznaky by měly praktického lékaře upozornit na renální onemocnění, kdy odeslat pacienta ke specialistovi
 13 Jaké příznaky by měly praktického lékaře upozornit na renální onemocnění, kdy odeslat pacienta ke specialistovi MUDr. Mariana Wohlfahrtová, PhD. Klinika nefrologie, Transplantcentrum, IKEM Úvod Nefrolog
13 Jaké příznaky by měly praktického lékaře upozornit na renální onemocnění, kdy odeslat pacienta ke specialistovi MUDr. Mariana Wohlfahrtová, PhD. Klinika nefrologie, Transplantcentrum, IKEM Úvod Nefrolog
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy o bezpečnosti (PSUR) pro ibuprofen, ibuprofen-lysin
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy o bezpečnosti (PSUR) pro ibuprofen, ibuprofen-lysin
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
KEYTRUDA. (pembrolizumab) Seznam důležitých imunitně zprostředkovaných nežádoucích účinků a jejich příznaků, včetně opatření a léčby
 Edukační materiál KEYTRUDA (pembrolizumab) Seznam důležitých imunitně zprostředkovaných nežádoucích účinků a jejich příznaků, včetně opatření a léčby Brožura pro Zdravotnického pracovníka Tento léčivý
Edukační materiál KEYTRUDA (pembrolizumab) Seznam důležitých imunitně zprostředkovaných nežádoucích účinků a jejich příznaků, včetně opatření a léčby Brožura pro Zdravotnického pracovníka Tento léčivý
Úzkost u seniorů. Stres, úzkost a nespavost ve stáří. Úzkost a poruchy chování ve stáří. Sborník přednášek z Jarního sympozia 2011
 Úzkost u seniorů Stres, úzkost a nespavost ve stáří MUDr. Petr Hrubeš Hradec Králové Úzkost a poruchy chování ve stáří MUDr. Vanda Franková Dobřany Sborník přednášek z Jarního sympozia 2011 Moderní trendy
Úzkost u seniorů Stres, úzkost a nespavost ve stáří MUDr. Petr Hrubeš Hradec Králové Úzkost a poruchy chování ve stáří MUDr. Vanda Franková Dobřany Sborník přednášek z Jarního sympozia 2011 Moderní trendy
PRŮKAZ PACIENTA. užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1
 PRŮKAZ PACIENTA užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě zdravotnického zařízení.
PRŮKAZ PACIENTA užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě zdravotnického zařízení.
dnavou artritidou (GA)
 EDUKAČNÍ MATERIÁLY ILARIS (kanakinumab) Průvodce pro lékaře k používání přípravku Jakékoli podezření na závažný nebo neočekávaný nežádoucí účinek a jiné skutečnosti závažné pro zdraví léčených osob musí
EDUKAČNÍ MATERIÁLY ILARIS (kanakinumab) Průvodce pro lékaře k používání přípravku Jakékoli podezření na závažný nebo neočekávaný nežádoucí účinek a jiné skutečnosti závažné pro zdraví léčených osob musí
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných látek viz bod 6.1.
 Sp. zn. sukls155368/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Silkis mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných
Sp. zn. sukls155368/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Silkis mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných
Familiární středomořská (Mediterranean) horečka (Fever)
 www.printo.it/pediatric-rheumatology/cz/intro Familiární středomořská (Mediterranean) horečka (Fever) Verze č 2016 2. DIAGNÓZA A LÉČBA 2.1 Jak se nemoc diagnostikuje? Obecně se uplatňuje následující postup:
www.printo.it/pediatric-rheumatology/cz/intro Familiární středomořská (Mediterranean) horečka (Fever) Verze č 2016 2. DIAGNÓZA A LÉČBA 2.1 Jak se nemoc diagnostikuje? Obecně se uplatňuje následující postup:
Přehled změn vybraných kapitol
 Přehled změn vybraných kapitol (aneb najdi 10 rozdílů.) změny guidelines 2012 Nové léčebné odpovědi Bendamustin Profylaxe infekčních komplikací Profylaxe TEN Léčba pacientů s renální insuficiencí Léčba
Přehled změn vybraných kapitol (aneb najdi 10 rozdílů.) změny guidelines 2012 Nové léčebné odpovědi Bendamustin Profylaxe infekčních komplikací Profylaxe TEN Léčba pacientů s renální insuficiencí Léčba
Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009
 Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLUCOPHAGE XR 750 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLUCOPHAGE XR 750 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
NeuroBloc. botulinový toxin typu B injekční roztok, U/ml
 NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) jodidu-( 131 I) sodného
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) jodidu-( 131 I) sodného
po 5 letech ... s excelentním kosmetickým výsledkem 2
 ... s excelentním kosmetickým výsledkem 2 pred lécbou 6. týden 12. týden po 1 roku po 3 letech po 5 letech Správný výber pro Vaše pacienty se superficiálními BCC - krátkodobá lécba s velice dobrým kosmetickým
... s excelentním kosmetickým výsledkem 2 pred lécbou 6. týden 12. týden po 1 roku po 3 letech po 5 letech Správný výber pro Vaše pacienty se superficiálními BCC - krátkodobá lécba s velice dobrým kosmetickým
Pioneer in Rare Diseases. Pozvánka na satelitní sympozium společnosti SOBI. Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B?
 Pioneer in Rare Diseases Pozvánka na satelitní sympozium společnosti SOBI Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B? Vážená paní doktorko, vážený pane doktore, dovolte, abychom
Pioneer in Rare Diseases Pozvánka na satelitní sympozium společnosti SOBI Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B? Vážená paní doktorko, vážený pane doktore, dovolte, abychom
Doporučení pro dávkování a způsob podávání přípravku Tasigna
 Klinické studie a přípravek Tasigna Ukázalo se, že přípravek Tasigna u některých pacientů prodlužuje QT interval. V klinické studii fáze II u pacientů s CML s přítomností Ph chromozomu v chronické či akcelerované
Klinické studie a přípravek Tasigna Ukázalo se, že přípravek Tasigna u některých pacientů prodlužuje QT interval. V klinické studii fáze II u pacientů s CML s přítomností Ph chromozomu v chronické či akcelerované
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
DODATKY, KTERÉ MAJÍ BÝT DOPLNĚNY DO PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH NIMESULID (SYSTÉMOVÉ FORMULACE)
 PŘÍLOHA III 1 DODATKY, KTERÉ MAJÍ BÝT DOPLNĚNY DO PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH NIMESULID (SYSTÉMOVÉ FORMULACE) Dodatky jsou psány kurzívou a podtrženě, vymazané
PŘÍLOHA III 1 DODATKY, KTERÉ MAJÍ BÝT DOPLNĚNY DO PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH NIMESULID (SYSTÉMOVÉ FORMULACE) Dodatky jsou psány kurzívou a podtrženě, vymazané
Infuzní roztok. Roztok je čirý, bezbarvý až slabě narůžověle-oranžový. Vnímání zabarvení se může lišit. Teoretická osmolarita: 305 mosm/l ph: 4,5 5,5
 Sp.zn.sukls176520/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Paracetamol B. Braun 10 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml infuzního roztoku obsahuje paracetamolum
Sp.zn.sukls176520/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Paracetamol B. Braun 10 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml infuzního roztoku obsahuje paracetamolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha II. Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC
 Příloha II Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC 68 Vědecké závěry Koordinační skupina pro vzájemné uznávání
Příloha II Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC 68 Vědecké závěry Koordinační skupina pro vzájemné uznávání
Edukační materiály. Imnovid (pomalidomid) Informace pro zdravotnické pracovníky. Brožura pokyny pro bezpečné použití přípravku
 Imnovid Edukační materiály, verze 3.0; schváleno SUKL 30/JAN/2017 Brožura pokyny pro bezpečné použití přípravku Edukační materiály Imnovid (pomalidomid) Informace pro zdravotnické pracovníky Brožura pokyny
Imnovid Edukační materiály, verze 3.0; schváleno SUKL 30/JAN/2017 Brožura pokyny pro bezpečné použití přípravku Edukační materiály Imnovid (pomalidomid) Informace pro zdravotnické pracovníky Brožura pokyny
CAPRELSA (vandetanibum) Pokyny pro pacienty a pečovatele ohledně dávkování a monitorování (pediatrické použití)
 CAPRELSA (vandetanibum) Pokyny pro pacienty a pečovatele ohledně dávkování a monitorování (pediatrické použití) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
CAPRELSA (vandetanibum) Pokyny pro pacienty a pečovatele ohledně dávkování a monitorování (pediatrické použití) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
satelitní sympozium společnosti Amgen Když ODPOVĚĎ je výjimečná
 satelitní sympozium společnosti Amgen Když ODPOVĚĎ je výjimečná Vážená paní doktorko, vážený pane doktore, rádi bychom Vás pozvali na satelitní sympozium společnosti Amgen, které proběhne u příležitosti
satelitní sympozium společnosti Amgen Když ODPOVĚĎ je výjimečná Vážená paní doktorko, vážený pane doktore, rádi bychom Vás pozvali na satelitní sympozium společnosti Amgen, které proběhne u příležitosti
PŘÍLOHA III DODATKY K SOUHRN ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACI
 PŘÍLOHA III DODATKY K SOUHRN ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACI 1 DODATKY MAJÍ BÝT ZAŘAZENY DO ODPOVÍDAJÍCÍCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH MOXIFLOXACIN Následující
PŘÍLOHA III DODATKY K SOUHRN ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACI 1 DODATKY MAJÍ BÝT ZAŘAZENY DO ODPOVÍDAJÍCÍCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH MOXIFLOXACIN Následující
Doporučený postup při řešení krvácivých komplikací u nemocných léčených přímými inhibitory FIIa a FXa (NOAC)
 Doporučený postup při řešení krvácivých komplikací u nemocných léčených přímými inhibitory FIIa a FXa (NOAC) Preambule: Dabigatran, rivaroxaban, apixaban jsou nová perorální antikoagulancia (NOAC), jejichž
Doporučený postup při řešení krvácivých komplikací u nemocných léčených přímými inhibitory FIIa a FXa (NOAC) Preambule: Dabigatran, rivaroxaban, apixaban jsou nová perorální antikoagulancia (NOAC), jejichž
U pacientů, jejichž tělesná hmotnost je vyšší než 100 kg, se dávky přesahující 800 mg/infuzi nedoporučují.
 EDUKAČNÍ MATERIÁLY RoActemra (tocilizumab) Kapesní dávkovací karta pro revmatoidní artritidu Přípravek RoActemra v kombinaci s metotrexátem (MTX) je indikován k léčbě středně těžké až těžké aktivní revmatoidní
EDUKAČNÍ MATERIÁLY RoActemra (tocilizumab) Kapesní dávkovací karta pro revmatoidní artritidu Přípravek RoActemra v kombinaci s metotrexátem (MTX) je indikován k léčbě středně těžké až těžké aktivní revmatoidní
EDUKAČNÍ MATERIÁLY. KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
Soňa Fraňková Klinika hepatogastroenterologie, Transplantcentrum IKEM
 Soňa Fraňková Klinika hepatogastroenterologie, Transplantcentrum IKEM 1971 Combes poprvé popsal membranózní glomerulonefritidu asociovanou s HBV infekcí (depozita imunokomplexů) Různé typy glomerulární
Soňa Fraňková Klinika hepatogastroenterologie, Transplantcentrum IKEM 1971 Combes poprvé popsal membranózní glomerulonefritidu asociovanou s HBV infekcí (depozita imunokomplexů) Různé typy glomerulární
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Zvláštní bezpečnostní informace
 Zvláštní bezpečnostní informace Edukační materiál pro lékaře Součást Plánu řízení rizik léčivého přípravku Arava Schváleno Státním ústavem pro kontrolu léčiv Zvláštní bezpečnostní informace Arava (leflunomid),
Zvláštní bezpečnostní informace Edukační materiál pro lékaře Součást Plánu řízení rizik léčivého přípravku Arava Schváleno Státním ústavem pro kontrolu léčiv Zvláštní bezpečnostní informace Arava (leflunomid),
Souhrn doporučení pro předepisujícího lékaře
 G Souhrn doporučení pro předepisujícího lékaře Kritéria výběru pacientů pro léčbu přípravkem GILENYA (fingolimod) Přípravek GILENYA je vhodný pro dospělé pacienty k léčbě vysoce aktivní relabující-remitentní
G Souhrn doporučení pro předepisujícího lékaře Kritéria výběru pacientů pro léčbu přípravkem GILENYA (fingolimod) Přípravek GILENYA je vhodný pro dospělé pacienty k léčbě vysoce aktivní relabující-remitentní
sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014
 sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYTELASE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ambenonii chloridum 10 mg v 1 tabletě. Pomocné látky
sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYTELASE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ambenonii chloridum 10 mg v 1 tabletě. Pomocné látky
Nová diagnóza = Studiová indikace. První relaps = Studiová indikace
 Velcade dostupné léčebné protokoly Nová diagnóza = Studiová indikace První relaps = Studiová indikace C M G Velcade dostupné léčebné protokoly Nová diagnóza = Studiová indikace První relaps = Studiová
Velcade dostupné léčebné protokoly Nová diagnóza = Studiová indikace První relaps = Studiová indikace C M G Velcade dostupné léčebné protokoly Nová diagnóza = Studiová indikace První relaps = Studiová
Důležité informace o užívání přípravku TASIGNA
 Důležité informace o užívání přípravku TASIGNA Důležité informace o užívání přípravku TASIGNA Co je důležité vědět o přípravku TASIGNA Přípravek TASIGNA je lék vydávaný pouze na lékařský předpis. TASIGNA
Důležité informace o užívání přípravku TASIGNA Důležité informace o užívání přípravku TASIGNA Co je důležité vědět o přípravku TASIGNA Přípravek TASIGNA je lék vydávaný pouze na lékařský předpis. TASIGNA
EXELON NÁPLASTI NÁVOD K POUŽITÍ & ZÁZNAMOVÁ KARTA VAŠÍ LÉČBY
 XLON NÁPLASTI NÁVOD K POUŽITÍ & ZÁZNAMOVÁ KARTA VAŠÍ LÉČBY Než se začnete léčit přípravkem xelon náplasti, přečtěte si pozorně celou příbalovou informaci požádejte někoho, aby Vám ji celou přečetl. Případné
XLON NÁPLASTI NÁVOD K POUŽITÍ & ZÁZNAMOVÁ KARTA VAŠÍ LÉČBY Než se začnete léčit přípravkem xelon náplasti, přečtěte si pozorně celou příbalovou informaci požádejte někoho, aby Vám ji celou přečetl. Případné
Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1
![Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1 Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1](/thumbs/102/154291766.jpg) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Edukační materiály
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Edukační materiály
Příloha III. Úpravy příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy příslušných bodů souhrnu údajů o přípravku a příbalové informace 26 Stávající informace o přípravcích se mění (vložení, náhrada nebo zrušení textu podle potřeby) tak, aby odpovídaly
Příloha III Úpravy příslušných bodů souhrnu údajů o přípravku a příbalové informace 26 Stávající informace o přípravcích se mění (vložení, náhrada nebo zrušení textu podle potřeby) tak, aby odpovídaly
Edukační materiály PRŮVODCE VYDÁVÁNÍM PRO LÉKÁRNÍKA. sublingvální tableta. 67, 133, 267, 400, 533, 800 mikrogramů.
 Edukační materiály sublingvální tableta 67, 133, 267, 400, 533, 800 mikrogramů fentanyli citras PRŮVODCE VYDÁVÁNÍM PRO LÉKÁRNÍKA Informace pro lékárníka. Před výdejem přípravku Vellofent si, prosím, přečtěte
Edukační materiály sublingvální tableta 67, 133, 267, 400, 533, 800 mikrogramů fentanyli citras PRŮVODCE VYDÁVÁNÍM PRO LÉKÁRNÍKA Informace pro lékárníka. Před výdejem přípravku Vellofent si, prosím, přečtěte
Příručka pro předepisující lékaře
 Edukační materiály Příručka pro předepisující lékaře LIXIANA (edoxabanum) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické
Edukační materiály Příručka pro předepisující lékaře LIXIANA (edoxabanum) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické
CAVE! Informační dopis pro zdravotnické pracovníky
 CAVE! Informační dopis pro zdravotnické pracovníky říjen 2017 Výpadek léčivého přípravku Trisenox (oxid arzenitý, koncentrát pro infuzní roztok 1 mg/ml): nahrazení léčivým přípravkem Phenasen (injekční
CAVE! Informační dopis pro zdravotnické pracovníky říjen 2017 Výpadek léčivého přípravku Trisenox (oxid arzenitý, koncentrát pro infuzní roztok 1 mg/ml): nahrazení léčivým přípravkem Phenasen (injekční
Celkové shrnutí vědeckého hodnocení přípravku Lipitor a související názvy (viz Příloha I)
 Příloha II Vědecké závěry a zdůvodnění potřebných úprav souhrnu údajů o přípravku, označení na obalu a příbalových informací předkládané Evropskou agenturou pro léčivé přípravky 23 Vědecké závěry Celkové
Příloha II Vědecké závěry a zdůvodnění potřebných úprav souhrnu údajů o přípravku, označení na obalu a příbalových informací předkládané Evropskou agenturou pro léčivé přípravky 23 Vědecké závěry Celkové
Důležité informace k užívání přípravku Tasigna
 Důležité informace k užívání přípravku Tasigna Co je důležité vědět o přípravku Tasigna... Přípravek Tasigna je lék vydávaný pouze na lékařský předpis. Tasigna se používá k léčbě leukemie nazývané chronická
Důležité informace k užívání přípravku Tasigna Co je důležité vědět o přípravku Tasigna... Přípravek Tasigna je lék vydávaný pouze na lékařský předpis. Tasigna se používá k léčbě leukemie nazývané chronická
Deprese u seniorů. Pohled geriatra na depresi u seniorů. Léčba deprese ve stáří zdroj uspokojení i frustrace lékaře
 Deprese u seniorů Pohled geriatra na depresi u seniorů Doc. MUDr. Iva Holmerová, Ph.D. Praha Léčba deprese ve stáří zdroj uspokojení i frustrace lékaře Prim. MUDr. Richard Krombholz Praha Sborník přednášek
Deprese u seniorů Pohled geriatra na depresi u seniorů Doc. MUDr. Iva Holmerová, Ph.D. Praha Léčba deprese ve stáří zdroj uspokojení i frustrace lékaře Prim. MUDr. Richard Krombholz Praha Sborník přednášek
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Návod pro pacienta / pečovatele
 Návod pro pacienta / pečovatele Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že
Návod pro pacienta / pečovatele Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že
Rozměr zavřeného průkazu mm
 Přední strana Str. 1 PRŮKAZ PACIENTA užívajícího přípravek Humira (určeno dospělým i dětským pacientům) Rozměr zavřeného průkazu 105 73 mm Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi
Přední strana Str. 1 PRŮKAZ PACIENTA užívajícího přípravek Humira (určeno dospělým i dětským pacientům) Rozměr zavřeného průkazu 105 73 mm Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi
Ibandronic Acid Accord 2 mg koncentrát pro infuzní roztok Ibandronic Acid Accord 6 mg koncentrát pro infuzní roztok acidum ibandronicum
 Ibandronic Acid Accord 2 mg koncentrát pro infuzní roztok acidum ibandronicum Máte- Pokud se kterýkoli z než V 1. Ibandronic Acid Accord a k 2. Ibandronic Acid Accord používat 3. Ibandronic Acid Accord
Ibandronic Acid Accord 2 mg koncentrát pro infuzní roztok acidum ibandronicum Máte- Pokud se kterýkoli z než V 1. Ibandronic Acid Accord a k 2. Ibandronic Acid Accord používat 3. Ibandronic Acid Accord
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
P. S t u d e n í P. S t u d e n í k
 P. S t u d e n í k Incidence chronické hepatitidy C u dialyzovaných pacientů Evropa, Austrálie:... 3-22% 3 (10x vyšší výskyt než v normální populaci) Japonsko, Egypt, JV Asie:... 50% Kellerman S., Hepatology,,
P. S t u d e n í k Incidence chronické hepatitidy C u dialyzovaných pacientů Evropa, Austrálie:... 3-22% 3 (10x vyšší výskyt než v normální populaci) Japonsko, Egypt, JV Asie:... 50% Kellerman S., Hepatology,,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum
 Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Glucosum monohydricum
 sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
PIRABENE 800 mg PIRABENE 1200 mg potahované tablety (Piracetamum)
 sp.zn. sukls152252/2014, sukls152875/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PIRABENE 800 mg PIRABENE 1200 mg potahované tablety (Piracetamum) Přečtěte si pozorně tuto příbalovou informaci, protože
sp.zn. sukls152252/2014, sukls152875/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PIRABENE 800 mg PIRABENE 1200 mg potahované tablety (Piracetamum) Přečtěte si pozorně tuto příbalovou informaci, protože
