INFORMACE PRO LÉKAŘE * A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI
|
|
|
- Petra Beránková
- před 5 lety
- Počet zobrazení:
Transkript
1 INFORMACE PRO LÉKAŘE * A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI Verze 6: 9. července 2010 * Léčbu přípravkem TYSABRI by měl zahajovat a sledovat specializovaný lékař se zkušenostmi v diagnostice a léčbě neurologických onemocnění ve střediscích s rychlým přístupem k MRI. Tysabri_EMEA_v9.indd 1 2/2/2011 8:47:41 AM
2 Tysabri_EMEA_v9.indd 2 2/2/2011 8:47:41 AM
3 OBSAH 1 ÚVOD PŘEHLED O TYSABRI Farmakoterapeutická skupina 2.2 Mechanismus účinku 3 TYSABRI : TERAPEUTICKÉ INDIKACE Terapeutické indikace 3.2 Léčba populací: Výběr pacienta 3.3 Kontraindikace 4 OPORTUNNÍ INFEKCE VČETNĚ PROGRESIVNÍ MULTIFOKÁLNÍ LEUKOENCEFALOPATIE (PML) Definice 4.2 Infekce včetně oportunních spojené s TYSABRI 4.3 Léčba potenciálních oportunních infekcí 4.4 Progresivní multifokální leukoencefalopatie (PML) 4.5 PML v klinických studiích s TYSABRI a po jeho uvedení na trh 4.6 Léčba populací: Souběžné terapie 5 DIAGNÓZA PML Všeobecné zásady 5.2 Klinické rozlišení mezi PML a relapsem RS 5.3 Diferenciace mezi PML a relapsem RS pomocí MRI 5.4 Laboratorní diferenciace mezi PML a relapsem RS 6 LÉČBA PML NEŽÁDOUCÍ REAKCE SPOJENÉ S INFUZEMI Přecitlivělost 7.2 Léčba hypersenzitivních reakcí spojených s infuzí v klinické praxi 7.3 Jiné nežádoucí reakce spojené s infuzemi 8 IMUNOGENICITA TYSABRI V KLINICKÝCH STUDIÍCH Protilátky proti natalizumabu v klinické praxi 9 JATERNÍ PŘÍHODY TYSABRI a jaterní příhody: pokyny k péči o pacienty 10 VZDĚLÁVACÍ PRŮVODCE Informování pacientů o přínosech a rizicích 10.2 Karta pacienta 11 LITERATURA PŘÍLOHY Příloha 1. Souhrn údajů o přípravku (SPC) Příloha 2. Příbalová informace (PIL) Příloha 3. Karta pacienta Příloha 4. Formuláře pro zahájení a pokračování léčby 3 Tysabri_EMEA_v9.indd 3 2/2/2011 8:47:41 AM
4 1 ÚVOD Tento návod k postupu byl vypracován pro lékaře, kteří používají přípravek TYSABRI a kontrolují léčbu v souladu s podmínkami registračního rozhodnutí léčiva, s cílem zajistit jeho bezpečné a efektivní používání. Obsahuje informace, které se mají používat společně se Souhrnem údajů o přípravku TYSABRI (SPC), Příbalovou informací (PIL), Kartou pacienta a Formuláři pro zahájení a pokračování léčby (viz přílohy 1 4). Je třeba, aby se lékaři, kteří přípravek TYSABRI používají a kontrolují léčbu, podělili o příslušné části tohoto dokumentu s radiology zabývajícími se diferenciální diagnostikou PML. Následující stránky obsahují tyto klíčové informace Přehled o přípravku TYSABRI Populace spadající do omezených indikací Informace o atypických a oportunních infekcích Oportunní infekce (včetně reaktivace tuberkulózy) Progresivní multifokální leukoencefalopatie (PML) Diagnóza PML; rozlišení mezi PML a relapsem roztroušené sklerózy (RS) Algoritmus léčby PML Hypersenzitivní reakce Infúzní reakce Tvorba protilátek Jaterní příhody Potřeba informovat pacienty o přínosech a rizicích TYSABRI a poskytnout jim na počátku léčby Kartu pacienta a Formulář pro zahájení léčby a poté po dvou letech terapie pomocí TYSABRI Formulář pro pokračování léčby. 4 Tysabri_EMEA_v9.indd 4 2/2/2011 8:47:42 AM
5 2 PŘEHLED O TYSABRI 2.1 Farmakoterapeutická skupina Selektivní imunosupresivní léčivo, ATC kód: L04AA Mechanismus účinku Natalizumab (TYSABRI ) je humanizovaná monoklonální protilátka, která se váže na adhezní molekulu, α4-integrin, na povrchu aktivovaných T buněk a dalších mononukleárních leukocytů. Tyto buňky hrají stěžejní úlohu v zánětlivé patogenezi roztroušené sklerózy (RS). Tím, že natalizumab blokuje interakci adhezní molekuly buněk, brání jejich migraci hematoencefalickou bariérou do míst zánětu. Navíc natalizumab může i potlačovat zánětlivou kaskádu narušováním interakce buněk v tkáni CNS. (Rudick & Sandrock, 2004; von Andrian & Englehardt, 2003). 3 TYSABRI : TERAPEUTICKÉ INDIKACE 3.1 Terapeutické indikace TYSABRI je indikován v monoterapii jako léčba modifikující onemocnění u vysoce aktivní relabující-remitující roztroušené sklerózy pro následující skupiny pacientů: Pacienti s vysokou aktivitou onemocnění navzdory léčbě interferonem beta Pacienti s rychle progredující, těžkou formou relabující-remitující roztroušené sklerózy 3.2 Léčba populací: Výběr pacienta TYSABRI je indikován v monoterapii jako léčba modifikující onemocnění u vysoce aktivní relabující-remitující roztroušené sklerózy, jež má zabránit relapsům a zpomalit progresi postižení. S ohledem na bezpečnost (viz 4.4 a 4.8 SPC) je léčba omezena na následující skupiny pacientů: Pacienti, kteří neodpověděli na plnou léčebnou kúru (trvající obvykle nejméně jeden rok) interferonem beta. Pacienti museli mít nejméně 1 relaps během léčby v předchozím roce a musí mít nejméně 9 T2-hyperintenzních lézí na MRI vyšetření mozku (nebo nejméně 1 gadolinium enhancující lézi). Nereagujícího pacienta je možno rovněž definovat jako pacienta s nezměněnou nebo zvýšenou četností relapsů nebo stále pokračujícími těžkými relapsy v porovnání s předchozím rokem. Tato skupina může zahrnovat jak pacienty, u nichž léčba interferonem vedla k neadekvátní terapeutické odezvě, tak pacienty, kteří ukončili léčbu interferonem beta kvůli nesnášenlivosti. Nepožaduje se, aby se před zahájením terapie TYSABRI použily všechny ostatní schválené typy léčby. Pacienti s rychle se vyvíjející těžkou relabující-remitující roztroušenou sklerózou, definovanou 2 či více relapsy v jednom roce a s 1 či více gadolinium enhancujícími lézemi na MRI mozku nebo významným zvýšením objemu T2 hyperintenzních lézí ve srovnání s předchozí nedávnou MRI. Tato skupina může zahrnovat pacienty dosud neléčené nebo pacienty v současnosti podstupující jakoukoliv jinou schválenou léčbu nebo ty, kteří takovou léčbu podstoupili nedávno. 5 Tysabri_EMEA_v9.indd 5 2/2/2011 8:47:42 AM
6 3.3 Kontraindikace Použití TYSABRI je u pacientů kontraindikováno v případě: přecitlivělosti na TYSABRI nebo na kteroukoliv pomocnou látku; progresivní multifokální leukoencefalopatie (PML); zvýšeného rizika oportunních infekcí včetně pacientů s narušenou imunitou (včetně pacientů podstupujících imunosupresivní terapii nebo těch, u nichž došlo k narušení imunity předchozími terapiemi, např. mitoxantronem nebo cyklofosfamidem); kombinace s intereferony beta nebo glatiramer acetátem; známého aktivního maligního onemocnění s výjimkou pacientů s bazocelulárním karcinomem kůže; dětí a mladistvých. 4 OPORTUNNÍ INFEKCE VČETNĚ PROGRESIVNÍ MULTIFOKÁLNÍ LEUKOENCEFALOPATIE (PML) Lékaři předepisující toto léčivo by měli vzít na vědomí možnost, že se během léčby TYSABRI může objevit PML a jiné oportunní infekce (včetně reaktivace tuberkulózy) a měli by je zahrnout do diferenciální diagnózy infekcí, k nimž dochází u pacientů léčených TYSABRI. Pacienti, jejich partneři a ošetřovatelé musí být informováni o příznacích, které mohou upozorňovat na počínající PML (viz kapitola 10.2, příloha 3: Karta pacienta a příloha 4: Formuláře pro zahájení a pokračování léčby). Jestliže je podezření na oportunní infekci, dávkování TYSABRI se musí pozastavit, dokud nebude možné díky dalším vyšetřením takové infekce vyloučit. 4.1 Definice Oportunní infekce je definována jako infekce způsobená organismem, který obvykle nezpůsobuje onemocnění nebo vyvolává pouze mírné či spontánně mizející onemocnění u lidí s normálně fungujícím imunitním systémem, ale způsobuje významnější onemocnění u lidí s narušenou imunitou. Jako příklad uvádíme PML, ezofageální kandidózu, systémové plísňové infekce, pneumonii vyvolanou Pneumocystis jirovecii, mykobakteriální infekce (včetně atypických mykobakterií, pulmonální a extrapulmonální tuberkulózy a reaktivace tuberkulózy), chronickou intestinální kryptosporidiózu, diseminované virové infekce (například diseminované herpetické nebo cytomegalovirové infekce), toxoplasmózu, kryptosporidiové infekce a Kaposiho sarkom. 4.2 Infekce včetně oportunních spojené s TYSABRI V klinických studiích RS byl hlášen případ průjmu vyvolaného prvoky rodu Cryptosporidium. V klinických studiích u pacientů s Crohnovou nemocí byly hlášeny další oportunní infekce, přičemž některé z nich byly smrtelné. V těchto studiích bylo běžné konkomitantní používání dalších přípravků včetně imunosupresiv. Od uvedení TYSABRI na trh jsou sporadicky hlášeny i jiné oportunní infekce Herpetické infekce Při klinických studiích se herpetické infekce (virus Varicella-Zoster, virus Herpes simplex) vyskytly o něco častěji u pacientů léčených natalizumabem než u pacientů léčených placebem. Po uvedení přípravku na trh byly hlášeny závažné případy včetně jednoho případu fatální herpetické encefalitidy u pacienta dříve léčeného přípravkem TYSABRI. 6 Tysabri_EMEA_v9.indd 6 2/2/2011 8:47:42 AM
7 4.3 Léčba potenciálních oportunních infekcí Všichni pacienti, kteří jsou léčeni TYSABRI a u nichž se projevují příznaky infekcí, by měli být kompletně vyšetřeni. Je třeba zvážit časné vyšetření u specializovaného lékaře se zkušenostmi s diagnostikou a léčbou oportunních infekcí. V případě závažných infekcí se musí vynaložit veškeré úsilí na určení původce. Jestliže je diagnostikována závažná oportunní infekce, léčba TYSABRI musí být ukončena. 4.4 Progresivní multifokální leukoencefalopatie (PML) Epidemiologie Progresivní multifokální leukoencefalopatie (PML) je subakutní, rozvíjející se neurodegenerativní onemocnění centrálního nervového systému (CNS). Byla popsána v třicátých letech a název byl poprvé použit v roce Poprvé byla popsána jako vzácná komplikace lymfoproliferativních onemocnění u pacientů ve středním věku a starších pacientů (Astrom, 1958). Byly rovněž hlášeny případy vyvolané imunosupresivní léčbou pacientů s autoimunitními poruchami a příjemců parenchymových orgánových transplantátů. Výskyt PML vzrostl v důsledku pandemie HIV. U pacientů s HIV byla udávána 5 % prevalence. Snížení mortality je spojováno se zavedením vysoce aktivní antiretrovirální terapie (HAART), která však nevede ke snížení výskytu PML u HIV pacientů (Koralnik, 2004) Etiologie Onemocnění zasahuje subkortikální bílou hmotu (Safak a Khalili, 2003) a je způsobeno reaktivací JC viru, humánního polyomaviru (Berger a další, 1998). Spouštěče replikace JCV nejsou známy, ale mohou být následkem souběhu rizikových faktorů, kdy jedním z nich je narušený buněčný imunitní systém. Může to být následkem infekce HIV, systémové imunosuprese nebo používáním antineoplastických léčiv a dále vlivem některých zhoubných nádorů Patologie Replikace JCV v mozku způsobuje lytickou infekci oligodendrocytů, což má za následek rozsáhlou destrukci myelinu. V subkortikální bílé hmotě vznikají mikroskopické léze, které se zvětšují a mohou splývat s charakteristickým obrazem při vyšetření MRI. Příznaky odráží multifokální obraz demyelinizace. Vizuální, motorické a kognitivní zhoršení je přítomno téměř vždy s kortikální slepotou, výraznou slabostí (například hemiparéza) a behaviorálními poruchami. Další příznaky zahrnují senzorické defekty a křeče (Berger, 1998). Tyto příznaky stejně jako jejich průběh mohou pomoci odlišit nástup PML od typických příznaků relapsu RS, ale může docházet k určitému překrytí Diagnóza EFNS vydala směrnice pro diagnózu a léčbu neurologických komplikací infekce HIV včetně PML (Portegies, 2004). Diagnostická kritéria uvádíme dále. Pomalu progredující fokální neurologické deficity s asymetrickými abnormalitami bílé hmoty na MRI naznačují přítomnost PML. Tyto, na T2 vážených obrazech hyperintenzní, léze jsou bez vychytávání Gd, není přítomen mass efekt. Subkortikální U vlákna jsou postižena charakteristickým způsobem. Detekce JCV DNA pomocí PCR silně podporuje diagnózu, protože má senzitivitu 72 až 100 % a specificitu 92 až 100 % (Cinque a další, 1997). Pokud je CSF-PCR negativní, doporučuje se opakovat CSF-PCR jednou nebo dvakrát. Mozková biopsie zůstává konečným potvrzujícím testem, ale pozitivní CSF-PCR nabízí přijatelný důkaz. MRI prokázala, že je užitečným nástrojem zjišťování možné PML (Whiteman, 1993) na podporu klinické diagnózy. Je-li k dispozici předchozí sken MRI jako reference, může pomoci při diferenciaci mezi PML a jinými neurologickými stavy, např. RS. Byl vypracován podrobný diagnostický algoritmus, který pomáhá lékařům vyhodnotit nové nebo zhoršující se neurologické příznaky u pacientů s RS léčených TYSABRI. Podrobně je popsán v bodě 5 tohoto Informačního balíčku. 7 Tysabri_EMEA_v9.indd 7 2/2/2011 8:47:42 AM
8 4.4.5 Prognóza Bylo prokázáno, že následky PML u pacientů s AIDS závisí na časné diagnóze a příslušné terapii, avšak onemocnění může být v mnoha případech fatální nebo mít za následek těžkou invaliditu (Koralnik 2004). Existuje důkaz, že vysazení imunosupresivní terapie a obnova imunity může být účinná pro zlepšení výsledku PML (Albrecht, 1998; Koralnik 2004; Crowder, 2005). Další informace naleznete v kapitole 6. Dostupnost vysoce aktivní antiretrovirální terapie (HAART) změnila klinické spektrum PML u osob infikovaných HIV. Ačkoliv výskyt nepoklesl, mortalita se snížila z 90 % na přibližně 50 % během prvních 3 měsíců v důsledku obnovy imunitního systému. 4.5 PML v klinických studiích s TYSABRI a po jeho uvedení na trh Hlášené případy Klinické studie před uvedením na trh V premarketingových klinických studiích byly zjištěny tři potvrzené případy PML související s TYSABRI : dva pacienti s RS a jeden pacient s Crohnovou chorobou (CD). Oba pacienti s RS dostávali natalizumab po více než 2 roky v kombinaci s IFNβ-1a (Langer-Gould a další, 2005; Kleinschmidt-DeMaster & Tyler 2005). CD pacient dostal osm dávek natalizumabu během 18 měsíčního období, narušení jeho imunity chronickým užíváním azathioprinu se projevilo perzistentní lymfopenií (van Assche a další, 2005). Dva z případů byly smrtelné, jeden pacient s RS a jeden s CD. U všech třech pacientů se jemné klinické změny projevily v časném stádiu průběhu jejich nemoci a pacienti, jejich rodiny nebo poskytovatelé zdravotní péče si jich povšimli. Po ohlášení případů z klinických studií bylo provedeno důkladné zhodnocení bezpečnosti, aby se stanovilo, zda-li se PML vyskytla u dalších pacientů léčených TYSABRI (Yousry a další, 2006). Toto komplexní hodnocení neodhalilo žádné další případy PML u více než 3000 vyšetřovaných pacientů. Téměř všichni pacienti, kteří dostávali natalizumab v posledních studiích, byli během hodnocení posuzováni, přičemž je nepravděpodobné, že by jakékoliv případy PML byly opomenuty. Výskyt PML se omezil na dva případy RS a jeden případ CD, jak bylo původně uvedeno. Výskyt PML mezi subjekty léčenými natalizumabem v klinických studiích s RS a CD se proto odhaduje na 1/1000 s intervalem spolehlivosti 95 % v rozmezí od 0,2 do 2,8/1000. Hodnocení rovněž prokázala, že neexistuje laboratorní test, který by umožnil předvídat nástup PML, což naznačuje, že klinický dohled a dozor je v tomto případě nejvhodnějším prostředkem sledování. Kraniální snímky MRI před léčbou byly užitečné pro odlišení RS od PML při nástupu neurologického zhoršení. Lékaři a pacienti by měli sledovat známky a příznaky PML a neodkládat přerušení léčby a zahájení vhodného diagnostického sledování (MRI, analýza mozkomíšního moku) u pacientů léčených natalizumabem, u nichž došlo k neurologickému zhoršení. Klinické studie po uvedení na trh a spontánní hlášení Po uvedení přípravku na trh byly hlášeny případy PML u pacientů s RS dostávajících TYSABRI v monoterapii. Klinické příznaky v těchto případech zahrnovaly epileptické záchvaty, ložiskové kortikální příznaky a takové symptomy, jako například hemiparéza, afázie a retrochiasmatické poruchy zraku, s doprovodnými změnami vědomí, chování a osobnosti. Symptomy přetrvávaly po dobu několika týdnů, někdy však i déle, zejména u kognitivních změn. Při hodnocení změn se na MRI ukázaly typické T2 hyperintenzní subkortikální léze s nejasnými hranicemi ve frontální, temporální, parietální nebo okcipitální oblasti mozku. Léze byly někdy unifokální, ale často multifokální nebo difuzně rozšířené. Asi v polovině případů objevivších se do dnešní doby se prokázalo určité vychytávání Gd, často ostrůvkovitého tvaru. Vyšetření JCV DNA pomocí CSF-PCR bylo v těchto případech pozitivní, s hodnotami mezi 11 a > kopiemi/ml. Asi polovina případů měla nízké hladiny JCV DNA v CSF (<500 kopií/ml). Nástrojem pro časnou diagnózu PML u těchto pacientů bylo provádění klinického dohledu (vigilance). Hodnocení rizikových faktorů spojených s rozvojem PML během terapie přípravkem TYSABRI ukázalo, že u pacientů léčených až po dobu 3 let se riziko s rostoucí délkou terapie zvyšuje. Počet pacientů léčených déle než 3 roky je příliš nízký na to, aby poskytl nějaký rozumný odhad četnosti nahlášených případů PML. Zvýšené riziko rozvoje PML se vyskytuje i u pacientů, kteří mají v anamnéze léčbu imunosupresivy před zahájením terapie přípravkem TYSABRI. Zdá se, že zvýšené riziko PML související s předchozím používáním imunosupresiv nesouvisí s délkou terapie přípravkem TYSABRI. Kromě výše popsaných nebyly zjištěny žádné jiné zřejmé rizikové faktory rozvoje PML. 8 Tysabri_EMEA_v9.indd 8 2/2/2011 8:47:42 AM
9 4.6 Léčba populací: Souběžné terapie Bezpečnost a účinnost TYSABRI v kombinaci s jinými imunosupresivními a antineoplastickými terapiemi nebyla plně stanovena. Souběžné používání těchto léčiv s TYSABRI může zvýšit riziko infekce včetně infekcí oportunních a je kontraindikováno v SPC (viz Příloha 1: SPC). V praxi po uvedení přípravku na trh se objevily případy PML u pacientů, kteří dříve užívali imunosupresiva, i u těch, kteří je neužívali. Pacienti s léčbou imunosupresivy v anamnéze však mohou trpět prodlouženou imunosupresí, a proto mají zvýšené riziko PML. Je třeba sledovat pacienty, kteří dříve užívali imunosupresiva, a ponechat dostatek času na obnovení imunitních funkcí. Lékaři musí vyhodnotit každý jednotlivý případ, aby rozhodli, zda-li je tu důkaz o narušení imunity před zahájením léčby TYSABRI (viz bod 5.3 SPC). V klinických studiích RS fáze III nebyla souběžná léčba relapsů krátkodobým podáváním kortikosteroidů spojena se zvýšeným výskytem infekce. V kombinaci s TYSABRI by se měly používat jen krátkodobé kůry kortikosteroidy. U všech pacientů, u nichž byla diagnostikována oportunní infekce, se musí TYSABRI trvale vysadit. 5 DIAGNÓZA PML Včetně diferenciace mezi PML a relapsem RS 5.1 Všeobecné zásady Při poskytování péče pacientům s RS, léčených TYSABRI, by se měly zvážit následující body: Všichni pacienti léčení přípravkem TYSABRI by měli být pravidelně klinicky sledováni, aby byla možná časná detekce změn neurologického stavu. Pokud se u pacientů léčených přípravkem TYSABRI objeví nějaké nové neurologické příznaky, vždy je třeba jako diagnózu zvážit PML. Doporučuje se provádění referenčního kraniálního snímkování MRI před léčbou, obvykle během 3 měsíců před zahájením podávání TYSABRI, s opakováním, které by se mělo provádět rutinně jednou za rok k aktualizaci referenčního stavu. Může to pomoci při diferenciaci PML od RS u pacientů, u nichž se objeví nové neurologické příznaky během terapie. Také se doporučuje, aby ošetřující lékař při žádosti o kontrolní MRI vyšetření informoval radiologa o tom, že pro potřeby diferenciální diagnózy je třeba vzít v potaz i PML nebo jiné oportunní infekce. Ve všech případech, kde je indikováno další vyšetření změn neurologického stavu, se podávání TYSABRI musí přerušit a nesmí se obnovit, dokud nebude přesvědčivě vyloučena jiná patologie než RS. Při dočasném vysazení terapie TYSABRI, na dobu dnů nebo týdnů, se neočekává, že by byla narušena její účinnost, a to kvůli farmakodynamice léčiva. Rozhodnutí pozastavit TYSABRI v jakémkoliv stádiu může být založeno na výchozím klinickém obrazu, průběhu příznaků nebo známek a/nebo odezvě na léčbu kortikosteroidy. Klíčovým zásahem je vysazení TYSABRI, pokud byla potvrzena PML. Podávání TYSABRI by se mělo znovu zahájit pouze tehdy, když bude vyloučena diagnóza PML (v případě potřeby opakováním klinických, MRI a laboratorních vyšetření, pokud přetrvává klinické podezření na PML) a bude-li to považováno za vhodné pokračování léčby RS. 5.2 Klinické rozlišení mezi PML a relapsem RS Následující návod a algoritmus (Obrázek 1) popisuje navrhovaný přístup ke klinickému hodnocení nových nebo zhoršujících se neurologických příznaků u pacientů s RS léčených TYSABRI. Nové nebo znova se vyskytnuvší příznaky by měly vyvolat pečlivé hodnocení s cílem posoudit základní patologii, např. RS nebo PML. Tabulka 1 zdůrazňuje klinické nálezy, které pomáhají odlišit RS od PML. Je třeba poznamenat, že tabulka nezahrnuje vše a mezi příznaky těchto dvou onemocnění může docházet ve velké míře 9 Tysabri_EMEA_v9.indd 9 2/2/2011 8:47:42 AM
10 k překrytí. Lékaři by měli vzít v úvahu, že klinický obraz PML nebo jiných oportunních infekcí lze obtížně odlišit od RS, zejména na počátku jeho rozvoje. Je důležité zaznamenat průběh a charakter dřívějších a současných příznaků, což usnadní péči o pacienty léčené TYSABRI. Tabulka 1. Klinický obraz RS a PML NÁLEZY UKAZUJÍCÍ NA: RS 1 PML 2 Nástup Akutní Subakutní Rozvoj Klinické nálezy Během hodin až dnů Normálně se stabilizuje Vyřeší se spontánně i bez terapie Diplopie Parestézie Paraparéza Optická neuritida Myelopatie Během týdnů Progresivní Afázie Behaviorální a neuropsychologická alterace Retrochiazmatické výpadky vizu Hemiparéza Epileptické záchvaty Je důležité zaznamenat průběh a charakter dřívějších a současných příznaků, což usnadní péči o pacienty léčené TYSABRI. Jestliže klinický obraz naznačuje přítomnost PML, měla by se co nejdříve provést další vyšetření zahrnující zobrazení MRI (Obrázek 2) a/nebo lumbální punkci a vyšetření mozkomíšního moku (CSF) (Obrázek 3). Konečná diagnóza PML by se měla provádět pouze na základě klinického obrazu, nálezu na MRI a přítomnosti JC viru v centrálním nervovém systému (CNS). Obrázek 1. Klinické hodnocení KLINICKÉ HODNOCENÍ NOVÝCH NEBO ZHORŠUJÍCÍCH SE NEUROLOGICKÝCH PŘÍZNAKŮ U RS PACIENTŮ LÉČENÝCH NATALIZUMABEM Příznaky zjištěné během sledování Anamnéza a vyšetření Pacient má nové neurologické příznaky Známky ukazující na RS 1 Klinický obraz? * Pokračovat v podávání TYSABRI Léčit jako relaps (steroidy?) 4 Známky ukazující na jinou patologii než RS 2,3 Klinický stav stabilizován nebo zlepšen? 5 NE Přerušit TYSABRI 6 Léčit jako relaps (steroidy?) 4 MRI / Lumbální punkce 10 1,2 Viz tabulka 1; 3 Kliničtí lékaři by měli brát v úvahu kromě PML i jinou non-rs patologii, zejména oportunní infekce.; 4 Relapsy by se měly léčit podle obvyklé klinické praxe. O krátkodobé léčbě steroidy lze uvažovat v případech, kdy je z klinických důvodů PML nepravděpodobná. Nedostatečná odezva na steroidy by měla být důvodem k dalšímu vyšetření.; 5 Klinické nálezy by se měly porovnat s těmi, které byly zaznamenány v klinickém obrazu této epizody.; 6 Jestliže je v klinickém obrazu nebo během dalšího sledování klinického stavu podezření na jinou patologii než RS, měly by se VŠECHNY další infuze odložit, dokud nebude definitivně vyloučena PML nebo jiné oportunní infekce. Tysabri_EMEA_v9.indd 10 2/2/2011 8:47:42 AM
11 5.3 Diferenciace mezi PML a relapsem RS pomocí MRI Standardní protokol MRI - bez kontrastní látky a s kontrastní látkou - pro sledování pacientů léčených TYSABRI je navržen tak, aby poskytoval nejlepší možné snímky jako pomůcku pro klinické rozhodování (Radue a další, 2005). Pro každý skener je třeba zvolit parametry sekvence MRI s ohledem na dobré zobrazení anatomie CNS a vizualizaci lézí RS. Konzistentní používání standardního protokolu MRI pomůže rozpoznat časné změny na MRI, zejména při podezření na PML kvůli klinickému obrazu. Navrhované indikace k MRI mozku: a) Před zahájením podávání TYSABRI se doporučuje pořídit současné referenční MRI (obvykle max. 3 měsíce staré) a MRI vyšetření rutinně jednou ročně opakovat k aktualizaci referenčního stavu. Může to pomoci při diferenciaci PML od RS u pacientů, u nichž se objeví nebo zhorší neurologické příznaky během terapie. b) Neočekávané klinické zhoršení/podezřelý klinický průběh (Obrázek 1) Protokol MRI pro RS může trvat > 30 minut, proto se doporučuje pohodlná poloha. Pro dobré porovnání snímku s dalšími skeny je zásadně důležité zaujmutí stejné polohy dle stejných anatomických značek. Kopie každého zobrazení by se měla zachovat (elektronicky archivovat) pro následné hodnocení, pokud bude klinicky indikováno. Standardní protokol kraniální MRI pro všechny snímky: Síla pole skeneru 1,0 T Tloušťka řezu 5 mm a žádná mezera Pokrýt celý mozek Orientace skenu na linii velkého švu (lokalizátor ve třech rovinách) Sagitální Sagitální zvětšený Požadované sekvence Sagitální FLAIR Axiální TSE PD/T2 Axiální FLAIR Axiální SE T1 před kontrastní látkou a po kontrastní látce Axiální SE T1 po kontrastní látce Gd injekce 0,1 mmol/kg během 30 sekund > 5 minutové zpoždění po injekci kontrastní látky Doporučení pro sekvence MRI při RS: T2: TR ms Krátká: TE ms, dlouhá TE ms T1: TR ms TE ms FLAIR: TR ms TE ms, TI ms 11 Tysabri_EMEA_v9.indd 11 2/2/2011 8:47:43 AM
12 Obrázek 2. Hodnocení MRI (více viz kapitola 5.1) Upozornění: podávání TYSABRI se musí přerušit a nesmí se obnovit, dokud nebude přesvědčivě vyloučena jiná patologie než RS. Při podezření na PML na základě klinického obrazu, není-li MRI rychle dostupná, je třeba co nejdříve provést laboratorní vyšetření, např. lumbální punkci, pro vyloučení PML. HODNOCENÍ NOVÝCH NEBO ZHORŠUJÍCÍCH SE NEUROLOGICKÝCH PŘÍZNAKŮ POMOCÍ MRI u RS PACIENTŮ LÉČENÝCH NATALIZUMABEM Standardní protokol MRI s Gd Léze typické pro RS 1 Povaha lézí? Netypické pro RS, možná PML 1 nebo oportunní infekce 2 Klinické sledování (steroidy) 3 Klinický stav stabilizován nebo zlepšen? 4 NE Lumbální punkce ANO Znovu začít podávat TYSABRI 5 Pravidelné sledování 1 Viz tabulka 2. Porovnání s prvotním snímkem může napomoci při interpretaci MRI nálezu.; 2 Kliničtí lékaři by měli brát v úvahu kromě PML i jinou non-rs patologii, zejména oportunní infekce.; 3 Relapsy by se měly léčit podle obvyklé klinické praxe. O krátkodobé léčbě steroidy lze uvažovat v případech, kdy je z klinických důvodů PML nepravděpodobná. Nedostatečná odezva na steroidy by měla být důvodem k dalšímu vyšetření.; 4 Klinické nálezy by se měly porovnat s těmi, které byly zaznamenány v klinickém obrazu této epizody.; 5 Podávání TYSABRI by se mělo obnovit pouze tehdy, až bude definitivně vyloučena PML nebo jiné oportunní infekce na základě klinických nálezů a/nebo dalších vyšetření. 12 Tysabri_EMEA_v9.indd 12 2/2/2011 8:47:43 AM
13 Tabulka 2. Parametry vizualizované na MRI Tyto parametry je nutné zvážit při diferenciální diagnóze RS a PML. (Nezapomeňte, že žádný z parametrů MRI není charakteristický pro onemocnění RS nebo PML) PARAMETR ROZTROUŠENÁ SKLERÓZA PROGRESIVNÍ MULTIFOKÁLNÍ LEUKOENCEFALOPATIE Orientace a lokalizace nových lézí Ohraničení Způsob rozšíření Mass efekt T2-vážené obrazy T1-vážené obrazy Sekvence FLAIR Vychytávání Atrofie Většinou fokální; může postihovat celý mozek a míchu, v bílé a případně i šedé hmotě Ostré okraje, většinou kruhové nebo ve tvaru prstu (zvláště periventrikulární léze), splývání s dalšími lézemi, mohou být postižena i U vlákna Zpočátku fokální léze se zvětšují v průběhu dnů nebo týdnů a později se velikost zmenšuje v průběhu měsíců Akutní léze vykazují určitý mass efekt Akutní léze: hyperintenzní centrum, izointenzní prstenec, diskrétní hyperintenzita mimo prstencovou strukturu Subakutní a chronické léze: hyperintenzní bez prstencové struktury Akutní léze: hustě hypointenzní (velké léze) nebo izointenzní (malé léze), zvyšující se intenzita signálu v čase u 80 procent, klesající intenzita signálu (axonální ztráta) u přibližně 20 procent Hyperintenzní, ostře ohraničené Akutní léze: husté homogenní vychytávání, ostré okraje a pokrývá celé rozšíření nové léze Subakutní léze: prstencové vychytávání s případným rozlišením během 1-2 měsíců Chronické léze: žádné vychytávání Fokální atrofie je možná kvůli fokální degeneraci bílé hmoty, bez progrese Difúzní a asymetrické léze (zpočátku někdy unifokální, ale často multifokální nebo difuzně rozšířené), hlavně subkortikální a vzácně periventrikulární, umístěné téměř výlučně v bílé hmotě, příležitostné rozšíření do hluboké šedé hmoty. Nález je často lokalizován v zadní jámě (mozeček, thalamus a bazální ganglia), ne v míše Špatně definované okraje, infiltrace, nepravidelného tvaru, omezené na bílou hmotu, nezasahují do šedé hmoty; tlačí proti cerebrálnímu kortexu, U vlákna poškozena vždy Léze se homogenně, stále a často rychle rozšiřují do sousedících (multifokální) a nesousedících (difuzně rozšířené) oblastí, nedochází ke spojování s dalšími lézemi, omezeny na bílou hmotu, nezasahují do kortexu Bez mass efektu i u větších lézí (ale léze mírně přiléhají k cerebrálnímu kortexu) Difúzně hyperintenzní, mírně vyšší intenzita nově poškozených oblastí v porovnání se staršími oblastmi, poněkud nepravidelná intenzita signálu lézí, někdy granulární vzhled Mírně hypointenzní při nástupu, přičemž intenzita signálu klesá v čase a podél zasažené plochy, žádné reverze intenzity signálu Upřednostňovaná sekvence pro diagnózu PML, protože hyperintenzita léze je patrnější, více informací o rozsahu léze než u T2 vážených obrazů, zejména u koronárních řezů Určité vychytávání bylo do dnešní doby pozorováno asi u poloviny případů, často ostrůvkovitého typu. Někdy je možné určité periferní vychytávání Bez fokální atrofie 5.4 Laboratorní diferenciace mezi PML a relapsem RS Tento algoritmus navrhuje, jak integrovat laboratorní vyšetření s klinickým hodnocením a MRI u pacientů léčených TYSABRI (Obrázek 2). Zjištění JCV DNA v mozkomíšním moku u symptomatických pacientů potvrzuje diagnózu PML. Negativní výsledek JCV DNA by však neměl vyloučit možnou diagnózu PML. V závislosti na klinickém obrazu a dostupnosti MRI může být analýza mozkomíšního moku provedena dříve. Pokud je JCV DNA vyšetření negativní a zůstává-li klinické podezření na PML vysoké, měla by se lumbální punkce provést opakovaně. Není-li při opakovaném testování v CSF detekována JCV DNA, zejména při provedení pomocí testu, jehož LOQ má nižší citlivost než doporučených 50 kopií/ml (viz níže), a zůstává-li podezření na základě klinického vyšetření a MRI vysoké, mělo by se zvážit provedení biopsie mozku. 13 Tysabri_EMEA_v9.indd 13 2/2/2011 8:47:43 AM
14 Mozkomíšní mok (CSF) získaný lumbální punkcí (LP): Dodržujte místní standardní postup pro LP. Odeberte požadované množství pro běžnou analýzu CSF (např. glukóza, proteiny a elementy). Předejte vzorek k analýze do místní laboratoře v souladu s místními postupy. Odeberte dalších 5 ml na PCR analýzu viru JC, aby se zajistilo, že pro analýzu budou k dispozici nejméně 2 ml. Navrhovaný postup přípravy mozkomíšního moku na PCR analýzu: Pipetou na jedno použití převeďte nejméně 0,5 ml CSF do 4 kryolahviček (např. nádoby s plastickým šroubovacím uzávěrem Nunc) pro analýzu JCV DNA. Na každou lahvičku zapište identifikaci osoby, typ vzorku (např. CSF) a datum odběru vzorku. Vzorky CSF, odesílané na analýzu DNA by měly být pokud možno zbaveny krve a nejlépe by měly pocházet z poslední odebrané zkumavky. První zkumavka s odběrem by se neměla používat pro DNA analýzu, pokud to nebude jediný dostupný vzorek. Pokud bude vzorek kontaminován krví, uveďte to na lahvičce a na formuláři připojeném ke vzorku odesílaném do laboratoře na analýzu. Zmrazte na 70 C (nebo na 20 C, pokud 70 C není k dispozici). Odešlete dvě zmrazené lahvičky do laboratoře a zbylé lahvičky uchovávejte jako zálohu. Všechny zbylé vzorky by se měly uchovávat ve zmrazeném stavu pro případ, že budou požadovány dodatečné vzorky nebo další testování. Je důležité, aby se vzorky zmrazily co nejdříve po odběru. Pokud okamžité zmrazení není možné, vzorky by se měly uchovávat při teplotě 4 C až do doby zmrazení. Analýza CSF na JCV DNA Vzorky CSF je třeba analyzovat co nejrychleji, aby se usnadnila diagnóza PML. Analýzy musí být založeny na metodologii kvantitativní PCR v reálném čase, maximalizující citlivost a specifičnost detekce. Doporučuje se použít analýzu s limitem kvantifikace (LOQ) 50 kopií/ml. PCR vyšetření CSF na přítomnost JCV DNA je možné realizovat v následujících laboratořích: Department of Virology, Medical University Vienna Kinderspitalgasse 15 A-1095 Vienna Tel Fax E: probenannahme-virologie@meduniwien.ac.at 14 Pokud podezření na PML na základě klinického stavu nebo MRI vyšetření přetrvává i přes negativní výsledek místní nebo referenční laboratoře na JCV pomocí PCR, a zejména pokud je výsledek založen na analýze, jejíž LOQ je méně citlivý než doporučovaných 50 kopií/ml, doporučuje se provést další test na JCV DNA (s týmž nebo čerstvým vzorkem CSF). Doporučuje se vzorky testovat v laboratoři, která je schopna kvantifikovat 50 kopií JCV/ml. Biogen Idec nemůže certifikovat žádnou laboratoř. V současné době, ke dni sestavení těchto materiálů, však Biogen Idec zná centrální laboratoř (Focus Diagnostics, Cypress, Kalifornie), která jako doplněk k provedenému počátečnímu testování může nabídnout referenční testování téhož nezpracovaného nebo čerstvého vzorku CSF od pacienta. Toto centrální zařízení provádí analýzu s limitem kvantifikace 50 kopií/ml, jak bylo stanoveno během validace testu. Limit detekce (LOD) v testu Focus je pod 50 kopiemi/ml, díky čemuž je diagnosticky relevantní, protože bylo pozorováno, že i výskyt nízkého počtu kopií JCV v lidském CSF může vést k rozvoji PML u pacienta. Jsou-li výsledky z Focus Diagnostics negativní a výsledky MRI vyšetření a klinické symptomy stále ukazují na výskyt PML u pacienta, vzorky se zašlou neprodleně pro potvrzení JCV v CSF do laboratoře Dr. Majora v National Institute of Health, protože test pro zkoumání JCV tohoto zařízení je zatím nejcitlivější ze všech dostupných. Eugene O. Major, Ph.D. National Institutes of Health, Laboratory of Molecular Medicine and Neuroscience 10 Center Drive, Building 10, Room 3B14 Bethesda, MD Tysabri_EMEA_v9.indd 14 2/2/2011 8:47:43 AM
15 Informace o způsobu přepravy vzorků do centrálního zařízení vám poskytne medicínské oddělení zastoupení Biogen Idec (Czech Republic) s.r.o., Na Pankráci 1683/127, Praha 4, tel: ,mobil: , iva.fenclova@biogenidec.com Obrázek 3. Laboratorní diferenciace (více viz kapitola 5.1) Upozornění: podávání TYSABRI se musí přerušit a nesmí se obnovit, dokud nebude přesvědčivě vyloučena jiná patologie než RS. LABORATORNÍ HODNOCENÍ NOVÝCH NEBO ZHORŠUJÍCÍCH SE NEUROLOGICKÝCH PŘÍZNAKŮ U RS PACIENTŮ LÉČENÝCH NATALIZUMABEM Lumbální punkce NE JCV DNA PCR pozitivní Klinický stav stabilizován nebo zlepšen? 1 NE Další vyšetření MRI a/nebo CSF ANO (Opakovaný) standardní protokol MRI s GD (po 2 měsících) 6 ANO ANO Podrobné klinické sledování 2 (steroidy?) NE Nové nebo rozvíjející se atypické léze? ANO Klinický stav stabilizován nebo zlepšen? NE (Opakovaná) lumbální punkce (po 2-3 týdnech) 5 ANO JCV DNA PCR pozitivní? ANO Znovu začít podávat TYSABRI 5 NE Pravidelné sledování Vyšetřit na jiné non-rs onemocnění než PML Léčit jako PML 1 Klinické nálezy by se měly porovnat s těmi, které byly zaznamenány v klinickém obrazu této epizody.; 2 Podrobné klinické sledování by se mělo opakovat nejméně po 2 týdnech. Relapsy by se měly léčit podle obvyklé klinické praxe. O krátkodobé léčbě steroidy lze uvažovat v případech, kdy je z klinických důvodů PML nepravděpodobná. Nedostatečná odezva na steroidy by měla být důvodem k dalšímu vyšetření.; 3 Podávání TYSABRI by se mělo obnovit pouze tehdy, až bude definitivně vyloučena PML nebo jiné oportunní infekce na základě klinických nálezů a/nebo dalších vyšetření.; 4 Kliničtí lékaři by měli zvážit i jinou non-rs patologii než PML, zejména oportunní infekce, nebo zvážit provedení biopsie mozku pro potvrzení/vyloučení přítomnosti JCV.; 5 Pokud přetrvávají agresivní klinické příznaky, opakované testování urychlete.; 6 Nebo v případě potřeby dříve. 15 Tysabri_EMEA_v9.indd 15 2/2/2011 8:47:43 AM
16 6 LÉČBA PML Použití antivirových léčiv, jako jsou cidofovir a cytarabin, se ukázalo v léčbě PML neúčinné, pokud jde o zlepšení výsledku u pacientů s PML (Hall, 1998; Aksamit, 2001; Marra, 2002; Gasnault, 2001). Zdá se, že nejefektivnější léčbou je rekonstituce imunity (obnovení normálních imunitních funkcí), a to na základě důkazů z dvou oblastí výzkumu. První je oblast HIV, kde pokud dojde ke vzniku PML u neléčeného pacienta, může zavedení HAART zvrátit průběh nemoci a zlepšit výsledek. Zadruhé u transplantovaných pacientů, kteří trpí PML, lze zlepšit výsledek, jestliže je možné snížit imunosupresi. Dostupné údaje naznačují, že včasné rozpoznání klinického rozvoje a léčba PML může výsledek zlepšit (Antinori a další, 2003; Berenguer a další, 2003; Clifford a další, 1999; Crowder a další, 2005; Geschwind a další, 2001; Shitrit a další, 2005). Je možné, že včasné rozpoznání PML a vysazení TYSABRI vede k obnovení imunity, které přispělo k přežití pacienta s RS, jak uvádí Langer Gould a kolegové (2005). Účinek výměny plasmy na clearance a farmakodynamiku TYSABRI byl proto hodnocen ve studii s 12 pacienty s RS. Odhadované celkové množství odstraněné látky po 3 výměnách plasmy (v rozmezí 5-8 dní) se pohybovalo přibližně kolem % (Khatri et al, 2009). To můžeme porovnat s přibližně 40 % pozorovanými v dřívějších studiích, ve kterých se měření provádělo po podobně dlouhé období po vysazení léku. Tyto údaje rovněž naznačují, že k důslednějšímu snížení koncentrací natalizumabu pod subterapeutické hladiny by bylo zapotřebí provést další výměny plasmy (celkem až 5 během 10 dní). Může to být užitečné pro rychlejší obnovení imunokompetence v mozku, což by mohlo napomoci při stabilizaci PML. Klinický přínos výměny plasmy nebo imunoadsorpce k odstranění TYSABRI a urychlení imunitní obnovy není znám. Než bude možno učinit jakékoli rozhodné závěry o klinickém přínosu tohoto zákroku, je třeba provést analýzu dalších případů společně s hodnocením dlouhodobého klinického stavu pacientů po výměně plasmy nebo imunoadsorpci. Lékaři si kromě toho musí být vědomi jednoho důsledku imunitní obnovy prováděné s cílem vyléčit PML: než se projeví zlepšení, může se objevit tzv. imunorestituční zánětlivý syndrom (IRIS, blíže viz níže) s doprovodným klinickým zhoršením. Tento klinický stav byl pozorován až dosud u většiny případů PML vzniklých po uvedení přípravku na trh. Imunorestituční zánětlivý syndrom (IRIS) Klinické neurologické zhoršení u pacientů s PML může být způsobeno destrukcí tkáně CNS zprostředkovanou JCV nebo při obnově imunitní funkce. Může dojít k intracerebrální imunitní zánětlivé reakci známé jako imunorestituční zánětlivý syndrom (IRIS). Podezření na IRIS vzniká především tehdy, jestliže pacienti s PML vykazují příznaky klinického zhoršení, doprovázené obvykle, avšak ne vždy, vychytáváním gadolinia PML lézemi, což se může a nemusí projevit na výsledku MRI. Klinické zhoršení je důsledkem lokální zánětlivé reakce včetně otoku a projevuje se jako zhoršení neurologických symptomů včetně hemiparézy, ataxie, poruch řeči a zraku, kognitivních změn/změn chování a epileptických záchvatů (v závislosti na lokalizaci IRIS). Tento stav může mít těžké následky včetně komatu a úmrtí. Přestože by se dalo očekávat, že množství viru JC v CSF se při IRIS sníží, je rovněž možné, že se může zvýšit kvůli narušení hematoencefalické bariéry (HEB) a uvolnění JCV z buněk rozložených během IRIS. U pacientů s HIV se IRIS obvykle objevuje do 2 až 3 měsíců od zahájení HAART. U pacientů léčených přípravkem TYSABRI dochází k rozvoji IRIS v rozmezí dní až několika týdnů po odstranění TYSABRI výměnou plasmy (PLEX) nebo imunoabsorpcí (IA). Přestože zánětlivá reakce po imunorestituci může být potřeba k odstranění buněk infikovaných virem JC, léčba aktivní zánětlivé reakce může být nezbytná k zabránění potenciální škody vyvolané IRIS (Talan, 2009; Elston a Thacker, 2009). Stav může ohrožovat život a může proto vyžadovat léčbu na jednotce intenzivní péče. Proto může být po PLEX nebo IA užitečné pravidelné klinické monitorování pacientů včetně monitorování MRI, aby se IRIS detekoval včas. Diagnóza a léčba IRIS je kontroverzní záležitostí a ohledně terapie dosud neexistuje konsensus. Nedávno však bylo navrženo, že k léčbě IRIS by mohly být užitečné kortikosteroidy, zejména u pacientů s těžkým až život ohrožujícím IRIS (Tan et al. 2009). V literatuře se uvádí následující terapeutický režim pro případ IRIS: 1) Perorálně prednison 1,5 mg/kg/den po dobu 2 týdnů s postupným snižováním po dobu 2 měsíců 2) Intravenózně methylprednisolon (1 g/den po 3 dny) s perorálním snižování po dobu 2 měsíců Pokud dojde během snižování dávky steroidů k dalšímu zhoršení a je to považováno za důsledek pokračujících nebo nových zánětlivých reakcí, může být zapotřebí další kúra vyššími dávkami steroidů. 16 Tysabri_EMEA_v9.indd 16 2/2/2011 8:47:43 AM
17 Profylaktická terapie steroidy se v současné době nedoporučuje. Vzhledem k tomu, že vědecké a medicínské poznatky včetně diagnostických kritérií i terapie IRIS se rychle vyvíjejí, kontaktuje prosím příslušné státní orgány své země, kde vám poskytnou nejaktuálnější informace o terapeutických doporučeních. 7 NEŽÁDOUCÍ REAKCE SPOJENÉ S INFUZEMI 7.1 Přecitlivělost Ve dvouletých kontrolovaných klinických studiích s pacienty trpícími RS se hypersenzitivní reakce vyskytovaly až u 4 % pacientů. Anafylaktické/anafylaktoidní reakce se vyskytly u méně než 1 % pacientů užívajících TYSABRI. Všichni pacienti se uzdravili bez následků. K hypersenzitivním reakcím obvykle došlo během infúze nebo do 1 hodiny po dokončení infuze. Riziko hypersenzitivity bylo nejvyšší u počátečních infuzí a u pacientů při opětovné expozici TYSABRI následující po počáteční krátké expozici (jedna nebo dvě infuze) a dlouhodobém období (3 měsíce nebo déle) bez léčby. Riziko hypersenzitivních reakcí by však mělo být zvažováno pro každou podávanou infuzi. 7.2 Léčba hypersensitivních reakcí spojených s infuzí v klinické praxi Je třeba, aby byly k dispozici prostředky pro zvládnutí hypersenzitivních reakcí. Po naředění je infuzi třeba aplikovat po dobu přibližně 1 hodiny a pacienty je třeba během infuze a 1 hodinu po jejím dokončení sledovat, zda nevykazují příznaky hypersenzitivní reakce. Při jakékoliv hypersenzitivní reakci během infuze (např. kopřivka se systémovými příznaky či bez nich, anafylaxe) by mělo být podávání léčiva neprodleně přerušeno a zachován vaskulární přístup pro neodkladnou léčbu a podávání tekutin. U pacientů, u kterých se objevila hypersenzitivní reakce, se terapie přípravkem TYSABRI musí trvale přerušit. Okamžité hypersenzitivní reakce by se měly léčit podle závažnosti reakce a standardního léčebného postupu daného zdravotnického zařízení. 7.3 Jiné nežádoucí reakce spojené s infuzemi Ve dvouletých kontrolovaných klinických studiích s pacienty trpícími RS byla příhoda spojená s infuzí definována jako nežádoucí příhoda, která se vyskytla v průběhu infuze nebo během 1 hodiny od ukončení infuze. K tomu došlo u 23,1 % RS pacientů léčených TYSABRI (placebo: 18,7 %). Infuzní reakce se taktéž vyskytovaly častěji u pacientů při opětovné expozici TYSABRI následující po počáteční krátké expozici (jedna nebo dvě infuze) a dlouhodobém období (3 měsíce nebo déle) bez léčby. Kromě hypersenzitivních reakcí uváděných výše, příhody, které byly častěji hlášeny u TYSABRI než u placeba, zahrnovaly závratě, nauseu, kopřivku a ztuhlost. Tyto příhody byly obvykle mírné z hlediska závažnosti, ustaly po ukončení podávání infuze a nevyžadovaly přerušení léčby. Jestliže budou individuální příznaky problematické, může být vhodná symptomatická léčba. O takových případech však nejsou žádné údaje. 17 Tysabri_EMEA_v9.indd 17 2/2/2011 8:47:43 AM
18 8 IMUNOGENICITA TYSABRI V KLINICKÝCH STUDIÍCH Ve dvouletých kontrolovaných klinických studiích pacientů s RS byly u 10 % pacientů detekovány alespoň jednou protilátky proti natalizumabu. Perzistentní antinatalizumabové protilátky (jeden pozitivní test reprodukovatelný při opakovaném testování za nejméně 6 týdnů) se vyvinuly přibližně u 6 % pacientů. Protilátky byly detekovány pouze v jednom případě u dalších 4 % pacientů. Perzistentní protilátky byly spojovány s podstatným poklesem účinnosti TYSABRI a zvýšeným výskytem nežádoucích příhod spojených s infuzemi včetně zvýšené míry výskytu ztuhlosti, nausey, zvracení a zrudnutí kůže. 8.1 Protilátky proti natalizumabu v klinické praxi Přibližně po 6 měsících terapie by se mělo zvážit podezření na přítomnost perzistentních protilátek, jestliže došlo ke snížení účinnosti nebo výskytu příhod pojících se s infuzemi (pacienti s hypersenzitivní reakcí by měli být vyřazeni z léčby). V těchto případech by měla být vyšetřena přítomnost protilátek, a budou-li i nadále pozitivní v opakovaném testu po 6 týdnech, léčba by se měla ukončit, protože perzistentní protilátky jsou spojovány s významným snížením účinnosti TYSABRI a zvýšenou incidencí hypersenzitivních reakcí. Vzhledem k tomu, že riziko hypersenzitivity je vyšší při obnovení podávání TYSABRI u pacientů po počáteční krátké expozici a dlouhodobém období bez léčby, přítomnost protilátek by měla být vyšetřena před obnovením podávání, a budou-li i nadále pozitivní v opakovaném testu po 6 týdnech, v léčbě by se nemělo pokračovat. Vyšetření protilátek proti natalizumabu je možné realizovat v následující laboratoři: Neurologisches Routinelabor Medical University Innsbruck Anichstrasse 35 A-6020 Innsbruck Tel.: Fax: E: neuro.labor@uki.at 9 JATERNÍ PŘÍHODY V období po uvedení přípravku na trh byly hlášeny spontánní případy závažných poruch funkce jater, zvýšená hladina jaterních enzymů a hyperbilirubinémie. Poškození jater může vzniknout kdykoli během léčby, dokonce i po užití první dávky. V několika případech došlo k opětovnému výskytu těchto reakcí poté, co byl přípravek TYSABRI znovu nasazen. U některých pacientů, kteří měli v předchozí zdravotní anamnéze abnormální výsledky jaterních testů, došlo při užívání přípravku TYSABRI k opětovnému zhoršení výsledků jaterních testů. Pacienti by měli být podle potřeby monitorováni, zdali u nich nedošlo k jaterní dysfunkci, a poučeni o tom, aby v případě výskytu známek či příznaků jaterní poruchy jako je žloutenka či zvracení, kontaktovali svého lékaře. V případě závažné poruchy funkce jater by měl být přípravek TYSABRI vysazen. 18 Tysabri_EMEA_v9.indd 18 2/2/2011 8:47:43 AM
19 9.1 TYSABRI a jaterní příhody: pokyny k léčbě pacientů Monitorování jaterních enzymů Údaje z klinických studií (AFFIRM, SENTINEL), kde byly jaterní funkce monitorovány při zařazení a pak každých 12 týdnů, ukázaly, že vzestup transamináz (ALT/AST) na jedno- až trojnásobek horní hranice normy (ULN) a na více než trojnásobek ULN byl u skupiny pacientů léčených přípravkem TYSABRI srovnatelný se skupinou, které bylo podáváno placebo. Všechna zvýšení ve skupině TYSABRI byla přechodná a necharakteristická ve smyslu nástupu nebo doby trvání příhod. Tremlett a spol. v souhrnném článku v r ukázala, že u významného počtu pacientů s RS, kterým bylo v klinických zkouškách podáváno placebo po dobu delší 2 let, bylo pozorováno spontánní zvýšení transamináz (ALT o 25 %, AST o 14 %); výskyt odpovídá výskytu ve skupinách, kterým bylo v klinických studiích přípravku TYSABRI podáváno placebo. V současné době nejsou do oficiální dokumentace zahrnuta žádná zvláštní povinná vyšetření, takže lékaři musí použít vlastní klinický úsudek a posoudit kdy, jak často a u koho vyšetření jaterních funkcí provádět. Při péči o pacienta by měly být brány v úvahu následující body: Výskyt rizikových faktorů pro jaterní dysfunkci před léčbou přípravkem TYSABRI (dřívější dysfunkce jater vlivem léků nebo virové infekce, současné užívání potenciálně hepatotoxických léčiv, požívání alkoholu atd.). Při výskytu rizikových faktorů může vstupní vyšetření (nebo výsledek posledního vyšetření) provedené před léčbou přípravkem TYSABRI pomoci určit pacienty s aktivním jaterním onemocněním. U pacientů s rizikovými faktory nebo s dokázaným poškozením jater během prvních 6 měsíců léčby je zapotřebí častěji monitorovat jaterní enzymy Zvýšení jaterních enzymů u pacientů léčených TYSABRI U pacientů s příznaky nebo známkami jaterní dysfunkce nebo u pacientů s asymptomatickým zvýšením jaterních transamináz na pětinásobek ULN během léčby přípravkem TYSABRI by další plánovaná infuze neměla být podána a měla by být zjištěna příčina zvýšení. Pokud jsou hodnoty jaterních enzymů pod pětinásobkem ULN při současné absenci příznaků, pokračování léčby přípravkem TYSABRI by mělo být zváženo na základě zhodnocení klinického stavu. Zhodnocení klinického stavu má vycházet z pacientovy anamnézy, současného užívání dalších léčiv, klinických příznaků a projevů. Za předpokladu, že přípravek TYSABRI je v infuzi podáván jednou za měsíc, je vhodné zvážit opakování jaterních testů za 1 2 týdny pro potvrzení správnosti prvního vyšetření a stanovení, zda se abnormalita zlepšuje, zůstává stejná nebo se zhoršuje. 10 VZDĚLÁVACÍ PRŮVODCE Lékaři musí informovat pacienty o přínosech a rizicích TYSABRI a předat jim před zahájením terapie Kartu pacienta (viz Příloha 3) a poté je pravidelně informovat o riziku vzniku PML. Vzhledem ke zvýšení rizika rozvoje PML s rostoucí délkou terapie je třeba, aby odborný lékař a pacient znovu individuálně přehodnotili přínos a riziko terapie přípravkem TYSABRI. Pacient by měl být o rizicích přípravku TYSABRI, zejména o zvýšeném riziku PML, opakovaně informován po 24 měsících a on i jeho ošetřovatelé by měli být poučeni o časných objektivních a subjektivních příznacích PML. Vzorové Formuláře pro zahájení a pokračování léčby jsou uvedeny v příloze 4. Monitorování pacientů léčených TYSABRI bude zajištěno zřízením národního registru TOP, který zahrne i všechny pacienty účastnící se neintervenční observační studie TOP (TYSABRI Observational Program), proto je velmi důležité začlenit a vést dokumentaci všech pacientů léčených TYSABRI již ve studii TOP. Získaná bezpečnostní data jsou nezbytná pro lékaře i pacienty a pro všeobecnou informovanost o bezpečnosti léčby přípravkem TYSABRI. 19 Tysabri_EMEA_v9.indd 19 2/2/2011 8:47:43 AM
Příloha IV. Vědecké závěry
 Příloha IV Vědecké závěry 37 Vědecké závěry Rychle narůstá počet vědeckých důkazů o progresivní multifokální leukoencefalopatii (PML) u pacientů léčených přípravkem Tysabri. Jsou k dispozici nové informace
Příloha IV Vědecké závěry 37 Vědecké závěry Rychle narůstá počet vědeckých důkazů o progresivní multifokální leukoencefalopatii (PML) u pacientů léčených přípravkem Tysabri. Jsou k dispozici nové informace
Natalizumabum TYSABRI 300 mg koncentrát pro infuzní roztok
 Edukační materiály Natalizumabum TYSABRI 300 mg koncentrát pro infuzní roztok INFORMACE PRO LÉKAŘE* A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI Verze 16: 21. června 2017 *Léčbu
Edukační materiály Natalizumabum TYSABRI 300 mg koncentrát pro infuzní roztok INFORMACE PRO LÉKAŘE* A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI Verze 16: 21. června 2017 *Léčbu
Příloha IV. Vědecké závěry
 Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
INFLECTRA SCREENINGOVÝ LIST. a výběru pacientů pro všechny schválené indikace. Obsahuje pokyny ke správnému screeningu
 Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
INFORMACE PRO LÉKAŘE * A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI
 INFORMACE PRO LÉKAŘE * A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI Verze 8: Prosinec 2010 * Léčbu přípravkem TYSABRI by měl zahajovat a sledovat specializovaný lékař se zkušenostmi
INFORMACE PRO LÉKAŘE * A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI Verze 8: Prosinec 2010 * Léčbu přípravkem TYSABRI by měl zahajovat a sledovat specializovaný lékař se zkušenostmi
INFORMACE PRO LÉKAŘE* A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI
 INFORMACE PRO LÉKAŘE* A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI Verze 9: 23. leden 2012 * Léčbu přípravkem TYSABRI by měl zahajovat a sledovat specializovaný lékař se zkušenostmi
INFORMACE PRO LÉKAŘE* A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI Verze 9: 23. leden 2012 * Léčbu přípravkem TYSABRI by měl zahajovat a sledovat specializovaný lékař se zkušenostmi
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH)
 Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH) Se souhlasem Evropské lékové agentury (EMA) a její
Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH) Se souhlasem Evropské lékové agentury (EMA) a její
8.12. 2011- akutní příjem pro susp. progresivní multifokální leukoencefalopatii (PML) indukovanou terapií, s pozitivitou protilátek proti JC viru
 8.12. 2011- akutní příjem pro susp. progresivní multifokální leukoencefalopatii (PML) indukovanou terapií, s pozitivitou protilátek proti JC viru Relaps remitující forma na th. Tysabri (natalizumab), poslední
8.12. 2011- akutní příjem pro susp. progresivní multifokální leukoencefalopatii (PML) indukovanou terapií, s pozitivitou protilátek proti JC viru Relaps remitující forma na th. Tysabri (natalizumab), poslední
Praxbind doporučení pro podávání (SPC)
 Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Zvažte oddálení podání regadenosonu u pacientů s nekontrolovanou hypertenzí.
 CAVE! Informační dopis pro zdravotníky Rapiscan (regadenoson) - Nové důležité doporučení pro minimalizaci rizika cévní mozkové příhody a prodloužení křečí vyvolaných přípravkem Rapiscan po podání aminofylinu.
CAVE! Informační dopis pro zdravotníky Rapiscan (regadenoson) - Nové důležité doporučení pro minimalizaci rizika cévní mozkové příhody a prodloužení křečí vyvolaných přípravkem Rapiscan po podání aminofylinu.
NeuroBloc. botulinový toxin typu B injekční roztok, U/ml
 NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
CZ PAR. QUETIAPINI FUMARAS Seroquel. UK/W/0004/pdWS/001 NL/W/0004/pdWS/001
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
Důležité informace pro pacienty
 MAVENCLAD (cladribinum) Důležité informace pro pacienty OBSAH Seznámení s přípravkem MAVENCLAD Jak se přípravek MAVENCLAD podává? Nežádoucí účinky a možná rizika Lymfopenie Herpes zoster (pásový opar)
MAVENCLAD (cladribinum) Důležité informace pro pacienty OBSAH Seznámení s přípravkem MAVENCLAD Jak se přípravek MAVENCLAD podává? Nežádoucí účinky a možná rizika Lymfopenie Herpes zoster (pásový opar)
INFORMACE PRO LÉKAŘE* A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI
 INFORMACE PRO LÉKAŘE* A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI Verze 12: 6. března 2014 *Léčbu přípravkem TYSABRI by měl zahajovat a sledovat specializovaný lékař se zkušenostmi
INFORMACE PRO LÉKAŘE* A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI Verze 12: 6. března 2014 *Léčbu přípravkem TYSABRI by měl zahajovat a sledovat specializovaný lékař se zkušenostmi
Důležité bezpečnostní informace pro zdravotnické pracovníky
 Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Co byste měl(a) vědět o léčivém přípravku
 Co byste měl(a) vědět o léčivém přípravku Důležité bezpečnostní informace pro pacienty léčené přípravkem MabThera 1 Co byste měl(a) vědět o přípravku MabThera Pokud máte revmatoidní artritidu (RA), granulomatózu
Co byste měl(a) vědět o léčivém přípravku Důležité bezpečnostní informace pro pacienty léčené přípravkem MabThera 1 Co byste měl(a) vědět o přípravku MabThera Pokud máte revmatoidní artritidu (RA), granulomatózu
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Informace pro zdravotnické odborníky
 EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
ÚHRADA V CENTRECH SE ZVLÁŠTNÍ SMLOUVOU V ROCE 2014 DIAGNOSTICKÁ SKUPINA: ROZTROUŠENÁ SKLERÓZA KONFERENCE PS PČR LISTOPAD 2014
 ÚHRADA V CENTRECH SE ZVLÁŠTNÍ SMLOUVOU V ROCE 2014 DIAGNOSTICKÁ SKUPINA: ROZTROUŠENÁ SKLERÓZA KONFERENCE PS PČR LISTOPAD 2014 STRUKTURA CENTROVÉ PÉČE Centrová péče 2014: 53 poskytovatelů zdravotnických
ÚHRADA V CENTRECH SE ZVLÁŠTNÍ SMLOUVOU V ROCE 2014 DIAGNOSTICKÁ SKUPINA: ROZTROUŠENÁ SKLERÓZA KONFERENCE PS PČR LISTOPAD 2014 STRUKTURA CENTROVÉ PÉČE Centrová péče 2014: 53 poskytovatelů zdravotnických
PRŮKAZ PACIENTA. užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1
 PRŮKAZ PACIENTA užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě zdravotnického zařízení.
PRŮKAZ PACIENTA užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě zdravotnického zařízení.
CZ PAR QUETIAPINUM. Seroquel. UK/W/0004/pdWS/001. NL/W/0004/pdWS/001
 CZ PAR Název (léčivá látka/ přípravek) Číslo procedury QUETIAPINUM Seroquel UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZVY PŘÍPRAVKŮ KLINICKÝCH STUDIÍ INN DRŽITELÉ PŘÍPRAVKŮ KLINICKÝCH STUDIÍ SCHVÁLENÉ
CZ PAR Název (léčivá látka/ přípravek) Číslo procedury QUETIAPINUM Seroquel UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZVY PŘÍPRAVKŮ KLINICKÝCH STUDIÍ INN DRŽITELÉ PŘÍPRAVKŮ KLINICKÝCH STUDIÍ SCHVÁLENÉ
Edukační materiál. Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera
 Edukační materiál Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera Přípravek Strattera je indikován k léčbě hyperkinetické
Edukační materiál Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera Přípravek Strattera je indikován k léčbě hyperkinetické
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Obr.1 Žilní splavy. https://s-media-cache-ak0.pinimg.com/564x/c3/91/8c/c3918c00db875bb460cf868b26ee1a0c.jpg
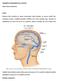 TROMBÓZA NITROLEBNÍCH ŽIL A SPLAVŮ Autor: Barbora Baštinská Výskyt Mozková žilní trombóza je vzácné onemocnění, jehož příznaky se mohou značně lišit. Vyskytuje se spíše u mladších pacientů a většinou (až
TROMBÓZA NITROLEBNÍCH ŽIL A SPLAVŮ Autor: Barbora Baštinská Výskyt Mozková žilní trombóza je vzácné onemocnění, jehož příznaky se mohou značně lišit. Vyskytuje se spíše u mladších pacientů a většinou (až
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) jodidu-( 131 I) sodného
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) jodidu-( 131 I) sodného
Pokud se chcete dozvědět o statinech a problematice léčby více, přejděte na. Partnerem je Diagnóza FH, z.s.
 BRÁT! SAMOZŘEJMĚ! Pokud se chcete dozvědět o statinech a problematice léčby více, přejděte na www.athero.cz Připravila Česká společnost pro aterosklerózu www.athero.cz Česká společnost pro aterosklerózu
BRÁT! SAMOZŘEJMĚ! Pokud se chcete dozvědět o statinech a problematice léčby více, přejděte na www.athero.cz Připravila Česká společnost pro aterosklerózu www.athero.cz Česká společnost pro aterosklerózu
EDUKAČNÍ MATERIÁL. Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid)
 EDUKAČNÍ MATERIÁL Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid) Leflunopharm (leflunomid), jako chorobu modifikující antirevmatikum (Disease-Modifying
EDUKAČNÍ MATERIÁL Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid) Leflunopharm (leflunomid), jako chorobu modifikující antirevmatikum (Disease-Modifying
Cévní mozková příhoda. Petr Včelák
 Cévní mozková příhoda Petr Včelák 12. 2. 2015 Obsah 1 Cévní mozková příhoda... 1 1.1 Příčiny mrtvice... 1 1.2 Projevy CMP... 1 1.3 Případy mrtvice... 1 1.3.1 Česko... 1 1.4 Diagnóza a léčba... 2 1.5 Test
Cévní mozková příhoda Petr Včelák 12. 2. 2015 Obsah 1 Cévní mozková příhoda... 1 1.1 Příčiny mrtvice... 1 1.2 Projevy CMP... 1 1.3 Případy mrtvice... 1 1.3.1 Česko... 1 1.4 Diagnóza a léčba... 2 1.5 Test
Účinný boj s LDL-cholesterolem? STATINY?!
 Účinný boj s LDL-cholesterolem? STATINY?! BRÁT! SAMOZŘEJMĚ! Pověry o statinech aneb Nevěřte všemu, co se povídá a píše O statinech, tedy lécích na snížení množství cholesterolu v krvi, koluje mezi laiky,
Účinný boj s LDL-cholesterolem? STATINY?! BRÁT! SAMOZŘEJMĚ! Pověry o statinech aneb Nevěřte všemu, co se povídá a píše O statinech, tedy lécích na snížení množství cholesterolu v krvi, koluje mezi laiky,
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Familiární středomořská (Mediterranean) horečka (Fever)
 www.printo.it/pediatric-rheumatology/cz/intro Familiární středomořská (Mediterranean) horečka (Fever) Verze č 2016 2. DIAGNÓZA A LÉČBA 2.1 Jak se nemoc diagnostikuje? Obecně se uplatňuje následující postup:
www.printo.it/pediatric-rheumatology/cz/intro Familiární středomořská (Mediterranean) horečka (Fever) Verze č 2016 2. DIAGNÓZA A LÉČBA 2.1 Jak se nemoc diagnostikuje? Obecně se uplatňuje následující postup:
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE
 LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE Léčba by měla být zahájena a sledována specialistou se zkušenostmi v léčbě revmatoidní artritidy a psoriatické artritidy. Lékař by měl poučit pacienty
LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE Léčba by měla být zahájena a sledována specialistou se zkušenostmi v léčbě revmatoidní artritidy a psoriatické artritidy. Lékař by měl poučit pacienty
Příloha III. Změny v příslušných bodech informací o přípravku
 Příloha III Změny v příslušných bodech informací o přípravku Poznámka: Tyto změny v příslušných bodech informací o přípravku jsou výsledkem postupu přezkoumání. Informace o přípravku může být následně
Příloha III Změny v příslušných bodech informací o přípravku Poznámka: Tyto změny v příslušných bodech informací o přípravku jsou výsledkem postupu přezkoumání. Informace o přípravku může být následně
Vše co potřebujete vědět o hemoroidech. Rady pro pacienty
 Vše co potřebujete vědět o hemoroidech Rady pro pacienty CO? CO? JAK? JAK? KDY? KDY? PROČ? PROČ? CO CO jsou hemoroidy? je hemoroidální onemocnění? Anatomie řitního kanálu a konečníku Hemoroidy jsou přirozenou
Vše co potřebujete vědět o hemoroidech Rady pro pacienty CO? CO? JAK? JAK? KDY? KDY? PROČ? PROČ? CO CO jsou hemoroidy? je hemoroidální onemocnění? Anatomie řitního kanálu a konečníku Hemoroidy jsou přirozenou
Rozměr zavřeného průkazu mm
 Přední strana Str. 1 PRŮKAZ PACIENTA užívajícího přípravek Humira (určeno dospělým i dětským pacientům) Rozměr zavřeného průkazu 105 73 mm Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi
Přední strana Str. 1 PRŮKAZ PACIENTA užívajícího přípravek Humira (určeno dospělým i dětským pacientům) Rozměr zavřeného průkazu 105 73 mm Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi
EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE
 EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE Příručka pro předepisujícího lékaře Pokyny pro zdravotnické pracovníky ohledně předepisování přípravku Cerdelga (eliglustat) Tento léčivý přípravek
EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE Příručka pro předepisujícího lékaře Pokyny pro zdravotnické pracovníky ohledně předepisování přípravku Cerdelga (eliglustat) Tento léčivý přípravek
CZ PAR. QUETIAPINI FUMARAS Seroquel. NL/W/0004/pdWS/002
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury NL/W/0004/pdWS/002 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA ZMĚNA V SmPC
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury NL/W/0004/pdWS/002 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA ZMĚNA V SmPC
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7
 PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7 Členský stát Žadatel nebo držitel rozhodnutí o registraci Vymyšlený název přípravku
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7 Členský stát Žadatel nebo držitel rozhodnutí o registraci Vymyšlený název přípravku
Perorální kladribin: bezpečnostní profil, monitorování pacientů a praktické zkušenosti.
 Perorální kladribin: bezpečnostní profil, monitorování pacientů a praktické zkušenosti. I V A N A K O V Á Ř O V Á C E N T R U M P R O D E M Y E L I N I Z A Č N Í O N E M O C N Ě N Í N E U R O L O G I C
Perorální kladribin: bezpečnostní profil, monitorování pacientů a praktické zkušenosti. I V A N A K O V Á Ř O V Á C E N T R U M P R O D E M Y E L I N I Z A Č N Í O N E M O C N Ě N Í N E U R O L O G I C
RS léčba. Eva Havrdová. Neurologická klinika 1.LF UK a VFN Praha
 RS léčba Eva Havrdová Neurologická klinika 1.LF UK a VFN Praha Progrese RS bez léčby Přirozený průběh: Doba do EDSS 6 (n=902) Konverze RR MS v progresivní MS 100 80 60 40 20 0 10 20 30 40 50 Čas (roky)
RS léčba Eva Havrdová Neurologická klinika 1.LF UK a VFN Praha Progrese RS bez léčby Přirozený průběh: Doba do EDSS 6 (n=902) Konverze RR MS v progresivní MS 100 80 60 40 20 0 10 20 30 40 50 Čas (roky)
Doporučení Farmakovigilančního výboru pro posuzování rizik léčiv (PRAC) k signálům pro aktualizaci informací o přípravku
 22. ledna 2015 EMA/PRAC/63322/2015 Farmakovigilanční výbor pro posuzování rizik léčiv Doporučení Farmakovigilančního výboru pro posuzování rizik léčiv (PRAC) k signálům pro aktualizaci informací o přípravku
22. ledna 2015 EMA/PRAC/63322/2015 Farmakovigilanční výbor pro posuzování rizik léčiv Doporučení Farmakovigilančního výboru pro posuzování rizik léčiv (PRAC) k signálům pro aktualizaci informací o přípravku
Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu
 Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu Marta Krejčí XIII. MM workshop a setkání CMG, Mikulov 11.4.2015 Doplněk č. 1 k doporučení z 9/2012: Diagnostika
Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu Marta Krejčí XIII. MM workshop a setkání CMG, Mikulov 11.4.2015 Doplněk č. 1 k doporučení z 9/2012: Diagnostika
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky
 Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky Prof. MUDr. Jitka Abrahámová, DrSc Onkologická klinika TN a 1. LF UK KOC (NNB + VFN + TN) St Gallén 2011 Rozsah onemocnění T, N, M ER, PgR
Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky Prof. MUDr. Jitka Abrahámová, DrSc Onkologická klinika TN a 1. LF UK KOC (NNB + VFN + TN) St Gallén 2011 Rozsah onemocnění T, N, M ER, PgR
PRŮKAZ PACIENTA. užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019
 PRŮKAZ PACIENTA užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě
PRŮKAZ PACIENTA užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě
Příloha II. Vědecké závěry a zdůvodnění změny v registraci
 Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
CAVE! Informační dopis pro zdravotnické pracovníky
 CAVE! Informační dopis pro zdravotnické pracovníky říjen 2017 Výpadek léčivého přípravku Trisenox (oxid arzenitý, koncentrát pro infuzní roztok 1 mg/ml): nahrazení léčivým přípravkem Phenasen (injekční
CAVE! Informační dopis pro zdravotnické pracovníky říjen 2017 Výpadek léčivého přípravku Trisenox (oxid arzenitý, koncentrát pro infuzní roztok 1 mg/ml): nahrazení léčivým přípravkem Phenasen (injekční
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Akutní respirační poruchy spojené s potápěním a dekompresí... Úvod Patofyziologie Klinické projevy Diagnostika Léčba Prognóza postižení Praktické rady
 1 Hemoptýza 1.1 Úvod a definice 1.2 Patofyziologie hemoptýzy 1.3 Příčiny hemoptýzy 1.4 Klasifikace hemoptýzy 1.5 Vyšetřovací metody 1.6 Diagnostické algoritmy 1.7 Diferenciální diagnostika hemoptýzy 1.8
1 Hemoptýza 1.1 Úvod a definice 1.2 Patofyziologie hemoptýzy 1.3 Příčiny hemoptýzy 1.4 Klasifikace hemoptýzy 1.5 Vyšetřovací metody 1.6 Diagnostické algoritmy 1.7 Diferenciální diagnostika hemoptýzy 1.8
HIV / AIDS MUDr. Miroslava Zavřelová Ústav preventivního lékařství LF MU
 HIV / AIDS MUDr. Miroslava Zavřelová Ústav preventivního lékařství LF MU e-mail: mizavrel@med.muni.cz I.E.S. Brno, 14. 10. 2014 Historie nákazy 1981 San Francisko, New York mladí pacienti s neobvyklými
HIV / AIDS MUDr. Miroslava Zavřelová Ústav preventivního lékařství LF MU e-mail: mizavrel@med.muni.cz I.E.S. Brno, 14. 10. 2014 Historie nákazy 1981 San Francisko, New York mladí pacienti s neobvyklými
PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Poznámka: Tyto úpravy souhrnu údajů o přípravku a
 PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku přijetí rozhodnutí Komisí. Poté,
PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku přijetí rozhodnutí Komisí. Poté,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Rekurentní horečka spojená s NRLP21
 www.printo.it/pediatric-rheumatology/cz/intro Rekurentní horečka spojená s NRLP21 Verze č 2016 1. CO JE TO REKURENTNÍ HOREČKA SPOJENÁ S NRLP12 1.1 Co je to? Rekurentní horečka spojená s NRLP12 patří mezi
www.printo.it/pediatric-rheumatology/cz/intro Rekurentní horečka spojená s NRLP21 Verze č 2016 1. CO JE TO REKURENTNÍ HOREČKA SPOJENÁ S NRLP12 1.1 Co je to? Rekurentní horečka spojená s NRLP12 patří mezi
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
Příloha I. Vědecké závěry
 Příloha I Vědecké závěry 1 Vědecké závěry Daklizumab beta je humanizovaná monoklonální protilátka IgG1, která moduluje signalizaci IL-2 blokádou signalizace CD25-dependentního receptoru pro IL-2 s vysokou
Příloha I Vědecké závěry 1 Vědecké závěry Daklizumab beta je humanizovaná monoklonální protilátka IgG1, která moduluje signalizaci IL-2 blokádou signalizace CD25-dependentního receptoru pro IL-2 s vysokou
LÉKAŘSKÁ VYŠETŘENÍ A LABORATORNÍ TESTY
 LÉKAŘSKÁ VYŠETŘENÍ A LABORATORNÍ TESTY Pokud čtete tento text, pravděpodobně jste v kontaktu s odborníkem na léčbu mnohočetného myelomu. Diagnóza mnohočetného myelomu je stanovena pomocí četných laboratorních
LÉKAŘSKÁ VYŠETŘENÍ A LABORATORNÍ TESTY Pokud čtete tento text, pravděpodobně jste v kontaktu s odborníkem na léčbu mnohočetného myelomu. Diagnóza mnohočetného myelomu je stanovena pomocí četných laboratorních
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
ANAMNÉZA DÁRKYNĚ PUPEČNÍKOVÉ KRVE
 ANAMNÉZA DÁRKYNĚ PUPEČNÍKOVÉ KRVE JMÉNO A PŘÍJMENÍ DÁRKYNÉ DATUM NAROZENÍ RODNÉ ČÍSLO ZAMĚSTNÁNÍ TELEFON ULICE A ČÍSLO POPISNÉ MĚSTO PSČ PORODNÍK MINULÉ TĚHOTENSTVÍ počet předchozích porodů počet spontánních
ANAMNÉZA DÁRKYNĚ PUPEČNÍKOVÉ KRVE JMÉNO A PŘÍJMENÍ DÁRKYNÉ DATUM NAROZENÍ RODNÉ ČÍSLO ZAMĚSTNÁNÍ TELEFON ULICE A ČÍSLO POPISNÉ MĚSTO PSČ PORODNÍK MINULÉ TĚHOTENSTVÍ počet předchozích porodů počet spontánních
Jana Bednářová. Oddělení klinické mikrobiologické FN Brno
 Aktuální klinická a laboratorní kritéria pro diagnostiku neuroborreliózy Jana Bednářová Oddělení klinické mikrobiologické FN Brno European Journal of Neurology 2010, 17: : 8 16 EFNS guidelines on the diagnosis
Aktuální klinická a laboratorní kritéria pro diagnostiku neuroborreliózy Jana Bednářová Oddělení klinické mikrobiologické FN Brno European Journal of Neurology 2010, 17: : 8 16 EFNS guidelines on the diagnosis
Demyelinizační onemocnění CNS. MUDr. Eva Krasulová Neurologická klinika 1.LF UK a VFN, Praha
 Demyelinizační onemocnění CNS MUDr. Eva Krasulová Neurologická klinika 1.LF UK a VFN, Praha Demyelinizace = poškození myelinu Neurodegenerace = poškození nervového vlákna - demyelinizace může nastat v
Demyelinizační onemocnění CNS MUDr. Eva Krasulová Neurologická klinika 1.LF UK a VFN, Praha Demyelinizace = poškození myelinu Neurodegenerace = poškození nervového vlákna - demyelinizace může nastat v
Příloha II. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 21 Vědecké závěry Celkové závěry vědeckého hodnocení přípravků Oxynal a Targin a souvisejících názvů (viz příloha I) Podkladové
Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 21 Vědecké závěry Celkové závěry vědeckého hodnocení přípravků Oxynal a Targin a souvisejících názvů (viz příloha I) Podkladové
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha III. Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
HIV (z klinického pohledu)
 HIV (z klinického pohledu) David Jilich HIV centrum, Nemocnice Na Bulovce, Praha 11.12. 2014 Vývoj situace ve světě Changes in incidance rate 2001 to 2009 zdroj: UNAIDS Zákadní charakteristika virová infekce
HIV (z klinického pohledu) David Jilich HIV centrum, Nemocnice Na Bulovce, Praha 11.12. 2014 Vývoj situace ve světě Changes in incidance rate 2001 to 2009 zdroj: UNAIDS Zákadní charakteristika virová infekce
Výskyt a význam infekce Borna disease virem u pacientů léčených
 Výskyt a význam infekce Borna disease virem u pacientů léčených pro závislost Sylva Racková Psychiatrická klinika LF UK v Plzni AT konference 28.04. 2010, Špindlerův Mlýn Borna Disease virus (BDV) charakteristika
Výskyt a význam infekce Borna disease virem u pacientů léčených pro závislost Sylva Racková Psychiatrická klinika LF UK v Plzni AT konference 28.04. 2010, Špindlerův Mlýn Borna Disease virus (BDV) charakteristika
Diagnostika a příznaky mnohočetného myelomu
 Diagnostika a příznaky mnohočetného myelomu J.Minařík, V.Ščudla Mnohočetný myelom Nekontrolované zmnožení nádorově změněných plasmatických buněk v kostní dřeni Mnohočetný = obvykle více oblastí kostní
Diagnostika a příznaky mnohočetného myelomu J.Minařík, V.Ščudla Mnohočetný myelom Nekontrolované zmnožení nádorově změněných plasmatických buněk v kostní dřeni Mnohočetný = obvykle více oblastí kostní
EDUKAČNÍ MATERIÁLY. Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce
 EDUKAČNÍ MATERIÁLY Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERIÁLY Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
U pacientů, jejichž tělesná hmotnost je vyšší než 100 kg, se dávky přesahující 800 mg/infuzi nedoporučují.
 EDUKAČNÍ MATERIÁLY RoActemra (tocilizumab) Kapesní dávkovací karta pro revmatoidní artritidu Přípravek RoActemra v kombinaci s metotrexátem (MTX) je indikován k léčbě středně těžké až těžké aktivní revmatoidní
EDUKAČNÍ MATERIÁLY RoActemra (tocilizumab) Kapesní dávkovací karta pro revmatoidní artritidu Přípravek RoActemra v kombinaci s metotrexátem (MTX) je indikován k léčbě středně těžké až těžké aktivní revmatoidní
EDUKAČNÍ MATERIÁLY. TRUVADA 200 mg / 245 mg POTAHOVANÉ TABLETY (EMTRICITABINUM/ TENOFOVIRUM DISOPROXILUM)
 EDUKAČNÍ MATERIÁLY TRUVADA 200 mg / 245 mg POTAHOVANÉ TABLETY (EMTRICITABINUM/ TENOFOVIRUM DISOPROXILUM) DŮLEŽITÉ BEZPEČNOSTNÍ INFORMACE PRO PŘEDEPISUJÍCÍ LÉKAŘE týkající se užívání přípravku Truvada k
EDUKAČNÍ MATERIÁLY TRUVADA 200 mg / 245 mg POTAHOVANÉ TABLETY (EMTRICITABINUM/ TENOFOVIRUM DISOPROXILUM) DŮLEŽITÉ BEZPEČNOSTNÍ INFORMACE PRO PŘEDEPISUJÍCÍ LÉKAŘE týkající se užívání přípravku Truvada k
HEMOFILIE - DIAGNOSTIKA A LÉČBA V SOUČASNOSTI
 HEMOFILIE - DIAGNOSTIKA A LÉČBA V SOUČASNOSTI Patofyziologie hemofilie Deficit koagulačního faktoru VIII (hemofilie A) nebo IX (hemofilie B), jeho dysfunkce nebo přítomnost jeho inhibitorů vede k poruše
HEMOFILIE - DIAGNOSTIKA A LÉČBA V SOUČASNOSTI Patofyziologie hemofilie Deficit koagulačního faktoru VIII (hemofilie A) nebo IX (hemofilie B), jeho dysfunkce nebo přítomnost jeho inhibitorů vede k poruše
PNEUMOKOKOVÉ INFEKCE A MOŽNOSTI PREVENCE aneb CO MŮŽE ZPŮSOBIT PNEUMOKOK
 PNEUMOKOKOVÉ INFEKCE A MOŽNOSTI PREVENCE aneb CO MŮŽE ZPŮSOBIT PNEUMOKOK Očkování! Nejvýznamnější možnost prevence infekčních chorob! Lepší infekční chorobě předcházet než ji léčit! Významný objev v medicíně,
PNEUMOKOKOVÉ INFEKCE A MOŽNOSTI PREVENCE aneb CO MŮŽE ZPŮSOBIT PNEUMOKOK Očkování! Nejvýznamnější možnost prevence infekčních chorob! Lepší infekční chorobě předcházet než ji léčit! Významný objev v medicíně,
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
NEU/VC hodin praktických cvičení / blok
 Studijní program : Všeobecné lékařství Název předmětu : Neurologie Rozvrhová zkratka : NEU/VC012 Rozvrh výuky : 18 hodin seminářů / blok 72 hodin praktických cvičení / blok Zařazení výuky : 4. ročník,
Studijní program : Všeobecné lékařství Název předmětu : Neurologie Rozvrhová zkratka : NEU/VC012 Rozvrh výuky : 18 hodin seminářů / blok 72 hodin praktických cvičení / blok Zařazení výuky : 4. ročník,
Příloha IV. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha IV Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 132 Vědecké závěry Výbor CHMP zvážil níže uvedené doporučení výboru PRAC ze dne 5. prosince 2013 s ohledem na postup podle
Příloha IV Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 132 Vědecké závěry Výbor CHMP zvážil níže uvedené doporučení výboru PRAC ze dne 5. prosince 2013 s ohledem na postup podle
Varicella v těhotenství. K.Roubalová Vidia s.r.o.
 Varicella v těhotenství K.Roubalová Vidia s.r.o. Infekce VZV 90% v dětství (3-5 let), 10% v dospělosti (horší průběh) Většina primárních infekcí symptomatická - Varicella Vždy virémie Infekčnost: vysoká:
Varicella v těhotenství K.Roubalová Vidia s.r.o. Infekce VZV 90% v dětství (3-5 let), 10% v dospělosti (horší průběh) Většina primárních infekcí symptomatická - Varicella Vždy virémie Infekčnost: vysoká:
Souhrn doporučení pro předepisujícího lékaře
 G Souhrn doporučení pro předepisujícího lékaře Kritéria výběru pacientů pro léčbu přípravkem GILENYA (fingolimod) Přípravek GILENYA je vhodný pro dospělé pacienty k léčbě vysoce aktivní relabující-remitentní
G Souhrn doporučení pro předepisujícího lékaře Kritéria výběru pacientů pro léčbu přípravkem GILENYA (fingolimod) Přípravek GILENYA je vhodný pro dospělé pacienty k léčbě vysoce aktivní relabující-remitentní
Vývoj nových léčiv. Preklinický výzkum Klinický výzkum
 Vývoj nových léčiv Preklinický výzkum Klinický výzkum Úvod Léčivo = nejprověřenější potravina vstupující do organismu Ideální léčivo kvalitní, účinné, bezpečné a dostupné Financování výzkumu léčiv souvislost
Vývoj nových léčiv Preklinický výzkum Klinický výzkum Úvod Léčivo = nejprověřenější potravina vstupující do organismu Ideální léčivo kvalitní, účinné, bezpečné a dostupné Financování výzkumu léčiv souvislost
Příloha II. Vědecké závěry
 Příloha II Vědecké závěry 74 Vědecké závěry Dne 7. července 2016 zahájila Velká Británie na základě farmakovigilančních údajů postup podle článku 31 směrnice 2001/83/ES a požádalo výbor PRAC, aby přezkoumal
Příloha II Vědecké závěry 74 Vědecké závěry Dne 7. července 2016 zahájila Velká Británie na základě farmakovigilančních údajů postup podle článku 31 směrnice 2001/83/ES a požádalo výbor PRAC, aby přezkoumal
Spasticita jako projev maladaptivní plasticity CNS po ischemické cévní mozkové příhodě a její ovlivnění botulotoxinem. MUDr.
 Spasticita jako projev maladaptivní plasticity CNS po ischemické cévní mozkové příhodě a její ovlivnění botulotoxinem MUDr. Tomáš Veverka Neurologická klinika Lékařské fakulty Univerzity Palackého a Fakultní
Spasticita jako projev maladaptivní plasticity CNS po ischemické cévní mozkové příhodě a její ovlivnění botulotoxinem MUDr. Tomáš Veverka Neurologická klinika Lékařské fakulty Univerzity Palackého a Fakultní
Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům
 12 October 2017 EMA/PRAC/662563/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC konaném
12 October 2017 EMA/PRAC/662563/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC konaném
Nemoci nervové soustavy. Doc. MUDr. Otakar Keller, CSc.
 Nemoci nervové soustavy Doc. MUDr. Otakar Keller, CSc. MKN 10 - VI.kap.l G00-99 G00-G09 Zánětlivé nemoci centrální nervové soustavy G10-G13 Systémové atrofie postihující primárně nervovou soustavu G20-G26
Nemoci nervové soustavy Doc. MUDr. Otakar Keller, CSc. MKN 10 - VI.kap.l G00-99 G00-G09 Zánětlivé nemoci centrální nervové soustavy G10-G13 Systémové atrofie postihující primárně nervovou soustavu G20-G26
Hemlibra (emicizumab) Subkutánní injekce. Návod pro zdravotnické pracovníky
 EDUKAČNÍ MATERIÁLY Hemlibra (emicizumab) Subkutánní injekce Návod pro zdravotnické pracovníky Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERIÁLY Hemlibra (emicizumab) Subkutánní injekce Návod pro zdravotnické pracovníky Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
PŘÍLOHA IV VĚDECKÉ ZÁVĚRY
 PŘÍLOHA IV VĚDECKÉ ZÁVĚRY Vědecké závěry Koinfekce virem hepatitidy B (HBV) a virem hepatitidy C (HCV) není vzhledem k podobnému způsobu přenosu neobvyklá. Je známo, že infekce HCV u pacientů s koinfekcí
PŘÍLOHA IV VĚDECKÉ ZÁVĚRY Vědecké závěry Koinfekce virem hepatitidy B (HBV) a virem hepatitidy C (HCV) není vzhledem k podobnému způsobu přenosu neobvyklá. Je známo, že infekce HCV u pacientů s koinfekcí
Vztah pacienta k diagnostice a léčbě idiopatických střevních zánětů možnosti a problémy
 Vztah pacienta k diagnostice a léčbě idiopatických střevních zánětů možnosti a problémy Vladimír Zbořil Interní - hepatogastroenterologická klinika Fakultní nemocnice Bohunice Masarykova Univerzita BRNO
Vztah pacienta k diagnostice a léčbě idiopatických střevních zánětů možnosti a problémy Vladimír Zbořil Interní - hepatogastroenterologická klinika Fakultní nemocnice Bohunice Masarykova Univerzita BRNO
Keytruda (pembrolizumabum)
 EMA/235911/2019 EMEA/H/C/003820 Přehled pro přípravek Keytruda a proč byl přípravek registrován v EU Co je přípravek Keytruda a k čemu se používá? Keytruda je protinádorový léčivý přípravek používaný k
EMA/235911/2019 EMEA/H/C/003820 Přehled pro přípravek Keytruda a proč byl přípravek registrován v EU Co je přípravek Keytruda a k čemu se používá? Keytruda je protinádorový léčivý přípravek používaný k
KRVÁCENÍ DO CNS U HEMOFILIKŮ
 KRVÁCENÍ DO CNS U HEMOFILIKŮ Hluší A. a kol. Hemato-onkologická klinika FN a LF UP Olomouc Každoroční setkání spolupracujících pracivišť, Prostějov 9.11.2013 úvod velmi těžká krvácivá komplikace s vysokou
KRVÁCENÍ DO CNS U HEMOFILIKŮ Hluší A. a kol. Hemato-onkologická klinika FN a LF UP Olomouc Každoroční setkání spolupracujících pracivišť, Prostějov 9.11.2013 úvod velmi těžká krvácivá komplikace s vysokou
KLINICKÝ PŘÍNOS RADIOLOGICKÝCH PARAMETRŮ U SPONDYLOGENNÍ CERVIKÁLNÍ MYELOPATIE
 KLINICKÝ PŘÍNOS RADIOLOGICKÝCH PARAMETRŮ U SPONDYLOGENNÍ CERVIKÁLNÍ MYELOPATIE Neurologická klinika LF MU a FN Brno Tomáš Horák 7.12.2017 MYELOPATIE = nezánětlivé onemocnění míchy Spondylogenní (kompresivní)
KLINICKÝ PŘÍNOS RADIOLOGICKÝCH PARAMETRŮ U SPONDYLOGENNÍ CERVIKÁLNÍ MYELOPATIE Neurologická klinika LF MU a FN Brno Tomáš Horák 7.12.2017 MYELOPATIE = nezánětlivé onemocnění míchy Spondylogenní (kompresivní)
