INFORMACE PRO LÉKAŘE * A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI
|
|
|
- Jan Dušek
- před 8 lety
- Počet zobrazení:
Transkript
1 INFORMACE PRO LÉKAŘE * A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI Verze 8: Prosinec 2010 * Léčbu přípravkem TYSABRI by měl zahajovat a sledovat specializovaný lékař se zkušenostmi v diagnostice a léčbě neurologických onemocnění ve střediscích s rychlým přístupem k MRI.
2 OBSAH 1 ÚVOD OPORTUNNÍ INFEKCE VČETNĚ PROGRESIVNÍ MULTIFOKÁLNÍ LEUKOENCEFALOPATIE (PML) Definice Infekce včetně oportunních spojené s TYSABRI Léčba potenciálních oportunních infekcí Progresivní multifokální leukoencefalopatie (PML) PML u pacientů léčených přípravkem TYSABRI Rizikové faktory PML DIAGNÓZA PML Všeobecné zásady Klinické rozlišení mezi PML a relapsem RS Rozlišení mezi PML a relapsem RS pomocí MRI Laboratorní rozlišení mezi PML a relapsem RS LÉČBA PML Imunorestituční zánětlivý syndrom (IRIS) NEŽÁDOUCÍ REAKCE SPOJENÉ S INFUZEMI Přecitlivělost Léčba hypersensitivních reakcí spojených s infuzí v klinické praxi Jiné nežádoucí reakce spojené s infuzemi Protilátky proti natalizumabu v klinické praxi POUČENÍ Informování pacientů o přínosech a rizicích Karta pacienta LITERATURA PŘÍLOHY Příloha 1. Souhrn údajů o přípravku (SPC) Příloha 2. Příbalová informace (PIL) Příloha 3. Karta pacienta Příloha 4. Formuláře při zahájení a pokračování léčby... 19
3 1 ÚVOD Tyto pokyny byly vypracovány pro lékaře, kteří zahajují a sledují léčbu přípravkem TYSABRI v souladu s podmínkami registračního rozhodnutí léčiva, s cílem zajistit jeho bezpečné a účinné používání. Obsahují informace, které se mají používat společně se Souhrnem údajů o přípravku TYSABRI (SPC) (příloha 1) a je doplněna Formuláři při zahájení a pokračování léčby přípravkem TYSABRI (příloha 4). Balíček pro lékaře také zahrnuje příbalovou informaci (PIL) a Kartu pacienta (přílohy 2 a 3). Doporučujeme, aby se lékaři, kteří léčbu přípravkem TYSABRI zahajují a sledují, podělili o příslušné části tohoto dokumentu s radiology zahrnutými do diferenciální diagnostiky PML. Verze 8 těchto pokynů byla revidována se záměrem soustředit se v první řadě na PML, která v současné době zůstává nejdůležitějším nežádoucím účinkem ovlivňujícím pacienty na TYSABRI, a poskytnout praktické rady lékařům, které nejsou dostupné v SPC. Ve verzi 8 těchto pokynů jsou nadále zachovány také informace o reakcích po infuzi, alergických reakcích a tvorbě protilátek. Další důležité otázky týkající se bezpečnosti spojené s podáváním TYSABRI a informace o pacientech vhodných k léčbě pomocí TYSABRI, jsou plně popsány v SPC. Lékaři by měli tyto pokyny používat společně s SPC. 3
4 2 OPORTUNNÍ INFEKCE VČETNĚ PROGRESIVNÍ MULTIFOKÁLNÍ LEUKOENCEFALOPATIE (PML) Lékaři předepisující toto léčivo by měli vzít na vědomí možnost, že se během léčby TYSABRI může objevit PML a jiné oportunní infekce (včetně reaktivace tuberkulózy) a měli by je zahrnout do diferenciální diagnózy infekcí, k nimž dochází u pacientů léčených TYSABRI. Pacienti, jejich partneři a ošetřovatelé musí být informováni o příznacích, které mohou upozorňovat na počínající PML (viz kapitola 6.2 a příloha 3: Karta pacienta, příloha 4: Formuláře při zahájení a pokračování léčby). Jestliže je podezření na oportunní infekci, dávkování TYSABRI se musí pozastavit, dokud nebude možné díky dalším vyšetřením takové infekce vyloučit. 2.1 Definice Oportunní infekce je definována jako infekce způsobená organismem, který obvykle nezpůsobuje onemocnění nebo vyvolává pouze mírné či spontánně mizející onemocnění u lidí s normálně fungujícím imunitním systémem, ale způsobuje významnější onemocnění u lidí s narušenou imunitou. Jako příklad uvádíme PML, ezofageální kandidózu, systémové plísňové infekce, pneumonii vyvolanou Pneumocystis carinii, mykobakteriální infekce (včetně atypických mykobakterií, pulmonální a extrapulmonální tuberkulózy a reaktivace tuberkulózy), chronickou intestinální kryptosporidiózu, diseminované virové infekce (například diseminované herpetické nebo cytomegalovirové infekce), toxoplasmózu, kryptosporidiové infekce a Kaposiho sarkom. 2.2 Infekce včetně oportunních spojené s TYSABRI V klinických studiích s RS byl hlášen případ průjmu vyvolaného prvoky rodu Cryptosporidium. V klinických studiích u pacientů s Crohnovou nemocí byly hlášeny další oportunní infekce, přičemž některé z nich byly smrtelné. V těchto studiích bylo běžné konkomitantní používání dalších přípravků včetně imunosupresiv. Od uvedení TYSABRI na trh jsou sporadicky hlášeny i jiné oportunní infekce Herpetické infekce Při klinických studiích se herpetické infekce (virus Varicella-Zoster, virus Herpes simplex) vyskytly o něco častěji u pacientů léčených TYSABRI než u pacientů léčených placebem. Po uvedení přípravku na trh byly hlášeny závažné případy včetně fatálních u pacientů léčených přípravkem TYSABRI. 2.3 Léčba potenciálních oportunních infekcí Všichni pacienti, kteří jsou léčeni TYSABRI a u nichž se projevují příznaky infekcí, by měli být kompletně vyšetřeni. Je třeba zvážit časné vyšetření u specializovaného lékaře se zkušenostmi s diagnostikou a léčbou oportunních infekcí. V případech závažných infekcí se musí vynaložit veškeré úsilí na určení původce. Jestliže je diagnostikována závažná oportunní infekce, léčba TYSABRI musí být zastavena. 2.4 Progresivní multifokální leukoencefalopatie (PML) Epidemiologie Progresivní multifokální leukoencefalopatie (PML) je subakutně se rozvíjející neurodegenerativní onemocnění centrálního nervového systému (CNS), které je způsobeno virem JC (JCV). Byla popsána v třicátých letech 20. století a název byl poprvé použit v roce Poprvé byla popsána jako vzácná komplikace lymfoproliferativních onemocnění u pacientů ve středním věku a starších pacientů (Astrom, 1958). Byly rovněž hlášeny případy vyvolané imunosupresivní léčbou pacientů s autoimunitními poruchami a příjemců parenchymových orgánových transplantátů. 4
5 Výskyt PML vzrostl v důsledku pandemie HIV. U pacientů s HIV byla udávána 5% prevalence. Snížení mortality je spojováno se zavedením vysoce aktivní antiretrovirální terapie (HAART), která však nevede ke snížení výskytu PML u HIV pacientů (Koralnik, 2004). Analýza dvoustupňového testu vyšetření protilátek proti JCV (STRATIFY JCV) u více než pacientů s RS prokázala výskyt protilátek proti JCV přibližně u 55 % pacientů. U pacientů s RS se prevalence přítomnosti protilátek proti JCV zvyšovala s věkem a byla nižší u žen než u mužů ve všech testovaných kohortách. Tyto nálezy jsou v souladu s výsledky uváděnými v literatuře pro zdravé dospělé osoby získané využitím podobné metodologie (Egli, 2009; Kean, 2009; Knowles, 2003). Obecně se nezdá, že by prevalence protilátek proti JCV byla ovlivněna předchozím užíváním imunosupresiv nebo předchozím či současným užíváním TYSABRI Etiologie Onemocnění zasahuje subkortikální bílou hmotu (Safak a Khalili, 2003) a je způsobeno reaktivací viru JC, humánního polyomaviru (Berger et al, 1998). Spouštěče replikace JCV nejsou známy, ale mohou být následkem souběhu rizikových faktorů, kdy jedním z nich je narušený buněčný imunitní systém. Může to být následkem infekce HIV, systémové imunosuprese nebo používáním antineoplastických léčiv a dále vlivem některých zhoubných nádorů Patologie Replikace JCV v mozku způsobuje lytickou infekci oligodendrocytů, což má za následek rozsáhlou destrukci myelinu. V subkortikální bílé hmotě vznikají mikroskopické léze, které se zvětšují a mohou splývat s charakteristickým obrazem při vyšetření MRI. Příznaky odráží multifokální obraz demyelinizace. Vizuální, motorické a kognitivní zhoršení je přítomno téměř vždy s kortikální slepotou, výraznou slabostí jako je hemiparéza a behaviorálními poruchami. Další příznaky zahrnují senzorické defekty, závratě a záchvaty (Berger, 1998). Tyto příznaky stejně jako jejich rozvoj mohou pomoci odlišit nástup PML od typických příznaků relapsu RS, ale může existovat i určité překrytí Diagnóza EFNS vydala směrnice pro diagnózu a léčbu neurologických komplikací infekce HIV včetně PML (Portegies, 2004). Diagnostická kritéria uvádíme dále. Pomalu progredující fokální neurologické deficity s asymetrickými abnormalitami bílé hmoty na MRI naznačují přítomnost PML. Tyto léze jsou na T2 vážené MRI bez vychytávání Gd, hyperintenzní, bez mass efektu. Subkortikální U vlákna jsou postižena charakteristickým způsobem. Detekce JCV DNA v mozkomíšním moku pomocí PCR silně podporuje diagnózu, protože má senzitivitu 72 až 100 % a specificitu 92 až 100 % (Cinque et al, 1997). Pokud je CSF-PCR negativní, doporučuje se opakovat CSF-PCR jednou nebo dvakrát. Použití vysoce citlivého PCR testu na zjištění přítomnosti JCV DNA je důležité (např. mez <50 kopií/ml), protože u mnoha případů potvrzené PML se prokázal nízký počet kopií. Mozková biopsie zůstává konečným potvrzujícím testem, ale pozitivní CSF-PCR nabízí přijatelný důkaz. MRI prokázala, že je užitečným nástrojem vyšetřování možné PML (Whiteman, 1993) na podporu klinické diagnózy. Je-li k dispozici předchozí sken MRI jako reference, může pomoci při diferenciaci mezi PML a jinými neurologickými stavy, např. RS. Byl vypracován podrobný diagnostický algoritmus, který pomáhá lékařům vyhodnotit nové nebo zhoršující se neurologické příznaky u pacientů s RS léčených TYSABRI. Podrobně je popsán v bodě 3 tohoto dokumentu Prognóza Včasná diagnóza, zastavení podávání TYSABRI a využití technologie PLEX mohou zlepšit výsledek onemocnění PML u postižených pacientů. Analýza údajů u prvních 12 pacientů, kteří přežili 6 měsíců od stanovení diagnózy PML, ukázala, že přibližně jedna třetina měla po PML menší disabilitu, i když na druhé straně další třetina zůstala těžce postižena. Toto je lepší výsledek, než byl hlášen u PML spojené s jinými základními onemocněními (Marzochetti, 2009; Shitrit, 2005; Crowder, 2005). 5
6 2.5 PML u pacientů léčených přípravkem TYSABRI Během dlouhodobých předregistračních studií byly hlášeny dva případy PML u pacientů s RS a hodnocení úplné bezpečnosti odhalila jeden další případ v klinické studii pacientů s Crohnovou chorobou, což naznačuje riziko rozvoje tohoto onemocnění asi u 1/1 000 pacientů (95 % CI: 0,2 2,8) (Yousry, 2006). V poregistračním období je riziko PML dobře charakterizováno v prvních třech letech léčby a zůstává na podobné nebo mírně vyšší úrovni, než jaká byla vidět v klinických studiích. 2.6 Rizikové faktory PML Následující rizikové faktory byly spojeny s rozvojem PML během podávání TYSABRI: Délka léčby. U pacientů léčených po více než 2 roky se riziko PML zvyšuje s rostoucí dobou léčby. Počet pacientů exponovaných léčbě po dobu delší než 4 roky je v současnosti příliš nízký na to, aby bylo možné poskytnout rozumný odhad počtu nahlášených případů PML a odpovědět na otázku, zda se riziko PML zvyšuje i dále. Předchozí imunosupresivní terapie. Pacienti, kteří mají před zahájením léčby TYSABRI v anamnéze terapii imunosupresivem, jsou vystaveni zvýšenému riziku rozvoje PML; zvýšené riziko PML spojené s předchozím užíváním imunosupresiva se zdá být dalším rizikovým faktorem k délce podávání TYSABRI po více než 24 měsíců. Přítomnost protilátek proti JCV. Pacienti, kteří jsou pozitivní na přítomnost protilátek proti JCV, mají více než dvakrát vyšší riziko rozvoje PML ve vztahu k incidenci PML pozorované mezi všemi pacienty léčenými TYSABRI. Pacienti, kteří jsou pozitivní na přítomnost protilátek proti JCV, mají přibližně 16x vyšší riziko rozvoje PML, než pacienti, kteří jsou na protilátky proti JCV negativní. Pacienti, kteří mají všechny tři rizikové faktory pro PML (tj. dostávají TYSABRI více než 2 roky a dříve absolvovali imunosupresivní terapii a jsou pozitivní na protilátky proti JCV) mají nejvyšší riziko PML, přibližně 9 z léčených pacientů. Odhad různé úrovně rizika PML u různých podskupin pacientů je znázorněn na obrázku 1 níže. Obrázek 1: Odhadovaná incidence PML stratifikovaná podle rizikového faktoru Protilátky proti JCV Negativní Pozitivní 0,2 /1 000 Předchozí užívání imunosupresiv Expozice natalizumabu 1 24 měsíců měsíců Pozitivita protilátek proti JCV bez předchozího užívání imunosupresiv ~ 0,4/1 000 ~ 2,6/1 000 Pozitivita protilátek proti JCV při předchozím užíváním imunosupresiv ~ 1,2/1 000 ~ 8,3/1 000 Data pro více než čtyřletou expozici TYSABRI jsou omezená 6
7 Bez ohledu na přítomnost či nepřítomnost rizikových faktorů PML je nutné zachovat zvýšené sledování z důvodu rizika PML u všech pacientů léčených TYSABRI Vyšetřování protilátek proti JCV Vyšetření protilátek proti JCV v séru před zahájením podávání TYSABRI nebo u pacientů, kteří jsou již TYSABRI léčeni, ale kteří nebyli dříve testováni, může poskytnout dodatečné informace o úrovni rizika PML. Jestliže je pacient jednou pozitivní na přítomnost protilátek proti JCV, považuje se to za zvýšené riziko rozvoje PML a protilátky se později již nemusí znovu vyšetřovat. Vyšetření by se mělo provádět pouze pomocí vhodného a ověřeného testu. 3 DIAGNÓZA PML Včetně rozlišení mezi PML a relapsem RS 3.1 Všeobecné zásady Při poskytování péče pacientům s RS léčených TYSABRI by se měly zvažovat následující body: Všichni pacienti léčení přípravkem TYSABRI by měli být pravidelně klinicky sledováni, aby byla možná časná detekce změn neurologického stavu. Pokud se u pacientů léčených přípravkem TYSABRI objeví nějaké nové neurologické příznaky, vždy je třeba jako diagnózu zvážit PML. Doporučuje se udělat referenční kraniální sken MRI před léčbou, obvykle během 3 měsíců před zahájením podávání TYSABRI, a opakovat ho jednou za rok pro aktualizaci této reference. Může to pomoci při diferenciaci PML od RS u pacientů, u nichž se objeví nové neurologické příznaky během terapie. Také se doporučuje, aby ošetřující lékař při žádosti o kontrolní MRI vyšetření informoval radiologa o tom, že pro potřeby diferenciální diagnózy je třeba vzít v potaz i PML nebo jiné oportunní infekce. Ve všech případech, kde je indikováno další vyšetření změn neurologického stavu, se podávání TYSABRI musí přerušit a nesmí se obnovit, dokud nebude přesvědčivě vyloučena jiná patologie než RS. Při vysazení terapie TYSABRI na krátkou dobu (dny nebo týdny), se neočekává, že by byla narušena její účinnost, a to vzhledem k farmakodynamice léčiva. Rozhodnutí pozastavit podávání TYSABRI v jakémkoliv stádiu může být založeno na výchozím klinickém obrazu, rozvoji příznaků nebo známek a/nebo odezvě na léčbu kortikosteroidy. Podávání TYSABRI musí být natrvalo zastaveno, jestliže je PML potvrzena. Podávání TYSABRI je možné znovu zahájit teprve tehdy, až bude vyloučena diagnóza PML (v případě potřeby opakováním klinických, MRI a laboratorních vyšetření, pokud přetrvává klinické podezření na PML). 3.2 Klinické rozlišení mezi PML a relapsem RS Následující návod a algoritmus (obrázek 2) popisuje navrhovaný přístup ke klinickému hodnocení nových nebo zhoršujících se neurologických příznaků u pacientů s RS léčených TYSABRI. Nové nebo znova se vyskytnuvší příznaky by měly vyvolat pečlivé hodnocení s cílem posoudit základní patologii, např. RS nebo PML. Tabulka 1 zdůrazňuje klinické nálezy, které pomáhají odlišit RS od PML. Je třeba poznamenat, že tabulka nezahrnuje vše a mezi příznaky těchto dvou onemocnění může docházet ve velké míře k překrytí. Lékaři by měli vzít v úvahu, že klinický obraz PML nebo jiných oportunních infekcí lze obtížně odlišit od RS, zejména na počátku jeho rozvoje. Je důležité zaznamenat průběh a charakter dřívějších a současných příznaků, což usnadní péči o pacienty léčené přípravkem TYSABRI. 7
8 Tabulka 1. Klinický obraz RS a PML NÁLEZY UKAZUJÍCÍ NA: RS 1 PML 2 Nástup Akutní Subakutní Rozvoj Klinické nálezy Během hodin až dnů Normálně se stabilizuje Vyřeší se spontánně i bez terapie Diplopie Parestézie Paraparéza Optická neuritida Myelopatie Během týdnů Progresivní Afázie Behaviorální a neuropsychologická alterace Retrochiazmatické výpadky vizu Hemiparéza Epileptické záchvaty Jestliže klinický obraz naznačuje přítomnost PML, měla by se co nejdříve provést další vyšetření zahrnující hodnocení MRI (obrázek 3) a/nebo lumbální punkci a vyšetření mozkomíšního moku (CSF) (obrázek 4). Konečná diagnóza PML by se měla provádět pouze na základě klinického obrazu, nálezu na MRI a přítomnosti DNA JC viru v centrálním nervovém systému (CNS). Obrázek 2. Klinické hodnocení KLINICKÉ HODNOCENÍ NOVÝCH NEBO ZHORŠUJÍCÍCH SE NEUROLOGICKÝCH PŘÍZNAKŮ U RS PACIENTŮ LÉČENÝCH NATALIZUMABEM Příznaky zjištěné během sledování Anamnéza a vyšetření Pacient má nové neurologické příznaky Známky ukazující na RS 1 Klinický obraz? * Pokračovat v podávání TYSABRI Léčit jako relaps (steroidy?) 4 Známky ukazující na jinou patologii než RS 2,3 Klinický stav stabilizován nebo zlepšen? 5 NE Přerušit TYSABRI 6 Léčit jako relaps (steroidy?) 4 MRI / Lumbální punkce 1 Viz tabulka 1; 2 Viz tabulka 1; 3 Kliničtí lékaři by měli brát v úvahu kromě PML i jinou non RS patologii, zejména oportunní infekce.; 4 Relapsy by se měly léčit podle obvyklé klinické praxe. O krátkodobé léčbě steroidy lze uvažovat v případech, kdy je z klinických důvodů PML nepravděpodobná. Nedostatečná odezva na steroidy by měla být důvodem k dalšímu vyšetření.; 5 Klinické nálezy by se měly porovnat s těmi, které byly zaznamenány v klinickém obrazu této epizody.; 6 Jestliže je v klinickém obrazu nebo během dalšího sledování klinického stavu podezření na jinou patologii než RS, měly by se VŠECHNY další infuze odložit, dokud nebude definitivně vyloučena PML nebo jiné oportunní infekce. 8
9 3.3 Rozlišení mezi PML a relapsem RS pomocí MRI Standardní protokol MRI nejlépe bez a s kontrastní látkou pro sledování pacientů léčených TYSABRI je navržen tak, aby poskytoval nejlepší možné snímky jako pomůcku pro klinické rozhodování (Radue et al, 2005). Pro každý skener je třeba zvolit parametry sekvence MRI s ohledem na dobré zobrazení anatomie CNS a vizualizaci lézí RS. Konzistentní používání standardního protokolu MRI pomůže rozpoznat časné změny na MRI, zejména při podezření na PML kvůli klinickému obrazu. Navrhované indikace pro MRI mozku: a) Před zahájením podávání TYSABRI se doporučuje pořídit současné MRI jako referenci (obvykle max. 3 měsíce staré) a MRI vyšetření rutinně jednou ročně opakovat pro aktualizaci této reference. Může to pomoci při diferenciaci PML od RS u pacientů, u nichž se objeví nebo zhorší neurologické příznaky během terapie. b) Neočekávané klinické zhoršení/podezřelý klinický průběh (obrázek 2). Protokol MRI pro RS může trvat > 30 minut, proto se doporučuje pohodlná poloha. Pro dobré porovnání snímku s dalšími skeny je zásadně důležité zaujmutí stejné polohy dle stejných anatomických značek. Kopie každého zobrazení by se měla zachovat (elektronicky archivovat) pro následné hodnocení, pokud bude klinicky indikováno. Standardní protokol kraniální MRI pro všechny snímky: Síla pole skeneru 1,0 T tloušťka řezu 5 mm a žádná mezera Pokrýt celý mozek Orientace skenu na subkallosní linii (lokalizátor ve třech rovinách) Sagitální Sagitální zvětšený Požadované sekvence Sagitální FLAIR Axiální TSE PD/T2 Axiální FLAIR Axiální SE T1 před a po kontrastní látce Gd injekce 0,1 mmol/kg během 30 sekund > 5 minutové zpoždění po injekci kontrastní látky Doporučení pro sekvence MRI při RS: T2: TR ms Krátká: TE ms, dlouhá TE ms T1: TR ms TE ms FLAIR: TR ms TE ms, TI 2,500 ms 9
10 Obrázek 3. Hodnocení MRI (viz kapitola 3.1) Podávání TYSABRI se musí přerušit a nesmí se obnovit, dokud nebude přesvědčivě vyloučena jiná patologie než RS. Při podezření na PML na základě klinického obrazu a není-li MRI rychle dostupná, je třeba co nejdříve provést laboratorní vyšetření, např. lumbální punkci, pro vyloučení PML. HODNOCENÍ NOVÝCH NEBO ZHORŠUJÍCÍCH SE NEUROLOGICKÝCH PŘÍZNAKŮ POMOCÍ MRI u RS PACIENTŮ LÉČENÝCH NATALIZUMABEM Standardní protokol MRI s Gd Léze typické pro RS 1 Povaha lézí? Netypické pro RS, možná PML 1 nebo oportunní infekce 2 Klinické sledování (steroidy) 3 Klinický stav stabilizován nebo zlepšen? 4 NE Lumbální punkce ANO Znovu začít podávat TYSABRI 5 Pravidelné sledování 1 Viz tabulka 2. Porovnání s prvotním snímkem může napomoci při interpretaci MRI nálezu.; 2 Kliničtí lékaři by měli brát v úvahu kromě PML i jinou non-rs patologii, zejména oportunní infekce.; 3 Relapsy by se měly léčit podle obvyklé klinické praxe. O krátkodobé léčbě steroidy lze uvažovat v případech, kdy je z klinických důvodů PML nepravděpodobná. Nedostatečná odezva na steroidy by měla být důvodem k dalšímu vyšetření.; 4 Klinické nálezy by se měly porovnat s těmi, které byly zaznamenány v klinickém obrazu této epizody.; 5 Podávání TYSABRI je možné obnovit teprve tehdy, až bude definitivně vyloučena PML nebo jiné oportunní infekce na základě klinických nálezů a/nebo dalších vyšetření. 10
11 Tabulka 2. Parametry vizualizované na MRI Tyto parametry je nutné zvážit při diferenciální diagnóze RS a PML. (Je třeba uvést, že žádný z parametrů MRI není charakteristický pro onemocnění RS nebo PML) PARAMETR ROZTROUŠENÁ SKLERÓZA PROGRESIVNÍ MULTIFOKÁLNÍ LEUKOENCEFALOPATIE Orientace a lokalizace nových lézí Ohraničení Způsob rozšíření Mass efekt T2 vážené obrazy T1 vážené obrazy Sekvence FLAIR Vychytávání Atrofie Většinou fokální; může postihovat celý mozek a míchu, v bílé a případně i šedé hmotě Ostré okraje, většinou kruhové nebo ve tvaru prstu (zvláště periventrikulární léze), splývání s dalšími lézemi, mohou být postižena i U vlákna Zpočátku fokální léze se zvětšují v průběhu dnů nebo týdnů a později se velikost zmenšuje v průběhu měsíců Akutní léze vykazují určitý mass efekt Akutní léze: hyperintenzní centrum, izointenzní prstenec, diskrétní hyperintenzita mimo prstencovou strukturu Subakutní a chronické léze: hyperintenzní bez prstencové struktury Akutní léze: hustě hypointenzní (velké léze) nebo izointenzní (malé léze), zvyšující se intenzita signálu v čase u 80 procent, klesající intenzita signálu (axonální ztráta) u přibližně 20 procent Hyperintenzní, ostře ohraničené Akutní léze: husté homogenní vychytávání, ostré okraje a pokrývá celé rozšíření nové léze Subakutní léze: prstencové vychytávání s případným rozlišením během 1 2 měsíců Chronické léze: žádné vychytávání Fokální atrofie je možná kvůli fokální degeneraci bílé hmoty, bez progrese Difúzní a asymetrické léze (zpočátku někdy unifokální, ale často multifokální nebo difuzně rozšířené), hlavně subkortikální a vzácně periventrikulární, umístěné téměř výlučně v bílé hmotě, příležitostné rozšíření do hluboké šedé hmoty. Nález je často lokalizován v zadní jámě (mozeček, thalamus a bazální ganglia), ne v míše Špatně definované okraje, infiltrace, nepravidelného tvaru, omezené na bílou hmotu, nezasahují do šedé hmoty; tlačí proti cerebrálnímu kortexu, U vlákna poškozena vždy Léze se homogenně, stále a často rychle rozšiřují do sousedících (multifokální) a nesousedících (difuzně rozšířené) oblastí, nedochází ke spojování s dalšími lézemi, omezeny na bílou hmotu, nezasahují do kortexu Bez mass efektu i u větších lézí (ale léze mírně přiléhají k cerebrálnímu kortexu) Difúzně hyperintenzní, mírně vyšší intenzita nově poškozených oblastí v porovnání se staršími oblastmi, poněkud nepravidelná intenzita signálu lézí, někdy granulární vzhled Mírně hypointenzní při nástupu, přičemž intenzita signálu klesá v čase a podél zasažené plochy, žádné reverze intenzity signálu Upřednostňovaná sekvence pro diagnózu PML, protože hyperintenzita léze je patrnější, více informací o rozsahu léze než u T2 vážených obrazů, zejména u koronárních řezů Určité vychytávání bylo do dnešní doby pozorováno asi u poloviny případů, často ostrůvkovitého typu. Někdy je možné určité periferní vychytávání Bez fokální atrofie 11
12 3.4 Laboratorní rozlišení mezi PML a relapsem RS Tento algoritmus navrhuje, jak laboratorní vyšetření může být integrováno s klinickým hodnocením a MRI u pacientů léčených TYSABRI (obrázek 3). Zjištění JCV DNA v mozkomíšním moku u symptomatických pacientů potvrzuje diagnózu PML. Negativní výsledek PCR na přítomnost JCV by však neměl vyloučit možnou diagnózu PML. V závislosti na klinickém obrazu a dostupnosti MRI může být analýza mozkomíšního moku provedena dříve. Pokud JCV DNA není detekována a zůstává-li klinické podezření na PML vysoké, měla by se lumbální punkce provést opakovaně. Není-li při opakovaném testování v CSF detekována JCV DNA, zejména při provedení pomocí testu, jehož limit kvantifikace (LOQ) má nižší citlivost než doporučených 50 kopií/ml (viz níže), a zůstává-li podezření na základě klinického vyšetření a MRI vysoké, mělo by se zvážit provedení biopsie mozku. Mozkomíšní mok (CSF) získaný lumbální punkcí (LP): Dodržujte místní standardní postup pro LP. Odeberte požadované množství pro běžnou analýzu CSF (např. glukóza, proteiny a buňky). Předejte vzorek k analýze do místní laboratoře v souladu s místními postupy. Dalších 5 ml na PCR analýzu viru JC by mělo být odebráno, aby se zajistilo, že pro analýzu budou k dispozici nejméně 2 ml. Navrhovaný postup přípravy mozkomíšního moku na PCR analýzu: Pipetou na jedno použití převeďte nejméně 0,5 ml CSF do 4 kryolahviček (např. nádoby s plastickým šroubovacím uzávěrem Nunc) pro PCR analýzu JCV. Na každou lahvičku zapište identifikaci osoby, typ vzorku (např. CSF) a datum odběru vzorku. Vzorky CSF, odesílané na analýzu DNA by měly být pokud možno bez krve a nejlépe by měly pocházet z poslední odebrané zkumavky. První zkumavka s odběrem by se neměla používat pro DNA analýzu, ledaže je to jediný dostupný vzorek. Pokud bude vzorek kontaminován krví, uveďte to na lahvičce a na formuláři připojeném ke vzorku, který se odesílá do laboratoře na analýzu. Zmrazte na 70 C (nebo na 20 C, pokud 70 C není k dispozici). Odešlete dvě zmrazené lahvičky do laboratoře a zbylé lahvičky uchovávejte jako zálohu. Všechny zbylé vzorky by se měly uchovávat ve zmrazeném stavu pro případ, že budou požadovány dodatečné vzorky nebo další testování. Je důležité, aby se vzorky zmrazily co nejdříve po odběru. Pokud okamžité zmrazení není možné, vzorky by se měly uchovávat při teplotě 4 C až do doby zmrazení. Analýza CSF na JCV DNA Vzorky CSF je třeba analyzovat co nejrychleji, aby se usnadnila diagnóza PML. Analýzy musí být založeny na metodologii kvantitativní PCR v reálném čase, aby došlo k maximalizaci citlivosti a specifičnosti detekce. Doporučuje se použít analýzu s limitem kvantifikace (LOQ) 50 kopií/ml. PCR vyšetření CSF na přítomnost JCV DNA je možné realizovat v následujících laboratořích: Department of Virology, Medical University Vienna Kinderspitalgasse 15 A-1095 Vienna Tel Fax E: probenannahme-virologie@meduniwien.ac.at Pokud podezření na PML na základě klinického stavu nebo MRI vyšetření přetrvává i přes negativní výsledek místní nebo referenční laboratoře na JCV pomocí PCR, a zejména pokud je výsledek založen na analýze, jejíž LOQ je méně citlivý než doporučovaných 50 kopií/ml, doporučuje se provést další test na JCV DNA (s týmž 12
13 nebo čerstvým vzorkem CSF). Doporučuje se vzorky testovat v laboratoři, která je schopna při vyšetření kvantifikovat 50 kopií JCV/ml. Biogen Idec nemůže certifikovat žádnou laboratoř. V současné době, ke dni sestavení těchto materiálů, však Biogen Idec zná centrální laboratoř (Focus Diagnostics, Cypress, Kalifornie), která jako doplněk k provedenému počátečnímu testování může nabídnout referenční testování téhož nezpracovaného nebo čerstvého vzorku CSF od pacienta. Test JCV DNA prováděný Focus Diagnostics má spodní hranici limitu kvantifikace 50 kopií/ml, jak bylo stanoveno během validace testu. Test má spodní hranici limitu detekce (LLOD) pod 50 kopiemi/ml. Tato úroveň detekce je diagnosticky relevantní, protože PML byla prokázána u pacientů s nízkým počtem kopií v CSF. Jsou-li výsledky z Focus Diagnostics negativní a výsledky MRI vyšetření a klinické symptomy stále ukazují na výskyt PML u pacienta, vzorky by měly být neprodleně zaslány pro potvrzení JCV v CSF do laboratoře Dr. Majora v National Institute of Health, protože toto zařízení má k dispozici zatím nejcitlivější test na vyšetření JCV. Eugene O. Major, Ph.D. National Institutes of Health, Laboratory of Molecular Medicine and Neuroscience 10 Center Drive, Building 10, Room 3B14 Bethesda, MD Informace o způsobu přepravy vzorků do centrálního zařízení Vám poskytne medicínské oddělení společnosti Biogen Idec (Czech Republic) s.r.o., Na Pankráci 1683/127, Praha 4, tel: , mobil: , iva.fenclova@biogenidec.com. 13
14 Obrázek 4. Laboratorní diferenciace (viz kapitola 3.1) Podávání TYSABRI se musí přerušit a nesmí se obnovit, dokud nebude přesvědčivě vyloučena jiná patologie než RS. LABORATORNÍ HODNOCENÍ NOVÝCH NEBO ZHORŠUJÍCÍCH SE NEUROLOGICKÝCH PŘÍZNAKŮ U RS PACIENTŮ LÉČENÝCH NATALIZUMABEM Lumbální punkce NE JCV DNA PCR pozitivní Klinický stav stabilizován nebo zlepšen? 1 NE Další vyšetření MRI a/nebo CSF ANO (Opakovaný) standardní protokol MRI s GD (po 2 měsících) 6 ANO ANO Podrobné klinické sledování 2 (steroidy?) NE Nové nebo rozvíjející se atypické léze? ANO Klinický stav stabilizován nebo zlepšen? NE (Opakovaná) lumbální punkce (po 2 3 týdnech) 5 ANO JCV DNA PCR pozitivní? ANO Znovu začít podávat TYSABRI 5 NE Pravidelné sledování Vyšetřit na jiné non RS onemocnění než PML Léčit jako PML 1 Klinické nálezy by se měly porovnat s těmi, které byly zaznamenány v klinickém obrazu této epizody.; 2 Podrobné klinické sledování by se mělo opakovat nejméně po 2 týdnech. Relapsy by se měly léčit podle obvyklé klinické praxe. O krátkodobé léčbě steroidy lze uvažovat v případech, kdy je z klinických důvodů PML nepravděpodobná. Nedostatečná odezva na steroidy by měla být důvodem k dalšímu vyšetření.; 3 Podávání TYSABRI by se mělo obnovit pouze tehdy, až bude definitivně vyloučena PML nebo jiné oportunní infekce na základě klinických nálezů a/nebo dalších vyšetření.; 4 Kliničtí lékaři by měli zvážit i jinou non RS patologii než PML, zejména oportunní infekce nebo zvážit provedení biopsie mozku pro potvrzení/vyloučení přítomnosti JCV.; 5 Pokud přetrvávají agresivní klinické příznaky, opakované testování urychlete.; 6 Nebo v případě potřeby dříve. 14
15 4 LÉČBA PML Použití antivirových léčiv, jako jsou cidofovir a cytarabin, se ukázalo v léčbě PML neúčinné, pokud jde o zlepšení výsledku u pacientů s PML (Hall, 1998; Aksamit, 2001; Marra, 2002; Gasnault, 2001). Zdá se, že nejefektivnější léčbou je rekonstituce imunity (obnovení normálních imunitních funkcí), a to na základě důkazů z dvou oblastí výzkumu. První je oblast HIV, kde pokud dojde ke vzniku PML u neléčeného pacienta, může zavedení HAART zvrátit průběh nemoci a zlepšit výsledek. Zadruhé u transplantovaných pacientů, kteří trpí PML, lze zlepšit výsledek, jestliže je možné snížit imunosupresi. Dostupné údaje naznačují, že včasné rozpoznání a léčba PML může výsledek zlepšit (Antinori et al, 2003; Berenguer et al, 2003; Clifford et al, 1999; Crowder et al, 2005; Geschwind et al, 2001; Shitrit et al, 2005). Je možné, že včasné rozpoznání PML a vysazení TYSABRI může vést k obnovení imunity, které přispělo k přežití pacienta s RS, jak uvádí Langer-Gould a kolegové (2005). Účinek výměny plasmy na clearance a farmakodynamiku TYSABRI byl proto hodnocen ve studii s 12 pacienty s RS. Odhadované celkové množství odstraněné látky po 3 výměnách plasmy (v rozmezí 5 8 dní) se pohybovalo přibližně kolem % (Khatri et al, 2009). To můžeme porovnat s přibližně 40 % pozorovanými v dřívějších studiích, ve kterých se měření provádělo po podobně dlouhé období po vysazení léku. Tyto údaje rovněž naznačují, že k důslednějšímu snížení koncentrací natalizumabu pod subterapeutické hladiny by bylo zapotřebí provést další výměny plasmy (celkem až 5 během 10 dní). Může to být užitečné pro rychlejší obnovení imunokompetence v mozku, což by mohlo napomoci při stabilizaci PML. Klinický přínos výměny plasmy nebo imunoadsorpce k odstranění TYSABRI a urychlení imunitní obnovy není znám. Než bude možno učinit jakékoli rozhodné závěry o klinickém přínosu tohoto zákroku, je třeba provést analýzu dalších případů společně s hodnocením dlouhodobého klinického stavu pacientů po výměně plasmy nebo imunoadsorpci. Lékaři si kromě toho musí být vědomi jednoho důsledku imunitní obnovy prováděné s cílem vyléčit PML: než se projeví zlepšení, může se objevit tzv. imunorestituční zánětlivý syndrom (IRIS, viz níže) s doprovodným klinickým zhoršením. Tento klinický stav byl pozorován až dosud u většiny případů PML vzniklých po uvedení přípravku na trh. 4.1 Imunorestituční zánětlivý syndrom (IRIS) Klinické neurologické zhoršení u pacientů s PML může být způsobeno destrukcí tkáně CNS zprostředkovanou JCV nebo při obnově imunitní funkce intracerebrální imunitní zánětlivou reakcí známou jako imunorestituční zánětlivý syndrom (IRIS). Podezření na IRIS vzniká především tehdy, jestliže pacienti s PML vykazují příznaky klinického zhoršení, doprovázené obvykle, avšak ne vždy, vychytáváním gadolinia PML lézemi, což se může a nemusí projevit na výsledku MRI. Klinické zhoršení je důsledkem lokální zánětlivé reakce včetně otoku a projevuje se jako zhoršení neurologických symptomů včetně hemiparézy, ataxie, poruch řeči a zraku, kognitivních změn/změn chování a záchvatů (v závislosti na lokalizaci IRIS). Tento stav může mít těžké následky včetně komatu a úmrtí. Přestože by se dalo očekávat, že množství viru JC v CSF se při IRIS sníží, je rovněž možné, že se může zvýšit kvůli narušení hematoencefalické bariéry (HEB) a uvolnění JCV z buněk rozložených během IRIS. U pacientů s HIV se IRIS obvykle objevuje do 2 až 3 měsíců od zahájení HAART. U pacientů léčených přípravkem TYSABRI dochází k rozvoji IRIS v rozmezí dní až několika týdnů po odstranění TYSABRI výměnou plasmy (PLEX) nebo imunoabsorpcí (IA). Ačkoli zánětlivá reakce po imunorestituci může být nezbytným krokem k odstranění buněk infikovaných virem JC, léčba aktivní zánětlivé reakce se může stát nezbytnou k zabránění potenciální škody vyvolané IRIS (Talan, 2009; Elston a Thacker, 2009). Stav může ohrožovat život a může proto vyžadovat léčbu na jednotce intenzivní péče. Proto může být po PLEX nebo IA užitečné pravidelné klinické monitorování pacientů včetně monitorování MRI, aby se IRIS detekoval včas. Diagnóza a léčba IRIS je kontroverzní záležitostí a ohledně terapie dosud neexistuje konsensus. Nedávno však bylo navrženo, že k léčbě IRIS by mohly být užitečné kortikosteroidy, zejména u pacientů s těžkým až život ohrožujícím IRIS (Tan et al, 2009; Clifford et al, 2010). V literatuře se uvádí následující terapeutický režim pro případ IRIS: 1) Perorálně prednison 1,5 mg/kg/den po dobu 2 týdnů s postupným snižováním po dobu 2 měsíců. 2) Intravenózně methylprednisolon (1 g/den po 3 nebo 5 dní) s perorálním snižováním po dobu 2 měsíců. Pokud dojde během snižování dávky steroidů k dalšímu zhoršení a je to považováno za důsledek pokračujících nebo nových zánětlivých reakcí, může být zapotřebí další kúra vyššími dávkami steroidů. Profylaktická terapie steroidy se v současné době nedoporučuje. Vzhledem k tomu, že vědecké a medicínské poznatky včetně diagnostických kritérií i terapie IRIS se rychle vyvíjejí, kontaktuje prosím příslušné státní lékařské a regulační autority, aby Vám poskytly nejaktuálnější informace o terapeutických doporučeních. 15
16 5 NEŽÁDOUCÍ REAKCE SPOJENÉ S INFUZEMI 5.1 Přecitlivělost Ve dvouletých kontrolovaných klinických studiích s pacienty s RS se hypersenzitivní reakce vyskytovaly až u 4 % pacientů. Anafylaktické/anafylaktoidní reakce se vyskytly u méně než 1 % pacientů užívajících TYSABRI. Všichni pacienti se uzdravili bez následků. K hypersenzitivním reakcím obvykle došlo během infuze nebo do 1 hodiny po skončení infuze. Riziko hypersenzitivity bylo nejvyšší u počátečních infuzí a u pacientů při opětovné expozici TYSABRI následující po počáteční krátké expozici (jedna nebo dvě infuze) a dlouhém období (3 měsíce nebo déle) bez léčby. Riziko hypersenzitivních reakcí by však mělo být zvažováno pro každou podávanou infuzi. 5.2 Léčba hypersensitivních reakcí spojených s infuzí v klinické praxi Je třeba, aby byly k dispozici prostředky pro zvládnutí hypersenzitivních reakcí. Po naředění je infuzi třeba aplikovat po dobu přibližně 1 hodiny a pacienty je třeba během infuze a 1 hodinu po jejím skončení sledovat, zda nevykazují příznaky hypersenzitivní reakce. Při jakékoliv hypersenzitivní reakci během infuze (např. kopřivka se systémovými příznaky či bez nich, anafylaxe) by mělo být podávání léčiva neprodleně přerušeno a zachován vaskulární přístup pro neodkladnou léčbu a podávání tekutin. Okamžité hypersenzitivní reakce by měly být léčeny podle závažnosti reakce a standardního léčebného postupu daného zdravotnického zařízení. U pacientů, u kterých se objevila hypersenzitivní reakce, musí být terapie přípravkem TYSABRI trvale ukončena. 5.3 Jiné nežádoucí reakce spojené s infuzemi Ve dvouletých kontrolovaných klinických studiích s pacienty s RS byla příhoda spojená s infuzí definována jako nežádoucí účinek, který se vyskytl v průběhu infuze nebo během 1 hodiny od ukončení infuze. K tomu došlo u 23,1 % pacientů s RS léčených TYSABRI (placebo: 18,7 %). Infuzní reakce se taktéž vyskytovaly častěji u pacientů při opětovné expozici TYSABRI následující po počáteční krátké expozici (jedna nebo dvě infuze) a dlouhém období (3 měsíce nebo déle) bez léčby. Kromě uváděných hypersenzitivních reakcí, příhody, které byly hlášeny častěji u TYSABRI než u placeba, zahrnovaly závratě, nauseu, kopřivku a ztuhlost. Tyto příhody byly obvykle mírné z hlediska závažnosti, ustaly po skončení infuze a nevyžadovaly přerušení léčby. Jestliže jsou individuální příznaky obtěžující, může být vhodná symptomatická léčba. O takových případech však nejsou žádné údaje. 5.4 Protilátky proti natalizumabu v klinické praxi Přibližně po 6 měsících terapie jestliže dochází ke snížení účinnosti nebo perzistenci nežádoucích účinků pojících se s infuzemi, by se mělo myslet na přítomnost perzistentních protilátek (pacienti s hypersenzitivní reakcí by měli být vyřazeni z léčby). V těchto případech by měla být vyšetřena přítomnost protilátek, a budou-li i nadále pozitivní v opakovaném testu po 6 týdnech, léčba by se měla ukončit, protože perzistentní protilátky jsou spojovány s významným snížením účinnosti TYSABRI a zvýšenou incidencí hypersenzitivních reakcí. Vzhledem k tomu, že riziko hypersenzitivity je vyšší při obnovení podávání TYSABRI u pacientů po počáteční krátké expozici a dlouhém období bez léčby, přítomnost protilátek by měla být vyšetřena před obnovením podávání, a budouli i nadále pozitivní v opakovaném testu po 6 týdnech, v léčbě by se nemělo pokračovat. Vyšetření protilátek proti natalizumabu je možné realizovat v následující laboratoři: Neurologisches Routinelabor Medical University Innsbruck Anichstrasse 35 A-6020 Innsbruck Tel.: Fax: E: neuro.labor@uki.at 16
17 6 POUČENÍ Lékaři musí informovat pacienty o přínosech a rizicích TYSABRI a předat jim před zahájením terapie Kartu pacienta (viz příloha 3) a poté je pravidelně informovat o riziku vzniku PML. Vzhledem ke zvýšení rizika rozvoje PML s rostoucí délkou terapie je třeba, aby odborný lékař a pacient znovu individuálně přehodnotili přínos a riziko terapie přípravkem TYSABRI. Pacient by měl být o rizicích přípravku TYSABRI, zejména o zvýšeném riziku PML, opakovaně informován po 24 měsících a on i jeho ošetřovatelé by měli být poučeni o časných objektivních a subjektivních příznacích PML. Vzorové Formuláře při zahájení a pokračování léčby jsou uvedeny v příloze 4. Monitorování pacientů léčených TYSABRI je zajištěno zřízením národního registru TOP, který zahrne i všechny pacienty účastnící se neintervenční observační studie TOP (TYSABRI Observational Program). Proto je velmi důležité začlenit a vést dokumentaci všech pacientů léčených TYSABRI již ve studii TOP. Získaná bezpečnostní data jsou nezbytná pro lékaře i pacienty a pro všeobecnou informovanost o bezpečnosti léčby přípravkem TYSABRI. Žádáme Vás laskavě o nahlášení všech podezření na výskyt PML v souvislosti s léčbou TYSABRI a také všech podezření na ostatní závažné nebo neočekávané nežádoucí účinky TYSABRI na formuláři Hlášení podezření na nežádoucí účinek léčiva (ke stažení na a zaslání na adresu Oddělení farmakovigilance SÚKL Šrobárova 48, Praha 10 nebo na adresu společnosti Biogen Idec (Czech Republic) s.r.o. Na Pankráci 1683/ Praha Informování pacientů o přínosech a rizicích Příbalová informace (PIL), která je obsažena v každém balení TYSABRI, vysvětluje jak výhody, tak rizika jazykem, který je pro pacienty dobře srozumitelný (u pacientů s RS to potvrdily testy srozumitelnosti). Příbalová informace je přiložena jako součást tohoto balíčku (příloha 2). Lékař by se měl seznámit s PIL dříve, než bude s pacientem probírat léčbu přípravkem TYSABRI. Lékaři by pacienty měli informovat o tom, že je důležité užívat dávky TYSABRI bez přerušení, zejména v průběhu počátečních měsíců léčby (viz bod 5.1 Přecitlivělost). Formuláře při zahájení a pokračování léčby popisují specificky riziko PML při terapii přípravkem TYSABRI (viz příloha 4). Je třeba, aby pacienti tyto formuláře dostali před zahájením a po 24 měsících terapie, aby se zajistila jejich plná informovanost o riziku PML. 6.2 Karta pacienta Pacientům musí být vydána Karta pacienta. Připomíná pacientům, že kvůli rizikům PML souvisejících s TYSABRI se musí obrátit na svého lékaře, pokud mají pocit, že se jejich RS zhoršuje nebo pokud oni nebo jejich rodinní příslušníci zaznamenají nové příznaky, jako jsou změny v náladě, chování, paměti, motorické slabosti či problémy v řeči a komunikaci. Partneři a ošetřovatelé by informace uvedené v Kartě pacienta měli znát také. Karta obsahuje místo k uvedení kontaktů, na které se pacient může obracet se svými dotazy. Ošetřující neurolog musí tuto část vyplnit při vystavení Karty. Karty pacienta jsou přiloženy jako součást tohoto balíčku pro lékaře (viz příloha 3). Další karty lze objednat u místního zastoupení Biogen Idec, kontaktní údaje jsou obsaženy v balíčku. 17
18 7 LITERATURA Aksamit AJ. Treatment of non-aids progressive multifocal leukoencephalopathy with cytosine arabinoside. J Neurovirol 2001;7: Albrecht H, Hoffmann C, Degen O, et al. Highly active antiretroviral therapy significantly improves the prognosis of patients with HIV-associated PML. AIDS 1998;12: Antinori A, Cingolani A, Lorenzini P, et al. Clinical epidemiology and prolonged survival of progressive multifocal leucoencephalopathy in AIDS related lymphomas responding tothe era of highly active antiretroviral therapy: data from the Italian registry investigative neuroaids (IRINA). J Neurovirol 2003;9 Suppl 1: Astrom KE, Mancall EL, Richardson EP Jr. Progressive multifocal leukoencephalopathy, a hitherto unrecognized complication of chronic lymphatic leukaemia and Hodgkin s disease. Brain 1958;81: Berenguer J, Miralles P, Arrizabalanga J et al. Clinical course and prognostic factors of progressive multifocal leukoencephalopathy in patients treated with highly active antiretroviral therapy. Clin Infect Dis Apr 15;36(8): Berger JR, Pall L, Lanska D et al. PML in patients with HIV infection. J Neurovirol 1998;4: Cinque P, Scarpellini P, et al. Diagnosis of central nervous system complications in HIV-infected patients: cerebrospinal fluid analysis by the polymerase chain reaction. AIDS 1997;11:1 17. Clifford DB, Yiannoutsos C, Glicksman M, et al. HAART improves prognosis in HIV-associated progressive multifocal leukoencephalopathy. Neurology 1999;52: Clifford DB, DeLuca A, Simpson DM, Arendt G, Giovanonni G, Nath A. Natalizumab-associated progressive multifocal leukoencephalopathy in patients with multiple sclerosis: lessons from 28 cases, Lancet Neurology 2010:9; Crowder CD, Gyure KA, Drachenberg CB, et al. Successful outcome of progressive multifocal leukoencephalopathy in a renal transplant patient. Am J Transplant 2005;5: Egli A, Infanti L, Dumoulin A, Buser A, Samaridis J, Stebler C, Gosert R, Hirsch HH. Prevalence of Polyomavirus BK and JC Infection and Replication in 400 Healthy Blood Donors. J Infect Dis 2009 Mar 15;199(6): Elston JW and H Thaker. Immune Reconsititution Inflammatory Syndrome. International Journal of STD and AIDS 2009;20: Gasnault J, Kousignian P, Kahraman M, et al. Cidofovir in AIDS-associated progressive multifocal leukoencephalopathy: a monocenter observational study with clinical and JC virus load monitoring. J Neurovirol 2001;7: Geschwind MD et al. The relative contributions of HAART and alpha-interferon for therapy of progressive multifocal leukoencephalopathy in AIDS. Journal of Neurovirology 2001;7(4): Hall CD, Dafni U, Simpson D, et al. Failure of cytarabine in progressive multifocal leukoencephalopathy associated with human immunodeficiency virus infection. AIDS Clinical Trial Groups 243 Team. N Engl J Med 1998; Kean JM, Rao S, Wang M, Garcea RL. Seroepidemiology of human polyomaviruses. PLoS Pathog 2009 Mar;5(3):e Kleinschmidt-DeMasters BK, Tyler KL. Progressive Multifocal Leukoencephalopathy Complicating Treatment with Natalizumab and Interferon Beta-1a for Multiple Sclerosis. N Engl J Med 2005;353: Khatri BO, Man S, Giovannoni G, et al. The effect of plasma exchange in accelerating clearance of natalizumab in patients with multiple sclerosis: Results of the PLEX study. Multiple Sclerosis 13, Supplement 2, October 2007, Abstract P576: S172clearance and restoring leukocyte function. Neurology 2009;72: Knowles WA, Pipkin P, Andrews N, Vyse A, Minor P, Brown DWG, Miller E. Population-based study of antibody to the human polyomaviruses BKV and JCV and the simian polyomavirus SV40. J Med Virol 2003 Sep;71(1): Koralnik IJ. New insights into progressive multifocal leukoencephalopathy. Curr Opin Neurol 2004;17: Langer-Gould A, Atlas S. Progressive Multifocal Leukoencephalopathy in a Patient Treated with Natalizumab. N Engl J Med 2005;353: Marra CM, Rajicic N, Barker DE, et al. A pilot study of cidofovir for progressive multifocal leukoencephalopathy in AIDS. AIDS 2002;16: Erratum in AIDS 2002;17:281. Portegiesa P,Solodb L Guidelines for the diagnosis and management of neurological complications of HIV infection. Eur J Neurol 2004;11: Radue E.W, Mueller-Lenke N., van Buchem N, Jaeger R, Miller D., Yousry T. Personal communication of a Consensus meeting by expert MRI panel
19 Rudick RA, Sandrock A. Natalizumab: alpha 4-integrin antagonist selective adhesion molecule inhibitors for MS. Expert Rev Neurother 2004;4: Safak M, Khalili K. An overview: Human polyomavirus JC virus and its associated disorders. J Neurovirol 2003;9(Suppl 1):3 9. Shitrit D, Lev N, Bar-Gil-Shitrit A, Kramer MR. Progressive multifocal leukoencephalopathy in transplant recipients. Transpl Int 2005;17: Talan J. HAART therapy for HIV-AIDS prompts PML and Immune Reconstitution Inflammatory Syndrome. Neurology Today 2009 Feb:8-9. Tan K, Roda R, Ostrow L et al. PML-IRIS in patients with HIV infection. Clinical manifestations and treatment with steroids. Neurology 2009;72: Tremlett H, Seemuller S, Zhao Y et al. Liver test abnormalities in multiple sclerosis: Findings from placebo-treated patients. Neurology 2006;67: van Assche G,van Ranst M, Progressive Multifocal Leukoencephalopathy after Natalizumab Therapy for Crohn s Disease. N Engl J Med 2005;353: von Andrian UH, Englehardt B. Alpha4 Integrins as Therapeutic Targets in Autoimmune Disease. N Engl J Med 2003;348: Whiteman ML, Post MJ, Berger JR, Tate LG, Bell MD, Limonte LP. Progressive multifocal leukoencephalopathy in 47 HIV seropositive patients: neuroimaging with clinical and pathologic correlation. Radiology 1993;187: Yousry TA, Major EO, et al. Evaluation for progressive multifocal leukoencephalopathy in patients treated with natalizumab. N Engl J Med 2006;355: PŘÍLOHY Příloha 1. Souhrn údajů o přípravku (SPC) Příloha 2. Příbalová informace (PIL) Příloha 3. Karta pacienta Příloha 4. Formuláře při zahájení a pokračování léčby 19
20 ZKRÁCENÁ INFORMACE O LÉČIVÉM PŘÍPRAVKU TYSABRI. Název přípravku: TYSABRI 300 mg koncentrát pro přípravu infuzního roztoku. Složení: 20mg natalizumabu/1ml koncentrátu. Rekombinantní humanizovaná protilátka proti α4-integrinu produkovaná linií myších buněk na základě technologie rekombinantní DNA. Terapeutické indikace*: TYSABRI je indikován v monoterapii jako léčba upravující onemocnění u pacientů s vysoce aktivní relabující remitující roztroušenou sklerózou (RR RS) pro následující skupiny pacientů: pacienti s vysokou aktivitou onemocnění navzdory léčbě interferonem beta nebo pacienti s rychle se vyvíjející těžkou RR RS. Dávkování: TYSABRI 300 mg i.v. infuzí 1x za 4 týdny po dobu 1 hodiny. Pacienti se musí sledovat během infuze a 1 hodinu po dokončení infuze. Kontraindikace: Hypersenzitivita na složky přípravku. Progresivní multifokální leukoencefalopatie (PML). Pacienti se zvýšeným rizikem oportunních infekcí (OI) včetně pacientů s narušenou imunitou (včetně pacientů podstupujících imunosupresivní terapie nebo těch, u nichž došlo k narušení imunity předchozími terapiemi, např. mitoxantronem nebo cyklofosfamidem). Kombinace s interferony beta nebo glatiramer acetátem. Známá aktivní maligní onemocnění s výjimkou pacientů s bazaliomem. Děti a mladiství. Upozornění pro použití*: PML: Použití TYSABRI bývá spojováno se zvýšeným rizikem PML, oportunní infekcí vyvolanou JC virem, která může být fatální nebo vést k těžké invaliditě. Riziko vzniku PML se zvyšuje s délkou podávání přípravku, zvláště pokud léčba trvá déle než dva roky, předchozím užíváním imunosupresivních léčiv a přítomností anti JCV protilátek. Před zahájením léčby musí být k dispozici současné (max. 3 měs. staré) MRI jako referenční obraz a toto vyšetření se musí opakovat každý rok. Při zahájení léčby a po dvou letech léčby musí být pacienti informováni o zvýšeném riziku PML a poučeni o časných známkách a příznacích PML. Pro stratifikaci rizika před nebo v průběhu léčby může testování anti JCV protilátek poskytnout podpůrné informace. Pacienti musí být sledováni v pravidelných intervalech. Jestliže se objeví nové neurologické příznaky, další podávání se musí pozastavit, dokud nebude PML vyloučena. Lékař musí sledovat příznaky ukazující na PML, kterých si pacient nemusí všimnout (např. kognitivní nebo psychiatrické příznaky). Jestliže se u pacienta vyvine PML, podávání musí být trvale ukončeno. PML a IRIS (imunorestituční zánětlivý syndrom): IRIS se vyskytuje téměř u všech pacientů s PML léčených TYSABRI po vysazení TYSABRI nebo jeho eliminaci z oběhu. IRIS je považován za důsledek obnovy funkce imunitního systému u pacientů s PML. Jiné OI: Při používání TYSABRI byly hlášeny jiné OI u pacientů s narušenou imunitou, zvláště s Crohnovou nemocí a s významnou komorbiditou i u pacientů s RS léčených TYSABRI jako monoterapií. Jestliže je podezření na OI, dávkování je třeba pozastavit, dokud nebude OI vyloučena. Jestliže se u pacienta vyvine OI, podávání musí být trvale ukončeno. Poučení: Každý předepisující lékař se musí obeznámit s Informacemi pro lékaře a Pokyny k léčbě. Lékaři musí s pacientem projednat výhody a rizika léčby a předat mu Kartu pacienta. Lékař a pacient musí podepsat Formulář o zahájení či pokračování léčby (po 2 letech léčby) a pacient musí informovat svého lékaře o léčbě TYSABRI, pokud má jakoukoli infekci. Hypersenzitivita: S přípravkem byly spojovány hypersenzitivní reakce včetně závažných systémových reakcí, ke kterým došlo do 1 hodiny po dokončení infuze. Riziko bylo nejvyšší u počátečních infuzí a u pacientů při opětovné expozici následující po počáteční krátké expozici (jedna nebo dvě infuze) a dlouhodobém období (3 měsíce nebo déle) bez léčby. Pacienti, u nichž se objevila hypersenzitivní reakce, musí být trvale vyřazeni z léčby TYSABRI. Současná či předchozí léčba imunosupresivy: Pacienti s anamnézou léčby imunosupresivními léčivy včetně cyklofosfamidu a mitoxantronu mohou trpět prolongovanou imunosupresí, a proto mohou mít zvýšené riziko PML. V kombinaci s TYSABRI lze používat krátké kúry kortikosteroidy. Imunogenicita: Zhoršení choroby nebo příhody spojené s infuzí mohou signalizovat vývoj antinatalizumabových protilátek. Jaterní příhody: Spontánní poškození jater může vzniknout kdykoli během léčby, i po užití první dávky. Pacienti by měli být monitorováni a poučeni. V případě závažné poruchy funkce jater by měl být přípravek TYSABRI vysazen. Zastavení léčby TYSABRI: Natalizumab zůstává v krvi a má farmakodynamické účinky přibližně 12 týdnů. Nežádoucí účinky: Časté: bolest hlavy, infekce močového traktu, nasofaryngitida, kopřivka, závratě, zvracení, nevolnost, artralgie, ztuhlost, pyrexie, únava. Méně časté: hypersenzitivita. Po uvedení přípravku na trh byl hlášen výskyt PML u pacientů, kterým byl lék podáván v monoterapii. Podmínky pro uchovávání: Koncentrát: Uchovávejte v chladničce (2 8 C). Chraňte před mrazem a světlem. Naředěný roztok: Po naředění neprodleně použijte, nejpozději do 8 hodin. Naředěný roztok uchovávejte při teplotě 2 8 C. Balení: 15 ml TYSABRI v injekční lahvičce se zátkou, těsněním a odnímatelným víčkem. 1 injekční lahvička v krabičce. Držitel rozhodnutí o registraci: Elan Pharma International Ltd., Monksland, Athlone, County Westmeath, Irsko. Registrační číslo: EU/1/06/346/001. Způsob úhrady a výdeje: Přípravek je vázán na lékařský předpis a je plně hrazen z prostředků veřejného zdravotního pojištění jako zvlášť účtovaný léčivý přípravek (ZULP). Datum revize textu: 06/2011. Před použitím si prosím pečlivě přečtěte Souhrn údajů o přípravku. Biogen Idec (Czech Republic) s.r.o., Na Pankráci 1683/127, Praha 4, tel.: , fax: , * Všimněte si prosím změn v informacích o léčivém přípravku. TY00-CZE červen 2011
INFORMACE PRO LÉKAŘE * A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI
 INFORMACE PRO LÉKAŘE * A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI Verze 6: 9. července 2010 * Léčbu přípravkem TYSABRI by měl zahajovat a sledovat specializovaný lékař se zkušenostmi
INFORMACE PRO LÉKAŘE * A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI Verze 6: 9. července 2010 * Léčbu přípravkem TYSABRI by měl zahajovat a sledovat specializovaný lékař se zkušenostmi
INFORMACE PRO LÉKAŘE* A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI
 INFORMACE PRO LÉKAŘE* A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI Verze 9: 23. leden 2012 * Léčbu přípravkem TYSABRI by měl zahajovat a sledovat specializovaný lékař se zkušenostmi
INFORMACE PRO LÉKAŘE* A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI Verze 9: 23. leden 2012 * Léčbu přípravkem TYSABRI by měl zahajovat a sledovat specializovaný lékař se zkušenostmi
INFORMACE PRO LÉKAŘE* A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI
 INFORMACE PRO LÉKAŘE* A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI Verze 12: 6. března 2014 *Léčbu přípravkem TYSABRI by měl zahajovat a sledovat specializovaný lékař se zkušenostmi
INFORMACE PRO LÉKAŘE* A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI Verze 12: 6. března 2014 *Léčbu přípravkem TYSABRI by měl zahajovat a sledovat specializovaný lékař se zkušenostmi
Příloha IV. Vědecké závěry
 Příloha IV Vědecké závěry 37 Vědecké závěry Rychle narůstá počet vědeckých důkazů o progresivní multifokální leukoencefalopatii (PML) u pacientů léčených přípravkem Tysabri. Jsou k dispozici nové informace
Příloha IV Vědecké závěry 37 Vědecké závěry Rychle narůstá počet vědeckých důkazů o progresivní multifokální leukoencefalopatii (PML) u pacientů léčených přípravkem Tysabri. Jsou k dispozici nové informace
Natalizumabum TYSABRI 300 mg koncentrát pro infuzní roztok
 Edukační materiály Natalizumabum TYSABRI 300 mg koncentrát pro infuzní roztok INFORMACE PRO LÉKAŘE* A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI Verze 16: 21. června 2017 *Léčbu
Edukační materiály Natalizumabum TYSABRI 300 mg koncentrát pro infuzní roztok INFORMACE PRO LÉKAŘE* A POKYNY K LÉČBĚ PACIENTŮ S ROZTROUŠENOU SKLERÓZOU PŘÍPRAVKEM TYSABRI Verze 16: 21. června 2017 *Léčbu
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
INFLECTRA SCREENINGOVÝ LIST. a výběru pacientů pro všechny schválené indikace. Obsahuje pokyny ke správnému screeningu
 Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
Příloha IV. Vědecké závěry
 Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH)
 Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH) Se souhlasem Evropské lékové agentury (EMA) a její
Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH) Se souhlasem Evropské lékové agentury (EMA) a její
RS léčba. Eva Havrdová. Neurologická klinika 1.LF UK a VFN Praha
 RS léčba Eva Havrdová Neurologická klinika 1.LF UK a VFN Praha Progrese RS bez léčby Přirozený průběh: Doba do EDSS 6 (n=902) Konverze RR MS v progresivní MS 100 80 60 40 20 0 10 20 30 40 50 Čas (roky)
RS léčba Eva Havrdová Neurologická klinika 1.LF UK a VFN Praha Progrese RS bez léčby Přirozený průběh: Doba do EDSS 6 (n=902) Konverze RR MS v progresivní MS 100 80 60 40 20 0 10 20 30 40 50 Čas (roky)
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Zvažte oddálení podání regadenosonu u pacientů s nekontrolovanou hypertenzí.
 CAVE! Informační dopis pro zdravotníky Rapiscan (regadenoson) - Nové důležité doporučení pro minimalizaci rizika cévní mozkové příhody a prodloužení křečí vyvolaných přípravkem Rapiscan po podání aminofylinu.
CAVE! Informační dopis pro zdravotníky Rapiscan (regadenoson) - Nové důležité doporučení pro minimalizaci rizika cévní mozkové příhody a prodloužení křečí vyvolaných přípravkem Rapiscan po podání aminofylinu.
Důležité bezpečnostní informace pro zdravotnické pracovníky
 Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
CAVE! Informační dopis pro zdravotnické pracovníky
 CAVE! Informační dopis pro zdravotnické pracovníky říjen 2017 Výpadek léčivého přípravku Trisenox (oxid arzenitý, koncentrát pro infuzní roztok 1 mg/ml): nahrazení léčivým přípravkem Phenasen (injekční
CAVE! Informační dopis pro zdravotnické pracovníky říjen 2017 Výpadek léčivého přípravku Trisenox (oxid arzenitý, koncentrát pro infuzní roztok 1 mg/ml): nahrazení léčivým přípravkem Phenasen (injekční
Co byste měl(a) vědět o léčivém přípravku
 Co byste měl(a) vědět o léčivém přípravku Důležité bezpečnostní informace pro pacienty léčené přípravkem MabThera 1 Co byste měl(a) vědět o přípravku MabThera Pokud máte revmatoidní artritidu (RA), granulomatózu
Co byste měl(a) vědět o léčivém přípravku Důležité bezpečnostní informace pro pacienty léčené přípravkem MabThera 1 Co byste měl(a) vědět o přípravku MabThera Pokud máte revmatoidní artritidu (RA), granulomatózu
8.12. 2011- akutní příjem pro susp. progresivní multifokální leukoencefalopatii (PML) indukovanou terapií, s pozitivitou protilátek proti JC viru
 8.12. 2011- akutní příjem pro susp. progresivní multifokální leukoencefalopatii (PML) indukovanou terapií, s pozitivitou protilátek proti JC viru Relaps remitující forma na th. Tysabri (natalizumab), poslední
8.12. 2011- akutní příjem pro susp. progresivní multifokální leukoencefalopatii (PML) indukovanou terapií, s pozitivitou protilátek proti JC viru Relaps remitující forma na th. Tysabri (natalizumab), poslední
PRŮKAZ PACIENTA. užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1
 PRŮKAZ PACIENTA užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě zdravotnického zařízení.
PRŮKAZ PACIENTA užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě zdravotnického zařízení.
Praxbind doporučení pro podávání (SPC)
 Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Edukační materiál. Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera
 Edukační materiál Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera Přípravek Strattera je indikován k léčbě hyperkinetické
Edukační materiál Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera Přípravek Strattera je indikován k léčbě hyperkinetické
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
Důležité informace pro pacienty
 MAVENCLAD (cladribinum) Důležité informace pro pacienty OBSAH Seznámení s přípravkem MAVENCLAD Jak se přípravek MAVENCLAD podává? Nežádoucí účinky a možná rizika Lymfopenie Herpes zoster (pásový opar)
MAVENCLAD (cladribinum) Důležité informace pro pacienty OBSAH Seznámení s přípravkem MAVENCLAD Jak se přípravek MAVENCLAD podává? Nežádoucí účinky a možná rizika Lymfopenie Herpes zoster (pásový opar)
ÚHRADA V CENTRECH SE ZVLÁŠTNÍ SMLOUVOU V ROCE 2014 DIAGNOSTICKÁ SKUPINA: ROZTROUŠENÁ SKLERÓZA KONFERENCE PS PČR LISTOPAD 2014
 ÚHRADA V CENTRECH SE ZVLÁŠTNÍ SMLOUVOU V ROCE 2014 DIAGNOSTICKÁ SKUPINA: ROZTROUŠENÁ SKLERÓZA KONFERENCE PS PČR LISTOPAD 2014 STRUKTURA CENTROVÉ PÉČE Centrová péče 2014: 53 poskytovatelů zdravotnických
ÚHRADA V CENTRECH SE ZVLÁŠTNÍ SMLOUVOU V ROCE 2014 DIAGNOSTICKÁ SKUPINA: ROZTROUŠENÁ SKLERÓZA KONFERENCE PS PČR LISTOPAD 2014 STRUKTURA CENTROVÉ PÉČE Centrová péče 2014: 53 poskytovatelů zdravotnických
NeuroBloc. botulinový toxin typu B injekční roztok, U/ml
 NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
Příloha II. Vědecké závěry a zdůvodnění změny v registraci
 Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Viru-Merz je účinný při léčbě infekce způsobené virem herpes simplex, ale pouze do fáze vzniku puchýřků.
 sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE
 EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE Příručka pro předepisujícího lékaře Pokyny pro zdravotnické pracovníky ohledně předepisování přípravku Cerdelga (eliglustat) Tento léčivý přípravek
EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE Příručka pro předepisujícího lékaře Pokyny pro zdravotnické pracovníky ohledně předepisování přípravku Cerdelga (eliglustat) Tento léčivý přípravek
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Rozměr zavřeného průkazu mm
 Přední strana Str. 1 PRŮKAZ PACIENTA užívajícího přípravek Humira (určeno dospělým i dětským pacientům) Rozměr zavřeného průkazu 105 73 mm Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi
Přední strana Str. 1 PRŮKAZ PACIENTA užívajícího přípravek Humira (určeno dospělým i dětským pacientům) Rozměr zavřeného průkazu 105 73 mm Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Obr.1 Žilní splavy. https://s-media-cache-ak0.pinimg.com/564x/c3/91/8c/c3918c00db875bb460cf868b26ee1a0c.jpg
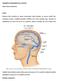 TROMBÓZA NITROLEBNÍCH ŽIL A SPLAVŮ Autor: Barbora Baštinská Výskyt Mozková žilní trombóza je vzácné onemocnění, jehož příznaky se mohou značně lišit. Vyskytuje se spíše u mladších pacientů a většinou (až
TROMBÓZA NITROLEBNÍCH ŽIL A SPLAVŮ Autor: Barbora Baštinská Výskyt Mozková žilní trombóza je vzácné onemocnění, jehož příznaky se mohou značně lišit. Vyskytuje se spíše u mladších pacientů a většinou (až
Nebido EDUKAČNÍ MATERIÁL. Jak úspěšně aplikovat přípravek. (testosterone undecanoate)
 EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
CZ PAR. QUETIAPINI FUMARAS Seroquel. UK/W/0004/pdWS/001 NL/W/0004/pdWS/001
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7
 PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7 Členský stát Žadatel nebo držitel rozhodnutí o registraci Vymyšlený název přípravku
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7 Členský stát Žadatel nebo držitel rozhodnutí o registraci Vymyšlený název přípravku
HIV / AIDS MUDr. Miroslava Zavřelová Ústav preventivního lékařství LF MU
 HIV / AIDS MUDr. Miroslava Zavřelová Ústav preventivního lékařství LF MU e-mail: mizavrel@med.muni.cz I.E.S. Brno, 14. 10. 2014 Historie nákazy 1981 San Francisko, New York mladí pacienti s neobvyklými
HIV / AIDS MUDr. Miroslava Zavřelová Ústav preventivního lékařství LF MU e-mail: mizavrel@med.muni.cz I.E.S. Brno, 14. 10. 2014 Historie nákazy 1981 San Francisko, New York mladí pacienti s neobvyklými
Informace pro zdravotnické odborníky
 EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
CZ PAR QUETIAPINUM. Seroquel. UK/W/0004/pdWS/001. NL/W/0004/pdWS/001
 CZ PAR Název (léčivá látka/ přípravek) Číslo procedury QUETIAPINUM Seroquel UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZVY PŘÍPRAVKŮ KLINICKÝCH STUDIÍ INN DRŽITELÉ PŘÍPRAVKŮ KLINICKÝCH STUDIÍ SCHVÁLENÉ
CZ PAR Název (léčivá látka/ přípravek) Číslo procedury QUETIAPINUM Seroquel UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZVY PŘÍPRAVKŮ KLINICKÝCH STUDIÍ INN DRŽITELÉ PŘÍPRAVKŮ KLINICKÝCH STUDIÍ SCHVÁLENÉ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
po 5 letech ... s excelentním kosmetickým výsledkem 2
 ... s excelentním kosmetickým výsledkem 2 pred lécbou 6. týden 12. týden po 1 roku po 3 letech po 5 letech Správný výber pro Vaše pacienty se superficiálními BCC - krátkodobá lécba s velice dobrým kosmetickým
... s excelentním kosmetickým výsledkem 2 pred lécbou 6. týden 12. týden po 1 roku po 3 letech po 5 letech Správný výber pro Vaše pacienty se superficiálními BCC - krátkodobá lécba s velice dobrým kosmetickým
U pacientů, jejichž tělesná hmotnost je vyšší než 100 kg, se dávky přesahující 800 mg/infuzi nedoporučují.
 EDUKAČNÍ MATERIÁLY RoActemra (tocilizumab) Kapesní dávkovací karta pro revmatoidní artritidu Přípravek RoActemra v kombinaci s metotrexátem (MTX) je indikován k léčbě středně těžké až těžké aktivní revmatoidní
EDUKAČNÍ MATERIÁLY RoActemra (tocilizumab) Kapesní dávkovací karta pro revmatoidní artritidu Přípravek RoActemra v kombinaci s metotrexátem (MTX) je indikován k léčbě středně těžké až těžké aktivní revmatoidní
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) jodidu-( 131 I) sodného
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) jodidu-( 131 I) sodného
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
sp.zn.sukls78453/2015
 sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příloha III. Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
Familiární středomořská (Mediterranean) horečka (Fever)
 www.printo.it/pediatric-rheumatology/cz/intro Familiární středomořská (Mediterranean) horečka (Fever) Verze č 2016 2. DIAGNÓZA A LÉČBA 2.1 Jak se nemoc diagnostikuje? Obecně se uplatňuje následující postup:
www.printo.it/pediatric-rheumatology/cz/intro Familiární středomořská (Mediterranean) horečka (Fever) Verze č 2016 2. DIAGNÓZA A LÉČBA 2.1 Jak se nemoc diagnostikuje? Obecně se uplatňuje následující postup:
PRŮKAZ PACIENTA. užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019
 PRŮKAZ PACIENTA užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě
PRŮKAZ PACIENTA užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě
Důležité informace týkající se léčivého přípravku MabThera (rituximab)
 Důležité informace týkající se léčivého přípravku MabThera (rituximab) Informace, které mohou pomoci lékařům při péči o pacienty léčené přípravkem MabThera (pro neonkologické indikace) 1 O této příručce
Důležité informace týkající se léčivého přípravku MabThera (rituximab) Informace, které mohou pomoci lékařům při péči o pacienty léčené přípravkem MabThera (pro neonkologické indikace) 1 O této příručce
KRVÁCENÍ DO CNS U HEMOFILIKŮ
 KRVÁCENÍ DO CNS U HEMOFILIKŮ Hluší A. a kol. Hemato-onkologická klinika FN a LF UP Olomouc Každoroční setkání spolupracujících pracivišť, Prostějov 9.11.2013 úvod velmi těžká krvácivá komplikace s vysokou
KRVÁCENÍ DO CNS U HEMOFILIKŮ Hluší A. a kol. Hemato-onkologická klinika FN a LF UP Olomouc Každoroční setkání spolupracujících pracivišť, Prostějov 9.11.2013 úvod velmi těžká krvácivá komplikace s vysokou
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Poznámka: Tyto úpravy souhrnu údajů o přípravku a
 PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku přijetí rozhodnutí Komisí. Poté,
PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku přijetí rozhodnutí Komisí. Poté,
Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu
 Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu Marta Krejčí XIII. MM workshop a setkání CMG, Mikulov 11.4.2015 Doplněk č. 1 k doporučení z 9/2012: Diagnostika
Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu Marta Krejčí XIII. MM workshop a setkání CMG, Mikulov 11.4.2015 Doplněk č. 1 k doporučení z 9/2012: Diagnostika
Perorální kladribin: bezpečnostní profil, monitorování pacientů a praktické zkušenosti.
 Perorální kladribin: bezpečnostní profil, monitorování pacientů a praktické zkušenosti. I V A N A K O V Á Ř O V Á C E N T R U M P R O D E M Y E L I N I Z A Č N Í O N E M O C N Ě N Í N E U R O L O G I C
Perorální kladribin: bezpečnostní profil, monitorování pacientů a praktické zkušenosti. I V A N A K O V Á Ř O V Á C E N T R U M P R O D E M Y E L I N I Z A Č N Í O N E M O C N Ě N Í N E U R O L O G I C
V roce 1981 byly v USA poprvé popsány příznaky nového onemocnění, které později dostalo jméno AIDS /Acquired Immune Deficiency Syndrome/ neboli
 Lenka Klimešová V roce 1981 byly v USA poprvé popsány příznaky nového onemocnění, které později dostalo jméno AIDS /Acquired Immune Deficiency Syndrome/ neboli Syndrom získaného imunodeficitu. V roce 1983
Lenka Klimešová V roce 1981 byly v USA poprvé popsány příznaky nového onemocnění, které později dostalo jméno AIDS /Acquired Immune Deficiency Syndrome/ neboli Syndrom získaného imunodeficitu. V roce 1983
Pioneer in Rare Diseases. Pozvánka na satelitní sympozium společnosti SOBI. Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B?
 Pioneer in Rare Diseases Pozvánka na satelitní sympozium společnosti SOBI Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B? Vážená paní doktorko, vážený pane doktore, dovolte, abychom
Pioneer in Rare Diseases Pozvánka na satelitní sympozium společnosti SOBI Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B? Vážená paní doktorko, vážený pane doktore, dovolte, abychom
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU ECOPORC SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU ECOPORC SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
Jana Bednářová. Oddělení klinické mikrobiologické FN Brno
 Aktuální klinická a laboratorní kritéria pro diagnostiku neuroborreliózy Jana Bednářová Oddělení klinické mikrobiologické FN Brno European Journal of Neurology 2010, 17: : 8 16 EFNS guidelines on the diagnosis
Aktuální klinická a laboratorní kritéria pro diagnostiku neuroborreliózy Jana Bednářová Oddělení klinické mikrobiologické FN Brno European Journal of Neurology 2010, 17: : 8 16 EFNS guidelines on the diagnosis
EDUKAČNÍ MATERIÁLY. Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce
 EDUKAČNÍ MATERIÁLY Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERIÁLY Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Příloha III. Změny v příslušných bodech informací o přípravku
 Příloha III Změny v příslušných bodech informací o přípravku Poznámka: Tyto změny v příslušných bodech informací o přípravku jsou výsledkem postupu přezkoumání. Informace o přípravku může být následně
Příloha III Změny v příslušných bodech informací o přípravku Poznámka: Tyto změny v příslušných bodech informací o přípravku jsou výsledkem postupu přezkoumání. Informace o přípravku může být následně
PNEUMOKOKOVÉ INFEKCE A MOŽNOSTI PREVENCE aneb CO MŮŽE ZPŮSOBIT PNEUMOKOK
 PNEUMOKOKOVÉ INFEKCE A MOŽNOSTI PREVENCE aneb CO MŮŽE ZPŮSOBIT PNEUMOKOK Očkování! Nejvýznamnější možnost prevence infekčních chorob! Lepší infekční chorobě předcházet než ji léčit! Významný objev v medicíně,
PNEUMOKOKOVÉ INFEKCE A MOŽNOSTI PREVENCE aneb CO MŮŽE ZPŮSOBIT PNEUMOKOK Očkování! Nejvýznamnější možnost prevence infekčních chorob! Lepší infekční chorobě předcházet než ji léčit! Významný objev v medicíně,
Cévní mozková příhoda. Petr Včelák
 Cévní mozková příhoda Petr Včelák 12. 2. 2015 Obsah 1 Cévní mozková příhoda... 1 1.1 Příčiny mrtvice... 1 1.2 Projevy CMP... 1 1.3 Případy mrtvice... 1 1.3.1 Česko... 1 1.4 Diagnóza a léčba... 2 1.5 Test
Cévní mozková příhoda Petr Včelák 12. 2. 2015 Obsah 1 Cévní mozková příhoda... 1 1.1 Příčiny mrtvice... 1 1.2 Projevy CMP... 1 1.3 Případy mrtvice... 1 1.3.1 Česko... 1 1.4 Diagnóza a léčba... 2 1.5 Test
EDUKAČNÍ MATERIÁLY. KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
Klinické hodnocení ARAMIS pro muže s rakovinou prostaty
 Klinické hodnocení ARAMIS pro muže s rakovinou prostaty Brožura pro účastníky DĚKUJEME VÁM, že jste se rozhodl zúčastnit klinického hodnocení ARAMIS pro muže s rakovinou prostaty. V této brožuře najdete
Klinické hodnocení ARAMIS pro muže s rakovinou prostaty Brožura pro účastníky DĚKUJEME VÁM, že jste se rozhodl zúčastnit klinického hodnocení ARAMIS pro muže s rakovinou prostaty. V této brožuře najdete
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE
 LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE Léčba by měla být zahájena a sledována specialistou se zkušenostmi v léčbě revmatoidní artritidy a psoriatické artritidy. Lékař by měl poučit pacienty
LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE Léčba by měla být zahájena a sledována specialistou se zkušenostmi v léčbě revmatoidní artritidy a psoriatické artritidy. Lékař by měl poučit pacienty
EDUKAČNÍ MATERIÁL. Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid)
 EDUKAČNÍ MATERIÁL Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid) Leflunopharm (leflunomid), jako chorobu modifikující antirevmatikum (Disease-Modifying
EDUKAČNÍ MATERIÁL Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid) Leflunopharm (leflunomid), jako chorobu modifikující antirevmatikum (Disease-Modifying
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Hemlibra (emicizumab) Subkutánní injekce. Návod pro zdravotnické pracovníky
 EDUKAČNÍ MATERIÁLY Hemlibra (emicizumab) Subkutánní injekce Návod pro zdravotnické pracovníky Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERIÁLY Hemlibra (emicizumab) Subkutánní injekce Návod pro zdravotnické pracovníky Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY
 MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze dne 9. dubna 2019 Č. j.: MZDR 15900/2019-5/OLZP Sp. zn. OLZP: S8/2019 *MZDRX015U4L9* MZDRX015U4L9 Ministerstvo zdravotnictví České republiky jako příslušný
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze dne 9. dubna 2019 Č. j.: MZDR 15900/2019-5/OLZP Sp. zn. OLZP: S8/2019 *MZDRX015U4L9* MZDRX015U4L9 Ministerstvo zdravotnictví České republiky jako příslušný
CZ PAR. QUETIAPINI FUMARAS Seroquel. NL/W/0004/pdWS/002
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury NL/W/0004/pdWS/002 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA ZMĚNA V SmPC
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury NL/W/0004/pdWS/002 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA ZMĚNA V SmPC
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Příloha II. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 21 Vědecké závěry Celkové závěry vědeckého hodnocení přípravků Oxynal a Targin a souvisejících názvů (viz příloha I) Podkladové
Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 21 Vědecké závěry Celkové závěry vědeckého hodnocení přípravků Oxynal a Targin a souvisejících názvů (viz příloha I) Podkladové
Kasuistiky pacientů s RS zaměřené na možnosti léčby dle úhradových podmínek
 Kasuistiky pacientů s RS zaměřené na možnosti léčby dle úhradových podmínek M.Dufek MS centrum FN u sv Anny, Brno Jarní seminář Merck, 23.-24.3.18, Brno Tato prezentace vznikla za podpory společnosti MeRCK
Kasuistiky pacientů s RS zaměřené na možnosti léčby dle úhradových podmínek M.Dufek MS centrum FN u sv Anny, Brno Jarní seminář Merck, 23.-24.3.18, Brno Tato prezentace vznikla za podpory společnosti MeRCK
Léčba vnějších genitálních a perianálních bradavic (condylomata acuminata)
 Léčba vnějších genitálních a perianálních bradavic (condylomata acuminata) Stimulace imunity tam, kde je potřeba Prokázaná účinnost Mechanismus účinku přípravku Aldara (1) Stimuluje vrozenou a buněčnou
Léčba vnějších genitálních a perianálních bradavic (condylomata acuminata) Stimulace imunity tam, kde je potřeba Prokázaná účinnost Mechanismus účinku přípravku Aldara (1) Stimuluje vrozenou a buněčnou
EDUKAČNÍ MATERIÁLY. TRUVADA 200 mg / 245 mg POTAHOVANÉ TABLETY (EMTRICITABINUM/ TENOFOVIRUM DISOPROXILUM)
 EDUKAČNÍ MATERIÁLY TRUVADA 200 mg / 245 mg POTAHOVANÉ TABLETY (EMTRICITABINUM/ TENOFOVIRUM DISOPROXILUM) DŮLEŽITÉ BEZPEČNOSTNÍ INFORMACE PRO PŘEDEPISUJÍCÍ LÉKAŘE týkající se užívání přípravku Truvada k
EDUKAČNÍ MATERIÁLY TRUVADA 200 mg / 245 mg POTAHOVANÉ TABLETY (EMTRICITABINUM/ TENOFOVIRUM DISOPROXILUM) DŮLEŽITÉ BEZPEČNOSTNÍ INFORMACE PRO PŘEDEPISUJÍCÍ LÉKAŘE týkající se užívání přípravku Truvada k
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Locatim perorální roztok pro novorozená telata mladší než 12 hodin 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Bovinní
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Locatim perorální roztok pro novorozená telata mladší než 12 hodin 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Bovinní
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYSABRI 300 mg koncentrát pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml koncentrátu obsahuje natalizumabum 20 mg.
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYSABRI 300 mg koncentrát pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml koncentrátu obsahuje natalizumabum 20 mg.
Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům
 12 October 2017 EMA/PRAC/662563/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC konaném
12 October 2017 EMA/PRAC/662563/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC konaném
RS základní informace
 RS základní informace Eva Kubala Havrdová 1. lékařská fakulta Univerzita Karlova a Všeobecná fakultní nemocnice v Praze RS: základní údaje Autoimunitní onemocnění CNS (mozku a míchy) Prevalence v ČR: 170/100
RS základní informace Eva Kubala Havrdová 1. lékařská fakulta Univerzita Karlova a Všeobecná fakultní nemocnice v Praze RS: základní údaje Autoimunitní onemocnění CNS (mozku a míchy) Prevalence v ČR: 170/100
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
ACTYNOX 50 % / 50 % V/V Oxid dusný (dinitrogenii oxidum) / kyslík (oxygenum) Medicinální plyn, stlačený PRŮVODCE PRO ZDRAVOTNICKÉ PRACOVNÍKY
 Edukační materiály Orgány veřejného zdraví stanovily určité podmínky pro tržní rozvoj přípravku ACTYNOX. Jednou z nich je předávat tyto informace zdravotnickým pracovníkům jako součást povinného plánu
Edukační materiály Orgány veřejného zdraví stanovily určité podmínky pro tržní rozvoj přípravku ACTYNOX. Jednou z nich je předávat tyto informace zdravotnickým pracovníkům jako součást povinného plánu
alergie na složky potravy SVOBODA Petr Ambulance estetické dermatologie, Pekařská 3, Brno
 alergie na složky potravy SVOBODA Petr Ambulance estetické dermatologie, Pekařská 3, 602 00 Brno alergie na potraviny - definice Imunologicky zprostředkovaný vedlejší účinek po požití potravy. alergie
alergie na složky potravy SVOBODA Petr Ambulance estetické dermatologie, Pekařská 3, 602 00 Brno alergie na potraviny - definice Imunologicky zprostředkovaný vedlejší účinek po požití potravy. alergie
Syfilis přehledně. MUDr.Hana Zákoucká Odd. STI, NRL pro syfilis, Státní zdravotní ústav ROCHE 6-2014
 Syfilis přehledně MUDr.Hana Zákoucká Odd. STI, NRL pro syfilis, Státní zdravotní ústav ROCHE 6-214 LEGISLATIVA Zákon č. 258/2 Sb., o ochraně veřejného zdraví Vyhláška MZ ČR č. 36/212 Sb., podmínky předcházení
Syfilis přehledně MUDr.Hana Zákoucká Odd. STI, NRL pro syfilis, Státní zdravotní ústav ROCHE 6-214 LEGISLATIVA Zákon č. 258/2 Sb., o ochraně veřejného zdraví Vyhláška MZ ČR č. 36/212 Sb., podmínky předcházení
Výskyt a význam infekce Borna disease virem u pacientů léčených
 Výskyt a význam infekce Borna disease virem u pacientů léčených pro závislost Sylva Racková Psychiatrická klinika LF UK v Plzni AT konference 28.04. 2010, Špindlerův Mlýn Borna Disease virus (BDV) charakteristika
Výskyt a význam infekce Borna disease virem u pacientů léčených pro závislost Sylva Racková Psychiatrická klinika LF UK v Plzni AT konference 28.04. 2010, Špindlerův Mlýn Borna Disease virus (BDV) charakteristika
Edukační materiály. KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře
 Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Akutní respirační poruchy spojené s potápěním a dekompresí... Úvod Patofyziologie Klinické projevy Diagnostika Léčba Prognóza postižení Praktické rady
 1 Hemoptýza 1.1 Úvod a definice 1.2 Patofyziologie hemoptýzy 1.3 Příčiny hemoptýzy 1.4 Klasifikace hemoptýzy 1.5 Vyšetřovací metody 1.6 Diagnostické algoritmy 1.7 Diferenciální diagnostika hemoptýzy 1.8
1 Hemoptýza 1.1 Úvod a definice 1.2 Patofyziologie hemoptýzy 1.3 Příčiny hemoptýzy 1.4 Klasifikace hemoptýzy 1.5 Vyšetřovací metody 1.6 Diagnostické algoritmy 1.7 Diferenciální diagnostika hemoptýzy 1.8
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
KLINICKÝ PŘÍNOS RADIOLOGICKÝCH PARAMETRŮ U SPONDYLOGENNÍ CERVIKÁLNÍ MYELOPATIE
 KLINICKÝ PŘÍNOS RADIOLOGICKÝCH PARAMETRŮ U SPONDYLOGENNÍ CERVIKÁLNÍ MYELOPATIE Neurologická klinika LF MU a FN Brno Tomáš Horák 7.12.2017 MYELOPATIE = nezánětlivé onemocnění míchy Spondylogenní (kompresivní)
KLINICKÝ PŘÍNOS RADIOLOGICKÝCH PARAMETRŮ U SPONDYLOGENNÍ CERVIKÁLNÍ MYELOPATIE Neurologická klinika LF MU a FN Brno Tomáš Horák 7.12.2017 MYELOPATIE = nezánětlivé onemocnění míchy Spondylogenní (kompresivní)
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Ecoporc SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Ecoporc SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 2 Jak sledovat bezpečnost léčivých přípravků v ČR problémy a výzvy MUDr. Jana Mladá Státní ústav pro kontrolu léčiv 3 O čem dnes? Monitorování bezpečnosti léčivých přípravků Farmakovigilanční systém Chyby
2 Jak sledovat bezpečnost léčivých přípravků v ČR problémy a výzvy MUDr. Jana Mladá Státní ústav pro kontrolu léčiv 3 O čem dnes? Monitorování bezpečnosti léčivých přípravků Farmakovigilanční systém Chyby
Standardy péče o osoby s revmatickou artritídou
 Standardy péče o osoby s revmatickou artritídou Translation into: Completed by: Email: SOC 1 Lidé s projevy RA by měli mít včasný přístup ke klinickým/zdravotnickým odborníkům kompetentním pro stanovení
Standardy péče o osoby s revmatickou artritídou Translation into: Completed by: Email: SOC 1 Lidé s projevy RA by měli mít včasný přístup ke klinickým/zdravotnickým odborníkům kompetentním pro stanovení
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Vanguard R injekční suspenze pro psy, kočky, skot, prasata, ovce, kozy, koně a fretky
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Vanguard R injekční suspenze pro psy, kočky, skot, prasata, ovce, kozy, koně a fretky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Vanguard R injekční suspenze pro psy, kočky, skot, prasata, ovce, kozy, koně a fretky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka
