ODBORNÁ STANOVISKA PŘEDSTAVENSTVA ČESKÉ STOMATOLOGICKÉ KOMORY
|
|
|
- Jaroslav Růžička
- před 8 lety
- Počet zobrazení:
Transkript
1 ODBORNÁ STANOVISKA PŘEDSTAVENSTVA ČESKÉ STOMATOLOGICKÉ KOMORY OSP 1/2004 k náležitostem endodontického ošetření... 1 OSP 1/2009 k používání výplní ze skloionomerního cementu v distálním úseku chrupu... 2 OSP 2/2009 k používání dentálních slitin stříbra a cínu... 3 OSP 3/2009 k vybavení pohotovostní lékárny v ordinaci zubního lékaře ve znění usnesení představenstva ČSK USN2012/003/ OSP 1/2010 k indikaci vyšetření intraorálním rentgenem... 8 OSP 1/2014 minimum pro standardní endodontické ošetření stálého zubu s dokončeným vývojem... 9 OSP 1/2015 k zevnímu bělení zubů... 11
2 OSP 1/2004 Strana 1 OSP 1/2004 k náležitostem endodontického ošetření Odborné stanovisko představenstva ČSK č. 1/2004 k náležitostem endodontického ošetření Jednání představenstva Doporučenou náležitostí endodontického ošetření je dokumentace jeho výsledku RTG snímkem nebo jinou zobrazovací metodou. Neposkytne-li pacient s pořízením takové dokumentace souhlas, vyžádá si zubní lékař negativní revers. Odborné stanovisko č. 1/2004 k náležitostem endodontického ošetření Jednání představenstva Komory
3 OSP 1/2009 Strana 2 Odborné stanovisko č. 1/2009 k používání výplní ze skloionomerního cementu v distálním úseku chrupu vydané představenstvem České stomatologické komory dle ust. 20b odst. 2 Organizačního řádu Stanov ČSK 1. Obecné charakteristiky Výplň ze skloionomerního cementu a) má při použití v distálním úseku chrupu u dospělých pacientů charakter výplně semipermanentní; b) nenahrazuje amalgamovou výplň, která je pro použití v distálním úseku chrupu vhodnější pro svoji mechanickou odolnost; c) je pro své protektivní a antikariogenní vlastnosti vhodná pro použití u pacientů se zhoršenou dentální hygienou; d) je vhodná pro použití u dočasných zubů, neboť má remineralizační a antikariogenní vlastnosti, je snadno zhotovitelná a neobsahuje kovy. 2. Materiál Pro distální úsek chrupu se předpokládá použití a) zpevněných skloionomerních cementů určených i pro distální úsek; b) kapslové formy materiálu. 3. Životnost Životnost výplní ze skloionomerního cementu je značně ovlivněna typem kavity a artikulačními poměry. Podle tříd výplní, resp. způsobu ošetření lze předpokládat životnost: a) 2 až 5 let v závislosti na artikulačních podmínkách, jde-li o výplň I. třídy; b) v řádu měsíců, nejvýše 2 roky, jde-li o výplň II. třídy; c) 5 let, jde-li o výplň V. třídy; d) 2 až 5 let, jde-li o zub endodonticky ošetřený a vyřazený z artikulace. V závislosti na konkrétních podmínkách lze namísto výměny výplně ze skloionomerního cementu, která selhala, připustit její opravu doplněním odpovídajícího skloionomerního materiálu. V Brně dne MUDr. Jiří Pekárek prezident České stomatologické komory Odborné stanovisko č. 1/2009 k používání výplní ze skloionomerního cementu v distálním úseku chrupu
4 OSP 2/2009 Strana 3 Odborné stanovisko č. 2/2009 k používání dentálních slitin stříbra a cínu vydané představenstvem České stomatologické komory dle ust. 20b odst. 2 Organizačního řádu Stanov ČSK 1. Sledované vlastnosti Dentální slitiny stříbra a cínu e) v agresivním prostředí ústní dutiny korodují, pokrývají se oxidy kovů a intenzivně se zbarvují; f) vykazují malou mechanickou odolnost. 2. Předpokládatelné důsledky Při použití dentální slitiny stříbra a cínu pro zhotovení kořenové nástavby je nutno předpokládat, že a) ionty kovu pronikají do měkkých tkání a u vnímavých pacientů vytvářejí metalické skvrny na měkkých tkáních přiléhajících k ošetřenému zubu; b) čep kořenové nástavby se snadno ohýbá; c) vyztužení kořenového čepu tzv. jádrem z chromkobaltového, chromniklového nebo ocelového drátu vylučuje možnost spojení jádra a slitiny při odlití kořenové nástavby; d) čep kořenové nástavby v důsledku koroze probarvuje krčkovou část plastových a kompozitních korunek. 3. Indikace Použití dentální slitiny je indikováno pouze při zhotovení kořenové nástavby, která není v kontaktu s dásní, a to za předpokladu, že ošetřovaný zub je současně opatřen nekovovou korunkou. V Brně dne MUDr. Jiří Pekárek prezident České stomatologické komory Odborné stanovisko č. 2/2009 k používání dentálních slitin stříbra a cínu
5 OSP 3/2009 Strana 4 Odborné stanovisko č. 3/2009 k vybavení pohotovostní lékárny v ordinaci zubního lékaře ve znění usnesení představenstva ČSK USN2012/03/009 vydané představenstvem České stomatologické komory dle ust. 20b odst. 2 Organizačního řádu Stanov ČSK K řádnému zajištění poskytnutí první pomoci v ordinaci zubního lékaře je doporučeno, aby ordinace zubního lékaře byla vybavena v přiměřeném množství léčivými přípravky a dalším vybavením uvedenými v tomto odborném stanovisku. 1. Léčivé přípravky Epinefrin (= adrenalin, injekční roztok), atropin (injekční roztok), dexamethason (nebo jiný kortikosteroid vhodný pro řešení akutních stavů, injekční roztok), lidokain 1% (ev. trimekain 1%, injekční roztok), diazepam (injekční roztok nebo roztok pro rektální podání), antihistaminikum (injekční roztok vhodný pro řešení akutních stavů, např. bisulepin), tramadol (injekční roztok), kaptopril (tablety), glycerol-trinitrát (= nitroglycerin, sublinguální tableta nebo spray), glukóza 40% (injekční roztok), glukóza 5% (infuzní roztok), fyziologický roztok (= natrii chlorati isotonica, infuzní roztok), aqua pro injectione (injekční roztok). 2. Technické vybavení Samorozpínací resuscitační vak, vzduchovody (ústní, příp. nosní), Esmarchovo škrtidlo se sponou, flexila, spojovací infuzní hadička, infuzní set, transfuzní jehly, injekční stříkačky a jehly, tampony, roztok k povrchové dezinfekci kůže, náplast, čelistní rozvěrač, fonendoskop, tonometr. V Praze dne MUDr. Pavel Chrz prezident České stomatologické komory Odborné stanovisko č. 3/2009 k vybavení pohotovostní lékárny v ordinaci zubního lékaře ve znění usnesení představenstva ČSK USN2012/03/009
6 OSP 3/2009 Strana 5 Stručné informace k použití doporučených léků při řešení náhlých příhod u dospělých pacientů v zubní ordinaci Tento text je pouze orientační a řešení náhlých příhod včetně správné aplikace a dávkování léčiv v zubní ordinaci zůstává plně na zodpovědnosti každého zubního lékaře. Vzhledem k měnícím se názvům originálních léčiv jsou v následující informaci použity jen názvy účinných látek. Předpokládá se, že každý zubní lékař má znalosti z farmakologie a že se seznámí s komplexními informacemi o vlastnostech, indikacích, kontraindikacích a vedlejších účincích originálních přípravků, které zařadí do svojí pohotovostní lékárny. Tyto informace jsou dostupné v příbalových letácích léčiv a v dalších odborných zdrojích, např. Doc. MUDr. Jiří Zemen, Ph.D. a MUDr. Robert Houba, Ph.D. - adrenalin (epinefrin) inj. Sympatomimetikum Indikace u akutních stavů: srdeční zástava, anafylaktický šok, bronchospasmus (anafylaktický i reflektorický), periferní selhávání krevního oběhu při dostatečné náplni krevního řečiště. Adrenalin zvyšuje v průběhu masáže systolický a diastolický tlak a nepůsobí vasokonstrikci v koronárním a mozkovém řečišti, snižuje defibrilační práh, má výhodný tonizující vliv při asystolii, má příznivý vliv na reperfúzi životně důležitých orgánů po obnově spontánní srdeční činnosti. Příklad použití u akutních stavů: Resuscitace: pro resuscitaci dospělého 1 mg intravenózně nebo intraoseálně, možno opakovat po 3-5 min Anafylaktický šok: 0,5 mg (1/2 amp) intramuskulárně nebo naředit 1 : (1 amp do 10 ml FR nebo G5%, nebo vody na injekci, odtáhnout 1 ml a znovu doředit do 10 ml) podávat 1-2 ml intravenózně. Opakovat dle stavu a TK po 3-5 minutách. Silný astmatický záchvat: 0,3 mg (0,3 ml intramuskulárně nebo naředit 1: (viz výše) 1 ml intravenózně. Opakovat dle stavu po 3-5 minutách. - atropin inj. Parasympatolytikum Indikace u akutních stavů: indikován při bradykardii pod 50/min a při bradykardii s hypotenzí nebo extrasystolami. Působí blokádu vagu a tím zrychluje frekvenci sinusového uzlu a převodu AV uzlem. Příklad použití u akutních stavů: 0,5-1 mg i.v. (na ředění je lépe použít vodu na injekce - protože injekční roztok atropinu není dlouhodobě kompatibilní s izotonickým roztokem chloridu sodného a 5% roztokem glukózy) - dexamethason inj. Glukokortikoid. Pro řešení akutních stavů lze použít i jiné vhodné kortikosteroidy, např. hydrocortison, methylprednisolon, prednisolon apod.). Odborné stanovisko č. 3/2009 k vybavení pohotovostní lékárny v ordinaci zubního lékaře ve znění usnesení představenstva ČSK USN2012/03/009
7 OSP 3/2009 Strana 6 Indikace u akutních stavů: adjuvantní léčení šokových stavů (jde o doplňkovou léčbu a musí být proto provázena komplexní terapií šoku), anafylaktický šok, akutní alergické projevy, status asthmaticus, Quinckeho edém a jiné edémy laryngu, hypoglykemické koma, akutní hyperkalcémie, tyreotoxická krize, (syndrom maligní hypertermie), uštknutí jedovatými hady, nebezpečné popíchání hmyzem Příklad použití u akutních stavů: dexamethason 4 mg odpovídá cca 100 mg hydrocortisonu. U akutních stavů podáváme intravenózně po naředění fyziologickým roztokem nebo 5% glukózou 4 16 mg dexamethasonu (nebo např. 500 mg hydrocortizonu nebo mg methyprednisolonu. - trimekain 1% inj. (ev. lidokain 1% inj.) Místní anestetikum, antiarytmikum, neovlivňuje normální AV převod. Indikace u akutních stavů: v akutní medicíně při léčbě komorových arytmií - komorové tachykardii (frekvence 140 a víc), komorové fibrilaci. Příklad použití u akutních stavů: asi 1-2 mg/kg tělesné hmotnosti pomalu (během 2-5 min) i.v. U dospělého 100 mg (1 amp 1% trimecainu i.v). - diazepam inj. Anxiolytikum, antiepileptikum, antikonvulzívum. Indikace u akutních stavů: lék první volby u akutních křečových stavů (tonicko-klonické záchvaty, status epilepticus, febrilní křeče ), ke zklidnění např. při záchvatu nestabilní anginy pectoris, IM nebo hypertenzní krizi Příklad použití u akutních stavů: u dospělých u křečových stavů: po 5 mg pomalu i.v. frakcionovaně až do dávky 20 mg. Je-li k dispozici diazepam pro rektální použití, aplikuje se 5-10 mg rektálně. U dospělých k sedaci (např. hypertenzní krize, infarktu myokardu či záchvatu nestabilní anginy pectoris) 5-10 mg i.v. ev. i.m. - bisulepin inj. Antihistaminikum s výrazným sedativním účinkem. Indikace u akutních stavů: akutní alergické stavy, astma bronchiale, Quinckeho edém, kopřivka. Absolutní indikací pro injekční (nejlépe i.v.) podání je celková alergická reakce (anafylaktický šok) ihned v návaznosti na podání adrenalinu, popř. glukokortikoidů. Příklad použití u akutních stavů: u dospělého pomalu i.v. 2-3 mg (ŘEDIT 5% GLUKÓZOU, např. do 10 ml), možno i hluboko i.m. - tramadol (inj.) Analgetikum-anodynum (možné je i jiné analgetikum-anodynum) Indikace u akutních stavů: střední a silné bolesti, v rámci náhlých příhod k tlumení kardiální bolesti Příklad použití u akutních stavů: při kardiální bolesti mg pomalu i.v. (nejlépe naředěného fyziologickým roztokem např. do 10 ml). Aplikovat pomalu abychom se vyhnuli nevolnosti. Odborné stanovisko č. 3/2009 k vybavení pohotovostní lékárny v ordinaci zubního lékaře ve znění usnesení představenstva ČSK USN2012/03/009
8 OSP 3/2009 Strana 7 - kaptopril (tbl.) Inhibitor ACE (Angiotensin Converting Enzyme). Indikace u akutních stavů: při hypertenzní krizi ke snížení TK Příklad použití u akutních stavů: při hypertenzní krizi 1 tbl. (12,5 mg) rozkousat a nechat rozplynout v ústech (nemocného je nutné odeslat RZP do nemocnice). - glycerol-trinitrát = nitroglycerin (subling. tbl. nebo spray) Vazodilatans s rychlým nástupem účinku, základní antianginózní lék. Indikace u akutních stavů: k přerušení nebo profylaxi záchvatu anginy pectoris. Příklad použití u akutních stavů: při anginózním záchvatu nebo před očekávaným záchvatem podat 1 2 dávky nitroglycerinu ve formě ústního spreje nebo 1 tbl (0,5 mg) nitroglycerinu sublingválně, nechat rozplynout v ústech (nepolykat!), při ústupu obtíží vysadit - glukóza 40% (inj.) Zdroj energie. Indikace u akutních stavů: řešení hypoglykemických stavů. Příklad použití u akutních stavů: při prvních příznacích hypoglykémie ihned vypít ml 40% glukózy, při hypoglykemickém kómatu podáváme intravenózně až 60 ml 40% glukózy. K intravenózní infuzi se přidává ml 40% glukózy (jako zředěný roztok), aby nedošlo k podráždění vény. Zpracovali 29. února 2012, doc. MUDr. Jiří Zemen, Ph.D. a MUDr. Robert Houba, Ph.D. Odborné stanovisko č. 3/2009 k vybavení pohotovostní lékárny v ordinaci zubního lékaře ve znění usnesení představenstva ČSK USN2012/03/009
9 OSP 1/2010 Strana 8 Odborné stanovisko č. 1/2010 k indikaci vyšetření intraorálním rentgenem vydané představenstvem České stomatologické komory dle ust. 20b odst. 2 Organizačního řádu Stanov ČSK Lékařské ozáření se smí uskutečnit pouze tehdy, je-li odůvodněno přínosem vyvažujícím rizika, která ozářením vznikají nebo mohou vzniknout. Vždy je třeba uvážit možnou volbu jiných vyšetřovacích postupů nebo zobrazovacích metod popř. jiných léčebných postupů. Pro uvedená vyšetření a ošetření jsou indikovány zpravidla následující počty intraorálních rtg snímků: vyšetření/ošetření maximální doporučený počet snímků RTG status 14 bitewing 5 endodontické ošetření jednoho k.k. 4 reendodoncie (fáze odstraňování kořenové výplně) 3 kořenové čepy 2 kontrola fixních protetických prací * dle rozsahu protetické práce obdobně jako u rtg statusu či bitewingu * kontrola protetických prací intraorálním rentgenem je zpravidla indikována pouze u náročnějších fixních náhrad, zejména u náhrad kotvených implantáty V Praze dne MUDr. Pavel Chrz prezident České stomatologické komory Odborné stanovisko č. 1/2010 k indikaci vyšetření intraorálním rentgenem
10 OSP 1/2014 Strana 9 Odborné stanovisko č. 1/2014 Minimum pro standardní endodontické ošetření stálého zubu s dokončeným vývojem vydané představenstvem České stomatologické komory dle ust. 20b odst. 2 Organizačního řádu Stanov ČSK Toto doporučení definuje minimálně potřebné kroky nutné k dostatečně kvalitnímu provedení nekomplikované primární endodoncie u stálého zubu s dokončeným vývojem kořene, jakožto jednoho ze základních výkonů každodenní stomatologické praxe. Řešení dalších situací, jako jsou endodontické ošetření zubů s nedokončeným vývojem, endodoncie dočasného chrupu, opakované endodontické ošetření reendodoncie a další, nejsou předmětem tohoto doporučení. Rovněž zde nejsou zahrnuty postupy endodontické chirurgie umožňující řešení některých neúspěchů konvenčního endodontického ošetření. Stanovení správné indikace pro endodontické ošetření. Léčba by měla být plánována pro ty zuby, které jsou funkčně nebo esteticky důležité, mají dobrý biologický faktor a příznivou prognózu. 1) Příprava zubu před ošetřením a) Předoperační rentgenový snímek Zhotovit intraorální rentgenový snímek zachycující celé kořeny s periapikální oblastí b) Lokální anestezie Aplikovat lokální anestezii dle zvážení ošetřujícího lékaře. c) Příprava zubu Odstranit všechny kazivé hmoty a nevyhovující výplně. Dle potřeby snížit okluzi k ochraně zubu proti fraktuře klinické korunky. d) Chirurgická příprava U hlubokých subgingiválních defektů tvrdých zubních tkání zvážit gingivektomii nebo chirurgické prodloužení korunky pro lepší zajištění suchého pracovního pole během výkonu a pro zlepšení situace pro postendodontickou rekonstrukci zubu. e) Provizorní dostavba V případě potřeby zhotovit preendodontickou dostavbu, která zajistí stabilní referenční bod, vytvoří rezervoár výplachové tekutiny a usnadní zajištění suchého pracovního pole. f) Suché pracovní pole Podmínkou úspěšného endodontického ošetření je zabránit kontaminaci cavum pulpae slinou a bakteriemi po celou dobu výkonu. Nejvýhodnější pro dlouhodobé zajištění suchého pracovního pole je aplikace kofferdam. Kofferdam zároveň zabrání vdechnutí či polknutí kořenového nástroje a vniknutí výplachové tekutiny do dutiny ústní. 2) Vlastní endodontické ošetření a) Trepanační otvor dle anatomických poměrů Správně umístěný a dostatečně rozsáhlý trepanační otvor je nezbytný pro získání bezpečného a přehledného přístupu ke kořenovému systému. Je nutné odstranit celý strop dřeňové dutiny, ale zároveň se snažit zachovat co největší množství tvrdých zubních tkání. Cílem je přehledná spodina cavum pulpae a dosažení přímého přístupu do kořenových kanálků, dále pak dosažení dostatečné retence dočasné výplně. b) Revize spodiny a nález kořenových kanálků Kontrola dna dřeňové dutiny, nalezení vstupů do kořenových kanálků, s výhodou je využití zvětšovací techniky. c) Zprůchodnění kořenových kanálků Cílem je odstranění případných překážek v průběhu kořenového kanálku a odhalit možné anatomické odchylky, před definitivní preparací kanálků - vytvoření hladké cesty. Odborné stanovisko č. 1/2014 Minimum pro standardní endodontické ošetření stálého zubu s dokončeným vývojem
11 OSP 1/2014 Strana 10 d) Stanovení pracovní délky Ke stanovení přesné pracovní délky od referenčního bodu použít apexlokátor, ev. měřící rtg snímek, nebo kombinaci obou. e) Preparace kořenových kanálků Preparací odstranit infikovaný obsah kořenového kanálku, zlikvidovat přítomné mikroorganismy, odstranit nečistoty a vypracovat pravidelný konus od apexu koronárně do zdravého dentinu tak, aby mohlo dojít k účinnému výplachu a následnému hermetickému uzávěru kořenového kanálku. f) Dezinfekce kořenového systému Požadavky na výplach kořenového systému jsou antibakteriální účinek, rozpouštění organického a anorganického obsahu kanálku i v nepřístupných částech systému, rozpuštění biofilmu, odstranění smear layer a lubrikace. Účinnost výplachu lze zvýšit pomocí sonické nebo ultrazvukové aktivace. g) Uzávěr kořenového systému plnění Cílem je zabránit průniku mikroorganismů a tekutin podél kořenové výplně a hermeticky uzavřít celý kořenový systém apikálně i koronálně. Použité materiály by měly být biokompatibilní, rozměrově stabilní, nereagující s tkáňovými tekutinami a nerozpustné, nepodporující růst bakterií, rentgenkontrastní a odstranitelné z kanálku, pokud je potřeba opakované ošetření. h) Kontrolní rentgenový snímek po zaplnění kořenového systému Slouží ke zhodnocení a kontrole definitivní kořenové výplně, dodržené pracovní délky, homogenity a těsnosti výplně zejména v apikální části. 3) Postendodontické ošetření Cílem je vytvořit hermetický uzávěr kořenového systému koronálně, k zábraně budoucí reinfekce kořenového systému a obnovení funkce zubu v dutině ústní. Volbou vhodného způsobu rekonstrukce minimalizovat riziko budoucí fraktury devitalizovaného zubu. Volba způsobu ošetření závisí na uvážení lékaře vzhledem k rozsahu defektu tvrdých zubních tkání a postavení zubu v rámci komplexního léčebného plánu. 4) Hodnocení úspěchu léčby Výsledek endodontického ošetření by měl být posuzován nejdéle po 1 roce a následně dle potřeby. Znaky úspěšného ošetření: 1) absence bolesti, otoku a píštěle, 2) bez ztráty funkce, 3) rentgenový snímek s výrazně se zmenšujícím, nebo normálním nálezem v periapikální oblasti. Znaky nejistého úspěchu ošetření Na rentgenovém snímku se periapikální léze nezměnila nebo jen mírně zmenšila. V případě nepřítomnosti příznaků infekce se doporučuje posoudit lézi opakovaně později - až do 4let. Znaky neúspěšného ošetření: 1) jsou přítomny symptomy infekce (bolest, otok, píštěl); 2) rentgenologicky viditelná léze, nově objevená po ošetření nebo zvětšení již přítomného ložiska; 3) mírně zmenšené nebo přetrvávající ložisko i po 4 letém sledování od doby ošetření; 4) přítomné známky pokračující resorbce kořene; 5) výjimka: rozsáhlé ložisko se může zhojit, ale zanechá na rtg viditelné nepravidelně mineralizované oblasti jako následek tvorby jizevnaté tkáně, ne jako projev pokračující periapikální ostitidy. Zub je třeba nadále sledovat. Usnesení představenstva ČSK č. USN2014/05/012 z jednání dne Odborné stanovisko č. 1/2014 Minimum pro standardní endodontické ošetření stálého zubu s dokončeným vývojem
12 OSP 1/2015 Strana 11 Odborné stanovisko č. 1/2015 k zevnímu bělení zubů vydané představenstvem České stomatologické komory dle ust. 20b odst. 2 Organizačního řádu Stanov ČSK Od platí Nařízení 1223/2009/ES o kosmetických přípravcích. Současné stanovisko Direktorátu pro zdraví a ochranu spotřebitele Evropské unie je takové, že všechny prostředky používané na bělení zubů jsou přípravky kosmetické. Certifikát na zdravotnický prostředek, tj. prostředek s obsahem peroxidu vodíku vyšším než 6% v okamžiku skončení jeho platnosti již nesmí být obnoven. Koncentrace peroxidu vodíku větší než 6% je označena jako zdraví škodlivá, jelikož hranice bezpečnosti (MoS) je při ní nižší než 100%. Roztok peroxidu vodíku o hmotnostních procentech 6 20% je z hlediska Chemického zákona 350/2011 Sb. klasifikován jako Xn- zdraví škodlivý s větami R22 Zdraví škodlivý při požití a R 41 nebezpečí vážného poškození očí. Perboritan sodný je řazený do přílohy III Nařízení1223/2009/ES omezeně přípustné látky. Maximální koncentrace pro přípravky ústní hygieny je 0.1% v přepočtu na kyselinu boritou. Nařízení komise EU 109/2012 o povolování a omezování chemických látek hodnotí perboritan sodný jako potencionálně rizikový a nebezpečný produkt, který mimo jiné negativně působí a toxicky ovlivňuje reprodukční schopnosti organismu. Proto by se expozice na lidský organismus měla omezit v maximální možné míře. Mechanismus bělicího účinku spočívá v rozkladu na peroxid vodíku (účinnou látku) a metaboritan sodný (vedlejší produkt). Zevní bělení zubů je považováno za proceduru, která může doplnit péči o hygienu dutiny ústní. U peroxidového bělení je účinnou látkou vždy peroxid vodíku. V souladu se současnou legislativou je možné aplikovat prostředky obsahující peroxid vodíku nebo peroxid močoviny s koncentrací nepřesahující 6% peroxidu vodíku (16% peroxidu močoviny). Preparáty s touto koncentrací lze aplikovat k domácímu použití na základě důkladné instruktáže pacienta při návštěvě zubního lékaře nebo dentální hygienistky. Úvodní fáze bělení může být provedena v ordinaci zubním lékařem nebo hygienistkou. I v tomto případě platí použití výše uvedených koncentrací. Alternativou, popř. doplněním zejména pro pacienty s méně výraznými povrchovými diskoloracemi, je neperoxidové bělení. Při mechanickém bělení jde o odstranění diskolorací abrazivními zubními pastami (RDA není povinen výrobce uvádět, optimum je kolem 50). Patří sem rovněž profesionální čištění v podobě depurace či air flow. Chemické neperoxidové bělení zahrnuje použití zubních past s přísadami enzymů papainu a bromelainu, citroxainu, výtažku z arktického lišejníku aj. Silné peroxidové bělení je v rozporu s Nařízením 1223/2009/ES. ČSK nedoporučuje používat k bělení zubů v rámci ústní hygieny silnější koncentrace než 6% peroxidu vodíku a 16% peroxidu močoviny, nedoporučuje používat perboritan sodný. Usnesení představenstva ČSK č. USN2015/01/009 z jednání dne Odborné stanovisko č. 1/2015 Zevní bělení zubů
ODBORNÁ STANOVISKA PŘEDSTAVENSTVA ČESKÉ STOMATOLOGICKÉ KOMORY
 ODBORNÁ STANOVISKA PŘEDSTAVENSTVA ČESKÉ STOMATOLOGICKÉ KOMORY OSP 1/2004 k náležitostem endodontického ošetření... 1 OSP 1/2009 k používání výplní ze skloionomerního cementu v distálním úseku chrupu...
ODBORNÁ STANOVISKA PŘEDSTAVENSTVA ČESKÉ STOMATOLOGICKÉ KOMORY OSP 1/2004 k náležitostem endodontického ošetření... 1 OSP 1/2009 k používání výplní ze skloionomerního cementu v distálním úseku chrupu...
ODBORNÁ STANOVISKA PŘEDSTAVENSTVA ČESKÉ STOMATOLOGICKÉ KOMORY
 ODBORNÁ STANOVISKA PŘEDSTAVENSTVA ČESKÉ STOMATOLOGICKÉ KOMORY OSP 1/2004 k náležitostem endodontického ošetření... 1 OSP 1/2009 k používání výplní ze skloionomerního cementu v distálním úseku chrupu...
ODBORNÁ STANOVISKA PŘEDSTAVENSTVA ČESKÉ STOMATOLOGICKÉ KOMORY OSP 1/2004 k náležitostem endodontického ošetření... 1 OSP 1/2009 k používání výplní ze skloionomerního cementu v distálním úseku chrupu...
Příloha č.1 k rozhodnutí o změně registrace sp.zn.sukls233573/2012. Příbalová informace: Informace pro uživatele
 Příloha č.1 k rozhodnutí o změně registrace sp.zn.sukls233573/2012 Příbalová informace: Informace pro uživatele Mesocain 1 % injekční roztok Trimecaini hydrochloridum Přečtěte si pozorně celou příbalovou
Příloha č.1 k rozhodnutí o změně registrace sp.zn.sukls233573/2012 Příbalová informace: Informace pro uživatele Mesocain 1 % injekční roztok Trimecaini hydrochloridum Přečtěte si pozorně celou příbalovou
Chirocaine Příbalová informace
 Chirocaine Příbalová informace Informace pro použití, čtěte pozorně Chirocaine 2,5 mg/ml Chirocaine 5 mg/ml Chirocaine 7,5 mg/ml (Levobupivacaini hydrochloridum) Injekční roztok Držitel rozhodnutí o registraci
Chirocaine Příbalová informace Informace pro použití, čtěte pozorně Chirocaine 2,5 mg/ml Chirocaine 5 mg/ml Chirocaine 7,5 mg/ml (Levobupivacaini hydrochloridum) Injekční roztok Držitel rozhodnutí o registraci
Chirocaine 5 mg/ml Chirocaine 7,5 mg/ml injekční roztok (Levobupivacaini hydrochloridum)
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Chirocaine 5 mg/ml Chirocaine 7,5 mg/ml injekční roztok (Levobupivacaini hydrochloridum) V příbalové informaci naleznete: 1. Co je přípravek Chirocaine a k
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Chirocaine 5 mg/ml Chirocaine 7,5 mg/ml injekční roztok (Levobupivacaini hydrochloridum) V příbalové informaci naleznete: 1. Co je přípravek Chirocaine a k
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls156125/2012
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls156125/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TENSAMIN Koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Dopamini
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls156125/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TENSAMIN Koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Dopamini
Srdeční zástava: Dospělí: 1 mg intravenózně nebo intraoseálně, event. 2-3 mg kanylou endotracheálně v 10 ml aq. pro inj každých 3 5 minut.
 sp.zn. sukls60536/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Adrenalin Léčiva injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Epinephrini hydrochloridum 1,2 mg (= Epinephrinum 1 mg) v 1 ml
sp.zn. sukls60536/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Adrenalin Léčiva injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Epinephrini hydrochloridum 1,2 mg (= Epinephrinum 1 mg) v 1 ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
Kompozity SUPER-COR. Univerzální světlem polymerující mikrohybridní kompozitní systém 1.2. Standardní balení: Kit (souprava)
 Výplňové materiály 1 SUPER-COR 1.2 OPTICOR FLOW 1.3 EVICROL 1.3 RETENSIN PLUS 1.4 ADHESOR 1.5 ADHESOR FINE 1.5 ADHESOR CARBOFINE 1.5 KAVITAN LC 1.6 KAVITAN PRO 1.6 KAVITAN PLUS 1.7 KAVITAN CEM 1.7 CARYOSAN
Výplňové materiály 1 SUPER-COR 1.2 OPTICOR FLOW 1.3 EVICROL 1.3 RETENSIN PLUS 1.4 ADHESOR 1.5 ADHESOR FINE 1.5 ADHESOR CARBOFINE 1.5 KAVITAN LC 1.6 KAVITAN PRO 1.6 KAVITAN PLUS 1.7 KAVITAN CEM 1.7 CARYOSAN
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 ke sdělení sp.zn.sukls188660/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Milgamma N 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Thiamini hydrochloridum 100 mg Pyridoxini hydrochloridum 100
Příloha č. 2 ke sdělení sp.zn.sukls188660/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Milgamma N 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Thiamini hydrochloridum 100 mg Pyridoxini hydrochloridum 100
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls74848/2010
 Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls74848/2010 1. NÁZEV PŘÍPRAVKU MONO MACK DEPOT MONO MACK 50 D tablety s proslouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls74848/2010 1. NÁZEV PŘÍPRAVKU MONO MACK DEPOT MONO MACK 50 D tablety s proslouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007 1. NÁZEV PŘÍPRAVKU UNIPRES 10 UNIPRES 20 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007 1. NÁZEV PŘÍPRAVKU UNIPRES 10 UNIPRES 20 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls208364/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls208364/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VISTAGAN Liquifilm 0,5 % Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Levobunololi
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls208364/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VISTAGAN Liquifilm 0,5 % Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Levobunololi
Příbalová informace: informace pro uživatele. Dilatrend 25 tablety Carvedilolum
 sp. zn.: sukls144781/2012 a sp. zn.: sukls88569/2014 Příbalová informace: informace pro uživatele Dilatrend 25 tablety Carvedilolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp. zn.: sukls144781/2012 a sp. zn.: sukls88569/2014 Příbalová informace: informace pro uživatele Dilatrend 25 tablety Carvedilolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls55068/2009
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls55068/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE AGOFOLLIN Injekční roztok (Estradioli dipropionas) Přečtěte si pozorně celou příbalovou
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls55068/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE AGOFOLLIN Injekční roztok (Estradioli dipropionas) Přečtěte si pozorně celou příbalovou
3M ESPE Position Penta /Quick. Imprint Bite. Silikonový otiskovací materiál pro registraci skusu. Silikonový otiskovací materiál pro pomocné otisky
 Protetický průvodce Situační otisky Registrace skusu Position Penta /Quick Silikonový otiskovací materiál pro pomocné otisky Imprint Bite Silikonový otiskovací materiál pro registraci skusu Všechny typické
Protetický průvodce Situační otisky Registrace skusu Position Penta /Quick Silikonový otiskovací materiál pro pomocné otisky Imprint Bite Silikonový otiskovací materiál pro registraci skusu Všechny typické
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.sukls90890/2011 PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.sukls90890/2011 PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE DICLOREUM, injekční roztok (diclofenacum natricum) Přečtěte si pozorně celou příbalovou
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.sukls90890/2011 PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE DICLOREUM, injekční roztok (diclofenacum natricum) Přečtěte si pozorně celou příbalovou
Hygiena zubů a dutiny ústní
 Hygiena zubů a dutiny ústní Zdraví vs orální zdraví Orální zdraví a zdraví celého organizmu spolu úzce souvisí Infekce v dutině ústní mohou vést k rozvoji zánětu zubů nebo dásní. Lidské zdraví je nedělitelné,
Hygiena zubů a dutiny ústní Zdraví vs orální zdraví Orální zdraví a zdraví celého organizmu spolu úzce souvisí Infekce v dutině ústní mohou vést k rozvoji zánětu zubů nebo dásní. Lidské zdraví je nedělitelné,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CHLORID SODNÝ 0,9% BAXTER 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Natrii chloridum: 9,0 g/l Jeden ml roztoku obsahuje 9 mg natrii chloridum mmol/l: Na + : 154
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CHLORID SODNÝ 0,9% BAXTER 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Natrii chloridum: 9,0 g/l Jeden ml roztoku obsahuje 9 mg natrii chloridum mmol/l: Na + : 154
Propofol Abbott. Příbalová informace. Informace pro použití, čtěte pozorně! Propofol Abbott (Propofolum) Injekční emulze
 Propofol Abbott Příbalová informace Informace pro použití, čtěte pozorně! Propofol Abbott (Propofolum) Injekční emulze Držitel rozhodnutí o registraci Abbott Laboratories s.r.o., Praha, Česká republika
Propofol Abbott Příbalová informace Informace pro použití, čtěte pozorně! Propofol Abbott (Propofolum) Injekční emulze Držitel rozhodnutí o registraci Abbott Laboratories s.r.o., Praha, Česká republika
Sp.zn.sukls185381/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls185381/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MINOXIDIL LAVINELI 5% kožní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Minoxidilum 50 mg/ml (5% w/v). Jeden střik spreje MINOXIDIL
Sp.zn.sukls185381/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MINOXIDIL LAVINELI 5% kožní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Minoxidilum 50 mg/ml (5% w/v). Jeden střik spreje MINOXIDIL
PRIME&BOND NT Dentální adhezívum na bázi Nano-Technologie
 Návod k použití PRIME&BOND NT Dentální adhezívum na bázi Nano-Technologie Prime&Bond NT je univerzální adhezivní prostředek spojující účinek primeru i bondu, vážící kompozitní a kompomerní materiály k
Návod k použití PRIME&BOND NT Dentální adhezívum na bázi Nano-Technologie Prime&Bond NT je univerzální adhezivní prostředek spojující účinek primeru i bondu, vážící kompozitní a kompomerní materiály k
Vykazuje se na akutních lůžkách interních oborů (1_1, 1_6, 1_7, 1_9, 2_1, 2_2, 2_5, 2_7, 2_9, 4_2, 4_3, 4_4, 4_7). 0.0 237.0 0 0 0.30 7.
 00041 000 A JEDEN DEN POBYTU PACIENTA VE STACIONÁŘI I. Vykazuje se, pokud délka pobytu dosáhne alespoň 8 hodin. V případě stacionáře s psychoterapeutickým programem (jako důvodem k přijetí do stacionáře),
00041 000 A JEDEN DEN POBYTU PACIENTA VE STACIONÁŘI I. Vykazuje se, pokud délka pobytu dosáhne alespoň 8 hodin. V případě stacionáře s psychoterapeutickým programem (jako důvodem k přijetí do stacionáře),
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Bupivacaini hydrochloridum 5,0 mg v 1 ml injekčního roztoku. Úplný seznam pomocných látek viz bod 6.1.
 Příloha č. 3 ke sdělení sp. zn. sukls120434/2011 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU MARCAINE 0,5% Injekční roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Bupivacaini hydrochloridum 5,0 mg v 1
Příloha č. 3 ke sdělení sp. zn. sukls120434/2011 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU MARCAINE 0,5% Injekční roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Bupivacaini hydrochloridum 5,0 mg v 1
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat.
 sp.zn. sukls88228/2014 Příbalová informace: Informace pro uživatele BONEFOS koncentrát pro infuzní roztok (Dinatrii clodronas) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls88228/2014 Příbalová informace: Informace pro uživatele BONEFOS koncentrát pro infuzní roztok (Dinatrii clodronas) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Insulinum humanum, rdna (vyrobený rekombinantní DNA technologií na Saccharomyces cerevisiae).
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Insulatard 100 m.j./ml Injekční suspenze v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Insulinum humanum, rdna (vyrobený rekombinantní DNA technologií
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Insulatard 100 m.j./ml Injekční suspenze v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Insulinum humanum, rdna (vyrobený rekombinantní DNA technologií
Příbalová informace: informace pro uživatele. Enap i.v. 1,25 mg/1 ml injekční roztok enalaprilatum dihydricum
 sp.zn. sukls184192/2014 Příbalová informace: informace pro uživatele Enap i.v. 1,25 mg/1 ml injekční roztok enalaprilatum dihydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn. sukls184192/2014 Příbalová informace: informace pro uživatele Enap i.v. 1,25 mg/1 ml injekční roztok enalaprilatum dihydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Esomeprazole Farmaprojects 40 mg, prášek pro přípravu infuzního/injekčního roztoku Esomeprazolum
 Sp.zn.sukls28217/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Esomeprazole Farmaprojects 40 mg, prášek pro přípravu infuzního/injekčního roztoku Esomeprazolum Přečtěte si pozorně celou příbalovou
Sp.zn.sukls28217/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Esomeprazole Farmaprojects 40 mg, prášek pro přípravu infuzního/injekčního roztoku Esomeprazolum Přečtěte si pozorně celou příbalovou
Naší filosofií je věda pro praxi
 HUMANCHEMIE GMBH D 31061 Alfeld/Leine Tel.: +49 (0)5181 24633 Fax: +49 (0)5181 81226 Web: www.humanchemie.de Certifikováno MED/CERT podle DIN EN ISO 13488/ISO 9002: 1994 Vše co potřebujete pro zachování
HUMANCHEMIE GMBH D 31061 Alfeld/Leine Tel.: +49 (0)5181 24633 Fax: +49 (0)5181 81226 Web: www.humanchemie.de Certifikováno MED/CERT podle DIN EN ISO 13488/ISO 9002: 1994 Vše co potřebujete pro zachování
OPATŘENÍ PŘEDSTAVENSTVA ČESKÉ STOMATOLOGICKÉ KOMORY
 OPATŘENÍ PŘEDSTAVENSTVA ČESKÉ STOMATOLOGICKÉ KOMORY OP 1/2009 Základní odborná příprava a profesní zkouška pro získání Osvědčení odbornosti praktický zubní lékař... 1 OP 2/2009 Rozšířená odborná příprava
OPATŘENÍ PŘEDSTAVENSTVA ČESKÉ STOMATOLOGICKÉ KOMORY OP 1/2009 Základní odborná příprava a profesní zkouška pro získání Osvědčení odbornosti praktický zubní lékař... 1 OP 2/2009 Rozšířená odborná příprava
1 ml obsahuje xylometazolini hydrochloridum 0,5 mg a ipratropii bromidum 0,6 mg.
 sp.zn. sukls65458/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Otrivin Rhinostop 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje xylometazolini hydrochloridum 0,5 mg a ipratropii bromidum 0,6
sp.zn. sukls65458/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Otrivin Rhinostop 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje xylometazolini hydrochloridum 0,5 mg a ipratropii bromidum 0,6
Léčiva používaná u chorob kardiovaskulárního systému
 Léčiva používaná u chorob kardiovaskulárního systému Poruchy srdečního rytmu Vznikají na podkladě poruchy rychlosti, pravidelnosti, vzniku a vedení nervového vzruchu Příčinou těchto poruch je poškození
Léčiva používaná u chorob kardiovaskulárního systému Poruchy srdečního rytmu Vznikají na podkladě poruchy rychlosti, pravidelnosti, vzniku a vedení nervového vzruchu Příčinou těchto poruch je poškození
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. CARVESAN 6,25 CARVESAN 25 tablety carvedilolum
 Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn. sukls249285/2011, sukls249280/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CARVESAN 6,25 CARVESAN 25 tablety carvedilolum Přečtěte si pozorně
Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn. sukls249285/2011, sukls249280/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CARVESAN 6,25 CARVESAN 25 tablety carvedilolum Přečtěte si pozorně
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MIFLONID 200 MIFLONID 400 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Prášek k inhalaci v tvrdých tobolkách užívaný v kombinaci s Aerolizerem. Jedna tobolka obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MIFLONID 200 MIFLONID 400 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Prášek k inhalaci v tvrdých tobolkách užívaný v kombinaci s Aerolizerem. Jedna tobolka obsahuje
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. GLUCIENT 500 mg tablety s prodlouženým uvolňováním metformini hydrochloridum
 Příloha č.2 k rozhodnutí o registraci sp.zn.sukls44373/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE GLUCIENT 500 mg tablety s prodlouženým uvolňováním metformini hydrochloridum Přečtěte si pozorně
Příloha č.2 k rozhodnutí o registraci sp.zn.sukls44373/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE GLUCIENT 500 mg tablety s prodlouženým uvolňováním metformini hydrochloridum Přečtěte si pozorně
sp.zn. sukls66229/2015 Příbalová informace: informace pro uživatele
 sp.zn. sukls66229/2015 Příbalová informace: informace pro uživatele Iomeron 150, injekční roztok Iomeron 200, injekční roztok Iomeron 250, injekční roztok Iomeron 300, injekční roztok Iomeron 350, injekční
sp.zn. sukls66229/2015 Příbalová informace: informace pro uživatele Iomeron 150, injekční roztok Iomeron 200, injekční roztok Iomeron 250, injekční roztok Iomeron 300, injekční roztok Iomeron 350, injekční
Mast také obsahuje 36 mg propylenglykolu a 140 mg lanolinu v 1 gramu rektální masti.
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls41675/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rectogesic 4 mg/g rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Glyceroli trinitras:
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls41675/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rectogesic 4 mg/g rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Glyceroli trinitras:
Jeden ml obsahuje dorzolamidi hydrochloridum 22,26 mg odpovídající dorzolamidum 20 mg.
 1. NÁZEV PŘÍPRAVKU Trusopt free bez konzervačních přísad 20 mg/ml oční kapky, roztok v jednodávkovém obalu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje dorzolamidi hydrochloridum 22,26 mg
1. NÁZEV PŘÍPRAVKU Trusopt free bez konzervačních přísad 20 mg/ml oční kapky, roztok v jednodávkovém obalu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje dorzolamidi hydrochloridum 22,26 mg
Antianginózní látky, kardiotonika, antiarytmika. Milan Sova
 Antianginózní látky, kardiotonika, antiarytmika Milan Sova Antianginózní látky Antianginózní látky Léčba anginy pectoris projev Ischemické choroby srdeční (ICHS) Používan vané skupiny látek: l Organické
Antianginózní látky, kardiotonika, antiarytmika Milan Sova Antianginózní látky Antianginózní látky Léčba anginy pectoris projev Ischemické choroby srdeční (ICHS) Používan vané skupiny látek: l Organické
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls25947/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ditropan 5 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje oxybutynini hydrochloridum 5 mg v jedné tabletě. Pomocné
sp.zn.sukls25947/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ditropan 5 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje oxybutynini hydrochloridum 5 mg v jedné tabletě. Pomocné
Cenové rozhodnutí Ministerstva zdravotnictví ze dne 20. prosince 2007, I. Základní pojmy. II. Způsob cenové regulace
 Cenové rozhodnutí Ministerstva zdravotnictví ze dne 20. prosince 2007, kterým se stanoví maximální ceny zdravotní péče zubních lékařů hrazené z veřejného zdravotního pojištění a stomatologických výrobků
Cenové rozhodnutí Ministerstva zdravotnictví ze dne 20. prosince 2007, kterým se stanoví maximální ceny zdravotní péče zubních lékařů hrazené z veřejného zdravotního pojištění a stomatologických výrobků
PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE. NEOFOLLIN Injekční roztok Estradioli valeras
 sp. zn. sukls75049/2013 PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE NEOFOLLIN Injekční roztok Estradioli valeras Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
sp. zn. sukls75049/2013 PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE NEOFOLLIN Injekční roztok Estradioli valeras Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Ebrantil i.v. 25, injekční roztok Ebrantil i.v. 50, injekční roztok urapidilum
 sp.zn. sukls144430/2014 Příbalová informace: informace pro pacienta Ebrantil i.v. 25, injekční roztok Ebrantil i.v. 50, injekční roztok urapidilum Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn. sukls144430/2014 Příbalová informace: informace pro pacienta Ebrantil i.v. 25, injekční roztok Ebrantil i.v. 50, injekční roztok urapidilum Přečtěte si pozorně celou příbalovou informaci dříve,
BEZPEČNOSTNÍ LIST (dle zákona č. 356/2003Sb. a Vyhlášky č. 231/2004 Sb.) Datum vydání: 21.7.2005 Datum revize: 8.3.2006 Strana: 1 ze 6 Název výrobku:
 Datum vydání: 21.7.2005 Datum revize: 8.3.2006 Strana: 1 ze 6 1. IDENTIFIKACE LÁTKY / PŘÍPRAVKU A VÝROBCE A DOVOZCE 1.1 Chemický název látky / obchodní název přípravku Název: Další názvy látky: -- 1.2
Datum vydání: 21.7.2005 Datum revize: 8.3.2006 Strana: 1 ze 6 1. IDENTIFIKACE LÁTKY / PŘÍPRAVKU A VÝROBCE A DOVOZCE 1.1 Chemický název látky / obchodní název přípravku Název: Další názvy látky: -- 1.2
Příbalová informace: informace pro uživatele. Bisogamma 5 potahované tablety Bisoprololi fumaras
 sp.zn.sukls112700/2015 Příbalová informace: informace pro uživatele Bisogamma 5 potahované tablety Bisoprololi fumaras Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn.sukls112700/2015 Příbalová informace: informace pro uživatele Bisogamma 5 potahované tablety Bisoprololi fumaras Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Arteriální hypertenze vysoký krevní tlak
 Arteriální hypertenze vysoký krevní tlak Onemocnění charakterizované zvýšeným tepenným tlakem ve velkém krevním oběhu je hypertenze arteriální. Jedno z nejčastějších onemocnění, jehož příčina není známa.
Arteriální hypertenze vysoký krevní tlak Onemocnění charakterizované zvýšeným tepenným tlakem ve velkém krevním oběhu je hypertenze arteriální. Jedno z nejčastějších onemocnění, jehož příčina není známa.
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls157416/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls157416/2011 1. NÁZEV PŘÍPRAVKU Aspirin 100 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tableta obsahuje léčivou látku:
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls157416/2011 1. NÁZEV PŘÍPRAVKU Aspirin 100 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tableta obsahuje léčivou látku:
sp.zn. sukls127336/2013 sukls53259/2014
 sp.zn. sukls127336/2013 sukls53259/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BETOPTIC S oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml suspenze obsahuje betaxololum 2,5 mg
sp.zn. sukls127336/2013 sukls53259/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BETOPTIC S oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml suspenze obsahuje betaxololum 2,5 mg
Příbalová informace: informace pro pacienta. SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum
 Příbalová informace: informace pro pacienta SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Příbalová informace: informace pro pacienta SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Heal Ozone. Obr. 1 Přístroj HealOzone
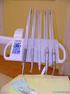 Heal Ozone Ošetření počátečního zubního kazu bez vrtání, bez strachu a hlavně bez bolesti novou převratnou technologií, která je vhodná pro děti i dospělé. Ozonoterapie se již po delší dobu použije v medicíně
Heal Ozone Ošetření počátečního zubního kazu bez vrtání, bez strachu a hlavně bez bolesti novou převratnou technologií, která je vhodná pro děti i dospělé. Ozonoterapie se již po delší dobu použije v medicíně
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU CHIROCAINE 5 mg/ml CHIROCAINE 7,5 mg/ml Injekční roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVANTITATIVNÍ A KVALITATIVNÍ SLOŽENÍ CHIROCAINE 5 mg/ml Léčivá látka: Levobupivacaini hydrochloridum
1. NÁZEV PŘÍPRAVKU CHIROCAINE 5 mg/ml CHIROCAINE 7,5 mg/ml Injekční roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVANTITATIVNÍ A KVALITATIVNÍ SLOŽENÍ CHIROCAINE 5 mg/ml Léčivá látka: Levobupivacaini hydrochloridum
Insulatard Penfill 100 mezinárodních jednotek/ml injekční suspenze v zásobní vložce.
 1. NÁZEV PŘÍPRAVKU Insulatard Penfill 100 mezinárodních jednotek/ml injekční suspenze v zásobní vložce. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 zásobní vložka obsahuje 3 ml, což odpovídá 300 mezinárodním
1. NÁZEV PŘÍPRAVKU Insulatard Penfill 100 mezinárodních jednotek/ml injekční suspenze v zásobní vložce. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 zásobní vložka obsahuje 3 ml, což odpovídá 300 mezinárodním
Anesia 10 mg/ml injekční/infuzní emulze
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls159819/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Anesia 10 mg/ml injekční/infuzní emulze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml injekční/infuzní
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls159819/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Anesia 10 mg/ml injekční/infuzní emulze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml injekční/infuzní
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Topotecan medac 1 mg/ml koncentrát pro přípravu infuzního roztoku Topotecanum
 Sp.zn. sukls194934/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Topotecan medac 1 mg/ml koncentrát pro přípravu infuzního roztoku Topotecanum Přečtěte si pozorně celou příbalovou informaci dříve,
Sp.zn. sukls194934/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Topotecan medac 1 mg/ml koncentrát pro přípravu infuzního roztoku Topotecanum Přečtěte si pozorně celou příbalovou informaci dříve,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls51947/2012 a sp.zn.: sukls80411/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BETADINE 75 mg/ml kožní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml kožního roztoku obsahuje povidonum
sp.zn.: sukls51947/2012 a sp.zn.: sukls80411/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BETADINE 75 mg/ml kožní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml kožního roztoku obsahuje povidonum
SYNTOSTIGMIN 15 mg tablety neostigmini bromidum
 sp.zn.sukls159001/2015 Příbalová informace: informace pro pacienta SYNTOSTIGMIN 15 mg tablety neostigmini bromidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn.sukls159001/2015 Příbalová informace: informace pro pacienta SYNTOSTIGMIN 15 mg tablety neostigmini bromidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ. Trimetazidini dihydrochloridum 35 mg v jedné tabletě s řízeným uvolňováním.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Angizidine 35 mg, tablety s řízeným uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Trimetazidini dihydrochloridum 35 mg v jedné tabletě s řízeným uvolňováním.
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Angizidine 35 mg, tablety s řízeným uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Trimetazidini dihydrochloridum 35 mg v jedné tabletě s řízeným uvolňováním.
SLOŽENÍ Stroncium-aluminium-sodium-fluoro-fosforo silikátové sklo Titan dioxid (pouze v opákní verzi) Koiniciátor polymerace
 Návod k použití Dyract Cem Plus Chemicky tuhnoucí kompomerní fixační cement Dyract Cem Plus - fixační cement pro použití ve stomatologii - spojuje hlavní výhody skloionomerních cementů - vazbu k zubní
Návod k použití Dyract Cem Plus Chemicky tuhnoucí kompomerní fixační cement Dyract Cem Plus - fixační cement pro použití ve stomatologii - spojuje hlavní výhody skloionomerních cementů - vazbu k zubní
Dle studií nalezených v rámci literární rešerše jsou nejčastějšími příčinami poškození při hrudní drenáži tyto faktory:
 POŠKOZENÍ PACIENTA PŘI HRUDNÍ DRENÁŽI ZJIŠTĚNÉ RIZIKO Národní systém hlášení nežádoucích událostí obdržel hlášení o nežádoucí události při hrudní drenáži s následkem úmrtí pacienta. Při rešerši zahraničních
POŠKOZENÍ PACIENTA PŘI HRUDNÍ DRENÁŽI ZJIŠTĚNÉ RIZIKO Národní systém hlášení nežádoucích událostí obdržel hlášení o nežádoucí události při hrudní drenáži s následkem úmrtí pacienta. Při rešerši zahraničních
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls198250/2014 1. NÁZEV PŘÍPRAVKU Magnerot Tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje magnesii orotas dihydricus 500 mg (odpovídá 32,8 mg magnesia)
sp.zn. sukls198250/2014 1. NÁZEV PŘÍPRAVKU Magnerot Tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje magnesii orotas dihydricus 500 mg (odpovídá 32,8 mg magnesia)
Transmetil 500 mg injekce prášek pro přípravu injekčního roztoku s rozpouštědlem
 sp. zn. sukls175449/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Transmetil 500 mg injekce prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 lahvička
sp. zn. sukls175449/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Transmetil 500 mg injekce prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 lahvička
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Benfogamma 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 obalená tableta obsahuje: Benfotiaminum 50,0 mg Pomocné látky viz bod 6.1 3. LÉKOVÁ FORMA Obalené tablety.
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Benfogamma 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 obalená tableta obsahuje: Benfotiaminum 50,0 mg Pomocné látky viz bod 6.1 3. LÉKOVÁ FORMA Obalené tablety.
Gadovist 1,0 mmol/ml injekční roztok Gadobutrolum Gadovist 1,0 mmol/ml injekční roztok v předplněné injekční stříkačce Gadobutrolum
 Sp.z. sukls177880/2014 a k sp.zn. sukls129971/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Gadovist 1,0 mmol/ml injekční roztok Gadobutrolum Gadovist 1,0 mmol/ml injekční roztok v předplněné injekční
Sp.z. sukls177880/2014 a k sp.zn. sukls129971/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Gadovist 1,0 mmol/ml injekční roztok Gadobutrolum Gadovist 1,0 mmol/ml injekční roztok v předplněné injekční
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Metronidazol B. Braun 5 mg/ml, infuzní roztok. metronidazolum
 sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Metronidazol B. Braun 5 mg/ml, infuzní roztok metronidazolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Metronidazol B. Braun 5 mg/ml, infuzní roztok metronidazolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn. sukls54203/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Digoxin 0,125 Léčiva Tablety Digoxinum 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 sp.zn. sukls54203/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Digoxin 0,125 Léčiva Tablety Digoxinum 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje digoxinum 0,125 mg. Pomocná látka
sp.zn. sukls54203/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Digoxin 0,125 Léčiva Tablety Digoxinum 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje digoxinum 0,125 mg. Pomocná látka
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls7946//2008
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls7946//2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Imigran Injekční roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden mililitr injekčního
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls7946//2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Imigran Injekční roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden mililitr injekčního
Rytmonorm. Souhrn údajů o přípravku ABBOTT Rytmonorm 1. NÁZEV PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU Rytmonorm 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Propafenoni hydrochloridum 70 mg ve 20 ml injekčního roztoku Pomocné látky viz bod 6.1 3. LÉKOVÁ FORMA Injekční roztok
1. NÁZEV PŘÍPRAVKU Rytmonorm 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Propafenoni hydrochloridum 70 mg ve 20 ml injekčního roztoku Pomocné látky viz bod 6.1 3. LÉKOVÁ FORMA Injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NO-SPA injekční roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Drotaverini hydrochloridum 40 mg ve 2 ml injekčního roztoku nebo 80 mg ve 4 ml injekčního roztoku
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NO-SPA injekční roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Drotaverini hydrochloridum 40 mg ve 2 ml injekčního roztoku nebo 80 mg ve 4 ml injekčního roztoku
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Valsacor 40 mg Valsacor 80 mg Valsacor 160 mg potahované tablety valsartanum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Valsacor 40 mg Valsacor 80 mg Valsacor 160 mg potahované tablety valsartanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Valsacor 40 mg Valsacor 80 mg Valsacor 160 mg potahované tablety valsartanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Injekční roztok. Tmavě hnědý, neprůhledný roztok s ph 5,0 7,0 a s přibližnou osmolaritou 400 mosm/l.
 sp.zn. sukls57833/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli
sp.zn. sukls57833/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Nasic pro děti nosní sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 10 gramů roztoku obsahuje 5 mg xylometazolini hydrochloridum a 500 mg dexpanthenolum.
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Nasic pro děti nosní sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 10 gramů roztoku obsahuje 5 mg xylometazolini hydrochloridum a 500 mg dexpanthenolum.
Příloha č. 3 ke sdělení sp.zn. sukls75515/2010
 Příloha č. 3 ke sdělení sp.zn. sukls75515/2010 1. Název přípravku Begrivac Souhrn údajů o přípravku Sezóna 2008/2009 Injekční suspenze v předplněných injekčních stříkačkách Vakcína proti chřipce (inaktivovaná,
Příloha č. 3 ke sdělení sp.zn. sukls75515/2010 1. Název přípravku Begrivac Souhrn údajů o přípravku Sezóna 2008/2009 Injekční suspenze v předplněných injekčních stříkačkách Vakcína proti chřipce (inaktivovaná,
Příloha č. 2 k rozhodnutí o změně sp.zn.sukls17828/10 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně sp.zn.sukls17828/10 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROSTIN 15 M 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden mililitr injekčního roztoku obsahuje 0,332 mg
Příloha č. 2 k rozhodnutí o změně sp.zn.sukls17828/10 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROSTIN 15 M 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden mililitr injekčního roztoku obsahuje 0,332 mg
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls10679/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls10679/2012 1. NÁZEV PŘÍPRAVKU THYMOGLOBULINE 5 mg/ml, prášek pro infuzní roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls10679/2012 1. NÁZEV PŘÍPRAVKU THYMOGLOBULINE 5 mg/ml, prášek pro infuzní roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls13958/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU Zofran Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls13958/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ondansetronum, 16 mg v jednom čípku. 3. LÉKOVÁ
1. NÁZEV PŘÍPRAVKU Zofran Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls13958/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ondansetronum, 16 mg v jednom čípku. 3. LÉKOVÁ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 1. NÁZEV PŘÍPRAVKU Nitresan 10 mg Nitresan 20 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 1. NÁZEV PŘÍPRAVKU Nitresan 10 mg Nitresan 20 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. PROPAFENON AL 150 PROPAFENON AL 300 potahované tablety propafenoni hydrochloridum
 Příloha č.1 ke sdělení sp.zn.sukls8522/2012 a sukls8523/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PROPAFENON AL 150 PROPAFENON AL 300 potahované tablety propafenoni hydrochloridum Přečtěte si pozorně
Příloha č.1 ke sdělení sp.zn.sukls8522/2012 a sukls8523/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PROPAFENON AL 150 PROPAFENON AL 300 potahované tablety propafenoni hydrochloridum Přečtěte si pozorně
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ANTITHROMBIN III NF BAXTER, prášek pro přípravu infuzního roztoku s rozpouštědlem 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ 1 ml rozpuštěného přípravku obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ANTITHROMBIN III NF BAXTER, prášek pro přípravu infuzního roztoku s rozpouštědlem 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ 1 ml rozpuštěného přípravku obsahuje
HEREDITÁRNÍ ANGIOEDÉM KAZUISTIKA
 HEREDITÁRNÍ ANGIOEDÉM KAZUISTIKA Ústav klinické imunologie a alergologie Univerzitní centrum pro primární imunodeficience LF MU a FN u sv. Anny v Brně Alena Plodíková Ivana Denková Helena Horáková 1 Hereditární
HEREDITÁRNÍ ANGIOEDÉM KAZUISTIKA Ústav klinické imunologie a alergologie Univerzitní centrum pro primární imunodeficience LF MU a FN u sv. Anny v Brně Alena Plodíková Ivana Denková Helena Horáková 1 Hereditární
BEZPEČNOSTNÍ LIST (podle Nařízení ES č. 1907/2006) Datum vydání: 9.9.2004 Datum revize: 8.12.2008 Strana: 1 z 6 Název výrobku:
 Datum vydání: 9.9.2004 Datum revize: 8.12.2008 Strana: 1 z 6 1. IDENTIFIKACE LÁTKY NEBO PŘÍPRAVKU A SPOLEČNOSTI NEBO PODNIKU 1.1 Identifikace látky nebo přípravku Název: Další názvy látky: -- 1.2 Použití
Datum vydání: 9.9.2004 Datum revize: 8.12.2008 Strana: 1 z 6 1. IDENTIFIKACE LÁTKY NEBO PŘÍPRAVKU A SPOLEČNOSTI NEBO PODNIKU 1.1 Identifikace látky nebo přípravku Název: Další názvy látky: -- 1.2 Použití
Příbalová informace: informace pro uživatele. Prostavasin prášek pro infuzní roztok Alprostadilum
 Příbalová informace: informace pro uživatele Prostavasin prášek pro infuzní roztok Alprostadilum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Příbalová informace: informace pro uživatele Prostavasin prášek pro infuzní roztok Alprostadilum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Léčivá látka: 100 ml roztoku obsahuje chlorhexidini digluconas 0,2 g, jako chlorhexidini digluconatis solutio 1 ml ve 100 ml roztoku.
 sp.zn. sukls108682/2012 a sp.zn. sukls64237/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Corsodyl 2 mg/ml Roztok pro ústní výplach 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 100 ml roztoku
sp.zn. sukls108682/2012 a sp.zn. sukls64237/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Corsodyl 2 mg/ml Roztok pro ústní výplach 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 100 ml roztoku
sp.zn.sukls188553/2014
 sp.zn.sukls188553/2014 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU tablety s prodlouženým uvolňováním. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním obsahuje pentoxifyllinum
sp.zn.sukls188553/2014 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU tablety s prodlouženým uvolňováním. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním obsahuje pentoxifyllinum
Infuzní roztok. Roztok je čirý, bezbarvý až slabě narůžověle-oranžový. Vnímání zabarvení se může lišit. Teoretická osmolarita: 305 mosm/l ph: 4,5 5,5
 Sp.zn.sukls176520/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Paracetamol B. Braun 10 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml infuzního roztoku obsahuje paracetamolum
Sp.zn.sukls176520/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Paracetamol B. Braun 10 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml infuzního roztoku obsahuje paracetamolum
Příbalová informace: informace pro uživatele. Nimbex Injekční roztok Cisatracurii besilas
 Příbalová informace: informace pro uživatele Nimbex Injekční roztok Cisatracurii besilas Přečtěte si pozorně celou příbalovou informaci dříve, než vám bude tento přípravek podán, protože obsahuje pro Vás
Příbalová informace: informace pro uživatele Nimbex Injekční roztok Cisatracurii besilas Přečtěte si pozorně celou příbalovou informaci dříve, než vám bude tento přípravek podán, protože obsahuje pro Vás
SAVO PEREX svěží vůně / SAVO PEREX květinová vůně
 Datum vydání: 31.5.2004 Datum revize: 3.12.2009 Strana: 1 z 5 1. IDENTIFIKACE LÁTKY / PŘÍPRAVKU A SPOLEČNOSTI 1.1 Chemický název látky / obchodní název přípravku Název: Další názvy látky: Savo Perex 1.2
Datum vydání: 31.5.2004 Datum revize: 3.12.2009 Strana: 1 z 5 1. IDENTIFIKACE LÁTKY / PŘÍPRAVKU A SPOLEČNOSTI 1.1 Chemický název látky / obchodní název přípravku Název: Další názvy látky: Savo Perex 1.2
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls250585/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls250585/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SALBUTAMOL WZF POLFA 2 SALBUTAMOL WZF POLFA 4 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls250585/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SALBUTAMOL WZF POLFA 2 SALBUTAMOL WZF POLFA 4 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna kapka obsahuje přibližně 1,5 mikrogramů latanoprostu.
 Příloha č. 3 k rozhodnutí o registraci sp.zn.sukls99149/2008 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Arulatan 50 mikrogramů/ml, oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml očních
Příloha č. 3 k rozhodnutí o registraci sp.zn.sukls99149/2008 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Arulatan 50 mikrogramů/ml, oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml očních
Souhrn údajů o přípravku PHOXILIUM 1,2 MMOL/L FOSFÁT
 Příloha č. 2a k rozhodnutí o změně registrace sp. zn. sukls58787/2011 Souhrn údajů o přípravku PHOXILIUM 1,2 MMOL/L FOSFÁT 1. Název přípravku PHOXILIUM 1,2 mmol/l fosfát Roztok pro hemodialýzu/hemofiltraci
Příloha č. 2a k rozhodnutí o změně registrace sp. zn. sukls58787/2011 Souhrn údajů o přípravku PHOXILIUM 1,2 MMOL/L FOSFÁT 1. Název přípravku PHOXILIUM 1,2 mmol/l fosfát Roztok pro hemodialýzu/hemofiltraci
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls174802/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU DICLOABAK 1 mg/ml, oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum natricum...1
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls174802/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU DICLOABAK 1 mg/ml, oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum natricum...1
PODPOŘ SVÉ ZDRAVÍ. www.podporsvezdravi.cz. Zácpa. Průjem. Hemoroidy. Obezita & Diabetes. Srdce & Cévy. Obezita & Diabetes. Srdce & Cévy.
 FENOLAX EUCARBON TASECTAN CARBO MED. MULTILAC DOBEXIL H OmegaDefend BAYFLEX EMOXEN GEL CandyS PŘESNÉ DÁVKOVÁNÍ FENOLAX Projímadlo v tabletách 5 mg 30 tablet FENOLAX www.fenolax.cz Pomáhá při akutní zácpě
FENOLAX EUCARBON TASECTAN CARBO MED. MULTILAC DOBEXIL H OmegaDefend BAYFLEX EMOXEN GEL CandyS PŘESNÉ DÁVKOVÁNÍ FENOLAX Projímadlo v tabletách 5 mg 30 tablet FENOLAX www.fenolax.cz Pomáhá při akutní zácpě
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Nolpaza 40mg prášek pro přípravu injekčního roztoku pantoprazolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Nolpaza 40mg prášek pro přípravu injekčního roztoku pantoprazolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BISOCARD 5 BISOCARD 10 potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Bisocard 5: Jedna potahovaná tableta obsahuje bisoprololi fumaras 5 mg Bisocard
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BISOCARD 5 BISOCARD 10 potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Bisocard 5: Jedna potahovaná tableta obsahuje bisoprololi fumaras 5 mg Bisocard
OPATŘENÍ PŘEDSTAVENSTVA ČESKÉ STOMATOLOGICKÉ KOMORY
 OPATŘENÍ PŘEDSTAVENSTVA ČESKÉ STOMATOLOGICKÉ KOMORY OP1/2009 Základní odborná příprava a profesní zkouška pro získání Osvědčení odbornosti praktický zubní lékař... 1 OP2/2009 Rozšířená odborná příprava
OPATŘENÍ PŘEDSTAVENSTVA ČESKÉ STOMATOLOGICKÉ KOMORY OP1/2009 Základní odborná příprava a profesní zkouška pro získání Osvědčení odbornosti praktický zubní lékař... 1 OP2/2009 Rozšířená odborná příprava
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE. NUROFEN PRO DĚTI JAHODA perorální suspenze ibuprofenum
 sp.zn.sukls73463/2014 dávkovací lžička PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE NUROFEN PRO DĚTI JAHODA perorální suspenze ibuprofenum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete
sp.zn.sukls73463/2014 dávkovací lžička PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE NUROFEN PRO DĚTI JAHODA perorální suspenze ibuprofenum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Klimicin injekční roztok. clindamycinum
 sp.zn.sukls213147/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Klimicin injekční roztok clindamycinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp.zn.sukls213147/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Klimicin injekční roztok clindamycinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Doc. MUDr. Taťjana Dostálová, DrSc. FIXNÍ A SNÍMATELNÁ PROTETIKA. Recenze: Doc. MUDr. Jiøí Bittner, CSc. MUDr. Marie Bartoòová, CSc.
 Doc. MUDr. Taťjana Dostálová, DrSc. FIXNÍ A SNÍMATELNÁ PROTETIKA Recenze: Doc. MUDr. Jiøí Bittner, CSc. MUDr. Marie Bartoòová, CSc. Grada Publishing, a.s., 2004 Cover Photo Allphoto Images, 2004 Vydala
Doc. MUDr. Taťjana Dostálová, DrSc. FIXNÍ A SNÍMATELNÁ PROTETIKA Recenze: Doc. MUDr. Jiøí Bittner, CSc. MUDr. Marie Bartoòová, CSc. Grada Publishing, a.s., 2004 Cover Photo Allphoto Images, 2004 Vydala
BEZPEČNOSTNÍ LIST (podle Nařízení ES č. 1907/2006) Datum vydání: 27.5.2008 Datum revize: Strana: 1 z 6 Název výrobku:
 Datum vydání: 27.5.2008 Datum revize: Strana: 1 z 6 1. IDENTIFIKACE LÁTKY NEBO PŘÍPRAVKU A SPOLEČNOSTI NEBO PODNIKU 1.1 Identifikace látky nebo přípravku Název: Chloramin TS Další názvy látky: přípravek
Datum vydání: 27.5.2008 Datum revize: Strana: 1 z 6 1. IDENTIFIKACE LÁTKY NEBO PŘÍPRAVKU A SPOLEČNOSTI NEBO PODNIKU 1.1 Identifikace látky nebo přípravku Název: Chloramin TS Další názvy látky: přípravek
Anafylaxe vážná hrozba alergie
 Anafylaxe vážná hrozba alergie Úvod Anafylaxe je náhle vzniklý a život ohrožující stav, jehož příčinou je ve většině případů prudká reakce organismu na kontakt s látkou vyvolávající alergii. Termín anafylaxe
Anafylaxe vážná hrozba alergie Úvod Anafylaxe je náhle vzniklý a život ohrožující stav, jehož příčinou je ve většině případů prudká reakce organismu na kontakt s látkou vyvolávající alergii. Termín anafylaxe
sp.zn.sukls49419/2013 (dávkovací trubička)
 sp.zn.sukls49419/2013 (dávkovací trubička) PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE NUROFEN PRO DĚTI ibuprofenum Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro Vás důležité údaje.
sp.zn.sukls49419/2013 (dávkovací trubička) PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE NUROFEN PRO DĚTI ibuprofenum Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro Vás důležité údaje.
