Pokyny pro zdravotnické pracovníky
|
|
|
- Štěpánka Staňková
- před 8 lety
- Počet zobrazení:
Transkript
1 Edukační materiál Pokyny pro zdravotnické pracovníky Použití přípravku (alemtuzumab) u pacientů s relabující-remitující roztroušenou sklerózou (RRRS) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Jakékoli podezření na závažný nebo neočekávaný nežádoucí účinek a jiné skutečnosti závažné pro zdraví léčených osob musí být hlášeno Státnímu ústavu pro kontrolu léčiv. Podrobnosti o hlášení najdete na: Adresa pro zasílání je Státní ústav pro kontrolu léčiv, oddělení farmakovigilance, Šrobárova 48, Praha 10, , farmakovigilance@sukl.cz. Pokud se hlášení týká biologického léčiva, je třeba doplnit i přesný obchodní název a číslo šarže. Tato informace může být také hlášena společnosti sanofi-aventis, s.r.o..
2 Obsah 1. Úvod k přípravku 3 2. Jaká pozdní rizika jsou spojena s použitím přípravku? 5 3. Přehled doporučeného monitorování pacientů 9 4. Péče o pacienty léčené přípravkem Lemtrada Další informace Nejčastější otázky 13 Přehled informací o přípravku Lemtrada Přípravek je indikován k léčbě dospělých pacientů s relabující-remitující roztroušenou sklerózou (RRRS) v aktivním stádiu onemocnění definovaném klinickými příznaky nebo nálezem daným zobrazovacími metodami. Tyto pokyny byly vypracovány v rámci plánu řízení rizik (RMP) pro předepisující lékaře a zdravotnické pracovníky (HCP) podílející se na péči o pacienty léčené přípravkem, k zajištění dalších informací ohledně potenciálních závažných rizik spojených s použitím přípravku. Na následujících stránkách je uveden popis rizik spojených s použitím přípravku, která zahrnují: Autoimunitní stavy, včetně: > imunitní trombocytopenické purpury (ITP), > nefropatií, včetně onemocnění s tvorbou protilátek proti glomerulární bazální membráně (anti-gbm), > poruch štítné žlázy. Tyto pokyny dále obsahují důležité informace o tom, jak zmírnit uvedená rizika prostřednictvím konzultací, monitorování a managementu pacientů. Upozorňujeme, že tyto pokyny nezahrnují všechna rizika spojená s použitím přípravku a nenahrazují Souhrn údajů o přípravku (SPC). Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakékoli podezření na nežádoucí účinky. 1. Úvod k přípravku Přípravek je indikován k léčbě dospělých pacientů s relabující-remitující roztroušenou sklerózou (RRRS) v aktivním stádiu onemocnění definovaném klinickými příznaky nebo nálezem daným zobrazovacími metodami. je monoklonální protilátka podávaná nitrožilně. Váže se na CD52, povrchový antigen přítomný ve vysokých hladinách na povrchu T a B lymfocytů, a v menší míře na NK buňkách, monocytech a makrofázích. Mechanismus, jakým přípravek uplatňuje svůj účinek u RS, není zcela vysvětlen. Výzkumy však ukazují na imunomodulační účinky prostřednictvím deplece a repopulace lymfocytů, včetně: > alterací v počtu, proporcích a vlastnostech některých podskupin lymfocytů po léčbě, > zvýšeného zastoupení podskupin regulačních T buněk, > zvýšeného zastoupení paměťových T a B lymfocytů, > přechodných účinků na složky vrozené imunity (tj. neutrofily, makrofágy, NK buňky). Za terapeutický účinek může odpovídat snížení hladin cirkulujících B a T buněk přípravkem a jejich následná repopulace. Použití alemtuzumabu je spojeno s rizikem závažných infekcí a autoimunitních stavů. Autoimunitní stavy se mohu objevit i mnoho let po léčbě a z hlediska závažnosti mohou být závažné až život ohrožující. Léčba přípravkem má být zahájena a sledována neurologem se zkušenostmi v léčbě pacientů s RS. Pro minimalizaci potenciálních rizik a vedlejších účinků přípravku se předepisující lékař a pacienti musí zavázat k následnému sledování po dobu 48 měsíců přípravku. Je důležité, aby pacienti vzali na vědomí, že je třeba pokračovat v monitorování, i když se cítí dobře a jejich RS je pod kontrolou. Navození spolupráce mezi vámi, vašim pacientem a vašim zdravotním týmem, a pečlivé zvážení, jak používat edukační nástroje pro pacienty, umožní pacientům, aby: > dodržovali docházku na předepsané periodické vyšetření, > včas identifikovali a hlásili symptomy, > získali včasnou a správnou léčbu v případě potřeby. Další informace jsou uvedeny v části pokynů s názvem Péče o pacienty léčené přípravkem. 2 Pokyny pro zdravotnické pracovníky Pokyny pro zdravotnické pracovníky 3
3 Pro ilustraci délky účinků léčby a délky požadovaného následného sledování si prosím prostudujte níže uvedené schéma s názvem Přehled a tabulku: Přehled monitorování při léčbě přípravkem. Přehled Začátek testování vzorků krve a moči před léčbou 1. cyklus léčby 5 dnů léčby 3 dny léčby Rok 1 Rok 2 Rok 3 Rok 4 Rok 5 Poznámka: 2 cykly léčby účinkují u většiny pacientů po dobu 2 let nebo i déle MONITOROVÁNÍ LÉČBY Pokračujte v monitorování po dobu 4 let 2. cyklus léčby Přehled monitorování při léčbě přípravkem. Stav Aktivita Načasování Imunitní trombocytopenická purpura (ITP) Nefropatie, včetně onemocnění anti-gbm Nefropatie, včetně onemocnění anti-gbm Onemocnění štítné žlázy U pacientek Lidský papilomavir (HPV) Kompletní krevní obraz a diferenciál Sérový kreatinin Analýza a mikroskopické vyšetření moči Funkční testy štítné žlázy (např. TSH) Screeningové vyšetření HPV Každé 3 měsíce, 1x ročně 2. Jaká pozdní rizika jsou spojena s použitím přípravku? Autoimunitní stavy Použití alemtuzumabu je spojeno s rizikem autoimunitních stavů, včetně: > imunitní trombocytopenické purpury (ITP), > poruch štítné žlázy, > nefropatií, včetně onemocnění s tvorbou protilátek proti glomerulární bazální membráně (anti-gbm). Tyto stavy mohou být závažné povahy, mohou vést k morbiditě a/nebo mortalitě, a mohou se objevit i mnoho let po léčbě. Časná detekce může zlepšit výsledky u pacientů, u nichž se tyto stavy vyskytnou. Je důležité pečlivě monitorovat laboratorní hodnoty a bedlivě sledovat příznaky a projevy. Prosím prostudujte si následující části pro lepší porozumění těmto rizikům. Imunitní trombocytopenická purpura (ITP) Imunitní trombocytopenická purpura je autoimunitní onemocnění, zpravidla spojené s tvorbou protilátek proti krevním destičkám. Deplece trombocytů snižuje srážlivost krve. Symptomy ITP mohou zahrnovat (mimo jiné) snadnou tvorbu modřin a krevních výronů, petechie, spontánní mukokutánní krvácení (např. epistaxe, hemoptýza), silnější menstruační krvácení v porovnání s normálním stavem nebo nepravidelné menstruační krvácení. Tyto klinické příznaky ITP se mohou objevit ještě před vznikem závažného krvácení. Cílem opatření na minimalizaci rizik, která jsou popsána v tomto dokumentu, je co nejdříve detekovat a léčit potenciální případy ITP. ITP může být závažným stavem vedoucím k morbiditě a mortalitě, a může se vyskytnout i několik let po podání léčby. V klinických hodnoceních byli pacienti pravidelně monitorováni a poučeni o příznacích a projevech ITP s cílem zajistit časnou detekci ITP. Na základě realizace těchto opatření byli pacienti s ITP diagnostikováni a léčeni včas a ve většině případů odpovídali na terapii první linie. Proto je nezbytné monitorovat všechny pacienty na ITP následujícím způsobem: > Kompletní krevní obraz a diferenciál je třeba provést před zahájením léčby a dále v měsíčních intervalech po dobu 48 měsíců. > Kontrola pacientů na klinické symptomy ITP. > Poučení pacientů o významu dodržování měsíčního monitorování krve a o potřebě pokračovat v tomto monitorování po dobu 48 měsíců. 4 Pokyny pro zdravotnické pracovníky Pokyny pro zdravotnické pracovníky 5
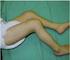
4 > Vzdělávání pacientů na téma jak rozpoznat symptomy související s ITP, a zdůraznění, že je zapotřebí zachovávat ostražitost. > Při podezření na ITP je třeba urychleně zahájit vhodné léčebné intervence, včetně okamžitého odeslání ke specialistovi. Závažné nebo rozsáhlé krvácení je život ohrožujícím stavem a vyžaduje okamžitou péči. Důležité informace o bezpečnosti použití přípravku jsou uvedeny v části Péče o pacienty léčené přípravkem. Potenciální rizika spojená s opakovanou léčbou přípravkem po výskytu ITP nejsou známa. Na podporu spolupráce/compliance pacientů byly vyvinuty speciální edukační nástroje pro pacienty. Podrobný popis těchto nástrojů je uveden v části Péče o pacienty léčené přípravkem. Zde je znázorněn příklad petechií na dolní končetině. Petechie jsou drobné, difúzně rozptýlené skvrnky pod kůží, které nabývají červené, fialové nebo purpurové barvy. Petechie se mohou vyskytnout kdekoli na těle pacienta, nemusí být omezeny pouze na oblast nohou. Příklady ITP Zde je znázorněn příklad nadměrné tvorby modřin. Modřiny se mohou vyskytnout kdekoli na těle pacienta. Zde je znázorněn příklad purpury pod jazykem. Purpura se může objevit na každé sliznici, včetně sliznic v ústní dutině (pod jazykem, na patře, na vnitřní části tváří, jazyku nebo dásních). Poznámka: Následující snímky mají pouze informační charakter a slouží jako příklad krevních výronů a petechií při ITP. Pacient může mít ITP i tehdy, pokud se u něho vyskytuje méně závažný typ krevního výronu nebo petechií, než je uvedeno na obrázku. Nefropatie včetně anti-gbm onemocnění Nefropatie, včetně onemocnění anti-gbm, jsou vzácně hlášeny u pacientů s roztroušenou sklerózou po léčbě přípravkem v klinických hodnoceních, a obecně se vyskytly do 39 měsíců po posledním podání přípravku. Klinické manifestace nefropatie mohou zahrnovat zvýšení hladin sérového kreatininu, hematurii a/nebo proteinurii. Častým projevem anti-gbm onemocnění je alveolární krvácení, které se manifestuje hemoptýzou, ačkoli nebylo dosud pozorováno v klinických hodnoceních. Vzhledem k tomu, že pacienti mohou zůstat asymptomatičtí, je důležité provádět periodické laboratorní testy. > Hladiny sérového kreatininu je třeba měřit před zahájením léčby a následně v měsíčních intervalech po dobu 48 měsíců. > Analýza moči včetně mikroskopického vyšetření se má provádět před zahájením léčby a dále v měsíčních intervalech po dobu 48 měsíců. Po uplynutí této periody je třeba provádět testování na základě klinických nálezů signalizujících nefropatii. > V případě pozorování klinicky významných změn hladin sérového kreatininu oproti výchozímu stavu, nevysvětlitelné hematurie a/nebo proteinurie je zapotřebí další posouzení nefropatie, včetně odeslání ke specialistovi. > Časná detekce a léčba nefropatie může snížit riziko špatného výsledu léčby. > U pacientů se suspektní nefropatií se velmi doporučuje odeslání ke specialistovi k dalšímu vyšetření. Anti-GBM onemocnění, pokud není léčeno, je život ohrožující stav, který vyžaduje okamžitou péči. Bez urychleného zahájení léčby se u pacienta může rychle vyvinout selhání ledvin vyžadující dialýzu a/nebo transplantaci a onemocnění může vést k úmrtí pacienta. Poruchy štítné žlázy Během klinických hodnocení byly hlášeny autoimunitní poruchy štítné žlázy, včetně hypertyreózy a a hypotyreózy. Poruchy štítné žlázy byly velmi časté v klinických hodnoceních a většina těchto poruch byla mírné až střední závažnosti a vyskytla se do 48 měsíců po první expozici organismu účinkům přípravku. Většinu poruch štítné žlázy se podařilo zvládnout pomocí konvenční terapie; u některých pacientů byla zapotřebí chirurgická intervence. Je důležité informovat pacienty, že v závislosti na stavu štítné žlázy u nich může být zapotřebí celoživotní léčba (např. při hypotyreóze). 6 Pokyny pro zdravotnické pracovníky Pokyny pro zdravotnické pracovníky 7
5 > Funkční vyšetření štítné žlázy, jako např. stanovení hladin tyreotropního hormonu (TSH), je třeba provést před zahájením léčby, a následně opakovat každé 3 měsíce po dobu 48 měsíců. Po uplynutí této periody je třeba provádět testování na základě klinických nálezů signalizujících onemocnění štítné žlázy. > Sledujte i nadále příznaky a projevy poruch štítné žlázy. > Onemocnění štítné žlázy představují zvláštní riziko u těhotných žen. Neléčené onemocnění štítné žlázy může vést k poškození nenarozeného plodu nebo dítěte po narození. Obzvláštní pozornost je zapotřebí věnovat těhotným ženám s Basedowovou chorobou (označovanou též jako Gravesova nemoc), protože protilátky proti receptorům tyreostimulačního hormonu matky se mohou přenášet do vyvíjejícího se plodu a způsobit přechodnou novorozeneckou Basedowovu nemoc. Zdravotničtí pracovníci zodpovědní za péči o těhotné pacientky musí být obeznámeni se zvýšeným rizikem onemocnění štítné žlázy v důsledku léčby přípravkem Lemtrada a s potřebou náležité léčby těchto onemocnění. 3. Přehled doporučeného monitorování pacientů V následující tabulce je uveden přehled milníků doporučených při monitorování. Pro každého pacienta, kterému předepíšete přípravek, navíc máte k dispozici soubor předtištěných kontrolních přehledů. léčby nezapomeňte ověřit bod Kontraindikace v přiloženém souhrnu údajů o přípravku (SPC). Stav Aktivita Načasování Imunitní trombocytopenická purpura (ITP) Nefropatie, včetně onemocnění anti-gbm Kompletní krevní obraz a diferenciál Sérový kreatinin Nefropatie, včetně onemocnění anti-gbm Analýza a mikroskopické vyšetření moči Onemocnění štítné žlázy Funkční testy štítné žlázy (např. TSH) Každé 3 měsíce, U pacientek Lidský papilomavir (HPV) Screeningové vyšetření HPV 1x ročně 8 Pokyny pro zdravotnické pracovníky Pokyny pro zdravotnické pracovníky 9
6 4. Péče o pacienty léčené přípravkem Lemtrada > Je mimořádně důležité, aby vaši pacienti vzali na vědomí, že musí absolvovat periodická vyšetření (po dobu 48 měsíců ), a to i tehdy, pokud budou asymptomatičtí a jejich onemocnění (RS) bude pod kontrolou. > Je zapotřebí naplánovat a vést periodické monitorování ve spolupráci s pacienty. > U nespolupracujících pacientů může být zapotřebí další poučení, při kterém se zdůrazní rizika vyplývající z vynechání plánovaných vyšetření a testů v rámci monitorování. > Je třeba monitorovat výsledky testů a pečlivě sledovat symptomy vedlejších účinků. > Prodiskutujte se svým pacientem tyto pokyny a příbalovou informaci k přípravku. Připomeňte pacientovi, aby pečlivě sledoval symptomy týkající se autoimunitních stavů a aby v případě obav vyhledal pomoc lékaře. > Požádejte pacienty, aby vždy nosili s sebou Kartu pacienta. Pacienti by měli ukázat tuto kartu všem zdravotnickým pracovníkům, kteří jim budou z jakéhokoli důvodu poskytovat péči, nebo v případě návštěvy pohotovostního oddělení. > Je třeba zajistit dostupnost odborníků a vybavení pro včasnou diagnózu a léčbu nejčastějších nežádoucích účinků, zejména autoimunitních stavů a infekcí. Nástroj pro podporu kompliance pacientů Pacienti, kterým bude předepsán přípravek mohou využít nástroj pro podporu kompliance v oblasti laboratorních vyšetření. Nástroj upozorňuje pacienta na periodické testování. Výzva přes internet: Pacienti se přihlásí a poskytnou svou ovou adresu pro generování a zasílání automatických ových výzev s upozorněním na každoměsíční laboratorní testy. Webová adresa bude uvedena v pokynech pro pacienta. Uvedená služba je nabízena prostřednictvím třetí strany, která bude shromažďovat a zpracovávat osobní údaje pacienta v souladu s platnými předpisy pro ochranu údajů. Osobní údaje pacientů budou uchovávány na zabezpečeném místě a nebudou předány jiným osobám, včetně výrobce přípravku. Přihlaste se na kde naleznete další možnosti, jak pomoci pacientům se zvládáním kontrolních vyšetření. 10 Pokyny pro zdravotnické pracovníky Pokyny pro zdravotnické pracovníky 11
7 5. Další informace Vakcinace > Pacientům se doporučuje, aby splnili požadavky na vakcinaci (podle národních předpisů) minimálně 6 týdnů před zahájením. > Bezpečnost imunizace živými vakcínami po léčbě přípravkem nebyla dosud hodnocena a živé vakcíny se proto nemají podávat pacientům, kteří v nedávně době absolvovali cyklus. > zvažte vakcinaci proti VZV u pacientů negativních na protilátky. Fertilita, antikoncepce, těhotenství a kojení > Ženy v reprodukčním věku by měly používat účinnou antikoncepci během podání a po dobu 4 měsíců po podání. > Nejsou prováděny žádné adekvátní a dobře kontrolované studie s přípravkem u těhotných žen. Přípravek by se měl podávat během těhotenství pouze tehdy, pokud potenciální přínos ospravedlňuje potenciální riziko pro plod. > Onemocnění štítné žlázy představují zvláštní riziko u těhotných žen (viz část 2, Poruchy štítné žlázy). U těhotných s Basedowovou chorobou (označovanou též jako Gravesova nemoc) se protilátky proti receptorům tyreostimulačního hormonu matky mohou přenášet do vyvíjejícího se plodu a způsobit přechodnou novorozeneckou Basedowovu nemoc. > Není známo, zda je alemtuzumab vylučován do lidského mateřského mléka. Riziko pro kojené dítě nelze vyloučit. Proto by během každého léčebného cyklu přípravkem a také po dobu 4 měsíců po podání poslední infuze každého léčebného cyklu mělo být kojení přerušeno. Přínos imunity získané z mateřského mléka však může u kojeného dítěte převážit riziko z potenciální expozice přípravku Lemtrada. > Nejsou k dispozici žádné adekvátní klinické bezpečnostní údaje o vlivu přípravku na fertilitu. V podstudii u 13 pacientů (mužů) léčených alemtuzumabem (léčených buď 12 mg, nebo 24 mg) nebyly zjištěny žádné známky aspermie, azoospermie, konzistentně sníženého počtu spermií, poruch motility ani zvýšení počtu morfologických abnormalit spermií. Je známo, že CD52 je přítomný v reprodukčních tkáních lidí a hlodavců. Údaje získané ve studiích na zvířatech ukazovaly účinky na fertilitu humanizovaných myší (viz bod 5.3 souhrnu údajů o přípravku), nicméně potenciální vliv na lidskou fertilitu během období expozice není na základě dostupných údajů znám. 6. Nejčastější otázky Prosím před předepsáním přípravku zvažte následující skutečnosti: Jaké laboratorní testy je třeba provést před zahájením? Je třeba provést následující testy: > kompletní krevní obraz a diferenciál, > sérový kreatinin, > funkční vyšetření štítné žlázy, např. stanovení TSH, > vyšetření moči, včetně mikroskopického vyšetření. Další informace jsou uvedeny v části 3, Přehled doporučeného monitorování pacientů. Mohu předepsat přípravek pacientům užívajícím jiný lék na RS? Přípravek dosud nebyl podáván k léčbě RS souběžně s jinými antineoplastickými nebo imunosupresivními léky. Stejně jako u všech ostatních imunomodulačních léků je třeba při zvažování vzít do úvahy potenciální kombinované účinky na imunitní systém pacienta. Souběžné použití přípravku s jakýmkoli z těchto léků by mohlo zvýšit riziko imunosuprese. Budu pokračovat v laboratorních testech během a po jejím ukončení? Jak dlouho? Ano, testování začíná před léčbou (vstupní testy) a mělo by pokračovat po dobu 48 měsíců. Podrobné informace včetně údajů o tom, jaké konkrétní testy provádět, kdy a jak dlouhou dobu, jsou uvedeny v části 3, Přehled doporučeného monitorování pacientů Jak mám postupovat, pokud se u mého pacienta objeví infekce v době, kdy chci zahájit léčebný cyklus s přípravkem? U pacientů s aktivní infekcí je třeba zvážit odložení zahájení na dobu, kdy se infekce dostane pod plnou kontrolu. Léčba Jak se přípravek podává, a jak dlouho infuze trvá? Přípravek se podává nitrožilní infuzí ve dvou cyklech s ročním odstupem. Úvodní cyklus léčby zahrnuje denní infuze po dobu 5 po sobě jdoucích dnů. Druhý cyklus léčby se podává o 12 měsíců později a zahrnuje každodenní infuze po dobu 3 po sobě jdoucích dnů. 12 Pokyny pro zdravotnické pracovníky Pokyny pro zdravotnické pracovníky 13
8 V případě výskytu infuzní reakce (IAR) zajistěte náležitou symptomatickou léčbu dle potřeby. Není-li infuze dobře tolerována, lze prodloužit dobu trvání infuze. V případě výskytu závažných infuzních reakcí je třeba zvážit okamžité ukončení nitrožilní infuze. V rámci klinických hodnocení byl výskyt anafylaktických nebo jiných závažných reakcí vyžadujících přerušení léčby velmi vzácný. Je třeba mít k dispozici připravené prostředky pro zvládnutí anafylaktických nebo jiných závažných reakcí. Lékaři by se měli obeznámit s kardiologickou anamnézou pacienta, protože infuzní reakce mohou zahrnovat srdeční symptomy, např. tachykardii. Je třeba mít k dispozici připravené prostředky pro zvládnutí anafylaktických nebo jiných závažných reakcí. Je třeba použít profylaktickou léčbu? Těsně před zahájením infuze přípravku je třeba pacienty premedikovat kortikosteroidy (1 000 mg methylprednisolonu nebo ekvivalent) po dobu prvních 3 dnů každého léčebného cyklu. Před podáním přípravku lze dále zvážit předléčení antihistaminiky a/nebo antipyretiky. Všem pacientům je třeba podávat perorální přípravky k profylaxi herpetických infekcí během léčby a po dobu minimálně 1 měsíce po léčbě. V klinických hodnoceních byl pacientům podáván acyclovir v dávce 200 mg [nebo ekvivalent] 2x denně. Monitorování vedlejších účinků Jaké jsou příznaky a projevy ITP? Symptomy ITP mohou zahrnovat (mimo jiné) snadnou tvorbu modřin, petechie, spontánní mukokutánní krvácení (např. epistaxe, hemoptýza), silné nebo nepravidelné menstruační krvácení. Tyto klinické příznaky ITP se mohou objevit před rozvojem závažného krvácení. Mezi příznaky ITP patří rovněž nízký počet destiček nebo významné změny kompletního krevního obrazu a diferenciálu oproti výchozímu stavu. Jak bych měl/a léčit pacienta s podezřením na ITP? Je důležité monitorovat všechny pacienty na ITP, aby bylo možné u každého pacienta stanovit včas diagnózu a nasadit odpovídající léčbu. Proto je nezbytné stanovit kompletní krevní obraz a diferenciál před zahájením léčby a dále v pravidelných měsíčních intervalech pod dobu 48 měsíců. V případě podezření na ITP je třeba neprodleně zahájit léčebnou intervenci, včetně okamžitého odeslání ke specializovanému lékaři. Závažné nebo rozsáhlé krvácení je život ohrožujícím stavem a vyžaduje okamžitou péči. Jaké symptomy mohou být spojeny s nefropatiemi, jako je například onemocnění anti-gbm? Manifestace nefropatií mohou zahrnovat zvýšení sérového kreatininu, hematurii a/nebo proteinurii. Častým projevem anti-gbm onemocnění je alveolární krvácení, které se manifestuje hemoptýzou, ačkoli nebylo dosud pozorováno v klinických hodnoceních. Vzhledem k tomu, že pacienti mohou zůstat asymptomatičtí, je důležité provádět periodické laboratorní testy (sérový kreatinin a analýza moči včetně mikroskopického vyšetření). Jak bych měl/a léčit pacienta s podezřením na nefropatii? V případě klinicky významných změn sérového kreatininu oproti výchozímu stavu, nevysvětlitelné hematurie, a/nebo proteinurie je nezbytné další vyšetření na nefropatii, včetně okamžitého odeslání ke specialistovi. Časná detekce a léčba nefropatií může snížit riziko špatného výsledku. Existují speciální pokyny pro léčbu pacientů, u nichž se vyvinula infekce? Žádné speciální pokyny nejsou k dispozici. Zajistěte léčbu infekcí standardními léčebnými postupy. Informace týkající se těhotenství a antikoncepce Mají pacientky ženského pohlaví užívat antikoncepci? Pokud chtějí otěhotnět, jak dlouho by měly čekat po léčbě přípravkem? Alfa poločas se blížil 4 5 dnům a byl srovnatelný mezi jednotlivými cykly vedoucími k nízkým nebo nedetekovatelným sérovým koncentracím během cca 30 dnů po každém léčebném cyklu. Ženy v reprodukčním věku by proto měly používat účinnou antikoncepci během podávání léčby a po dobu 4 měsíců po každé sérii. Bude mít dopad na budoucí fertilitu u žen nebo mužů? Neexistují žádné adekvátní klinické údaje o bezpečnostní týkající se vlivu přípravku Lemtrada na plodnost. V podstudii zahrnující 13 mužů léčených alemtuzumabem (užívajících buď 12 mg nebo 24 mg), nebyly získány důkazy o aspermii, azoospermii, trvale sníženém počtu spermií, poruchách motility nebo nárůstu morfologických abnormalit spermií. Antigen CD52 je přítomen na reprodukčních tkáních u lidí i u myší. Údaje získané ve studiích na zvířatech ukazovaly účinky na fertilitu humanizovaných myší (viz. bod Pokyny pro zdravotnické pracovníky Pokyny pro zdravotnické pracovníky 15
9 souhrnu údajů o přípravku), potenciální dopad na fertilitu u lidí během doby expozice však na základě dostupných údajů není znám. Měly by kojící pacientky absolvovat cyklus? Není známo, zda je alemtuzumab vylučován do lidského mateřského mléka. Riziko pro kojené dítě nelze vyloučit. Proto by během každého léčebného cyklu přípravkem a také po dobu 4 měsíců po podání poslední infuze každého léčebného cyklu mělo být kojení přerušeno. Přínos imunity získané z mateřského mléka však může u kojeného dítěte převážit riziko z potenciální přípravku Lemtrada. Co je třeba zohlednit z hlediska vakcinace při zvažování? Bezpečnost imunizace živými vakcínami po léčbě přípravkem nebyla dosud hodnocena a živé vakcíny se proto nemají podávat pacientům, kteří v nedávně době absolvovali cyklus. Pacientům se doporučuje, aby splnili požadavky na vakcinaci (podle národních předpisů) minimálně 6 týdnů před zahájením. zvažte možnost vakcinace proti VZV u pacientů negativních na protilátky. Poznámky 16 Pokyny pro zdravotnické pracovníky Pokyny pro zdravotnické pracovníky 17
10 18 Pokyny pro zdravotnické pracovníky Pokyny pro zdravotnické pracovníky 19
11 sanofi-aventis, s.r.o. Evropská 846/ Praha 6 Tel.: Fax: officecz@genzyme.com
POKYNY PRO ZDRAVOTNICKÉ PRACOVNÍKY, JAK OMEZIT ZÁVAŽNÁ RIZIKA PŘÍPRAVKU LEMTRADA
 EDUKAČNÍ MATERIÁL LEMTRADA POKYNY PRO ZDRAVOTNICKÉ PRACOVNÍKY, JAK OMEZIT ZÁVAŽNÁ RIZIKA PŘÍPRAVKU LEMTRADA Použití přípravku LEMTRADA (alemtuzumab) u pacientů s relabující-remitující roztroušenou sklerózou
EDUKAČNÍ MATERIÁL LEMTRADA POKYNY PRO ZDRAVOTNICKÉ PRACOVNÍKY, JAK OMEZIT ZÁVAŽNÁ RIZIKA PŘÍPRAVKU LEMTRADA Použití přípravku LEMTRADA (alemtuzumab) u pacientů s relabující-remitující roztroušenou sklerózou
LEMTRADA. Pokyny pro pacienty. Důležité informace pro pacienty začínající léčbu přípravkem LEMTRADA. alemtuzumab 12mg i.v.
 Pokyny pro pacienty Důležité informace pro pacienty začínající léčbu přípravkem Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že
Pokyny pro pacienty Důležité informace pro pacienty začínající léčbu přípravkem Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Informovaný souhlas pacienta(tky) s výkonem. Nitrožilní aplikace monoklonální protilátky alemtuzumab (LEMTRADA)
 Informovaný souhlas pacienta(tky) s výkonem Nitrožilní aplikace monoklonální protilátky alemtuzumab (LEMTRADA) Vážená paní, Vážený pane, vzhledem k tomu, že jako svéprávný jedinec se podílíte významným
Informovaný souhlas pacienta(tky) s výkonem Nitrožilní aplikace monoklonální protilátky alemtuzumab (LEMTRADA) Vážená paní, Vážený pane, vzhledem k tomu, že jako svéprávný jedinec se podílíte významným
EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE
 EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE Příručka pro předepisujícího lékaře Pokyny pro zdravotnické pracovníky ohledně předepisování přípravku Cerdelga (eliglustat) Tento léčivý přípravek
EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE Příručka pro předepisujícího lékaře Pokyny pro zdravotnické pracovníky ohledně předepisování přípravku Cerdelga (eliglustat) Tento léčivý přípravek
LEMTRADA alemtuzumab 12 mg i.v.
 POKYNY PRO PACIENTY Důležité informace pro pacienty začínající léčbu přípravkem LEMTRADA Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte
POKYNY PRO PACIENTY Důležité informace pro pacienty začínající léčbu přípravkem LEMTRADA Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte
Důležité bezpečnostní informace pro zdravotnické pracovníky
 Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Hlášení těhotenství (formulář) RO-GNE: HLÁŠENÍ TĚHOTENSTVÍ
 Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Zároveň žádáme
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Zároveň žádáme
Informace pro zdravotnické odborníky
 EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
Návod pro pacienta / pečovatele
 Návod pro pacienta / pečovatele Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že
Návod pro pacienta / pečovatele Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že
Edukační materiál. Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera
 Edukační materiál Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera Přípravek Strattera je indikován k léčbě hyperkinetické
Edukační materiál Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera Přípravek Strattera je indikován k léčbě hyperkinetické
PRŮKAZ PACIENTA. užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019
 PRŮKAZ PACIENTA užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě
PRŮKAZ PACIENTA užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě
INFLECTRA SCREENINGOVÝ LIST. a výběru pacientů pro všechny schválené indikace. Obsahuje pokyny ke správnému screeningu
 Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
Důležité informace pro pacienty
 MAVENCLAD (cladribinum) Důležité informace pro pacienty OBSAH Seznámení s přípravkem MAVENCLAD Jak se přípravek MAVENCLAD podává? Nežádoucí účinky a možná rizika Lymfopenie Herpes zoster (pásový opar)
MAVENCLAD (cladribinum) Důležité informace pro pacienty OBSAH Seznámení s přípravkem MAVENCLAD Jak se přípravek MAVENCLAD podává? Nežádoucí účinky a možná rizika Lymfopenie Herpes zoster (pásový opar)
Hlášení těhotenství (formulář)
 Hlášení těhotenství (formulář) OSOBA PODÁVAJÍCÍ HLÁŠENÍ Počáteční Následné sledování Jméno a příjmení: Upřesnění: Lékař (specializace) Lékárník pacient ostatní (upřesněte) Kontaktní adresa: Telefonní číslo:
Hlášení těhotenství (formulář) OSOBA PODÁVAJÍCÍ HLÁŠENÍ Počáteční Následné sledování Jméno a příjmení: Upřesnění: Lékař (specializace) Lékárník pacient ostatní (upřesněte) Kontaktní adresa: Telefonní číslo:
Program prevence početí při léčbě přípravkem Erivedge: Důležité informace o prevenci početí a antikoncepci pro pacienta užívajícího přípravek Erivedge
 Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Program prevence
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Program prevence
(alemtuzumab 12 mg i.v.)
 EDUKAČNÍ MATERIÁL Pomůcka pro podání přípravku Tento text je pouze doporučením a pomůckou pro podávání léčivého přípravku Lemtrada. Nenahrazuje edukační materiály, které jsou k dispozici pro předepisující
EDUKAČNÍ MATERIÁL Pomůcka pro podání přípravku Tento text je pouze doporučením a pomůckou pro podávání léčivého přípravku Lemtrada. Nenahrazuje edukační materiály, které jsou k dispozici pro předepisující
EDUKAČNÍ MATERIÁLY. TRUVADA 200 mg / 245 mg POTAHOVANÉ TABLETY (EMTRICITABINUM/ TENOFOVIRUM DISOPROXILUM)
 EDUKAČNÍ MATERIÁLY TRUVADA 200 mg / 245 mg POTAHOVANÉ TABLETY (EMTRICITABINUM/ TENOFOVIRUM DISOPROXILUM) DŮLEŽITÉ BEZPEČNOSTNÍ INFORMACE PRO PŘEDEPISUJÍCÍ LÉKAŘE týkající se užívání přípravku Truvada k
EDUKAČNÍ MATERIÁLY TRUVADA 200 mg / 245 mg POTAHOVANÉ TABLETY (EMTRICITABINUM/ TENOFOVIRUM DISOPROXILUM) DŮLEŽITÉ BEZPEČNOSTNÍ INFORMACE PRO PŘEDEPISUJÍCÍ LÉKAŘE týkající se užívání přípravku Truvada k
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH)
 Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH) Se souhlasem Evropské lékové agentury (EMA) a její
Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH) Se souhlasem Evropské lékové agentury (EMA) a její
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) jodidu-( 131 I) sodného
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) jodidu-( 131 I) sodného
Příloha II. Vědecké závěry
 Příloha II Vědecké závěry 74 Vědecké závěry Dne 7. července 2016 zahájila Velká Británie na základě farmakovigilančních údajů postup podle článku 31 směrnice 2001/83/ES a požádalo výbor PRAC, aby přezkoumal
Příloha II Vědecké závěry 74 Vědecké závěry Dne 7. července 2016 zahájila Velká Británie na základě farmakovigilančních údajů postup podle článku 31 směrnice 2001/83/ES a požádalo výbor PRAC, aby přezkoumal
Zvažte oddálení podání regadenosonu u pacientů s nekontrolovanou hypertenzí.
 CAVE! Informační dopis pro zdravotníky Rapiscan (regadenoson) - Nové důležité doporučení pro minimalizaci rizika cévní mozkové příhody a prodloužení křečí vyvolaných přípravkem Rapiscan po podání aminofylinu.
CAVE! Informační dopis pro zdravotníky Rapiscan (regadenoson) - Nové důležité doporučení pro minimalizaci rizika cévní mozkové příhody a prodloužení křečí vyvolaných přípravkem Rapiscan po podání aminofylinu.
PRŮKAZ PACIENTA. užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1
 PRŮKAZ PACIENTA užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě zdravotnického zařízení.
PRŮKAZ PACIENTA užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě zdravotnického zařízení.
EDUKAČNÍ MATERIÁLY. Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce
 EDUKAČNÍ MATERIÁLY Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERIÁLY Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Program prevence početí při léčbě přípravkem Erivedge: Důležité informace o prevenci početí a antikoncepci pro pacienta užívajícího přípravek Erivedge
 Program prevence početí při léčbě přípravkem Erivedge: Důležité informace o prevenci početí a antikoncepci pro pacienta užívajícího přípravek Erivedge Erivedge může způsobit závažné vrozené vady Může vést
Program prevence početí při léčbě přípravkem Erivedge: Důležité informace o prevenci početí a antikoncepci pro pacienta užívajícího přípravek Erivedge Erivedge může způsobit závažné vrozené vady Může vést
Edukační materiál. Yervoy (ipilimumab) Časté otázky Brožura pro. zdravotníky
 Edukační materiál Yervoy (ipilimumab) Časté otázky Brožura pro zdravotníky Přípravek YERVOY je indikován k léčbě pokročilého melanomu (neresekovatelného nebo metastazujícího) u dospělých. 1 Tento léčivý
Edukační materiál Yervoy (ipilimumab) Časté otázky Brožura pro zdravotníky Přípravek YERVOY je indikován k léčbě pokročilého melanomu (neresekovatelného nebo metastazujícího) u dospělých. 1 Tento léčivý
Familiární středomořská (Mediterranean) horečka (Fever)
 www.printo.it/pediatric-rheumatology/cz/intro Familiární středomořská (Mediterranean) horečka (Fever) Verze č 2016 2. DIAGNÓZA A LÉČBA 2.1 Jak se nemoc diagnostikuje? Obecně se uplatňuje následující postup:
www.printo.it/pediatric-rheumatology/cz/intro Familiární středomořská (Mediterranean) horečka (Fever) Verze č 2016 2. DIAGNÓZA A LÉČBA 2.1 Jak se nemoc diagnostikuje? Obecně se uplatňuje následující postup:
TOCTINO (ALITRETINOIN)
 EDUKAČNÍ MATERIÁLY TOCTINO (ALITRETINOIN) PROGRAM PREVENCE TĚHOTENSTVÍ POKYNY PRO LÉKAŘE A LÉKÁRNÍKY Pokyny pro lékaře předepisující TOCTINO Prosíme, abyste si tyto pokyny pečlivě přečetli před tím, než
EDUKAČNÍ MATERIÁLY TOCTINO (ALITRETINOIN) PROGRAM PREVENCE TĚHOTENSTVÍ POKYNY PRO LÉKAŘE A LÉKÁRNÍKY Pokyny pro lékaře předepisující TOCTINO Prosíme, abyste si tyto pokyny pečlivě přečetli před tím, než
Hemlibra (emicizumab) Subkutánní injekce. Návod pro zdravotnické pracovníky
 EDUKAČNÍ MATERIÁLY Hemlibra (emicizumab) Subkutánní injekce Návod pro zdravotnické pracovníky Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERIÁLY Hemlibra (emicizumab) Subkutánní injekce Návod pro zdravotnické pracovníky Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
BAVENCIO (avelumab) Váš průvodce informacemi pro pacienta
 Váš průvodce informacemi pro pacienta BAVENCIO (avelumab) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli
Váš průvodce informacemi pro pacienta BAVENCIO (avelumab) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli
Perorální kladribin: bezpečnostní profil, monitorování pacientů a praktické zkušenosti.
 Perorální kladribin: bezpečnostní profil, monitorování pacientů a praktické zkušenosti. I V A N A K O V Á Ř O V Á C E N T R U M P R O D E M Y E L I N I Z A Č N Í O N E M O C N Ě N Í N E U R O L O G I C
Perorální kladribin: bezpečnostní profil, monitorování pacientů a praktické zkušenosti. I V A N A K O V Á Ř O V Á C E N T R U M P R O D E M Y E L I N I Z A Č N Í O N E M O C N Ě N Í N E U R O L O G I C
Praxbind doporučení pro podávání (SPC)
 Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Rozměr zavřeného průkazu mm
 Přední strana Str. 1 PRŮKAZ PACIENTA užívajícího přípravek Humira (určeno dospělým i dětským pacientům) Rozměr zavřeného průkazu 105 73 mm Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi
Přední strana Str. 1 PRŮKAZ PACIENTA užívajícího přípravek Humira (určeno dospělým i dětským pacientům) Rozměr zavřeného průkazu 105 73 mm Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi
EDUKAČNÍ MATERIÁL. Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid)
 EDUKAČNÍ MATERIÁL Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid) Leflunopharm (leflunomid), jako chorobu modifikující antirevmatikum (Disease-Modifying
EDUKAČNÍ MATERIÁL Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid) Leflunopharm (leflunomid), jako chorobu modifikující antirevmatikum (Disease-Modifying
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Edukační materiály. KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře
 Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Rekurentní horečka spojená s NRLP21
 www.printo.it/pediatric-rheumatology/cz/intro Rekurentní horečka spojená s NRLP21 Verze č 2016 1. CO JE TO REKURENTNÍ HOREČKA SPOJENÁ S NRLP12 1.1 Co je to? Rekurentní horečka spojená s NRLP12 patří mezi
www.printo.it/pediatric-rheumatology/cz/intro Rekurentní horečka spojená s NRLP21 Verze č 2016 1. CO JE TO REKURENTNÍ HOREČKA SPOJENÁ S NRLP12 1.1 Co je to? Rekurentní horečka spojená s NRLP12 patří mezi
Příloha IV. Vědecké závěry
 Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha II. Vědecké závěry a zdůvodnění změny v registraci
 Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
Co byste měl(a) vědět o léčivém přípravku
 Co byste měl(a) vědět o léčivém přípravku Důležité bezpečnostní informace pro pacienty léčené přípravkem MabThera 1 Co byste měl(a) vědět o přípravku MabThera Pokud máte revmatoidní artritidu (RA), granulomatózu
Co byste měl(a) vědět o léčivém přípravku Důležité bezpečnostní informace pro pacienty léčené přípravkem MabThera 1 Co byste měl(a) vědět o přípravku MabThera Pokud máte revmatoidní artritidu (RA), granulomatózu
Vývoj nových léčiv. Preklinický výzkum Klinický výzkum
 Vývoj nových léčiv Preklinický výzkum Klinický výzkum Úvod Léčivo = nejprověřenější potravina vstupující do organismu Ideální léčivo kvalitní, účinné, bezpečné a dostupné Financování výzkumu léčiv souvislost
Vývoj nových léčiv Preklinický výzkum Klinický výzkum Úvod Léčivo = nejprověřenější potravina vstupující do organismu Ideální léčivo kvalitní, účinné, bezpečné a dostupné Financování výzkumu léčiv souvislost
Brožura s informacemi pro pacienta a rodiče pacienta s ahus
 Brožura s informacemi pro pacienta a rodiče pacienta s ahus Schválena SÚKL dne 18. března 2019 SLOVNÍK POJMŮ Atypický hemolytickouremický syndrom (ahus) Vzácná porucha způsobená chronickou a nadměrnou
Brožura s informacemi pro pacienta a rodiče pacienta s ahus Schválena SÚKL dne 18. března 2019 SLOVNÍK POJMŮ Atypický hemolytickouremický syndrom (ahus) Vzácná porucha způsobená chronickou a nadměrnou
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha III. Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
NeuroBloc. botulinový toxin typu B injekční roztok, U/ml
 NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin. Informace pro lékaře EU
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Listopad 2016 Informace pro lékaře EU Tento léčivý přípravek podléhá dalšímu
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Listopad 2016 Informace pro lékaře EU Tento léčivý přípravek podléhá dalšímu
Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1
![Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1 Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1](/thumbs/102/154291766.jpg) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Edukační materiály
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Edukační materiály
CAPRELSA (vandetanibum) Pokyny pro pacienty a pečovatele ohledně dávkování a monitorování (pediatrické použití)
 CAPRELSA (vandetanibum) Pokyny pro pacienty a pečovatele ohledně dávkování a monitorování (pediatrické použití) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
CAPRELSA (vandetanibum) Pokyny pro pacienty a pečovatele ohledně dávkování a monitorování (pediatrické použití) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Nebido EDUKAČNÍ MATERIÁL. Jak úspěšně aplikovat přípravek. (testosterone undecanoate)
 EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
HIV (z klinického pohledu)
 HIV (z klinického pohledu) David Jilich HIV centrum, Nemocnice Na Bulovce, Praha 11.12. 2014 Vývoj situace ve světě Changes in incidance rate 2001 to 2009 zdroj: UNAIDS Zákadní charakteristika virová infekce
HIV (z klinického pohledu) David Jilich HIV centrum, Nemocnice Na Bulovce, Praha 11.12. 2014 Vývoj situace ve světě Changes in incidance rate 2001 to 2009 zdroj: UNAIDS Zákadní charakteristika virová infekce
Důležité informace k užívání přípravku Tasigna
 Důležité informace k užívání přípravku Tasigna Co je důležité vědět o přípravku Tasigna... Přípravek Tasigna je lék vydávaný pouze na lékařský předpis. Tasigna se používá k léčbě leukemie nazývané chronická
Důležité informace k užívání přípravku Tasigna Co je důležité vědět o přípravku Tasigna... Přípravek Tasigna je lék vydávaný pouze na lékařský předpis. Tasigna se používá k léčbě leukemie nazývané chronická
Příručka k přípravku KEYTRUDA. (pembrolizumab) Informace pro pacienty. Informace pro pacienty
 Příručka k přípravku KEYTRUDA (pembrolizumab) Informace pro pacienty Informace pro pacienty Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět
Příručka k přípravku KEYTRUDA (pembrolizumab) Informace pro pacienty Informace pro pacienty Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět
Kelapril 5mg 7x14tbl.
 Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Your journey inspires ours.
 Lilly Diabetes Your journey inspires ours. V Praze dne 20. ledna 2012 Vážená paní doktorko, vážený pane doktore, v zastoupení společnosti Takeda Pharmaceuticals Europe Ltd. Vám v příloze zasíláme edukační
Lilly Diabetes Your journey inspires ours. V Praze dne 20. ledna 2012 Vážená paní doktorko, vážený pane doktore, v zastoupení společnosti Takeda Pharmaceuticals Europe Ltd. Vám v příloze zasíláme edukační
LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE
 LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE Léčba by měla být zahájena a sledována specialistou se zkušenostmi v léčbě revmatoidní artritidy a psoriatické artritidy. Lékař by měl poučit pacienty
LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE Léčba by měla být zahájena a sledována specialistou se zkušenostmi v léčbě revmatoidní artritidy a psoriatické artritidy. Lékař by měl poučit pacienty
Příloha I Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Souhrn doporučení pro předepisujícího lékaře
 G Souhrn doporučení pro předepisujícího lékaře Kritéria výběru pacientů pro léčbu přípravkem GILENYA (fingolimod) Přípravek GILENYA je vhodný pro dospělé pacienty k léčbě vysoce aktivní relabující-remitentní
G Souhrn doporučení pro předepisujícího lékaře Kritéria výběru pacientů pro léčbu přípravkem GILENYA (fingolimod) Přípravek GILENYA je vhodný pro dospělé pacienty k léčbě vysoce aktivní relabující-remitentní
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Glucosum monohydricum
 sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU LEMTRADA 12 mg koncentrát pro infuzní roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje alemtuzumabum 12 mg v 1,2
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU LEMTRADA 12 mg koncentrát pro infuzní roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje alemtuzumabum 12 mg v 1,2
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU LEMTRADA 12 mg koncentrát pro infuzní roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje alemtuzumabum 12 mg v 1,2
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU LEMTRADA 12 mg koncentrát pro infuzní roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje alemtuzumabum 12 mg v 1,2
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
RADA A POUČENÍ LÉKAŘE
 RADA A POUČENÍ LÉKAŘE Obsah: Uživatelky kombinované hormonální antikoncepce Léčebné účinky kombinované hormonální antikoncepce Kontraindikace kombinované hormonální antikoncepce Vysvětlivky: COC = z anglického
RADA A POUČENÍ LÉKAŘE Obsah: Uživatelky kombinované hormonální antikoncepce Léčebné účinky kombinované hormonální antikoncepce Kontraindikace kombinované hormonální antikoncepce Vysvětlivky: COC = z anglického
PNEUMOKOKOVÉ INFEKCE A MOŽNOSTI PREVENCE aneb CO MŮŽE ZPŮSOBIT PNEUMOKOK
 PNEUMOKOKOVÉ INFEKCE A MOŽNOSTI PREVENCE aneb CO MŮŽE ZPŮSOBIT PNEUMOKOK Očkování! Nejvýznamnější možnost prevence infekčních chorob! Lepší infekční chorobě předcházet než ji léčit! Významný objev v medicíně,
PNEUMOKOKOVÉ INFEKCE A MOŽNOSTI PREVENCE aneb CO MŮŽE ZPŮSOBIT PNEUMOKOK Očkování! Nejvýznamnější možnost prevence infekčních chorob! Lepší infekční chorobě předcházet než ji léčit! Významný objev v medicíně,
Důležité informace o užívání přípravku TASIGNA
 Důležité informace o užívání přípravku TASIGNA Důležité informace o užívání přípravku TASIGNA Co je důležité vědět o přípravku TASIGNA Přípravek TASIGNA je lék vydávaný pouze na lékařský předpis. TASIGNA
Důležité informace o užívání přípravku TASIGNA Důležité informace o užívání přípravku TASIGNA Co je důležité vědět o přípravku TASIGNA Přípravek TASIGNA je lék vydávaný pouze na lékařský předpis. TASIGNA
CZ PAR. QUETIAPINI FUMARAS Seroquel. UK/W/0004/pdWS/001 NL/W/0004/pdWS/001
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
Zdravotní deník pro sledování léčby
 Zdravotní deník pro sledování léčby Péče o muže s rakovinou prostaty Proč bych měl být sledován pravidelně? Lékaři mi nedávno zjistili rakovinu prostaty, se kterou se budu dlouhodobě léčit. Můj lékař zvolil
Zdravotní deník pro sledování léčby Péče o muže s rakovinou prostaty Proč bych měl být sledován pravidelně? Lékaři mi nedávno zjistili rakovinu prostaty, se kterou se budu dlouhodobě léčit. Můj lékař zvolil
Klinické hodnocení u bolestí spojených s endometriózou. Bolest, kterou cítíte, je skutečná... i když to ostatní nevidí. A822523
 Klinické hodnocení u bolestí spojených s endometriózou Bolest, kterou cítíte, je skutečná... i když to ostatní nevidí. A822523 Studie SOLSTICE se provádí v přibližně 200 výzkumných centrech na celém světě.
Klinické hodnocení u bolestí spojených s endometriózou Bolest, kterou cítíte, je skutečná... i když to ostatní nevidí. A822523 Studie SOLSTICE se provádí v přibližně 200 výzkumných centrech na celém světě.
Mirena (levonorgestrel) Jaydess (levonorgestrel) Kyleena (levonorgestrel)
 EDUKAČNÍ MATERIÁLY Rozdíly mezi přípravky Mirena (levonorgestrel) Jaydess (levonorgestrel) Kyleena (levonorgestrel) Léčivý přípravek Jaydess podléhá dalšímu sledování. To umožní rychlé získání nových informací
EDUKAČNÍ MATERIÁLY Rozdíly mezi přípravky Mirena (levonorgestrel) Jaydess (levonorgestrel) Kyleena (levonorgestrel) Léčivý přípravek Jaydess podléhá dalšímu sledování. To umožní rychlé získání nových informací
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
von Willebrandova choroba Mgr. Jaroslava Machálková
 von Willebrandova choroba Mgr. Jaroslava Machálková von Willebrandova choroba -je dědičná krvácivá choroba způsobená vrozeným kvantitativním či kvalitativním defektem von Willebrandova faktoru postihuje
von Willebrandova choroba Mgr. Jaroslava Machálková von Willebrandova choroba -je dědičná krvácivá choroba způsobená vrozeným kvantitativním či kvalitativním defektem von Willebrandova faktoru postihuje
EDUKAČNÍ MATERIÁLY. KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
Edukační materiály. Imnovid (pomalidomid) Informace pro zdravotnické pracovníky. Brožura pokyny pro bezpečné použití přípravku
 Imnovid Edukační materiály, verze 3.0; schváleno SUKL 30/JAN/2017 Brožura pokyny pro bezpečné použití přípravku Edukační materiály Imnovid (pomalidomid) Informace pro zdravotnické pracovníky Brožura pokyny
Imnovid Edukační materiály, verze 3.0; schváleno SUKL 30/JAN/2017 Brožura pokyny pro bezpečné použití přípravku Edukační materiály Imnovid (pomalidomid) Informace pro zdravotnické pracovníky Brožura pokyny
Fluorochinolony a riziko prodloužení QT intervalu Finální text SPC a PIL odsouhlasený PhVWP v prosinci 2010
 Fluorochinolony a riziko prodloužení QT intervalu Finální text SPC a PIL odsouhlasený PhVWP v prosinci 2010 Gemifloxacin 1 and moxifloxacin SPC 4.3 Kontraindikace V preklinickém i klinickém hodnocení byly
Fluorochinolony a riziko prodloužení QT intervalu Finální text SPC a PIL odsouhlasený PhVWP v prosinci 2010 Gemifloxacin 1 and moxifloxacin SPC 4.3 Kontraindikace V preklinickém i klinickém hodnocení byly
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
Viru-Merz je účinný při léčbě infekce způsobené virem herpes simplex, ale pouze do fáze vzniku puchýřků.
 sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Průvodce použitím přípravku YERVOY (ipilimumab)
 Průvodce použitím přípravku YERVOY (ipilimumab) Informační brožura pro pacienty Yervoy podléhá dalšímu sledování, které umožní rychlé získávání nových informací o bezpečnosti. Pokud se u Vás vyskytne jakýkoli
Průvodce použitím přípravku YERVOY (ipilimumab) Informační brožura pro pacienty Yervoy podléhá dalšímu sledování, které umožní rychlé získávání nových informací o bezpečnosti. Pokud se u Vás vyskytne jakýkoli
Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím
 Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím Poznámka: Tyto změny příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referralové
Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím Poznámka: Tyto změny příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referralové
Informační karta pro pacientku
 Informační karta pro pacientku Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u
Informační karta pro pacientku Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u
Kapitola III. Poruchy mechanizmů imunity. buňka imunitního systému a infekce
 Kapitola III Poruchy mechanizmů imunity buňka imunitního systému a infekce Imunitní systém Zásadně nutný pro přežití Nezastupitelná úloha v obraně proti infekcím Poruchy imunitního systému při rozvoji
Kapitola III Poruchy mechanizmů imunity buňka imunitního systému a infekce Imunitní systém Zásadně nutný pro přežití Nezastupitelná úloha v obraně proti infekcím Poruchy imunitního systému při rozvoji
Hlášení těhotenství (formulář)
 Hlášení těhotenství (formulář) RO-GNE: HLÁŠENÍ TĚHOTENSTVÍ přijetí hlášení společností Roche (den-měsíc-rok): Lokální číslo: AER: OSOBA PODÁVAJÍCÍ HLÁŠENÍ Počáteční Následné sledování Jméno a příjmení:
Hlášení těhotenství (formulář) RO-GNE: HLÁŠENÍ TĚHOTENSTVÍ přijetí hlášení společností Roche (den-měsíc-rok): Lokální číslo: AER: OSOBA PODÁVAJÍCÍ HLÁŠENÍ Počáteční Následné sledování Jméno a příjmení:
sp.zn.sukls78453/2015
 sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Základní informace o interferenci daratumumabu s testy krevní kompatibility
 EDUKAČNÍ MATERÁLY Daratumumab Základní informace o interferenci daratumumabu s testy krevní kompatibility Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERÁLY Daratumumab Základní informace o interferenci daratumumabu s testy krevní kompatibility Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7
 PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7 Členský stát Žadatel nebo držitel rozhodnutí o registraci Vymyšlený název přípravku
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7 Členský stát Žadatel nebo držitel rozhodnutí o registraci Vymyšlený název přípravku
Deficit antagonisty IL-1 receptoru (DIRA)
 www.printo.it/pediatric-rheumatology/cz/intro Deficit antagonisty IL-1 receptoru (DIRA) Verze č 2016 1. CO JE DIRA? 1.1 O co se jedná? Deficit antagonisty IL-1Receptoru (DIRA) je vzácné vrozené onemocnění.
www.printo.it/pediatric-rheumatology/cz/intro Deficit antagonisty IL-1 receptoru (DIRA) Verze č 2016 1. CO JE DIRA? 1.1 O co se jedná? Deficit antagonisty IL-1Receptoru (DIRA) je vzácné vrozené onemocnění.
U pacientů, jejichž tělesná hmotnost je vyšší než 100 kg, se dávky přesahující 800 mg/infuzi nedoporučují.
 EDUKAČNÍ MATERIÁLY RoActemra (tocilizumab) Kapesní dávkovací karta pro revmatoidní artritidu Přípravek RoActemra v kombinaci s metotrexátem (MTX) je indikován k léčbě středně těžké až těžké aktivní revmatoidní
EDUKAČNÍ MATERIÁLY RoActemra (tocilizumab) Kapesní dávkovací karta pro revmatoidní artritidu Přípravek RoActemra v kombinaci s metotrexátem (MTX) je indikován k léčbě středně těžké až těžké aktivní revmatoidní
CAVE! Informační dopis pro zdravotnické pracovníky
 CAVE! Informační dopis pro zdravotnické pracovníky říjen 2017 Výpadek léčivého přípravku Trisenox (oxid arzenitý, koncentrát pro infuzní roztok 1 mg/ml): nahrazení léčivým přípravkem Phenasen (injekční
CAVE! Informační dopis pro zdravotnické pracovníky říjen 2017 Výpadek léčivého přípravku Trisenox (oxid arzenitý, koncentrát pro infuzní roztok 1 mg/ml): nahrazení léčivým přípravkem Phenasen (injekční
Volibris co byste měli vědět
 EDUKAČNÍ MATERIÁL Informace pro pacienty, kterým byl předepsán přípravek Volibris. Léčba přípravkem Volibris co byste měli vědět Tato brožurka přináší informace a doporučení týkající se léčby přípravkem
EDUKAČNÍ MATERIÁL Informace pro pacienty, kterým byl předepsán přípravek Volibris. Léčba přípravkem Volibris co byste měli vědět Tato brožurka přináší informace a doporučení týkající se léčby přípravkem
ANAMNÉZA DÁRKYNĚ PUPEČNÍKOVÉ KRVE
 ANAMNÉZA DÁRKYNĚ PUPEČNÍKOVÉ KRVE JMÉNO A PŘÍJMENÍ DÁRKYNÉ DATUM NAROZENÍ RODNÉ ČÍSLO ZAMĚSTNÁNÍ TELEFON ULICE A ČÍSLO POPISNÉ MĚSTO PSČ PORODNÍK MINULÉ TĚHOTENSTVÍ počet předchozích porodů počet spontánních
ANAMNÉZA DÁRKYNĚ PUPEČNÍKOVÉ KRVE JMÉNO A PŘÍJMENÍ DÁRKYNÉ DATUM NAROZENÍ RODNÉ ČÍSLO ZAMĚSTNÁNÍ TELEFON ULICE A ČÍSLO POPISNÉ MĚSTO PSČ PORODNÍK MINULÉ TĚHOTENSTVÍ počet předchozích porodů počet spontánních
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha III. Změny příslušných bodů informace o přípravku
 Příloha III Změny příslušných bodů informace o přípravku Poznámka: Tyto změny v příslušných bodech souhrnu údajů a přípravku a příbalové informace jsou výsledkem postupu přezkoumání. Informace o přípravku
Příloha III Změny příslušných bodů informace o přípravku Poznámka: Tyto změny v příslušných bodech souhrnu údajů a přípravku a příbalové informace jsou výsledkem postupu přezkoumání. Informace o přípravku
Pioneer in Rare Diseases. Pozvánka na satelitní sympozium společnosti SOBI. Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B?
 Pioneer in Rare Diseases Pozvánka na satelitní sympozium společnosti SOBI Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B? Vážená paní doktorko, vážený pane doktore, dovolte, abychom
Pioneer in Rare Diseases Pozvánka na satelitní sympozium společnosti SOBI Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B? Vážená paní doktorko, vážený pane doktore, dovolte, abychom
CZ PAR. QUETIAPINI FUMARAS Seroquel. NL/W/0004/pdWS/002
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury NL/W/0004/pdWS/002 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA ZMĚNA V SmPC
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury NL/W/0004/pdWS/002 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA ZMĚNA V SmPC
KEYTRUDA. (pembrolizumab) Seznam důležitých imunitně zprostředkovaných nežádoucích účinků a jejich příznaků, včetně opatření a léčby
 Edukační materiál KEYTRUDA (pembrolizumab) Seznam důležitých imunitně zprostředkovaných nežádoucích účinků a jejich příznaků, včetně opatření a léčby Brožura pro Zdravotnického pracovníka Tento léčivý
Edukační materiál KEYTRUDA (pembrolizumab) Seznam důležitých imunitně zprostředkovaných nežádoucích účinků a jejich příznaků, včetně opatření a léčby Brožura pro Zdravotnického pracovníka Tento léčivý
