PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
|
|
|
- Jindřich Neduchal
- před 8 lety
- Počet zobrazení:
Transkript
1 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1
2 1. NÁZEV PŘÍPRAVKU Insulin Human Winthrop Rapid 100 IU/ml injekční roztok v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml Insulin Human Winthropu Rapid obsahuje 100 IU (3,5 mg) léčivé látky lidského inzulínu. Jedna injekční lahvička obsahuje 5 ml, což se rovná 500 IU inzulínu. Jedna IU (mezinárodní jednotka) odpovídá 0,035 mg bezvodého lidského inzulínu. Insulin Human Winthrop Rapid je neutrální roztok inzulínu (normální inzulín). Lidský inzulín v Insulin Human Winthrop Rapid se vyrábí technologií rekombinace DNA s využitím kmenů K12 bakterie Escherichia coli. Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Injekční roztok v injekční lahvičce. Roztok je čirý, bezbarvý a má konzistenci vody. 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikace Diabetes mellitus, kde je vyžadována léčba inzulínem. Insulin Human Winthrop Rapid je také vhodný k léčbě hyperglykemického kómatu a ketoacidózy, a také k dosažení stabilizace pacientů s diabetes mellitus v období před, během a po chirurgickém zákroku. 4.2 Dávkování a způsob podání Požadované hladiny glukózy v krvi, použité inzulínové přípravky a dávkování inzulínu (dávky a jejich časové rozvržení) musí být určeny individuálně a upraveny tak, aby vyhovovaly dietě, fyzické aktivitě a životnímu stylu pacienta. Denní dávky a časový rozvrh podání Pro dávkování inzulínu nejsou pevná pravidla. Avšak průměrný požadavek je často 0,5 až 1,0 IU/kg tělesné hmotnosti za den. Základní metabolický požadavek je 40 % až 60 % celkové denní potřeby. Insulin Human Winthrop Rapid se podává subkutánní injekcí 15 až 20 minut před jídlem. Při léčbě těžké hyperglykémie nebo ketoacidózy obzvláště je podávání inzulínu součástí komplexního terapeutického režimu, který zahrnuje opatření k ochraně pacientů před případnými závažnými komplikacemi při relativně rychlém snížení hladiny krevního cukru. Tento režim vyžaduje pečlivé monitorování (metabolický stav, acidobazická rovnováha a stav elektrolytů, parametry životních funkcí atd.) na jednotce intenzívní péče nebo v podobném zařízení. Převod na Insulin Human Winthrop Rapid Při převádění pacienta z jednoho inzulínového přípravku na jiný může být nezbytná úprava dávkování. To platí, například, při převodu: - ze zvířecího inzulínu (zejména hovězího inzulínu) na lidský inzulín, 2
3 - z jednoho lidského inzulínu na jiný, - z režimu s pouze normálním inzulínem na režim s inzulínem s protrahovaným účinkem. Potřeba úpravy (např. snížení) dávky může nastat okamžitě po převodu. Eventuálně se může vyvinout postupně během období několika týdnů. Po převodu ze zvířecího inzulínu na lidský může být nutné snížení dávky především u pacientů, kteří: - byli již dříve kontrolováni na poměrně nízkých hladinách krevního glukózy, - mají sklon k hypoglykémii, - dříve potřebovali vyšší dávky inzulínu v důsledku přítomnosti protilátek proti inzulínu. Během převodu a v počátečních týdnech po něm je doporučen důsledný metabolický monitoring. U pacientů, u kterých jsou požadavky vysokých dávek inzulínu z důvodu přítomnosti protilátek proti inzulínu, musí být při převodu zvažován lékařský dohled v nemocnici nebo v podobném zařízení. Druhotná úprava dávky Zlepšení metabolické kontroly může mít za následek zvýšení citlivosti k inzulínu, vedoucí ke snížení jeho potřeby. Úprava dávky může být nutná například, když: - se změní hmotnost pacienta, - se změní životní styl pacienta, - nastanou další okolnosti, které mohou podnítit zvýšený sklon k hypo- nebo hyperglykémii (viz bod 4.4). Použití u zvláštních skupin pacientů U pacientů se zhoršenou funkcí jater nebo ledvin, stejně tak u starších pacientů, může být snížena potřeba inzulínu (viz bod 4.4). Způsob podání Insulin Human Winthrop Rapid obsahuje 100 IU inzulínu v 1 ml roztoku. Pro podání mohou být použity pouze injekční stříkačky určené pro tuto sílu inzulínu (100 IU v 1 ml). Injekční stříkačky nesmí obsahovat žádné jiné léčivé přípravky nebo residua (např. stopy heparinu). Insulin Human Winthrop Rapid se podává subkutánně. Absorpce inzulínu a z toho vyplývající hypoglykemický účinek dávky se může lišit od jedné injekční oblasti ke druhé (např. břišní stěna ve srovnání se stehnem). Místo vpichu v injekční oblasti musí být střídáno od jedné injekce ke druhé. Insulin Human Winthrop Rapid může být také podán intravenózně. Intravenózní inzulínová terapie obecně musí být prováděna na jednotce intenzívní péče nebo za srovnatelných podmínek monitorování a léčby (viz Denní dávky a časový rozvrh podání ). Další podrobnosti o zacházení viz bod Kontraindikace Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku. Insulin Human Winthrop Rapid se nesmí používat do externích nebo implantovaných inzulínových pump nebo do peristaltických pump se silikonovými hadičkami. 4.4 Zvláštní upozornění a opatření pro použití Pacienti s přecitlivělostí na Insulin Human Winthrop Rapid, pro které není k dispozici lépe tolerovaný inzulínový přípravek, smějí pokračovat v léčbě pouze za přísného lékařského dohledu a je-li to nezbytné, v kombinaci s antialergickou léčbou. 3
4 U pacientů s alergií na zvířecí inzulín se doporučuje provést intradermální kožní test před převodem na Insulin Human Winthrop Rapid, protože se musí počítat s možností zkřížené imunologické reakce. U pacientů se zhoršenými renálními funkcemi může být potřeba inzulínu snížena z důvodu sníženého metabolizmu inzulínu. U starších pacientů může vést progresívní zhoršování renálních funkcí k plynulému snižování potřeby inzulínu. U pacientů se závažnou poruchou funkce jater může být potřeba inzulínu snížena z důvodu snížené kapacity pro glukoneogenezu a sníženého metabolizmu inzulínu. V případě nedostatečné úpravy glykémie nebo sklonu k hyper-nebo hypoglykemickým epizodám je nezbytné ověřit, zda pacient dodržuje předepsaný léčebný režim, přezkoumat místa a správnost techniky vpichu a všechny další faktory předtím, než se uvažuje o úpravě dávky. Hypoglykémie Hypoglykémie se může objevit, jestliže dávka inzulínu je v poměru k jeho potřebě příliš vysoká. Zvláštní opatrnost a intenzívní monitorování hladiny glukózy v krvi se doporučuje u těch pacientů, u kterých mohou být hypoglykemické epizody zvláště klinicky významné, tak jako u pacientů s významnými stenózami koronárních arterií nebo krevních cév zásobujících mozek (riziko kardiálních nebo cerebrálních komplikací hypoglykémie), stejně jako u pacientů s proliferativní retinopatií, zvláště neléčené fotokoagulací (riziko přechodné amaurózy vyvolané hypoglykémií). Pacienti by měli být obeznámeni s okolnostmi, za kterých jsou varovné příznaky hypoglykémie oslabeny. Varovné symptomy hypoglykémie mohou být změněny, být méně výrazné nebo zcela chybět u některých rizikových skupin. K nim patří pacienti: - u kterých byla glykemická kontrola význačně zlepšena, - u kterých se hypoglykémie vyvíjí postupně, - starší, - po převodu ze zvířecího inzulínu na lidský inzulín, - u kterých je přítomna autonomní neuropatie, - s dlouhou anamnézou diabetu, - trpící psychiatrickým onemocněním, - současně léčení některými dalšími léčivými přípravky (viz bod 4.5). Takové situace mohou vést k těžké hypoglykémii (a možné ztrátě vědomí) dříve, než si pacient hypoglykémii stihne uvědomit. Pokud jsou zaznamenány normální nebo snížené hladiny glykovaného hemoglobinu, lze předpokládat možnost rekurentních, nerozpoznaných (zejména nočních) epizod hypoglykémie. Nezbytnými předpoklady pro snížení rizika hypoglykémie jsou dodržování dávkování a dietního režimu, správné podávání inzulínu a schopnost pacienta rozpoznat příznaky hypoglykémie. Faktory zvyšující sklon k hypoglykémii mohou vyžadovat zvlášť pečlivé sledování a mohou si vynutit úpravu dávky. Patří mezi ně: - změna injekční oblasti, - zlepšení citlivosti k inzulínu (např. odstraněním stresových faktorů), - nezvyklá, zvýšená nebo prodloužená fyzická aktivita, - přidružené nemoci (např. zvracení, průjem), - neadekvátní příjem potravy, - vynechání jídla, - konzumace alkoholu, - některé nekompenzované endokrinní poruchy (např. u hypothyreoidismu a u nedostatečnosti adenohypofýzy nebo adrenokortikální nedostatečnosti), - současná léčba některými jinými léčivými přípravky. 4
5 Interkurentní nemoci Přidružené nemoci vyžadují intenzívní metabolický monitoring. V mnoha případech jsou indikovány testy na ketolátky v moči a často je nutná úprava dávky inzulínu. Potřeba inzulínu je často zvýšená. Pacienti s diabetem typu I musí pokračovat v pravidelném režimu příjmu alespoň malého množství sacharidů, dokonce i tehdy, když jsou schopni jíst pouze málo nebo nejí vůbec, nebo zvrací atd. a nesmějí nikdy vynechat inzulín úplně. 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce Řada látek ovlivňuje metabolismus glukózy a může vyžadovat úpravu dávky lidského inzulínu. Mezi látky, které mohou zvýšit hypoglykemický účinek a zvýšit náchylnost k hypoglykémii patří perorální antidiabetika, ACE inhibitory, disopyramid, fibráty, fluoxetin, inhibitory MAO, pentoxifylin, propoxyfen, salicyláty a sulfonamidová antibiotika. Mezi látky, které mohou snižovat hypoglykemický účinek patří kortikosteroidy, danazol, diazoxid, diuretika, glukagon, isoniazid, estrogeny a progesterony, deriváty fenothiazinu, somatropin, sympatomimetika (např. epinefrin [adrenalin], salbutamol, terbutalin) a thyreoidní hormony. Beta-blokátory, klonidin, soli lithia nebo alkohol mohou buď zesílit, nebo oslabit hypoglykemický účinek inzulínu. Pentamidin může vyvolat hypoglykémii, kterou může někdy následovat hyperglykémie. Navíc vlivem sympatolytických léčivých přípravků, jako jsou beta-blokátory, klonidin, guanethidin a reserpin, mohou být známky adrenergní protiregulace sníženy nebo mohou zcela chybět. 4.6 Těhotenství a kojení Těhotenství Nejsou k dispozici klinické údaje o podávání lidského inzulínu během těhotenství. Inzulín neprochází placentární bariérou. Při předepisování těhotným ženám je nutno postupovat opatrně. Je nutné, aby byla u pacientek s preexistujícím diabetem nebo s těhotenským diabetem udržována dobrá metabolická kontrola.potřeba inzulínu může klesat během prvního trimestru a obecně se zvyšuje během druhého a třetího trimestru. Okamžitě po porodu potřeba inzulínu rapidně poklesne (zvýšené riziko hypoglykémie). Pečlivý monitoring glukózy je nutný. Kojení Nepředpokládají se žádné účinky na kojence. Insulin Human Winthrop Rapid lze během kojení používat. Kojící ženy mohou vyžadovat úpravu dávky inzulínu a diety. 4.7 Účinky na schopnost řídit a obsluhovat stroje Schopnost koncentrace a reakce pacienta může být zhoršena následkem hypoglykémie nebo hyperglykémie nebo např. následkem poruchy zraku. To může představovat riziko v situacích, kde jsou tyto schopnosti zvláště důležité (např. při řízení vozidla nebo obsluze strojů). Pacient by měl být seznámen s opatřeními zabraňujícími vzniku hypoglykémie během řízení. To je důležité zejména u těch, kteří mají sníženou nebo chybějící vnímavost k varovným příznakům hypoglykémie nebo mají časté epizody hypoglykémie. Doporučení řízení nebo obsluhy strojů by mělo být za těchto okolností zváženo. 5
6 4.8 Nežádoucí účinky Hypoglykémie, obecně nejčastější nežádoucí účinek inzulínové terapie, se může objevit, jestliže je dávka inzulínu vzhledem k jeho potřebě příliš vysoká. V klinických studiích a po uvedení na trh se frekvence mění podle skupin pacientů a dávkovacích režimů, proto nemůže být žádná přesná frekvence uvedena. Těžké hypoglykemické ataky, zvláště pokud jsou rekurentní, mohou vést k neurologickému poškození. Dlouhotrvající nebo těžké hypoglykemické epizody mohou být život ohrožující. U mnoha pacientů předcházejí příznakům neuroglykopenie známky adrenergní protiregulace. Obecně platí, že čím větší a rychlejší je pokles glukózy v krvi, tím výraznější je jev protiregulace a jeho symptomy. Následující nežádoucí účinky, které se vyskytly během klinických studií, jsou seřazeny níže podle orgánových systémů a podle snižujícího se výskytu: velmi časté ( 1/10); časté ( 1/100, <1/10); méně časté ( 1/1 000, <1/100); vzácné ( 1/10 000, <1/1 000); velmi vzácné (<1/10 000), neznámé (z dostupných údajů nemohou být odhadnuty). V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti. Poruchy imunitního systému Méně časté: šok Neznámé: časné alergické reakce (hypotenze, angioneurotický edém, bronchospasmus, generalizované kožní reakce), protilátky proti inzulínu Časné alergické reakce na inzulín nebo na pomocné látky mohou být život ohrožující. Podávání inzulínu může způsobit tvorbu protilátek proti inzulínu. Ve vzácných případech může přítomnost těchto protilátek proti inzulínu vyžadovat úpravu dávkování inzulínu, aby se vyrovnala tendence k hyper- nebo hypoglykémii. Poruchy metabolizmu a výživy Časté: edém Neznámé: retence sodíku Inzulín může způsobit retenci sodíku a vznik otoků, zvláště je-li předchozí špatná metabolická kontrola zlepšena intenzívní inzulínovou terapií. Oční poruchy Neznámé: proliferační retinopatie, diabetická retinopatie, poruchy vidění Výrazná změna v glykémii může být příčinou přechodného zhoršení zraku, způsobeného přechodnou změnou napětí a indexu lomu v čočkách. Dlouhodobé zlepšení glykemické kontroly snižuje riziko progrese diabetické retinopatie. Avšak zintenzivnění inzulínové terapie s náhlým zlepšením glykemické kontroly může být spojeno s přechodným zhoršením diabetické retinopatie. Poruchy kůže a podkoží Neznámé: lipodystrofie 6
7 Tak jako při každé inzulínové terapii se může v místě vpichu vyvinout lipodystrofie zpomalující lokální absorpci inzulínu. Plynulé střídání místa vpichu v oblasti podání může pomoci omezit tyto reakce nebo jim zabránit. Celkové a jinde nezařazené poruchy a lokální reakce po podání Časté: reakce v místě vpichu Méně časté: kopřivka v místě vpichu Neznámé: zánět v místě vpichu, otok v místě vpichu, bolest v místě vpichu, svědění v místě vpichu, zarudnutí v místě vpichu Většina mírných reakcí na inzulín v místě vpichu obvykle odezní během několika dnů nebo několika týdnů. 4.9 Předávkování Příznaky Předávkování inzulínu může vést k těžké a někdy dlouhodobé a život ohrožující hypoglykémii. Léčba Mírné hypoglykemické epizody mohou být obvykle léčeny perorálním podáním sacharidů. Může být potřeba upravit dávkování léčivého přípravku, dietní režim, nebo fyzickou aktivitu. Závažnější epizody spojené s kómatem, křečemi nebo neurologickou poruchou mohou být léčeny intramuskulárně/subkutánně podaným glukagonem nebo intravenózně podanou koncentrovanou glukózou. Dlouhodobé podávání sacharidů a sledování stavu je nezbytné, protože hypoglykémie se může po zjevném klinickém zlepšení opakovat. 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1 Farmakodynamické vlastnosti Farmakoterapeutická skupina: Antidiabetikum. Inzulíny a analogy s rychlým nástupem účinku, ATC kód: A10AB01 Způsob účinku Inzulín - snižuje hladinu glukózy v krvi a podporuje anabolické účinky, stejně jako potlačuje katabolické účinky, - zvyšuje přesun glukózy do buněk stejně jako tvorbu glykogenu ve svalech a játrech a zlepšuje utilizaci pyruvátu. To inhibuje glykogenolýzu a glukoneogenezu, - zvyšuje lipogenezu v játrech a v tukové tkáni a inhibuje lipolýzu, - podporuje vychytávání aminokyselin buňkami a podporuje syntézu proteinů, - zvyšuje vychytávání draslíku buňkami. Farmakodynamické vlastnosti Insulin Human Winthrop Rapid je inzulín s rychlým nástupem a krátkým trváním účinku. Po subkutánní injekci nastupuje účinek během 30 minut, fáze maximálního účinku je mezi 1 až 4 hodinami po injekci a trvání účinku je 7 až 9 hodin. 5.2 Farmakokinetické vlastnosti 7
8 U zdravých jedinců je sérový poločas inzulínu přibližně 4 až 6 minut. U pacientů s těžkou renální nedostatečností je delší. Je však třeba si uvědomit, že farmakokinetika inzulínu neodráží jeho metabolický účinek. 5.3 Předklinické údaje vztahující se k bezpečnosti Akutní toxicita byla studována po subkutánním podání na potkanech. Nebyly prokázány žádné známky toxického účinku. Studie lokální tolerance po subkutánním a intramuskulárním podání u králíků nepodávají žádná význačná zjištění. Studie farmakodynamických účinků následujících po subkutánním podání u králíků a psů ukázaly očekávané hypoglykemické reakce. 6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek Metakresol, dihydrát dihydrogenfosforečnanu sodného, glycerol, hydroxid sodný, kyselina chlorovodíková (pro úpravu ph), voda na injekci. 6.2 Inkompatibility Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě 6.6. Mísitelnost nebo inkompatibility s ostatními inzulíny viz bod 6.6. Je třeba se pečlivě ujistit, že se do roztoku inzulínu nedostal žádný alkohol nebo jiná dezinficiencia. 6.3 Doba použitelnosti 2 roky. Doba použitelnosti po prvním použití: přípravek může být používán až čtyři týdny. Doporučuje se zaznamenat na obal datum prvního odebrání z injekční lahvičky. Otevřená injekční lahvička nesmí být skladována při teplotě vyšší než 25 C a musí být chráněna před přímým teplem nebo světlem. 6.4 Zvláštní opatření pro uchovávání Uchovávejte v chladničce (2 0 C C). Chraňte před mrazem. Je nutno zajistit, aby se injekční lahvička v krabičce přímo nedotýkala mrazicího boxu nebo mrazicích vložek. Uchovávejte injekční lahvičku v krabičce, aby byl přípravek chráněn před světlem. Pro podmínky pro uchovávání otevřených injekčních lahviček viz bod Druh obalu a velikost balení 5 ml roztoku v injekční lahvičce (bezbarvé sklo typu I) s pertlem (hliník), gumovou chlorobutylovou zátkou (typ I) a odtrhávacím víčkem (polypropylen). Dostupná jsou balení s 1 a 5 injekčními lahvičkami. Na trhu nemusí být všechny velikosti balení. 6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním 8
9 Před prvním odebráním inzulínu z injekční lahvičky odstraňte plastikové ochranné víčko. Neprotřepávejte injekční lahvičku prudce, protože to může způsobit napěnění. Pěna může bránit přesnému odměření dávky. Insulin Human Winthrop Rapid smí být podán pouze, je-li roztok čirý, bezbarvý, bez viditelných pevných částic, a má-li konzistenci vody. Stejně jako u jiných inzulínových přípravků nesmí být Insulin Human Winthrop Rapid míchán s roztoky obsahujícími redukční činidla, jako jsou thioly a siřičitany. Je třeba také pamatovat na to, že běžný neutrální inzulín se při hodnotách ph kolem 4,5 až 6,5 vysráží. Míchání inzulínů Insulin Human Winthrop Rapid může být míchán se všemi lidskými inzulíny Sanofi-Aventis, ale NE s těmi, které jsou určeny speciálně pro použití do inzulínových pump. Insulin Human Winthrop Rapid se také NESMÍ míchat s inzulíny zvířecího původu nebo s inzulínovými analogy. Pokud jsou dva různé inzulíny odebírány do jedné injekční stříkačky, doporučuje se, aby inzulín s krátkou dobou účinku byl odebrán první, aby se zabránilo kontaminaci injekční lahvičky přípravkem s dlouhodobým účinkem. Doporučeno je injikovat okamžitě po smíchání. Inzulíny dvou různých koncentrací (např. 100 IU v 1 ml a 40 IU v 1 ml) nesmí být míchány. Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. 7. DRŽITEL ROZHODNUTÍ O REGISTRACI Sanofi-Aventis Deutschland GmbH, D Frankfurt am Main, Německo 8. REGISTRAČNÍ ČÍSLO(A) 9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE 10. DATUM REVIZE TEXTU 9
10 1. NÁZEV PŘÍPRAVKU Insulin Human Winthrop Rapid 40 IU/ml injekční roztok v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml Insulin Human Winthropu Rapid obsahuje 40 IU (1,4 mg) léčivé látky lidského inzulínu. Jedna injekční lahvička obsahuje 10 ml, což se rovná 400 IU inzulínu. Jedna IU (mezinárodní jednotka) odpovídá 0,035 mg bezvodého lidského inzulínu. Insulin Human Winthrop Rapid je neutrální roztok inzulínu (normální inzulín). Lidský inzulín v Insulin Human Winthrop Rapid se vyrábí technologií rekombinace DNA s využitím kmenů K12 bakterie Escherichia coli. Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Injekční roztok v injekční lahvičce. Roztok je čirý, bezbarvý a má konzistenci vody. 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikace Diabetes mellitus, kde je vyžadována léčba inzulínem. Insulin Human Winthrop Rapid je také vhodný k léčbě hyperglykemického kómatu a ketoacidózy, a také k dosažení stabilizace pacientů s diabetes mellitus v období před, během a po chirurgickém zákroku. 4.2 Dávkování a způsob podání Požadované hladiny glukózy v krvi, použité inzulínové přípravky a dávkování inzulínu (dávky a jejich časové rozvržení) musí být určeny individuálně a upraveny tak, aby vyhovovaly dietě, fyzické aktivitě a životnímu stylu pacienta. Denní dávky a časový rozvrh podání Pro dávkování inzulínu nejsou pevná pravidla. Avšak průměrný požadavek je často 0,5 až 1,0 IU/kg tělesné hmotnosti za den. Základní metabolický požadavek je 40 % až 60 % celkové denní potřeby. Insulin Human Winthrop Rapid se podává subkutánní injekcí 15 až 20 minut před jídlem. Při léčbě těžké hyperglykémie nebo ketoacidózy obzvláště, je podávání inzulínu součástí komplexního terapeutického režimu, který zahrnuje opatření k ochraně pacientů před případnými vážnými komplikacemi při relativně rychlém snížení hladiny krevního cukru. Tento režim vyžaduje pečlivé monitorování (metabolický stav, acidobazická rovnováha a stav elektrolytů, parametry životních funkcí atd.) na jednotce intenzívní péče nebo v podobném zařízení. Převod na Insulin Human Winthrop Rapid Při převádění pacienta z jednoho inzulínového přípravku na jiný může být nezbytná úprava dávkování. To platí, například, při převodu: - ze zvířecího inzulínu (zejména hovězího inzulínu) na lidský inzulín, 10
11 - z jednoho lidského inzulínu na jiný, - z režimu s pouze normálním inzulínem na režim s inzulínem s protrahovaným účinkem. Potřeba úpravy (např. snížení) dávky může nastat okamžitě po převodu. Eventuálně se může vyvinout postupně během období několika týdnů. Po převodu ze zvířecího inzulínu na lidský může být nutné snížení dávky především u pacientů, kteří: - byli již dříve kontrolováni na poměrně nízkých hladinách krevního cukru, - mají sklon k hypoglykémii, - dříve potřebovali vyšší dávky inzulínu v důsledku přítomnosti protilátek proti inzulínu. Během převodu a v počátečních týdnech po něm je doporučen důsledný metabolický monitoring. U pacientů, u kterých jsou požadavky vysokých dávek inzulínu z důvodu přítomnosti protilátek proti inzulínu, musí být při převodu zvažován lékařský dohled v nemocnici nebo v podobném zařízení. Druhotná úprava dávky Zlepšení metabolické kontroly může mít za následek zvýšení citlivosti k inzulínu, vedoucí ke snížení jeho potřeby. Úprava dávky může být nutná například když: - se změní hmotnost pacienta, - se změní životní styl pacienta, - nastanou další okolnosti, které mohou podnítit zvýšený sklon k hypo- nebo hyperglykémii (viz bod 4.4). Použití u zvláštních skupin pacientů U pacientů se zhoršenou funkcí jater nebo ledvin, stejně tak u starších pacientů, může být snížena potřeba inzulínu (viz bod 4.4). Způsob podání Insulin Human Winthrop Rapid obsahuje 40 IU inzulínu v 1 ml roztoku. Pro podání mohou být použity pouze injekční stříkačky určené pro tuto sílu inzulínu (40 IU v 1 ml). Injekčnístříkačky nesmí obsahovat žádné jiné léčivé přípravky nebo residua (např. stopy heparinu). Insulin Human Winthrop Rapid se podává subkutánně. Absorpce inzulínu a z toho vyplývající hypoglykemický účinek dávky se může lišit od jedné injekční oblasti ke druhé (např. břišní stěna ve srovnání se stehnem). Místo vpichu v injekční oblasti musí být střídáno od jedné injekce ke druhé. Insulin Human Winthrop Rapid může být také podán intravenózně. Intravenózní inzulínová terapie obecně musí být prováděna na jednotce intenzívní péče nebo za srovnatelných podmínek monitorování a léčby (viz Denní dávky a časový rozvrh podání ). Další podrobnosti o zacházení viz bod Kontraindikace Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku. Insulin Human Winthrop Rapid se nesmí používat do externích nebo implantovaných inzulínových pump nebo do peristaltických pump se silikonovými hadičkami. 4.4 Zvláštní upozornění a opatření pro použití Pacienti s přecitlivělostí na Insulin Human Winthrop Rapid, pro které není k dispozici lépe tolerovaný inzulínový přípravek smějí pokračovat v léčbě pouze za přísného lékařského dohledu a je-li to nezbytné, v kombinaci s antialergickou léčbou. 11
12 U pacientů s alergií na zvířecí inzulín se doporučuje provést intradermální kožní test před převodem na Insulin Human Winthrop Rapid, protože se musí počítat s možností zkřížené imunologické reakce. U pacientů se zhoršenými renálními funkcemi může být potřeba inzulínu snížena z důvodu sníženého metabolizmu inzulínu. U starších pacientů může vést progresívní zhoršení renálních funkcí k plynulému snižování potřeby inzulínu. U pacientů se závažnou poruchou funkce jater může být potřeba inzulínu snížena z důvodu snížené kapacity pro glukoneogenezu a sníženého metabolizmu inzulínu. V případě nedostatečné úpravy glykémie nebo sklonu k hyper-nebo hypoglykemickým epizodám je nezbytné ověřit, zda pacient dodržuje předepsaný léčebný režim, přezkoumat místa a správnost techniky vpichu a všechny další faktory předtím, než se uvažuje o úpravě dávky. Hypoglykémie Hypoglykémie se může objevit, jestliže dávka inzulínu je v poměru k jeho potřebě příliš vysoká. Zvláštní opatrnost a intenzívní monitorování hladiny glukózy v krvi se doporučuje u těch pacientů, u kterých mohou být hypoglykemické epizody zvláště klinicky významné, tak jako u pacientů s významnými stenózami koronárních arterií nebo krevních cév zásobujících mozek (riziko kardiálních nebo cerebrálních komplikací hypoglykémie), stejně jako u pacientů s proliferativní retinopatií, zvláště neléčené fotokoagulací (riziko přechodné amaurózy vyvolané hypoglykémií). Pacienti by měli být obeznámeni s okolnostmi, za kterých jsou varovné příznaky hypoglykémie oslabeny. Varovné symptomy hypoglykémie mohou být změněny, být méně výrazné nebo zcela chybět u některých rizikových skupin. K nim patří pacienti: - u kterých byla glykemická kontrola význačně zlepšena, - u kterých se hypoglykémie vyvíjí postupně, - starší, - po převodu ze zvířecího inzulínu na lidský inzulín, - u kterých je přítomna autonomní neuropatie, - s dlouhou anamnézou diabetu, - trpící psychiatrickým onemocněním,, - současně léčení některými dalšími léčivými přípravky (viz bod 4.5). Takové situace mohou vést k těžké hypoglykémii (a možné ztrátě vědomí) dříve než si pacient hypoglykémii stihne uvědomit. Pokud jsou zaznamenány normální nebo snížené hladiny glykovaného hemoglobinu, lze předpokládat možnost rekurentních, nerozpoznaných (zejména nočních) epizod hypoglykémie. Nezbytnými předpoklady pro snížení rizika hypoglykémie jsou dodržování dávkování a dietního režimu, správné podávání inzulínu a schopnost pacienta rozpoznat příznaky hypoglykémie. Faktory zvyšující sklon k hypoglykémii mohou vyžadovat zvlášť pečlivé sledování a mohou si vynutit úpravu dávky. Patří mezi ně: - změna injekční oblasti, - zlepšení citlivosti k inzulínu (např. odstraněním stresových faktorů), - nezvyklá, zvýšená nebo prodloužená fyzická aktivita, - přidružené nemoci (např. zvracení, průjem), - neadekvátní příjem potravy, - vynechání jídla, - konzumace alkoholu, - některé nekompenzované endokrinní poruchy (např. u hypothyreoidismu a u nedostatečnosti adenohypofýzy nebo adrenokortikální nedostatečnosti), - současná léčba některými jinými léčivými přípravky. 12
13 Interkurentní nemoci Přidružené nemoci vyžadují intenzívní metabolický monitoring. V mnoha případech jsou indikovány testy na ketolátky v moči a často je nutná úprava dávky inzulínu. Potřeba inzulínu je často zvýšená. Pacienti s diabetem typu I musí pokračovat v pravidelném režimu příjmu alespoň malého množství sacharidů, dokonce i tehdy, když jsou schopni jíst pouze málo nebo nejí vůbec, nebo zvrací atd. a nesmějí nikdy vynechat inzulín úplně. 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce Řada látek ovlivňuje metabolismus glukózy a může vyžadovat úpravu dávky lidského inzulínu. Mezi látky, které mohou zvýšit hypoglykemický účinek a zvýšit náchylnost k hypoglykémii patří perorální antidiabetika, ACE inhibitory, disopyramid, fibráty, fluoxetin, inhibitory MAO, pentoxifylin, propoxyfen, salicyláty a sulfonamidová antibiotika. Mezi látky, které mohou snižovat hypoglykemický účinek patří kortikosteroidy, danazol, diazoxid, diuretika, glukagon, isoniazid, estrogeny a progesterony, deriváty fenothiazinu, somatropin, sympatomimetika (např. epinefrin [adrenalin], salbutamol, terbutalin) a thyreoidní hormony. Beta-blokátory, klonidin, soli lithia nebo alkohol mohou buď zesílit, nebo oslabit hypoglykemický účinek inzulínu. Pentamidin může vyvolat hypoglykémii, kterou může někdy následovat hyperglykémie. Navíc vlivem sympatolytických léčivých přípravků, jako jsou beta-blokátory, klonidin, guanethidin a reserpin, mohou být známky adrenergní protiregulace sníženy nebo mohou zcela chybět. 4.6 Těhotenství a kojení Těhotenství Nejsou k dispozici klinické údaje o podávání lidského inzulínu během těhotenství. Inzulín neprochází placentární bariérou. Při předepisování těhotným ženám nutno postupovat opatrně. Je nutné, aby byla u pacientek s preexistujícím diabetem nebo s těhotenským diabetem udržována dobrá metabolická kontrola. Potřebainzulínu může klesat během prvního trimestru a obecně se zvyšuje během druhého a třetího trimestru. Okamžitě po porodu potřeba inzulínu rapidně poklesne (zvýšené riziko hypoglykémie). Pečlivý monitoring glukózy je nutný. Kojení Nepředpokládají se žádné účinky na kojence. Insulin Human Winthrop Rapid lze během kojení používat. Kojící ženy mohou vyžadovat úpravu dávky inzulínu a diety. 4.7 Účinky na schopnost řídit a obsluhovat stroje Schopnost koncentrace a reakce pacienta může být zhoršena následkem hypoglykémie nebo hyperglykémie nebo např. následkem poruchy zraku. To může představovat riziko v situacích, kde jsou tyto schopnosti zvláště důležité (např. při řízení vozidla nebo obsluze strojů). Pacient by měl být seznámen s opatřeními, zabraňujícími vzniku hypoglykémie během řízení. To je důležité zejména u těch, kteří mají sníženou nebo chybějící vnímavost k varovným příznakům hypoglykémie nebo mají časté epizody hypoglykémie. Doporučení řízení nebo obsluhy strojů by mělo být za těchto okolností zváženo. 13
14 4.8 Nežádoucí účinky Hypoglykémie, obecně nejčastější nežádoucí účinek inzulínové terapie, se může objevit, jestliže je dávka inzulínu vzhledem k jeho potřebě příliš vysoká. V klinických studiích a po uvedení na trh se frekvence mění podle skupin pacientů a dávkovacích režimů, proto nemůže být žádná přesná frekvence uvedena. Těžké hypoglykemické ataky, zvláště pokud jsou rekurentní, mohou vést k neurologickému poškození. Dlouhotrvající nebo těžké hypoglykemické epizody mohou být život ohrožující. U mnoha pacientů předcházejí příznakům neuroglykopenie známky adrenergní protiregulace. Obecně platí, že čím větší a rychlejší je pokles glukózy v krvi, tím výraznější je jev protiregulace a jeho symptomy. Následující nežádoucí účinky, které se vyskytly během klinických studií, jsou seřazeny níže podle orgánových systémů a podle snižujícího se výskytu: velmi časté (>1/10); časté (>1/100, <1/10); méně časté (>1/1 000, <1/100); vzácné (>1/10 000, <1/1 000); velmi vzácné (<1/10 000); neznámé (z dostupných údajů nemohou být odhadnuty). V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti. Poruchy imunitního systému Méně časté: šok Neznámé: časné alergické reakce (hypotenze, angioneurotický edém, bronchospasmus, generalizované kožní reakce), protilátky proti inzulínu Časné alergické reakce na inzulín nebo na pomocné látky mohou být život ohrožující. Podávání inzulínu může způsobit tvorbu protilátek proti inzulínu. Ve vzácných případech může přítomnost těchto protilátek proti inzulínu vyžadovat úpravu dávkování inzulínu, aby se vyrovnala tendence k hyper- nebo hypoglykémii. Poruchy metabolizmu a výživy Časté: edém Neznámé: retence sodíku Inzulín může způsobit retenci sodíku a vznik otoků, zvláště je-li předchozí špatná metabolická kontrola zlepšena intenzívní inzulínovou terapií. Oční poruchy Neznámé: proliferační retinopatie, diabetická retinopatie, poruchy vidění Výrazná změna v glykémii může být příčinou přechodného zhoršení zraku, způsobeného přechodnou změnou napětí a indexu lomu v čočkách. Dlouhodobé zlepšení glykemické kontroly snižuje riziko progrese diabetické retinopatie. Avšak zintenzivnění inzulínové terapie s náhlým zlepšením glykemické kontroly může být spojeno s přechodným zhoršením diabetické retinopatie. Poruchy kůže a podkoží Neznámé: lipodystrofie 14
15 Tak jako při každé inzulínové terapii se může v místě vpichu vyvinout lipodystrofie zpomalující lokální absorpci inzulínu. Plynulé střídání místa vpichu v oblasti podání může pomoci omezit tyto reakce nebo jim zabránit. Celkové a jinde nezařazené poruchy a lokální reakce po podání Časté: reakce v místě vpichu Méně časté: kopřivka v místě vpichu Neznámé: zánět v místě vpichu, otok v místě vpichu, bolest v místě vpichu, svědění v místě vpichu, zarudnutí v místě vpichu Většina mírných reakcí na inzulín v místě vpichu obvykle odezní během několika dnů nebo několika týdnů. 4.9 Předávkování Příznaky Předávkování inzulínu může vést k těžké a někdy dlouhodobé a život ohrožující hypoglykémii. Léčba Mírné hypoglykemické epizody mohou být obvykle léčeny perorálním podáním sacharidů. Může být potřeba upravit dávkování léčivého přípravku, dietní režim, nebo fyzickou aktivitu. Závažnější epizody spojené s kómatem, křečemi nebo neurologickou poruchou mohou být léčeny intramuskulárně/subkutánně podaným glukagonem nebo intravenózně podanou koncentrovanou glukózou. Dlouhodobé podávání sacharidů a sledování stavu je nezbytné, protože hypoglykémie se může po zjevném klinickém zlepšení opakovat. 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1 Farmakodynamické vlastnosti Farmakoterapeutická skupina: Antidiabetikum. Inzulíny a analogy s rychlým nástupem účinku, ATC kód: A10AB01 Způsob účinku Inzulín - snižuje hladinu glukózy v krvi a podporuje anabolické účinky, stejně jako potlačuje katabolické účinky, - zvyšuje přesun glukózy do buněk stejně jako tvorbu glykogenu ve svalech a játrech a zlepšuje utilizaci pyruvátu. To inhibuje glykogenolýzu a glukoneogenezu, - zvyšuje lipogenezu v játrech a v tukové tkáni a inhibuje lipolýzu, - podporuje vychytávání aminokyselin buňkami a podporuje syntézu proteinů, - zvyšuje vychytávání draslíku buňkami. Farmakodynamické vlastnosti Insulin Human Winthrop Rapid je inzulín s rychlým nástupem a krátkým trváním účinku. Po subkutánní injekci nastupuje účinek během 30 minut, fáze maximálního účinku je mezi 1 až 4 hodinami po injekci a trvání účinku je 7 až 9 hodin. 5.2 Farmakokinetické vlastnosti 15
16 U zdravých jedinců je sérový poločas inzulínu přibližně 4 až 6 minut. U pacientů s těžkou renální nedostatečností je delší. Je však třeba si uvědomit, že farmakokinetika inzulínu neodráží jeho metabolický účinek. 5.3 Předklinické údaje vztahující se k bezpečnosti Akutní toxicita byla studována po subkutánním podání na potkanech. Nebyly prokázány žádné známky toxického účinku. Studie lokální tolerance po subkutánním a intramuskulárním podání u králíků nepodávají žádná význačná zjištění. Studie farmakodynamických účinků následujících po subkutánním podání u králíků a psů ukázaly očekávané hypoglykemické reakce. 6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek Metakresol, dihydrát dihydrogenfosforečnanu sodného, glycerol, hydroxid sodný, kyselina chlorovodíková (pro úpravu ph), voda na injekci. 6.2 Inkompatibility Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě 6.6. Mísitelnost nebo inkompatibility s ostatními inzulíny viz bod 6.6. Je třeba se pečlivě ujistit, že se do roztoku inzulínu nedostal žádný alkohol nebo jiná dezinficiencia. 6.3 Doba použitelnosti 2 roky. Doba použitelnosti po prvním použití: přípravek může být používána až čtyři týdny. Doporučuje se zaznamenat na obal datum prvního odebrání z injekční lahvičky. Otevřená injekční lahvička nesmí být skladována při teplotě vyšší než 25 C a musí být chráněna před přímým teplem nebo světlem. 6.4 Zvláštní opatření pro uchovávání Uchovávejte v chladničce (2 0 C C). Chraňte před mrazem. Je nutno zajistit, aby se injekční lahvička v krabičce přímo nedotýkala mrazicího boxu nebo mrazicích vložek. Uchovávejte injekční lahvičku v krabičce, aby byl přípravek chráněn před světlem. Pro podmínky pro uchovávání otevřených injekčních lahviček viz bod Druh obalu a velikost balení 10ml roztoku v injekční lahvičce (bezbarvé sklo typu I) s pertlem (hliník), gumovou chlorobutylovou zátkou (typ I) a odtrhávacím víčkem (polypropylen). Dostupná jsou balení s 1 a 5 injekčními lahvičkami. Na trhu nemusí být všechny velikosti balení. 6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním 16
17 Před prvním odebráním inzulínu z injekční lahvičky, odstraňte plastikové ochranné víčko. Neprotřepávejte injekční lahvičku prudce, protože to může způsobit napěnění. Pěna může bránit přesnému odměření dávky. Insulin Human Winthrop Rapid smí být podán pouze, je-li roztok čirý, bezbarvý, bez viditelných pevných částic, a má-li konzistenci vody. Stejně jako u jiných inzulínových přípravků nesmí být Insulin Human Winthrop Rapid míchán s roztoky obsahujícími redukční činidla, jako jsou thioly a siřičitany. Je třeba také pamatovat na to, že běžný neutrální inzulín se při hodnotách ph kolem 4,5 až 6,5 vysráží. Míchání inzulínů Insulin Human Winthrop Rapid může být míchán se všemi lidskými inzulíny Sanofi-Aventis, ale NE s těmi, které jsou určeny speciálně pro použití do inzulínových pump. Insulin Human Winthrop Rapid se také NESMÍ míchat s inzulíny zvířecího původu nebo s inzulínovými analogy. Pokud jsou dva různé inzulíny odebírány do jedné injekční stříkačky, doporučuje se, aby inzulín s krátkou dobou účinku byl odebrán první, aby se zabránilo kontaminaci injekční lahvičky přípravkem s dlouhodobým účinkem. Doporučeno je injikovat okamžitě po smíchání. Inzulíny dvou různých koncentrací (např. 100 IU v 1 ml a 40 IU v 1 ml) nesmí být míchány. Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. 7. DRŽITEL ROZHODNUTÍ O REGISTRACI Sanofi-Aventis Deutschland GmbH, D Frankfurt am Main, Německo 8. REGISTRAČNÍ ČÍSLO(A) 9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE 10. DATUM REVIZE TEXTU 17
18 1. NÁZEV PŘÍPRAVKU Insulin Human Winthrop Rapid 100 IU/ml injekční roztok v zásobní vložce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml Insulin Human Winthropu Rapid obsahuje 100 IU (3,5 mg) léčivé látky lidského inzulínu. Jedna zásobní vložka obsahuje 3 ml, což se rovná 300 IU inzulínu. Jedna IU (mezinárodní jednotka) odpovídá 0,035 mg bezvodého lidského inzulínu. Insulin Human Winthrop Rapid je neutrální roztok inzulínu (normální inzulín). Lidský inzulín v Insulin Human Winthrop Rapid se vyrábí technologií rekombinace DNA s využitím kmenů K12 bakterie Escherichia coli. Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Injekční roztok v zásobní vložce Roztok je čirý, bezbarvý a má konzistenci vody. 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikace Diabetes mellitus, kde je vyžadována léčba inzulínem. Insulin Human Winthrop Rapid je také vhodný k léčbě hyperglykemického kómatu a ketoacidózy, a také k dosažení stabilizace pacientů s diabetes mellitus v období před, během a po chirurgickém zákroku. 4.2 Dávkování a způsob podání Požadované hladiny glukózy v krvi, použité inzulínové přípravky a dávkování inzulínu (dávky a jejich časové rozvržení) musí být určeny individuálně a upraveny tak, aby vyhovovaly dietě, fyzické aktivitě a životnímu stylu pacienta. Denní dávky a časový rozvrh podání Pro dávkování inzulínu nejsou pevná pravidla. Avšak průměrný požadavek je často 0,5 až 1,0 IU/kg tělesné hmotnosti za den. Základní metabolický požadavek je 40 % až 60 % celkové denní potřeby. Insulin Human Winthrop Rapid se podává subkutánní injekcí 15 až 20 minut před jídlem. Při léčbě těžké hyperglykémie nebo ketoacidózy obzvláště, je podávání inzulínu součástí komplexního terapeutického režimu, který zahrnuje opatření k ochraně pacientů před případnými vážnými komplikacemi při relativně rychlém snížení hladiny krevního cukru. Tento režim vyžaduje pečlivé monitorování (metabolický stav, acidobazická rovnováha a stav elektrolytů, parametry životních funkcí atd.) na jednotce intenzívní péče nebo v podobném zařízení. Převod na Insulin Human Winthrop Rapid Při převádění pacienta z jednoho inzulínového přípravku na jiný může být nezbytná úprava dávkování. To platí, například, při převodu: - ze zvířecího inzulínu (zejména hovězího inzulínu) na lidský inzulín, 18
19 - z jednoho lidského inzulínu na jiný, - z režimu s pouze normálním inzulínem na režim s inzulínem s protrahovaným účinkem. Potřeba úpravy (např. snížení) dávky může nastat okamžitě po převodu. Eventuálně se může vyvinout postupně během období několika týdnů. Po převodu ze zvířecího inzulínu na lidský může být nutné snížení dávky především u pacientů, kteří: - byli již dříve kontrolováni na poměrně nízkých hladinách krevního cukru, - mají sklon k hypoglykémii, - dříve potřebovali vyšší dávky inzulínu v důsledku přítomnosti protilátek proti inzulínu. Během převodu a v počátečních týdnech po něm je doporučen důsledný metabolický monitoring.. U pacientů, u kterých jsou požadavky vysokých dávek inzulínu z důvodu přítomnosti protilátek proti inzulínu, musí být při převodu zvažován lékařský dohled v nemocnici nebo v podobném zařízení. Druhotná úprava dávky Zlepšení metabolické kontroly může mít za následek zvýšení citlivosti k inzulínu, vedoucí ke snížení jeho potřeby. Úprava dávky může být nutná například když: - se změní hmotnost pacienta, - se změní životní styl pacienta, - nastanou další okolnosti, které mohou podnítit zvýšený sklon k hypo- nebo hyperglykémii (viz bod 4.4). Použití u zvláštních skupin pacientů U pacientů se zhoršenou funkcí jater nebo ledvin, stejně tak u starších pacientů, může být snížena potřeba inzulínu (viz bod 4.4). Způsob podání Insulin Human Winthrop Rapid v zásobních vložkách byl vyvinut pro použití do dávkovacího pera typu OptiPen. Insulin Human Winthrop Rapid se podává subkutánně. Absorpce inzulínu a z toho vyplývající hypoglykemický účinek dávky se může lišit od jedné injekční oblasti ke druhé (např. břišní stěna ve srovnání se stehnem). Místo vpichu v injekční oblasti musí být střídáno od jedné injekce ke druhé. Insulin Human Winthrop Rapid může být také podán intravenózně. Intravenózní inzulínová terapie obecně musí být prováděna na jednotce intenzívní péče nebo za srovnatelných podmínek monitorování a léčby (viz Denní dávky a časový rozvrh podání.) Další podrobnosti pro použití viz bod Kontraindikace Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku. Insulin Human Winthrop Rapid se nesmí používat do externích nebo implantovaných inzulínových pump nebo do peristaltických pump se silikonovými hadičkami. 4.4 Zvláštní upozornění a opatření pro použití Pacienti s přecitlivělostí na Insulin Human Winthrop Rapid, pro které není k dispozici lépe tolerovaný inzulínový přípravek smějí pokračovat v léčbě pouze za přísného lékařského dohledu a je-li to nezbytné, v kombinaci s antialergickou léčbou. 19
20 U pacientů s alergií na zvířecí inzulín se doporučuje provést intradermální kožní test před převodem na Insulin Human Winthrop Rapid, protože se musí počítat s možností zkřížené imunologické reakce. U pacientů se zhoršenými renálními funkcemi může být potřeba inzulínu snížena z důvodu sníženého metabolizmu inzulínu. U starších pacientů může vést progresívní zhoršení renálních funkcí k plynulému snižování potřeby inzulínu. U pacientů se závažnou poruchou funkce jater může být potřeba inzulínu snížena z důvodu snížené kapacity pro glukoneogenezu a sníženého metabolizmu inzulínu. V případě nedostatečné úpravy glykémie nebo sklonu k hyper-nebo hypoglykemickým epizodám je nezbytné ověřit, zda pacient dodržuje předepsaný léčebný režim, přezkoumat místa a správnost techniky vpichu a všechny další faktory předtím, než se uvažuje o úpravě dávky. Hypoglykémie Hypoglykémie se může objevit, jestliže dávka inzulínu je v poměru k jeho potřebě příliš vysoká. Zvláštní opatrnost a intenzívní monitorování hladiny glukózy v krvi se doporučuje u těch pacientů, u kterých mohou být hypoglykemické epizody zvláště klinicky významné, tak jako u pacientů s významnými stenózami koronárních arterií nebo krevních cév zásobujících mozek (riziko kardiálních nebo cerebrálních komplikací hypoglykémie), stejně jako u pacientů s proliferativní retinopatií, zvláště neléčené fotokoagulací (riziko přechodné amaurózy vyvolané hypoglykémií). Pacienti by měli být obeznámeni s okolnostmi, za kterých jsou varovné příznaky hypoglykémie oslabeny. Varovné symptomy hypoglykémie mohou být změněny, být méně výrazné nebo zcela chybět u některých rizikových skupin. K nim patří pacienti: - u kterých byla glykemická kontrola význačně zlepšena, - u kterých se hypoglykémie vyvíjí postupně, - starší, - po převodu ze zvířecího inzulínu na lidský inzulín, - u kterých je přítomna autonomní neuropatie, - s dlouhou anamnézou diabetu, - trpící psychiatrickým onemocněním,, - současně léčení některými dalšími léčivými přípravky (viz bod 4.5). Takové situace mohou vést k těžké hypoglykémii (a možné ztrátě vědomí) dříve než si pacient hypoglykémii stihne uvědomit. Pokud jsou zaznamenány normální nebo snížené hladiny glykovaného hemoglobinu, lze předpokládat možnost rekurentních, nerozpoznaných (zejména nočních) epizod hypoglykémie. Nezbytnými předpoklady pro snížení rizika hypoglykémie jsou dodržování dávkování a dietního režimu, správné podávání inzulínu a schopnost pacienta rozpoznat příznaky hypoglykémie. Faktory zvyšující sklon k hypoglykémii mohou vyžadovat zvlášť pečlivé sledování a mohou si vynutit úpravu dávky. Patří mezi ně: - změna injekční oblasti, - zlepšení citlivosti k inzulínu (např. odstraněním stresových faktorů), - nezvyklá, zvýšená nebo prodloužená fyzická aktivita, - přidružené nemoci (např. zvracení, průjem), - neadekvátní příjem potravy, - vynechání jídla, - konzumace alkoholu, - některé nekompenzované endokrinní poruchy (např. u hypothyreoidismu a u nedostatečnosti adenohypofýzy nebo adrenokortikální nedostatečnosti), - současná léčba některými jinými léčivými přípravky. 20
21 Interkurentní nemoci Přidružené nemoci vyžadují intenzívní metabolický monitoring. V mnoha případech jsou indikovány testy na ketolátky v moči a často je nutná úprava dávky inzulínu. Potřeba inzulínu je často zvýšená. Pacienti s diabetem typu I musí pokračovat v pravidelném režimu příjmu alespoň malého množství sacharidů, dokonce i tehdy, když jsou schopni jíst pouze málo nebo nejí vůbec, nebo zvrací atd. a nesmějí nikdy vynechat inzulín úplně. 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce Řada látek ovlivňuje metabolismus glukózy a může vyžadovat úpravu dávky lidského inzulínu. Mezi látky, které mohou zvýšit hypoglykemický účinek a zvýšit náchylnost k hypoglykémii patří perorální antidiabetika, ACE inhibitory, disopyramid, fibráty, fluoxetin, inhibitory MAO, pentoxifylin, propoxyfen, salicyláty a sulfonamidová antibiotika. Mezi látky, které mohou snižovat hypoglykemický účinek patří kortikosteroidy, danazol, diazoxid, diuretika, glukagon, isoniazid, estrogeny a progesterony, deriváty fenothiazinu, somatropin, sympatomimetika (např. epinefrin [adrenalin], salbutamol, terbutalin) a thyreoidní hormony. Beta-blokátory, klonidin, soli lithia nebo alkohol mohou buď zesílit, nebo oslabit hypoglykemický účinek inzulínu. Pentamidin může vyvolat hypoglykémii, kterou může někdy následovat hyperglykémie. Navíc vlivem sympatolytických léčivých přípravků, jako jsou beta-blokátory, klonidin, guanethidin a reserpin, mohou být známky adrenergní protiregulace sníženy nebo mohou zcela chybět. 4.6 Těhotenství a kojení Těhotenství Nejsou k dispozici klinické údaje o podávání lidského inzulínu během těhotenství. Inzulín neprochází placentární bariérou. Při předepisování těhotným ženám nutno postupovat opatrně. Je nutné, aby byla u pacientek s preexistujícím diabetem nebo s těhotenským diabetem udržována dobrá metabolická kontrola.potřeba inzulínu může klesat během prvního trimestru a obecně se zvyšuje během druhého a třetího trimestru. Okamžitě po porodu potřeba inzulínu rapidně poklesne (zvýšené riziko hypoglykémie). Pečlivý monitoring glukózy je nutný. Kojení Nepředpokládají se žádné účinky na kojence. Insulin Human Winthrop Rapid lze během kojení používat. Kojící ženy mohou vyžadovat úpravu dávky inzulínu a diety. 4.7 Účinky na schopnost řídit a obsluhovat stroje Schopnost koncentrace a reakce pacienta může být zhoršena následkem hypoglykémie nebo hyperglykémie nebo např. následkem poruchy zraku. To může představovat riziko v situacích, kde jsou tyto schopnosti zvláště důležité (např. při řízení vozidla nebo obsluze strojů). Pacient by měl být seznámen s opatřeními, zabraňujícími vzniku hypoglykémie během řízení. To je důležité zejména u těch, kteří mají sníženou nebo chybějící vnímavost k varovným příznakům hypoglykémie nebo mají časté epizody hypoglykémie. Doporučení řízení nebo obsluhy strojů by mělo být za těchto okolností zváženo. 21
22 4.8 Nežádoucí účinky Hypoglykémie, obecně nejčastější nežádoucí účinek inzulínové terapie, se může objevit, jestliže je dávka inzulínu vzhledem k jeho potřebě příliš vysoká. V klinických studiích a po uvedení na trh se frekvence mění podle skupin pacientů a dávkovacích režimů, proto nemůže být žádná přesná frekvence uvedena. Těžké hypoglykemické ataky, zvláště pokud jsou rekurentní, mohou vést k neurologickému poškození. Dlouhotrvající nebo těžké hypoglykemické epizody mohou být život ohrožující. U mnoha pacientů předcházejí příznakům neuroglykopenie známky adrenergní protiregulace. Obecně platí, že čím větší a rychlejší je pokles glukózy v krvi, tím výraznější je jev protiregulace a jeho symptomy. Následující nežádoucí účinky, které se vyskytly během klinických studií, jsou seřazeny níže podle orgánových systémů a podle snižujícího se výskytu: velmi časté (>1/10); časté (>1/100, <1/10); méně časté (>1/1 000, <1/100); vzácné (>1/10 000, <1/1 000); velmi vzácné (<1/10 000), neznámé (z dostupných údajů nemohou být odhadnuty). V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti. Poruchy imunitního systému Méně časté: šok Neznámé: časné alergické reakce (hypotenze, angioneurotický edém, bronchospasmus, generalizované kožní reakce), protilátky proti inzulínu Časné alergické reakce na inzulín nebo na pomocné látky mohou být život ohrožující. Podávání inzulínu může způsobit tvorbu protilátek proti inzulínu. Ve vzácných případech může přítomnost těchto protilátek proti inzulínu vyžadovat úpravu dávkování inzulínu, aby se vyrovnala tendence k hyper- nebo hypoglykémii. Poruchy metabolizmu a výživy Časté: edém Neznámé: retence sodíku Inzulín může způsobit retenci sodíku a vznik otoků, zvláště je-li předchozí špatná metabolická kontrola zlepšena intenzívní inzulínovou terapií. Oční poruchy Neznámé: proliferační retinopatie, diabetická retinopatie, poruchy vidění Výrazná změna v glykémii může být příčinou přechodného zhoršení zraku, způsobeného přechodnou změnou napětí a indexu lomu v čočkách. Dlouhodobé zlepšení glykemické kontroly snižuje riziko progrese diabetické retinopatie. Avšak zintenzivnění inzulínové terapie s náhlým zlepšením glykemické kontroly může být spojeno s přechodným zhoršením diabetické retinopatie. Poruchy kůže a podkoží Neznámé: lipodystrofie 22
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Insuman Rapid 100 IU/ml injekční roztok v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 100 IU insulinum humanum (odpovídá
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Insuman Rapid 100 IU/ml injekční roztok v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 100 IU insulinum humanum (odpovídá
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Insuman Rapid 40 IU/ml injekční roztok v injekční lahvičce Insuman Rapid 100 IU/ml injekční roztok v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Insuman Rapid 40 IU/ml injekční roztok v injekční lahvičce Insuman Rapid 100 IU/ml injekční roztok v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Apidra 100 U/ml, injekční roztok v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 100 U insulinum glulisinum (odpovídá
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Apidra 100 U/ml, injekční roztok v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 100 U insulinum glulisinum (odpovídá
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Insulinum humanum, rdna (vyrobený rekombinantní DNA technologií na Saccharomyces cerevisiae).
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Insulatard 100 m.j./ml Injekční suspenze v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Insulinum humanum, rdna (vyrobený rekombinantní DNA technologií
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Insulatard 100 m.j./ml Injekční suspenze v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Insulinum humanum, rdna (vyrobený rekombinantní DNA technologií
Insulatard Penfill 100 mezinárodních jednotek/ml injekční suspenze v zásobní vložce.
 1. NÁZEV PŘÍPRAVKU Insulatard Penfill 100 mezinárodních jednotek/ml injekční suspenze v zásobní vložce. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 zásobní vložka obsahuje 3 ml, což odpovídá 300 mezinárodním
1. NÁZEV PŘÍPRAVKU Insulatard Penfill 100 mezinárodních jednotek/ml injekční suspenze v zásobní vložce. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 zásobní vložka obsahuje 3 ml, což odpovídá 300 mezinárodním
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Popis přípravku : Prášek: bílý lyofilizát. Rozpouštědlo: čirá bezbarvá tekutina
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Apidra 100 U/ml, injekční roztok v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 100 U insulinum glulisinum (odpovídá
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Apidra 100 U/ml, injekční roztok v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 100 U insulinum glulisinum (odpovídá
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Lantus 100 jednotek/ml injekční roztok v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje insulinum glarginum* 100 jednotek
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Lantus 100 jednotek/ml injekční roztok v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje insulinum glarginum* 100 jednotek
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 1 ml obsahuje 100 IU insulinum humanum biosyntheticum (původem z rekombinantní DNA produkované E.coli).
 sp.zn. sukls249291/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Humulin R Cartridge, injekční roztok v zásobní vložce injekční roztok v zásobní vložce v předplněném peru 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp.zn. sukls249291/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Humulin R Cartridge, injekční roztok v zásobní vložce injekční roztok v zásobní vložce v předplněném peru 2. KVALITATIVNÍ A KVANTITATIVNÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU . NÁZEV PŘÍPRAVKU NovoRapid 00 jednotek/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ ml roztoku obsahuje 00 jednotek insulinum aspartum* (ekvivalentní 3,5
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU . NÁZEV PŘÍPRAVKU NovoRapid 00 jednotek/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ ml roztoku obsahuje 00 jednotek insulinum aspartum* (ekvivalentní 3,5
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jeden ml obsahuje insulinum humanum 100 IU (původem z rekombinantní DNA produkované E.coli).
 Sp.zn. sukls217401/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Humulin R Cartridge 100 IU/ml injekční roztok v zásobní vložce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje insulinum humanum
Sp.zn. sukls217401/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Humulin R Cartridge 100 IU/ml injekční roztok v zásobní vložce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje insulinum humanum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls59594/25009, a příloha k sp.zn.: sukls230271/2012 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls59594/25009, a příloha k sp.zn.: sukls230271/2012 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 1 ml obsahuje 100 IU insulinum humanum biosyntheticum (původem z rekombinantní DNA produkované E.coli).
 sp.zn. sukls294773/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Humulin R KwikPen 100 IU/ml injekční roztok v předplněném peru 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje 100 IU insulinum
sp.zn. sukls294773/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Humulin R KwikPen 100 IU/ml injekční roztok v předplněném peru 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje 100 IU insulinum
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011. Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Levemir 100 j./ml injekční roztok v zásobní vložce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje 100 jednotek insulinum detemirum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Levemir 100 j./ml injekční roztok v zásobní vložce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje 100 jednotek insulinum detemirum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Insulinum humanum, rdna (vyrobený rekombinantní DNA technologií v Saccharomyces cerevisiae).
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mixtard 30, 100 m.j. /ml. Injekční suspenze v injekční lahvičce. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Insulinum humanum, rdna (vyrobený rekombinantní DNA
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mixtard 30, 100 m.j. /ml. Injekční suspenze v injekční lahvičce. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Insulinum humanum, rdna (vyrobený rekombinantní DNA
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 400 mg + 40 mg. čípky PROCTO-GLYVENOL. 50 mg/g + 20 mg/g. rektální krém
 sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Apidra 100 jednotek/ml injekční roztok v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 100 jednotek insulinum glulisinum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Apidra 100 jednotek/ml injekční roztok v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 100 jednotek insulinum glulisinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě (inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5
1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě (inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Feligen CRP Lyofilizát pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lyofilizovaná složka Léčivé
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Feligen CRP Lyofilizát pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lyofilizovaná složka Léčivé
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Insulatard 40 mezinárodních jednotek/ml injekční suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 injekční lahvička obsahuje 10 ml, což odpovídá
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Insulatard 40 mezinárodních jednotek/ml injekční suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 injekční lahvička obsahuje 10 ml, což odpovídá
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 5 mg/ml injekční roztok pro skot a prasata
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Humulin M3 (30/70) Cartridge 100 IU/ml injekční suspenze v zásobní vložce
 Sp.zn. sukls217401/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Humulin M3 (30/70) Cartridge 100 IU/ml injekční suspenze v zásobní vložce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje insulinum
Sp.zn. sukls217401/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Humulin M3 (30/70) Cartridge 100 IU/ml injekční suspenze v zásobní vložce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje insulinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 1 ml obsahuje 100 IU insulinum humanum biosyntheticum isophanum (původem z rekombinantní DNA produkované E.coli).
 sp.zn. sukls181535/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Humulin N 100 m.j./ml injekční suspenze v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje 100 IU insulinum humanum
sp.zn. sukls181535/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Humulin N 100 m.j./ml injekční suspenze v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje 100 IU insulinum humanum
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 1 ml obsahuje 100 U insulinum humanum biosyntheticum (původem z rekombinantní DNA produkované E. coli).
 sp.zn. sukls213318/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Humulin M3 (30/70) Cartridge, injekční suspenze v zásobní vložce injekční suspenze v zásobní vložce v předplněném peru 2. KVALITATIVNÍ
sp.zn. sukls213318/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Humulin M3 (30/70) Cartridge, injekční suspenze v zásobní vložce injekční suspenze v zásobní vložce v předplněném peru 2. KVALITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jeden ml obsahuje insulinum humanum 100 IU (původem z rekombinantní DNA produkované E.coli).
 Sp.zn.sukls397471/2017 a k sp.zn.sukls398707/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Humulin N 100 IU/ml injekční suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje insulinum humanum
Sp.zn.sukls397471/2017 a k sp.zn.sukls398707/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Humulin N 100 IU/ml injekční suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje insulinum humanum
1 dávka - 0,5 ml obsahuje: Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty2)..25 mikrogramů
 sp.zn. sukls120097/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti břišnímu tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp.zn. sukls120097/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti břišnímu tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls209717/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fenistil 1 mg/g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram gelu obsahuje dimetindeni maleas 1 mg. Pomocné látky se známým
sp.zn.sukls209717/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fenistil 1 mg/g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram gelu obsahuje dimetindeni maleas 1 mg. Pomocné látky se známým
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok
 www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1.NÁZEV PŘÍPRAVKU: AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok 2.KVALITATIVNÍ A KVANTITATIVNÍ
www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1.NÁZEV PŘÍPRAVKU: AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok 2.KVALITATIVNÍ A KVANTITATIVNÍ
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum
 Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009
 Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLUCOPHAGE XR 750 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLUCOPHAGE XR 750 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls115710/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLYPRESSIN 1 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule s 8,5 ml
Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls115710/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLYPRESSIN 1 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule s 8,5 ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Canigen Puppy 2b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Složení v dávce 1 ml Léčivá látka: Parvovirus enteritidis canis attenuatum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Canigen Puppy 2b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Složení v dávce 1 ml Léčivá látka: Parvovirus enteritidis canis attenuatum
Mixtard mezinárodních jednotek/ml injekční suspenze v injekční lahvičce.
 1. NÁZEV PŘÍPRAVKU Mixtard 30 40 mezinárodních jednotek/ml injekční suspenze v injekční lahvičce. Mixtard 30 100 mezinárodních jednotek/ml injekční suspenze v injekční lahvičce. Mixtard 30 Penfill 100
1. NÁZEV PŘÍPRAVKU Mixtard 30 40 mezinárodních jednotek/ml injekční suspenze v injekční lahvičce. Mixtard 30 100 mezinárodních jednotek/ml injekční suspenze v injekční lahvičce. Mixtard 30 Penfill 100
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
Sp.zn.sukls88807/2015
 Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp. zn. sukls230046/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp. zn. sukls230046/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls29736/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TEARS NATURALE II oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje dextranum 70 1,0 mg a hypromelosum 3,0
sp.zn.sukls29736/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TEARS NATURALE II oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje dextranum 70 1,0 mg a hypromelosum 3,0
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU . NÁZEV PŘÍPRAVKU Actraphane 30 40 mezinárodních jednotek/ml injekční suspenze. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ injekční lahvička obsahuje 0 ml, což odpovídá
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU . NÁZEV PŘÍPRAVKU Actraphane 30 40 mezinárodních jednotek/ml injekční suspenze. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ injekční lahvička obsahuje 0 ml, což odpovídá
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Toujeo 300 jednotek/ml injekční roztok v předplněném peru 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje insulinum glarginum* 300 jednotek
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Toujeo 300 jednotek/ml injekční roztok v předplněném peru 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje insulinum glarginum* 300 jednotek
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU ECOPORC SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU ECOPORC SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Actrapid Innolet/Actrapid FlexPen 1 předplněné pero obsahuje 3 ml odpovídající 300 mezinárodním jednotkám. 1 ml roztoku obsahuje
 1. NÁZEV PŘÍPRAVKU Actrapid 40 mezinárodních jednotek/ml injekční roztok v injekční lahvičce. Actrapid 100 mezinárodních jednotek/ml injekční roztok v injekční lahvičce. Actrapid Penfill 100 mezinárodních
1. NÁZEV PŘÍPRAVKU Actrapid 40 mezinárodních jednotek/ml injekční roztok v injekční lahvičce. Actrapid 100 mezinárodních jednotek/ml injekční roztok v injekční lahvičce. Actrapid Penfill 100 mezinárodních
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Humulin N (NPH) KwikPen 100 IU/ml injekční suspenze v předplněném peru
 Sp.zn. sukls217401/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Humulin N (NPH) KwikPen 100 IU/ml injekční suspenze v předplněném peru 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje insulinum
Sp.zn. sukls217401/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Humulin N (NPH) KwikPen 100 IU/ml injekční suspenze v předplněném peru 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje insulinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mixtard 30 40 mezinárodních jednotek/ml injekční suspenze v injekční lahvičce. Mixtard 30 100 mezinárodních jednotek/ml injekční suspenze v injekční
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mixtard 30 40 mezinárodních jednotek/ml injekční suspenze v injekční lahvičce. Mixtard 30 100 mezinárodních jednotek/ml injekční suspenze v injekční
1. NÁZEV PŘÍPRAVKU. Humalog 100 IU/ml KwikPen, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 1. NÁZEV PŘÍPRAVKU Humalog 100 IU/ml KwikPen, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje 100 U (odpovídá 3,5 mg) insulinum lisprum (původem z rekombinantní DNA produkované E.coli).
1. NÁZEV PŘÍPRAVKU Humalog 100 IU/ml KwikPen, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje 100 U (odpovídá 3,5 mg) insulinum lisprum (původem z rekombinantní DNA produkované E.coli).
1 ml roztoku obsahuje 100 jednotek insulinum aspartum* (ekvivalentní 3,5 mg). 1 zásobní vložka obsahuje 3 ml odpovídající 300 jednotkám.
 1. NÁZEV PŘÍPRAVKU NovoRapid Penfill 100 jednotek/ml injekční roztok v zásobní vložce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje 100 jednotek insulinum aspartum* (ekvivalentní 3,5 mg).
1. NÁZEV PŘÍPRAVKU NovoRapid Penfill 100 jednotek/ml injekční roztok v zásobní vložce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje 100 jednotek insulinum aspartum* (ekvivalentní 3,5 mg).
Přecitlivělost na léčivé látky nebo na kteroukoliv z pomocných látek uvedených v bodě 6.1.
 sp.zn.: sukls50035/2010, sukls106419/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 g Selachiorum
sp.zn.: sukls50035/2010, sukls106419/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 g Selachiorum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Vanguard R injekční suspenze pro psy, kočky, skot, prasata, ovce, kozy, koně a fretky
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Vanguard R injekční suspenze pro psy, kočky, skot, prasata, ovce, kozy, koně a fretky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Vanguard R injekční suspenze pro psy, kočky, skot, prasata, ovce, kozy, koně a fretky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls186703/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vasopos N oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Tetryzolini hydrochloridum 0,5 mg v 1 ml (cca 30 kapek) Úplný seznam
sp.zn.sukls186703/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vasopos N oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Tetryzolini hydrochloridum 0,5 mg v 1 ml (cca 30 kapek) Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.sukls158765/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.sukls158765/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě
*Inzulín glargin se vyrábí technologií rekombinace DNA u bakterie Escherichia coli.
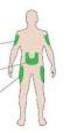 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
ANNEX I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 ANNEX I SOUHRN ÚDAJŮ O PŘÍPRAVKU . NÁZEV PŘÍPRAVKU Actrapid 40 mezinárodních jednotek/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ injekční lahvička obsahuje 0 ml odpovídající 400 mezinárodním
ANNEX I SOUHRN ÚDAJŮ O PŘÍPRAVKU . NÁZEV PŘÍPRAVKU Actrapid 40 mezinárodních jednotek/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ injekční lahvička obsahuje 0 ml odpovídající 400 mezinárodním
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls265484/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU AVAXIM 160 U, injekční suspenze v předplněné injekční stříkačce Vakcína proti hepatitidě A (inaktivovaná, adsorbovaná) 2. KVALITATIVNÍ
sp.zn.: sukls265484/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU AVAXIM 160 U, injekční suspenze v předplněné injekční stříkačce Vakcína proti hepatitidě A (inaktivovaná, adsorbovaná) 2. KVALITATIVNÍ
Složení vakcíny odpovídá doporučení SZO (pro severní polokouli) a EU rozhodnutí pro sezónu2007/2008
 Příbalová informace - RP Informace pro použití, čtěte pozorně! Begrivac (vakcína proti chřipce) Injekční suspenze Sezóna 2007/2008 Držitel rozhodnutí o registraci a výrobce Novartis Vaccines and Diagnostics
Příbalová informace - RP Informace pro použití, čtěte pozorně! Begrivac (vakcína proti chřipce) Injekční suspenze Sezóna 2007/2008 Držitel rozhodnutí o registraci a výrobce Novartis Vaccines and Diagnostics
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Cyclix 250 µg/ml injekční roztok pro skot 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml injekčního roztoku obsahuje: Léčivá(é) látka(y):
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Cyclix 250 µg/ml injekční roztok pro skot 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml injekčního roztoku obsahuje: Léčivá(é) látka(y):
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls195317/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin-POS 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls195317/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin-POS 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 1 dávka - 0,5 ml obsahuje: Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty2)..25 mikrogramů
 sp. zn. sukls183609/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti břišnímu tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp. zn. sukls183609/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti břišnímu tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Léčivá látka: Glucagonum, rdna (vyrobený rekombinantní DNA technologií na Saccharomyces cerevisiae).
 Příloha k sp. zn. sukls19074/2007 a příloha k sp. zn. sukls34813/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GlucaGen 1 mg HypoKit, prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ
Příloha k sp. zn. sukls19074/2007 a příloha k sp. zn. sukls34813/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GlucaGen 1 mg HypoKit, prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ
Fludeoxythymidine ( 18 F) 1 8 GBq k datu a hodině kalibrace voda na injekci, chlorid sodný 9 mg/ml
 Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému
Pomocné látky se známým účinkem: prostý sirup 67%, usušená tekutá glukosa.
 sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
Injekční roztok. Tmavě hnědý, neprůhledný roztok s ph 5,0 7,0 a s přibližnou osmolaritou 400 mosm/l.
 sp.zn. sukls57833/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli
sp.zn. sukls57833/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls85525/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GAVISCON LIQUID PEPPERMINT 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Natrii alginas Natrii hydrogencarbonas Calcii carbonas 500,0 mg/10
sp. zn. sukls85525/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GAVISCON LIQUID PEPPERMINT 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Natrii alginas Natrii hydrogencarbonas Calcii carbonas 500,0 mg/10
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Glucosum monohydricum
 sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls243839/2011 a sp.zn.: sukls113646/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum 10,0 mg (odpovídá
sp.zn.: sukls243839/2011 a sp.zn.: sukls113646/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum 10,0 mg (odpovídá
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls212686/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Chlorid sodný 0,9% Braun Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 000 ml roztoku obsahuje: natrii chloridum Koncentrace
sp.zn. sukls212686/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Chlorid sodný 0,9% Braun Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 000 ml roztoku obsahuje: natrii chloridum Koncentrace
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls106163/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cerebrolysin, 215,2 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1ml roztoku obsahuje cerebrolysinum 215,2 mg v 1 ml
sp. zn. sukls106163/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cerebrolysin, 215,2 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1ml roztoku obsahuje cerebrolysinum 215,2 mg v 1 ml
sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014
 sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYTELASE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ambenonii chloridum 10 mg v 1 tabletě. Pomocné látky
sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYTELASE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ambenonii chloridum 10 mg v 1 tabletě. Pomocné látky
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Vakcína proti Haemophilus influenzae b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Act-HIB Vaccine, prášek pro přípravu inj. roztoku s rozpouštědlem Vakcína proti Haemophilus influenzae b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka:
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Act-HIB Vaccine, prášek pro přípravu inj. roztoku s rozpouštědlem Vakcína proti Haemophilus influenzae b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Ecoporc SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Ecoporc SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Canigen DHA 2 PPi/LR Lyofilizát pro přípravu injekční suspenze s rozpouštědlem. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky:
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Canigen DHA 2 PPi/LR Lyofilizát pro přípravu injekční suspenze s rozpouštědlem. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky:
sp.zn. sukls294169/2016
 sp.zn. sukls294169/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Arufil 20 mg/ml oční kapky, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje povidonum K30 20 mg (= 24 kapek).
sp.zn. sukls294169/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Arufil 20 mg/ml oční kapky, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje povidonum K30 20 mg (= 24 kapek).
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls123741/2010
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls123741/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VAXIGRIP, injekční suspenze v předplněné injekční stříkačce. Vakcína proti chřipce (inaktivovaná,
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls123741/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VAXIGRIP, injekční suspenze v předplněné injekční stříkačce. Vakcína proti chřipce (inaktivovaná,
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 20 mg/ml injekční roztok pro skot, prasata a koně
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 20 mg/ml injekční roztok pro skot, prasata a koně 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedem ml obsahuje: Léčivá(é) látka(y):
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 20 mg/ml injekční roztok pro skot, prasata a koně 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedem ml obsahuje: Léčivá(é) látka(y):
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls49271/2012 a sp.zn. sukls255463/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Glukóza 40 Braun koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku
sp.zn. sukls49271/2012 a sp.zn. sukls255463/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Glukóza 40 Braun koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls83386/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam pomocných látek viz
sp.zn. sukls83386/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam pomocných látek viz
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Humalog 100 IU/ml, injekční roztok v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 2.1. Obecný popis Humalog je sterilní, čirý, bezbarvý
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Humalog 100 IU/ml, injekční roztok v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 2.1. Obecný popis Humalog je sterilní, čirý, bezbarvý
