Síra a sloučeniny síry. 1. Síra S. Sloučeniny. rekuperace síry z jiných průmyslových surovin a produktů. vulkanizační přísady. Kyselina sírová H2SO4
|
|
|
- Radek Slavík
- před 6 lety
- Počet zobrazení:
Transkript
1 Síra a sloučeniny síry Sloučeniny Kyselina sírová H2SO4 Oxidy síry Sirouhlík CS2 (viskózní vlákna) 1. Síra S Zdroje: těžba elementární síry rekuperace síry z jiných průmyslových surovin a produktů (např. zemní plyn, ropa, uhlí, rafinérské plyny) Použití: výroba kyseliny sírové (85 90 %) vulkanizační přísady 1
2 1.1 Těžba síry Ložiska: Polsko (Tarnobrzeg), Rusko (Kujbyšev), Mexiko, USA Metody: 1. Povrchová těžba (síronosné štěrky) povrchová těžba drcení mletí třídění flotace koncentrát (80 85 %) odvodnění (odstředivka) vytavení nebo destilace 2. Hlubinná těžba Povrchová těžba (síronosné štěrky) Fraschův způsob: vtlačování horké vody (165 C, 2,5 MPa) do hlubinného ložiska roztavení síry okolo sondy vytlačování roztavené síry na povrch tlakovým vzduchem (4 MPa) 2
3 1.2 Rekuperace síry z H2S Postup: 1. Zachycení a koncentrace H2S z jiné suroviny 2. Oxidace H2S za vzniku elementární síry (Clausův proces) 1. Zachycení a koncentrace H2S z jiné suroviny fyzikální nebo chemická absorpce s následnou regenerací absorpčního činidla Způsoby: 1. Mokré způsoby (vhodné pro plyny s vyšším obsahem H2S) 2. Suché způsoby Mokré způsoby absorpce absorpční roztoky: roztok Na2CO3, K2CO3, metanol (proces Rectisol), thioarsenitan sodný (proces Thylox), ethanolaminy 3
4 Suché způsoby Zachycování na hydratovaném oxidu železitém (plynárenská/luxova hmota) Adsorpce: Fe2O3.x H2O + 3 H2S Fe2S3 + (x + 3) H2O Regenerace: oxidace vlhké hmoty vzduchem při vyloučení síry Fe2S3 + x H2O + O2 Fe2O3.x H2O + 3S Odstranění síry extrakce sirouhlíkem, (NH4)2S nebo spálení na SO2 2. Oxidace H2S za vzniku elementární síry (Clausův proces) 1. Spálení části H2S vzdušným kyslíkem na SO2 H2S + 3/2 O2 SO2 + H2O 2. Oxidace H2S 2 H2S + O2 = S2 + 2 H2O 2 H2S + SO2 = 3/8 S8 + 2 H2O 4
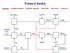
5 Blokové schéma Clausova procesu H 2S vzduch topný plyn Spalovací komora spalovací vytvoření směsi H2S: SO2 = 2 :1 (mol) komora XH2S (celk/kum.) = % utilizační Utilizační výměník výměník ochlazení na cca 300 C Reaktor 1 reaktor 1 katalyzátor: Co Mo na nosiči Al2O3 t = 300 C, XH2S (celk/kum.) = % kondenzace Kondenzace síry síry chlazení a kondenzace síry, t 170 C 5
6 ohřev Ohřev ohřev na teplotu t 220 C reaktor 2 Reaktor 2 katalyzátor: Al2O3 s velkým povrchem ( m 2 /g) t = 300 C, XH2S (celk/kum.) = 96 % čištění Čištění odplynů odplynů obvykle Wellman Lordova technologie absorpce: vodný roztok NaSO3 a NaHSO3 Pozn. Výtěžky síry: 2 reaktory XH2S = 96 % 3 reaktory XH2S = 98 % 6
7 2. Kyselina sírová H2SO4 Použití: výroba průmyslová hnojiva (fosforečná a dusíkatá) organické látky (barviva, výbušiny, izokyanáty, mýdla, detergenty, plasty, viskózová vlákna) anorganické látky (kyselina fluorovodíková, chromová, Al2(SO4)3, titanová běloba) Produkce: kyselina oleum (dýmavá kyselina ; roztok oxidu sírového v kyselině sírové) Vlastnosti: azeotrop 98,3 % H2SO4 silně hygroskopická látka organické látky zuhelnaťuje Metody: 1. Katalytická oxidace SO2 na SO3 a jeho absorpce ve vodě 2. Přepracování a koncentrace odpadních kyselin 7
8 2.1 Katalytická oxidace SO2 na SO3 a jeho absorpce ve vodě Zdroje SO2 spalování elementární síry S + O2 SO2 pražení kovových sulfidů pyrity (FeS2), zinkové blejno (ZnS2), galenit (PbS2), chalkopyrit (CuFeS2 ; sulfid železnatoměďnatý) FeS2 + 11/2 O2 Fe2O3 + 4 SO2 štěpení síranů sádrovec: 4 CaSO4 + 2 C 4 CaO + 4 SO2 + 2 CO2 zelená skalice (FeSO4) odpad z výroby titanové běloby vyráběné z ilmenitu, moření kovů Porovnání: elementární síra x pražení elementární síra pražení investičně levnější vyšší znečištění pražného plynu nutnost čistění provozně levnější ztráty síry při pražení odpadová technologie vedlejší produkty: výpalky 8
9 A. spalování elementární síry pozn. S (g) + O2 (g) SO2 (g) 3x přebytek vzduchu menší investiční a Hr 0 = 296 kj/mol ; odvod tepla výrobou páry provozní náklady pražný plyn: teoreticky 21 % SO2, prakticky 7 12 % B. Pražení kovových sulfidů pražný plyn nutno čistit pyrit: FeS2 + 11/2 O2 Fe2O3 + 4 SO2 ztráty síry Hr 0 = kj/mol ; odvod tepla výrobou páry pražný plyn: cso2 = 8 15 % ; vedlejší produkt: výpalky etážové pece ( C), fluidní pece, rotační pece ( C) 9
10 C. Štěpení síranů sádrovec: 1. fáze: 4 CaSO4 + 2 C 4 CaO + 4 SO2 + 2 CO2 Hr 0 = 608 kj/mol ; teplo dodáváno spalováním topného plynu rotační pec: sádrovec + uhlí + jíl + písek + ( C) pražný plyn: cso2 = 7 10 % ; plyn nutno čistit 2. fáze: CaO + písek + jíl + ( C) portlandský cement zelená skalice (FeSO4.7 H2O) Bayerův postup 1. fáze: dehydratace 2 FeSO4.7 H2O 2 FeSO4.H2O + 12 H2O 200 C, fluidní sušárna 2. fáze: termické štěpení 2 FeSO4.H2O Fe2O3 + 2 SO2 + 1/2 O2 + 2 H2O fluidní pece, rotační pece, etážové pece energie na štěpení: spalování síry, ZP, topného oleje 10
11 Čistění plynů z pražení horký pražný plyn utilizační pára Utilizační výměník výměník ochlazení plynů na cca 400 C, využití tepla na výrobu páry sekce: Suché čištění vysoká teplota nutná pro zabránění kondenzace H2SO4 cyklon 1. Cyklon elektrofiltry 2. Elektrofiltry výstup: C ochlazení Ochlazení plynů výstup: C 11
12 vypírka sekce: Mokré čištění 1. Vypírka zkrápěno zředěnou H2SO4 ochlazení na 30 C, odstranění zbytků prachu, As2O3 vzniká mlha H2SO4 ze SO3 vzniklého oxidací SO2 ; reakce katalyzována oxidy Fe prací věže, Venturiho pračka mokré 2. Mokré elektrofiltry elektrofiltry odstranění mlhy H 2SO4, zbytků prachu, As2O3 sušení 3. Sušení plynu pomocí konc. H2SO4 plynu 2 věže zkrápěné koncentrovanou kyselinou vyčištěný ochlazený a vyčištěný plyn plyn 40 C, % obj. SO2 12
13 2.1.2 Výroba SO2 spalováním elementární síry 1. Roztavení tuhé síry S (s) S (l) roztavení tuhé síry při teplotě 150 C ttání = 113 C? proč 150 C? S (l) má při teplotě C viskozitní minimum 2. Spálení síry S (g) + O2 (g) SO2 (g) spalování s vysušeným vzduchem spalovací pec s rozprašovacími hořáky na kapalnou síru rozprašovací hořáky cíl: jemné rozptýlení kapalné síry tak, aby došlo k jejímu odpaření tlakové rozprašování hořáky s dvoulátkovým rozprašováním rotační rozprašování (nástřik na rotující válec ( /min), vytvoření filmu, rozprášení filmu odstředivou silou, kolem válce kruhová štěrbina, do které se přivádí vzduch) ochlazení plynu v utilizačním výměníku na 450 C složení plynu: teoreticky 21 % SO2 prakticky až trojnásobný přebytek vzduchu 7 12 % SO2, obsah O2 pak stačí na výrobu SO3 13
14 2.1.3 Výroba H2SO4 ze SO2 Katalytická oxidace SO2 na SO3 a jeho absorpce ve vodě Technologie dle způsobu katalýzy oxidace SO2 A. Heterogenní katalýza kovy nebo jejich oxidy tzv. kontaktní způsoby B. Homogenní katalýza oxidy dusíku (resp. hydrogensíranu nitrosylu NOHSO4) tzv. nitrózní způsoby (věžový, komorový způsob) 14
15 Porovnání: kontaktní x komorový způsob kontaktní způsob komorový způsob kyselina vysoké čistoty a libovolné koncentrace včetně olea kyselina max. 78 % vyšší produktivita možno zpracovat plyny s cso2 = 0,5 3 % (proces Ciba-Geigy) vyšší požadavky na čistotu plynů nutno suché i mokré čištění suché čištění dostačující oddělená absorpční a oxidační část současná absorpce SO3 a oxidace SO2 katalytické jedy: prach, sloučeniny As, mlha H2SO4 možno zpracovat nečistou síru obsahující katalytické jedy Materiály olovo, kujné železo, křemíková litina, ocel andezit, diabas, křemen, čedič, šamot, kyselinovzdorný beton, plasty 15
16 2.1.4 Kontaktní způsob výroby H2SO4 (heterogenní katalýza kovy nebo jejich oxidy) Postup 1. Heterogenní katalýza oxidace SO2 kovy nebo jejich oxidy 2 SO2 (g) + O2 (g) 2 SO3 (g) Hr 0 = 197 kj/mol 2. Absorpce SO3 Absorpce do H2SO4 dokonalá rozpustnost: 98,3 % H2SO4 t = 35 C ch2so4 < 98,3 % : tvorba mlhy H2SO4, kterou nelze zachytit Absorpce do olea ch2so4 > 98,3 % : pohlcuje SO3 nedokonale 3. Čištění koncových plynů Absorpce (vypírka): amoniak, vodný roztok Na2SO3 + NaHSO3 (Wellman-Lord) Adsorpce na aktivním uhlí (proces Lurgi Sulfacid) Oxidace peroxidem vodíku (proces Peracidox) nebo H2SO5 (k.peroxomonosírová) 16
17 Ad 1 Heterogenní katalýza oxidace SO2 kovy nebo jejich oxidy 2 SO2 (g) + O2 (g) 2 SO3 (g) Hr 0 = 197 kj/mol Termodynamické a kinetické posouzení Kin: pomalá reakce vyžaduje katalyzátor ; katalyzátory aktivní pro T > 400 C T > 400 C z hlediska rovnováhy nepříznivé T: kompromis mezi TD a KIN Td: T: exotermická reakce + Ka = f (T) + Chatelier T posun EQ doleva p: ϕ = 1 kontrakce objemu p výtěžek Katalyzátory 5 % oxid vanadičný V2O5 + promotory K2O, Na2O, Ag2O na porézním nosiči (křemelina, diatomit) spodní pracovní teplota (spodní hranice aktivity): C 17
18 Výtěžek SO3 podporuje: teplota nižší ; C ; spodní hranice dána pracovními podmínkami katalyzátoru tlak zvýšení tlaku (0,5 MPa, postup Uge Kuhlmann) snížení koncentrace SO3 vícenásobné kontaktování = dvojí/trojí oxidace s vloženou absorpcí Postup dosažení maximálního výtěžku 1. fáze Adibatické vedení procesu: 450 C 590 C vysoká rychlost reakce, dosažení konverze 70 % 2. fáze Ochlazení na 440 C a vedení reakce při nižších teplotách (max do 500 C) pomalejší, ale s vyšší konverzí ; dosažená celková konverze 98 % oxidace trvá cca 3 4 s, končí při teplotě 440 C 18
19 Porovnání: Jednoduché kontaktování x dvojité kontaktování s meziabsorpcí jednoduché kontaktování bez meziabsorpce dvojité kontaktování s meziabsorpcí * Max. konverze 98 % 99,6 99,7 % Absorpce Koncové plyny po 4. etáži absorpce do: 98,5 99 % H2SO4 nebo oleum po 3. etáži absorpce do: 98,5 99 % H2SO4 po poslední etáži absorpce do: 98,5 99 % H2SO4 nebo oleum nutno čistit není nutno čistit emise 10x nižší * Bayer AG Absorpce: absorpční věže: protiproudé, s výplní pračka: souproud 19
20 Kontaktní tělesa Kontaktní tělesa etážová fluidní Etážová kontaktní tělesa sítová patra ; 4 5 pater pro jednoduché kontaktování vrstva katalyzátoru na sítovém patře chlazení: horní patra 450 C, spodní patra 430 C Fluidní kontaktní tělesa fluidní vrstva: katalyzátor ve formě otěruvzdorných kuliček přívod plynu zespoda, odvádění tepla trubkovými chladiči izotermní vedení reakce možno zpracovávat plyny s vyšší koncentrací SO2 20
21 Jednoduché kontaktování schéma SO2 (7 12 %) sušený Úprava složení na 10 % SO2 sušeným vzduchem vzduch 450 C, 10 % katalyzátor etáž 1 konverze SO2 (celk/kumul) = % 620 C 450 C Σ katalyzátor etáž 2 konverze SO2 (celk/kumul) = % 620 C 450 C Σ katalyzátor etáž 3 konverze SO2 (celk/kumul) = % 430 C Σ 21
22 katalyzátor etáž 4 konverze SO2 (celk/kumul) = 98 % 430 C Σ 22
23 Dvojité kontaktování s meziabsorpcí schéma SO2 Úprava složení na 10 % SO2 sušeným vzduchem sušený vzduch 450 C, 10 % katalyzátor etáž C 450 C Σ katalyzátor etáž C 450 C Σ katalyzátor etáž 3 Σ C HE konverze SO2 (celk/kumul) = % konverze SO2 (celk/kumul) = % konverze SO2 (celk/kumul) = % % H2SO4, C absorpční kolona náplňová (Raschig) % H2SO4, C 0,6 1 % obj. SO2 23
24 0,6 1 % obj. SO2 katalyzátor etáž 4 Doplňkový kontakt katalyzátor etáž 5 Σ C konverze SO2 (celk/kumul) = 99,6 99,7 % absorpce 24
25 Mokrá katalýza (kontaktování za mokra) zpracování vlhkého SO2 vzniklého spalováním H2S ; min. konc. H2S = 10 % spalování H2S s přebytkem vzduchu: H2S + 3 O2 2 SO2 + 2 H2O katalytická oxidace vlhkého SO2 na SO3 vysoký podíl H2O % H2SO4 zlepšení: kondenzace vodní páry z plynu % H2SO4 použití: zpracování H2S v koksovnách 25
26 2.1.5 Nitrózní způsob výroby H2SO4 (mokrá katalýza s NOHSO4 jako oxid. činidlem) Princip Katalytická oxidace SO2 vzdušným kyslíkem, která probíhá ve vodném roztoku katalyzovaná oxidy dusíku (NO, NO2), které slouží jako přenašeče kyslíku mokrá katalýza s NOHSO4 jako oxid. činidlem Oxidy dusíku cirkulují rozpuštěné v H2SO4 ve formě hydrogensíranu nitrosylu [NO][HSO4] Způsoby komorový způsob věžový způsob A. Komorový způsob olověné komory produkční + oxidační část reakce: 1. rozklad roztoku hydrogensíranu nitrosylu vznik NOX 2. oxidace SO2 SO3 + absorpce vodní mlhou 26
27 B. Věžový způsob pražný plyn roztok plyn Denitrační věž výplň z AV1 na AV 2 vstup: pražný plyn, t = 350 C roztok [NO][HSO4] z absorpční věže 1 denitrační obsah NOX 7 13 % HNO3 věž 78 % kyselina výstup: 78 % H2SO4 ( 30 % produkce) část plynu na produkční věž 1 část plynu na absorpční věž 2 roztok Produkční věž 1 výplň z AV1 vstup: plyn z denitrační věže produkční roztok [NO][HSO4] z absorpční věže 1 + věž 1 70 % přídavek HNO3, H2O výstup: 70 % H2SO4 (část na absorpční věž 1) kyselina plyn na produkční věž 2 27
28 část 70 % kyseliny produkční věž 2 70 % kyselina Produkční věž 2 výplň vstup: plyn z produkční věže 1 část roztok 70 % H2SO4 ze spodku věže výstup: 70 % H2SO4 (část na vršek věže) plyn na oxidační věž Oxidační věž cíl: zajistit NO:NO2 = 1:1 ; bez výplně oxidační vstup: plyn z produkční věže 2 věž výstup: plyn na absorpční věž 1 část 70 % Absorpční věž 1 kyseliny z PV 2 + roztok z AV 2 absorpční věž 1 roztok na DV vstup: plyn z oxidační věže část 70 % kyseliny z produkční věže 2 roztok [NO][HSO4] z absorpční věže 2 výstup: plyn na absorpční věž 2 roztok [NO][HSO4] na denitrační věž 28
29 část 78 % Absorpční věž 2 kyseliny z DV absorpční věž 2 roztok na AV1 vstup: plyn z absorpční věže 1 část kyseliny z denitrační věže výstup: roztok [NO][HSO4] (na absorpční věž 1) odplyn odplyn Produkt část 78 % kyseliny z denitrační věže část 70 % kyseliny z produkčních věží nižší koncentrace + znečištění omezené využití (např. výroba superfosfátu) 29
30 2.2 Výroba H2SO4 z odpadních kyselin (min. koncentrace 20 % H2SO4) Přepracování použitých kyselin A. Málo znečištěné kyseliny (min. koncentrace 20 % H2SO4) Zakoncentrování + oxidační odstranění organických látek (např. přídavkem HNO3) B. Vysoce znečištěné kyseliny (min. koncentrace 60 % H2SO4) termické štěpení H2SO4 : redukční, oxidační 1. štěpení H2SO4: 2 H2SO4 2 SO2 + O2 + 2 H2O 2. využití SO2 pro výrobu kyseliny 30
31 Porovnání: Redukční x oxidační termické štěpení redukční termické štěpení oxidační termické štěpení redukce organických látek na uhlík redukce organických látek na CO2 kyselé odpady z rafinačních procesů z petro, kyselé dehty, pryskyřice koks redukční atmosféra spalování koksu kouřové plyny ( 1000 C) oxidační atmosféra spalování s nadbytkem vzduchu kouřové plyny ( C) teplota v peci C zdroj energie: koks zdroj energie: palivo (topný olej, plyn) rotační pec pec s rozprašováním odpadní kyseliny 31
32 2.2.1 Koncentrování kyselin Termodynamické posouzení Energeticky náročné: vysoké výparné teplo vody + dehydratační teplo H2SO4 Bod varu 70 % H2SO4 160 C (100 kpa) 54 C (1 kpa) 96 % H2SO4 320 C (100 kpa) Dvojstupňové odpařování 1 předkoncentrování 20 % % normální tlak snížený tlak (cirkulační odparka) 2 dokoncentrování % 90 % a více normální tlak 32
33 A. Předkoncentrování A1. Venturiho trubice větší množství zředěné H2SO4 kyseliny silně znečištěné tuhými látkami možnost využití odpadního tepla na nižší teplotní hladině teplo: ohřev proudícího plynu, ohřev kyseliny A2. Ponorný hořák zředěné kyseliny obsahující soli soli krystalizující během odpařování přímé vytápění kouřovými plyny vhodné: H2SO4 z titanové běloby, z moření oceli A3. Cirkulační odparka snížený tlak + nepřímý přívod tepla 33
34 B. Dokoncentrování B1. Destilace dle Pauliga normální tlak + nepřímý přívod tepla přídavek HNO 3: odstranění organických látek oxidací (redukce HNO3 na dusík) litinový kotel s vroucí 96 % kyselinou (320 C) destilační kolona nástřik: odpadní kyselina dest. zbytek: 96 % kyselina destilát: voda B2. Bayerův Bertramsův způsob normální tlak filmová odparka křemenová s předřazenou cirkulační odparkou dokoncentrování: až 98 % 34
35 3. Oxidy síry % SO2 (l) 1. absorpce a regenerace SO2 kondenzace za zvýšeného tlaku (500 kpa) ochlazením (kapalným amoniakem) 2. reakce síry s oxidem sírovým 2 SO3 (l) + S (l) 3 SO2 (l) použití: výroba buničiny, úprava minerálních olejů (odstranění nečistot obsahujících síru), desinfekční a konzervační prostředek, výroba chemikálií % SO3 (l) destilace olea a zkapalnění par (destilace: filmová nebo cirkulační odparka z drahých kovů) použití: sulfonační činidlo (vhodnější než kyselina chlorosírová (při použití nevzniká chlorovodík) (prací prostředky) 35
36 4. Sirouhlík (sulfid uhličitý) CS2 Použití: výroba viskózových vláken pesticidy gumárenské chemikálie (urychlovače vulkanizace) rozpouštědlo inhibitory koroze Metody: 1. Uhlí + síra retorty naplněné uhlím + roztavená síra síra se odpařuje a reaguje s uhlím (900 C) izolace CS2 kondenzací retorta: nepřímý ohřev, elektrický odporový ohřev 2. Metan + síra CH4 (g) + 2 S2 CS2 (g) 650 C, kat. na bázi Al2O3 V obou případech: izolace CS2 kondenzací čištění CS2 destilací odplyny: zpracování H2S pomocí Clausova procesu Radek
1.1 Suroviny síry Průmyslově využitelné suroviny pro zisk síry nebo jejích sloučenin nebo dalších složek obsažených v příslušných minerálech výskyt:
 1. Chemie a technologie sloučenin síry 1.1 Suroviny síry Průmyslově využitelné suroviny pro zisk síry nebo jejích sloučenin nebo dalších složek obsažených v příslušných minerálech výskyt: Elementární síra:
1. Chemie a technologie sloučenin síry 1.1 Suroviny síry Průmyslově využitelné suroviny pro zisk síry nebo jejích sloučenin nebo dalších složek obsažených v příslušných minerálech výskyt: Elementární síra:
Fosfor a sloučeniny fosforu. Suroviny. Sloučeniny. kalcinace pro oddělení organických. Kyselina trihydrogenfosforečná H3PO4
 Fosfor a sloučeniny fosforu Sloučeniny Fosfor bílý Kyselina trihydrogenfosforečná H3PO4 Suroviny Apatit Ca5 (PO4)3(F, OH, Cl) fluoroapatity úpravy mletí promývání sítování magnetické oddělování oxidů železa
Fosfor a sloučeniny fosforu Sloučeniny Fosfor bílý Kyselina trihydrogenfosforečná H3PO4 Suroviny Apatit Ca5 (PO4)3(F, OH, Cl) fluoroapatity úpravy mletí promývání sítování magnetické oddělování oxidů železa
Příklady úspěšných projektů čistší produkce (Cleaner Production) Výroba: kyseliny sírové mikrokorundu
 Příklady úspěšných projektů čistší produkce (Cleaner Production) Výroba: kyseliny sírové mikrokorundu Ing. Miroslav Richter, PhD., EUR ING Fakulta životního prostředí Univerzity J.E.Purkyně v Ústí n.l.
Příklady úspěšných projektů čistší produkce (Cleaner Production) Výroba: kyseliny sírové mikrokorundu Ing. Miroslav Richter, PhD., EUR ING Fakulta životního prostředí Univerzity J.E.Purkyně v Ústí n.l.
Omezování plynných emisí. Ochrana ovzduší ZS 2012/2013
 Omezování plynných emisí Ochrana ovzduší ZS 2012/2013 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Omezování plynných emisí Ochrana ovzduší ZS 2012/2013 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Průmysl dusíku. amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin. NaClO NaOH CO(NH 2 ) 2.
 Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
Kyselina fosforečná Suroviny: Výroba: termický způsob extrakční způsob
 Kyselina fosforečná bezbarvá krystalická sloučenina snadno rozpustná ve vodě komerčně dodávané koncentrace 75% H 3 PO 4 s 54,3% P 2 O 5 80% H 3 PO 4 s 58.0% P 2 O 5 85% H 3 PO 4 s 61.6% P 2 O 5 po kyselině
Kyselina fosforečná bezbarvá krystalická sloučenina snadno rozpustná ve vodě komerčně dodávané koncentrace 75% H 3 PO 4 s 54,3% P 2 O 5 80% H 3 PO 4 s 58.0% P 2 O 5 85% H 3 PO 4 s 61.6% P 2 O 5 po kyselině
VÝROBA KYSELINY SÍROVÉ TEXT PRO UČITELE
 VÝROBA KYSELINY SÍROVÉ TEXT PRO UČITELE Mgr. Jana Prášilová prof. RNDr. Jiří Kameníček, CSc. Olomouc, 2013 Obsah 1. Téma v učebnicích používaných na gymnáziích 2. Teoretické poznatky k problematice Kontaktní
VÝROBA KYSELINY SÍROVÉ TEXT PRO UČITELE Mgr. Jana Prášilová prof. RNDr. Jiří Kameníček, CSc. Olomouc, 2013 Obsah 1. Téma v učebnicích používaných na gymnáziích 2. Teoretické poznatky k problematice Kontaktní
DUM č. 15 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 15 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 15 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
Amoniak. 1913 průmyslová výroba syntetického amoniaku
 Amoniak 1913 průmyslová výroba syntetického amoniaku využití 20 % výroba dusíkatých hnojiv 80 % nejrůznější odvětví průmyslu (plasty, vlákna, výbušiny, hydrazin, aminy, amidy, nitrily a další organické
Amoniak 1913 průmyslová výroba syntetického amoniaku využití 20 % výroba dusíkatých hnojiv 80 % nejrůznější odvětví průmyslu (plasty, vlákna, výbušiny, hydrazin, aminy, amidy, nitrily a další organické
Zplyňování biomasy. Sesuvný generátor. Autotermní zplyňování Autotermní a alotermní zplyňování
 Zplyňování = termochemická přeměna uhlíkatého materiálu v pevném či kapalném skupenství na výhřevný energetický plyn pomocí zplyňovacích médií a tepla. Produktem je plyn obsahující výhřevné složky (H 2,
Zplyňování = termochemická přeměna uhlíkatého materiálu v pevném či kapalném skupenství na výhřevný energetický plyn pomocí zplyňovacích médií a tepla. Produktem je plyn obsahující výhřevné složky (H 2,
Kyselina dusičná. jedna z nejdůležitějších chemikálií
 Kyselina dusičná jedna z nejdůležitějších chemikálií Výroba: minulost - surovinou pro průmyslovou výrobu dusičnan sodný (ledek sodný, guano) současnost - katalytické spalování amoniaku (první výrobní jednotka
Kyselina dusičná jedna z nejdůležitějších chemikálií Výroba: minulost - surovinou pro průmyslovou výrobu dusičnan sodný (ledek sodný, guano) současnost - katalytické spalování amoniaku (první výrobní jednotka
VY_32_INOVACE_30_HBEN11
 Sloučeniny síry Temacká oblast : Chemie anorganická chemie Datum vytvoření: 15. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Sloučeniny síry sulfan, oxidy a
Sloučeniny síry Temacká oblast : Chemie anorganická chemie Datum vytvoření: 15. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Sloučeniny síry sulfan, oxidy a
Omezování plynných emisí. Ochrana ovzduší ZS 2010/2011
 Omezování plynných emisí Ochrana ovzduší ZS 2010/2011 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Omezování plynných emisí Ochrana ovzduší ZS 2010/2011 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE. Ing. Stanislav HONUS
 NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE Ing. Stanislav HONUS ORGANICKÝ MATERIÁL Spalování Chemické přeměny Chem. přeměny ve vodním prostředí Pyrolýza Zplyňování Chemické Biologické Teplo
NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE Ing. Stanislav HONUS ORGANICKÝ MATERIÁL Spalování Chemické přeměny Chem. přeměny ve vodním prostředí Pyrolýza Zplyňování Chemické Biologické Teplo
Síra a její sloučeniny
 Síra a její sloučeniny Mgr. Jana Pertlová Copyright istudium, 2008, http://www.istudium.cz Žádná část této publikace nesmí být publikována a šířena žádným způsobem a v žádné podobě bez výslovného svolení
Síra a její sloučeniny Mgr. Jana Pertlová Copyright istudium, 2008, http://www.istudium.cz Žádná část této publikace nesmí být publikována a šířena žádným způsobem a v žádné podobě bez výslovného svolení
5. Nekovy sı ra. 1) Obecná charakteristika nekovů. 2) Síra a její vlastnosti
 5. Nekovy sı ra 1) Obecná charakteristika nekovů 2) Síra a její vlastnosti 1) Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu. Jsou to prvky uspořádané
5. Nekovy sı ra 1) Obecná charakteristika nekovů 2) Síra a její vlastnosti 1) Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu. Jsou to prvky uspořádané
Název školy: Číslo a název sady: klíčové aktivity: Jméno a příjmení autora: Mgr. Alexandra Šlegrová
 Název školy: Číslo a název projektu: Číslo a název šablony klíčové aktivity: Označení materiálu: Typ materiálu: Předmět, ročník, obor: Číslo a název sady: Téma: Jméno a příjmení autora: STŘEDNÍ ODBORNÁ
Název školy: Číslo a název projektu: Číslo a název šablony klíčové aktivity: Označení materiálu: Typ materiálu: Předmět, ročník, obor: Číslo a název sady: Téma: Jméno a příjmení autora: STŘEDNÍ ODBORNÁ
Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška Rafinace pohonných hmot, zpracování sulfanu, výroba vodíku
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška Rafinace pohonných hmot, zpracování sulfanu, výroba vodíku
Směsi a čisté látky, metody dělení
 Směsi a čisté látky, metody dělení LÁTKY Chemicky čisté látky Sloučeniny Chemické prvky Homogenní Roztoky pevné kapalné plynné Směsi Heterogenní Suspenze Emulze Pěna Aerosol Chemicky čisté látky: prvky
Směsi a čisté látky, metody dělení LÁTKY Chemicky čisté látky Sloučeniny Chemické prvky Homogenní Roztoky pevné kapalné plynné Směsi Heterogenní Suspenze Emulze Pěna Aerosol Chemicky čisté látky: prvky
Bilan a ce c zák á l k ad a ní pojm j y m aplikace zákonů o zachování čehokoli 10.10.2008 3
 Výpočtový seminář z Procesního inženýrství podzim 2008 Bilance Materiálové a látkové 10.10.2008 1 Tématické okruhy bilance - základní pojmy bilanční schéma způsoby vyjadřování koncentrací a přepočtové
Výpočtový seminář z Procesního inženýrství podzim 2008 Bilance Materiálové a látkové 10.10.2008 1 Tématické okruhy bilance - základní pojmy bilanční schéma způsoby vyjadřování koncentrací a přepočtové
Modul 02 - Přírodovědné předměty
 Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 - Přírodovědné předměty Hana Gajdušková Výskyt
Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 - Přírodovědné předměty Hana Gajdušková Výskyt
Kovy a metody jejich výroby
 Kovy a metody jejich výroby Kovy v periodické tabulce Základní vlastnosti kovů 80 % prvků v přírodě jsou kovy, v PSP stoupá kovový charakter směrem DOLEVA Vlastnosti: Fyzikální kovový lesk kujnost a tažnost
Kovy a metody jejich výroby Kovy v periodické tabulce Základní vlastnosti kovů 80 % prvků v přírodě jsou kovy, v PSP stoupá kovový charakter směrem DOLEVA Vlastnosti: Fyzikální kovový lesk kujnost a tažnost
Paliva. nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování
 Paliva Paliva nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování Dělení paliv podle skupenství pevná uhlí, dřevo kapalná benzín,
Paliva Paliva nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování Dělení paliv podle skupenství pevná uhlí, dřevo kapalná benzín,
TECHNOLOGIE OCHRANY OVZDUŠÍ
 TECHNOLOGIE OCHRANY OVZDUŠÍ Přednáška č. 5 Přednášející: Ing. Marek Staf, Ph.D. tel. 0 444 458; e-mail marek.staf@vscht.cz budova A, ústav 16, č. dveří 16 Snímek 1. Osnova přednášky Suchá vápencová metoda
TECHNOLOGIE OCHRANY OVZDUŠÍ Přednáška č. 5 Přednášející: Ing. Marek Staf, Ph.D. tel. 0 444 458; e-mail marek.staf@vscht.cz budova A, ústav 16, č. dveří 16 Snímek 1. Osnova přednášky Suchá vápencová metoda
Prvky V.A a VI.A skupiny
 Prvky V.A a VI.A skupiny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Duben 2010 Mgr. Alena Jirčáková Prvky V.A skupiny - vlastnosti - Prvky s pěti
Prvky V.A a VI.A skupiny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Duben 2010 Mgr. Alena Jirčáková Prvky V.A skupiny - vlastnosti - Prvky s pěti
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115
 Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: CZ.1.07/1.5.00/34.0410 Číslo šablony: 23 Název materiálu: Ročník: Identifikace materiálu: Jméno autora: Předmět: Tématický celek:
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: CZ.1.07/1.5.00/34.0410 Číslo šablony: 23 Název materiálu: Ročník: Identifikace materiálu: Jméno autora: Předmět: Tématický celek:
Ropa Kondenzované uhlovodíky
 Nejdůležitější surovina pro výrobu organických sloučenin Nejvýznamnější surovina světové ekonomiky Výroba energie Chemické zpracování - 15 % Cena a zásoby ropy (70-100 let) Ropné krize Nutnost hledání
Nejdůležitější surovina pro výrobu organických sloučenin Nejvýznamnější surovina světové ekonomiky Výroba energie Chemické zpracování - 15 % Cena a zásoby ropy (70-100 let) Ropné krize Nutnost hledání
1. V jakých typech sloučenin se železo v přírodě nachází? 2. Jmenujte příklad jedné železné rudy (název a vzorec):
 ŽELEZO - cvičení 1. V jakých typech sloučenin se železo v přírodě nachází? 2. Jmenujte příklad jedné železné rudy (název a vzorec): 1. V jakých typech sloučenin se železo v přírodě nachází? V oxidech,
ŽELEZO - cvičení 1. V jakých typech sloučenin se železo v přírodě nachází? 2. Jmenujte příklad jedné železné rudy (název a vzorec): 1. V jakých typech sloučenin se železo v přírodě nachází? V oxidech,
PARAMO Pardubice. Studijní materiál k předmětu Chemická exkurze C6950 Brno 2011
 Studijní materiál k předmětu Chemická exkurze C6950 Brno 2011 PARAMO Pardubice Vypracoval: Mgr. Radek Matuška Úpravy: Mgr. Zuzana Garguláková, doc. Ing. Vladimír Šindelář, Ph.D. Obecné informace PARAMO,
Studijní materiál k předmětu Chemická exkurze C6950 Brno 2011 PARAMO Pardubice Vypracoval: Mgr. Radek Matuška Úpravy: Mgr. Zuzana Garguláková, doc. Ing. Vladimír Šindelář, Ph.D. Obecné informace PARAMO,
TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ)
 TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ) 5. část TĚKAVÉ ORGANICKÉ SLOUČENINY A PACHOVÉ LÁTKY Zpracoval: Tým autorů EVECO Brno, s.r.o. TĚKAVÉ ORGANICKÉ SLOUČENINY Těkavé organické
TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ) 5. část TĚKAVÉ ORGANICKÉ SLOUČENINY A PACHOVÉ LÁTKY Zpracoval: Tým autorů EVECO Brno, s.r.o. TĚKAVÉ ORGANICKÉ SLOUČENINY Těkavé organické
atomová hmotnost S + O 2 -> SO 2 Fe + S -> FeS
 PRVKY ŠESTÉ SKUPINY - CHALKOGENY Mezi chalkogeny (nepřechodné prvky 6.skupiny) zařazujeme kyslík, síru, selen, tellur a radioaktivní polonium. Společnou vlastností těchto prvků je šest valenčních elektronů
PRVKY ŠESTÉ SKUPINY - CHALKOGENY Mezi chalkogeny (nepřechodné prvky 6.skupiny) zařazujeme kyslík, síru, selen, tellur a radioaktivní polonium. Společnou vlastností těchto prvků je šest valenčních elektronů
Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH. atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na +
 OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
CELIO a.s. CZU Linka na úpravu odpadů za účelem jejich dalšího energetického využití SLUDGE
 CELIO a.s. CZU00168 Linka na úpravu odpadů za účelem jejich dalšího energetického využití SLUDGE Kód Název odpadu Příjem Pro úpravu 01 05 04 O Vrtné kaly a odpady obsahující sladkou vodu 01 05 05 N Vrtné
CELIO a.s. CZU00168 Linka na úpravu odpadů za účelem jejich dalšího energetického využití SLUDGE Kód Název odpadu Příjem Pro úpravu 01 05 04 O Vrtné kaly a odpady obsahující sladkou vodu 01 05 05 N Vrtné
Dusík a sloučeniny dusíku. 1. Amoniak NH3. Sloučeniny. Haber Bosch Mitaschův postup. amonné soli chladivo. močovina anorganické a organické syntézy
 Dusík a sloučeniny dusíku Sloučeniny Amoniak NH3 Kyselina dusičná HNO3 Kyanovodík Močovina Hydroxylamin ( kaprolaktam polyamid 6) 1. Amoniak NH3 Použití: výroba HNO3 plasty a vlákna močovina anorganické
Dusík a sloučeniny dusíku Sloučeniny Amoniak NH3 Kyselina dusičná HNO3 Kyanovodík Močovina Hydroxylamin ( kaprolaktam polyamid 6) 1. Amoniak NH3 Použití: výroba HNO3 plasty a vlákna močovina anorganické
Orientačně lze uvažovat s potřebou cca 650 750 Kcal na vypaření 1 l kapalné odpadní vody.
 Proces Biodestil Biodestil je nový pokrokový proces pro zpracování vysoce kontaminovaných nebo zasolených odpadních vod, které jsou obtížně likvidovatelné ostatními konvenčními metodami. Tento proces je
Proces Biodestil Biodestil je nový pokrokový proces pro zpracování vysoce kontaminovaných nebo zasolených odpadních vod, které jsou obtížně likvidovatelné ostatními konvenčními metodami. Tento proces je
Perspektivní metody. PROČ sušení pevných paliv? Většina dodané energie se ztrácí. Klasická metoda sušení horkými spalinami
 Perspektivní metody sušení pevných paliv Klasická metoda sušení horkými spalinami Uzavřený mlecí okruh PROČ sušení pevných paliv? zvýšení výhřevnosti snazší vzněcování spalování při vyšší teplotě menší
Perspektivní metody sušení pevných paliv Klasická metoda sušení horkými spalinami Uzavřený mlecí okruh PROČ sušení pevných paliv? zvýšení výhřevnosti snazší vzněcování spalování při vyšší teplotě menší
Energetické využití odpadu. 200 let První brněnské strojírny
 200 let První brněnské strojírny Řešení využití odpadů v nové produktové linii PBS Spalování odpadů Technologie spalování vytříděného odpadu, kontaminované dřevní hmoty Depolymerizace a možnosti využití
200 let První brněnské strojírny Řešení využití odpadů v nové produktové linii PBS Spalování odpadů Technologie spalování vytříděného odpadu, kontaminované dřevní hmoty Depolymerizace a možnosti využití
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Oxidace a redukce jsou chemické reakce spojené s výměnou elektronů. Při oxidaci látka elektrony uvolňuje a její oxidační číslo se zvyšuje.
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Oxidace a redukce jsou chemické reakce spojené s výměnou elektronů. Při oxidaci látka elektrony uvolňuje a její oxidační číslo se zvyšuje.
3. Soda a potaš Ing. Miroslav Richter, Ph.D., EUR ING
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE 3. Soda a potaš Ing. Miroslav Richter, Ph.D., EUR ING Výroby sody a potaše Suroviny, Přehled výrobních technologií
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE 3. Soda a potaš Ing. Miroslav Richter, Ph.D., EUR ING Výroby sody a potaše Suroviny, Přehled výrobních technologií
zadání příkladů 10. výsledky příkladů 7. 3,543 litru kyslíku
 zadání Jaký bude objem vodíku při tlaku 105 kpa a teplotě 15 stupňů Celsia, který vznikne reakcí 8 gramů zinku s nadbytkem kyseliny trihydrogenfosforečné? Jaký bude objem vodíku při tlaku 97 kpa a teplotě
zadání Jaký bude objem vodíku při tlaku 105 kpa a teplotě 15 stupňů Celsia, který vznikne reakcí 8 gramů zinku s nadbytkem kyseliny trihydrogenfosforečné? Jaký bude objem vodíku při tlaku 97 kpa a teplotě
ÚPRAVA VODY V ENERGETICE. Ing. Jiří Tomčala
 ÚPRAVA VODY V ENERGETICE Ing. Jiří Tomčala Úvod Voda je v elektrárnách po palivu nejdůležitější surovinou Její množství v provozních systémech elektráren je mnohonásobně větší než množství spotřebovaného
ÚPRAVA VODY V ENERGETICE Ing. Jiří Tomčala Úvod Voda je v elektrárnách po palivu nejdůležitější surovinou Její množství v provozních systémech elektráren je mnohonásobně větší než množství spotřebovaného
CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK
 CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK Význam stechiometrických koeficientů 2 H 2 (g) + O 2 (g) 2 H 2 O(l) Počet reagujících částic 2 molekuly vodíku reagují s 1 molekulou kyslíku za vzniku
CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK Význam stechiometrických koeficientů 2 H 2 (g) + O 2 (g) 2 H 2 O(l) Počet reagujících částic 2 molekuly vodíku reagují s 1 molekulou kyslíku za vzniku
ZŠ ÚnO, Bratří Čapků 1332
 Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace
 Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Denitrifikace. Ochrana ovzduší ZS 2012/2013
 Denitrifikace Ochrana ovzduší ZS 2012/2013 1 Úvod Pojem oxidy dusíku NO NO 2 Další formy NO x Vznik NO x 2 Vlastnosti NO Oxid dusnatý Vlastnosti M mol,no = 30,01 kg/kmol V mol,no,n = 22,41 m 3 /kmol ρ
Denitrifikace Ochrana ovzduší ZS 2012/2013 1 Úvod Pojem oxidy dusíku NO NO 2 Další formy NO x Vznik NO x 2 Vlastnosti NO Oxid dusnatý Vlastnosti M mol,no = 30,01 kg/kmol V mol,no,n = 22,41 m 3 /kmol ρ
Technologie zplyňování biomasy
 Technologie zplyňování biomasy Obsah prezentace Profil společnosti Proces zplyňování Zplyňovací technologie Generátorový plyn Rozdělení technologií Typy zplyňovacích jednotek Čištění plynu Systém GB Gasifired
Technologie zplyňování biomasy Obsah prezentace Profil společnosti Proces zplyňování Zplyňovací technologie Generátorový plyn Rozdělení technologií Typy zplyňovacích jednotek Čištění plynu Systém GB Gasifired
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ
 SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
TERMICKÉ PROCESY PŘI VYUŽITÍ ALTERNATIVNÍCH SUROVIN. Most, 13.6.2013 Autor: Doc. Ing. J.LEDERER, CSc.
 TERMICKÉ PROCESY PŘI VYUŽITÍ ALTERNATIVNÍCH SUROVIN Most, 13.6.2013 Autor: Doc. Ing. J.LEDERER, CSc. OBSAH PRINCIPY POUŽÍVANÝCH TERMOCHEMICKÝCH PROCESŮ VELKOKAPACITNÍ REALIZACE TERMOCHEMICKÝCH PROCESŮ
TERMICKÉ PROCESY PŘI VYUŽITÍ ALTERNATIVNÍCH SUROVIN Most, 13.6.2013 Autor: Doc. Ing. J.LEDERER, CSc. OBSAH PRINCIPY POUŽÍVANÝCH TERMOCHEMICKÝCH PROCESŮ VELKOKAPACITNÍ REALIZACE TERMOCHEMICKÝCH PROCESŮ
Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np:
 PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
Předmět: CHEMIE Ročník: 8. ŠVP Základní škola Brno, Hroznová 1. Výstupy předmětu
 Chemie ukázka chemického skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce práce s dostupnými a běžně používanými látkami (směsmi). Na základě piktogramů žák posoudí nebezpečnost
Chemie ukázka chemického skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce práce s dostupnými a běžně používanými látkami (směsmi). Na základě piktogramů žák posoudí nebezpečnost
SHRNUTÍ A ZÁKLADNÍ POJMY UČEBNICE ZÁKLADY CHEMIE 1
 SHRNUTÍ A ZÁKLADNÍ POJMY UČEBNICE ZÁKLADY CHEMIE 1 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu -
SHRNUTÍ A ZÁKLADNÍ POJMY UČEBNICE ZÁKLADY CHEMIE 1 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu -
Chemie - 1. ročník. očekávané výstupy ŠVP. Žák:
 očekávané výstupy RVP témata / učivo Chemie - 1. ročník Žák: očekávané výstupy ŠVP přesahy, vazby, mezipředmětové vztahy průřezová témata 1.1., 1.2., 1.3., 7.3. 1. Chemie a její význam charakteristika
očekávané výstupy RVP témata / učivo Chemie - 1. ročník Žák: očekávané výstupy ŠVP přesahy, vazby, mezipředmětové vztahy průřezová témata 1.1., 1.2., 1.3., 7.3. 1. Chemie a její význam charakteristika
Technické plyny. kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny)
 Technické plyny kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny) Kapalný vzduch složení vzduchu Před zkapalněním odstranění nežádoucích složek, např. vodní pára, CO 2, prach Zkapalňování
Technické plyny kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny) Kapalný vzduch složení vzduchu Před zkapalněním odstranění nežádoucích složek, např. vodní pára, CO 2, prach Zkapalňování
Linka na úpravu odpadů stabilizace / neutralizace
 CELIO a.s. CZU00168 Linka na úpravu odpadů stabilizace / neutralizace Původce musí doložit výluh č. III. Kód Název odpadu Přijetí 01 03 04 N Hlušina ze zpracování sulfidické rudy obsahující kyseliny nebo
CELIO a.s. CZU00168 Linka na úpravu odpadů stabilizace / neutralizace Původce musí doložit výluh č. III. Kód Název odpadu Přijetí 01 03 04 N Hlušina ze zpracování sulfidické rudy obsahující kyseliny nebo
Název odpadu. 010307 N Jiné odpady z fyzikálního a chemického zpracování rudných nerostů obsahující nebezpečné látky x
 5. Stabilizace CELIO a.s. Název odpadu 010304 N Hlušina ze zpracování sulfidické rudy obsahující kyseliny nebo kyselinotvorné látky x 010305 N Jiná hlušina obsahující nebezpečné látky x 010307 N Jiné odpady
5. Stabilizace CELIO a.s. Název odpadu 010304 N Hlušina ze zpracování sulfidické rudy obsahující kyseliny nebo kyselinotvorné látky x 010305 N Jiná hlušina obsahující nebezpečné látky x 010307 N Jiné odpady
Přírodní zdroje uhlovodíků. a jejich zpracování
 Přírodní zdroje uhlovodíků a jejich zpracování 1 Rozdělení: Přírodní zdroje org. látek fosilní - zemní plyn, ropa, uhlí (vznikají geochemickými procesy miliony let) recentní (současné) - dřevo, rostlinné
Přírodní zdroje uhlovodíků a jejich zpracování 1 Rozdělení: Přírodní zdroje org. látek fosilní - zemní plyn, ropa, uhlí (vznikají geochemickými procesy miliony let) recentní (současné) - dřevo, rostlinné
IV. Chemické rovnice A. Výpočty z chemických rovnic 1
 A. Výpočty z chemických rovnic 1 4. CHEMICKÉ ROVNICE A. Výpočty z chemických rovnic a. Výpočty hmotností reaktantů a produktů b. Výpočty objemů reaktantů a produktů c. Reakce látek o různých koncentracích
A. Výpočty z chemických rovnic 1 4. CHEMICKÉ ROVNICE A. Výpočty z chemických rovnic a. Výpočty hmotností reaktantů a produktů b. Výpočty objemů reaktantů a produktů c. Reakce látek o různých koncentracích
Chemické procesy v ochraně životního prostředí
 Chemické procesy v ochraně životního prostředí 1. Vliv výroby energie na životní prostředí 2. Zpracování výfukových plynů ze spalovacích motorů 3. Zachycování oxidů síry ve spalinách 4. Výroba paliv pro
Chemické procesy v ochraně životního prostředí 1. Vliv výroby energie na životní prostředí 2. Zpracování výfukových plynů ze spalovacích motorů 3. Zachycování oxidů síry ve spalinách 4. Výroba paliv pro
V zařízení budou sbírány nebo vykupovány tyto druhy odpadů kategorie O ostatní : Katalogové Název odpadu
 V zařízení budou sbírány nebo vykupovány tyto druhy odpadů kategorie O ostatní : Katalogové Název odpadu číslo 02 01 10 Kovové odpady 03 01 01 Odpadní kůra a korek 03 01 05 Piliny, hobliny, odřezky, dřevo,
V zařízení budou sbírány nebo vykupovány tyto druhy odpadů kategorie O ostatní : Katalogové Název odpadu číslo 02 01 10 Kovové odpady 03 01 01 Odpadní kůra a korek 03 01 05 Piliny, hobliny, odřezky, dřevo,
Zplyňování a zkapalňování uhlí Doc. Ing. Karel Ciahotný, CSc.
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zplyňování a zkapalňování uhlí Doc. Ing. Karel Ciahotný, CSc. Zplyňování uhlí technologický proces přeměny pevných
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zplyňování a zkapalňování uhlí Doc. Ing. Karel Ciahotný, CSc. Zplyňování uhlí technologický proces přeměny pevných
Název odpadu. 010307 N Jiné odpady z fyzikálního a chemického zpracování rudných nerostů obsahující nebezpečné látky x
 3. S NO CELIO a.s. Název odpadu 010304 N Hlušina ze zpracování sulfidické rudy obsahující kyseliny nebo kyselinotvorné látky x 010305 N Jiná hlušina obsahující nebezpečné látky x 010307 N Jiné odpady z
3. S NO CELIO a.s. Název odpadu 010304 N Hlušina ze zpracování sulfidické rudy obsahující kyseliny nebo kyselinotvorné látky x 010305 N Jiná hlušina obsahující nebezpečné látky x 010307 N Jiné odpady z
Zpracování ropy doc. Ing. Josef Blažek, CSc. 3. přednáška
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 3. přednáška Termické a katalytické krakování a hydrokrakování těžkých
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 3. přednáška Termické a katalytické krakování a hydrokrakování těžkých
Povolené odpady: Číslo Kategorie Název odpadu
 Povolené odpady: Číslo Kategorie 010101 O Odpady z těžby rudných nerostů 010102 O Odpady z těžby nerudných nerostů Název odpadu 010304 N Hlušina ze zpracování sulfidické rudy obsahující kyseliny nebo kyselinotvorné
Povolené odpady: Číslo Kategorie 010101 O Odpady z těžby rudných nerostů 010102 O Odpady z těžby nerudných nerostů Název odpadu 010304 N Hlušina ze zpracování sulfidické rudy obsahující kyseliny nebo kyselinotvorné
Přírodní zdroje uhlovodíků
 Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Říjen 2010 Mgr. Alena Jirčáková Zemní plyn - vznik: Výskyt často spolu s ropou (naftový zemní plyn) nebo
Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Říjen 2010 Mgr. Alena Jirčáková Zemní plyn - vznik: Výskyt často spolu s ropou (naftový zemní plyn) nebo
Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0
 Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
Seznam odpadů sběr, výkup a úprava odpadů, kat. O
 Seznam odpadů sběr, výkup a úprava odpadů, kat. O 01 01 01 Odpady z těžby rudných nerostů 01 01 02 Odpady z těžby nerudných nerostů 01 03 06 Jiná hlušina neuvedená pod čísly 01 03 04 a 01 03 05 01 03 08
Seznam odpadů sběr, výkup a úprava odpadů, kat. O 01 01 01 Odpady z těžby rudných nerostů 01 01 02 Odpady z těžby nerudných nerostů 01 03 06 Jiná hlušina neuvedená pod čísly 01 03 04 a 01 03 05 01 03 08
Nakládání s upotřebenými odpadními oleji
 Nakládání s upotřebenými odpadními oleji 1.11.2012 Ing. Martin Holek, Bc. Lada Rozlílková množství v t 210 000 180 000 150 000 120 000 90 000 60 000 30 000 0 2000 2001 2002 2003 2004 2005 2006 2007 2008
Nakládání s upotřebenými odpadními oleji 1.11.2012 Ing. Martin Holek, Bc. Lada Rozlílková množství v t 210 000 180 000 150 000 120 000 90 000 60 000 30 000 0 2000 2001 2002 2003 2004 2005 2006 2007 2008
Problematika ropných látek
 Problematika ropných látek vlastní ropné látky + aditiva ropných výrobků Forma: volné ropné látky emulze vodný roztok Přímý vliv na člověka (ekzémy i karcinomy) Vliv na životní prostředí vytvoření olejového
Problematika ropných látek vlastní ropné látky + aditiva ropných výrobků Forma: volné ropné látky emulze vodný roztok Přímý vliv na člověka (ekzémy i karcinomy) Vliv na životní prostředí vytvoření olejového
Odstraňování Absorption minoritních nečistot z bioplynu
 www.vscht.cz Ústav plynárenství, koksochemie a ochrany ovzduší Laboruntersuchungen der Karel Ciahotný Gastrocknung e-mail:karel.ciahotny@vscht.cz mit Hilfe von Adsorption und Odstraňování Absorption minoritních
www.vscht.cz Ústav plynárenství, koksochemie a ochrany ovzduší Laboruntersuchungen der Karel Ciahotný Gastrocknung e-mail:karel.ciahotny@vscht.cz mit Hilfe von Adsorption und Odstraňování Absorption minoritních
Zpracování ropy - Pracovní list
 Číslo projektu Název školy Předmět CZ.107/1.5.00/34.0425 INTEGROVANÁ STŘEDNÍ ŠKOLA TECHNICKÁ BENEŠOV Černoleská 1997, 256 01 Benešov BIOLOGIE A EKOLOGIE Tematický okruh Téma Ročník 2. Autor Datum výroby
Číslo projektu Název školy Předmět CZ.107/1.5.00/34.0425 INTEGROVANÁ STŘEDNÍ ŠKOLA TECHNICKÁ BENEŠOV Černoleská 1997, 256 01 Benešov BIOLOGIE A EKOLOGIE Tematický okruh Téma Ročník 2. Autor Datum výroby
CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N VÝROBA MTBE
 CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N409059 VÝROBA MTBE Fyzikální a chemické vlastnosti Suroviny Reakce Technologie Dvoustupňová výroba Jednostupňová výroba Charakteristiky technologií Zdroje
CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N409059 VÝROBA MTBE Fyzikální a chemické vlastnosti Suroviny Reakce Technologie Dvoustupňová výroba Jednostupňová výroba Charakteristiky technologií Zdroje
Inovace bakalářského studijního oboru Aplikovaná chemie CZ.1.07/2.2.00/ Výpočty z chemických vzorců
 Výpočty z chemických vzorců 1. Hmotnost kyslíku je 80 g. Vypočítejte : a) počet atomů kyslíku ( 3,011 10 atomů) b) počet molů kyslíku (2,5 mol) c) počet molekul kyslíku (1,505 10 24 molekul) d) objem (dm
Výpočty z chemických vzorců 1. Hmotnost kyslíku je 80 g. Vypočítejte : a) počet atomů kyslíku ( 3,011 10 atomů) b) počet molů kyslíku (2,5 mol) c) počet molekul kyslíku (1,505 10 24 molekul) d) objem (dm
Třífázové trubkové reaktory se zkrápěným ložem katalyzátoru. Roman Snop
 Třífázové trubkové reaktory se zkrápěným ložem katalyzátoru Roman Snop Charakteristika Zkrápěné reaktory jsou nejvhodněji aplikovatelné na provoz heterogenně katalyzovaných reakcí. Nacházejí uplatnění
Třífázové trubkové reaktory se zkrápěným ložem katalyzátoru Roman Snop Charakteristika Zkrápěné reaktory jsou nejvhodněji aplikovatelné na provoz heterogenně katalyzovaných reakcí. Nacházejí uplatnění
SPALOVÁNÍ A KOTLE. Fosilní paliva a jejich vlastnosti BIOMASA. doc. Ing. Tomáš Dlouhý, CSc. Obnovitelné palivo
 SPALOVÁNÍ A KOTLE doc. Ing. Tomáš Dlouhý, CSc. 1 ENERGIE Energie je extensivní veličina definuje se jako schopnost hmoty konat práci vyskytuje se v nejrůznějších formách Z hlediska jejího využití se často
SPALOVÁNÍ A KOTLE doc. Ing. Tomáš Dlouhý, CSc. 1 ENERGIE Energie je extensivní veličina definuje se jako schopnost hmoty konat práci vyskytuje se v nejrůznějších formách Z hlediska jejího využití se často
Gymnázium Jiřího Ortena, Kutná Hora. Pojmy Metody a formy Poznámky
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie 2. ročník a sexta 2 hodiny týdně Školní tabule, interaktivní tabule, tyčinkové a kalotové modely molekul, zpětný
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie 2. ročník a sexta 2 hodiny týdně Školní tabule, interaktivní tabule, tyčinkové a kalotové modely molekul, zpětný
Kód a ceník odpadů ukládaných na skládce Klenovice Technické služby Tábor s.r.o.
 Kód a ceník odpadů ukládaných na skládce Klenovice Technické služby Tábor s.r.o. Celková cena s DPH = ( ( cena Kč/t + finanční rezerva ) x %DPH ) + základní poplatek obci Identifikační kód: CZC00517 ZÚJ
Kód a ceník odpadů ukládaných na skládce Klenovice Technické služby Tábor s.r.o. Celková cena s DPH = ( ( cena Kč/t + finanční rezerva ) x %DPH ) + základní poplatek obci Identifikační kód: CZC00517 ZÚJ
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115
 Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: Číslo šablony: CZ.1.07/1.5.00/34.0410 III/2 Inovace a zkvalitnění výuky prostřednictvím ICT. Název materiálu: Fosilní zdroje
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: Číslo šablony: CZ.1.07/1.5.00/34.0410 III/2 Inovace a zkvalitnění výuky prostřednictvím ICT. Název materiálu: Fosilní zdroje
BENZIN A MOTOROVÁ NAFTA
 BENZIN A MOTOROVÁ NAFTA BENZIN je směs kapalných uhlovodíků s pěti až jedenácti atomy uhlíku v řetězci (C 5 - C 11 ). Jeho složení je proměnlivé podle druhu a zpracování ropy, ze které pochází. 60-65%
BENZIN A MOTOROVÁ NAFTA BENZIN je směs kapalných uhlovodíků s pěti až jedenácti atomy uhlíku v řetězci (C 5 - C 11 ). Jeho složení je proměnlivé podle druhu a zpracování ropy, ze které pochází. 60-65%
Ročník VIII. Chemie. Období Učivo téma Metody a formy práce- kurzívou. Kompetence Očekávané výstupy. Průřezová témata. Mezipřed.
 Úvod IX. -ukázka chem.skla přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce-práce s dostupnými a běžně používanými látkami, hodnocení jejich rizikovosti, posoudí bezpečnost vybraných
Úvod IX. -ukázka chem.skla přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce-práce s dostupnými a běžně používanými látkami, hodnocení jejich rizikovosti, posoudí bezpečnost vybraných
Chemie. Mgr. Petra Drápelová Mgr. Jaroslava Vrbková. Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou
 Chemie Mgr. Petra Drápelová Mgr. Jaroslava Vrbková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH ROVNIC VY_32_INOVACE_03_3_18_CH Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH
Chemie Mgr. Petra Drápelová Mgr. Jaroslava Vrbková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH ROVNIC VY_32_INOVACE_03_3_18_CH Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH
tvorbou anionu tato schopnost je menší než u kyslíku
 Chalkogeny Elektronová konfigurace:. => valenčních elektronů => maximální oxidační číslo je Odlišnost vlastností O 2 a ostatních prvků způsobeny: vysokou elektronegativitou O neschopností O tvořit excitované
Chalkogeny Elektronová konfigurace:. => valenčních elektronů => maximální oxidační číslo je Odlišnost vlastností O 2 a ostatních prvků způsobeny: vysokou elektronegativitou O neschopností O tvořit excitované
Úlohy: 1) Vypočítejte tepelné zabarvení dané reakce z následujících dat: C 2 H 4(g) + H 2(g) C 2 H 6(g)
 Úlohy: 1) Vypočítejte tepelné zabarvení dané reakce z následujících dat: C 2 H 4(g) + H 2(g) C 2 H 6(g) C 2 H 4(g) + 3O 2(g ) 2CO 2(g) +2H 2 O (l) H 0 298,15 = -1410,9kJ.mol -1 2C 2 H 6(g) + 7O 2(g) 4CO
Úlohy: 1) Vypočítejte tepelné zabarvení dané reakce z následujících dat: C 2 H 4(g) + H 2(g) C 2 H 6(g) C 2 H 4(g) + 3O 2(g ) 2CO 2(g) +2H 2 O (l) H 0 298,15 = -1410,9kJ.mol -1 2C 2 H 6(g) + 7O 2(g) 4CO
6.Úprava a čistění vod pro průmyslové a speciální účely
 6.Úprava a čistění vod pro průmyslové a speciální účely Ivan Holoubek Zdeněk Horsák RECETOX, Masaryk University, Brno, CR holoubek@recetox.muni.cz; http://recetox.muni.cz Inovace tohoto předmětu je spolufinancována
6.Úprava a čistění vod pro průmyslové a speciální účely Ivan Holoubek Zdeněk Horsák RECETOX, Masaryk University, Brno, CR holoubek@recetox.muni.cz; http://recetox.muni.cz Inovace tohoto předmětu je spolufinancována
SPALOVÁNÍ A KOTLE. Fosilní paliva a jejich vlastnosti. Přírodní a umělá paliva BIOMASA. Doc. Ing. Tomáš Dlouhý, CSc.
 SPALOVÁNÍ A KOTLE Doc. Ing. Tomáš Dlouhý, CSc. 1 ENERGIE Energie je extensivní veličina definuje se jako schopnost hmoty konat práci vyskytuje se v nejrůznějších formách Z hlediska jejího využití se často
SPALOVÁNÍ A KOTLE Doc. Ing. Tomáš Dlouhý, CSc. 1 ENERGIE Energie je extensivní veličina definuje se jako schopnost hmoty konat práci vyskytuje se v nejrůznějších formách Z hlediska jejího využití se často
CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N REAKTIVNÍ EXTRAKCE
 CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N409059 Obecné principy Procesní aspekty Chemismus Činidla Zařízení Příklady použití Výroba uranu Výroba kobaltu Zdroje informací Obecné principy Většina průmyslových
CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N409059 Obecné principy Procesní aspekty Chemismus Činidla Zařízení Příklady použití Výroba uranu Výroba kobaltu Zdroje informací Obecné principy Většina průmyslových
REVIZE PODÍLŮ PM 10 A PM 2,5 PRO POTŘEBY ROZPTYLOVÝCH STUDIÍ. Ing. Miloslav Modlík, Ing. Helena Hnilicová Oddělení emisí a zdrojů, ČHMÚ
 REVIZE PODÍLŮ PM 10 A PM 2,5 PRO POTŘEBY ROZPTYLOVÝCH STUDIÍ Ing. Miloslav Modlík, Ing. Helena Hnilicová Oddělení emisí a zdrojů, ČHMÚ Přehled 1. Úvod 2. Současný stav 3. Odůvodnění změn 4. Přehled podílů
REVIZE PODÍLŮ PM 10 A PM 2,5 PRO POTŘEBY ROZPTYLOVÝCH STUDIÍ Ing. Miloslav Modlík, Ing. Helena Hnilicová Oddělení emisí a zdrojů, ČHMÚ Přehled 1. Úvod 2. Současný stav 3. Odůvodnění změn 4. Přehled podílů
DEZA, a.s. Studijní materiál k předmětu Chemická exkurze C6950 Brno 2011
 Studijní materiál k předmětu Chemická exkurze C6950 Brno 2011 DEZA, a.s. Vypracovala: Bc. et Bc. Monika Janoušková Úpravy: Mgr. Zuzana Garguláková, doc. Ing. Vladimír Šindelář, Ph.D. Obecné informace DEZA,
Studijní materiál k předmětu Chemická exkurze C6950 Brno 2011 DEZA, a.s. Vypracovala: Bc. et Bc. Monika Janoušková Úpravy: Mgr. Zuzana Garguláková, doc. Ing. Vladimír Šindelář, Ph.D. Obecné informace DEZA,
C1200 Úvod do studia biochemie 4.2 Velké cykly prvků. OpVK CZ.1.07/2.2.00/
 C1200 Úvod do studia biochemie 4.2 Velké cykly prvků OpVK CZ.1.07/2.2.00/15.0233 Petr Zbořil Biochemické cykly prvků Velké cykly prvků jako zobecnění přeměn látek při popisu jejich koloběhu Země jako superorganismus
C1200 Úvod do studia biochemie 4.2 Velké cykly prvků OpVK CZ.1.07/2.2.00/15.0233 Petr Zbořil Biochemické cykly prvků Velké cykly prvků jako zobecnění přeměn látek při popisu jejich koloběhu Země jako superorganismus
Biologické odsiřování bioplynu. Ing. Dana Pokorná, CSc.
 Biologické odsiřování bioplynu Ing. Dana Pokorná, CSc. Sulfan problematická složka bioplynu Odkud se sulfan v bioplynu bere? Organická síra proteiny s inkorporovanou sírou Odpady a odpadní vody z průmyslu
Biologické odsiřování bioplynu Ing. Dana Pokorná, CSc. Sulfan problematická složka bioplynu Odkud se sulfan v bioplynu bere? Organická síra proteiny s inkorporovanou sírou Odpady a odpadní vody z průmyslu
H H C C C C C C H CH 3 H C C H H H H H H
 Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
PRŮMYSLOVÉ PROCESY. Přenos tepla II Odparky a krystalizátory
 PRŮMYSLOVÉ PROCESY Přenos tepla II Odparky a krystalizátory Prof. Ing. Tomáš Jirout, Ph.D. (e-mail: Tomas.Jirout@fs.cvut.cz, tel.: 2 2435 2681) Poděkování: Při přípravě prezentace byly použity a převzaty
PRŮMYSLOVÉ PROCESY Přenos tepla II Odparky a krystalizátory Prof. Ing. Tomáš Jirout, Ph.D. (e-mail: Tomas.Jirout@fs.cvut.cz, tel.: 2 2435 2681) Poděkování: Při přípravě prezentace byly použity a převzaty
SOLI A JEJICH VYUŽITÍ. Soli bezkyslíkatých kyselin Soli kyslíkatých kyselin Hydrogensoli Hydráty solí
 SOLI A JEJICH VYUŽITÍ Soli bezkyslíkatých kyselin Soli kyslíkatých kyselin Hydrogensoli Hydráty solí POUŽITÍ SOLÍ Zemědělství dusičnany, draselné soli, fosforečnany. Stavebnictví, sochařství vápenaté soli.
SOLI A JEJICH VYUŽITÍ Soli bezkyslíkatých kyselin Soli kyslíkatých kyselin Hydrogensoli Hydráty solí POUŽITÍ SOLÍ Zemědělství dusičnany, draselné soli, fosforečnany. Stavebnictví, sochařství vápenaté soli.
KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení. Ing. Miroslav Richter, PhD.
 KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení Ing. Miroslav Richter, PhD., EUR ING 2014 Materiálové bilance 3.5.1 Do tkaninového filtru vstupuje 10000
KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení Ing. Miroslav Richter, PhD., EUR ING 2014 Materiálové bilance 3.5.1 Do tkaninového filtru vstupuje 10000
ZŠ ÚnO, Bratří Čapků 1332
 Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 2 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 2 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Tvorba škodlivin při spalování
 Tvorba škodlivin při spalování - Při spalování dochází ke vzniku řady škodlivin - Je třeba spalovací proces vést tak, aby se minimalizoval vznik škodlivin (byly dodrženy emisní limity) - Emisní limity
Tvorba škodlivin při spalování - Při spalování dochází ke vzniku řady škodlivin - Je třeba spalovací proces vést tak, aby se minimalizoval vznik škodlivin (byly dodrženy emisní limity) - Emisní limity
Vodík jako alternativní ekologické palivo. palivové články a vodíkové hospodářství
 Vodík jako alternativní ekologické palivo palivové články a vodíkové hospodářství Charakteristika vodíku vodík je nejrozšířenějším prvkem ve vesmíru na Zemi je třetím nejrozšířenějším prvkem po kyslíku
Vodík jako alternativní ekologické palivo palivové články a vodíkové hospodářství Charakteristika vodíku vodík je nejrozšířenějším prvkem ve vesmíru na Zemi je třetím nejrozšířenějším prvkem po kyslíku
POROVNÁNÍ EMISNÍCH LIMITŮ A NAMĚŘENÝCH KONCENTRACÍ S ÚROVNĚMI EMISÍ SPOJENÝMI S BAT PRO VÝROBU CEMENTU A VÁPNA (COR 1)
 Ministerstvo životního prostředí Sekce technické ochrany životního prostředí Odbor posuzování vlivů na životní prostředí a integrované prevence Čj. 6285/ENV/15 *MIZPP00FESP3* MIZPP00FESP3 Datum 30.01.2015
Ministerstvo životního prostředí Sekce technické ochrany životního prostředí Odbor posuzování vlivů na životní prostředí a integrované prevence Čj. 6285/ENV/15 *MIZPP00FESP3* MIZPP00FESP3 Datum 30.01.2015
Vyjádření. k žádosti o vydání změny integrovaného povolení PRECHEZA a.s. CENIA, česká informační agentura životního prostředí
 Vyjádření k žádosti o vydání změny integrovaného povolení PRECHEZA a.s. CENIA, česká informační agentura životního prostředí Litevská 8/1174, 100 05 Praha 10 tel.: +420 267 225 232 fax: + 420 271 724 306
Vyjádření k žádosti o vydání změny integrovaného povolení PRECHEZA a.s. CENIA, česká informační agentura životního prostředí Litevská 8/1174, 100 05 Praha 10 tel.: +420 267 225 232 fax: + 420 271 724 306
VI.A SKUPINA PS VY_32_INOVACE.MERKOVA.ANCHEM.03
 VI.A SKUPINA PS VY_3_INOVACE.MERKOVA.ANCHEM.03 Obecná charakteristika VI.A skupina PS zahrnuje prvky O,S,Se,Te,Po (ó slečno, sejměte též podkolenky) Mají 6 valenčních elektronů, z nichž 4 se nacházejí
VI.A SKUPINA PS VY_3_INOVACE.MERKOVA.ANCHEM.03 Obecná charakteristika VI.A skupina PS zahrnuje prvky O,S,Se,Te,Po (ó slečno, sejměte též podkolenky) Mají 6 valenčních elektronů, z nichž 4 se nacházejí
