Biologická terapie systémového lupus erythematodes zaměřeno na belimumab
|
|
|
- Daniel Beránek
- před 8 lety
- Počet zobrazení:
Transkript
1 Biologická terapie systémového lupus erythematodes zaměřeno na belimumab MUDr. Jan Vachek 1 ; MUDr. Hana Ciferská, Ph.D. 2 ; prof. MUDr. Vladimír Tesař, DrSc. 1 1 Klinika nefrologie VFN v Praze a 1. LF UK, 2 Revmatologický ústav a Revmatologická klinika, 1. LF UK, Praha Souhrn Vachek J, Ciferská H, Tesař V.. Remedia 2014; 24: Belimumab je prvním biologickým lékem schváleným v USA, Kanadě a Evropě k terapii systémového lupus erythematodes (SLE) a prvním novým léčivem v této indikaci po více než padesáti letech. Jde o plně humánní rekombinantní IgG1λ monoklonální protilátku blokující vazbu solubilního BLyS (stimulátor B-lymfocytů, soluble B lymphocyte stimulator) na B-lymfocyty. V současnosti je belimumab schválen Evropskou lékovou agenturou (EMA) v indikaci přídatné léčby dospělých pacientů se SLE s pozitivními autoprotilátkami s vysokým stupněm aktivity choroby bez přítomnosti aktivního postižení ledvin či centrálního nervového systému. Aktuálně probíhají další studie i u pacientů s aktivní lupusovou nefritidou a u dalších autoimunitních onemocnění (Sjögrenův syndrom, ANCA asociované vaskulitidy) a dalších stavů. Klíčová slova: belimumab biologická terapie systémový lupus erythematodes BLyS BAFF. Summary Vachek J, Ciferska H, Tesar V. Biological therapy of systemic lupus erythematosus focused on belimumab. Remedia 2014; 24: Belimumab is the first biological drug approved in the U.S., Canada and Europe for the treatment of systemic lupus erythematosus (SLE) and the first new drug for this indication after more than fifty years. It is a fully human recombinant IgG1λ monoclonal antibody, which inhibits the binding of soluble form of BLyS (soluble B lymphocyte stimulator) to B-lymphocytes. Currently, belimumab is approved by the European Medicines Agency (EMA) for the indication of adjunctive treatment of adult patients with SLE with positive autoantibodies with high disease activity without the presence of active renal disease or damage to the central nervous system. Currently, further studies are underway in patients with active lupus nephritis and other autoimmune diseases (Sjögren s syndrome, ANCA associated vasculitis) and other conditions. Key words: belimumab biological therapy systemic lupus erythematosus BlyS BAFF. Úvod Systémový lupus erythematodes (SLE) je autoimunitní systémové onemocnění často se projevující postižením více orgánových systémů (kůže, klouby, kardiovaskulární systém, ledviny, centrální i periferní nervový systém, plíce a další), které je doprovázeno výraznými abnormalitami imunitního systému. Jde o vzácné onemocnění, které postihuje častěji ženy; poměr dospělých žen a mužů se SLE je 9 : 1 [1]. Patogenetických mechanismů vzniku SLE je studováno mnoho, jedním z nich je porucha interakce mezi T-lymfocyty a B-lymfocyty ve smyslu mj. defektní apoptózy, přežívání autoreaktivních klonů, nadprodukce autoprotilátek, poruchy signálních molekul a jejich receptorů. B-lymfocyty představují základní buňky protilátkové imunity, podílejí se na tvorbě autoprotilátek a regulaci imunitní odpovědi. Prostřednictvím prezentace antigenu a kostimulačních molekul indukují aktivaci a diferenciaci T-lymfocytů. Zcela novým terapeutickým přístupem v terapii SLE je blokáda vazby solubilního BLyS (stimulátor B-lymfocytů, soluble B lymphocyte stimulator), označovaného rovněž zkratkou BAFF (B-lymfocyty aktivující faktor, B-cell activating factor), na B-lymfocyty (obr. 1) [2]. BLyS patří mezi cytokiny řazené do rodiny TNF (tumor necrosis factor) a je exprimován na povrchu buněk B-buněčné linie, působí jako jejich silný aktivátor. Hraje také zásadní roli při B-buněčné proliferaci a diferenciaci [3]. U pacientů se SLE byly popsány jeho zvýšené hladiny spolu s akcentovanou buněčnou expresí. Přestože však byl prokázán vztah mezi hladinami BLyS a aktivitou SLE, není dosud role BLyS v patogenezi SLE zcela jasná [4]. BLyS je za účasti dalších zánětlivých cytokinů (IL-2, IFNγ, TNFα) štěpen na solubilní proteinovou část. Na povrchu B-lymfocytů je BLyS vázán třemi buněčnými receptory označovanými jako BLyS receptor 3 (BR3), transmembránový aktivátor s modulátorem vápníku a cyklofilin ligand interaktor (TACI, transmembrane activactor and calcium modulator and cyclophilin ligand interactor) a antigen maturace B-lymfocytů (BCMA, B-cell maturation antigen), z nichž nejsilnější vazbu má receptor BR3 [5, 6]. Blokáda této vazby vede k apoptóze a inhibici maturace B-lymfocytů. Po podání belimumabu dochází k selektivní supresi CD20 pozitivních B-lymfocytů a plazmatických buněk s krátkým poločasem [2, 5]. Farmakokinetika a farmakodynamika Belimumab je rekombinantní lidský imunoglobulin IgG1λ o molekulární hmotnosti 147 kda, který vytváří komplexy se solubilní formou BLyS a inhibicí její vazby na buněčné receptory vede k supresi, snížení diferenciace, aktivace a přežívání B-lymfocytů. Belimumab se neváže na B-lymfocyty přímo, ale prostřednictvím vazby na BLyS. U pacientů se SLE léčených belimumabem byly v klinických studiích zjištěny výrazně snížené hladiny cirkulujících C19+, CD20+ aktivovaných B-lymfocytů [2, 7]. Při dlouhodobém klinickém sledování byly statisticky významně snížené hladiny B-lymfocytů v 52. týdnu léčby (p = 0,008). Studie prokázaly, že belimumab ovlivňuje nejdříve pokles počtu nově aktivovaných B-lymfocytů (ve 12. až 14. týdnu, p < 0,05) a až poté pokles počtu plazmatických a paměťových buněk (v 76. týdnu; p < 0,01 a p < 0,05) [7]. Belimumab v intravenózní dávce 10 mg/kg dosahoval maximálních sérových koncentrací (rozmezí: μg/ml) krátce po ukončení aplikace. Sérová koncentrace belimumabu klesala bioexponenciálně s distribučním poločasem 42 hodin a s terminálním poločasem 19,4 dne. Clearance se pohybovala v rozmezí ml/den. Celkový distribuční objem belimumabu činil 5,29 litru. Přesná cesta eliminace belimumabu není plně objasněna [8, 9]. Bezpečnost a interakce Bezpečnost belimumabu se neliší od bezpečnosti biologických přípravků ovlivňujících B-lymfocyty. Klinické studie fáze II a III přinesly při sledování nežádoucích účinků belimumabu poměrně příznivé výsledky [2, 7]. U celkem 2133 pacientů se SLE sledovaných ve studiích fáze II a III byl hlášen výskyt nežádoucích účinků jakékoli závažnosti. Nežádoucí příhody byly zaznamenány u 93 % pacientů ze skupiny, která dostávala placebo, a u 92 % pacientů ze skupiny léčené belimumabem. 208
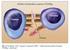
2 1. 3. BLyS BR3 TACI BLyS B-lymfocyt Obr. 1 Schematické znázornění mechanismu účinku belimumabu. Nejčastěji byly hlášeny: nevolnost (15 %), průjem (12 %), pyretická reakce (10 %), nazofaryngitida (9 %), bronchitida (9 %), nespavost (7 %), deprese (5 %), bolesti hlavy (5 %), cystitida (4 %), leukopenie (4 %) a virová gastroenteritida (3 %). V průběhu klinických sledování hodnotících účinnost a bezpečnost belimumabu u SLE bylo zaznamenáno celkem 10 případů malignit, z toho 5 nádorů solidních orgánů (dva nádory prsu, jeden nádor žaludku, jeden nádor děložního čípku a jeden nádor ovaria) a 5 nemelanomových nádorů kůže. Hematologické malignity ve sledované skupině zaznamenány nebyly. V průběhu sledování bylo dokumentováno celkem 15 úmrtí. Tři úmrtí byla zaznamenána v placebové skupině ve studii BLISS-52 v důsledku infekčních komplikací a kardiovaskulární příhody, jedno úmrtí nastalo z neobjasněné příčiny. Ve skupině pacientů léčených belimumabem v dávce 1 mg/kg bylo celkem šest úmrtí (maligní tumor, iktus, suicidium, infekce, komplikace základní choroby, z neobjasněné příčiny) a ve skupině léčené dávkou 10 mg belimumabu/kg bylo také šest úmrtí (komplikace choroby, celkem třikrát infekční komplikace, suicidium, kardiovaskulární komplikace) [7, 10, 11]. 2. BCMA 1. Prezentace antigenu na periferii a aktivace monocytů vede k uvolnění BlyS. 2. BLyS je za účasti dalších zánětlivých cytokinů (IL-2, IFNγ, TNFα) štěpen na solubilní proteinovou část. 3. Na povrchu B-lymfocytů je solubilní BLyS vázán třemi druhy buněčných receptorů: BR3, TACI a BCMA, z nichž nejsilnější vazbu má receptor BR3. BLyS působí jako silný aktivátor B-lymfocytů. Zvýšené hladiny BLyS přispívají k abnormálnímu vývoji B-lymfocytů. 4. Belimumab vytváří komplexy se solubilní formou BLyS. 5. Inhibicí vazby BLyS na buněčné receptory vede k supresi, snížení diferenciace, aktivace a přežívání B-lymfocytů. Belimumab inhibuje přežití B-lymfocytů, včetně autoreaktivních B-lymfocytů, a snižuje diferenciaci B-lymfocytů na plazmatické buňky produkující imunoglobuliny. BLyS stimulátor B-lymfocytů, soluble B lymphocyte stimulator; BR3 BLyS receptor 3; TACI transmembránový aktivátor s modulátorem vápníku a cyklofilin ligand interaktor, transmembrane activactor and calcium modulator and cyclophilin ligand interactor; BCMA antigen maturace B-lymfocytů, B-cell maturation antigen V klinických studiích u pacientů se SLE nebyly prokázány interakce či změny farmakokinetických vlastností chronicky podávaných léčiv (antimalarika, glukokortikoidy, azathioprin, methotrexát, mykofenolát mofetil, inhibitory ACE, nesteroidní antiflogistika a statiny). Výrobce nedoporučuje kombinaci belimumabu s dalšími léky biologické povahy, jejichž cílem jsou B-lymfocyty (anti- -CD20 rituximab) kvůli zvýšení nárůstu rizika závažných infekcí. Ze stejného důvodu není doporučována ani konkomitantní terapie cyklofosfamidem. Nevhodná je vakcinace živými vakcínami při probíhající léčbě belimumabem, vzhledem k typu probíhající imunosuprese [7, 8, 11]. Indikace a dávkování Americký úřad FDA (U.S. Food and Drug Administration) schválil 9. března 2011 belimumab k terapii SLE. V návaznosti na toto schválení proběhla úspěšná registrace i v České republice, v jednání je dosud úhrada belimumabu. Česká revmatologická společnost (ČRS) vypracovala indikační kritéria podávání belimumabu vycházející z doporučení FDA [12]. 4. belimumab 5. Podávání belimumabu není zatím indikováno a není obecně doporučováno u pacientů se SLE s těmito orgánovými projevy: aktivní neurolupus s postižením centrálního nervového systému, aktivní lupusová nefritida III., IV. a V. typu vyžadující razantní imunosupresi dle protokolu, přítomnost proteinurie s hodnotou vyšší než 6 g/24 h a elevace hladin kreatininu nad 220 μmol/l. Lupusová nefritida per se však nepředstavuje kontraindikaci léčby belimumabem, kontraindikací je jen aktivní lupusová nefritida. Pacient s lupusovou nefritidou s normální renální funkcí a non-nefrotickou proteinurií může být pro extrarenální indikace belimumabem léčen. U pacientů, kteří trpí hypogamaglobulinemií s hodnotami imunoglobulinu G nižšími než 400 mg/dl (IgG < 400 mg/dl) nebo deficiencí IgA (IgA < 10 mg/dl), se belimumab nedoporučuje podávat. Vylučujícím kritériem pro terapii je přítomnost hepatitidy B a C, pozitivita HIV či závažná probíhající infekce. Rovněž jsou vyloučeni pacienti se známou alergií na složky podávaného léčiva [13]. Belimumab je indikován u pacientů se SLE s klinickou i humorální aktivitou bez přítomnosti vylučovacích kritérií. Musí být přítomna pozitivita antinukleárních protilátek (ANA) a/nebo anti-dsdna protilátek a snížení hladin komplementu. Aktivita choroby hodnocená skórovacím systémem SELENA-SLEDAI (SELENA, Safety of Estrogens in Lupus Erythematosus National Assessment; SLEDAI, Systemic Lupus Erythematosus Disease Activity Index) musí mít hodnotu vyjádřenou jako 6 nebo více. Pokud po šesti měsících léčby belimumabem nedojde ke klinickému ani laboratornímu zlepšení hodnocenému pomocí skóre SELENA- -SLEDAI 4bodové snížení SELENA-SLEDAI skóre nebo dojde k nárůstu skóre, jsou tito pacienti považováni za non-respondéry a terapie belimumabem by měla být ukončena [8, 11 13]. Terapie belimumabem je u pacientů se SLE zahajována indukční dávkou 10 mg/kg podávanou ve dnech 0, 14 a 28, která je následována udržovací terapií, kdy je infuze podávána ve 4týdenních intervalech. Před podáním infuze belimumabu se doporučuje podat antihistaminikum s antipyretikem k minimalizaci poinfuzních reakcí [13]. Klinické studie Bezpečnost a účinnost léčby belimumabem byla prokázána v klinických studiích fáze I a II a ve dvou studiích fáze III trvajících 52 a 76 týdnů. Nyní jsou k dispozici i data ze sedmiletého sledování hodnotícího dlouhodobou účinnost a bezpečnostní profil belimumabu. Klinické studie fáze I Primárním cílem randomizované, multicentrické a dvojitě slepé studie fáze I (LBSL01) bylo stanovení bezpečnosti a snášenlivosti léčby belimumabem pacienty se SLE. Do studie bylo zařazeno celkem 70 pacientů se SLE 209
3 splňujících podmínky určené studijním protokolem (stabilní klinická aktivita a léčba SLE, absence podávání cyklofosfamidu, nepřítomnost aktivní lupusové nefritidy a postižení centrálního nervového systému, nepřítomnost závažných infekcí). Pacienti byli randomizováni do skupin léčených belimumabem (57 pacientů) a placebové skupiny (13 pacientů). Belimumab byl podáván v dávkách 1 mg/kg, 4 mg/kg, 10 mg/kg a 20 mg/kg v jedné nebo dvou aplikacích ve dni 0 a následně 21. den. Léčba byla dobře tolerována a incidence nežádoucích příhod se proti placebové skupině nelišila. Byl dokumentován statisticky signifikantně významný pokles počtu CD20+ B-lymfocytů u pacientů po jedné dávce belimumabu proti placebu (den 42, p = 0,0042; den 84, p = 0,0036), následně po dvou dávkách (den 105, p = 0,0305). Ovlivnění aktivity SLE belimumabem nebylo prokázáno, nicméně data získaná touto studií poskytla cenné údaje pro další fáze klinického zkoušení II a III [2, 7]. Studie fáze II Randomizovaná, multicentrická a dvojitě slepá studie fáze II (LBL02) vyhodnocovala snášenlivost a účinnost belimumabu u pacientů s aktivním a středně aktivním SLE bez přítomnosti závažných orgánových manifestací (ledviny, centrální nervový systém). Ve studii bylo celkem 449 pacientů randomizovaně rozděleno do skupin dle podávané dávky belimumabu (1 mg/kg, 4 mg/kg a 10 mg/kg) a do placebové skupiny. K hodnocení odpovědi na terapii byl použit skórovací systém SELENA-SLEDAI a skupina pacientů léčených belimumabem vykazovala 19,5% zlepšení proti původním hodnotám. Medián doby do vypuknutí prvního vzplanutí nemoci (tzv. flare) byl 83 dní u pacientů léčených belimumabem, ale 67 dní ve skupině pacientů dostávajících placebo. Pacienti léčení belimumabem měli statisticky signifikantně nižší výskyt vypuknutí flare v průběhu 24. až 52. týdne (154 dní vs. 108 dní, p = 0,0361). Pokles počtu CD20+ společně s poklesem hladiny anti-dsdna protilátek byl statisticky signifikantní ve skupině s belimumabem proti placebu v týdnu 52. Mezi skupinami pacientů se výskyt nežádoucích příhod nelišil. Studie LBL02 nedosáhla svého primárního cíle, nebyla prokázána výrazně vyšší efektivita belimumabu proti placebu. Předpokládanou příčinou bylo malé omezení konkomitantní terapie a nevhodné nastavení primárních cílů, které mělo rozlišovat více mezi skupinou léčenou belimumabem a placebovou skupinou. Nicméně výsledky LBL02 umožnily plynulý přechod ke studiím fáze III [14]. Studie fáze III BLISS-52 a BLISS-76 (obr. 2) byly studie fáze III určené pro dospělé pacienty s aktivním SLE s protilátkovou aktivitou se stabilní imunosupresivní terapií (skóre 6 dle SELENA-SLEDAI, se sérologickou pozitivitou antinukleárních protilátek ANA v titru 1 : 80 a s pozitivitou anti-dsdna protilátek 30 IU/ml). Do studie nebyli zařazeni pacienti se závažnými orgánovými komplikacemi (aktivní lupusová nefritida, postižení CNS) a s předchozí terapií léky ovlivňujícími B-lymfocyty (rituximab) či s terapií cyklofosfamidem v posledních šesti měsících, pacienti léčení intravenózními imunoglobuliny nebo vysokými dávkami steroidů (> 100 mg/den) v posledních třech měsících. Obě studie fáze III porovnávaly účinnost a bezpečnost belimumabu podávaného intravenózně v dávkách 1 mg/kg a 10 mg/kg, a to ve dnech 0, 14 a 28, dále pak každých 28 dní (podávání ve studii BLISS-52 bylo ukončeno ve 48. týdnu, ve studii BLISS-76 v 72. týdnu) ve srovnání s placebem. Primárním cílem obou studií bylo zhodnocení tzv. SLE responder indexu (SRI) na začátku, v průběhu a na konci klinického sledování, dále porovnání výsledků skóre SELENA-SLEDAI a monitorace prostřednictvím skóre BILAG (British Isles Lupus Assessment Group), zaměřeného na výskyt nových či zhoršení stávajících manifestací SLE [15, 16]. Studie BLISS-52 Studie BLISS-52 zahrnovala celkem 865 pacientů rozdělených do skupin podle dávky belimumabu (1 mg/kg, n = 288 pacientů; 10 mg/kg, n = 290 pacientů) a do placebové skupiny (n = 287 pacientů). Rozdíl v počtu pacientů, kteří ukončili studii kvůli neefektivitě belimumabu oproti placebu, nebyl statisticky signifikantní (4,17 % při podávání dávky 1 mg/kg, 4,14 % při podávání dávky 10 mg/kg vs. 5,57 % při podávání placeba). Terapeutická odpověď hodnocená indexem SRI v týdnech 28 a 52 byla statisticky signifikantně vyšší ve skupinách léčených belimumabem než v placebové skupině (p < 0,05). Rovněž u skupiny pacientů léčených belimumabem bylo pomocí skórovacího indexu SELENA-SLEDAI zaznamenáno zlepšení hodnocené jako pokles o více než 4 body v týdnu 52 proti placebu. Flare se objevil u 70 % pacientů ve skupině léčené belimumabem v dávce 1 mg/kg (p = 0,0026) a u 71 % pacientů ve skupině léčené dávkou 10 mg/kg (p = 0,0036) proti 80% výskytu Charakteristika souboru pacientů aktivní SLE skóre SELENA-SLEDAI 6 sérologická pozitivita (ANA v titru 1 : 80 a/nebo anti-dsdna 30 IU/ml) stabilní imunosupresivní terapie alespoň 30 dnů před zahájením podávání belimumabu vylučovací kritéria: lupusová nefritida, postižení CNS, předchozí terapie léky ovlivňujícími B-lymfocyty (rituximab), terapie cyklofosfamidem v posledních šesti měsících, podávání i.v. imunoglobulinů, podávání vysokých dávek kortikoidů ( 100 mg/den) v posledních třech měsících Cíl zhodnocení SLE responder indexu (SRI) na začátku, v průběhu a na konci klinického sledování porovnání výsledků skóre SELENA-SLEDAI a monitorace prostřednictvím skóre BILAG Studie BLISS pacientů 18 let studie probíhala od května 2007 do března 2010 dávkování: i.v. infuze v den 0, 14, 28, a dále každých 28 dní až do 48. týdne celkem podáváno 52 týdnů Studie BLISS pacientů 18 let studie probíhala od února 2007 do března 2010 dávkování: i.v. infuze v den 0, 14, 28, a dále každých 28 dní až do 72. týdne celkem podáváno 76 týdnů n = 288 belimumab 1 mg/kg n = 290 belimumab 10 mg/kg n = 287 placebo n = 271 belimumab 1 mg/kg n = 273 belimumab 10 mg/kg n = 275 placebo Obr. 2 Přehled ukončených klinických studií fáze III s belimumabem. SLE systémový lupus erythematodes; SELENA-SLEDAI (SELENA, Safety of Estrogens in Lupus Erythematosus National Assessment; SLEDAI, Systemic Lupus Erythematosus Disease Activity Index); ANA antinukleární protilátky; skóre BILAG British Isles Lupus Assessment Group, skóre zaměřené na výskyt nových či zhoršení stávajících manifestací SLE 210
4 u pacientů ve skupině s placebem. Průměrná doba do výskytu prvního flare byla při léčbě belimumabem 126 dní (dávka 1 mg/kg) a 119 dní (dávka 10 mg/kg), zatímco ve skupině placeba byla průměrná doba jen 84 dní. V laboratorním hodnocení byl zaznamenán statisticky významný pokles hladiny anti-dsdna protilátek až jejich vymizení u pacientů léčených belimumabem proti placebu (p < 0,02). Byla zjištěna normalizace hladin komplementu 4 (C4) při terapii belimumabem proti placebu (p < 0,03) a statisticky signifikantní zvýšení hladin C3 bylo zjištěno jen ve skupině pacientů léčených dávkou 10 mg/kg proti placebu (p = 0,0005). Dobrá terapeutická odpověď ve skupině s belimumabem umožnila částečnou detrakci steroidní terapie. Belimumab se zdál účinnější než placebo při zhodnocení skórovacích indexů aktivity a laboratorních parametrů v 52. týdnu léčby. Rozdíly v účinnosti dle dávky belimumabu nebyly statisticky signifikantní. Výskyt nežádoucích příhod byl obdobný ve skupinách léčených belimumabem v dávkách 1 mg/kg a 10 mg/kg a v placebové skupině. Byly pozorovány závažné infekce v jednotlivých skupinách u 22, 13 a 17 pacientů. Hypersenzitivní reakce na podání infuze byly stejné v obou skupinách s belimumabem, v každé z nich u dvou pacientů [15, 16]. Studie BLISS-76 Studie BLISS-76 zahrnovala celkem 819 pacientů rozdělených do skupin podle podávané dávky belimumabu (1 mg/kg, n = 271 pacientů; 10 mg/kg, n = 273 pacientů) a do placebové skupiny (n = 275 pacientů). Rozdíl v počtu pacientů, kteří ukončili studii z důvodu neefektivity belimumabu vůči placebu, nebyl statisticky signifikantní (4,43 % při podávání dávky 1 mg/kg, 6,23 % při dávkování 10 mg/kg belimumabu vs. 7,27 % při podávání placeba). Terapeutická odpověď hodnocená indexem SRI v týdnu 52 a 76 byla vyšší ve skupinách léčených belimumabem než v placebové skupině, nicméně rozdíl nebyl statisticky signifikantně významný. Skupina pacientů léčených belimumabem prokázala i pomocí skórovacího indexu SELENA-SLEDAI zlepšení hodnocené jako pokles o více než 4 body v týdnu 52 proti placebu, ale výsledek nebyl statisticky signifikantní. Při hodnocení v 76. týdnu byl nalezen statisticky signifikantní rozdíl mezi skupinou dostávající belimumab v dávce 1 mg/kg a placebovou skupinou (42,1 % vs. 33,8 %, p < 0,05). Skupina pacientů dostávajících dávku 10 mg/kg nevykazovala statisticky signifikantní rozdíl proti placebu (41,4 %, p = nesignifikantní). Odpověď hodnocená skórovacím systém BILAG u pacientů léčených dávkou 1 mg/kg belimumabu byla v 52. týdnu 74,9 %, zatímco při podávání placeba 65,5 % (p < 0,05) a v 76. týdnu činil tento poměr 69,0 % vs. 58,9 % (p < 0,05). Zlepšení hodnocené skórovacím systémem SF-36 PSC (36-item Short Form Physical Component Score), které bylo zaznamenáno ve skupině s dávkou 1 mg/kg (+4,37) oproti skupině s placebem (+2,85) v týdnu 52, bylo statisticky významné (p = 0,012). Ve 28. a 76. týdnu nebyl zaznamenán statisticky signifikantní rozdíl mezi těmito skupinami ani mezi skupinou s dávkou 10 mg/kg a skupinou s placebem. Výskyt závažných vzplanutí nemoci byl ve skupinách léčených belimumabem statisticky signifikantně nižší proti placebové skupině. V laboratorním hodnocení byl zaznamenán statisticky významný pokles hladiny anti-dsdna protilátek až jejich vymizení u pacientů v terapii belimumabem (1 mg/kg) proti placebu v týdnech 52 a 76 (p < 0,01), respektive tomu tak bylo i při podávání dávky 10 mg/kg (p < 0,001). Byla zaznamenána normalizace hladin komplementu 4 (C4) při terapii belimumabem proti placebu (p < 0,03). U hladin C3 bylo pozorováno zvýšení hodnocené v týdnu 52 a 76 ve skupině s dávkou 1 mg/kg proti placebu, nicméně bez statistické významnosti, naopak ve skupině s dávkou 10 mg/kg bylo zvýšení oproti placebu statisticky významné, a to 43,5 % (p < 0,01), respektive 51,3 % (p < 0,001). Dobrá terapeutická odpověď ve skupině s belimumabem umožnila částečné snížení dávek steroidní terapie. Belimumab se zdál účinnější než placebo při zhodnocení skórovacích indexů aktivity a laboratorních parametrů v 52. a 76. týdnu léčby. Rozdíly v účinnosti dle dávky belimumabu nebyly statisticky signifikantní. Výskyt nežádoucích příhod byl obdobný ve skupinách léčených belimumabem v dávkách 1 mg/kg a 10 mg/kg a v placebové skupině [15, 16]. Post hoc analýza studií BLISS-52 a BLISS-76 Velmi zajímavá data týkající se změn renálních parametrů přinesla post hoc analýza výsledků studií BLISS-52 a BLISS-76. Obě dvě studie nebyly primárně zaměřeny na posouzení vlivu belimumabu na projevy lupusové nefritidy, aktivní lupusová nefritida byla i mezi vylučujícími kritérii pro zařazení do klinického hodnocení. Pacienti léčení belimumabem měli příznivější výsledky renálních parametrů (proteinurie, glomerulární filtrace, renální relapsy, sérologická aktivita choroby) než nemocní v placebové skupině, ačkoli rozdíly mezi oběma skupinami nebyly statisticky signifikantní. U pacientů s renálním postižením přítomným již při vstupu do studie, kteří byli léčeni mykofenolátem, došlo k výraznějšímu zlepšení renálních parametrů, pokud současně užívali belimumab. Výsledky této analýzy naznačují, že terapie belimumabem by mohla být pro pacienty s renálním postižením přínosem, limitací je však malý počet pacientů, a je proto třeba dalších hodnocení [17]. Použití v graviditě a laktaci O použití belimumabu v těhotenství je k dispozici zatím jen malé množství údajů. Studie na zvířatech u opic neukázaly na přímé ani nepřímé škodlivé účinky belimumabu s ohledem na reprodukční toxicitu, belimumab je dle klasifikace FDA hodnocen v kategorii C. V platném SPC se uvádí, že ženy ve fertilním věku musí během léčby a po dobu nejméně 4 měsíců od ukončení léčby užívat účinnou antikoncepci [13]. Přesto došlo k desítkám gravidit, jejichž výsledky zatím nejsou příliš povzbudivé [14]. To však nelze v současnosti připisovat nežádoucím účinkům belimumabu, ale spíše nepříznivému vlivu základního onemocnění [18]. V těhotenském registru výrobce je v současnosti zahrnuto šest pacientek a zatím bylo referováno o narození dvou zdravých dětí [19]. O užití belimumabu v době kojení je ještě méně údajů. Dle SPC se doporučuje při rozhodnutí o kojení zvážit prospěch z kojení pro dítě a prospěch z léčby pro ženu [13]. Byl prokázán přestup belimumabu do mateřského mléka opic, není ale známo, zda se po požití systémově vstřebává. Vzhledem k velikosti molekuly se však dá očekávat jen minimální přestup belimumabu do mateřského mléka a jeho degradace v zažívacím traktu kojence. Závěr Belimumab představuje inovativní léčivo indikované k terapii SLE. Jde o humánní monoklonální protilátku, která inhibuje biologickou aktivitu stimulátoru B-lymfocytů (BLyS). Belimumab je v současnosti indikován k terapii aktivního SLE, nejsou-li přítomny vylučující orgánové komplikace (aktivní lupusová nefritida s deteriorací renálních funkcí a nefrotickou proteinurií, neurolupus). Pacient s lupusovou nefritidou, normální renální funkcí a non-nefrotickou proteinurií může být pro extrarenální indikace belimumabem léčen. Terapie belimumabem byla ve více studiích účinná, dobře tolerovaná a bezpečná. V současnosti belimumab není lékem první volby, ale je užíván v kombinaci s dalšími imunosupresivy (např. s azathioprinem, mykofenolátem) k udržení remise. Zatím nejsou k dispozici relevantní data o účinnosti a bezpečnosti belimumabu u pacientů s aktivní lupusovou nefritidou a postižením CNS, zde je třeba dalších hodnocení s větším počtem pacientů. V České republice je belimumab již registrován, není však zatím stanovena jeho úhrada, a vedle klinických studií je proto podáván jen na základě schválení revizním lékařem zdravotní pojišťovny. Obě pracoviště autorů tohoto sdělení již mají s podáváním belimumabu zkušenosti. Širšímu využití této léčby zatím brání nejen absence stanovené úhrady, ale také skutečnost, že belimumab je určen pro skupinu pacientů, kteří mají již jiné terapeutické alternativy, a dále chybění přesvědčivých dat u těžkých forem SLE se závažnými orgánovými komplikacemi. Belimumab je dále zkoušen a zdá se perspektivní v některých dalších indikacích, a to nejen revmatologických (Sjögrenův syndrom, ANCA asociované vaskulitidy), ale i transplantologických a neurologických (např. myasthenia gravis). 213
5 Literatura [1] Urowitz M, Gladman D, Ibanez D, et al. Evolution of disease burden over 5 years in a multicentre inception SLE cohort. Arthritis Care Res (Hoboken) [2] Baker KP, Edwards BM, Main SH, et al. Generation and characterization of LymphoStat-B, a human monoclonal antibody that antagonizes the bioactivities of B lymphocyte stimulator. Arthritis Rheum 2003; 48: [3] Treml JF, Hao Y, Stadanlick JE, et al. The BLyS family: toward a molecular understanding of B cell homeostasis. Cell Biochem Biophys 2009; 53: [4] Jakob N, Stohl W. Cytokine disturbances in systemic lupus erythematosus. Arthritis Res Ther 2011; 13: 228. [5] Cancro MP. The BLyS/BAFF family of ligands and receptors: key targets in the therapy and understanding of autoimmunity. Ann Rheum Dis 2006; 65 (Suppl 3): [6] Elsawa SF, Novak AJ, Grote DM, et al. B-lymphocyte stimulator (BLyS) stimulates immunoglobulin production and malignant B-cell growth in Waldenstrom macroglobulinemia. Blood 2006; 107: [7] Furie R, Stohl W, Ginzler EM, et al. Belimumab Study Group. Biologic activity and safety of belimumab, a neutralizing anti-b-lymphocyte stimulator (BLyS) monoclonal antibody: a phase I trial in patients with systemic lupus erythematosus. Arthritis Res Ther 2008; 10: 109. [8] Lamore R, Parmar S, Patel K, Hilas O. Belimumab (Benlysta): a breakthrough therapy for systemic lupus erythematosus. P T 2012 ;37: [9] Halpern WG, Lappin P, Zanardi T, et al. Chronic administration of belimumab, a BLyS antagonist, decreases tissue and peripheral blood B-lymphocyte populations in cynomolgus monkeys: pharmacokinetic, pharmacodynamic, and toxicologic effects. Toxicol Sci 2006; 91: [10] Jacobi AM, Huang W, Wang T, et al. Effect of long- -term belimumab treatment on B cells in systemic lupus erythematosus: extension of a phase II, double-blind, placebo-controlled, dose-ranging study. Arthritis Rheum 2010; 62: [11] Merrill JT, Ginzler EM, Wallace DJ. Long-term safety profile of belimumab plus standard therapy in patients with systemic lupus erythematosus. Arthritis Rheum 2012 Jun 5. doi: /art [12] Horák P, Tegzová D, Závada J, et al. Doporučení ČRS pro léčbu nemocných se SLE. Čes Revmatol 2013; 21: [13] European Medicines Agency. Benlysta (belimumab): EU Summary of Product Characteristics. WC pdf Navštíveno 30. května [14] Wallace DJ, Stohl W, Furie RA, et al. A phase II, randomized, double-blind, placebo-controlled, dose-ranging study of belimumab in patients with active systemic lupus erythematosus. Arthritis Rheum 2009; 61: [15] Navarra SV, Guzmán RM, Gallacher AE, et al. BLISS-52 Study Group. Efficacy and safety of belimumab in patients with active systemic lupus erythematosus: a randomised, placebo-controlled, phase 3 trial. Lancet 2011; 377: [16] Hahn BH. Belimumab for Systemic Lupus Erythematosus. N Engl J Med 2013; 368: [17] Furie R, Petri M, Zamani O, et al. A phase III, randomized, placebo-controlled study of belimumab, a monoclonal antibody that inhibits B lymphocyte stimulator, in patients with systemic lupus erythematosus. BLISS-76 Study Group. Arthritis Rheum 2011; 63: [18] Peart E, Clowse ME. Systemic lupus erythematosus and pregnancy outcomes: an update and review of the literature. Curr Opin Rheumatol 2014; 26: [19] Landy H, Powell M, Hill D, et al. Belimumab pregnancy registry: prospective cohort study of pregnancy outcomes. Obstet Gynecol 2014; 123 Suppl 1: 62S. Doručeno do redakce: Přijato k publikaci: MUDr. Jan Vachek Klinika nefrologie VFN v Praze a 1. LF UK U Nemocnice 2, Praha 2 jan.vachek@gmail.com 214
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Belimumabum je lidská monoklonální protilátka IgG1λ produkovaná buněčnou linií savčích buněk (NS0) pomocí rekombinantní DNA technologie.
 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
Přínos farmakokinetického monitorování pro optimalizaci biologické léčby ISZ. T. Vaňásek (Hradec Králové)
 Přínos farmakokinetického monitorování pro optimalizaci biologické léčby ISZ T. Vaňásek (Hradec Králové) Farmakokinetické monitorování BL Biologická léčba Cílená modifikace imunitní reakce spojené s patogenezí
Přínos farmakokinetického monitorování pro optimalizaci biologické léčby ISZ T. Vaňásek (Hradec Králové) Farmakokinetické monitorování BL Biologická léčba Cílená modifikace imunitní reakce spojené s patogenezí
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
Perorální kladribin: bezpečnostní profil, monitorování pacientů a praktické zkušenosti.
 Perorální kladribin: bezpečnostní profil, monitorování pacientů a praktické zkušenosti. I V A N A K O V Á Ř O V Á C E N T R U M P R O D E M Y E L I N I Z A Č N Í O N E M O C N Ě N Í N E U R O L O G I C
Perorální kladribin: bezpečnostní profil, monitorování pacientů a praktické zkušenosti. I V A N A K O V Á Ř O V Á C E N T R U M P R O D E M Y E L I N I Z A Č N Í O N E M O C N Ě N Í N E U R O L O G I C
Atestační otázky z oboru alergologie a klinická imunologie
 Publikováno z 2. lékařská fakulta Univerzity Karlovy v Praze ( https://www.lf2.cuni.cz) Atestační otázky z oboru alergologie a klinická imunologie Okruh základy imunologie 1. Buňky, tkáně a orgány imunitního
Publikováno z 2. lékařská fakulta Univerzity Karlovy v Praze ( https://www.lf2.cuni.cz) Atestační otázky z oboru alergologie a klinická imunologie Okruh základy imunologie 1. Buňky, tkáně a orgány imunitního
Sledování dětí exponovaných intrauterinně anti- TNFa léčbě
 Sledování dětí exponovaných intrauterinně anti- TNFa léčbě 1 Dana Ďuricová, 1 Eva Dvořáková, 2 Jana Koželuhová, 3 Pavel Kohout, 1,5 Katarína Mitrová, 4 Marianna Durilová, 5 Kristýna Zárubová, 5 Ondřej
Sledování dětí exponovaných intrauterinně anti- TNFa léčbě 1 Dana Ďuricová, 1 Eva Dvořáková, 2 Jana Koželuhová, 3 Pavel Kohout, 1,5 Katarína Mitrová, 4 Marianna Durilová, 5 Kristýna Zárubová, 5 Ondřej
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Příloha č.4 Seznam imunologických vyšetření. Obsah. Seznam imunologických vyšetření
 Příloha č.4 Seznam imunologických vyšetření Obsah IgA... 2 IgG... 3 IgM... 4 IgE celkové... 5 Informační zdroje:... 6 Stránka 1 z 6 Název: IgA Zkratka: IgA Typ: kvantitativní Princip: turbidimetrie Jednotky:
Příloha č.4 Seznam imunologických vyšetření Obsah IgA... 2 IgG... 3 IgM... 4 IgE celkové... 5 Informační zdroje:... 6 Stránka 1 z 6 Název: IgA Zkratka: IgA Typ: kvantitativní Princip: turbidimetrie Jednotky:
CZ PAR. QUETIAPINI FUMARAS Seroquel. UK/W/0004/pdWS/001 NL/W/0004/pdWS/001
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
CZ PAR QUETIAPINUM. Seroquel. UK/W/0004/pdWS/001. NL/W/0004/pdWS/001
 CZ PAR Název (léčivá látka/ přípravek) Číslo procedury QUETIAPINUM Seroquel UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZVY PŘÍPRAVKŮ KLINICKÝCH STUDIÍ INN DRŽITELÉ PŘÍPRAVKŮ KLINICKÝCH STUDIÍ SCHVÁLENÉ
CZ PAR Název (léčivá látka/ přípravek) Číslo procedury QUETIAPINUM Seroquel UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZVY PŘÍPRAVKŮ KLINICKÝCH STUDIÍ INN DRŽITELÉ PŘÍPRAVKŮ KLINICKÝCH STUDIÍ SCHVÁLENÉ
Ribomunyl: mechanismus účinku(1) ZÍSKANÁ IMUNITNÍ ODPOVĚĎ PROTI VIRŮM A BAKTERIÍM. Dny
 RIBOMUNYL JE RIBOZOM-KOMPONENTNÍ TERAPEUTICKÝ PŘÍSTUP K PREVENCI OPAKOVANÝCH KTERÉ MAJÍ VYŠŠÍ POČET EPIZOD NEŽ SE OČEKÁVÁ KLINICKOU ÚČINNOSTÍ A DOBRÝM PROFILEM : mechanismus účinku(1) MEMBRÁNOVÁ FRAKCE
RIBOMUNYL JE RIBOZOM-KOMPONENTNÍ TERAPEUTICKÝ PŘÍSTUP K PREVENCI OPAKOVANÝCH KTERÉ MAJÍ VYŠŠÍ POČET EPIZOD NEŽ SE OČEKÁVÁ KLINICKOU ÚČINNOSTÍ A DOBRÝM PROFILEM : mechanismus účinku(1) MEMBRÁNOVÁ FRAKCE
Subpopulace B lymfocytů v klinické imunologii
 Subpopulace B lymfocytů v klinické imunologii Marcela Vlková Ústav klinické imunologie a alergologie, FN u sv. Anny v Brně B lymfocyty základními buňkami specifické humorální imunity primární funkce -
Subpopulace B lymfocytů v klinické imunologii Marcela Vlková Ústav klinické imunologie a alergologie, FN u sv. Anny v Brně B lymfocyty základními buňkami specifické humorální imunity primární funkce -
Přípravek BI ve srovnání s přípravkem Humira u pacientů se středně těžkou až těžkou ložiskovou lupénkou
 Přípravek ve srovnání s přípravkem u pacientů se středně těžkou až těžkou ložiskovou lupénkou Toto je shrnutí klinické studie, které se účastnili pacienti s ložiskovou lupénkou. Je vypracováno pro širokou
Přípravek ve srovnání s přípravkem u pacientů se středně těžkou až těžkou ložiskovou lupénkou Toto je shrnutí klinické studie, které se účastnili pacienti s ložiskovou lupénkou. Je vypracováno pro širokou
Bezpečnost a účinnost přípravku Neoclarityn 5 mg potahované tablety u dětí mladších 12 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
 1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
Léčba hypertenze v těhotenství
 Léčba hypertenze v těhotenství Zelinka Tomáš III. interní klinika - klinika endokrinologie a metabolismu, 1. LF UK a VFN, Praha Centrum pro výzkum, diagnostiku a léčbu arteriální hypertenze Komplexní kardiovaskulární
Léčba hypertenze v těhotenství Zelinka Tomáš III. interní klinika - klinika endokrinologie a metabolismu, 1. LF UK a VFN, Praha Centrum pro výzkum, diagnostiku a léčbu arteriální hypertenze Komplexní kardiovaskulární
VÝSLEDKY. Účastnící se pacienti měli riziko kardiovaskulárních onemocnění
 Účinek linagliptinu na kardiovaskulární zdraví a funkci ledvin u pacientů s diabetem 2. typu, kteří mají riziko kardiovaskulárního onemocnění (studie CARMELINA, 1218.22) Lidé s riziko kardiovaskulárního
Účinek linagliptinu na kardiovaskulární zdraví a funkci ledvin u pacientů s diabetem 2. typu, kteří mají riziko kardiovaskulárního onemocnění (studie CARMELINA, 1218.22) Lidé s riziko kardiovaskulárního
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘEHLED KLINICKÝCH STUDIÍ DOSTUPNÝCH V ČR PRO NEMOCNÉ S MNOHOČETNÝM MYELOMEM. MUDr. Evžen Gregora Lucie Ficeková
 PŘEHLED KLINICKÝCH STUDIÍ DOSTUPNÝCH V ČR PRO NEMOCNÉ S MNOHOČETNÝM MYELOMEM MUDr. Evžen Gregora Lucie Ficeková Česká myelomová skupina, Velké Bílovice, 20.4. - 21.4. 2007 AKTIVNÍ KLINICKÉ STUDIE Probíhá
PŘEHLED KLINICKÝCH STUDIÍ DOSTUPNÝCH V ČR PRO NEMOCNÉ S MNOHOČETNÝM MYELOMEM MUDr. Evžen Gregora Lucie Ficeková Česká myelomová skupina, Velké Bílovice, 20.4. - 21.4. 2007 AKTIVNÍ KLINICKÉ STUDIE Probíhá
Vývoj nových léčiv. Preklinický výzkum Klinický výzkum
 Vývoj nových léčiv Preklinický výzkum Klinický výzkum Úvod Léčivo = nejprověřenější potravina vstupující do organismu Ideální léčivo kvalitní, účinné, bezpečné a dostupné Financování výzkumu léčiv souvislost
Vývoj nových léčiv Preklinický výzkum Klinický výzkum Úvod Léčivo = nejprověřenější potravina vstupující do organismu Ideální léčivo kvalitní, účinné, bezpečné a dostupné Financování výzkumu léčiv souvislost
Příloha II. Vědecké závěry a zdůvodnění změny v registraci
 Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
CZ PAR. QUETIAPINI FUMARAS Seroquel. NL/W/0004/pdWS/002
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury NL/W/0004/pdWS/002 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA ZMĚNA V SmPC
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury NL/W/0004/pdWS/002 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA ZMĚNA V SmPC
Co přináší biologická léčba nespecifických zánětů střevních. Keil R.
 Co přináší biologická léčba nespecifických zánětů střevních Keil R. Příčiny vzniku nespecifických střevních zánětů Vzniká u geneticky disponovaných osob Je důsledkem abnormální imunitní odpovědi na faktory
Co přináší biologická léčba nespecifických zánětů střevních Keil R. Příčiny vzniku nespecifických střevních zánětů Vzniká u geneticky disponovaných osob Je důsledkem abnormální imunitní odpovědi na faktory
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU VPRIV 200 U prášek pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 200 jednotek* (U) velaglucerasum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU VPRIV 200 U prášek pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 200 jednotek* (U) velaglucerasum
Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010
 Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUTAMID SANDOZ 250 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Flutamidum
Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUTAMID SANDOZ 250 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Flutamidum
U pacientů, jejichž tělesná hmotnost je vyšší než 100 kg, se dávky přesahující 800 mg/infuzi nedoporučují.
 EDUKAČNÍ MATERIÁLY RoActemra (tocilizumab) Kapesní dávkovací karta pro revmatoidní artritidu Přípravek RoActemra v kombinaci s metotrexátem (MTX) je indikován k léčbě středně těžké až těžké aktivní revmatoidní
EDUKAČNÍ MATERIÁLY RoActemra (tocilizumab) Kapesní dávkovací karta pro revmatoidní artritidu Přípravek RoActemra v kombinaci s metotrexátem (MTX) je indikován k léčbě středně těžké až těžké aktivní revmatoidní
Příloha č.4 Seznam imunologických vyšetření
 Příloha č.6 Laboratorní příručka Laboratoří MeDiLa, v05 - Seznam imunologických Příloha č.4 Seznam imunologických Obsah IgA... 2 IgG... 3 IgM... 4 IgE celkové... 5 Informační zdroje:... 6 Stránka 1 z 6
Příloha č.6 Laboratorní příručka Laboratoří MeDiLa, v05 - Seznam imunologických Příloha č.4 Seznam imunologických Obsah IgA... 2 IgG... 3 IgM... 4 IgE celkové... 5 Informační zdroje:... 6 Stránka 1 z 6
Je možné zvýšit současnou účinnost biologické léčby IBD?
 Je možné zvýšit současnou účinnost biologické léčby IBD? Martin Bortlík Klinické a výzkumné centrum pro střevní záněty ISCARE a Interní klinika UVN a 1. LF UK Praha Obsah přednášky Jaká je současná situace?
Je možné zvýšit současnou účinnost biologické léčby IBD? Martin Bortlík Klinické a výzkumné centrum pro střevní záněty ISCARE a Interní klinika UVN a 1. LF UK Praha Obsah přednášky Jaká je současná situace?
Specifická imunitní odpověd. Veřejné zdravotnictví
 Specifická imunitní odpověd Veřejné zdravotnictví MHC molekuly glykoproteiny exprimovány na všech jaderných buňkách (MHC I) nebo jenom na antigen prezentujících buňkách (MHC II) u lidí označovány jako
Specifická imunitní odpověd Veřejné zdravotnictví MHC molekuly glykoproteiny exprimovány na všech jaderných buňkách (MHC I) nebo jenom na antigen prezentujících buňkách (MHC II) u lidí označovány jako
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU STELARA 45 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 45 mg ustekinumabum v 0,5 ml. Ustekinumabum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU STELARA 45 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 45 mg ustekinumabum v 0,5 ml. Ustekinumabum
Možnosti využití hematologické léčby u MG
 Možnosti využití hematologické léčby u MG Tomáš Kozák 3. lékařská fakulta UK v Praze a FN Královské Vinohrady Autoimunitní choroby (AID) Ehrlich a Morgenroth, 1901: horror autotoxicus Shoenfeld, 1999,
Možnosti využití hematologické léčby u MG Tomáš Kozák 3. lékařská fakulta UK v Praze a FN Královské Vinohrady Autoimunitní choroby (AID) Ehrlich a Morgenroth, 1901: horror autotoxicus Shoenfeld, 1999,
Nano World Cancer Day 2014
 31. ledna 2014 Celoevropská akce ETPN pořádaná současně ve 13 členských zemích Evropské unie Rakousko (Štýrský Hradec), Česká republika (Praha), Finsko (Helsinky), Francie (Paříž), Německo (Erlangen),
31. ledna 2014 Celoevropská akce ETPN pořádaná současně ve 13 členských zemích Evropské unie Rakousko (Štýrský Hradec), Česká republika (Praha), Finsko (Helsinky), Francie (Paříž), Německo (Erlangen),
INFLECTRA SCREENINGOVÝ LIST. a výběru pacientů pro všechny schválené indikace. Obsahuje pokyny ke správnému screeningu
 Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
Příloha IV. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha IV Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 132 Vědecké závěry Výbor CHMP zvážil níže uvedené doporučení výboru PRAC ze dne 5. prosince 2013 s ohledem na postup podle
Příloha IV Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 132 Vědecké závěry Výbor CHMP zvážil níže uvedené doporučení výboru PRAC ze dne 5. prosince 2013 s ohledem na postup podle
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
Přehled statistických výsledků
 Příloha 7 Přehled statistických výsledků 1 Úvod, zdroj dat a zadání analýz Statistická zpracování popsaná v tomto dokumentu vychází výhradně z dat Registru AINSO, tedy z dat sbíraných již podle návrhu
Příloha 7 Přehled statistických výsledků 1 Úvod, zdroj dat a zadání analýz Statistická zpracování popsaná v tomto dokumentu vychází výhradně z dat Registru AINSO, tedy z dat sbíraných již podle návrhu
Trombocytopenie v těhotenství
 Trombocytopenie v těhotenství doc. MUDr. Antonín Pařízek, CSc. Gynekologicko-porodnická klinika 1. LF UK a VFN v Praze Definice normální počet trombocytů u netěhotných žen 150-400 x 10 9 /l v těhotenství
Trombocytopenie v těhotenství doc. MUDr. Antonín Pařízek, CSc. Gynekologicko-porodnická klinika 1. LF UK a VFN v Praze Definice normální počet trombocytů u netěhotných žen 150-400 x 10 9 /l v těhotenství
Vztah pacienta k diagnostice a léčbě idiopatických střevních zánětů možnosti a problémy
 Vztah pacienta k diagnostice a léčbě idiopatických střevních zánětů možnosti a problémy Vladimír Zbořil Interní - hepatogastroenterologická klinika Fakultní nemocnice Bohunice Masarykova Univerzita BRNO
Vztah pacienta k diagnostice a léčbě idiopatických střevních zánětů možnosti a problémy Vladimír Zbořil Interní - hepatogastroenterologická klinika Fakultní nemocnice Bohunice Masarykova Univerzita BRNO
Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu
 Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu Marta Krejčí XIII. MM workshop a setkání CMG, Mikulov 11.4.2015 Doplněk č. 1 k doporučení z 9/2012: Diagnostika
Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu Marta Krejčí XIII. MM workshop a setkání CMG, Mikulov 11.4.2015 Doplněk č. 1 k doporučení z 9/2012: Diagnostika
Novinky a trendy v léčbě autoimunitních (dysimunitních) nervosvalových onemocnění. J. Bednařík Neurologická klinika LFMU a FN Brno
 Novinky a trendy v léčbě autoimunitních (dysimunitních) nervosvalových onemocnění J. Bednařík Neurologická klinika LFMU a FN Brno Cíl a obsah přednášky Obecné trendy ve výzkumu a praktickém managementu
Novinky a trendy v léčbě autoimunitních (dysimunitních) nervosvalových onemocnění J. Bednařík Neurologická klinika LFMU a FN Brno Cíl a obsah přednášky Obecné trendy ve výzkumu a praktickém managementu
Vývoj VZV vakcín. Chlíbek Roman Katedra epidemiologie Fakulta vojenského zdravotnictví UO Hradec Králové
 Vývoj VZV vakcín Ticháčkovy dny vojenských epidemiologů, 17.5. 2012 Chlíbek Roman Katedra epidemiologie Fakulta vojenského zdravotnictví UO Hradec Králové Herpes zoster (HZ) 1953 první izolace viru (Thomas
Vývoj VZV vakcín Ticháčkovy dny vojenských epidemiologů, 17.5. 2012 Chlíbek Roman Katedra epidemiologie Fakulta vojenského zdravotnictví UO Hradec Králové Herpes zoster (HZ) 1953 první izolace viru (Thomas
Přehled změn vybraných kapitol
 Přehled změn vybraných kapitol (aneb najdi 10 rozdílů.) změny guidelines 2012 Nové léčebné odpovědi Bendamustin Profylaxe infekčních komplikací Profylaxe TEN Léčba pacientů s renální insuficiencí Léčba
Přehled změn vybraných kapitol (aneb najdi 10 rozdílů.) změny guidelines 2012 Nové léčebné odpovědi Bendamustin Profylaxe infekčních komplikací Profylaxe TEN Léčba pacientů s renální insuficiencí Léčba
Klinický profil, léčba a prognóza 121 případů Guillainova- Barrého syndromu u 119 nemocných prospektivně zaznamenaných v české národním registru GBS.
 Klinický profil, léčba a prognóza 121 případů Guillainova- Barrého syndromu u 119 nemocných prospektivně zaznamenaných v české národním registru GBS. J.Bednařík 1, 2, M.Škorňa 1, J.Kuchyňka 3, R.Mazanec
Klinický profil, léčba a prognóza 121 případů Guillainova- Barrého syndromu u 119 nemocných prospektivně zaznamenaných v české národním registru GBS. J.Bednařík 1, 2, M.Škorňa 1, J.Kuchyňka 3, R.Mazanec
 www.printo.it/pediatric-rheumatology/cz/intro Terapie Verze č 2016 13. Biologická léčba Nové perspektivy v léčbě se rozvinuly v posledních letech s nástupem tzv. biologických léků. Tento název je používán
www.printo.it/pediatric-rheumatology/cz/intro Terapie Verze č 2016 13. Biologická léčba Nové perspektivy v léčbě se rozvinuly v posledních letech s nástupem tzv. biologických léků. Tento název je používán
Funkční blokáda. AChR protilátky se příčně. receptorů protilátkami
 Racionální terapie kortikosteroidy u myasthenia gravis, rizika a benefit léčby Iveta Nováková Neurologická klinika VFN, Praha Nervosvalový přenos Funkční blokáda Destrukce nervosvalové ploténky Nervosvalový
Racionální terapie kortikosteroidy u myasthenia gravis, rizika a benefit léčby Iveta Nováková Neurologická klinika VFN, Praha Nervosvalový přenos Funkční blokáda Destrukce nervosvalové ploténky Nervosvalový
Desloratadin STADA 5 mg jsou modré, kulaté, bikonvexní potahované tablety o průměru přibližně 6,5 mm.
 Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
PŘÍLOHA I. Page 1 of 5
 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, KONCENTRACE VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOB(Y) PODÁNÍ, DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH Page 1 of 5 Členský stát Žadatel
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, KONCENTRACE VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOB(Y) PODÁNÍ, DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH Page 1 of 5 Členský stát Žadatel
Přehled klinických studií u CLL v ČR v roce 2014
 Přehled klinických studií u CLL v ČR v roce 2014 Datum aktualizace: 28. 3. 2014 Zpracoval: dr. Špaček,VFN Praha, martin.spacek2@vfn.cz http://www.cll.cz Klinické studie v ČR 2014 Lenalidomid imunomodulace
Přehled klinických studií u CLL v ČR v roce 2014 Datum aktualizace: 28. 3. 2014 Zpracoval: dr. Špaček,VFN Praha, martin.spacek2@vfn.cz http://www.cll.cz Klinické studie v ČR 2014 Lenalidomid imunomodulace
Příloha IV. Vědecké závěry
 Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
Příloha IV. Vědecké závěry
 Příloha IV Vědecké závěry 53 Vědecké závěry 1. - Doporučení výboru PRAC Podkladové informace Ivabradin je látka snižující srdeční frekvenci se specifickým účinkem na sinusový uzel bez účinku na dobu intraatriálního,
Příloha IV Vědecké závěry 53 Vědecké závěry 1. - Doporučení výboru PRAC Podkladové informace Ivabradin je látka snižující srdeční frekvenci se specifickým účinkem na sinusový uzel bez účinku na dobu intraatriálního,
Příloha II. Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC
 Příloha II Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC 68 Vědecké závěry Koordinační skupina pro vzájemné uznávání
Příloha II Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC 68 Vědecké závěry Koordinační skupina pro vzájemné uznávání
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
Souhrn údajů o přípravku
 Příloha č. 3 ke sdělení sp.zn. sukls93024/2010 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Isoprinosine tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: inosinum pranobexum 500 mg v 1 tabletě
Příloha č. 3 ke sdělení sp.zn. sukls93024/2010 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Isoprinosine tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: inosinum pranobexum 500 mg v 1 tabletě
HIV (z klinického pohledu)
 HIV (z klinického pohledu) David Jilich HIV centrum, Nemocnice Na Bulovce, Praha 11.12. 2014 Vývoj situace ve světě Changes in incidance rate 2001 to 2009 zdroj: UNAIDS Zákadní charakteristika virová infekce
HIV (z klinického pohledu) David Jilich HIV centrum, Nemocnice Na Bulovce, Praha 11.12. 2014 Vývoj situace ve světě Changes in incidance rate 2001 to 2009 zdroj: UNAIDS Zákadní charakteristika virová infekce
Výskyt a význam infekce Borna disease virem u pacientů léčených
 Výskyt a význam infekce Borna disease virem u pacientů léčených pro závislost Sylva Racková Psychiatrická klinika LF UK v Plzni AT konference 28.04. 2010, Špindlerův Mlýn Borna Disease virus (BDV) charakteristika
Výskyt a význam infekce Borna disease virem u pacientů léčených pro závislost Sylva Racková Psychiatrická klinika LF UK v Plzni AT konference 28.04. 2010, Špindlerův Mlýn Borna Disease virus (BDV) charakteristika
2018 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 Evropské přehodnocení fluorochinolonů nová doporučení k omezení používání MUDr. Eva Jirsová SÚKL Fluorochinolony hlavní pozitiva Velmi dobře účinné proti širokému spektru bakterií Dobře pronikají do buněk
Evropské přehodnocení fluorochinolonů nová doporučení k omezení používání MUDr. Eva Jirsová SÚKL Fluorochinolony hlavní pozitiva Velmi dobře účinné proti širokému spektru bakterií Dobře pronikají do buněk
Příloha II. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 21 Vědecké závěry Celkové závěry vědeckého hodnocení přípravků Oxynal a Targin a souvisejících názvů (viz příloha I) Podkladové
Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 21 Vědecké závěry Celkové závěry vědeckého hodnocení přípravků Oxynal a Targin a souvisejících názvů (viz příloha I) Podkladové
Keytruda (pembrolizumabum)
 EMA/235911/2019 EMEA/H/C/003820 Přehled pro přípravek Keytruda a proč byl přípravek registrován v EU Co je přípravek Keytruda a k čemu se používá? Keytruda je protinádorový léčivý přípravek používaný k
EMA/235911/2019 EMEA/H/C/003820 Přehled pro přípravek Keytruda a proč byl přípravek registrován v EU Co je přípravek Keytruda a k čemu se používá? Keytruda je protinádorový léčivý přípravek používaný k
Perorální bakteriální. u alergických pacientů. Jaroslav Bystroň Ingrid Richterová
 Perorální bakteriální imunomodulátory u alergických pacientů Jaroslav Bystroň Ingrid Richterová Imunitní systém Fyziologické obranné bariéry Nemají imunologickou povahu První etáží imunitní reakce jsou:
Perorální bakteriální imunomodulátory u alergických pacientů Jaroslav Bystroň Ingrid Richterová Imunitní systém Fyziologické obranné bariéry Nemají imunologickou povahu První etáží imunitní reakce jsou:
Role BAFF cytokinu v transplantačních reakcích. Mgr. Zuzana Sekerková RNDr. Alena Sekerková
 Role BAFF cytokinu v transplantačních reakcích Mgr. Zuzana Sekerková RNDr. Alena Sekerková OIG OKI Historie transplantací 4. 5. století př. n. l. Lékař Sushruta Samhita (Indie) postupy pro rekonstrukci
Role BAFF cytokinu v transplantačních reakcích Mgr. Zuzana Sekerková RNDr. Alena Sekerková OIG OKI Historie transplantací 4. 5. století př. n. l. Lékař Sushruta Samhita (Indie) postupy pro rekonstrukci
Vyšetření imunoglobulinů
 Vyšetření imunoglobulinů Celkové mn. Ig elektroforéza bílkovin jako procentuální zastoupení gamafrakce, vyšetřením ke zjištění možného paraproteinu. velmi hrubé vyšetření, odhalení pouze výrazných změn
Vyšetření imunoglobulinů Celkové mn. Ig elektroforéza bílkovin jako procentuální zastoupení gamafrakce, vyšetřením ke zjištění možného paraproteinu. velmi hrubé vyšetření, odhalení pouze výrazných změn
Co jsou imunodeficience? Imunodeficience jsou stavy charakterizované zvýšenou náchylností k infekcím
 Imunodeficience. Co jsou imunodeficience? Imunodeficience jsou stavy charakterizované zvýšenou náchylností k infekcím Základní rozdělení imunodeficiencí Primární (obvykle vrozené) Poruchy genů kódujících
Imunodeficience. Co jsou imunodeficience? Imunodeficience jsou stavy charakterizované zvýšenou náchylností k infekcím Základní rozdělení imunodeficiencí Primární (obvykle vrozené) Poruchy genů kódujících
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
Příloha II. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 406 Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci Ibuprofen je nesteroidní protizánětlivé léčivo (NSAID)
Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 406 Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci Ibuprofen je nesteroidní protizánětlivé léčivo (NSAID)
Progrese HIV infekce z pohledu laboratorní imunologie
 Progrese HIV infekce z pohledu laboratorní imunologie 1 Lochmanová A., 2 Olbrechtová L., 2 Kolčáková J., 2 Zjevíková A. 1 OIA ZÚ Ostrava 2 klinika infekčních nemocí, FN Ostrava HIV infekce onemocnění s
Progrese HIV infekce z pohledu laboratorní imunologie 1 Lochmanová A., 2 Olbrechtová L., 2 Kolčáková J., 2 Zjevíková A. 1 OIA ZÚ Ostrava 2 klinika infekčních nemocí, FN Ostrava HIV infekce onemocnění s
Důležité bezpečnostní informace pro zdravotnické pracovníky
 Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Světle červené, ploché, kulaté, skvrnité tablety, na jedné straně označené písmenem K.
 1. NÁZEV PŘÍPRAVKU Aerius 2,5 mg tablety dispergovatelné v ústech 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg. Pomocné látky se známým
1. NÁZEV PŘÍPRAVKU Aerius 2,5 mg tablety dispergovatelné v ústech 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg. Pomocné látky se známým
Přehled novinek v medikamentózní léčbě UC. Dana Ďuricová Klinické a výzkumné centrum pro střevní záněty, ISCARE IVF, a.s., Praha
 Přehled novinek v medikamentózní léčbě UC Dana Ďuricová Klinické a výzkumné centrum pro střevní záněty, ISCARE IVF, a.s., Praha JAK inhibitory (tofacitinib) Ustekinumab Obsah Anti-trafficking agents ovlivnění
Přehled novinek v medikamentózní léčbě UC Dana Ďuricová Klinické a výzkumné centrum pro střevní záněty, ISCARE IVF, a.s., Praha JAK inhibitory (tofacitinib) Ustekinumab Obsah Anti-trafficking agents ovlivnění
Výsledky léčby sibutraminem v iniciální šestitýdenní fázi studie SCOUT. MUDr. Igor Karen
 Výsledky léčby sibutraminem v iniciální šestitýdenní fázi studie SCOUT MUDr. Igor Karen 1 První výsledky studie SCOUT Všichni lékaři se setkávají ve svých praxích s obézními pacienty Někteří již kardiovaskulární
Výsledky léčby sibutraminem v iniciální šestitýdenní fázi studie SCOUT MUDr. Igor Karen 1 První výsledky studie SCOUT Všichni lékaři se setkávají ve svých praxích s obézními pacienty Někteří již kardiovaskulární
Institut pro zdravotní ekonomiku a technology assessment (IHETA) Kolektiv autorů: Jiří Klimeš, Tomáš Doležal, Milan Vocelka
 Nákladová efektivita atorvastatinu v porovnání se simvastatinem v prevenci kardiovaskulárních onemocnění v České republice dopady zkráceného revizního řízení Institut pro zdravotní ekonomiku a technology
Nákladová efektivita atorvastatinu v porovnání se simvastatinem v prevenci kardiovaskulárních onemocnění v České republice dopady zkráceného revizního řízení Institut pro zdravotní ekonomiku a technology
Prof. MUDr. Karel Pavelka, DrSc. Revmatologický ústav Praha Klinika revmatologie 1. LF UK
 Prof. MUDr. Karel Pavelka, DrSc. Revmatologický ústav Praha Klinika revmatologie 1. LF UK Historie centrové péče v revmatologii podnětem zavedení biologické léčby RA v roce 2000 diskuze DOHADOVACÍ ŘÍZENÍ
Prof. MUDr. Karel Pavelka, DrSc. Revmatologický ústav Praha Klinika revmatologie 1. LF UK Historie centrové péče v revmatologii podnětem zavedení biologické léčby RA v roce 2000 diskuze DOHADOVACÍ ŘÍZENÍ
Interpretace sérologických nálezů v diagnostice herpetických virů. K.Roubalová
 Interpretace sérologických nálezů v diagnostice herpetických virů K.Roubalová Specifické vlastnosti herpetických virů ovlivňují protilátkovou odpověď Latence a celoživotní nosičství Schopnost reaktivace,
Interpretace sérologických nálezů v diagnostice herpetických virů K.Roubalová Specifické vlastnosti herpetických virů ovlivňují protilátkovou odpověď Latence a celoživotní nosičství Schopnost reaktivace,
Možnosti léčby CRPC s časem přibývají
 Možnosti léčby CRPC s časem přibývají Jana Katolická Onkologicko-chirurgické oddělení Fakultní nemocnice u Sv. Anny Mnoho studií - jen čtyři nové léky Enzalutamid Abirateron + prednison Cabazitaxel Radium-223
Možnosti léčby CRPC s časem přibývají Jana Katolická Onkologicko-chirurgické oddělení Fakultní nemocnice u Sv. Anny Mnoho studií - jen čtyři nové léky Enzalutamid Abirateron + prednison Cabazitaxel Radium-223
Ekonomické aspekty biologické léčby Modelový příklad revmatoidní artritdy
 Ekonomické aspekty biologické léčby Modelový příklad revmatoidní artritdy MUDr. Jana Skoupá, MBA Pharma Projects s.r.o. Česká farmako-ekonomická společnost Praha, 15.9.2009 Struktura prezentace Proč model
Ekonomické aspekty biologické léčby Modelový příklad revmatoidní artritdy MUDr. Jana Skoupá, MBA Pharma Projects s.r.o. Česká farmako-ekonomická společnost Praha, 15.9.2009 Struktura prezentace Proč model
Vývoj nového léčiva. as. MUDr. Martin Votava, PhD.
 Vývoj nového léčiva as. MUDr. Martin Votava, PhD. Příprava na vývoj a registraci LP Náklady na vývoj: 800 mil USD Doba vývoje: 10 let Úspěšnost: 0,005% - 0,001% Vývoj nového léčivého přípravku IND NDA
Vývoj nového léčiva as. MUDr. Martin Votava, PhD. Příprava na vývoj a registraci LP Náklady na vývoj: 800 mil USD Doba vývoje: 10 let Úspěšnost: 0,005% - 0,001% Vývoj nového léčivého přípravku IND NDA
INPULSIS -ON: Dlouhodobá bezpečnost nintedanibu u pacientů s idiopatickou plicní fibrózou (IPF)
 INPULSIS -ON: Dlouhodobá bezpečnost nintedanibu u pacientů s idiopatickou plicní fibrózou (IPF) Toto je shrnutí klinické studie, které se účastnili pacienti IPF. Je vypracováno pro širokou veřejnost. Obsahuje
INPULSIS -ON: Dlouhodobá bezpečnost nintedanibu u pacientů s idiopatickou plicní fibrózou (IPF) Toto je shrnutí klinické studie, které se účastnili pacienti IPF. Je vypracováno pro širokou veřejnost. Obsahuje
5 omylů (problémů) center BL dle revizí VZP a jak jim předcházet. Martin Bortlík Klinické a výzkumné centrum pro střevní záněty ISCARE, Praha
 5 omylů (problémů) center BL dle revizí VZP a jak jim předcházet Martin Bortlík Klinické a výzkumné centrum pro střevní záněty ISCARE, Praha Úvod Provádění revizí je zákonnou povinností ZP ( 4 zákona č.
5 omylů (problémů) center BL dle revizí VZP a jak jim předcházet Martin Bortlík Klinické a výzkumné centrum pro střevní záněty ISCARE, Praha Úvod Provádění revizí je zákonnou povinností ZP ( 4 zákona č.
Praxbind doporučení pro podávání (SPC)
 Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg.
 1 NÁZEV PŘÍPRAVKU Neoclarityn 2,5 mg tablety dispergovatelné v ústech 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5
1 NÁZEV PŘÍPRAVKU Neoclarityn 2,5 mg tablety dispergovatelné v ústech 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5
Pomocná látka se známým účinkem: Jedna tableta obsahuje 75 mg monohydrátu laktosy. Úplný seznam pomocných látek viz bod 6.1.
 sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
VÝZNAM REGULACE APOPTÓZY V MEDICÍNĚ
 REGULACE APOPTÓZY 1 VÝZNAM REGULACE APOPTÓZY V MEDICÍNĚ Příklad: Regulace apoptózy: protein p53 je klíčová molekula regulace buněčného cyklu a regulace apoptózy Onemocnění: více než polovina (70-75%) nádorů
REGULACE APOPTÓZY 1 VÝZNAM REGULACE APOPTÓZY V MEDICÍNĚ Příklad: Regulace apoptózy: protein p53 je klíčová molekula regulace buněčného cyklu a regulace apoptózy Onemocnění: více než polovina (70-75%) nádorů
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls10679/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls10679/2012 1. NÁZEV PŘÍPRAVKU THYMOGLOBULINE 5 mg/ml, prášek pro infuzní roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls10679/2012 1. NÁZEV PŘÍPRAVKU THYMOGLOBULINE 5 mg/ml, prášek pro infuzní roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Diferenciální diagnostika selhání ledvin u mnohočetného myelomu. Zdeněk Adam Interní hematoonkologická klinika LF MU a FN Brno
 Diferenciální diagnostika selhání ledvin u mnohočetného myelomu Zdeněk Adam Interní hematoonkologická klinika LF MU a FN Brno Základní epidemiologická data Incidence renálního selhání s kreatininem > 1,5
Diferenciální diagnostika selhání ledvin u mnohočetného myelomu Zdeněk Adam Interní hematoonkologická klinika LF MU a FN Brno Základní epidemiologická data Incidence renálního selhání s kreatininem > 1,5
Česká Myelomová Skupina na poli mnohočetného myelomu
 Česká Myelomová Skupina na poli mnohočetného myelomu Vladimír Maisnar IV. interní hematologická klinika LF UK a FN Hradec Králové Lázně Bělohrad, 10. září 2016 Epidemiologická data: MM 1% všech malignit,
Česká Myelomová Skupina na poli mnohočetného myelomu Vladimír Maisnar IV. interní hematologická klinika LF UK a FN Hradec Králové Lázně Bělohrad, 10. září 2016 Epidemiologická data: MM 1% všech malignit,
Léčba astma bronchiale
 Léčba astma bronchiale Karel Urbánek, Ústav farmakologie LF UP v Olomouc 26. října 2011 Astma Úvod 2 agonisté Xantiny Antimuskarinika Kortikoidy Stabilizátory mastocytů a antileukotrieny Astma Chronické
Léčba astma bronchiale Karel Urbánek, Ústav farmakologie LF UP v Olomouc 26. října 2011 Astma Úvod 2 agonisté Xantiny Antimuskarinika Kortikoidy Stabilizátory mastocytů a antileukotrieny Astma Chronické
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
CELKOVÉ SHRNUTÍ VĚDECKÉHO HODNOCENÍ LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH KYSELINU VALPROOVOU/VALPROÁT (viz Příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV V SOUHRNECH ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÝCH INFORMACÍCH PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 104 VĚDECKÉ ZÁVĚRY CELKOVÉ SHRNUTÍ VĚDECKÉHO
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV V SOUHRNECH ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÝCH INFORMACÍCH PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 104 VĚDECKÉ ZÁVĚRY CELKOVÉ SHRNUTÍ VĚDECKÉHO
Kapitola III. Poruchy mechanizmů imunity. buňka imunitního systému a infekce
 Kapitola III Poruchy mechanizmů imunity buňka imunitního systému a infekce Imunitní systém Zásadně nutný pro přežití Nezastupitelná úloha v obraně proti infekcím Poruchy imunitního systému při rozvoji
Kapitola III Poruchy mechanizmů imunity buňka imunitního systému a infekce Imunitní systém Zásadně nutný pro přežití Nezastupitelná úloha v obraně proti infekcím Poruchy imunitního systému při rozvoji
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls42544-6/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pexogies 0,088 mg tablety Pexogies 0,18 mg tablety Pexogies 0,7 mg tablety 2. KVALITATIVNÍ A
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls42544-6/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pexogies 0,088 mg tablety Pexogies 0,18 mg tablety Pexogies 0,7 mg tablety 2. KVALITATIVNÍ A
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aerius 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aerius 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
EDUKAČNÍ MATERIÁL. Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid)
 EDUKAČNÍ MATERIÁL Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid) Leflunopharm (leflunomid), jako chorobu modifikující antirevmatikum (Disease-Modifying
EDUKAČNÍ MATERIÁL Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid) Leflunopharm (leflunomid), jako chorobu modifikující antirevmatikum (Disease-Modifying
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7
 PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7 Členský stát Žadatel nebo držitel rozhodnutí o registraci Vymyšlený název přípravku
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7 Členský stát Žadatel nebo držitel rozhodnutí o registraci Vymyšlený název přípravku
PŘEDČASNĚ NAROZENÝCH DĚTÍ
 OČKOVÁNÍ PŘEDČASNĚ NAROZENÝCH DĚTÍ Jitka Škovránková Dětské očkovací centrum FN Motol Ve světě se doporučuje stejně očkovat nezralé jako zralé děti, přestože existují kvalitativní i kvantitativní rozdíly
OČKOVÁNÍ PŘEDČASNĚ NAROZENÝCH DĚTÍ Jitka Škovránková Dětské očkovací centrum FN Motol Ve světě se doporučuje stejně očkovat nezralé jako zralé děti, přestože existují kvalitativní i kvantitativní rozdíly
Očkování chronicky nemocných
 Očkování chronicky nemocných Jan Smetana Roman Chlíbek Renáta Šošovičková 1 Fakulta vojenského zdravotnictví UO Hradec Králové Komu je očkování určeno (pomineme význam plošné vakcinace) 2 1. Osoby se zvýšeným
Očkování chronicky nemocných Jan Smetana Roman Chlíbek Renáta Šošovičková 1 Fakulta vojenského zdravotnictví UO Hradec Králové Komu je očkování určeno (pomineme význam plošné vakcinace) 2 1. Osoby se zvýšeným
Příloha IV. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha IV Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 27 Vědecké závěry Celkové shrnutí vědeckého hodnocení postkoitálních antikoncepčních léčivých přípravků obsahujících levonorgestrel
Příloha IV Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 27 Vědecké závěry Celkové shrnutí vědeckého hodnocení postkoitálních antikoncepčních léčivých přípravků obsahujících levonorgestrel
Celkové shrnutí vědeckého hodnocení přípravku Atacand Plus a související názvy (viz Příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÝCH INFORMACÍ PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 14 Vědecké závěry Celkové
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÝCH INFORMACÍ PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 14 Vědecké závěry Celkové
Mechanismy a působení alergenové imunoterapie
 Mechanismy a působení alergenové imunoterapie Petr Panzner Ústav imunologie a alergologie LF UK a FN Plzeň Zavedení termínu alergie - rozlišení imunity a přecitlivělosti Pasivní přenos alergenspecifické
Mechanismy a působení alergenové imunoterapie Petr Panzner Ústav imunologie a alergologie LF UK a FN Plzeň Zavedení termínu alergie - rozlišení imunity a přecitlivělosti Pasivní přenos alergenspecifické
ÚVOD DO TRANSPLANTAČNÍ IMUNOLOGIE
 ÚVOD DO TRANSPLANTAČNÍ IMUNOLOGIE Základní funkce imunitního systému Chrání integritu organizmu proti škodlivinám zevního a vnitřního původu: chrání organizmus proti patogenním mikroorganizmům a jejich
ÚVOD DO TRANSPLANTAČNÍ IMUNOLOGIE Základní funkce imunitního systému Chrání integritu organizmu proti škodlivinám zevního a vnitřního původu: chrání organizmus proti patogenním mikroorganizmům a jejich
Bevacizumab u starších pacientů s kolorektálním karcinomem
 Bevacizumab u starších pacientů s kolorektálním karcinomem MUDr. Tomáš Büchler, PhD. Onkologické oddělení Fakultní Thomayerovy nemocnice a Onkologická klinika 1. lékařské fakulty UK a VFN, Praha XIV. Staškovy
Bevacizumab u starších pacientů s kolorektálním karcinomem MUDr. Tomáš Büchler, PhD. Onkologické oddělení Fakultní Thomayerovy nemocnice a Onkologická klinika 1. lékařské fakulty UK a VFN, Praha XIV. Staškovy
