Laboratorní cvičení organická chemie
|
|
|
- Blanka Švecová
- před 8 lety
- Počet zobrazení:
Transkript
1 Laboratorní cvičení organická chemie Seznam úloh: 1a Ethylbromid 1b terc-butylchlorid 2 Kyselina 3-fenylpropanová 3 Nitrace fenolu 4 Azobenzen 5 Ethylenacetal ethylesteru 3-oxobutanové kyseliny 6a Ethylenacetal 4,4-difenyl-4-hydroxybutan-2-on 6b 4,4-Difenyl-4-hydroxybutan-2-on 7 3-Nitroacetofenon 8a 1-(3-Nitrofenyl)ethanol 8b 3-Aminoacetofenon 9 Pinakol 10 Kyselina benzoová 11 Kyselina anthranilová 12 Ethyl-acetát 13 2-Hydroxy-5-methyl-2 -nitroazobenzen 14 2-(2-Hydroxy-5-methylfenyl)benzotriazol 15 Kyselina 2-chlorbenzoová 16 Aminolýza 1-chlor-2,4-dinitrobenzenu 17a Extrakce rostlinných barviv na Soxhletově extraktoru 17b Izolace trimyristinu z muškátového oříšku 18 1,2,3,4,6-Penta-O-acetyl-β-D-glukopyranosa 1
2 2 Booklet
3 Vlastnosti rozpouštědel Látka Fyzikální vlastnosti Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] ethanol methanol hexan toluen ether aceton petrolether
4 Úloha 1a: Ethylbromid Příjmení a jméno: List :1/2 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup: Do baňky o obsahu 500 ml vpravíme 55 ml koncentrované kyseliny sírové a pak opatrně za stálého míchání přidáváme po částech 0,60 mol ethanolu. Horkou směs potom zvenčí ochladíme studenou vodou na teplotu C, přidáme 40 g ledu a potom 0,42 mol bromidu draselného. Směs opatrně destilujeme ze síťky za použití kahanu tak, aby nepřekypěla do chladiče. Předlohu destilační aparatury naplníme do poloviny vodou s ledovou tříští a alonž pomocí hadičky upravíme tak, aby její vývod zasahoval těsně pod hladinu vody v předloze. Předlohu ještě chladíme zevně ledem. Reakce je skončena, jakmile ustane přechod olejovitých kapiček do předlohy. Vzhledem k tomu, že kapaliny v předloze přibývá, je nutné dávat pozor, aby se při podtlaku nedostala chladičem do horké destilační baňky, což se může stát při přerušení zahřívání. Hadička alonže musí stále zasahovat těsně pod hladinu kapaliny v baňce. Ethylbromid tvořící spodní vrstvu oddělíme od vody v dělící nálevce a v suché baničce vysušíme bezvodým chloridem vápenatým. Po sušení se sušidla zbavíme filtrací (pozorethylbromid je rychle těkavá látka). Surový produkt předestilujeme z vodní lázně do suché předlohy chlazené zevně ledem. Použijeme destilační most s NZ 14 zábrusy. Zaznamenáme teplotu varu produktu, stanovíme výtěžek a změříme index lomu. Fyzikálně chemické vlastnosti: ethanol KBr Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] ethylbromid K úvaze: 1. Proč se při přípravě ethylbromidu přidává do reakčního prostředí led? 2. Jaké vedlejší produkty mohou vznikat při přípravě ethylbromidu? 3. Jakým mechanismem reakce probíhá a proč? 4. Proč je při přípravě ethylbromidu nutná přítomnost kyseliny sírové? 5. Proč se ethylbromid jímá pod hladinu vody obsahující ledovou tříšť? 4
5 Úloha 1a: Ethylbromid Příjmení a jméno: List :1/2 Mechanismus (schéma) reakce: Výpočty: Pozorování: Závěr: 5
6 Úloha 1b: terc-butylchlorid Příjmení a jméno: List :1/2 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup: V dělící nálevce o objemu 250 ml protřepáváme 30 minut směs 0,5 mol terc-butylalkoholu s 130 ml koncentrované kyseliny chlorovodíkové. Je-li terc-butylalkohol částečně zkrystalizovaný, je potřeba ho rozpustit rozehřátím na vodní lázni. Spodní vodnou vrstvu potom oddělíme a horní promýváme 10 % roztokem hydrogenuhličitanu sodného do neutrální reakce. Surový produkt vysušíme pevným chloridem vápenatým. Po sušení se sušidla zbavíme filtrací a surový produkt předestilujeme za použití aparatury s NZ 14 zábrusy. Sledujeme a zapisujeme teplotní průběh destilace. Změříme index lomu a stanovíme výtěžek. Fyzikálně chemické vlastnosti: Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] terc-butylalkohol HCl terc-butylchlorid K úvaze: 1. Jakým mechanismem tato reakce probíhá a proč? 2. Jaké by mohly vznikat vedlejší produkty? 3. Jak jinak by se dal nazvat produkt? 6
7 Úloha 1b: terc-butylchlorid Příjmení a jméno: List :2/2 Mechanismus (schéma) reakce: Výpočty: Pozorování: Závěr: 7
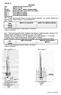
8 Úloha 2: Kyselina 3-fenylpropanová Příjmení a jméno: List :1/4 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup:! Student si přinese milimetrový papír velikosti A4! Kyselinu 3-fenylpropanovou připravíme hydrogenací kyseliny skořicové ve speciální aparatuře znázorněné na obrázku. 1. Provedeme aktivaci katalyzátoru (Raney-Ni).Vrchovatou malou lžičku katalyzátoru vložíme do Erlenmayerovy baňky a zalijeme ml ethanolu. Na plotýnkovém vařiči přivedeme k varu a velmi krátce povaříme. Při zahřívání směs pozorujeme a mícháme. Odděláme z vařiče a dekantujeme. Po dekantaci ke katalyzátoru opět přilijeme ethanol a celý postup aktivace opakujeme. Aktivaci provádíme nejméně 3x. 2. Aktivovaný dekantovaný katalyzátor pomocí ethanolu (asi 50 ml) vypláchneme s Erlenmayerovy baňky do suché hydrogenační nádobky (1), přidáme 0,02 mol suché rozpráškované kyseliny skořicové a vložíme teflonové míchadlo. 3. Pod hydrogenační nádobku (1) umístíme elektromagnetickou míchačku (2) pro pohon míchadla. 4. Kalibrované válcové nádobky (3), (4) a (5) naplníme po horní barevnou značku vodou z nádobky (6) na principu spojitých nádob. 5. Kohouty (7), (8) a (9) uzavřeme. 6. Kohoutem (10) spojíme hydrogenační aparaturu s atmosférou a hadici (11) umístíme ven z okna laboratoře. 7. Trojcestný kohout (12) nastavíme tak, abychom mohli z tlakové láhve zavádět vodík přes promývačku s roztokem manganistanu draselného (13) do hydrogenační aparatury. Vodík přivádíme do aparatury asi 5 minut za účelem jejího propláchnutí. 8. Potom omezíme přívod vodíku na minimum, uzavřeme kohout (10) a současně trojcestný kohout (12) nastavíme tak, aby vodík měl volný průchod do atmosféry (mimo hydrogenační aparaturu). 9. Nádobku (6) přemístíme do spodní polohy, otevřeme kohouty (7), (8), (9), zvětšíme přívod vodíku, který trojcestným kohoutem (12) zavádíme do hydrogenační aparatury tak dlouho, až vodík vytlačí vodu z nádobek (3), (4), (5) do nádobky (6). 10. Následně nastavením kohoutu (12) zamezíme přístupu vodíku do hydrogenační aparatury a přívod vodíku uzavřeme ventilem na tlakové láhvi. 11. Potom překontrolujeme správnost naplnění hydrogenační aparatury vodíkem tak, že při vyrovnaných hladinách v nádobce (6) a nádobkách (3), (4), (5) musí sahat hladina vody po značku odpovídající nule v nádobkách (3), (4), (5). Podle potřeby upustíme přebytečný vodík do atmosféry kohoutem (12). Pokračování na další straně! 8
9 Úloha 2: Kyselina 3-fenylpropanová Příjmení a jméno: List :2/4 12. Ihned uzavřeme kohouty (7) a (8), nádobku (6) přemístíme do horní polohy a překontrolujeme těsnost aparatury tak, že vyčkáme asi 10 minut. Jestliže se během této doby hladina vody v nádobce (5) nezmění, lze považovat aparaturu za dostatečně těsnou. 13. Reakční směs v nádobce začneme míchat a od tohoto okamžiku v časových intervalech 15 minut odečítáme spotřebu vodíku, a to vždy při vyrovnaných hladinách v nádobce (6) a v nádobce (5). 14. Jakmile voda naplní nádobku (5), uzavřeme kohout (9), otevřeme kohout (8) a začneme používat nádobku (4). Podobně můžeme využít i nádobku (3). 15. Hydrogenaci můžeme považovat za skončenou, jestliže v intervalu 15 minut již nedojde ke znatelné spotřebě vodíku. Sestrojíme křivku závislosti spotřeby vodíku (v mililitrech) na čase (v minutách), tzv. hydrogenační křivku. Po skončení hydrogenace zbavíme reakční směs suspenze katalyzátoru filtrací. Katalyzátor na filtračním papíru promyjeme navíc asi 15 ml teplého ethanolu. Filtrační papír propíchneme a použitý katalyzátor spláchneme ethanolem (nejlépe ze střičky) do lahvičky opatřené nápisem Použitý Raney- Ni. Je nutné zajistit, aby na filtračním papíru nezůstal Ra-Ni, který je po vyschnutí samozápalný! Z filtrátu odpaříme ethanol na rotační vakuové odparce. Po ochlazení vykrystaluje kyselina 3- fenylpropanová, kterou rekrystalujeme z vody pod zpětným chladičem za použití vhodného adsorbentu. (Pracujeme v digestoři!) Sušíme za laboratorní teploty v exikátoru. Stanovíme výtěžek a změříme teplotu tání. Příprava Raney-Ni Do 100 ml 25 % roztoku hydroxidu sodného vnášíme po malých dávkách jemně rozdrcenou Raneyovu slitinu (Ni-Al) za intenzivního míchání a chlazení. Nastává prudký vývin vodíku. Chlazením regulujeme přiměřený var reakční směsi. Po vnesení celého množství Raneyovy slitiny reakční směs zahříváme na vodní lázni pokud se nepřestane vyvíjet vodík. Pak necháme směs usadit, kapalinu opatrně odlijeme a zahřívání opakujeme ještě dvakrát vždy se 100 ml čerstvě připraveného 25 % hydroxidu sodného. Pak Raney-Ni promýváme destilovanou vodou tak dlouho až promývací voda nevykazuje alkalickou reakci na fenolftalein. Katalyzátor zbavíme vody promýváním ethanolem. Raney-Ni uchováváme pod bezvodým ethanolem. Poznámka: Tuto operaci nebudete provádět. Takto připravený Raney-Ni budete mít k dispozici v láhvi opatřené nápisem Raney-Ni. 9
10 Úloha 2: Kyselina 3-fenylpropanová Příjmení a jméno: List :3/4 Fyzikálně chemické vlastnosti: Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] kyselina skořicová kyselina 3-fenylpropanová K úvaze 1. Proč se musí aktivovaný Raney-Ni uchovávat pod ethanolem? 2. Katalytická hydrogenace je adiční reakce. Jedná se o adici cis nebo trans? 3. Kyselina skořicová může existovat ve formě dvou izomerů. O jaké izomery se jedná? 4. Daly by se pro hydrogenaci použít jiné katalyzátory? Jestliže ano, jaké? Mechanismus (schéma) reakce: Výpočty: 10
11 Úloha 2: Kyselina 3-fenylpropanová Příjmení a jméno: List :4/4 Pozorování: Závěr: 11
12 Úloha 3: Nitrace fenolu Příjmení a jméno: List :1/2 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup:! Práce v digestoři!! Práce v rukavicích! Do trojhrdlé baňky obsahu 250 ml opatřené mechanickým míchadlem, přikapávací nálevkou a teploměrem umístíme 0,26 mol 40 % kyseliny dusičné a za intenzivního míchání a chlazení ledem velmi pomalu přikapeme 0,11 mol fenolu. Fenol nejprve zkapalníme rozehřátím na vodní lázni a poté odvažujeme do kádinky, do které byly vpraveny cca 2 ml vody. Rovněž do přikapávací nálevky vstříkneme střičkou malé množství vody a poté teprve nalejeme odvážený fenol, jinak hrozí nebezpečí opětovného zatuhnutí fenolu přímo ve výpusti přikapávací nálevky. Teplota reakční směsi během přikapávání nesmí překročit 10 C. Po přidání fenolu pokračujeme v míchání ještě 30 minut za laboratorní teploty. Pak přidáme do nádobky s reakční směsí 50 ml vody, důkladně promícháme a po ustání směsi fenolů vodu opatrně slijeme. Promývání opakujeme stejným způsobem ještě čtyřikrát. o- Nitrofenol oddělíme destilací s vodní parou. Destilát řádně ochladíme. Krystaly produktu odsajeme a překrystalujeme z 50 % ethanolu za použití adsorbentu. Ke zbytku v destilační baňce přidáme aktivní uhlí, povaříme a zfiltrujeme. Po ochlazení vykrystaluje z filtrátu p-nitrofenol, který odsajeme a promyjeme studenou vodou. p-nitrofenol rekrystalujeme z 2 % kyseliny chlorovodíkové s přídavkem aktivního uhlí. Stanovíme teploty tání a výtěžek obou nitrofenolů. Fyzikálně chemické vlastnosti: Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] fenol kys. dusičná 40 % o-nitrofenol p-nitrofenol K úvaze: 1. Proč musíme při nitraci fenolu udržovat teplotu reakční směsi do 10 C? 2. Proč používá 40 % kyselina dusičná? 3. Proč těká s vodní parou o-nitrofenol a ne p-nitrofenol? 4. Dala by se použít na rozdělení obou nitrofenolů jiná metoda? Jestliže ano, jaká? 5. Jaký bude přibližně vzájemný poměr obou nitrofenolů? 12
13 Úloha 3: Nitrace fenolu Příjmení a jméno: List :2/2 Mechanismus (schéma) reakce: Výpočty: Pozorování: Závěr: 13
14 Úloha 4: Azobenzen Příjmení a jméno: List :1/3 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup: Práce v digestoři! Azobenzen připravíme elektrochemickou redukcí nitrobenzenu (schéma zapojení znázorněno na obrázku) ve speciálně upravené nádobce, která má katodový a anodový prostor oddělený diafragmou. Anodový prostor, do kterého zasahuje olověná elektroda, naplníme nasyceným roztokem uhličitanu sodného ve vodě, zahřátého na 100 C. V digestoři pod zpětným chladičem připravíme roztok obsahující 0,04 mol nitrobenzenu, 0,1 mol krystalického octanu sodného a 100 ml ethanolu o teplotě cca 70 C, který vpravíme do katodového prostoru, do kterého zasahuje niklová elektroda a celou aparaturu uzavřeme zpětným chladičem. Nyní připojíme celý systém ke zdroji stejnosměrného proudu (18-24 V). Na ampérmetru udržujeme intenzitu proudu na 8 A a reakci necháme probíhat po dobu 25 minut. Poté snížíme proud na 5 A a budeme jej na této hodnotě udržovat dalších 20 min. Katolyt následně umístíme do promývačky, zchladíme a poté roztokem intenzivně prosáváme vzduch alespoň po dobu 60 minut. Azobenzen z roztoku vysrážíme přidáním cca 100 ml destilované vody. Krystalky odsajeme, vysušíme při laboratorní teplotě a překrystalujeme z malého množství petroletheru (asi 20 ml) s použitím vhodného adsorbentu. Stanovíme výtěžek a změříme teplotu tání. Čistotu překrystalovaného produktu překontrolujeme chromatografií na Silufolu. Jako eluent použijeme směs ethyl-acetát : hexan v poměru 1:4. Vypočteme retenční faktor a chromatogram nalepíme do protokolu. Schéma zapojení: Pb Ni V A = 12 V Fyzikálně chemické vlastnosti: Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] nitrobenzen octan sodný- -krystalický azobenzen 14
15 Úloha 4: Azobenzen Příjmení a jméno: List :2/3 K úvaze: 1. Jaké jsou důvody prosávání vzduchu roztokem katolytu po skončení elektrochemické redukce? 2. Po delším stání na světle nebo po ozáření se může na chromatogramu objevit nová skvrna. Jaké látce patří? 3. Dal by se azobenzen připravit jiným způsobem? 4. K výměně kolika elektronů při této reakci dochází? Mechanismus (schéma) reakce: Výpočty: 15
16 Úloha 4: Azobenzen Příjmení a jméno: List :3/3 Pozorování: Závěr: 16
17 Úloha 5: Ethylenacetal ethylesteru 3-oxobutanové kyseliny Příjmení a jméno: List :1/2 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup: Do baňky obsahu 250 ml nalijeme 0,23 mol acetoctanu ethylnatého, 0,24 mol ethylenglykolu a přidáme 0,2 g monohydrátu kyseliny p-toluensulfonové a 100 ml toluenu. Baňku opatříme azeotropním nástavcem s chladičem a roztok refluxujeme tak dlouho, až se již v nástavci neoddělují žádné kapičky vody. Po ochlazení reakční směsi na laboratorní teplotu ji v dělící nálevce promyjeme 35 ml 10 % vodného roztoku hydroxidu sodného, dvakrát 50 ml vody a v baňce vysušíme bezvodým uhličitanem draselným. Po filtraci odpaříme na rotační vakuové odparce toluen a surový produkt vakuově předestilujeme. Sledujeme a zapisujeme teplotní průběh destilace. Stanovíme výtěžek a stanovíme index lomu u všech frakcí destilace. Fyzikálně chemické vlastnosti: Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] acetoctan ethylnatý ethylenglykol produkt (8 torr) K úvaze: 1. Jaký je rozdíl mezi vodní a olejovou vývěvou, které se používají jako zdroj vakua při vakuové destilaci? 2. Proč se do reakční směsi přidává kyselina p-toluensulfonová? 3. Proč se provádí azeotropní destilace? 4. Co je to vymrazovačka a k čemu slouží? 5. Proč se provádí vakuová destilace? 6. Jaký je důvod promývání reakční směsi po skončení reakce roztokem hydroxidu sodného? 17
18 Úloha 5: Ethylenacetal ethylesteru 3-oxobutanové kyseliny Příjmení a jméno: List :1/2 Mechanismus (schéma) reakce: Výpočty: Pozorování: Závěr: 18
19 Úloha 6a: Ethylenacetal 4,4-difenyl-4-hydroxybutan-2-on Příjmení a jméno: List :1/2 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup: A) FENYLMAGNESIUMBROMID Přípravu fenylmagnesiumbromidu (Grignardova činidla) uskutečníme v trojhrdlé baňce o objemu 250 ml opatřené zpětným chladičem, přikapávací nálevkou a míchadlem poháněným elektromagnetickou míchačkou. Celou aparaturu zajistíme chlorkalciovými uzávěry. Do baňky umístíme 0,1 mol hořčíkových hoblin, 15 ml suchého etheru a zrnko jodu. Přidáme asi 1/20 z celkového množství 0,1 mol brombenzenu, který jsme umístili do přikapávací nálevky (nemíchat!). Začátek reakce poznáme podle vzniku slabého zákalu, částečného odbarvení a zahřívání reakční směsi. Po zahájení reakce přidáváme za míchání roztok zbylého brombenzenu v 25 ml suchém etheru takovou rychlostí, aby ether mírně vřel. Je-li reakce příliš prudká, chladíme baňku zevně studenou vodou. Po přidání celého množství brombenzenu směs mícháme a zahříváme k mírnému varu až do úplného zreagování hořčíku. B) ETHYLENACETAL 4,4-DIFENYL-4-HYDROXYBUTAN-2-ON Roztok fenylmagnesiumbromidu (připraveného podle oddílu A) ochladíme a po kapkách k němu za stálého míchání přidáváme roztok 0,05 mol ethylenacetalu ethylesteru 3-oxobutanové kyseliny rozpuštěného v 25 ml bezvodého etheru. Po přidání veškerého ethylenacetalu směs v baňce ztuhne. Baňku sejmeme a v digestoři mícháme za chlazení vodou tyčinkou ještě asi 5 minut. Za chlazení a stálého míchání přidáváme po částech směs 50 ml vody a 50 g ledu. V baňce vytvoří dvě vrstvy. Horní (etherickou) odlijeme do dělící nálevky. Ke spodní (gelovité) přidáme 25 ml etheru a důkladně promícháme. Etherickou vrstvu přilijeme k prvnímu podílu v dělící nálevce. A znova stejným způsobem provedeme extrakci etherem. Spojené etherické extrakty promyjeme 50 ml vody a vysušíme bezvodým síranem sodným. Ether oddestilujeme na rotační vakuové odparce, baňku zevně řádně zchladíme a získaný pevný zbytek překrystalujeme z ethanolu za použití vhodného adsorbentu. Změříme teplotu tání a stanovíme výtěžek. Fyzikálně chemické vlastnosti: Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] brombenzen hořčík výchozí látka * produkt *ethylenacetal ethylester 3-oxobutanové kyseliny 19
20 Úloha 6a: Ethylenacetal 4,4-difenyl-4-hydroxybutan-2-on Příjmení a jméno: List :2/2 Mechanismus (schéma) reakce: Výpočty: Pozorování: Závěr: 20
21 Úloha 6b: 4,4-Difenyl-4-hydroxybutan-2-on Příjmení a jméno: List :1/2 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup: 0,004 mol produktu z předchozí úlohy (ethylenacetal 4,4-difenyl-4-hydroxybutan-2-on) navážíme do baňky o obsahu 100 ml, přidáme 25 ml směsi tvořené 1 ml 1M kyseliny chlorovodíkové, 5 ml vody a 50 ml acetonu (směs máš připravenou). Na baňku nasadíme zpětný chladič a refluxujeme 15 minut. Po ochlazení nalijeme obsah baňky do směsi 10 ml nasyceného roztoku hydrogenuhličitanu sodného a 10 ml vody. Produkt extrahujeme třikrát 20 ml etheru. Spojené etherické extrakty promyjeme 30 ml vody. Po vysušení bezvodým chloridem vápenatým odpaříme rozpouštědlo na rotační vakuové odparce. Surový produkt rekrystalujeme z petroletheru za použití vhodného absorbentu. Změříme teplotu tání a stanovíme výtěžek. Fyzikálně chemické vlastnosti: Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] výchozí látka* produkt *Ethylenacetal 4,4-difenyl-4-hydroxybutan-2-on K úvaze: 1. Proč se příprava 4,4-difenyl-4-hydroxybutan-2-onu z acetoctanu ethylnatého provádí přes stadium ethylenacetalu? 21
22 Úloha 6b: 4,4-Difenyl-4-hydroxybutan-2-on Příjmení a jméno: List :2/2 Mechanismus (schéma) reakce: Výpočty: Pozorování: Závěr: 22
23 Úloha 7: 3-Nitroacetofenon Příjmení a jméno: List :1/2 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup: Do trojhrdlé baňky o objemu 500 ml (nebo 250 ml) opatřené mechanickým míchadlem, přikapávací nálevkou a teploměrem, který zasahuje do reakční směsi, nalijeme 37 ml koncentrované kyseliny sírové. Spustíme míchadlo, baňku ochladíme (chladící směs: ethanol-suchý led) až teplota kyseliny v baňce klesne na 0 C. Potom opatrně přikapeme 0,125 mol acetofenonu tak, aby teplota v baňce, během přikapávání, nepřestoupila 5 C. Pak směs ochladíme na -7 C a přidáváme ochlazenou nitrační směs (0-5 C) tvořenou 15 ml koncentrované kyseliny sírové a 10 ml koncentrované kyseliny dusičné takovou rychlostí, aby celá operace netrvala déle než 30 minut a teplota reakční směsi se pohybovala v rozmezí -5 až 0 C. Po přidání nitrační směsi mícháme, za stálého chlazení, ještě 10 minut. Pak směs za míchání tyčinkou nalijeme na ledovou tříšť tvořenou 165 g ledu a 375 ml vody. Produkt se mícháním srazí jako žlutý maz až tuhá látka. Jakmile led roztaje, nitrosloučeninu odsajeme a na filtru zbavíme vody vytlačením skleněnou zátkou. Po přenesení do kádinky ji propláchneme dvakrát 75 ml vody a potom rozmícháme v 8 ml ethanolu. Po každém z těchto tří promývání produkt odsajeme a dokonale vytlačíme skleněnou zátkou. Potom jej rekrystalujeme z 25 až 35 ml ethanolu s přídavkem aktivního uhlí. Teplý roztok za horka zfiltrujeme do 250 ml studené vody za intenzivního míchání skleněnou tyčinkou. Po několika minutách stání produkt odsajeme, promyjeme 50 ml studené vody a co nejvíce vymačkáme do sucha. Druhou rekrystalizaci provedeme asi z 30 ml ethanolu za použití aktivního uhlí. Vyloučené žluté krystaly odsajeme a sušíme na vzduchu. Stanovíme výtěžek a změříme teplotu tání. Čistotu produktu můžeme ověřit infračervenou spektroskopií. Fyzikálně chemické vlastnosti: Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] acetofenon 3-nitroacetofenon K úvaze: 1. Proč se při přípravě 3-nitroacetofenonu musí reakční směs chladit? 2. Proč dochází k substituci do polohy meta? 3. Proč se acetofenon nejprve přikape ke kyselině sírové až a potom se přidává nitrační směs? 23
24 Úloha 7: 3-Nitroacetofenon Příjmení a jméno: List :2/2 Mechanismus (schéma) reakce: Výpočty: Pozorování: Závěr: 24
25 Úloha 8a: 1-(3-Nitrofenyl)ethanol Příjmení a jméno: List :1/2 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup: Ve 250 ml baňce opatřené zpětným chladičem rozpustíme 0,013 mol 3-nitroacetofenonu v 30 ml methanolu a zahřejeme topným hnízdem tak, aby se veškerý 3-nitroacetofenon rozpustil. Potom roztok ochladíme zevně ledovou lázní. K suspenzi pomalu přidáme 0,016 mol tetrahydridoboritanu sodného a vzniklou směs občas protřepáváme po dobu 15 minut. Pak přilijeme 20 ml destilované vody a směs povaříme 30 minut pod zpětným chladičem. Ochlazenou reakční směs extrahujeme dvakrát 30 ml etheru a spojené etherické extrakty důkladně vysušíme bezvodým síranem sodným. Ether oddestilujeme na rotační vakuové odparce. Zbylý nahnědlý olej po ochlazení zkrystaluje. Produkt rekrystalujeme z toluenu s vhodným adsorbentem. Stanovíme výtěžek a změříme teplotu tání. Čistotu produktu můžeme ověřit infračervenou spektroskopií a porovnat se spektry výchozí látky. Fyzikálně chemické vlastnosti: Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] 3-nitroacetofenon Na[BH 4 ] 1-(3-nitrofenyl)- ethanol 62 K úvaze: 1. Proč po skončení reakce vaříme reakční směs s vodou? 25
26 Úloha 8a: 1-(3-Nitrofenyl)ethanol Příjmení a jméno: List :2/2 Mechanismus (schéma) reakce: Výpočty: Pozorování: Závěr: 26
27 Úloha 8b: 3-Aminoacetofenon Příjmení a jméno: List :1/2 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup: V baňce NZ 29 o objemu 100ml s rovným dnem opatřené zpětným chladičem smícháme 0,013 mol 3- nitroacetofenonu a 0,034 mol jemně granulovaného cínu, přidáme směs 29 ml vody a 11 ml koncentrované kyseliny chlorovodíkové. Refluxujeme na elektromagnetické míchačce za stálého míchání po dobu 90 minut. Ochlazenou reakční směs zfiltrujeme a k filtrátu za míchání a chlazení v ledové lázni přidáme 24 ml 40 % hydroxidu sodného. Vyloučenou sraženinu odsajeme, promyjeme studenou vodou a překrystalujeme z cca 80 ml vody za přídavku aktivního uhlí. Stanovíme výtěžek produktu a změříme jeho teplotu tání. Čistotu produktu můžeme ověřit infračervenou spektroskopií a porovnat se spektry výchozí látky. Fyzikálně chemické vlastnosti: Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] 3-nitroacetofenon cín 3-aminoacetofenon K úvaze: 1. Která látka v reakční směsi redukuje nitroskupinu na aminoskupinu? 2. K výměně kolika elektronů při této reakci dochází? 27
28 Úloha 8b: 3-Aminoacetofenon Příjmení a jméno: List :2/2 Mechanismus (schéma) reakce: Výpočty: Pozorování: Závěr: 28
29 Úloha 9: Pinakol Příjmení a jméno: List :1/2 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup: Do baňky objemu 250 ml opatřené přikapávací nálevkou, chladičem a chlorkalciovým uzávěrem nasypeme 0,08 mol hořčíkových hoblin a přilijeme 20 ml suchého toluenu. Přikapáváme roztok 0,0075 mol chloridu rtuťnatého v 0,175 mol suchého acetonu. Jakmile začne nabíhat reakce, přidávání zrychlíme a rychlostí přikapávání řídíme průběh reakce. Až pomine bouřlivá fáze reakce (nemusí nastat), přidáme do reakční směsi roztok 0,085 mol suchého acetonu v 5 ml suchého toluenu. V případě, že se reakce zpomalí, baňku zahříváme topným hnízdem do zreagování veškerého hořčíku (operace trvá celkem asi 60 minut). Tvoří se přitom pevný meziprodukt, který zaplní asi 1/2 objemu baňky. Po zreagování hořčíku sejmeme chladič a přikapávací nálevku, baňkou silně protřepeme, aby se obsah rozdrobil. Potom opět nasadíme chladič a baňku zahříváme 30 minut. K reakční směsi potom přikapeme 0,30 molu vody a vaříme dalších 30 minut. Po ochlazení na 50 C směs zfiltrujeme tak, aby pevná fáze zůstala v baňce (filtrovat v digestoři!). Ke zbylému tuhému zbytku v baňce přidáme 25 ml toluenu, povaříme 10 minut a opět zfiltrujeme. Oba filtráty spojíme. Filtrát zahustíme na rotační vakuové odparce na poloviční objem. K filtrátu přidáme 0,85 mol vody a necháme 20 minut krystalovat v mrazícím boxu. Vyloučený hexahydrát pinakolu odsajeme, promyjeme toluenem a sušíme při laboratorní teplotě v digestoři. Změříme teplotu tání a stanovíme výtěžek. Fyzikálně chemické vlastnosti: hořčík HgCl 2 Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] aceton hexahydrát pinakolu K úvaze: 1. Proč přidáváme ke směsi chlorid rtuťnatý? 2. Jak zní systematický název pro pinakol? 3. Proč se reakce provádí za vyloučení vzdušné vlhkosti? 4. K výměně kolika elektronů při této reakci dochází? 29
30 Úloha 9: Pinakol Příjmení a jméno: List :1/2 Mechanismus (schéma) reakce: Výpočty: Pozorování: Závěr: 30
31 Úloha 10: Kyselina benzoová Příjmení a jméno: List :1/3 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup: A) FENYLMAGNESIUMBROMID Přípravu fenylmagnesiumbromidu (Grignardova činidla) uskutečníme v trojhrdlé baňce o objemu 250 ml opatřené zpětným chladičem, přikapávací nálevkou a míchadlem poháněným elektromagnetickou míchačkou. Celá aparatura je opatřena chlorkalciovými uzávěry. Do baňky umístíme 0,05 mol hořčíkových hoblin, 13 ml suchého etheru a zrnko jodu. Do přikapávací nálevky nalijeme 0,05 mol brombenzenu a z tohoto množství do reakční směsi přikápneme asi 1/20 brombenzenu. Počkáme až se nastartuje reakce (nemíchat!). Začátek reakce poznáme podle vzniku slabého zákalu, částečného odbarvení a zahřívání reakční směsi. Po zahájení reakce přidáváme za míchání roztok zbylého brombenzenu, ke kterému jsme přidali 20 ml suchého etheru takovou rychlostí, aby ether mírně vřel. Je-li reakce příliš prudká, chladíme baňku zevně studenou vodou. Po přidání celého množství brombenzenu směs mícháme a zahříváme k mírnému varu až do úplného zreagování hořčíku. B) KYSELINA BENZOOVÁ!Práce v digestoři! Do kádinky s 1 mol jemně rozdrceného pevného oxidu uhličitého (suchého ledu) přilijeme za míchání etherický roztok fenylmagnesiumbromidu připraveného podle oddílu A). Až se většina suchého ledu odpaří, přidáme 100 g ledu a 30 ml zředěné (1:1) kyseliny chlorovodíkové. Za míchání tyčinkou vyčkáme, až se led rozpustí. Takto připravenou směs protřepáváme v dělící nálevce nejprve etherem (dvakrát po 20 ml etheru). Etherické extrakty spojíme a opět v dělící nálevce je promyjeme nejdříve dvakrát 20 ml vody (vodu odstraníme) a nakonec dvakrát 50 ml 5 % vodného roztoku hydroxidu sodného. Spojené vodné alkalické extrakty povaříme v kádince krátce s aktivním uhlím, zfiltrujeme a ochlazený filtrát okyselíme koncentrovanou kyselinou chlorovodíkovou. Vyloučenou kyselinu benzoovou odsajeme, ještě přímo na filtru dokonale promyjeme vodou a vysušíme při 50 C ve vakuové sušárně. Stanovíme výtěžek a změříme teplotu tání. Fyzikálně chemické vlastnosti: Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] brombenzen hořčík oxid uhličitý kyselina benzoová K úvaze 1. Proč se příprava Grignardova činidla provádí za vyloučení vzdušné vlhkosti? 2. Co by se stalo, jestliže by se do reakčního prostředí dostala voda před započetím a jestliže po skončení reakce? 3. V čem spočívá aktivace počátku reakce jodem (bromem)? 4. Dalo by se na přípravu Grignardova činidla použít jiné rozpouštědlo než diethylether? Které? 5. Jaký vliv bude mít na průběh reakce použití plynného oxidu uhličitého místo pevného? 6. Co se stane po protřepání etherického roztoku kyseliny benzoové s vodným roztokem hydroxidu sodného? 31
32 Úloha 10: Kyselina benzoová Příjmení a jméno: List :2/3 Mechanismus (schéma) reakce: Výpočty: Pozorování: Závěr: 32
33 Úloha 11: Kyselina anthranilová Příjmení a jméno: List :1/2 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup:! Práce v digestoři!!dodržuj zásady práce s bromem! V kádince o objemu 150 ml rozpustíme 14 g hydroxidu sodného v 80 ml destilované vody a ochladíme v lázni z acetonu nebo ethanolu a suchého ledu až na teplotu -5 až 0 C. Potom za stálého míchání přidáváme 3,6 ml bromu po kapkách přímo z odměrného válce. Rychlost přikapávání volíme tak, aby se jednotlivé kapky stačily rozpustit a aby teplota směsi stále zůstávala v rozmezí 0-5 C. V míchání pokračujeme dokud se veškerý brom nerozpustí. Mezitím si v kádince o obsahu 150 ml připravíme suspenzi 10 g ftalimidu v 15 ml destilované vody. Kádinku se suspenzí vložíme do chladící lázně a k suspenzi opatrně přidáváme za stálého míchání roztok prve připravený rozpuštěním bromu ve vodném roztoku hydroxidu sodného. Reakční směs ponecháme v chladící lázni za stálého míchání ještě 20 minut po rozpuštění suspenze ftalimidu. Potom kádinku z lázně odstraníme a v příležitostném míchání pokračujeme, dokud reakční směs nedosáhne teploty laboratoře. Dále reakční směs zvolna ohřejeme na 80 C a přidáme 8 g hydroxidu sodného rozdrceného v předehřáté třecí misce. Horký roztok zfiltrujeme do kádinky o obsahu 400 ml. Po ochlazení filtrát opatrně zneutralizujeme koncentrovanou kyselinou chlorovodíkovou na ph 7. Průběh neutralizace sledujeme ph papírkem. Kyselinu anthranilovou vyloučíme z roztoku opatrným přidáním 10 ml ledové kyseliny octové za intenzivního míchání. Produkt odsajeme, promyjeme malým množstvím ledové vody a překrystalujeme z vody za použití aktivního uhlí. Změříme teplotu tání a stanovíme výtěžek. Fyzikálně chemické vlastnosti: Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] ftalimid brom kyselina anthranilová K úvaze: 1. Hofmannovu odbourávání amidů podléhají pouze primární amidy karboxylových kyselin. Je odbourávání ftalimidu výjimkou? 2. Proč se k vyloučení kyseliny anthranilové používá kyselina octová a nikoli chlorovodíková? 3. Jaký plyn se uvolňuje při přípravě kyseliny anthranilové? 4. Co znamená pojem ledová kyselina octová? 33
34 Úloha 11: Kyselina anthranilová Příjmení a jméno: List :2/2 Mechanismus (schéma) reakce: Výpočty: Pozorování: Závěr: 34
35 Úloha 12: Ethyl-acetát Příjmení a jméno: List :1/2 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup: Do baňky o obsahu 100 ml nalijeme 0,1 mol ethanolu a 6 ml koncentrované kyseliny sírové. Baňku ponoříme do olejové lázně a postavíme aparaturu na přípravu ethylacetátu (viz aparatury). Lázeň začneme vyhřívat na 140 C. Mezitím si připravíme esterifikační směs složenou z 0,9 mol ethanolu a 1 mol kyseliny octové. Z dělící nálevky, jejíž konec zasahuje pod hladinu kapaliny v baňce, potom přes Claisenův nástavec přidáme jednorázově 5 ml této směsi a zbytek esterifikační směsi přidáváme tak rychle, jak rychle destiluje vznikající ester. Surový ester protřepeme třikrát 20 ml 15 % roztokem uhličitanu sodného, až se již neuvolňují bublinky plynu (pozor-zpočátku se uvolňuje velké množství plynu CO 2 ). Pak následuje protřepání produktu s 20 ml nasyceného roztoku chloridu vápenatého a vysušení bezvodým chloridem vápenatým. Surový produkt předestilujeme za použití aparatury s NZ 14 zábrusy. Sledujeme a zapisujeme teplotní průběh destilace. Stanovíme výtěžek a změříme index lomu. Fyzikálně chemické vlastnosti: ethanol kyselina octová ethyl-acetát K úvaze: Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] 1. Proč promýváme surový ester nejprve roztokem uhličitanu sodného, potom nasyceným roztokem chloridu vápenatého? 2. Proč se esterifikační směs musí do reakční baňky přikapávat? 3. Jaký účel má vydestilovávání vzniklého esteru z reakční směsi? 35
36 Úloha 12: Ethyl-acetát Příjmení a jméno: List :2/2 Mechanismus (schéma) reakce: Výpočty: Pozorování: Závěr: 36
37 Úloha 13: 2-Hydroxy-5-methyl-2 -nitroazobenzen Příjmení a jméno: List :1/2 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup: V kádince o objemu 250 ml smísíme 0,02 mol hydroxidu sodného, 0,1 mol uhličitanu sodného, 0,02 mol p-kresolu a 60 ml vody, směs zahříváme (nevařit!) a mícháme v digestoři. Vzniklý roztok potom ochladíme na 0 C. V další kádince o objemu 100 ml si připravíme roztok diazoniové soli. 0,02 mol o-nitroanilinu důkladně rozmícháme s 5,4 ml kyseliny chlorovodíkové a přidáme 10 g ledu. Pak pomalu za míchání přilijeme ochlazený roztok ( 0-5 C ) 1,5 g dusitanu sodného v 5 ml vody, který jsme připravili v další kádince o objemu 50 ml. Za občasného promíchávání ponecháme stát 15 minut, přičemž kontrolujeme teplotu, aby se pohybovala v rozmezí 0 až 5 C. Takto připravenou diazonivou sůl potom zfiltrujeme přímo do již dříve připraveného roztoku p-kresolátu sodného ochlazeného na teplotu nižší než 10 C. Filtrační nálevku předchladíme v ledové drti. Teplotu diazoniové soli během filtrace udržujeme stále v rozmezí 0 až 5 C tak, že přímo na filtr ve filtrační nálevce přidáváme kousky ledu.během filtrace filtrát neustále intenzivně mícháme Po přikapání diazoniové soli necháme temně fialovou suspenzi azobarviva stát za laboratorní teploty za občasného míchání. Konec reakce je možné poznat podle toho, že matečný louh, ve kterém plavou shluky barviva, je čirý. Barvivo odsajeme, důkladně promyjeme vodou a rekrystalujeme z ethanolu za použití aktivního uhlí. Čistotu produktu ověříme tenkovrstvou chromatografií na Silufolu. Vyvíjecí soustava je tvořena směsí ethyl-acetát - hexan v poměru 1 : 4. Vypočítáme retenční faktor a chromatogram nalepíme do protokolu. Stanovíme výtěžek a změříme teplotu tání. Fyzikálně chemické vlastnosti: Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] hydroxid sodný uhličitan sodný p-kresolu o-nitroanilinu dusitan sodný produkt 121 K úvaze: 1. Do jaké skupiny reakcí by jste zařadili diazotaci? 2. Proč provádíme kopulaci v alkalickém prostředí? 3. Proč do kopulačního prostředí přidáváme uhličitan sodný? 4. Do jaké skupiny reakcí by jste kopulaci zařadili? 5. Proč musíme při přípravě diazoniové soli udržovat teplotu v rozmezí 0 až 5 C? 37
38 Úloha 13: 2-Hydroxy-5-methyl-2 -nitroazobenzen Příjmení a jméno: List :2/2 Mechanismus (schéma) reakce: Výpočty: Pozorování: Závěr: 38
39 Úloha 14: 2-(2-Hydroxy-5-methylfenyl)benzotriazol Příjmení a jméno: List :1/2 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup A Ve 150 ml 5% roztoku hydroxidu sodného rozsuspendujeme za míchání 0,01 mol 2-hydroxy-5- methyl-2 -nitroazobenzenu. K připravené suspenzi přidáme po částech za míchání během 20 minut 0,05 mol dithioničitanu sodného. Po přidání veškerého množství dithioničitanu pomalu zahřejeme reakční směs k varu a 1 hodinu refluxujeme. Obsah baňky potom za horka zfiltrujeme s aktivním uhlím, filtrát ochladíme na laboratorní teplotu a nasytíme plynným oxidem uhličitým z tlakové lahve. Vyloučený produkt odsajeme, dobře promyjeme vodou vysušíme při 95 C a rekrystalujeme z toluenu. Změříme teplotu tání získaného produktu a stanovíme výtěžek. Postup B 13 gramů kvasnic rozmícháme v 50 ml vlažné destilované vody. K suspenzi přidáme lžičku sacharosy a ponecháme stát 15 až 25 minut, aby se kvasinky oživily. Mezitím rozpustíme 1,2 g 2- hydroxy-5-methyl-2 -nitroazobenzenu spolu s 1 g hydroxidu sodného v 60 ml ethanolu za mírného zahřátí na teplotu 50 C. K takto získanému roztoku pak přilijeme suspenzi kvasnic. Necháme míchat za laboratorní teploty 30 až 45 minut. Potom reakční směs zahřejeme na 80 C a v míchání pokračujeme 2 až 3 hodiny, dokud se zbarvení reakční směsi nezmění z červené na hnědou. Suspenzi pak necháme usadit a zfiltrujeme ji na fritě přes mořský písek. Filtrát ještě přefiltrujeme přes filtrační papír, okyselíme zředěnou (1 : 1) kyselinou chlorovodíkovou a opět přefiltrujeme přes skládaný filtr. Vzniklou směs extrahujeme ethyl-acetátem. Po rozdělení emulze organickou vrstvu vysušíme bezvodým síranem sodným. Roztok zahustíme na rotační vakuové odparce. Po ochlazení vyloučený žlutý produkt odsajeme na filtrační jehle a rekrystalujeme z toluenu. Fyzikálně chemické vlastnosti: Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] výchozí látka dithioničitan sodný produkt výchozí látka produkt K úvaze: 1. Proč sytíme reakční směs po skončení reakce oxidem uhličitým? 39
40 Úloha 14: 2-(2-Hydroxy-5-methylfenyl)benzotriazol Příjmení a jméno: List :2/2 Mechanismus (schéma) reakce: Výpočty: Pozorování: Závěr: 40
41 Úloha 15: Kyselina 2-chlorbenzoová Příjmení a jméno: List :1/2 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup: V kádince 400 ml smísíme 0,025 mol kyseliny anthranilové se 7 ml koncentrované kyseliny chlorovodíkové a rozmícháme. Pak přidáme 20 gramů ledu. Jakmile klesne teplota pod 3 C, začneme přikapávat ochlazený roztok (0-5 C ) 0,025 mol dusitanu sodného v 5 ml destilované vody. Směs neustále promícháváme a teplotu udržujeme v rozmezí 0 až 5 C. Průběh tvorby diazoniové soli indikujeme jodidoškrobovým papírkem v intervalu asi 20 min.. Dále si připravíme roztok 0,025 mol chloridu měďného v 15 ml koncentrované kyseliny chlorovodíkové. Roztok ochladíme na teplotu 0 C a pomalu za intenzivního míchání jej opatrně přilijeme k roztoku diazoniové soli v kádince o objemu 400 ml. Reakce probíhá velmi intenzivně a směs silně pění. Reakční směs potom necháme stát 1 hodinu za občasného promíchání. Vyloučenou kyselinu 2-chlorbenzoovou odsajeme, promyjeme malým množstvím studené vody a překrystalujeme ze směsi voda - ethanol v poměru 2 : 1 za přídavku aktivního uhlí. Stanovíme výtěžek a změříme teplotu tání. Fyzikálně chemické vlastnosti: Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] kyselina anthranilová dusitan sodný chlorid měďný Cu 2 Cl 2 k. 2-chlorbenzoová K úvaze: 1. Proč musíme při přípravě diazoniové soli udržovat teplotu v rozmezí 0 až 5 C? 2. Do jaké skupiny reakcí byste přípravu kyseliny 2-chlorbenzoové zařadili? 3. Co je principem indikace konce reakce jodidoškrobovým papírkem? 4. Jaký plyn se uvolňuje při přípravě kyseliny 2-chlorbenzoové? 41
42 Úloha 15: Kyselina 2-chlorbenzoová Příjmení a jméno: List :2/2 Mechanismus (schéma) reakce: Výpočty: Pozorování: Závěr: 42
43 Úloha 16: Aminolýza 1-chlor-2,4-dinitrobenzenu Příjmení a jméno: List :1/2 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup: K 0,0075 mol 1-chlor-2,4-dinitrobenzenu přidáme 20 ml ethanolu a 0,015 mol aromatického aminu. Reakci provedeme s anilinem a anisidinem. Reakční směs refluxujeme na vodní lázni po dobu 15 minut, potom směs ochladíme, vyloučený surový produkt odsajeme a rekrystalujeme z ethanolu za použití aktivního uhlí. O čistotě obou produktů se přesvědčíme chromatografií na tenké vrstvě na materiálu Silufol. Malé množství obou produktů odděleně rozpustíme v acetonu na kapkovací destičce a kapilárou naneseme na kraje chromatografické destičky, doprostřed dáme směsný vzorek obou aminů. K vyvíjení použijeme směs ethyl-acetát hexan v poměru 1 : 4. Vypočítáme hodnoty RF, chromatogram nalepíme do protokolu. Stanovíme výtěžky a změříme teploty tání. Do závěru uveďte správné názvy obou produktů. Fyzikálně chemické vlastnosti: Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] anilin p-anisidin 1-chlor- -2,4-dinitrobenzen produkt reakce s anilinem 156 produkt reakce s p-anisidinem 142 K úvaze: 1. Do jaké skupiny reakcí byste zařadili aminolýzu? 2. Který z použitých aminů bude v tomto případě reaktivnější a proč? 3. Jak byste správně nazvali vzniklé produkty? 4. Co je to retenční faktor (RF)? 43
44 Úloha 16: Aminolýza 1-chlor-2,4-dinitrobenzenu Příjmení a jméno: List :2/2 Mechanismus (schéma) reakce: Výpočty: Pozorování: Závěr: 44
45 Úloha 17a: Extrakce rostlinných barviv na Soxhletově extraktoru Příjmení a jméno: List :1/2 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup: V mixéru rozmělníme 10 g čerstvého zeleného rostlinného materiálu, přidáme 1 g práškovitého uhličitanu vápenatého a jemně rozetřenou hmotu napěchujeme do extrakční patrony. Patronu umístíme do Soxhletova extraktoru. Do baňky o obsahu 250 ml nalijeme 150 ml acetonu, přidáme varné kamínky a extrahujeme po dobu asi 2 hodin. Acetonový extrakt potom pečlivě vysušíme bezvodým síranem sodným, sušidlo odfiltrujeme a filtrát zahustíme na rotační vakuové odparce na poloviční objem. Extrakt naneseme kapilárou na silufolovou desku tak, že vytvoříme na startu silufolu souvislou vodorovnou čáru. Vzorek alespoň 2x převrstvíme. Chromatogram vyvineme ve směsi petrolether isopropylalkohol voda v poměru 100 : 10 : 0,25. Při dobrém rozdělení je na chromatogramu vidět sedm barevných čar. Chromatogram nalepíme do protokolu do sekce pozorování. β karoten feofytin chlorofyl α chlorofyl β lutein violaxanthin neoxanthin start K úvaze: 1. Jak lze poznat, že extrakce je již skončená? 45
46 Úloha 17a: Extrakce rostlinných barviv na Soxhletově extraktoru Příjmení a jméno: List :2/2 Pozorování: Závěr: 46
47 Úloha 17b: Izolace trimyristinu z muškátového oříšku Příjmení a jméno: List :1/2 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup: Do baňky o obsahu 100 ml nasypeme 4 g mletého muškátového oříšku, přidáme 20 ml ethanolu, opatříme zpětným chladičem a 60 minut refluxujeme. Vyextrahovaný trimyristin oddělíme od ostatních pevných zbytků filtrací za sníženého tlaku (odsáváním). Filtraci provádíme na horké aparatuře, protože trimyristin z chladného ethanolu vykrystalizovává. Rozpouštědlo odpaříme na rotační vakuové odparce, zbytek za horka pod chladičem rozpustíme v 5 ml acetonu. Směs nesmí vařit a stěny baňky se nesmí dotýkat zahřívacího média. Roztok necháme pomalu ochladit na teplotu laboratoře a pak ho ponoříme do ledové tříště. Produkt odsajeme a sušíme při laboratorní teplotě. Zvážíme a stanovíme teplotu tání. Trimyristin existuje ve třech polymorfních formách. Fyzikálně chemické vlastnosti: Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] nestálá forma produktu 32,1 nestálá forma produktu 41,8 stálá forma produktu 56,5 47
48 Úloha 17b: Izolace trimyristinu z muškátového oříšku Příjmení a jméno: List :2/2 Pozorování: Závěr: 48
49 Úloha 18: 1,2,3,4,6-Penta-O-acetyl-β-D-glukopyranosa Příjmení a jméno: List :1/2 Datum práce: Hodnotil: Hodnocení: A B C D E F Poznámky: Postup: Do dvouhrdlé baňky o obsahu 100 ml vpravíme teflonové míchadlo, 0,04 mol taveného octanu sodného a 25 ml acetanhydridu. Ihned začneme míchat míchadélkem, poháněným elektromagnetickou míchačkou. Připravenou reakční směs zahřejeme na teplotu 70 o C. Hned přidáme 0,03 mol glukosy a zahříváme pod zpětným chladičem za stálého míchání po dobu 1 hodiny. Teplotu reakční směsi udržujeme na 100 o C. Z počátku je reakce velmi exotermická, a proto je třeba pečlivě sledovat teplotu a včas zabránit přehřátí reakční směsi. Poté směs nalijeme na ledovou tříšť tvořenou 100 g ledu a 50 g vody a látku necháme vykrystalovat. Po rozpuštění ledu surový produkt odsajeme, promyjeme 25 ml vody a důkladně zbavíme vody. Rekrystalujeme ze 100 ml cca 60 % ethanolu s použitím aktivního uhlí a po důkladném odsátí sušíme ve vakuové sušárně. Stanovíme výtěžek a teplotu tání. Fyzikálně chemické vlastnosti: Látka Fyzikální vlastnosti Navážky Název Vzorec M r T t [ºC] T v [ºC] ρ 20 [g/cm 3 ] n D 20 m [g] V[cm 3 ] octan sodný acetanhydrid glukosa produkt
50 Úloha 18: 1,2,3,4,6-Penta-O-acetyl-β-D-glukopyranosa Příjmení a jméno: List :2/2 Mechanismus (schéma) reakce: Výpočty: Pozorování: Závěr: 50
51 51
C3070 Organická chemie - laboratorní cvičení molekulární biologie
 Seznam úloh předmětu: C3070 Organická chemie - laboratorní cvičení molekulární biologie 3) Nitrace fenolu 5) Ethylenacetal ethylesteru 3-oxobutanové kyseliny 10) Kyselina benzoová 11) Kyselina anthranilová
Seznam úloh předmětu: C3070 Organická chemie - laboratorní cvičení molekulární biologie 3) Nitrace fenolu 5) Ethylenacetal ethylesteru 3-oxobutanové kyseliny 10) Kyselina benzoová 11) Kyselina anthranilová
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 10 Bílkoviny Pro potřeby projektu
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 10 Bílkoviny Pro potřeby projektu
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 8 Sacharidy Pro potřeby projektu
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 8 Sacharidy Pro potřeby projektu
UHLOVODÍKY A HALOGENDERIVÁTY
 LABORATORNÍ PRÁCE Č. 25 UHLOVODÍKY A HALOGENDERIVÁTY PRINCIP Uhlovodíky jsou nejjednodušší organické sloučeniny, jejichž molekuly jsou tvořeny pouze uhlíkem a vodíkem. Uhlovodíky klasifikujeme z několika
LABORATORNÍ PRÁCE Č. 25 UHLOVODÍKY A HALOGENDERIVÁTY PRINCIP Uhlovodíky jsou nejjednodušší organické sloučeniny, jejichž molekuly jsou tvořeny pouze uhlíkem a vodíkem. Uhlovodíky klasifikujeme z několika
OKRUH 7 Karboxylové kyseliny
 OKRUH 7 Karboxylové kyseliny Pro karboxylové kyseliny je charakteristická přítomnost jedné nebo více karboxylových skupin Monokarboxylové kyseliny Příprava kyseliny mravenčí z chloroformu a její důkaz
OKRUH 7 Karboxylové kyseliny Pro karboxylové kyseliny je charakteristická přítomnost jedné nebo více karboxylových skupin Monokarboxylové kyseliny Příprava kyseliny mravenčí z chloroformu a její důkaz
Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii
 Datum: Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii Tlak vzduchu: Teplota vzduchu: Laboratorní cvičení č. Oddělování složek směsí
Datum: Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii Tlak vzduchu: Teplota vzduchu: Laboratorní cvičení č. Oddělování složek směsí
RCOOR + H 2 O. Inovace bakalářského studijního oboru Aplikovaná chemie CZ.1.07/2.2.00/ Esterifikace
 Esterifikace Estery jsou funkční deriváty karboxylových kyselin. Připravují se reakcí karboxylových kyselin s alkoholy nebo s fenoly. RCOOH+ HOR RCOOR + H 2 O K přípravě esterů je vhodné použít vyšší alifatické
Esterifikace Estery jsou funkční deriváty karboxylových kyselin. Připravují se reakcí karboxylových kyselin s alkoholy nebo s fenoly. RCOOH+ HOR RCOOR + H 2 O K přípravě esterů je vhodné použít vyšší alifatické
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 9 Lipidy Pro potřeby projektu
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 9 Lipidy Pro potřeby projektu
Návod k laboratornímu cvičení. Fenoly
 Návod k laboratornímu cvičení Fenoly Úkol č. 1: Příprava fenolátu sodného Pomůcky: váhy, kádinka, zkumavky Chemikálie: 10% roztok hydroxidu sodného NaOH (C), 5%roztok kyseliny chlorovodíkové HCl (C, X
Návod k laboratornímu cvičení Fenoly Úkol č. 1: Příprava fenolátu sodného Pomůcky: váhy, kádinka, zkumavky Chemikálie: 10% roztok hydroxidu sodného NaOH (C), 5%roztok kyseliny chlorovodíkové HCl (C, X
Organizace praktika. Bezpečnost a ochrana zdraví při práci v praktiku Obecné zásady první pomoci v chemické laboratoři
 Organizace praktika Praktikum z organické chemie probíhá pod záštitou Ústavu chemie a technologie ochrany životního prostředí v laboratořích organické chemie 2033, 2034 a 2035. Studenti prezenčního studia
Organizace praktika Praktikum z organické chemie probíhá pod záštitou Ústavu chemie a technologie ochrany životního prostředí v laboratořích organické chemie 2033, 2034 a 2035. Studenti prezenčního studia
LABORATORNÍ PRÁCE č.2
 LABORATORNÍ PRÁCE č.2 Téma: Dělení směsí II Úkol č.1: Destilace směsi manganistan draselný voda Teorie: Jedná se o jeden z nejdůležitějších způsobů oddělování složek kapalných směsí a jejich čištění. Složky
LABORATORNÍ PRÁCE č.2 Téma: Dělení směsí II Úkol č.1: Destilace směsi manganistan draselný voda Teorie: Jedná se o jeden z nejdůležitějších způsobů oddělování složek kapalných směsí a jejich čištění. Složky
Úloha č. 1 Příprava nifedipinu
 Úloha č. 1 Příprava nifedipinu Do kulaté baňky o objemu 50 ml předložíme 4 mmol 2-nitrobenzaldehydu, 9 mmol methylacetacetátu, 1,2 ml 25% NH 4 OH a 1 ml methanolu. Na baňku nasadíme zpětný chladič a umístíme
Úloha č. 1 Příprava nifedipinu Do kulaté baňky o objemu 50 ml předložíme 4 mmol 2-nitrobenzaldehydu, 9 mmol methylacetacetátu, 1,2 ml 25% NH 4 OH a 1 ml methanolu. Na baňku nasadíme zpětný chladič a umístíme
KARBOXYLOVÉ KYSELINY
 LABORATORNÍ PRÁCE Č. 28 KARBOXYLOVÉ KYSELINY PRINCIP Karboxylové kyseliny jsou látky, které ve své molekule obsahují jednu nebo více karboxylových skupin. Odvozují se od nich dva typy derivátů, substituční
LABORATORNÍ PRÁCE Č. 28 KARBOXYLOVÉ KYSELINY PRINCIP Karboxylové kyseliny jsou látky, které ve své molekule obsahují jednu nebo více karboxylových skupin. Odvozují se od nich dva typy derivátů, substituční
Laboratorní cvičení z kinetiky chemických reakcí
 Laboratorní cvičení z kinetiky chemických reakcí LABORATORNÍ CVIČENÍ 1. Téma: Ovlivňování průběhu reakce změnou koncentrace látek. podmínek průběhu reakce. Jednou z nich je změna koncentrace výchozích
Laboratorní cvičení z kinetiky chemických reakcí LABORATORNÍ CVIČENÍ 1. Téma: Ovlivňování průběhu reakce změnou koncentrace látek. podmínek průběhu reakce. Jednou z nich je změna koncentrace výchozích
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í LABORATORNÍ PRÁCE Č. 6 PRÁCE S PLYNY
 LABORATORNÍ PRÁCE Č. 6 PRÁCE S PLYNY Mezi nejrozšířenější práce s plyny v laboratoři patří příprava a důkazy oxidu uhličitého CO 2, kyslíku O 2, vodíku H 2, oxidu siřičitého SO 2 a amoniaku NH 3. Reakcí
LABORATORNÍ PRÁCE Č. 6 PRÁCE S PLYNY Mezi nejrozšířenější práce s plyny v laboratoři patří příprava a důkazy oxidu uhličitého CO 2, kyslíku O 2, vodíku H 2, oxidu siřičitého SO 2 a amoniaku NH 3. Reakcí
RUŠENÁ KRYSTALIZACE A SUBLIMACE
 LABORATORNÍ PRÁCE Č. 5 RUŠENÁ KRYSTALIZACE A SUBLIMACE KRYSTALIZACE PRINCIP Krystalizace je důležitý postup při získávání čistých tuhých látek z jejich roztoků. Tuhá látka se rozpustí ve vhodném rozpouštědle.
LABORATORNÍ PRÁCE Č. 5 RUŠENÁ KRYSTALIZACE A SUBLIMACE KRYSTALIZACE PRINCIP Krystalizace je důležitý postup při získávání čistých tuhých látek z jejich roztoků. Tuhá látka se rozpustí ve vhodném rozpouštědle.
látka Obr. k úkolům 1 a 2 Obr. k úkolu 3
 cvičení: A Téma: Základní vlastnosti organických látek Cíl: Teplota varu a tání Pomůcky: žákovská souprava, teploměr, skleněná trubička, Chemikálie: ethanol CH 3 CH 2 OH, aceton CH 3 COCH 3, naftalen Úkol
cvičení: A Téma: Základní vlastnosti organických látek Cíl: Teplota varu a tání Pomůcky: žákovská souprava, teploměr, skleněná trubička, Chemikálie: ethanol CH 3 CH 2 OH, aceton CH 3 COCH 3, naftalen Úkol
Schlenkovské techniky II
 Schlenkovské techniky II Cílem této úlohy je další procvičování činností s vakuovou linkou a další využití schlenkovských technik. Bude se jednat o práci s organickými rozpouštědly, extrakci a destilaci
Schlenkovské techniky II Cílem této úlohy je další procvičování činností s vakuovou linkou a další využití schlenkovských technik. Bude se jednat o práci s organickými rozpouštědly, extrakci a destilaci
VÝŽIVA LIDSTVA Mléko a zdraví
 GYMNÁZIUM JANA OPLETALA LITOVEL Odborná práce přírodovědného kroužku VÝŽIVA LIDSTVA Mléko a zdraví Vypracovali: Martina Hubáčková, Petra Vašíčková, Pavla Kubíčková, Michaela Pavlovská, Jitka Tichá, Petra
GYMNÁZIUM JANA OPLETALA LITOVEL Odborná práce přírodovědného kroužku VÝŽIVA LIDSTVA Mléko a zdraví Vypracovali: Martina Hubáčková, Petra Vašíčková, Pavla Kubíčková, Michaela Pavlovská, Jitka Tichá, Petra
Sešit pro laboratorní práci z chemie
 Sešit pro laboratorní práci z chemie téma: Příprava oxidu měďnatého autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační číslo
Sešit pro laboratorní práci z chemie téma: Příprava oxidu měďnatého autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační číslo
Návody ke cvičení C2200 Chemická syntéza
 Ústav chemie Přírodovědecké fakulty Masarykovy univerzity Návody ke cvičení C2200 Chemická syntéza Kolektiv autorů Brno 20. dubna 2011 Tento text vznikl v rámci realizace projektu P VK CZ.1.07/2.2.00/07.0436
Ústav chemie Přírodovědecké fakulty Masarykovy univerzity Návody ke cvičení C2200 Chemická syntéza Kolektiv autorů Brno 20. dubna 2011 Tento text vznikl v rámci realizace projektu P VK CZ.1.07/2.2.00/07.0436
Obrázek 3: Zápis srážecí reakce
 VG STUDENT CHEMIE T É M A: SRÁŽENÍ, IZOLACE SRAŽENIN Vypracoval/a: Spolupracoval/a: Třída: Datum: ANOTACE: V této laboratorní práci se žáci seznámí s pojmem sraženina a srážení, provedou srážení jodidu
VG STUDENT CHEMIE T É M A: SRÁŽENÍ, IZOLACE SRAŽENIN Vypracoval/a: Spolupracoval/a: Třída: Datum: ANOTACE: V této laboratorní práci se žáci seznámí s pojmem sraženina a srážení, provedou srážení jodidu
Návod k laboratornímu cvičení. Alkoholy
 Úkol č. 1: Ověřování fyzikálních vlastností alkoholů Návod k laboratornímu cvičení Alkoholy Pomůcky: 3 velké zkumavky - A,B,C, hodinové sklíčko, kapátko nebo skleněná tyčinka Chemikálie: etanol (F), etan-1,2-
Úkol č. 1: Ověřování fyzikálních vlastností alkoholů Návod k laboratornímu cvičení Alkoholy Pomůcky: 3 velké zkumavky - A,B,C, hodinové sklíčko, kapátko nebo skleněná tyčinka Chemikálie: etanol (F), etan-1,2-
Návod k laboratornímu cvičení. Oddělování složek směsí I
 Návod k laboratornímu cvičení Oddělování složek směsí I Úkol č. 1: Usazování Pomůcky: dělící nálevka, držák, svorka, stojan, kádinka Chemikálie: voda, potravinářské barvivo, olej 1. Dělící nálevku upevníme
Návod k laboratornímu cvičení Oddělování složek směsí I Úkol č. 1: Usazování Pomůcky: dělící nálevka, držák, svorka, stojan, kádinka Chemikálie: voda, potravinářské barvivo, olej 1. Dělící nálevku upevníme
Návod k laboratornímu cvičení. Efektní pokusy
 Návod k laboratornímu cvičení Efektní pokusy Úkol č. 1: Chemikova zahrádka Pomůcky: skleněná vana, lžička na chemikálie. Chemikálie: vodní sklo, síran zinečnatý ZnSO 4 (X i ), síran železnatý FeSO 4, chlorid
Návod k laboratornímu cvičení Efektní pokusy Úkol č. 1: Chemikova zahrádka Pomůcky: skleněná vana, lžička na chemikálie. Chemikálie: vodní sklo, síran zinečnatý ZnSO 4 (X i ), síran železnatý FeSO 4, chlorid
Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii
 Datum: Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii Laboratorní cvičení č. Tlak vzduchu: Teplota vzduchu: Bílkoviny(proteiny) Vlhkost
Datum: Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii Laboratorní cvičení č. Tlak vzduchu: Teplota vzduchu: Bílkoviny(proteiny) Vlhkost
T É M A: SRÁŽENÍ, GRAVIMETRIE. Spolupracoval/a: ANOTACE: TEORIE: VÁŽKOVÁ ANALÝZA (GRAVIMETRIE)
 SEMINÁŘ STUDENT CHEMIE T É M A: Vypracoval/a: Spolupracoval/a: SRÁŽENÍ, GRAVIMETRIE Třída: Datum: ANOTACE: V této laboratorní práci se žáci seznámí s využití metody srážení v kvantitativní analýze tzv.
SEMINÁŘ STUDENT CHEMIE T É M A: Vypracoval/a: Spolupracoval/a: SRÁŽENÍ, GRAVIMETRIE Třída: Datum: ANOTACE: V této laboratorní práci se žáci seznámí s využití metody srážení v kvantitativní analýze tzv.
Standardní operační postup
 Standardní operační postup CHOL_1 Stanovení cholesterolu v potravinách metodou HPLC V Brně dne 20. 3. 2011 Vypracoval: RNDr. Ivana Borkovcová, Ph.D. 1. Princip Po alkalické hydrolýze (saponifikaci, zmýdelnění)
Standardní operační postup CHOL_1 Stanovení cholesterolu v potravinách metodou HPLC V Brně dne 20. 3. 2011 Vypracoval: RNDr. Ivana Borkovcová, Ph.D. 1. Princip Po alkalické hydrolýze (saponifikaci, zmýdelnění)
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í LABORATORNÍ PRÁCE Č. 14 SRÁŽECÍ REAKCE
 LABORATORNÍ PRÁCE Č. 14 SRÁŽECÍ REAKCE PRINCIP Srážecí reakce je reakce, při níž se alespoň jeden z produktů vylučuje z reakční směsi ve formě tuhé fáze (sraženiny). A + (aq) + B - (aq) AB (s) (Reakce
LABORATORNÍ PRÁCE Č. 14 SRÁŽECÍ REAKCE PRINCIP Srážecí reakce je reakce, při níž se alespoň jeden z produktů vylučuje z reakční směsi ve formě tuhé fáze (sraženiny). A + (aq) + B - (aq) AB (s) (Reakce
Vzdělávání středoškolských pedagogů a studentů středních škol jako nástroj ke zvyšování kvality výuky přírodovědných předmětů CZ.1.07/1.1.00/14.
 Praktické cvičení z chemie 1) Stanovení lipofilních listových barviv pomocí adsorpční chromatografie. 2) Stanovení proteinů v roztoku. 3) Homogenizace rostlinného materiálu pomocí tekutého dusíku a stanovení
Praktické cvičení z chemie 1) Stanovení lipofilních listových barviv pomocí adsorpční chromatografie. 2) Stanovení proteinů v roztoku. 3) Homogenizace rostlinného materiálu pomocí tekutého dusíku a stanovení
Reakce organických látek
 Pavel Lauko 5.2.2002 DI I. roč. 3.sk. Reakce organických látek 1. Příprava methanu dekarboxylací octanu sodného Roztoky a materiál: octan sodný, natronové vápno, manganistan draselný, cyklohexan. Postup:
Pavel Lauko 5.2.2002 DI I. roč. 3.sk. Reakce organických látek 1. Příprava methanu dekarboxylací octanu sodného Roztoky a materiál: octan sodný, natronové vápno, manganistan draselný, cyklohexan. Postup:
Název: Acidobazické indikátory
 Název: Acidobazické indikátory Autor: Mgr. Jiří Vozka, Ph.D. Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, biologie, fyzika Ročník: 3. (1. ročník vyššího
Název: Acidobazické indikátory Autor: Mgr. Jiří Vozka, Ph.D. Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, biologie, fyzika Ročník: 3. (1. ročník vyššího
Sešit pro laboratorní práci z chemie
 Sešit pro laboratorní práci z chemie téma: Příprava roztoků a měření ph autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační
Sešit pro laboratorní práci z chemie téma: Příprava roztoků a měření ph autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační
DĚLÍCÍ METODY. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: 28. 5. 2012. Ročník: osmý. Vzdělávací oblast: Člověk a příroda / Chemie / Směsi
 Autor: Mgr. Stanislava Bubíková DĚLÍCÍ METODY Datum (období) tvorby: 28. 5. 2012 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Směsi 1 Anotace: Žáci se seznámí s nejčastěji používanými separačními
Autor: Mgr. Stanislava Bubíková DĚLÍCÍ METODY Datum (období) tvorby: 28. 5. 2012 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Směsi 1 Anotace: Žáci se seznámí s nejčastěji používanými separačními
Návod k laboratornímu cvičení. Alkaloidy a steroidy
 Návod k laboratornímu cvičení Úkol č. 1: Sublimace kofeinu Alkaloidy a steroidy Pomůcky: 2 hodinová sklíčka, elektrický vařič, siťka, stojan s kruhem, filtrační papír Chemikálie: suché čajové lístky (černý,
Návod k laboratornímu cvičení Úkol č. 1: Sublimace kofeinu Alkaloidy a steroidy Pomůcky: 2 hodinová sklíčka, elektrický vařič, siťka, stojan s kruhem, filtrační papír Chemikálie: suché čajové lístky (černý,
Oborový workshop pro ZŠ CHEMIE
 PRAKTICKÁ VÝUKA PŘÍRODOVĚDNÝCH PŘEDMĚTŮ NA ZŠ A SŠ CZ.1.07/1.1.30/02.0024 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Oborový workshop pro ZŠ CHEMIE
PRAKTICKÁ VÝUKA PŘÍRODOVĚDNÝCH PŘEDMĚTŮ NA ZŠ A SŠ CZ.1.07/1.1.30/02.0024 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Oborový workshop pro ZŠ CHEMIE
LP č. 6 - BÍLKOVINY. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: 28. 2. 2013. Ročník: devátý
 LP č. 6 - BÍLKOVINY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 28. 2. 2013 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci prakticky ověří
LP č. 6 - BÍLKOVINY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 28. 2. 2013 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci prakticky ověří
téma: Úvodní praktikum - Práce v laboratoři autor: Ing. Dagmar Kučerová
 téma: Úvodní praktikum - Práce v laboratoři cíl praktika: Žáci budou seznámeni s laboratorním řádem a poučeni o bezpečnosti práce. pomůcky: laboratorní řád popis aktivit: Žáci se seznámí se všemi body
téma: Úvodní praktikum - Práce v laboratoři cíl praktika: Žáci budou seznámeni s laboratorním řádem a poučeni o bezpečnosti práce. pomůcky: laboratorní řád popis aktivit: Žáci se seznámí se všemi body
VÝROBA UHLIČITANU SODNÉHO TEXT PRO UČITELE
 VÝROBA UHLIČITANU SODNÉHO TEXT PRO UČITELE Mgr. Jana Prášilová prof. RNDr. Jiří Kameníček, CSc. Olomouc, 2013 Obsah 1. Téma v učebnicích používaných na gymnáziích 2. Teoretické poznatky k problematice
VÝROBA UHLIČITANU SODNÉHO TEXT PRO UČITELE Mgr. Jana Prášilová prof. RNDr. Jiří Kameníček, CSc. Olomouc, 2013 Obsah 1. Téma v učebnicích používaných na gymnáziích 2. Teoretické poznatky k problematice
Návod k laboratornímu cvičení. Cukry(sacharidy)
 Návod k laboratornímu cvičení Cukry(sacharidy) Úkol č. 1: Odlišení glukosy a fruktosy Pomůcky: zkumavky, lžička na chemikálie, kádinka, stojan, držák, kruh, síťka, plynový kahan, zápalky Chemikálie: fruktosa,
Návod k laboratornímu cvičení Cukry(sacharidy) Úkol č. 1: Odlišení glukosy a fruktosy Pomůcky: zkumavky, lžička na chemikálie, kádinka, stojan, držák, kruh, síťka, plynový kahan, zápalky Chemikálie: fruktosa,
NOVÉ NÁMĚTY PRO DEMONSTRAČNÍ POKUSY. Ondřej Maca, Tereza Kudrnová
 NOVÉ NÁMĚTY PRO DEMONSTRAČNÍ POKUSY Ondřej Maca, Tereza Kudrnová HUSTÝ DÝM 1) pro koho: 1. ročník čtyřletého gymnázia 2) zařazení do učiva: vlastnosti látek; halogeny; pentely 3) pomůcky: zkumavka se zátkou,
NOVÉ NÁMĚTY PRO DEMONSTRAČNÍ POKUSY Ondřej Maca, Tereza Kudrnová HUSTÝ DÝM 1) pro koho: 1. ročník čtyřletého gymnázia 2) zařazení do učiva: vlastnosti látek; halogeny; pentely 3) pomůcky: zkumavka se zátkou,
Inovace bakalářského studijního oboru Aplikovaná chemie CZ.1.07/2.2.00/ Výpočty z chemických vzorců
 Výpočty z chemických vzorců 1. Hmotnost kyslíku je 80 g. Vypočítejte : a) počet atomů kyslíku ( 3,011 10 atomů) b) počet molů kyslíku (2,5 mol) c) počet molekul kyslíku (1,505 10 24 molekul) d) objem (dm
Výpočty z chemických vzorců 1. Hmotnost kyslíku je 80 g. Vypočítejte : a) počet atomů kyslíku ( 3,011 10 atomů) b) počet molů kyslíku (2,5 mol) c) počet molekul kyslíku (1,505 10 24 molekul) d) objem (dm
Praktické ukázky analytických metod ve vinařství
 Praktické ukázky analytických metod ve vinařství Ing. Mojmír Baroň Stanovení v moštu Stanovení ph a veškerých titrovatelných kyselin Stanovení ph Princip: Hodnota ph je záporný dekadický logaritmus aktivity
Praktické ukázky analytických metod ve vinařství Ing. Mojmír Baroň Stanovení v moštu Stanovení ph a veškerých titrovatelných kyselin Stanovení ph Princip: Hodnota ph je záporný dekadický logaritmus aktivity
Termochemie. Úkol: A. Určete změnu teploty při rozpouštění hydroxidu sodného B. Určete reakční teplo reakce zinku s roztokem měďnaté soli
 1. Termochemie Úkol: Určete změnu teploty při rozpouštění hydroxidu sodného B. Určete reakční teplo reakce zinku s roztokem měďnaté soli Pomůcky : a) kádinky, teploměr, odměrný válec, váženka, váhy, kalorimetr,
1. Termochemie Úkol: Určete změnu teploty při rozpouštění hydroxidu sodného B. Určete reakční teplo reakce zinku s roztokem měďnaté soli Pomůcky : a) kádinky, teploměr, odměrný válec, váženka, váhy, kalorimetr,
Solární dům. Vybrané experimenty
 Solární dům Vybrané experimenty 1. Závislost U a I na úhlu osvitu stolní lampa, multimetr a) Zapojíme články sériově. b) Na výstup připojíme multimetr. c) Lampou budeme články nasvěcovat pod proměnlivým
Solární dům Vybrané experimenty 1. Závislost U a I na úhlu osvitu stolní lampa, multimetr a) Zapojíme články sériově. b) Na výstup připojíme multimetr. c) Lampou budeme články nasvěcovat pod proměnlivým
Cíl úlohy: Najít vhodné rozpouštědlo pro překrystalování zkoušené látky a samotná krystalizace.
 Úloha A Krystalizace ejdůležitější metodou čištění tuhých látek je krystalizace. Zakládá se na rozdílné rozpustnosti zkoumané látky a její příměsí v určitém rozpouštědle za různých teplot. Při krystalizaci
Úloha A Krystalizace ejdůležitější metodou čištění tuhých látek je krystalizace. Zakládá se na rozdílné rozpustnosti zkoumané látky a její příměsí v určitém rozpouštědle za různých teplot. Při krystalizaci
Úloha č. 9 Stanovení hydroxidu a uhličitanu vedle sebe dle Winklera
 Úloha č. 9 Stanovení hydroxidu a uhličitanu vedle sebe dle Winklera Princip Jde o klasickou metodu kvantitativní chemické analýzy. Uhličitan vedle hydroxidu se stanoví ve dvou alikvotních podílech zásobního
Úloha č. 9 Stanovení hydroxidu a uhličitanu vedle sebe dle Winklera Princip Jde o klasickou metodu kvantitativní chemické analýzy. Uhličitan vedle hydroxidu se stanoví ve dvou alikvotních podílech zásobního
Návod k laboratornímu cvičení. Oddělování složek směsí II
 Úkol č. 1: Destilace Návod k laboratornímu cvičení Oddělování složek směsí II Pomůcky: plynový kahan, stojan, držák, síťka, alonž, teploměr, chladič, destilační baňka, jímadlo, gumové hadičky (na přívod
Úkol č. 1: Destilace Návod k laboratornímu cvičení Oddělování složek směsí II Pomůcky: plynový kahan, stojan, držák, síťka, alonž, teploměr, chladič, destilační baňka, jímadlo, gumové hadičky (na přívod
LABORATORNÍ STANOVENÍ SÍRANŮ VE VODNÉM ROZTOKU
 LABORATORNÍ STANOVENÍ SÍRANŮ VE VODNÉM ROZTOKU Cílem práce je stanovit koncentraci síranů v neznámém vzorku postupem A, B a C a porovnat jednotlivé metody mezi sebou. Protokol musí osahovat veškeré výpočty
LABORATORNÍ STANOVENÍ SÍRANŮ VE VODNÉM ROZTOKU Cílem práce je stanovit koncentraci síranů v neznámém vzorku postupem A, B a C a porovnat jednotlivé metody mezi sebou. Protokol musí osahovat veškeré výpočty
 LEKCE 5 Krystalizace separace složek homogenních směsí - krystalizace druhy krystalizace: volná krystalizace rušená krystalizace frakční krystalizace krystalizace změnou složení rozpouštědla vykrývání
LEKCE 5 Krystalizace separace složek homogenních směsí - krystalizace druhy krystalizace: volná krystalizace rušená krystalizace frakční krystalizace krystalizace změnou složení rozpouštědla vykrývání
Návod k laboratornímu cvičení. Bílkoviny
 Úkol č. 1: Důkazy bílkovin ve vaječném bílku a) natvrdo uvařené vejce s kyselinou dusičnou Pomůcky: Petriho miska, pipeta, nůž. Návod k laboratornímu cvičení Bílkoviny Chemikálie: koncentrovaná kyselina
Úkol č. 1: Důkazy bílkovin ve vaječném bílku a) natvrdo uvařené vejce s kyselinou dusičnou Pomůcky: Petriho miska, pipeta, nůž. Návod k laboratornímu cvičení Bílkoviny Chemikálie: koncentrovaná kyselina
VETERINÁRNÍ A FARMACEUTICKÁ UNIVERZITA FAKULTA FARMACEUTICKÁ ÚSTAV CHEMICKÝCH LÉČIV. Závěrečná zpráva. řešení projektu IVA číslo 2014FaF/3150/064
 VETERINÁRNÍ A FARMACEUTICKÁ UNIVERZITA FAKULTA FARMACEUTICKÁ ÚSTAV CHEMICKÝCH LÉČIV Závěrečná zpráva řešení projektu IVA číslo 2014FaF/3150/064 Zavedení fotochemických úloh do cvičení z organické chemie
VETERINÁRNÍ A FARMACEUTICKÁ UNIVERZITA FAKULTA FARMACEUTICKÁ ÚSTAV CHEMICKÝCH LÉČIV Závěrečná zpráva řešení projektu IVA číslo 2014FaF/3150/064 Zavedení fotochemických úloh do cvičení z organické chemie
Univerzita Jana Evangelisty Purkyně v Ústí nad Labem. Ing. Jana Šauliová, CSc.
 Univerzita Jana Evangelisty Purkyně v Ústí nad Labem Přírodovědecká fakulta PREPARATIVNÍ ORGANICKÁ CHEMIE a LABORATOŘE Z ORGANICKÉ CHEMIE I Ing. Jana Šauliová, CSc. 2007 2 TENTO TITUL JE SPOLUFINANCOVÁN
Univerzita Jana Evangelisty Purkyně v Ústí nad Labem Přírodovědecká fakulta PREPARATIVNÍ ORGANICKÁ CHEMIE a LABORATOŘE Z ORGANICKÉ CHEMIE I Ing. Jana Šauliová, CSc. 2007 2 TENTO TITUL JE SPOLUFINANCOVÁN
různorodé suspenze (pevná látka v kapalné) emulze (nemísitelné kapaliny) pěna (plynná l. v kapalné l.) mlha (kapalná l. v plynné l.
 Obsah: 6_Směsi... 2 7_Roztoky, složení roztoku... 3 8_PL_Složení roztoku - příklady... 4 9_Rozpustnost látky... 8 10_ PL_Rozpustnost ve vodě... 9 11_ Dělení směsí... 11 1 6_ Směsi - jsou látky složené
Obsah: 6_Směsi... 2 7_Roztoky, složení roztoku... 3 8_PL_Složení roztoku - příklady... 4 9_Rozpustnost látky... 8 10_ PL_Rozpustnost ve vodě... 9 11_ Dělení směsí... 11 1 6_ Směsi - jsou látky složené
13/sv. 8 (85/503/EHS) Tato směrnice je určena členským státům.
 62 31985L0503 L 308/12 ÚŘEDNÍ VĚSTNÍK EVROPSKÝCH SPOLEČENSTVÍ 20.11.1985 PRVNÍ SMĚRNICE KOMISE ze dne 25. října 1985 o metodách pro analýzu potravinářských kaseinů a kaseinátů (85/503/EHS) KOMISE EVROPSKÝCH
62 31985L0503 L 308/12 ÚŘEDNÍ VĚSTNÍK EVROPSKÝCH SPOLEČENSTVÍ 20.11.1985 PRVNÍ SMĚRNICE KOMISE ze dne 25. října 1985 o metodách pro analýzu potravinářských kaseinů a kaseinátů (85/503/EHS) KOMISE EVROPSKÝCH
Reakce kyselin a zásad
 seminář 6. 1. 2011 Chemie Reakce kyselin a zásad Známe několik teorií, které charakterizují definují kyseliny a zásady. Nejstarší je Arrheniova teorie, která je platná pro vodné prostředí, podle které
seminář 6. 1. 2011 Chemie Reakce kyselin a zásad Známe několik teorií, které charakterizují definují kyseliny a zásady. Nejstarší je Arrheniova teorie, která je platná pro vodné prostředí, podle které
Organická chemie 1 - sylabus
 Organická chemie 1 - sylabus Anotace Organická chemie je zaměřena na sloučeniny uhlíku, jejich klasifikaci, názvosloví, strukturu a vlastnosti, jejich použití v praxi. Obsahem první části jsou obecné principy
Organická chemie 1 - sylabus Anotace Organická chemie je zaměřena na sloučeniny uhlíku, jejich klasifikaci, názvosloví, strukturu a vlastnosti, jejich použití v praxi. Obsahem první části jsou obecné principy
UHLIČITAN NIKELNATÝ BAZICKÝ (SRÁŽENÍ)
 UHLIČITAN NIKELNATÝ BAZICKÝ (SRÁŽENÍ) NaHCO 3 + 3 NiSO 4 + 3 H 2 O NiCO 3. 2 Ni(OH) 2. 4 H 2 O + 3 Na 2 SO 4 + 5 CO 2 Na 2 CO 3 + 3 NiSO 4 + 6 H 2 O NiCO 3. 2 Ni(OH) 2. 4 H 2 O + 3 Na 2 SO 4 + 2 CO 2 (NH
UHLIČITAN NIKELNATÝ BAZICKÝ (SRÁŽENÍ) NaHCO 3 + 3 NiSO 4 + 3 H 2 O NiCO 3. 2 Ni(OH) 2. 4 H 2 O + 3 Na 2 SO 4 + 5 CO 2 Na 2 CO 3 + 3 NiSO 4 + 6 H 2 O NiCO 3. 2 Ni(OH) 2. 4 H 2 O + 3 Na 2 SO 4 + 2 CO 2 (NH
Oxidace benzaldehydu vzdušným kyslíkem a roztokem
 Úloha: Karbonylové sloučeniny a sacharidy, č. 2 Úkoly: Oxidace benzaldehydu Důkaz aldehydu Schiffovým činidlem Redukční vlastnosti karbonylových sloučenin a sacharidů (Reakce s Tollensovým a Fehlingovým
Úloha: Karbonylové sloučeniny a sacharidy, č. 2 Úkoly: Oxidace benzaldehydu Důkaz aldehydu Schiffovým činidlem Redukční vlastnosti karbonylových sloučenin a sacharidů (Reakce s Tollensovým a Fehlingovým
Jednotné pracovní postupy zkoušení krmiv STANOVENÍ OBSAHU VÁPNÍKU MANGANOMETRICKY
 Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU VÁPNÍKU MANGANOMETRICKY 1 Rozsah a účel Tato metoda specifikuje podmínky pro stanovení celkového obsahu vápníku v krmivech, krmných směsích a premixech.
Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU VÁPNÍKU MANGANOMETRICKY 1 Rozsah a účel Tato metoda specifikuje podmínky pro stanovení celkového obsahu vápníku v krmivech, krmných směsích a premixech.
Odborná práce přírodovědného kroužku Gymnázia Jana Opletala Litovel, Opletalova 189. Sacharidy
 Odborná práce přírodovědného kroužku Gymnázia Jana Opletala Litovel, Opletalova 189 Sacharidy Vypracovali: Jana Andrýsková, Aneta Čulíková, Jan Dvořáček, David Hrachovina, Petra Hrachovinová, Eva Podivínská,
Odborná práce přírodovědného kroužku Gymnázia Jana Opletala Litovel, Opletalova 189 Sacharidy Vypracovali: Jana Andrýsková, Aneta Čulíková, Jan Dvořáček, David Hrachovina, Petra Hrachovinová, Eva Podivínská,
Pokusy z organické chemie
 Pokusy z organické chemie Iveta Turková, Jiří Šibor 1. HALOGENACE ALKANŮ A CYKLOALKANŮ Pomůcky: 3 zkumavky se zátkami, indikátorový papírek, stojánek na zkumavky Chemikálie: hexan, cyklohexan, benzin,
Pokusy z organické chemie Iveta Turková, Jiří Šibor 1. HALOGENACE ALKANŮ A CYKLOALKANŮ Pomůcky: 3 zkumavky se zátkami, indikátorový papírek, stojánek na zkumavky Chemikálie: hexan, cyklohexan, benzin,
Organická chemie 2 Anotace Cíle Osnova předmětu
 Organická chemie 2 Anotace Organická chemie je zaměřena na sloučeniny uhlíku, jejich klasifikaci, názvosloví, strukturu a vlastnosti, jejich použití v praxi. Obsahem druhé části je chemie kyslíkatých derivátů
Organická chemie 2 Anotace Organická chemie je zaměřena na sloučeniny uhlíku, jejich klasifikaci, názvosloví, strukturu a vlastnosti, jejich použití v praxi. Obsahem druhé části je chemie kyslíkatých derivátů
Návody na praktika z Cytologie verze 2015
 Návody na praktika z Cytologie verze 2015 Témata cvičení: 1. Úvodní cvičení, výpočty a příprava roztoků 2. Prvkové složení rostlinné buňky 3. Bílkoviny 4. Sacharidy 5. Lipidy, cholesterol, důkaz mýdla
Návody na praktika z Cytologie verze 2015 Témata cvičení: 1. Úvodní cvičení, výpočty a příprava roztoků 2. Prvkové složení rostlinné buňky 3. Bílkoviny 4. Sacharidy 5. Lipidy, cholesterol, důkaz mýdla
Kapalina, pevná látka, plyn
 Obsah Co je to chemie? Kapalina, pevná látka, plyn Kyselina, zásada K čemu je chemie dobrá? Jak to vypadá v laboratoři? Bezpečnost práce Chemické pokusy Co je to chemie? Kapalina, pevná látka, plyn Kyselina,
Obsah Co je to chemie? Kapalina, pevná látka, plyn Kyselina, zásada K čemu je chemie dobrá? Jak to vypadá v laboratoři? Bezpečnost práce Chemické pokusy Co je to chemie? Kapalina, pevná látka, plyn Kyselina,
Inovace bakalářského studijního oboru Aplikovaná chemie CZ.1.07/2.2.00/15.0247
 Papírová a tenkovrstvá chromatografie Jednou z nejrozšířenějších analytických metod je bezesporu chromatografie, umožňující účinnou separaci látek nutnou pro spolehlivou identifikaci a kvantifikaci složek
Papírová a tenkovrstvá chromatografie Jednou z nejrozšířenějších analytických metod je bezesporu chromatografie, umožňující účinnou separaci látek nutnou pro spolehlivou identifikaci a kvantifikaci složek
Neutralizace kyseliny zásadou
 Neutralizace kyseliny zásadou Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 15 minut Pomůcky a) chemikálie - kyselina chlorovodíková - hydroxid sodný
Neutralizace kyseliny zásadou Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 15 minut Pomůcky a) chemikálie - kyselina chlorovodíková - hydroxid sodný
Sacharidy - důkaz organických látek v přírodních materiálech pomocí žákovské soupravy pro chemii
 Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.1.28/02.0055 Sacharidy - důkaz organických látek v přírodních materiálech pomocí žákovské soupravy pro chemii (laboratorní práce)
Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.1.28/02.0055 Sacharidy - důkaz organických látek v přírodních materiálech pomocí žákovské soupravy pro chemii (laboratorní práce)
Bílkoviny (laboratorní práce)
 Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.128/02.0055 Bílkoviny (laboratorní práce) Označení: EU-Inovace-Ch-9-08 Předmět: chemie Cílová skupina: 9. třída Autor: Mgr. Simona
Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.128/02.0055 Bílkoviny (laboratorní práce) Označení: EU-Inovace-Ch-9-08 Předmět: chemie Cílová skupina: 9. třída Autor: Mgr. Simona
LABORATOŘ ANALÝZY POTRAVIN A PŘÍRODNÍCH PRODUKTŮ
 LABORATOŘ ANALÝZY POTRAVIN A PŘÍRODNÍCH PRODUKTŮ Stanovení monosacharidů a oligosacharidů (metoda titrace po inverzi) Garant úlohy: Ing. Lucie Drábová, Ph.D. OBSAH Základní požadované znalosti pro vstupní
LABORATOŘ ANALÝZY POTRAVIN A PŘÍRODNÍCH PRODUKTŮ Stanovení monosacharidů a oligosacharidů (metoda titrace po inverzi) Garant úlohy: Ing. Lucie Drábová, Ph.D. OBSAH Základní požadované znalosti pro vstupní
LP č.2 SUBLIMACE, CHROMATOGRAFIE
 LP č.2 SUBLIMACE, CHROMATOGRAFIE Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 12. 6. 2012 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Směsi 1 Anotace: Žáci navrhnou postupy a
LP č.2 SUBLIMACE, CHROMATOGRAFIE Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 12. 6. 2012 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Směsi 1 Anotace: Žáci navrhnou postupy a
CHEMIE Pracovní list č.3 žákovská verze Téma: Acidobazická titrace Mgr. Lenka Horutová Student a konkurenceschopnost
 www.projektsako.cz CHEMIE Pracovní list č.3 žákovská verze Téma: Acidobazická titrace Lektor: Projekt: Reg. číslo: Mgr. Lenka Horutová Student a konkurenceschopnost CZ.1.07/1.1.07/03.0075 Teorie: Základem
www.projektsako.cz CHEMIE Pracovní list č.3 žákovská verze Téma: Acidobazická titrace Lektor: Projekt: Reg. číslo: Mgr. Lenka Horutová Student a konkurenceschopnost CZ.1.07/1.1.07/03.0075 Teorie: Základem
Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády. 46. ročník 2009/2010. KRAJSKÉ KOLO kategorie D
 Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády 46. ročník 2009/2010 KRAJSKÉ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH TEORETICKÁ ČÁST (60 bodů) Úloha 1 Vlastnosti prvků 26
Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády 46. ročník 2009/2010 KRAJSKÉ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH TEORETICKÁ ČÁST (60 bodů) Úloha 1 Vlastnosti prvků 26
Hydroxidy a indikátory demonstrační
 název typ: zařazení: Pomůcky: Chemikálie: Postup: pozorování rovnice, vysvětlení Hydroxidy a indikátory demonstrační Hydroxidy. Indikátory. 3 zkumavky, kapátko NaOH(C), fenolftalein, lakmus, ph papírek
název typ: zařazení: Pomůcky: Chemikálie: Postup: pozorování rovnice, vysvětlení Hydroxidy a indikátory demonstrační Hydroxidy. Indikátory. 3 zkumavky, kapátko NaOH(C), fenolftalein, lakmus, ph papírek
ODMĚRNÁ ANALÝZA - TITRACE
 LABORATORNÍ PRÁCE Č. 35 ODMĚRNÁ ANALÝZA - TITRACE PRINCIP Odměrnou analýzou (titrací) se stanovuje obsah určité složky ve vzorku. Podstatou odměrného stanovení je chemická reakce mezi odměrným roztokem
LABORATORNÍ PRÁCE Č. 35 ODMĚRNÁ ANALÝZA - TITRACE PRINCIP Odměrnou analýzou (titrací) se stanovuje obsah určité složky ve vzorku. Podstatou odměrného stanovení je chemická reakce mezi odměrným roztokem
téma: Halogeny-úvod autor: Ing. František Krejčí, CSc. cíl praktika: žáci si osvojí znalosti z chemie halogenů doba trvání: 2 h
 téma: Halogeny-úvod cíl praktika: žáci si osvojí znalosti z chemie halogenů pomůcky: psací potřeby popis aktivit: Žáci si osvojí problematiku halogenů, popíší jejich elektronovou konfiguraci a z ní vyvodí
téma: Halogeny-úvod cíl praktika: žáci si osvojí znalosti z chemie halogenů pomůcky: psací potřeby popis aktivit: Žáci si osvojí problematiku halogenů, popíší jejich elektronovou konfiguraci a z ní vyvodí
Směsi a čisté látky, metody dělení
 Směsi a čisté látky, metody dělení LÁTKY Chemicky čisté látky Sloučeniny Chemické prvky Homogenní Roztoky pevné kapalné plynné Směsi Heterogenní Suspenze Emulze Pěna Aerosol Chemicky čisté látky: prvky
Směsi a čisté látky, metody dělení LÁTKY Chemicky čisté látky Sloučeniny Chemické prvky Homogenní Roztoky pevné kapalné plynné Směsi Heterogenní Suspenze Emulze Pěna Aerosol Chemicky čisté látky: prvky
UHLIČITAN NIKELNATÝ (SRÁŽENÍ)
 UHLIČITAN NIKELNATÝ (SRÁŽENÍ) NaHCO 3 + NiSO 4 NiCO 3 + NaHSO 4 Připravte 5g uhličitanu nikelnatého. Připravíme si 10% roztok hydrogenuhličitanu sodného a zahřejeme ho téměř k varu. Za stálého míchání
UHLIČITAN NIKELNATÝ (SRÁŽENÍ) NaHCO 3 + NiSO 4 NiCO 3 + NaHSO 4 Připravte 5g uhličitanu nikelnatého. Připravíme si 10% roztok hydrogenuhličitanu sodného a zahřejeme ho téměř k varu. Za stálého míchání
Téma : Uhlovodíky Areny Toluen a naftalen Název : Vlastnosti toluenu a naftalenu
 Téma : Uhlovodíky Areny Toluen a naftalen Název : Vlastnosti toluenu a naftalenu Typ pokusu : demonstrační Princip : Areny starším názvem aromatické uhlovodíky, vzaly tento svůj název podle své typické
Téma : Uhlovodíky Areny Toluen a naftalen Název : Vlastnosti toluenu a naftalenu Typ pokusu : demonstrační Princip : Areny starším názvem aromatické uhlovodíky, vzaly tento svůj název podle své typické
Kalorimetrická měření I
 KATEDRA EXPERIMENTÁLNÍ FYZIKY PŘÍRODOVĚDECKÁ FAKULTA UNIVERZITY PALACKÉHO V OLOMOUCI FYZIKÁLNÍ PRAKTIKUM Z MOLEKULOVÉ FYZIKY A TERMODYNAMIKY Kalorimetrická měření I Úvod Teplo Teplo Q je určeno energií,
KATEDRA EXPERIMENTÁLNÍ FYZIKY PŘÍRODOVĚDECKÁ FAKULTA UNIVERZITY PALACKÉHO V OLOMOUCI FYZIKÁLNÍ PRAKTIKUM Z MOLEKULOVÉ FYZIKY A TERMODYNAMIKY Kalorimetrická měření I Úvod Teplo Teplo Q je určeno energií,
STANOVENÍ CHLORIDŮ. Odměrné argentometrické stanovení chloridů podle Mohra
 STANOVENÍ CHLORIDŮ Odměrné argentometrické stanovení chloridů podle Mohra Cíl práce Stanovte titr odměrného standardního roztoku dusičnanu stříbrného titrací 5 ml standardního srovnávacího roztoku chloridu
STANOVENÍ CHLORIDŮ Odměrné argentometrické stanovení chloridů podle Mohra Cíl práce Stanovte titr odměrného standardního roztoku dusičnanu stříbrného titrací 5 ml standardního srovnávacího roztoku chloridu
Vodík, kyslík a jejich sloučeniny
 I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 8 Vodík, kyslík a jejich sloučeniny
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 8 Vodík, kyslík a jejich sloučeniny
Součástí cvičení je krátký test.
 1 KVALITATIVNÍ ANORGANICKÁ ANALÝZA Laboratorní úloha č.1 KATIONTY TVOŘÍCÍ NEROZPUSTNÉ CHLORIDY A SÍRANY, KATION NH 4 + DOMÁCÍ PŘÍPRAVA 1. Prostudujte si dále uvedený návod 2. Prostudujte si text v Příloze
1 KVALITATIVNÍ ANORGANICKÁ ANALÝZA Laboratorní úloha č.1 KATIONTY TVOŘÍCÍ NEROZPUSTNÉ CHLORIDY A SÍRANY, KATION NH 4 + DOMÁCÍ PŘÍPRAVA 1. Prostudujte si dále uvedený návod 2. Prostudujte si text v Příloze
LP č. 5 - SACHARIDY. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: 28. 2. 2013. Ročník: devátý
 LP č. 5 - SACHARIDY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 28. 2. 2013 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci si prakticky vyzkouší
LP č. 5 - SACHARIDY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 28. 2. 2013 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci si prakticky vyzkouší
Ústřední komise Chemické olympiády. 42. ročník. KRAJSKÉ KOLO Kategorie D. SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut
 Ústřední komise Chemické olympiády 42. ročník 2005 2006 KRAJSKÉ KOLO Kategorie D SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut Institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy
Ústřední komise Chemické olympiády 42. ročník 2005 2006 KRAJSKÉ KOLO Kategorie D SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut Institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy
JODOMETRICKÉ STANOVENÍ ROZPUŠTĚNÉHO KYSLÍKU
 JODOMETRICKÉ STANOVENÍ ROZPUŠTĚNÉHO KYSLÍKU (dle Winklera v Alsterbergově modifikaci) Cílem je stanovení rozpuštěného kyslíku v pitné vodě z vodovodního řádu. Protokol musí osahovat veškeré potřebné hodnoty
JODOMETRICKÉ STANOVENÍ ROZPUŠTĚNÉHO KYSLÍKU (dle Winklera v Alsterbergově modifikaci) Cílem je stanovení rozpuštěného kyslíku v pitné vodě z vodovodního řádu. Protokol musí osahovat veškeré potřebné hodnoty
ORGANICKÁ CHEMIE Laboratorní práce č. 9
 Téma: Bílkoviny, enzymy ORGANICKÁ CHEMIE Laboratorní práce č. 9 Úkol 1: Dokažte, že mléko obsahuje bílkovinu kasein. Kasein je hlavní bílkovinou obsaženou v savčím mléce. Výroba řady mléčných výrobků je
Téma: Bílkoviny, enzymy ORGANICKÁ CHEMIE Laboratorní práce č. 9 Úkol 1: Dokažte, že mléko obsahuje bílkovinu kasein. Kasein je hlavní bílkovinou obsaženou v savčím mléce. Výroba řady mléčných výrobků je
Katedra chemie FP TUL ANC-C4. stechiometrie
 ANC-C4 stechiometrie ANC-C4 Studenti vyrobili Mohrovu sůl (síran železnato-amonný-hexahydrát). Protože nechali vyrobenou látku volně krystalovat, došlo časem k pokrytí krystalů hydrolytickými produkty
ANC-C4 stechiometrie ANC-C4 Studenti vyrobili Mohrovu sůl (síran železnato-amonný-hexahydrát). Protože nechali vyrobenou látku volně krystalovat, došlo časem k pokrytí krystalů hydrolytickými produkty
Neutralizační (acidobazické) titrace
 Neutralizační (acidobazické) titrace Neutralizační titrace jsou založeny na reakci mezi kyselinou a zásadou. V podstatě se vždy jedná o reakci iontů H + s ionty OH - podle schematu: H + + OH - H O V průběhu
Neutralizační (acidobazické) titrace Neutralizační titrace jsou založeny na reakci mezi kyselinou a zásadou. V podstatě se vždy jedná o reakci iontů H + s ionty OH - podle schematu: H + + OH - H O V průběhu
METODY ČIŠTĚNÍ ORGANICKÝCH LÁTEK
 METODY ČIŠTĚNÍ ORGANICKÝCH LÁTEK Chemické sloučeniny se připravují z jiných chemických sloučenin. Tento děj se nazývá chemická reakce, kdy z výchozích látek (reaktantů) vznikají nové látky (produkty).
METODY ČIŠTĚNÍ ORGANICKÝCH LÁTEK Chemické sloučeniny se připravují z jiných chemických sloučenin. Tento děj se nazývá chemická reakce, kdy z výchozích látek (reaktantů) vznikají nové látky (produkty).
Sešit pro laboratorní práci z chemie
 Sešit pro laboratorní práci z chemie téma: Oddělování složek směsí autor: MVDr. Alexandra Gajová vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační číslo
Sešit pro laboratorní práci z chemie téma: Oddělování složek směsí autor: MVDr. Alexandra Gajová vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační číslo
CHEMICKY ČISTÁ LÁTKA A SMĚS
 CHEMICKY ČISTÁ LÁTKA A SMĚS Látka = forma hmoty, která se skládá z velkého množství základních stavebních částic: atomů, iontů a... Látky se liší podle druhu částic, ze kterých se skládají. Druh částic
CHEMICKY ČISTÁ LÁTKA A SMĚS Látka = forma hmoty, která se skládá z velkého množství základních stavebních částic: atomů, iontů a... Látky se liší podle druhu částic, ze kterých se skládají. Druh částic
1.08 Tvrdost vody. Projekt Trojlístek
 1. Chemie a společnost 1.08. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je určena pro žáky 2. stupně ZŠ
1. Chemie a společnost 1.08. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je určena pro žáky 2. stupně ZŠ
T É M A: CHROMATOGRAFIE. Spolupracoval/a: ANOTACE: TEORIE:
 VG STUDENT CHEMIE T É M A: Vypracoval/a: Spolupracoval/a: CHROMATOGRAFIE Třída: Datum: ANOTACE: V této laboratorní práci se žáci seznámí s metodou TLC chromatografie a jejím využitím pro oddělování jednotlivých
VG STUDENT CHEMIE T É M A: Vypracoval/a: Spolupracoval/a: CHROMATOGRAFIE Třída: Datum: ANOTACE: V této laboratorní práci se žáci seznámí s metodou TLC chromatografie a jejím využitím pro oddělování jednotlivých
Spektrofotometrické stanovení fosforečnanů ve vodách
 Spektrofotometrické stanovení fosforečnanů ve vodách Úkol: Spektrofotometricky stanovte obsah fosforečnanů ve vodě Chemikálie: 0,07165 g dihydrogenfosforečnan draselný KH 2 PO 4 75 ml kyselina sírová H
Spektrofotometrické stanovení fosforečnanů ve vodách Úkol: Spektrofotometricky stanovte obsah fosforečnanů ve vodě Chemikálie: 0,07165 g dihydrogenfosforečnan draselný KH 2 PO 4 75 ml kyselina sírová H
ORGANICKÁ CHEMIE Laboratorní práce č. 3
 Téma: Hydroxyderiváty uhlovodíků ORGANICKÁ CHEMIE Laboratorní práce č. 3 Úkol 1: Dokažte přítomnost ethanolu ve víně. Ethanol bezbarvá kapalina, která je základní součástí alkoholických nápojů. Ethanol
Téma: Hydroxyderiváty uhlovodíků ORGANICKÁ CHEMIE Laboratorní práce č. 3 Úkol 1: Dokažte přítomnost ethanolu ve víně. Ethanol bezbarvá kapalina, která je základní součástí alkoholických nápojů. Ethanol
Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii
 Datum: Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii Laboratorní cvičení č. Tlak vzduchu: Teplota vzduchu: Vodík a kyslík Vlhkost
Datum: Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii Laboratorní cvičení č. Tlak vzduchu: Teplota vzduchu: Vodík a kyslík Vlhkost
ÚLOHA 1: Stanovení koncentrace kyseliny ve vzorku potenciometrickou titrací
 UPOZORNĚNÍ V tabulkách pro jednotlivé úlohy jsou uvedeny předpokládané pomůcky, potřebné pro vypracování experimentální části úlohy. Některé pomůcky (lžička, váženka, stopky, elmag. míchadélko, tyčinka
UPOZORNĚNÍ V tabulkách pro jednotlivé úlohy jsou uvedeny předpokládané pomůcky, potřebné pro vypracování experimentální části úlohy. Některé pomůcky (lžička, váženka, stopky, elmag. míchadélko, tyčinka
Jednotné pracovní postupy zkoušení krmiv Stanovení obsahu celkového a volného tryptofanu metodou HPLC
 Strana 1 STANOVENÍ OBSAHU CELKOVÉHO A VOLNÉHO TRYPTOFANU METODOU HPLC 1 Rozsah a účel Metoda specifikuje podmínky pro stanovení obsahu celkového a volného tryptofanu v krmivech metodou vysokoúčinné kapalinové
Strana 1 STANOVENÍ OBSAHU CELKOVÉHO A VOLNÉHO TRYPTOFANU METODOU HPLC 1 Rozsah a účel Metoda specifikuje podmínky pro stanovení obsahu celkového a volného tryptofanu v krmivech metodou vysokoúčinné kapalinové
KVALITATIVNÍ ELEMENTÁRNÍ ANALÝZA ORGANICKÝCH LÁTEK
 LABORATORNÍ PRÁCE Č. 24 KVALITATIVNÍ ELEMENTÁRNÍ ANALÝZA ORGANICKÝCH LÁTEK PRINCIP Organická kvalitativní elementární analýza zkoumá chemické složení organických látek, zabývá se identifikací jednotlivých
LABORATORNÍ PRÁCE Č. 24 KVALITATIVNÍ ELEMENTÁRNÍ ANALÝZA ORGANICKÝCH LÁTEK PRINCIP Organická kvalitativní elementární analýza zkoumá chemické složení organických látek, zabývá se identifikací jednotlivých
