PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
|
|
|
- Dalibor Ovčačík
- před 6 lety
- Počet zobrazení:
Transkript
1 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1
2 1. NÁZEV PŘÍPRAVKU EVICEL roztoky pro tkáňové lepidlo. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivými látkami jsou: Složka 1 Proteinum humanum praeparatum obsahující hlavně fibrinogenum humanum a fibronectinum humanum* 1ml injekční lahvička 2ml injekční lahvička 5ml injekční lahvička mg mg mg Složka 2 Thrombinum humanum IU IU IU * Celkové množství proteinu je mg/ml Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Roztoky pro tkáňové lepidlo, čiré nebo lehce opalescentní roztoky. 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikace EVICEL je určen u dospělých k podpůrné léčbě v chirurgii ke zlepšení hemostázy, kdy běžné chirurgické techniky nejsou dostačující (viz bod 5.1). EVICEL je určen u dospělých rovněž na podporu sutury pro hemostázu v cévní chirurgii a k utěsnění místa sutury při uzávěru dury mater. 4.2 Dávkování a způsob podání EVICEL smí používat pouze zkušení chirurgové, kteří absolvovali školení pro jeho použití. Dávkování Množství přípravku EVICEL a četnost aplikace by měla vždy vycházet z klinických potřeb pacienta. Podávaná dávka závisí na proměnných, mezi něž patří kromě jiného druh chirurgického zákroku, velikost plochy, způsob plánované aplikace a počet aplikací.aplikace přípravku musí být individuálně upravena ošetřujícím lékařem. V kontrolovaných klinických studiích v cévní chirurgii se individuální dávka pohybovala do 4 ml, pro utěsnění místa sutury při uzávěru dury mater byly použity dávky až 8 ml, zatímco při retroperitoneálním nebo intraabdominálním chirurgickém výkonu byla individuální dávka do 10 ml. Při některých postupech (např. traumata jater) je nicméně potřeba většího množství přípravku. 2
3 Výchozí množství přípravku aplikovaného na danou anatomickou oblast nebo povrch by mělo být natolik velké, aby jím byla zcela pokryta určená plocha. V případě potřeby lze aplikaci opakovat. Způsob podání Evicel je určen pro epilezionální podání. Pokyny na přípravu léčivého přípravku před podáním naleznete v bodě 6.6. Přípravek je nutné aplikovat pouze podle pokynů a s pomocí prostředků doporučených pro tento přípravek (viz bod 6.6). Před aplikací přípravku EVICEL je třeba povrch rány osušit standardní technikou (např. přerušovanou aplikací kompresních obvazů, pomocí tamponů nebo odsávacích zařízení). Aby se předešlo riziku potenciálně život ohrožující vzduchové nebo plynové embolie, smí se EVICEL aplikovat pouze pomocí stlačeného CO 2. Konkrétní doporučení ohledně požadovaného tlaku a vzdálenosti od tkáně při nástřiku v závislosti na chirurgickém zákroku a typu aplikační špičky naleznete v bodech 4.4 a Kontraindikace Přípravek EVICEL se nesmí používat intravaskulárně. Hypersenzitivita na léčivou látku(y) nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Přípravek EVICEL se nesmí aplikovat nástřikem při endoskopických zákrocích. Pro laparoskopii viz bod 4.4. EVICEL se nesmí používat pro utěsnění sutury linie dura mater, pokud jsou přítomné mezery větší než 2 mm, které přetrvávají po sešití. EVICEL se nesmí používat jako lepidlo pro fixaci záplat dura mater. EVICEL se nesmí používat jako uzavírací prostředek, pokud není možné duru mater sešít. 4.4 Zvláštní upozornění a opatření pro použití EVICEL je pouze pro epilezionální podání. Nesmí se podávat intravaskulárně. V případě neúmyslné intravaskulární aplikace může dojít k tromboembolickým komplikacím s ohrožením života. Při použití nástřikových zařízení s tlakovým regulátorem pro aplikaci výrobku EVICEL došlo k životu ohrožující vzduchové nebo plynové embolii. Zdá se, že tato příhoda souvisí s použitím nástřikových zařízení při vyšším než doporučeném tlaku nebo v těsné blízkosti povrchu tkáně. EVICEL se smí aplikovat nástřikem pouze v případech, kdy je možné přesně odhadnout vzdálenost nástřikového zařízení od tkáně, zejména během laparoskopie. Vzdálenost od tkáně a tlak CO 2 musí být v rozmezí doporučeném výrobcem (tlak a vzdálenost viz tabulka v bodě 6.6). Při nástřiku výrobku EVICEL je třeba monitorovat změny v krevním tlaku, pulzu, nasycení kyslíkem a koncentrace CO 2 na konci výdechu, protože je zde možnost výskytu plynové embolie. Při používání přídatných špiček s tímto výrobkem je třeba řídit se návodem k použití špiček. Před podáním přípravku EVICEL je potřeba zajistit dostatečnou ochranu (zakrytí) částí přiléhajících k místu, které má být ošetřeno, aby se zabránilo nechtěné adhezi ostatních tkání. EVICEL je třeba aplikovat v tenké vrstvě. Příliš silný nános může negativně ovlivnit účinek přípravku a proces hojení rány. 3
4 Nejsou k dispozici náležité údaje k použití tohoto přípravku k lepení tkání, při podávání pomocí flexibilního endoskopu k léčbě krvácení nebo k použití při gastrointestinálních anastomózách. Podobně jako u jiných přípravků obsahujících proteiny může dojít ke vzniku hypersenzitivních reakcí alergického typu. Příznaky hypersenzitivních reakcí zahrnují vyrážku, generalizovanou kopřivku, pocit tíže na hrudi, dušnost, hypotenzi a anafylaxi. Pokud se tyto příznaky vyskytnou, aplikace musí být okamžitě přerušena. V případě šoku je nutno dodržovat standardní lékařské postupy pro léčbu šoku. Souběžné použití přípravku EVICEL pro utěsnění sutury dura mater pomocí implantátů ze syntetických materiálů nebo záplat dury mater nebylo hodnoceno v klinických studiích. Nebylo provedeno hodnocení použití přípravku EVICEL u pacientů, kteří podstupují radioterapii do 7 dnů po operaci. Není známo, zda by radioterapie mohla ovlivnit účinnost fibrinového lepidla, pokud se použije k utěsnění linie sutury při uzávěru dura mater. Před aplikací přípravku EVICEL pro utěsnění linie sutury dury mater má být dosaženo kompletní hemostázy. Použití přípravku EVICEL jako utěsnění při transfenoidálních a otoneurochirurgických postupech nebylo hodnoceno. Standardní opatření zabraňující přenosu infekce v souvislosti s používáním léčivých přípravků vyrobených z lidské krve nebo plazmy zahrnují výběr dárců, testování jednotlivých odebraných dávek krve a plazmy na specifické ukazatele infekce a zařazení účinných výrobních postupů k inaktivaci/odstranění virů. Přes všechna tato opatření nemůže být možnost přenosu infekčních činitelů při podávání léčivých přípravků vyráběných z lidské krve nebo plazmy zcela vyloučena, což platí i v případě dosud neznámých nebo nových virů a jiných patogenů. Prováděná opatření jsou považována za účinná v případě obalených virů, jako je HIV, virus hepatitidy C a virus hepatitidy B, a v případě neobaleného viru hepatitidy A. Omezenou účinnost mohou mít tato opatření u neobalených virů, jako je parvovirus B19. Infekce parvovirem B19 může mít vážné následky u těhotných žen (fetální infekce) a u jedinců se sníženou funkcí imunitního systému nebo se zvýšenou erytropoézou (například hemolytická anémie). Je důrazně doporučováno při každé aplikaci přípravku EVICEL zaznamenat jméno pacienta a číslo šarže přípravku tak, aby bylo možné zpětně přiřadit k pacientovi číslo použité šarže. 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce Nebyly provedeny žádné studie interakcí. Stejně jako podobné přípravky nebo roztoky obsahující trombin může být EVICEL denaturován kontaktem s roztoky obsahujícími alkohol, jód nebo těžké kovy (např. antiseptické roztoky). Před aplikací je třeba tyto látky odstranit v maximálně možné míře. 4.6 Fertilita, těhotenství a kojení Bezpečnost fibrinových tkáňových lepidel/hemostatik u těhotných nebo kojících žen nebyla v kontrolovaných klinických studiích ověřována. Experimentální studie na zvířatech nejsou dostatečné pro posouzení bezpečnosti tohoto přípravku v souvislosti s reprodukcí, vývojem embrya či plodu, průběhem těhotenství a perinatálním a postnatálním vývojem. Proto by měl být přípravek podáván těhotným nebo kojícím ženám jen tehdy, je-li to nezbytně nutné. 4.7 Účinky na schopnost řídit a obsluhovat stroje Není relevantní. 4
5 4.8 Nežádoucí účinky Shrnutí bezpečnostního profilu Přecitlivělost či alergické reakce (které se mohou projevit jako angioedém, pálení a bodání v místě aplikace, bronchospasmus, třesavka, zrudnutí, generalizovaná kopřivka, bolesti hlavy, vyrážka, hypotenze, letargie, nauzea, neklid, tachykardie, pocit tíže na hrudi, mravenčení, zvracení, dušnost) se mohou vyskytnout ve vzácných případech u pacientů, kterým byla podána fibrinová tkáňová lepidla/hemostatika. Tyto nežádoucí účinky se v ojedinělých případech rozvinuly v závažnou anafylaxi. Mohou být zaznamenány zejména tehdy, pokud je přípravek aplikován opakovaně či pokud je podáván pacientům, o nichž je známo, že jsou přecitlivělí na určité složky přípravku. Ve vzácných případech může dojít k vytvoření protilátek proti složkám fibrinového tkáňového lepidla/hemostatik. Neúmyslná intravaskulární aplikace přípravku může vést k tromboembolické příhodě a k diseminované intravaskulární koagulaci (DIC, disseminated intravascular coagulation), přičemž existuje rovněž riziko anafylaktické reakce (viz 4.4). Při použití nástřikových zařízení s tlakovým regulátorem při aplikaci přípravku EVICEL došlo k životu ohrožující vzduchové nebo plynové embolii. Zdá se, že tato příhoda souvisí s použitím nástřikových zařízení při vyšším než doporučeném tlaku nebo v těsné blízkosti povrchu tkáně. Informace o bezpečnostních hlediscích v souvislosti s přenosnými agens viz bod 4.4. Tabulka nežádoucích účinků Tabulka uvedená níže představuje nežádoucí účinky podle databáze MedDRA (třída orgánových systémů a preferovaný termín). Četnosti výskytu byly vyhodnoceny podle těchto kritérií: velmi časté ( 1/10); časté ( 1/100 až <1/10); méně časté ( 1/1 000 až <1/100); vzácné ( 1/ až <1/1 000); velmi vzácné (<1/10 000), není známo (z dostupných údajů nelze určit). Třídy orgánových systémů podle Preferovaný termín Četnost databáze MedDRA Nežádoucí účinky ve studii z oblasti retroperitoneální a intraabdominální chirurgie Infekce a infestace Břišní absces Časté Nežádoucí účinky ve studii z oblasti cévní chirurgie Infekce a infestace Infekce štěpu, stafylokoková Méně časté infekce Cévní poruchy Hematom Méně časté Celkové poruchy a reakce v místě aplikace Periferní edém Méně časté Vyšetření Snížená hladina hemoglobinu Méně časté Poranění, otravy a procedurální komplikace Nežádoucí účinky ve studii z oblasti neurochirurgie Krvácení v místě incize Okluze cévního štěpu Rána Postprocedurální hematom Pooperační komplikace v ráně Méně časté Méně časté Méně časté Méně časté Méně časté Infekce a infestace Meningitida Časté 5
6 Poruchy nervového systému Intrakraniální hypertenze (únik mozkomíšního moku) Rinorea mozkomíšního moku Bolesti hlavy Hydrocefalus Subdurální hygrom Časté Časté Časté Časté Časté Cévní poruchy Hematom Časté Popis vybraných nežádoucích účinků Výskyt nežádoucích účinků ve studii z oblasti retroperitoneální a intraabdominální chirurgie Mezi 135 pacienty podstupujícími retroperitoneální a intraabdominální chirurgický výkon (67 pacientů bylo léčeno přípravkem EVICEL a 68 pacientů bylo zařazeno v kontrolní skupině) nebyly podle posouzení zkoušejících zaznamenány žádné nežádoucí příhody v příčinné souvislosti se sledovanou léčbou. Nicméně 3 závažné nežádoucí příhody (jeden břišní absces ve skupině léčené přípravkem EVICEL a jeden břišní a jeden pánevní absces v kontrolní skupině) byly podle zadavatele studie posouzeny jako příhody s možným vztahem ke sledované léčbě. Nežádoucí účinky cévní chirurgie V kontrolované studii, do které bylo zařazeno 147 pacientů podstupujících zavedení cévního štěpu (75 z nich léčených přípravkem EVICEL a 72 v kontrolní skupině), byla u celkem 16 pacientů v průběhu studie zaznamenána nežádoucí příhoda, při které došlo k trombóze/okluzi štěpu. Tyto příhody byly rovnoměrně rozloženy napříč léčebnými větvemi 8 výskytů jak ve skupině ošetřené přípravek EVICEL, tak v kontrolní skupině. Byla provedena neintervenční poregistrační studie bezpečnosti, která zahrnovala 300 pacientů podstupujících vaskulární chirurgický zákrok, během kterého byl použit EVICEL. Monitorování bezpečnosti se zaměřilo na specifické nežádoucí účinky z hlediska průchodnosti štěpů, trombotických příhod a krvácivých příhod. V průběhu této studie nebyly hlášeny žádné nežádoucí účinky. Nežádoucí účinky neurochirurgie V kontrolované klinické studii zahrnující 139 pacientů, kteří podstupují elektivní neurochirurgické zákroky (89 léčených přípravkem EVICEL a 50 v kontrolní skupině), se celkem u 7 subjektů léčených přípravkem EVICEL vyskytlo devět nežádoucích účinků, které byly považovány za možná související s hodnoceným přípravkem. Tyto zahrnovaly intrakraniální hypotenzi (únik mozkomíšního moku), rinoreu mozkomíšního moku, meningitidu, bolesti hlavy, hydrocefalus, subdurální hygrom a hematom. Incidence úniku mozkomíšního moku a incidence infekce operační rány byly sledovány jako bezpečnostní koncové body ve studii. Za 30 dnů po operaci byla incidence infekce operační rány mezi dvěma léčebnými skupinami podobná. Pooperační únik mozkomíšního moku se objevil za 30 dnů od léčby u 4 z 89 (4,5 %) subjektů léčených přípravkem EVICEL (dva případy úniku mozkomíšního moku s poruchou hojení rány a dva případy rinorey) a u 1 z 50 (2,0 %) subjektů léčených dalšími suturami. Hlášení podezření na nežádoucí účinky Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. 6
7 4.9 Předávkování Nebyl hlášen žádný případ předávkování. 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1 Farmakodynamické vlastnosti Farmakoterapeutická skupina: lokální hemostatika, kombinace, ATC kód: B02BC30 Mechanismus účinku Fibrinadhezní systém spouští poslední fázi fyziologického srážení krve. Přeměna fibrinogenu na fibrin nastává štěpením fibrinogenu na fibrin-monomery a fibrinopeptidy. Fibrin-monomery agregují a vytvářejí fibrinovou sraženinu. Faktor XIIIa, což je trombinem aktivovaný faktor XIII, vytváří fibrinovou síť. Ionty vápníku jsou potřebné jak pro přeměnu fibrinogenu, tak k propojení fibrinu do sítě. S postupujícím hojením rány se vlivem plazminu zvyšuje fibrinolytická aktivita a začne docházet k degradaci fibrinu na fibrin-degradační produkty. Klinická účinnost a bezpečnost Klinické studie prokazující hemostázu a lepší srůstání švu byly provedeny na celkovém počtu 147 pacientů (75 ošetřených přípravkem EVICEL, 72 v kontrolní skupině), kteří podstoupili cévní operaci s polytetrafluoretylenovými štěpy, a na celkovém počtu 135 pacientů (66 ošetřených přípravkem EVICEL, 69 v kontrolní skupině), kteří podstoupili retroperitoneální a intraabdominální chirurgický výkon. Účinnost přípravku EVICEL pro utěsnění linie sutury při uzávěru dury mater byla prokázána u 139 pacientů (89 léčených přípravkem EVICEL a 50 v kontrolní skupině), kteří podstoupili kraniotomii nebo kraniektomii. Pediatrická populace K prokázání bezpečnosti a účinnosti přípravku EVICEL u dětí a dospívajících není k dispozici dostatek údajů. Ze 135 pacientů, kteří byli zařazeni do kontrolované studie testující účinky přípravku EVICEL a podstoupili retroperitoneální nebo intraabdominální operaci, byli 4 pacienti ošetření tímto přípravkem ve věku 16 let nebo mladší. Z nich byly 2 děti ve věku 2 a 5 let a 2 byli mladiství ve věku 16 let. V současné době nejsou k dispozici žádné údaje týkající se dětí mladších 2 let. 5.2 Farmakokinetické vlastnosti EVICEL je určen pouze k použití na léze. Intravaskulární podání je kontraindikováno. Intravaskulární farmakokinetické studie nebyly tudíž u lidí prováděny. Studie byly prováděny na králících k vyhodnocení absorpce a eliminace trombinu, je-li aplikován na povrch rány v játrech po parciální hepatektomii. Použitím 125 I-trombinu byla prokázána pomalá absorpce biologicky neaktivních peptidů vzniklých rozkladem trombinu, jejich C max v plazmě bylo dosaženo po 6 8 hodinách. Ve svém maximu (C max) představovala plasmatická koncentrace pouze 1 2 % z aplikované dávky. Fibrinová tkáňová lepidla/hemostatika jsou metabolizována stejným způsobem jako endogenní fibrin, tedy fibrinolýzou a fagocytózou. 5.3 Předklinické údaje vztahující se k bezpečnosti Studie prováděné na bakteriích ke stanovení mutagenity byly negativní pro samotný trombin, biologické léčivé složky (obsahující fibrinogen, citrát, glycin, kyselinu tranexamovou a argininhydrochlorid), samotný TnBP a samotný Triton X-100 ve všech zkoumaných koncentracích. Ve 7
8 zkouškách prováděných k posouzení mutagenity u savčích buněk, v testech chromozomových aberací a indukce tvorby mikrojader byly výsledky pro všechny koncentrace kombinace TnBP a Tritonu X- 100 rovněž negativní. Po lokální aplikaci je absorpce trombinu do plasmy pomalá a jde hlavně o degradační produkty trombinu, které jsou eliminovány. Žádné toxikologické účinky v důsledku použití čisticích a rozpouštěcích činidel (TnBP a Triton X- 100) k inaktivaci virů nejsou očekávány vzhledem k tomu, že zbytkové hodnoty jsou menší než 5 µg/ml. Studie neurotoxicity prováděné s přípravkem EVICEL potvrdily, že subdurální podání u králíků není spojeno s žádným výskytem neurotoxicity. Neurobehaviorální pozorování po dobu 14±1 dní nezaznamenala žádné abnormální nálezy. Žádné závažné makroskopické známky lokální intolerance a žádné makroskopické nálezy související s léčbou nebyly pozorovány. Analýza mozkomíšního moku neukázala významnější příznaky zánětu. 6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek Injekční lahvička s lidským fibrinogenem: Arginin-hydrochlorid Glycin Chlorid sodný Natrium-citrát Chlorid vápenatý Voda na injekci Injekční lahvička s lidským trombinem: Chlorid vápenatý Lidský roztok albuminu Mannitol Natrium-acetát Voda na injekci 6.2 Inkompatibility Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky. 6.3 Doba použitelnosti 2 roky V rámci 2leté doby použitelnosti mohou být neotevřené injekční lahvičky po rozmrazení chráněné před světlem uchovávány při teplotě 2 C 8 C po dobu až 30 dnů. Lahvičky mohou být uchovávány při pokojové teplotě až po dobu 24 hodin. Na konci této doby musí být přípravek buď spotřebován, nebo zlikvidován. 6.4 Zvláštní opatření pro uchovávání Uchovávejte v mrazničce při teplotě -18 C nebo nižší. Opakovaně nezmrazujte. Injekční lahvičky uchovávejte ve vnějším kartónovém obalu, aby byly chráněny před světlem. 8
9 Injekční lahvičky je třeba uchovávat ve svislé poloze. Podmínky uchovávání tohoto léčivého přípravku po rozmrazení viz bod 6.3. Nová doba použitelnosti při skladovací teplotě 2 C 8 C má být označena na kartónovém obalu, ale nesmí přesáhnout dobu použitelnosti uvedenou výrobcem na krabičce a štítku. Na konci této doby musí být přípravek použit nebo zlikvidován. Jakmile je přípravek natažen do aplikačního zařízení, musí být okamžitě použit. 6.5 Druh obalu a obsah balení EVICEL je dodáván v balení obsahujícím dvě samostatné injekční lahvičky (sklo typu I) s pryžovou zátkou (typ I), z nichž každá obsahuje 1 ml, 2 ml nebo 5 ml roztoku lidského fibrinogenu a lidského trombinu. Aplikační zařízení a příslušné přídatné špičky jsou dodávány zvlášť. Na trhu nemusí být všechny velikosti balení. 6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním Návod k použití je uveden rovněž v části příbalové informace určené pro zdravotnické pracovníky. Roztoky jsou čiré nebo lehce opalescentní. Nepoužívejte roztoky, které jsou zakalené nebo obsahují usazeniny. Rozmrazení: Injekční lahvičky je třeba rozmrazit jedním z následujících způsobů: 2 C 8 C (chladnička): injekční lahvičky se rozmrazují 1 den, nebo 20 C 25 C (pokojová teplota): injekční lahvičky se rozmrazují 1 hodinu, nebo 37 C (např. vodní lázeň za použití aseptických technik nebo ohřívání injekčních lahviček v dlaních): injekční lahvičky by se měly rozmrazit do 10 minut a nesmí být vystaveny této teplotě déle než 10 minut nebo dokud nejsou dostatečně rozmražené. Teplota nesmí přesáhnout 37 C. Před použitím musí přípravek dosáhnout teploty 20 C 30 C. Sestavení zařízení EVICEL by měl být aplikován pouze za použití aplikačního zařízení EVICEL označeného známkou CE a podle potřeby též za použití přídatných špiček k této aplikační pomůcce. Příbalové informace s podrobným návodem k použití přípravku EVICEL s pomocí aplikačního zařízení a případně i přídatných špiček jsou dodávány v balení aplikačního zařízení a přídatných špiček. Přídatné špičky smějí používat pouze osoby dostatečně vyškolené v oblasti laparoskopických zákroků, zákroků s laparoskopickou asistencí či otevřených chirurgických zákroků. Natáhněte obsah obou injekčních lahviček do aplikačního zařízení a postupujte při tom podle návodu k použití aplikačního zařízení, který je součástí balení. Obě stříkačky by měly být naplněny stejným množstvím tekutiny a neměly by obsahovat žádné vzduchové bubliny. K přípravě podání přípravku EVICEL se nepoužívají jehly. 9
10 Aplikace kapáním Držte špičku aplikátoru co nejblíže povrchu tkáně, avšak bez toho, aby se jí špička aplikátoru během aplikace dotkla, a pokapejte jednotlivými kapkami ošetřovanou oblast. Jestliže se špička aplikátoru ucpe, špička katétru může být zkracována po 0,5 cm. Aplikace nástřikem Aby se předešlo riziku potenciálně život ohrožující vzduchové nebo plynové embolie, smí se EVICEL aplikovat pouze pomocí stlačeného CO 2 (viz tabulka níže). Regulátor tlaku je třeba používat v souladu s pokyny výrobce. Spojte krátkou trubici na aplikačním zařízení se zasunovací luerovou koncovkou na dlouhé trubici, která přivádí plyn. Připojte samičí luerový spoj trubice s plynem (s 0,2μm bakteriostatickým filtrem) k regulátoru tlaku. Při aplikaci přípravku EVICEL pomocí nástřikového zařízení je nutné zajistit, že rozsah tlaku a vzdálenosti od tkáně odpovídá rozmezí, které doporučil držitel registrace tohoto výrobku, jak je uvedeno v následující tabulce: Operace Otevřená operace Laparosko pické zákroky Nástřiková souprava, která má být použita Aplikační zařízení EVICEL Špičky aplikátoru, které mají být použity Ohebná špička, 6 cm Tuhá špička, 35 cm Ohebná špička, 45 cm Tuhá špička, 35 cm Ohebná špička, 45 cm Tlakový regulátor, který má být použit Tlakový regulátor Omrix Doporučená vzdálenost od cílové tkáně cm (4 6 palců) 4 10 cm (1,6 4 palce) Doporučený tlak při nástřiku psi (1,4 1,7 bar) psi (1,0 1,4 bar) 20 psi (1,4 bar) Přípravek by měl být nastříkán na povrch tkáně v krátkých dávkách (0,1 0,2 ml) tak, aby se vytvořila tenká rovnoměrná vrstva. EVICEL vytvoří průhledný film přes celou ošetřovanou oblast. Při nástřiku výrobku EVICEL je třeba monitorovat změny v krevním tlaku, pulzu, nasycení kyslíkem a koncentraci CO 2 na konci výdechu, protože je zde možnost výskytu plynové embolie. Při používání přídatných špiček s tímto výrobkem je třeba řídit se návodem k použití. Likvidace Všechen nepoužitý přípravek nebo odpad musí být zlikvidovány v souladu s místními požadavky. 7. DRŽITEL ROZHODNUTÍ O REGISTRACI Omrix Biopharmaceuticals N.V. Leonardo Da Vinci Laan 15 B-1831 Diegem Belgie 10
11 Tel.: Fax: REGISTRAČNÍ ČÍSLO(A) EU/1/08/473/001 EU/1/08/473/002 EU/1/08/473/ DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE Datum první registrace: 6. října 2008 Datum posledního prodloužení registrace: 6. října DATUM REVIZE TEXTU Podrobné informace o tomto léčivém přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky 11
12 PŘÍLOHA II A. VÝROBCE BIOLOGICKÝCH LÉČIVÝCH LÁTEK A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU 12
13 A. VÝROBCE BIOLOGICKÝCH LÉČIVÝCH LÁTEK A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ Název a adresa výrobce biologické léčivé látky Fibrinogenum humanum a thrombinum humanum: Omrix Biopharmaceuticals Ltd. Plasma Fractionation Institute (Omrix-PFI) MDA Blood Bank Sheba Hospital Ramat Gan POB 888 Kiryat Ono Izrael Fibrinogenum humanum: Omrix Biopharmaceuticals Ltd. Jerusalem Plant (Omrix-JP) 5 Kiryat Hamada St., Ramot Meir Building Har-Hotzvim P.O.B Jerusalem , Izrael Název a adresa výrobce odpovědného za propouštění šarží Omrix Biopharmaceuticals N.V. Leonardo Da Vinci Laan 15 B-1831 Diegem Belgie B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz Příloha I: Souhrn údajů o přípravku, bod 4.2). Úřední propouštění šarží Podle článku 114 směrnice 2001/83/ES bude úřední propouštění šarží provádět některá státní laboratoř nebo laboratoř k tomuto účelu určená. C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE Pravidelně aktualizované zprávy o bezpečnosti Požadavky předkládat pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek jsou stanoveny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakýchkoli následujících aktualizacích zveřejněných na evropském webovém portálu pro léčivé přípravky. D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU 13
14 Plán řízení rizik (RMP) Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu registrace a ve veškerých schválených následných aktualizacích RMP. Aktualizovaný RMP je třeba předložit: na žádost Evropské agentury pro léčivé přípravky při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik). Pokud se shodují data předložené aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně. Další opatření k minimalizaci rizik V souladu s - rozhodnutím Evropské komise pro tuto proceduru EMEA/H/C/000898/A20/0018 pro zmírnění rizika potenciálně život ohrožující embolie způsobené vzduchem/plynem při nástřiku přípravku při vyšším než doporučeném tlaku a/nebo v těsné blízkosti povrchu tkáně, musí držitel rozhodnutí o registraci zajistit: - Pokud je přípravek EVICEL nastřikován stlačeným plynem, měl by to být plynný oxid uhličitý, protože větší rozpustnost oxidu uhličitého v krvi snižuje riziko embolie. - EVICEL se nenastřikuje přes endoskop, pokud nelze dodržet doporučenou minimální bezpečnou vzdálenost od tkáně. Regulátory tlaku nesmí překročit maximální tlak 1,7 barů pro nástřik EVICEL a obsahují štítky s doporučeným tlakem a vzdáleností. Držitel rozhodnutí o registraci zajistí, aby všichni uživatelé nástřikové aplikace tohoto výrobku obdrželi: - štítky pro regulátor tlaku s informacemi o správném tlaku a vzdálenostech při otevřených a laparoskopických postupech - varovnou tabulku s informacemi o správném tlaku a vzdálenostech při otevřených a laparoskopických postupech - visačku s návodem k použití pro umístění na vzduchové hadici zařízení. Pokud se visačka dodává jako součást zdravotnického výrobku, je třeba ji zahrnout do příbalové informace formou změny registrace Držitel rozhodnutí o registraci musí zajistit, aby v každém členském státě, kde je přípravek Evicel uváděn na trh, byly zdravotnickému personálu, který používá přípravek Evicel, poskytnuty vzdělávací materiály zaměřené na zvýšení povědomí o riziku život ohrožující embolie při nesprávném nástřiku přípravku a poskytnutí pokynů, jak toto riziko zvládat: Tyto vzdělávací materiály by měly obsahovat: o Souhrn údajů o přípravku o Část s bodem Následující informace jsou určeny pouze lékařům nebo zdravotnickému personálu nejnovější příbalové informace o Školicí materiál pro zdravotnický personál Školicí materiál pro zdravotnický personál musí informovat o o riziku život ohrožující embolie při nesprávném nástřiku přípravku o použití pouze stlačeného CO 2 14
15 o o o o o omezení na otevřené a laparoskopické chirurgické zákroky, přičemž musí být dodržována minimální vzdálenost nástřiku: - otevřený chirurgický zákrok minimálně 10 cm - laparoskopický chirurgický zákrok minimálně 4 cm, pokud lze přesně posoudit rozprašovací vzdálenost správný tlak a vzdálenost od tkáně podle druhu chirurgického zákroku (otevřený nebo laparoskopický) požadavek na osušení rány s použitím standardní techniky (např. střídavá aplikace kompresí, tyčinek, použití odsávačů) před použitím výrobku požadavek na pečlivé sledování krevního tlaku, tepu, saturace kyslíkem a CO 2 na konci výdechu během nastřikování přípravku, aby se zjistila případná plynová embolie které regulátory je třeba použít v souladu s doporučením výrobce a návodem k použití v souhrnu údajů o přípravku Přesný obsah a formát vzdělávacího materiálu a vzdělávacího programu, včetně komunikačních médií, způsobů distribuce a všech dalších aspektů programu, musí být dohodnuty s příslušnou národní autoritou. 15
16 PŘÍLOHA III OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE 16
17 A. OZNAČENÍ NA OBALU 17
18 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KARTÓNOVÁ KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU EVICEL roztoky pro tkáňové lepidlo. fibrinogenum humanum, thrombinum humanum 2. OBSAH LÉČIVÉ LÁTKY/ LÉČIVÝCH LÁTEK Léčivé látky v přípravku jsou následující: Složka 1: 1 injekční lahvička obsahuje 1 ml proteinum humanum praeparatum (50 90 mg/ml) Složka 2: 1 injekční lahvička obsahuje 1 ml thrombinum humanum ( IU/ml). Léčivé látky v přípravku jsou následující: Složka 1: 1 injekční lahvička obsahuje 2 ml proteinum humanum praeparatum (50 90 mg/ml) Složka 2: 1 injekční lahvička obsahuje 2 ml thrombinum humanum ( IU/ml). Léčivé látky v přípravku jsou následující: Složka 1: 1 injekční lahvička obsahuje 5 ml proteinum humanum praeparatum (50 90 mg/ml) Složka 2: 1 injekční lahvička obsahuje 5 ml thrombinum humanum ( IU/ml). 3. SEZNAM POMOCNÝCH LÁTEK Lidský fibrinogen: arginin-hydrochlorid, glycin, chlorid sodný, natrium-citrát, chlorid vápenatý, voda na injekci. Lidský trombin: chlorid vápenatý, lidský albumin, mannitol, natrium-acetát, voda na injekci. 4. LÉKOVÁ FORMA A OBSAH BALENÍ Roztoky pro tkáňové lepidlo 1 injekční lahvička obsahuje 1 ml proteinum humanum praeparatum 1 injekční lahvička obsahuje 1 ml thrombinum humanum 1 injekční lahvička obsahuje 2 ml proteinum humanum praeparatum 1 injekční lahvička obsahuje 2 ml thrombinum humanum 1 injekční lahvička obsahuje 5 ml proteinum humanum praeparatum 1 injekční lahvička obsahuje 5 ml thrombinum humanum 18
19 5. ZPŮSOB A CESTA/CESTY PODÁNÍ Epilezionální podání. Před použitím si přečtěte příbalovou informaci. 6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ Uchovávejte mimo dohled a dosah dětí. 7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ Nepoužívejte intravaskulárně 8. POUŽITELNOST Použitelné do: 9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ Udržujte ve svislé poloze. Rozmrazený přípravek znovu nezmrazujte. Uchovávejte ve vnějším kartónovém obalu při teplotě -18 C nebo nižší, aby byl přípravek chráněn před světlem. Po rozmrazení uchovávejte neotevřené injekční lahvičky ve vnějším kartónovém obalu při teplotě 2 C 8 C po dobu až 30 dnů od: 10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ 11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI Omrix Biopharmaceuticals N.V. Leonardo Da Vinci Laan 15 B-1831 Diegem Belgie 12. REGISTRAČNÍ ČÍSLO/ČÍSLA EU/1/08/473/001 EU/1/08/473/002 EU/1/08/473/ ČÍSLO ŠARŽE Č.š.: 19
20 14. KLASIFIKACE PRO VÝDEJ 15. NÁVOD K POUŽITÍ 16. INFORMACE V BRAILLOVĚ PÍSMU Nevyžaduje se odůvodnění přijato. 17. JEDINEČNÝ IDENTIFIKÁTOR 2D ČÁROVÝ KÓD 2D čárový kód s jedinečným identifikátorem. 18. JEDINEČNÝ IDENTIFIKÁTOR DATA ČITELNÁ OKEM PC: SN: NN: 20
21 MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK INJEKČNÍ LAHVIČKY 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ EVICEL roztoky pro tkáňové lepidlo fibrinogenum humanum: Složka 1: proteinum humanum praeparatum mg/ml 2. ZPŮSOB PODÁNÍ Epilezionální podání. 3. POUŽITELNOST Použitelné do: 4. ČÍSLO ŠARŽE Č.š.: 5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET 1 ml 2 ml 5 ml 6. JINÉ Používá se jako léčivý přípravek o dvou složkách s dodaným zařízením k aplikaci. 21
22 MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK INJEKČNÍ LAHVIČKY 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ EVICEL roztoky pro tkáňové lepidlo thrombinum humanum: Složka 2: thrombinum humanum IU/ml 2. ZPŮSOB PODÁNÍ Epilezionální podání. 3. POUŽITELNOST Použitelné do: 4. ČÍSLO ŠARŽE Č.š.: 5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET 1 ml 2 ml 5 ml 6. JINÉ Používá se jako léčivý přípravek o dvou složkách s dodaným zařízením k aplikaci. 22
23 B. PŘÍBALOVÁ INFORMACE 23
24 Příbalová informace: informace pro pacienta EVICEL roztoky pro tkáňové lepidlo fibrinogenum humanum/ thrombinum humanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje obsahovat pro Vás důležité údaje. - Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu. - Máte-li jakékoli další otázky, zeptejte se svého lékaře. - Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4. Co naleznete v této příbalové informaci: 1. Co je EVICEL a k čemu se používá 2. Co potřebujete vědět, než začnete EVICEL používat 3. Jak se EVICEL používá 4. Možné nežádoucí účinky 5 Jak EVICEL uchovávat 6. Obsah balení a další informace 1. Co je EVICEL a k čemu se používá EVICEL je tkáňové lepidlo na bázi lidského fibrinu, které je dodáváno v balení obsahujícím dvě samostatné injekční lahvičky, každá s obsahem 1 ml, 2 ml nebo 5 ml roztoku (jedna lidského fibrinogenu a druhá lidského trombinu). Aplikační zařízení a příslušné přídatné špičky jsou dodávány zvlášť. Fibrinogen je koncentrát srážlivého proteinu a trombin je enzym, který způsobuje, že se srážlivý protein spojuje. Při smíchání obou složek dochází tudíž k okamžitému srážení. EVICEL se používá u dospělých při chirurgických operacích ke zmírnění krvácení a mokvání během operace a po operaci. EVICEL lze použít při cévních operacích a při operacích v prostoru mezi střevy a zadní stěnou dutiny břišní. EVICEL lze také použít jako podporu pro vodotěsný uzávěr mozkových obalů (tvrdá plena mozková) během neurochirurgického zákroku, pokud jsou další chirurgické techniky nedostatečné. Přípravek se nakape nebo nastříká na řezanou tkáň, kde vytvoří tenkou vrstvu, která tkáň zalepí anebo zastaví krvácení. 2. Co potřebujete vědět, než začnete EVICEL používat Nepoužívejte EVICEL Jestliže jste přecitlivělý/á (alergický/á) na přípravky vyrobené z lidské krve nebo na kteroukoli další složku přípravku EVICEL (uvedenou v bodě 6). Příznaky alergických reakcí zahrnují kopřivku, vyrážku, pocit tísně na hrudi, dušnost, pokles krevního tlaku a dýchací obtíže. Pakliže se tyto příznaky objeví, podávání musí být okamžitě přerušeno. 24
25 EVICEL se nesmí podávat intravaskulárně EVICEL se nesmí používat při endoskopických operacích. Pro laparoskopii viz doporučení níže. EVICEL se nesmí používat pro utěsnění linie sutury tvrdé pleny mozkové, pokud jsou po sešití přítomné mezery větší než 2 mm. EVICEL se nesmí používat jako lepidlo pro fixaci záplat tvrdé pleny mozkové. EVICEL se nesmí používat jako lepidlo, pokud není možné tvrdou plenu mozkovou sešít. Upozornění a opatření Aby se předešlo riziku potenciálně život ohrožující vzduchové neboli plynové embolie, smí se EVICEL aplikovat pouze pomocí stlačeného CO 2, Před aplikací přípravku EVICEL je třeba povrch rány osušit standardní technikou (např. přerušovanou aplikací kompresních obvazů, pomocí tamponů nebo odsávacích zařízení). Když je EVICEL během operace podáván, chirurg musí dbát na to, aby přípravek aplikoval pouze na povrch tkáně. EVICEL nesmí být vstřikován do tkáně nebo do krevních cév, protože by došlo ke vzniku sraženin a k ohrožení života. Použití přípravku EVICEL v rámci následujících postupů nebylo zkoumáno, a proto nejsou k dispozici žádné informace prokazující účinnost přípravku v těchto zákrocích: slepování tkání; chirurgický zákrok na mozku či míše, s výjimkou podpory vodotěsného uzávěru mozkových obalů (tvrdá plena mozková); kontrola krvácení v žaludku či ve střevech prostřednictvím aplikace přípravku endoskopem (trubicí); lepení tkání při chirurgických zákrocích na střevech; utěsnění při transfenoidálních a otoneurochirurgických zákrocích. Není známo, zda by radiační terapie mohla ovlivnit účinnost fibrinového lepidla, pokud se použije pro utěsnění linie sutury během neurochirurgického zákroku. Použití přípravku EVICEL během neurochirurgického zákroku u pacientů, kteří jsou současně léčení implantáty nebo záplatami tvrdé pleny mozkové, nebylo hodnoceno v klinických studiích. Krvácení má být kontrolováno před použitím přípravku EVICEL, aby se utěsnila linie sutury tvrdé pleny mozkové. EVICEL se aplikuje v tenké vrstvě. Příliš silný nános může negativně ovlivnit působnost výrobku a proces hojení rány. Při použití nástřikových zařízení s tlakovým regulátorem při aplikaci výrobku EVICEL došlo k životu ohrožující vzduchové nebo plynové embolii. Zdá se, že tato příhoda souvisí s použitím nástřikových zařízení při vyšším než doporučeném tlaku nebo v těsné blízkosti povrchu tkáně. EVICEL se smí aplikovat nástřikem pouze v případech, kdy je možné přesně odhadnout vzdálenost nástřikového zařízení od tkáně, zejména během laparoskopie. Vzdálenost od tkáně a tlak musí být v rozmezí doporučeném výrobcem (viz tabulka v bodu Návod k použití). Při nástřiku výrobku EVICEL je třeba monitorovat změny v krevním tlaku, pulzu, nasycení kyslíkem a koncentraci CO 2 na konci výdechu, protože je zde možnost výskytu vzduchové nebo plynové embolie. Nástřiková zařízení a přídavné špičky jsou dodávány s návodem k použití obsahujícím doporučené rozmezí tlaku a vzdálenosti k povrchu tkáně, které je třeba přesně dodržovat. Okolí místa aplikace je třeba ochránit, aby se zajistilo, že přípravek EVICEL bude aplikován pouze na povrch určených oblastí. Mohou se vyskytnout hypersenzitivní reakce alergického druhu stejně jako v případě jiných 25
26 přípravků s obsahem bílkovin. Mezi příznaky těchto reakcí patří kopřivka, vyrážka, pocit tíže na hrudi, dušnost, pokles krevního tlaku a anafylaxe. Při výskytu těchto příznaků je třeba okamžitě přerušit podávání přípravku. Jsou-li léčivé přípravky vyráběné z lidské krve nebo plazmy, musí být učiněna určitá opatření, aby se zabránilo přenosu infekcí na pacienty. Tato opatření zahrnují pečlivý výběr dárců krve a plazmy, aby bylo zajištěno vyloučení těch, u nichž je riziko infekcí, a rovněž testování jednotlivých odebraných dávek a plazmy na příznaky virů/infekcí. Výrobci těchto přípravků používají při zpracování krve a plazmy také postupy, které mohou viry inaktivovat nebo odstranit. Přes všechna tato opatření nemůže být možnost přenosu infekce při podávání léků vyráběných z lidské krve nebo plazmy zcela vyloučena, což platí i v případě dosud neznámých nebo nových virů či jiných druhů infekcí. Opatření uplatňovaná při výrobě fibrinogenu a trombinu jsou považována za účinná v případě lipidem obalených virů, jako je virus lidské imunodeficience (HIV), virus hepatitidy B a virus hepatitidy C, a v případě neobaleného viru hepatitidy A. Omezenou účinnost mohou mít tato opatření u parvoviru B19. Infekce parvovirem B19 může mít vážné následky u těhotných ženy (infekce plodu) a u jedinců se sníženou funkcí imunitního systému nebo s některým z typů chudokrevnosti (např. srpkovitá anémie nebo hemolytická anémie). Zdravotničtí pracovníci zaznamenají jméno pacienta a číslo šarže přípravku tak, aby bylo možné dohledat zdroj případné infekce. Děti a dospívající K dispozici jsou příliš omezené údaje na podporu bezpečnosti a účinnosti přípravku EVICEL u dětí a dospívajících. Další léčivé přípravky a přípravek EVICEL Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat, včetně léků bez předpisu. Těhotenství a kojení K posouzení toho, zda existují zvláštní rizika spojená s používáním přípravku EVICEL během těhotenství a kojení, není k dispozici dostatek údajů. Vzhledem k tomu, že EVICEL se používá při operačních zákrocích, měla byste se v případě, že jste těhotná nebo kojíte, poradit se svým lékařem o celkové riskantnosti tohoto zákroku. 3. Jak se EVICEL používá Váš ošetřující lékař vám přípravek EVICEL podá během operace. Během operace lékař nakape nebo nastříká EVICEL na tkáň pomocí aplikačního zařízení. Toto zařízení umožňuje nanést ve stejném okamžiku stejné množství obou složek přípravku EVICEL a zajistit jejich rovnoměrné smísení, což je důležité pro optimální účinek tkáňového lepidla. Použité množství přípravku EVICEL závisí na ploše tkáně, která má být v průběhu operace ošetřena. Přípravek se nakape na tkáň ve velmi malém množství nebo se nastříká v krátkých dávkách (0,1 0,2 ml) tak, aby se vytvořila tenká rovnoměrná vrstva. Pokud aplikace jediné vrstvy přípravku EVICEL k zastavení krvácení nepostačuje, je možné nanést druhou vrstvu. 4. Možné nežádoucí účinky Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého. Následující nežádoucí účinky, které se vyskytly v průběhu klinických studií, byly vyhodnoceny jako účinky, které mohou mít příčinnou souvislost s léčbou přípravkem EVICEL. 26
27 Nejvážnější nežádoucí účinky - Tekutina odcházející z rány nebo nosu (únik mozkomíšního moku, rinorea mozkomíšního moku) - Bolesti hlavy, nevolnost a zvracení (v důsledku subdurálního hygromu, což je hromadění mozkomíšního moku v subdurálním prostoru) - Horečka nebo chronická zácpa, nadýmání (v důsledku břišního abscesu) Frekvence výskytu uvedených účinků byla častá (mohou postihovat až 1 osobu z 10). - Necitlivost nebo bolesti končetin, změna barvy kůže (v důsledku uzávěru štěpu nebo trombózy) Četnost tohoto účinku byla méně častá (může postihovat až 1 osobu ze 100). Pokud se u vás vyskytne kterýkoli z výše uvedených nežádoucích účinků nebo jiné příznaky související s operací, sdělte to okamžitě svému lékaři nebo chirurgovi. Pokud se necítíte dobře, okamžitě to sdělte svému lékaři, a to i v případě, že vaše příznaky se od těch výše popsaných budou lišit. Další nežádoucí účinky Další nežádoucí účinky, které byly hlášeny jako časté během klinických zkoušek s přípravkem EVICEL (tj. mohly postihovat až 1 osobu z 10), zahrnovaly meningitidu a akumulaci mozkomíšního moku v mozkových dutinách (hydrocefalus). Frekvence všech těchto účinků byla častá. Nežádoucí účinky, které byly během klinických zkoušek přípravku EVICEL méně časté (tj. mohly postihovat až 1 osobu ze 100), zahrnovaly infekci, akumulaci krve (hematom), otok, pokles hemoglobinu a pooperační komplikace z rány (včetně krvácení nebo infekce). EVICEL je fibrinové tkáňové lepidlo. Fibrinová tkáňová lepidla mohou obecně, i když pouze ve vzácných případech (až 1 pacient z 1000), vyvolat alergickou reakci. V případě, že by se u vás alergická reakce vyskytla, mohl(a) byste mít některý z následujících příznaků: kožní vyrážku, kopřivku, pocit tísně na hrudi, třesavku, zrudnutí, bolest hlavy, nízký krevní tlak, otupělost, nevolnost, neklid, zrychlenou srdeční frekvenci, mravenčení, zvracení nebo dušnost. U pacientů ošetřených přípravkem EVICEL nebyla dosud žádná alergická reakce zaznamenána. Je rovněž teoreticky možné, že by se u vás vytvořily protilátky proti proteinům obsaženým v přípravku EVICEL a tyto protilátky by pak mohly mít nepříznivý vliv na srážení krve. Výskyt tohoto typu příhody není známý (není možné odhadnout z dostupných údajů). Hlášení nežádoucích účinků Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku. 5. Jak EVICEL uchovávat Uchovávejte tento přípravek mimo dohled a dosah dětí. Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na štítku a krabičce za nápisem Použitelné do. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce. Injekční lahvičky je třeba skladovat ve svislé poloze. 27
28 Uchovávejte v mrazničce při teplotě -18 C nebo nižší. Uchovávejte injekční lahvičky v krabičce, aby byl přípravek chráněn před světlem. Znovu nezmrazujte. Po rozmrazení mohou být neotevřené injekční lahvičky chráněné před světlem uchovávány při teplotě 2 C 8 C po dobu až 30 dnů. Přípravek během této doby již nelze znovu zmrazit. Nová doba použitelnosti při teplotě uchovávání 2 C 8 C má být označena na kartónovém obalu, ale nesmí přesáhnout dobu použitelnosti uvedenou výrobcem na krabičce a štítku. Na konci této doby musí být přípravek použit nebo zlikvidován. Fibrinogenové a trombinové složky jsou stabilní při pokojové teplotě až po dobu 24 hodin. Po dosažení pokojové teploty chraňte přípravek EVICEL před chladem. Jakmile je natažen do aplikačního zařízení, musí být okamžitě použit. Po 24 hodinách při pokojové teplotě nepoužitý přípravek zlikvidujte. 6. Obsah balení a další informace Co EVICEL obsahuje Léčivými látkami jsou: Složka 1: proteinum humanum praeparatum (obsahující zejména fibrinogen a fibronektin mg/ml) Složka 2: thrombinum humanum ( IU/ml) Dalšími složkami jsou: Složka 1: arginin-hydrochlorid, glycin, chlorid sodný, natrium-citrát, chlorid vápenatý a voda na injekci. Složka 2: chlorid vápenatý, lidský roztok albuminu, mannitol, natrium-acetát a voda na injekci. Jak EVICEL vypadá a co obsahuje toto balení Velikost balení EVICEL je tkáňové lepidlo na bázi lidského fibrinu, které je dodáváno v balení obsahujícím dvě samostatné skleněné injekční lahvičky. Každá obsahuje 1 ml, 2 ml nebo 5 ml roztoku lidského fibrinogenu v jedné a lidského trombinu v druhé. Přípravek EVICEL je dostupný v následujících velikostech balení: 2 x 1 ml, 2 x 2 ml a 2 x 5 ml. Všechny velikosti balení nemusí být na trhu ve všech zemích. Aplikační zařízení a příslušné přídatné špičky jsou dodávány zvlášť. Držitel rozhodnutí o registraci Omrix Biopharmaceuticals N.V. Leonardo Da Vinci Laan 15 B-1831 Diegem Belgie Tel.: Fax:
29 Výrobce: Omrix Biopharmaceuticals Ltd Plasma Fractionation Institute Sheba Hospital, Tel Hashomer Ramat Gan , Israel Tel.: Fax: Tato příbalová informace byla naposledy revidována Další zdroje informací Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky: Na webových stránkách Evropské agentury pro léčivé přípravky je tato příbalová informace k dispozici ve všech úředních jazycích EU/EHP. 29
30 Následující informace jsou určeny pouze pro zdravotnické pracovníky. NÁVOD K POUŽITÍ Přečtěte si tuto informaci dříve, než otevřete balení EVICEL je dodáván ve sterilním balení, a je tudíž důležité používat pouze nepoškozená balení, která nebyla otevřena (přípravek není možné znovu sterilizovat). Uchovávání Schválená doba použitelnosti přípravku EVICEL jsou 2 roky při uchovávání při teplotě -18 o C. Nepoužívejte po uplynutí doby použitelnosti vyznačené na krabičce a štítku. V rámci 2leté doby použitelnosti mohou být neotevřené injekční lahvičky po rozmrazení chráněné před světlem uchovávány při teplotě 2 C 8 C (v chladničce) po dobu až 30 dnů. Na krabičce, kde je pro to určené místo, zaznamenejte datum, kdy byl přípravek uložen do chladničky. Znovu nezmrazujte. Složky fibrinogenu a trombinu jsou stabilní při pokojové teplotě až po dobu 24 hodin, jakmile jsou však nataženy do aplikačního zařízení, musí být okamžitě použity. Injekční lahvičky je třeba uchovávat ve svislé poloze. Nepoužívejte po uplynutí doby použitelnosti vyznačené na krabičce a štítku. Uchovávejte mimo dohled a dosah dětí. Aplikační zařízení se má uchovávat při pokojové teplotě odděleně od fibrinogenu a trombinu. Rozmrazení Injekční lahvičky je třeba rozmrazit jedním z následujících způsobů: 2 C 8 C (chladnička): injekční lahvičky se rozmrazují 1 den, nebo 20 C 25 C (pokojová teplota): injekční lahvičky se rozmrazují 1 hodinu, nebo 37 C (např. vodní lázeň za použití aseptických technik nebo ohřívání injekčních lahviček v dlaních): injekční lahvičky by se měly rozmrazit do 10 minut a nesmí být vystaveny této teplotě déle než 10 minut nebo dokud nejsou dostatečně rozmražené. Teplota nesmí přesáhnout 37 C. Před použitím musí přípravek dosáhnout teploty 20 C 30 C. Příprava EVICEL by měl být aplikován pouze za použití aplikačního zařízení EVICEL označeného známkou CE a podle potřeby též za použití přídatné špičky k tomuto zařízení. Příbalové informace s podrobným návodem k použití přípravku EVICEL s pomocí aplikačního zařízení a případně i přídatné špičky jsou dodávány v balení aplikačního zařízení a jeho přídatných špiček. Přídatné špičky smějí používat pouze osoby dostatečně vyškolené v oblasti laparoskopických zákroků, zákroků s laparoskopickou asistencí či otevřených chirurgických zákroků. Přípravek je nutné rekonstituovat a aplikovat pouze podle pokynů a s pomocí prostředků doporučených pro tento výrobek. Aby se předešlo riziku potenciálně život ohrožující vzduchové nebo plynové embolie, smí se EVICEL aplikovat pouze pomocí stlačeného CO 2. Roztoky jsou čiré nebo lehce opalescentní. Nepoužívejte roztoky, které jsou zakalené nebo obsahují usazeniny. Natáhněte obsah obou injekčních lahviček do aplikačního zařízení a postupujte při tom podle návodu k použití aplikačního zařízení. Obě stříkačky by měly být naplněny stejným množstvím 30
31 tekutiny a neměly by obsahovat žádné vzduchové bubliny. K přípravě podání přípravku EVICEL se nepoužívají jehly. Před aplikací přípravku EVICEL je třeba povrch rány osušit standardní technikou (např. přerušovanou aplikací kompresních obvazů, pomocí tamponů nebo odsávacích zařízení). Aplikace kapáním Držte špičku aplikátoru co nejblíže povrchu tkáně, avšak bez toho, aby se jí špička aplikátoru během aplikace dotkla, a pokapejte jednotlivými kapkami ošetřovanou oblast. Jestliže se špička aplikátoru ucpe, špička katétru může být zkracována po 0,5 cm. Aplikace nástřikem EVICEL se smí aplikovat nástřikem pouze za použití stlačeného CO 2. Spojte krátkou trubici na aplikačním zařízení se zasunovací luerovou koncovkou na dlouhé trubici, která přivádí plyn. Připojte samičí luerový spoj trubice s plynem (s 0,2μm bakteriostatickým filtrem) k regulátoru tlaku. Tlakový regulátor by měl být použit v souladu s pokyny výrobce. Při aplikaci přípravku EVICEL pomocí nástřikového zařízení je nutné dodržet rozsah tlaku a vzdálenosti od tkáně doporučené výrobcem: Operace Otevřená operace Laparosko pické zákroky Nástřiková souprava, která má být použita Aplikační zařízení EVICEL Špičky aplikátoru, které mají být použity Ohebná špička, 6 cm Tuhá špička, 35 cm Ohebná špička, 45 cm Tuhá špička, 35 cm Tlakový regulátor, který má být použit Tlakový regulátor Omrix Vzdálenost od cílové tkáně cm (4 6 palců) 4 10 cm (1,6 4 palce) Tlak při nástřiku psi (1,4 1,7 bar) psi (1,0 1,4 bar) 20 psi (1,4 bar) Ohebná špička, 45 cm Přípravek by měl být nastříkán na povrch tkáně v krátkých dávkách (0,1 0,2 ml) tak, aby se vytvořila tenká rovnoměrná vrstva. EVICEL vytvoří průhledný film přes celou ošetřovanou oblast. Při nástřiku výrobku EVICEL je třeba monitorovat změny v krevním tlaku, pulzu, nasycení kyslíkem a koncentraci CO 2 na konci výdechu, protože je zde možnost výskytu plynové embolie. Likvidace Všechen nepoužitý přípravek nebo odpad musí být zlikvidovány v souladu s místními požadavky. 31
Příloha III Dodatky, které je třeba přidat do příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Dodatky, které je třeba přidat do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku
Příloha III Dodatky, které je třeba přidat do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU EVICEL roztoky pro přípravu tkáňového lepidla 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivými látkami jsou: Složka 1 Lidský srážlivý protein obsahující
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU EVICEL roztoky pro přípravu tkáňového lepidla 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivými látkami jsou: Složka 1 Lidský srážlivý protein obsahující
Léčivé látky: fibrinogenum humanum, thrombinum humanum, aprotininum (syntetické), calcii chloridum
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU VNĚJŠÍ KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Prášky a rozpouštědla pro tkáňové lepidlo Léčivé látky: fibrinogenum humanum, thrombinum humanum, aprotininum (syntetické), calcii
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU VNĚJŠÍ KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Prášky a rozpouštědla pro tkáňové lepidlo Léčivé látky: fibrinogenum humanum, thrombinum humanum, aprotininum (syntetické), calcii
Příbalová informace: informace pro uživatele
 sp.zn. sukls55434/2017 Příbalová informace: informace pro uživatele Kybernin P 500 IU prášek a rozpouštědlo pro injekční/infuzní roztok Kybernin P 1000 IU prášek a rozpouštědlo pro injekční/infuzní roztok
sp.zn. sukls55434/2017 Příbalová informace: informace pro uživatele Kybernin P 500 IU prášek a rozpouštědlo pro injekční/infuzní roztok Kybernin P 1000 IU prášek a rozpouštědlo pro injekční/infuzní roztok
Viru-Merz je účinný při léčbě infekce způsobené virem herpes simplex, ale pouze do fáze vzniku puchýřků.
 sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Procto-Glyvenol 400 mg + 40 mg čípky
 sp.zn. sukls74884/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Procto-Glyvenol 400 mg + 40 mg čípky (tribenosidum, lidocaini hydrochloridum monohydricum) Přečtěte si pozorně tuto příbalovou informaci
sp.zn. sukls74884/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Procto-Glyvenol 400 mg + 40 mg čípky (tribenosidum, lidocaini hydrochloridum monohydricum) Přečtěte si pozorně tuto příbalovou informaci
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU. Léčivý přípravek již není registrován
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
sp.zn.sukls78453/2015
 sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství. 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fanhdi 50 IU/ml Fanhdi
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství. 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fanhdi 50 IU/ml Fanhdi
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 sp.zn. sukls102912/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Pasteurised Human Antitetanus Immunoglobulin Grifols 250 IU/1 ml a 500 IU/2 ml injekční roztok v předplněné injekční stříkačce Immunoglobulinum
sp.zn. sukls102912/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Pasteurised Human Antitetanus Immunoglobulin Grifols 250 IU/1 ml a 500 IU/2 ml injekční roztok v předplněné injekční stříkačce Immunoglobulinum
Příloha 1: Příslušné části "Souhrnu údajů o přípravku", které byly revidované (pozměňovací návrhy k textu jsou zvýrazněny tučně)
 Příloha 1: Příslušné části "Souhrnu údajů o přípravku", které byly revidované (pozměňovací návrhy k textu jsou zvýrazněny tučně) Souhrn údajů o přípravku 4.4 Zvláštní upozornění a opatření pro použití
Příloha 1: Příslušné části "Souhrnu údajů o přípravku", které byly revidované (pozměňovací návrhy k textu jsou zvýrazněny tučně) Souhrn údajů o přípravku 4.4 Zvláštní upozornění a opatření pro použití
Příbalová informace: informace pro uživatele. VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa
 Příbalová informace: informace pro uživatele VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa Přečtěte si pozorně celou příbalovou informaci před použitím tohoto přípravku, protože obsahuje
Příbalová informace: informace pro uživatele VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa Přečtěte si pozorně celou příbalovou informaci před použitím tohoto přípravku, protože obsahuje
Příbalová informace: informace pro uživatele Flexbumin 200 g/l infuzní roztok Albuminum humanum
 Příbalová informace: informace pro uživatele Flexbumin 200 g/l infuzní roztok Albuminum humanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Příbalová informace: informace pro uživatele Flexbumin 200 g/l infuzní roztok Albuminum humanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
TachoSil je téměř bílá matrice pro tkáňové lepidlo. Léčivá strana matrice, která je pokryta fibrinogenem a trombinem, je označena žlutě.
 1. NÁZEV PŘÍPRAVKU TachoSil matrice pro tkáňové lepidlo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden cm 2 TachoSilu obsahuje: Fibrinogenum humanum Thrombinum humanum 2,0 IU 5,5 mg Úplný seznam pomocných
1. NÁZEV PŘÍPRAVKU TachoSil matrice pro tkáňové lepidlo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden cm 2 TachoSilu obsahuje: Fibrinogenum humanum Thrombinum humanum 2,0 IU 5,5 mg Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
Příbalová informace: informace pro pacienta. Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky
 sp.zn. sukls227576/2009 Příbalová informace: informace pro pacienta Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky alcohol dichlorobenzylicus, amylmetacresolum, levomentholum Přečtěte si pozorně tuto
sp.zn. sukls227576/2009 Příbalová informace: informace pro pacienta Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky alcohol dichlorobenzylicus, amylmetacresolum, levomentholum Přečtěte si pozorně tuto
Příloha II. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 3 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Quixil Podkladové informace Quixil je fibrinové tkáňové lepidlo
Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 3 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Quixil Podkladové informace Quixil je fibrinové tkáňové lepidlo
Pomocné látky se známým účinkem: prostý sirup 67%, usušená tekutá glukosa.
 sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Immunoglobulinum humanum normale Jeden ml injekčního roztoku obsahuje Immunoglobulinum humanum normale 160 mg.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IGAMPLIA 160 mg/ml, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Immunoglobulinum humanum normale Jeden ml injekčního roztoku obsahuje Immunoglobulinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IGAMPLIA 160 mg/ml, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Immunoglobulinum humanum normale Jeden ml injekčního roztoku obsahuje Immunoglobulinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
ANTITHROMBIN III NF BAXTER Prášek pro přípravu infuzního roztoku s rozpouštědlem Antithrombinum humanum
 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE ANTITHROMBIN III NF BAXTER Prášek pro přípravu infuzního roztoku s rozpouštědlem Antithrombinum humanum Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE ANTITHROMBIN III NF BAXTER Prášek pro přípravu infuzního roztoku s rozpouštědlem Antithrombinum humanum Přečtěte si pozorně celou příbalovou informaci dříve,
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. ALBUNORM 5% 50g/l, infuzní roztok Lidský albumin
 Sp.zn.sukls151598/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ALBUNORM 5% 50g/l, infuzní roztok Lidský albumin Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Sp.zn.sukls151598/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ALBUNORM 5% 50g/l, infuzní roztok Lidský albumin Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU TachoSil matrice pro tkáňové lepidlo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden cm 2 TachoSilu obsahuje: Fibrinogenum humanum Thrombinum humanum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU TachoSil matrice pro tkáňové lepidlo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden cm 2 TachoSilu obsahuje: Fibrinogenum humanum Thrombinum humanum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ANTITHROMBIN III NF BAXTER, prášek pro přípravu infuzního roztoku s rozpouštědlem 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ 1 ml rozpuštěného přípravku obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ANTITHROMBIN III NF BAXTER, prášek pro přípravu infuzního roztoku s rozpouštědlem 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ 1 ml rozpuštěného přípravku obsahuje
Příbalová informace: informace pro uživatele. Bricanyl 0,5 mg/ml injekční roztok terbutalini sulfas
 Příbalová informace: informace pro uživatele Bricanyl 0,5 mg/ml injekční roztok terbutalini sulfas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Příbalová informace: informace pro uživatele Bricanyl 0,5 mg/ml injekční roztok terbutalini sulfas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok
 www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1.NÁZEV PŘÍPRAVKU: AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok 2.KVALITATIVNÍ A KVANTITATIVNÍ
www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1.NÁZEV PŘÍPRAVKU: AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok 2.KVALITATIVNÍ A KVANTITATIVNÍ
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Vnitřní obal (štítek): Rozpouštědlo ve skleněné lahvičce, typ I, obsah 10 ml
 MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Vnitřní obal (štítek): Rozpouštědlo ve skleněné lahvičce, typ I, obsah 10 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ Voda na injekci 10 ml 2. ZPŮSOB
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Vnitřní obal (štítek): Rozpouštědlo ve skleněné lahvičce, typ I, obsah 10 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ Voda na injekci 10 ml 2. ZPŮSOB
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. OMACOR 1000 mg měkké tobolky Omega-3 acidorum esteri ethylici 90
 Sp.zn.sukls118606/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE OMACOR 1000 mg měkké tobolky Omega-3 acidorum esteri ethylici 90 Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Sp.zn.sukls118606/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE OMACOR 1000 mg měkké tobolky Omega-3 acidorum esteri ethylici 90 Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA
 sp.zn.sukls49563/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte si
sp.zn.sukls49563/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte si
Příbalová informace: informace pro uživatele. Haemocomplettan P 2 g Prášek pro injekční/infuzní roztok. (fibrinogenum humanum)
 sp.zn. sukls169431/2015 Příbalová informace: informace pro uživatele Haemocomplettan P 2 g Prášek pro injekční/infuzní roztok (fibrinogenum humanum) Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn. sukls169431/2015 Příbalová informace: informace pro uživatele Haemocomplettan P 2 g Prášek pro injekční/infuzní roztok (fibrinogenum humanum) Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: informace pro uživatele. Haemocomplettan P 2 g Prášek pro injekční/infuzní roztok. (fibrinogenum humanum)
 sp.zn. sukls223368/2013 Příbalová informace: informace pro uživatele Haemocomplettan P 2 g Prášek pro injekční/infuzní roztok (fibrinogenum humanum) Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn. sukls223368/2013 Příbalová informace: informace pro uživatele Haemocomplettan P 2 g Prášek pro injekční/infuzní roztok (fibrinogenum humanum) Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. CAMILIA perorální roztok v jednodávkovém obalu
 sp.zn. sukls179376/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CAMILIA perorální roztok v jednodávkovém obalu Chamomilla vulgaris 9 CH, Phytolacca decandra 5 CH, Rheum 5 CH Přečtěte si pozorně tuto
sp.zn. sukls179376/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CAMILIA perorální roztok v jednodávkovém obalu Chamomilla vulgaris 9 CH, Phytolacca decandra 5 CH, Rheum 5 CH Přečtěte si pozorně tuto
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Anbinex 50 IU/ml, prášek a rozpouštědlo pro injekční roztok Antithrombinum III
 sp.zn. sukls43174/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Anbinex 50 IU/ml, prášek a rozpouštědlo pro injekční roztok Antithrombinum III Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn. sukls43174/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Anbinex 50 IU/ml, prášek a rozpouštědlo pro injekční roztok Antithrombinum III Přečtěte si pozorně celou příbalovou informaci dříve,
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls107935/2012
 sp.zn. sukls107935/2012 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta Mucoplant proti kašli s jitrocelem a medem sirup Plantaginis extractum fluidum Přečtěte si pozorně tuto příbalovou
sp.zn. sukls107935/2012 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta Mucoplant proti kašli s jitrocelem a medem sirup Plantaginis extractum fluidum Přečtěte si pozorně tuto příbalovou
prášek pro infuzní roztok
 sp.zn. sukls52667/2015 Příbalová informace: informace pro uživatele Soluvit N prášek pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp.zn. sukls52667/2015 Příbalová informace: informace pro uživatele Soluvit N prášek pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Příbalová informace: informace pro uživatele
 sp.zn. sukls120097/2014 Příbalová informace: informace pro uživatele TYPHIM Vi Injekční roztok v předplněné injekční stříkačce Typhoidi capsulae Vi polysaccharidum purificatum (stripe Ty2) - (polysacharidová
sp.zn. sukls120097/2014 Příbalová informace: informace pro uživatele TYPHIM Vi Injekční roztok v předplněné injekční stříkačce Typhoidi capsulae Vi polysaccharidum purificatum (stripe Ty2) - (polysacharidová
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 400 mg + 40 mg. čípky PROCTO-GLYVENOL. 50 mg/g + 20 mg/g. rektální krém
 sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro přípravu infuzního roztoku
 Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls242661/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro přípravu
Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls242661/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro přípravu
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum
 Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 sp.zn. sukls171995/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte
sp.zn. sukls171995/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte
Příbalová informace: informace pro uživatele. ANTITHROMBIN III BAXALTA Prášek a rozpouštědlo pro infuzní roztok Antithrombinum III
 Příbalová informace: informace pro uživatele ANTITHROMBIN III BAXALTA Prášek a rozpouštědlo pro infuzní roztok Antithrombinum III Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příbalová informace: informace pro uživatele ANTITHROMBIN III BAXALTA Prášek a rozpouštědlo pro infuzní roztok Antithrombinum III Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Parsabiv 2,5 mg injekční roztok Parsabiv 5 mg injekční roztok Parsabiv 10 mg injekční roztok Etelcalcetidum Tento přípravek podléhá dalšímu sledování. To umožní
Příbalová informace: informace pro uživatele Parsabiv 2,5 mg injekční roztok Parsabiv 5 mg injekční roztok Parsabiv 10 mg injekční roztok Etelcalcetidum Tento přípravek podléhá dalšímu sledování. To umožní
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Hirudoid forte gel 445mg/100g glycosaminoglycani polysulfas z hovězí trachey (průdušnice)
 www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva sp.zn. sukls9243/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Hirudoid forte gel 445mg/100g glycosaminoglycani polysulfas z hovězí
www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva sp.zn. sukls9243/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Hirudoid forte gel 445mg/100g glycosaminoglycani polysulfas z hovězí
Příbalová informace: informace pro pacienta. ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro infuzní roztok
 sp.zn. sukls36126/2014 Příbalová informace: informace pro pacienta ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci
sp.zn. sukls36126/2014 Příbalová informace: informace pro pacienta ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro uživatele Rhesonativ 625 IU/ml, injekční roztok Lidský imunoglobulin anti-d
 sp.zn. sukls117295/2013 Příbalová informace: informace pro uživatele Rhesonativ 625 IU/ml, injekční roztok Lidský imunoglobulin anti-d Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp.zn. sukls117295/2013 Příbalová informace: informace pro uživatele Rhesonativ 625 IU/ml, injekční roztok Lidský imunoglobulin anti-d Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011. Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku)
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ciprobay 200 Infuzní roztok ciprofloxacinum 2. OBSAH LÉČIVÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ciprobay 200 Infuzní roztok ciprofloxacinum 2. OBSAH LÉČIVÉ
Jeden ml injekčního roztoku obsahuje granisetronum 1 mg (ve formě hydrochloridu)
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 3 mg/3 ml 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml injekčního roztoku obsahuje granisetronum 1 mg (ve formě hydrochloridu) 3. SEZNAM
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 3 mg/3 ml 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml injekčního roztoku obsahuje granisetronum 1 mg (ve formě hydrochloridu) 3. SEZNAM
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Bronchostop sirup. Léčivé látky: suchý tymiánový extrakt, tekutý proskurníkový extrakt
 Sp.zn.sukls391511/2017 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Bronchostop sirup Léčivé látky: suchý tymiánový extrakt, tekutý proskurníkový extrakt Přečtěte si pozorně tuto příbalovou informaci dříve,
Sp.zn.sukls391511/2017 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Bronchostop sirup Léčivé látky: suchý tymiánový extrakt, tekutý proskurníkový extrakt Přečtěte si pozorně tuto příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Glucosum monohydricum
 sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
Příbalová informace: informace pro uživatele. Sodium Chromate ( 51 Cr) Solution 37 MBq/ml, radionuklidový prekurzor, roztok
 sp.zn. sukls301709/2016 Příbalová informace: informace pro uživatele Sodium Chromate ( 51 Cr) Solution 37 MBq/ml, radionuklidový prekurzor, roztok Natrii chromas ( 51 Cr) Přečtěte si pozorně celou příbalovou
sp.zn. sukls301709/2016 Příbalová informace: informace pro uživatele Sodium Chromate ( 51 Cr) Solution 37 MBq/ml, radionuklidový prekurzor, roztok Natrii chromas ( 51 Cr) Přečtěte si pozorně celou příbalovou
Příbalová informace: informace pro pacienta. Maltofer 50 mg/ml perorální kapky, roztok
 sp.zn.: sukls229282/2011 Příbalová informace: informace pro pacienta Maltofer 50 mg/ml perorální kapky, roztok polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn.: sukls229282/2011 Příbalová informace: informace pro pacienta Maltofer 50 mg/ml perorální kapky, roztok polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Jedna předplněná injekční stříkačka obsahuje immunoglobulinum humanum anti-d 1500 IU (300 mikrogramů).
 sp. zn. sukls262204/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Igamad 1500 IU, injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
sp. zn. sukls262204/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Igamad 1500 IU, injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
Příbalová informace: informace pro pacienta. ANACID 258 mg/388 mg perorální suspenze. Magnesii hydroxidum, Algeldrati suspensio
 sp.zn. sukls264215/2017 Příbalová informace: informace pro pacienta ANACID 258 mg/388 mg perorální suspenze Magnesii hydroxidum, Algeldrati suspensio Přečtěte si pozorně tuto příbalovou informaci dříve,
sp.zn. sukls264215/2017 Příbalová informace: informace pro pacienta ANACID 258 mg/388 mg perorální suspenze Magnesii hydroxidum, Algeldrati suspensio Přečtěte si pozorně tuto příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Sinupret perorální kapky, roztok Herbarum extractum pro Sinupret
 sp.zn.sukls240326/2018 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Sinupret perorální kapky, roztok Herbarum extractum pro Sinupret Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento
sp.zn.sukls240326/2018 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Sinupret perorální kapky, roztok Herbarum extractum pro Sinupret Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento
Příbalová informace: informace pro uživatele. IMVANEX injekční suspenze Vakcína proti pravým neštovicím (živý modifikovaný virus vakcínie Ankara)
 Příbalová informace: informace pro uživatele IMVANEX injekční suspenze Vakcína proti pravým neštovicím (živý modifikovaný virus vakcínie Ankara) Tento přípravek podléhá dalšímu sledování. To umožní rychlé
Příbalová informace: informace pro uživatele IMVANEX injekční suspenze Vakcína proti pravým neštovicím (živý modifikovaný virus vakcínie Ankara) Tento přípravek podléhá dalšímu sledování. To umožní rychlé
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU Lahev s obsahem 300 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Levetiracetam UCB 100 mg/ml, perorální roztok levetiracetamum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU Lahev s obsahem 300 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Levetiracetam UCB 100 mg/ml, perorální roztok levetiracetamum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden
Jeden ml obsahuje: Proteinum plasmatis humani... 200 mg (čistota minimálně 98% IgG)
 1. NÁZEV PŘÍPRAVKU Hizentra 200 mg/ml injekční roztok k subkutánnímu podání 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Immunoglobulinum humanum normale (SCIg) Jeden ml obsahuje: Proteinum plasmatis humani...
1. NÁZEV PŘÍPRAVKU Hizentra 200 mg/ml injekční roztok k subkutánnímu podání 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Immunoglobulinum humanum normale (SCIg) Jeden ml obsahuje: Proteinum plasmatis humani...
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU, NEBO POKUD NENÍ VNĚJŠÍ OBAL NA VNITŘNÍM OBALU
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU, NEBO POKUD NENÍ VNĚJŠÍ OBAL NA VNITŘNÍM OBALU Papírová krabička; 1 injekční lahvička (2 ml) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml roztoku
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU, NEBO POKUD NENÍ VNĚJŠÍ OBAL NA VNITŘNÍM OBALU Papírová krabička; 1 injekční lahvička (2 ml) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml roztoku
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
INFORMACE: INFORMACE PRO UŽIVATELE. DIPIDOLOR, 7,5 mg/ml, injekční roztok Piritramidum
 INFORMACE: INFORMACE PRO UŽIVATELE DIPIDOLOR, 7,5 mg/ml, injekční roztok Piritramidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
INFORMACE: INFORMACE PRO UŽIVATELE DIPIDOLOR, 7,5 mg/ml, injekční roztok Piritramidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabičce 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cupri tetramibi tetrafluoroboras 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: Cupri tetramibi tetrafluoroboras 0,5 mg v jedné injekční lahvičce
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabičce 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cupri tetramibi tetrafluoroboras 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: Cupri tetramibi tetrafluoroboras 0,5 mg v jedné injekční lahvičce
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.: sukls102912/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pasteurised Human Antitetanus Immunoglobulin Grifols 250 IU/1 ml a 500 IU/2 ml, injekční roztok v předplněné injekční stříkačce 2. SLOŽENÍ
Sp.zn.: sukls102912/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pasteurised Human Antitetanus Immunoglobulin Grifols 250 IU/1 ml a 500 IU/2 ml, injekční roztok v předplněné injekční stříkačce 2. SLOŽENÍ
Příbalová informace: informace pro pacienta. Maltofer, 10 mg/ml sirup. polymaltosum ferricum
 sp.zn. sukls65847/2017 Příbalová informace: informace pro pacienta Maltofer, 10 mg/ml sirup polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn. sukls65847/2017 Příbalová informace: informace pro pacienta Maltofer, 10 mg/ml sirup polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
Jedna lahvička s práškem také obsahuje arginin, kyselinu fosforečnou 85% a polysorbát 80. Rozpouštědlo: voda na injekci.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (VELIKOST BALENÍ 10 MG) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Actilyse 10 mg Alteplasum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna lahvička obsahuje 10 mg alteplasy (což odpovídá
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (VELIKOST BALENÍ 10 MG) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Actilyse 10 mg Alteplasum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna lahvička obsahuje 10 mg alteplasy (což odpovídá
s energií 172 kev (91 %) a 246 kev (94 %). Vnitřní konverzí vzniká záření rentgenové s energií 23 kev a 26 kev.
 sp.zn. sukls101319/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Indium (In111) Chloride 370 MBq/ml, radionuklidový prekurzor, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Obsah lahvičky k datu a
sp.zn. sukls101319/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Indium (In111) Chloride 370 MBq/ml, radionuklidový prekurzor, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Obsah lahvičky k datu a
Přecitlivělost na léčivé látky nebo na kteroukoliv z pomocných látek uvedených v bodě 6.1.
 sp.zn.: sukls50035/2010, sukls106419/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 g Selachiorum
sp.zn.: sukls50035/2010, sukls106419/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 g Selachiorum
Příbalová informace: informace pro uživatele. Harpagofyt ležatý Apomedica 600 mg potahované tablety Harpagophyti radicis extractum siccum
 sp.zn.sukls103902/2015, sukls103869/2015 Příbalová informace: informace pro uživatele Harpagofyt ležatý Apomedica 600 mg potahované tablety Harpagophyti radicis extractum siccum Přečtěte si pozorně tuto
sp.zn.sukls103902/2015, sukls103869/2015 Příbalová informace: informace pro uživatele Harpagofyt ležatý Apomedica 600 mg potahované tablety Harpagophyti radicis extractum siccum Přečtěte si pozorně tuto
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 OZNAČENÍ NA OBALU ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Text na krabičku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU suspenze Paracetamolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum 120 mg v 5 ml suspenze 3. SEZNAM
OZNAČENÍ NA OBALU ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Text na krabičku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU suspenze Paracetamolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum 120 mg v 5 ml suspenze 3. SEZNAM
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA
 sp.zn.sukls93493/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA BRONCHIPRET TYMIÁN A PRVOSENKA, POTAHOVANÉ TABLETY 160 mg/60 mg Thymi extractum siccum, Primulae extractum siccum Přečtěte si pozorně tuto
sp.zn.sukls93493/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA BRONCHIPRET TYMIÁN A PRVOSENKA, POTAHOVANÉ TABLETY 160 mg/60 mg Thymi extractum siccum, Primulae extractum siccum Přečtěte si pozorně tuto
Příbalová informace: informace pro uživatele
 sp.zn. sukls136451/2013 a sp.zn. sukls36933/2014 Příbalová informace: informace pro uživatele Aprokam50 mg prášek pro injekční roztok cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než
sp.zn. sukls136451/2013 a sp.zn. sukls36933/2014 Příbalová informace: informace pro uživatele Aprokam50 mg prášek pro injekční roztok cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Příbalová informace: informace pro uživatele AESCIN-TEVA. 20 mg, enterosolventní tablety. escinum alfa
 sp.zn. sukls113741/2015 Příbalová informace: informace pro uživatele AESCIN-TEVA 20 mg, enterosolventní tablety escinum alfa Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls113741/2015 Příbalová informace: informace pro uživatele AESCIN-TEVA 20 mg, enterosolventní tablety escinum alfa Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
Popis přípravku : Prášek: bílý lyofilizát. Rozpouštědlo: čirá bezbarvá tekutina
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
Ferrum. Opakovaná léčba Diafer 50 mg/ml injekčním roztokem je používána k doplnění a udržení zásob železa v těle.
 sp.zn. sukls57833/2014 Příbalová informace: informace pro pacienta 50 mg/ml injekční roztok Ferrum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete
sp.zn. sukls57833/2014 Příbalová informace: informace pro pacienta 50 mg/ml injekční roztok Ferrum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete
Příbalová informace: Informace pro pacienta
 sp.zn.sukls98480/2015 Příbalová informace: Informace pro pacienta Mucoplant břečťanový sirup proti kašli sirup Léčivá látka: Hederae helicis folii extractum siccum (suchý extrakt z břečťanového listu)
sp.zn.sukls98480/2015 Příbalová informace: Informace pro pacienta Mucoplant břečťanový sirup proti kašli sirup Léčivá látka: Hederae helicis folii extractum siccum (suchý extrakt z břečťanového listu)
Přečtěte si pozorně celou příbalovou informaci, než začnete tento přípravek používat, protože obsahuje pro Vás důležité informace.
 Sp.zn. sukls42539/2013 a k sukls204682/2013 Příbalová informace: informace pro uživatele ARTISS Roztoky pro tkáňové lepidlo, zmrazené Léčivé látky: Fibrinogenum humanum, thrombinum humanum, aprotininum,
Sp.zn. sukls42539/2013 a k sukls204682/2013 Příbalová informace: informace pro uživatele ARTISS Roztoky pro tkáňové lepidlo, zmrazené Léčivé látky: Fibrinogenum humanum, thrombinum humanum, aprotininum,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
Příbalová informace: informace pro uživatele. FINALGON 4 mg/g + 25 mg/g, mast nonivamidum/nicoboxilum
 Příloha č. 1 k rozhodnutí o registraci sp.zn. sukls51148/2011 Příbalová informace: informace pro uživatele FINALGON 4 mg/g + 25 mg/g, mast nonivamidum/nicoboxilum Přečtěte si pozorně celou příbalovou informaci
Příloha č. 1 k rozhodnutí o registraci sp.zn. sukls51148/2011 Příbalová informace: informace pro uživatele FINALGON 4 mg/g + 25 mg/g, mast nonivamidum/nicoboxilum Přečtěte si pozorně celou příbalovou informaci
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Příloha III. Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (předplněná injekční stříkačka se zasazenou jehlou) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Metoject 50 mg/ml injekční roztok Methotrexatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (předplněná injekční stříkačka se zasazenou jehlou) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Metoject 50 mg/ml injekční roztok Methotrexatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Příbalová informace: Informace pro pacienta. Octenisept. kožní roztok. octenidini dihydrochloridum, phenoxyethanolum
 sp.zn.sukls232740/2015 Příbalová informace: Informace pro pacienta Octenisept kožní roztok octenidini dihydrochloridum, phenoxyethanolum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete
sp.zn.sukls232740/2015 Příbalová informace: Informace pro pacienta Octenisept kožní roztok octenidini dihydrochloridum, phenoxyethanolum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete
BIOVISC ORTHO M. Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci.
 Česky BIOVISC ORTHO M Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci. NÁVOD K POUŽITÍ SLOŽENÍ Jeden ml obsahuje: Kyselina hyaluronová Mannitol 20 mg 5 mg Fosfátem pufrovaný
Česky BIOVISC ORTHO M Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci. NÁVOD K POUŽITÍ SLOŽENÍ Jeden ml obsahuje: Kyselina hyaluronová Mannitol 20 mg 5 mg Fosfátem pufrovaný
Příbalová informace: informace pro uživatele. MIBG (I123) injection injekční roztok Iobenguanum ( 123 I) a Iobenguani sulfas
 Příbalová informace: informace pro uživatele MIBG (I123) injection injekční roztok Iobenguanum ( 123 I) a Iobenguani sulfas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro uživatele MIBG (I123) injection injekční roztok Iobenguanum ( 123 I) a Iobenguani sulfas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA. Maltofer 10 mg/ml sirup
 sp.zn.: sukls229281/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Maltofer 10 mg/ml sirup polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn.: sukls229281/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Maltofer 10 mg/ml sirup polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Pavulon 4mg = 2ml injekční roztok. Pancuronii bromidum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Pavulon 4mg = 2ml injekční roztok Pancuronii bromidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. Ponechte si
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Pavulon 4mg = 2ml injekční roztok Pancuronii bromidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. Ponechte si
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
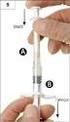 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabičce 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cuprotetramibi tetrafluoroboras 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: Cuprotetramibi tetrafluoroboras 0,5 mg v jedné injekční lahvičce
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabičce 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cuprotetramibi tetrafluoroboras 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: Cuprotetramibi tetrafluoroboras 0,5 mg v jedné injekční lahvičce
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. BENZOCAIN LIFE PHARMA 8 MG Pastilky (benzocainum)
 sp.zn. sukls8590/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE BENZOCAIN LIFE PHARMA 8 MG Pastilky (benzocainum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn. sukls8590/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE BENZOCAIN LIFE PHARMA 8 MG Pastilky (benzocainum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
