C1 Chemie Nepřímá přeměna methanu Výroba syntézního plynu Zemní plyn Primární benzíny Těžký topný olej Tuhá paliva Využití Výroba chemikálií Paliva
|
|
|
- Zdeněk Bárta
- před 9 lety
- Počet zobrazení:
Transkript
1 Methan (zemní plyn) - prokázaná světová zásoba = 1, m 3 - předpoklad zhruba na let - 93 % - palivo (topení, výroba energie) - 7 % - chemický průmysl Doprava zemního plynu - plynovody (6-8 MPa) - kapalný stav (tankery K) - náklady na dopravu do Evropy až % z ceny Výhled selektivní katalytické přeměny methanu na vybrané produkty
2 Zpracování zemního plynu (methan - C1 chemie) Přímá přeměna methanu selektivní oxidace (methanol, formaldehyd) - chlorované methany - amoxidace na kyanovodík - sirouhlík - acetylen - katalytická přeměna na ethylen, benzen (vývoj katalyzátoru a membránového reaktoru) Nepřímá přeměna methanu syntézní plyn (chemikálie, paliva) - výroba vodíku pro syntézu amoniaku - methanol - Fischer-Tropschova syntéza
3 Termodynamika reakcí methanu na vyšší uhlovodíky Stabilita molekuly methanu - nutnost vysokých reakčních teplot Reaktivita alkanů roste s délkou řetězce Vznik vodíku při přeměně methanu (nejvyšší poměr H/C ve všech sloučeninách) Reakce v oxidační atmosféře - selektivita katalyzátoru - přesná kontrola parametrů procesu - minimalizace úplné oxidace nebo chlorace - doba kontaktu
4 Závislost celkové rovnovážné konverze (X) a rovnovážných selektivit (S) některých uhlovodíků na teplotě při tlaku 1 atmosféry Celková rovnovážná konverze methanu při 1000 K je zhruba 10 % S rostoucím tlakem hodnota konverze klesá (Le Chatelierův princip) Využití membránového reaktoru pro odstraňování produktů reakce 2 CH 4 C 2 H H 2 6 CH 4 C 6 H H 2
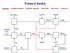
5 Nepřímá přeměna methanu Výroba syntézního plynu Zemní plyn Primární benzíny Těžký topný olej Tuhá paliva Využití Výroba chemikálií Paliva
6 Výroba syntézního plynu C1 Chemie Zemní plyn Primární benzíny Těžký topný olej Tuhá paliva + H 2 Desulfurizace (Co, Mo) + H 2 O Parní reformování (Ni, K 2 O, Al 2 O 3 ) Parciální oxidace Zplyňování H 2 CO CH 4 Surový plyn Čistící operace SYNTÉZNÍ PLYN Methanol Fischer-Tropsch Oxo-reakce
7 Výroba syntézního plynu zplyňováním uhlí Proces se skládá z celé řady paralelních a následných reakcí exotermické spalování uhlíku 2C + O 2 2 CO H = kj/mol endotermická tvorba vodního plynu C + H 2 O CO + H 2 H = 130 kj/mol Boudouardova rovnováha C + CO 2 2 CO H = 172 kj/mol rovnováha konverze vodního plynu CO + H 2 O CO 2 + H 2 H = - 42 kj/mol rovnováha tvorby methanu C + 2H 2 CH 4 H = - 75 kj/mol redukční tvorba methanu CO + 3H 2 CH 4 + H 2 O H = kj/mol Energetická náročnost procesu autotermický proces allotermický proces o C reakce mezi uhlíkem a zplyňovacím médiem vnější zdroj energie
8 Winklerovo zplyňování jemnozrnné nespékavé uhlí fluidní vrstva - atmosferický tlak vodní pára + kyslík o C H 2 : CO = 1,4 : 1 Proces Koppersův - Totzekův práškové uhlí, ropný koks vodní pára + kyslík o C potlačení tvorby kondenzovaných uhlovodíků CO + H 2 > 90 % Lurgiho tlakové zplyňování kusové uhlí, hnědouhelné brikety - kontinuální reaktor 2-3 MPa, o C - odplynění vodní pára + kyslík velký obsah methanu (výroba syntetického zemního plynu) benzen, fenol, dehet % použitého uhlí výroba technologického tepla Složení surového plynu závisí na typu použitého uhlí
9 Výroba syntézního plynu štěpením zemního plynu a ropy Kombinace exotermických a endotermických reakcí za přítomnosti kyslíku a vody -CH /2 O 2 CO + H 2 H = - 92 kj/mol -CH H 2 O CO + 2H 2 H = kj/mol Dva základní principy Parní štěpení působení vody za přítomnosti katalyzátoru vnější zdroj tepla Autotermické štěpení za přítomnosti vody částečné spalování suroviny jako zdroj technologického tepla
10 Parní štěpení (ICI) C1 Chemie Surovina - uhlovodíky do bodu varu 200 o C Třístupňový proces Hydrogenační desulfurace Katalyzátor CoO + MoO 3 na nosiči (Al 2 O 3 ) o C Odsíření surovin!!! - méně než 1 ppm Hydrogenace nenasycených uhlovodíků Vlastní štěpná reakce Ni + K 2 O na Al 2 O o C, 1,5-4,0 MPa Průtokový reaktor Spalování zemního plynu - zdroj tepla Druhotné štěpení Vznik methanu za vyšších tlaků Ni katalyzátor (1200 o C) Štěpení methanu za přítomnosti H 2 O Výhoda - nevznikají saze - není nutná regenerace katalyzátoru
11 Autotermické štěpení (BASF, Lurgi, Texaco, Shell) Parciální oxidace ropných frakcí (methan - destilační zbytky ropy) spalování předehřáté suroviny podstechiometrickým množstvím kyslíku bez katalyzátoru 3,0-8,0 MPa, o C vznikající teplo se používá na vlastní parní štěpení vznik sazí Výhoda - využití různých ropných frakcí
12 Čištění syntézního plynu a jeho využití Odstranění plynných látek (H 2 S, COS, CO 2 ) Nežádoucí vliv na deaktivaci katalyzátorů, na chemické reakce (inertní plyn) Postupy čištění zemního plynu Regenerace adsorpčních médií Rectisol (Lurgi) - tlakové praní methanolem Selexol - rozpustnost plynů v polyglykoldimethyletheru Sulfinol (Shell) - sulfolan, di-2-propanolamin, voda Purisol (Lurgi) - N-methylpyrrolidon ethanolamin, propylenkarbonát, alkalické soli aminokarboxylových kyselin (Alkacid) roztok K 2 CO 3 (Benfield) adsorpce na molekulových sítech (UCC) odplynění za vyšších teplot převedení H 2 S na elementární síru (Clausovy pece)
13 Použití syntézního plynu poměr CO/H 2 - použití - katalytická konverze (oxidy Fe, Cr) obsah CO = 3,0 % CO + H 2 O CO 2 + H 2 - zdroj čistého vodíku katalyzátory na bázi oxidů Cu a Zn CO = 0,1 % ( o C)
14 Projekt Adam-Eva Cyklický proces na výrobu tepla Štěpení methanu vodní parou (Eva) teplo z jaderného reaktoru Dálkovod Methanizace syntézního plynu (Adam) exotermický proces Dálkovod CH 4 + H 2 O 3 H 2 + CO CO + 3H 2 CH 4 + H 2 O H = kj/mol H = kj/mol Projekt společností Rheinbraun a KFA Jülich
15 Výroba čistého oxidu uhelnatého Oddělování CO C1 Chemie z plynů při koksování uhlí z plynů při krakování uhlovodíků ze syntézního plynu z generátorového plynu (C + vzduch 30 % CO + 70 % N 2 ) fyzikální (kondenzace a nízkoteplotní destilace) dělení směsi H 2 /CO/CH 4 - ochlazení -180 o C (tlak 4 MPa) - kondenzace CO a CH 4 - nízkoteplotní destilace (0,25 MPa) - oddestilování CO (0,1 % CH 4 ) chemické (absorpce ve vodném roztoku měďných solí) - 30 MPa, vodný roztok CuCl v HCl (amoniakální roztok uhličitanu nebo mravenčanu měďného) - absorpce CO v roztoku CuCl a AlCl 3 v toluenu (25 o C, 2,0 MPa) - uvolnění CO ( o C, 0,1-0,4 MPa)
16 Použití CO v kombinaci s vodíkem (chemie syntézního plynu) - výroba methanolu - výroba uhlovodíků (Fischer-Tropschova reakce) - hydroformylace v kombinaci s nukleofilními činidly (H 2 O, alkoholy) - Reppeho karbonylace (kyselina akrylová a propionová a jejich estery) - Kochova syntéza (karboxylové kyseliny) přímé použití - reakce s chlorem (fosgen, isokyanáty) - reakce s kovy (karbonyly kovů - katalyzátory)
17 Výroba čistého vodíku dostatečná zásoba v přírodních zdrojích (voda, fosilní paliva) surovina budoucnosti (chemie, energetika) Petrochemická výroba štěpení ropy (40-50 %) zemní plyn (30 %) uhlí (15 %) Elektrochemická výroba 3-5 %
18 Petrochemická výroba vodíku syntézní plyn zemní plyn (CH 4 + H 2 O 3 H 2 + CO H = kj/mol) bohatý na vodík rafinační zpracování lehkých ropných destilátů cyklizace, aromatizace uhlovodíků aromatizace methanu (možnost do budoucnosti) Izolace vodíku ze syntézních plynů odstranění H 2 S a COS konverze CO vodní parou (CO + H 2 O CO 2 + H 2 ) odstranění CO 2 odstranění stop CO převedením na CH 4 (katalyzátor Ni na nosiči, o C)
19 Elektrochemická výroba vodíku přímá elektrolýza - rozklad H 2 O, HF, HCl (22-25 %) rozklad vody sodíkovým amalgámem získaný vodík > 99 % - není nutné čištění Význam vodíku lze očekávat velký nárůst výroba tepla a energie chemický průmysl transport a akumulace energie motory do aut
20 Využití vodíku v průmyslu Syntéza amoniaku Hydrogenační odstraňování síry Hydrogenační krakování Syntéza methanolu Hydrogenace benzen na cyklohexan nitrobenzen na anilín Ztužování tuků
21 Výroba amoniaku Jeden z nejdůležitějších procesů chemického průmyslu Roční produkce ~ 100 x 10 6 tun Haber-Boschův proces (1913) První průmyslový proces využívající vysoký tlak Zkoušeno katalyzátorů Katalyzátor - Fe-oxid (Al 2 O 3, K 2 O, CaO) 30 MPa o C Fritz Haber Nobelova cena 1918 Carl Bosch Nobelova cena 1931
22 Reakční mechanismus syntézy amoniaku (Langmuir-Hinshelwoodův mechanismus) 1) Disociativní chemisorpce reaktantů N 2 (g) N 2 - L 2 N - L H 2 (g) 2 H - L 2) Reakce adsorbovaných disociovaných reaktantů N - L + H - L NH - L + H - L NH 2 - L NH 3 - L 3) Desorpce produktů NH 3 - L NH 3 (g) Rychlost určující krok reakce - disociace adsorbovaného dusíku Katalyzátor obsahuje % Fe, aktivace = redukce Fe Průmyslová výroba = 8 stupňů 3 CH N O 2 4 NH CO 2
23 Langmuir-Hinshelwoodův mechanismus B
24 Rideal-Eleyův-mechanismus C1 Chemie
25 Úloha adsorpce a desorpce na syntézu amoniaku Aktivita Reakce řízena adsorpcí N 2 Reakce řízena adsorpcí NH 3 H ads (N 2 nebo NH 3 )
26 Syntéza amoniaku - průmyslová výroba H 2, zemní plyn 1) Desulfurizace (hydrotreating) - Co/Mo katalyzátor, 4 MPa (CH 3 ) 2 S + 2 H 2 2 CH 4 + H 2 S 2) Adsorpce H 2 S na ZnO H 2 S + ZnO ZnS + H 2 O Pára 3) Primární štěpení, Ni katalyzátor, 830 o C CH 4 + H 2 O CO + 3 H 2 Vzduch 4) Sekundární štěpení, Ni katalyzátor, 1000 o C Odstranění stop CH 4 5) Vysokoteplotní konverze, tvorba H 2, Fe katalyzátor, 400 o C CO + H 2 O CO 2 + H 2 6) Nízkoteplotní konverze, Cu katalyzátor, 220 o C (praní CO 2 ) 7) Odstranění stop CO/CO 2, Ni katalyzátor CO + 3 H 2 CH 4 + H 2 O N 2 8) Syntéza amoniaku, Fe-oxid (Al 2 O 3, K 2 O), 30 MPa o C N H 2 2 NH 3 Amoniak
27 Výroba methanolu Mittasch (1923) CO + 2 H 2 CH 3 OH H = - 92 kj/mol Katalyzátor ZnO/Cr 2 O 3, MPa, o C (BASF) Katalyzátor na bázi Cu-ZnO-Cr 2 O 3, 5-10 MPa, nižší teploty (ICI, Lurgi) Aktivační efekt CO 2 CO H 2 CH 3 OH + H 2 O H = - 50 kj/mol Konkurenční reakce CO 2 + H 2 CO + H 2 O H = 41 kj/mol
28 Reakční mechanismus tvorby methanolu Katalyzátor na bázi Cu Adsorpce CO na aktivním centru (Cu) Disociativní adsorpce vodíku Série hydrogenačních kroků Desorpce methanolu
29 Reakční mechanismus tvorby methanolu Katalyzátor na bázi modifikovaného ZnO Inserce CO do povrchové hydroxylové skupiny Hydrogenační kroky Dehydratace Tvorba povrchově vázané methoxy skupiny Desorpce methanolu
30 Reakční mechanismus tvorby methanolu - nejnovější představy Katalyzátor na bázi modifikovaného Cu/ZnO v systému CO/CO 2 /H 2 H 2 2 H-L L - aktivní centrum H-L + CO 2 HCOO-L HCOO-L + 2 H-L CH 3 O-L + O-L CH 3 O-L + H-L CH 3 OH-L + L CH 3 OH CO-L + O-L CO 2 -L + L CO 2 Všechny důležité kroky reakce probíhají na jemně dispergovaných částicích Cu Předpoklad - úloha CO = odstranění povrchově vázaného atomárního kyslíku tvorba CO 2 CO 2 - vlastní reaktant
31 Využití methanolu v průmyslu Přidávání do automobilových benzínů (do 10 % - rozpustnost) Antidetonátor methyl-terc.butyl-ether (MTBE) Ekologicky čisté palivo (budoucnost) Výroba nižších uhlovodíků (MTO - Methanol to Olefines, Mobil Oil) - zeolity Výroba benzínů (MTG - Methanol to Gasoline, Mobil Oil) - zeolity Formaldehyd (40 % methanolu) Kyselina octová (karbonylace methanolu, BASF, Monsanto) Acetanhydrid, ethylendiacetát, vinylacetát, methylamin, methylmethakrylát, dimethyltereftalát, atd.
32 Syntéza uhlovodíků z CO a H 2 (Fischer-Tropschova reakce) Cíl - přeměna uhlí na kapalná paliva (Německo - F.Fischer, H.Tropsch) n CO + 2n H 2 (-CH 2 -) n + H 2 O H = kj/mol Katalyzátor na bázi Co ( o C) lineární uhlovodíky (nízké oktanové číslo, kvalitní motorová nafta) Výroba syntetických pohonných hmot z uhlí - nelze konkurovat ropě (dosud) Perspektiva výroby uhlíkatých surovin Velký výzkum (multifunkční katalyzátory) Katalyzátory na bázi železa - uhlovodíky, ethanol, propanol, aceton Katalyzátory na bázi ruthenia (100 o C, MPa) - vysokomolekulární lineární alkany Jihoafrická republika (proces Synthol) - Fe katalyzátor (200 kt/rok) zbytkový plyn těžký olej lehký olej vodný roztok kyslíkatých látek
33 Oxo syntéza (hydroformylace) Reakce olefinu s CO za přítomnosti vodíku - vyšší aldehyd O. Roelen (1938) Ruhrchemie C 2 H 4, CO, H 2 Co, Th (T, p) = propionaldehyd 1945 první technologická jednotka BASF, Hüls, Ruhrchemie největší producenti Podmínky Mpa, o C Nejdůležitější produkty butanol, 2-ethylhexanol Směs isomerů možnost vzniku aldehydické skupiny na obou koncích dvojné vazby Původní katalyzátor Co 2 (CO) 8, modifikace fosfinem Odstranění katalyzátoru zahřátí = rozklad vznik kovového kobaltu
34 Oxo syntéza (hydroformylace) Reakce olefinu s CO za přítomnosti vodíku - vyšší aldehyd Nejdůležitější homogenně katalyzovaná reakce (Hoechst, BASF, Union Carbide) Propylen na 1-butanol nebo 2-ethylhexanol Nový katalyzátor Výhody HRh(CO)(PPh 3 ) o C, 1-2,5 MPa Rh 1000 krát aktivnější než Co PPh 3 - vyšší selektivita na aldehyd, - převaha lineárních aldehydů - stabilita katalyzátoru - doba života
35 Mechanismus hydroformylace propylenu na katalyzátorů HRh(CO)(PPh 3 ) 3 Disociace fosfinového ligandu - tvorba koordinačně nenasyceného komplexu Koordinace olefinu - inserce olefinu Inserce CO - tvorba acyl komplexu Hydrogenolýza acyl komplexu - uvolnění aldehydu
36 Hydroformylace propylenu C1 Chemie Nový typ katalyzátoru (Ruhrchemie/Rhône Poulenc) Rh-komplex rozpustný ve vodě Systém dvou fází (vodní + organická) Reakce probíhá na rozhraní obou fází
37 Výroba kyseliny octové (karbonylace methanolu) Proces firmy Monsanto Mechanismus - adice methyljodidu na Rh-komplex - přesmyk CO - tvorba acyl komplexu - adice CO - eliminace acetyliodidu
38 Mechanismus výroby kyseliny octové První krok reakce Závěrečný krok Reakční podmínky CH 3 OH + HI CH 3 I + H 2 O CH 3 COI + H 2 O CH 3 COOH + HI 3-4 MPa, o C Využití - methanol (99 %), CO (> 90 %) Destilační separace produktů CO, CH 3 I, dimethylether - Rh-komplex Recyklace Rh-komplexu Nevýhoda - koroze - jod Vývoj Immobilizace katalyzátoru Nahrazení jodu
39 Výroba olefinů a benzínů z methanolu MTO proces - Methanol to Olefins MTG proces - Methanol to gasoline V závislosti na zdroji surovin - Nový Zéland (Motonui), tun/rok Zemní plyn Syntézní plyn Methanol Benzíny Reakční mechanismus Methanol Dimethylether Delší olefiny Aromatické uhlovodíky + Parafiny Tvorba C-C vazeb =?? MTG proces (Mobil Oil) o C, 2 MPa, rychlá deaktivace katalyzátoru (několik hodin) Katalyzátor ZSM-5 - zatížení 2 kg methanolu / 1 kg katalyzátoru.hodina Propan Isobutan Buteny C 5 + (%) Pevné lože katalyzátoru 4,6 8,8 1,1 81,3 Fluidní lože katalyzátoru 4,4 11,0 5,8 68,2
40 Výroba olefinů a benzínů z methanolu Výroba benzínů = následné reakce po tvorbě olefinů MTO proces - Zeolit ZSM-5 Výroba ethylenu - SAPO-34 Methanol DME + H 2 O Nízké olefiny + H 2 O Vyšší olefiny + H 2 O Benzíny + H 2 O MTO MTG Ethylen Propylen Buteny C 5 + MTO 5,2 32,9 19,1 19,7 UOP/Norsk Hydro 48,0 33,1 9,6 2,4 Výroba ethylenu a propylenu krakováním ropy - dosud jednoznačně převyšuje Krakování C 5 -C 6 frakce po zpracování ropy možnost další výroby ethylenu a propylenu
41 Výroba benzínů z methanolu Zeolit ZSM-5 - vliv doby kontaktu na selektivitu přeměny methanolu
42 Dvoustupňová výroba benzínů z methanolu (Mobil Oil) Odplyn Odplyn Cu/ZnO ZSM-5 Benzín CO + H 2 MeOH MeOH H 2 O Jednostupňová výroba benzínů ze syntézního plynu (Haldor Topsoe) Recyklace Odplyn CO + H 2 Katalyzátor Benzín H 2 O
43 Výroba MTBE z methanolu C1 Chemie Vysoké oktanové číslo (přidání do benzínů do 10 %) Snižuje obsah CO ve výfukových plynech CH 3 OH + CH 2 =C(CH 3 ) 2 CH 3 OC(CH 3 ) 3 H = - 37 kj/mol Výtěžek reakce % (vztaženo na isobuten) C 4 frakce po parním štěpení primárních benzínů (po extrakci butadienu) Kyselý katalyzátor - iontoměnič ( o C) Ekologické problémy - omezení použití MTBE do benzínů (USA) (nahrazení ETBE, TAME) kancerogenita
44 Výroba bílkovin z methanolu (fermentační procesy) Mikrobiální odbourávání methanu CH 4 CH 3 OH HCHO HCOOH CO 2 Nejobtížnější krok - odbourání methanu na methanol Fermentace methanolu (kmen bakterií Pseudomonas, ICI) Bílkovinná hmota (přes 80 % bílkovin) Separace aminokyselin (asparagin, leucin, alanin, kyselina glutamová) Jednobuněčné proteiny Přísada krmiv (spolu se sojovými boby a rybí moučkou)
45 Výroba formaldehydu z methanolu Tři základní formy - vodný roztok (35-55 %) - trimer (trioxan) - polymerní forma (paraformaldehyd, 10 a více jednotek) Zdroj surovin methanol C 1 -C 4 alkany dimethyl ether Výroba z methanolu - dehydrogenace (oxidativní dehydrogenace) methanolu za přítomnosti stříbrných nebo měděných katalyzátorů - oxidace na katalyzátoru MoO 3 /Fe
46 Výroba formaldehydu dehydrogenací (oxidativní dehydrogenací) methanolu za přítomnosti stříbrných nebo měděných katalyzátorů BASF, Degussa, DuPont, ICI, Monsanto Katalyzátor - stříbrné síťky, krystalky mědi (stabilita 2-4 měsíce, elektrochemická regenerace) S, halogenidy snadná otrava Dehydrogenace methanolu CH 3 OH HCHO + H 2 H = 84 kj/mol Oxidativní dehydrogenace CH 3 OH + 1/2 O 2 HCHO + H 2 O H = kj/mol Podstechiometrické množství vzduchu dodržení optimální reakční teploty - omezení úplné oxidace methanolu Reakční teplota Výtěžek formaldehydu - 88 % 1,22 t methanol 1 t formaldehyd o C, neúplná konverze methanolu - nutnost recyklace o C, přídavek vody - úplná konverze
47 Výroba formaldehydu oxidací methanolu na katalyzátoru MoO 3 /Fe Montecatini, IFP, Lummus, Lurgi Oxidativní dehydrogenace CH 3 OH + 1/2 O 2 HCHO + H 2 O H = kj/mol Katalyzátor (19 % Fe 2 O % MoO 3 ) molybdenan železitý životnost katalyzátoru - dva roky Reakční teplota o C, ochlazení v proudu vody - formaldehyd (37-60 %) Konverze methanolu % Selektivita na formaldehyd % Vedlejší produkty - CO, CO 2, kyselina mravenčí Obdobný systém pro dimethylether
48 Výroba methylaminů z methanolu BASF, ICI, Montedison Reakce mezi amoniakem a methanolem CH 3 OH + NH 3 NH 2 CH 3 + H 2 O H = - 21 kj/mol Reakční teplota o C, tlak 1,5-3,0 MPa Katalyzátor - Al 2 O 3, Al 2 (SO 4 ) 3, AlPO 4 Alkylace do vyšších stupňů dimethylamin, trimethylamin Separace produktů - extrakční destilace Využití methylaminů rozpouštědla léčiva detergenty herbicidy insekticidy
49 Přímá konverze methanu C1 Chemie Mnohem méně využívaná než konverze nepřímá Freony Kyanovodík Sirouhlík Acetylen Freony Přímá chlorinace s Cl 2 nebo HCl + vzduch Exotermická reakce, radikálový řetězový mechanismus Ekologie - ozonová díra Názvosloví CFC (počet atomů uhlíku - 1, počet atomů vodíku + 1, počet atomů fluoru) CH 4 + Cl 2 CH 3 Cl + CH 2 Cl 2 + CHCl 3 + CCl 4 37 % 41 % 19 % 3 % Zvýšený tlak o C, iniciace UV zářením (homolýza chloru) Výroba methylchloridu velký nadbytek methanu v reakční směsi Chlorace do vyšších stupňů recyklace méněchlorovaných produktů Rozdělení - destilace
50 Kyanovodík Andrussowův proces C1 Chemie (vedlejší produkt při amoxidaci propylenu na akrylonitril) CH 4 + NH 3 + 3/2 O 2 HCN + 2H 2 O H = kj/mol katalyzátor - slitina Pt/Rh ( o C, 0,2 MPa, doba kontaktu milisekunda) rychlé ochlazení reakční směsi - zabránění reakce HCN + H 2 O NH 3 + CO Využití - např. syntéza adiponitrilu, výroba Nylonu 6-6 ( tun) speciální organické syntézy Degussa CH 4 + NH 3 HCN + 3 H 2 H = 251 kj/mol Katalyzátor korund + Pt, Ru, Al ( o C, selektivita na HCN = 91 %) Shawiniganův postup C 3 H NH 3 3 HCN + 7 H o C, selektivita 87 %
51 Sirouhlík Reakce methanu se sírou CH 4 + 4/x S x CS 2 + H 2 S Katalyzátor - silikagel, MgO (650 o C) Nezbytná čistota methanu > 99 %, ochlazení reakční směsi na 130 o C, separace a recyklace S, H 2 S se převádí zpět na S Využití pro výrobu CCl 4 - USA tun Acetylen Výroba reakcí karbidu vápenatého s vodou reakce páleného vápna a koksu v elektrickém oblouku ( o C) Nyní zejména pyrolýzou methanu Pyrolýza v elektrickém oblouku (Huels) o C Reakční teplota 1500 o C (BASF), O 2 /CH 4 = 0,65 Selektivita na acetylen (8 %), syntézní plyn + ethylen (1 %) Vysoká energetická náročnost Využití - sváření, vinyl acetát, vinyl chlorid, acetylénová čerň ( tun)
52 Výzkum přímé konverze methanu Oxidativní dimerizace methanu (oxidative coupling - OCM) 2 CH 4 + O 2 C 2 H H 2 O H = kj/mol Studované katalyzátory - PbO, Mn 2 O 3, SnO 2, Pr 6 O 11 - nízká selektivita (ethan, CO x, C 3+, vodík) NaBMg 4 MnO x (850 o C) - konverze methanu 25 %, selektivita C % Li 2 O - MgO Velký výzkum - minimální výtěžek 40 % ethylenu (stále nedosaženo)
53 Výzkum přímé konverze methanu Neoxidativní dimerizace nebo aromatizace methanu Převedení methanu na ethylen, benzen, naftalen 2 CH 4 C 2 H H 2 6 CH 4 C 6 H H 2 Obrovský přebytek vodíku Nutnost posunutí rovnováhy reakce (membránový reaktor) Termodynamická konverze (10 % o C) Katalyzátor MoO 3 /zeolit (ZSM-5, MCM-22) Tvorba MoC y O x v průběhu reakce Aktivní centrum není dosud přesně popsáno MoC y O x aktivace methanu Zeolit zabránění následných reakcí uhlovodíkových částic
11. Zemní plyn jako energetická a chemická surovina. Ing. Tomáš Hlinčík, Ph.D.
 11. Zemní plyn jako energetická a chemická surovina Ing. Tomáš Hlinčík, Ph.D. Zpracování zemního plynu Nepřímá přeměna methanu syntézní plyn (chemikálie, paliva) - výroba vodíku pro syntézu amoniaku -
11. Zemní plyn jako energetická a chemická surovina Ing. Tomáš Hlinčík, Ph.D. Zpracování zemního plynu Nepřímá přeměna methanu syntézní plyn (chemikálie, paliva) - výroba vodíku pro syntézu amoniaku -
Ropa Kondenzované uhlovodíky
 Nejdůležitější surovina pro výrobu organických sloučenin Nejvýznamnější surovina světové ekonomiky Výroba energie Chemické zpracování - 15 % Cena a zásoby ropy (70-100 let) Ropné krize Nutnost hledání
Nejdůležitější surovina pro výrobu organických sloučenin Nejvýznamnější surovina světové ekonomiky Výroba energie Chemické zpracování - 15 % Cena a zásoby ropy (70-100 let) Ropné krize Nutnost hledání
Zplyňování biomasy. Sesuvný generátor. Autotermní zplyňování Autotermní a alotermní zplyňování
 Zplyňování = termochemická přeměna uhlíkatého materiálu v pevném či kapalném skupenství na výhřevný energetický plyn pomocí zplyňovacích médií a tepla. Produktem je plyn obsahující výhřevné složky (H 2,
Zplyňování = termochemická přeměna uhlíkatého materiálu v pevném či kapalném skupenství na výhřevný energetický plyn pomocí zplyňovacích médií a tepla. Produktem je plyn obsahující výhřevné složky (H 2,
H H C C C C C C H CH 3 H C C H H H H H H
 Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
zpracování těžkých frakcí na motorová paliva (mazut i vakuový zbytek)
 Ropa štěpné procesy zpracování těžkých frakcí na motorová paliva (mazut i vakuový zbytek) typy štěpných procesů: - termické krakování - katalytické krakování - hydrogenační krakování (hydrokrakování) podmínky
Ropa štěpné procesy zpracování těžkých frakcí na motorová paliva (mazut i vakuový zbytek) typy štěpných procesů: - termické krakování - katalytické krakování - hydrogenační krakování (hydrokrakování) podmínky
OMEZOVÁNÍ NEGATIVNÍCH ENVIRONMENTÁLNÍCH DOPADŮ PŘI VÝROBĚ PALIV A PETROCHEMIKÁLIÍ. Seminář, Bratislava, 6.6.2013 Autor: J.LEDERER
 OMEZOVÁNÍ NEGATIVNÍCH ENVIRONMENTÁLNÍCH DOPADŮ PŘI VÝROBĚ PALIV A PETROCHEMIKÁLIÍ Seminář, Bratislava, 6.6.2013 Autor: J.LEDERER OBSAH - CESTY K REDUKCI NOVOTVORBY CO 2 NEOBNOVITELNÉ SUROVINY OMEZENÍ UHLÍKOVÝCH
OMEZOVÁNÍ NEGATIVNÍCH ENVIRONMENTÁLNÍCH DOPADŮ PŘI VÝROBĚ PALIV A PETROCHEMIKÁLIÍ Seminář, Bratislava, 6.6.2013 Autor: J.LEDERER OBSAH - CESTY K REDUKCI NOVOTVORBY CO 2 NEOBNOVITELNÉ SUROVINY OMEZENÍ UHLÍKOVÝCH
ZŠ ÚnO, Bratří Čapků 1332
 Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N VÝROBA MTBE
 CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N409059 VÝROBA MTBE Fyzikální a chemické vlastnosti Suroviny Reakce Technologie Dvoustupňová výroba Jednostupňová výroba Charakteristiky technologií Zdroje
CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N409059 VÝROBA MTBE Fyzikální a chemické vlastnosti Suroviny Reakce Technologie Dvoustupňová výroba Jednostupňová výroba Charakteristiky technologií Zdroje
VLASTNOSTI ALKANŮ 2. RADIKÁLOVÁ SUBSTITUCE 3. ELIMINAČNÍ REAKCE VÝZNAMNÉ ALKANY. Substituční reakce. Sulfochlorace alkanů. Termolýza.
 Kromě CO 2 vznikají i saze roste svítivost Substituční reakce vazby: C C C H jsou nepolární => jsou radikálové S R...radikálová substituce 3 fáze... VLASTNOSTI ALKANŮ tady něco chybí... 2. RADIKÁLOVÁ SUBSTITUCE
Kromě CO 2 vznikají i saze roste svítivost Substituční reakce vazby: C C C H jsou nepolární => jsou radikálové S R...radikálová substituce 3 fáze... VLASTNOSTI ALKANŮ tady něco chybí... 2. RADIKÁLOVÁ SUBSTITUCE
Průmysl dusíku. amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin. NaClO NaOH CO(NH 2 ) 2.
 Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
TERMICKÉ PROCESY PŘI VYUŽITÍ ALTERNATIVNÍCH SUROVIN. Most, 13.6.2013 Autor: Doc. Ing. J.LEDERER, CSc.
 TERMICKÉ PROCESY PŘI VYUŽITÍ ALTERNATIVNÍCH SUROVIN Most, 13.6.2013 Autor: Doc. Ing. J.LEDERER, CSc. OBSAH PRINCIPY POUŽÍVANÝCH TERMOCHEMICKÝCH PROCESŮ VELKOKAPACITNÍ REALIZACE TERMOCHEMICKÝCH PROCESŮ
TERMICKÉ PROCESY PŘI VYUŽITÍ ALTERNATIVNÍCH SUROVIN Most, 13.6.2013 Autor: Doc. Ing. J.LEDERER, CSc. OBSAH PRINCIPY POUŽÍVANÝCH TERMOCHEMICKÝCH PROCESŮ VELKOKAPACITNÍ REALIZACE TERMOCHEMICKÝCH PROCESŮ
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115
 Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: Číslo šablony: CZ.1.07/1.5.00/34.0410 III/2 Inovace a zkvalitnění výuky prostřednictvím ICT. Název materiálu: Fosilní zdroje
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: Číslo šablony: CZ.1.07/1.5.00/34.0410 III/2 Inovace a zkvalitnění výuky prostřednictvím ICT. Název materiálu: Fosilní zdroje
Rozdělení uhlovodíků
 Rozdělení uhlovodíků 1/8 Alkany a cykloalkany Obecné vzorce: alkany C n H 2n+2, cykloalkany C n H 2n, kde n je přirozené číslo Homologický přírustek: - CH 2 - Alkany přímé ( n - alkany) rozvětvené Primární,
Rozdělení uhlovodíků 1/8 Alkany a cykloalkany Obecné vzorce: alkany C n H 2n+2, cykloalkany C n H 2n, kde n je přirozené číslo Homologický přírustek: - CH 2 - Alkany přímé ( n - alkany) rozvětvené Primární,
EVROPSKÝ PARLAMENT C6-0267/2006. Společný postoj. Dokument ze zasedání 2003/0256(COD) 06/09/2006
 EVROPSKÝ PARLAMENT 2004 Dokument ze zasedání 2009 C6-0267/2006 2003/0256(COD) CS 06/09/2006 Společný postoj Společný postoj Rady k přijetí nařízení Evropského parlamentu a Rady o registraci, hodnocení,
EVROPSKÝ PARLAMENT 2004 Dokument ze zasedání 2009 C6-0267/2006 2003/0256(COD) CS 06/09/2006 Společný postoj Společný postoj Rady k přijetí nařízení Evropského parlamentu a Rady o registraci, hodnocení,
4 frakce 4 5 UHLOVODÍKY Oddělení isobutenu z 4 frakce (4 rafinát) - rozdílná reaktivita - butany nereagují Hydratace isobutenu na terc. butyl alkohol
 4 5 UHLOVODÍKY 4 frakce - buteny, butadien, butany Starší výroby dehydratace butanolů disproporcionace propylenu (Shawinigan, Kanada) dimerizace acetylenu Současné způsoby krakování primárních benzínů
4 5 UHLOVODÍKY 4 frakce - buteny, butadien, butany Starší výroby dehydratace butanolů disproporcionace propylenu (Shawinigan, Kanada) dimerizace acetylenu Současné způsoby krakování primárních benzínů
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
OMEZOVÁNÍ NEGATIVNÍCH ENVIRONMENTÁLNÍCH DOPADŮ PŘI VÝROBĚ PALIV A PETROCHEMIKÁLIÍ. Most, Autor: Doc. Ing. J.LEDERER, CSc.
 OMEZOVÁNÍ NEGATIVNÍCH ENVIRONMENTÁLNÍCH DOPADŮ PŘI VÝROBĚ PALIV A PETROCHEMIKÁLIÍ Most, 29.11.2012 Autor: Doc. Ing. J.LEDERER, CSc. OBSAH - CESTY K REDUKCI NOVOTVORBY CO 2 NEOBNOVITELNÉ SUROVINY OMEZENÍ
OMEZOVÁNÍ NEGATIVNÍCH ENVIRONMENTÁLNÍCH DOPADŮ PŘI VÝROBĚ PALIV A PETROCHEMIKÁLIÍ Most, 29.11.2012 Autor: Doc. Ing. J.LEDERER, CSc. OBSAH - CESTY K REDUKCI NOVOTVORBY CO 2 NEOBNOVITELNÉ SUROVINY OMEZENÍ
NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE. Ing. Stanislav HONUS
 NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE Ing. Stanislav HONUS ORGANICKÝ MATERIÁL Spalování Chemické přeměny Chem. přeměny ve vodním prostředí Pyrolýza Zplyňování Chemické Biologické Teplo
NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE Ing. Stanislav HONUS ORGANICKÝ MATERIÁL Spalování Chemické přeměny Chem. přeměny ve vodním prostředí Pyrolýza Zplyňování Chemické Biologické Teplo
Škola: Gymnázium, Brno, Slovanské náměstí 7 III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 VY_32_INOVACE_C.3.01 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT
VY_32_INOVACE_C.3.01 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT
Autor: Tomáš Galbička Téma: Alkany a cykloalkany Ročník: 2.
 Alkany uhlovodíky s otevřeným řetězcem a pouze jednoduchými vazbami vazby sigma, největší výskyt elektronů na spojnici jader v názvu mají koncovku an Cykloalkany uhlovodíky s uzavřeným řetězcem a pouze
Alkany uhlovodíky s otevřeným řetězcem a pouze jednoduchými vazbami vazby sigma, největší výskyt elektronů na spojnici jader v názvu mají koncovku an Cykloalkany uhlovodíky s uzavřeným řetězcem a pouze
Amoniak. 1913 průmyslová výroba syntetického amoniaku
 Amoniak 1913 průmyslová výroba syntetického amoniaku využití 20 % výroba dusíkatých hnojiv 80 % nejrůznější odvětví průmyslu (plasty, vlákna, výbušiny, hydrazin, aminy, amidy, nitrily a další organické
Amoniak 1913 průmyslová výroba syntetického amoniaku využití 20 % výroba dusíkatých hnojiv 80 % nejrůznější odvětví průmyslu (plasty, vlákna, výbušiny, hydrazin, aminy, amidy, nitrily a další organické
CH 2 = CH 2 ethen systematický název propen CH 2 = CH CH 3 but-1-en CH 2 = CH CH 2 CH 3 but-2-en CH 3 CH = CH CH 3 buta-1,3-dien CH 2 = CH CH = CH 2
 Základní názvy organických látek alifatické nasycené alkany (příklady s nerozvětvenými řetězci) methan CH 4 ethan CH 3 CH 3 propan CH 3 CH 2 CH 3 butan CH 3 CH 2 CH 2 CH 3 pentan CH 3 CH 2 CH 2 CH 2 CH
Základní názvy organických látek alifatické nasycené alkany (příklady s nerozvětvenými řetězci) methan CH 4 ethan CH 3 CH 3 propan CH 3 CH 2 CH 3 butan CH 3 CH 2 CH 2 CH 3 pentan CH 3 CH 2 CH 2 CH 2 CH
TVORBA UHLÍKATÝCH PRODUKTŮ PŘI I PYROLÝZE UHLOVODÍKŮ
 TVORBA UHLÍKATÝCH PRODUKTŮ PŘI I PYROLÝZE UHLOVODÍKŮ Martin Hrádel 5. ročník Školitel: Doc. Ing. Zdeněk Bělohlav, CSc. Obsah Úvod Mechanismus vzniku a vlastnosti uhlíkatých produktů Provozního sledování
TVORBA UHLÍKATÝCH PRODUKTŮ PŘI I PYROLÝZE UHLOVODÍKŮ Martin Hrádel 5. ročník Školitel: Doc. Ing. Zdeněk Bělohlav, CSc. Obsah Úvod Mechanismus vzniku a vlastnosti uhlíkatých produktů Provozního sledování
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace
 Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Zplyňování a zkapalňování uhlí Doc. Ing. Karel Ciahotný, CSc.
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zplyňování a zkapalňování uhlí Doc. Ing. Karel Ciahotný, CSc. Zplyňování uhlí technologický proces přeměny pevných
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zplyňování a zkapalňování uhlí Doc. Ing. Karel Ciahotný, CSc. Zplyňování uhlí technologický proces přeměny pevných
Kyslíkaté deriváty. 1) Hydroxyderiváty: a) Alkoholy b) Fenoly. řešení. Dle OH = hydroxylová skupina
 Kyslíkaté deriváty řešení 1) Hydroxyderiváty: a) Alkoholy b) Fenoly Dle = hydroxylová skupina 1 Hydroxyderiváty Alifatické alkoholy: náhrada 1 nebo více atomů H. hydroxylovou skupinou (na 1 atom C vázaná
Kyslíkaté deriváty řešení 1) Hydroxyderiváty: a) Alkoholy b) Fenoly Dle = hydroxylová skupina 1 Hydroxyderiváty Alifatické alkoholy: náhrada 1 nebo více atomů H. hydroxylovou skupinou (na 1 atom C vázaná
Základní škola a mateřská škola Hutisko Solanec. žák uvede základní druhy uhlovodíků, jejich použití a zdroje. Chemie - 9. ročník
 Základní škola a mateřská škola Hutisko Solanec Digitální učební materiál Anotace: Autor: Jazyk: Očekávaný výstup: Speciální vzdělávací potřeby: Klíčová slova: Druh učebního materiálu: Druh interaktivity:
Základní škola a mateřská škola Hutisko Solanec Digitální učební materiál Anotace: Autor: Jazyk: Očekávaný výstup: Speciální vzdělávací potřeby: Klíčová slova: Druh učebního materiálu: Druh interaktivity:
Paliva. nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování
 Paliva Paliva nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování Dělení paliv podle skupenství pevná uhlí, dřevo kapalná benzín,
Paliva Paliva nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování Dělení paliv podle skupenství pevná uhlí, dřevo kapalná benzín,
HYDROXYDERIVÁTY. Alkoholy Fenoly Bc. Miroslava Wilczková
 HYDROXYDERIVÁTY Alkoholy Fenoly Bc. Miroslava Wilczková HYDROXYDERIVÁTY Alkoholy -OH skupina vázána na uhlíkový atom alifatického řetězce Fenoly -OH skupina vázána na uhlíku, který je součástí aromatického
HYDROXYDERIVÁTY Alkoholy Fenoly Bc. Miroslava Wilczková HYDROXYDERIVÁTY Alkoholy -OH skupina vázána na uhlíkový atom alifatického řetězce Fenoly -OH skupina vázána na uhlíku, který je součástí aromatického
Učivo OPAKOVÁNÍ Z 8.ROČNÍKU. REDOXNÍ REAKCE - oxidace a redukce - výroba železa a oceli - koroze - galvanický článek - elektrolýza
 OPAKOVÁNÍ Z 8.ROČNÍKU - vysvětlí pojmy oxidace a redukce - určí, které ze známých reakcí patří mezi redoxní reakce - popíše princip výroby surového železa a oceli, zhodnotí jejich význam pro národní hospodářství
OPAKOVÁNÍ Z 8.ROČNÍKU - vysvětlí pojmy oxidace a redukce - určí, které ze známých reakcí patří mezi redoxní reakce - popíše princip výroby surového železa a oceli, zhodnotí jejich význam pro národní hospodářství
3. Oxid uhlenatý. 1. Syntézní plyn. 5. Formaldehyd. 4. Metanol. 2. Vodík. Základní organické sloučeniny
 Základní organické sloučeniny 1. Syntézní plyn 2. Vodík 3. Oxid uhlenatý 4. Metanol 5. Formaldehyd 1 1. Syntézní plyn směs CO a H2 v různém poměru k syntéze některých organických poloproduktů metanol,
Základní organické sloučeniny 1. Syntézní plyn 2. Vodík 3. Oxid uhlenatý 4. Metanol 5. Formaldehyd 1 1. Syntézní plyn směs CO a H2 v různém poměru k syntéze některých organických poloproduktů metanol,
Učební osnovy pracovní
 2 týdně, povinný Chemické reakce II. Žák: používá s porozuměním pojmy oxidace, red. vysvětlí podstatu výroby kovů z rud nakreslí schéma elektrolýzy a galvanického článku, porovná oba děje, uvede příklady
2 týdně, povinný Chemické reakce II. Žák: používá s porozuměním pojmy oxidace, red. vysvětlí podstatu výroby kovů z rud nakreslí schéma elektrolýzy a galvanického článku, porovná oba děje, uvede příklady
Opakování učiva organické chemie Smart Board
 Opakování učiva organické chemie Smart Board VY_52_INOVACE_200 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie ročník: 9 Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
Opakování učiva organické chemie Smart Board VY_52_INOVACE_200 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie ročník: 9 Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
Kolik energie by se uvolnilo, kdyby spalování ethanolu probíhalo při teplotě o 20 vyšší? Je tato energie menší nebo větší než při teplotě 37 C?
 TERMOCHEMIE Reakční entalpie při izotermním průběhu reakce, rozsah reakce 1 Kolik tepla se uvolní (nebo spotřebuje) při výrobě 2,2 kg acetaldehydu C 2 H 5 OH(g) = CH 3 CHO(g) + H 2 (g) (a) při teplotě
TERMOCHEMIE Reakční entalpie při izotermním průběhu reakce, rozsah reakce 1 Kolik tepla se uvolní (nebo spotřebuje) při výrobě 2,2 kg acetaldehydu C 2 H 5 OH(g) = CH 3 CHO(g) + H 2 (g) (a) při teplotě
 Základní anorganické výroby PRŮMYSLVÁ ANRGANICKÁ CHEMIE Voda Výroba Filtrace Úprava dstraňování nečistot Vodík Výroba vodíku Petrochemie Elektrochemie Peroxid vodíku a anorganické peroxosloučeniny Dusík
Základní anorganické výroby PRŮMYSLVÁ ANRGANICKÁ CHEMIE Voda Výroba Filtrace Úprava dstraňování nečistot Vodík Výroba vodíku Petrochemie Elektrochemie Peroxid vodíku a anorganické peroxosloučeniny Dusík
CH 3 -CH 3 -> CH 3 -CH 2 -OH -> CH 3 -CHO -> CH 3 -COOH ethan ethanol ethanal kyselina octová
 KARBOXYLOVÉ KYSELINY Karboxylové kyseliny jsou sloučeniny, v jejichž molekule je karboxylová funkční skupina: Jsou nejvyššími organickými oxidačními produkty uhlovodíků: primární aldehydy uhlovodíky alkoholy
KARBOXYLOVÉ KYSELINY Karboxylové kyseliny jsou sloučeniny, v jejichž molekule je karboxylová funkční skupina: Jsou nejvyššími organickými oxidačními produkty uhlovodíků: primární aldehydy uhlovodíky alkoholy
DERIVÁTY - OPAKOVÁNÍ
 DERIVÁTY - OPAKOVÁNÍ Doplňte k názvu derivátu uhlovodíku charakteristickou skupinu: alkohol Název derivátu Charakteristická skupina nitroderivát karboxylová kyselina aldehyd halogenderivát keton Doplňte
DERIVÁTY - OPAKOVÁNÍ Doplňte k názvu derivátu uhlovodíku charakteristickou skupinu: alkohol Název derivátu Charakteristická skupina nitroderivát karboxylová kyselina aldehyd halogenderivát keton Doplňte
Přírodní zdroje uhlovodíků. a jejich zpracování
 Přírodní zdroje uhlovodíků a jejich zpracování 1 Rozdělení: Přírodní zdroje org. látek fosilní - zemní plyn, ropa, uhlí (vznikají geochemickými procesy miliony let) recentní (současné) - dřevo, rostlinné
Přírodní zdroje uhlovodíků a jejich zpracování 1 Rozdělení: Přírodní zdroje org. látek fosilní - zemní plyn, ropa, uhlí (vznikají geochemickými procesy miliony let) recentní (současné) - dřevo, rostlinné
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115
 Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: CZ.1.07/1.5.00/34.0410 Číslo šablony: III/2 Inovace a zkvalitnění výuky prostřednictvím ICT. Název materiálu: Opakovací test
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: CZ.1.07/1.5.00/34.0410 Číslo šablony: III/2 Inovace a zkvalitnění výuky prostřednictvím ICT. Název materiálu: Opakovací test
Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška Rafinace pohonných hmot, zpracování sulfanu, výroba vodíku
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška Rafinace pohonných hmot, zpracování sulfanu, výroba vodíku
Aldehydy, ketony, karboxylové kyseliny
 Projekt: Inovace oboru Mechatronik pro Zlínský kraj Registrační číslo: CZ.1.07/1.1.08/03.0009 Aldehydy, ketony, karboxylové kyseliny Aldehydy jsou organické sloučeniny, které obsahují aldehydickou funkční
Projekt: Inovace oboru Mechatronik pro Zlínský kraj Registrační číslo: CZ.1.07/1.1.08/03.0009 Aldehydy, ketony, karboxylové kyseliny Aldehydy jsou organické sloučeniny, které obsahují aldehydickou funkční
www.zlinskedumy.cz Inovace výuky prostřednictvím šablon pro SŠ
 Název projektu Číslo projektu Název školy Autor Název šablony Název DUMu Inovace výuky prostřednictvím šablon pro SŠ CZ.1.07/1.5.00/34.0748 Gymnázium Jana Pivečky a Střední odborná škola Slavičín Mgr.
Název projektu Číslo projektu Název školy Autor Název šablony Název DUMu Inovace výuky prostřednictvím šablon pro SŠ CZ.1.07/1.5.00/34.0748 Gymnázium Jana Pivečky a Střední odborná škola Slavičín Mgr.
Technické plyny. kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny)
 Technické plyny kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny) Kapalný vzduch složení vzduchu Před zkapalněním odstranění nežádoucích složek, např. vodní pára, CO 2, prach Zkapalňování
Technické plyny kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny) Kapalný vzduch složení vzduchu Před zkapalněním odstranění nežádoucích složek, např. vodní pára, CO 2, prach Zkapalňování
HOŘENÍ A VÝBUCH. Ing. Hana Věžníková, Ph. D.
 HOŘENÍ A VÝBUCH Ing. Hana Věžníková, Ph. D. 1 HOŘENÍ A VÝBUCH Definice hoření Vysvětlení procesu hoření Základní podmínky pro hoření Co jsou hořlavé látky (hořlaviny) a jak je lze klasifikovat Chemické
HOŘENÍ A VÝBUCH Ing. Hana Věžníková, Ph. D. 1 HOŘENÍ A VÝBUCH Definice hoření Vysvětlení procesu hoření Základní podmínky pro hoření Co jsou hořlavé látky (hořlaviny) a jak je lze klasifikovat Chemické
Základní chemické pojmy
 MZ CHEMIE 2015 MO 1 Základní chemické pojmy Atom, molekula, prvek, protonové číslo. Sloučenina, chemicky čistá látka, směs, dělení směsí. Relativní atomová hmotnost, molekulová hmotnost, atomová hmotnostní
MZ CHEMIE 2015 MO 1 Základní chemické pojmy Atom, molekula, prvek, protonové číslo. Sloučenina, chemicky čistá látka, směs, dělení směsí. Relativní atomová hmotnost, molekulová hmotnost, atomová hmotnostní
16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší?
 16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší? 4) Urči typy konstituční izomerie. 5) Co je tautomerie
16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší? 4) Urči typy konstituční izomerie. 5) Co je tautomerie
Gymnázium Vysoké Mýto nám. Vaňorného 163, Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto H 3 C Vymezení arenů V aromatickém cyklu dochází k průniku orbitalů kolmých k rovině cyklu. Vzniká tzv. delokalizovaná vazba π. Stabilita benzenu
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto H 3 C Vymezení arenů V aromatickém cyklu dochází k průniku orbitalů kolmých k rovině cyklu. Vzniká tzv. delokalizovaná vazba π. Stabilita benzenu
materiál č. šablony/č. sady/č. materiálu: Autor:
 Masarykova základní škola Klatovy, tř. Národních mučedníků 185, 339 01 Klatovy; 376312154, fax 376326089 E-mail: skola@maszskt.investtel.cz; internet: www.maszskt.investtel.cz Kód přílohy vzdělávací VY_32_INOVACE_CH8SA_01_03_14
Masarykova základní škola Klatovy, tř. Národních mučedníků 185, 339 01 Klatovy; 376312154, fax 376326089 E-mail: skola@maszskt.investtel.cz; internet: www.maszskt.investtel.cz Kód přílohy vzdělávací VY_32_INOVACE_CH8SA_01_03_14
UHLOVODÍKY ALKANY (...)
 UHLOVODÍKY ALKANY (...) alifatické nasycené uhlovodíky nerozvětvené i rozvětvené mezi atomy uhlíku pouze jednoduché vazby (σ vazby), mezi nimi úhel 109 28 název: kmen + an obecný vzorec C n H 2n + 2 tvoří
UHLOVODÍKY ALKANY (...) alifatické nasycené uhlovodíky nerozvětvené i rozvětvené mezi atomy uhlíku pouze jednoduché vazby (σ vazby), mezi nimi úhel 109 28 název: kmen + an obecný vzorec C n H 2n + 2 tvoří
VY_32_INOVACE_29_HBENO5
 Alkany reakce Temacká oblast : Chemie organická chemie Datum vytvoření: 15. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Výroba alkanů. Reakvita alkanů, důležité
Alkany reakce Temacká oblast : Chemie organická chemie Datum vytvoření: 15. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Výroba alkanů. Reakvita alkanů, důležité
Vzdělávací obsah vyučovacího předmětu
 Vzdělávací obsah vyučovacího předmětu Chemie 9. ročník Zpracovala: Mgr. Michaela Krůtová ANORGANICKÉ SLOUČENINY KYSELINY porovná vlastnosti a použití vybraných prakticky významných kyselin orientuje se
Vzdělávací obsah vyučovacího předmětu Chemie 9. ročník Zpracovala: Mgr. Michaela Krůtová ANORGANICKÉ SLOUČENINY KYSELINY porovná vlastnosti a použití vybraných prakticky významných kyselin orientuje se
MATURITNÍ OTÁZKY Z CHEMIE
 MATURITNÍ OTÁZKY Z CHEMIE 1 Složení a struktura atomu Vývoj představ o složení a struktuře atomu, elektronový obal atomu, modely atomu, pojem orbital, typy orbitalů, jejich znázorňování a pravidla pro
MATURITNÍ OTÁZKY Z CHEMIE 1 Složení a struktura atomu Vývoj představ o složení a struktuře atomu, elektronový obal atomu, modely atomu, pojem orbital, typy orbitalů, jejich znázorňování a pravidla pro
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Alklany a cykloalkany Homologická řada alkanů Nerozvětvené alkany tvoří homologickou řadu obecného vzorce C n H 2n+2, kde n jsou malá celá čísla.
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Alklany a cykloalkany Homologická řada alkanů Nerozvětvené alkany tvoří homologickou řadu obecného vzorce C n H 2n+2, kde n jsou malá celá čísla.
Karboxylové kyseliny a jejich funkční deriváty
 Karboxylové kyseliny a jejich funkční deriváty Úvod Karboxylové kyseliny jsou nejdůležitější organické kyseliny. Jejich funkční skupina je karboxylová skupina a tento název je složen ze slov karbonyl a
Karboxylové kyseliny a jejich funkční deriváty Úvod Karboxylové kyseliny jsou nejdůležitější organické kyseliny. Jejich funkční skupina je karboxylová skupina a tento název je složen ze slov karbonyl a
Zpracování ropy doc. Ing. Josef Blažek, CSc. 5. přednáška
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 5. přednáška Reformování a izomerace benzinů, výroba benzinových složek
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 5. přednáška Reformování a izomerace benzinů, výroba benzinových složek
Reálné gymnázium a základní škola města Prostějova Školní vzdělávací program pro ZV Ruku v ruce
 6 ČLOVĚK A PŘÍRODA UČEBNÍ OSNOVY 6. 2 Chemie Časová dotace 8. ročník 2 hodiny 9. ročník 2 hodiny Celková dotace na 2. stupni je 4 hodiny. Charakteristika: Vyučovací předmět chemie vede k poznávání chemických
6 ČLOVĚK A PŘÍRODA UČEBNÍ OSNOVY 6. 2 Chemie Časová dotace 8. ročník 2 hodiny 9. ročník 2 hodiny Celková dotace na 2. stupni je 4 hodiny. Charakteristika: Vyučovací předmět chemie vede k poznávání chemických
Vysoká škola chemicko-technologická v Praze. Ústav organické technologie. Václav Matoušek
 Vysoká škola chemicko-technologická v Praze Ústav organické technologie VŠCHT PRAHA SVOČ 2005 Václav Matoušek Školitel : Ing. Petr Kačer, PhD. Prof. Ing. Libor Červený, DrSc. Proč asymetrická hydrogenace?
Vysoká škola chemicko-technologická v Praze Ústav organické technologie VŠCHT PRAHA SVOČ 2005 Václav Matoušek Školitel : Ing. Petr Kačer, PhD. Prof. Ing. Libor Červený, DrSc. Proč asymetrická hydrogenace?
DUM VY_52_INOVACE_12CH24
 Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH24 autor: Kristýna Anna olníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 9. vzdělávací oblast: vzdělávací obor: tematický
Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH24 autor: Kristýna Anna olníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 9. vzdělávací oblast: vzdělávací obor: tematický
Vzdělávací oblast: Člověk a příroda. Vyučovací předmět: Chemie. Třída: kvarta. Očekávané výstupy. Poznámky. Přesahy. Průřezová témata.
 Vzdělávací oblast: Člověk a příroda Vyučovací předmět: Chemie Třída: kvarta Očekávané výstupy Vysvětlí pojmy oxidace, redukce, oxidační činidlo, redukční činidlo Rozliší redoxní rovnice od neredoxních
Vzdělávací oblast: Člověk a příroda Vyučovací předmět: Chemie Třída: kvarta Očekávané výstupy Vysvětlí pojmy oxidace, redukce, oxidační činidlo, redukční činidlo Rozliší redoxní rovnice od neredoxních
1. PROCES A PODMÍNKY HOŘENÍ, HOŘLAVÉ LÁTKY
 1. PROCES A PODMÍNKY HOŘENÍ, HOŘLAVÉ LÁTKY V této kapitole se dozvíte: Jak lze definovat hoření? Jak lze vysvětlit proces hoření? Jaké jsou základní podmínky pro hoření? Co jsou hořlavé látky (hořlaviny)
1. PROCES A PODMÍNKY HOŘENÍ, HOŘLAVÉ LÁTKY V této kapitole se dozvíte: Jak lze definovat hoření? Jak lze vysvětlit proces hoření? Jaké jsou základní podmínky pro hoření? Co jsou hořlavé látky (hořlaviny)
Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch
 Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch Atom, složení a struktura Chemické prvky-názvosloví, slučivost Chemické sloučeniny, molekuly Chemická vazba
Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch Atom, složení a struktura Chemické prvky-názvosloví, slučivost Chemické sloučeniny, molekuly Chemická vazba
HYDROXYDERIVÁTY UHLOVODÍKŮ
 Na www.studijni-svet.cz zaslal(a): Nemám - Samanta YDROXYDERIVÁTY ULOVODÍKŮ - deriváty vody, kdy jeden z vodíkových atomů je nahrazen uhlovodíkovým zbytkem alkyl alkoholy aryl = fenoly ( 3 - ; 3 2 - ;
Na www.studijni-svet.cz zaslal(a): Nemám - Samanta YDROXYDERIVÁTY ULOVODÍKŮ - deriváty vody, kdy jeden z vodíkových atomů je nahrazen uhlovodíkovým zbytkem alkyl alkoholy aryl = fenoly ( 3 - ; 3 2 - ;
Alkany a cykloalkany
 Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Září 2010 Mgr. Alena Jirčáková Charakteristika alkanů: Malá reaktivita, odolné chemickým činidlům Nasycené
Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Září 2010 Mgr. Alena Jirčáková Charakteristika alkanů: Malá reaktivita, odolné chemickým činidlům Nasycené
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: Číslo DUMu: VY_32_INOVACE_10_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné
 Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 12.02.2013 Číslo DUMu: VY_32_INOVACE_10_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Obecná
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 12.02.2013 Číslo DUMu: VY_32_INOVACE_10_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Obecná
Zpracování ropy doc. Ing. Josef Blažek, CSc.
 ODBONÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PO VÝKON STÁTNÍ SPÁVY OCHANY OVZDUŠÍ V ČESKÉ EPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 2. přednáška Složení ropy, základní schémata zpracování ropy, odsolování a
ODBONÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PO VÝKON STÁTNÍ SPÁVY OCHANY OVZDUŠÍ V ČESKÉ EPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 2. přednáška Složení ropy, základní schémata zpracování ropy, odsolování a
1. ročník Počet hodin
 SOUSTAVY LÁTEK A JEJICH SLOŽENÍ rozdělení přírodních látek a vlastnosti chemických látek soustavy látek a jejich složení STAVBA ATOMU historie pohledu na atom složení a struktura atomu stavba atomu VELIČINY
SOUSTAVY LÁTEK A JEJICH SLOŽENÍ rozdělení přírodních látek a vlastnosti chemických látek soustavy látek a jejich složení STAVBA ATOMU historie pohledu na atom složení a struktura atomu stavba atomu VELIČINY
1)uhlovodík musí být cyklický, všechny atomy musí být v jedné rovině
 Otázka: Areny Předmět: Chemie Přidal(a): I. Prokopová 3 podmínky: 1)uhlovodík musí být cyklický, všechny atomy musí být v jedné rovině 2) musí existovat minimálně dvě možnosti uspořádání π elektronů 3)
Otázka: Areny Předmět: Chemie Přidal(a): I. Prokopová 3 podmínky: 1)uhlovodík musí být cyklický, všechny atomy musí být v jedné rovině 2) musí existovat minimálně dvě možnosti uspořádání π elektronů 3)
Škola: Gymnázium, Brno, Slovanské náměstí 7 III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
ANORGANICKÁ ORGANICKÁ
 EMIE ANORGANIKÁ ORGANIKÁ 1 EMIE ANORGANIKÁ Anorganické látky Oxidy: O, O 2.. V neživé přírodě.. alogenidy: Nal.. ydroxidy: NaO Uhličitany: ao 3... Kyseliny: l. ydrogenuhličitany: NaO 3. 2 EMIE ORGANIKÁ
EMIE ANORGANIKÁ ORGANIKÁ 1 EMIE ANORGANIKÁ Anorganické látky Oxidy: O, O 2.. V neživé přírodě.. alogenidy: Nal.. ydroxidy: NaO Uhličitany: ao 3... Kyseliny: l. ydrogenuhličitany: NaO 3. 2 EMIE ORGANIKÁ
Základní škola, Ostrava Poruba, Bulharská 1532, příspěvková organizace
 Chemie - 8. ročník pozorování, pokus a bezpečnost práce Určí společné a rozdílné vlastnosti látek vlastnosti látek hustota, rozpustnost, tepelná a elektrická vodivost, vliv atmosféry na vlastnosti a stav
Chemie - 8. ročník pozorování, pokus a bezpečnost práce Určí společné a rozdílné vlastnosti látek vlastnosti látek hustota, rozpustnost, tepelná a elektrická vodivost, vliv atmosféry na vlastnosti a stav
Názvosloví Konformace Isomerie. Uhlíky: primární (1 o ) sekundární (2 o ) terciární (3 o ) kvartérní (4 o )
 ALKANY 1 Názvosloví Konformace Isomerie Uhlíky: primární (1 o ) sekundární (2 o ) terciární (3 o ) kvartérní (4 o ) 2 Alkany (resp. cykloalkany) jsou nejzákladnější organické sloučeniny složené pouze z
ALKANY 1 Názvosloví Konformace Isomerie Uhlíky: primární (1 o ) sekundární (2 o ) terciární (3 o ) kvartérní (4 o ) 2 Alkany (resp. cykloalkany) jsou nejzákladnější organické sloučeniny složené pouze z
4. ročník - seminář Vzdělávací obor - Člověk a příroda
 Gymnázium, Milevsko, Masarykova 183 Školní vzdělávací program (ŠVP) pro vyšší stupeň osmiletého studia a čtyřleté studium Vyučovací předmět - Chemie 4. ročník - seminář Vzdělávací obor - Člověk a příroda
Gymnázium, Milevsko, Masarykova 183 Školní vzdělávací program (ŠVP) pro vyšší stupeň osmiletého studia a čtyřleté studium Vyučovací předmět - Chemie 4. ročník - seminář Vzdělávací obor - Člověk a příroda
Učební osnovy Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemický kroužek ročník 6.-9.
 Učební osnovy Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemický kroužek ročník 6.-9. Školní rok 0/03, 03/04 Kapitola Téma (Učivo) Znalosti a dovednosti (výstup) Počet hodin pro kapitolu Úvod
Učební osnovy Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemický kroužek ročník 6.-9. Školní rok 0/03, 03/04 Kapitola Téma (Učivo) Znalosti a dovednosti (výstup) Počet hodin pro kapitolu Úvod
Karbonylové sloučeniny
 Karbonylové sloučeniny více než 120 o 120 o C O C C d + d - C O C sp 2 C sp 2 R C O H R 1 C O R 2 1.aldehydy, ketony Nu E R C O R C O 2. karboxylové kyseliny a funkční deriváty O H 3. deriváty kys. uhličité
Karbonylové sloučeniny více než 120 o 120 o C O C C d + d - C O C sp 2 C sp 2 R C O H R 1 C O R 2 1.aldehydy, ketony Nu E R C O R C O 2. karboxylové kyseliny a funkční deriváty O H 3. deriváty kys. uhličité
Chemické procesy v ochraně životního prostředí
 Chemické procesy v ochraně životního prostředí 1. Vliv výroby energie na životní prostředí 2. Zpracování výfukových plynů ze spalovacích motorů 3. Zachycování oxidů síry ve spalinách 4. Výroba paliv pro
Chemické procesy v ochraně životního prostředí 1. Vliv výroby energie na životní prostředí 2. Zpracování výfukových plynů ze spalovacích motorů 3. Zachycování oxidů síry ve spalinách 4. Výroba paliv pro
Chemie NÁRODNÍ SROVNÁVACÍ ZKOUŠKY BŘEZNA 2017
 NÁRODNÍ SROVNÁVACÍ ZKOUŠKY Chemie T BŘEZNA 2017 D : 4. BŘEZNA 2017 : 212 : 30 M. M. : 29,0 : 26,7 M. : 8,8 % S : -9,7 M. : -4,3 : 14,7 Zopakujte si základní informace ke zkoušce: n Test obsahuje 30 úloh.
NÁRODNÍ SROVNÁVACÍ ZKOUŠKY Chemie T BŘEZNA 2017 D : 4. BŘEZNA 2017 : 212 : 30 M. M. : 29,0 : 26,7 M. : 8,8 % S : -9,7 M. : -4,3 : 14,7 Zopakujte si základní informace ke zkoušce: n Test obsahuje 30 úloh.
Ch - Uhlovodíky VARIACE
 Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukových materiálů je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE Tento dokument byl kompletně vytvořen, sestaven a vytištěn
Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukových materiálů je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE Tento dokument byl kompletně vytvořen, sestaven a vytištěn
Úvod Obecný vzorec alkoholů je R-OH.
 Alkoholy a fenoly Úvod becný vzorec alkoholů je R-. Názvosloví alkoholů a fenolů Běžná jména alkoholů se odvozují od alifatického zbytku připojeného k hydroxylové skupině, ke kterému se přidá slovo alkohol.
Alkoholy a fenoly Úvod becný vzorec alkoholů je R-. Názvosloví alkoholů a fenolů Běžná jména alkoholů se odvozují od alifatického zbytku připojeného k hydroxylové skupině, ke kterému se přidá slovo alkohol.
Organická chemie 3.ročník studijního oboru - kosmetické služby.
 Organická chemie 3.ročník studijního oboru - kosmetické služby. T-7 Funkční a substituční deriváty karboxylových kyselin Zpracováno v rámci projektu Zlepšení podmínek ke vzdělávání Registrační číslo projektu:
Organická chemie 3.ročník studijního oboru - kosmetické služby. T-7 Funkční a substituční deriváty karboxylových kyselin Zpracováno v rámci projektu Zlepšení podmínek ke vzdělávání Registrační číslo projektu:
III/2 Inovace a zkvalitnění výuky prostřednictvím ICT. Test k ověření znalostí o ropě 2. verze
 Číslo projektu CZ.1.07/1.5.00/34.0514 Číslo a název šablony klíčové aktivity III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Tematická oblast Suroviny organické technologie, vy_32_inovace_ma_09_32
Číslo projektu CZ.1.07/1.5.00/34.0514 Číslo a název šablony klíčové aktivity III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Tematická oblast Suroviny organické technologie, vy_32_inovace_ma_09_32
Alkyny. C n H 2n-2 (obsahuje jednu trojnou vazbu) uhlíky v sp hybridizaci
 Alkyny C n H 2n-2 (obsahuje jednu trojnou vazbu) uhlíky v sp hybridizaci 1 Klasifikace 2 Alkyny - dvě π vazby; lineární uspořádání Pozor! 3 Vlastnosti -π elektrony jsou méně mobilní než u alkenů H CH 3
Alkyny C n H 2n-2 (obsahuje jednu trojnou vazbu) uhlíky v sp hybridizaci 1 Klasifikace 2 Alkyny - dvě π vazby; lineární uspořádání Pozor! 3 Vlastnosti -π elektrony jsou méně mobilní než u alkenů H CH 3
Školní výstupy Učivo (pojmy) Poznámka
 Vyučovací předmět: Chemie (Ch) Ročník Předmět Průřezová témata Mezipředmět. vazby Školní výstupy Učivo (pojmy) Poznámka Období splnění Metodická poznámka Rozsah vyžadovaného učiva OSV 1 (praktické pokusy)
Vyučovací předmět: Chemie (Ch) Ročník Předmět Průřezová témata Mezipředmět. vazby Školní výstupy Učivo (pojmy) Poznámka Období splnění Metodická poznámka Rozsah vyžadovaného učiva OSV 1 (praktické pokusy)
V. Soustavy s chemickou reakcí
 V. Soustavy s chemickou reakcí 1 5. Soustavy s chemickou reakcí 5.1 Základní pojmy 5.2 Rozdělení reakcí 5.3 Reakční kinetika 5.3.1 Podmínky pro zreagování dvou molekul 5.3.2 Mechanismy reakce 5.3.3 Rychlost
V. Soustavy s chemickou reakcí 1 5. Soustavy s chemickou reakcí 5.1 Základní pojmy 5.2 Rozdělení reakcí 5.3 Reakční kinetika 5.3.1 Podmínky pro zreagování dvou molekul 5.3.2 Mechanismy reakce 5.3.3 Rychlost
Chemické principy průmyslových výrob
 Chemické principy průmyslových výrob Jiří Vohlídal Katedra fyzikální a makromolekulární chemie Přírodovědecká fakulta University Karlovy, Praha Jiří Čejka Ústav fyzikální chemie Jaroslava Heyrovského Akademie
Chemické principy průmyslových výrob Jiří Vohlídal Katedra fyzikální a makromolekulární chemie Přírodovědecká fakulta University Karlovy, Praha Jiří Čejka Ústav fyzikální chemie Jaroslava Heyrovského Akademie
5. CHEMICKÉ REAKCE. KLASIFIKACE CHEMICKÝCH REAKCÍ a) Podle vnějších změn Reakce skládání = SYNTÉZY z jednodušších -> složitější 2H 2 + O 2 -> 2H 2 O
 Na www.studijni-svet.cz zaslal(a): Kikusska94 5. CHEMICKÉ REAKCE Je děj při kterém v molekulách reagujících látek dochází k zániku některých vazeb a ke vzniku vazeb nových. Produkty rekce mají jiné chemické
Na www.studijni-svet.cz zaslal(a): Kikusska94 5. CHEMICKÉ REAKCE Je děj při kterém v molekulách reagujících látek dochází k zániku některých vazeb a ke vzniku vazeb nových. Produkty rekce mají jiné chemické
Omezování plynných emisí. Ochrana ovzduší ZS 2012/2013
 Omezování plynných emisí Ochrana ovzduší ZS 2012/2013 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Omezování plynných emisí Ochrana ovzduší ZS 2012/2013 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
CHEMIE - Úvod do organické chemie
 Název školy Číslo projektu Autor Název šablony Název DUMu Stupeň a typ vzdělávání Vzdělávací oblast Vzdělávací obor Vzdělávací okruh Druh učebního materiálu Cílová skupina Anotace SŠHS Kroměříž CZ.1.07/1.5.00/34.0911
Název školy Číslo projektu Autor Název šablony Název DUMu Stupeň a typ vzdělávání Vzdělávací oblast Vzdělávací obor Vzdělávací okruh Druh učebního materiálu Cílová skupina Anotace SŠHS Kroměříž CZ.1.07/1.5.00/34.0911
Inovace profesní přípravy budoucích učitelů chemie
 Inovace profesní přípravy budoucích učitelů chemie I n v e s t i c e d o r o z v o j e v z d ě l á v á n í CZ.1.07/2.2.00/15.0324 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem
Inovace profesní přípravy budoucích učitelů chemie I n v e s t i c e d o r o z v o j e v z d ě l á v á n í CZ.1.07/2.2.00/15.0324 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem
1. Termochemie - příklady 1. ročník
 1. Termochemie - příklady 1. ročník 1.1. Urči reakční teplo reakce: C (g) + 1/2 O 2 (g) -> CO (g), ΔH 1 =?, známe-li C (g) + O 2 (g) -> CO 2 (g) ΔH 2 = -393,7 kj/mol CO (g) + 1/2 O 2 -> CO 2 (g) ΔH 3 =
1. Termochemie - příklady 1. ročník 1.1. Urči reakční teplo reakce: C (g) + 1/2 O 2 (g) -> CO (g), ΔH 1 =?, známe-li C (g) + O 2 (g) -> CO 2 (g) ΔH 2 = -393,7 kj/mol CO (g) + 1/2 O 2 -> CO 2 (g) ΔH 3 =
Zpracování ropy - Pracovní list
 Číslo projektu Název školy Předmět CZ.107/1.5.00/34.0425 INTEGROVANÁ STŘEDNÍ ŠKOLA TECHNICKÁ BENEŠOV Černoleská 1997, 256 01 Benešov BIOLOGIE A EKOLOGIE Tematický okruh Téma Ročník 2. Autor Datum výroby
Číslo projektu Název školy Předmět CZ.107/1.5.00/34.0425 INTEGROVANÁ STŘEDNÍ ŠKOLA TECHNICKÁ BENEŠOV Černoleská 1997, 256 01 Benešov BIOLOGIE A EKOLOGIE Tematický okruh Téma Ročník 2. Autor Datum výroby
PROPEN - PŘEHLED VYUŽITÍ
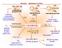 PRPEN - PŘEHLED VYUŽITÍ polymery propandioly propylenkarbonát isopropanolaminy C 4 aldehydy alkoholy kyseliny jejich estery CH methyloxiran (propylenoxid) hydroformylace hydrokarbonylace + 2 isopropylbenzen
PRPEN - PŘEHLED VYUŽITÍ polymery propandioly propylenkarbonát isopropanolaminy C 4 aldehydy alkoholy kyseliny jejich estery CH methyloxiran (propylenoxid) hydroformylace hydrokarbonylace + 2 isopropylbenzen
T E C H N I C K Á chemická odolnost membrána čistá polyurea TECNOCOAT P-2049
 TEKUTÁ OCHRANNÁ HYDROIZOLAČNÍ MEMBRÁNA T E C H N I C K Á S L O Ž K A chemická odolnost membrána čistá polyurea TECNOCOAT P-2049 t93 568 21 11 f93 568 02 11 e-mail: info@ Voda Solanka xxxxxx Odolná Chlorovaná
TEKUTÁ OCHRANNÁ HYDROIZOLAČNÍ MEMBRÁNA T E C H N I C K Á S L O Ž K A chemická odolnost membrána čistá polyurea TECNOCOAT P-2049 t93 568 21 11 f93 568 02 11 e-mail: info@ Voda Solanka xxxxxx Odolná Chlorovaná
Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/
 Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/34.0448 Číslo projektu Číslo materiálu Název školy Autor Tematický celek Ročník CZ.1.07/1.5.00/34.0448 ICT- PZC 2/11 Zdroje uhlovodíků Střední
Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/34.0448 Číslo projektu Číslo materiálu Název školy Autor Tematický celek Ročník CZ.1.07/1.5.00/34.0448 ICT- PZC 2/11 Zdroje uhlovodíků Střední
Základní škola, Ostrava Poruba, Bulharská 1532, příspěvková organizace
 Chemie - 8. ročník pozorování, pokus a bezpečnost práce Určí společné a rozdílné vlastnosti látek vlastnosti látek hustota, rozpustnost, tepelná a elektrická vodivost, vliv atmosféry na vlastnosti a stav
Chemie - 8. ročník pozorování, pokus a bezpečnost práce Určí společné a rozdílné vlastnosti látek vlastnosti látek hustota, rozpustnost, tepelná a elektrická vodivost, vliv atmosféry na vlastnosti a stav
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 KARBONYLOVÉ SLOUČENINY = látky, které obsahují karbonylovou skupinu Aldehydy mají skupinu C=O na konci řetězce, aldehydická skupina má potom tvar... Názvosloví aldehydů: V systematickém názvu je zakončení
KARBONYLOVÉ SLOUČENINY = látky, které obsahují karbonylovou skupinu Aldehydy mají skupinu C=O na konci řetězce, aldehydická skupina má potom tvar... Názvosloví aldehydů: V systematickém názvu je zakončení
Radiační odstraňování vybraných kontaminantů z podzemních a odpadních vod
 Radiační odstraňování vybraných kontaminantů z podzemních a odpadních vod Václav Čuba, Viliam Múčka, Milan Pospíšil, Rostislav Silber ČVUT v Praze Centrum pro radiochemii a radiační chemii Fakulta jaderná
Radiační odstraňování vybraných kontaminantů z podzemních a odpadních vod Václav Čuba, Viliam Múčka, Milan Pospíšil, Rostislav Silber ČVUT v Praze Centrum pro radiochemii a radiační chemii Fakulta jaderná
Redoxní reakce Jsou to chem. reakce, při kterých se mění oxidační čísla atomů. Každá redoxní reakce se skládá z oxidace a redukce.
 Chemické reakce 1) Zákon zachování hmotnosti Součet hmotností výchozích látek a produktů se během chemické reakce nemění. 2) Zákon zachování energie Energie při chemických reakcích nevzniká ani nezaniká,
Chemické reakce 1) Zákon zachování hmotnosti Součet hmotností výchozích látek a produktů se během chemické reakce nemění. 2) Zákon zachování energie Energie při chemických reakcích nevzniká ani nezaniká,
Teoretický protokol ze cvičení 6. 12. 2010 Josef Bušta, skupina: 1, obor: fytotechnika
 Úloha: Karboxylové kyseliny, č. 3 Úkoly: Příprava kys. mravenčí z chloroformu Rozklad kys. mravenčí Esterifikace Rozklad kys. šťavelové Příprava kys. benzoové oxidací toluenu Reakce kys. benzoové a salicylové
Úloha: Karboxylové kyseliny, č. 3 Úkoly: Příprava kys. mravenčí z chloroformu Rozklad kys. mravenčí Esterifikace Rozklad kys. šťavelové Příprava kys. benzoové oxidací toluenu Reakce kys. benzoové a salicylové
Předmět: Chemie Ročník: 9.
 Předmět: Chemie Ročník: 9. Očekávané výstupy Školní výstupy Učivo Průřezová témata 1. ANORGANICKÉ SLOUČENINY Uvede příklady uplatňování Popíše princip neutralizace Neutralizace neutralizace v praxi Vysvětlí
Předmět: Chemie Ročník: 9. Očekávané výstupy Školní výstupy Učivo Průřezová témata 1. ANORGANICKÉ SLOUČENINY Uvede příklady uplatňování Popíše princip neutralizace Neutralizace neutralizace v praxi Vysvětlí
