Praktickéaspekty léčby kastračně rezistentního karcinomu prostaty a jejídopad na kvalitu života pacientů. Jana Katolická FN u svatéanny, Brno
|
|
|
- Petr Toman
- před 9 lety
- Počet zobrazení:
Transkript
1 Praktickéaspekty léčby kastračně rezistentního karcinomu prostaty a jejídopad na kvalitu života pacientů Jana Katolická FN u svatéanny, Brno
2 2012 Radium Enzalutamide Denosumab 2004 Cabazitaxel Denosumab <1996 ADT Zoledronic acid Docetaxel ADT Sipuleucel-T Abiraterone Post-doc Zoledronic acid Cabazitaxel Sipuleucel-T Abiraterone pre & post-doc Zoledronic acid Docetaxel Docetaxel ADT ADT
3 studie TAX 327 metastatický kastračně rezistentní karcinom prednison + mitoxantron 12mg/m2 každétři týdny, docetaxel 75mg/m2 vetřitýdenním intervalu docetaxel 30mg/m2 týdněpo dobu 5 týdnůsvynecháním aplikace všestém týdnu. superiorita docetaxelu vtřitýdenním intervalu podánípřed mitoxantronem v signifikantním prodloužení: medián celkového přežití(19,2 vs 16,3 měsíce; p=0.004), PSA odpovědi (45% vs 32%; p<0,001), ústup bolesti (35% vs 22%; p=0.01) kvalita života (22% vs 13%; p=0.009).
4 Kontraindikace podánídocetaxelu hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku pacienti s výchozím počtem neutrofilů< buněk/mm3. pacienti s těžkým poškozením funkce jater
5 Toxicita docetaxelu kožní, neurologická, retence tekutin lokalizovaný kožníerytém na končetinách (dlaněa chodidla) spolu s edémem s následnou deskvamací. pozorovány závažnésymptomy jako je vyrážka s následnou deskvamací. retence tekutin ve forměpleurálního výpotku, perikardiálního výpotku nebo ascitu periferní neurotoxicita
6 Hypersenzitivníreakce v průběhu prvnía druhéinfuze možnost vzniku hypersenzitivníreakce může se vyskytnout v průběhu několika málo minut po počátku infuze docetaxelu nutno mít k dispozici prostředky pro léčbu hypotenze a bronchospasmu.
7 Docetaxel a interakce s jinými léčivy silněse váže na proteiny (více než95 %). metabolismus docetaxelu se může změnit současným podáváním látek, které indukují nebo inhibujícytochrom P450-3A nebo jsou jím metabolizovány: cyklosporin, terfenadin, ketokonazol, erythromycin a troleandomycin. existuje potenciální nebezpečí významné interakce.
8 Farmakokinetika docetaxelu za přítomnosti prednisonu Docetaxel je metabolizován CYP3A4 a o prednisonu je známo, že CYP3A4 indukuje. Nebyl pozorován statisticky významný efekt prednisonu na farmakokinetiku docetaxelu.
9 Docetaxel a staršínemocní Docetaxel jednou za 3 týdny 333 nemocných, z toho 209 nemocných bylo ve věku 65 let a více a 68 nemocných bylo starších 75 let. U nemocných léčených docetaxelem jednou za 3 týdny je incidence poškození nehtů o 10 % vyšší u nemocných ve věku 65 let a více ve srovnánís mladšími pacienty. Incidence horečky, průjmu, anorexie a periferních otoků byla o 10 % vyšší u nemocných ve věku 75 leta více ve srovnánís mladšími než65 let.
10 Způsob podánía stabilita docetaxelu infuzníroztok docetaxelu Intravenozní aplikace s premedikací kortikoidy, pokud je uchováván při teplotědo 25 C, stabilní24 hodin (včetnějednéhodiny infuze při intravenózním podání).
11 Léčba po docetaxelu
12 Cabazitaxel - indikačníkritéria v kombinaci s prednisonem nebo prednisolonem je hrazen v terapii druhélinie metastazujícího kastračněrezistentního karcinomu prostaty pacientům se stavem výkonnosti ECOG 0-1 dříve léčeným režimem obsahujícím docetaxel, u kterých došlo k progresi onemocněnív průběhu terapie docetaxelem v prvnílinii či do 3 měsícůod jejího ukončení.
13 Cabazitaxel - indikačníkritéria Ze zdravotního pojištění je hrazeno maximálně 10 podaných cyklůléčivého přípravku, pokud dojde k progresi před 10. cyklem, je léčba hrazena pouze do progrese onemocnění.přípravek neníhrazen pacientům s periferníneuropatiínebo stomatitidou 2. či vyššího stupněa pacientům se závažnými komorbiditami (včetně duplicitních malignit).
14 Dávkovánícabazitaxelu Doporučenádávka cabazitaxelu je 25 mg /m2 podávaná formou jednohodinové intravenózní infuze každé3 týdny v kombinaci s 10 mg prednisonu nebo prednisolonu perorálně denněpo celou dobu léčby.
15 Premedikace cabazitaxel mábýt podána alespoň30 minut před každým podáním ke zmírněnírizika a závažnosti hypersenzitivity majíbýt intravenózně podány následující léčivé přípravky: antihistaminikum kortikosteroid antagonista Doporučuje se profylaxe antiemetiky, kterálze podle potřeby podat perorálněnebo intravenózně. Je třeba zajistit dostatečnou hydrataci pacienta po celou dobu léčby, aby se předešlo komplikacím Růstovéfaktory
16 Po-docetaxelu Cabazitaxel: nejčastější nežádoucí účinky Mitoxantron (N=371) Všechny stupně (%) Stupeň 3 (%) Cabazitaxel (N=371) Všechny stupně (%) Stupeň 3 (%) Různé nežádoucí úč Febrilní neutropenie Průjem 11 < Únava Bolesti zad Nausea 23 < Zvracení Hematurie Bolesti břicha
17 Kontraindikace podání cabazitaxelu Hypersenzitivita na cabazitaxel, na jinétaxany nebo na kteroukoli pomocnou látku obsaženou v tomto přípravku, včetně polysorbátu 80. Počet neutrofilůmenšínež1500/mm3. Porucha funkce jater (bilirubin 1x ULN nebo AST a/nebo ALT 1,5x ULN). Souběžné očkování vakcínou proti žluté zimnici
18 Interakce cabazitaxelu vyvarovat se současného podáváníse silnými inhibitory CYP3A, kterémohou zvyšovat plazmatickou koncentraci cabazitaxelu Pokud se současnému podávánísilných inhibitorůcyp3a nelze vyhnout, je třeba zvážit pečlivémonitorovánítoxicity a sníženídávky cabazitaxelu
19 Interakce cabazitaxelu silné inhibitory CYP3A : ketokonazol, itrakonazol, klaritromycin, indinavir, nefazodon, nelfinavir, ritonavir, sachinavir, telitromycin, vorikonazol neboť může dojít ke zvýšení plazmatické koncentrace cabazitaxelu
20 Interakce cabazitaxelu Induktory CYP3A -sníženíplazmatickékoncentrace cabazitaxelu Opakovanépodávánírifampinu (600 mg jednou denně), který je silným induktorem CYP3A, mělo za následek zvýšení clearance cabazitaxelu o 21% Je třeba vyvarovat se současného podávánísilných induktorůcyp3a -fenytoin, karbamazepin, rifampin, rifabutin, rifapentin, fenobarbital Kromě toho by se pacienti měli vyhýbat užívání třezalky tečkované.
21 Interakce cabazitaxelu OATP1B1 cabazitaxel in vitro inhibuje transport proteinů organickým aniontovým transportním polypeptidem OATP1B1. Riziko interakce se substráty OATP1B1 (např. statiny, valsartan, repaglinid) existuje zejména během trváníinfuze (1 hodina) a až20 minut po ukončeníinfuze. Před podáním substrátůoatp1b1 se doporučuje dodržet odstup 12 hodin před aplikacíinfuze a nejméně3 hodiny po ukončeníinfuze.
22 Interakce cabazitaxelu Očkování Podáváníživých nebo atenuovaných vakcín pacientům, kteří mají v důsledku užívání chemoterapeutik sníženou funkci imunitního systému, může mít za následek závažnénebo fatálníinfekce. U pacientůléčených kabazitaxelem je třeba vyvarovat se očkováníživou atenuovanou vakcínou. Neživénebo inaktivovanévakcíny lze podávat, nicméně odpověď na tyto vakcíny může být menší
23 Bezpečnost cabazitaxelu Na základěbezpečnostního profilu může mít cabazitaxel mírný vliv na schopnost řídit nebo obsluhovat stroje, protože může zapříčinit únavu a závrať. Pacienty je třeba upozornit, aby neřídili a neobsluhovali stroje, pokud během léčby zaznamenajítyto nežádoucíúčinky.
24 Kastračněrezistentníkarcinom prostaty Enzalutamid Abirateron 24
25 Abirateron acetát je inhibitor enzymu CYP17(cytochromu P-17), který selektivně působí na syntézu androgenů vnadledvinách, varlatech a takétumoru prostaty. 25
26 Podávání abirateronu Dávkování: 1000 mg (4x250 mg) jednorázově Užití spolu s malou dávkou prednisonu/prednisolonu (2x5 mg) Způsob podání: Polykat celé, zapíjet vodou Uchovávejte při teplotědo 30 C. NE s jídlem! (jídlo může zvýšit systémovou expozici abirateronu) Minimálně2 hodiny po jídle Minimálně 1 hodina před jídlem 1 hod 1 hod 1 hod SPC Zytiga
27 Pre -chemo indikace
28 Studie COU-AA-302 Pacienti Progresivní chemo-naïve mcrpc pacienti (Plan N = 1088) Asymptomatičtí nebo mírně symptomatičtí R A N D O M I Z A C E 1:1 AA 1000 mg denně Prednisone 5 mg BID ( n = 546) Placebo denně Prednisone 5 mg BID (Actual n = 542) cíle Co-primární: rpfs OS sekundární Doba do užití opiátů(nádorově závislá bolest) Doba do zahájení chemoterapie Doba do změny ECOG-PS TTPP Fáze 3 multicentrická, randomizovaná, dvojitě-zaslepená, placebem kontrolovaná stduie 151 center, 12 zemí; USA, Europe, Australia, Canada Stratifikace podle ECOG performance status 0 vs. 1 Ryan et al. N Engl J Med 2013; 368(2):
29 Pre-chemo indikace abirateronu dle SPC Metastatický CRPC bez viscerálních metastáz Asymptomatický/mírně symptomatický Po selhání ADT Chemoterapie není klinicky indikovaná Pouze po schválení individuální žádosti pojišťovnou: 16 SPC Zytiga
30 Post -chemo indikace
31 Studie COU-AA-301 fáze 3, mezinárodní, multicentrická, randomizovaná, dvojitě slepá, placebem-kontrolovaná (147 center, 13 zemí; USA, Europe, Australia, Canada) 1195 pacientů s progresí, mcrpc předléčení1 nebo2režimy chemoterapie, jeden z nich docetaxel Randomisace 2:1 Stratifikace: ECOG performance status (0-1 vs. 2) Nejhorší bolest v posledních 24 hodinách(bpi short form; 0-3 [absent] vs [přítomná]) předchozíchemoterapie(1 vs. 2) Typprogrese(PSA pouzevs. radiografickáprogrese s nebo bez PSA progrese) Abiraterone acetate 1000 mg denně Prednisone 5mg 2x denně Placebo denně Prednisone 5mg 2x denně L É Č B A D O P R O G R E S E Primární cíl: OS (25% improvement; HR 0.8) de Bono et al. N Engl J Med 2011; 346(21):
32 Indikačníomezení abirateron v post -chemoindikaci v kombinaci s prednisonem nebo prednisolonem je hrazen v terapii druhé linie metastazujícího kastračně rezistentního karcinomu prostaty pacientům se stavem výkonnosti ECOG 0-1 dříve léčeným režimem obsahujícím docetaxel, progrese onemocněnív průběhu terapie docetaxelem v prvnílinii či do 3 měsícůod jejího ukončení. rovněžhrazen pacientům, u kterých nenímožnév terapii druhélinie použít taxany (zejména z důvodu jejich nežádoucích účinků). Zdůvodněnímusíbýt uvedeno v dokumentaci pacienta. Léčba je hrazena pouze do progrese onemocnění.
33 Pro léčbu specifickénežádoucíúčinky Retence tekutiny/edémy Abiraterone + Prednisone (n = 791) Všechny stupně Grade 3 Grade 4 Všechny stupně Placebo + Prednisone (n = 394) Grade 3 Grade 4 33% 2% <1% 24% 1% 0 Hypokalemie 18% 4% <1% 9% <1% 0 Kardiální onemocnění Abnormální jaterní testy 16% 4% 1% 12% 2% <1% 11% 4% <1% 9% 3% <1% Hypertense 11% 1% 0 8% <1% 0 Fizazi et al. Lancet Oncol 2012; 13(10):
34 Monitoring léčby abirateronem Sérové transaminázy ALT, AST Před nasazením terapie První 3 měsíce každé 2 týdny Následně 1x měsíčně Sérové kálium (udržovat hladinu kália v séru 4 mmol/l) Krevní tlak Retence tekutin Všechny 1x měsíčně Pokud anamnéza KV onemocnění, monitoring SPC Zytiga
35 Pozastavení léčby abitaronem Jakákoliv toxicita 3. stupně Po ustoupenínú(stupeň1) je možno léčbu obnovit Zvýšení transamináz na 5-násobek normy Po normalizaci jaterních testůje možnéléčbu obnovit poloviční dávkou, tj. 500 mg/den Pokud se znovu objevíprojevy hepatotoxicity, léčbu trvale ukončit SPC Zytiga
36 Interakce abirateron Během léčby je nutno se vyvarovat podávání silných induktorůcyp3a4 (např. fenytoinu, karbamazepinu, rifampicinu, rifabutinu, rifapentinu, fenobarbitalu, třezalce tečkované [Hypericum perforatum]), V samostatnéklinickéstudii farmakokinetických interakcína zdravých dobrovolnících nemělo současnépodáváníketokonazolu, silného inhibitoru CYP3A4, klinicky významný účinek na farmakokinetiku abirateronu.
37 Interakce abirateron Opatrnost je nutnápři současném podávánís léčivými přípravky aktivovanými nebo metabolizovanými CYP2D6,abirateron je inhibitorem jaterních léky metabolizujících enzymů CYP2D6 a CYP2C8. Je nutno zvážit snížení dávek léčivých přípravků metabolizovaných CYP2D6 s úzkou terapeutickou šíří CYP2D6 jsou metoprolol, propranolol, desipramin, venlafaxin, haloperidol, risperidon, propafenon, flekainid, kodein, oxykodon a tramadol -potřebujícyp2d6 k vytvořenísvých účinných analgetických metabolitů.
38 Celkovépřežitív závislosti na doběpodání docetaxelu Fizazi et al. Lancet Oncol 2012; 13(10): (Supplementary Information)
39 Celkovépřežitív závislosti na době podání docetaxelu Nebyl pozorován trend prodlouženímediánuos u pacientůléčenýchdocetaxelem 3 měsíce ve studii abirateron + prednisone vs. placebo + prednisone Rozdíl není statistickysignifikantníprotože v této skupiněbyl malý počet léčených, ale v porovnánís celou skupinou byl výsledek konzistentní. U nemocných léčenýchdocetaxelem více jak3 měsícemedian OS byl delšíuabirateronu+ prednisone vs. placebo + prednisone Fizazi et al. Lancet Oncol 2012; 13(10):
40 Cítíi pacienti benefit léčby? COU-AA-301 : AA + prednisone umcrpc po předléčení docetaxelem: prodloužení celkového přežití,prodlouženípřežitíbez progrese onemocnění(pfs), prodlouženídoby do skeletal-related events, symptomů(bolest, únava) a zlepšení funkčního stavu COU-AA-302AA + prednisone u chemotherapie-naivních mcrpc: prodloužení rpfs, oddálenídoby podáníchemoterapie Basch et al. ESMO 2012; Abstract 8950 (Oral Presentation)
41 Vliv abitareonu na bolest Pain Interference COU-AA-302 Median doby do progrese pain interference 10.3 měsíce u AA + prednisone skupiny vs 7.4 měsíce v placebo + prednisone skupině (P = 0.005) Basch et al. ESMO 2012; Abstract 8950 (Oral Presentation)
42 Vliv abirateronu na bolest užívání opiátů COU-AA-302 Median doby do užití opiátů pro nádorovou bolest Nedosaženo ve AA + prednison skupině 23.7 měsíců v placebo + prednison skupině (P = ) Basch et al. ESMO 2012; Abstract 8950 (Oral Presentation)
43 Medián doby do změny funkčního stavu COU-AA-302 AA + P (měsíce) Placebo + P (měsíce) P Value Hazard Ratio (95% CI) FACT-G PCS < Fyzická pohoda Funkční pohoda Emoční pohoda Sociální/rodinná pohoda 0.76 ( ) 0.70 ( ) 0.76 ( ) 0.76 ( ) 0.71 ( ) 0.94 ( ) Basch et al. ESMO 2012; Abstract 8950 (Oral Presentation)
44 Bolest COU-AA-301 Abiraterone + prednisone zlepšení symptomů kostního postiženíumcrpc po-docetaxel vs. placebo + prednisone Abiraterone + prednisone: Signifikantnězmírňuje bolest Oddálení progrese bolesti Oddálení doby do SREs Logothetis et al. Lancet Oncol 2012: 2012; 13:
45 Kvalita života COU-AA-301 Abiateron + prednison u mcrpc podocetaxelu: (Fyzické+ funkční+ sociální): odpověď46% u abiraterone + prednisone vs 25% u placebo + prednisone arm (p<0.0001) Signifikantnívliv na zlepšeníúnavy Harland et al. Eur J Cancer 2013; 49(17):
46 Enzalutamidcílípřímo na androgenníreceptor a jeho efekt se v signální cestě projevuje ve třech krocích CYTOPLAZMA Testosteron DHEA Blokuje vazbu androgenů na AR 2. Brání translokaci AR do jádra AR Enzalutamide 3. Narušuje vazbu AR na DNA a předchází modulaci genové exprese Enzalutamide AR Enzalutamide JÁDRO AR=androgenní receptor; DHEA=dehydroepiandrosteron; DHT=dihydrotestosteron
47 Enzalutamid indikace k Pre chemo léčbě mcrpc, asymptomatičtí nebo mírně symptomatičtí po selháníadt a u nichždosud nebyla CHT klinicky indikována léčbě mcrpc, pokud došlo k progresi při nebo po léčbě docetaxelem Úhrada léčby enzalutamidu postchemo mcrpc Stav výkonnosti 0-2 dle ECOG Přítomnost kostních a/nebo v měkkých tkáních a/nebo viscerálních metastáz Dříve léčených docetaxelem, u kterých došlo k progresi onemocnění. Léčba je hrazena do progrese (rtg. progrese nebo výskytu nepříznivé skeletální příhody). 47
48 Pre -chemo indikace
49 PREVAILpre chemo: Studie fáze III u pacientůs mcrpc po selhání ADT Populace pacientů: 1717 mužů s progredujícím mcrpc Asymptomatičtí/ mírně symptomatičtí Bez předchozí chemoterapeutické léčby Kortikosteroidy povoleny ale nevyžadovány R A N D O M I Z A C E 1:1 Enzalutamid 160 mg/den (kapsle) n=872 Placebo n=845 Co- primární cíle: OS celkové přežití rpfs doba do radiologické progrese
50 PREVAIL pre chemo: Benefit OS napříčvšemi podskupinami Podskupiny Počet pacientů enzalutamid / placebo Hazard ratio pro OS (95% CI) Všichni pacienti 872 / ( ) ECOG performance status = / ( ) ECOG performance status = / ( ) Věk < / ( ) Věk / ( ) Geografický region Severní Amerika 218 / ( ) Geografický region Evropa 465 / ( ) Geografický region Zbytek světa 189 / ( ) Viscerální onemocnění(plíce a/nebo játra) ano Viscerální onemocnění(plíce a/nebo játra) ne 98 / ( ) 774 / ( ) Favorizuje enzalutamid Favorizuje placebo
51 PREVAIL pre chemo: Bezpečnost Enzalutamid (n=871) Placebo (n=844) Délka trvání léčby, medián, měsíce Nežádoucí účinky 96.9% 93.2% Závažné nežádoucí účinky 32.0% 26.8% Nežádoucí účinky stupně % 37.1% Doba do prvního NÚstupně 3, medián, měsíce Přerušení léčby pro nežádoucí účinky 5.6% 6.0% Nežádoucí účinky vedoucí k úmrtní 4.2% 3.8%
52 Post -chemo indikace
53 AFFIRM post chemo: Design studie AFFIRM je dvojitě slepá, placebem kontrolovaná studie fáze III Nábor pacientů ve 156 centrech v 15 zemích (09/ /2010) 1199 pacientůs progredujícím mcrpc 1 2předchozílinie chemoterapie( 1 docetaxel) R A N D O M I Z A C E 2:1 Enzalutamid 160 mg denně n=800 Placebo n=399 Primární cíl: Overall survival (celkové přežití) Design studie AFFIRM zahrnuje doporučenípcwg2 (Prostate Cancer Clinical Trials Working Group 2) Exkluzníkritéria: závažnédalšíonemocnění, infekce či komorbidita, mozkovémetastázy, maligníonemocněnív posledních 5 ti letech, léčba antagonisty androgenního receptoru, inhibitory 5alfa reduktázy, estrogeny nebo chemoterapeuticky během 4 týdnůpřed zařazením do studie. Kortikosteroidy nebyly požadovány, ale byly povoleny. Scher HI, et al. N Eng J Med 2012;367: (Protocol). 5 3
54 AFFIRM post chemo: Post-hoc analýza u LTE pacientů Pacienti s dlouhodobou léčebnou odpovědína enzalutamid majívětšíos benefit ve srovnání s celou populací léčenou enzalutamidem LTE pacienti jsou ti, kteří setrvali na léčbě 12 měsíců OS (%) Placebo: 13.6 months (95% CI: ) Enzalutamide LTE: NYR (95% CI: NYR NYR) Enzalutamide all-enzalutamide: 18.4 months (95% CI: 17.3 NYR) Months PBO ENZA (All Patients) ENZA (LTE)
55 AFFIRM post chemo: Post-hoc analýza u LTE pacientů Pacienti LTE měli méně pokročilé onemocnění při vstupu do studie ve srovnání s celou populací léčenou enzalutamidem Vstupní charakteristika Enzalutamid LTE (n=276) Enzalutamid všichni nemocní (n=800) Placebo (n=399) Median (rozmezí) věk, roky 71 ( ) 69 ( ) 69 ( ) 75 let, % Median trvání od diagnózy, měsíce Vstupní stupeň únavy = 0 or 1, %* Median Gleason score ECOG performance status 2, % BPI otázka 3 score 4, % Median PSA, ng/ml Median hemoglobin, g/l Median alkalická fosfatáza, U/L Median LDH, U/L Jaterní metastázy ve screeningu, % Plicní metastázy ve screeningu% >20kostních metastáz ve screeningu, %
56 AFFIRM post chemo: nežádoucíúčinky Výskyt nežádoucích účinkůbyl srovnatelný v obou skupinách navzdory tomu, že reportovacíobdobípro enzalutamid bylo více než2x delšínežu placeba (medián 8.3 měsíců vs. 3.0 měsíců) ZávažnéNÚa NÚstupně 3 byly méněčastéu enzalutamidu ve srovnánís placebem (34% vs. 39% and 45% vs. 53%). 5 6
57 AFFIRM post chemo: bezpečnost Během studie byla pečlivěmonitorována neurotoxicita, hepatotoxicita a kardiotoxicita Léčba enzalutamidem nebyla spojena s jaterní nebo kardiální toxicitou 5 7
58 AFFIRM: nejčastější AE při léčbě enzalutamidem* AEs, n (%) Všechny příhody (všechny stupně) Enzalutamid (n=800) Placebo (n=399) Enzalutamid (n=800) Stupeň 3 Placebo (n=399) Únava 269 (34) 116 (29) 50 (6) 29 (7) Průjem 171 (21) 70 (18) 9 (1) 1 (<1) Hot flush 162 (20) 41 (10) 0 0 Musculoskeletální bolest 109 (14) 40 (10) 8 (1) 1 (<1) Bolest hlavy 93 (12) 22 (6) 6 (<1) 0 Jsou v této kategorii zahrnuty nežádoucíúčinky, kterése vyskytly u> 10% pacientůve skupině senzalutamidema pokud se ve skupiněs enzalutamidem vyskytli tak v míře, kterábyla alespoňo 2% vyššínežve skupiněs placebem AE=nežádoucí účinek 58 Scher HI, et al. N Engl J Med 2012;367:
59 Staršípacientipost-hoc analýza: Enzalutamid signifikantněprodlužuje OS ve srovnánís placebem jak u mladších tak u starších nemocných Ve skupině mladších <75 let a starších 75 let enzalutamid signifikantně prodlužuje OS ve srovnání s placebem 100 OS (%) Enzalutamid <75 let Enzalutamid 75 let Placebo <75 let Placebo 75 let Placebo 75 let: 13.3 měsíců (95% CI: ) Placebo <75 let: 13.6 měsíců (95% CI: ) Měsíce Enzalutamid 75 let: 18.2 měsíců (95% CI: 15.4 NYR) Enzalutamid <75 let: NYR (95% CI: 17.3 NYR) CI=confidence interval; NYR=nedosaženo; OS=celkové přežití. Sternberg CN, et al. Presented at ASCO-GU 2013; Poster presentation
60 Cítíi pacienti benefit léčby? Affirm: enzaultamid u mcrpc po předléčení docetaxelem: prodlouženícelkového přežití,prodlouženípřežitíbez progrese onemocnění(pfs), prodlouženídoby do skeletal-related events, symptomů(bolest, únava) a zlepšení funkčního stavu Prevail enzalutamid u chemotherapienaivních mcrpc: prodloužení rpfs, oddálení doby podáníchemoterapie Basch et al. ESMO 2012; Abstract 8950 (Oral Presentation)
61 PREVAIL pre chemo: rpfs enzalutamid redukuje riziko radiograficképrogrese nebo úmrtío 81% 100 HR=0.186 (95% CI: ); p< rpfs (%) Enzalutamide 20 Placebo měsíce Enzalutamide, n Placebo, n
62 AFFIRM:post chemo:doba do progrese bolesti byla signifikantně delší pro enzalutamid než pro placebo(fact-p) Bez zhoršení bolesti (%) HR=0.564 (95% CI: ); p= % redukce rizika zhoršení bolesti Placebo: 13.8 měsíců (95% CI: 13.8 NYR) Enzalutamid: NYR (95% CI: NYR, NYR) Měsíce Enzalutamid, n Placebo, n
63 AFFIRMpost chemo: Signifikantněvíce pacientůna enzalutamidu mázkušenost se zlepšením kvality života ve srovnání s pacienty na placebu Enzalutamid (n=800) Placebo (n=399) Pacienti hodnotící při zařazení a po zařazení FACT-P, n (%) 651 (81) 257 (64) Odpověď v kvalitě života* (%) Rozdíl v odpovědi(%) 25 p value p<
64 Léčebnáodpověďdle HRQoLAFFIRM Signifikantněvíce pacientůléčených enzalutamidem po chemoterapii docetaxelem zaznamenalo zlepšení v HRQoL ve srovnání s placebem (43% vs. 18%; p<0.001)* Enzalutamid (n=651) Placebo (n=257) p<0.001 ^ p=0.006 ^ 6 4
65 Dávkování Doporučenádávka je 160 mg enzalutamidu 4x 40 mg tobolky, jako jedna denní perorální dávka. Nenínutný prednison Užitía efekt preparátu neníspojen s jídlem 65
66 Výhody tabletovéformy léčby Tabletováforma preference tzv. běžného životního stylu komfort a pohodlí domácího prostředí zkrácený pobyt v nemocnici sníženíanxiozity nemocných starších 65 let z cizího prostředí chybíkonfrontace s úzkostía potížemi jiných pacientů neztrácejí intimitu a soukromí 66
67 Kostnímetastázy u pokročilého karcinomu prostaty: Související důsledky SREsouvisís vyššímorbiditou 1,2, vyššími léčebnými náklady 3 a nižšíkvalitou života 4 Negativní dopad na přežití 1,2 Zhoršená pohyblivost a komprese míchy 2 Kostní příhody Zvýšené zdravotnické náklady 3 Snížená kvalita života 4. 67
68 Radium-223: Fyzikálnívlastnosti Standardizovaný přípravek ve skleněnéinjekčnílahvičce 1 Jednorázová skleněná injekční lahvička připravená ihned k použití obsahuje 6 ml roztoku 1 Čirý, bezbarvý, izotonický roztok s ph v rozmezí6,0 až8,0 Koncentrace radioaktivity: 1000 kbq/ml(27 µci/ml) 1 Detekovatelná řádně kalibrovaným měřičem aktivity Poločas rozpadu: 11,4 dne 1 Doba použitelnosti: 28 dní 1 Žádnéradioaktivníodpady s dlouhou životnostípo rozpadu látky 2 Režim dávkování 1 50 kbq/kg tělesné hmotnosti, podáváno v 6 injekcích ve 4týdenních intervalech Výpočet dávkování 1 Podávaný objem (ml) = tělesná hmotnost (kg) dávka (50 kbq/kg tělesné hmotnosti) korekční faktor rozpadu kbq/ml 1 68
69 Radium-223: Skupiny pacientů s omezením Bezpečnost a účinnost chemoterapie současněpodávanés radiem-223 nebyla stanovena. Chemoterapie současně podávaná s radiem-223 může přispívat k supresi kostní dřeně. Radium-223 nemusíbýt vhodnépro muže s akutním zánětlivým onemocněním střev Terapie radiem-223 by měla být odložena až po ortopedické stabilizaci jakýchkoliv zlomenin nebo po léčběkomprese míchy 69
70 Radium-223: Manipulace a způsob podání Manipulace Standardníbezpečnostnípostupy týkajícíseradiofarmak podle pokynůa nařízení země Způsob podání Rukavicea ochranný plášťpři manipulaci s krvía tělesnými tekutinami 1 Během podání nejsou vyžadovány žádné zvláštní ochranné prostředky V určeném ambulantním klinickém zařízení od oprávněných osob Vypočtený objem radia-223 se natáhne do injekční stříkačky Výpočet dávky se potvrdí řádně kalibrovaným měřičem aktivity Pomalá i.v. injekce trvající až 1 minutu Nepoužité radium-223 a materiál použitý při jeho přípravě nebo aplikaci by měly být zlikvidovány v souladu s místními předpisy pro radioaktivní odpad 1. 70
71 Radium-223: Pokyny pro pacienty Pacienti se mohou vrátit domůihned po injekci 1 Je třeba dbát zvýšenéopatrnosti při zacházenís materiály, kterépřicházejído kontaktu s tělesnými tekutinami, jako je např. ložníprádlo 2 V průběhu léčby a po dobu až6 následujících měsícůje třeba používat účinnéantikoncepčnímetody 2 Po aplikaci injekce je nutnépečlivědodržovat hygienu 2 Dbát zvýšené opatrnosti při manipulaci s materiály, které mohou přijít do styku s tělesnými tekutinami 1 71
72 ALSYMPCA: Bezpečnost a tolerabilita a Pacienti v analýze bezpečnosti obdrželi alespoň 1 dávku; 1 pacientovi ve skupině s placebem byla aplikována 1 injekce radia-223 (týden 0) a je zařazen do analýzy bezpečnosti radia-223. Parker C, et al. N Engl J Med. 2013;369:
73 ALSYMPCA: Zajímavénehematologické nežádoucípříhody Nejčastější nehematologické nežádoucí příhody související s léčbou (všech stupňů) Aktualizovaná analýza. Parker C, et al. N Engl J Med. 2013;369:
74 ALSYMPCA: Zajímavéhematologické nežádoucípříhody Nejčastější hematologické nežádoucí příhody související s léčbou (všech stupňů) Aktualizovaná analýza. Parker C, et al. N Engl J Med. 2013;369:
75 223 Radium -Současnásituace v ČR 223 Radium bylo registrováno v Evropěv listopadu 2013 (schválení EMA) 223 Radium je hrazeno z prostředkůveřejného zdravotního pojištěníod dubna 2014 (opatřeníobecnépovahy vydal SUKL ) Povolenípro podávání 223 Radia majív současnédobě Pracovištěnukleárnímedicíny (IKEM, VFN, Motol, Olomouc, Ostrava, Plzeň, Ústínad Labem, ČeskéBudějovice, Jihlava, FN Bohunice BRNO) Povolenípouze pro odbornost 407 nukleárnímedicína jako ZULP Maximálnípočet je 6 dávek
76 Kortikosteroidy (KS) a jejich možný podíl na progresi CRPC Ačkoliv mají glukokortikoidy nesporný pozitivní efekt u onkologicky nemocných, mohou se rovněž podílet na progresi onemocnění Úloha kortikosteroidů v léčbě karcinomu prostaty: Hormonálníléčba třetí linie mcrpc -suprimujítvorbu ACTH v hypofýze, čímžsnižujítvorbu androgenův nadledvinách Zlepšují kvalitu života, redukují bolest a únavu Redukují NÚ chemoterapie (docetaxel, cabazitaxel) a mineralokortikoidní toxicitu inhibitorů androgenní biosyntézy (ketokonazol, abirateron) Nevýhody KS: Léčba je spojena s nežádoucími účinky rizika spojenás léčbou zahrnují: diabetes/hyperglykémie, osteoporóza, přírůstek na váze, ztráta svalové hmoty, výskyt infekcí, edémy, katarakta atd.
77 Souběžná léčba kortikosteroidy post-hoc analýza: Enzalutamidprodloužil OS ve srovnánís placebem bez ohledu na souběžnou léčbu kortikoidy Bez kortikosteroidů HR: (95% CI: ), p< % redukce rizika úmrtí Enzalutamid: NYR 95% CI: NYR NYR S kortikosteroidy HR: (95% CI: ), p= % redukce rizika úmrtí OS (%) Placebo: 18.8 měsíců 95% CI: 15.5 NYR OS (%) Enzalutamid + CS: 12.8 měsíců 95% CI: Placebo + CS: 9.6 měsíců 95% CI: Měsíce Měsíce CI: confidence interval; HR=hazard ratio; CS=kortikosteroidy; NYR=nedosaženo, OS=celkové přežití Scher HI, et al. Presented at ASCO-GU 2013; Oral presentation
78 Pacientiléčeníkortikosteroidy měli více přidružených chorob a více pokročilé onemocnění Pacienti s kortikosteroidy ve studii Pacienti neléčení kortikosteroidy ve studii Enzalutamid (n=381, 48%*) Placebo (n=178, 45% ) Enzalutamid (n=419, 52%*) Placebo (n=221, 55% ) Vstupní charakteristika Věk Median, roky let,% Median Gleason score ECOG performance status = 2, % BPI 4 otázka 3, % Rozsah onemocnění Median PSA, ng/ml Median hemoglobin, g/l Median alkalické fosfatázy, U/L Median LDH, U/L pouze elevace PSA na vstupu, % metastázy jaterní ve screeningu, % metastázy plicní ve screeningu,% >20 kostních metastáz ve screeningu, % Median doby od stanovení dg., měsíce *% z celkového počtu léčených enzalutamidem; % z celkového počtu léčených placebem ECOG=Eastern Cooperative Oncology Group; LDH=lactát dehydrogenáza; PSA=prostatický-specifický antigen. Scher HI, et al. Presented at ASCO-GU 2013; Oral presentation
79 Kortikosteroidy??? Vliv terapie kortikoidy na efekt antiadrogenů v terapii mcrcp Nelze potvrdit ani subanalýzou studie COU-AA-301 s abirateronem + prednison vs placebo + prednison po docetaxelu Nejedná se o důležitý nezávislý prognostický faktor na celkové přežití Je spojen s horšívstupnícharakteristikou pacientů(horšíecog PSA, Gleason score, algický syndrom, LDH) Bez kortikoidů (vstup) S kortikoidy (vstup) AA+P n=537 P n=260 HR(95%CI) P value AA+P n=260 P n=138 HR(95%CI) P value Medián OS, měsíce ( ) ( ) n:počet nemocných, AA + P:abirateron+ prednison, P:placebo 79
80 Prodloužení přežití Novéléky v mcrcp Každý se svými nežádoucími účinky Dobrájejich předvídatelnost a možnosti terapie Zlepšení kvality života
Možnosti léčby CRPC s časem přibývají
 Možnosti léčby CRPC s časem přibývají Jana Katolická Onkologicko-chirurgické oddělení Fakultní nemocnice u Sv. Anny Mnoho studií - jen čtyři nové léky Enzalutamid Abirateron + prednison Cabazitaxel Radium-223
Možnosti léčby CRPC s časem přibývají Jana Katolická Onkologicko-chirurgické oddělení Fakultní nemocnice u Sv. Anny Mnoho studií - jen čtyři nové léky Enzalutamid Abirateron + prednison Cabazitaxel Radium-223
Nové možnosti. terapeutického ovlivnění pokročilého karcinomu prostaty. Mám nádor prostaty a co dál? Jana Katolická
 MEZINÁRODNÍ CENTRUM KLINICKÉHO VÝZKUMU Nové možnosti TVOŘÍME BUDOUCNOST MEDICÍNY terapeutického ovlivnění pokročilého karcinomu prostaty Jana Katolická Primář onkologicko-chirurgické oddělení Mám nádor
MEZINÁRODNÍ CENTRUM KLINICKÉHO VÝZKUMU Nové možnosti TVOŘÍME BUDOUCNOST MEDICÍNY terapeutického ovlivnění pokročilého karcinomu prostaty Jana Katolická Primář onkologicko-chirurgické oddělení Mám nádor
Možnosti léčby CRPC. Michaela Matoušková
 Možnosti léčby CRPC Michaela Matoušková Pokročilý karcinom prostaty prevalence CaP 65215 pokročilý CaP st. III 8492 st. IV 5884 14376 CRPC cca 900-1000 Zdroj dat www.uroweb.cz CRPC Kastrační hladina testosteronu
Možnosti léčby CRPC Michaela Matoušková Pokročilý karcinom prostaty prevalence CaP 65215 pokročilý CaP st. III 8492 st. IV 5884 14376 CRPC cca 900-1000 Zdroj dat www.uroweb.cz CRPC Kastrační hladina testosteronu
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
Nové možnosti v léčbě generalizovaného karcinomu prostaty. MUDr. Jaroslav Hájek Klinika onkologická, FN Ostrava
 Nové možnosti v léčbě generalizovaného karcinomu prostaty MUDr. Jaroslav Hájek Klinika onkologická, FN Ostrava 29.6.2017 Karcinom prostaty průběh onemocnění Docetaxel/chemoterapie Smrt Objem nádoru Lokální
Nové možnosti v léčbě generalizovaného karcinomu prostaty MUDr. Jaroslav Hájek Klinika onkologická, FN Ostrava 29.6.2017 Karcinom prostaty průběh onemocnění Docetaxel/chemoterapie Smrt Objem nádoru Lokální
Kazuistika ČUS. MUDr. PharmDr Jan Dvořák RTO klinika FNKV, 3. LF UK
 Kazuistika ČUS MUDr. PharmDr Jan Dvořák RTO klinika FNKV, 3. LF UK Pacient S.U. Dg. C61 v roce 2009, 56 let 8/2009 biopsie GLS 9 (4+5), PSA 8.22 μg/l 11/2009 RAPE, pt2c pn0(5 uzlin) M0, GS 7 (4+3), R0
Kazuistika ČUS MUDr. PharmDr Jan Dvořák RTO klinika FNKV, 3. LF UK Pacient S.U. Dg. C61 v roce 2009, 56 let 8/2009 biopsie GLS 9 (4+5), PSA 8.22 μg/l 11/2009 RAPE, pt2c pn0(5 uzlin) M0, GS 7 (4+3), R0
Co mě může potkat při návratu onemocnění. Nové přístupy biologická léčba karcinomu prostaty. MUDr. Hana Študentová, Ph.D.
 Co mě může potkat při návratu onemocnění. Nové přístupy biologická léčba karcinomu prostaty MUDr. Hana Študentová, Ph.D. Obsah Obecný úvod Androgenní signalizace Možnosti systémové léčby Závěr Koho se
Co mě může potkat při návratu onemocnění. Nové přístupy biologická léčba karcinomu prostaty MUDr. Hana Študentová, Ph.D. Obsah Obecný úvod Androgenní signalizace Možnosti systémové léčby Závěr Koho se
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU ZYTIGA 250 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje abirateroni acetas 250 mg Pomocné látky Jedna tableta obsahuje
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU ZYTIGA 250 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje abirateroni acetas 250 mg Pomocné látky Jedna tableta obsahuje
Stratifikace pacientů, prognostické faktory. Jana Katolická FN u svaté Anny, Brno
 Stratifikace pacientů, prognostické faktory Jana Katolická FN u svaté Anny, Brno mcrcp heterogenní onemocnění Absence validovaných biomarkerů pro identifikaci pacienta : Se špatnou prognózou Rezistentní
Stratifikace pacientů, prognostické faktory Jana Katolická FN u svaté Anny, Brno mcrcp heterogenní onemocnění Absence validovaných biomarkerů pro identifikaci pacienta : Se špatnou prognózou Rezistentní
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls137130/2011
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls137130/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TAXEGIS 20 mg koncentrát a rozpouštědlo pro přípravu infuzního roztoku TAXEGIS 80 mg koncentrát
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls137130/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TAXEGIS 20 mg koncentrát a rozpouštědlo pro přípravu infuzního roztoku TAXEGIS 80 mg koncentrát
ZYTIGA (ABIRATERONI ACETAS) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY
 NÁDORY PROSTATY 69 ZYTIGA (ABIRATERONI ACETAS) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY Oravcová I. Úvod Zytiga, jejíž účinnou látkou je abirateron acetát, byla registrována v
NÁDORY PROSTATY 69 ZYTIGA (ABIRATERONI ACETAS) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY Oravcová I. Úvod Zytiga, jejíž účinnou látkou je abirateron acetát, byla registrována v
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Docetaxel Accord 20 mg/1 ml koncentrát pro přípravu infúzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml koncentrátu obsahuje 20 mg
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Docetaxel Accord 20 mg/1 ml koncentrát pro přípravu infúzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml koncentrátu obsahuje 20 mg
XOFIGO (RADIUM-223 DICHLORID) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY
 NÁDORY PROSTATY 63 XOFIGO (RADIUM-223 DICHLORID) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY Kolektiv autorů Úvod Léčivý přípravek (radium-223 dichlorid) byl 13. listopadu 2013 schválen
NÁDORY PROSTATY 63 XOFIGO (RADIUM-223 DICHLORID) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY Kolektiv autorů Úvod Léčivý přípravek (radium-223 dichlorid) byl 13. listopadu 2013 schválen
Současné možnosti léčby mcrpc. Michaela Matoušková Urocentrum Praha
 Současné možnosti léčby mcrpc Michaela Matoušková Urocentrum Praha Pokročilý karcinom prostaty prevalence CaP 54505 pokročilý CaP st. III 6744 st. IV 5521 12265 CRPC cca 900-1000 Zdroj dat www.uroweb.cz
Současné možnosti léčby mcrpc Michaela Matoušková Urocentrum Praha Pokročilý karcinom prostaty prevalence CaP 54505 pokročilý CaP st. III 6744 st. IV 5521 12265 CRPC cca 900-1000 Zdroj dat www.uroweb.cz
Možnosti léčby kastračně rezistentního metastatického karcinomu prostaty
 Možnosti léčby kastračně rezistentního metastatického karcinomu prostaty Iveta Kolářová Oddělení klinické a radiační onkologie Pardubice Multiscan s.r.o. Pardubická krajská nemocnice, a.s. Pardubice 19.9.2012
Možnosti léčby kastračně rezistentního metastatického karcinomu prostaty Iveta Kolářová Oddělení klinické a radiační onkologie Pardubice Multiscan s.r.o. Pardubická krajská nemocnice, a.s. Pardubice 19.9.2012
19. ZHOUBNÝ NOVOTVAR PROSTATY (C61)
 19. ZHOUBNÝ NOVOTVAR PROSTATY (C61) 19.1 Léčba lokalizovaného a lokálně pokročilého karcinomu prostaty (ct1-3 N0 M0) 19.1.1 Léčba nízce rizikového (ct1-2a a GS 6 a PSA < 10 μg/l) a středně rizikového (ct2b-c
19. ZHOUBNÝ NOVOTVAR PROSTATY (C61) 19.1 Léčba lokalizovaného a lokálně pokročilého karcinomu prostaty (ct1-3 N0 M0) 19.1.1 Léčba nízce rizikového (ct1-2a a GS 6 a PSA < 10 μg/l) a středně rizikového (ct2b-c
Nová diagnóza = Studiová indikace. První relaps = Studiová indikace
 Velcade dostupné léčebné protokoly Nová diagnóza = Studiová indikace První relaps = Studiová indikace C M G Velcade dostupné léčebné protokoly Nová diagnóza = Studiová indikace První relaps = Studiová
Velcade dostupné léčebné protokoly Nová diagnóza = Studiová indikace První relaps = Studiová indikace C M G Velcade dostupné léčebné protokoly Nová diagnóza = Studiová indikace První relaps = Studiová
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
sp.zn.sukls103802/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU ANDROCUR DEPOT 300 mg, injekční roztok
 sp.zn.sukls103802/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU ANDROCUR DEPOT 300 mg, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule o obsahu 3 ml obsahuje cyproteroni acetas
sp.zn.sukls103802/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU ANDROCUR DEPOT 300 mg, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule o obsahu 3 ml obsahuje cyproteroni acetas
Potahovaná tableta. Nachové oválné potahované tablety (20 mm dlouhé x 10 mm široké) s vyraženým AA na jedné straně a 500 na druhé straně.
 1. NÁZEV PŘÍPRAVKU ZYTIGA 500 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje abirateroni acetas 500 mg. Pomocné látky se známým účinkem Jedna potahovaná
1. NÁZEV PŘÍPRAVKU ZYTIGA 500 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje abirateroni acetas 500 mg. Pomocné látky se známým účinkem Jedna potahovaná
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls 212259/2010, sukls212261/2010 a příloha k sp. zn. sukls170374/2010
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls 212259/2010, sukls212261/2010 a příloha k sp. zn. sukls170374/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ondansetron Arrow 4 mg Ondansetron
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls 212259/2010, sukls212261/2010 a příloha k sp. zn. sukls170374/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ondansetron Arrow 4 mg Ondansetron
Hormonální léčba metastatického karcinomu prostaty. Marko Babjuk. FN Motol a 2 LFUK, Praha
 Hormonální léčba metastatického karcinomu prostaty Marko Babjuk FN Motol a 2 LFUK, Praha Hormonální osa DHT a AR Testosterone 5a-R AR s DHT ligandem (Dimery) DHT Hsp 70 RA (Inaktivní) Hsp 90 Androgen Response
Hormonální léčba metastatického karcinomu prostaty Marko Babjuk FN Motol a 2 LFUK, Praha Hormonální osa DHT a AR Testosterone 5a-R AR s DHT ligandem (Dimery) DHT Hsp 70 RA (Inaktivní) Hsp 90 Androgen Response
Dosavadní zkušenosti s léčbou lenalidomidem v České republice
 Dosavadní zkušenosti s léčbou lenalidomidem v České republice Luděk Pour Ščudla V., Maisnar V., Gregora E., Schützová M., Špička I., Holánek M., Bačovský J., Straub J., Adam Z., Hájek R. Společná analýza
Dosavadní zkušenosti s léčbou lenalidomidem v České republice Luděk Pour Ščudla V., Maisnar V., Gregora E., Schützová M., Špička I., Holánek M., Bačovský J., Straub J., Adam Z., Hájek R. Společná analýza
Tableta s prodlouženým uvolňováním. Popis přípravku : bílé, kulaté, nepotahované tablety se zkosenými hranami.
 Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls37077/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls37077/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Bevacizumab u starších pacientů s kolorektálním karcinomem
 Bevacizumab u starších pacientů s kolorektálním karcinomem MUDr. Tomáš Büchler, PhD. Onkologické oddělení Fakultní Thomayerovy nemocnice a Onkologická klinika 1. lékařské fakulty UK a VFN, Praha XIV. Staškovy
Bevacizumab u starších pacientů s kolorektálním karcinomem MUDr. Tomáš Büchler, PhD. Onkologické oddělení Fakultní Thomayerovy nemocnice a Onkologická klinika 1. lékařské fakulty UK a VFN, Praha XIV. Staškovy
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls118033/2010
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls118033/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cardioxane prášek pro přípravu infuzního roztoku. 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls118033/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cardioxane prášek pro přípravu infuzního roztoku. 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls211402/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje alfuzosini hydrochloridum10
sp. zn. sukls211402/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje alfuzosini hydrochloridum10
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Urorec 4 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje silodosinum 4 mg. Úplný seznam pomocných látek viz
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Urorec 4 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje silodosinum 4 mg. Úplný seznam pomocných látek viz
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU. Přípavek již není registrován
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Docetaxel Mylan 20 mg/ 1 ml koncentrát pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml koncentrátu obsahuje docetaxelum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Docetaxel Mylan 20 mg/ 1 ml koncentrát pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml koncentrátu obsahuje docetaxelum
Rozdíly mezi novými a klasickými léky u mnohočetného myelomu Luděk Pour IHOK FN Brno
 C Z E C H G R O U P CZECH GROUP 1 Rozdíly mezi novými a klasickými léky u mnohočetného myelomu Luděk Pour IHOK FN Brno C M G M Y E L O M A Č E S K Á M YE LO M O VÁ S K U P IN A Setkání klubu pacientů 11.5.2016
C Z E C H G R O U P CZECH GROUP 1 Rozdíly mezi novými a klasickými léky u mnohočetného myelomu Luděk Pour IHOK FN Brno C M G M Y E L O M A Č E S K Á M YE LO M O VÁ S K U P IN A Setkání klubu pacientů 11.5.2016
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Docetaxel Hospira UK Limited 20 mg/1 ml koncentrát pro infuzní roztok Docetaxel Hospira UK Limited 80 mg/4 ml koncentrát pro infuzní roztok Docetaxel
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Docetaxel Hospira UK Limited 20 mg/1 ml koncentrát pro infuzní roztok Docetaxel Hospira UK Limited 80 mg/4 ml koncentrát pro infuzní roztok Docetaxel
! "#$%&'(#)*+,)-!./01'!&'2*3'0)4! 3#2%2*#)*)-56!&'37%)6(8!9362*'*:!!
 ! "#$%&'(#)*+,)-!./01'!&'2*3'0)4! 3#2%2*#)*)-56!&'37%)6(8!9362*'*:!! ;36
! "#$%&'(#)*+,)-!./01'!&'2*3'0)4! 3#2%2*#)*)-56!&'37%)6(8!9362*'*:!! ;36
Praxbind doporučení pro podávání (SPC)
 Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aerius 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aerius 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
Hormonální léčba metastatického karcinomu prostaty. Marko Babjuk. FN Motol a 2 LFUK, Praha
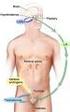 Hormonální léčba metastatického karcinomu prostaty Marko Babjuk FN Motol a 2 LFUK, Praha Hormonální osa Androgenní suprese potlačuje růst prostatických buněk. Efektu lze dosáhnout chirurgickou kastrací
Hormonální léčba metastatického karcinomu prostaty Marko Babjuk FN Motol a 2 LFUK, Praha Hormonální osa Androgenní suprese potlačuje růst prostatických buněk. Efektu lze dosáhnout chirurgickou kastrací
Děti a mladiství Pro podávání přípravku Urorec u dětí a mladistvých neexistuje žádná relevantní indikace.
 1. NÁZEV PŘÍPRAVKU Urorec 4 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje 4 mg silodosinum. Úplný seznam pomocných látek viz bod 6.1. 3. LÉKOVÁ FORMA Tvrdá tobolka.
1. NÁZEV PŘÍPRAVKU Urorec 4 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje 4 mg silodosinum. Úplný seznam pomocných látek viz bod 6.1. 3. LÉKOVÁ FORMA Tvrdá tobolka.
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 1. NÁZEV PŘÍPRAVKU Ramonna 1500 mikrogramů, tableta
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ramonna 1500 mikrogramů, tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje levonorgestrelum1500 mikrogramů. Pomocné látky se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ramonna 1500 mikrogramů, tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje levonorgestrelum1500 mikrogramů. Pomocné látky se známým účinkem:
Celkové shrnutí vědeckého hodnocení přípravku Kytril a souvisejících názvů (viz příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÉ INFORMACE PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 11 Vědecké závěry Celkové
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÉ INFORMACE PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 11 Vědecké závěry Celkové
Doporučení pro dávkování a způsob podávání přípravku Tasigna
 Klinické studie a přípravek Tasigna Ukázalo se, že přípravek Tasigna u některých pacientů prodlužuje QT interval. V klinické studii fáze II u pacientů s CML s přítomností Ph chromozomu v chronické či akcelerované
Klinické studie a přípravek Tasigna Ukázalo se, že přípravek Tasigna u některých pacientů prodlužuje QT interval. V klinické studii fáze II u pacientů s CML s přítomností Ph chromozomu v chronické či akcelerované
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Léčba lokalizovaného a lokálně pokročilého karcinomu prostaty (ct1-3 N0 M0)
 4.3. ZHOUBNÝ NOVOTVAR PROSTATY Léčba lokalizovaného a lokálně pokročilého karcinomu prostaty (ct1-3 N0 M0) Léčba nízce rizikového (ct1-2a a GS 6 a PSA < 10 μg/l) a středně rizikového (ct2b-c a/nebo GS
4.3. ZHOUBNÝ NOVOTVAR PROSTATY Léčba lokalizovaného a lokálně pokročilého karcinomu prostaty (ct1-3 N0 M0) Léčba nízce rizikového (ct1-2a a GS 6 a PSA < 10 μg/l) a středně rizikového (ct2b-c a/nebo GS
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg.
 1 NÁZEV PŘÍPRAVKU Neoclarityn 2,5 mg tablety dispergovatelné v ústech 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5
1 NÁZEV PŘÍPRAVKU Neoclarityn 2,5 mg tablety dispergovatelné v ústech 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jeden ml koncentrátu obsahuje docetaxelum 20 mg (jako docetaxelum trihydricum).
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Taxespira 20 mg/1 ml koncentrát pro infuzní roztok Taxespira 80 mg/4 ml koncentrát pro infuzní roztok Taxespira 120 mg/6 ml koncentrát pro infuzní roztok Taxespira
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Taxespira 20 mg/1 ml koncentrát pro infuzní roztok Taxespira 80 mg/4 ml koncentrát pro infuzní roztok Taxespira 120 mg/6 ml koncentrát pro infuzní roztok Taxespira
Doporučené postupy pro hormonální léčbu karcinomu prostaty 2012
 Závěr expertní komise ve složení: Babjuk M, Hora M, Katolická J, Kubecová M, Matoušková M, Melichar B, Petera J, Soumarová R, Študent V Podmínkou pro nasazení hormonální terapie je histologicky verifikovaný
Závěr expertní komise ve složení: Babjuk M, Hora M, Katolická J, Kubecová M, Matoušková M, Melichar B, Petera J, Soumarová R, Študent V Podmínkou pro nasazení hormonální terapie je histologicky verifikovaný
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jeden ml koncentrátu pro infuzní roztok obsahuje docetaxelum 20 mg.
 Sp.zn. sukls114278/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Tolnexa 20 mg/ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml koncentrátu pro infuzní roztok obsahuje
Sp.zn. sukls114278/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Tolnexa 20 mg/ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml koncentrátu pro infuzní roztok obsahuje
Bezpečnost a účinnost přípravku Neoclarityn 5 mg potahované tablety u dětí mladších 12 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
 1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
Desloratadin STADA 5 mg jsou modré, kulaté, bikonvexní potahované tablety o průměru přibližně 6,5 mm.
 Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
: Medikamentózní léčba kastračně rezistentního karcinomu. Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1. LF UK a TN KOC ( NNB+VFN+TN )
 : Medikamentózní léčba kastračně rezistentního karcinomu Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1. LF UK a TN KOC ( NNB+VFN+TN ) Vývoj standardizované incidence a úmrtnosv ( na 100 000
: Medikamentózní léčba kastračně rezistentního karcinomu Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1. LF UK a TN KOC ( NNB+VFN+TN ) Vývoj standardizované incidence a úmrtnosv ( na 100 000
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tvrdá tobolka obsahuje dutasteridum 0,5 mg a tamsulosini hydrochloridum 0,4 mg (což odpovídá tamsulosinum 0,367 mg).
 sp. zn. sukls257577/2012 a k sp. zn. sukls167111/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Duodart 0,5 mg/0,4 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje
sp. zn. sukls257577/2012 a k sp. zn. sukls167111/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Duodart 0,5 mg/0,4 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje
2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje 15 mg nebo 30 mg nebo 45 mg mirtazapinum. Pomocné látky viz bod 6.1.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mirtawin 15 mg Mirtawin 30 mg Mirtawin 45 mg 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje 15 mg nebo 30 mg nebo 45 mg mirtazapinum.
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mirtawin 15 mg Mirtawin 30 mg Mirtawin 45 mg 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje 15 mg nebo 30 mg nebo 45 mg mirtazapinum.
9. ZHOUBNÝ NOVOTVAR OVARIÍ A TUBY (C56-57)
 9. ZHOUBNÝ NOVOTVAR OVARIÍ A TUBY (C56-57) 9.1 Epiteliální 9.1.1 Chemoterapie jako součást primární léčby Po chirurgické léčbě epiteliálních ovariálních ZN nutno považovat primární chemoterapii za kurativní.
9. ZHOUBNÝ NOVOTVAR OVARIÍ A TUBY (C56-57) 9.1 Epiteliální 9.1.1 Chemoterapie jako součást primární léčby Po chirurgické léčbě epiteliálních ovariálních ZN nutno považovat primární chemoterapii za kurativní.
Registr Herceptin Karcinom prsu
 I. Primární diagnostika Registr Herceptin Karcinom prsu Vstupní parametry Rok narození Věk Kód zdravotní pojišťovny (výběr) o 111 o 201 o 205 o 207 o 209 o 211 o 213 o 217 o 222 Datum stanovení diagnózy
I. Primární diagnostika Registr Herceptin Karcinom prsu Vstupní parametry Rok narození Věk Kód zdravotní pojišťovny (výběr) o 111 o 201 o 205 o 207 o 209 o 211 o 213 o 217 o 222 Datum stanovení diagnózy
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls69108/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Docetaxel Teva 20 mg/ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje docetaxelum
Sp.zn. sukls69108/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Docetaxel Teva 20 mg/ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje docetaxelum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Topotecan Eagle 3 mg/1 ml koncentrát pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu pro přípravu infuzního
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Topotecan Eagle 3 mg/1 ml koncentrát pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu pro přípravu infuzního
Nové léčebné možnosti v léčbě mnohočetného myelomu GROUP. Roman Hájek 3.9.2005. Lednice
 Nové léčebné možnosti v léčbě mnohočetného myelomu CZECH CMG M Y E L O M A GROUP ČESKÁ MYELOMOVÁ SKUPINA ČESKÁ MYELOMOVÁ SKUPINA CZECH CMG M Y E L O M A NADAČNÍ FOND GROUP Roman Hájek 3.9.2005 Lednice
Nové léčebné možnosti v léčbě mnohočetného myelomu CZECH CMG M Y E L O M A GROUP ČESKÁ MYELOMOVÁ SKUPINA ČESKÁ MYELOMOVÁ SKUPINA CZECH CMG M Y E L O M A NADAČNÍ FOND GROUP Roman Hájek 3.9.2005 Lednice
Velcade První výsledky z IHOK FN Brno. Luděk Pour. Roman Hájek, Marta Krejčí,Andrea Křivanová, Lenka Zahradová, Zdeněk Adam CMG
 Velcade První výsledky z IHOK FN Brno Luděk Pour Roman Hájek, Marta Krejčí,Andrea Křivanová, Lenka Zahradová, Zdeněk Adam CZECH CMG M Y E L O M A GROUP Č ESKÁ MYELOMOVÁ SKUPINA Velcade = bortezomib Nobelova
Velcade První výsledky z IHOK FN Brno Luděk Pour Roman Hájek, Marta Krejčí,Andrea Křivanová, Lenka Zahradová, Zdeněk Adam CZECH CMG M Y E L O M A GROUP Č ESKÁ MYELOMOVÁ SKUPINA Velcade = bortezomib Nobelova
Jedna tableta s prodlouženým uvolňováním obsahuje 0,4 mg tamsulosini hydrochloridum, což odpovídá 0,367 mg tamsulosinum.
 sp.zn.sukls48957/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Tamsulosin HCl Teva 0,4 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním
sp.zn.sukls48957/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Tamsulosin HCl Teva 0,4 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním
CZ PAR QUETIAPINUM. Seroquel. UK/W/0004/pdWS/001. NL/W/0004/pdWS/001
 CZ PAR Název (léčivá látka/ přípravek) Číslo procedury QUETIAPINUM Seroquel UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZVY PŘÍPRAVKŮ KLINICKÝCH STUDIÍ INN DRŽITELÉ PŘÍPRAVKŮ KLINICKÝCH STUDIÍ SCHVÁLENÉ
CZ PAR Název (léčivá látka/ přípravek) Číslo procedury QUETIAPINUM Seroquel UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZVY PŘÍPRAVKŮ KLINICKÝCH STUDIÍ INN DRŽITELÉ PŘÍPRAVKŮ KLINICKÝCH STUDIÍ SCHVÁLENÉ
PARALEN 500 tablety. Doporučené dávkování paracetamolu; VĚK HMOTNOST Jednotlivá dávka Max. denní dávka 21-25 kg
 Příloha č. 2 k opravě sdělení sp.zn. sukls226519/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg.
Příloha č. 2 k opravě sdělení sp.zn. sukls226519/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg.
Pomocná látka se známým účinkem: Jedna tableta obsahuje 75 mg monohydrátu laktosy. Úplný seznam pomocných látek viz bod 6.1.
 sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
Příbalová informace informace pro uživatele. Irinotecan Medico Uno 20 mg/ml koncentrát pro přípravu infuzního roztoku
 Příloha č.2 k rozhodnutí o registraci sp.zn. sukls49585/2008 Příbalová informace informace pro uživatele Irinotecan Medico Uno 20 mg/ml koncentrát pro přípravu infuzního roztoku Irinotecani hydrochloridum
Příloha č.2 k rozhodnutí o registraci sp.zn. sukls49585/2008 Příbalová informace informace pro uživatele Irinotecan Medico Uno 20 mg/ml koncentrát pro přípravu infuzního roztoku Irinotecani hydrochloridum
Světle červené, ploché, kulaté, skvrnité tablety, na jedné straně označené písmenem K.
 1. NÁZEV PŘÍPRAVKU Aerius 2,5 mg tablety dispergovatelné v ústech 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg. Pomocné látky se známým
1. NÁZEV PŘÍPRAVKU Aerius 2,5 mg tablety dispergovatelné v ústech 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg. Pomocné látky se známým
Lékový registr ALIMTA
 Lékový registr Pravidelný report Maligní pleurální mezoteliom (MPM) Stav registru k datu 31. 3. 2014 Pneumoonkologická centra zapojená v projektu Alimta 1. FN Brno Jihlavská 20, 625 00 Brno - Bohunice
Lékový registr Pravidelný report Maligní pleurální mezoteliom (MPM) Stav registru k datu 31. 3. 2014 Pneumoonkologická centra zapojená v projektu Alimta 1. FN Brno Jihlavská 20, 625 00 Brno - Bohunice
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU TAXOTERE 20 mg/0,5 ml koncentrát a rozpouštědlo pro infúzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna jednodávková injekční lahvička TAXOTERE
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU TAXOTERE 20 mg/0,5 ml koncentrát a rozpouštědlo pro infúzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna jednodávková injekční lahvička TAXOTERE
Přehled změn vybraných kapitol
 Přehled změn vybraných kapitol (aneb najdi 10 rozdílů.) změny guidelines 2012 Nové léčebné odpovědi Bendamustin Profylaxe infekčních komplikací Profylaxe TEN Léčba pacientů s renální insuficiencí Léčba
Přehled změn vybraných kapitol (aneb najdi 10 rozdílů.) změny guidelines 2012 Nové léčebné odpovědi Bendamustin Profylaxe infekčních komplikací Profylaxe TEN Léčba pacientů s renální insuficiencí Léčba
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Každá jednodávková injekční lahvička obsahuje docetaxelum 20 mg/ml
 Sp.zn. sukls254406/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Docetaxel Actavis 20 mg/ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá jednodávková injekční lahvička
Sp.zn. sukls254406/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Docetaxel Actavis 20 mg/ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá jednodávková injekční lahvička
SYSTÉMOVÁ LÉČBA NÁDORŮ MOČOVÉHO MĚCHÝŘE
 SYSTÉMOVÁ LÉČBA NÁDORŮ MOČOVÉHO MĚCHÝŘE Jana Katolická FN u svaté Anny, Brno CZ/ONCO/617/0088 1 UROTELIÁLNÍ KARCINOM MOČOVÉHO MĚCHÝŘE CHEMOSENZITIVNÍ ONEMOCNĚNÍ. V době stanovení diagnózy je 15 % lokálně
SYSTÉMOVÁ LÉČBA NÁDORŮ MOČOVÉHO MĚCHÝŘE Jana Katolická FN u svaté Anny, Brno CZ/ONCO/617/0088 1 UROTELIÁLNÍ KARCINOM MOČOVÉHO MĚCHÝŘE CHEMOSENZITIVNÍ ONEMOCNĚNÍ. V době stanovení diagnózy je 15 % lokálně
Nežádoucí účinky nových léků
 Nežádoucí účinky nových léků MUDr. Jan Straub XII. Myeloma workshop Mikulov 12.4. 2014 Nežádoucí účinky nových léků thalidomid bortezomib lenalidomid Obecné shrnutí + výsledky registračních studií Srovnání
Nežádoucí účinky nových léků MUDr. Jan Straub XII. Myeloma workshop Mikulov 12.4. 2014 Nežádoucí účinky nových léků thalidomid bortezomib lenalidomid Obecné shrnutí + výsledky registračních studií Srovnání
Lékový registr ALIMTA
 Lékový registr Pravidelný report Maligní pleurální mezoteliom (MPM) Stav registru k datu 19. 10. 2015 Pneumoonkologická centra zapojená v projektu Alimta 1. FN Brno Jihlavská 20, 625 00 Brno - Bohunice
Lékový registr Pravidelný report Maligní pleurální mezoteliom (MPM) Stav registru k datu 19. 10. 2015 Pneumoonkologická centra zapojená v projektu Alimta 1. FN Brno Jihlavská 20, 625 00 Brno - Bohunice
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Docetaxel Accord 20 mg/1 ml koncentrát pro infuzní roztok Docetaxel Accord 80 mg/4 ml koncentrát pro infuzní roztok Docetaxel Accord 160 mg/8 ml
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Docetaxel Accord 20 mg/1 ml koncentrát pro infuzní roztok Docetaxel Accord 80 mg/4 ml koncentrát pro infuzní roztok Docetaxel Accord 160 mg/8 ml
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU TAXOTERE 20 mg/0,5 ml koncentrát a rozpouštědlo pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna jednodávková injekční lahvička TAXOTERE
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU TAXOTERE 20 mg/0,5 ml koncentrát a rozpouštědlo pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna jednodávková injekční lahvička TAXOTERE
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 5 mg/ml injekční roztok pro skot a prasata
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU XATRAL UNO tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Alfuzosini hydrochloridum 10 mg v jedné tabletě. Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU XATRAL UNO tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Alfuzosini hydrochloridum 10 mg v jedné tabletě. Úplný seznam
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Docetaxel Accord 20 mg/1 ml koncentrát pro infuzní roztok Docetaxel Accord 80 mg/4 ml koncentrát pro infuzní roztok Docetaxel Accord 160 mg/8 ml
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Docetaxel Accord 20 mg/1 ml koncentrát pro infuzní roztok Docetaxel Accord 80 mg/4 ml koncentrát pro infuzní roztok Docetaxel Accord 160 mg/8 ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Každá jednodávková injekční lahvička obsahuje docetaxelum 20 mg/ml
 Sp.zn. sukls10119/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Docetaxel Actavis 20 mg/ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá jednodávková injekční lahvička
Sp.zn. sukls10119/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Docetaxel Actavis 20 mg/ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá jednodávková injekční lahvička
CORECT - VECTIBIX. Klinický registr pacientů s metastatickým kolorektálním karcinomem. Stav registru k datu
 CORECT - VECTIBIX Klinický registr pacientů s metastatickým kolorektálním karcinomem Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr
CORECT - VECTIBIX Klinický registr pacientů s metastatickým kolorektálním karcinomem Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 1. NÁZEV PŘÍPRAVKU Nitresan 10 mg Nitresan 20 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 1. NÁZEV PŘÍPRAVKU Nitresan 10 mg Nitresan 20 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
Biologická léčba karcinomu prsu. Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN)
 Biologická léčba karcinomu prsu Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN) Cílená léčba Ca prsu Trastuzumab (HercepNn) AnN HER2 neu pronlátka LapaNnib (Tyverb)
Biologická léčba karcinomu prsu Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN) Cílená léčba Ca prsu Trastuzumab (HercepNn) AnN HER2 neu pronlátka LapaNnib (Tyverb)
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU DOCETAXEL KABI 20 mg/1 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu obsahuje docetaxelum 20 mg. Jedna
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU DOCETAXEL KABI 20 mg/1 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu obsahuje docetaxelum 20 mg. Jedna
Nejnovější metody léčby karcinomu prostaty
 Nejnovější metody léčby karcinomu prostaty FN a LFUK HRADEC KRÁLOVÉ Josef Košna Urologická klinika FN a LFUK Hradec Králové Úvod Nádor prostaty je druhým nejčastějším nádorem u mužů po kožních nádorech
Nejnovější metody léčby karcinomu prostaty FN a LFUK HRADEC KRÁLOVÉ Josef Košna Urologická klinika FN a LFUK Hradec Králové Úvod Nádor prostaty je druhým nejčastějším nádorem u mužů po kožních nádorech
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU DOCETAXEL KABI 80 mg/4 ml koncentrát pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu obsahuje 20 mg docetaxelum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU DOCETAXEL KABI 80 mg/4 ml koncentrát pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu obsahuje 20 mg docetaxelum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls40560/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 1mg/ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje loratadinum 1 mg. Pomocná látka se známým účinkem:
sp.zn.sukls40560/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 1mg/ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje loratadinum 1 mg. Pomocná látka se známým účinkem:
CZ PAR. QUETIAPINI FUMARAS Seroquel. UK/W/0004/pdWS/001 NL/W/0004/pdWS/001
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MIFLONID 200 MIFLONID 400 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Prášek k inhalaci v tvrdých tobolkách užívaný v kombinaci s Aerolizerem. Jedna tobolka obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MIFLONID 200 MIFLONID 400 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Prášek k inhalaci v tvrdých tobolkách užívaný v kombinaci s Aerolizerem. Jedna tobolka obsahuje
Pomalidomid první rok léčby v ČR
 C Z E C H G R O U P CZECH GROUP 1 Pomalidomid první rok léčby v ČR Luděk Pour IHOK FN Brno XIII. Výroční setkání CMG 10. 4. 2015 Mikulov C M G M Y E L O M A Č E S K Á M YE LO M O VÁ S K U P IN A CMG ČESKÁ
C Z E C H G R O U P CZECH GROUP 1 Pomalidomid první rok léčby v ČR Luděk Pour IHOK FN Brno XIII. Výroční setkání CMG 10. 4. 2015 Mikulov C M G M Y E L O M A Č E S K Á M YE LO M O VÁ S K U P IN A CMG ČESKÁ
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU JEVTANA 60 mg koncentrát a rozpouštědlo pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml koncentrátu obsahuje cabazitaxelum 40
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU JEVTANA 60 mg koncentrát a rozpouštědlo pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml koncentrátu obsahuje cabazitaxelum 40
Informace pro zdravotnické odborníky
 EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
Analytický report projektu AVASTIN klinický registr
 Analytický report projektu AVASTIN klinický registr Karcinom prsu Stav k datu 10. 4. 2011 Registr Avastin je podporován výzkumným ý grantem firmy Roche. Česká Institut t onkologická biostatistiky společnost
Analytický report projektu AVASTIN klinický registr Karcinom prsu Stav k datu 10. 4. 2011 Registr Avastin je podporován výzkumným ý grantem firmy Roche. Česká Institut t onkologická biostatistiky společnost
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Emselex 7,5 mg, tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 7,5 mg darifenacinum (jako hydrobromid)
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Emselex 7,5 mg, tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 7,5 mg darifenacinum (jako hydrobromid)
Pravidelný report projektu BREAST - Avastin
 Pravidelný report projektu BREAST - Avastin Stav k datu 10. 10. 2011 Analýza dat: Mgr. Zbyněk Bortlíček Informační technologie: RNDr. Daniel Klimeš, Ph.D. Management projektu: Ing. Petr Brabec, Mgr. Karel
Pravidelný report projektu BREAST - Avastin Stav k datu 10. 10. 2011 Analýza dat: Mgr. Zbyněk Bortlíček Informační technologie: RNDr. Daniel Klimeš, Ph.D. Management projektu: Ing. Petr Brabec, Mgr. Karel
1. NÁZEV PŘÍPRAVKU. Xtandi - 80 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ. Jedna potahovaná tableta obsahuje enzalutamidum 40 mg.
 1. NÁZEV PŘÍPRAVKU Xtandi - 40 mg potahované tablety Xtandi - 80 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Xtandi - 40 mg potahované tablety Jedna potahovaná tableta obsahuje enzalutamidum
1. NÁZEV PŘÍPRAVKU Xtandi - 40 mg potahované tablety Xtandi - 80 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Xtandi - 40 mg potahované tablety Jedna potahovaná tableta obsahuje enzalutamidum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
