SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU. Každá tableta obsahuje 100 mg levodopy a 25 mg benserazidu (vo forme benserazidium hydrochloridu).
|
|
|
- Karel Čech
- před 7 lety
- Počet zobrazení:
Transkript
1 Schválený text k rozhodnutiu o zmene, ev.č. 2016/00748 SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU Madopar Dispersible 125 mg dispergovateľné tablety 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Každá tableta obsahuje 100 mg levodopy a 25 mg benserazidu (vo forme benserazidium hydrochloridu). Úplný zoznam pomocných látok, pozri časť LIEKOVÁ FORMA Dispergovateľná tableta. Okrúhle biele tablety s označením ROCHE 125 na jednej strane a s deliacou ryhou na druhej strane. 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikácie Madopar dispersible 125 mg je indikovaný na liečbu Parkinsonovej choroby. Madopar dispersible 125 mg je vhodný pre pacientov, u ktorých je potrebný rýchlejší nástup účinku, napr. u pacientov so skorou rannou alebo popoludňajšou akinézou, alebo u ktorých sa prejavuje oneskorenie účinku (fenomén delayed on ) alebo skracovanie doby účinnosti jednotlivej dávky levodopy (fenomén wearing off ). 4.2 Dávkovanie a spôsob podávania Schéma dávkovania a podávania je rôzna a je možné poskytnúť iba usmernenie. Dospelí Pacienti bez predchádzajúcej liečby levodopou Odporúčaná začiatočná dávka je jedna polovica (62,5 mg) dispergovateľnej tablety Madopar Dispersible 125 mg trikrát alebo štyrikrát denne. Ak je ochorenie v pokročilom štádiu, začiatočná dávka má byť jedna dispergovateľná tableta Madopar Dispersible 125 mg trikrát denne. Následne sa má denná dávka zvýšiť o jednu dispergovateľnú tabletu Madopar Dispersible 125 mg jedenkrát alebo dvakrát týždenne až do dosiahnutia úplného terapeutického účinku alebo do výskytu vedľajších účinkov. U niektorých starších pacientov môže byť postačujúce začať liečbu jednou polovicou (62,5 mg) dispergovateľnej tablety Madopar Dispersible 125 mg jedenkrát alebo dvakrát denne, pričom dávka sa raz za tri alebo štyri dni zvýši o jednu polovicu dispergovateľnej tablety Madopar Dispersible 125 mg. 1
2 Účinná dávka je zvyčajne v rozmedzí od štyroch do ôsmich dispergovateľných tabliet lieku Madopar Dispersible 125 mg denne rozdelených do jednotlivých dávok, pričom väčšina pacientov potrebuje najviac šesť dispergovateľných tabliet Madopar Dispersible 125 mg denne. Optimálne zlepšenie sa zvyčajne pozoruje v priebehu jedného až troch týždňov, ale úplný terapeutický účinok môže byť zjavný až po nejakej dobe. Z tohto dôvodu sa odporúča nechať uplynúť niekoľko týždňov pred tým, ako sa zváži zvýšenie dávky nad priemerné dávkovacie rozmedzie. Ak sa ani potom nedosiahne uspokojivé zlepšenie, dávka Madoparu sa môže zvyšovať, avšak opatrne. Zriedkavo je potrebné podávať viac ako desať 125 mg dispergovateľných tabliet Madopar Dispersible denne. Liečba má pokračovať aspoň šesť mesiacov, pred tým, ako sa na základe absencie klinickej odpovede skonštatuje zlyhanie liečby. Pacienti po predchádzajúcej liečbe levodopou Odporúča sa nasledujúci postup: Levodopa v monoterapii sa má vysadiť a liečba Madoparom sa má začať nasledujúci deň. Pacient má začať liečbu dispergovateľnými tabletami Madopar Dispersible 125 mg, ktorých celkový počet je o jednu dispergovateľnú tabletu nižší ako celkový počet 500 mg tabliet užívaných predtým (napríklad ak pacient predtým užíval 2 g levodopy denne, nasledujúci deň má začať liečbu troma dispergovateľnými tabletami lieku Madopar Dispersible 125 mg). Pacient má byť pozorovaný jeden týždeň a potom sa má v prípade potreby dávka zvyšovať spôsobom určeným pre nových pacientov. Pacienti po predchádzajúcej liečbe inými kombináciami levodopy/inhibítora dekarboxylázy Predchádzajúca liečba sa má vysadiť na 12 hodín. Aby sa minimalizovali akékoľvek možné účinky z vysadenia levodopy, môže byť prospešné ukončiť predchádzajúcu liečbu večer a liečbu Madoparom začať nasledujúce ráno. Začiatočná dávka Madoparu má byť jedna polovica (62,5 mg) dispergovateľnej tablety Madopar Dispersible 125 mg trikrát alebo štyrikrát denne. Následne sa táto dávka má zvyšovať spôsobom určeným pre pacientov bez predchádzajúcej liečby levodopou. Madopar sa môže podávať súbežne s inými antiparkinsonikami. Počas začiatočnej fázy liečby Madoparom sa má pokračovať v už zavedenej liečbe inými antiparkinsonikami, napr. anticholinergikami alebo amantadínom. V ďalšej fáze liečby Madoparom, v ktorej sa jeho terapeutický účinok stane zjavným, však môže byť potrebné zníženie dávky iných liečiv alebo ich postupné vysadenie. Starší pacienti Aj keď u starších pacientov môže byť v súvislosti s vekom znížená znášanlivosť levodopy, Madopar je zrejme dobre znášaný a vedľajšie účinky zvyčajne nie sú problémové. Pediatrická populácia Madopar Dispersible sa nemá podávať pacientom mladším ako 25 rokov; z tohto dôvodu nie sú k dispozícii odporúčania pre dávkovanie lieku Madopar Dispersible 125 mg pre pediatrickú populáciu. Spôsob podávania Madopar Dispersible 125 mg tablety sa majú prehltnúť celé alebo rozpustiť v ml vody. Po úplnom rozpustení tablety sa v priebehu niekoľkých minút vytvorí roztok mliečneho vzhľadu. Pred použitím treba roztok premiešať a použiť v priebehu pol hodiny po rozpustení tablety. Ak je to možné, Madopar Dispersible 125 mg tablety sa majú užiť 30 minút pred jedlom alebo 1 hodinu po jedle. Dispergovateľné tablety Madoparu sú obzvlášť vhodné pre pacientov, ktorí majú ťažkosti s prehĺtaním pevných liekových foriem. 2
3 4.3 Kontraindikácie Levodopa-benserazid sa nesmie podávať pacientom so známou precitlivenosťou na levodopu alebo benserazid alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Levodopa-benserazid sa nesmie podávať spolu s neselektívnymi inhibítormi monoaminooxidázy (MAO). Avšak selektívne inhibítory MAO-B, ako selegilín a rasagilín a selektívne inhibítory MAO- A ako moklobemid, nie sú kontraindikované. Kombinácia selektívnych inhibítorov MAO-A a MAO-B je však ekvivalentná neselektívnej inhibícii, a preto sa táto kombinácia nemá podávať súbežne s levodopou -benserazidom (pozri časť 4.5). Levodopa-benserazid sa nesmie podávať pacientom s ťažkými poruchami endokrinného systému (napr. feochromocytóm, hypertyreóza, Cushingov syndróm), s poruchami funkcie obličiek (s výnimkou pacientov s RLS na dialýze), alebo poruchami funkcie pečene, s poruchami funkcie srdca (napr. závažné srdcové arytmie a srdcové zlyhávanie), s psychiatrickými ochoreniami s psychotickou zložkou alebo pacientom s glaukómom so zatvoreným uhlom. Levodopa-benserazid sa nesmie podávať pacientom mladším ako 25 rokov (musí byť ukončený vývoj kostry). Levodopa-benserazid sa nesmie podávať gravidným ženám alebo ženám vo fertilnom veku, ktoré nepoužívajú účinnú antikoncepciu. Ak žena, ktorá užíva levodopu-benserazid otehotnie, liek sa musí vysadiť (podľa odporúčania lekára). 4.4 Osobitné upozornenia a opatrenia pri používaní U niektorých citlivých pacientov sa môžu vyskytnúť reakcie z precitlivenosti. U pacientov s glaukómom s otvoreným uhlom sa odporúča pravidelné meranie vnútroočného tlaku, ktorý môže byť zvýšený v dôsledku užívania levodopy. Zvýšená opatrnosť je potrebná, keď sa podáva levodopa-benserazid pacientom s existujúcimi poruchami srdca (napr. koronárne ochorenie tepien, srdcová arytmia alebo srdcové zlyhávanie (pozri tiež časť 4.3). U týchto pacientov sa má sledovať funkcia srdca s osobitnou opatrnosťou predovšetkým na začiatku liečby a potom pravidelne v priebehu liečby. Starostlivé sledovanie pacientov s rizikovými faktormi (napr. starší pacienti, súbežné podávanie antihypertenzív alebo iných liekov s ortostatickým účinkom) alebo s predchádzajúcou ortostatickou hypotenziou sa odporúča najmä na začiatku liečby alebo pri zvyšovaní dávok. Pri podávaní levodopy - benserazidu bol hlásený možný pokles hodnôt krvného obrazu ( napr. hemolytická anémia, trombocytopénia a leukopénia). V niekoľkých prípadoch bola hlásená agranulocytóza a pancytopénia, ktorých súvislosť s levodopou- benserazidom sa nevedela potvrdiť ani úplne vylúčiť. Preto sa má v priebehu liečby vykonávať pravidelná kontrola krvného obrazu. U pacientov s Parkinsonovou chorobou a RLS môže byť súčasťou klinického obrazu depresia, ktorá sa môže sa vyskytnúť aj u pacientov liečených levodopou-benserazidom. Všetkých pacientov treba starostlivo sledovať z dôvodu psychologických zmien a depresie so samovražednými myšlienkami alebo bez nich. Levodopa-benserazid môže navodiť dopamín dysregulačný syndróm a z toho vyplývajúce nadmerné užívanie lieku. Malý počet pacientov trpí kognitívnymi a behaviorálnymi poruchami, ktoré môžu byť 3
4 priamo spojené s užívaním nadmerného množstva lieku v rozpore s odporučením lekára a vysoko presahujú dávky potrebné na liečbu ich motorických porúch. Ak je u pacienta potrebná celková anestézia, môže sa pokračovať v normálnom režime podávania levodopy-benserazidu až do anestézie, s výnimkou prípadov, ak ide o anestéziu halotanom. U pacientov, ktorí podstupujú celkovú anestéziu halotanom, sa má liečba levodopou-benserazidom prerušiť hodín pred chirurgickým výkonom preto, že u týchto pacientov existuje zvýšené riziko arytmií a kolísanie krvného tlaku. Po chirurgickom výkone sa môže podávanie levodopy-benserazidu obnoviť a postupne zvyšovať dávku až na pôvodnú dávku. Liečba levodopou-benserazidom sa musí ukončiť postupne. Náhle vysadenie liečby by mohlo vyvolať život ohrozujúci stav - neuroleptický malígny syndróm ( hyperpyrexia, svalová stuhnutosť, prípadné psychické zmeny a zvýšená sérová kreatinínfosfokináza, ďalšie príznaky vo vážnych prípadoch môžu zahŕňať myoglobinúriu, rabdomyolýzu - a akútne zlyhanie obličiek) Ak sa rozvinie kombinácia takýchto príznakov a znakov, treba pacienta starostlivo sledovať, v prípade potreby hospitalizovať a začať príslušnú symptomatickú liečbu. Treba zvážiť i opätovné nasadenie liečby levodopa benserazidom. Použitie levodopy je spojené so somnolenciou a epizódami náhleho upadnutia do spánku. Veľmi zriedkavo bolo hlásené náhle upadnutie do spánku počas denných aktivít, v niektorých prípadoch bez zjavnej ospalosti alebo varovných príznakov. Pacienti musia byť o tejto skutočnosti informovaní a musia byť upozornení na to, aby boli počas liečby levodopou pri vedení vozidla alebo obsluhe strojov opatrní. Pacienti, u ktorých sa vyskytne somnolencia a/alebo epizóda náhleho upadnutia do spánku, nesmú viesť vozidlo alebo obsluhovať stroje. Okrem toho sa u nich môže zvážiť zníženie dávky alebo ukončenie liečby (pozri časť 4.7). Impulzívne poruchy Pacientov je nutné pravidelne sledovať z dôvodu rozvinutia impulzívnych porúch. Pacientov a ich ošetrovateľov treba upozorniť, že u pacientov liečených agonistami dopamínu a/alebo dopaminergnými liekmi s obsahom levodopy vrátane Madoparu sa môžu rozvinúť behaviorálne symptómy impulzívnych porúch, vrátane patologickej hráčskej závislosti, zvýšeného libida, hypersexuality, nutkavého utrácania alebo nakupovania, záchvatového a nutkavého prejedania sa. Ak sa tieto príznaky objavia, odporúčame prehodnotiť liečbu. Laboratórne testy Počas liečby sa odporúča sa pravidelné hodnotenie funkcie pečene, obličiek, kardiovaskulárnych funkcií a vyšetrenie krvného obrazu (počtu krviniek). U pacientov s cukrovkou majú byť častejšie kontrolované hladiny cukru v krvi a dávka antidiabetík sa má upraviť podľa hladín cukru v krvi. Malígny melanóm Epidemiologické štúdie preukázali, že u pacientov s Parkinsonovou chorobou je vyššie riziko vzniku melanómu ako u bežnej populácii (približne 2-6 násobne vyššie). Nie je jasné, či zaznamenané zvýšené riziko bolo z dôvodu Parkinsonovej choroby alebo iných faktorov, ako podanie levodopy na liečbu Parkinsonovej choroby. Preto sa pacientom a lekárom odporúča pravidelne kontrolovať možný vznik melanómu, keď sa levodopa-benserazid užíva v akejkoľvek indikácii. Pokiaľ je to možné, majú sa robiť pravidelné kožné vyšetrenia príslušným odborníkom (napr. dermatológom). 4.5 Liekové a iné interakcie Farmakokinetické interakcie 4
5 Súbežné podávanie anticholinergného liečiva trihexyfenidylu so štandardnými liekovými formami levodopy-benserazidu znižuje rýchlosť, ale nie rozsah absorpcie levodopy. Trihexyfenidyl podaný súbežne s levodopou-benserazidom vo forme HBS neovplyvňuje farmakokinetiku levodopy. Súbežné podávanie antacíd s levodopou-benserazidom vo forme HBS redukuje absorpciu levodopy až o 32 %. Síran železnatý znižuje maximálnu plazmatickú koncentráciu a AUC levodopy o %. Farmakokinetické zmeny pozorované počas súbežnej liečby síranom železnatým sú pravdepodobne klinicky významné u niektorých pacientov, ale nie u všetkých. Metoklopramid zvyšuje rýchlosť absorpcie levodopy. Domperidón môže zvýšiť biodostupnosť levodopy stimuláciou gastrického vyprázdňovania. Farmakodynamické interakcie Neuroleptiká, opioidy a antihypertenzíva obsahujúce rezerpín inhibujú účinok levodopy-benserazidu. Súbežné podanie antipsychotík so schopnosťami blokovať dopamínové receptory, zvlášť antagonisti D2-receptorov môžu pôsobiť proti antiparkinsonským účinkom levodopy-benserazidu, preto sa majú užívať s opatrnosťou. Levodopa môže znížiť antipsychotický účinok týchto liekov. Pri podávaní týchto liekov je potrebná mimoriadna opatrnosť, pacient má byť starostlivo sledovaný pre možnú stratu antiparkinsonského účinku a zhoršenie príznakov Parkinsonovej choroby. U pacientov došlo k symptomatickej ortostatickej hypotenzii, keď sa pacientom pridala liečba kombináciou levodopy a inhibítora dekarboxylázy, ktorým už boli podávané antihypersenzitíva. U pacientov užívajúcich antihypertenzíva sa liečba levodopou-benserazidom musí zaviesť opatrne. Je potrebné sledovať krvný tlak, aby bolo možné v prípade potreby upraviť dávku ktoréhokoľvek z liekov. Súčasné podávanie levodopy-benserazidu so sympatomimetikami (liečivá ako adrenalín, noradrenalín, isoproterenol alebo amfetamín, ktoré stimulujú sympatický nervový systém) môže zosilňovať ich účinky, a preto sa tieto kombinácie neodporúčajú. Ak je potrebné súčasné podávanie týchto liečiv, je nevyhnutné sledovanie kardiovaskulárneho systému a prípadne zníženie sympatomimetík. Ak sa levodopa-benserazid podáva pacientom, ktorí užívajú ireverzibilné neselektívne inhibítory MAO, levodopa benserazid sa má začať podávať aspoň 2 týždne po prerušení podávania inhibítora MAO. V opačnom prípade môže dôjsť k vzniku hypertenznej krízy (pozri časť 4.3). Selektívne inhibítory MAO-B, ako selegilín a rasagilín a selektívne inhibítory MAO-A, ako moklobemid, sa môžu predpísať pacientom ktorí užívajú levodopu-benserazid. U pacientov, ktorí užívajú selektívny inhibítor MAO sa odporúča upraviť dávku levodopy podľa individuálnej potreby pacienta, ako z hľadiska účinnosti, tak i znášanlivosti. Kombinácia selektívnych inhibítorov MAO-A a MAO-B je ekvivalentná neselektívnej inhibícii MAO, a preto sa táto kombinácia nemá podávať súbežne s levodopou-benserazidom (pozri časť 4.3). Kombinácia s inými liečivami ako sú anticholinergiká, amantadín, selegilín, agonisti dopamínu a bromokriptín je dovolená, i keď môže k dôjsť k zintenzívneniu žiaducich aj nežiaducich účinkov liečby. Môže byť potrebné zníženie dávky levodopy-benserazidu alebo súbežne podávanej látky. Pri začatí adjuvantnej liečby inhibítorom COMT môže byť potrebné zníženie dávky levodopybenserazidu. Pri začatí liečby levodopou-benserazidom nemajú byť anticholinergiká náhle vysadené, pretože levodopa začne účinkovať až po nejakom čase. 5
6 Levodopa môže ovplyvňovať výsledky laboratórnych testov katecholamínov, kreatinínu, kyseliny močovej a glukózy. Výsledky vyšetrení moču môžu vykazovať falošnú pozitivitu na ketónové látky. U pacientov, ktorí užívajú levodopu-benserazid, sa môžu pozorovať falošne pozitívne výsledky Coombsovho testu. Potrava bohatá na bielkoviny môže znižovať absorpciu levodopy z gastrointestinálneho traktu. Pri celkovej anestézii halotanom sa má liečba levodopou-benserazidom ukončiť 12 až 48 hodín pred chirurgickým výkonom, lebo môže dôjsť ku kolísaniu krvného tlaku a/alebo k výskytu srdcovej arytmie. Celkovú anestéziu navodenú inými anestetikami pozri časť Fertilita, gravidita a laktácia Gravidita, fertilita Madopar je kontraindikovaný počas gravidity a u žien vo fertilnom veku, ktoré nepoužívajú účinnú antikoncepciu (pozri časti 4.4 a 5.3). Dojčenie Pretože nie je známe, či benserazid preniká do materského mlieka, matky, ktoré sú liečené levodopoubenserazidom by nemali dojčiť, lebo sa nedá vylúčiť výskyt malformácií kostry detí. 4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje Pacienti liečení levodopou, u ktorých sa vyskytuje somnolencia a/alebo epizódy náhleho upadnutia do spánku, musia byť informovaní, že nesmú viesť vozidlo alebo vykonávať činnosti (napr. obsluha strojov), v ktorých narušená bdelosť môže pre nich alebo pre ostatné osoby predstavovať riziko závažného zranenia alebo úmrtia, a to až dovtedy, kým u nich takéto opakované epizódy alebo somnolencia neustúpia (pozri časť 4.4). 4.8 Nežiaduce účinky Nasledujúce nežiaduce účinky boli hlásené, keď sa podávala levodopa- benserazid (frekvencia nie je známa, nedá sa odhadnúť z dostupných údajov). Kategórie frekvencie sú: Veľmi časté 1/10 Časté 1/100 až < 1/10 Menej časté 1/1 000 až < 1/100 Zriedkavé 1/ až < 1/1 000 Veľmi zriedkavé < 1/ Neznáme (častosť sa nedá odhadnúť z dostupných údajov) Poruchy krvi a lymfatického systému Poruchy metabolizmu a výživy hemolytická anémia leukopénia trombocytopénia znížená chuť do jedla 6
7 Psychické poruchy Poruchy nervového systému Poruchy srdca a srdcovej činnosti Poruchy ciev dopamín dysregulačný syndróm stav zmätenosti depresia agitácia* úzkosť insomnia* halucinácie* bludy* dezorientácia* patologické hráčstvo zvýšené libido hypersexualita nutkavé nakupovanie prejedanie sa symptóm poruchy jedenia ageúzia dysgeúzia dyskinézia (choreiformná a atetotická) výkyvy v terapeutickej odpovedi fenomén zamrznutia zhoršenie stavu na konci dávkovacieho intervalu náhle chaotické kolísanie stavu somnolencia náhle upadnutie do spánku arytmia ortostatická hypotenzia Poruchy gastrointestinálneho traktu Poruchy pečene a žlčových ciest Poruchy kože a podkožného tkaniva nauzea vracanie hnačka zmena farby slín zmena farby jazyka zmena farby zubov zmena farby sliznice úst zvýšené hladiny transamináz zvýšené hladiny alkalickej fosfatázy zvýšené hladiny gamaglutamyltransferázy pruritus 7
8 vyrážka Poruchy kostrovej a svalovej sústavy a spojivového tkaniva Poruchy obličiek a močových ciest syndróm nepokojných nôh zvýšená močovina v krvi chromatúria *Tieto účinky sa môžu vyskytnúť zvlášť u starších pacientov a u pacientov, ktorí majú tieto poruchy v anamnéze. Poruchy krvi a lymfatického systému V zriedkavých prípadoch boli hlásené prípady hemolytickej anémie, dočasnej leukopénie a trombocytopénie. Preto sa má, tak ako pri akejkoľvek dlhotrvajúcej liečbe levodopou, pravidelne vyšetrovať krvný obraz a hodnotiť funkcia pečene a obličiek. Poruchy metabolizmu a výživy Boli hlásené prípady anorexie. Psychiatrické poruchy U pacientov s Parkinsonovou chorobou a syndrómom nepokojných nôh, ktorí sú liečení Madoparom, sa môže vyskytnúť depresia ako súčasť klinického obrazu. Agitácia, úzkosť, insomnia, halucinácie, bludy a dočasná dezorientácia sa môžu vyskytnúť zvlášť u starších pacientov s týmito poruchami v anamnéze. Bol tiež hlásený výskyt dopamín dysregulačného syndrómu. Impulzívne poruchy U pacientov liečených agonistami dopamínu a/alebo inými dopaminergnými liekmi s obsahom levodopy vrátane Madoparu sa môžu rozvinúť patologické hráčstvo, zvýšené libido, hypersexualita, nutkavé utrácanie alebo nakupovanie, záchvatové a nutkavé prejedania sa. Poruchy nervového systému Boli hlásené ojedinelé prípady ageúzie a dysgeúzie. V neskorších fázach liečby sa môžu vyskytnúť dyskinézy (napr. choreiformné alebo atetotické). Znížením dávky je ich zvyčajne možné úplne odstrániť alebo zmierniť na znesiteľnú mieru. Počas dlhodobej liečby môžu vzniknúť aj fluktuácie v odpovedi na liečbu. Tieto zahŕňajú epizódy náhleho zamrznutia na mieste (fenomén freezingu ), zhoršenie stavu na konci dávkovacieho intervalu (fluktuácie typu end of dose ) a náhle chaotické kolísanie stavu (fluktuácie typu on-off ). Úpravou dávky alebo častejším podávaním menších jednotlivých dávok je ich zvyčajne možné úplne odstrániť alebo zmierniť na znesiteľnú mieru. Následne je možné pokúsiť sa o opätovné zvýšenie dávky za účelom zintenzívnenia terapeutického účinku. Užívanie Madoparu je spojené so somnolenciou a veľmi zriedkavo bolo spojené s nadmernou ospalosťou počas dňa a epizódami náhleho upadnutia do spánku. Poruchy ciev Ortostatické poruchy zvyčajne ustúpia po znížení dávky Madoparu. Poruchy gastrointestinálneho traktu Nežiaduce gastrointestinálne účinky, ktoré sa môžu vyskytnúť najmä v skorých fázach liečby, je zvyčajne možné zvládnuť užívaním levodopy-benserazidu s jedlom alebo nápojom alebo pomalým zvyšovaním dávky. 8
9 Poruchy kostrovej a svalovej sústavy a spojivového tkaniva Syndróm nepokojných nôh: Rozvoj augmentácie (presun symptómov z večera/noci do skorého odpoludnia a večera - pred užitím nasledujúcej dávky) je najčastejším nežiaducim účinkom dlhodobej dopaminergnej liečby. Laboratórne a funkčné vyšetrenia Môže dôjsť k zmene sfarbenia moču, zvyčajne do svetločervenej farby, ktorá po odstátí stmavne. Môže tiež dôjsť k zmene sfarbenia iných telesných tekutín alebo tkanív, vrátane slín, jazyka, zubov alebo sliznice úst, alebo k vytvoreniu škvŕn. Hlásenie podozrení na nežiaduce reakcie Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na Štátny ústav pre kontrolu liečiv, Sekcia klinického skúšania liekov a farmakovigilancie, Kvetná 11, SK Bratislava 26, Tel: Fax: , internetová stránka: neziaduce.ucinky@sukl.sk Predávkovanie Príznaky a znaky Príznaky a znaky predávkovania sú kvalitatívne podobné vedľajším účinkom terapeutických dávok Madoparu, ale môžu byť závažnejšie. Predávkovanie môže spôsobiť kardiovaskulárne vedľajšie účinky (napr. srdcové arytmie), psychiatrické poruchy (napr. zmätenosť a nespavosť), gastrointestinálne účinky (napr. nauzeu a dávenie) a abnormálne mimovoľné pohyby (pozri časť 4.8). Liečba Je potrebné monitorovať vitálne funkcie pacienta a prijať podporné opatrenia tak, ako si to vyžaduje klinický stav pacienta. U pacientov môže byť potrebná najmä symptomatická liečba kardiovaskulárnych účinkov (napr. antiarytmiká) alebo účinkov na centrálny nervový systém (napr. dychové stimulanciá, neuroleptiká). 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1 Farmakodynamické vlastnosti Farmakoterapeutická skupina:antiparkinsoniká, dopa a jej deriváty. ATC kód: N04BA02 Mechanizmus účinku Dopamín, ktorý pôsobí v mozgu ako neurotransmiter, sa v bazálnych gangliách pacientov s Parkinsonovou chorobou nenachádza v dostatočnom množstve. Levodopa (INN) alebo L-DOPA (3,4-dihydroxy L-fenylalanín) je intermediárnou látkou v biosyntéze dopamínu. Levodopa (prekurzor dopamínu) sa používa ako prekurzor (prodrug) na zvýšenie hladín dopamínu, pretože má schopnosť prechádzať hematoencefalickou bariérou, zatiaľ čo samotný dopamín túto schopnosť nemá. Len čo sa levodopa dostane do centrálneho nervového systému (CNS), prostredníctvom dekarboxylázy aromatických L-aminokyselín sa metabolizuje na dopamín. 9
10 Levodopa sa po podaní rýchlo dekarboxyluje na dopamín v extracerebrálnych ako aj cerebrálnych tkanivách. Následkom toho sa väčšina podanej levodopy nedostane do bazálnych ganglií a periférne vytvorený dopamín často spôsobuje nežiaduce účinky. Z tohto dôvodu je obzvlášť žiaduca inhibícia extracelulárnej dekarboxylácie levodopy. To je možné dosiahnuť súbežným podávaním levodopy a benserazidu, ktorý je inhibítorom periférnej dekarboxylázy. Madopar je kombinácia dvoch liečiv v pomere 4:1 - tento pomer sa preukázal ako optimálny v klinických štúdiách a počas terapeutického používania - a je rovnako účinný ako veľké dávky samostatne podávanej levodopy. 5.2 Farmakokinetické vlastnosti Absorpcia Vo vzorkách krvi odobratých pred podaním dávky sú zistiteľné nízke hladiny endogénnej levodopy. Po perorálnom podaní Madoparu sa levodopa a benserazid rýchlo absorbujú, hlavne v horných častiach tenkého čreva, v ktorom absorpcia nie je závislá od miesta. Interakčné štúdie poukazujú na to, že keď sa levodopa podáva v kombinácii s benserazidom, absorbuje sa väčšie množstvo levodopy ako pri samostatnom podávaní levodopy. Maximálna plazmatická koncentrácia levodopy sa dosiahne približne do 1 hodiny po podaní Madoparu. Absolútna biologická dostupnosť levodopy zo štandardného lieku Madopar je približne 98 %. Maximálna plazmatická koncentrácia levodopy a rozsah absorpcie (AUC) sa zvyšujú úmerne dávke ( mg levodopy). Po podaní Madoparu so štandardným jedlom je maximálna plazmatická koncentrácia levodopy nižšia o 30 % a dosahuje sa neskôr. Príjem jedla zvyčajne znižuje rozsah absorpcie levodopy o 15 %, to však môže byť rôzne. Distribúcia Levodopa prechádza hematoencefalickou bariérou prostredníctvom saturovateľného transportného mechanizmu. Neviaže sa na plazmatické bielkoviny. Benserazid podávaný v terapeutických dávkach neprechádza hematoencefalickou bariérou. Benserazid sa koncentruje hlavne v obličkách, pľúcach, tenkom čreve a pečeni. Biotransformácia Dve hlavné cesty metabolizmu levodopy sú dekarboxylácia, pri ktorej vzniká dopamín, ktorý sa následne v menšej miere premieňa na noradrenalín a vo väčšej miere na neúčinné metabolity, a O-metylácia, pri ktorej vzniká 3-O-metyldopa, ktorá má eliminačný polčas približne 15 hodín a kumuluje sa u pacientov užívajúcich terapeutické dávky Madoparu. Pri podávaní levodopy spolu s benserazidom sa znížená periférna dekarboxylácia levodopy prejavuje vyššími plazmatickými hladinami levodopy a 3-O-metyldopy. Benserazid sa hydrolyzuje na trihydroxybenzylhydrazín v sliznici čreva a v pečeni. Tento metabolit je silný inhibítor dekarboxylázy aromatických aminokyselín. Eliminácia V prítomnosti inhibítora periférnej dekarboxylázy, benserazidu, je eliminačný polčas levodopy približne 1,5 hodiny. U starších pacientov je eliminačný polčas mierne (o 25 %) predĺžený. Klírens levodopy je 430 ml/min. Benserazid sa takmer úplne vylučuje vo forme metabolitov. Metabolity sa vylučujú hlavne obličkami (64 %) a v malom rozsahu stolicou (24 %). 5.3 Predklinické údaje o bezpečnosti Neaplikovateľné. 10
11 6. FARMACEUTICKÉ INFORMÁCIE 6.1 Zoznam pomocných látok Bezvodá kyselina citrónová (E330) Predželatínovaný škrob Mikrokryštalická celulóza (E460) Magnéziumstearát (E572) 6.2 Inkompatibility Neaplikovateľné. 6.3 Čas použiteľnosti 3 roky. 6.4 Špeciálne upozornenia na uchovávanie Uchovávajte pri teplote neprevyšujúcej 25 C. Uchovávajte v pôvodnom obale. Fľašu udržiavajte dôkladne uzatvorenú na ochranu pred vlhkosťou. Madopar Dispersible 125 mg sa má užiť v priebehu pol hodiny po rozpustení tablety. 6.5 Druh obalu a obsah balenia Fľaša z hnedého skla so skrutkovým polyetylénovým uzáverom, vysúšadlo, vatový tampón, papierová škatuľa, písomná informácia pre používateľa. Veľkosť balenia: 30 tabliet alebo100 tabliet Na trh nemusia byť uvedené všetky veľkosti balenia. 6.6 Špeciálne opatrenia na likvidáciu Žiadne zvláštne požiadavky. 7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII Roche Slovensko, s.r.o., Cintorínska 3/A, Bratislava, Slovenská republika 8. REGISTRAČNÉ ČÍSLO 27/0156/00-S 9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE Dátum prvej registrácie: Dátum posledného predĺženia registrácie:
12 10. DÁTUM REVÍZIE TEXTU September
PRÍLOHA III DODATKY K SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNEJ INFORMÁCII PRE POUŽÍVATEĽOV
 PRÍLOHA III DODATKY K SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNEJ INFORMÁCII PRE POUŽÍVATEĽOV Tieto zmeny v SPC a písomnej informácii pre používateľov sú platné v čase Rozhodnutia Komisie. Po
PRÍLOHA III DODATKY K SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNEJ INFORMÁCII PRE POUŽÍVATEĽOV Tieto zmeny v SPC a písomnej informácii pre používateľov sú platné v čase Rozhodnutia Komisie. Po
(tolkapón) tablety DENNÍK PACIENTA. Pomôže vám dodržiavať pravidelné vyšetrenia funkcie pečene počas prvého roku užívania
 (tolkapón) tablety DENNÍK PACIENTA Pomôže vám dodržiavať pravidelné vyšetrenia funkcie pečene po prvého roku užívania INFORMÁCIE O PACIENTOVI 03 PRED UŽITÍM TASMARU SI, PROSÍM, PREČÍTAJTE NASLEDOVNÉ INFORMÁCIE
(tolkapón) tablety DENNÍK PACIENTA Pomôže vám dodržiavať pravidelné vyšetrenia funkcie pečene po prvého roku užívania INFORMÁCIE O PACIENTOVI 03 PRED UŽITÍM TASMARU SI, PROSÍM, PREČÍTAJTE NASLEDOVNÉ INFORMÁCIE
Príloha III. Úpravy súhrnu charakteristických vlastností lieku, označenie na obale a písomná informácia je výsledkom postupu preskúmania.
 Príloha III Úprava príslušným častí súhrnu charakteristických vlastností lieku a písomnej informácii pre používateľa Poznámka: Úpravy súhrnu charakteristických vlastností lieku, označenie na obale a písomná
Príloha III Úprava príslušným častí súhrnu charakteristických vlastností lieku a písomnej informácii pre používateľa Poznámka: Úpravy súhrnu charakteristických vlastností lieku, označenie na obale a písomná
Písomná informácia pre používateľa. Madopar Dispersible 125 mg dispergovateľné tablety levodopa a benserazid
 Schválený text k rozhodnutiu o zmene, ev.č. 2016/00748 Písomná informácia pre používateľa Madopar Dispersible 125 mg dispergovateľné tablety levodopa a benserazid Pozorne si prečítajte celú písomnú informáciu
Schválený text k rozhodnutiu o zmene, ev.č. 2016/00748 Písomná informácia pre používateľa Madopar Dispersible 125 mg dispergovateľné tablety levodopa a benserazid Pozorne si prečítajte celú písomnú informáciu
NÁZOV, FARMACEUTICKÁ FORMA, MNOŽSTVO ÚČINNÝCH LÁTOK V LIEKU, SPÔSOB PODÁVANIA, UCHÁDZAČ, DRŽITEĽ ROZHODNUTIA O REGISTRÁCII V ČLENSKÝCH ŠTÁTOCH
 PRÍLOHA I NÁZOV, FARMACEUTICKÁ FORMA, MNOŽSTVO ÚČINNÝCH LÁTOK V LIEKU, SPÔSOB PODÁVANIA, UCHÁDZAČ, DRŽITEĽ ROZHODNUTIA O REGISTRÁCII V ČLENSKÝCH ŠTÁTOCH 1 LIEKY OBSAHUJÚCE JÓDKAZEÍN/TIAMÍN S UDELENÝM POVOLENÍM
PRÍLOHA I NÁZOV, FARMACEUTICKÁ FORMA, MNOŽSTVO ÚČINNÝCH LÁTOK V LIEKU, SPÔSOB PODÁVANIA, UCHÁDZAČ, DRŽITEĽ ROZHODNUTIA O REGISTRÁCII V ČLENSKÝCH ŠTÁTOCH 1 LIEKY OBSAHUJÚCE JÓDKAZEÍN/TIAMÍN S UDELENÝM POVOLENÍM
ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV
 ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV 25 PRÍLOHY K DOPLNENIU RELEVANTNÝCH SEKCII SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU LIEKOV OBSAHUJÚCICH
ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV 25 PRÍLOHY K DOPLNENIU RELEVANTNÝCH SEKCII SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU LIEKOV OBSAHUJÚCICH
Príloha III. Úprava relevantných častí Súhrnu charakteristických vlastností lieku a Písomnej informácie pre používateľa
 Príloha III Úprava relevantných častí Súhrnu charakteristických vlastností lieku a Písomnej informácie pre používateľa Poznámka: Tento súhrn charakteristických vlastností lieku, označenia obalov a písomnej
Príloha III Úprava relevantných častí Súhrnu charakteristických vlastností lieku a Písomnej informácie pre používateľa Poznámka: Tento súhrn charakteristických vlastností lieku, označenia obalov a písomnej
Informácie o liečbe Gilenyou (fingolimod), ktoré je dôležité si pamätať
 Informácie o liečbe Gilenyou (fingolimod), ktoré je dôležité si pamätať Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že
Informácie o liečbe Gilenyou (fingolimod), ktoré je dôležité si pamätať Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že
Choďte menej v noci, užívajte si viac cez deň
 Novinka pre pacientov s LUTS/BPH Choďte menej v noci, užívajte si viac cez deň Novinka v liečbe LUTS/BPH Negatívne vplyvy noktúrie Lekári považujú noktúriu za jeden z najviac obťažujúcich symptómov LUTS/BPH.
Novinka pre pacientov s LUTS/BPH Choďte menej v noci, užívajte si viac cez deň Novinka v liečbe LUTS/BPH Negatívne vplyvy noktúrie Lekári považujú noktúriu za jeden z najviac obťažujúcich symptómov LUTS/BPH.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls20362/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Madopar HBS tvrdé tobolky s řízeným uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Levodopum 100 mg, Benserazidi hydrochloridum 28,5
sp.zn. sukls20362/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Madopar HBS tvrdé tobolky s řízeným uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Levodopum 100 mg, Benserazidi hydrochloridum 28,5
MAGNOSOLV V TEHOTENSTVE
 V TEHOTENSTVE Tehotenstvo predstavuje stav nedostatku horčíka v organizme hladina horčíka v sére klesá asi o 10% (1) Dôsledkom manifestného nedostatku horčíka môže byť zvýšené riziko potratu - predčasný
V TEHOTENSTVE Tehotenstvo predstavuje stav nedostatku horčíka v organizme hladina horčíka v sére klesá asi o 10% (1) Dôsledkom manifestného nedostatku horčíka môže byť zvýšené riziko potratu - predčasný
Biologické aktivity magnézia (2) Zastúpenie magnézia v organizme (2) Štvrtý najčastejší katión v ľudskom organizme
 Biologické aktivity magnézia (2) Štvrtý najčastejší katión v ľudskom organizme Druhý najčastejší katión v intracelulárnom priestore Podieľa sa na metabolizme enzýmov, elektrolytov a energetickom metabolizme
Biologické aktivity magnézia (2) Štvrtý najčastejší katión v ľudskom organizme Druhý najčastejší katión v intracelulárnom priestore Podieľa sa na metabolizme enzýmov, elektrolytov a energetickom metabolizme
Lieky a pacienti s bolesťou
 Dozadu Na začiatok Ďalej Lieky a pacienti s bolesťou Kúpite si občas v lekárni lieky na bolesť alebo vám ich pravidelne predpisuje lekár? Čítajte ďalej a zistite, či pri liečbe občasnej alebo chronickej
Dozadu Na začiatok Ďalej Lieky a pacienti s bolesťou Kúpite si občas v lekárni lieky na bolesť alebo vám ich pravidelne predpisuje lekár? Čítajte ďalej a zistite, či pri liečbe občasnej alebo chronickej
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Levodopum 200 mg, Benserazidi hydrochloridum 57 mg (= Benserazidum 50 mg) v l tabletě
 sp.zn. sukls20362/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Madopar 250 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Levodopum 200 mg, Benserazidi hydrochloridum 57 mg (= Benserazidum 50 mg)
sp.zn. sukls20362/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Madopar 250 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Levodopum 200 mg, Benserazidi hydrochloridum 57 mg (= Benserazidum 50 mg)
2. Kvalitatívne a kvantitatívne zloženie lieku Triprolidini hydrochloridum 25,0 mg, Pseudoephedrini hydrochloridum 600,0 mg v 100 ml sirupu.
 1 Súhrn charakteristických vlastností lieku (SPC) 1. Názov lieku TRIFED sirup 2. Kvalitatívne a kvantitatívne zloženie lieku Triprolidini hydrochloridum 25,0 mg, Pseudoephedrini hydrochloridum 600,0 mg
1 Súhrn charakteristických vlastností lieku (SPC) 1. Názov lieku TRIFED sirup 2. Kvalitatívne a kvantitatívne zloženie lieku Triprolidini hydrochloridum 25,0 mg, Pseudoephedrini hydrochloridum 600,0 mg
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU. Jedna obalená tableta obsahuje 12,5 mg sodnej soli tianeptínu (čo zodpovedá 11,87 mg tianeptínu).
 Príloha č. 1 k notifikácii o zmene, ev.č.: 2015/02247-Z1B SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU COAXIL obalené tablety 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Jedna obalená tableta
Príloha č. 1 k notifikácii o zmene, ev.č.: 2015/02247-Z1B SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU COAXIL obalené tablety 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Jedna obalená tableta
ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV
 ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV 41 ZMENY, KTORÉ MAJÚ BYŤ ZAHRNUTÉ DO PRÍSLUŠNÝCH ČASTÍ SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV 41 ZMENY, KTORÉ MAJÚ BYŤ ZAHRNUTÉ DO PRÍSLUŠNÝCH ČASTÍ SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 Príloha č. 2 k notifikácii o zmene, ev. č.: 2017/01968-Z1B Schválený text k rozhodnutiu o prevode, ev. č.: 2017/01969-TR 1. NÁZOV LIEKU Capsagamma 53 mg/100 g krém SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
Príloha č. 2 k notifikácii o zmene, ev. č.: 2017/01968-Z1B Schválený text k rozhodnutiu o prevode, ev. č.: 2017/01969-TR 1. NÁZOV LIEKU Capsagamma 53 mg/100 g krém SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA. Zinkorot tablety Liečivo: dihydrát zinkumorotátu
 Schválený text k rozhodnutiu o prevode, ev.č. 2012/07128 Príloha č. 3 k notifikácii zmeny v registrácii lieku, ev.č. 2012/07129 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA Zinkorot tablety Liečivo: dihydrát zinkumorotátu
Schválený text k rozhodnutiu o prevode, ev.č. 2012/07128 Príloha č. 3 k notifikácii zmeny v registrácii lieku, ev.č. 2012/07129 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA Zinkorot tablety Liečivo: dihydrát zinkumorotátu
Hlavným rizikovým faktorom glaukómu je zvýšený vnútroočný tlak (IOT) (asi 2% populácie vo veku rokov a 8% nad 70 rokov má zvýšený IOT).
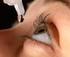 Glaukóm je skupina ochorení, ktorá môže spôsobiť stratu zraku bez varovných príznakov. Vyše 3 MILIÓNOV Američanov má glaukóm. Len polovica z nich to VIE. DIIAGNÓZA JE PRVÝM KROKOM ZÁCHRANY VÁŠHO ZRAKU
Glaukóm je skupina ochorení, ktorá môže spôsobiť stratu zraku bez varovných príznakov. Vyše 3 MILIÓNOV Američanov má glaukóm. Len polovica z nich to VIE. DIIAGNÓZA JE PRVÝM KROKOM ZÁCHRANY VÁŠHO ZRAKU
Vyšetrenie trvá 2 3 hodiny, počas ktorých pacient opakovane vydýchne do prístroja. Lek ár by mal byť informovaný:
 Dychový test na SIBO pokyny pre pacienta je bezbolestný dychový test, ktorým možno diagnostikovať bakteriálne prerastanie v tenk om čreve na základe stanovenia koncentrácie v odíka vo vydychovanom vzduchu.
Dychový test na SIBO pokyny pre pacienta je bezbolestný dychový test, ktorým možno diagnostikovať bakteriálne prerastanie v tenk om čreve na základe stanovenia koncentrácie v odíka vo vydychovanom vzduchu.
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls167002/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls167002/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MADOPAR 62,5 tablety pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls167002/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MADOPAR 62,5 tablety pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ
Písomná informácia pre používateľa. Ebixa 10 mg filmom obalené tablety Memantínchlorid
 Písomná informácia pre používateľa Ebixa 10 mg filmom obalené tablety Memantínchlorid Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre vás dôležité
Písomná informácia pre používateľa Ebixa 10 mg filmom obalené tablety Memantínchlorid Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre vás dôležité
Příloha č.2 k rozhodnutí o změně registrace sp.zn.sukls251828/2012
 Příloha č.2 k rozhodnutí o změně registrace sp.zn.sukls251828/2012 1. NÁZEV PŘÍPRAVKU Madopar HBS tvrdé tobolky s řízeným uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Levodopum
Příloha č.2 k rozhodnutí o změně registrace sp.zn.sukls251828/2012 1. NÁZEV PŘÍPRAVKU Madopar HBS tvrdé tobolky s řízeným uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Levodopum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls120720/2011
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls120720/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Madopar 250 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Levodopum 200 mg, Benserazidi
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls120720/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Madopar 250 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Levodopum 200 mg, Benserazidi
Příbalová informace: informace pro uživatele. Madopar 250 tablety. Levodopum, benserazidum
 sp.zn. sukls238937/2015 Příbalová informace: informace pro uživatele Madopar 250 tablety Levodopum, benserazidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn. sukls238937/2015 Příbalová informace: informace pro uživatele Madopar 250 tablety Levodopum, benserazidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
Protokol o začatí, kontrole a zmene liečby psoriatickej artritídy
 Zdravotná poisťovňa: Všeobecná zdravotná poisťovňa Kód zdravotnej poisťovne: 25 Protokol o začatí, kontrole a zmene liečby psoriatickej artritídy Liečba: začatie liečby pokračovanie liečby zmena biologickej
Zdravotná poisťovňa: Všeobecná zdravotná poisťovňa Kód zdravotnej poisťovne: 25 Protokol o začatí, kontrole a zmene liečby psoriatickej artritídy Liečba: začatie liečby pokračovanie liečby zmena biologickej
Lifestyle drugs NOOTROPIKÁ. PharmDr. Zuzana Klimaszová
 Lifestyle drugs NOOTROPIKÁ PharmDr. Zuzana Klimaszová PSYCHOFARMAKÁ rozdelenie Neuroleptiká Antidepresíva Anxiolytiká a Sedatíva Psychodysleptiká Psychostimulanciá (NOOTROPIKÁ) PSYCHOSTIMULANCIÁ charakteristika
Lifestyle drugs NOOTROPIKÁ PharmDr. Zuzana Klimaszová PSYCHOFARMAKÁ rozdelenie Neuroleptiká Antidepresíva Anxiolytiká a Sedatíva Psychodysleptiká Psychostimulanciá (NOOTROPIKÁ) PSYCHOSTIMULANCIÁ charakteristika
Písomná informácia pre používateľa. Marixino 10 mg filmom obalené tablety memantínchlorid
 Písomná informácia pre používateľa Marixino 10 mg filmom obalené tablety memantínchlorid Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre vás dôležité
Písomná informácia pre používateľa Marixino 10 mg filmom obalené tablety memantínchlorid Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre vás dôležité
Príloha III. Úpravy príslušných častí súhrnu charakteristických vlastností lieku, označenia na obale a písomnej informácie pre používateľov
 Príloha III Úpravy príslušných častí súhrnu charakteristických vlastností lieku, označenia na obale a písomnej informácie pre používateľov 20 SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU [je potrebné vložiť
Príloha III Úpravy príslušných častí súhrnu charakteristických vlastností lieku, označenia na obale a písomnej informácie pre používateľov 20 SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU [je potrebné vložiť
Všeobecne záväzné nariadenie Mesta Trenčianske Teplice č. x/2016 o používaní pyrotechnických výrobkov na území mesta Trenčianske Teplice
 Dôvodová správa S účinnosťou k 2.12.2015 došlo k zmene zákona č. 58/2014 Z. z. o výbušninách, výbušných predmetoch a munícii a o zmene a doplnení niektorých zákonov v znení neskorších predpisov, ktorý
Dôvodová správa S účinnosťou k 2.12.2015 došlo k zmene zákona č. 58/2014 Z. z. o výbušninách, výbušných predmetoch a munícii a o zmene a doplnení niektorých zákonov v znení neskorších predpisov, ktorý
Urinfekt test infekcie močových ciest
 Urinfekt test infekcie močových ciest Urinfekt test infekcie močových ciest (IMC) patria spolu s respiračnými infekciami k najčastejším zápalovým ochoreniam, ktoré sa vyskytujú v priebehu celého života
Urinfekt test infekcie močových ciest Urinfekt test infekcie močových ciest (IMC) patria spolu s respiračnými infekciami k najčastejším zápalovým ochoreniam, ktoré sa vyskytujú v priebehu celého života
Analýza rizík a kontrolné opatrenia
 Analýza rizík a kontrolné opatrenia Monika Karácsonyová Karol Munka 2. workshop k projektu SK0135 30.3.2011 VÚVH Bratislava Analýza rizík systematický proces využívania dostupných informácií na identifikovanie
Analýza rizík a kontrolné opatrenia Monika Karácsonyová Karol Munka 2. workshop k projektu SK0135 30.3.2011 VÚVH Bratislava Analýza rizík systematický proces využívania dostupných informácií na identifikovanie
Dusičnany v pitnej vode
 Dusičnany v pitnej vode Povolenú hodnotu dusičnanov v pitnej vode stanovuje NV SR č. 354/2006 Z.z. (platné znenie) a určuje medznú hodnotu pre ukazovateľ dusičnany najviac 50 mg.l -1. Prípustnú hodnotu
Dusičnany v pitnej vode Povolenú hodnotu dusičnanov v pitnej vode stanovuje NV SR č. 354/2006 Z.z. (platné znenie) a určuje medznú hodnotu pre ukazovateľ dusičnany najviac 50 mg.l -1. Prípustnú hodnotu
Protokol o začatí a kontrole liečby závažnej osteoporózy liekom
 Zdravotná poisťovňa: Kód zdravotnej poisťovne: Protokol o začatí a kontrole liečby závažnej osteoporózy liekom Liečba začatie liečby pokračova liečby ukonče liečby Meno, priezvisko a špecializácia navrhujúceho
Zdravotná poisťovňa: Kód zdravotnej poisťovne: Protokol o začatí a kontrole liečby závažnej osteoporózy liekom Liečba začatie liečby pokračova liečby ukonče liečby Meno, priezvisko a špecializácia navrhujúceho
Sledovanie nadčasov, vyšetrenia zamestnanca a sprievodu
 Sledovanie nadčasov, vyšetrenia zamestnanca a sprievodu a) sledovanie nadčasov všeobecne za celú firmu alebo osobitne u každého zamestnanca V menu Firma Nastavenia na karte Upozornenia je možné hromadne
Sledovanie nadčasov, vyšetrenia zamestnanca a sprievodu a) sledovanie nadčasov všeobecne za celú firmu alebo osobitne u každého zamestnanca V menu Firma Nastavenia na karte Upozornenia je možné hromadne
Písomná informácia pre používateľa
 Písomná informácia pre používateľa Oprymea 0,088 mg tablety Oprymea 0,18 mg tablety Oprymea 0,35 mg tablety Oprymea 0,7 mg tablety Oprymea 1,1 mg tablety pramipexol Pozorne si prečítajte celú písomnú informáciu
Písomná informácia pre používateľa Oprymea 0,088 mg tablety Oprymea 0,18 mg tablety Oprymea 0,35 mg tablety Oprymea 0,7 mg tablety Oprymea 1,1 mg tablety pramipexol Pozorne si prečítajte celú písomnú informáciu
(REF: ARV-HA-3 / REF: ARV-HA-1)
 Hyaluronát sodný 2% (REF: ARV-HA-3 / REF: ARV-HA-1) OBSAH, ref. ARV-HA-3 OBSAH, ref. ARV-HA-1 3 ArthroVisc injekčné striekačky 1 ArthroVisc injekčná striekačka 3 zarážky prsta 1 zarážka prsta Ver.4.X /
Hyaluronát sodný 2% (REF: ARV-HA-3 / REF: ARV-HA-1) OBSAH, ref. ARV-HA-3 OBSAH, ref. ARV-HA-1 3 ArthroVisc injekčné striekačky 1 ArthroVisc injekčná striekačka 3 zarážky prsta 1 zarážka prsta Ver.4.X /
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU. Každá tableta obsahuje 157,36 mg dihydrátu zinkumorotátu (zodpovedá 25 mg zinku).
 Schválený text k rozhodnutiu o prevode, ev.č. 2012/07128 Príloha č. 2 k notifikácii zmeny v registrácii lieku, ev.č. 2012/07129 1. NÁZOV LIEKU Zinkorot tablety SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
Schválený text k rozhodnutiu o prevode, ev.č. 2012/07128 Príloha č. 2 k notifikácii zmeny v registrácii lieku, ev.č. 2012/07129 1. NÁZOV LIEKU Zinkorot tablety SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
Osoba podľa 8 zákona finančné limity, pravidlá a postupy platné od
 A. Právny rámec Osoba podľa 8 zákona finančné limity, pravidlá a postupy platné od 18. 4. 2016 Podľa 8 ods. 1 zákona č. 343/2015 Z. z. o verejnom obstarávaní a o zmene a doplnení niektorých zákonov v znení
A. Právny rámec Osoba podľa 8 zákona finančné limity, pravidlá a postupy platné od 18. 4. 2016 Podľa 8 ods. 1 zákona č. 343/2015 Z. z. o verejnom obstarávaní a o zmene a doplnení niektorých zákonov v znení
Výprava do kosti: Najčastejším ochorením kostí na svete je osteoporóza.
 Výprava do kosti: Kosť je živé tkanivo. Ako mnohé ďalšie tkanivá v tele, aj kostra sa počas života potrebuje neustále obnovovať. Celá kostra dospelého človeka sa kompletne obnoví v priebehu 7 10 rokov.
Výprava do kosti: Kosť je živé tkanivo. Ako mnohé ďalšie tkanivá v tele, aj kostra sa počas života potrebuje neustále obnovovať. Celá kostra dospelého človeka sa kompletne obnoví v priebehu 7 10 rokov.
Podpora kognitívnych funkcií v rámci asistovaného samoliečenia
 Podpora kognitívnych funkcií v rámci asistovaného samoliečenia Peter Stanko ADC Solutions, spol. s r. o. Prezentácia bola pripravená v spolupráci so spoločnosťou EGIS SLOVAKIA Dispenzačná starostlivosť
Podpora kognitívnych funkcií v rámci asistovaného samoliečenia Peter Stanko ADC Solutions, spol. s r. o. Prezentácia bola pripravená v spolupráci so spoločnosťou EGIS SLOVAKIA Dispenzačná starostlivosť
MAVENCLAD. Príručka pre pacientov Verzia 1.3, 18. jún 2017
 MAVENCLAD Príručka pre pacientov Verzia 1.3, 18. jún 2017 Dôležité informácie pre pacientov začínajúcich liečbu MAVENCLADOM OBSAH Úvod k MAVENCLADU Ako sa podáva MAVENCLAD? Vedľajšie účinky a možné riziká
MAVENCLAD Príručka pre pacientov Verzia 1.3, 18. jún 2017 Dôležité informácie pre pacientov začínajúcich liečbu MAVENCLADOM OBSAH Úvod k MAVENCLADU Ako sa podáva MAVENCLAD? Vedľajšie účinky a možné riziká
II. Európsky kongres hokejovej medicíny, Bratislava Kanabis a šport. Jindra Valentová. Farmaceutická fakulta Univerzita Komenského v Bratislave
 II. Európsky kongres hokejovej medicíny, Bratislava 2016 Kanabis a šport Jindra Valentová Farmaceutická fakulta Univerzita Komenského v Bratislave KANABIS Najrozšírenejšia a najužívanejšia omamná droga
II. Európsky kongres hokejovej medicíny, Bratislava 2016 Kanabis a šport Jindra Valentová Farmaceutická fakulta Univerzita Komenského v Bratislave KANABIS Najrozšírenejšia a najužívanejšia omamná droga
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o změně registrace sp.zn. sukls31224-5/2009, příloha k sp.zn. sukls31221/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Levodopa-Benserazide Teva 100/25 mg tvrdé tobolky Levodopa-Benserazide
Příloha č. 3 k rozhodnutí o změně registrace sp.zn. sukls31224-5/2009, příloha k sp.zn. sukls31221/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Levodopa-Benserazide Teva 100/25 mg tvrdé tobolky Levodopa-Benserazide
VESTNÍK MINISTERSTVA ZDRAVOTNÍCTVA SLOVENSKEJ REPUBLIKY
 VESTNÍK MINISTERSTVA ZDRAVOTNÍCTVA SLOVENSKEJ REPUBLIKY Čiastka 7- Dňa 2. apríla 1997 Ročník 45 OBSAH: Oznamovacia časť: Odporúčame výživové dávky pre obyvateľstvo v Slovenskej republike Národný plán rozvoja
VESTNÍK MINISTERSTVA ZDRAVOTNÍCTVA SLOVENSKEJ REPUBLIKY Čiastka 7- Dňa 2. apríla 1997 Ročník 45 OBSAH: Oznamovacia časť: Odporúčame výživové dávky pre obyvateľstvo v Slovenskej republike Národný plán rozvoja
Biele až sivobiele, okrúhle, ploché, skosené tablety, s vtlačeným GIL a 1 na jednej strane a hladké na druhej strane.
 SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU AZILECT 1 mg tablety 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Každá tableta obsahuje 1 mg rasagilínu (ako mesilát). Úplný zoznam pomocných látok,
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU AZILECT 1 mg tablety 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Každá tableta obsahuje 1 mg rasagilínu (ako mesilát). Úplný zoznam pomocných látok,
Autizmus, tráviace funkcie a vplyv probiotík
 Autizmus, tráviace funkcie a vplyv probiotík K. Babinská, S. Lakatošová, A. Tomova, V. Husárová, A. Pivovarčiová, J. Bakoš, A. Harinek, L. Slobodníková, V. Piačková, A. Gvozdjáková, M. Bucová, A. Čorejová,
Autizmus, tráviace funkcie a vplyv probiotík K. Babinská, S. Lakatošová, A. Tomova, V. Husárová, A. Pivovarčiová, J. Bakoš, A. Harinek, L. Slobodníková, V. Piačková, A. Gvozdjáková, M. Bucová, A. Čorejová,
5.3.3 Vyhlásenie na zdanenie príjmov zo závislej činnosti
 časť 5. diel 3. kapitola 3 str. 1 5.3.3 Vyhlásenie na zdanenie príjmov zo závislej činnosti Výška preddavku na daň závisí od toho, či má zamestnanec u zamestnávateľa podpísané vyhlásenie na zdanenie príjmov
časť 5. diel 3. kapitola 3 str. 1 5.3.3 Vyhlásenie na zdanenie príjmov zo závislej činnosti Výška preddavku na daň závisí od toho, či má zamestnanec u zamestnávateľa podpísané vyhlásenie na zdanenie príjmov
OCHRANA INOVÁCIÍ PROSTREDNÍCTVOM OBCHODNÝCH TAJOMSTIEV A PATENTOV: DETERMINANTY PRE FIRMY EURÓPSKEJ ÚNIE ZHRNUTIE
 OCHRANA INOVÁCIÍ PROSTREDNÍCTVOM OBCHODNÝCH TAJOMSTIEV A PATENTOV: DETERMINANTY PRE FIRMY EURÓPSKEJ ÚNIE ZHRNUTIE júl 2017 OCHRANA INOVÁCIÍ PROSTREDNÍCTVOM OBCHODNÝCH TAJOMSTIEV A PATENTOV: DETERMINANTY
OCHRANA INOVÁCIÍ PROSTREDNÍCTVOM OBCHODNÝCH TAJOMSTIEV A PATENTOV: DETERMINANTY PRE FIRMY EURÓPSKEJ ÚNIE ZHRNUTIE júl 2017 OCHRANA INOVÁCIÍ PROSTREDNÍCTVOM OBCHODNÝCH TAJOMSTIEV A PATENTOV: DETERMINANTY
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
 Schválený text k rozhodnutiu o zmene v registrácii, ev. číslo 2011/05744 a 2012/01053 SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU Duodopa intestinálny gél 20 mg/ml + 5 mg/ml 2. KVALITATÍVNE
Schválený text k rozhodnutiu o zmene v registrácii, ev. číslo 2011/05744 a 2012/01053 SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU Duodopa intestinálny gél 20 mg/ml + 5 mg/ml 2. KVALITATÍVNE
Písomná informácia pre používateľa. Nolicin 400 mg filmom obalené tablety norfloxacín
 Príloha č.2 k notifikácii o zmene, ev.č.: 2013/05931-ZIB, 2014/05865-ZIB Písomná informácia pre používateľa Nolicin 400 mg filmom obalené tablety norfloxacín Pozorne si prečítajte celú písomnú informáciu
Príloha č.2 k notifikácii o zmene, ev.č.: 2013/05931-ZIB, 2014/05865-ZIB Písomná informácia pre používateľa Nolicin 400 mg filmom obalené tablety norfloxacín Pozorne si prečítajte celú písomnú informáciu
Náhla cievna mozgová príhoda
 Náhla cievna mozgová príhoda Náhla cievna mozgová príhoda Náhla cievna mozgová príhoda predstavuje 3. najčastejšiu príčinu úmrtí Je akútnym prejavom cievneho ochorenia mozgu (COM) alebo KVS. Vyžaduje neodkladnú
Náhla cievna mozgová príhoda Náhla cievna mozgová príhoda Náhla cievna mozgová príhoda predstavuje 3. najčastejšiu príčinu úmrtí Je akútnym prejavom cievneho ochorenia mozgu (COM) alebo KVS. Vyžaduje neodkladnú
Vplyv konzumácie ovocia a zeleniny na výskyt metabolického syndrómu u klientov poradne zdravia
 Regionálny úrad verejného zdravotníctva so sídlom v Košiciach, Odbor podpory zdravia Vplyv konzumácie ovocia a zeleniny na výskyt metabolického syndrómu u klientov poradne zdravia Seminár pre MTP pracovníkov,
Regionálny úrad verejného zdravotníctva so sídlom v Košiciach, Odbor podpory zdravia Vplyv konzumácie ovocia a zeleniny na výskyt metabolického syndrómu u klientov poradne zdravia Seminár pre MTP pracovníkov,
Astronomická fotografia -- kuchárka pre digitálnu fotografiu
 Astronomická fotografia -- kuchárka pre digitálnu fotografiu Peter Delinčák, sekcia astronomickej fotografie SAS Úvodom S príchodom digitálnych fotoaparátov sa otvorili nové možnosti pre astronomickú fotografiu.
Astronomická fotografia -- kuchárka pre digitálnu fotografiu Peter Delinčák, sekcia astronomickej fotografie SAS Úvodom S príchodom digitálnych fotoaparátov sa otvorili nové možnosti pre astronomickú fotografiu.
Smernica k poskytovaniu stravných lístkov. č. 04/01/2013
 ZÁKLADNÁ ŠKOLA S MATERSKOU ŠKOLOU, ANDREJA KUBINU 34, TRNAVA Smernica k poskytovaniu stravných lístkov č. 04/01/2013 Dátum zavedenia: 01.01.2013 Schválené: Mgr. Jozef Jankovič riaditeľ školy OBSAH 1. Právne
ZÁKLADNÁ ŠKOLA S MATERSKOU ŠKOLOU, ANDREJA KUBINU 34, TRNAVA Smernica k poskytovaniu stravných lístkov č. 04/01/2013 Dátum zavedenia: 01.01.2013 Schválené: Mgr. Jozef Jankovič riaditeľ školy OBSAH 1. Právne
Činnosť dermatovenerologických ambulancií v SR 2015
 Štatistické prehľady Činnosť dermatovenerologických ambulancií v SR 2015 Prehľad informuje o výsledkoch štatistického zisťovania na základe ročného výkazu o činnosti dermatovenerologickej ambulancie A
Štatistické prehľady Činnosť dermatovenerologických ambulancií v SR 2015 Prehľad informuje o výsledkoch štatistického zisťovania na základe ročného výkazu o činnosti dermatovenerologickej ambulancie A
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 1. NÁZOV LIEKU Vermox 100 mg, tablety SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE LIEKU Liečivo: mebendazol 100 mg v jednej tablete. Pomocná látka so známym účinkom:
1. NÁZOV LIEKU Vermox 100 mg, tablety SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE LIEKU Liečivo: mebendazol 100 mg v jednej tablete. Pomocná látka so známym účinkom:
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV. Hidrasec pre deti 30 mg granulát na perorálnu suspenziu. Racekadotril
 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Hidrasec pre deti 30 mg granulát na perorálnu suspenziu Racekadotril Pozorne si prečítajte celú písomnú informáciu predtým, než začnete užívať tento liek, pretože obsahuje
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Hidrasec pre deti 30 mg granulát na perorálnu suspenziu Racekadotril Pozorne si prečítajte celú písomnú informáciu predtým, než začnete užívať tento liek, pretože obsahuje
Ako zamedziť tvorbe plesní v byte?
 Ako zamedziť tvorbe plesní v byte? Obvodové steny mnohých bytových domov postavených pred rokom 1991 (najmä panelových) majú nedostatočné tepelnoizolačné vlastnosti a nízku priepustnosť vodných pár. V
Ako zamedziť tvorbe plesní v byte? Obvodové steny mnohých bytových domov postavených pred rokom 1991 (najmä panelových) majú nedostatočné tepelnoizolačné vlastnosti a nízku priepustnosť vodných pár. V
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 Príloha č. 2 k notifikácii o zmene, ev. č.: 2015/01588 - Z1B SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU ERDOMED 300 mg tvrdé kapsuly 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Každá kapsula
Príloha č. 2 k notifikácii o zmene, ev. č.: 2015/01588 - Z1B SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU ERDOMED 300 mg tvrdé kapsuly 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Každá kapsula
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls42544-6/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pexogies 0,088 mg tablety Pexogies 0,18 mg tablety Pexogies 0,7 mg tablety 2. KVALITATIVNÍ A
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls42544-6/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pexogies 0,088 mg tablety Pexogies 0,18 mg tablety Pexogies 0,7 mg tablety 2. KVALITATIVNÍ A
Činnosť kardiologických ambulancií v SR 2016
 Štatistické prehľady Činnosť kardiologických ambulancií v SR 2016 Prehľad prináša výsledky štatistického zisťovania na základe ročného výkazu o činnosti kardiologickej A (MZ SR) 17-01 za rok 2016 realizovaného
Štatistické prehľady Činnosť kardiologických ambulancií v SR 2016 Prehľad prináša výsledky štatistického zisťovania na základe ročného výkazu o činnosti kardiologickej A (MZ SR) 17-01 za rok 2016 realizovaného
Odpočet daňovej straty po Ing. Mgr. Martin Tužinský, PhD.
 Odpočet daňovej straty po 1.1.2014 Ing. Mgr. Martin Tužinský, PhD. Odpočet daňovej straty Možnosť a pravidlá odpočítania daňovej straty od základu dane z príjmov v nasledujúcich zdaňovacích obdobiach sú
Odpočet daňovej straty po 1.1.2014 Ing. Mgr. Martin Tužinský, PhD. Odpočet daňovej straty Možnosť a pravidlá odpočítania daňovej straty od základu dane z príjmov v nasledujúcich zdaňovacích obdobiach sú
P R O G R A M SEMINÁROV A PRAKTICKÝCH CVIČENÍ z predmetu Lekárska biochémia pre študijný program VŠEOBECNÉ LEKÁRSTVO
 P R O G R A M SEMINÁROV A PRAKTICKÝCH CVIČENÍ z predmetu Lekárska biochémia pre študijný program VŠEOBECNÉ LEKÁRSTVO 1. TÝŽDEŇ Téma: VITAMÍNY Vitamíny. Rozdelenie vitamínov a ich význam vo funkčných a
P R O G R A M SEMINÁROV A PRAKTICKÝCH CVIČENÍ z predmetu Lekárska biochémia pre študijný program VŠEOBECNÉ LEKÁRSTVO 1. TÝŽDEŇ Téma: VITAMÍNY Vitamíny. Rozdelenie vitamínov a ich význam vo funkčných a
ELEKTROKONVULZÍVNA TERAPIA PRÍRUČKA PRE PACIENTOV
 ELEKTROKONVULZÍVNA TERAPIA PRÍRUČKA PRE PACIENTOV 1 2 Milí pacienti, v súčasnosti absolvuje elektrokonvulzívnu liečbu ročne približne 1 milión ľudí na celom svete. Jej účinnosť je veľmi vysoká a pri niektorých
ELEKTROKONVULZÍVNA TERAPIA PRÍRUČKA PRE PACIENTOV 1 2 Milí pacienti, v súčasnosti absolvuje elektrokonvulzívnu liečbu ročne približne 1 milión ľudí na celom svete. Jej účinnosť je veľmi vysoká a pri niektorých
Manuál Generovanie prístupových práv E-Recept
 Manuál Generovanie prístupových práv E-Recept Obsah Čo je e-recept... 2 Online pobočka správa prístupov... 3 Aktivácia registrovaného používateľa... 4 Pridaj nového neregistrovaného používateľa... 5 Zabudnuté
Manuál Generovanie prístupových práv E-Recept Obsah Čo je e-recept... 2 Online pobočka správa prístupov... 3 Aktivácia registrovaného používateľa... 4 Pridaj nového neregistrovaného používateľa... 5 Zabudnuté
Písomná informácia pre používateľa. STADATUSSIN perorálny roztok 1,35 mg/ml. pentoxyverín
 Schválený text k rozhodnutiu o registrácii, ev. č.: 2015/04605-REG Písomná informácia pre používateľa STADATUSSIN perorálny roztok 1,35 mg/ml pentoxyverín Pozorne si prečítajte celú písomnú informáciu
Schválený text k rozhodnutiu o registrácii, ev. č.: 2015/04605-REG Písomná informácia pre používateľa STADATUSSIN perorálny roztok 1,35 mg/ml pentoxyverín Pozorne si prečítajte celú písomnú informáciu
Analýza dopravnej situácie v SR
 Analýza dopravnej situácie v SR Príloha č. 4 Nehodovosť Dopravná nehodovosť na pozemných komunikáciách predstavuje dôležitý ukazovateľ úrovne cestných podmienok (stavebno-technického stavu) a premávkových
Analýza dopravnej situácie v SR Príloha č. 4 Nehodovosť Dopravná nehodovosť na pozemných komunikáciách predstavuje dôležitý ukazovateľ úrovne cestných podmienok (stavebno-technického stavu) a premávkových
úzkosť Aby sme si rozumeli
 a Aby sme si rozumeli úzkosť (z latinčiny - anxieta) nie je strach pri strachu vieme, čoho sa bojíme, úzkosť je menej jasná; niekedy sa bojíme úzkosti nepríjemné pocity: napätie; tlak v žalúdku; brnenie
a Aby sme si rozumeli úzkosť (z latinčiny - anxieta) nie je strach pri strachu vieme, čoho sa bojíme, úzkosť je menej jasná; niekedy sa bojíme úzkosti nepríjemné pocity: napätie; tlak v žalúdku; brnenie
PLASTOVÉ KARTY ZÁKAZNÍKOV
 PLASTOVÉ KARTY ZÁKAZNÍKOV OBSAH 1 Plastové karty základné informácie... 1 2 Distribúcia plastových kariet zákazníkom... 1 2.1 Jednorázová hromadná distribúcia kariet... 1 2.2 Pravidelná distribúcia plastových
PLASTOVÉ KARTY ZÁKAZNÍKOV OBSAH 1 Plastové karty základné informácie... 1 2 Distribúcia plastových kariet zákazníkom... 1 2.1 Jednorázová hromadná distribúcia kariet... 1 2.2 Pravidelná distribúcia plastových
Plán riadenia rizík (RMP)
 Plán riadenia rizík (RMP) PharmDr. M. Verčinská, PhD. RNDr. T. Magálová Tematický kurz SARAP Bratislava, 7.04.2017 Obsah Legislatíva Základné pojmy Cieľ a štruktúra RMP Bezpečnostná špecifikácia Opatrenia
Plán riadenia rizík (RMP) PharmDr. M. Verčinská, PhD. RNDr. T. Magálová Tematický kurz SARAP Bratislava, 7.04.2017 Obsah Legislatíva Základné pojmy Cieľ a štruktúra RMP Bezpečnostná špecifikácia Opatrenia
Pravidlá marketingovej akcie Tablety
 Pravidlá marketingovej akcie Tablety I. Organizátor Usporiadateľom súťaže je mbank SPÒŁKA AKCYJNA, akciová spoločnosť so sídlom Senatorska 18, Varšava, 00-950, Identifikačné číslo: 001254524, zapísaná
Pravidlá marketingovej akcie Tablety I. Organizátor Usporiadateľom súťaže je mbank SPÒŁKA AKCYJNA, akciová spoločnosť so sídlom Senatorska 18, Varšava, 00-950, Identifikačné číslo: 001254524, zapísaná
ODPORÚČANIE KOMISIE. z o podávaní správ o kontrolách týkajúcich sa cestnej prepravy nebezpečného tovaru
 SK SK SK EURÓPSKA KOMISIA Brusel, 21.2.2011 K(2011) 909 v konečnom znení ODPORÚČANIE KOMISIE z 21.2.2011 o podávaní správ o kontrolách týkajúcich sa cestnej prepravy nebezpečného tovaru SK SK ODPORÚČANIE
SK SK SK EURÓPSKA KOMISIA Brusel, 21.2.2011 K(2011) 909 v konečnom znení ODPORÚČANIE KOMISIE z 21.2.2011 o podávaní správ o kontrolách týkajúcich sa cestnej prepravy nebezpečného tovaru SK SK ODPORÚČANIE
w w w. a l z h e i m e r. s k
 Čo je Alzheimerova choroba? Degeneratívne ochorenie mozgu, pri ktorom dochádza k zániku mozgových buniek a ku zmene látkovej premeny v mozgu. Je to najčastejšia forma demencie - spôsobuje poruchy mozgu
Čo je Alzheimerova choroba? Degeneratívne ochorenie mozgu, pri ktorom dochádza k zániku mozgových buniek a ku zmene látkovej premeny v mozgu. Je to najčastejšia forma demencie - spôsobuje poruchy mozgu
Písomná informácia pre používateľku. Escepran 25 mg filmom obalené tablety exemestan
 Príloha č.2 k notifikácii o zmene, ev.č.: 2016/02506-Z1B Písomná informácia pre používateľku Escepran 25 mg filmom obalené tablety exemestan Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete
Príloha č.2 k notifikácii o zmene, ev.č.: 2016/02506-Z1B Písomná informácia pre používateľku Escepran 25 mg filmom obalené tablety exemestan Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
VYHODNOTENIE ANONYMNÉHO DOTAZNÍKA ŽIAKOV V ŠKOLSKEJ JEDÁLNI ZŠ s MŠ FRANCISCIHO V POPRADE ZA ŠK. ROK 2014/2015
 VYHODNOTENIE ANONYMNÉHO DOTAZNÍKA ŽIAKOV V ŠKOLSKEJ JEDÁLNI ZŠ s MŠ FRANCISCIHO V POPRADE ZA ŠK. ROK 2014/2015 V čase od 8.6.2015 do 20.6.2015 tak ako každý rok prebehli v každej triede tematické besedy
VYHODNOTENIE ANONYMNÉHO DOTAZNÍKA ŽIAKOV V ŠKOLSKEJ JEDÁLNI ZŠ s MŠ FRANCISCIHO V POPRADE ZA ŠK. ROK 2014/2015 V čase od 8.6.2015 do 20.6.2015 tak ako každý rok prebehli v každej triede tematické besedy
Zavádzanie centrálneho venózneho katétra. spracovala: Lucia Staroňová
 Zavádzanie centrálneho venózneho katétra spracovala: Lucia Staroňová Definícia Zavedenie centrálneho venózneho katétra (CVK ) je invazívny lekársky výkon, ktorý je súčasťou diagnosticko - terapeutického
Zavádzanie centrálneho venózneho katétra spracovala: Lucia Staroňová Definícia Zavedenie centrálneho venózneho katétra (CVK ) je invazívny lekársky výkon, ktorý je súčasťou diagnosticko - terapeutického
Program ovocie a zelenina do škôl Školské ovocie
 Program ovocie a zelenina do škôl Školské ovocie Cieľom predkladanej správy je opísať výsledky monitorovania údajov o spotrebe ovocia a zeleniny u detí, žiakov a rodičov (ďalej len monitorovanie) v Slovenskej
Program ovocie a zelenina do škôl Školské ovocie Cieľom predkladanej správy je opísať výsledky monitorovania údajov o spotrebe ovocia a zeleniny u detí, žiakov a rodičov (ďalej len monitorovanie) v Slovenskej
Podlimitná zákazka Verejný obstarávateľ
 Finančné limity platné a účinné po 1. marci 2015 Podlimitná zákazka Verejný obstarávateľ BEŽNE DOSTUPNÉ NA TRHU 1 000 eur < 134 000 eur b) bod 3. alebo c)] Stavebné práce 1 000 eur < 5 186 000 eur b) bod.
Finančné limity platné a účinné po 1. marci 2015 Podlimitná zákazka Verejný obstarávateľ BEŽNE DOSTUPNÉ NA TRHU 1 000 eur < 134 000 eur b) bod 3. alebo c)] Stavebné práce 1 000 eur < 5 186 000 eur b) bod.
Pivo. Návod na použitie PIVA. PaedDr. Vlado Zlatoš
 Pivo Návod na použitie PIVA. PaedDr. Vlado Zlatoš Čo je to pivo? základné suroviny: slad, chmeľ, voda fázy výroby: výroba mladiny, kvasenie, dokvasovanie, pasterizácia a stáčanie piva Existuje asi 24 druhov
Pivo Návod na použitie PIVA. PaedDr. Vlado Zlatoš Čo je to pivo? základné suroviny: slad, chmeľ, voda fázy výroby: výroba mladiny, kvasenie, dokvasovanie, pasterizácia a stáčanie piva Existuje asi 24 druhov
Písomná informácia pre používateľa. Sorvasta 15 mg. Sorvasta 10 mg. Sorvasta 20 mg Sorvasta 30 mg Sorvasta 40 mg. filmom obalené tablety.
 Príloha č.2 k notifikácii o zmene, ev. č: 2013/02835 Písomná informácia pre používateľa Sorvasta 5 mg Sorvasta 10 mg Sorvasta 15 mg Sorvasta 20 mg Sorvasta 30 mg Sorvasta 40 mg filmom obalené tablety rosuvastatín
Príloha č.2 k notifikácii o zmene, ev. č: 2013/02835 Písomná informácia pre používateľa Sorvasta 5 mg Sorvasta 10 mg Sorvasta 15 mg Sorvasta 20 mg Sorvasta 30 mg Sorvasta 40 mg filmom obalené tablety rosuvastatín
STAROSTLIVOSŤ O PACIENTA S ASTHMOU BRONCHIALE V AMBULANCII PRAKTICKÉHO LEKÁRA. MUDr. Iveta Vaverková ambulancia praktického lekára Bratislava
 STAROSTLIVOSŤ O PACIENTA S ASTHMOU BRONCHIALE V AMBULANCII PRAKTICKÉHO LEKÁRA MUDr. Iveta Vaverková ambulancia praktického lekára Bratislava ASTHMA BRONCHIALE Chronická zápalová choroba dýchacích ciest
STAROSTLIVOSŤ O PACIENTA S ASTHMOU BRONCHIALE V AMBULANCII PRAKTICKÉHO LEKÁRA MUDr. Iveta Vaverková ambulancia praktického lekára Bratislava ASTHMA BRONCHIALE Chronická zápalová choroba dýchacích ciest
REBRÍČKY. Predaj CD za mesiac 4U2Rock. Počet CD predaných za mesiac. K-Band D. A. R. Metalfolk. Mesiac
 Ukážky uvoľnených úloh z matematickej gramotnosti PISA 2012 REBRÍČKY V januári vyšli nové CD skupín 4U2Rock a K-Band. Vo februári nasledovali CD skupín D.A.R. a Metalfolk. V uvedenom grafe je znázornený
Ukážky uvoľnených úloh z matematickej gramotnosti PISA 2012 REBRÍČKY V januári vyšli nové CD skupín 4U2Rock a K-Band. Vo februári nasledovali CD skupín D.A.R. a Metalfolk. V uvedenom grafe je znázornený
Návrh postupu pre stanovenie počtu odborných zástupcov na prevádzkovanie verejných vodovodov a verejných kanalizácií v správe vodárenských spoločnosti
 1 Návrh postupu pre stanovenie počtu odborných zástupcov na prevádzkovanie verejných vodovodov a verejných kanalizácií v správe vodárenských spoločnosti Oprávnenie prevádzkovať verejný vodovod alebo verejnú
1 Návrh postupu pre stanovenie počtu odborných zástupcov na prevádzkovanie verejných vodovodov a verejných kanalizácií v správe vodárenských spoločnosti Oprávnenie prevádzkovať verejný vodovod alebo verejnú
Písomná informácia pre používateľa. DALACIN C 150 mg DALACIN C 300 mg tvrdé kapsuly. klindamycín
 Písomná informácia pre používateľa DALACIN C 150 mg DALACIN C 300 mg tvrdé kapsuly klindamycín Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre
Písomná informácia pre používateľa DALACIN C 150 mg DALACIN C 300 mg tvrdé kapsuly klindamycín Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre
Parikalcitol alebo cinakalcet s vitamínom D v liečbe sekundárnej hyperparatyreózy u dialyzovaných? Výsledky štúdie IMPACT SHPT
 Parikalcitol alebo cinakalcet s vitamínom D v liečbe sekundárnej hyperparatyreózy u dialyzovaných? Výsledky štúdie IMPACT SHPT Adrián Okša LF SZU Bratislava CKD MBD Biochemické zmeny P, Ca 1,25(OH)D PTH
Parikalcitol alebo cinakalcet s vitamínom D v liečbe sekundárnej hyperparatyreózy u dialyzovaných? Výsledky štúdie IMPACT SHPT Adrián Okša LF SZU Bratislava CKD MBD Biochemické zmeny P, Ca 1,25(OH)D PTH
Zákon č. 595/2003 Z. z. Dodatočné daňové priznanie k dani z príjmov právnickej osoby za rok 2015
 Dodatočné daňové priznanie k dani z príjmov právnickej osoby za rok 2015 1 povinnosť podať daňové priznanie (DP): podľa 15(1) daňového poriadku má každý, komu táto povinnosť vyplýva zo ZDP alebo ten, koho
Dodatočné daňové priznanie k dani z príjmov právnickej osoby za rok 2015 1 povinnosť podať daňové priznanie (DP): podľa 15(1) daňového poriadku má každý, komu táto povinnosť vyplýva zo ZDP alebo ten, koho
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 Príloha č. 1 k notifikácii o zmene: 2016/00414-Z1B SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU Amsidyl 75 mg/1,5 ml koncentrát a rozpúšťadlo na infúzny koncentrát 2. KVALITATÍVNE A KVANTITATÍVNE
Príloha č. 1 k notifikácii o zmene: 2016/00414-Z1B SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU Amsidyl 75 mg/1,5 ml koncentrát a rozpúšťadlo na infúzny koncentrát 2. KVALITATÍVNE A KVANTITATÍVNE
Písomná informácia pre používateľa. Asolfena 5 mg Asolfena 10 mg filmom obalené tablety. solifenacíniumsukcinát
 Schválený text k rozhodnutiu o predĺžení, ev. č.: 2014/07689-PRE, 2014/07690-PRE Písomná informácia pre používateľa Asolfena 5 mg Asolfena 10 mg filmom obalené tablety solifenacíniumsukcinát Pozorne si
Schválený text k rozhodnutiu o predĺžení, ev. č.: 2014/07689-PRE, 2014/07690-PRE Písomná informácia pre používateľa Asolfena 5 mg Asolfena 10 mg filmom obalené tablety solifenacíniumsukcinát Pozorne si
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU Xyzal 5 mg/10 ml perorálny roztok 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE 1 ml perorálneho roztoku obsahuje 0,5 mg levocetirizín dihydrochloridu.
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1. NÁZOV LIEKU Xyzal 5 mg/10 ml perorálny roztok 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE 1 ml perorálneho roztoku obsahuje 0,5 mg levocetirizín dihydrochloridu.
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV
 Príloha č. 2 k notifikácii o zmene v registrácii lieku, ev.č.: 2012/08201-Z1B PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Rolpryna SR 2 mg tablety s predĺženým uvoľňovaním Rolpryna SR 4 mg tablety s predĺženým
Príloha č. 2 k notifikácii o zmene v registrácii lieku, ev.č.: 2012/08201-Z1B PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Rolpryna SR 2 mg tablety s predĺženým uvoľňovaním Rolpryna SR 4 mg tablety s predĺženým
Finančné riaditeľstvo Slovenskej republiky
 Finančné riaditeľstvo Slovenskej republiky Informácia k zdaňovaniu príjmu zamestnanca pri poskytnutí motorového vozidla zamestnancovi na používanie na služobné aj súkromné účely upravený text zelenou farbou
Finančné riaditeľstvo Slovenskej republiky Informácia k zdaňovaniu príjmu zamestnanca pri poskytnutí motorového vozidla zamestnancovi na používanie na služobné aj súkromné účely upravený text zelenou farbou
Návod na vkladanie záverečných prác do AIS
 Návod na vkladanie záverečných prác do AIS Povinnosti študenta pri odovzdávaní záverečne práce do AIS: Študenti vkladajú záverečné práce do AIS sami a vypĺňajú aj Doplňujúce informácie ZP, vypĺňajú návrh
Návod na vkladanie záverečných prác do AIS Povinnosti študenta pri odovzdávaní záverečne práce do AIS: Študenti vkladajú záverečné práce do AIS sami a vypĺňajú aj Doplňujúce informácie ZP, vypĺňajú návrh
KONTROLA INTERAKCIÍ LIEKOV
 KONTROLA INTERAKCIÍ LIEKOV manuál pre pacienta www.interakcieliekov.sk www.interakcieliekov.sk 1. Aplikácia pre pacientov Pomocou aplikácie, ktorá sa nachádza na stránke www.interakcieliekov.sk je možné
KONTROLA INTERAKCIÍ LIEKOV manuál pre pacienta www.interakcieliekov.sk www.interakcieliekov.sk 1. Aplikácia pre pacientov Pomocou aplikácie, ktorá sa nachádza na stránke www.interakcieliekov.sk je možné
Smernica primátora č. 2/2011 o vykonávaní kontroly požívania alkoholu, omamných látok alebo psychotropných látok
 Smernica primátora č. 2/2011 o vykonávaní kontroly požívania alkoholu, omamných látok alebo psychotropných látok Primátor mesta Svidník podľa 13 odsek 4 písmeno e) zákona SNR č. 369/1990 Zb. o obecnom
Smernica primátora č. 2/2011 o vykonávaní kontroly požívania alkoholu, omamných látok alebo psychotropných látok Primátor mesta Svidník podľa 13 odsek 4 písmeno e) zákona SNR č. 369/1990 Zb. o obecnom
Streda o 14:00 hod.
 Odborné stretnutie so spolupracujúcimi špecialistami a všeobecnými praktickými lekármi pre dospelých s témami z oblasti nefrológie a dialýzy Dialyzačné stredisko BASK03 Bratislava B. Braun Avitum s.r.o.,
Odborné stretnutie so spolupracujúcimi špecialistami a všeobecnými praktickými lekármi pre dospelých s témami z oblasti nefrológie a dialýzy Dialyzačné stredisko BASK03 Bratislava B. Braun Avitum s.r.o.,
NOVÉ NARIADENIE EÚ O OCHRANE OSOBNÝCH ÚDAJOV v kontexte kybernetickej bezpečnosti. Brno, 31. mája 2017
 NOVÉ NARIADENIE EÚ O OCHRANE OSOBNÝCH ÚDAJOV v kontexte kybernetickej bezpečnosti Brno, 31. mája 2017 Nariadenie Európskeho parlamentu a rady (EÚ) 2016/679 Z 27. apríla 2016 o ochrane fyzických osôb pri
NOVÉ NARIADENIE EÚ O OCHRANE OSOBNÝCH ÚDAJOV v kontexte kybernetickej bezpečnosti Brno, 31. mája 2017 Nariadenie Európskeho parlamentu a rady (EÚ) 2016/679 Z 27. apríla 2016 o ochrane fyzických osôb pri
Písomná informácia pre používateľa. DALACIN V 2 % vaginálny krém klindamycín
 Schválený text k rozhodnutiu o zmene, ev. č.: 2011/05682, 2013/05546 Písomná informácia pre používateľa DALACIN V 2 % vaginálny krém klindamycín Pozorne si prečítajte celú písomnú informáciu predtým, ako
Schválený text k rozhodnutiu o zmene, ev. č.: 2011/05682, 2013/05546 Písomná informácia pre používateľa DALACIN V 2 % vaginálny krém klindamycín Pozorne si prečítajte celú písomnú informáciu predtým, ako
