Ontogenetický původ chrupavčitých elementů lebky axolotla
|
|
|
- Aleš Tobiška
- před 6 lety
- Počet zobrazení:
Transkript
1 UNIVERZITA KARLOVA V PRAZE PŘÍRODOVĚDECKÁ FAKULTA Katedra zoologie Ontogenetický původ chrupavčitých elementů lebky axolotla DIPLOMOVÁ PRÁCE Bc. Lenka Kloučková Vedoucí práce: Mgr. Robert Černý, Ph.D. PRAHA 2011
2 Prohlášení Prohlášení Prohlašuji, že jsem diplomovou práci vypracovala samostatně pod vedením Mgr. Roberta Černého, Ph.D. a s použitím citované literatury. V Praze dne
3 Poděkování Poděkování Chtěla bych tímto poděkovat svému školiteli Mgr. Robertu Černému, Ph.D. za pomoc, čas a cenné rady, které mi věnoval během řešení a sepisování mé diplomové práce. Dále chci poděkovat Mgr. Vladimíru Soukupovi za jeho ochotu, trpělivost a velkou pomoc, kterou mi věnoval během mého prvního pobytu v laboratoři v Drážďanech. V neposlední řadě bych také chtěla vyjádřit svůj vděk doktoru Hansu-Henningu Epperleinovi za umožnění práce v jeho laboratoři a jeho rady během ní. Děkuji svým rodičům, prarodičům a manželovi za podporu během celého studia. Dále bych chtěla poděkovat Fondu mobility University Karlovy za částečné financování mého pobytu v Dráždanech. 3
4 Obsah Obsah Obsah... 5 Abstrakt... 6 Abstract Úvod Cíle práce Hlava obratlovců Neurokranium Viscerokranium Viscerokranium Ambystoma mexicanum Dermatokranium Fate mapping Neurální lišta Metodika Práce s živými embryi Příprava embryí k transplantaci Vlastní transplantace Transplantace ve stadiu Transplantace ve stadiu Následná kontrola Příprava embryí na analýzu Převod vzorků do želatiny Analýza embryí Odželatinizování kryostatových řezů Imunohistochemické barvení Výsledky Ontogenetický původ chrupavek viscerokrania Transplantace celé hlavové neurální lišty Transplantace trigeminálního proudu neurální lišty
5 Obsah Transplantace hyoidního proudu neurální lišty Transplantace branchiálního proudu neurální lišty Zeleně značené buňky, které nemají původ v neurální liště Ostatní struktury vznikající z buněk hlavové neurální lišty Další výsledky Diskuse Většina chrupavčitých elementů viscerokrania pochází z neurální lišty Basibranchiale 2 nemá původ v neurální liště Dvojí původ basibranchiale Plasticita buněk neurální lišty může negativně ovlivňovat výsledky Buňky neurální lišty jednoho proudu mohou tvořit pojivové tkáně v sousední oblasti Intertrabekula Neurální lišta může přispívat do nasální kapsule Buňky neurální lišty přispívají do chrupavčité otické kapsule Návrh práce do budoucna Závěr Vysvětlivky Citovaná literatura
6 Abstrakt Abstrakt Ačkoliv některé aspekty jednotlivých studií se liší, je všeobecně přijímán fakt, že chrupavčité elementy viscerokrania obratlovců mají svůj původ v buňkách neurální lišty. Ve své práci upřesňuji tento fakt na modelovém živočichovi Ambystoma mexicanum na základě isotopických a isochronických transplantací prekurzorů neurální lišty - neurálních valů, případně již uzavřené neurální trubice před odmigrováním buněk. Celkem jsem pro svůj výzkum provedla 179 transplantací. Analyzovala jsem poté 67 embryí ve stadiích a 7 larev o délce mm. Touto moderní metodou prokazuji, že ventro-kaudální element viscerokrania nemá původ v neurální liště. Dále potvrzuji a upřesňuji, ze které anterio-posteriorní úrovně neurálních valů, případně rhombomer zadního mozku vznikají jednotlivé proudy neurální lišty a následně viscerální chrupavky axolotla. Jeden z elementů, basibranchiale 1, má dokonce dvojí původ. Uvádím a diskutuji zde také některé další deriváty hlavové neurální lišty jako například mezenchym hlavy a vnějších žaber, trabekuly, část otické kapsule nebo pojivové tkáně v hlavě. Klíčová slova Chrupavka, viscerokranium, neurální lišta, zelený fluorescenční protein, axolotl mexický 6
7 Abstract Abstract Despite the fact that some aspects of single studies differ, there s a generally accepted view that the whole cartilaginous viscerocranium of vertebrates is neural crest derived. By the series of isotopic transplantation experiments of presumptive neural crest on the model organism Ambystoma mexicanum I partly specify this oppinion and prove that the most ventro-caudal cartilage, the second basibranchial, is of a different origin. Furher I mention the level of the presumptive neural crest where the single parts of cartilaginous viscerocranium arise from. Moreover there is one element, the first basibranchial, which has double origin. I discuss also some other neural crest derivatives such as head and outer gills mesenchyme, the trabeculae cranii, part of the cartilaginous otic capsule or the connective tissue in the head. I have performed 179 transplantations between transgenic and normal axolotl embryos. My final analysis is composed of 65 embryos of stage and 7 larvae of lenght of mm. Key words axolotl Cartilage, viscerocranium, neural crest, green fluorescent protein, mexican 7
8 Úvod 1. Úvod 1.1. Cíle práce Cílem této diplomové práce je ověření ontogenetického původu chrupavčitých struktur faryngeální oblasti modelového organismu Ambystoma mexicanum. Jelikož se obecně předpokládá, že chrupavky viscerokrania jsou tvořeny výhradně buňkami neurální lišty, jako další cíl si kladu přesnější určení toho, ze které rostro-kaudální úrovně hlavové neurální lišty pocházejí jednotlivé chrupavčité elementy. Dále jsem se zaměřila na plasticitu buněk neurální lišty. Metodou pro moji práci jsou isotopické transplantace částí neurálních valů, případně neurální trubice s buňkami neurální lišty. Díky dlouhodobé spolupráci mého školitele, doktora Roberta Černého a profesora Hanse Henninga Epperleina jsem měla skvělou příležitost práce v laboratoři v Drážďanech, kde je vše potřebné vybavení a především dostupný zdroj embryonálního materiálu pro mé experimenty. Pro svou práci jsem si vybrala embrya axolotla mexického Ambystoma mexicanum. Jednak kvůli jejich relativně velkým rozměrům a tudíž lepší manipulaci během operací, jednak kvůli jejich dobré dostupnosti v Max Planc institutu v Drážďanech, ale hlavně kvůli dostupnosti transgenní GFP+ formy, díky které je vnitrodruhová transplantace relativně velmi jednoduchou metodou značení buněk (viz kapitola 1.3. a 2.). V naší laboratoři na fakultě bohužel zatím nemůžeme pracovat s geneticky modifikovanými organismy, a proto pro mne byly experimenty prováděné přímo v Drážďanech nejschůdnější cestou Hlava obratlovců Hlava je unikátním znakem obratlovců, jejich evoluční novinkou, apomorfním znakem (kupř. Gans and Northcutt, 1983; Roček, 2002). Hlava poskytuje ochranu centrální nervové soustavě, nese hlavní smyslové orgány a faryngeální oblast jako její část zajišťuje důležité funkce, jako je přijímání potravy a dýchání. Podpůrnými elementy těchto funkcí u obojživelníků jsou před metamorfózou faryngeální chrupavky, které poskytují oporu svalům čelistí a branchiální oblasti. Můžeme tedy říct, že tyto chrupavky jsou prvními elementy, které zajišťují základní životní funkce obojživelníků. Obojživelníci jsou již dlouho 8
9 Úvod objektem evolučně-vývojových studií. Můžeme to přisoudit jejich nespočtu životních strategií a tomu, že právě oni jsou živočichy žijícími mezi vodou a souší. Díky nim můžeme poznat velkou část evoluce života na Zemi. Současně s hlavou se v evoluci obratlovců objevila i neurální lišta a neurální plakody (viz kapitola 1.4.) jako nový, nikoliv však výhradní zdroj buněčného materiálu pro tak významnou strukturu (Hall, 2005 srv. Jeffery et al., 2004). V roce 1983 byla publikována teorie Nové hlavy (Gans and Northcutt, 1983). Gans a Northcutt ve své práci, stručně řečeno, popsali klíčový význam neurální lišty, neurálních plakod a potažmo rostrální části hlavy pro evoluci obratlovců. Uvádějí, že tyto struktury se vyvinuly ve spojení s přechodem z jednoduchého získávání potravy nasáváním a filtrováním na aktivní predaci. Dále také to, že ta část lebky, která je souběžná s notochordem, je embryonálně tvořena buňkami mezodermu. Naopak prechordální část lebky má být tvořena buňkami neurální lišty (Gans and Northcutt, 1983). Jak dnes víme, tato teorie se shoduje se skutečností pouze částečně (viz níže) Neurokranium Hlavu můžeme rozdělit na několik topologických i funkčních částí. První z nich je neurokranium, tedy mozkovna. Její hlavní funkcí je chránit mozek a přidružené smyslové orgány. Nejpřednější část mozkovny, tzv. prechordální neurokranium má ontogenetický původ z buněk neurální lišty a tvoří ji prechordalia neboli trabekuly 1. Zbytek mozkovny je tvořen jednak buňkami původem z hlavového mezodermu, tedy parachordalii, dále senzorickými kapsulemi (olfaktorickou, optickou a otickou), a také mezodermem trupovým, původem ze sklerotomu somitů (Couly et al., 1993; Liem, 2001; Piekarski and Olsson, 2007). Senzorické kapsule mají původ mezodermální i z buněk neurální lišty (nasální a část otické kapsule) (podle Kardong, 1995). Prechordální kranium se nachází, jak napovídá název, před nejanteriornějším koncem notochordu. Bylo zjištěno, že tato část lebky nemůže být tvořena buňkami mezodermu (Gans and Northcutt, 1983), a to kvůli jeho 1 Trabekuly jsou problematickým článkem ve striktním oddělování neurokrania od viscerokrania. Můžeme je totiž počítat do obou těchto částí hlavy. K neurokraniu patří jednak z hlediska topologie a částečně i funkce- podílí se na pevné ochraně mozku. K viscerokraniu je však můžeme řadit také, a to hlavně díky tomu, že často zastupují funkci horní čelisti, ale i pro jejich původ v neurální liště. 9
10 Úvod neschopnosti tvořit chrupavky v nepřítomnosti signální molekuly sonic hedgehog, kterou exprimuje právě notochord (Kuratani et al., 2001). Proto se v evoluci pro ni musel vyvinout nový zdroj materiálu neurální lišta. Naopak parachordální kranium může být tvořeno buňkami z obou zdrojů neurální lišty i mezodermu. Neurokranium může být zaměněno s názvem chondrokranium (dle Kardong, 1995) Viscerokranium Druhým funkčním celkem hlavy je viscerokranium (jiným názvém též splanchnokranium). Jeho všeobecnou funkcí u čelistnatců je především zajištění opory žaber a dýchacích svalů. Jeho elementy dále tvoří čelisti a hyoidní aparát. Viscerokranium obratlovců sestává z faryngeálních (viscerálních) chrupavek, které u nejpůvodnějších obratlovců plnily pouze funkci podpory dýchacích orgánů, ale také faryngeálních svalů (např. Kardong, 1995). Chrupavky viscerokrania měly všechny snad původně stejný tvar a skládaly se z pěti párových a jednoho nepárového elementu. Tyto původní části se nazývají suprapharyngobranchiale, infrapharyngobranchiale, epibranchiale, ceratobranchiale, hypobranchiale a mediálně uložený nepárový element basibranchiale (Roček, 2002). Tyto části branchiálního koše byly ventrálně propojeny basibranchiálními elementy a dorsálně se připojovaly k chordě dorsalis pomocí supra a infrapharyngobranchiálií. Tvořily tedy celistvý branchiální koš (např. Kardong, 1995; Liem, 2001). Viscerokranium dnešních obratlovců vypadá však jinak, dorzální elementy jednotlivých oblouků se redukovaly a přeměnou některých celých viscerálních oblouků se pak vyvinuly čelisti, podpůrný aparát jazyka a středoušní kůstky. U recentních obratlovců se první, mandibulární oblouk viscerokrania přeměnil v čelisti. Ventrální element, nazývaný Meckelova chrupavka, typicky tvoří chrupavčitou spodní čelist. Dorzální element, palatoquadratum, zdaleka ne vždy tvoří horní čelist, protože může být pouze vertikální chrupavkou, která spojuje čelistní aparát s bazí neurokrania (tak je tomu i u obojživelníků). Horní čelist pak jednoduše tvoří přední část baze mozkovny, tedy trabekuly (později trabecula communis). Druhý, hyoidní (jazylkový) oblouk viscerokrania je přeměněn na tzv. jazylkový aparát oběcně tvoří oporu pro jazyk. Avšak jeho prominentní element, hyomandibula, spojuje u některých obratlovců čelisti s mozkovnou. Konkrétně u 10
11 Úvod obojživelníků hýbou elementy jazylkového oblouku spodinou ústní nahoru a dolů. Třetí a další faryngeální oblouky plní původní funkci, tedy jsou oporou dýchacím orgánům a nazýváme je branchiálními (u obojživelníků jsou celkem 4) (např. Kardong, 1995; Liem, 2001; Roček, 2002) Viscerokranium Ambystoma mexicanum Jelikož se má diplomová práce zabývá původem chrupavek viscerokrania u axolotla mexického, zmíním se o něm podrobněji. Axolotl Ambystoma mexicanum je odvozený ocasatý obojživelník s relativně jednoduchou stavbou viscerokrania. Mandibulární oblouk tvoří Meckelova chrupavka tvaru rozšířeného písmene U a palatoquadratum, které se nachází ve vertikální poloze. Ventrální část palatoquadrata (budoucí quadratum) je kloubně spojena s kaudálním koncem Meckelovy chrupavky (budoucím articulare) a tvoří spolu primární čelistní kloub. Opačným koncem je palatoquadratum spojeno s bazí neurokrania a zastupuje tak chybějící hyomandibulu v připojení spodní čelisti k mozkovně. Hyoidní oblouk je tvořen párovými elementy ceratohyale a hypohyale, druhé z nich se připojují ventrálním koncem k anteriorní části prvního basibranchiale. První branchiální oblouk tvoří párová ceratobranchialia a hypobranchialia, ventrálně je uložen nepárový mediální element basibranchiale Obr Chrupavčité viscerokranium Ambystoma mexicanum. Barveno pomocí Alciánové modři. Převzato a upraveno podle Cerny et al., 2004b. 1 (na jeho anteriorní část se pojí hypohyale, na jeho posteriorní část hypobranchiale 1). Druhý branchiální oblouk je tvořen stejně jako první, ale na basibranchiale 2 se pojí pouze anteriorně hypobranchiale 2. Třetí branchiální oblouk je dnes tvořen pouze ceratobranchialii, která se připojují na mediální konec ceratobranchiale 2. Čtvrtý branchiální oblouk je také tvořen ceratobranchialii, ta se však napojují na mediální část ceratobranchiale 3 (Reilly and Lauder, 1988). Basibranchiale 2 je 11
12 Úvod posazeno ventrálně pod basibranchiale1 tak, že posteriorní konec basibranchiale 1 shora překrývá anteriorní konec basibranchiale 2. Jak je vidět z obrázku 1.1. basibranchiale 2 vystupuje jako samostatná chrupavka relativně daleko kaudálně Dermatokranium Dermatokranium je, jak již název napovídá, ta část lebky, jejíž kosti vznikají dermální osifikací vaziva ve škáře. Je tedy tvořeno superficiálními kostmi, které téměř úplně překrývají původní chrupavky nebo kosti neurokrania a viscerokrania. Jedná se o kosti střechy lebeční, kosti patrové série, dermální čelistní kosti a u ryb dále kosti skřelové série Fate mapping Fate mapping neboli studování osudu buněčných linií je důležitý fenomén v evolučně-developmentálních studiích. Jedná se o souhrn metod, jejichž výsledkem by měl být popis buněčné linie, jejího chování a distribuce do ní náležejících buněk od jejího vzniku po určitý čas nebo do určené doby ve vývoji. V praxi to znamená vhodně označit konkrétní skupinu buněk v živém organismu a díky této značce sledovat vývoj, dělení a distribuci buněk této linie během dané doby. Metody fate mappingu se samozřejmě v průběhu času měnily a dá se předpokládat, že se dále měnit budou. Metoda mojí diplomové práce se taktéž řadí do kategorie fate mappingu. Vůbec nejjednodušší a první metodou fate mappingu je prosté sledování buněk v živém organismu pod mikroskopem. Osvědčila se především při pozorování embryí bezobratlých živočichů, která bývají průhledná, a proto můžeme sledovat jednotlivé buňky bez umělé značky 2. Tato metoda byla zdokonalena přidáním kamery, a tak bylo možné vůbec poprvé určit celou buněčnou linii živého organismu Caenorhabditis elegans (Maupas, 1900; Stern and Fraser, 2001). Dále se zmíním o metodách sledování osudu buněk neurální lišty, protože i já jsem sledovala právě tyto buňky. Další pozorovací metodou byla ta, kdy se využívalo specifických buněčných znaků v jednom organismu, jako třeba přítomnost žloutkových kapének nebo 2 Dalším živočichem, který se stal oblíbeným modelovým organismem (nejen) díky průhlednosti svých embryí a tím pádem lepší pozorovatelnosti buněk, je tzv, zebrafish Danio rerio (Hamilton-Buchanan, 1822). Embrya této rybky jsou kompletně transparentní celých prvních 24 hodin vývoje, jsou relativně velká a disponují i dalšími výhodami pro úspěšné vývojové studie.( Nüsslein-Volhard and Dahm, 2002) 12
13 Úvod pigmentu uvnitř buněk, pro identifikaci buněk jednotlivých linií. Ty se pak pozorovaly na řezech pod mikroskopem (kupř. De Beer, 1947). Na dnešní poměry relativně primitivní metodou byly embryonální extirpace. Jedná se o jednoduché odstranění části embryonální tkáně (části neurální lišty) a následné sledování vývojových abnormalit. Tato metoda však měla dvě obrovské nevýhody. První z nich byla vysoká úmrtnost takto operovaných embryí v důsledku příliš velkého zásahu do vývoje organismu. Druhým problémem byla nedůvěryhodnost výsledků. Na jednu stranu při odstranění příliš malé části tkáně jsou okolní buňky neurální lišty schopné úplně nebo částečně nahradit ztráty (Sadaghiani and Thiébaud, 1987; Wahl and Noden, 2001). Na druhou stranu odstraněním jakékoliv tkáně odstraníme také její indukční vliv na okolní buňky, a tím pádem případně nevyvinuté struktury nemusí být nutně původem z chybějící tkáně, ale mohou být touto extirpovanou tkání pouze indukovány (např. Hall, 1999). Mnohem pokročilejšími jsou různorodé metody značení a barvení buněk. Samozřejmě pro sledování celé buněčné linie potřebujeme takovou značku, která se bude přenášet i do dceřiných buněk původní označené populace, a to pokud možno co nejdéle. Z barvících metod jen krátce uvedu například vitální barviva, která mohou být rozpustná ve vodě nebo v tucích (ta jsou vhodnější). Do cílových buněk se tato barviva přenášejí dnes tzv. fokálními injekcemi (přímo do místa, kde chceme buňky označit) (Epperlein et al., 2000; Cerny et al., 2004a). Další značící technikou je radioaktivní značení buněk. Zásadní změnu ve fate mappingu, týkajícího se osudu buněk neurální lišty, přinesla převratná technika Nicole Le Douarin, která použila mezidruhové chiméry. Tato metoda spočívá v transplantaci části neurální lišty embrya jednoho druhu na odpovídající místo na embryu jiného druhu, kde byla předem odstraněna odpovídající tkáň. Díky specifických buněčným znakům pak můžeme pozorovat buňky donorového embrya v těle embrya, které transplantát přijalo (Le Liévre and Le Douarin, 1975; Le Douarin and Kalcheim, 1999). Při jejích pokusech tohoto druhu byla použita dárcovská embrya křepelky (Coturnix coturnix; Linnaeus, 1758) a hostitelská embrya kuřete (Gallus gallus; Linnaeus, 1758). Známe však mezidruhové chiméry dalších ptáků (Schneider and Helms, 2003; Tucker and Lumsden, 2004), žab (Sadaghiani and Thiébaud, 1987), ocasatých obojživelníků a dokonce chiméry mezi žábou a ocasatým obojživelníkem (Wagner, 1949 ex Hall, 13
14 Úvod 1999) nebo kuřetem a myší (Lwigale and Schneider, 2008). Při této technice fate mappingu však vždy musíme počítat s tím, že některé vlastnosti si nesou transplantované buňky s sebou a jiné vlastnosti jsou ovlivněny hostitelským prostředím, do kterého byly buňky přeneseny (Schneider and Helms, 2003). Tento problém se však dá jednoduše vyřešit, a to transplantacemi do příjemce stejného druhu, jako je druh dárcovský. Tím pádem ale musíme transplantované buňky označit jinak. Starší metodou, co se týče studia neurální lišty, je značení fluorescenčním dextranem, který se vpraví do embrya ve stadiu jedné buňky. Tento marker vydrží v buňkách organismu až několik měsíců a je možné ho pozorovat jak v živých, tak ve fixovaných vzorcích (Gross and Hanken, 2004, 2005). Novější metodou je ta, kdy transplantujeme část tkáně z dárcovského transgenního embrya, které ve všech svých buňkách exprimuje zelený (dnes již i jinak barevný) fluorescenční protein GFP (Borchers, Epperlein and Wedlich, 2000), do embrya normálního, případně albinotického (kupř. Soukup et al., 2009; Piekarski and Olsson, 2011). Jelikož fluorescenční protein buňka sama exprimuje během celého života, tento marker je dlouhotrvající, žádným způsobem se neředí, a při vhodném skladování je velmi dobře rozpoznatelný i po několika měsících po fixaci vzorků. V dnešní době není problém sehnat tato transgenní embrya, jelikož se pro vědecké účely komerčně chovají fluorescenční protein exprimují i jejich pohlavní buňky (Sobkow et al., 2006). Nespornou výhodou této metodiky je absence nepředvídatelných vlivů jako při transplantaci do příjemce jiného druhu. Můžeme takto transplantovat prakticky jakoukoliv tkáň, nebo třeba jen její malou část, a to ve stadiu, které si sami zvolíme. Díky všem zmíněným výhodám si troufám tvrdit, že metoda transplantací mezi transgenním a normálním embryem je dnes nepřekonanou, a to i přes nevýhodu, že ne vše, co později při analýze vykazuje signál, pochází bezesporu z původně transplantované tkáně (viz kapitola 3.2.). Jako další nevýhodu, kterou ale trpí všechny transplantační postupy, bych mohla uvést možnost ovlivnění výsledků v důsledku schopnosti okolní tkáně částečně nahrazovat ztráty (viz kapitola 4.4.). O původu GFP a zavedení takto transgenně upravených axolotlů se podrobněji zmiňuji ve své bakalářské práci (Fialová, 2009). Pro další postupy značení a pozorování migrujících buněk neurální lišty u ptáků viz také Guan, 2005, kapitola
15 Úvod O dalších způsobech značení buněk v živých organismech a jejich dalším pozorování se již zmíním jen stručně. Je to například použití retrovirálního vektoru, který zanese značku do buňky, ale sám se dál nemůže množit (Evans and Noden, 2006; Stern and Fraser, 2001). Nakonec také na přípravu složitá metoda genetického fate mappingu, která využívá místně-specifické rekombinázy v kombinaci s promotory pro konkrétní buněčnou linii (např. neurální lištu). Pak dvě linie transgenních organismů díky jaderným kaskádám po zkřížení produkují potomstvo s označenou požadovanou buněčnou linií, např. neurální lištou (Mesp1- cre/rosa 26: Yoshida et al., 2008; Wnt1-Cre/R26R: Chai et al., 2000; Jiang et al., 2002) Neurální lišta Neurální lišta je výhradně embryonální struktura, která se vyskytuje pouze u obratlovců a je považována za jejich evoluční novinku (kupř. Hall, 2005). Jedná se o populaci vysoce migratorních mezenchymových buněk, které na svých konečných pozicích dávají vzniknout mnoha buněčným typům, potažmo tkáním (Hall, 1999; Le Douarin and Kalcheim, 1999). Neurální lišta embryonálně vzniká během neurulace nebo těsně po ní, a to na rozhraní mezi neurální trubicí a jí překrývající pokožkou. Je tedy odvozena od ektodermu, ale z hlediska velkého množství buněk, které produkuje, a velmi vysokého počtu jejích derivátů, ji můžeme považovat za čtvrtý zárodečný list (Hall, 2000). Po svém vzniku podstoupí buňky neurální lišty epitelo-mezenchymální proměnu (Shook and Keller, 2003) a začnou migrovat ventro-laterálním směrem na své budoucí pozice. Tato proměna buněk z typu epiteliálního na typ mezenchymální je podmíněna prostředím, ve kterém se buňky nacházejí (Schneider, 1999; Blentic et al., 2008). Buňky neurální lišty migrují v tzv. rostrokaudální vlně, tedy obecně platí, že čím více anteriorně, tím dříve buňky začínají migrovat. Považuji za důležité zmínit také to, že samotné migrující buňky neurální lišty si po určitý čas zachovávají multipotenci (Le Douarin and Dupin, 2003), a dokonce některé z nich si i na svých konečných pozicích po migraci zachovávají unikátní charakteristiky kmenových buněk (Chung et al., 2009). Neurální lištu můžeme dělit na hlavovou a trupovou, a to jak z hlediska vlastností jejích buněk, tak i kvůli množství buněčných typů, které z ní v hlavě nebo v trupu diferencují. V trupu buňky neurální lišty migrují jednotlivě a více či 15
16 Úvod méně homogenně rozložené. Vznikají z nich pouze nervy a přidružené nervové buňky, nervová ganglia, buňky dřeně nadledvin a melanocyty (např. Hall, 1999). V hlavě je situace úplně jiná. Neurální lišta zde migruje ve třech základních semknutých proudech, které jsou evolučně velice konzervativní a vypadají přibližně stejně u všech obratlovců, viz obr (kupř. Baker, 2008; Falck et al, 2002). Směrem od anteriorní strany nazýváme proudy neurální lišty trigeminální (např. Horigome et al, 1999), hyoidní a branchiální. Poslední z nich se později dělí na čtyři. Trigeminální proud neurální lišty migruje z oblasti zadní části prosencephala, mesencephala a prvních dvou rhombomer (rh) rhombencephala (Cerny et al., 2004a). Obr Ukázka migrujících proudů neurální lišty tu obratlovců. Podle Falck et al., Hyoidní proud migruje z oblasti rh 4 a branchiální proud z oblasti rh 6 a 7 (Lumsden et al., 1991). Z oblastí rhombomer 3 a 5 nemigrují samostatné proudy (rhombomera 5 odpovídá poloze otické kapsule), ale buňky neurální lišty zde také vznikají. Většina těchto buněk však podstoupí apoptozu (Graham et al., 1993), a ty, které zbydou, se nejprve přesunou do sousedních rhombomer (kraniálně i kaudálně) a poté migrují s buňkami neurální lišty příslušných proudů (Birgbauer et al, 1995). Jiná studie navrhuje, že přeživší buňky neurální lišty z rhombomer 3 a 5 se přesunou pouze do oblasti rhombomery 4 a poté migrují s buňkami hyoidního proudu (Köntges and Lumsden, 1996). Co se týká derivátů hlavové neurální lišty, jejich výčet je zde daleko delší než u lišty trupové. Vznikají zde také neurocyty, pomocné nervové buňky, nervová ganglia, a melanocycy. Dále však také kosti a chrupavky, tuková tkáň, škára a svalové vazivo, ciliární svaly, rohovka a další (Santagati and Rijli, 2003; Hall, 1999). 16
17 Metodika 2. Metodika 2.1. Práce s živými embryi Příprava embryí k transplantaci Všechny mé experimenty s živými embryi probíhaly v Lékařském teoretickém centru (Medizinisch Theoretisches Zentrum, MTZ), které je součástí Lékařské fakulty Carl Gustav Carus v Drážďanech. V laboratoři Hans-Henning Epperleina jsem měla k dispozici všechno potřebné vybavení k těmto experimentům, a to hlavně speciální lamerární flow box, který můžeme popsat jako částečně uzavřený prostor, kde se díky zvláštní filtraci vzduchu, který proudí do a z pracovního prostoru, snižuje množství znečištění a bakterií na minimum. Tím pádem práce s živým materiálem je, za dodržení dalších postupů, méně ohrožena případnými bakteriálními nebo plísňovými problémy. Embrya druhu Ambystoma mexicanum byla získána z chovné kolonie v Max Planck Institute (MPI) v Drážďanech. Používala jsem jednak takzvané bílé mutanty, u kterých je zamezeno migraci pigmentových buněk z jejich původní pozice (pracovní označení dd, v textu jako normální ) a jednak zde vyšlechtěné transgenní GFP mutanty, kteří v každé buňce produkují zelený fluorescenční protein (green fluorescent protein, GFP) (Sobkow et al., 2006). Dostávala jsem je v různých stádiích vývoje od blastul po neuruly. Embrya jsem uchovávala v normální neupravené vodě v teplotě 7-8 C. Před vlastní přípravou na transplantace jsem je vložila do Erlenmeyerovy baňky a v ní několikrát propláchla sterilním Steinbergovým roztokem (Steinberg, 1957) s přídavkem antibiotika Ciprobay (Bayer) a antimykotika Gibco (Invitrogen). Od této chvíle jsem s embryi pracovala už vždy jen ve výše popsaném flow boxu a ve Steinbergově roztoku. Před začátkem nebo po konci gastrulace (podle stadia, ve kterém jsem je obdržela) jsem embrya zbavila gelových ochranných obalů, a to pomocí dvou nabroušených špičatých pinzet, co chvíli sterilizovaných plamenem. Poté jsem embrya pod fluorescenční lampou rozdělila do Petriho misek s vrstvou 2% agaru na transgenní a normální. Po dosažení stádia potřebného pro transplantaci (stadia jsem určovala podle standardní stadiovací tabulky podle Bordzilovskaya et al., 1989) jsem do nové Petriho misky s vrstvou 2% agaru a Steinbergovým roztokem přenesla vždy 17
18 Metodika jedno transgenní a jedno normální embryo. Tato dvě embrya jsem vybírala vždy tak, aby byla co nejpřesněji stejně velká a ve stejném stadiu vývoje. Do agaru jsem si pomocí pinzety udělala dvě vhodně velké jamky, ve kterých embrya držela během operace. Embrya jsem, opět pomocí dvou pinzet, zbavila vitelinní membrány (posledního jemného obalu) a nastavila do připravených jamek Vlastní transplantace Prováděla jsem oboustranné izotopické transplantace celých nebo částí neurálních valů (případně neurální trubice), kdy dárcem bylo vždy transgenní GFP embryo a příjemcem embryo normální. Pro zjištění osudu buněčných linií (fate mapping) celé hlavové neurální lišty jsem transplantovala oboustranně celé hlavové neurální valy (obr. 2A) ve stadiích (Bordzilovskaya et al., 1989). Pro fate mapping buněčné linie trigeminálního proudu hlavové neurální lišty jsem transplantovala přední polovinu pomyslného kruhu neurálních valů hlavové neurální lišty (obr. 3A) ve stadiích Pro fate mapping buněčné linie hyoidního proudu hlavové neurální lišty jsem transplantovala výřez neurální trubice v oblasti rhombomery 4 (rh4) ve stadiích (obr. 4A, B). Nakonec pro zmapování osudu branchiálních proudů hlavové neurální lišty jsem transplantovala výřez uzavřené neurální trubice od rh6 kaudálně (posteriorní hranice nebyla přesně určena, protože buňky trupové NC nepřispívají do hlavových struktur (Raven, 1931; Hall, 1999)) (obr. 5A, B), taktéž ve stádiích Vlastní transplantace probíhala v Petriho misce na vrstvě 2% agaru a ve Steinbergově roztoku. Pracovala jsem pod binokulární lupou pomocí wolframových jehel nabroušených do zúžené, ale zakulacené špičky. Nutno dodat, že u takové operace vždycky riskujeme kontaminaci transplantátu buňkami mezodermu. Tomu jsem se snažila předejít preparováním vždy co nejtenčí vrstvičky neurálních valů. Naštěstí v tomto stadiu jsou buňky ektodermu velmi soudržné a naopak relativně dobře oddělitelné od pod nimi ležící vrstvy mezodermu. Buňky mezodermu jsou také velmi dobře rozpoznatelné (větší a čistě bílé) od ektodermálních buněk, takže i transplantát se dal před přenesením od nich částečně očistit, pokud na něm nějaké byly. Ovšem ne vždy se mi to úplně povedlo, a to hlavně v první várce, kdy jsem se vše teprve učila, takže některé vzorky jsou bohužel mezodermem kontaminovány. Během všech analýz jsem ale kontaminaci mezodermem věnovala pozornost, jak bude rozvedeno v diskusi. 18
19 Metodika Transplantace ve stadiu Nutno podotknout, že všechny operace probíhaly co možná nejpodobněji jedna druhé. Jedinou odlišnost tvoří to, že u některých transplantací jsem přenášela valy včetně jejich transversální (úplně nejanteriornější) části, a u některých jsem transversální val nepřenášela. Na výsledek to nemělo žádný markantní vliv, jak bude zmíněno ve výsledcích. Nejprve jsem pomocí jehly opatrně rozrušila ektodermovou vrstvu na hranicích neurálních valů normálního embrya (příjemce transplantátu), poté jsem to samé provedla u transgenního embrya (dárce). Následně jsem dalším rozrušováním jehlou úplně oddělila a odstranila neurální valy normálního embrya. Poté jsem opatrně odpreparovala i neurální valy transgenního embrya a přesunula je na stejné místo na připraveném příjemci. Samozřejmě jsem dbala na anterioposteriorní i dorso-ventrální orientaci přenášených transplantátů. Díky účinné embryonální regeneraci se transplantované části, téměř volně položené na příjemci transplantátu, poměrně záhy přilepily do rány a poté i rychle zhojily. Pokud se regenerace nedařila dobře, přitiskla jsem neurální val do rány malým odřezkem krycího sklíčka položeným pomocí pinzety na embryo. Po zhojení rány jsem embryo vyndala z důlku v agaru a nechala ho volně vyvíjet v laboratorní teplotě. (viz obr. 2, 3) Transplantace ve stadiu 21 Pro zjištění příspěvku hyoidní nebo branchiální části neurální lišty jsem transplantovala ve stadiu 21, a to hlavně z důvodu relativně vyšší rozpoznatelnosti/ odhadnutelnosti hranic rhombomer. Toto stadium je však nejpozdější, na kterém se operace pro moje účely mohla provést, protože buňky neurální lišty ještě neopustily oblast neurální trubice (Falck et al., 2002; Cerny et al., 2004b; Ambystoma punctatum: Stone, 1922). Nejprve jsem oboustranně rozrušila ektodermovou vrstvičku na hranici mezi neurální trubicí a tělem příjemce, tak stejně u transgenního embrya. Poté jsem jehlou nebo mikroskalpelem opatrně příčně rozřízla neurální trubici na kraniální i kaudální straně požadovaného výřezu, opět nejprve u příjemce a poté u dárce. Nakonec jsem podebrala celou neurální trubici tak, abych nenarušila pod ní ležící mezoderm. Odstranila jsem výřez z normálního embrya a na jeho místo umístila transgenní transplantát. Dbala jsem na anterio-posteriorní i dorso-ventrální 19
20 Metodika orientaci transplantátu. Také bylo velice důležité zachovat neporušený ektoderm překrývající transplantát, protože s ním jsou v kontaktu buňky neurální lišty, které právě začínají migrovat ventrálně. (viz obr. 4, 5) Následná kontrola Transplantovaná embrya jsem pozorovala pod binokulární lupou a fluorescenčním světlem ve stadiích migrace proudů buněk hlavové neurální lišty (nejlépe stadia pro všechny migrující proudy hlavové neurální lišty, ale pro pozorování trigeminálního proudu můžeme použít embrya již od stadia 24, pro hyoidní proud jsou nejlepší stadia a pro branchiální proud od stadia 30). Tuto kontrolu jsem prováděla jednak pro případné zjištění zřetelných poškození následky velkého zásahu do vývoje (taková poškození nebyla pozorována) a jednak pro potvrzení toho, že jsem transplantovala vždy jen tu část, kterou jsem chtěla. To znamená, že by měl migrovat vždy jen jeden zelený proud buněk neurální lišty a v ostatních proudech by neměly být žádné zelené buňky, v případě transplantace celých neurálních valů naopak měly být všechny proudy kompletně zelené (Obr. 2B, 3B, 4C, 5C). Poslední kontrola proběhla těsně před fixací. Některá embrya se nevyvíjela normálně a vykazovala na první pohled viditelné abnormality. Taková embrya jsem v této fázi vyřadila a dále je nezpracovávala. 20
21 Metodika Obr. 2 Transplantace celých hlavových neurálních valů. Zeleně jsou transplantované buňky (A) neurálních valů a (B) migrující neurální lišty. Bílé schéma ukazuje, kterou část neurálních valů jsem transplantovala. Obr. 3 Transplantace trigeminálních neurálních valů. Zeleně jsou transplantované buňky (A) neurálních valů a (B) migrujícího trigeminálního proudu neurální lišty. Bílé schéma ukazuje, kterou část neurálních valů jsem transplantovala. 21
22 Metodika Obr. 4 Transplantace hyoidních buněk neurální lišty. (A) Embryo v Petriho misce po transplantaci, čáry naznačují místa řezů. (B) Stejný pohled pod fluorescenční lampou. (C) Zeleně jsou migrující buňky hyoidního proudu neurální lišty ve stadiu 29. Obr. 5 Transplantace branchiálních buněk neurální lišty. (A) Embryo v Petriho misce po transplantaci, čáry naznačují místa řezů. (B) Stejný pohled pod fluorescenční lampou. (C) Zeleně jsou migrující buňky branchiálního proudu neurální lišty ve stadiu
23 Metodika 2.2. Příprava embryí na analýzu Po dosažení mnou požadovaného stadia (40 42, případně 15 19mm larvy) jsem embrya uspala látkou MS-222 (Tricaine methane sulphonate, SERVA) přímo do Petriho misky, a následně rovnou fixovala ve 4% roztoku paraformaldehydu v PBS přes noc. Po fixaci jsem oddělila a zlikvidovala část za branchiální oblastí každého embrya a vzorky jsem postupně převedla do želatiny podle protokolu. Následně jsem vzorky na suchém ledu zalila do nové želatiny a zmrazila v malých plastových krabičkách používaných pro kryostat. Zalitá embrya jsem do doby dalšího zpracování uchovávala v -80 C Převod vzorků do želatiny 1. Fixujeme vzorky ve 4% PFA (paraformaldehyd) přes noc ve 4 C. 2. Promyjeme vzorky 3x v 0,1M PBS (phosphate buffered saline), celkem 1 hodinu v pokojové teplotě. 3. Infiltrujeme vzorky v 10% sacharóze v 0,1M PBS přes noc na třepačce ve 4 C. 4. Infiltrujeme vzorky ve 20% sacharóze v 0,1M PBS přes noc na třepačce ve 4 C. 5. Inkubujeme vzorky v 3,25% želatině (Merck, Bloom 100) ve 20% sacharóze v 0,1M PBS přes noc ve 37 C. 6. Inkubujeme vzorky v 7,5% želatině ve 20% sacharóze v 0,1M PBS půl hodiny v 37 C. 7. Vzorky zalijeme do 7,5% želatiny ve 20% sacharóze v 0,1M PBS v plastových krabičkách a správně je naorientujeme, poté necháme zmrazit na suchém ledu Analýza embryí Veškerá další práce a analýza embryí probíhala již v Praze. Embrya jsem přímo v želatině řezala na kryostatu Leica CM 3050S na řezy o tloušťce 20 μm při teplotě v rozmezí mezi -21 a -27 C. Většinu embryí jsem řezala horizontálně, některá frontálně. Zmražené želatinové bločky jsem nejprve vyndala z plastových krabiček a pomocí Tissue Freezing Medium (Jung) jsem je připevnila a přimrazila na terčíky v kryostatu. Během řezání jsem měla připravená podložní skla na topné ploše, a to vždy pod krytem vyrobeným z alobalové folie, abych předešla ztrácení fluorescenčního GFP signálu. Řezy na sklech jsem zbavila želatiny podle protokolu (2.3.1.) a obarvila standardním imunohistochemickým barvením podle 23
24 Metodika protokolu (2.3.2.). Zkusila jsem 3 různé primární protilátky. První z nich byla protilátka proti myosinu 12/101 mouse anti newt (Developmental Studies Hybridoma Bank) v koncentraci 1 : 200 pro detekci kosterních svalů (Ericsson and Olsson, 2004). Další protilátkou byl Fibronectin rabbit anti human (DAKO) v koncentraci 1 : 100 pro celkově lepší orientaci v tkáních. Poslední byl Kolagen typu II mouse anti chicken (II-II6B3, Developmental Studies Hybridoma Bank) v koncetraci 1 : 200, který je specifický pro chrupavku. Jako sekundární protilátky jsem používala Alexa Fluor 594 goat anti rabbit a goat anti mouse (Invitrogen), podle povahy primární protilátky. Pro obarvení jader (jaderné DNA) a současně zalití pod krycí skla jsem používala VECTASHIELD HardSet Mounting Medium with DAPI (Vector Laboratories). Toto médium jednak zjednodušuje práci díky přeskočení kroku samostatného barvení jader DAPI a jednak velice dobře předchází rychlé ztrátě fluorescenčního signálu. Skla jsem vždy skladovala v horizontální poloze ve 4 C. Řezy jsem po obarvení analyzovala pod fluorescenčním mikroskopem Olympus BX 51, pod zeleným, červeným a modrým filtrem. Fotila jsem je kamerou značky SPOT RT Camera od společnosti Diagnostic Instruments Inc., nejčastěji na zvětšení 200x, detaily na zvětření 400x a celkové pohledy na zvětšení 100x. Takto získané obrázky jsem dále upravovala a barevné varianty na sebe skládala v programu Spot Advanced (Diagnostic Instruments Inc.) Konečné úpravy pro potřebu této práce jsem prováděla v programu IrfanView a Malování Odželatinizování kryostatových řerů 1. Skla se suchými řezy ponoříme na 1 minutu do 3% želatiny v 38% vodném roztoku etanolu v 37 C. 2. Opláchneme skla 2 minuty ve vodě v 37 C Imunohistochemické barvení 1. Řezy z kryostatu opláchneme několik minut 1% vodným roztokem BSA (bovine serum albumin). Mezitím si připravíme primární protilátku. 2. Okapeme skla a aplikujeme primární protilátku. Skla s protilátkou uložíme přes noc do vlhké komůrky ve 4 C. 24
25 Metodika 3. Okapeme ze sklíček primární protilátku a opláchneme 0,1M PBS. Poté ještě oplachujeme 0,1M PBS 3x po 10 minutách. Mezitím si připravíme sekundární protilátku. 4. Slijeme PBS a aplikujeme sekundární protilátku. Skla s protilátkou uložíme přes noc do vlhké komůrky ve 4 C. 5. Okapeme ze sklíček sekundární protilátku a opláchneme 0,1M PBS. Poté ještě oplachujeme 0,1M PBS 3x po 10 minutách. 6. Zakápneme skla vždy dvěma až třemi kapkami VECTASHIELD HardSet Mounting Medium with DAPI (Vector Laboratories). Několikrát necháme nakláněním sklíčka medium protéci tam a zpět, aby se obarvila jádra. 7. Přikryjeme krycím sklem. 25
26 Výsledky 3. Výsledky Transplantace jsem prováděla během dvou čtyřtýdenních stáží v laboratoři Dr. Hans-Henning Epperleina v letech 2009 a V roce 2009 jsem celkově provedla 65 transplantací. Z toho bylo 20 přenosů celých hlavových neurálních valů, 14 přenosů neurálních valů pro trigeminální proud neurální lišty, 22 transplantací částí neurální trubice v oblasti rhombomery 4 pro hyoidní proud neurální lišty a 9 transplantací výřezů neurální trubice oblasti od rhobomery 6 posteriorně pro branchiální proudy neurální lišty. V roce 2010 jsem provedla celkem 114 transplantací. Z toho 31 transplantací celých hlavových neurálních valů, 19 transplantací trigeminální části neurálních valů, 37 transplantací pro hyoidní proud neurální lišty a 27 transplantací pro branchiální proudy neurální lišty. Úspěšnost přežití transplantovaných embryí byla velmi vysoká. Celkem mi ze 179 operovaných vzorků do ukončení vývoje samovolně uhynulo 7 embryí. Všechny byly v roce 2010, a to z jediné várky, na jejíž horší kvalitu mě sám chovatel předem upozornil. Pravděpodobně kvůli velkému zásahu do raného vývoje bylo před fixací 10 z celkového počtu 172 embryí viditelně poškozeno, a to většinou buď abnormálně vyvinutou hlavou, nebo velmi málo vyvinutými žábrami. Tato embrya jsem dál nezpracovávala. Ze začátku jsem si musela metodou pokus-omyl co nejpřesněji určit hranice presumptivních oblastí jednotlivých proudů hlavové neurální lišty. Samozřejmě, tyto hranice již byly popsány z jiných experimentů (např. Epperlein et al., 2000; Hanken and Gross, 2005), takže jsem měla jistou představu. Z toho důvodu hlavně první rok vznikala po transplantacích embrya s různě rozmístěnými zeleně značenými buňkami (například zeleným hyoidním a současně částečně zelenými branchiálními proudy neurální lišty). Tyto hranice jsou pochopitelně velmi úzké, ale také většinou nejsou nikterak jasně vyznačené. Proto jsem prováděla kontroly během migrace buněk neurální lišty. U každého embrya jsem si zaznamenala, která část buněk neurální lišty migruje, a posléze jsem je podle toho analyzovala. Samozřejmě tato jednoduchá vizuální kontrola není stoprocentní, protože si nemůžeme být jistí, že vidíme všechny zeleně značené buňky, obzvláště pak ty, 26
27 Výsledky které nemigrují těsně pod pokožkou, za předpokladu, že proud buněk neurální lišty není jednovrstevný. V Praze jsem nejdříve analyzovala embrya, u kterých byl podle kontroly během migrace buněk neurální lišty označen pouze jeden nebo naopak všechny proudy buněk neurální lišty. Poté jsem analyzovala i některé vzorky s méně vydařenými transplantacemi. Celkem jsem na kryostatu nařezala a fluorescenčně obarvila 88 vzorků. Z toho 25 vzorků bylo pro celou hlavovou neurální lištu, 21 pro trigeminální, 23 pro hyoidní a 20 pro branchiální proudy neurální lišty. Pokud se jedná o počet vzorků skutečně použitých do výsledné analýzy, dostaneme se na číslo 20 pro celou hlavovou neurální lištu, 17 pro trigeminální, 18 pro hyoidní a 19 pro branchiální proudy neurální lišty. Čísla jsou snížená o ty vzorky, které se například nepodařily dobře obarvit, nevykazovaly dobrý GFP signál, byly po řezání potrhané atp. Vzorky, které jsem ani nebarvila, byly většinou ty, u kterých se nepovedly přesné transplantace, měla jsem u nich problémy s řezáním na kryostatu nebo analýza nebyla možná z jiného důvodu. Pro lepší orientaci v obrázcích nyní uvedu podrobný popis dvou co nejvíce všeobecných řezů. Na obrázku 6A vidíme horizontální řez celou hlavou axolotla ve stadiu 41. Levá strana embrya je říznutá více dorzálně než pravá, rostrální část směřuje nahoru. Na levé straně tedy můžeme vidět od shora nasální kapsuli, která je obklopena mezenchymálními buňkami neurální lišty. Sama její výstelka také svítí zeleně, ale to jsou buňky původní neurální plakody, která se vchlípila z ektodermu, který byl také transplantován, dovnitř. Pokud postupujeme levou částí dolů, můžeme vidět neznačenou dvouvrstevnou pokožku, pod kterou se nachází škára původem z neurální lišty. Další zeleně značené mezenchymální buňky obklopují tři červeně značené svaly. Soustředný útvar, který tyto tři svaly obklopují, je příčný řez chrupavčitým palatoquadratem. V levé dolní části obrázku můžeme pozorovat 4 horizontálně uložené chrupavky branchiální oblasti. V nejspodnější části pak vidíme viscerální svalstvo, které je částečně protknuto zeleně značenými buňkami, které tvoří pojivovou tkáň tohoto svalu. Na pravé straně obrázku můžeme opět od shora pozorovat zelený mezenchym a škáru. Níže pak část Meckelovy chrupavky s jedním velice zřetelně rozeznatelným zubem. Pod ní se nachází část ceratohyale a hypohyale, které mediálně navazuje na první basibranchiale. 27
28 Výsledky Distálně pak ceratohyale nasedá na červeně značený sval. Mediálně pod zmíněným basibranchiale 1 se nachází jeho posteriorní část, ze které vybíhá hypobranchiale 1. Pod ním lze ještě rozlišit hypobranchiale 2, ale ostatní branchiální chrupavky jsou již nezřetelné z důvodu příliš ventrální roviny tohoto řezu. Na této fotografii můžeme dále pozorovat červeně značené svaly, které spolu s mezenchymem neurální lišty vybíhají posteriorně do vnějších žaber. Na vedlejším obrázku 6B pak vidíme pohled na farynx 17mm dlouhé larvy axolotla. Opět, rostrální část směřuje nahoru. V levé horní části vidíme černě a zeleně ohraničené oko. Pod ním se pak nachází zeleně ohraničený sval. Zelené ohraničení jsou buňky neurální lišty, které na povrchu svalu tvoří jeho obal (povázku). Pod tímto svalem leží palatoquadratum, které je celé tvořeno buňkami neurální lišty. Laterálně od něj leží další mandibulární sval. Pod palatoquadratem se laterálně nachází sval hyoidní a mediálně od něj pak distální konec ceratohyalia, který je celý z buněk neurální lišty. Pod ním se pak nachází 4 rozpoznatelné chrupavky- ceratobranchialia 1-4. Mezi oběma ceratobranchialii 4 se nachází viscerální svalstvo a mezenchymální buňky neurální lišty. Pod ním už vidíme začátek těla axolotla. Na pravé straně můžeme vidět kromě oka stejné elementy jako na straně levé. Pod palatoquadratem se nacházejí zeleně značené protáhlé buňky- myocyty vzniklé z nedopatřením transplantovaného mezodermu. Z vnitřní strany vidíme většinou dvouvrstevný epitel, který představuje endodermální výstelku faryngu. Uprostřed je faryngeální dutina. 28
29 Výsledky Obr. 6 Horizontální řezy faryngem (A) embrya ve stadiu 41 a (B) larvy velké 17 mm. Popis v textu, kapitola 3. Barvy: modrá, DAPI; zelená, buňky neurální lišty; červená, svalstvo. 29
30 Výsledky 3.1. Ontogenetický původ chrupavek viscerokrania Transplantace celé hlavové neurální lišty Pro studium osudu buněčné linie všech buněk hlavové neurální lišty jsem zanalyzovala celkem 20 vzorků. Z toho 13 vzorků embryí bylo analyzováno ve stadiu a 7 vzorků larev velkých mm. Díky nativnímu GFP jsem zjistila, že všechna (tedy 100%) zkoumaná embrya měla veškeré viscerální chrupavky kromě basibranchiale 2 odvozené z buněk neurální lišty. Z neurální lišty jsou tedy: prechordální chrupavka (trabekula) (obr. 7), Meckelova chrupavka, palatoquadratum, hypohyale, ceratohyale, basibranchiale 1, hypobranchiale 1 i 2, ceratobranchiale 1 až 4. (viz obr. 6A,B) Zajímavým zjištěním je nicméně to, že i když jsem transplantovala celou hlavovou neurální lištu, a to v dostatečně raném stadiu, v několika případech se stalo, že v chrupavkách několik buněk nebylo zeleně značených (řádově maximálně desítky). (Viz obr. 8) Transplantace trigeminálního proudu neurální lišty Jak již bylo uvedeno, pro dosažení značení buněk trigeminálního proudu neurální lišty jsem oboustranně transplantovala přední polovinu pomyslného kruhu hlavových neurálních valů. Samozřejmě zde není žádná morfologická hranice, která by oddělovala neurální valy, ze kterých vznikají buňky trigeminálního proudu od těch, odkud již vznikají buňky hyoidního proudu neurální lišty. Proto v některých vzorcích bohužel nebyla označena nejkaudálnější část trigeminálního proudu. Pro příspěvek trigeminálního proudu neurální lišty do viscerokrania jsem zanalyzovala celkem 17 vzorků. Zjistila jsem, že z tohoto proudu vznikají trabekuly (obr. 9A), Meckelova chrupavka spodní čelisti (obr. 9B) a palatoquadratum (obr. 9C). Meckelova chrupavka měla v pěti případech značeno méně než 95% buněk 3. Přičítám to tomu, že při operaci těchto embryí jsem nepřenášela transversální část neurálních valů (viz kapitola ). Co se týče trabekuly, méně než 95% jejích buněk bylo značeno u dvou ze 13ti vzorků. Bohužel u čtyř prvních vzorků, které jsem analyzovala, jsem si stav trabekul nezapisovala a nefotila. Pokud podrobněji zmíním palatoquadratum, zde bohužel ve 12ti případech bylo značeno méně než 3 Procenta buněk viscerálních chrupavek, které vykazovaly nebo nevykazovaly GFP signál, jsem při analýzách určovala odhadem. Bohužel nebylo v mých silách počítat u každého elementu přesný počet buněk. 30
31 Výsledky z 95% buněk. V 5ti případech dokonce signál vykazovalo méně než 40% buněk (obr. 9A). Více se o tomto výsledku zmíním v diskusi. Na obrázku 9D je velmi dobře vidět chrupavčitý primární čelistní kloub tvořený ventrální částí palatoquadrata a posteriorní částí Meckelovy chrupavky Transplantace hyoidního proudu neurální lišty Tuto transplantaci jsem prováděla na embryích ve stadiu 21, kdy je již uzavřená neurální trubice, ale buňky neurální lišty ještě nemigrují ventrálně mimo ni (Falck et al., 2002; Cerny et al., 2004b). U tohoto typu operace bylo nejsložitější rozeznat oblast neurální trubice, kterou je potřeba přenést, aby migrovaly opravdu pouze buňky hyoidního proudu neurální lišty (tzn. přenést pouze oblast rhombomery 4). Jednak je tato oblast velmi úzká a jednak hranice rhombomer jsou rozpoznatelné jen na některých embryích. Proto se zde velmi liší počet odoperovaných od počtu skutečně analyzovaných vzorků (59 : 18). Z 18ti vzorků, které jsem na kryostatu nařezala a zanalyzovala, bylo 14 vzorků čistých transplantací, kde při kontrole po operaci migroval opravdu pouze hyoidní proud neurální lišty. Co se týče chrupavek, zjistila jsem, že z tohoto proudu neurální lišty vznikají ceratohyalia, hypohyalia a anteriorní část basibranchiale 1. Ceratohyalia byla úplně značena (nad 95% buněk) u devíti vzorků, u zbylých pěti bylo vždy značeno nad 60% buněk. Hypohyální chrupavky měly úplně stejný výsledek, tedy 9 vzorků se všemi značenými buňkami a 5 vzorků s více než 60% značením buněk. Co se týče anteriorní části basibranchiale 1, znovu se dostaneme na shodný počet, tedy 9 vzorků s úplným značením a 5 vzorků se slabším. Ze čtrnácti embryí, která jsem analyzovala pro hyoidní proud neurální lišty byla celkem 4, u nichž byly všechny zmíněné chrupavky značené pouze nad 60%. Připisuji to pravděpodobně velmi úzkému transplantátu, který jsem u nich přenášela. Zbylý jeden neúplně značený element, který jsem uváděla v odstavci výše, byl vždy u jiného embrya. U většiny těchto embryí však svítí všechny chrupavky z více než 95%. (Viz obr. 10A, B) Dvě z analyzovaných embryí měly značené také některé buňky ceratobranchiale 1 (5-10% buněk). Sedm embryí mělo také značeny buňky kolem palatoquadrata nebo Meckelovy chrupavky. Zajímavé je, že některá z těchto embryí dokonce ani neměla značené všechny buňky ceratohyalií (obr. 10A, B). 31
32 Výsledky Tento jev tedy připisuji plasticitě buněk neurální lišty, případně omezenému míchání buněk mezi jednotlivými proudy (viz kapitola 4.4.) Transplantace branchiálního proudu neurální lišty Zmíněná transplantace byla prováděna vždy ve stadiu Z mých analýz vyplývá, že z branchiálního proudu neurální lišty vždy vzniká ceratobranchiale 1 4, hypobranchiale 1 a 2, basibranchiale 1 kromě jeho anteriorní části (obr. 11A, B, C). Z devatenácti embryí, uvedených na začátku této kapitoly, tři vykazovala abnormální vnitřní stavbu, a proto je do analýzy počítat nemohu. Jedno další embryo mělo značenou i část hyoidního proudu neurální lišty a tudíž ho vyřazuji také. Zbylo mi 15 vzorků, z nichž u všech byla úplně značená ceratobranchialia 3 a 4 (tzn., že GFP signál vykazovalo více než 95% buněk v těchto elementech). Pokud se dostaneme k ceratobranchiale 2, to v 10ti případech bylo značno úplně, v pěti případech z více než 60%. Hypobranchiale 2 bylo v 9ti případech značeno úplně, v pěti případech signál vykazovalo více než 60% buněk a v jednom případě svítilo pouze 40-60% buněk. Dohromady mohu uvést ceratobranchiale 1 a hypobranchiale 1, kdy byly bohužel tyto elementy značeny úplně pouze u 3 embryí, přes 60% buněk bylo značeno u embrya jednoho. U zbytku vzorků (celkem 11) tyto elementy signál vykazovaly jen málo, a to do 40% všech buněk. Poslední element vznikající z branchiálního proudu neurální lišty, je posteriorní část basibranchiale 1 (obr. 11A, C). Tento element byl úplně značen, stejně jako předchozí, u 3 vzorků. V dalších třech případech byl značen mezi 40 a 60%. V ostatních devíti případech vykazovalo GFP signál v posteriorní části basibranchiale 1 pouze asi 5-20% buněk. Basibranchiale 2 nevykazovalo nikdy žádné buňky zeleně značené (obr. 11D, 14A). I při tomto typu transplantací se mi stávalo, že ačkoliv nebylo úplně označené celé ceratobranchiale 1 a hypobranchiale 1, několik zelených buněk se objevilo kolem nebo přímo uvnitř ceratohyale. 32
33 Výsledky Obr. 7 Trabekula. Horizontální řez larvou velkou 17 mm. Na fotografii vidíme trabekulu, která je z buněk neurální lišty. Navazuje na ni parachordalium, které z buněk neurální lišty není. Barvy: modrá, DAPI; zelená, buňky neurální lišty. Obr. 8 Horizontální řez larvou velkou 18 mm. Šipky označují buňky, které nevykazují GFP signál. Barvy: modrá, DAPI; zelená, buňky neurální lišty. 33
34 Výsledky Obr. 9 Výsledky transplantace trigeminálního proudu neurální lišty. (A, B) horizontální řezy embryi ve stadiu 41. (A) Pohled na zcela značenou trabekulu a z poloviny značené palatoquadratum. Všimněme si ne zcela značeného oka. (B) Pohled na téměř zcela značenou Meckelovu chrupavku. Všimněme si zubů a dermis úst. 34
35 Výsledky Pokr. Obr. 9 Výsledky transplantace trigeminálního proudu neurální lišty. Horizontální řezy (C) embryem ve stadiu 41, (D) larvou velikou 17 mm po transplantaci celé hlavové neurální lišty. (C) Téměř úplně značené palatoquadratum, plus 3 buňky v ceratohyale (šipky). (D) Detail prim. čelistního kloubu mezi Meckelovou chrupavkou a palatoquadratem. Barvy: modrá, DAPI; zelená, buňky neurální lišty; červená, fibronektin (B, D) kolagen II (C). 35
36 Výsledky Obr. 10 Výsledky transplantace hyoidního proudu neurální lišty. Horizontální řezy embryi ve stadiu 41. (A) Hyoidní oblouk včetně všech jeho částí. Všimněme si úplného značení anteriorní části basibranchiale 1. (B) Pravé ceratohyale jiného embrya. (A, B) Některé buňky ceratohyale nevykazují signál (úzké šipky), ale okolo sousedních elementů jsou některé buňky značeny (široké šipky). Barvy: modrá, DAPI; zelená, buňky neurální lišty; červená, fibronektin (B) kolagen II (A). 36
37 Výsledky Obr. 11 Výsledky transplantace branchiálního proudu neurální lišty. (A) Horizontální řez embryem ve stadiu 40. Značeny jsou všechny branchiální chrupavky kromě anteriorní části BB1. (B) Detail horizontálního řezu branchiálními chrupavkami larvy velké 19mm. Několik chrupavčitých buněk nevykazuje signál (šipky). 37
38 Výsledky Pokr. Obr. 11 Výsledky transplantace branchiálního proudu neurální lišty. (C) Horizontální řez embryem ve stadiu 41. Anteriorní část BB1 není značena. (D) Horizontální řez larvou velkou 18 mm. Basibranchiale 2 nevykazuje žádný signál (srv. s ceratohyale). Barvy: modrá, DAPI; zelená, buňky neurální lišty; červená, svaly (A,B); kolagen II (C); fibronektin (D). 38
39 Výsledky 3.2. Zeleně značené buňky, které nemají původ v neurální liště Jak je vidět na mých řezech, vzniklých hlavně po transplantacích celé hlavové neurální lišty, kromě chrupavek viscerokrania nacházíme v hlavě i další zeleně značené buňky a struktury. Ne vždy to však znamená, že takto označené buňky mají původ v neurální liště. Komplexní a výraznou strukturou, která je zeleně označená, je centrální nervová soustava. Ta vzniká neurulací, během níž jsem prováděla první typ transplantací. Z hlediska toho, jaké transplantáty jsem přenášela, je mozek přirozeně z části zeleně značený. U transplantací jednotlivých částí hlavové neurální lišty zeleně svítí vždy odpovídající část mozku. Pokud jsem transplantovala části neurální trubice ve stadiu 21, je značení mozku markantnější. (viz obr. 12A, B, C, D) Některé zelené buňky, které na řezech vidíme, jsou buňky pokožky (dvouvrstevná struktura na povrchu embrya) a buňky od původní epidermis odvozené. Tyto buňky jsou zelené samozřejmě kvůli tomu, že u obou typů transplantací jsem přenášela také epidermis. Kromě té můžeme na řezech vidět značenou výstelku otických (obr. 13A) i olfaktorických kapsul a některé části oka (obr. 13B). Neurální plakody, ze kterých výstelka senzorických kapsulí pochází, totiž vznikají invaginací zesílených oblastí pokožky obratlovců na hranici mezi neurálním valem a vlastním tělem embrya (kupř. Schlosser, 2006). Pokud pozorujeme zeleně značené buňky přímo ve svalech (obr. 14A), připisuji to nedokonalému oddělení mezodermových buněk od těch ektodermových během transplantací, a tím pádem přenesení malého množství mezodermu. Svalové buňky samozřejmě z buněk neurální lišty nediferencují. Pokud ovšem vidíme svítit zelené buňky těsně kolem svalových svazků nebo i mezi jednotlivými myocyty (obr. 14B), můžeme je za buňky původem z neurální lišty označit (viz níže). Ostatní zeleně značené buňky již jsou buňky odvozené od neurální lišty. 39
40 Výsledky Obr. 12 Značené části mozku u jednotlivých typů transplantací. Horizontální řezy embryi ve stadiu 41 (B, C, D) nebo 42 (A). (A) Značení anterorní části mozku po transplantaci neurálních valů oblasti trigeminální neurální lišty. (B) Celkový pohled na značení části mozku po transplantaci neurální trubice v oblasti rhombomery 4. (C) Detail značení části mozku v oblasti rhombomery 4. (D) Značení mozku po transplantaci části neurální trubice od oblasti rhombomery 6 posteriorně. Barvy: modrá, DAPI; zelená, buňky neurální lišty; červená, fibronektin. Obr. 13 Značené části senzorického epitelu v kapsulích. Horizontální řezy embryi ve stadiu 40 (A) a 42 (B). (A) Mediální části výstelky otické kapsule jsou značeny, pocházejí z transplantované epidermis (resp. neurální plakody). (B) Řez okem, kde sítnice je značená úplně, ale jiné části pouze částečně. Barvy: modrá, DAPI; zelená, buňky neurální lišty; červená, svaly. 40
41 Výsledky Obr. 14 Dvojí původ značených buněk ve svalech. (A) Horizontální řez larvou velkou 19 mm. Šipky označují značené myocyty diferencované z transplantovaných buněk mezodermu. (B) Horizontální řez embryem ve stadiu 42. Zelené buňky označené šipkami jsou mezenchymální buňky, které tvoří pojiva a vazivové obaly svalů. Barvy: modrá, DAPI; zelená, buňky neurální lišty; červená, svaly. 41
42 Výsledky 3.3. Ostatní struktury vznikající z buněk hlavové neurální lišty Další struktury, které pochází z buněk neurální lišty, jsou většinou dobře rozeznatelné na řezech, kde byla transplantována celá hlavová neurální lišta. Kromě chrupavek a neurální trubice je dominantní tkání na řezech zeleně svítící mezenchym (nejlépe je vidět na řezech embryí ve stadiu 41-42) (např. obr. 9C, 12A, 13A). Mezenchymové buňky jsou takové buňky, které nejsou ještě plně diferencované a prozatím vyplňují prostor mezi ostatními strukturami, případně někam migrují. Mohou dát vznik různým typům tkání, jako vazivu, chrupavce, tukové tkáni atd. Právě buňky neurální lišty jsou po epitelo-mezenchymální proměně (viz kapitola 1.4.) mezenchymovou strukturou a podle toho byla a je také nazývána ektomezenchymem (Platt, 1897) mezenchymem odvozeným od ektodermu (další název, mesektoderm, se spíše nepoužívá). Mezi mezenchymem rostrálního konce embrya můžeme také velice dobře rozeznat zeleně značené nasální kapsule (obr. 16), a to včetně jejich výstelky, která však pochází z neurálních plakod (Kardong, 1995). Nasální kapsule ovšem nejsou ještě chondrifikovány, a to ani na mých větších larvách, a proto nemohu potvrdit ani vyvrátit původ jejich chrupavek z neurální lišty. Další strukturou, která vzniká z neurální lišty, a tudíž je na řezech značená, jsou ganglia kraniálních nervů, pomocné neuronální buňky a samotné nervy (např. obr. 13A, 18A, B) Velice zajímavým výsledkem mé práce je zjištění, že mezenchymové buňky neurální lišty vyplňují vnější žábry. Jak vidíme na obrázcích 17A, B vybíhají mezenchymové buňky z těla axolotla nepřerušeným proudem od distálních konců ceratobranchiálních elementů přímo do vnějších žaber a vyplňují je až na samý jejich konec. Souběžně s nimi do vnějších žaber vybíhají samozřejmě také svaly a cévy. Jak je vidět na obrázku 18, kromě buněk její výstelky (obr. 13, kapitola 3.2.) jsou také značeny některé buňky chrupavčité otické kapsule. Další strukturou, která má původ v buňkách hlavové neurální lišty, jsou zuby (Soukup et al., 2008; Chai et al., 2000). Jak vyplývá z obrázku 19, z neurální lišty vzniká dentin i zubní pulpa. Zubní destičky jsou dále ohraničeny mezenchymálními buňkami neurální lišty. 42
43 Výsledky 3.4. Další výsledky Během svých analýz a barvení kolagenem typu II jsem zjistila, že tato protilátka se váže na nejdistálnější konce zubů axolotla ve stadiu (obr. 19A). Na larvách velkých mm jsem toto barvení již nepozorovala. 43
44 Výsledky Obr. 15 Detail basibranchiale 1 a jeho připojení k hypohyale a hypobranchiale 1. Obr. 16 Detail trabekuly a částečně značených nasálních kapsulí. Barvy: Modrá, DAPI; zelená, buňky neurální lišty; červená, kolagen II. 44
45 Výsledky Obr. 17 Mezenchym vnějších žaber je tvoře buňkami neurální lišty. (A) Celkový pohled na vnější žábry vybíhající od distálního konce ceratobranchialií. (B) Detail vnější žábry, vyplněné pouze svaly a mezenchymem původem z neurální lišty. Barvy: modrá, DAPI; zelená, buňky neurální lišty; červená, svaly. 45
46 Výsledky Obr. 18 Detail chrupavčité otické kapsule larev velkých 17 mm. Bíle jsou ohraničeny části OC se značenými buňkami. Barvy: Modrá, DAPI; zelená, buňky neurální lišty; červená, kolagen II. 46
47 Výsledky Obr. 19 Zubní pulpa a dentin pocházejí z buněk neurální lišty. (A) Detail zubů larvy velikosti 17 mm. (B) Zuby embrya ve stadiu 42 jsou označeny šipkami. Jejich špičky značí kolagen II. Barvy: Modrá, DAPI; zelená, buňky neurální lišty; červená, kolagen II. 47
Ontogenetický původ chrupavčitých a kostěných elementů lebky obratlovců
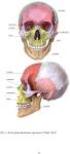 UNI V E R Z I T A K A R L O V A V PR A Z E PŘÍRODOVĚDECKÁ FAKULTA K atedra zoologie Ontogenetický původ chrupavčitých a kostěných elementů lebky obratlovců BAKALÁŘSKÁ PRÁCE Lenka Fialová Vedoucí práce:
UNI V E R Z I T A K A R L O V A V PR A Z E PŘÍRODOVĚDECKÁ FAKULTA K atedra zoologie Ontogenetický původ chrupavčitých a kostěných elementů lebky obratlovců BAKALÁŘSKÁ PRÁCE Lenka Fialová Vedoucí práce:
Vývoj obličeje nosní a ústní dutiny Vývoj zubu
 Vývoj obličeje nosní a ústní dutiny Vývoj zubu Jelínek- Moore-Perceaud, Patten, Schumacher, Vacek mikrofotografie Kraus R. Histologický a embryologický ústav Doc. MUDr. Hana Brichová, CSc. vývoj obličeje
Vývoj obličeje nosní a ústní dutiny Vývoj zubu Jelínek- Moore-Perceaud, Patten, Schumacher, Vacek mikrofotografie Kraus R. Histologický a embryologický ústav Doc. MUDr. Hana Brichová, CSc. vývoj obličeje
Histogeneze příklady. 151 Kurs 5: Vývoj buněk a tkání
 Histogeneze příklady 151 Kurs 5: Vývoj buněk a tkání Kurs 5: Vývoj buněk a tkání 137 Kasuistika: Thalidomide 138 Základní morfogenetické procesy 139 Regenerace a reparace 140 Ženský reprodukční systém
Histogeneze příklady 151 Kurs 5: Vývoj buněk a tkání Kurs 5: Vývoj buněk a tkání 137 Kasuistika: Thalidomide 138 Základní morfogenetické procesy 139 Regenerace a reparace 140 Ženský reprodukční systém
Gastrulace, neurulace, somitogenese 508
 Gastrulace, neurulace, somitogenese 508 Gastrulace Zásadní děj vývoje - 3. týden Tvorba intraembryonálního mesodermu: Proliferace epiblastu Kaudální morfogenetické centrum: o o Primitivní (Hensenův) uzel
Gastrulace, neurulace, somitogenese 508 Gastrulace Zásadní děj vývoje - 3. týden Tvorba intraembryonálního mesodermu: Proliferace epiblastu Kaudální morfogenetické centrum: o o Primitivní (Hensenův) uzel
Buňky, tkáně, orgány, orgánové soustavy. Petr Vaňhara Ústav histologie a embryologie LF MU
 Buňky, tkáně, orgány, orgánové soustavy Petr Vaňhara Ústav histologie a embryologie LF MU Dnešní přednáška: Koncept uspořádání tkání Embryonální vznik tkání Typy tkání a jejich klasifikace Orgánové soustavy
Buňky, tkáně, orgány, orgánové soustavy Petr Vaňhara Ústav histologie a embryologie LF MU Dnešní přednáška: Koncept uspořádání tkání Embryonální vznik tkání Typy tkání a jejich klasifikace Orgánové soustavy
"Učení nás bude více bavit aneb moderní výuka oboru lesnictví prostřednictvím ICT ". Ontogeneze živočichů
 "Učení nás bude více bavit aneb moderní výuka oboru lesnictví prostřednictvím ICT ". Ontogeneze živočichů postembryonální vývoj 1/73 Ontogeneze živočichů = individuální vývoj živočichů, pokud vznikají
"Učení nás bude více bavit aneb moderní výuka oboru lesnictví prostřednictvím ICT ". Ontogeneze živočichů postembryonální vývoj 1/73 Ontogeneze živočichů = individuální vývoj živočichů, pokud vznikají
Obecná a srovnávací odontologie. Vývojové souvislosti 4 zubní epitel vs. mesenchym v zubním vývoje i evoluci
 Obecná a srovnávací odontologie Vývojové souvislosti 4 zubní epitel vs. mesenchym v zubním vývoje i evoluci Ontogeneze zubu: vzájemné a opakující se interakce zubního mesenchymu a epitelu Dle současných
Obecná a srovnávací odontologie Vývojové souvislosti 4 zubní epitel vs. mesenchym v zubním vývoje i evoluci Ontogeneze zubu: vzájemné a opakující se interakce zubního mesenchymu a epitelu Dle současných
FLUORESCENČNÍ MIKROSKOP
 FLUORESCENČNÍ MIKROSKOP na gymnáziu Pierra de Coubertina v Táboře Pavla Trčková, kabinet Biologie, GPdC Tábor Co je fluorescence Fluorescence je jev spočívající v tom, že některé látky (fluorofory) po
FLUORESCENČNÍ MIKROSKOP na gymnáziu Pierra de Coubertina v Táboře Pavla Trčková, kabinet Biologie, GPdC Tábor Co je fluorescence Fluorescence je jev spočívající v tom, že některé látky (fluorofory) po
Mezonefros. Neokortex s glomeruly. Metanefrogenní blastém. dřeň s kanálky. Magn. x10. Henleovy kličky (nižší buňky) Sběrací kanálek (vyšší buňky)
 Podpořeno grantem FRVŠ 524/2011 Ledviny NEFRON funkční jednotka Kůra - renální tělísko (glomerulus + Bowmanův váček) - proximální tubulus (zpětné vstřebávání) - distální tubulus Dřeň - Henleova klička
Podpořeno grantem FRVŠ 524/2011 Ledviny NEFRON funkční jednotka Kůra - renální tělísko (glomerulus + Bowmanův váček) - proximální tubulus (zpětné vstřebávání) - distální tubulus Dřeň - Henleova klička
Univerzita Karlova v Praze Přírodovědecká fakulta
 Univerzita Karlova v Praze Přírodovědecká fakulta Studijní program: Biologie Studijní obor: Biologie Agáta Horáčková Trabekula a její význam pro vývoj a evoluci přední části hlavy obratlovců Bakalářská
Univerzita Karlova v Praze Přírodovědecká fakulta Studijní program: Biologie Studijní obor: Biologie Agáta Horáčková Trabekula a její význam pro vývoj a evoluci přední části hlavy obratlovců Bakalářská
Embryonální období. Martin Špaček. Odd. histologie a embryologie
 Modul IB Embryonální období Martin Špaček Odd. histologie a embryologie Zdroje obrázků: Moore, Persaud: Zrození člověka Rarey, Romrell: Clinical human embryology Scheinost: Digitální zobrazování počátků
Modul IB Embryonální období Martin Špaček Odd. histologie a embryologie Zdroje obrázků: Moore, Persaud: Zrození člověka Rarey, Romrell: Clinical human embryology Scheinost: Digitální zobrazování počátků
Číslo projektu CZ.1.07/1.5.00/ Název školy. Moravské gymnázium Brno, s.r.o. Autor. Mgr. Martin Hnilo
 Číslo projektu CZ.1.07/1.5.00/34.0743 Název školy Moravské gymnázium Brno, s.r.o. Autor Mgr. Martin Hnilo Tematická oblast Biologie 2 Zoologický systém. Embryogeneze. Ročník 2. Datum tvorby 02.09.2013
Číslo projektu CZ.1.07/1.5.00/34.0743 Název školy Moravské gymnázium Brno, s.r.o. Autor Mgr. Martin Hnilo Tematická oblast Biologie 2 Zoologický systém. Embryogeneze. Ročník 2. Datum tvorby 02.09.2013
Připomínka z minula: jen my obratlovci máme (složenou) kůži
 Připomínka z minula: jen my obratlovci máme (složenou) kůži kopinatec má sice vrstvu, označenou jako škára (dermis), tato však není součástí kůže jako orgánu a sestává jen z vrstev kolagenu; pravá škára
Připomínka z minula: jen my obratlovci máme (složenou) kůži kopinatec má sice vrstvu, označenou jako škára (dermis), tato však není součástí kůže jako orgánu a sestává jen z vrstev kolagenu; pravá škára
Stavba kosti (Viz BIOLOGIE ČLOVĚKA, s. 12-13) Mechanické vlastnosti kosti. Vznik a vývoj kosti
 S_Kost1a.doc S O U S T A V A K O S T E R N Í Autor textu: RNDr. Miroslav TURJAP, 2004. Určeno: Jako pomocný text pro žáky III. ročníku gymnázia. Odkazy: Novotný, I. - Hruška, M. : BIOLOGIE ČLOVĚKA. Praha,
S_Kost1a.doc S O U S T A V A K O S T E R N Í Autor textu: RNDr. Miroslav TURJAP, 2004. Určeno: Jako pomocný text pro žáky III. ročníku gymnázia. Odkazy: Novotný, I. - Hruška, M. : BIOLOGIE ČLOVĚKA. Praha,
Buňka. základní stavební jednotka organismů
 Buňka základní stavební jednotka organismů Buňka Buňka je základní stavební a funkční jednotka těl organizmů. Toto se netýká virů (z lat. virus jed, je drobný vnitrobuněčný cizopasník nacházející se na
Buňka základní stavební jednotka organismů Buňka Buňka je základní stavební a funkční jednotka těl organizmů. Toto se netýká virů (z lat. virus jed, je drobný vnitrobuněčný cizopasník nacházející se na
IZOLACE, SEPARACE A DETEKCE PROTEINŮ I. Vlasta Němcová, Michael Jelínek, Jan Šrámek
 IZOLACE, SEPARACE A DETEKCE PROTEINŮ I Vlasta Němcová, Michael Jelínek, Jan Šrámek Studium aktinu, mikrofilamentární složky cytoskeletu pomocí dvou metod: detekce přímo v buňkách - fluorescenční barvení
IZOLACE, SEPARACE A DETEKCE PROTEINŮ I Vlasta Němcová, Michael Jelínek, Jan Šrámek Studium aktinu, mikrofilamentární složky cytoskeletu pomocí dvou metod: detekce přímo v buňkách - fluorescenční barvení
Anatomie kostry. Kostra psa. 1. lebka 2. obličej 3. dolní čelist 4. jazylka. 5. hrtanové a průdušnicové chrupavky.
 Anatomie kostry Kostra psa 1. lebka 2. obličej 3. dolní čelist 4. jazylka 5. hrtanové a průdušnicové chrupavky 1 / 6 6. krční obratle 7. hrudní obratle 8. bederní obratle 9. křížové obratle 10. ocasní
Anatomie kostry Kostra psa 1. lebka 2. obličej 3. dolní čelist 4. jazylka 5. hrtanové a průdušnicové chrupavky 1 / 6 6. krční obratle 7. hrudní obratle 8. bederní obratle 9. křížové obratle 10. ocasní
Biologie buněk neurální lišty ve vztahu ke kraniofaciální diversitě obratlovců
 UNIVERZITA KARLOVA V PRAZE PŘÍRODOVĚDECKÁ FAKULTA Katedra zoologie Biologie buněk neurální lišty ve vztahu ke kraniofaciální diversitě obratlovců BAKALÁŘSKÁ PRÁCE Jan Štundl Vedoucí práce: Mgr. Robert
UNIVERZITA KARLOVA V PRAZE PŘÍRODOVĚDECKÁ FAKULTA Katedra zoologie Biologie buněk neurální lišty ve vztahu ke kraniofaciální diversitě obratlovců BAKALÁŘSKÁ PRÁCE Jan Štundl Vedoucí práce: Mgr. Robert
Biologie - Sexta, 2. ročník
 - Sexta, 2. ročník Biologie Výchovné a vzdělávací strategie Kompetence k řešení problémů Kompetence komunikativní Kompetence občanská Kompetence sociální a personální Kompetence k podnikavosti Kompetence
- Sexta, 2. ročník Biologie Výchovné a vzdělávací strategie Kompetence k řešení problémů Kompetence komunikativní Kompetence občanská Kompetence sociální a personální Kompetence k podnikavosti Kompetence
Diferenciace tkání. Diferenciace blastocysta: Cytotrofoblast. Trofoblast. Syncytiotrofoblast. Epiblast. Embryoblast. Hypoblast
 Histogenese 511 Diferenciace tkání Diferenciace blastocysta: Trofoblast Cytotrofoblast Syncytiotrofoblast Embryoblast Epiblast Hypoblast Extraembryonální mesoderm Epiblast Diferenciace epiblastu: Gamety
Histogenese 511 Diferenciace tkání Diferenciace blastocysta: Trofoblast Cytotrofoblast Syncytiotrofoblast Embryoblast Epiblast Hypoblast Extraembryonální mesoderm Epiblast Diferenciace epiblastu: Gamety
PARAZITÉ Z BLÍZKA LARVY MOTOLIC (PRACOVNÍ LIST)
 PARAZITÉ Z BLÍZKA LARVY MOTOLIC (PRACOVNÍ LIST) Mgr. Kateřina Mikešová, UK v Praze, PřF, katedra učitelství a didaktiky biologie Jméno studenta: Třída: Datum: Motolice jsou výhradně endoparazité obratlovců,
PARAZITÉ Z BLÍZKA LARVY MOTOLIC (PRACOVNÍ LIST) Mgr. Kateřina Mikešová, UK v Praze, PřF, katedra učitelství a didaktiky biologie Jméno studenta: Třída: Datum: Motolice jsou výhradně endoparazité obratlovců,
Typy nervových soustav
 Tematická oblast Typy nervových soustav Datum vytvoření 19. 9. 2012 Ročník Stručný obsah Způsob využití Autor Kód Biologie - biologie živočichů 3. ročník čtyřletého G a 7. ročník osmiletého G Prezentace
Tematická oblast Typy nervových soustav Datum vytvoření 19. 9. 2012 Ročník Stručný obsah Způsob využití Autor Kód Biologie - biologie živočichů 3. ročník čtyřletého G a 7. ročník osmiletého G Prezentace
ANOTACE vytvořených/inovovaných materiálů
 ANOTACE vytvořených/inovovaných materiálů Číslo projektu Číslo a název šablony klíčové aktivity Tematická oblast Formát Druh učebního materiálu Druh interaktivity CZ.1.07/1.5.00/34.0722 III/2 Inovace a
ANOTACE vytvořených/inovovaných materiálů Číslo projektu Číslo a název šablony klíčové aktivity Tematická oblast Formát Druh učebního materiálu Druh interaktivity CZ.1.07/1.5.00/34.0722 III/2 Inovace a
Buňka. Kristýna Obhlídalová 7.A
 Buňka Kristýna Obhlídalová 7.A Buňka Buňky jsou nejmenší a nejjednodušší útvary schopné samostatného života. Buňka je základní stavební a funkční jednotkou živých organismů. Zatímco některé organismy jsou
Buňka Kristýna Obhlídalová 7.A Buňka Buňky jsou nejmenší a nejjednodušší útvary schopné samostatného života. Buňka je základní stavební a funkční jednotkou živých organismů. Zatímco některé organismy jsou
Název: POZOROVÁNÍ PLASTIDŮ,VAKUOL, BUNĚČNÉ STĚNY Autor: Paed.Dr.Ludmila Pipková
 Název: POZOROVÁNÍ PLASTIDŮ,VAKUOL, BUNĚČNÉ STĚNY Autor: Paed.Dr.Ludmila Pipková Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět: biologie Mezipředmětové vztahy: ekologie Ročník: 2.a 3.
Název: POZOROVÁNÍ PLASTIDŮ,VAKUOL, BUNĚČNÉ STĚNY Autor: Paed.Dr.Ludmila Pipková Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět: biologie Mezipředmětové vztahy: ekologie Ročník: 2.a 3.
TEST:Bc-1314-BLG Varianta:0 Tisknuto:18/06/2013 ------------------------------------------------------------------------------------------ 1.
 TEST:Bc-1314-BLG Varianta:0 Tisknuto:18/06/2013 1. Genotyp je 1) soubor genů, které jsou uloženy v rámci 1 buněčného jádra 2) soubor pozorovatelných vnějších znaků 3) soubor všech genů organismu 4) soubor
TEST:Bc-1314-BLG Varianta:0 Tisknuto:18/06/2013 1. Genotyp je 1) soubor genů, které jsou uloženy v rámci 1 buněčného jádra 2) soubor pozorovatelných vnějších znaků 3) soubor všech genů organismu 4) soubor
EU PENÍZE ŠKOLÁM NÁZEV PROJEKTU : MÁME RÁDI TECHNIKU REGISTRAČNÍ ČÍSLO PROJEKTU :CZ.1.07/1.4.00/
 EU PENÍZE ŠKOLÁM NÁZEV PROJEKTU : MÁME RÁDI TECHNIKU REGISTRAČNÍ ČÍSLO PROJEKTU :CZ.1.07/1.4.00/21.0663 Speciální základní škola a Praktická škola Trmice Fűgnerova 22 400 04 1 Identifikátor materiálu:
EU PENÍZE ŠKOLÁM NÁZEV PROJEKTU : MÁME RÁDI TECHNIKU REGISTRAČNÍ ČÍSLO PROJEKTU :CZ.1.07/1.4.00/21.0663 Speciální základní škola a Praktická škola Trmice Fűgnerova 22 400 04 1 Identifikátor materiálu:
Advanced Therapies Products Produkty Moderní terapie a výrobní laboratoře. Barbara Kubešová
 Advanced Therapies Products Produkty Moderní terapie a výrobní laboratoře Barbara Kubešová Národní Tkáňové Centrum, a.s. vyvíjí a vyrábí léčivé přípravky pro Advancedtherapiesa zpracovává tkáně a buňky
Advanced Therapies Products Produkty Moderní terapie a výrobní laboratoře Barbara Kubešová Národní Tkáňové Centrum, a.s. vyvíjí a vyrábí léčivé přípravky pro Advancedtherapiesa zpracovává tkáně a buňky
Neurulace. Vývoj ektodermu.
 Neurulace. Vývoj ektodermu. Ústav pro histologii a embryologii 1.LF Univerzity Karlovy Přednášející: Doc. MUDr. Tomáš Kučera, Ph.D. Předmět: Obecná histologie a obecná embryologie, kód B02241 Datum: 19.12.2013
Neurulace. Vývoj ektodermu. Ústav pro histologii a embryologii 1.LF Univerzity Karlovy Přednášející: Doc. MUDr. Tomáš Kučera, Ph.D. Předmět: Obecná histologie a obecná embryologie, kód B02241 Datum: 19.12.2013
PŘEDMLUVA 8 1. ZÁKLADNÍ EMBRYOLOGICKÉ POJMY 9 2. VÝZNAM EMBRYOLOGIE PRO KLINICKOU MEDICÍNU 13
 PŘEDMLUVA 8 1. ZÁKLADNÍ EMBRYOLOGICKÉ POJMY 9 2. VÝZNAM EMBRYOLOGIE PRO KLINICKOU MEDICÍNU 13 3. GENETICKÁ KONTROLA VÝVOJE A ZÁKLADNÍ VÝVOJOVÉ PROCESY 17 3.1 Základní vývojové procesy 18 3.1.1 Proliferace
PŘEDMLUVA 8 1. ZÁKLADNÍ EMBRYOLOGICKÉ POJMY 9 2. VÝZNAM EMBRYOLOGIE PRO KLINICKOU MEDICÍNU 13 3. GENETICKÁ KONTROLA VÝVOJE A ZÁKLADNÍ VÝVOJOVÉ PROCESY 17 3.1 Základní vývojové procesy 18 3.1.1 Proliferace
Stavba kostry hrudního koše strunatců
 Stavba kostry hrudního koše strunatců Tematická oblast Datum vytvoření 9. 10. 2012 Ročník Stručný obsah Způsob využití Autor Kód Biologie biologie živočichů 3. ročník čtyřletého G a 7. ročník osmiletého
Stavba kostry hrudního koše strunatců Tematická oblast Datum vytvoření 9. 10. 2012 Ročník Stručný obsah Způsob využití Autor Kód Biologie biologie živočichů 3. ročník čtyřletého G a 7. ročník osmiletého
2.ročník - Zoologie. Rozmnožování Zárodečné listy (10)
 2.ročník - Zoologie Rozmnožování Zárodečné listy (10) ROZMNOŽOVÁNÍ A VÝVIN ROZMNOŽOVÁNÍ: 1) Nepohlavní = zachována stejná genetická informace rodiče a potomka - založeno na schopnosti regenerace (obnovy
2.ročník - Zoologie Rozmnožování Zárodečné listy (10) ROZMNOŽOVÁNÍ A VÝVIN ROZMNOŽOVÁNÍ: 1) Nepohlavní = zachována stejná genetická informace rodiče a potomka - založeno na schopnosti regenerace (obnovy
Rozvoj vzdělávání žáků karvinských základních škol v oblasti cizích jazyků Registrační číslo projektu: CZ.1.07/1.1.07/02.0162
 Rozvoj vzdělávání žáků karvinských základních škol v oblasti cizích jazyků Registrační číslo projektu: CZ.1.07/1.1.07/02.0162 ZŠ Prameny Určeno pro 8. třída (pro 3. 9. třídy) Sekce Základní / Nemocní /
Rozvoj vzdělávání žáků karvinských základních škol v oblasti cizích jazyků Registrační číslo projektu: CZ.1.07/1.1.07/02.0162 ZŠ Prameny Určeno pro 8. třída (pro 3. 9. třídy) Sekce Základní / Nemocní /
PRAKTICKÉ CVIČENÍ č. 1
 PRAKTICKÉ CVIČENÍ č. 1 Název cvičení: ŽIVOČIŠNÉ TKÁNĚ Teoretický úvod: Tkáň je soubor morfologicky podobných buněk, které plní určitou funkci. Buňky tvořící tkáň mohou být stejného typu, existují však
PRAKTICKÉ CVIČENÍ č. 1 Název cvičení: ŽIVOČIŠNÉ TKÁNĚ Teoretický úvod: Tkáň je soubor morfologicky podobných buněk, které plní určitou funkci. Buňky tvořící tkáň mohou být stejného typu, existují však
prokaryotní Znaky prokaryoty
 prokaryotní buňka Znaky prokaryoty Základní stavební jednotka bakterií a sinic Mikroskopická velikost viditelné pouze v optickém mikroskopu Buňka neobsahuje organely Obsahuje pouze 1 biomembránu cytoplazmatickou
prokaryotní buňka Znaky prokaryoty Základní stavební jednotka bakterií a sinic Mikroskopická velikost viditelné pouze v optickém mikroskopu Buňka neobsahuje organely Obsahuje pouze 1 biomembránu cytoplazmatickou
VY_32_INOVACE_002. VÝUKOVÝ MATERIÁL zpracovaný v rámci projektu EU peníze školám
 VY_32_INOVACE_002 VÝUKOVÝ MATERIÁL zpracovaný v rámci projektu EU peníze školám Registrační číslo projektu: CZ. 1.07. /1. 5. 00 / 34. 0696 Šablona: III/2 Název: Buňka Vyučovací předmět: Základy ekologie
VY_32_INOVACE_002 VÝUKOVÝ MATERIÁL zpracovaný v rámci projektu EU peníze školám Registrační číslo projektu: CZ. 1.07. /1. 5. 00 / 34. 0696 Šablona: III/2 Název: Buňka Vyučovací předmět: Základy ekologie
Základní morfogenetické procesy
 Základní morfogenetické procesy 502 Základní morfogenetické procesy Mechanismy, které se uplatňují v ontogenesi, tedy při vývoji jedince od zygoty k mnohobuněčnému organismu Buněčná úroveň diferenciace
Základní morfogenetické procesy 502 Základní morfogenetické procesy Mechanismy, které se uplatňují v ontogenesi, tedy při vývoji jedince od zygoty k mnohobuněčnému organismu Buněčná úroveň diferenciace
7. Rozmnožování a vývoj živočichů: osemenění, oplození a embryogeneze
 7. Rozmnožování a vývoj živočichů: osemenění, oplození a embryogeneze Morfologie, histologie a ontogeneze rostlin a živočichů: Část 2: histologie a vývoj živočichů Osemenění (inseminace) = uvedení spermií
7. Rozmnožování a vývoj živočichů: osemenění, oplození a embryogeneze Morfologie, histologie a ontogeneze rostlin a živočichů: Část 2: histologie a vývoj živočichů Osemenění (inseminace) = uvedení spermií
Protokol ke cvičení z Biologie vodních živočichů
 Katedra zoologie a Ornitologická laboratoř Protokol ke cvičení z Biologie vodních živočichů Jméno : Obor,ročník : Datum : Úvod Cílem tohoto cvičení je praktická ukázka fixace a preparace vodních bezobratlých
Katedra zoologie a Ornitologická laboratoř Protokol ke cvičení z Biologie vodních živočichů Jméno : Obor,ročník : Datum : Úvod Cílem tohoto cvičení je praktická ukázka fixace a preparace vodních bezobratlých
Otázka: Opěrná soustava. Předmět: Biologie. Přidal(a): Kostra. Kosterní (opěrná) soustava:
 Otázka: Opěrná soustava Předmět: Biologie Přidal(a): Kostra Kosterní (opěrná) soustava: základem je kost, soubor kostí v těle = kostra 206 230 kostí (novorozenec 300) tvoří pouze 14% tělesné hmotnosti
Otázka: Opěrná soustava Předmět: Biologie Přidal(a): Kostra Kosterní (opěrná) soustava: základem je kost, soubor kostí v těle = kostra 206 230 kostí (novorozenec 300) tvoří pouze 14% tělesné hmotnosti
PROSTOROVÁ DYNAMIKA EKTO- A ENDODERMU BĚHEM
 Univerzita Karlova v Praze Přírodovědecká fakulta Katedra zoologie PROSTOROVÁ DYNAMIKA EKTO- A ENDODERMU BĚHEM FARYNGOGENEZE VE VZTAHU K ZUBNÍM ZÁKLADŮM Bakalářská práce VLADIMÍR SOUKUP Školitel: Mgr.
Univerzita Karlova v Praze Přírodovědecká fakulta Katedra zoologie PROSTOROVÁ DYNAMIKA EKTO- A ENDODERMU BĚHEM FARYNGOGENEZE VE VZTAHU K ZUBNÍM ZÁKLADŮM Bakalářská práce VLADIMÍR SOUKUP Školitel: Mgr.
Šablona č. 01.33. Přírodopis. Opakování: Kosterní soustava člověka
 Šablona č. 01.33 Přírodopis Opakování: Kosterní soustava člověka Anotace: Opakování učiva o kosterní soustavě člověka Autor: Ing. Ivana Přikrylová Očekávaný výstup: Písemné opakování učiva o kosterní soustavě.
Šablona č. 01.33 Přírodopis Opakování: Kosterní soustava člověka Anotace: Opakování učiva o kosterní soustavě člověka Autor: Ing. Ivana Přikrylová Očekávaný výstup: Písemné opakování učiva o kosterní soustavě.
VPHP - dekontaminační metoda na bázi par peroxidu vodíku pro aseptickou produkci léčiv
 Laboratoř oboru Výroba léčiv (N111049) a Organická technologie (N111025) E VPHP - dekontaminační metoda na bázi par peroxidu vodíku pro aseptickou produkci léčiv Vedoucí práce: Umístění práce: Ing. Jiří
Laboratoř oboru Výroba léčiv (N111049) a Organická technologie (N111025) E VPHP - dekontaminační metoda na bázi par peroxidu vodíku pro aseptickou produkci léčiv Vedoucí práce: Umístění práce: Ing. Jiří
Praktický kurz Příprava nanočástic metodami syntézy v žížalách, charakterizace - Imunohistochemické barvení
 Laboratoř Metalomiky a Nanotechnologií Praktický kurz Příprava nanočástic metodami syntézy v žížalách, charakterizace - Imunohistochemické barvení Vyučující: Mgr. Bc. Markéta Komínková Postup imunohistochemického
Laboratoř Metalomiky a Nanotechnologií Praktický kurz Příprava nanočástic metodami syntézy v žížalách, charakterizace - Imunohistochemické barvení Vyučující: Mgr. Bc. Markéta Komínková Postup imunohistochemického
Základní škola praktická Halenkov VY_32_INOVACE_03_03_12. Člověk I.
 Základní škola praktická Halenkov VY_32_INOVACE_03_03_12 Člověk I. Číslo projektu CZ.1.07/1.4.00/21.3185 Klíčová aktivita III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Zařazení učiva v rámci ŠVP
Základní škola praktická Halenkov VY_32_INOVACE_03_03_12 Člověk I. Číslo projektu CZ.1.07/1.4.00/21.3185 Klíčová aktivita III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Zařazení učiva v rámci ŠVP
Anatomie. Roviny. Směry
 Anatomie Pro popis těla se používá terminologie rovin a směrů abychom se orientovali v umístění jednotlivých částí a v pohybech, je to něco jako kompas. Postavení těla pro popis je vzpřímený postoj s volně
Anatomie Pro popis těla se používá terminologie rovin a směrů abychom se orientovali v umístění jednotlivých částí a v pohybech, je to něco jako kompas. Postavení těla pro popis je vzpřímený postoj s volně
DIDAKTICKÝ TEST- OBECNÁ ZOOLOGIE
 DIDAKTICKÝ TEST- OBECNÁ ZOOLOGIE 1. Která část neuronu přijímá vzruchy? a) tělo neuronu a dendrity b) pouze tělo neuronu c) axon (neurit) a dendrity d) axon (neurit) a tělo neuronu 2. Mozeček je důležité
DIDAKTICKÝ TEST- OBECNÁ ZOOLOGIE 1. Která část neuronu přijímá vzruchy? a) tělo neuronu a dendrity b) pouze tělo neuronu c) axon (neurit) a dendrity d) axon (neurit) a tělo neuronu 2. Mozeček je důležité
Termíny z časného vývoje zárodku:
 Embryologie Termíny z časného vývoje zárodku: Ovulace 14.den menstruačního cyklu Oplodnění fertilizace vznik zygoty a dokončení 2. zracího dělení Rýhování mitotické dělení buněk (blastomer) a vznik moruly
Embryologie Termíny z časného vývoje zárodku: Ovulace 14.den menstruačního cyklu Oplodnění fertilizace vznik zygoty a dokončení 2. zracího dělení Rýhování mitotické dělení buněk (blastomer) a vznik moruly
GENETIKA 1. Úvod do světa dědičnosti. Historie
 GENETIKA 1. Úvod do světa dědičnosti Historie Základní informace Genetika = věda zabývající se dědičností a proměnlivostí živých soustav sleduje variabilitu (=rozdílnost) a přenos druhových a dědičných
GENETIKA 1. Úvod do světa dědičnosti Historie Základní informace Genetika = věda zabývající se dědičností a proměnlivostí živých soustav sleduje variabilitu (=rozdílnost) a přenos druhových a dědičných
Seminář pro maturanty
 Úvod do biologie člověka Seminář pro maturanty 2006 Organismy mají hierarchickou strukturu Buňka - tkáň - orgán - orgánová soustava celkem asi 216 typů buněk v lidském těle tkáň = skupina buněk stejné
Úvod do biologie člověka Seminář pro maturanty 2006 Organismy mají hierarchickou strukturu Buňka - tkáň - orgán - orgánová soustava celkem asi 216 typů buněk v lidském těle tkáň = skupina buněk stejné
Mnohobuněčné kvasinky
 Laboratoř buněčné biologie PROJEKT Mnohobuněčné kvasinky Libuše Váchová ve spolupráci s laboratoří Prof. Palkové (PřFUK) Do laboratoře přijímáme studenty se zájmem o vědeckou práci Kontakt: vachova@biomed.cas.cz
Laboratoř buněčné biologie PROJEKT Mnohobuněčné kvasinky Libuše Váchová ve spolupráci s laboratoří Prof. Palkové (PřFUK) Do laboratoře přijímáme studenty se zájmem o vědeckou práci Kontakt: vachova@biomed.cas.cz
Protokol č. 7 Pozorování živých a mrtvých buněk kvasinek Vitální test
 Protokol č. 7 Pozorování živých a mrtvých buněk kvasinek Vitální test Cíl cvičení: Bude se jednat o přímé nebo nepřímé stanovení počtu buněk? Stanovujeme počet živých nebo mrtvých buněk? Jak odlišíme živé
Protokol č. 7 Pozorování živých a mrtvých buněk kvasinek Vitální test Cíl cvičení: Bude se jednat o přímé nebo nepřímé stanovení počtu buněk? Stanovujeme počet živých nebo mrtvých buněk? Jak odlišíme živé
9. Evo-devo. Thomas Huxley ( )
 9. Evo-devo Můžeme žasnout nad procesem, kterým se z vajíčka vyvine dospělý jedinec, ale bez problémů přijímáme tento proces jako každodenní fakt. Je to pouze nedostatek fantazie, který nám brání pochopit,
9. Evo-devo Můžeme žasnout nad procesem, kterým se z vajíčka vyvine dospělý jedinec, ale bez problémů přijímáme tento proces jako každodenní fakt. Je to pouze nedostatek fantazie, který nám brání pochopit,
Základní škola praktická Halenkov VY_32_INOVACE_03_03_01. Obratlovci a jejich znaky
 Základní škola praktická Halenkov VY_32_INOVACE_03_03_01 Obratlovci a jejich znaky Číslo projektu CZ.1.07/1.4.00/21.3185 Klíčová aktivita III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Zařazení
Základní škola praktická Halenkov VY_32_INOVACE_03_03_01 Obratlovci a jejich znaky Číslo projektu CZ.1.07/1.4.00/21.3185 Klíčová aktivita III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Zařazení
ZÁKLADY FUNKČNÍ ANATOMIE
 OBSAH Úvod do studia 11 1 Základní jednotky živé hmoty 13 1.1 Lékařské vědy 13 1.2 Buňka - buněčné organely 18 1.2.1 Biomembrány 20 1.2.2 Vláknité a hrudkovité struktury 21 1.2.3 Buněčná membrána 22 1.2.4
OBSAH Úvod do studia 11 1 Základní jednotky živé hmoty 13 1.1 Lékařské vědy 13 1.2 Buňka - buněčné organely 18 1.2.1 Biomembrány 20 1.2.2 Vláknité a hrudkovité struktury 21 1.2.3 Buněčná membrána 22 1.2.4
BLOK 3: (záznam pozorování, experimentu, bádání, apod.)
 BLOK 3: PROTOKOLY (záznam pozorování, experimentu, bádání, apod.) LABORATORNÍ PROTOKOLY Dva druhy: (1) Zápisky (poznámky) o vlastním průběhu práce (2) Zpráva (shrnutí) o výsledcích Ad (1). Věrný zápis
BLOK 3: PROTOKOLY (záznam pozorování, experimentu, bádání, apod.) LABORATORNÍ PROTOKOLY Dva druhy: (1) Zápisky (poznámky) o vlastním průběhu práce (2) Zpráva (shrnutí) o výsledcích Ad (1). Věrný zápis
Základní škola praktická Halenkov VY_32_INOVACE_02_02_19. Třídění organismů obratlovci
 Základní škola praktická Halenkov VY_32_INOVACE_02_02_19 Třídění organismů obratlovci Číslo projektu CZ.1.07/1.4.00/21.3185 Klíčová aktivita III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Zařazení
Základní škola praktická Halenkov VY_32_INOVACE_02_02_19 Třídění organismů obratlovci Číslo projektu CZ.1.07/1.4.00/21.3185 Klíčová aktivita III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Zařazení
připomínka z minula...dlužím vám něco?!? Videa Zdroj pdf moodle
 připomínka z minula...dlužím vám něco?!? Videa Zdroj pdf moodle Morfologie živočichů MB170P46 Pokryv těla, integument, povrchy: specializace povrchů, kůže, keratinizace, deriváty Pokryv těla, integument,
připomínka z minula...dlužím vám něco?!? Videa Zdroj pdf moodle Morfologie živočichů MB170P46 Pokryv těla, integument, povrchy: specializace povrchů, kůže, keratinizace, deriváty Pokryv těla, integument,
Tento dokument vznikl v rámci projektu Zkvalitnění výuky prostřednictvím ICT Registrační číslo: CZ.1.07/1.5.00/34.0459
 Tento dokument vznikl v rámci projektu Zkvalitnění výuky prostřednictvím ICT Registrační číslo: CZ.1.07/1.5.00/34.0459 VY_32_INOVACE_1.20.Bi.Obojzivelnici Autor: ing. Tkáč Ladislav Datum vytvoření: 18.
Tento dokument vznikl v rámci projektu Zkvalitnění výuky prostřednictvím ICT Registrační číslo: CZ.1.07/1.5.00/34.0459 VY_32_INOVACE_1.20.Bi.Obojzivelnici Autor: ing. Tkáč Ladislav Datum vytvoření: 18.
Cvičení 4: CHEMICKÉ SLOŽENÍ BUŇKY, PROKARYOTA Jméno: PROKARYOTA PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU ROZTĚR BAKTERIÍ
 Cvičení 4: CHEMICKÉ SLOŽENÍ BUŇKY, PROKARYOTA Jméno: Skupina: PROKARYOTA PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU ROZTĚR BAKTERIÍ Praktický úkol: bakterie (koky, tyčky) vyžíhejte bakteriologickou kličku
Cvičení 4: CHEMICKÉ SLOŽENÍ BUŇKY, PROKARYOTA Jméno: Skupina: PROKARYOTA PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU ROZTĚR BAKTERIÍ Praktický úkol: bakterie (koky, tyčky) vyžíhejte bakteriologickou kličku
Western blotting. 10% APS 20,28 µl 40,56 µl 81,12 µl 20,28 µl 40,56 µl 81,12 µl
 Western blotting 1. Příprava gelu složení aparatury hustotu gelu volit podle velikosti proteinů příprava rozdělovacího gelu: 10% 12% počet gelů 1 2 4 1 2 4 objem 6 ml 12 ml 24 ml 6 ml 12 ml 24 ml 40% akrylamid
Western blotting 1. Příprava gelu složení aparatury hustotu gelu volit podle velikosti proteinů příprava rozdělovacího gelu: 10% 12% počet gelů 1 2 4 1 2 4 objem 6 ml 12 ml 24 ml 6 ml 12 ml 24 ml 40% akrylamid
Prokaryota x Eukaryota. Vibrio cholerae
 Živočišná buňka Prokaryota x Eukaryota Vibrio cholerae Dělení živočišných buněk: buňky jednobuněčných organismů (volně žijící samostatné jednotky) buňky mnohobuněčných větší morfologické i funkční celky
Živočišná buňka Prokaryota x Eukaryota Vibrio cholerae Dělení živočišných buněk: buňky jednobuněčných organismů (volně žijící samostatné jednotky) buňky mnohobuněčných větší morfologické i funkční celky
BUNĚČNÁ STĚNA - struktura a role v rostlinné buňce
 BUNĚČNÁ STĚNA - struktura a role v rostlinné buňce Buněčná stěna O buněčné stěně: Buněčná stěna je nedílnou součástí každé rostlinné buňky a je jednou z charakteristických struktur odlišujících buňku rostlinnou
BUNĚČNÁ STĚNA - struktura a role v rostlinné buňce Buněčná stěna O buněčné stěně: Buněčná stěna je nedílnou součástí každé rostlinné buňky a je jednou z charakteristických struktur odlišujících buňku rostlinnou
Erytrocyty. Hemoglobin. Krevní skupiny a Rh faktor. Krevní transfúze. Somatologie Mgr. Naděžda Procházková
 Erytrocyty. Hemoglobin. Krevní skupiny a Rh faktor. Krevní transfúze. Somatologie Mgr. Naděžda Procházková Formované krevní elementy: Buněčné erytrocyty, leukocyty Nebuněčné trombocyty Tvorba krevních
Erytrocyty. Hemoglobin. Krevní skupiny a Rh faktor. Krevní transfúze. Somatologie Mgr. Naděžda Procházková Formované krevní elementy: Buněčné erytrocyty, leukocyty Nebuněčné trombocyty Tvorba krevních
EU PENÍZE ŠKOLÁM NÁZEV PROJEKTU : MÁME RÁDI TECHNIKU REGISTRAČNÍ ČÍSLO PROJEKTU :CZ.1.07/1.4.00/21.0663
 EU PENÍZE ŠKOLÁM NÁZEV PROJEKTU : MÁME RÁDI TECHNIKU REGISTRAČNÍ ČÍSLO PROJEKTU :CZ.1.07/1.4.00/21.0663 Speciální základní škola a Praktická škola Trmice Fűgnerova 22 400 04 1 Identifikátor materiálu:
EU PENÍZE ŠKOLÁM NÁZEV PROJEKTU : MÁME RÁDI TECHNIKU REGISTRAČNÍ ČÍSLO PROJEKTU :CZ.1.07/1.4.00/21.0663 Speciální základní škola a Praktická škola Trmice Fűgnerova 22 400 04 1 Identifikátor materiálu:
PRACOVNÍ LIST- SOUSTAVA DÝCHACÍ A CÉVNÍ
 PRACOVNÍ LIST- SOUSTAVA DÝCHACÍ A CÉVNÍ 1. Doplň větu. Dýchání (respirace) je mechanismus, při kterém většina živočichů přijímá a odstraňuje ze svých tkání. 2. U většiny živočichů s druhotnou tělní dutinou
PRACOVNÍ LIST- SOUSTAVA DÝCHACÍ A CÉVNÍ 1. Doplň větu. Dýchání (respirace) je mechanismus, při kterém většina živočichů přijímá a odstraňuje ze svých tkání. 2. U většiny živočichů s druhotnou tělní dutinou
II. SVALOVÁ TKÁŇ PŘÍČNĚ PRUHOVANÁ (ŽÍHANÁ) = svalovina kosterní
 II. SVALOVÁ TKÁŇ PŘÍČNĚ PRUHOVANÁ (ŽÍHANÁ) = svalovina kosterní základní stavební jednotkou svalové vlákno, představující mnohojaderný útvar (soubuní) syncytiálního charakteru; vykazuje příčné pruhování;
II. SVALOVÁ TKÁŇ PŘÍČNĚ PRUHOVANÁ (ŽÍHANÁ) = svalovina kosterní základní stavební jednotkou svalové vlákno, představující mnohojaderný útvar (soubuní) syncytiálního charakteru; vykazuje příčné pruhování;
Základy mikroskopování
 Gymnázium a Střední odborná škola pedagogická, Čáslav, Masarykova 248 M o d e r n í b i o l o g i e reg. č.: CZ.1.07/1.1.32/02.0048 TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM
Gymnázium a Střední odborná škola pedagogická, Čáslav, Masarykova 248 M o d e r n í b i o l o g i e reg. č.: CZ.1.07/1.1.32/02.0048 TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM
Metoda Live/Dead aneb využití fluorescenční mikroskopie v bioaugmentační praxi. Juraj Grígel Inovativní sanační technologie ve výzkumu a praxi
 Metoda Live/Dead aneb využití fluorescenční mikroskopie v bioaugmentační praxi Juraj Grígel Inovativní sanační technologie ve výzkumu a praxi Co je to vlastně ta fluorescence? Některé látky (fluorofory)
Metoda Live/Dead aneb využití fluorescenční mikroskopie v bioaugmentační praxi Juraj Grígel Inovativní sanační technologie ve výzkumu a praxi Co je to vlastně ta fluorescence? Některé látky (fluorofory)
LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 3. TESTY ŽIVOTASCHOPNOSTI A POČÍTÁNÍ BUNĚK
 LRR/BUBCV CVIČEÍ Z BUĚČÉ BILGIE 3. TESTY ŽIVTASCHPSTI A PČÍTÁÍ BUĚK TERETICKÝ ÚVD: Při práci s buňkami je jedním ze základních sledovaných parametrů stanovení jejich životaschopnosti (viability). Tímto
LRR/BUBCV CVIČEÍ Z BUĚČÉ BILGIE 3. TESTY ŽIVTASCHPSTI A PČÍTÁÍ BUĚK TERETICKÝ ÚVD: Při práci s buňkami je jedním ze základních sledovaných parametrů stanovení jejich životaschopnosti (viability). Tímto
Renáta Kenšová. Název: Školitel: Datum: 24. 10. 2014
 Název: Školitel: Sledování distribuce zinečnatých iontů v kuřecím zárodku za využití moderních technik Monitoring the distribution of zinc ions in chicken embryo using modern techniques Renáta Kenšová
Název: Školitel: Sledování distribuce zinečnatých iontů v kuřecím zárodku za využití moderních technik Monitoring the distribution of zinc ions in chicken embryo using modern techniques Renáta Kenšová
Rozvoj vzdělávání žáků karvinských základních škol v oblasti cizích jazyků Registrační číslo projektu: CZ.1.07/1.1.07/02.0162
 ZŠ Určeno pro Sekce Předmět Rozvoj vzdělávání žáků karvinských základních škol v oblasti cizích jazyků Registrační číslo projektu: CZ.1.07/1.1.07/02.0162 Téma / kapitola Dělnická 6. 7. třídy ZŠ základní
ZŠ Určeno pro Sekce Předmět Rozvoj vzdělávání žáků karvinských základních škol v oblasti cizích jazyků Registrační číslo projektu: CZ.1.07/1.1.07/02.0162 Téma / kapitola Dělnická 6. 7. třídy ZŠ základní
Základní škola praktická Halenkov VY_32_INOVACE_03_03_03. Ryby
 Základní škola praktická Halenkov VY_32_INOVACE_03_03_03 Ryby Číslo projektu CZ.1.07/1.4.00/21.3185 Klíčová aktivita III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Zařazení učiva v rámci ŠVP Přírodopis
Základní škola praktická Halenkov VY_32_INOVACE_03_03_03 Ryby Číslo projektu CZ.1.07/1.4.00/21.3185 Klíčová aktivita III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Zařazení učiva v rámci ŠVP Přírodopis
Dějiny somatologie hlavním motivem byla touha vědět, co je příčinou nemoci a smrti
 patří mezi biologické vědy, které zkoumají živou přírodu hlavním předmětem zkoumání je člověk název je odvozen od řeckých slov: SOMA = TĚLO LOGOS = VĚDA, NAUKA Dějiny somatologie hlavním motivem byla touha
patří mezi biologické vědy, které zkoumají živou přírodu hlavním předmětem zkoumání je člověk název je odvozen od řeckých slov: SOMA = TĚLO LOGOS = VĚDA, NAUKA Dějiny somatologie hlavním motivem byla touha
1- živočichové úvod. Moravské gymnázium Brno s.r.o. RNDr. Monika Jörková. Tematická oblast. Ročník 2. Datum tvorby 10.9.2013
 Číslo projektu CZ.1.07/1.5.00/34.0743 Název školy Autor Tematická oblast Moravské gymnázium Brno s.r.o. RNDr. Monika Jörková 1- živočichové úvod Ročník 2. Datum tvorby 10.9.2013 Anotace - pro učitele i
Číslo projektu CZ.1.07/1.5.00/34.0743 Název školy Autor Tematická oblast Moravské gymnázium Brno s.r.o. RNDr. Monika Jörková 1- živočichové úvod Ročník 2. Datum tvorby 10.9.2013 Anotace - pro učitele i
Nové orgány na postupu
 Nové orgány na postupu Pěstování celých orgánů z kmenových buněk je v současnosti oblíbené. Základní postup, který biologové používají, je vesměs podobný. Aby se kmenová buňka změnila ve správný buněčný
Nové orgány na postupu Pěstování celých orgánů z kmenových buněk je v současnosti oblíbené. Základní postup, který biologové používají, je vesměs podobný. Aby se kmenová buňka změnila ve správný buněčný
Životaschopnost. (= vitalita = viabilita) počet živých buněk. 100 = [%] počet všech buněk
![Životaschopnost. (= vitalita = viabilita) počet živých buněk. 100 = [%] počet všech buněk Životaschopnost. (= vitalita = viabilita) počet živých buněk. 100 = [%] počet všech buněk](/thumbs/94/120369223.jpg) Životaschopnost (= vitalita = viabilita) počet živých buněk. 100 = ---------------------------------------- [%] počet všech buněk Využití: při kultivaci buněk pro různé účely (hodnocení cytotoxického účinku,
Životaschopnost (= vitalita = viabilita) počet živých buněk. 100 = ---------------------------------------- [%] počet všech buněk Využití: při kultivaci buněk pro různé účely (hodnocení cytotoxického účinku,
Vitální barvení, rostlinná buňka, buněčné organely
 Vitální barvení, rostlinná buňka, buněčné organely Vitální barvení používá se u nativních preparátů a rozumíme tím zvýšení kontrastu určitých buněčných složek v živých buňkách, nebo tkáních pomocí barvení
Vitální barvení, rostlinná buňka, buněčné organely Vitální barvení používá se u nativních preparátů a rozumíme tím zvýšení kontrastu určitých buněčných složek v živých buňkách, nebo tkáních pomocí barvení
Použití v laboratorních podmínkách
 Použití v laboratorních podmínkách Obsah Velcorin použití v laboratorních podmínkách Strana 3 5 Úvod Strana 3 Bezpečnostní opatření Strana 3 Pracovní postup (senzoricky) Strana 4 Pracovní postup (mikrobiologicky)
Použití v laboratorních podmínkách Obsah Velcorin použití v laboratorních podmínkách Strana 3 5 Úvod Strana 3 Bezpečnostní opatření Strana 3 Pracovní postup (senzoricky) Strana 4 Pracovní postup (mikrobiologicky)
Téma: Testy životaschopnosti a Počítání buněk
 LRR/BUBV vičení z buněčné biologie Úloha č. 3 Téma: Testy životaschopnosti a Počítání Úvod: Při práci s buňkami je jedním ze základních sledovaných parametrů stanovení jejich životaschopnosti (viability).
LRR/BUBV vičení z buněčné biologie Úloha č. 3 Téma: Testy životaschopnosti a Počítání Úvod: Při práci s buňkami je jedním ze základních sledovaných parametrů stanovení jejich životaschopnosti (viability).
Živočišné tkáně EPITELOVÁ TKÁŇ
 PL 15 /LP 4 Živočišné tkáně EPITELOVÁ TKÁŇ Teorie: Stavba a funkce tkání Tkáně představují soubory buněk stejného původu, metabolismu, funkce i tvaru. Z hlediska vývoje, stavby a funkce je dělíme na tkáně:
PL 15 /LP 4 Živočišné tkáně EPITELOVÁ TKÁŇ Teorie: Stavba a funkce tkání Tkáně představují soubory buněk stejného původu, metabolismu, funkce i tvaru. Z hlediska vývoje, stavby a funkce je dělíme na tkáně:
Z čeho se skládá naše tělo
 biologie Z čeho se skládá naše tělo Akademie věd ČR hledá mladé vědce Úvodní list Předmět: Biologie Cílová skupina: 1. ročník SŠ/G (podle zařazení učiva) Délka trvání: 90 min. Název hodiny: Z čeho se skládá
biologie Z čeho se skládá naše tělo Akademie věd ČR hledá mladé vědce Úvodní list Předmět: Biologie Cílová skupina: 1. ročník SŠ/G (podle zařazení učiva) Délka trvání: 90 min. Název hodiny: Z čeho se skládá
Základní pojmy a vztahy: Vlnová délka (λ): vzdálenost dvou nejbližších bodů vlnění kmitajících ve stejné fázi
 LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 1. SVĚTELNÁ MIKROSKOPIE A PREPARÁTY V MIKROSKOPII TEORETICKÝ ÚVOD: Mikroskopie je základní metoda, která nám umožňuje pozorovat velmi malé biologické objekty. Díky
LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 1. SVĚTELNÁ MIKROSKOPIE A PREPARÁTY V MIKROSKOPII TEORETICKÝ ÚVOD: Mikroskopie je základní metoda, která nám umožňuje pozorovat velmi malé biologické objekty. Díky
Žahavci. Nervová soustava je velmi primitivní (je rozptýlená). Tvoří jí volně umístěné a propojené jednotlivé nervové buňky.
 Žahavci 1. Co vše patří pod kmen žahavci? Když se řeknou žahavci, většina z nás si představí žahavé medúzy plovoucí v moři. Zkoušeli jste se zamyslet nad tím, jak se vlastně medúzy rozmnožují? Které další
Žahavci 1. Co vše patří pod kmen žahavci? Když se řeknou žahavci, většina z nás si představí žahavé medúzy plovoucí v moři. Zkoušeli jste se zamyslet nad tím, jak se vlastně medúzy rozmnožují? Které další
4.2.3 ŠÍŘE FREKVENČNÍHO PÁSMA CHOROVÉHO ELEMENTU A DISTRIBUČNÍ FUNKCE VLNOVÝCH NORMÁL
 4.2.3 ŠÍŘE FREKVENČNÍHO PÁSMA CHOROVÉHO ELEMENTU A DISTRIBUČNÍ FUNKCE VLNOVÝCH NORMÁL V předchozích dvou podkapitolách jsme ukázali, že chorové emise se mohou v řadě případů šířit nevedeným způsobem. Připomeňme
4.2.3 ŠÍŘE FREKVENČNÍHO PÁSMA CHOROVÉHO ELEMENTU A DISTRIBUČNÍ FUNKCE VLNOVÝCH NORMÁL V předchozích dvou podkapitolách jsme ukázali, že chorové emise se mohou v řadě případů šířit nevedeným způsobem. Připomeňme
KOSTRA HLAVY. Somatologie Mgr. Naděžda Procházková
 KOSTRA HLAVY Somatologie Mgr. Naděžda Procházková Lebka - CRANIUM Obličejová část SPLANCHNOCRANIUM -u člověka je poměrně malá - spojení kostí mají přibližně klínový tvar - horní oddíl pevně spojené kosti
KOSTRA HLAVY Somatologie Mgr. Naděžda Procházková Lebka - CRANIUM Obličejová část SPLANCHNOCRANIUM -u člověka je poměrně malá - spojení kostí mají přibližně klínový tvar - horní oddíl pevně spojené kosti
Embryologie III. Vývoj žloutkového váčku, amnion, chorion. Extraembryonální coelom. Ústav pro histologii a embryologii 1.LF Univerzity Karlovy
 Embryologie III Vývoj žloutkového váčku, amnion, chorion. Extraembryonální coelom. Ústav pro histologii a embryologii 1.LF Univerzity Karlovy Přednášející: Doc. MUDr. Tomáš Kučera, Ph.D. Předmět: Obecná
Embryologie III Vývoj žloutkového váčku, amnion, chorion. Extraembryonální coelom. Ústav pro histologii a embryologii 1.LF Univerzity Karlovy Přednášející: Doc. MUDr. Tomáš Kučera, Ph.D. Předmět: Obecná
1 Popis vzorku. 2 Detekční limit vyšetření. 3 Časová náročnost. 4 Zpracování vzorku. 4.1 Množství vzorku. 4.2 Odběr vzorků
 1 Popis vzorku Podle tohoto postupu se vyšetřují vzorky různých druhů masných výrobků. Pomocí histochemického barvení lze prokázat přítomnost škrobových zrn a na jejich základě vyslovit podezření o použití
1 Popis vzorku Podle tohoto postupu se vyšetřují vzorky různých druhů masných výrobků. Pomocí histochemického barvení lze prokázat přítomnost škrobových zrn a na jejich základě vyslovit podezření o použití
Rozvoj vzdělávání žáků karvinských základních škol v oblasti cizích jazyků Registrační číslo projektu: CZ.1.07/1.1.07/02.0162
 Rozvoj vzdělávání žáků karvinských základních škol v oblasti cizích jazyků Registrační číslo projektu: CZ.1.07/1.1.07/02.0162 ZŠ Určeno pro Sekce Předmět Prameny 6. 7. třída (pro 3. 9. třídy) Základní
Rozvoj vzdělávání žáků karvinských základních škol v oblasti cizích jazyků Registrační číslo projektu: CZ.1.07/1.1.07/02.0162 ZŠ Určeno pro Sekce Předmět Prameny 6. 7. třída (pro 3. 9. třídy) Základní
Obecná a srovnávací odontologie. Vývojové souvislosti 1: vznik a vývoj zubu jako produkt genetických regulačních kaskád, odontogenní regulační kód
 Obecná a srovnávací odontologie Vývojové souvislosti 1: vznik a vývoj zubu jako produkt genetických regulačních kaskád, odontogenní regulační kód Vývojové souvislosti 1: vznik a vývoj zubu jako produkt
Obecná a srovnávací odontologie Vývojové souvislosti 1: vznik a vývoj zubu jako produkt genetických regulačních kaskád, odontogenní regulační kód Vývojové souvislosti 1: vznik a vývoj zubu jako produkt
Přímé stanovení celkového počtu buněk kvasinek pomocí Bürkerovy komůrky Provedení vitálního testu
 Přímé stanovení celkového počtu buněk kvasinek pomocí Bürkerovy komůrky Provedení vitálního testu Otázky k zamyšlení: Bude se jednat o přímé nebo nepřímé stanovení počtu buněk? Stanovujeme počet živých
Přímé stanovení celkového počtu buněk kvasinek pomocí Bürkerovy komůrky Provedení vitálního testu Otázky k zamyšlení: Bude se jednat o přímé nebo nepřímé stanovení počtu buněk? Stanovujeme počet živých
Střední průmyslová škola strojnická Olomouc, tř. 17. listopadu 49
 Střední průmyslová škola strojnická Olomouc, tř. 17. listopadu 49 Výukový materiál zpracovaný v rámci projektu Výuka moderně Registrační číslo projektu: CZ.1.07/1.5.00/34.0205 Šablona: III/2 Přírodovědné
Střední průmyslová škola strojnická Olomouc, tř. 17. listopadu 49 Výukový materiál zpracovaný v rámci projektu Výuka moderně Registrační číslo projektu: CZ.1.07/1.5.00/34.0205 Šablona: III/2 Přírodovědné
Malý test znalostí odběrových skupin - fotografie
 Malý test znalostí odběrových skupin - fotografie správné odpovědi, vyhodnocení a komentáře PT#V/8/2018 Odběry vzorků přírodní koupaliště Připravil: Petr Pumann, Státní zdravotní ústav, 3. 7. 2018 Účastníci
Malý test znalostí odběrových skupin - fotografie správné odpovědi, vyhodnocení a komentáře PT#V/8/2018 Odběry vzorků přírodní koupaliště Připravil: Petr Pumann, Státní zdravotní ústav, 3. 7. 2018 Účastníci
ČESKÁ ZEMĚDĚLSKÁ UNIVERZITA V PRAZE Fakulta životního prostředí Katedra ekologie a životního prostředí. Obror Aplikovaná ekoligie.
 ČESKÁ ZEMĚDĚLSKÁ UNIVERZITA V PRAZE Fakulta životního prostředí Katedra ekologie a životního prostředí Obror Aplikovaná ekoligie Bakalářská práce Doupné stromy v lesích Den-trees in the forests Vedoucí
ČESKÁ ZEMĚDĚLSKÁ UNIVERZITA V PRAZE Fakulta životního prostředí Katedra ekologie a životního prostředí Obror Aplikovaná ekoligie Bakalářská práce Doupné stromy v lesích Den-trees in the forests Vedoucí
Kloubní výživa Ecce Vita s hydrolizovaným Kolagenem
 Kloubní výživa Ecce Vita s hydrolizovaným Kolagenem Tento produkt byl vyvinut ve spolupráci Mudr. Davida Freje, Ing. Ivety Jecmik Skuherské a odborníků z Japonska. Funkční a dobře vstřebatelná kombinace
Kloubní výživa Ecce Vita s hydrolizovaným Kolagenem Tento produkt byl vyvinut ve spolupráci Mudr. Davida Freje, Ing. Ivety Jecmik Skuherské a odborníků z Japonska. Funkční a dobře vstřebatelná kombinace
Praktické cvičení č. 1.
 Praktické cvičení č. 1. Cvičení 1. 1. Všeobecné pokyny ke cvičení, zápočtu a zkoušce Bezpečnost práce 2. Mikroskopie - mikroskop a mikroskopická technika - převzetí pracovních pomůcek - pozorování trvalého
Praktické cvičení č. 1. Cvičení 1. 1. Všeobecné pokyny ke cvičení, zápočtu a zkoušce Bezpečnost práce 2. Mikroskopie - mikroskop a mikroskopická technika - převzetí pracovních pomůcek - pozorování trvalého
ROZMNOŽOVÁNÍ A VÝVIN MNOHOBUNĚČNÝCH, TKÁNĚ
 ROZMNOŽOVÁNÍ A VÝVIN MNOHOBUNĚČNÝCH, TKÁNĚ 1. Doplň následující věty. Pohlavní buňky u fylogeneticky nižších živočichů vznikají z nediferenciovaných buněk. Přeměna těchto buněk v buňky pohlavní je určována
ROZMNOŽOVÁNÍ A VÝVIN MNOHOBUNĚČNÝCH, TKÁNĚ 1. Doplň následující věty. Pohlavní buňky u fylogeneticky nižších živočichů vznikají z nediferenciovaných buněk. Přeměna těchto buněk v buňky pohlavní je určována
Zákon odrazu. Úhel odrazu je roven úhlu dopadu, přičemž odražené paprsky zůstávají v rovině dopadu.
 1. ZÁKON ODRAZU SVĚTLA, ODRAZ SVĚTLA, ZOBRAZENÍ ZRCADLY, Dívejme se skleněnou deskou, za kterou je tmavší pozadí. Vidíme v ní vlastní obličej a současně vidíme předměty za deskou. Obojí však slaběji než
1. ZÁKON ODRAZU SVĚTLA, ODRAZ SVĚTLA, ZOBRAZENÍ ZRCADLY, Dívejme se skleněnou deskou, za kterou je tmavší pozadí. Vidíme v ní vlastní obličej a současně vidíme předměty za deskou. Obojí však slaběji než
Projekt realizovaný na SPŠ Nové Město nad Metují
 Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 Přírodovědné předměty Hana Gajdušková 1 Viry
Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 Přírodovědné předměty Hana Gajdušková 1 Viry
Výměnné pobyty s US vysokými školami
 Výměnné pobyty s US vysokými školami Hlavní řešitel: prof. RNDr. David Lukáš, CSc. Fakulta textilní, Katedra netkaných textilií a nanovlákenných materiálů Závěrečný seminář k rozvojovým programům MŠMT
Výměnné pobyty s US vysokými školami Hlavní řešitel: prof. RNDr. David Lukáš, CSc. Fakulta textilní, Katedra netkaných textilií a nanovlákenných materiálů Závěrečný seminář k rozvojovým programům MŠMT
