Celkové shrnutí vědeckého hodnocení přípravku Diflucan a souvisejících názvů (viz příloha I)
|
|
|
- Žaneta Moravcová
- před 6 lety
- Počet zobrazení:
Transkript
1 PŘÍLOHA II Vědecké závěry a zdůvodnění potřebných úprav souhrnu údajů o přípravku, označení na obalu a příbalové informace předkládané Evropskou agenturou pro léčivé přípravky 31
2 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Diflucan a souvisejících názvů (viz příloha I) Flukonazol je látka náležející do skupiny chemických látek, které se nazývají triazolové deriváty. Flukonazol inhibuje především syntézu ergosterolu u plísní a mykotické enzymy, jejichž působení je zprostředkováno cytochromem p-450. Flukonazol má protiplísňový účinek proti většině klinicky běžných druhů kvasinek rodu Candida. Flukonazol účinkuje také in vitro proti druhům rodu Cryptococcus. Flukonazol, azol třetí generace, je charakterizován vysokou perorální biologickou dostupností, širokou distribucí v tělních tekutinách a tkáních, předvídatelnou renální clearancí a podáváním jednou denně. Způsob rozpouštění umožňuje perorální i intravenózní podání. Vzhledem k podobným farmakokinetickým vlastnostem perorálně a intravenózně podávaného flukonazolu a dobré biologické dostupnosti flukonazolu lze výsledky získané při perorálním podávání rovněž použít pro intravenózní lékovou formu. Flukonazol je pro perorální podání k dispozici ve formě 50mg, 100mg, 150mg a 200mg tobolek, ve formě sirupu 5 mg/ml a ve formě prášku pro přípravu perorální suspenze rekonstitucí s vodou 50 mg nebo 200 mg/ml. Vzhledem k tomu, že léčba kandidózy genitálií vyžaduje podání jedné 150mg dávky flukonazolu, je v některých členských státech flukonazol k dispozici ve vhodné lékové formě obsahující jednu 150mg tobolku pouze pro indikaci kandidózy genitálií, konkrétně pro léčbu akutní vaginální kandidózy a kandidové balanitidy. Flukonazol je k dispozici rovněž pro intravenózní použití ve formě fyziologického roztoku s obsahem 2 mg/ml. Flukonazol byl rovněž k dispozici pro lokální použití ve formě 0,5% gelu. Tato léková forma byla schválena pouze v Itálii a byla indikována k léčbě dermatomykóz vyvolaných dermatofyty, kvasinkami a plísněmi. V průběhu hodnocení postupu držitel rozhodnutí o registraci dobrovolně stáhl přípravek ve formě gelu z evropského trhu. Výsledek tohoto postupu přezkoumání proto nezahrnuje hodnocení gelové lékové formy. Přípravek Diflucan byl zahrnut do seznamu přípravků, u nichž má být sjednocen souhrn údajů o přípravku podle čl. 30 odst. 2 směrnice 2001/83/ES, v platném znění. Vzhledem k tomu, že členské státy vydaly rozdílná rozhodnutí o registraci výše uvedených přípravků (a souvisejících názvů), uvědomila Evropská komise sekretariát výboru CHMP agentury EMA o oficiálním předložení záležitosti k přezkoumání podle článku 30 směrnice 2001/83/ES, v platném znění, aby se vyřešily rozdíly mezi souhrny údajů o přípravku vydanými jednotlivými státy a tak se sjednotil souhrn údajů o přípravku v rámci celé Evropské unie. Bod 4.1 Terapeutické indikace 50mg, 100mg, 150mg a 200mg tobolky, sirup 5 mg/ml, prášek pro přípravu perorální suspenze 50 mg/5 ml nebo 200 mg/5 ml, infuzní roztok 2 mg/ml Výbor CHMP zhodnotil údaje o přípravku, přičemž vzal v úvahu stávající vnitrostátní údaje o přípravku a vědecké poznatky, a projednal indikace pro každé jednotlivé onemocnění. Výbor rovněž projednal a odůvodnil profylaktické použití přípravku Diflucan, které se liší od terapeutických indikací. Byly objasněny rovněž pediatrické indikace přípravku. 32
3 Ve všech studiích slizniční kandidózy byl flukonazol u dospělých i pediatrických pacientů stejně účinný nebo účinnější než standardní přípravky. Flukonazol byl rovněž celkově dobře snášen a v souvislosti s dávkami až do 400 mg/den včetně nebyly zaznamenány žádné klinicky významné změny. Výsledky svědčí ve prospěch flukonazolu jako vhodného přípravku k léčbě slizniční kandidózy, včetně orofaryngeální, jícnové kandidózy, kandidurie a chronické mukokutánní kandidózy. Výbor CHMP se shodl na tom, že by měl být flukonazol indikován pro léčbu chronické orální atrofické kandidózy (bolestivosti kolem zubní náhrady), pokud není dentální hygiena nebo lokální léčba dostatečná. Byla zkoumána indikace při prevenci relapsu u imunokompromitovaných pacientů (v důsledku HIV nebo nádorového onemocnění). Jednalo se o několik různých dávkovacích režimů, 100 mg/den, 200 mg/den a 200 mg třikrát týdně. Ve všech studiích byl flukonazol při prevenci klinického relapsu stejně účinný nebo účinnější než placebo. U pacientů s nádorovým onemocněním byl při prevenci mykologického relapsu účinnější než placebo. Výbor CHMP dospěl k závěru, že kontinuální léčba flukonazolem v dávce 100 mg/den a kontinuální nebo intermitentní léčba v dávce 200 mg/den je účinná při prevenci relapsu orofaryngeální nebo jícnové kandidózy u imunokompromitovaných pacientů a je rovněž dobře snášena. Výbor CHMP souhlasí s oddělením léčby od profylaxe relapsu orofaryngeální kandidózy a s náležitou úpravou dávkování. Kandidová infekce v oblasti genitálií u mužů a žen je relativně častá a dobře reaguje na perorální podání flukonazolu. Flukonazol je schválen pro léčbu akutní nebo opakované kandidové vulvovaginitidy u žen a kandidové balanitidy u mužů. Flukonazol se rovněž používá jako udržovací léčba (profylaxe) při prevenci recidivy vaginální kandidózy. Perorální léčba jednou dávkou flukonazolu u vaginální kandidózy a kandidové balanitidy byla používána přibližně 30 let. Důkazy jsou založeny na třech studiích v rámci programu klinických zkoušek, které zkoumaly vulvovaginální kandidózu, a jedné studii v rámci programu klinických zkoušek, která zkoumala kandidovou balanitidu. Farmakokinetický profil flukonazolu umožňuje jeho použití jako jediné léčivé látky vzhledem k jeho prodlouženému poločasu eliminace (přibližně 36 hodin) a jeho distribuci do tkání a sekretů vagíny s koncentracemi, které přesahují minimální inhibiční koncentraci C. albicans, přetrvávající po dobu nejméně 72 hodin. Celkově poskytuje jedna 150mg dávka flukonazolu bezpečnou a účinnou léčbu vulvovaginální kandidózy u dospělých žen nebo kandidové balanitidy u dospělých mužů. Výbor CHMP dospěl k názoru, že jedna dávka flukonazolu vzhledem k jeho účinku proti druhům rodu Candida a jeho farmakokinetickým vlastnostem nabízí bezpečnou, účinnou a výhodnou alternativu k lokální léčbě kandidové vaginitidy a kandidové balanitidy u dospělých a při prevenci recidivy vaginální kandidózy. Výbor CHMP uznal, že údaje předložené držitelem rozhodnutí o registraci byly s ohledem na tyto indikace uspokojivé. Endemické mykózy představují v několika zemích závažný problém pro veřejné zdraví a jejich výskyt stále vzrůstá v souvislosti s šířením HIV infekce. Kokcidiomykóza je onemocnění s proměnlivými projevy. Incidence těchto plísňových infekcí v endemických oblastech stoupá a počet osob, které cestují do určitých endemických oblastí Spojených států a Jižní Ameriky, narůstá. Léčba flukonazolem je účinná u několika hlubokých mykóz. Tato skutečnost je podepřena údaji z klinických studií a uvedena v klinických pokynech. Výbor CHMP dospěl k závěru, že flukonazol v dávce 400 mg až 800 mg denně je bezpečnou a účinnou primární léčbou kokcidiomykózy. Výbor CHMP se rovněž shodl na tom, že držitel rozhodnutí o registraci předložil dostatečné údaje týkající se účinnosti a bezpečnosti flukonazolu v rámci léčby invazivních plísňových infekcí (kryptokokóza, invazivní kandidóza) ve srovnání s ostatními léčebnými možnostmi a prokázal příznivý poměr přínosů a rizik. Používání flukonazolu pro výše uvedené indikace je rovněž podpořeno pokyny Americké společnosti pro infekční onemocnění (IDSA). S ohledem na indikace parakokcidiomykózy, histoplazmózy, lymfokutánní sporotrichózy, kde jiné přípravky selhaly nebo nebyly snášeny, výbor CHMP 33
4 usoudil, že předložená data týkající se účinnosti nebyla dostatečná. Proto nejsou tyto indikace nadále uvedeny v bodě 4.1 souhrnu údajů o přípravku a do odpovídajícího bodu bylo zařazeno upozornění. Mezi dermatomykózy patří tinea pedis, tinea corporis, tinea cruris, tinea vesicolor, tinea unguinium (onychomykóza) a kožní kandidové infekce. Použití flukonazolu při léčbě kožních plísňových infekcí bylo zkoumáno v několika srovnávacích i nesrovnávacích studiích. Tyto studie prokázaly, že perorální flukonazol je účinnou a dobře snášenou protiplísňovou látkou proti tinea corporis, tinea cruris, tinea pedis, tinea vesicolor a onychomykóze. Ohledně tinea unguinium (onychomykóza) se došlo k závěru, že flukonazol je indikován pouze v případě, že podání jiné látky není považováno za vhodné. Výbor CHMP souhlasil s konečným zněním této indikace. Kryptokoková meningitida je způsobena plísní Cryptococcus neoformans. Ačkoliv C. neoformans obvykle infikuje imunokompromitované osoby, k jejímu rozvoji může dojít i u pacientů bez zřejmých poruch imunitního systému. Flukonazol prokázal in vitro a in vivo účinnost proti plísni Cryptococcus neoformans, a poskytuje tak klinickým lékařům možnost léčby, která je méně toxická než amfotericin B. Flukonazol je bezpečnou a účinnou protiplísňovou léčbou u zdravých i imunokompromitovaných pacientů s kryptokokovou meningitidou a k dispozici jsou klinická data podporující používání flukonazolu při léčbě tohoto onemocnění u dětí i dospělých. Výbor CHMP rovněž uznal, že podpůrné údaje zohledňují pouze indikaci kryptokokové meningitidy, která je uvedena v souhrnu údajů o přípravku, nikoliv obecnou indikaci kryptokokózy. Ukázalo se, že flukonazol je bezpečnou a účinnou léčbou invazivní kandidózy. Flukonazol a amfotericin B vykazovaly podobnou míru klinické reakce a míru přežití při léčbě kandidémie, nežádoucí účinky ve vztahu k podávanému přípravku však byly častěji zaznamenány v souvislosti s amfotericinem B. Výbor CHMP dospěl k závěru, že flukonazol je ve srovnání s jinými možnostmi léčby bezpečný a účinný léčivý přípravek při profylaxi nebo léčbě invazivní kandidózy. Tato indikace neodkazuje na žádné jiné individuální formy invazivních kandidových infekcí. Invazivní kandidové infekce se staly obvyklými a život ohrožujícími komplikacemi u pacientů s leukemií, nádorovým onemocněním, hematologickými malignitami a u pacientů po transplantaci kostní dřeně. Zvláště pacienti s neutropenií jsou výrazně ohroženi rozvojem kandidémie. Protiplísňové přípravky se používají v mnoha profylaktických indikacích, ale pouze několik studií náležitě hodnotilo jejich účinnost. Původní žádosti pro indikace prevence plísňových infekcí zahrnovaly 7 srovnávacích klinických studií, ve kterých 755 pacientů užívalo perorální flukonazol, 383 pacientů placebo a 374 pacientů perorální srovnávací léčivý přípravek. Většina pacientů zahájila protiplísňovou profylaxi před navozením neutropenie chemoterapií nebo radioterapií, kterou podstoupili z důvodu maligního onemocnění nebo transplantace kostní dřeně. V původní žádosti bylo uvedeno použití flukonazolu jako profylaktické látky k prevenci rozvoje plísňové infekce u neutropenických pacientů. Flukonazol byl zaveden rovněž jako standardní léčba v rámci prevence rozvoje infekcí u neutropenických pacientů. V nedávné době zveřejnila Americká společnost pro infekční onemocnění (IDSA: Pappas a kol., 2009) aktualizované pokyny týkající se použití protiplísňových látek při indikaci prevence, ve kterých není flukonazol pro prevenci doporučen. Výbor CHMP souhlasil s předloženými údaji a uznal, že flukonazol je účinný při profylaxi kandidových infekcí u pacientů s dlouhodobou neutropenií. 34
5 Použití u dětí V letech se uskutečnil společný pracovní projekt EU Hodnocení pediatrických údajů. Farmakokinetické údaje z 5 studií byly hodnoceny u 113 pediatrických pacientů; jednalo se o 2 studie, ve kterých se použila jedna dávka, 2 studie, ve kterých se použilo více dávek, a jednu studii u nezralých novorozenců. Další údaje byly k dispozici ze studie zabývající se používáním přípravku k léčbě z humánních důvodů (EU, 2006). Navržený text pro farmakokinetika u dětí byl schválen v rámci společného pracovního projektu EU. Flukonazol je účinný při léčbě plísňových infekcí u dospělých v rozmezí dávek, které je doporučeno ve vnitrostátních souhrnech údajů o přípravku ( mg denně). V pediatrické populaci se flukonazol používá při léčbě slizniční kandidózy (orofaryngeální, jícnové), systémové kandidózy a kryptokokových infekcí a při prevenci plísňových infekcí u ohrožených imunokompromitovaných dětí po cytotoxické chemoterapii nebo radioterapii. slizniční kandidóza (orofaryngeální a jícnová) u dětí Akutní orální kandidóza se může vyskytnout až u 5 % novorozenců. Nejčastěji je spojena se závažnou imunologickou poruchou, kterou způsobila tato onemocnění: diabetes mellitus, leukemie, lymfom, maligní onemocnění, neutropenie a HIV infekce tam, kde je indikátorem klinické progrese do onemocnění AIDS. Predispozičními faktory je rovněž použití širokospektrých antibiotik, kortikosteroidů, cytotoxických léčivých přípravků a radioterapie. Orofaryngeální kandidóza je nadále jednou z nejčastějších oportunních infekcí u HIV infikovaných dětí v éře vysoce účinné antiretrovirové terapie (HAART) (28 % dětí), s mírou výskytu 0,93 na 100 dětí/roků. Jícnová kandidóza je primárně spojena s HIV infekcí nebo jinými formami imunosuprese u dětí. Výskyt jícnové kandidózy je po zavedení léčby HAART kolem roku 2001 přibližně 0,08 na 100 dětí/roků. Kandidová ezofagitida se nadále objevuje u dětí, které na antiretrovirovou léčbu nereagují. Mezi rizikové faktory jícnové kandidózy u dětí s infekcí HIV patří nízký počet CD4 (<100 buněk/mm 3 ), vysoká virová zátěž a neutropenie (<500 buněk/mm 3 ). Systémová léčba je v případě onemocnění jícnu nezbytná a u HIV infikovaných dětí, které trpí jícnovou kandidózou a příznaky postižení jícnu, by měla být zahájena empiricky. U většiny pacientů by měly příznaky ustoupit během několika dnů po zahájení účinné léčby. Roztoky flukonazolu pro perorální nebo intravenózní podání podávané po dobu dnů jsou při léčbě kandidové ezofagitidy vysoce účinné. Výbor CHMP souhlasil s tím, že dostupná data jsou dostatečná pro bezpečné a účinné používání flukonazolu k léčbě a prevenci slizniční (orofaryngeální a jícnové) kandidózy u dětí. Invazivní kandidóza u dětí Diseminovaná kandidóza není u dětí infikovaných virem HIV častá, ale Candida se může rozšířit z jícnu především v přítomnosti infekce virem herpes simplex (HSV) nebo cytomegalovirem (CMV). Kandidóza se vyskytuje až u 12 % HIV infikovaných dětí s dlouhodobě zavedenými centrálními venózními katétry pro celkovou parenterální výživu nebo intravenózní podávání antibiotik. Flukonazol se používá při léčbě invazivních kandidových infekcí u dětí. Léčba invazivní kandidózy vyžaduje vyšší dávky flukonazolu než při léčbě mukokutánních onemocnění. Alternativně lze podat počáteční léčbu amfotericinem B a poté dokončit léčbu podáváním flukonazolu. Flukonazol podávaný u dětí v dávce 12 mg/kg/den zprostředkovává expozici podobnou standardní denní dávce 400 mg u dospělých. Podávání vyšších dávek se u dětí nedoporučuje. Výbor CHMP dospěl k názoru, že léčba invazivní kandidózy u dětí je dostatečně prokázaná. 35
6 Kryptokokové infekce u dětí Kryptokokóza je charakteristickou oportunní infekcí pro AIDS. Mezi další okolnosti, které zvyšují riziko infekce, patří některé lymfomy (např. Hodgkinův lymfom), sarkoidóza a dlouhodobá léčba kortikosteroidy. Kryptokokové infekce se pravděpodobněji vyskytnou ve spojení s onemocněním HIV, ale jejich výskyt je výrazně méně častý u HIV infikovaných dětí než u dospělých. Flukonazol se používá k léčbě pediatrických pacientů s kryptokokovým onemocněním. Stejně jako v případě indikace u dospělých byl i u dětí výbor CHMP toho názoru, že jsou k dispozici dostatečné důkazy pro indikaci přípravku při léčbě a prevenci relapsu kryptokokové meningitidy. Profylaxe kandidových infekcí u imunokompromitovaných dětí Údaje podporující indikace flukonazolu při prevenci plísňových infekcí u imunokompromitovaných pediatrických pacientů v mezinárodní registrační dokumentaci (1993) byly získány ze tří studií u dětí. Jedna studie zkoumala účinnost léčby samotným flukonazolem oproti účinnosti léčby samotným nystatinem, druhá studie se týkala srovnání s perorálními polyeny (nystatinem nebo amfotericinem B) a ve třetí studii se účinnost léčby flukonazolem porovnávala s účinností léčby ketokonazolem. Flukonazol podávaný v dávkách 1 mg/kg/den a 3 mg/kg/den byl při prevenci plísňových infekcí účinnější než srovnávací léčivý přípravek. Dávka flukonazolu doporučená při prevenci plísňových infekcí u dospělých je mg a na základě výše uvedeného algoritmu je doporučená dávka u dětí 3 12 mg/kg/den. Výbor CHMP se shodl na tom, že flukonazol je indikován při profylaxi kandidových infekcí u imunokompromitovaných pacientů. Na závěr přijal výbor CHMP následující soubor indikací přípravku Diflucan a souvisejících názvů pro tobolky (50 mg, 100 mg, 150 mg a 200 mg), infuzní roztok, sirup a prášek pro přípravu perorální suspenze. Přípravek Diflucan (flukonazol) je indikován při léčbě těchto plísňových infekcí (viz bod 5.1). Přípravek Diflucan je u dospělých určen k léčbě: kryptokokové meningitidy (viz bod 4.4), kokcidiomykózy (viz bod 4.4), invazivní kandidózy, slizniční kandidózy, včetně orofaryngeální, jícnové kandidózy, kandidurie a chronické mukokutánní kandidózy, chronické orální atrofické kandidózy (bolestivosti kolem zubní náhrady), pokud dentální hygiena nebo lokální léčba není dostatečná, vaginální kandidózy, akutní nebo opakované; pokud není lokální léčba vhodná, kandidové balanitidy, pokud není lokální léčba vhodná, dermatomykózy, včetně tinea pedis, tinea corporis, tinea cruris, tinea vesicolor a kožních kandidových infekcí, pokud není indikována systémová léčba, Tinea unguinium (onychomykózy), pokud jsou jiné léky považovány za nevhodné. Přípravek Diflucan je u dospělých určen k profylaxi: relapsu kryptokokové meningitidy u pacientů s vysokým rizikem recidivy, relapsu orofaryngeální nebo jícnové kandidózy u pacientů infikovaných virem HIV, kteří jsou vysoce ohroženi relapsem, zmírnění výskytu opakované vaginální kandidózy (4 nebo více epizod za rok), 36
7 profylaxi kandidových infekcí u pacientů s dlouhodobou neutropenií (jako jsou pacienti s hematologickými malignitami léčení chemoterapií nebo pacienti po transplantaci hematopoetických kmenových buněk (viz bod 5.1). Přípravek Diflucan je indikován u zralých novorozenců, kojenců, batolat, dětí a dospívajících ve věku od 0 do 17 let: Přípravek Diflucan se používá k léčbě slizniční kandidózy (orofaryngeální, jícnové), invazivní kandidózy, kryptokokové meningitidy a k profylaxi kandidových infekcí u imunokompromitovaných pacientů. Přípravek Diflucan lze použít v rámci udržovací léčby k prevenci relapsu kryptokokové meningitidy u dětí s vysokým rizikem recidivy (viz bod 4.4). Léčbu lze zahájit před tím, než jsou známy výsledky kultivací a ostatních laboratorních vyšetření. Jakmile jsou ale tyto výsledky k dispozici, je nutné protiinfekční léčbu náležitě upravit. Je třeba přihlédnout k oficiálním pokynům týkajícím se vhodného používání protiplísňových přípravků. Léková forma jedna 150mg tobolka Indikace genitální kandidózy a konkrétněji vulvovaginální kandidózy u dospělých žen a kandidové balanitidy u dospělých mužů byla schválena v některých členských státech pro balení obsahující jednu 150mg tobolku vzhledem k výhodné jednodávkové léčbě. Výbor CHMP uznal, že údaje předložené držitelem rozhodnutí o registraci byly s ohledem na tyto indikace uspokojivé. Vzhledem k tomu, že léčba první linie této kandidózy je lokální aplikace, je balení obsahující jednu 150mg tobolku určeno pro výše zmíněné indikace genitální kandidózy u dospělých, u kterých není lokální léčba vhodná. Pro balení s jednou 150mg tobolkou byl bod 4.1 souhrnu údajů o přípravku schválen výborem CHMP v tomto znění: Přípravek Diflucan (flukonazol) je indikován při léčbě těchto plísňových infekcí u dospělých (viz bod 5.1): akutní vaginální kandidózy, pokud není lokální léčba vhodná, kandidová balanitidy, pokud není lokální léčba vhodná. Léčbu lze zahájit před tím, než jsou známy výsledky kultivací a ostatních laboratorních vyšetření. Jakmile jsou ale tyto výsledky k dispozici, je nutné protiinfekční léčbu náležitě upravit. Je třeba přihlédnout k oficiálním pokynům týkajícím se vhodného používání protiplísňových přípravků. Bod 4.2 Dávkování a způsob podání Mezi členskými státy se objevily rozdíly v dávkování u různých infekcí, např. u jednotlivých slizničních kandidových infekcí. Ke stejné situaci došlo v souvislosti s kryptokokózou/prevencí kryptokokových infekcí, invazivní kandidózou nebo vaginální kandidózou. Byly rovněž zaznamenány odlišnosti ve znění doporučení ohledně dávkování u dospívajících a dětí ve všech indikacích. Ohledně sjednocení dávkování byl držitel rozhodnutí o registraci požádán o zařazení tabulky s doporučenými dávkami pro každou indikaci do bodu dávkování a o rozlišení mezi léčbou a prevencí. Vzhledem k rychlé a téměř úplné perorální absorpci se dávky flukonazolu 37
8 doporučené při léčbě anebo profylaxi v různých indikacích s ohledem na perorální (ve formě tobolek, perorální suspenze a sirupu) a intravenózní podání neliší. Na základě předložených údajů se výbor CHMP dohodl na doporučeném dávkování pro každou indikaci. Pediatrická populace Farmakokinetický profil flukonazolu u dětí má velmi dobře prostudovanou souvislost s farmakokinetickým profilem u dospělých s ohledem na distribuční objem a clearance. To vede ke stanovení dávkovacího režimu u dětí, který odpovídá dávkovacímu režimu u dospělých. Dávky 3 mg/kg u dětí se ukázaly jako účinné proti plísňovým infekcím u imunokompromitovaných dětí a rovněž při léčbě pediatrických pacientů se závažnými plísňovými infekcemi, jako je kryptokoková meningitida. Výbor CHMP si povšiml, že bylo pominuto dávkování u dospívajících. Žádný z vnitrostátních souhrnů údajů o přípravku nezohledňoval tuto věkovou skupinu. Na základě otázek vznesených výborem CHMP předložil držitel rozhodnutí o registraci pro tuto specifickou věkovou skupinu dávkování na základě Pokynů k roli farmakokinetiky ve vývoji léčivého přípravku pro pediatrickou populaci, Výbor CHMP rovněž zastával názor, že bezpečnost a účinnost nebyla v rámci indikace genitální kandidózy v pediatrické populaci prokázána vzhledem k tomu, že dostupné údaje u dětí a dospívajících pocházejí ze studií jiných indikací než genitální kandidózy. Ve velmi vzácných případech je léčba dospívajících nevyhnutelná (tj. žádné jiné, především lokální možnosti léčby nejsou vhodné) a tyto případy by neměly být zcela vyjmuty z léčby. Konečné znění v bodě 4.2 souhrnu údajů o přípravku týkající se této indikace tedy zohledňuje diskusi výboru CHMP o všech lékových formách, včetně balení obsahujícího jednu 150mg tobolku. V konečném schváleném znění bodu 4.2 souhrnu údajů o přípravku jsou dávky v pediatrické populaci rozděleny podle věkových skupin na kojence, batolata a děti (28 dní až 11 let), dospívající (12 až 17 let) a zralé novorozence (0 až 27 dní). Bod 4.4 Zvláštní upozornění a opatření pro použití S ohledem na jednotlivé odstavce tohoto bodu se mezi všemi členskými státy vyskytují odlišnosti. Obecně by zohledněn hlavní bezpečnostní profil ze dne 2. dubna Bylo přidáno upozornění týkající se onemocnění tinea capitis a skutečnost, že by se přípravek neměl používat u dětí. S ohledem na kryptokokózu jsou důkazy účinnosti flukonazolu při léčbě kryptokokózy postihující jiné oblasti (např. plicní nebo kožní kryptokokóza) omezené. V případě hlubokých endemických mykóz byly důkazy účinnosti flukonazolu při léčbě ostatních forem endemických mykóz, jako je parakokcidiomykóza, lymfokutánní sporotrichóza a histoplazmóza, omezené a byly vyňaty z bodu 4.1 informací o přípravku. Tento bod byl tedy doplněn o upozornění. S ohledem na pacienty s poruchou ledvin bylo do informací o přípravku zařazeno upozornění s křížovým odkazem na bod 4.4 dávkování u této skupiny pacientů. Zdůraznilo se upozornění týkající se účinku na kardiovaskulární systém a souvislosti s prodloužením QT intervalu na elektrokardiogramu. Současné podávání flukonazolu s jinými léčivými přípravky, které prodlužují QT interval a které se metabolizují prostřednictvím cytochromu P450 (CYP) 3A4, je kontraindikováno. Halofantrin v doporučené terapeutické dávce 38
9 prokazatelně prodlužuje QTc interval a je substrátem enzymu CYP3A4. Současné používání flukonazolu a halofantrinu se proto nedoporučuje. Podrobnější informace byly zahrnuty do bodu 4.5 souhrnu údajů o přípravku. Tento bod byl rovněž doplněn o upozornění týkající se reakcí přecitlivělosti v souvislosti s jinými azoly. Vzhledem k tomu, že flukonazol je silný inhibitor CYP2C9 a mírný inhibitor CYP3A4 a je rovněž inhibitorem CYP2C19, měli by být pacienti současně léčení léčivými přípravky s úzkým terapeutickým oknem, které jsou metabolizovány enzymy CYP2C9, CYP2C19 a CYP3A4, sledováni. Všechny výše uvedené změny byly schváleny výborem CHMP a jsou platné pro všechny lékové formy. Bod 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce Výbor CHMP vzal na vědomí návrh držitele rozhodnutí o registraci a přijal pro tento bod sjednocený text. Uvedení látek, u kterých je známo zapojení enzymu CYP 3A4 a další nepříznivé vlivy na prodloužení QT intervalu (jako je halofantrin, midazolam a triazolam), je oprávněné. Uvedení znění týkající se interakce itrakonazolu (jiného triazolu) v informacích o přípravku pro saquinavir bylo s ohledem na nedávné změny na označení na obalu pro saquinavir (kontraindikace souběžného podávání s jinými léky, které prodlužují QTc interval) pozměněno. Souběžné podávání flukonazolu a saquinaviru bylo proto kontraindikováno a uvedl se křížový odkaz na bod 4.3 v informacích o přípravku. Všechny výše uvedené změny byly schváleny výborem CHMP a jsou platné pro všechny lékové formy. Bod 4.8 Nežádoucí účinky Výbor CHMP vzal na vědomí návrh držitele rozhodnutí o registraci a schválil sjednocené znění tohoto bodu, které se týká všech lékových forem přípravku Diflucan. Při sjednocování nežádoucích účinků uvedených ve vnitrostátních souhrnech údajů o přípravku Diflucan byl zohledněn hlavní bezpečnostní profil. Byl upřesněn obecný text klasifikace frekvencí výskytu a nežádoucí účinky zjištěné v průběhu sledování přípravku od uvedení na trh. Také byla přehodnocena frekvence výskytu mnoha nežádoucích účinků. Byla přezkoumána metodika a statistický přístup současně s poskytnutými údaji a výbor CHMP dospěl k názoru, že odhadované frekvence výskytu jsou přiměřené. Bod 5.1 Farmakodynamické vlastnosti Tento bod byl z části přepracován v souladu s pokyny. Do tohoto bodu byly zařazeny podnadpisy, např. mechanismus účinku, vztah mezi farmakokinetickými a farmakodynamickými vlastnostmi, mechanismy rezistence a hranice citlivosti (podle Evropské komise pro testování antimikrobiální citlivosti - EUCAST). Další body souhrnu údajů o přípravku Držitel rozhodnutí o registraci byl vyzván, aby vyhodnotil všechny další body souhrnů údajů o přípravku schválených na vnitrostátní úrovni a navrhl vhodné změny v textu tam, kde se vyskytují 39
10 odlišnosti. Navíc byly opraveny drobné typografické chyby. Výbor CHMP se všemi těmito změnami souhlasil. Příbalová informace Po provedení všech změn v souhrnu údajů o přípravku se některé z nich zohlednily v příbalové informaci. Po provedení úprav byla příbalová informace podrobena testu srozumitelnosti, který byl předložen a hodnocen během postupu přezkoumání. Výbor CHMP schválil výsledné znění příbalové informace. KVALITA MODUL 3 Držitel rozhodnutí o registraci předložil návrh na sjednocení modulu kvality. Údaje o vývoji, výrobě a kontrole tobolek, prášku pro přípravu perorální suspenze, sirupu a infuzního roztoku byly prezentovány uspokojivým způsobem. Výsledky provedených zkoušek prokázaly uspokojivou shodu a jednotnost významných charakteristik kvality přípravku a vedly k závěru, že přípravky by měly mít uspokojivý a jednotný účinek v klinickém použití. Na základě přezkoumání údajů přijal výbor CHMP sjednocený modul 3. 40
11 Zdůvodnění potřebných úprav souhrnu údajů o přípravku, označení na obalu a příbalové informace Výbor CHMP na základě posouzení návrhu a odpovědí držitele rozhodnutí o registraci a diskusí v rámci výboru schválil sjednocené znění souboru dokumentů s informacemi o přípravku pro různé varianty balení přípravku Diflucan a souvisejících názvů, přičemž vzal v úvahu jeho lékové formy. Sjednoceny byly zejména indikace a s nimi související doporučená dávkování. Byl přijat rovněž sjednocený modul 3. Výbor CHMP na základě výše uvedeného považoval poměr přínosů a rizik pro přípravek Diflucan a související názvy za příznivý a byl toho názoru, že je možné schválit sjednocené znění informací o přípravku. Vzhledem k tomu, že předmětem předložení záležitosti k přezkoumání bylo sjednocení souhrnů údajů o přípravku, označení na obalu a příbalové informace, souhrn údajů o přípravku, označení na obalu a příbalová informace navržené držiteli rozhodnutí o registraci byly posouzeny na základě předložené dokumentace a vědecké diskuse v rámci výboru, výbor CHMP doporučil pozměnit rozhodnutí o registraci přípravku Diflucan a souvisejících názvů (viz příloha I). Souhrn údajů o přípravku, označení na obalu a příbalová informace jsou uvedeny v příloze III. 41
Příloha II. Vědecké závěry a zdůvodnění změny v registraci
 Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
Celkové shrnutí vědeckého hodnocení přípravku Kytril a souvisejících názvů (viz příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÉ INFORMACE PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 11 Vědecké závěry Celkové
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÉ INFORMACE PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 11 Vědecké závěry Celkové
Celkové shrnutí vědeckého hodnocení přípravku Atacand Plus a související názvy (viz Příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÝCH INFORMACÍ PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 14 Vědecké závěry Celkové
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÝCH INFORMACÍ PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 14 Vědecké závěry Celkové
Příloha II. Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC
 Příloha II Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC 68 Vědecké závěry Koordinační skupina pro vzájemné uznávání
Příloha II Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC 68 Vědecké závěry Koordinační skupina pro vzájemné uznávání
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
PŘÍLOHA I. Seznam názvů, lékové formy, množství účinné látky v lécích, způsob podávání a uchazeči v členských státech
 PŘÍLOHA I Seznam názvů, lékové formy, množství účinné látky v lécích, způsob podávání a uchazeči v členských státech 1 Členský stát EU/EHP Žadatel (Smyšlený název) Název Koncentrace Léková forma Způsob
PŘÍLOHA I Seznam názvů, lékové formy, množství účinné látky v lécích, způsob podávání a uchazeči v členských státech 1 Členský stát EU/EHP Žadatel (Smyšlený název) Název Koncentrace Léková forma Způsob
STŘEDNÍ ZDRAVONICKÁ ŠKOLA KROMĚŘÍŽ SPECIÁLNÍ FARMAKOLOGIE KLINICKÁ PROPEDEUTIKA ANTIMYKOTIKA ROČNÍK: 3. ŠKOLNÍ ROK: 2012 / 2013
 STŘEDNÍ ZDRAVONICKÁ ŠKOLA KROMĚŘÍŽ SPECIÁLNÍ FARMAKOLOGIE KLINICKÁ PROPEDEUTIKA ANTIMYKOTIKA ROČNÍK: 3. ŠKOLNÍ ROK: 2012 / 2013 STUDIJNÍ OBOR: ZDRAVOTNICKÝ ASISTENT OBSAH 1.Úvod...3 2. Historický vývoj
STŘEDNÍ ZDRAVONICKÁ ŠKOLA KROMĚŘÍŽ SPECIÁLNÍ FARMAKOLOGIE KLINICKÁ PROPEDEUTIKA ANTIMYKOTIKA ROČNÍK: 3. ŠKOLNÍ ROK: 2012 / 2013 STUDIJNÍ OBOR: ZDRAVOTNICKÝ ASISTENT OBSAH 1.Úvod...3 2. Historický vývoj
Příloha IV. Vědecké závěry
 Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7
 PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7 Členský stát Žadatel nebo držitel rozhodnutí o registraci Vymyšlený název přípravku
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7 Členský stát Žadatel nebo držitel rozhodnutí o registraci Vymyšlený název přípravku
Příloha II. Vědecké závěry
 Příloha II Vědecké závěry 74 Vědecké závěry Dne 7. července 2016 zahájila Velká Británie na základě farmakovigilančních údajů postup podle článku 31 směrnice 2001/83/ES a požádalo výbor PRAC, aby přezkoumal
Příloha II Vědecké závěry 74 Vědecké závěry Dne 7. července 2016 zahájila Velká Británie na základě farmakovigilančních údajů postup podle článku 31 směrnice 2001/83/ES a požádalo výbor PRAC, aby přezkoumal
PŘÍLOHA I. Page 1 of 5
 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, KONCENTRACE VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOB(Y) PODÁNÍ, DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH Page 1 of 5 Členský stát Žadatel
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, KONCENTRACE VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOB(Y) PODÁNÍ, DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH Page 1 of 5 Členský stát Žadatel
(Smyšlený název) Název Vertimen 8 mg Tabletten. Vertimen 16 mg Tabletten. Vertisan 16 mg Таблетка. Vertisan 8 mg Tableta 8 mg Tableta Perorální podání
 PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÉHO(LÉČIVÝCH)PŘÍPRAVKU(Ů), LÉKOVÁ(É) FORMA(Y), KONCENTRACE, ZPŮSOB(Y) PODÁNÍ, ŽADATEL(É), DRŽITEL(É) ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EHP Držitel
PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÉHO(LÉČIVÝCH)PŘÍPRAVKU(Ů), LÉKOVÁ(É) FORMA(Y), KONCENTRACE, ZPŮSOB(Y) PODÁNÍ, ŽADATEL(É), DRŽITEL(É) ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EHP Držitel
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu
 Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu Marta Krejčí XIII. MM workshop a setkání CMG, Mikulov 11.4.2015 Doplněk č. 1 k doporučení z 9/2012: Diagnostika
Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu Marta Krejčí XIII. MM workshop a setkání CMG, Mikulov 11.4.2015 Doplněk č. 1 k doporučení z 9/2012: Diagnostika
Příloha I. Seznam názvů, lékových forem, síly léčivého přípravku, způsobu podání, žadatelů v členských státech.
 Příloha I Seznam názvů, lékových forem, síly léčivého přípravku, způsobu podání, žadatelů v členských státech. 1 Členský stat EU/EEA Žadatel Smyšlený název Síla Léková forma Cesta podání Belgie Mometasone
Příloha I Seznam názvů, lékových forem, síly léčivého přípravku, způsobu podání, žadatelů v členských státech. 1 Členský stat EU/EEA Žadatel Smyšlený název Síla Léková forma Cesta podání Belgie Mometasone
Složení Léčivá látka: Fluconazolum 2 mg v 1ml fyziologického roztoku, určeného pro intravenózní infuzi Pomocné látky: Chlorid sodný, voda na injekci.
 Příbalová informace RP Informace pro použití, čtěte pozorně! DIFLUCAN i.v. (Fluconazolum) Infuzní roztok Držitel rozhodnutí o registraci: Pfizer spol.s r.o., Praha, Česká republika Výrobce: Pfizer S.A.,
Příbalová informace RP Informace pro použití, čtěte pozorně! DIFLUCAN i.v. (Fluconazolum) Infuzní roztok Držitel rozhodnutí o registraci: Pfizer spol.s r.o., Praha, Česká republika Výrobce: Pfizer S.A.,
Celkové závěry vědeckého hodnocení přípravku Femara a souvisejících názvů (viz příloha I)
 Příloha II Vědecké závěry a zdůvodnění potřebných úprav v souhrnu údajů o přípravku, označení na obalu a příbalové informaci předkládané Evropskou agenturou pro léčivé přípravky 7 Vědecké závěry Celkové
Příloha II Vědecké závěry a zdůvodnění potřebných úprav v souhrnu údajů o přípravku, označení na obalu a příbalové informaci předkládané Evropskou agenturou pro léčivé přípravky 7 Vědecké závěry Celkové
PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, ŽADATELÉ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH
 PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, ŽADATELÉ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EEA Itálie Španělsko Švédsko Držitel
PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, ŽADATELÉ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EEA Itálie Španělsko Švédsko Držitel
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
CELKOVÉ SHRNUTÍ VĚDECKÉHO HODNOCENÍ LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH KYSELINU VALPROOVOU/VALPROÁT (viz Příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV V SOUHRNECH ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÝCH INFORMACÍCH PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 104 VĚDECKÉ ZÁVĚRY CELKOVÉ SHRNUTÍ VĚDECKÉHO
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV V SOUHRNECH ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÝCH INFORMACÍCH PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 104 VĚDECKÉ ZÁVĚRY CELKOVÉ SHRNUTÍ VĚDECKÉHO
Příloha II. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 8 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Nasonex a souvisejících názvů (viz příloha I) Léčivá složka
Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 8 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Nasonex a souvisejících názvů (viz příloha I) Léčivá složka
Celkové shrnutí vědeckého hodnocení čípků obsahujících terpenové deriváty (viz příloha I).
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ ZRUŠENÍ ČI ZMĚN PŘÍSLUŠNÝCH ODDÍLŮ SOUHRNŮ ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÝCH INFORMACÍ PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY S OHLEDEM
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ ZRUŠENÍ ČI ZMĚN PŘÍSLUŠNÝCH ODDÍLŮ SOUHRNŮ ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÝCH INFORMACÍ PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY S OHLEDEM
Příloha II. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 406 Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci Ibuprofen je nesteroidní protizánětlivé léčivo (NSAID)
Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 406 Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci Ibuprofen je nesteroidní protizánětlivé léčivo (NSAID)
Amoxicilin 200 mg Kyselina klavulanová 50 mg Prednisolon 10 mg. Amoxicilin 200 mg Kyselina klavulanová 50 mg Prednisolon 10 mg
 Příloha I Seznam názvů, lékových forem, síly veterinárního léčivého přípravku, živočišných druhů, cesty podání, ochranných lhůt, žadatelů a držitelů rozhodnutí o registraci v členských státech 1/9 Členský
Příloha I Seznam názvů, lékových forem, síly veterinárního léčivého přípravku, živočišných druhů, cesty podání, ochranných lhůt, žadatelů a držitelů rozhodnutí o registraci v členských státech 1/9 Členský
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ NEOBNOVENÍ ROZHODNUTÍ O REGISTRACI
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ NEOBNOVENÍ ROZHODNUTÍ O REGISTRACI 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Ethirfin a souvisejících názvů (viz příloha I) 1. Úvod Společnost
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ NEOBNOVENÍ ROZHODNUTÍ O REGISTRACI 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Ethirfin a souvisejících názvů (viz příloha I) 1. Úvod Společnost
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Celkové shrnutí vědeckého hodnocení přípravku Tienam a související názvy (viz příloha I)
 Příloha II Vědecké závěry a zdůvodnění potřebných úprav souhrnu údajů o přípravku, označení na obalu a příbalových informací předkládané Evropskou agenturou pro léčivé přípravky 7 Vědecké závěry Celkové
Příloha II Vědecké závěry a zdůvodnění potřebných úprav souhrnu údajů o přípravku, označení na obalu a příbalových informací předkládané Evropskou agenturou pro léčivé přípravky 7 Vědecké závěry Celkové
Příloha II. Vědecké závěry
 Příloha II Vědecké závěry 7 Vědecké závěry Amitriptylin je dobře známé tricyklické antidepresivum s prokázaným mechanismem účinku a použitím (Brunton 2011). Amitriptylin je terciární amin, který působí
Příloha II Vědecké závěry 7 Vědecké závěry Amitriptylin je dobře známé tricyklické antidepresivum s prokázaným mechanismem účinku a použitím (Brunton 2011). Amitriptylin je terciární amin, který působí
Celkové shrnutí vědeckého hodnocení přípravku Lipitor a související názvy (viz Příloha I)
 Příloha II Vědecké závěry a zdůvodnění potřebných úprav souhrnu údajů o přípravku, označení na obalu a příbalových informací předkládané Evropskou agenturou pro léčivé přípravky 23 Vědecké závěry Celkové
Příloha II Vědecké závěry a zdůvodnění potřebných úprav souhrnu údajů o přípravku, označení na obalu a příbalových informací předkládané Evropskou agenturou pro léčivé přípravky 23 Vědecké závěry Celkové
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 1. NÁZEV PŘÍPRAVKU MYCOSYST 150 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje fluconazolum 150 mg. Pomocné látky se známým účinkem: jedna tvrdá tobolka obsahuje
1. NÁZEV PŘÍPRAVKU MYCOSYST 150 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje fluconazolum 150 mg. Pomocné látky se známým účinkem: jedna tvrdá tobolka obsahuje
Celkové shrnutí vědeckého hodnocení přípravku Norvasc a přípravků souvisejících názvů (viz příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV V SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÉ INFORMACI PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY Vědecké závěry Celkové
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV V SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÉ INFORMACI PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY Vědecké závěry Celkové
Příloha IV. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha IV Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 132 Vědecké závěry Výbor CHMP zvážil níže uvedené doporučení výboru PRAC ze dne 5. prosince 2013 s ohledem na postup podle
Příloha IV Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 132 Vědecké závěry Výbor CHMP zvážil níže uvedené doporučení výboru PRAC ze dne 5. prosince 2013 s ohledem na postup podle
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU FLUCONAZOL Ardez 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka : Fluconazolum 2 mg/ml ve fyziologickém roztoku k intravenózní aplikaci. 3. LÉKOVÁ FORMA
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU FLUCONAZOL Ardez 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka : Fluconazolum 2 mg/ml ve fyziologickém roztoku k intravenózní aplikaci. 3. LÉKOVÁ FORMA
PŘÍLOHA I. SEZNAM NÁZVŮ LÉČIVých PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, žadatelé, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH
 PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVých PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, žadatelé, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EEA Bulharsko Francie Německo Irsko
PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVých PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, žadatelé, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EEA Bulharsko Francie Německo Irsko
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Pokyny pro podávání přípravku a sledování pacienta
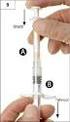 Pokyny pro podávání přípravku a sledování pacienta Informace pro lékaře a zdravotní sestry Červenec 2011 2 Úvod Tato příručka je určena předepisujícím lékařům a zdravotním sestrám a poskytuje praktický
Pokyny pro podávání přípravku a sledování pacienta Informace pro lékaře a zdravotní sestry Červenec 2011 2 Úvod Tato příručka je určena předepisujícím lékařům a zdravotním sestrám a poskytuje praktický
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Diflucan 50 mg Diflucan 100 mg Diflucan 150 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diflucan 50 mg Jedna tvrdá tobolka obsahuje fluconazolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Diflucan 50 mg Diflucan 100 mg Diflucan 150 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diflucan 50 mg Jedna tvrdá tobolka obsahuje fluconazolum
Příloha II. Vědecké závěry
 Příloha II Vědecké závěry 7 Vědecké závěry Celkové shrnutí vědeckého hodnocení perorálních léčivých přípravků s metadonem obsahujících povidon Metadon je syntetický opioid. Metadon se používá k léčbě středně
Příloha II Vědecké závěry 7 Vědecké závěry Celkové shrnutí vědeckého hodnocení perorálních léčivých přípravků s metadonem obsahujících povidon Metadon je syntetický opioid. Metadon se používá k léčbě středně
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls100416/2012 a příloha ke sp. zn. sukls116705/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls100416/2012 a příloha ke sp. zn. sukls116705/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flukonazol PMCS 100 mg tvrdé tobolky 2. KVALITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls100416/2012 a příloha ke sp. zn. sukls116705/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flukonazol PMCS 100 mg tvrdé tobolky 2. KVALITATIVNÍ
Amoxicilin 200 mg Kyselina klavulanová 50 mg Prednisolon 10 mg. Amoxicilin 200 mg Kyselina klavulanová 50 mg Prednisolon 10 mg
 Příloha I Seznam názvů, lékových forem, síly veterinárního léčivého přípravku, živočišných druhů, cesty podání, ochranných lhůt, žadatelů a držitelů rozhodnutí o registraci v členských státech 1/7 Členský
Příloha I Seznam názvů, lékových forem, síly veterinárního léčivého přípravku, živočišných druhů, cesty podání, ochranných lhůt, žadatelů a držitelů rozhodnutí o registraci v členských státech 1/7 Členský
sp.zn.: sukls201171/2012
 sp.zn.: sukls201171/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FORCAN - 150 tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: fluconazolum 150 mg v 1 tvrdé tobolce; Pomocné látky
sp.zn.: sukls201171/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FORCAN - 150 tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: fluconazolum 150 mg v 1 tvrdé tobolce; Pomocné látky
PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOB PODÁNÍ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH
 PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOB PODÁNÍ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Léčivé přípravky obsahující dextropropoxyfen registrované v Evropské
PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOB PODÁNÍ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Léčivé přípravky obsahující dextropropoxyfen registrované v Evropské
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls73103/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LAMISIL 1% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram přípravku Lamisil 1% krém obsahuje terbinafini hydrochloridum 10 mg,
sp.zn.sukls73103/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LAMISIL 1% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram přípravku Lamisil 1% krém obsahuje terbinafini hydrochloridum 10 mg,
Indikace přípravku Zetamac v ordinaci praktického lékaře
 Indikace přípravku Zetamac v ordinaci praktického lékaře MUDr. Igor Karen 13.10. 2009 Zetamac léková forma azithromycinum 2g granule s prodlouženým uvolňováním pro přípravu perorální suspenze s příchutí
Indikace přípravku Zetamac v ordinaci praktického lékaře MUDr. Igor Karen 13.10. 2009 Zetamac léková forma azithromycinum 2g granule s prodlouženým uvolňováním pro přípravu perorální suspenze s příchutí
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 1. NÁZEV PŘÍPRAVKU MYCOSYST 150 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje fluconazolum 150 mg. Pomocné látky se známým účinkem: jedna tvrdá tobolka obsahuje
1. NÁZEV PŘÍPRAVKU MYCOSYST 150 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje fluconazolum 150 mg. Pomocné látky se známým účinkem: jedna tvrdá tobolka obsahuje
Antimykotika. 16. listopadu 2011. Přehled. Úvod. Polyenová. Azolová. Alylaminy a morfoliny. Ostatní. Mykózy
 Ústav farmakologie LF UP 16. listopadu 2011 Přehled Úvod Polyenová Azolová Alylaminy a morfoliny Ostatní Mykózy Systémové mykózy systémová kandidóza kryptokoková meningitis či endokarditis plicní aspergilóza
Ústav farmakologie LF UP 16. listopadu 2011 Přehled Úvod Polyenová Azolová Alylaminy a morfoliny Ostatní Mykózy Systémové mykózy systémová kandidóza kryptokoková meningitis či endokarditis plicní aspergilóza
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls125919/2016 a sukls142652/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flukonazol PMCS 100 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje fluconazolum
sp. zn. sukls125919/2016 a sukls142652/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flukonazol PMCS 100 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje fluconazolum
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
1/18. Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls198059/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls198059/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluconazol Aurobindo 50 mg tvrdé tobolky Fluconazol Aurobindo 100 mg tvrdé tobolky Fluconazol
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls198059/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluconazol Aurobindo 50 mg tvrdé tobolky Fluconazol Aurobindo 100 mg tvrdé tobolky Fluconazol
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls202096/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flukonazol PMCS 100 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje fluconazolum 100 mg. Pomocné látky
sp. zn. sukls202096/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flukonazol PMCS 100 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje fluconazolum 100 mg. Pomocné látky
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Diflucan 50 mg tvrdé tobolky Diflucan 100 mg tvrdé tobolky Diflucan 150 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diflucan 50 mg Jedna tvrdá tobolka
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Diflucan 50 mg tvrdé tobolky Diflucan 100 mg tvrdé tobolky Diflucan 150 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diflucan 50 mg Jedna tvrdá tobolka
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DIFLUCAN i.v., infuzní roztok Diflucan 50 mg, tvrdé tobolky Diflucan 100 mg, tvrdé tobolky Diflucan 150 mg, tvrdé tobolky (fluconazolum) 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DIFLUCAN i.v., infuzní roztok Diflucan 50 mg, tvrdé tobolky Diflucan 100 mg, tvrdé tobolky Diflucan 150 mg, tvrdé tobolky (fluconazolum) 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha IV. Vědecké závěry
 Příloha IV Vědecké závěry 53 Vědecké závěry 1. - Doporučení výboru PRAC Podkladové informace Ivabradin je látka snižující srdeční frekvenci se specifickým účinkem na sinusový uzel bez účinku na dobu intraatriálního,
Příloha IV Vědecké závěry 53 Vědecké závěry 1. - Doporučení výboru PRAC Podkladové informace Ivabradin je látka snižující srdeční frekvenci se specifickým účinkem na sinusový uzel bez účinku na dobu intraatriálního,
Příloha. Vědecké závěry a zdůvodnění zamítnutí předložené Evropskou agenturou pro léčivé přípravky
 Příloha Vědecké závěry a zdůvodnění zamítnutí předložené Evropskou agenturou pro léčivé přípravky Vědecké závěry předložené Evropskou agenturou pro léčivé přípravky Celkové shrnutí vědeckého zhodnocení
Příloha Vědecké závěry a zdůvodnění zamítnutí předložené Evropskou agenturou pro léčivé přípravky Vědecké závěry předložené Evropskou agenturou pro léčivé přípravky Celkové shrnutí vědeckého zhodnocení
SOUHRN ÚDAJŮ O PRÍPRAVKU
 sp.zn.sukls88141/2015 SOUHRN ÚDAJŮ O PRÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYCOMAX 100 MYCOMAX 150 tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mycomax 100: Jedna tvrdá tobolka obsahuje fluconazolum 100
sp.zn.sukls88141/2015 SOUHRN ÚDAJŮ O PRÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYCOMAX 100 MYCOMAX 150 tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mycomax 100: Jedna tvrdá tobolka obsahuje fluconazolum 100
Příloha II. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 21 Vědecké závěry Celkové závěry vědeckého hodnocení přípravků Oxynal a Targin a souvisejících názvů (viz příloha I) Podkladové
Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 21 Vědecké závěry Celkové závěry vědeckého hodnocení přípravků Oxynal a Targin a souvisejících názvů (viz příloha I) Podkladové
CZ PAR. QUETIAPINI FUMARAS Seroquel. UK/W/0004/pdWS/001 NL/W/0004/pdWS/001
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 5 mg/ml injekční roztok pro skot a prasata
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
2. CO MUSÍTE VĚDĚT NEŽ ZAČNETE FLUCONAZOL ARDEZ UŽÍVAT
 Příbalová informace RP Informace pro použití, čtěte pozorně! Fluconazol Ardez Infúzní roztok K intravenóznímu podání 2 mg/ ml 200 mg/100 ml Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příbalová informace RP Informace pro použití, čtěte pozorně! Fluconazol Ardez Infúzní roztok K intravenóznímu podání 2 mg/ ml 200 mg/100 ml Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ ZAMÍTNUTÍ
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ ZAMÍTNUTÍ 4 VĚDECKÉ ZÁVĚRY CELKOVÉ SHRNUTÍ VĚDECKÉHO HODNOCENÍ PŘÍPRAVKU MYDERISON Tolperison je centrálně působící svalové relaxans indikované u spasticity kosterních
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ ZAMÍTNUTÍ 4 VĚDECKÉ ZÁVĚRY CELKOVÉ SHRNUTÍ VĚDECKÉHO HODNOCENÍ PŘÍPRAVKU MYDERISON Tolperison je centrálně působící svalové relaxans indikované u spasticity kosterních
PŘÍLOHA II VĚDECKÉ ZÁVĚRY
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY 22 Vědecké závěry Podkladové informace Přípravek Durogesic je transdermální náplast obsahující fentanyl, což je silné syntetické opioidní analgetikum, které patří do skupiny piperidinových
PŘÍLOHA II VĚDECKÉ ZÁVĚRY 22 Vědecké závěry Podkladové informace Přípravek Durogesic je transdermální náplast obsahující fentanyl, což je silné syntetické opioidní analgetikum, které patří do skupiny piperidinových
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
SEZNAM SMYŠLENÝCH NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, ZPŮSOBU PODÁNÍ A DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH (EHP)
 PŘÍLOHA I SEZNAM SMYŠLENÝCH NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, ZPŮSOBU PODÁNÍ A DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH (EHP) 1 Členský stát Držitel rozhodnutí o registraci Smyšlený
PŘÍLOHA I SEZNAM SMYŠLENÝCH NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, ZPŮSOBU PODÁNÍ A DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH (EHP) 1 Členský stát Držitel rozhodnutí o registraci Smyšlený
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, SÍLA LÉČIVÉHO PŘÍPRAVKU, ZPŮSOB PODÁNÍ, ŽADATEL A DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH
 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, SÍLA LÉČIVÉHO PŘÍPRAVKU, ZPŮSOB PODÁNÍ, ŽADATEL A DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH Členský stát Dánsko Německo Irsko Itálie Španělsko Držitel rozhodnutí
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, SÍLA LÉČIVÉHO PŘÍPRAVKU, ZPŮSOB PODÁNÍ, ŽADATEL A DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH Členský stát Dánsko Německo Irsko Itálie Španělsko Držitel rozhodnutí
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy o bezpečnosti (PSUR) pro ibuprofen, ibuprofen-lysin
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy o bezpečnosti (PSUR) pro ibuprofen, ibuprofen-lysin
Příloha II. Vědecké závěry a zdůvodnění zamítnutí registrace předkládané Evropskou agenturou pro léčivé přípravky
 Příloha II Vědecké závěry a zdůvodnění zamítnutí registrace předkládané Evropskou agenturou pro léčivé přípravky 4 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Furosemide Vitabalans a souvisejících
Příloha II Vědecké závěry a zdůvodnění zamítnutí registrace předkládané Evropskou agenturou pro léčivé přípravky 4 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Furosemide Vitabalans a souvisejících
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
Příloha II. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 3 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Quixil Podkladové informace Quixil je fibrinové tkáňové lepidlo
Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 3 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Quixil Podkladové informace Quixil je fibrinové tkáňové lepidlo
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
Obsah léčivých látek. název přípravku. Loratadine Vitabalans 10 mg tablety. 10 mg tableta Perorální podání. Loratadine Vitabalans
 Příloha I Seznam názvů, lékových forem, obsahů léčivých látek v léčivých přípravcích, způsobu podání, žadatelů / držitelů rozhodnutí o registraci v členských státec 1 Členský stát EU/EHP Držitel rozhodnutí
Příloha I Seznam názvů, lékových forem, obsahů léčivých látek v léčivých přípravcích, způsobu podání, žadatelů / držitelů rozhodnutí o registraci v členských státec 1 Členský stát EU/EHP Držitel rozhodnutí
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU RILEXINE 300 tbl. ad us.vet. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Cefalexinum (ut monohydricum): V jedné 800 mg tabletě
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU RILEXINE 300 tbl. ad us.vet. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Cefalexinum (ut monohydricum): V jedné 800 mg tabletě
Pomocné látky se známým účinkem: prostý sirup 67%, usušená tekutá glukosa.
 sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
Příloha č. 2 ke sdělení sp. zn.: sukls245530/2011
 Příloha č. 2 ke sdělení sp. zn.: sukls245530/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYCOMAX SIR sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml sirupu obsahuje fluconazolum 5 mg. Pomocné látky:
Příloha č. 2 ke sdělení sp. zn.: sukls245530/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYCOMAX SIR sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml sirupu obsahuje fluconazolum 5 mg. Pomocné látky:
PŘÍLOHA III SOUHRN ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
 PŘÍLOHA III SOUHRN ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE Poznámka: Toto SPC, označení na obalu a příbalová informace je verze platná v době rozhodnutí Komise. Po rozhodnutí Komise
PŘÍLOHA III SOUHRN ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE Poznámka: Toto SPC, označení na obalu a příbalová informace je verze platná v době rozhodnutí Komise. Po rozhodnutí Komise
Příloha II. Vědecké závěry a zdůvodnění zamítnutí předkládané Evropskou agenturou pro léčivé přípravky (EMA)
 Příloha II Vědecké závěry a zdůvodnění zamítnutí předkládané Evropskou agenturou pro léčivé přípravky (EMA) 29 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravků Norditropin SimpleXx, Norditropin
Příloha II Vědecké závěry a zdůvodnění zamítnutí předkládané Evropskou agenturou pro léčivé přípravky (EMA) 29 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravků Norditropin SimpleXx, Norditropin
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Vývoj nových léčiv. Preklinický výzkum Klinický výzkum
 Vývoj nových léčiv Preklinický výzkum Klinický výzkum Úvod Léčivo = nejprověřenější potravina vstupující do organismu Ideální léčivo kvalitní, účinné, bezpečné a dostupné Financování výzkumu léčiv souvislost
Vývoj nových léčiv Preklinický výzkum Klinický výzkum Úvod Léčivo = nejprověřenější potravina vstupující do organismu Ideální léčivo kvalitní, účinné, bezpečné a dostupné Financování výzkumu léčiv souvislost
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls105115/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Imazol krémpasta 10 mg/g Kožní pasta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram pasty obsahuje clotrimazolum 10 mg. Pomocné
sp.zn.: sukls105115/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Imazol krémpasta 10 mg/g Kožní pasta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram pasty obsahuje clotrimazolum 10 mg. Pomocné
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Diflucan I.V. 2 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje fluconazolum 2 mg. 1 lahvička s 25 ml infuzního roztoku obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Diflucan I.V. 2 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje fluconazolum 2 mg. 1 lahvička s 25 ml infuzního roztoku obsahuje
Keytruda (pembrolizumabum)
 EMA/235911/2019 EMEA/H/C/003820 Přehled pro přípravek Keytruda a proč byl přípravek registrován v EU Co je přípravek Keytruda a k čemu se používá? Keytruda je protinádorový léčivý přípravek používaný k
EMA/235911/2019 EMEA/H/C/003820 Přehled pro přípravek Keytruda a proč byl přípravek registrován v EU Co je přípravek Keytruda a k čemu se používá? Keytruda je protinádorový léčivý přípravek používaný k
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) jodidu-( 131 I) sodného
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) jodidu-( 131 I) sodného
CAVE! Informační dopis pro zdravotnické pracovníky
 CAVE! Informační dopis pro zdravotnické pracovníky říjen 2017 Výpadek léčivého přípravku Trisenox (oxid arzenitý, koncentrát pro infuzní roztok 1 mg/ml): nahrazení léčivým přípravkem Phenasen (injekční
CAVE! Informační dopis pro zdravotnické pracovníky říjen 2017 Výpadek léčivého přípravku Trisenox (oxid arzenitý, koncentrát pro infuzní roztok 1 mg/ml): nahrazení léčivým přípravkem Phenasen (injekční
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Smyšlený název Obsah léčivých látek Léková forma Živočišné druhy. Držitel rozhodnutí o registraci. Členský stát EU/EHP
 Příloha I Seznam názvů, lékových forem, obsahů léčivých látek veterinárního léčivého přípravku, živočišných druhů a držitelů rozhodnutí o registraci v členských státech 1/10 Členský stát EU/EHP Držitel
Příloha I Seznam názvů, lékových forem, obsahů léčivých látek veterinárního léčivého přípravku, živočišných druhů a držitelů rozhodnutí o registraci v členských státech 1/10 Členský stát EU/EHP Držitel
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému
Pomocné látky: 1 ml také obsahuje 9 mg chloridu sodného (odpovídá 0,154 mmol sodíku)
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls21186/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluconazol Kabi 2 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 50 ml infuzního
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls21186/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluconazol Kabi 2 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 50 ml infuzního
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls12726/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluconazole B. Braun 2 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 50 ml infuzního roztoku obsahuje fluconazolum 100
sp. zn. sukls12726/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluconazole B. Braun 2 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 50 ml infuzního roztoku obsahuje fluconazolum 100
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FORCAN- 50 FORCAN-150 FORCAN-200 Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: fluconazolum 50 mg, 150 mg nebo 200 mg v 1tvrdé tobolce;
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FORCAN- 50 FORCAN-150 FORCAN-200 Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: fluconazolum 50 mg, 150 mg nebo 200 mg v 1tvrdé tobolce;
Informace pro zdravotnické odborníky
 EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 400 mg + 40 mg. čípky PROCTO-GLYVENOL. 50 mg/g + 20 mg/g. rektální krém
 sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
