ZŠ ÚnO, Bratří Čapků 1332
|
|
|
- Vojtěch Pavlík
- před 10 lety
- Počet zobrazení:
Transkript
1 Chemicus Media Trade - úvdní brazvka - Nvá hra, Pkračvat ve hře, Výukvá část, Uknčit Biscpii Nvá hra start výukvé adventury Chemicus Pkračvat ve hře pkračvat v přerušené hře na předchzím místě Výukvá část výukvá (encyklpedická) část prgramu - d přehledu kapitl a pdkapitl je mžné se vrátit kliknutím na název kapitly (vlev nahře) - navigace uvnitř kapitly (vprav nahře) zleva: zpět na předchzí kapitlu stránku zpět histrie seznam dsud navštívených stránek stránku vpřed vpřed na následující kapitlu - návrat d hlavníh menu (úvdní brazvky) zelené tlačítk dle uprstřed Látky a jejich vlastnsti C rzumíme pd pjmem chemie? Svět látek Chemie jak věda Člvěk a chemie Rzpznávání látek pdle jejich vlastnstí Rzpznávání látek našimi smysly Elektrická vdivst a magnetismus Železný drát Grafitvá tuha Dřev Teplta tání a teplta varu Teplta tání Teplta varu Teplta tání a varu u znečištěných látek Hustta Důležité skupiny látek Kvy Vlastnsti kvů Slitiny Sli Vlastnsti slí Směsi látek a jejich ddělvání Druhy slučenin Směsi a jejich skupenství Hmgenní směsi Způsby dělení slučenin Filtrace Odpaření rzpuštědla Destilace Frakční destilace, extrakce, chrmatgrafie Skupenství látek Stavvá skupenství 3 druhy skupenství Změna skupenství Přitažlivé síly Difůze Částečky se rzprstírají samvlně Látky a jejich změny Chemické reakce
2 Přeměna látek v kuchyni Přeměny látek při šklním pkusu Nejmenší stavební prvky látek Kuličkvý mdel Daltnův mdel atmu Histrie tabulky peridických prvků Řeč chemických značek Chemické značky Chemické značky v histrii Dnešní systém chemických značek Chemické vzrce Chemické názvslví Názvslví v češtině Výstražné symbly Nebezpečné látky Jedvaté látky Vzduch, ve kterém žijeme Slžky vzduchu Chemické značky v histrii Kyslík Dusík Reakce s kyslíkem Kvy reagují s kyslíkem Oxidace xidace Pmalá xidace Nekvy reagují s kyslíkem Znečišťvání živtníh prstředí spalinami Katalyzátr Knstrukce a princip katalyzátru Lambda-snda, bezlvnatý benzín Vzrce a chemické reakce Atmvá hmtnstní jedntka Atmvá hmtnstní jedntka Relativní mlekulvá hmtnst Pčet částic a látkvé mnžství Látkvé mnžství a jeh jedntka ml, Avgadrv čísl Avgadrva věta Mlární hmtnst Mlární hmtnst M Sestavení vzrců Stechimetrický vzrec Mlekulvý vzrec Tvření rvnic chemických reakcí Slvní frmulace rvnice a Pužití chemických značek a vzrců Vyčíslení rvnice Další příklady Výrba kvů Výskyt kvů Od xidu měďnatéh k mědi Termitvá metda Výrba survéh železa ve vyské peci Železné rudy, vyská pec Děje ve vyské peci Prdukty vyské pece Ze survéh železa se stává cel Metda spalvání kyslíkem Výrba v elektrické peci, speciální celi Vda je živt Význam vdy Vda chemický prvek? Vda jak chemická slučenina, analýza vdy Rvnice reakce, syntéza vdy Vdík nsitel energie buducnsti? Význam vdíku Význam vdíku, vdík a energie
3 Prblémy s vdíkem jak palivem Stavba atmu a chemické vazby Struktura atmu Elektrické vlastnsti látek Mdel jádr-bal 3 druhy elementárních částic Atmvá hmtnstní jedntka, nuklenvé čísl Slupkvý mdel Terie stavbě atmvéh (elektrnvéh) balu Obsazvání slupek Iztpy Látky mhu vyzařvat Rentgenvé záření Objev radiaktivity Peridická tabulka prvků Struktura peridické tabulky prvků Ppis tabulky Rzmístění prvků v tabulce Hlavní a vedlejší skupiny Skupiny prvků Alkalické kvy Kvy alkalických zemin Skupina uhlíku Prvky skupiny, diamant Grafit Buckminster fulleren Halgeny Prvky skupiny, diamant Vzácné plyny Intvá vazba Reaktivita Vznik intu Reakce sdíku s chlórem Stav vzácnéh plynu Oxidace a redukce Redxní reakce Redukční a xidační činidla Tvrba slných krystalů Rzpuštění krystalů sli Elektrická vdivst sli Vazba elektrnvéh páru Vazby mezi atmy Vazba mezi atmy Kvalentní vazba Vazba elektrnvéh páru Anmálie vdy Vdíkvé můstky, vdíkvá vazba Phlcvání mikrvln, vda jak rzpuštědl Ftchemie Elektrmagnetické vlny Elektrmagnetické záření, Planckva knstanta, ftn Časvé spektrum Obrázky světlcitlivých slí a stříbra Ftgrafický film Osvětlení, vyvlání, ustálení, pzitiv Elektrchemie Redxní reakce v elektrchemii Elektrnvé přechdy Oxidace a redukce Oxidačně-redukční reakce a činidla Od plčlánků ke galvanickým článkům Plčlánek Schéma plčlánku Anda a katda
4 Elektrchemické nábje Redxní reakce Činidla Elektrchemická řada napětí Pužití galvanických článků Baterie Akumulátr Dbíjení akumulátrů Schéma akumulátru Princip akumulátru Palivvý článek Palivvý článek Schéma vdíkv-kyslíkvéh palivvéh článku Elektrlýza Elektrlytické štěpení vdy Elektrlýza a elektrlyty C se děje při elektrlýze? Galvanvání Kyseliny, zásady a neutralizace Kyseliny, živtní prstředí a technika Význam kyselin Kyseliny a jejich využití Kyseliny v průmyslu, zátěž pr živtní prstředí Kyselinám na stpě Kyselina chlrvdíkvá Význam kyseliny chlrvdíkvé Chemické slžení kyseliny chlrvdíkvé Chlridy sli kyseliny chlrvdíkvé Kyselina siřičitá Vznik kyseliny chlrvdíkvé Umírání lesa kvůli kyselým dešťům Kyselina sírvá Výrba kyseliny sírvé Vlastnsti a využití kyseliny sírvé Vlastnsti kyseliny sírvé Nebezpečí úrazu, využití kyseliny sírvé Sli kyseliny sírvé Hydrgensírany a sírany Reakce kyseliny sírvé s xidy kvů Kyselina uhličitá Tvrba kyseliny uhličité Sli kyseliny uhličité Hydrgenuhličitany a uhličitany Jedlá sda, uhličitan vápenatý Přirzený klběh vápence Technický klběh vápence Pálení vápna Hašení vápna Tuhnutí malty Klběh vápence Tahák - kyselina dusičná Tahák pr kyselinu dusičnu Zásady v dmácnsti a v průmyslu Význam a vlastnsti hydrxidů Chemické slžení hydrxidů Důležité zásady Hydrxid sdný Hydrxid vápenatý Amniak Síla kyselin a zásad Hdnta ph ph, univerzální indikátr Hdnta ph vybraných látek Neutralizace
5 Reakce kyselin s hydrxidy Neutralizace Příklady neutralizací Odsíření kuře Zpldiny při spalvání Vznik sádry Organická chemie Organická chemie c je t? Chemie slučenin uhlíku Organická chemie Začátky rganické chemie Uhlvdíky Metan nejednduší uhlvdík Výskyt, vlastnsti, stavba Vazby v mlekule metanu Butan Hmlgická řada alkanů Hmlgická řada Přehled alkanů Izmery Izmer Pravidla pjmenvání izmerů Izpentan, n-pentan Vlastnsti a pužití alkanů Skupenství alkanů Rzpuštění alkanů Rpa a zemní plyn rganické látky ze země Jak vznikla rpa a zemní plyn Těžba a transprt fsilních survin Zpracvání rpy Frakční destilace Příměsi rpy Frakční destilace Zvláštní uhlvdíky Eten - alken Eten Alkeny Etin alkin Halgenderiváty uhlvdíků Benzen armatický uhlvdík Terpény Zemská atmsféra v hržení Ozónvý smg Ozónvá díra Ozónvá vrstva Freny Skleníkvý efekt Skleníkvý efekt Glbální teplení Etanl nebli alkhl Výrba alkhlu Etanl Příprava alkhlu Účinek alkhlu na naše těl Stavba mlekuly ethanlu Vlastnsti a využití ethanlu Etanl jak paliv Etanl jak rzpuštědl Amfifilní ethanl Skupina alkhlů Alkanly Alkanly Vlastnsti alkhlů Rzpznání metanlu a etanlu Izmery alkanlů
6 Vícenásbné alkhly Dily, trily..., glykl Glycerin Srbit Skupina karbxylvých kyselin Ocet a kyselina ctvá Karbxylvá skupina Prtlýza Organické kyseliny Organické kyseliny Přehled alkanvých kyselin Karbxylvé kyseliny v přírdě Z alkhlů a karbxylvých kyselin vznikají estery Přílha Výrba esteru Esterifikace Funkce kyseliny sírvé Ester jak vůně armatické látky Vsky a tuky jsu také estery Vsky a tuky Mastné kyseliny Binafta vegetariánské paliv Plyester materiál 20. stletí Makrmlekula, plyestery Vznik plyesterů Některé důležité matematické vzrce Hmtnstní a bjemvý zlmek Některé důležité údaje látkách Prvky Přehled prvků značka skupenství hustta teplta tání teplta varu Slučeniny Přehled slučenin značka skupenství hustta teplta varu Peridická sustava prvků Přehled prvků značka přadvé čísl atmvá hmtnst elektrnegativita Likvidace chemických dpadních látek Likvidace dpadu Index A-Z A-D E F-K K L-O O-S S-T U-V Z Uknčit Biscpii knec prgramu
Lékařská chemie - přednáška č.2
 Lékařská chemie - přednáška č.2 hlavní bigenní prvky Václav Babuška Vaclav.Babuska@lfp.cuni.cz Prvkvé slžení Země a živých rganismů 3 Prvkvé slžení Země a živých rganismů 4 Prvkvé slžení Země a živých
Lékařská chemie - přednáška č.2 hlavní bigenní prvky Václav Babuška Vaclav.Babuska@lfp.cuni.cz Prvkvé slžení Země a živých rganismů 3 Prvkvé slžení Země a živých rganismů 4 Prvkvé slžení Země a živých
ZŠ ÚnO, Bratří Čapků 1332
 Physicus - Návrat Media Trade - úvdní brazvka - kn Výukvé adventury, Zapnut (přechd d výukvé části), Inventář, Nastavení Nastavení Ulžit ulžení aktuálníh stavu hry (k dispzici je celkem 24 pzic, p vyčerpání
Physicus - Návrat Media Trade - úvdní brazvka - kn Výukvé adventury, Zapnut (přechd d výukvé části), Inventář, Nastavení Nastavení Ulžit ulžení aktuálníh stavu hry (k dispzici je celkem 24 pzic, p vyčerpání
Speciální ZŠ a MŠ Adresa. U Červeného kostela 110, TEPLICE Číslo op. programu CZ Název op. programu
 Subjekt Speciální ZŠ a MŠ Adresa U Červenéh kstela 110, 415 01 TEPLICE Čísl p. prgramu CZ. 1. 07 Název p. prgramu OP Vzdělávání pr knkurenceschpnst Čísl výzvy 21 Název výzvy Žádst fin. pdpru z OP VK -
Subjekt Speciální ZŠ a MŠ Adresa U Červenéh kstela 110, 415 01 TEPLICE Čísl p. prgramu CZ. 1. 07 Název p. prgramu OP Vzdělávání pr knkurenceschpnst Čísl výzvy 21 Název výzvy Žádst fin. pdpru z OP VK -
ZŠ ÚnO, Bratří Čapků 1332
 Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 2 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 2 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
ZŠ ÚnO, Bratří Čapků 1332
 Digitální učebnice fyziky J. Beňuška - hlavní stránka (zleva) - úvdní menu, výběr tématických celků, vpřed na další celek (slupec vprav) Úvdní menu infrmace práci s prgramem Úvdem IKT ve vyučvání Prč výukvé
Digitální učebnice fyziky J. Beňuška - hlavní stránka (zleva) - úvdní menu, výběr tématických celků, vpřed na další celek (slupec vprav) Úvdní menu infrmace práci s prgramem Úvdem IKT ve vyučvání Prč výukvé
ZŠ ÚnO, Bratří Čapků 1332
 Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Alkalické kovy (Li, Na, K, Rb, Cs, Fr) prvky 1.A skupiny kromě H
 Alkalické kvy (Li, Na, K, Rb, Cs, Fr) prvky 1.A skupiny krmě H Označení alkalické kvy, prtže hydrxidy těcht kvů jsu silně zásadité Elektrnvá knfigurace valenční vrstvy je, ke kvvé vazbě přispívají každý
Alkalické kvy (Li, Na, K, Rb, Cs, Fr) prvky 1.A skupiny krmě H Označení alkalické kvy, prtže hydrxidy těcht kvů jsu silně zásadité Elektrnvá knfigurace valenční vrstvy je, ke kvvé vazbě přispívají každý
ZŠ ÚnO, Bratří Čapků 1332
 Physicus Media Trade - úvdní brazvka - Nvá hra, Nahrát hru, Výukvá část Nvá hra start výukvé adventury Physicus mžnst měnit nastavení a nahrání/ulžení hry (ikna CD) : Hlasitst nastavení pmcí táhla Prlínání
Physicus Media Trade - úvdní brazvka - Nvá hra, Nahrát hru, Výukvá část Nvá hra start výukvé adventury Physicus mžnst měnit nastavení a nahrání/ulžení hry (ikna CD) : Hlasitst nastavení pmcí táhla Prlínání
ZŠ ÚnO, Bratří Čapků 1332
 Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 1 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 1 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Očekávané výstupy podle RVP ZV Učivo předmětu Přesahy a vazby
 Předmět: CHEMIE Ročník: 8. Časová dotace: 2 hodiny týdně Očekávané výstupy podle RVP ZV Učivo předmětu Přesahy a vazby Konkretizované tematické okruhy realizovaného průřezového tématu září orientuje se
Předmět: CHEMIE Ročník: 8. Časová dotace: 2 hodiny týdně Očekávané výstupy podle RVP ZV Učivo předmětu Přesahy a vazby Konkretizované tematické okruhy realizovaného průřezového tématu září orientuje se
9. Membránové procesy
 9. Membránvé prcesy Obsáhlá, různrdá prblematika, širké uplatnění v praxi ( výrba pitné vdy dslení mřské vdy, příprava čisté vdy ve farmaceutickém průmyslu, membránvé sušení plynů, dělení azetrpických
9. Membránvé prcesy Obsáhlá, různrdá prblematika, širké uplatnění v praxi ( výrba pitné vdy dslení mřské vdy, příprava čisté vdy ve farmaceutickém průmyslu, membránvé sušení plynů, dělení azetrpických
sluč H o 298 (C 2 H 4, g) = 52,7 kj mol -1 sluč H o 298 (CO 2, g) = -394,5 kj mol -1 sluč H o 298 (H 2 O, l) = -285,8 kj mol -1. [Q p = ,5 kj]
![sluč H o 298 (C 2 H 4, g) = 52,7 kj mol -1 sluč H o 298 (CO 2, g) = -394,5 kj mol -1 sluč H o 298 (H 2 O, l) = -285,8 kj mol -1. [Q p = ,5 kj] sluč H o 298 (C 2 H 4, g) = 52,7 kj mol -1 sluč H o 298 (CO 2, g) = -394,5 kj mol -1 sluč H o 298 (H 2 O, l) = -285,8 kj mol -1. [Q p = ,5 kj]](/thumbs/92/108027517.jpg) TERMODYNAMIKA 1. Sustava bsahující 1,0 ml mnatmickéh ideálníh plynu vykná reverzibilně následující cyklický děj: stav 1 3 4 V/dm 3 // T/K,4 // 73,4 // 546 44,8 // 546,4 // 73 Vypčítejte tlak sustavy v
TERMODYNAMIKA 1. Sustava bsahující 1,0 ml mnatmickéh ideálníh plynu vykná reverzibilně následující cyklický děj: stav 1 3 4 V/dm 3 // T/K,4 // 73,4 // 546 44,8 // 546,4 // 73 Vypčítejte tlak sustavy v
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace
 Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
integrované povolení
 Integrvané pvlení čj. MSK 102663/2010 ze dne 12.10.2010, ve znění pzdějších změn V rámci aktuálníh znění výrkvé části integrvanéh pvlení jsu zapracvány dsud vydané změny příslušnéh integrvanéh pvlení.
Integrvané pvlení čj. MSK 102663/2010 ze dne 12.10.2010, ve znění pzdějších změn V rámci aktuálníh znění výrkvé části integrvanéh pvlení jsu zapracvány dsud vydané změny příslušnéh integrvanéh pvlení.
ZŠ ÚnO, Bratří Čapků 1332
 Biscpia Media Trade - úvdní brazvka - Nastavení, Nvá hra (p spuštění přibude Pkračvat ve hře, Ulžit hru a Nahrát hru), Mzkvé centrum, Uknčit Biscpii Nastavení Kmentář Zapnut/Vypnut (kmentář hlasvý průvdce
Biscpia Media Trade - úvdní brazvka - Nastavení, Nvá hra (p spuštění přibude Pkračvat ve hře, Ulžit hru a Nahrát hru), Mzkvé centrum, Uknčit Biscpii Nastavení Kmentář Zapnut/Vypnut (kmentář hlasvý průvdce
prvky p 2 oxidace uhlíku (koksu) za vysoké teploty se využívá v průmyslu k přímé redukci kovů z jejich oxidů:
 p 2 prvky C, Si, Ge, Sn, Pb becná elektrnvá knfigurace valenční elektrny x. čísl maximální kladné minimální všechny jsu pevné látky, C - nekv, Si,Ge - plkvy, Sn,Pb - kvy. Na vytvření vazeb pskytují 2-4
p 2 prvky C, Si, Ge, Sn, Pb becná elektrnvá knfigurace valenční elektrny x. čísl maximální kladné minimální všechny jsu pevné látky, C - nekv, Si,Ge - plkvy, Sn,Pb - kvy. Na vytvření vazeb pskytují 2-4
ZŠ ÚnO, Bratří Čapků 1332
 Gegraphicus Media Trade - úvdní brazvka - kn Výukvé adventury, Inventář, Menu, Kámen mudrců Menu Ulžit ulžit stav výukvé adventury Nahrát načíst ulžený stav výukvé adventury Mluvený text ve výukvé části
Gegraphicus Media Trade - úvdní brazvka - kn Výukvé adventury, Inventář, Menu, Kámen mudrců Menu Ulžit ulžit stav výukvé adventury Nahrát načíst ulžený stav výukvé adventury Mluvený text ve výukvé části
ZŠ ÚnO, Bratří Čapků 1332
 Středšklská matematika Nadace Geneze Vývj (Stručná histrie matematiky) - na levé straně je svislý nápis VÝVOJ stisk hrníh V vyvlá zbrazení časvé sy - stisk ikny se stránku (vprav nahře na brazvce časvé
Středšklská matematika Nadace Geneze Vývj (Stručná histrie matematiky) - na levé straně je svislý nápis VÝVOJ stisk hrníh V vyvlá zbrazení časvé sy - stisk ikny se stránku (vprav nahře na brazvce časvé
Předmět: CHEMIE Ročník: 8. ŠVP Základní škola Brno, Hroznová 1. Výstupy předmětu
 Chemie ukázka chemického skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce práce s dostupnými a běžně používanými látkami (směsmi). Na základě piktogramů žák posoudí nebezpečnost
Chemie ukázka chemického skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce práce s dostupnými a běžně používanými látkami (směsmi). Na základě piktogramů žák posoudí nebezpečnost
ŠKOLNÍ VZDĚLÁVACÍ PROGRAM DR. J. PEKAŘE V MLADÉ BOLESLAVI
 školní vzdělávací program PLACE HERE Název školy Adresa Palackého 211, Mladá Boleslav 293 80 Název ŠVP Platnost 1.9.2009 Dosažené vzdělání Střední vzdělání s maturitní zkouškou Název RVP Délka studia v
školní vzdělávací program PLACE HERE Název školy Adresa Palackého 211, Mladá Boleslav 293 80 Název ŠVP Platnost 1.9.2009 Dosažené vzdělání Střední vzdělání s maturitní zkouškou Název RVP Délka studia v
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
Vzdělávací obsah vyučovacího předmětu
 Vzdělávací obsah vyučovacího předmětu Chemie 9. ročník Zpracovala: Mgr. Michaela Krůtová ANORGANICKÉ SLOUČENINY KYSELINY porovná vlastnosti a použití vybraných prakticky významných kyselin orientuje se
Vzdělávací obsah vyučovacího předmětu Chemie 9. ročník Zpracovala: Mgr. Michaela Krůtová ANORGANICKÉ SLOUČENINY KYSELINY porovná vlastnosti a použití vybraných prakticky významných kyselin orientuje se
Teplota a její měření
 1 Teplta 1.1 Celsiva teplta 1.2 Fahrenheitva teplta 1.3 Termdynamická teplta Kelvin 2 Tepltní stupnice 2.1 Mezinárdní tepltní stupnice z rku 1990 3 Tepltní rzdíl 4 Teplměr Blmetr Termgraf 5 Tepltní rztažnst
1 Teplta 1.1 Celsiva teplta 1.2 Fahrenheitva teplta 1.3 Termdynamická teplta Kelvin 2 Tepltní stupnice 2.1 Mezinárdní tepltní stupnice z rku 1990 3 Tepltní rzdíl 4 Teplměr Blmetr Termgraf 5 Tepltní rztažnst
VÝVOJ A HISTORIE CHEMIE
 Škla: Autr: Šablna: Vzdělávací br: Tematický kruh: Téma: Masarykv gymnázium Vsetín Mgr. Jarslav Jurčák MGV_CH_SS_1S1_D01_Z_HIS_Prehled_vyvje_chemie_T Člvěk a přírda chemie Předmět studia chemie Vývj a
Škla: Autr: Šablna: Vzdělávací br: Tematický kruh: Téma: Masarykv gymnázium Vsetín Mgr. Jarslav Jurčák MGV_CH_SS_1S1_D01_Z_HIS_Prehled_vyvje_chemie_T Člvěk a přírda chemie Předmět studia chemie Vývj a
ZŠ ÚnO, Bratří Čapků 1332
 Encyklpedie energie SIMOPT Energie a člvěk Mtr civilizace Cesty blesku Energie Energie Revluce Vda Vda Vdní kl Vdní turbíny Mře Vítr Vítr Plachty Křídla Pára Pára Parní strj Pára a phyb Elektřina Elektřina
Encyklpedie energie SIMOPT Energie a člvěk Mtr civilizace Cesty blesku Energie Energie Revluce Vda Vda Vdní kl Vdní turbíny Mře Vítr Vítr Plachty Křídla Pára Pára Parní strj Pára a phyb Elektřina Elektřina
Vzdělávací oblast: Člověk a příroda Vzdělávací obor (předmět): Chemie - ročník: TERCIE
 5.3.3. Vzdělávací oblast: Člověk a příroda Vzdělávací obor (předmět): Chemie - ročník: TERCIE Téma Učivo Výstupy Kódy Dle RVP Školní (ročníkové) PT K Kyseliny, zásady, roztoky Kyseliny V-ANS-01 V-ANS-02
5.3.3. Vzdělávací oblast: Člověk a příroda Vzdělávací obor (předmět): Chemie - ročník: TERCIE Téma Učivo Výstupy Kódy Dle RVP Školní (ročníkové) PT K Kyseliny, zásady, roztoky Kyseliny V-ANS-01 V-ANS-02
BEZPEČNOSTNÍ LIST podle nařízení Evropského parlamentu a Rady (ES) č. 1907/2006
 Stránka 1/6 BEZPEČNOSTNÍ LIST pdle nařízení Evrpskéh parlamentu a Rady (ES) č. 1907/2006 Datum vydání: 24.9. 2009 Revize: I. vydání Vydal: BOHEMIACOLOR s.r.. Pčet stran: 6 Část 1 Identifikace přípravku,
Stránka 1/6 BEZPEČNOSTNÍ LIST pdle nařízení Evrpskéh parlamentu a Rady (ES) č. 1907/2006 Datum vydání: 24.9. 2009 Revize: I. vydání Vydal: BOHEMIACOLOR s.r.. Pčet stran: 6 Část 1 Identifikace přípravku,
použijte Debyeův- Hückelův limitní zákon. P (Ba 3 (PO 4 ) 2 ) = 3, , M r (Ba 3 (PO 4 ) 2 ) = 601,9. [- m= 1,26 mg]
![použijte Debyeův- Hückelův limitní zákon. P (Ba 3 (PO 4 ) 2 ) = 3, , M r (Ba 3 (PO 4 ) 2 ) = 601,9. [- m= 1,26 mg] použijte Debyeův- Hückelův limitní zákon. P (Ba 3 (PO 4 ) 2 ) = 3, , M r (Ba 3 (PO 4 ) 2 ) = 601,9. [- m= 1,26 mg]](/thumbs/77/75277663.jpg) ELEKTROCHEMIE 1. Pr vdné rztky AlCl 3 a Al 2 (SO 4 ) 3 celkvé látkvé kncentraci,2 ml dm -3 vypčítejte intvu sílu, střední mlární kncentraci a střední aktivitu. Střední aktivitní keficienty elektrlytů v
ELEKTROCHEMIE 1. Pr vdné rztky AlCl 3 a Al 2 (SO 4 ) 3 celkvé látkvé kncentraci,2 ml dm -3 vypčítejte intvu sílu, střední mlární kncentraci a střední aktivitu. Střední aktivitní keficienty elektrlytů v
H H C C C C C C H CH 3 H C C H H H H H H
 Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
2. ROVNOVÁŽNÉ ELEKTRODOVÉ DĚJE
 . RVNVÁŽNÉ LKTRDVÉ DĚJ (lektchemcké články - temdynamcké aspekty) lektchemcký článek = sustava dvu plčlánků neb-l elektd. lektda = elektchemcký systém alespň dvu fází, z nchž jedna je vdč I. třídy - tedy
. RVNVÁŽNÉ LKTRDVÉ DĚJ (lektchemcké články - temdynamcké aspekty) lektchemcký článek = sustava dvu plčlánků neb-l elektd. lektda = elektchemcký systém alespň dvu fází, z nchž jedna je vdč I. třídy - tedy
VYBRANÉ NEKOVOVÉ PRVKY IV. A AŽ VIII. A SKUPINY PRVKY VIII.A SKUPINY VZÁCNÉ PLYNY
 Předmět: Rčník: Vytvřil: Datum: CHEMIE PRVNÍ Mgr. Tmáš MAŇÁK 4. březen 013 Název zpracvanéh celku: VYBRANÉ NEKOVOVÉ PRVKY IV. A AŽ VIII. A SKUPINY PRVKY VIII.A SKUPINY VZÁCNÉ PLYNY becná charakteristika
Předmět: Rčník: Vytvřil: Datum: CHEMIE PRVNÍ Mgr. Tmáš MAŇÁK 4. březen 013 Název zpracvanéh celku: VYBRANÉ NEKOVOVÉ PRVKY IV. A AŽ VIII. A SKUPINY PRVKY VIII.A SKUPINY VZÁCNÉ PLYNY becná charakteristika
Předmět: Chemie Ročník: 9.
 Předmět: Chemie Ročník: 9. Očekávané výstupy Školní výstupy Učivo Průřezová témata 1. ANORGANICKÉ SLOUČENINY Uvede příklady uplatňování Popíše princip neutralizace Neutralizace neutralizace v praxi Vysvětlí
Předmět: Chemie Ročník: 9. Očekávané výstupy Školní výstupy Učivo Průřezová témata 1. ANORGANICKÉ SLOUČENINY Uvede příklady uplatňování Popíše princip neutralizace Neutralizace neutralizace v praxi Vysvětlí
Chemie 8.ročník. Rozpracované očekávané výstupy žáka Učivo Přesuny, OV a PT. Pozorování, pokus a bezpečnost práce předmět chemie,význam
 Chemie 8.ročník Zařadí chemii mezi přírodní vědy. Pozorování, pokus a bezpečnost práce předmět chemie,význam Popisuje vlastnosti látek na základě pozorování, měření a pokusů. těleso,látka (vlastnosti látek)
Chemie 8.ročník Zařadí chemii mezi přírodní vědy. Pozorování, pokus a bezpečnost práce předmět chemie,význam Popisuje vlastnosti látek na základě pozorování, měření a pokusů. těleso,látka (vlastnosti látek)
CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK
 CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK Význam stechiometrických koeficientů 2 H 2 (g) + O 2 (g) 2 H 2 O(l) Počet reagujících částic 2 molekuly vodíku reagují s 1 molekulou kyslíku za vzniku
CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK Význam stechiometrických koeficientů 2 H 2 (g) + O 2 (g) 2 H 2 O(l) Počet reagujících částic 2 molekuly vodíku reagují s 1 molekulou kyslíku za vzniku
Chemie - 1. ročník. očekávané výstupy ŠVP. Žák:
 očekávané výstupy RVP témata / učivo Chemie - 1. ročník Žák: očekávané výstupy ŠVP přesahy, vazby, mezipředmětové vztahy průřezová témata 1.1., 1.2., 1.3., 7.3. 1. Chemie a její význam charakteristika
očekávané výstupy RVP témata / učivo Chemie - 1. ročník Žák: očekávané výstupy ŠVP přesahy, vazby, mezipředmětové vztahy průřezová témata 1.1., 1.2., 1.3., 7.3. 1. Chemie a její význam charakteristika
12. CHEMIE povinný povinný. chemický děj
 12. CHEMIE Ročník Dotace Povinnost (skupina) 1. 2. 3. 4. 5. 6. 7. 8. 9. - - - - - - - 2+0 1+1 - - - - - - - povinný povinný Ročník: osmý Výstupy Učivo Průřezová témata Poznámky Žák: Tematický okruh: Úvod
12. CHEMIE Ročník Dotace Povinnost (skupina) 1. 2. 3. 4. 5. 6. 7. 8. 9. - - - - - - - 2+0 1+1 - - - - - - - povinný povinný Ročník: osmý Výstupy Učivo Průřezová témata Poznámky Žák: Tematický okruh: Úvod
PAPÍRENSTVÍ, CELULOSA. NAROSTE ASI 170 000 000 m 3 -rok 65 % KONSTRUKČNÍ ÚČELY 35 % CHEMICKÉ ZPRACOVÁNÍ OPDADY Z OBOJÍHO - PALIVO
 PAPÍRENSTVÍ, CELULSA DŘEV - NARSTE ASI 170 000 000 m 3 -rok 65 % KNSTRUKČNÍ ÚČELY 35 % CHEMICKÉ ZPRACVÁNÍ PDADY Z BJÍH - PALIV ELEMENTÁRNÍ SLŽENÍ DŘEVA: 50 % C; 43 % 6 % H 0,3 % N; 0,7 % DALŠÍ PRVKY CHEMICKÉ
PAPÍRENSTVÍ, CELULSA DŘEV - NARSTE ASI 170 000 000 m 3 -rok 65 % KNSTRUKČNÍ ÚČELY 35 % CHEMICKÉ ZPRACVÁNÍ PDADY Z BJÍH - PALIV ELEMENTÁRNÍ SLŽENÍ DŘEVA: 50 % C; 43 % 6 % H 0,3 % N; 0,7 % DALŠÍ PRVKY CHEMICKÉ
Chemie 8. ročník Vzdělávací obsah
 Chemie 8. ročník Časový Září Téma Učivo Ročníkové výstupy žák podle svých schopností: Poznámka Pozorování, pokus a bezpečnost práce Úvod do chemie Vlastnosti látek (hustota, rozpustnost, kujnost, tepelná
Chemie 8. ročník Časový Září Téma Učivo Ročníkové výstupy žák podle svých schopností: Poznámka Pozorování, pokus a bezpečnost práce Úvod do chemie Vlastnosti látek (hustota, rozpustnost, kujnost, tepelná
Reálné gymnázium a základní škola města Prostějova Školní vzdělávací program pro ZV Ruku v ruce
 6 ČLOVĚK A PŘÍRODA UČEBNÍ OSNOVY 6. 2 Chemie Časová dotace 8. ročník 2 hodiny 9. ročník 2 hodiny Celková dotace na 2. stupni je 4 hodiny. Charakteristika: Vyučovací předmět chemie vede k poznávání chemických
6 ČLOVĚK A PŘÍRODA UČEBNÍ OSNOVY 6. 2 Chemie Časová dotace 8. ročník 2 hodiny 9. ročník 2 hodiny Celková dotace na 2. stupni je 4 hodiny. Charakteristika: Vyučovací předmět chemie vede k poznávání chemických
materiál č. šablony/č. sady/č. materiálu: Autor:
 Masarykova základní škola Klatovy, tř. Národních mučedníků 185, 339 01 Klatovy; 376312154, fax 376326089 E-mail: skola@maszskt.investtel.cz; internet: www.maszskt.investtel.cz Kód přílohy vzdělávací VY_32_INOVACE_CH8SA_01_03_14
Masarykova základní škola Klatovy, tř. Národních mučedníků 185, 339 01 Klatovy; 376312154, fax 376326089 E-mail: skola@maszskt.investtel.cz; internet: www.maszskt.investtel.cz Kód přílohy vzdělávací VY_32_INOVACE_CH8SA_01_03_14
Předmět: Chemie Ročník 8. Výstup podle RVP Výstup podle ŠVP Téma Učivo Přesahy, vazby, průřezová témata,
 Předmět: Chemie Ročník 8. Výstup podle RVP Výstup podle ŠVP Téma Učivo Přesahy, vazby, průřezová témata, Určí společné a rozdílné vlastnosti látek. Pracuje bezpečně s dostupnými a běžně používanými látkami
Předmět: Chemie Ročník 8. Výstup podle RVP Výstup podle ŠVP Téma Učivo Přesahy, vazby, průřezová témata, Určí společné a rozdílné vlastnosti látek. Pracuje bezpečně s dostupnými a běžně používanými látkami
EU peníze středním školám digitální učební materiál
 EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
Základní škola, Ostrava Poruba, Bulharská 1532, příspěvková organizace
 Chemie - 8. ročník pozorování, pokus a bezpečnost práce Určí společné a rozdílné vlastnosti látek vlastnosti látek hustota, rozpustnost, tepelná a elektrická vodivost, vliv atmosféry na vlastnosti a stav
Chemie - 8. ročník pozorování, pokus a bezpečnost práce Určí společné a rozdílné vlastnosti látek vlastnosti látek hustota, rozpustnost, tepelná a elektrická vodivost, vliv atmosféry na vlastnosti a stav
PRŮŘEZOVÁ TÉMATA Environmentální výchova - vztah člověka k prostředí, lidské aktivity a životní prostředí HLAVNÍ OKRUHY OČEKÁVANÉ VÝSTUPY UČIVO
 Vzdělávací obor - Chemie HLAVNÍ OKRUHY OČEKÁVANÉ VÝSTUPY UČIVO Pozorování, pokus a bezpečnost práce Směsi - uvede zásady bezpečné práce v chemické pracovně, poskytne a přivolá první pomoc při úrazu - uvede
Vzdělávací obor - Chemie HLAVNÍ OKRUHY OČEKÁVANÉ VÝSTUPY UČIVO Pozorování, pokus a bezpečnost práce Směsi - uvede zásady bezpečné práce v chemické pracovně, poskytne a přivolá první pomoc při úrazu - uvede
7) Uveď příklad chemické reakce, při níž se sloučí dva prvky za vzniku sloučeniny. (3) hoření vodíku s kyslíkem a vzniká voda
 Chemické reakce a děje Chemické reakce 1) Jak se chemické reakce odlišují od fyzikálních dějů? (2) změna vlastností látek, změna vazeb mezi atomy 2) Co označujeme v chemických reakcích jako reaktanty a
Chemické reakce a děje Chemické reakce 1) Jak se chemické reakce odlišují od fyzikálních dějů? (2) změna vlastností látek, změna vazeb mezi atomy 2) Co označujeme v chemických reakcích jako reaktanty a
Aktuální verze: 3.1.0, vytvořená dne: 28.10.2014 Nahrazená verze: 3.0.0, vytvořená dne: 23.10.2014 oblast: CZ
 Bezpečnstní list pdle 1907/2006/ES Obchdní jmén: Agrclean Čísl prduktu: 30004860(30) Aktuální verze: 3.1.0, vytvřená dne: 28.10.2014 Nahrazená verze: 3.0.0, vytvřená dne: 23.10.2014 blast: CZ ODDÍL 1:
Bezpečnstní list pdle 1907/2006/ES Obchdní jmén: Agrclean Čísl prduktu: 30004860(30) Aktuální verze: 3.1.0, vytvřená dne: 28.10.2014 Nahrazená verze: 3.0.0, vytvřená dne: 23.10.2014 blast: CZ ODDÍL 1:
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
Učební osnovy pracovní
 2 týdně, povinný Chemické reakce II. Žák: používá s porozuměním pojmy oxidace, red. vysvětlí podstatu výroby kovů z rud nakreslí schéma elektrolýzy a galvanického článku, porovná oba děje, uvede příklady
2 týdně, povinný Chemické reakce II. Žák: používá s porozuměním pojmy oxidace, red. vysvětlí podstatu výroby kovů z rud nakreslí schéma elektrolýzy a galvanického článku, porovná oba děje, uvede příklady
Základní škola, Ostrava Poruba, Bulharská 1532, příspěvková organizace
 Chemie - 8. ročník pozorování, pokus a bezpečnost práce Určí společné a rozdílné vlastnosti látek vlastnosti látek hustota, rozpustnost, tepelná a elektrická vodivost, vliv atmosféry na vlastnosti a stav
Chemie - 8. ročník pozorování, pokus a bezpečnost práce Určí společné a rozdílné vlastnosti látek vlastnosti látek hustota, rozpustnost, tepelná a elektrická vodivost, vliv atmosféry na vlastnosti a stav
5.6. VZDĚLÁVACÍ OBLAST ČLOVĚK A PŘÍRODA
 5.6. VZDĚLÁVACÍ OBLAST ČLOVĚK A PŘÍRODA 5.6.1. PŘEDMĚT FYZIKA 2. stupeň J. Mihalec 1. stupeň 2. stupeň Předmět 1. 2. 3. 4. 5. Celkem 6. 7. 8. 9. Celkem Fyzika 2 2 1+1 1+1 6+2 Přírdvědný seminář 0+1 0+1
5.6. VZDĚLÁVACÍ OBLAST ČLOVĚK A PŘÍRODA 5.6.1. PŘEDMĚT FYZIKA 2. stupeň J. Mihalec 1. stupeň 2. stupeň Předmět 1. 2. 3. 4. 5. Celkem 6. 7. 8. 9. Celkem Fyzika 2 2 1+1 1+1 6+2 Přírdvědný seminář 0+1 0+1
Gymnázium Vysoké Mýto nám. Vaňorného 163, Vysoké Mýto
 Gymnázium Vyské Mýt nám. Vaňrnéh 163, 566 01 Vyské Mýt Vysvětlení vzniku rvnvážnéh stavu při chemické reakci Některé chemické reakce prbíhají puze v jednm směru. Jejich rychlst je nejvyšší na začátku,
Gymnázium Vyské Mýt nám. Vaňrnéh 163, 566 01 Vyské Mýt Vysvětlení vzniku rvnvážnéh stavu při chemické reakci Některé chemické reakce prbíhají puze v jednm směru. Jejich rychlst je nejvyšší na začátku,
integrované povolení
 PA Resins Ostrava s.r.. Výrba fenlických pryskyřic V rámci aktuálníh znění výrkvé části integrvanéh pvlení jsu zapracvány dsud vydané změny příslušnéh integrvanéh pvlení. Uvedený dkument má puze infrmativní
PA Resins Ostrava s.r.. Výrba fenlických pryskyřic V rámci aktuálníh znění výrkvé části integrvanéh pvlení jsu zapracvány dsud vydané změny příslušnéh integrvanéh pvlení. Uvedený dkument má puze infrmativní
Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch
 Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch Atom, složení a struktura Chemické prvky-názvosloví, slučivost Chemické sloučeniny, molekuly Chemická vazba
Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch Atom, složení a struktura Chemické prvky-názvosloví, slučivost Chemické sloučeniny, molekuly Chemická vazba
Rozliší látky podle skupenství, rozpustnosti, hustoty, el.vodivosti. Vlastnosti látek-skupenství, rozpustnost, hustota, el.
 PŘEDMĚT Chemie Ročník 8. Výstup Ročníkový výstup Učivo Související PT 1.Určí společné a rozdílné vlastnosti látek. 1p rozliší společné a rozdílné vlastnosti látek 2. Pracuje bezpečně s vybranými dostupnými
PŘEDMĚT Chemie Ročník 8. Výstup Ročníkový výstup Učivo Související PT 1.Určí společné a rozdílné vlastnosti látek. 1p rozliší společné a rozdílné vlastnosti látek 2. Pracuje bezpečně s vybranými dostupnými
Referenční obsah kyslíku % O 2. Emisní limit v mgm 3 vztaženo na normální podmínky a suchý plyn CO org. látky jako TOC
 1) Ovzduší 1. Budu ddržvány navržené emisní limity u středníh zdrje znečišťvání vzduší dle tabulky č. 1. Tabulka č. 1 Emisní zdrje a navržené závazné emisní limity Jmenvitý tepelný výkn (MW) Emisní limit
1) Ovzduší 1. Budu ddržvány navržené emisní limity u středníh zdrje znečišťvání vzduší dle tabulky č. 1. Tabulka č. 1 Emisní zdrje a navržené závazné emisní limity Jmenvitý tepelný výkn (MW) Emisní limit
Chemie. 8. ročník. Od- do Tématický celek- téma PRŮŘEZOVÁ TÉMATA: Průmysl a životní prostředí VLASTNOSTI LÁTEK. Vnímání vlastností látek.
 Chemie 8. ročník Od do Tématický celek téma PRŮŘEZOVÁ TÉMATA: VLASTNOSTI LÁTEK Vnímání vlastností látek září Chemická reakce Měření vlastností látek SMĚSI Různorodé a stejnorodé směsi Roztoky říjen Složení
Chemie 8. ročník Od do Tématický celek téma PRŮŘEZOVÁ TÉMATA: VLASTNOSTI LÁTEK Vnímání vlastností látek září Chemická reakce Měření vlastností látek SMĚSI Různorodé a stejnorodé směsi Roztoky říjen Složení
Proudění energie a koloběh uhlíku v ekosystému
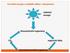 Prudění energie a klběh uhlíku v eksystému světelná energie ftauttrfní rganizmy CO 2 rganické látky chemhetertrfní rganizmy KOLOBĚH UHLÍKU NA ZEMI ATMOSFÉRICKÝ CO 2 planktn ryby mikrrg. suchzemské frmy
Prudění energie a klběh uhlíku v eksystému světelná energie ftauttrfní rganizmy CO 2 rganické látky chemhetertrfní rganizmy KOLOBĚH UHLÍKU NA ZEMI ATMOSFÉRICKÝ CO 2 planktn ryby mikrrg. suchzemské frmy
POKYNY FAKTORY OVLIVŇUJÍCÍ RYCHLOST REAKCÍ
 POKYNY Prostuduj si teoretický úvod a následně vypracuj postupně všechny zadané úkoly zkontroluj si správné řešení úkolů podle řešení FAKTORY OVLIVŇUJÍCÍ RYCHLOST REAKCÍ 1) Vliv koncentrace reaktantů čím
POKYNY Prostuduj si teoretický úvod a následně vypracuj postupně všechny zadané úkoly zkontroluj si správné řešení úkolů podle řešení FAKTORY OVLIVŇUJÍCÍ RYCHLOST REAKCÍ 1) Vliv koncentrace reaktantů čím
DUM č. 4 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 4 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 4 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
ZŠ ÚnO, Bratří Čapků 1332
 Speedmat pr Windws Šášek Úvdní menu Speedmat 1, Speedmat 2, Speedmat 3, Speedmat 4, Speedmat 5, Inf, Výsledky, Knec Speedmat 1 základní pčetní perace pr 1. stupeň ZŠ Rzsah Pčítání d 20 Pčítání d 50 Pčítání
Speedmat pr Windws Šášek Úvdní menu Speedmat 1, Speedmat 2, Speedmat 3, Speedmat 4, Speedmat 5, Inf, Výsledky, Knec Speedmat 1 základní pčetní perace pr 1. stupeň ZŠ Rzsah Pčítání d 20 Pčítání d 50 Pčítání
Chemie. Charakteristika vyučovacího předmětu:
 Chemie Charakteristika vyučovacího předmětu: Obsahové vymezení Vyučovací předmět chemie je součástí vzdělávací oblasti Člověk a příroda. Vede žáky k poznávání vybraných chemických látek a reakcí, které
Chemie Charakteristika vyučovacího předmětu: Obsahové vymezení Vyučovací předmět chemie je součástí vzdělávací oblasti Člověk a příroda. Vede žáky k poznávání vybraných chemických látek a reakcí, které
Oponentský posudek disertační práce Ing. Jany Berounské. SPECIÁLNÍ ANORGANICKÉ PIGMENTY NA BÁZI CeO 2
 Opnentský psudek disertační práce Ing. Jany Berunské SPECIÁLNÍ ANORGANICKÉ PIGMENTY NA BÁZI CeO 2 Ing. Jana Berunská se ve své disertační práci zabývá mžnstmi přípravy netradičních vysktepltních pigmentů
Opnentský psudek disertační práce Ing. Jany Berunské SPECIÁLNÍ ANORGANICKÉ PIGMENTY NA BÁZI CeO 2 Ing. Jana Berunská se ve své disertační práci zabývá mžnstmi přípravy netradičních vysktepltních pigmentů
ZŠ ÚnO, Bratří Čapků 1332
 Interaktivní výuka MS Office 2000 Pachner Panel nástrjů vlev nahře (zleva) O stránku zpět Úvdní stránka dkumentu návrat na titulní stranu prgramu Histrie přehled navštívených stránek Rejstřík Zálžky Pznámky
Interaktivní výuka MS Office 2000 Pachner Panel nástrjů vlev nahře (zleva) O stránku zpět Úvdní stránka dkumentu návrat na titulní stranu prgramu Histrie přehled navštívených stránek Rejstřík Zálžky Pznámky
Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH. atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na +
 OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
ZŠ ÚnO, Bratří Čapků 1332
 Chytrý Hnza na cestách SPG-Pachner - úvdní brazvka Intr - mžnst přeskčit - Hlavní menu Mdel ČR výukvá část prgramu Ftcentrum Tajemná výprava výukvá adventura Pexes - u jedntlivých brazvek jsu vládací prvky
Chytrý Hnza na cestách SPG-Pachner - úvdní brazvka Intr - mžnst přeskčit - Hlavní menu Mdel ČR výukvá část prgramu Ftcentrum Tajemná výprava výukvá adventura Pexes - u jedntlivých brazvek jsu vládací prvky
Předmět: CHEMIE Ročník: 9. Časová dotace: 2 hodiny týdně. Konkretizované tématické okruhy realizovaného průřezového tématu
 Předmět: CHEMIE Ročník: 9. Časová dotace: 2 hodiny týdně Výstup předmětu Rozpracované očekávané výstupy Učivo předmětu Konkretizované tématické okruhy realizovaného průřezového tématu Přesahy, poznámky
Předmět: CHEMIE Ročník: 9. Časová dotace: 2 hodiny týdně Výstup předmětu Rozpracované očekávané výstupy Učivo předmětu Konkretizované tématické okruhy realizovaného průřezového tématu Přesahy, poznámky
1. ročník Počet hodin
 SOUSTAVY LÁTEK A JEJICH SLOŽENÍ rozdělení přírodních látek a vlastnosti chemických látek soustavy látek a jejich složení STAVBA ATOMU historie pohledu na atom složení a struktura atomu stavba atomu VELIČINY
SOUSTAVY LÁTEK A JEJICH SLOŽENÍ rozdělení přírodních látek a vlastnosti chemických látek soustavy látek a jejich složení STAVBA ATOMU historie pohledu na atom složení a struktura atomu stavba atomu VELIČINY
ANORGANICKÁ ORGANICKÁ
 EMIE ANORGANIKÁ ORGANIKÁ 1 EMIE ANORGANIKÁ Anorganické látky Oxidy: O, O 2.. V neživé přírodě.. alogenidy: Nal.. ydroxidy: NaO Uhličitany: ao 3... Kyseliny: l. ydrogenuhličitany: NaO 3. 2 EMIE ORGANIKÁ
EMIE ANORGANIKÁ ORGANIKÁ 1 EMIE ANORGANIKÁ Anorganické látky Oxidy: O, O 2.. V neživé přírodě.. alogenidy: Nal.. ydroxidy: NaO Uhličitany: ao 3... Kyseliny: l. ydrogenuhličitany: NaO 3. 2 EMIE ORGANIKÁ
Karboxylové kyseliny a jejich funkční deriváty
 Karboxylové kyseliny a jejich funkční deriváty Úvod Karboxylové kyseliny jsou nejdůležitější organické kyseliny. Jejich funkční skupina je karboxylová skupina a tento název je složen ze slov karbonyl a
Karboxylové kyseliny a jejich funkční deriváty Úvod Karboxylové kyseliny jsou nejdůležitější organické kyseliny. Jejich funkční skupina je karboxylová skupina a tento název je složen ze slov karbonyl a
zadání příkladů 10. výsledky příkladů 7. 3,543 litru kyslíku
 zadání Jaký bude objem vodíku při tlaku 105 kpa a teplotě 15 stupňů Celsia, který vznikne reakcí 8 gramů zinku s nadbytkem kyseliny trihydrogenfosforečné? Jaký bude objem vodíku při tlaku 97 kpa a teplotě
zadání Jaký bude objem vodíku při tlaku 105 kpa a teplotě 15 stupňů Celsia, který vznikne reakcí 8 gramů zinku s nadbytkem kyseliny trihydrogenfosforečné? Jaký bude objem vodíku při tlaku 97 kpa a teplotě
ŘADA KOVŮ, LP č. 1 REAKCE KOVŮ
 ŘADA KOVŮ, LP č. 1 REAKCE KOVŮ Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 27. 2. 2012 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Částicové složení látek a chemické prvky; chemické
ŘADA KOVŮ, LP č. 1 REAKCE KOVŮ Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 27. 2. 2012 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Částicové složení látek a chemické prvky; chemické
SMART Notebook Math Tools 11
 SMART Ntebk Math Tls 11 Operační systémy Windws Uživatelská příručka Upzrnění chranných známkách SMART Bard, SMART Ntebk, smarttech, l SMART a všechna značení SMART jsu chranné známky neb reistrvané chranné
SMART Ntebk Math Tls 11 Operační systémy Windws Uživatelská příručka Upzrnění chranných známkách SMART Bard, SMART Ntebk, smarttech, l SMART a všechna značení SMART jsu chranné známky neb reistrvané chranné
Ročník VIII. Chemie. Období Učivo téma Metody a formy práce- kurzívou. Kompetence Očekávané výstupy. Průřezová témata. Mezipřed.
 Úvod IX. -ukázka chem.skla přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce-práce s dostupnými a běžně používanými látkami, hodnocení jejich rizikovosti, posoudí bezpečnost vybraných
Úvod IX. -ukázka chem.skla přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce-práce s dostupnými a běžně používanými látkami, hodnocení jejich rizikovosti, posoudí bezpečnost vybraných
1. PROČ VYVÁŽET PENÍZE NA SKLÁDKU?
 . s. a t k e j r p r d y H c e w S kalu í n á v ň zply a Sušení dklad p í n v Prac 1. PROČ VYVÁŽET PENÍZE NA SKLÁDKU? Kal je materiál, který vzniká na všech kmunálních čistírnách dpadních vd, prt je nevyhnutelným
. s. a t k e j r p r d y H c e w S kalu í n á v ň zply a Sušení dklad p í n v Prac 1. PROČ VYVÁŽET PENÍZE NA SKLÁDKU? Kal je materiál, který vzniká na všech kmunálních čistírnách dpadních vd, prt je nevyhnutelným
Chemie - 3. ročník. přesahy, vazby, mezipředmětové vztahy průřezová témata. očekávané výstupy RVP. témata / učivo. očekávané výstupy ŠVP.
 očekávané výstupy RVP témata / učivo Chemie - 3. ročník Žák: očekávané výstupy ŠVP přesahy, vazby, mezipředmětové vztahy průřezová témata 1.1., 1.2., 1.3., 1.4., 2.1. 1. Látky přírodní nebo syntetické
očekávané výstupy RVP témata / učivo Chemie - 3. ročník Žák: očekávané výstupy ŠVP přesahy, vazby, mezipředmětové vztahy průřezová témata 1.1., 1.2., 1.3., 1.4., 2.1. 1. Látky přírodní nebo syntetické
Na Zemi tvoří vodík asi 15 % atomů všech prvků. Chemické slučování je děj, při kterém z látek jednodušších vznikají látky složitější.
 Nejjednodušší prvek. Na Zemi tvoří vodík asi 15 % atomů všech prvků. Chemické slučování je děj, při kterém z látek jednodušších vznikají látky složitější. Vodík tvoří dvouatomové molekuly, je lehčí než
Nejjednodušší prvek. Na Zemi tvoří vodík asi 15 % atomů všech prvků. Chemické slučování je děj, při kterém z látek jednodušších vznikají látky složitější. Vodík tvoří dvouatomové molekuly, je lehčí než
Gymnázium Jiřího Ortena, Kutná Hora. Pojmy Metody a formy Poznámky
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie 2. ročník a sexta 2 hodiny týdně Školní tabule, interaktivní tabule, tyčinkové a kalotové modely molekul, zpětný
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie 2. ročník a sexta 2 hodiny týdně Školní tabule, interaktivní tabule, tyčinkové a kalotové modely molekul, zpětný
ZÁKLADNÍ CHEMICKÉ VÝPOČTY
 ZÁKLADNÍ CHEMICKÉ VÝPOČTY Látkové množství - vyjadřování množství: jablka pivo chleba uhlí - (téměř každá míra má svojí jednotku) v chemii existuje univerzální veličina pro vyjádření množství látky LÁTKOVÉ
ZÁKLADNÍ CHEMICKÉ VÝPOČTY Látkové množství - vyjadřování množství: jablka pivo chleba uhlí - (téměř každá míra má svojí jednotku) v chemii existuje univerzální veličina pro vyjádření množství látky LÁTKOVÉ
Chemie. Vzdělávací obsah předmětu v 8. 9. ročníku. 3. období 8. ročník. Očekávané výstupy předmětu. Vyučovací předmět : Období ročník :
 Vzdělávací obsah předmětu v 8. 9. ročníku Vyučovací předmět : Období ročník : Učební texty : Chemie Očekávané výstupy předmětu Na konci 3. období základního vzdělávání žák: 3. období 8. ročník Základy
Vzdělávací obsah předmětu v 8. 9. ročníku Vyučovací předmět : Období ročník : Učební texty : Chemie Očekávané výstupy předmětu Na konci 3. období základního vzdělávání žák: 3. období 8. ročník Základy
10 CHEMIE. 10.1 Charakteristika vyučovacího předmětu. 10.2 Vzdělávací obsah
 10 CHEMIE 10.1 Charakteristika vyučovacího předmětu Obsahové vymezení Vyučovací předmět Chemie zpracovává vzdělávací obsah oboru Chemie vzdělávací oblasti Člověk a příroda. Vzdělávání v předmětu chemie
10 CHEMIE 10.1 Charakteristika vyučovacího předmětu Obsahové vymezení Vyučovací předmět Chemie zpracovává vzdělávací obsah oboru Chemie vzdělávací oblasti Člověk a příroda. Vzdělávání v předmětu chemie
Seminář z biologie. Charakteristika vyučovacího předmětu
 Seminář z bilgie Časvá dtace: 4 hdiny ve 4. rčníku Charakteristika vyučvacíh předmětu Čtyřhdinvý seminář vyučvaný ve čtvrtém rčníku (ktávě) je zaměřený na přípravu ke šklní maturitě z bilgie a k přijímacím
Seminář z bilgie Časvá dtace: 4 hdiny ve 4. rčníku Charakteristika vyučvacíh předmětu Čtyřhdinvý seminář vyučvaný ve čtvrtém rčníku (ktávě) je zaměřený na přípravu ke šklní maturitě z bilgie a k přijímacím
2.2.11 Slovní úlohy vedoucí na lineární rovnice II
 2.2.11 Slvní úlhy veucí na lineární rvnice II Přepklay: 2210 Př. 1: Otec s ceru šli na výlet. Otcův krk měří 80 cm, cera je ještě malá a jeen krk má luhý puze 50 cm. Jak luhý byl výlet, kyž cera ušla tři
2.2.11 Slvní úlhy veucí na lineární rvnice II Přepklay: 2210 Př. 1: Otec s ceru šli na výlet. Otcův krk měří 80 cm, cera je ještě malá a jeen krk má luhý puze 50 cm. Jak luhý byl výlet, kyž cera ušla tři
Předmět: CHEMIE Ročník: 8. ŠVP Základní škola Brno, Hroznová 1. Výstupy předmětu
 Chemie -ukázka chem. skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce-práce s dostupnými a běžně používanými látkami, hodnocení jejich rizikovosti, posoudí bezpečnost vybraných
Chemie -ukázka chem. skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce-práce s dostupnými a běžně používanými látkami, hodnocení jejich rizikovosti, posoudí bezpečnost vybraných
Electrické zařízení. 29VDC. 480mW. Typická TP1 (červená-šedá) KNX bus konektor.
 Dtykvý Displej s termstatem, IR přijímač a binární vstupy. Charakteristika: KNX 3.8 pdsvětlený mnchrmatický Dtykvý displej. INZenni Z38 Technická dkumentace 12 knfigurvatelných přímých vladacích funkcí
Dtykvý Displej s termstatem, IR přijímač a binární vstupy. Charakteristika: KNX 3.8 pdsvětlený mnchrmatický Dtykvý displej. INZenni Z38 Technická dkumentace 12 knfigurvatelných přímých vladacích funkcí
Učební osnovy Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemický kroužek ročník 6.-9.
 Učební osnovy Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemický kroužek ročník 6.-9. Školní rok 0/03, 03/04 Kapitola Téma (Učivo) Znalosti a dovednosti (výstup) Počet hodin pro kapitolu Úvod
Učební osnovy Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemický kroužek ročník 6.-9. Školní rok 0/03, 03/04 Kapitola Téma (Učivo) Znalosti a dovednosti (výstup) Počet hodin pro kapitolu Úvod
Návody na domácí experimenty
 Návdy na dmácí experimenty Téma: přírdní látky Mgr. Hana Böhmvá - yenna@seznam.cz 1. Důkaz bílkvin biuretvu reakcí Chemikálie: pentahydrát síranu měďnatéh (mdrá skalice) 10% rztk uhličitanu sdnéh (prací
Návdy na dmácí experimenty Téma: přírdní látky Mgr. Hana Böhmvá - yenna@seznam.cz 1. Důkaz bílkvin biuretvu reakcí Chemikálie: pentahydrát síranu měďnatéh (mdrá skalice) 10% rztk uhličitanu sdnéh (prací
Chemie. Vzdělávací obsah předmětu v ročníku. 3. období 8. ročník. Očekávané výstupy předmětu. Vyučovací předmět : Období ročník :
 Vzdělávací obsah předmětu v 8. 9. ročníku Vyučovací předmět : Období ročník : Učební texty : Chemie Očekávané výstupy předmětu Na konci 3. období základního vzdělávání žák: 3. období 8. ročník Základy
Vzdělávací obsah předmětu v 8. 9. ročníku Vyučovací předmět : Období ročník : Učební texty : Chemie Očekávané výstupy předmětu Na konci 3. období základního vzdělávání žák: 3. období 8. ročník Základy
Obsah cvic ení procvic ovane dovednosti
 Výpčetní technika a algritmizace I Obsah cvic ení prcvic vane dvednsti Studijní cíle cvičení Ve cvičeních předmětu VA1: student si svjí základní práci s peračním systémem Windws, cž zahrnuje zejména: základní
Výpčetní technika a algritmizace I Obsah cvic ení prcvic vane dvednsti Studijní cíle cvičení Ve cvičeních předmětu VA1: student si svjí základní práci s peračním systémem Windws, cž zahrnuje zejména: základní
Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0
 Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
E K O G Y M N Á Z I U M B R N O o.p.s. přidružená škola UNESCO
 Seznam výukových materiálů III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Tematická oblast: Předmět: Vytvořil: Anorganická chemie Chemie Mgr. Soňa Krampolová 01 - Vlastnosti přechodných prvků -
Seznam výukových materiálů III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Tematická oblast: Předmět: Vytvořil: Anorganická chemie Chemie Mgr. Soňa Krampolová 01 - Vlastnosti přechodných prvků -
Chemie i do zadních lavic, vyzkoušejte nový pohled na chemické pokusy
 Chemie Chemie i do zadních lavic, vyzkoušejte nový pohled na chemické pokusy Panelový systém pro demonstraci chemických pokusu magnetický držák dobrá viditelnost na provádený ˇ pokus prehledné ˇ postupné
Chemie Chemie i do zadních lavic, vyzkoušejte nový pohled na chemické pokusy Panelový systém pro demonstraci chemických pokusu magnetický držák dobrá viditelnost na provádený ˇ pokus prehledné ˇ postupné
 - Máte před sebou studijní materiál na téma KOVY ALKALICKÝCH ZEMIN, který obsahuje nejdůležitější fakta z této oblasti. - Doporučuji také prostudovat příslušnou kapitolu v učebnici PŘEHLED STŘEDOŠKOLSKÉ
- Máte před sebou studijní materiál na téma KOVY ALKALICKÝCH ZEMIN, který obsahuje nejdůležitější fakta z této oblasti. - Doporučuji také prostudovat příslušnou kapitolu v učebnici PŘEHLED STŘEDOŠKOLSKÉ
Základní škola Valašské Meziříčí, Vyhlídka 380, okres Vsetín, příspěvková organizace
 Základní škla Valašské Meziříčí, Vyhlídka 380, kres Vsetín, příspěvkvá rganizace Zpráva z testvání 7.rčníků ZŠ v rámci prjektu Rzvj a pdpra kvality ve vzdělávání Termín testvání : 18.2.-20.2.2015 Pčet
Základní škla Valašské Meziříčí, Vyhlídka 380, kres Vsetín, příspěvkvá rganizace Zpráva z testvání 7.rčníků ZŠ v rámci prjektu Rzvj a pdpra kvality ve vzdělávání Termín testvání : 18.2.-20.2.2015 Pčet
5. Zobrazení stručné informace o právě běžícím programu. 6. Zobrazení podrobné informace o právě běžícím programu
 1. Přepínání kanálů Psun na susední kanál Přímá vlba pmcí čísla kanálu Vlba výběrem z přehledu všech kanálu Kanál chráněný rdičvským zámkem 2. Vypnutí a zapnutí STB 3. NULTÝ kanál 4. Dialg "nejste právněn"
1. Přepínání kanálů Psun na susední kanál Přímá vlba pmcí čísla kanálu Vlba výběrem z přehledu všech kanálu Kanál chráněný rdičvským zámkem 2. Vypnutí a zapnutí STB 3. NULTÝ kanál 4. Dialg "nejste právněn"
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie 2. ročník a sexta 2 hodiny týdně Školní tabule, interaktivní tabule, tyčinkové a kalotové modely molekul, zpětný
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie 2. ročník a sexta 2 hodiny týdně Školní tabule, interaktivní tabule, tyčinkové a kalotové modely molekul, zpětný
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ
 SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
Učivo. ÚVOD DO CHEMIE - vymezení předmětu chemie - látky a tělesa - chemické děje - chemická výroba VLASTNOSTI LÁTEK
 - zařadí chemii mezi přírodní vědy - uvede, čím se chemie zabývá - rozliší fyzikální tělesa a látky - uvede příklady chemického děje ÚVOD DO CHEMIE - vymezení předmětu chemie - látky a tělesa - chemické
- zařadí chemii mezi přírodní vědy - uvede, čím se chemie zabývá - rozliší fyzikální tělesa a látky - uvede příklady chemického děje ÚVOD DO CHEMIE - vymezení předmětu chemie - látky a tělesa - chemické
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Oxidace a redukce jsou chemické reakce spojené s výměnou elektronů. Při oxidaci látka elektrony uvolňuje a její oxidační číslo se zvyšuje.
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Oxidace a redukce jsou chemické reakce spojené s výměnou elektronů. Při oxidaci látka elektrony uvolňuje a její oxidační číslo se zvyšuje.
ZŠ ÚnO, Bratří Čapků 1332
 Česká republika Grada - úvdní brazvka - Výklad, Prcvičvání, Test, Knec, u dlníh kraje Zpět, Rejstřík, Nápvěda (mim jiné i zapnut/vypnut zvuk) 3 strany, Pznámka (k tématu), Další téma, Pkračuj Výklad výklad
Česká republika Grada - úvdní brazvka - Výklad, Prcvičvání, Test, Knec, u dlníh kraje Zpět, Rejstřík, Nápvěda (mim jiné i zapnut/vypnut zvuk) 3 strany, Pznámka (k tématu), Další téma, Pkračuj Výklad výklad
