Přechodné kovy v organické chemii
|
|
|
- Anežka Konečná
- před 8 lety
- Počet zobrazení:
Transkript
1 1 Přechodné kovy v organické chemii Moderní organická chemie využívá přechodné kovy v řadě katalytických i stechiometrických reakcí z nichž některé mají zásadní význam pro průmyslovou výrobu. Je to důsledek toho, že prakticky každá organická funkční skupina je schopna koordinace k přechodným kovům a tato koordinace pak výrazně mění chemické chování těchto skupin. Elektrofilní skupiny se stávají nukleofilními a naopak, dochází ke stabilizaci nestálých molekul a intermediátů, zatímco stabilní molekuly se stávají reaktivními. Navíc v koordinační sféře přechodných kovů mohou probíhat reakce, které jsou u nepřechodných prvků méně obvyklé, nebo neprobíhají vůbec. Formalismus Na rozdíl od uhlíku mají přechodné kovy většinou několik stabilních oxidačních stavů, různé geometrie a koordinační čísla, a to vše má vliv na jejich reaktivitu. Existuje několik formálních pravidel, která umožňují toto velké množství informací logicky uspořádat. Průběh reakcí v koordinační sféře přechodných kovů souvisí s rozložením elektronů v daném komplexu. Pro jeho posouzení je důležitý oxidační stav kovu, počet d-elektronů v daném oxidačním stavu, koordinační číslo a počet volných koordinačních míst kovu. xidační stav se obvykle definuje jako náboj, který zůstane atomu kovu po odebrání všech ligandů i s elektrony, které tvoří vazbu kov-ligand (obr.1). Takto určený oxidační stav není fyzikální vlastnost, kterou by bylo možno měřit. Je to formální veličina, užitečná pro určení počtu elektronů ve valenční sféře kovu. Přitom chemické vlastnosti ligandu nemusí vždy tomuto formalizmu odpovídat. Např. v hydridech přechodných kovů je hydridový ligand vždy považován za -, i když jsou některé hydridy přechodných kovů silné kyseliny. FeCl 2 Ni(C) 4 (Ph 3 P) 2 Pd(C 3 )Cl Co(C) 4 Fe 2() (2) 2Cl (-) Ni (0) 4C Pd 2() (2) 2PPh 3 Cl (-) (-) C 3 Co () 4C (-) (1) br.1: Příklady určování oxidačního stavu
2 2 d-elektronová konfigurace je počet elektronů, který má příslušný přechodný kov v daném oxidačním stavu. Přitom, na rozdíl od volných atomů, považujeme za d-elektrony všechny valenční elektrony. To znamená, že titan má v oxidačním stavu 0 formálně 4d elektrony, v oxidačním stavu 2 2d elektrony a v oxidačním stavu 4 0d elektronů (říkáme, že mají konfiguraci d 4, d 2 případně d 0 ). Celkový počet elektronů v koordinační sféře je pak dán součtem d-elektronů kovu v daném oxidačním stavu a počtu elektronů, kterými do koordinační sféry přispívají ligandy. Přitom koordinační sféra kovu může obsahovat maximálně 18 elektronů. Tato skutečnost je známá jako 18ti elektronové pravidlo. Komplexy, ve kterých je tohoto maximálního počtu elektronů dosaženo, se označují jako koordinačně nasycené. Komplexy, které mají v koordinační sféře méně než 18 elektronů jsou koordinačně nenasycené, mají volná koordinační místa a jsou proto obvykle velmi reaktivní. igandy se koordinují k přechodným kovům svými elektronovými páry. Přitom každý elektronový pár obsadí jedno koordinační místo. Počet takto ligandy dosazených elektronových párů je označován jako koordinační číslo kovu. Pokud se každý ligand komplexuje pouze jedním elektronovým párem (monodentátní ligandy), je koordinační číslo rovno počtu ligandů. Polydentátní ligandy obsadí větší množství koordinačních míst. Typy ligandů brovské množství ligandů, se kterými se v chemii přechodných kovů setkáváme, lze formálně rozdělit do tří skupin. a) Formální anionty. Nejběžnější ligandy tohoto typu jsou: - (alkyl), Ar - (aryl), - (hydrid), C - (acyl), X - (halogen). Ve většině případů fungují tyto ligandy jako donory dvou elektronů a zaujímají jedno koordinační místo nazývají se monohapto ligandy a značí se η 1. Pokud ligand nese další elektronové páry schopné koordinace k přechodnému kovu, mohou se rovněž účastnit komplexace. Allylová skupina (obr.2) může být vázána jedním atomem jako η 1 ligand (donor dvou elektronů) nebo, pokud se koordinace zúčastní i dvojná vazba, váže se všemi třemi atomy uhlíku jako η 3 ligand. V druhém případě dodávává do koordinační sféry kovu čtyři elektrony a zabírá dvě koordinační místa. Přitom je stále považován za formální monoanion. ndex u symbolu η označuje tzv. hapticitu, tj. počet atomů, kterými je ligand vázán k přechodnému kovu.
3 3 M η 1 2e - ( = alkyl, aryl, vinyl) alkyl: M C 3 η 1 2e - aryl: M η 1 2e - vinyl: M η 1 2e - halogenid: M Br η 1 2e - allyl: M η 1 2e - (σ) η 3 4e - (π) M br.2: Způsob vazby některých aniontových ligandů s uvedením hapticity a počtem elektronů kterým přispívají do koordinační sféry přechodného kovu. b) Formálně neutrální ligandy. Do této skupiny patří nejen důležité ligandy jako fosfiny nebo aminy, které se používají k ovlivnění reaktivity kovu, ale i ligandy jako oxid uhelnatý, alkeny, alkyny, dieny a aromáty, které jsou častými substráty při chemických reakcích. fosfin 3 P M η 1 2e - 1,3-dien M η 4 4e - amin karbonyl 3 N M C M η 1 2e - η 1 2e - cyklobutadien M η 4 4e - alken M η 2 2e - aren η 6 6e - M br.3: Některé neutrální ligandy s uvedením hapticity a počtem elektronů kterým přispívají do koordinační sféry přechodného kovu. c) Formální kationty. S těmito ligandy se setkáváme poměrně zřídka. Příkladem je nitrosylová skupina (N ) kation, který je dvouelektronovým donorem.
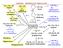
4 4 Výše uvedené principy umožňují určit prakticky u každého komplexu oxidační stav kovu, celkový počet elektronů ve valenční sféře a rozhodnout, zda se jedná o komplex koordinačně nasycený nebo nenasycený. Například komplex h(pph 3 ) 3 Cl (Wilkinsonův hydrogenační katalyzátor) (br. 4) je neutrální sloučenina obsahující jeden formální anion (Cl - ) a tři neutrální ligandy (PPh 3 ), z nichž každý přispívá do koordinační sféry dvěma elektrony. Protože celkově je komplex neutrální a přitom obsahuje jeden záporně nabitý ligand, musí mít rhodium formální náboj 1, tj. oxidační stav je 1 a d-elektronová konfigurace d 8 (h, d 8 ). K celkovému počtu elektronů v koordinační sféře přispívá rhodium osmi elektrony, tři fosfinové ligandy celkem šesti elektrony a chloridový anion dvěma elektrony. Celkem je pak v koordinační sféře 16 elektronů, komplex je tedy koordinačně nenasycený. Ph 3 P PPh 3 h Ph 3 P Cl Cl - 2e -, náboj -1 3 x PPh 3 3 x 2e-, bez náboje (Wilkinsonův hydrogenační katalyzátor) neutrální komplex, jeden ligand s nábojem -1 h, d 8 Celkový počet elektronů: 8 (h ) 6 (3PPh 3 ) 2 (Cl) = 16e - koordinačně nenasycený br.4: xidační stav, počítání elektronů eakce probíhající v koordinační sféře přechodných kovů To co činí komplexy přechodných kovů tak přitažlivé pro organickou syntézu jsou reakce, které probíhají v koordinační sféře přechodných kovů, především oxidativní adice a její opak reduktivní eliminace a také inserce nenasycených molekul, jejímž opakem je v deinserce. S většinou těchto reakcí se v chemii nepřechodných prvků můžeme setkat také, ale pouze vyjímečně. V případě přechodných kovů se jedná o obecné reakce, které probíhají velmi snadno a dají se s výhodou použít k aktivaci organických molekul a k tvorbě nových vazeb uhlík-uhlík a uhlík-heteroatom. Navíc jsou tyto reakce často velmi specifické, což umožňuje rozlišit podobná reakční centra v molekule. Substituce ligandů Tato reakce je nedílnou součástí všech syntetických reakcí, kterých se účastní přechodný kov. Aby taková reakce proběhla, musí totiž nejprve dojít ke koordinaci substrátu
5 5 k přechodnému kovu. Pro katalytický průběh reakce je navíc nutnou podmínkou, aby se produkt vázal ke kovu pouze slabě a v průběhu reakce byl nahrazen další molekulou substrátu. xidativní adice a reduktivní eliminace Tyto reakce jsou základem řady syntetických reakcí a mohou probíhat, protože přechodné kovy mohou existovat v několika různých oxidačních stavech. Názvy oxidativní adice a reduktivní eliminace jsou obecné a označují celý proces bez ohledu na mechanismus, kterých existuje celá řada. Koordinačně nenasycený přechodný kov M, obvykle v nízkém oxidačním stavu (0 nebo 1), a proto elektronově bohatý a nukleofilní, reaguje se substrátem A-B za tvorby nového komplexu A-M-B, ve kterém se kov formálně vmezeřil do vazby A-B. Vzhledem k tomu, že formalismus určování oxidačního stavu přiřazuje vazebné elektrony skupinám A a B, dojde ke zvýšení formálního oxidačního čísla kovu o 2. Tato reakce je známá i z chemie nepřechodných kovů. Příkladem je tvorba Grignardova činidla, např. methylmagnesium jodidu z hořčíku a jodmethanu. M n A B M v nízkém oxidačním stavu (n = 0; 1) oxidativní adice reduktivní eliminace A (n2) M B M se formálně oxiduje C 3 Br Mg (0) oxidativní adice C 3 Mg () Br Na rozdíl od hořčíku, kde k reakci dochází na povrchu kovu, probíhá oxidativní adice komplexů přechodných kovů v homogenní fázi (v roztoku) a proto neobyčejně snadno. Navíc, v případě přechodných kovů je oxidativní adice mnohem obecnější. Substrátů, které se mohou oxidativně adovat, je celá řada. Z pohledu organického chemika jsou nezajímavější: a) polární elektrofily (X 2, X, -X, C()X, S 2 X); b) nepolární molekuly ( 2, 3 Si-, C(), -, Ar-). Z toho je zřejmé, že v mnoha případech přitom dochází ke vzniku vazby kov-vodík a kov-uhlík a tím k aktivaci řady substrátů. Dále je uveden příklad oxidativní adice vodíku na komplex rhodia (Wilkinsonův katalyzátor), která je klíčovým krokem při homogenní katalytické hydrogenaci alkenů na tomto katalyzátoru. Druhá reakce oxidativní adice arylhalogenidu na komplex palladia se uplatní při mnoha užitečných, palladiem katalyzovaných reakcích. Vzhledem k tomu, že palladium v oxidačním stavu 2 preferuje koordinační číslo 4, dochází při reakci k uvolnění dvou molekul trifenylfosfinu.
6 6 (Ph 3 P) 3 h () Cl 2 (Ph 3 P) 3 h () Cl (Ph 3 P) 4 Pd (0) Ph (Ph 3 P) 2 Pd () Ph 2Ph 3 P eduktivní eliminace, opak oxidativní adice, je posledním krokem mnoha katalytických reakcí. Je to hlavní způsob, jak jsou přechodné kovy využívány k tvorbě C-C a C- vazeb v organické syntéze. C=C 2 (Ph 3 P) 2 Pd () Ph Ph C=C 2 (Ph 3 P) 2 Pd (0) nserce a β-eliminace Důležitou reakcí pro organickou syntézu je inserce. Při ní se nenasycený ligand nejčastěji oxid uhelnatý, alken nebo alkyn formálně vmezeří do sousední vazby kov-ligand. Například v případě alkenu, pokud je sousedním ligandem hydrid nebo alkyl, dochází při reakci k tvorbě nové vazby C- nebo C-C a současně vzniká i nová σ-vazba kov-uhlík. značení inserce je poněkud zavádějící, ve skutečnosti dochází k migraci ligandu na sousední nenasycený ligand. Při reakci se uvolní koordinační místo původně obsazené migrujícím ligandem. nserce je obvykle vratnou reakcí, ale přidáním ligandu, který uvolněné koordinační místo obsadí, je možno posunout rovnováhu zcela ve prospěch produktu. X M Y M Y X Y = C, C C, C C,... X =,,... M Y X = volné koordinační místo Z hlediska syntetického využití patří mezi nejdůležitější reakce tohoto typu inserce oxidu uhelnatého a inserce alkenů. nserce oxidu uhelnatého do σ-vazby kov-uhlík je využívána pro přípravu aldehydů ketonů a derivátů karboxylových kyselin. Následující reakce je mezistupněm při průmyslové hydroformylaci propenu. (C) 4 Co C 2 C 2 C 3 (C) 3 Co C C 2 C 2 C 3
7 7 Velmi snadno dochází k inserci alkenů do vazby kov-vodík (klíčový krok při katalytické hydrogenaci alkenů) a σ-vazby kov-uhlík. Zpětná reakce k inserci alkenů do vazby kovuhlík je β-eliminace nejběžnější způsob rozkladu alkylových komplexů přechodných kovů. M "inserce" β-eliminace cis M Následující příklady ukazují inserci propenu do vazby h-, ke které dochází při katalytické hydrogenaci propenu na Wilkinsonově katalyzátoru a vznik styrenu β-eliminací vodíku z 2- fenylethylového ligandu na palladiu. (Ph 3 P) 2 (Cl)h C 2 C C 3 (Ph 3 P) 2 (Cl)h C 2 2 C C3 C 2 (Ph 3 P) 2 ()Pd C (Ph 3 P) 2 (l)pd C2 C Transmetalace Při této reakci dochází k přenosu organické skupiny () na komplex přechodného kovu. Vzniklá organokovová sloučenina je pak obvykle využita v další reakci, která využívá specifické reaktivity přechodných kovů (oxidativní adice, inserce, reduktivní eliminace,...) k tvorbě C-C vazby. M M X M MX M = Zn, Zr, B, Sn, Cu, Si, g,... M = přechodný kov X = halogen,... Transmetalace je dobře známá i u nepřechodných prvků. Transmetalací je například příprava tetramethylsilanu reakcí chloridu křemičitého s methylmagnesium chloridem. Příkladem transmetalace u komplexu přechodného kovu může být reakce zirkonocendichloridu s methyllithiem.
8 8 SiCl 4 4C 3 MgCl Si(C 3 ) 4 4MgCl 2 Zr Cl Cl 2C 3 i Zr C 3 2iCl C 3 Tvorba metalacyklů Zvláštní postavení mezi alkylovými komplexy přechodných kovů mají cyklické sloučeniny, ve kterých je kov součástí cyklu. Většinou jsou stabilnější než odpovídající necyklické organokovové sloučeniny, vznikají specifickými reakcemi a jsou intermediáty některých důležitých reakcí. Nejvýznamnější jsou komplexy se čtyř- a pětičlenným kruhem. Deriváty se čtyřčlenným kruhem - metalacyklobutany (meziprodukty při metathese alkenů) vznikají nejčastěji [22] cykloadicí karbenových komplexů s alkeny. Vzhledem k tomu, že se těchto reakcí zúčastní d-orbitaly, nepatří mezi reakce zakázané z důvodu orbitalové symetrie. n M n M Vratnost této reakce je základem metathesy alkenů, což je reakce při které dochází k výměně alkylidenových skupin mezi alkeny. Katalyzátory metatézy alkenů jsou karbenové komplexy. 1 2 kat Při reakci nejprve dochází reakcí katalyzátoru s jedním reagujícím alkenem ke vzniku metalacyklobutanu. ozštěpením vzniklého metalacyklobutanu se vytvoří alken a nový karbenový komplex. pakování těchto kroků vede postupně k produktům, které neobsahují karbenový ligand katalyzátoru, tj. ke všem produktům uvedeným ve schématu.
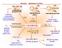
9 9 1 2 n M 1 2 n M 1 2 n M 1 M n M M n n Tato reakce se stala součástí některých chemických výrob a v poslední době se uplatňuje i v organické syntéze. Některé průmyslově důležité katalytické procesy. omogenní katalytická hydrogenace Výhodou homogenních katalyzátorů je jejich vysoká selektivita, mírné reakční podmínky a možnost zavedení chirality do produktu, pokud použijeme chirální ligand. Základem všech homogenně katalyzovaných hydrogenací je vznik hydridu přechodného kovu. K tomu dochází nejčastěji oxidativní adicí 2. Dále je uveden zjednodušený katalytický cyklus pro hydrogenaci Wilkinsonovým katalyzátorem hcl(pph 3 ) 3. Tento katalyzátor je široce využíván pro svojí selektivitu, vysokou účinnost a vysoký počet katalytických cyklů. V přítomnosti tohoto katalyzátoru se hydrogenují nekonjugované alkeny a alkyny a to za atmosferického tlaku a laboratorní teploty. Při reakci dochází nejprve k disociaci jednoho fosfinového ligandu, který je nahrazen molekulou rozpouštědla. Následuje oxidativní adice molekulárního vodíku za vzniku dihydridu a koordinace molekuly alkenu, která je následována insercí alkenu do vazby h-. Vzniklý komplex pak podléhá reduktivní eliminaci za vzniku produktu a katalyzátor se regeneruje.
10 10 substituce ligandu Cl Cl h - S h 2-2 oxidativní adice Cl h S substituce ligandu Cl h reduktivní eliminace Cl S h inserce = Ph 3 P S = rozpouštědlo Vysokou selektivitu je možno demonstrovat na hydrogenaci nitrostyrenu. Přitom se hydrogenuje pouze C=C vazba a nitroskupina zůstává zachována. Při použití heterogenních katalyzátorů se hydrogenuje jak dvojná C=C vazba, tak i nitroskupina na aminoskupinu. N 2 3 hcl 2 N 2 brovský význam mělo zjištění, že zavedení chirálního ligandu do molekuly katalyzátoru vede ke vzniku převážně jednoho enantiomeru produktu (enantioselektivní reakce). dpadá tak pracné dělení racemátu a vzhledem k tomu, že je většinou požadován pouze jeden enantiomer produktu je spotřeba výchozí látky poloviční. Množství chirálních ligandů, které byly využity při různých enantioselektivních reakcích jde do tisíců. Příkladem úspěšných chirálních ligandů je například CAPS (s chirálními centry v uhlíkatém skeletu) a BNAP (axiální chiralita).
11 11 * * PPh 2 PPh 2 PPh 2 PPh 2 CAPS BNAP Prvním velkým úspěchem v této oblasti byla asymetrická hydrogenace methylesteru kyseliny (Z)-α-acetylamidoskořicové, při které vzniká ()-N-acetylfenylalanin (obsah (S)- enantiomeru < 2%). C 2 C 3 Ph NCC 3 2 [(* 2 )hs 2 ] 3 CC 2 * = CAPS, S = rozpouštědlo N C 2 Ph C 2 C 3 () > 98% V tomto případě se jako katalyzátor využívají kationoidní komplexy rhodia typu [h( 2 *)S 2 ], kde 2 * značí chirální bidentátní ligand např. CAPS a S představuje molekulu polárního rozpouštědla např. methanol. Slabě vázané rozpouštědlo je pak v průběhu reakce nahrazeno substrátem. Mechanismus této reakce zahrnuje 1) koordinaci alkenu, 2) oxidativní adici 2, 3) inserci alkenu, 4) reduktivní eliminaci. Při koordinadi skořicanu vzniká nové chirální centrum (na kovu), což spolu s chiralitou ligandu vede ke vzniku dvou diastereoizomerních komplexů. Analýzou směsi bylo zjištěno, že jeden z nich silně převažuje (> 95%). Předpokládalo se proto, že hydrogenací tohoto diastereoizomeru vzniká produkt, který byl při reakci skutečně získán, tedy s konfigurací (). Převažující diastereoizomer se podařilo izolovat, ale analýza ukázala, že se jedná o diastereoizomer z něhož hydrogenací vzniká (S) produkt. Další studium ukázalo, že méně zastoupený diastereoizomer je při oxidativní adici asi 1000x reaktivnější než diastereoizomer, který v reakční směsi převládá. Přitom existuje rychle se ustanovující rovnováha mezi oběma diastereoizomery, která umožňuje převedení převažujícího, méně reaktivního diastereoizomeru na méně zastoupený, ale reaktivnější. Celý mechanismus znázorňuje následující schéma.
12 12 P S h P S Ph 3 C 2 C N C 3 ychlá rovnováha Ph h 1) Koordinace Diastereoizomery Ph h 3 C 2 C N C 3 <5% >95% 3 C N C 2 C 3 2 ychle 2) xidativní adice Stupeň určující reakční rychlost 2 Pomalu Ph Ph 3 C 2 C h N C 3 h N 3 C C 2 C 3 3) nserce S S Ph 3 C 2 C h N C 3 h N 3 C Ph C 2 C 3 4) eduktivní eliminace 3 CC N C 2 Ph C 2 C 3 3 CC N C 2 Ph C 2 C 3 () >98% (S) <98%
13 13 Dalším příkladem využití enantioselektivní hydrogenace je výroba -dopy (Monsanto), která se používá při léčení Parkinsonovy choroby. -dopa C 2 N 2 ydroformylace alkenů V přítomnosti některých komplexů přechodných kovů reagují alkeny se směsí vodíku a oxidu uhelnatého na vzniku aldehydů. Tato reakce se někdy označuje jako hydroformylace, protože při ní formálně dochází k adici formaldehydu na dvojnou vazbu. Průmyslově nejdůležitější je hydroformylace propenu, která s použitím kobaltového nebo rhodiového katalyzátoru poskytuje směs n- a isobutyraldehydu. h nebo Co kat. C 3 -C=C 2 C 2 C 3 C 2 C 2 -C= C 3 CC 3 C= Nejstarším, ale stále používaným katalyzátorem je Co 2 (C) 8. Mechanismus hydroformylace s jeho použitím znázorňuje následující schéma. Vlastním katalyzátorem je Co(C) 4, který vzniká hydrogenolýzou Co 2 (C) 8. Moderní katalyzátory hydroformylace jsou na bázi rhodia, jsou mnohem aktivnější a fungují za mírnějších podmínek než kobaltové katalyzátory. Selektivita těchto katalyzátorů (poměr lineárního a rozvětveného produktu) se ovlivňuje zavedením fosfinových ligandů.
14 14 0 Co 2 (C) Co(C) 4 C - C Co(C) 3 reduktivní eliminace koordinace (C) 3 Co (C) 3 Co 2 oxidativní adice inserce (C) 3 Co (C) 3 Co inserce (C) 4 Co - C C koordinace Alkoxykarbonylace alkenů eakcí alkenů s C v přítomnosti vody, alkoholů nebo aminů vznikají deriváty karboxylových kyselin (karboxylové kyseliny, estery nebo amidy). C 3 -C=C 2 C C 3 h nebo Co kat C atm C 3 C 2 C 2 -C 2 C 3 C 3 CC 3 C 2 C 3 Mechanismus této reakce je podobný mechanismu hydroformylace. ozdíl je v tom, že při karbalkoxylaci je acylový komplex štěpen nukleofilem (vodou, alkoholem nebo aminem), zatímco při hydroformylaci vodíkem. Podobně je možno karbalkoxylovat i alkyny. Acetylen poskytuje podle reakčních podmínek mono- nebo dikarbalkoxyderivát. Tyto reakce se staly základem průmyslové výroby kyseliny akrylové a jantarové.
15 15 0 Co 2 (C) Co(C) 4 C 3 C - C Co(C) 3 C 3 koordinace (C) 4 Co (C) 3 Co C koordinace inserce (C) 3 Co (C) 3 Co inserce (C) 4 Co - C C koordinace C C C 2 Ni(C) 4 2 C=C-C 2 C 180 C, 35 atm 3 C C 2C 2 2 Co 2 (C) C, 170 atm 3 C 2 C C 2 C 3 Karbonylace methanolu (Monsanto process) Karbonylace methanolu na kyselinu octovou je pravděpodobně technologicky nejúspěšnější homogenně katalyzovaná reakce. Je extrémně rychlá, selektivní a poskytuje vysoké výtěžky za poměrně mírných podmínek. Základem je katalytický systém obsahující rhodium a jodidové anionty. Jako prekatalyzátor může být použit prakticky jakýkoliv zdroj rhodia a jodu. Za podmínek reakce z nich vzniká [h(c) 2 2 ] - a methyljodid, který vstupuje
16 16 do katalytického cyklu. Primárním produktem reakce je acetyljodid, který se převádí v závislosti na reakčních podmínkách na methylacetát nebo acetanhydrid reakcí s methanolem nebo kyselinou octovou. Uvolněný jodovodík pak převádí další methanol na methyljodid. a acetanhydrid se zvlášť hydrolyzuje vodou na kyselinu octovou. C 3 C h kat., (-) 180 C, atm C 3 C 2 99% C 3 C [h(c) 2 2 ] (-) C 3 reduktivní eliminace oxidativní adice [C 3 C-h(C) 2 3 ] (-) inserce C [C 3 h(c) 2 3 ] (-) C 3 C C 3 C 2 (C 3 ) C 3 C--CC 3 (C 3 C 2 C 3 ) C 3 C 3 2 Polymerizace alkenů katalyzovaná přechodnými kovy Za objevení těchto reakcí byla Zieglerovi a Nattovi udělena v roce 1983 Nobelova cena za chemii. Katalyticky aktivní centrum na kterém dochází k polymerizaci je alkylový komplex přechodného kovu, při polymerizaci pak dochází k opakované inserci alkenu. Podobně jako při radikálové polymerizaci zahrnuje tato reakce tři základní kroky: a) iniciaci, b) propagaci a c) terminaci.
17 17 n MX (-) ( (-) ) a) iniciace polymer n M n M koordinace β-eliminace n M n M c) terminace inserce b) propagace n M n M inserce n M koordinace k p >> k t... vysokomolekulární polymer k p ~ k t... oligomer kp << kt... dimer Při prvním kroku iniciaci (a) dochází ke vzniku koordinačně nenasyceného alkylového komplexu přechodného kovu n M-, často reakcí halogenidu přechodného kovu s alkylovou sloučeninou nepřechodného kovu (například trialkylhliníkem). Jinou možností je tvorba koordinačně nenasyceného hydridu n M-, ze kterého vznikne katalytické centrum n M- insercí alkenu. Propagace - inserční reakce (b) se skládá ze dvou stupňů: koordinace alkenu a tvorby C-C vazby. Pro koordinaci alkenu je nutné volné koordinační místo, to však samo o sobě nestačí. Aby byla polymerizace efektivní, musí být alken zároveň i dobrým ligandem. Proto jsou polymerizační reakce tohoto typu obvykle omezeny na ethylen a stericky nebráněné alkeny s koncovou dvojnou vazbou. (ethylen > propen > 1-buten). ychlost propagace je důležitým faktorem, který ovlivňuje molekulovou hmotnost polymeru. Pro polymery
18 18 s vysokou molekulovou hmotností jsou typické velmi vysoké reakční rychlosti (až monomerních jednotek na jedno katalytické centrum za sekundu). Nejobvyklejším způsoben terminace (c) je β-eliminace vodíkového atomu. elativní rychlost propagace (k p ) a terminace je určující pro molekulovou hmotnost polymeru. V případě, kdy je k p mnohem větší než k t, je produktem vysokomolekulární polymer, v případě, kdy jsou k p a k t zhruba stejné vznikají nízkomolekulární oligomery a pokud je k t mnohem větší než k p vzniká výlučně dimer. Vznik polymerů s vysokou molekulovou hmotností je typický pro přechodné kovy ze začátku přechodné serie (skupiny V, V a V). Při polymerizaci propenu vzniká chirální centrum. Existují tři typy uspořádání chirálních center v polypropylenu. Všechny představují polymery hlava-ocas, ale liší se relativní orientací chirálních center. sotaktický polypropylen má stejnou absolutní konfiguraci na všech chirálních centrech, v případě syndiotaktického polypropylenu se absolutní konfigurace chirálních center na polymerním řetězci pravidelně střídá, zatímco ataktický polypropylen má náhodné uspořádání chirálních center.výhodou Ziegler- Nattových katalyzátorů je, že umožňují přípravu isotaktického polypropylenu, který má nejlepší technologické vlastnosti a je proto nejžádanější. isotaktický polymer n syndiotaktický polymer n ataktický polymer n ligomerizace alkenů Žádanou surovinou pro výrobu tenzidů jsou 1-alkeny s atomy uhlíku (tzv. α- olefiny). Tyto alkeny se obvykle připravují oligomerizací ethylenu. Z hlediska mechanismu se jedná o podobnou reakci jako je polymerizace alkenů. ozdíl spočívá v tom, že při použití oligomerizačních katalyzátorů probíhá terminační reakce rychleji. Příkladem technického využití oligomerizace ethylenu je Shell igher lefin Process (SP). V tomto případě je reakce katalyzována hydridovým komplexem niklu (nikl má větší tendenci k β-eliminaci než kovy ze začátku přechodného systému). Získá se směs, která obsahuje vedle žádaných alkenů C 10 C 18 i nižší a vyšší oligomery. 2 C C 2 [Ni]- 2 C C(C 2 -C 2 ) n [Ni]- = Ni P Ph 2
19 19 Komerční SP technologie proto zahrnuje další stupně. Destilací se α-alkeny rozdělí na tři frakce C 4 -C 8, C 10 -C 18 (ta se využije jako taková) a > C 18. První a třetí frakce se na heterogenním katalyzátoru izomerizují tak, že se posune dvojná vazba dovnitř řetězce, potom se frakce smísí a podrobí metathese. C 4 - C 8 41% C 10 - C % C % metathesa Mo 3 /Al Výsledkem je směs lineárních alkenů C 10 -C 18 s dvojnou vazbou uvnitř řetězce, která se podrobí hydroformylaci. Použitý katalyzátor současně alkeny izomerizuje na 1-alkeny a aldehydy vzniklé hydroformylací se za podmínek reakce hydrogenují na primární alkoholy C 11 C 19, které se používají např. jako změkčovadla. SP technologie tak převádí relativně laciný ethylen na hodnotné α-alkeny a vyšší primární alkoholy. Co(C) Co(C) C 4 C C CC C 2 C C C/ 2 2 C/ 2 C C 2 C 2 C 2 -C= 2 Co(C) 4 C C 2 ydratace alkenů Wacker process. Koordinace přechodného kovu ve vyšším oxidačním stavu (například Pd ) k alkenu vede ke snížení elektronové hustoty na dvojné vazbě, která pak může reagovat s nukleofily. Nejběžnější z těchto reakcí je palladiem katalyzovaná hydratace alkenů. Z hlediska mechanismu se jedná o obdobu kysele katalyzované hydratace alkenů. Elektrofilem, který aktivuje dvojnou vazbu je v jednom případě Pd, ve druhém. Nukleofilem je v obou případech voda. ozdíl je v tom, že zatímco při kysele katalyzované adici vody je produkt adice (alkohol) stálý, alkylový komplex palladia vzniklý při palladiem katalyzované reakci
20 20 podléhá β-eliminaci. Konečným produktem je proto keton. egioselektivita palladiem katalyzované hydratace je stejná jako při kysele katalyzované reakci (tvoří se nejstabilnější karbokation). Z 1-alkenů tak vznikají methylketony. Kysele katalyzovaná hydratace but-1-enu: C 3 C 2 C C 2 C 3 C 2 C C 2 3 C 3 C 2 C C 3 - butan-2-ol Pd() katalyzovaná hydratace but-1-enu: Pd 2 C 3 C 2 C C 2 Pd 2 C 3 C 2 C C 2 C 3 C 2 C C Pd 2 2 C 3 C 2 C C Pd 2 β-eliminace - Pd C 3 C 2 C C 3 C 3 C 2 C C 2 butan-2-on V případě ethylenu je produktem reakce v přítomnosti chloridu palladnatého acetaldehyd. ydrid palladia, který vznikne při β-eliminaci není stálý, reduktivně eliminuje chlorovodík za vzniku Pd(0). Palladium v oxidačním stavu 0 však není elektrofilem. Proto, aby bylo možno reakci provádět katalyticky, provádí se reakce v přítomnosti katalytického množství chloridu měďnatého, který oxiduje Pd(0) zpět na PdCl 2. Přitom z chloridu měďnatého vzniká chlorid měďný, který se oxiduje zpět na chlorid měďnatý vzdušným kyslíkem (samotné Pd(0) se kyslíkem neoxiduje). Tato reakce, při které se oxiduje ethylen v přítomnosti katalytického množství PdCl 2 a CuCl 2 vzdušným kyslíkem na acetaldehyd je známá jako Wacker process a je základem průmyslové výroby acetaldehydu.
21 2 CuCl C C C PdCl 2 2 C C 2 - Cl 2 C PdCl PdCl 2 β-eliminace Cl Pd(0) Pd Cl C 3 C= Pd Cl
Vlastnosti. Pozor! H 3 C CH 3 H CH 3
 Alkeny Vlastnosti C n 2n obsahují dvojné vazby uhlíky v sp 2 hybridizaci násobná vazba vzniká překryvem 2p orbitalů obou atomů uhlíku nad a pod prostorem obsazeným vazbou aby k překryvu mohlo dojít, musí
Alkeny Vlastnosti C n 2n obsahují dvojné vazby uhlíky v sp 2 hybridizaci násobná vazba vzniká překryvem 2p orbitalů obou atomů uhlíku nad a pod prostorem obsazeným vazbou aby k překryvu mohlo dojít, musí
Alkeny. Alkeny. Největšíprůmyslový význam majíethen (ethylen) a propen (propylen) jako suroviny pro další přeměny nebo pro polymerace
 Alkeny Dvojná vazba je tvořena jednou vazbou sigma a jednou vazbou pí. Dvojná vazba je kratší než vazba jednoduchá a všechny čtyři atomy vázané na dvojnou vazbu leží v jedné rovině. Fyzikální vlastnosti
Alkeny Dvojná vazba je tvořena jednou vazbou sigma a jednou vazbou pí. Dvojná vazba je kratší než vazba jednoduchá a všechny čtyři atomy vázané na dvojnou vazbu leží v jedné rovině. Fyzikální vlastnosti
Obsah. 2. Mechanismus a syntetické využití nejdůležitějších organických reakcí 31 2.1. Adiční reakce 31 2.1.1. Elektrofilní adice (A E
 Obsah 1. Typy reakcí, reakčních komponent a jejich roztřídění 6 1.1. Formální kritérium pro klasifikaci reakcí 6 1.2. Typy reakčních komponent a způsob jejich vzniku jako další kriterium pro klasifikaci
Obsah 1. Typy reakcí, reakčních komponent a jejich roztřídění 6 1.1. Formální kritérium pro klasifikaci reakcí 6 1.2. Typy reakčních komponent a způsob jejich vzniku jako další kriterium pro klasifikaci
Organická chemie (KATA) rychlý souhrn a opakování
 Organická chemie (KATA) rychlý souhrn a opakování Molekulové orbitaly hybridizace N a O Polarita vazby, induktivní efekt U kovalentní vazby mezi rozdílnými atomy, nebude elektronový pár oběma atomy sdílen
Organická chemie (KATA) rychlý souhrn a opakování Molekulové orbitaly hybridizace N a O Polarita vazby, induktivní efekt U kovalentní vazby mezi rozdílnými atomy, nebude elektronový pár oběma atomy sdílen
Úvod do studia organické chemie
 Úvod do studia organické chemie 1828... Wöhler... uměle připravil močovinu Organická chemie - chemie sloučenin uhlíku a vodíku, případně dalších prvků (O, N, X, P, S) Příčiny stability uhlíkových řetězců:
Úvod do studia organické chemie 1828... Wöhler... uměle připravil močovinu Organická chemie - chemie sloučenin uhlíku a vodíku, případně dalších prvků (O, N, X, P, S) Příčiny stability uhlíkových řetězců:
Karbonylové sloučeniny
 Karbonylové sloučeniny více než 120 o 120 o C O C C d + d - C O C sp 2 C sp 2 R C O H R 1 C O R 2 1.aldehydy, ketony Nu E R C O R C O 2. karboxylové kyseliny a funkční deriváty O H 3. deriváty kys. uhličité
Karbonylové sloučeniny více než 120 o 120 o C O C C d + d - C O C sp 2 C sp 2 R C O H R 1 C O R 2 1.aldehydy, ketony Nu E R C O R C O 2. karboxylové kyseliny a funkční deriváty O H 3. deriváty kys. uhličité
H H C C C C C C H CH 3 H C C H H H H H H
 Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Karboxylové kyseliny a jejich funkční deriváty
 Karboxylové kyseliny a jejich funkční deriváty Úvod Karboxylové kyseliny jsou nejdůležitější organické kyseliny. Jejich funkční skupina je karboxylová skupina a tento název je složen ze slov karbonyl a
Karboxylové kyseliny a jejich funkční deriváty Úvod Karboxylové kyseliny jsou nejdůležitější organické kyseliny. Jejich funkční skupina je karboxylová skupina a tento název je složen ze slov karbonyl a
1. ročník Počet hodin
 SOUSTAVY LÁTEK A JEJICH SLOŽENÍ rozdělení přírodních látek a vlastnosti chemických látek soustavy látek a jejich složení STAVBA ATOMU historie pohledu na atom složení a struktura atomu stavba atomu VELIČINY
SOUSTAVY LÁTEK A JEJICH SLOŽENÍ rozdělení přírodních látek a vlastnosti chemických látek soustavy látek a jejich složení STAVBA ATOMU historie pohledu na atom složení a struktura atomu stavba atomu VELIČINY
OCH/OC2. Karbonylové sloučeniny 1
 OCH/OC2 Karbonylové sloučeniny 1 1 Rozdělení Aldehyd Keton Karboxylová kyselina Acylhalogenid Ester Anhydrid Amid Azid Hydrazid Hydroxamová kyselina Lakton Laktam 2 Rozdělení Deriváty kyseliny uhličité
OCH/OC2 Karbonylové sloučeniny 1 1 Rozdělení Aldehyd Keton Karboxylová kyselina Acylhalogenid Ester Anhydrid Amid Azid Hydrazid Hydroxamová kyselina Lakton Laktam 2 Rozdělení Deriváty kyseliny uhličité
Halogenderiváty. Halogenderiváty
 Názvosloví Halogeny jsou v názvu vždy v předponě. Trichlormethan mátriviálnínázev CHLOROFORM Podle připojení halogenu je dělíme na primární sekundární a terciární Br Vazba mezi uhlíkem a halogenem je polarizovaná
Názvosloví Halogeny jsou v názvu vždy v předponě. Trichlormethan mátriviálnínázev CHLOROFORM Podle připojení halogenu je dělíme na primární sekundární a terciární Br Vazba mezi uhlíkem a halogenem je polarizovaná
EU peníze středním školám digitální učební materiál
 EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
Alkyny. C n H 2n-2 (obsahuje jednu trojnou vazbu) uhlíky v sp hybridizaci
 Alkyny C n H 2n-2 (obsahuje jednu trojnou vazbu) uhlíky v sp hybridizaci 1 Klasifikace 2 Alkyny - dvě π vazby; lineární uspořádání Pozor! 3 Vlastnosti -π elektrony jsou méně mobilní než u alkenů H CH 3
Alkyny C n H 2n-2 (obsahuje jednu trojnou vazbu) uhlíky v sp hybridizaci 1 Klasifikace 2 Alkyny - dvě π vazby; lineární uspořádání Pozor! 3 Vlastnosti -π elektrony jsou méně mobilní než u alkenů H CH 3
POUŽITÍ ORGANOSLOUČENIN PŘECHODNÝCH KOVŮ V KATALÝZE
 POUŽITÍ ORGANOSLOUČENIN PŘECHODNÝCH KOVŮ V KATALÝZE Komplexy přechodných kovů jsou v současné době velmi intenzivně využívány při řadě katalytických procesů nejen v chemickém výzkumu, ale i v průmyslové
POUŽITÍ ORGANOSLOUČENIN PŘECHODNÝCH KOVŮ V KATALÝZE Komplexy přechodných kovů jsou v současné době velmi intenzivně využívány při řadě katalytických procesů nejen v chemickém výzkumu, ale i v průmyslové
18. Reakce v organické chemii
 1) homolýza, heterolýza 2) substituce, adice, eliminace, přesmyk 3) popis mechanismů hlavních typů reakcí (S R, A E, A R ) 4) příklady 18. Reakce v organické chemii 1) Homolýza, heterolýza KLASIFIKACE
1) homolýza, heterolýza 2) substituce, adice, eliminace, přesmyk 3) popis mechanismů hlavních typů reakcí (S R, A E, A R ) 4) příklady 18. Reakce v organické chemii 1) Homolýza, heterolýza KLASIFIKACE
Příklady k semináři z organické chemie OCH/SOCHA. Doc. RNDr. Jakub Stýskala, Ph.D.
 Příklady k semináři z organické chemie /SA Doc. RNDr. Jakub Stýskala, Ph.D. Příklady k procvičení 1. Které monochlorované deriváty vzniknou při radikálové chloraci následující sloučeniny. Který z nich
Příklady k semináři z organické chemie /SA Doc. RNDr. Jakub Stýskala, Ph.D. Příklady k procvičení 1. Které monochlorované deriváty vzniknou při radikálové chloraci následující sloučeniny. Který z nich
Pericycklické reakce
 Reakce, v nichž se tvoří nebo zanikají vazby na konci π-systému. Nejedná se o iontový ani radikálový mechanismus, intermediáty nejsou ani kationty ani anionty! Průběh reakce součinným procesem přes cyklický
Reakce, v nichž se tvoří nebo zanikají vazby na konci π-systému. Nejedná se o iontový ani radikálový mechanismus, intermediáty nejsou ani kationty ani anionty! Průběh reakce součinným procesem přes cyklický
Úvod Obecný vzorec alkoholů je R-OH.
 Alkoholy a fenoly Úvod becný vzorec alkoholů je R-. Názvosloví alkoholů a fenolů Běžná jména alkoholů se odvozují od alifatického zbytku připojeného k hydroxylové skupině, ke kterému se přidá slovo alkohol.
Alkoholy a fenoly Úvod becný vzorec alkoholů je R-. Názvosloví alkoholů a fenolů Běžná jména alkoholů se odvozují od alifatického zbytku připojeného k hydroxylové skupině, ke kterému se přidá slovo alkohol.
Polymerizace. Polytransformace
 vznik makromolekuly Polymerizace Polytransformace Podmínky vzniku makromolekuly Podmínky vzniku makromolekuly 1) chemická podmínka Výchozí nízkomolekulární látka(y) musí být z pohledu polymerní reakce
vznik makromolekuly Polymerizace Polytransformace Podmínky vzniku makromolekuly Podmínky vzniku makromolekuly 1) chemická podmínka Výchozí nízkomolekulární látka(y) musí být z pohledu polymerní reakce
Aminy a další dusíkaté deriváty
 Aminy a další dusíkaté deriváty Aminy jsou sloučeniny příbuzné amoniaku, u kterých jsou nahrazeny jeden, dva nebo všechny tři atomy vodíku alkylovými nebo arylovými skupinami. Aminy mají stejně jako amoniak,
Aminy a další dusíkaté deriváty Aminy jsou sloučeniny příbuzné amoniaku, u kterých jsou nahrazeny jeden, dva nebo všechny tři atomy vodíku alkylovými nebo arylovými skupinami. Aminy mají stejně jako amoniak,
Inovace studia molekulární a buněčné biologie
 Investice do rozvoje vzdělávání Inovace studia molekulární a buněčné biologie Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Investice do rozvoje vzdělávání
Investice do rozvoje vzdělávání Inovace studia molekulární a buněčné biologie Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Investice do rozvoje vzdělávání
Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/
 Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 LRR/CHPB2 Chemie pro biology 2 Reakce a reakční mechanismy v organické chemii Lucie Szüčová Osnova: homolytické a heterolytické
Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 LRR/CHPB2 Chemie pro biology 2 Reakce a reakční mechanismy v organické chemii Lucie Szüčová Osnova: homolytické a heterolytické
Reakce aldehydů a ketonů s N-nukleofily
 Reakce aldehydů a ketonů s N-nukleofily bdobně jako aminy se adují na karbonyl i jiné dusíkaté nukleofily: 2,4-dinitrofenylhydrazin aceton 2,4dinitrofenylhydrazon 2,4-dinitrofenylhydrazon acetaldehydu
Reakce aldehydů a ketonů s N-nukleofily bdobně jako aminy se adují na karbonyl i jiné dusíkaté nukleofily: 2,4-dinitrofenylhydrazin aceton 2,4dinitrofenylhydrazon 2,4-dinitrofenylhydrazon acetaldehydu
Základní typy reakcí organokovových sloučenin přechodných kovů. Jiří Pospíšil
 Základní typy reakcí organokovových sloučenin přechodných kovů Jiří Pospíšil Vybrané důležité reakce TS v org.chem 1. CROSS-COUPLING 1. nejčastěji Pd katalyzovaná tvorba C-C a C-X vazby 2. Cu-OS příprava
Základní typy reakcí organokovových sloučenin přechodných kovů Jiří Pospíšil Vybrané důležité reakce TS v org.chem 1. CROSS-COUPLING 1. nejčastěji Pd katalyzovaná tvorba C-C a C-X vazby 2. Cu-OS příprava
2. Polarita vazeb, rezonance, indukční a mezomerní
 32 Polarita vazeb a reaktivita 2. Polarita vazeb, rezonance, indukční a mezomerní efekty ktetové pravidlo je užitečné pro prvky druhé periody (,, ) a halogeny. Formální náboj atomu určíme jako rozdíl počtu
32 Polarita vazeb a reaktivita 2. Polarita vazeb, rezonance, indukční a mezomerní efekty ktetové pravidlo je užitečné pro prvky druhé periody (,, ) a halogeny. Formální náboj atomu určíme jako rozdíl počtu
Platinové kovy. Obecné vlastnosti. Ruthenium a osmium. Jméno: Jana Homolková UČO:
 Platinové kovy Obecné vlastnosti Patří zde prvky druhé a třetí triády 8. skupiny periodického systému. Prvky druhé triády (Ru, Rh, Pd) se nazývají lehké platinové kovy. Prvky třetí triády se nazývají (Os,
Platinové kovy Obecné vlastnosti Patří zde prvky druhé a třetí triády 8. skupiny periodického systému. Prvky druhé triády (Ru, Rh, Pd) se nazývají lehké platinové kovy. Prvky třetí triády se nazývají (Os,
Ethery, thioly a sulfidy
 Ethery, thioly a sulfidy Úvod becný vzorec alkoholů je R--R. Ethery Názvosloví etherů Názvy etherů obsahují jména alkylových a arylových sloučenin ze kterých tvořeny v abecedním pořadí následované slovem
Ethery, thioly a sulfidy Úvod becný vzorec alkoholů je R--R. Ethery Názvosloví etherů Názvy etherů obsahují jména alkylových a arylových sloučenin ze kterých tvořeny v abecedním pořadí následované slovem
1. Jeden elementární záporný náboj 1,602.10-19 C nese částice: a) neutron b) elektron c) proton d) foton
 varianta A řešení (správné odpovědi jsou podtrženy) 1. Jeden elementární záporný náboj 1,602.10-19 C nese částice: a) neutron b) elektron c) proton d) foton 2. Sodný kation Na + vznikne, jestliže atom
varianta A řešení (správné odpovědi jsou podtrženy) 1. Jeden elementární záporný náboj 1,602.10-19 C nese částice: a) neutron b) elektron c) proton d) foton 2. Sodný kation Na + vznikne, jestliže atom
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: Číslo DUMu: VY_32_INOVACE_10_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné
 Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 12.02.2013 Číslo DUMu: VY_32_INOVACE_10_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Obecná
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 12.02.2013 Číslo DUMu: VY_32_INOVACE_10_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Obecná
PŘECHODNÉ KOVY V ORGANICKÉ SYNTÉZE - ZÁKLADNÍ PRINCIPY
 Chem. Listy 91, 216-226 (1997) PŘECHODNÉ KOVY V ORGANICKÉ SYNTÉZE - ZÁKLADNÍ PRINCIPY DALIMIL DVOŘÁK Ústav organické chemie, Vysoká škola chemicko-techno- syntetických postupů využívajících katalytických
Chem. Listy 91, 216-226 (1997) PŘECHODNÉ KOVY V ORGANICKÉ SYNTÉZE - ZÁKLADNÍ PRINCIPY DALIMIL DVOŘÁK Ústav organické chemie, Vysoká škola chemicko-techno- syntetických postupů využívajících katalytických
Aromacké uhlovodíky reakce
 Aromacké uhlovodíky reakce Temacká oblast : Chemie organická chemie Datum vytvoření: 20. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Reakce výroby nesubstuovaných
Aromacké uhlovodíky reakce Temacká oblast : Chemie organická chemie Datum vytvoření: 20. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Reakce výroby nesubstuovaných
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 KARBONYLOVÉ SLOUČENINY = látky, které obsahují karbonylovou skupinu Aldehydy mají skupinu C=O na konci řetězce, aldehydická skupina má potom tvar... Názvosloví aldehydů: V systematickém názvu je zakončení
KARBONYLOVÉ SLOUČENINY = látky, které obsahují karbonylovou skupinu Aldehydy mají skupinu C=O na konci řetězce, aldehydická skupina má potom tvar... Názvosloví aldehydů: V systematickém názvu je zakončení
VLASTNOSTI ALKANŮ 2. RADIKÁLOVÁ SUBSTITUCE 3. ELIMINAČNÍ REAKCE VÝZNAMNÉ ALKANY. Substituční reakce. Sulfochlorace alkanů. Termolýza.
 Kromě CO 2 vznikají i saze roste svítivost Substituční reakce vazby: C C C H jsou nepolární => jsou radikálové S R...radikálová substituce 3 fáze... VLASTNOSTI ALKANŮ tady něco chybí... 2. RADIKÁLOVÁ SUBSTITUCE
Kromě CO 2 vznikají i saze roste svítivost Substituční reakce vazby: C C C H jsou nepolární => jsou radikálové S R...radikálová substituce 3 fáze... VLASTNOSTI ALKANŮ tady něco chybí... 2. RADIKÁLOVÁ SUBSTITUCE
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 16, 566 01 Vysoké Mýto Alkeny Vlastnosti dvojné vazby Hybridizace uhlíku vázaného dvojnou vazbou je sp. Valenční úhel který svírají vazby na uhlíkovém atomu je přibližně
Gymnázium Vysoké Mýto nám. Vaňorného 16, 566 01 Vysoké Mýto Alkeny Vlastnosti dvojné vazby Hybridizace uhlíku vázaného dvojnou vazbou je sp. Valenční úhel který svírají vazby na uhlíkovém atomu je přibližně
HALOGENDERIVÁTY UHLOVODÍKŮ
 HALOGENDERIVÁTY UHLOVODÍKŮ R X, Ar - X Obsahují ve svých molekulách vazbu uhlík-halogen (C-X) -I > +M Například : chlormethan, methylchlorid trichlormethan, chloroform trijodmethan, jodoform chlorid uhličitý,
HALOGENDERIVÁTY UHLOVODÍKŮ R X, Ar - X Obsahují ve svých molekulách vazbu uhlík-halogen (C-X) -I > +M Například : chlormethan, methylchlorid trichlormethan, chloroform trijodmethan, jodoform chlorid uhličitý,
ORGANICKÁ CHEMIE I pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Vyučující na semináři...
 ORGANICKÁ CEMIE I pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Vyučující na semináři... Počet bodů v části A:... Počet bodů v části B:... Počet bodů celkem:...
ORGANICKÁ CEMIE I pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Vyučující na semináři... Počet bodů v části A:... Počet bodů v části B:... Počet bodů celkem:...
Karboxylové kyseliny
 Karboxylové kyseliny Názvosloví pokud je karboxylováskupina součástířetězce, sloučenina mákoncovku -ovákyselina. Pokud je mimo řetězec má sloučenina koncovku karboxylová kyselina. butanová kyselina cyklohexankarboxylová
Karboxylové kyseliny Názvosloví pokud je karboxylováskupina součástířetězce, sloučenina mákoncovku -ovákyselina. Pokud je mimo řetězec má sloučenina koncovku karboxylová kyselina. butanová kyselina cyklohexankarboxylová
Organická chemie pro biochemiky II část 14 14-1
 rganická chemie pro biochemiky II část 14 14-1 oxidace a redukce mají v organické chemii trochu jiný charakter než v chemii anorganické obvykle u jde o adici na systém s dvojnou vazbou či štěpení vazby
rganická chemie pro biochemiky II část 14 14-1 oxidace a redukce mají v organické chemii trochu jiný charakter než v chemii anorganické obvykle u jde o adici na systém s dvojnou vazbou či štěpení vazby
Charakteristika Teorie kyselin a zásad. Příprava kyselin Vlastnosti + typické reakce. Významné kyseliny. Arrheniova teorie Teorie Brönsted-Lowryho
 Petra Ustohalová 1 harakteristika Teorie kyselin a zásad Arrheniova teorie Teorie Brönsted-Lowryho Příprava kyselin Vlastnosti + typické reakce Fyzikální a chemické Významné kyseliny 2 Látky, které ve
Petra Ustohalová 1 harakteristika Teorie kyselin a zásad Arrheniova teorie Teorie Brönsted-Lowryho Příprava kyselin Vlastnosti + typické reakce Fyzikální a chemické Významné kyseliny 2 Látky, které ve
Bc. Miroslava Wilczková
 KOMPLEXNÍ SLOUČENINY Bc. Miroslava Wilczková Komplexní sloučeniny Začal studovat Alfred Werner. Na základě získaných chemických a fyzikálních vlastností objasnil základní rysy jejich vnitřní struktury,
KOMPLEXNÍ SLOUČENINY Bc. Miroslava Wilczková Komplexní sloučeniny Začal studovat Alfred Werner. Na základě získaných chemických a fyzikálních vlastností objasnil základní rysy jejich vnitřní struktury,
Stereochemie 7. Přednáška 7
 Stereochemie 7 Přednáška 7 1 ptická čistota p = [ ]poz [ ]max x 100 = ee = [R] - [S] [R] + [S] x 100 p optická čistota [R], [S] molární frakce R a S enantiomerů ee + 100 %R = ee + %S = ee + 100 - %R =
Stereochemie 7 Přednáška 7 1 ptická čistota p = [ ]poz [ ]max x 100 = ee = [R] - [S] [R] + [S] x 100 p optická čistota [R], [S] molární frakce R a S enantiomerů ee + 100 %R = ee + %S = ee + 100 - %R =
Chemie. Mgr. Petra Drápelová Mgr. Jaroslava Vrbková. Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou
 Chemie Mgr. Petra Drápelová Mgr. Jaroslava Vrbková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou CHEMICKÁ VAZBA VY_32_INOVACE_03_3_07_CH Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou CHEMICKÁ VAZBA Volné atomy v přírodě
Chemie Mgr. Petra Drápelová Mgr. Jaroslava Vrbková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou CHEMICKÁ VAZBA VY_32_INOVACE_03_3_07_CH Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou CHEMICKÁ VAZBA Volné atomy v přírodě
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 ORGANIKÁ EMIE = chemie sloučenin látek obsahujících vazby Organické látky = všechny uhlíkaté sloučeniny kromě..., metal... and metal... Zdroje organických sloučenin = živé organismy nebo jejich fosílie:
ORGANIKÁ EMIE = chemie sloučenin látek obsahujících vazby Organické látky = všechny uhlíkaté sloučeniny kromě..., metal... and metal... Zdroje organických sloučenin = živé organismy nebo jejich fosílie:
PÍSEMNÁ ČÁST PŘIJÍMACÍ ZKOUŠKY Z CHEMIE bakalářský studijní obor Bioorganická chemie 2011
 Kód uchazeče:... Datum:... PÍSEMNÁ ČÁST PŘIJÍMACÍ ZKUŠKY Z CHEMIE bakalářský studijní obor Bioorganická chemie 2011 30 otázek maximum: 60 bodů čas: 60 minut 1. Napište názvy anorganických sloučenin: (4
Kód uchazeče:... Datum:... PÍSEMNÁ ČÁST PŘIJÍMACÍ ZKUŠKY Z CHEMIE bakalářský studijní obor Bioorganická chemie 2011 30 otázek maximum: 60 bodů čas: 60 minut 1. Napište názvy anorganických sloučenin: (4
Reaktivita karboxylové funkce
 eaktivita karboxylové funkce - M efekt, - I efekt - I efekt < + M efekt - I efekt kyslíku eaktivita: 1) itlivost na působení bází - tvorba solí karboxylových kyselin (také většina nukleofilů zde působí
eaktivita karboxylové funkce - M efekt, - I efekt - I efekt < + M efekt - I efekt kyslíku eaktivita: 1) itlivost na působení bází - tvorba solí karboxylových kyselin (také většina nukleofilů zde působí
Opakování
 Slabé vazebné interakce Opakování Co je to atom? Opakování Opakování Co je to atom? Atom je nejmenší částice hmoty, chemicky dále nedělitelná. Skládá se z atomového jádra obsahujícího protony a neutrony
Slabé vazebné interakce Opakování Co je to atom? Opakování Opakování Co je to atom? Atom je nejmenší částice hmoty, chemicky dále nedělitelná. Skládá se z atomového jádra obsahujícího protony a neutrony
Řešené příklady k procvičení
 Řešené příklady k procvičení 1. Nakreslete strukturní vzorce všech následujících látek a označte, které jsou chirální nebo jsou mezosloučeninami. cischlorcyklohexanol transchlorcyklohexanol cischlorcyklohexanol
Řešené příklady k procvičení 1. Nakreslete strukturní vzorce všech následujících látek a označte, které jsou chirální nebo jsou mezosloučeninami. cischlorcyklohexanol transchlorcyklohexanol cischlorcyklohexanol
Izomerie Reakce organických sloučenin Názvosloví organické chemie. Tomáš Hauer 2.LF UK
 Izomerie Reakce organických sloučenin Názvosloví organické chemie Tomáš Hauer 2.LF UK Izomerie Izomerie izomerní sloučeniny stejný sumární vzorec, různá struktura prostorové uspořádání = izomery různé
Izomerie Reakce organických sloučenin Názvosloví organické chemie Tomáš Hauer 2.LF UK Izomerie Izomerie izomerní sloučeniny stejný sumární vzorec, různá struktura prostorové uspořádání = izomery různé
Škola: Gymnázium, Brno, Slovanské náměstí 7 III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
5. CHEMICKÉ REAKCE. KLASIFIKACE CHEMICKÝCH REAKCÍ a) Podle vnějších změn Reakce skládání = SYNTÉZY z jednodušších -> složitější 2H 2 + O 2 -> 2H 2 O
 Na www.studijni-svet.cz zaslal(a): Kikusska94 5. CHEMICKÉ REAKCE Je děj při kterém v molekulách reagujících látek dochází k zániku některých vazeb a ke vzniku vazeb nových. Produkty rekce mají jiné chemické
Na www.studijni-svet.cz zaslal(a): Kikusska94 5. CHEMICKÉ REAKCE Je děj při kterém v molekulách reagujících látek dochází k zániku některých vazeb a ke vzniku vazeb nových. Produkty rekce mají jiné chemické
Reakce alkanů 75. mechanismem), iniciované světlem nebo radikálovými iniciátory: Oxidace kyslíkem, hoření, tvorba hydroperoxidů.
 eakce alkanů 75 5. eakce alkanů Alkany poskytují především radikálové reakce (často probíhající řetězovým mechanismem), iniciované světlem nebo radikálovými iniciátory: alogenace pomocí X 2 ; bromaci lze
eakce alkanů 75 5. eakce alkanů Alkany poskytují především radikálové reakce (často probíhající řetězovým mechanismem), iniciované světlem nebo radikálovými iniciátory: alogenace pomocí X 2 ; bromaci lze
Vysoká škola chemicko-technologická v Praze. Ústav organické technologie. Václav Matoušek
 Vysoká škola chemicko-technologická v Praze Ústav organické technologie VŠCHT PRAHA SVOČ 2005 Václav Matoušek Školitel : Ing. Petr Kačer, PhD. Prof. Ing. Libor Červený, DrSc. Proč asymetrická hydrogenace?
Vysoká škola chemicko-technologická v Praze Ústav organické technologie VŠCHT PRAHA SVOČ 2005 Václav Matoušek Školitel : Ing. Petr Kačer, PhD. Prof. Ing. Libor Červený, DrSc. Proč asymetrická hydrogenace?
1.1.2 VLASTNOSTI HALOGENDERIVÁTŮ, U KTERÝCH NENÍ HALOGEN VÁZÁN NA AROMATICKÉM JÁDŘE
 .. VLASTSTI ALGEDEIVÁTŮ, U KTEÝ EÍ ALGE VÁZÁ A AMATIKÉM JÁDŘE... Fyzikální vlastnosti Těkavost odpovídá molekulové hmotnosti. Kapalné halogenderiváty jsou aprotickými rozpouštědly polárnějšími než uhlovodíky....
.. VLASTSTI ALGEDEIVÁTŮ, U KTEÝ EÍ ALGE VÁZÁ A AMATIKÉM JÁDŘE... Fyzikální vlastnosti Těkavost odpovídá molekulové hmotnosti. Kapalné halogenderiváty jsou aprotickými rozpouštědly polárnějšími než uhlovodíky....
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto FUNKČNÍ DEIVÁTY KABXYLVÝH KYSELIN X KABXYLVÉ KYSELINY funkční deriváty + H reakce na vazbě vodík kyslík hydroxylové skupiny reakce probíhající
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto FUNKČNÍ DEIVÁTY KABXYLVÝH KYSELIN X KABXYLVÉ KYSELINY funkční deriváty + H reakce na vazbě vodík kyslík hydroxylové skupiny reakce probíhající
Škola: Gymnázium, Brno, Slovanské náměstí 7 III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 VY_32_INOVACE_C.3.01 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT
VY_32_INOVACE_C.3.01 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT
Škola: Gymnázium, Brno, Slovanské náměstí 7 III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Chemie organokovových sloučenin mezi organickou a anorganickou chemií
 Chemie organokovových sloučenin mezi organickou a anorganickou chemií Jiří Pospíšil j.pospisil@upol.cz pospisil@orgchem.upol.cz http://www.thepospisilresearchgroup.cz/prednasky/ Na úvod Hodnotící metody
Chemie organokovových sloučenin mezi organickou a anorganickou chemií Jiří Pospíšil j.pospisil@upol.cz pospisil@orgchem.upol.cz http://www.thepospisilresearchgroup.cz/prednasky/ Na úvod Hodnotící metody
1.1.2. ALKENY C n H 2n
 1.1.. ALKEY n n 1.1..1. Příprava 1 3 4 I) Z látek se stejným počtem atomů především eliminační reakce 1) Transeliminace v tranzitním stavu jsou eliminující skupiny v antiperiplanární konformaci a) Dehydrohalogenace
1.1.. ALKEY n n 1.1..1. Příprava 1 3 4 I) Z látek se stejným počtem atomů především eliminační reakce 1) Transeliminace v tranzitním stavu jsou eliminující skupiny v antiperiplanární konformaci a) Dehydrohalogenace
Radikály jsou zároveň velmi reaktivní - stabilních radikálů, které lze izolovat a skladovat, není příliš mnoho.
 Radikálové reakce se odlišují od reakcí, se kterými jsme se dosud setkali. Při zápisu mechanismů nebudeme přesunovat elektronové páry, ale pouze jeden elektron. To se mimojiné projeví na způsobu, jak takové
Radikálové reakce se odlišují od reakcí, se kterými jsme se dosud setkali. Při zápisu mechanismů nebudeme přesunovat elektronové páry, ale pouze jeden elektron. To se mimojiné projeví na způsobu, jak takové
Substituce na aromatickém jádře S E Ar, S N Ar. Elektrofilní aromatická substituce S E Ar
 Substituce na aromatickém jádře S E Ar, S N Ar Už jsme viděli příklady benzenových jader, které jsou substituované ruznými skupinami, např. halogeny, hydroxy skupinou apod. Ukážeme si tedy, jak se tyto
Substituce na aromatickém jádře S E Ar, S N Ar Už jsme viděli příklady benzenových jader, které jsou substituované ruznými skupinami, např. halogeny, hydroxy skupinou apod. Ukážeme si tedy, jak se tyto
Substituční deriváty karboxylových kyselin
 Substituční deriváty karboxylových kyselin Vznikají substitucemi v, ke změnám v karboxylové funkční skupině. Poloha nové skupiny se často ve spojení s triviálními názvy označuje řeckými písmeny: Mají vlastnosti
Substituční deriváty karboxylových kyselin Vznikají substitucemi v, ke změnám v karboxylové funkční skupině. Poloha nové skupiny se často ve spojení s triviálními názvy označuje řeckými písmeny: Mají vlastnosti
Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np:
 PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
UHLOVODÍKY ALKANY (...)
 UHLOVODÍKY ALKANY (...) alifatické nasycené uhlovodíky nerozvětvené i rozvětvené mezi atomy uhlíku pouze jednoduché vazby (σ vazby), mezi nimi úhel 109 28 název: kmen + an obecný vzorec C n H 2n + 2 tvoří
UHLOVODÍKY ALKANY (...) alifatické nasycené uhlovodíky nerozvětvené i rozvětvené mezi atomy uhlíku pouze jednoduché vazby (σ vazby), mezi nimi úhel 109 28 název: kmen + an obecný vzorec C n H 2n + 2 tvoří
Reakce v organické chemii
 Reakce v organické chemii Temacká oblast : Chemie organická chemie Datum vytvoření: 25. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Základní typy reakcí organických
Reakce v organické chemii Temacká oblast : Chemie organická chemie Datum vytvoření: 25. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Základní typy reakcí organických
OCH/OC2. Heterocyklické sloučeniny
 CH/C2 Heterocyklické sloučeniny 1 ázvosloví 5-ti členné heterocykly 6-ti členné heterocykly 2 ázvosloví earomatické (nasycené) heterocykly. 3 Aromaticita heterocyklů 4 Aromaticita heterocyklů 5 Rezonanční
CH/C2 Heterocyklické sloučeniny 1 ázvosloví 5-ti členné heterocykly 6-ti členné heterocykly 2 ázvosloví earomatické (nasycené) heterocykly. 3 Aromaticita heterocyklů 4 Aromaticita heterocyklů 5 Rezonanční
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace
 Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch
 Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch Atom, složení a struktura Chemické prvky-názvosloví, slučivost Chemické sloučeniny, molekuly Chemická vazba
Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch Atom, složení a struktura Chemické prvky-názvosloví, slučivost Chemické sloučeniny, molekuly Chemická vazba
ALKENY NENASYCENÉ UHLOVODÍKY
 ALKENY NENASYCENÉ ULOVODÍKY 1 ALKENY - mají ve svých molekulách alespoň jednu dvojnou vazbu- C=C homologický vzorec : C n 2n názvy od alkanů zakončeny koncovkou en CYKLOALKENY - homologický vzorec : C
ALKENY NENASYCENÉ ULOVODÍKY 1 ALKENY - mají ve svých molekulách alespoň jednu dvojnou vazbu- C=C homologický vzorec : C n 2n názvy od alkanů zakončeny koncovkou en CYKLOALKENY - homologický vzorec : C
Podmínky vzniku makromolekuly
 Podmínky vzniku makromolekuly Vznik makromolekuly Podmínky vzniku makromolekuly 1) chemická podmínka Výchozí nízkomolekulární látka(y) musí být z pohledu polymerní reakce nejméně dvoufunkční 2) termodynamická
Podmínky vzniku makromolekuly Vznik makromolekuly Podmínky vzniku makromolekuly 1) chemická podmínka Výchozí nízkomolekulární látka(y) musí být z pohledu polymerní reakce nejméně dvoufunkční 2) termodynamická
Obsah Chemická reakce... 2 PL:
 Obsah Chemická reakce... 2 PL: Vyčíslení chemické rovnice - řešení... 3 Tepelný průběh chemické reakce... 4 Rychlost chemických reakcí... 4 Rozdělení chemických reakcí... 4 1 Chemická reakce děj, při němž
Obsah Chemická reakce... 2 PL: Vyčíslení chemické rovnice - řešení... 3 Tepelný průběh chemické reakce... 4 Rychlost chemických reakcí... 4 Rozdělení chemických reakcí... 4 1 Chemická reakce děj, při němž
nano.tul.cz Inovace a rozvoj studia nanomateriálů na TUL
 Inovace a rozvoj studia nanomateriálů na TUL nano.tul.cz Tyto materiály byly vytvořeny v rámci projektu ESF OP VK: Inovace a rozvoj studia nanomateriálů natechnické univerzitě vliberci Kde jsme aminy již
Inovace a rozvoj studia nanomateriálů na TUL nano.tul.cz Tyto materiály byly vytvořeny v rámci projektu ESF OP VK: Inovace a rozvoj studia nanomateriálů natechnické univerzitě vliberci Kde jsme aminy již
OPVK CZ.1.07/2.2.00/
 OPVK CZ.1.07/2.2.00/28.0184 Základní principy vývoje nových léčiv OCH/ZPVNL Mgr. Radim Nencka, Ph.D. ZS 2012/2013 Molekulární interakce SAR Možné interakce jednotlivých funkčních skupin 1. Interakce alkoholů
OPVK CZ.1.07/2.2.00/28.0184 Základní principy vývoje nových léčiv OCH/ZPVNL Mgr. Radim Nencka, Ph.D. ZS 2012/2013 Molekulární interakce SAR Možné interakce jednotlivých funkčních skupin 1. Interakce alkoholů
Inovace profesní přípravy budoucích učitelů chemie
 Inovace profesní přípravy budoucích učitelů chemie I n v e s t i c e d o r o z v o j e v z d ě l á v á n í CZ.1.07/2.2.00/15.0324 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem
Inovace profesní přípravy budoucích učitelů chemie I n v e s t i c e d o r o z v o j e v z d ě l á v á n í CZ.1.07/2.2.00/15.0324 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem
OCH/OC2. Karbonylové sloučeniny 2
 OCH/OC2 Karbonylové sloučeniny 2 1 Reaktivita karbonylových sloučenin Nukleofilní adice na karbonylovou skupinu A N vody vznik hydrátů A N alkoholů tvorba acetalů a ketalů A N HCN vznik kyanhydrinů A N
OCH/OC2 Karbonylové sloučeniny 2 1 Reaktivita karbonylových sloučenin Nukleofilní adice na karbonylovou skupinu A N vody vznik hydrátů A N alkoholů tvorba acetalů a ketalů A N HCN vznik kyanhydrinů A N
Struktura organických sloučenin
 Struktura organických sloučenin Vzorce: Empirický (stechiometrický) druh atomů a jejich poměrné zastoupení v molekule Sumární(molekulový) druh a počet atomů v molekule Strukturní které atomy jsou spojeny
Struktura organických sloučenin Vzorce: Empirický (stechiometrický) druh atomů a jejich poměrné zastoupení v molekule Sumární(molekulový) druh a počet atomů v molekule Strukturní které atomy jsou spojeny
Hydroxysloučeniny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Únor
 Hydroxysloučeniny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Únor 2011 Mgr. Alena Jirčáková Hydroxysloučeniny Dělení hydroxysloučenin: Deriváty
Hydroxysloučeniny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Únor 2011 Mgr. Alena Jirčáková Hydroxysloučeniny Dělení hydroxysloučenin: Deriváty
Studijní materiál k organickým úlohám 55. ročníku ChO kat. A
 Studijní materiál k organickým úlohám 55. ročníku Ch kat. A Jaromír Literák (literak@chemi.muni.cz) V úlohách letošního ročníku se budete potkávat především s reakcemi karbonylových sloučenin a aminů.
Studijní materiál k organickým úlohám 55. ročníku Ch kat. A Jaromír Literák (literak@chemi.muni.cz) V úlohách letošního ročníku se budete potkávat především s reakcemi karbonylových sloučenin a aminů.
16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší?
 16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší? 4) Urči typy konstituční izomerie. 5) Co je tautomerie
16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší? 4) Urči typy konstituční izomerie. 5) Co je tautomerie
ETHYLEN - PRŮMYSLOVÉ ZPRACOVÁNÍ
 H ethanol CH= acetaldehyd CH octová kys. C CH= vinylacetát ETHYLE - PRŮMYSLVÉ ZPRACVÁÍ oxiran (ethylenoxid) ~ 10 % + 2 ~ 20 % -H 2 + KYS. KATAL. ETHE CH= styren (-CH- -) n Ph polystyren PS a jeho kopolymery
H ethanol CH= acetaldehyd CH octová kys. C CH= vinylacetát ETHYLE - PRŮMYSLVÉ ZPRACVÁÍ oxiran (ethylenoxid) ~ 10 % + 2 ~ 20 % -H 2 + KYS. KATAL. ETHE CH= styren (-CH- -) n Ph polystyren PS a jeho kopolymery
TEST + ŘEŠENÍ. PÍSEMNÁ ČÁST PŘIJÍMACÍ ZKOUŠKY Z CHEMIE bakalářský studijní obor Bioorganická chemie 2010
 30 otázek maximum: 60 bodů TEST + ŘEŠEÍ PÍSEMÁ ČÁST PŘIJÍMACÍ ZKUŠKY Z CEMIE bakalářský studijní obor Bioorganická chemie 2010 1. apište názvy anorganických sloučenin: (4 body) 4 BaCr 4 kyselina peroxodusičná
30 otázek maximum: 60 bodů TEST + ŘEŠEÍ PÍSEMÁ ČÁST PŘIJÍMACÍ ZKUŠKY Z CEMIE bakalářský studijní obor Bioorganická chemie 2010 1. apište názvy anorganických sloučenin: (4 body) 4 BaCr 4 kyselina peroxodusičná
Chemie NÁRODNÍ SROVNÁVACÍ ZKOUŠKY BŘEZNA 2017
 NÁRODNÍ SROVNÁVACÍ ZKOUŠKY Chemie T BŘEZNA 2017 D : 4. BŘEZNA 2017 : 212 : 30 M. M. : 29,0 : 26,7 M. : 8,8 % S : -9,7 M. : -4,3 : 14,7 Zopakujte si základní informace ke zkoušce: n Test obsahuje 30 úloh.
NÁRODNÍ SROVNÁVACÍ ZKOUŠKY Chemie T BŘEZNA 2017 D : 4. BŘEZNA 2017 : 212 : 30 M. M. : 29,0 : 26,7 M. : 8,8 % S : -9,7 M. : -4,3 : 14,7 Zopakujte si základní informace ke zkoušce: n Test obsahuje 30 úloh.
7. Pericyklické reakce
 Pericyklické reakce 103 7. Pericyklické reakce Součinné reakce probíhající přes cyklický transitní stav, ve kterém dochází k cyklickému uspořádání atomů a interagujících molekul. Průběh reakce je určován
Pericyklické reakce 103 7. Pericyklické reakce Součinné reakce probíhající přes cyklický transitní stav, ve kterém dochází k cyklickému uspořádání atomů a interagujících molekul. Průběh reakce je určován
Organická chemie II. Aldehydy a ketony II. Zdeněk Friedl. Kapitola 20. Solomons & Fryhle: Organic Chemistry 8th Ed., Wiley 2004
 Organická chemie II Zdeněk Friedl Kapitola 20 Aldehydy a ketony II Solomons & Fryhle: Organic Chemistry 8th Ed., Wiley 2004 Aldolové reakce karbonylových sloučenin RS aldehydů a ketonů kyselost α-vodíkových
Organická chemie II Zdeněk Friedl Kapitola 20 Aldehydy a ketony II Solomons & Fryhle: Organic Chemistry 8th Ed., Wiley 2004 Aldolové reakce karbonylových sloučenin RS aldehydů a ketonů kyselost α-vodíkových
Rozdělení uhlovodíků
 Rozdělení uhlovodíků 1/8 Alkany a cykloalkany Obecné vzorce: alkany C n H 2n+2, cykloalkany C n H 2n, kde n je přirozené číslo Homologický přírustek: - CH 2 - Alkany přímé ( n - alkany) rozvětvené Primární,
Rozdělení uhlovodíků 1/8 Alkany a cykloalkany Obecné vzorce: alkany C n H 2n+2, cykloalkany C n H 2n, kde n je přirozené číslo Homologický přírustek: - CH 2 - Alkany přímé ( n - alkany) rozvětvené Primární,
Autor: Tomáš Galbička Téma: Alkany a cykloalkany Ročník: 2.
 Alkany uhlovodíky s otevřeným řetězcem a pouze jednoduchými vazbami vazby sigma, největší výskyt elektronů na spojnici jader v názvu mají koncovku an Cykloalkany uhlovodíky s uzavřeným řetězcem a pouze
Alkany uhlovodíky s otevřeným řetězcem a pouze jednoduchými vazbami vazby sigma, největší výskyt elektronů na spojnici jader v názvu mají koncovku an Cykloalkany uhlovodíky s uzavřeným řetězcem a pouze
AROMATICKÉ SLOUČENINY - REAKTIVITA TYPICKÉ REAKCE AROMATICKÝCH SLOUČENIN - SUBSTITUCE ELEKTROFILNÍ AROMATICKÁ
 TYPICKÉ EAKCE AMATICKÝC SLUČENIN - SUBSTITUCE ELEKTFILNÍ AMATICKÁ + E E E - E mechanismus substituce elekrofilní aromatické komplex komplex produkt SE Ar E reakční koordináta C 3 + BF 4 3 C C 3 3 C aromatické
TYPICKÉ EAKCE AMATICKÝC SLUČENIN - SUBSTITUCE ELEKTFILNÍ AMATICKÁ + E E E - E mechanismus substituce elekrofilní aromatické komplex komplex produkt SE Ar E reakční koordináta C 3 + BF 4 3 C C 3 3 C aromatické
16.UHLOVODÍKY A IZOMERIE ORGANICKÝCH SLOUČENIN IZOMERIE:
 16.UHLOVODÍKY A IZOMERIE ORGANICKÝCH SLOUČENIN IZOMERIE: 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem se liší? 4) Vyber správné
16.UHLOVODÍKY A IZOMERIE ORGANICKÝCH SLOUČENIN IZOMERIE: 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem se liší? 4) Vyber správné
ZÁKLADY KOORDINAČNÍ CHEMIE
 ZÁKLADY KOORDINAČNÍ CHEMIE Vznik komplexu: vazba se uskutečňuje donor-akceptorovým způsobem (z hlediska Lewisovy teorie kyselin a zásad jde o acidobazickou reakci) P 5 + P 6 P + P ligandy centrální atom
ZÁKLADY KOORDINAČNÍ CHEMIE Vznik komplexu: vazba se uskutečňuje donor-akceptorovým způsobem (z hlediska Lewisovy teorie kyselin a zásad jde o acidobazickou reakci) P 5 + P 6 P + P ligandy centrální atom
ORGANICKÁ CHEMIE I pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Zápočet udělil(a)...
 RGANICKÁ CHEMIE I pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Zápočet udělil(a)... Počet bodů v části A:... Počet bodů v části B:... Počet bodů celkem:...
RGANICKÁ CHEMIE I pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Zápočet udělil(a)... Počet bodů v části A:... Počet bodů v části B:... Počet bodů celkem:...
PROPEN - PŘEHLED VYUŽITÍ
 PRPEN - PŘEHLED VYUŽITÍ polymery propandioly propylenkarbonát isopropanolaminy C 4 aldehydy alkoholy kyseliny jejich estery CH methyloxiran (propylenoxid) hydroformylace hydrokarbonylace + 2 isopropylbenzen
PRPEN - PŘEHLED VYUŽITÍ polymery propandioly propylenkarbonát isopropanolaminy C 4 aldehydy alkoholy kyseliny jejich estery CH methyloxiran (propylenoxid) hydroformylace hydrokarbonylace + 2 isopropylbenzen
Kyslíkaté deriváty. 1) Hydroxyderiváty: a) Alkoholy b) Fenoly. řešení. Dle OH = hydroxylová skupina
 Kyslíkaté deriváty řešení 1) Hydroxyderiváty: a) Alkoholy b) Fenoly Dle = hydroxylová skupina 1 Hydroxyderiváty Alifatické alkoholy: náhrada 1 nebo více atomů H. hydroxylovou skupinou (na 1 atom C vázaná
Kyslíkaté deriváty řešení 1) Hydroxyderiváty: a) Alkoholy b) Fenoly Dle = hydroxylová skupina 1 Hydroxyderiváty Alifatické alkoholy: náhrada 1 nebo více atomů H. hydroxylovou skupinou (na 1 atom C vázaná
VY_32_INOVACE_29_HBENO5
 Alkany reakce Temacká oblast : Chemie organická chemie Datum vytvoření: 15. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Výroba alkanů. Reakvita alkanů, důležité
Alkany reakce Temacká oblast : Chemie organická chemie Datum vytvoření: 15. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Výroba alkanů. Reakvita alkanů, důležité
Základní chemické pojmy
 MZ CHEMIE 2015 MO 1 Základní chemické pojmy Atom, molekula, prvek, protonové číslo. Sloučenina, chemicky čistá látka, směs, dělení směsí. Relativní atomová hmotnost, molekulová hmotnost, atomová hmotnostní
MZ CHEMIE 2015 MO 1 Základní chemické pojmy Atom, molekula, prvek, protonové číslo. Sloučenina, chemicky čistá látka, směs, dělení směsí. Relativní atomová hmotnost, molekulová hmotnost, atomová hmotnostní
ZŠ ÚnO, Bratří Čapků 1332
 Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
HYDROXYDERIVÁTY. Alkoholy Fenoly Bc. Miroslava Wilczková
 HYDROXYDERIVÁTY Alkoholy Fenoly Bc. Miroslava Wilczková HYDROXYDERIVÁTY Alkoholy -OH skupina vázána na uhlíkový atom alifatického řetězce Fenoly -OH skupina vázána na uhlíku, který je součástí aromatického
HYDROXYDERIVÁTY Alkoholy Fenoly Bc. Miroslava Wilczková HYDROXYDERIVÁTY Alkoholy -OH skupina vázána na uhlíkový atom alifatického řetězce Fenoly -OH skupina vázána na uhlíku, který je součástí aromatického
Chemické repetitorium. Václav Pelouch
 ZÁKLADY OBECNÉ A KLINICKÉ BIOCHEMIE 2004 Chemické repetitorium Václav Pelouch kapitola ve skriptech - 1 Anorganická a obecná chemie Stavba atomu Atom je nejmenší částice hmoty, která obsahuje jádro (složené
ZÁKLADY OBECNÉ A KLINICKÉ BIOCHEMIE 2004 Chemické repetitorium Václav Pelouch kapitola ve skriptech - 1 Anorganická a obecná chemie Stavba atomu Atom je nejmenší částice hmoty, která obsahuje jádro (složené
CHEMIE - Úvod do organické chemie
 Název školy Číslo projektu Autor Název šablony Název DUMu Stupeň a typ vzdělávání Vzdělávací oblast Vzdělávací obor Vzdělávací okruh Druh učebního materiálu Cílová skupina Anotace SŠHS Kroměříž CZ.1.07/1.5.00/34.0911
Název školy Číslo projektu Autor Název šablony Název DUMu Stupeň a typ vzdělávání Vzdělávací oblast Vzdělávací obor Vzdělávací okruh Druh učebního materiálu Cílová skupina Anotace SŠHS Kroměříž CZ.1.07/1.5.00/34.0911
Organické látky. Organická geochemie a rozpuštěný organický uhlík
 Organická geochemie a rozpuštěný organický uhlík struktura, nomenklatura a funkční skupiny huminové látky a další přírodní OC reaktivita DOC/POC distribuce kyselost (acidita) Přírodní a znečišťující organické
Organická geochemie a rozpuštěný organický uhlík struktura, nomenklatura a funkční skupiny huminové látky a další přírodní OC reaktivita DOC/POC distribuce kyselost (acidita) Přírodní a znečišťující organické
