II. Chemie a technologie sloučenin fosforu
|
|
|
- Roman Prokop
- před 9 lety
- Počet zobrazení:
Transkript
1 II. Chemie a technologie sloučenin fosforu 1. Suroviny fosforu Jsou rozlišovány dva základní typy fosfátů s obecným vzorcem vystihujícím jejich základní chemické složení Ca 5 (PO 4 ) 3 X : fosfority sedimentárního původu, kde "X" může být iont F, Cl a hlavně CO 3 2, apatity vulkanického původu, kde je iont Cl ve stopovém množství a zpravidla výrazně převažuje obsah iontu F nad CO 3 2, dále je fosfor obsažen v kostech obratlovců ve formě hydroxilfosforečnanu vápenatého (hydroxilapatitu) Ca 5 (PO 4 ) 3 (OH). Z hlediska zpracování a možností komplexního využití suroviny jsou velmi zajímavé apatity. V ČR je zpracováván apatitový koncentrát z poloostrova Kola v Rusku a v menší míře apatitový koncentrát Foskor z Jihoafrické republiky. Souběžně s apatitem se v ložiscích vyskytují další minerály obsahující významné prvky: hliník v nefelinu NaAlSiO 4, titan v titanitu CaTiOSiO 4, perowskitu CaTiO 3, rutilu TiO 2 nebo ilmenitu FeTiO 3, zirkon v badeleiytu ZrO 2 nebo zirkonu ZrSiO 4, železo v magnetitu Fe 3 O 4, měď v kupritu Cu 2 O. Z tohoto důvodu je těžená ruda po rozdrcení úpravárensky zpracovávána na mokré cestě (plavením, hydraulickým tříděním, flotací) nebo i magnetickou separací sloučenin železa s cílem zisku koncentrátů dříve uvedených minerálů dále průmyslově zpracovatelných. Vápenatý iont v krystalové mřížce apatitů bývá do určité míry nahrazen dalšími prvky skupiny kovů alkalických zemin ( hlavně Mg, Sr, Ba v koncentraci 0,1 2,5%) nebo prvky skupiny kovů vzácných zemin (do 1,0%). V průběhu chemického přepracovávání apatitů je lze z příslušných roztoků získávat v podobě koncentrátů. Čistý fosfor je výráběn elektrotermicky v odporově obloukových pecích redukcí přírodních fosfátů koksem za přítomnosti oxidu křemičitéhoza teplot nad 1400 o C: 2 Ca 5 (PO 4 ) 3 F + 15 C + 21/2 SiO 2 10 CaSiO 3 + 3/2 P 4 + 1/2 SiF CO Páry fosforu z prostoru hermeticky uzavřené pece těkají. Z proudu horkého plynu je fosfor oddělen jeho ochlazením, kdy zkondenzuje. Sloučeniny arzénu stopově přítomné ve fosfátech nebo koksu jsou rovněž redukovány na elementární arzén, který těká z pecí spolu s fosforem. Společně s ním kondenzuje a znečišťuje ho. Vznikající bílý fosfor je skladován pod vodou. Bílý fosfor je velmi reaktivní na vzduchu se samovolně vzněcuje! Významně méně reaktivní jsou další krystalické modifikace fosfor červený a černý. Bílý fosfor intenzivně reaguje s plynným chlórem za vzniku chloridů fosforitých a fosforečných, které jsou používány jako chlorační činidla při organických syntézách. 2 P + 3 Cl 2 2 PCl 3 2 P + 5 Cl 2 2 PCl 5
2 2. Sloučeniny fosforu Nejdůležitější sloučeninou fosforu je kyselina fosforečná, která byla brzy po objevu prvku fosforu připravena r Boylem reakcí P 4 O 10 s vodou. Současná roční výroba kyseliny fosforečné, druhé nejdůležitější anorganické kyseliny, přesahuje 40 mil. tun. Kyselina fosforečná a její soli jsou dnes nepostradatelnou součástí našeho života. Přes 60% vyráběného P 2 O 5 se spotřebuje ve formě hnojiv, 25% v detergentech a pracích prášcích a zbývajících 15% ve farmaceutickém, krmivářském a potravinářském průmyslu. Na našem území je jediný závod, Fosfa Poštorná, který vyrábí jak kyselinu fosforečnou tak i řadu jejich solí. KYSELINA FOSFOREČNÁ 2.1 Vlastnosti Bezvodá (tzn. 100%) kyselina fosforečná je bezbarvá krystalická látka s bodem tání 42 C. Je neomezeně mísitelná s vodou. S rostoucí koncentrací kyseliny se značně zvyšuje viskozita roztoku a např. 85% kyselina je syrupovitá kapalina. Kyselina fosforečná je komerčně dostupná ve třech koncentracích, a to jako 75% s bodem tání 20 C, 80% tající při 0 C a 85% s bodem tání 21 C. Kyselina fosforečná je trojsytná kyselina, která ve vodném roztoku disociuje podle schématu H 3 PO 4 H + + H 2 PO 4 H + + HPO 4 2 H + + PO 4 3 Od kyseliny fosforečné jsou odvozeny tři řady solí, a to dihydrogenfosforečnany, např. NaH 2 PO 4, jejichž vodný roztok je slabě kyselý, slabě alkalické hydrogenfosforečnany, např. Na 2 HPO 4, a ve vodném roztoku silně alkalické fosforečnany, např. Na 3 PO 4. Kyselina fosforečná není toxická, dráždí však oči a dýchací trakt. Za bezpečnou dávku podanou orálně se považují 4 g za den. Mnoho nealkoholických nápojů obsahuje 0.5 až 1 g kys. fosforečné v 1 litru k dosažení kyselé chuti. Rovněž fosforečnany, pokud neobsahují toxické kationty, nevykazují toxicitu s výjimkou kondenzovaného fosforečnanu, tzv. hexametafosfátu sodného (viz. kap ), který po požití může způsobit i smrtelnou otravu. 2.2 Výroba kyseliny fosforečné Rozlišujeme 2 způsoby přípravy kyseliny fosforečné, a to výrobu termickou a extrakční, nazývanou také vyrobou na mokré cestě. Termická výroba vychází z elementárního fosforu a produkuje koncentrovanou a velmi čistou kyselinu. Extrakční výroba H 3 PO 4 založená na rozkladu přírodního fosforečnanu minerální kyselinou, nejčastěji H 2 SO 4, poskytuje zředěnou a znečištěnou kyselinu. Z ekonomických důvodů je však 95% veškeré kyseliny fosforečné je vyráběno na mokré cestě Termický proces Termická výroba kyseliny fosforečné sestává ze dvou stupňů, a to spálení elementárního fosforu na oxid:
3 4 P + 5 O 2 P 4 O 10 doprovázené silným vývojem tepla, a slabě exotermní reakci oxidu fosforečného s vodou P 4 O H 2 O 4 H 3 PO 4 V průmyslově zavedených postupech se oba stupně realizují buď v jednom zařízení (proces IG) nebo odděleně (proces TVA a Hoechst). Proces IG v hlavě mírně konické kovové spalovací věže je umístěna tryska, do níž se stlačeným vzduchem vhání roztavený fosfor., Ten se rozstřikuje do prostoru spalovací věže kde hoří plamenem o teplotě přesahující 2000 C. Po vnitřní stěně věže stéká zředěná kyselina fosforečná, která ji ochlazuje a současně rozpouští vznikající oxid fosforečný. Do spodní části prostoru spalovací věže je rozstřikována kyselina fosforečná k ochlazení odplynů. Kyselina, která se shromažďuje na dně spalovací věže má teplotu 85 C. Část této kyseliny se vrací jako recykl zpět do věže přes chladič, kde se ochladí na 65 C a část se odvádí jako hotový produkt. Odplyny ze spalovací věže mají teplotu 100 C a unáší asi 30% vzniklého oxidu fosforečného. Odplyny se zavádí do dvou ejektorových Venturiho praček zařazených v sérii, kde se P 2 O 5 rozpouští ve zředěné kyselině fosforečné. Zředěná H 3 PO 4 z praček se shromažďuje v zásobnících, odkud je zčásti vracena do praček a zčásti do spalovací věže. Celé zařízení pracuje v mírném podtlaku vyvozovaném ventilátorem. Odplyn z praček po průchodu separátorem kapek je veden na komín. V TVA procesu se fosfor spaluje ve věži, která je z vnějšku chlazena vodou. Spalné plyny obsahující oxid fosforečný jsou vedeny do absorpční věže chlazené z vnějšku vodou a z vnitřku zředěnou kyselinou fosforečnou stékájící po stěnách. V kyselině se oxid fosforečný rozpouští za vzniku 75% kyseliny. 40 až 70% vzniklého oxidu fosforečného unášeného proudem plynu z absorpční věže je zachyceno ve Venturiho pračce a následujícím separátoru kapek. Jak IG tak i TVA proces nevyužívají značné množství tepla vznikajícího při spalování fosforu. Konstrukce spalovací věže v procesu Hoechst, obr. 4.3, umožňuje toto teplo využít na výrobu páry. Stěny spalovací věže jsou tvořeny stočenou trubkou, ve které proudí voda. Ta se teplem přeměňuje na směs páry a vody, která je udržována pod tlakem 15 MPa. V separátoru se voda oddělí od páry a je vracena zpět do pláště. Pára se ve výměníku umístěném ve spalovací věži zahřeje na 400 C a je odváděna na místo spotřeby. Termická kyselina je velmi čistá a obsahuje jen stopová množství prvků přítomných ve spalovaném fosforu. Výjimku představuje arzen, který vždy doprovází fosfor. Jeho koncentrace se v termické kyselině fosforečné pohybuje v rozmezí 5 až 30 ppm. Pro použití kyseliny v potravinářství je třeba arzen odstranit, tj. kyselinu dearzenizovat, viz. kap Extrakční proces Extrakční proces výroby kyseliny fosforečné je znám od r Jeho skutečný rozvoj však nastal až po 2. světové válce, kdy se začala intenzívně používat hnojiva. Postup je založen na rozkladu přírodních fosforečnanů, nejčastěji apatitu s obsahem fluoru, zpravidla kyselinou sírovou podle rovnice Ca 5 (PO 4 ) 3 F + 5 H 2 SO 4 + x H 2 O 5 CaSO 4.x H 2 O + 3 H 3 PO 4 + HF
4 kde x je 0, 0.5 nebo 2. Vzniklá kyselina fosforečná je znečištěná prvky přítomnými ve fosforečnanu, většinou Si, Ca, Fe, Al, Cr, Zn, V, Ni, Cu, Mn, As a Pb. Vedeme li rozklad fosforečnanu při teplotě 80 C vzniká dihydrát síranu vápenatého, CaSO 4.2H 2 O, při teplotě rozkladu 90 až 110 C vzniká hemihydrát CaSO 4.0.5H 2 O a nad 110 C dostaneme bezvodý síran, tzv. anhydrit. Příslušné postupy výroby kyseliny označujeme jako dihydrátový, hemihydrátový a anhydritový proces. Anhydritový proces není průmyslově realizován, neboť při teplotách nad 110 C je zředěná kyselina fosforečná již velmi silně korozivní a narážíme na obtíže s konstrukčním materiálem zařízení, který by byl schopen takovému prostředí vzdorovat. Klasickým postupem výroby kyseliny fosforečné na mokré cestě je dihydrátový proces. Rozemletý fosfát s částicemi pod 150 µm je dávkován do míchaného vnějšího mezikruží rozkladného reaktoru, obr Kyselina sírová je uváděna do reaktoru na jiném místě vnějšího mezikruží aby se dostatečně zředila než přijde do styku s fosfátem. Pokud by totiž fosfát reagoval s nezředěnou kyselinou, vytvořil by se na povrchu částic rychle povlak síranu vápenatého, který by zabránil dokonalému proreagování fosfátu. Teplota při rozkladu je udržována na 70 až 80 C uváděním chladícího vzduchu na hladinu suspenze. Suspenze vstupuje otvorem u dna do vnitřního válce reaktoru odkud je z hladiny odváděna na filtraci, kde se oddělí znečištěný dihydrát síranu vápenatého, tzv. fosfosádra. Filtrace se provádí buď pásovými filtry nebo talířovým filtrem speciální konstrukce. Filtrát je cca 50% kyselina fosforečná. Filtrační koláč je promyt vodou a promývací kapalina zředěná kyselina fosforečná je vracena do reaktoru. a) Výhodou dihydrátového postupu je poměrně nízká reakční teplota kdy problémy s korozí nejsou významné. Navíc lze tímto postupem zpracovat většinu přírodních fosforečnanů. Nevýhodou postupu je nízký výtěžek, 90 až 95% P 2 O 5 obsaženého v surovině, vznik zředěné kyseliny fosforečné, kterou je většinou nutno dále zahustit odpařením v sérii vakuových odparek a tvorba značného množství odpadní fosfosádry. b) Neustálý vzrůst cen energie si vynutil vypracování tzv. hemihydrátového postupu, který produkuje cca 75% kyselinu a odpadá tudíž nutnost zařazovat energeticky náročné odpařování. Čistý hemihydrátový postup není nikde realizován pro nízký výtěžek pohybující se kolem 90% P 2 O 5. c) S výhodou se však používá kombinace hemihydrátového a dihydrátového postupu, kdy výtěžek dosahuje 99%, vznikající kyselinu není třeba odpařovat a současně je produkována čistá sádra, která může být použita ve stavebnictví. Při tomto postupu se vede rozklad apatitu při 90 až 110 C. V důsledku vyšší teploty probíhá rozklad rychleji než u dihydrátového postupu. Vzniklý hemihydrát síranu vápenatého je ze suspenze separován a při teplotě 60 C překrystalován ze zředěné kyseliny fosforečné na dihydrát. H 3 PO 4 připravená mokrou cestou obsahuje kovy, které musí být pro mnohá použití kyseliny odstraněny. Jde především o arzen, který se odstraní srážením roztokem Na 2 S přimíchaným do kyseliny. Vyloučený velmi málo rozpustný As 2 S 3 je z kyseliny odstraněn filtrací. Obdobně může být vysráženo Cd přísadou organického činidla (alkylesteru
5 alkyldithiofosforečné kyseliny). Vyloučená tuhá fáze se opět z kyseliny odstraní filtrací. Jiný způsob čištění je založen na extrakci kyseliny do organické fáze (izopropylalkohol, butanol, amylalkohol aj.). Většina nečistot, zejména kationty kovů, zůstanou ve vodné fázi. Po promytí extraktu se organická fáze odstraní např. destilací a zůstane čistá kyselina fosforečná. 2.3 Odpady z výroby kyseliny fosfor ečné Při termickém procesu nevznikají odpady při výrobě H 3 PO 4, ale při výrobě elementárního fosforu, který vstupuje jako surovina do výroby kyseliny. Struska vznikající v množství přibližně 8 t na 1 t fosforu, je tvořena převážně křemičitanem vápenatým a je využívána ve stavebnictví jako plnivo, izolační materiál a při stavbě komunikací. Při extrakčním procesu výroby H 3 PO 4 odpadá kolem 5 t fosfosádry na 1 t P 2 O 5 v kyselině, tzn. na světě ročně vznikne kolem 150 mil. t fosfosádry. Likvidace tohoto množství odpadů představuje největší problém spojený s extrakční výrobou kyseliny fosforečné. Výrobny ležící u moře čerpaly suspenzi fosfosádry do moře. Pokud je v moři dostatečné proudění, nepředstavuje fosfosádra pro ekosystém žádnou hrozbu. Síran vápenatý, který je v mořské vodě již přítomen ve značném množství, se rychle rozpustí a těžké kovy jsou ve vodě přítomny ve větší koncentraci než ve fosfosádře, takže složení mořské vody není nijak ovlivněno. Uvedeným způsobem se likviduje cca 10% z celkového množství vznikající fosfosádry. Vnitrozemské výrobny suspenzi fosfosádry obvykle zředí a odčerpají na odkaliště. Vyčeřená voda z odkaliště je recyklována. Tento způsob likvidace odpadu má však nevýhodu v emisích fluoridů ze skládky a ve znečišťování povrchových a podpovrchových vod fosforečnany. Je možné také fosfosádru vysušit a ukládat např. ve vytěžených dolech. Teoreticky lze fosfosádru použít jako surovinu ve stavebnictví např. pro výrobu sádrokartonů nebo jako přísadu do cementu, v zemědělství a v papírenském průmyslu jako plnivo do papíru. Toto využití je však omezeno jak pro obsah nečistot ve fosfosádře, tak i v důsledku dostupnosti levného přírodního sádrovce. Fosfosádra je průmyslově využívána jen v Japonsku a Koreji, které nemají zdroj přírodního sádrovce. Každý přírodní fosfát obsahuje až několik procent fluoru ve formě anorganických sloučenin. Při rozkladu fosfátu minerální kyselinou se fluor uvolňuje jako HF, který s přítomným SiO 2 reaguje za vzniku těkajícího plynného SiF 4. SiF 4 je absorbován ve vodě za vzniku kyseliny hexafluorokřemičité H 2 SiF 6 o koncentraci až 25%. 3 SiF H 2 O + 2 HF 2 H 2 SiF 6 + H 4 SiO 4 3 FOSFOREČNANY SiF HF H 2 SiF 6 Vedle kyseliny fosforečné jsou komerčně důležité její soli fosforečnany. Podle struktury 3 rozlišujeme fosforečnany jednoduché obsahující jednotlivé PO 4 skupiny a fosforečnany kondenzované s vazbami O P O P O. Kondenzované fosforečnany mohou mít strukturu buď: lineární, jako např. anion trifosforečnanu [P 3 O 10 ] 5 cyklickou jako v případě trimetafosfátu [PO 3 ] 3. rozvětvenou jako v případě tzv. ultrafosfátů
6 3.1 Jednoduché fosforečnany Průmyslově jsou ve významných množstvích vyráběny sodné, draselné, amonné a vápenaté fosforečnany: Všechny tři sodné fosforečnany, NaH 2 PO 4, Na 2 HPO 4 a Na 3 PO 4, se vyrábí neutralizací H 3 PO 4 sodou nebo louhem sodným. K přípravě Na 3 PO 4 je třeba použít NaOH aby bylo dosaženo požadované ph. Ochlazením zneutralizovaného roztoku vykrystaluje příslušný fosforečnan jako hydrát, který se dále separuje na odstředivce. K získání bezvodé soli je třeba odstranit krystalovou vodu z hydrátu kalcinací v rotační peci. Alternativní postup pro získání bezvodých solí je uvádění roztoku fosforečnanu přímo do rozprašovací sušárny. NaH 2 PO 4 se užívá k úpravě povrchu kovů a také tvoří součást kyselých detergentů. Dále se používá jako minerální přísada do krmiva, v potravinářství se přidává jako stabilizátor ph do džusů a polévek. Na 2 HPO 4 se používá jako přísada do detergentů, na úpravu napájecích vod teplovodních kotlů a jako prostředek zabraňující koagulaci při zahušťování nebo sušení mléka. Hlavní použití Na 3 PO 4 je na úpravu napájecí vody pro parní kotle. Jelikož vodný roztok Na 3 PO 4, saponifikuje tuky, je používán jako průmyslový čistící prostředek pro stroje, nádobí a lahve. Draselné fosforečnany jsou s výjimkou KH 2 PO 4 více rozpustné ve vodě než odpovídající sodné soli. Vyrábí se neutralizací kyseliny fosforečné louhem draselným a následnou ochlazovací krystalizací nebo vysušením roztoku. KH 2 PO 4 a K 2 HPO 4 jsou užívány v džusech jako nutriční minerální přísada. Krystaly KH 2 PO 4 mají piezoelektrické vlastnosti a jsou využívány ve speciální elektrotechnice. Fosforečnany amonné se vyrábí neutralizací kyseliny fosforečné amoniakem a následnou krystalizací nebo odpařením roztoku. Fosforečnany amonné, které krystalují ve formě bezvodých solí, se užívají jako hnojiva, hasicí prášky, pro nehořlavou úpravu textilu a dřeva. Jejich zhášecí účinek je založen na tom, že se teplem rozloží na NH 3 a H 3 PO 4, která podporuje karbonizaci organických látek a tak omezuje tvorbu hořlavých plynů. Navíc v žáru vznikající polymerní kyseliny fosforečné vytváří na povrchu hořícího materiálu souvislou vrstvu, která zabraňuje přístupu kyslíku. Z fosforečnanů vápenatých se vyrábí Ca(H 2 PO 4 ) 2 jako bezvodá sůl nebo jako monohydrát. Kyselina fosforečná se v míchaném reaktoru neutralizuje vodnou suspenzí CaO, CaCO 3 nebo Ca(OH) 2. Výsledná hustá suspenze je potom vysušena a rozemleta nebo sušena na rozprašovací sušárně. Ca(H 2 PO 4 ) 2 je používán jako minerální přísada do potravin a jako stabilizátor mléčných výrobků. H 3 PO 4 + CaCO 3 CaHPO 4 + CO 2 + H 2 O Hydrogenfosforečnan vápenatý tvořící dihydrát CaHPO 4.2H 2 O a bezvodou sůl CaHPO 4 je vyráběn v množství přesahující 2 mil. t ročně. Vyrábí se neutralizací kyseliny fosforečné. Pokud je teplota během neutralizace udržována pod 40 C dostaneme suspenzi dihydrátu, nad 40 C vzniká bezvodá sůl. Hydrogenfosforečnan vápenatý se používá ve farmaceutickém průmyslu jako plnivo do tabletovaných léků, plnivo do zubních past a jako přísada do krmiva, tzv. krmný fosfát.
7 Ten se připravuje z kyseliny fosforečné vyrobené na mokré cestě vyčištěné částečnou neutralizací Ca(OH) 2, kdy se fluor vyloučí ve formě CaF 2, Fe a Al jako nerozpustné fosforečnany. Eventuálně přítomný hexafluorokřemičitan se vysráží přídavkem rozpustné sodné nebo draselné soli. Takto vyčištěná kyselina se smísí se stechiometrickým množstvím Ca(OH) 2 nebo CaCO 3 a vzniklý hydrogenfosforečnan vápenatý se vysuší a rozemele. 3.2 Kondenzované fosforečnany Kondenzované fosforečnany se obecně připravují z jednoduchých hydrogenfosforečnanů alkalických kovů vydělením vody teplem. Tak např. vznik difosforečnanu tetrasodného Na 4 P 2 O 7 z hydrogenfosforečnanu sodného Na 2 HPO 4 při zahřívání na teploty kolem 300 o C probíhá následujícím např. mechanizmem: NaH 2 PO Na 2 HPO 4 Na 5 P 3 O H 2 O Všechny kondenzované fosforečnany jsou rozpustné ve vodě. Vyšší kondenzované fosforečnany reagují jako soli silné jednosytné kyseliny a ve vodném roztoku hydrolyzují na jednoduché fosforečnany. Rychlost hydrolýzy je silně závislá na teplotě a ph roztoku. Tak např. trifosforečnan pentasodný Na 5 P 3 O 10 je v neutrálním vodném roztoku při 25 C stabilní více jak rok, zatímco při ph = 3 se při 100 C rozloží za asi 3 minuty. Cyklické fosforečnany, tzv. metafosfáty, jsou v neutrálních roztocích za pokojové teploty rovněž velmi stabilní. Při vyšších teplotách se v kyselých roztocích velmi rychle rozkládají, nejprve na lineární kondenzované fosforečnany, které dále hydrolyzují na jednoduché fosforečnany. Kondenzované fosforečnany vážou kationty kovů jako Ca, Mg, Fe a maskují je tak, že nemohou být vysráženy obvyklými činidly. Této vlastnosti polyfosforečnanů se využívá zejména v pracích prášcích a detergentech. Z kondenzovaných fosforečnanů je významný difosforečnan tetrasodný Na 4 P 2 O 7 a trifosforečnan pentasodný (nazývaný tripolyfosforečnan) Na 5 P 3 O 10. Na 4 P 2 O 7, bílý nehygroskopický prášek, se vyrábí kalcinací Na 2 HPO 4 v rotační peci při 300 C. Hydrogenfosforečnan je připraven neutralizací kyseliny fosforečné, roztok je vysušen v rozprašovací sušárně a bezvodý Na 2 HPO 4 je potom kalcinován. Difosforečnan tetrasodný se používá při úpravě povrchu kovů, v čistících prostředcích, při vrtných pracech k úpravě viskozity suspenze a jako stabilizátor konzistence zubních past obsahujících plnivo CaHPO 4.2H 2 O. Trifosforečnan pentasodný je nejmasověji vyráběným fosforečnanem. Jeho současná roční produkce přesahuje 3 mil. t. Připravuje se kalcinací směsi hydrogen a dihydrogenfosforečnanu sodného ve stechiometrickém poměru při 300 až 550 C: 2Na 2 HPO 4 + NaH 2 PO 4 Na 5 P 3 O H 2 O Výroba se uskutečňuje jako jednostupňový nebo dvoustupňový proces. V jednostupňovém procesu je roztok fosforečnanů vysušen a kalcinován v jednom aparátu, zatímco ve
8 dvoustupňovém procesu je roztok směsi fosforečnanů nejprve vysušen a tuhá fáze potom kalcinována. V dalším popíšeme jen jednostupňový proces, obr Roztok směsi fosforečnanů v požadovaném poměru se připraví neutralizací kyseliny fosforečné roztokem sody nebo louhu sodného. Roztok je nastřikován do věže tryskou kolem níž jsou umístěny hořáky spalující plyn. Plameny šlehají do středu věže. Roztok se při postupu věží rychle vysuší a tuhá fáze vykalcinuje na polyfosforečnan. Většina tuhého produktu se zachytí ve spodním kónusu věže. Nezachycená část unášená spalnými plyny je oddělena v cyklonech. Odplyny z věže se promývají vodou a vypouští do atmosféry. Produkt z věže a cyklonů je ochlazen v chladiči a skladován v sile. Tavením směsi dihydrogen a hydrogenfosforečnanu sodného v molárním poměru větším než 1:2 vzniká směs kondenzovaných fosforečnanů s délkou řetězce proměnnou podle reakčních podmínek a následného zpracování taveniny. Rychlým ochlazením taveniny se získá sklovitá hmota, která se označuje jako tavené fosforečnany. Všechny tyto fosforečnany jsou rozpustné ve vodě a jsou hygroskopické. Kondenzované fosforečnany mají rozsáhlé použití. Používají se k úpravě vody (změkčení) pro kotle vyrábějící páru. Výhodou kondenzovaných fosforečnanů proti jednoduchým fosforečnanům, které sráží kationty alkalických zemin ve formě nerozpustných fosforečnanů hned po přidání, je to, že k jejich vyloučení dojde až v kotli při zvýšené teplotě vody a nerozpustné fosforečnany mohou být proto odstraňovány z kotle jako suspenze. Kondenzované fosforečnany zabraňují vylučování CaCO 3. Toho se využívá při výrobě teplé vody a v průmyslových chladicích systémech. Přídavkem 2 až 5 g fosforečnanu na 1 m 3 vody se zamezí vylučování jak CaCO 3 tak i kotelního kamene. Kondenzované fosforečnany, zejména trifosforečnan pentasodný, jsou využívány v pracích prostředcích a detergentech, kde 1) změkčují vodu a zabraňují usazování sloučenin alkalických zemin na vláknech a topném elementu pračky, 2) v důsledku stabilizace emulzí a dispergačních vlastností podporují prací proces. V potravinářství se kondenzované fosforečnany používají při výrobě tavených sýrů, zahuštěného a sušeného mléka, kde přeměňují koagulující kaseinát vápenatý na sodný jehož emulsi s tukem stabilizují. Dispergačních účinků kondenzovaných fosforečnanů a jejich schopnosti vázat vápník je využíváno při přípravě instantních výrobků, jako např. pudinků, zmrzlin, omáček, polévek. Přidávají se také do masové směsi na výrobu uzenin, kde zabraňují změnám struktury proteinů a následující ztrátě vody. V průmyslu jsou kondenzované fosforečnany využívány jako dispergační a stabilizační činidla při přípravě suspenzí pigmentů a emulsních barev, kde zvyšují jejich krycí schopnost a životnost (skladovací dobu). Obdobné použití je i v textilním průmyslu při barvení textilu a v papírenském průmyslu při výrobě plněného papíru. Použití a výroba 4. Fosforečná hnojiva jednoduchá a kombinovaná typu NPK 4.1. Úvod Základním problémem výroby všech fosforečných hnojiv včetně kombinovaných je nutnost změny molárního poměru 5 : 3 mezi vápníkem a fosforem ve výchozích, ve vodě téměř nerozpustných fosfátech, na poměr min. 1 : 1, nejlépe 1 : 2, které jsou ve vodě dobře rozpustné, tj. rozpustné i ve slabých kyselinách přítomných v půdním roztoku. Teprve pak jsou asimilovatelné přijatelné kořenovým systémem rostlin z půdních roztoků.
9 V 19. století bylo zjištěno, že rostliny potřebují ke svému zdárnému vývoji a vyšším výnosům žádaných plodin především sloučeniny prvků N, P, K, Ca a Mg. Z tohoto důvodu bylo rolníky využíváno ve stále větší míře ke hnojení: chlévské mrvy obsahující organickou hmotu, amidický, amoniakální a nitrátový dusík pocházející z močoviny, draselné soli a v menší míře fosforečnany, kompostů fekálií, kostní moučky, vysokopecní strusky, rozemletých surových fosfátů, průmyslových hnojiv jednoduchých a později dvou a vícesložkových. Od druhé poloviny 19. století byla zavedena Evropě včetně Čech výroba tzv. jednoduchého superfosfátu. Tan byl vyráběn rozkladem jemně rozemletých fosfátů kyselinou sírovou o koncentraci cca % hm., což vystihuje následující sumární rovnice: Ca 5 (PO 4 ) 3 F + 3 H 2 SO 4 CaHPO 4 + Ca(H 2 PO 4 ) CaSO 4 + HF Výchozí suroviny byly intenzivně promíchány v rozkladném reaktoru malaxeru a ještě tekutá rozkladná směs, kdy v prvním kroku vznikala rozkladem části fosfátu kyselina fosforečná. Rozložená břečka natékala do rozkladné komory, kde ztuhla hlavně díky vznikajícímu dihydrátu síranu vápenatého sádry. Ztuhlá reakční směs byla mechanicky vykrajována z rozkladné komory a dopravována do haly zrání. Zde během 2 3 týdnů probíhal rozklad dalšího podílu fosfátu s kyselinou fosforečnou (viz níže uvedená rovnice). Jednoduchý superfosfát byl vyráběn s obsahem P 2 O 5 do 20 % hm. dle složení výchozího fosfátu. Po průmyslovém zvládnutí technologie výroby extrakční kyseliny fosforečné byla zavedena výroba superfosfátů obohacených, kdy byl rozklad realizován směsí kyselin sírové a fosforečné, a zejména superfosfátu trojitého s obsahem P 2 O 5 nad 40 % hm. Rozklad surového fosfátu byl realizován jen kyselinou fosforčnou, jak je uvedeno dále: Ca 5 (PO 4 ) 3 F + 7 H 3 PO 4 5 Ca(H 2 PO 4 ) 2 + HF Superfosfáty jsou používány jako jednosložková průmyslová hnojiva nebo jsou používány pro výrobu směsných vícesložkových hnojiv typu NP či NPK přídavkem dusičnanů amonných, případně KCl nebo K 2 SO 4. Z hlediska zastoupení základních biogenních prvků jsou rozeznávána průmyslová hnojiva: jednosložková obsahují pouze jeden ze základních biogenních prvků (živin), t.j. dusík, fosfor nebo draslík. Míchání složek je obvykle realizováno v bubnovém granulátoru za přídavku čpavkové vody. Surový granulát je sušen, tříděn, chlazen a povrchově upravován postřikem s pudrováním. vícesložková dvojitá (obsahující dva z uvedených prvků) nebo plná obsahující všechny tři základní biogenní prvky. Do vícesložkových hnojiv bývají přidávány i stopové prvky významné pro výživu rostlin (B, Cu, Mo, Zn, Fe aj.).
10 Vícesložková hnojiva jsou dále rozlišována na hnojiva: směsná, vyráběná pouhým smícháním jednosložkových hnojiv v požadovaném poměru živin bez potřeby průběhu chemických reakcí ve směsi, kombinovaná, kde spolu jednotlivé složky během výroby musí chemicky reagovat. Právě při výrobě kombinovaných hnojiv je technologicky výhodné použití surovin s vysokou koncentrací základních složek a minimem znečišťujících příměsí. Některé ze složek reakčního systému je nezbytné oddělovat nebo je alespoň vázat do sloučenin nerozpustných ve vodě pro zajištění žádaných kvalitativních znaků, případně je oddělovat z jiných důvodů v hnojivu jsou balastem a snižují jeho koncentraci, ale jinak jsou velmi žádané pro možnost dalšího využití Suroviny pro výrobu kombinovaných hnojiv Základními surovinami pro výrobu kombinovaných hnojiv jsou: kapalný nebo plynný čpavek, kyselina dusičná s koncentrací %, fosfáty nebo kyselina fosforečná, chlorid nebo síran draselný. Dalšími surovinami může být dle zvolené technologie např. kyselina sírová, síran amonný, oxid uhličitý, dusičnan amonný, případně fosforečnany amonné. Z uvedených základních surovin má pro volbu výrobní technologie a kvalitu produktu rozhodující význam zpracovávaný fosfát. Z hlediska zpracování a možností komplexního využití suroviny jsou velmi zajímavé apatity. V ČR je zpracováván apatitový koncentrát z poloostrova Kola v Rusku a v menší míře apatitový koncentrát Foskor z Jihoafrické republiky (viz dříve) Technologie výroby kombinovaných hnojiv Základní technologickou operací při výrobě kombinovaných hnojiv je rozklad fosfátů v min. 5% ním přebytku kyseliny dusičné s koncentrací nad 53,0 %hm.: 2 Ca 5 (PO 4 ) 3 F + 20 HNO 3 10 Ca(NO 3 ) H 3 PO HF Cílem rozkladu je převedení všech složek do roztoku, tzv. rozložené břečky. Dalším úkolem je úprava poměru mezi P a Ca tak, aby ve výsledném produktu po neutralizaci čpavkem a přídavku draselné složky byl fosfor ve sloučeninách dobře rozpustných ve vodě nebo slabých minerálních kyselinách. Jen tak je z půdního roztoku přístupný rostlinám. Této podmínce vyhovují dihydrogen nebo minimálně hydrogenfosforečnany vápenaté vznikající při neutralizaci: 7 Ca(NO 3 ) H 3 PO HF + 14 NH 3 6 CaHPO 4 + CaF NH 4 NO 3 Ze stechiometrických rovnic rozkladu a neutralizace je patrné, že se musí odstranit nebo do jiných nerozpustných sloučenin vázat min. 3 moly Ca z původně přítomného fluoridofosforečnanu vápenatého. Podle způsobu úpravy poměru mezi fosforem a vápníkem jsou rozlišovány následující základní technologie výroby NPK:
11 NPK 2 rozklad je realizován kyselinou dusičnou s přídavkem kyseliny sírové, kdy je přebytečný vápník vázán do dihydrátu síranu vápenatého sádry CaSO 4.2H 2 O, která zůstává po neutralizaci čpavkem v hnojivu. Sádra je balastem, který snižuje koncentraci živin v hnojivu. NPK 3 rozložená břečka je po částečné neutralizaci čpavkem sycena oxidem uhličitým, který váže vápník do uhličitanu vápenatého zůstávajícího v hnojivu. Do vzniklé suspenze je po odpaření dávkován chlorid nebo síran draselný. Vzniklá tavenina je granulována, surový granulát sušen, chlazen, tříděn a vytříděný produkt povrchově upravován. Nadsítný podíl z třídění po rozdrcení a podsítný podíl je přímo vracen zpět do ganulace. NPK 4A po rozkladu v kyselině dusičné je dávkován hydrogensíran amonný, který část vápníku sráží v formě sádry. Další postup zpracování suspenze po neutralizaci čpavkem je stejný pro všechny typy NPK jako je tomu pro NPK 3. NPK 4B po rozkladu v kyselině dusičné je dávkován síran draselný a amonný, které sráží vápník jako sádru. NPK NF po rozkladu fosfátu kyselinou dusičnou je do rozložené břečky dávkována kyselina fosforečná snižující koncentraci vápníku upravující jeho poměr k fosforu. NPK 1 z podchlazené rozložené břečky je po krystalizaci (vymražení) filtrací oddělen tetrahydrát dusičnanu vápenatého (obr. 14.). Vymrazovací technologie výroby NPK l (tzv. ODDA proces firmy Norsk Hydro a jeho další modifikace) poskytuje několik možností zisku důležitých sloučenin dále dobře zpracovatelných na komerčně zajímavé produkty o jejichž výrobě bude pojednáno v navazujících kapitolách. Ing. Miroslav Richter, Ph.D.,EUR ING Ústí n.l.,
Tematický blok 2 Zdroje znečišťování ovzduší Chemický průmysl Ing. Miroslav Richter, Ph.D., EUR ING miroslav.richter@ujep.cz
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Tematický blok 2 Zdroje znečišťování ovzduší Chemický průmysl Ing. Miroslav Richter, Ph.D., EUR ING miroslav.richter@ujep.cz
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Tematický blok 2 Zdroje znečišťování ovzduší Chemický průmysl Ing. Miroslav Richter, Ph.D., EUR ING miroslav.richter@ujep.cz
Fosfor a sloučeniny fosforu. Suroviny. Sloučeniny. kalcinace pro oddělení organických. Kyselina trihydrogenfosforečná H3PO4
 Fosfor a sloučeniny fosforu Sloučeniny Fosfor bílý Kyselina trihydrogenfosforečná H3PO4 Suroviny Apatit Ca5 (PO4)3(F, OH, Cl) fluoroapatity úpravy mletí promývání sítování magnetické oddělování oxidů železa
Fosfor a sloučeniny fosforu Sloučeniny Fosfor bílý Kyselina trihydrogenfosforečná H3PO4 Suroviny Apatit Ca5 (PO4)3(F, OH, Cl) fluoroapatity úpravy mletí promývání sítování magnetické oddělování oxidů železa
Kyselina fosforečná Suroviny: Výroba: termický způsob extrakční způsob
 Kyselina fosforečná bezbarvá krystalická sloučenina snadno rozpustná ve vodě komerčně dodávané koncentrace 75% H 3 PO 4 s 54,3% P 2 O 5 80% H 3 PO 4 s 58.0% P 2 O 5 85% H 3 PO 4 s 61.6% P 2 O 5 po kyselině
Kyselina fosforečná bezbarvá krystalická sloučenina snadno rozpustná ve vodě komerčně dodávané koncentrace 75% H 3 PO 4 s 54,3% P 2 O 5 80% H 3 PO 4 s 58.0% P 2 O 5 85% H 3 PO 4 s 61.6% P 2 O 5 po kyselině
Dusík a fosfor. Dusík
 5.9.010 Dusík a fosfor Dusík lyn Bezbarvý, bez chuti a zápachu Vyskytuje se v dvouatomových molekulách N Molekuly dusíku extremně stabilní říprava: reakce dusitanů s amonnými ionty NH N N ( ( ( ( Výroba:
5.9.010 Dusík a fosfor Dusík lyn Bezbarvý, bez chuti a zápachu Vyskytuje se v dvouatomových molekulách N Molekuly dusíku extremně stabilní říprava: reakce dusitanů s amonnými ionty NH N N ( ( ( ( Výroba:
FOSFA, a.s. Studijní materiál k předmětu Chemická exkurze C6950 Brno 2011
 Studijní materiál k předmětu Chemická exkurze C6950 Brno 2011 FOSFA, a.s. Vypracoval: Mgr. David Škoda Úpravy: Mgr. Zuzana Garguláková, doc. Ing. Vladimír Šindelář, Ph.D. Obecné informace Fosfa, a.s. největší
Studijní materiál k předmětu Chemická exkurze C6950 Brno 2011 FOSFA, a.s. Vypracoval: Mgr. David Škoda Úpravy: Mgr. Zuzana Garguláková, doc. Ing. Vladimír Šindelář, Ph.D. Obecné informace Fosfa, a.s. největší
 - Máte před sebou studijní materiál na téma KOVY ALKALICKÝCH ZEMIN, který obsahuje nejdůležitější fakta z této oblasti. - Doporučuji také prostudovat příslušnou kapitolu v učebnici PŘEHLED STŘEDOŠKOLSKÉ
- Máte před sebou studijní materiál na téma KOVY ALKALICKÝCH ZEMIN, který obsahuje nejdůležitější fakta z této oblasti. - Doporučuji také prostudovat příslušnou kapitolu v učebnici PŘEHLED STŘEDOŠKOLSKÉ
DUM č. 4 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 4 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 4 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
3. Soda a potaš Ing. Miroslav Richter, Ph.D., EUR ING
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE 3. Soda a potaš Ing. Miroslav Richter, Ph.D., EUR ING Výroby sody a potaše Suroviny, Přehled výrobních technologií
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE 3. Soda a potaš Ing. Miroslav Richter, Ph.D., EUR ING Výroby sody a potaše Suroviny, Přehled výrobních technologií
Průmyslová hnojiva biogenní prvky
 Průmyslová hnojiva biogenní prvky - kyslík - základní složka organické hmoty (CO 2 ) - uhlík - základní složka organické hmoty (CO 2 ) - vodík - základní složka organické hmoty - dusík -součást bílkovin
Průmyslová hnojiva biogenní prvky - kyslík - základní složka organické hmoty (CO 2 ) - uhlík - základní složka organické hmoty (CO 2 ) - vodík - základní složka organické hmoty - dusík -součást bílkovin
SOLI. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: 12. 4. 2013. Ročník: osmý
 SOLI Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 12. 4. 2013 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Anorganické sloučeniny 1 Anotace: Žáci se seznámí s vlastnostmi solí,
SOLI Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 12. 4. 2013 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Anorganické sloučeniny 1 Anotace: Žáci se seznámí s vlastnostmi solí,
Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0
 Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ)
 TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ) 3. část ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Zpracoval: Tým autorů EVECO Brno, s.r.o. ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Množství SO 2, HCl,
TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ) 3. část ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Zpracoval: Tým autorů EVECO Brno, s.r.o. ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Množství SO 2, HCl,
NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV:VY_32_INOVACE_102_Soli AUTOR: Igor Dubovan ROČNÍK, DATUM: 9., 15. 9.
 NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV:VY_32_INOVACE_102_Soli AUTOR: Igor Dubovan ROČNÍK, DATUM: 9., 15. 9. 2011 VZDĚL. OBOR, TÉMA: Chemie, Soli ČÍSLO PROJEKTU: OPVK
NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV:VY_32_INOVACE_102_Soli AUTOR: Igor Dubovan ROČNÍK, DATUM: 9., 15. 9. 2011 VZDĚL. OBOR, TÉMA: Chemie, Soli ČÍSLO PROJEKTU: OPVK
Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np:
 PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
Omezování plynných emisí. Ochrana ovzduší ZS 2012/2013
 Omezování plynných emisí Ochrana ovzduší ZS 2012/2013 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Omezování plynných emisí Ochrana ovzduší ZS 2012/2013 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
ÚVOD. Hlízkové bakterie Bobovité Mořští. Bradyrhyzobium japonicum Jetel luční ptáci
 ÚVOD Hlízkové bakterie Bobovité Mořští Bradyrhyzobium japonicum Jetel luční ptáci Guano je mineralizovaný trus mořských ptáků, živících se rybami. GUANO Běžná dávka kombinovaného hnojiva je 300-500 kg
ÚVOD Hlízkové bakterie Bobovité Mořští Bradyrhyzobium japonicum Jetel luční ptáci Guano je mineralizovaný trus mořských ptáků, živících se rybami. GUANO Běžná dávka kombinovaného hnojiva je 300-500 kg
Soli kyslíkatých kyselin
 Soli kyslíkatých kyselin Temacká oblast : Chemie anorganická chemie Datum vytvoření: 19. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Soli důležitých anorganických
Soli kyslíkatých kyselin Temacká oblast : Chemie anorganická chemie Datum vytvoření: 19. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Soli důležitých anorganických
ÚPRAVA VODY V ENERGETICE. Ing. Jiří Tomčala
 ÚPRAVA VODY V ENERGETICE Ing. Jiří Tomčala Úvod Voda je v elektrárnách po palivu nejdůležitější surovinou Její množství v provozních systémech elektráren je mnohonásobně větší než množství spotřebovaného
ÚPRAVA VODY V ENERGETICE Ing. Jiří Tomčala Úvod Voda je v elektrárnách po palivu nejdůležitější surovinou Její množství v provozních systémech elektráren je mnohonásobně větší než množství spotřebovaného
Typy hnojiv. močovma kyanamid dusíkaté vápno s 18%N celkový dusík, dusíkjako celkový; kyanamid vápenatý,
 Příloha č. 3 k vyhlášce č. 474/2000 Sb. Typy hnojiv Druh hnojiva: 1. Minerální jednosložková hnojiva a) dusíkatá hnojiva typ označení typu minimální součásti určující hodnocené součásti a složení, způsob
Příloha č. 3 k vyhlášce č. 474/2000 Sb. Typy hnojiv Druh hnojiva: 1. Minerální jednosložková hnojiva a) dusíkatá hnojiva typ označení typu minimální součásti určující hodnocené součásti a složení, způsob
HOŘČÍK KOVY ALKALICKÝCH ZEMIN. Pozn. Elektronová konfigurace valenční vrstvy ns 2
 HOŘČÍK KOVY ALKALICKÝCH ZEMIN Pozn. Elektronová konfigurace valenční vrstvy ns 2 Hořčík Vlastnosti: - stříbrolesklý, měkký, kujný kov s nízkou hustotou (1,74 g.cm -3 ) - diagonální podobnost s lithiem
HOŘČÍK KOVY ALKALICKÝCH ZEMIN Pozn. Elektronová konfigurace valenční vrstvy ns 2 Hořčík Vlastnosti: - stříbrolesklý, měkký, kujný kov s nízkou hustotou (1,74 g.cm -3 ) - diagonální podobnost s lithiem
Pozn.: Pokud není řečeno jinak jsou pod pojmem procenta míněna vždy procenta hmotnostní.
 Sebrané úlohy ze základních chemických výpočtů Tento soubor byl sestaven pro potřeby studentů prvního ročníku chemie a příbuzných předmětů a nebyl nikterak revidován. Prosím omluvte případné chyby, překlepy
Sebrané úlohy ze základních chemických výpočtů Tento soubor byl sestaven pro potřeby studentů prvního ročníku chemie a příbuzných předmětů a nebyl nikterak revidován. Prosím omluvte případné chyby, překlepy
ROZDĚLENÍ A POŽADAVKY NA KATEGORIE FUNKCE VÝROBKU, KATEGORIE SLOŽKOVÝCH MATERIÁLŮ. Jana Meitská Sekce zemědělských vstupů ÚKZÚZ Brno
 ROZDĚLENÍ A POŽADAVKY NA KATEGORIE FUNKCE VÝROBKU, KATEGORIE SLOŽKOVÝCH MATERIÁLŮ Jana Meitská Sekce zemědělských vstupů ÚKZÚZ Brno KATEGORIE HNOJIVÝCH VÝROBKŮ (DLE FUNKCE) 1. Hnojivo 2. Materiál k vápnění
ROZDĚLENÍ A POŽADAVKY NA KATEGORIE FUNKCE VÝROBKU, KATEGORIE SLOŽKOVÝCH MATERIÁLŮ Jana Meitská Sekce zemědělských vstupů ÚKZÚZ Brno KATEGORIE HNOJIVÝCH VÝROBKŮ (DLE FUNKCE) 1. Hnojivo 2. Materiál k vápnění
POPIS VYNÁLEZU K AUTORSKÉMU OSVĚDČENÍ (И) В, G 01 P 17/00. (54) Způeob získávání eoli prvkťl vzácných zemin
 ČESKOSLOVENSKA SOCIALISTICKÁ REPUBLIKA ( 19 ) POPIS VYNÁLEZU K AUTORSKÉMU OSVĚDČENÍ (61) (23) Výstavnf priorita (22) Přihlášeno 12 09 86 (2») PV 8176-86.P (И) В, (51) Int. CI.4 G 01 P 17/00 ÚFTAD PRO VYNÁLEZY
ČESKOSLOVENSKA SOCIALISTICKÁ REPUBLIKA ( 19 ) POPIS VYNÁLEZU K AUTORSKÉMU OSVĚDČENÍ (61) (23) Výstavnf priorita (22) Přihlášeno 12 09 86 (2») PV 8176-86.P (И) В, (51) Int. CI.4 G 01 P 17/00 ÚFTAD PRO VYNÁLEZY
Inovace bakalářského studijního oboru Aplikovaná chemie CZ.1.07/2.2.00/ Výpočty z chemických vzorců
 Výpočty z chemických vzorců 1. Hmotnost kyslíku je 80 g. Vypočítejte : a) počet atomů kyslíku ( 3,011 10 atomů) b) počet molů kyslíku (2,5 mol) c) počet molekul kyslíku (1,505 10 24 molekul) d) objem (dm
Výpočty z chemických vzorců 1. Hmotnost kyslíku je 80 g. Vypočítejte : a) počet atomů kyslíku ( 3,011 10 atomů) b) počet molů kyslíku (2,5 mol) c) počet molekul kyslíku (1,505 10 24 molekul) d) objem (dm
Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH. atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na +
 OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
STANOVENÍ CHLORIDŮ. Odměrné argentometrické stanovení chloridů podle Mohra
 STANOVENÍ CHLORIDŮ Odměrné argentometrické stanovení chloridů podle Mohra Cíl práce Stanovte titr odměrného standardního roztoku dusičnanu stříbrného titrací 5 ml standardního srovnávacího roztoku chloridu
STANOVENÍ CHLORIDŮ Odměrné argentometrické stanovení chloridů podle Mohra Cíl práce Stanovte titr odměrného standardního roztoku dusičnanu stříbrného titrací 5 ml standardního srovnávacího roztoku chloridu
Omezování plynných emisí. Ochrana ovzduší ZS 2010/2011
 Omezování plynných emisí Ochrana ovzduší ZS 2010/2011 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Omezování plynných emisí Ochrana ovzduší ZS 2010/2011 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
CHO cvičení, FSv, ČVUT v Praze
 2. Chemické rovnice Chemická rovnice je schématický zápis chemického děje (reakce), který nás informuje o reaktantech (výchozích látkách), produktech, dále o stechiometrii reakce tzn. o vzájemném poměru
2. Chemické rovnice Chemická rovnice je schématický zápis chemického děje (reakce), který nás informuje o reaktantech (výchozích látkách), produktech, dále o stechiometrii reakce tzn. o vzájemném poměru
Ch - Hydroxidy VARIACE
 Ch - Hydroxidy Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl kompletně vytvořen,
Ch - Hydroxidy Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl kompletně vytvořen,
Odborná škola výroby a služeb, Plzeň, Vejprnická 56, Plzeň. Číslo materiálu 19. Bc. Lenka Radová. Vytvořeno dne
 Název školy Název projektu Číslo projektu Číslo šablony Odborná škola výroby a služeb, Plzeň, Vejprnická 56, 318 00 Plzeň Digitalizace výuky CZ.1.07/1.5.00/34.0977 VY_32_inovace_ZZV19 Číslo materiálu 19
Název školy Název projektu Číslo projektu Číslo šablony Odborná škola výroby a služeb, Plzeň, Vejprnická 56, 318 00 Plzeň Digitalizace výuky CZ.1.07/1.5.00/34.0977 VY_32_inovace_ZZV19 Číslo materiálu 19
Registrační číslo projektu: CZ.1.07/1.4.00/21.2939. Název projektu: Investice do vzdělání - příslib do budoucnosti
 Registrační číslo projektu: CZ.1.07/1.4.00/21.2939 Název projektu: Investice do vzdělání - příslib do budoucnosti Číslo přílohy: VY_číslo šablony_inovace_číslo přílohy Autor Datum vytvoření vzdělávacího
Registrační číslo projektu: CZ.1.07/1.4.00/21.2939 Název projektu: Investice do vzdělání - příslib do budoucnosti Číslo přílohy: VY_číslo šablony_inovace_číslo přílohy Autor Datum vytvoření vzdělávacího
SOLI A JEJICH VYUŽITÍ. Soli bezkyslíkatých kyselin Soli kyslíkatých kyselin Hydrogensoli Hydráty solí
 SOLI A JEJICH VYUŽITÍ Soli bezkyslíkatých kyselin Soli kyslíkatých kyselin Hydrogensoli Hydráty solí POUŽITÍ SOLÍ Zemědělství dusičnany, draselné soli, fosforečnany. Stavebnictví, sochařství vápenaté soli.
SOLI A JEJICH VYUŽITÍ Soli bezkyslíkatých kyselin Soli kyslíkatých kyselin Hydrogensoli Hydráty solí POUŽITÍ SOLÍ Zemědělství dusičnany, draselné soli, fosforečnany. Stavebnictví, sochařství vápenaté soli.
Směsi a čisté látky, metody dělení
 Směsi a čisté látky, metody dělení LÁTKY Chemicky čisté látky Sloučeniny Chemické prvky Homogenní Roztoky pevné kapalné plynné Směsi Heterogenní Suspenze Emulze Pěna Aerosol Chemicky čisté látky: prvky
Směsi a čisté látky, metody dělení LÁTKY Chemicky čisté látky Sloučeniny Chemické prvky Homogenní Roztoky pevné kapalné plynné Směsi Heterogenní Suspenze Emulze Pěna Aerosol Chemicky čisté látky: prvky
1932 H. C. 1934 M.L.E.
 Vodík Historie 1671 Robert Boyle uvolnění vodíku rozpouštěním Fe v HCl nebo H 2 SO 4 1766 Henry Cavendish podrobný popis vlastností 1932 H. C. Urey objev deuteria 1934 M.L.E. Oliphant, P. Harteck a E.
Vodík Historie 1671 Robert Boyle uvolnění vodíku rozpouštěním Fe v HCl nebo H 2 SO 4 1766 Henry Cavendish podrobný popis vlastností 1932 H. C. Urey objev deuteria 1934 M.L.E. Oliphant, P. Harteck a E.
Ohlašovací prahy pro úniky a přenosy pro ohlašování do IRZ/E-PRTR
 Celkový dusík Základní informace Ohlašovací prahy pro úniky a přenosy pro ohlašování do IRZ/E-PRTR Základní charakteristika Použití Zdroje úniků Dopady na životní prostředí Dopady na zdraví člověka, rizika
Celkový dusík Základní informace Ohlašovací prahy pro úniky a přenosy pro ohlašování do IRZ/E-PRTR Základní charakteristika Použití Zdroje úniků Dopady na životní prostředí Dopady na zdraví člověka, rizika
III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Průmysl dusíku. amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin. NaClO NaOH CO(NH 2 ) 2.
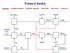 Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
CHEMICKÉ VÝPOČTY HMOTNOST REAKTANTŮ A PRODUKTŮ PŘI CHEMICKÉ REAKCI PROJEKT EU PENÍZE ŠKOLÁM OPERAČNÍ PROGRAM VZDĚLÁVÁNÍ PRO KONKURENCESCHOPNOST
 CHEMICKÉ VÝPOČTY HMOTNOST REAKTANTŮ A PRODUKTŮ PŘI CHEMICKÉ REAKCI PROJEKT EU PENÍZE ŠKOLÁM OPERAČNÍ PROGRAM VZDĚLÁVÁNÍ PRO KONKURENCESCHOPNOST VÝPOČET HMOTNOSTI REAKTANTŮ A PRODUKTŮ PŘI CHEMICKÉ REAKCI
CHEMICKÉ VÝPOČTY HMOTNOST REAKTANTŮ A PRODUKTŮ PŘI CHEMICKÉ REAKCI PROJEKT EU PENÍZE ŠKOLÁM OPERAČNÍ PROGRAM VZDĚLÁVÁNÍ PRO KONKURENCESCHOPNOST VÝPOČET HMOTNOSTI REAKTANTŮ A PRODUKTŮ PŘI CHEMICKÉ REAKCI
Ing. Jiří Charvát, Ing. Pavel Kolář Z 13 NOVÉ SMĚRY A PERSPEKTIVY SANACE HORNINOVÉHO PROSTŘEDÍ PO CHEMICKÉ TĚŽBĚ URANU NA LOŽISKU STRÁŽ
 Ing. Jiří Charvát, Ing. Pavel Kolář Z 13 NOVÉ SMĚRY A PERSPEKTIVY SANACE HORNINOVÉHO PROSTŘEDÍ PO CHEMICKÉ TĚŽBĚ URANU NA LOŽISKU STRÁŽ Chemická těžba uranu byla v o. z. TÚU Stráž pod Ralskem provozována
Ing. Jiří Charvát, Ing. Pavel Kolář Z 13 NOVÉ SMĚRY A PERSPEKTIVY SANACE HORNINOVÉHO PROSTŘEDÍ PO CHEMICKÉ TĚŽBĚ URANU NA LOŽISKU STRÁŽ Chemická těžba uranu byla v o. z. TÚU Stráž pod Ralskem provozována
Metody gravimetrické
 Klíčový požadavek - kvantitativní vyloučení stanovované složky z roztoku - málorozpustná sloučenina - SRÁŽECÍ ROVNOVÁHY VYLUČOVACÍ FORMA se převede na (sušení, žíhání) CHEMICKY DEFINOVANÝ PRODUKT - vážitelný
Klíčový požadavek - kvantitativní vyloučení stanovované složky z roztoku - málorozpustná sloučenina - SRÁŽECÍ ROVNOVÁHY VYLUČOVACÍ FORMA se převede na (sušení, žíhání) CHEMICKY DEFINOVANÝ PRODUKT - vážitelný
DUM č. 2 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 2 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 2 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
Tematický blok 2 Zdroje znečišťování ovzduší Chemický průmysl Ing. Miroslav Richter, Ph.D., EUR ING miroslav.richter@ujep.cz
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Tematický blok 2 Zdroje znečišťování ovzduší Chemický průmysl Ing. Miroslav Richter, Ph.D., EUR ING miroslav.richter@ujep.cz
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Tematický blok 2 Zdroje znečišťování ovzduší Chemický průmysl Ing. Miroslav Richter, Ph.D., EUR ING miroslav.richter@ujep.cz
KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení. Ing. Miroslav Richter, PhD.
 KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení Ing. Miroslav Richter, PhD., EUR ING 2014 Materiálové bilance 3.5.1 Do tkaninového filtru vstupuje 10000
KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení Ing. Miroslav Richter, PhD., EUR ING 2014 Materiálové bilance 3.5.1 Do tkaninového filtru vstupuje 10000
Získávání lithia a rubidia z cinvalditových odpadů po těžbě Sn-W rud na Cínovci
 Získávání lithia a rubidia z cinvalditových odpadů po těžbě Sn-W rud na Cínovci doc. Ing. Jitka Jandová, CSc. Ústav kovových materiálů a korozního inženýrství, Vysoká škola chemicko-technologická v Praze
Získávání lithia a rubidia z cinvalditových odpadů po těžbě Sn-W rud na Cínovci doc. Ing. Jitka Jandová, CSc. Ústav kovových materiálů a korozního inženýrství, Vysoká škola chemicko-technologická v Praze
474/2000 Sb. VYHLÁŠKA Ministerstva zemědělství ze dne 13. prosince 2000 o stanovení požadavků na hnojiva
 474/2000 Sb. VYHLÁŠKA Ministerstva zemědělství ze dne 13. prosince 2000 o stanovení požadavků na hnojiva Změna: 401/2004 Sb. Změna: 209/2005 Sb. Ministerstvo zemědělství stanoví podle 3 odst. 5 a 16 písm.
474/2000 Sb. VYHLÁŠKA Ministerstva zemědělství ze dne 13. prosince 2000 o stanovení požadavků na hnojiva Změna: 401/2004 Sb. Změna: 209/2005 Sb. Ministerstvo zemědělství stanoví podle 3 odst. 5 a 16 písm.
5. Nekovy sı ra. 1) Obecná charakteristika nekovů. 2) Síra a její vlastnosti
 5. Nekovy sı ra 1) Obecná charakteristika nekovů 2) Síra a její vlastnosti 1) Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu. Jsou to prvky uspořádané
5. Nekovy sı ra 1) Obecná charakteristika nekovů 2) Síra a její vlastnosti 1) Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu. Jsou to prvky uspořádané
DUM č. 6 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 6 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 6 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
U Ústav procesní a zpracovatelské techniky FS ČVUT. Názvosloví solí kyslíkatých kyselin
 (oxokyselin) Obecný vzorec: K m A n K - vzorec kationtu A - vzorec aniontu m, n - indexy - počty iontů - přirozená čísla Pozn.1 - Indexy m, n rovné 1 se nepíší. Pozn.2 - Jsou -li oba indexy m, n dělitelné
(oxokyselin) Obecný vzorec: K m A n K - vzorec kationtu A - vzorec aniontu m, n - indexy - počty iontů - přirozená čísla Pozn.1 - Indexy m, n rovné 1 se nepíší. Pozn.2 - Jsou -li oba indexy m, n dělitelné
Jednotné pracovní postupy zkoušení krmiv STANOVENÍ OBSAHU VÁPNÍKU MANGANOMETRICKY
 Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU VÁPNÍKU MANGANOMETRICKY 1 Rozsah a účel Tato metoda specifikuje podmínky pro stanovení celkového obsahu vápníku v krmivech, krmných směsích a premixech.
Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU VÁPNÍKU MANGANOMETRICKY 1 Rozsah a účel Tato metoda specifikuje podmínky pro stanovení celkového obsahu vápníku v krmivech, krmných směsích a premixech.
ZÁKLADNÍ CHEMICKÉ VÝPOČTY
 ZÁKLADNÍ CHEMICKÉ VÝPOČTY Látkové množství - vyjadřování množství: jablka pivo chleba uhlí - (téměř každá míra má svojí jednotku) v chemii existuje univerzální veličina pro vyjádření množství látky LÁTKOVÉ
ZÁKLADNÍ CHEMICKÉ VÝPOČTY Látkové množství - vyjadřování množství: jablka pivo chleba uhlí - (téměř každá míra má svojí jednotku) v chemii existuje univerzální veličina pro vyjádření množství látky LÁTKOVÉ
Škola: Střední škola obchodní, České Budějovice, Husova 9. Inovace a zkvalitnění výuky prostřednictvím ICT
 Škola: Střední škola obchodní, České Budějovice, Husova 9 Projekt MŠMT ČR: EU PENÍZE ŠKOLÁM Číslo projektu: Název projektu školy: Šablona III/2: CZ.1.07/1.5.00/34.0536 Výuka s ICT na SŠ obchodní České
Škola: Střední škola obchodní, České Budějovice, Husova 9 Projekt MŠMT ČR: EU PENÍZE ŠKOLÁM Číslo projektu: Název projektu školy: Šablona III/2: CZ.1.07/1.5.00/34.0536 Výuka s ICT na SŠ obchodní České
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ
 SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
Ústřední komise Chemické olympiády. 42. ročník. KRAJSKÉ KOLO Kategorie D. SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut
 Ústřední komise Chemické olympiády 42. ročník 2005 2006 KRAJSKÉ KOLO Kategorie D SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut Institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy
Ústřední komise Chemické olympiády 42. ročník 2005 2006 KRAJSKÉ KOLO Kategorie D SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut Institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy
Sloučeniny dusíku a fosforu
 VY_32_IOVACE_30_BE13.notebook Sloučeniny dusíku a fosforu Temacká oblast : Chemie anorganická chemie Datum vytvoření: 25. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný
VY_32_IOVACE_30_BE13.notebook Sloučeniny dusíku a fosforu Temacká oblast : Chemie anorganická chemie Datum vytvoření: 25. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný
Potravinářské a biochemické technologie
 Potravinářské a biochemické technologie část Technologie cukru P.Kadlec, E. Šárka - PTB-cukr 1 P.Kadlec, E. Šárka - PTB-cukr 2 VÝROBA CUKRU V ČR A VE SVĚTĚ Počátky průmyslové výroby cukru u nás - rok 1831
Potravinářské a biochemické technologie část Technologie cukru P.Kadlec, E. Šárka - PTB-cukr 1 P.Kadlec, E. Šárka - PTB-cukr 2 VÝROBA CUKRU V ČR A VE SVĚTĚ Počátky průmyslové výroby cukru u nás - rok 1831
Elektrotermické procesy
 Elektrotermické procesy Elektrolýza tavenin Výroba Al Elektrické pece Výroba P Výroba CaC 1 Vysokoteplotní procesy, využívající elektrický ohřev (případně v kombinaci s elektrolýzou) Elektrotermické procesy
Elektrotermické procesy Elektrolýza tavenin Výroba Al Elektrické pece Výroba P Výroba CaC 1 Vysokoteplotní procesy, využívající elektrický ohřev (případně v kombinaci s elektrolýzou) Elektrotermické procesy
Dusík a jeho sloučeniny
 Dusík a jeho sloučeniny Mgr. Jana Pertlová Copyright istudium, 2008, http://www.istudium.cz Žádná část této publikace nesmí být publikována a šířena žádným způsobem a v žádné podobě bez výslovného svolení
Dusík a jeho sloučeniny Mgr. Jana Pertlová Copyright istudium, 2008, http://www.istudium.cz Žádná část této publikace nesmí být publikována a šířena žádným způsobem a v žádné podobě bez výslovného svolení
Zplyňování biomasy. Sesuvný generátor. Autotermní zplyňování Autotermní a alotermní zplyňování
 Zplyňování = termochemická přeměna uhlíkatého materiálu v pevném či kapalném skupenství na výhřevný energetický plyn pomocí zplyňovacích médií a tepla. Produktem je plyn obsahující výhřevné složky (H 2,
Zplyňování = termochemická přeměna uhlíkatého materiálu v pevném či kapalném skupenství na výhřevný energetický plyn pomocí zplyňovacích médií a tepla. Produktem je plyn obsahující výhřevné složky (H 2,
16.5.2010 Halogeny 1
 16.5.010 Halogeny 1 16.5.010 Halogeny Prvky VII.A skupiny: F, Cl, Br, I,(At) Obecnávalenčníkonfigurace:ns np 5 Pro plné zaplnění valenční vrstvy potřebují 1 e - - nejčastější sloučeniny s oxidačním číslem
16.5.010 Halogeny 1 16.5.010 Halogeny Prvky VII.A skupiny: F, Cl, Br, I,(At) Obecnávalenčníkonfigurace:ns np 5 Pro plné zaplnění valenční vrstvy potřebují 1 e - - nejčastější sloučeniny s oxidačním číslem
Solné rekordy. Úkol 1a: Na obrázku 1 jsou zobrazeny nejdůležitější soli. Napiš vzorce kyselin, od nichž se tyto soli odvozují.
 Soli nad zlato Dostupné z Metodického portálu www.rvp.cz, ISSN: 1802-4785, financovaného z ESF a státního rozpočtu ČR. Provozováno Výzkumným ústavem pedagogickým v Praze. Solné rekordy Úkol 1a: Na obrázku
Soli nad zlato Dostupné z Metodického portálu www.rvp.cz, ISSN: 1802-4785, financovaného z ESF a státního rozpočtu ČR. Provozováno Výzkumným ústavem pedagogickým v Praze. Solné rekordy Úkol 1a: Na obrázku
Bilan a ce c zák á l k ad a ní pojm j y m aplikace zákonů o zachování čehokoli 10.10.2008 3
 Výpočtový seminář z Procesního inženýrství podzim 2008 Bilance Materiálové a látkové 10.10.2008 1 Tématické okruhy bilance - základní pojmy bilanční schéma způsoby vyjadřování koncentrací a přepočtové
Výpočtový seminář z Procesního inženýrství podzim 2008 Bilance Materiálové a látkové 10.10.2008 1 Tématické okruhy bilance - základní pojmy bilanční schéma způsoby vyjadřování koncentrací a přepočtové
1) BEZKYSLÍKATÉ KYSELINY:
 KYSELINY Jsou to látky, které se ve vodě štěpí na kationty H + a anionty (radikály) kyseliny (např. Cl -, NO 3-, SO 4 2- ). 1) BEZKYSLÍKATÉ KYSELINY: (koncovka -vodíková) Kyselina fluorovod vodíková chlorovod
KYSELINY Jsou to látky, které se ve vodě štěpí na kationty H + a anionty (radikály) kyseliny (např. Cl -, NO 3-, SO 4 2- ). 1) BEZKYSLÍKATÉ KYSELINY: (koncovka -vodíková) Kyselina fluorovod vodíková chlorovod
ZŠ ÚnO, Bratří Čapků 1332
 Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 2 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 2 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ)
 KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ) Úloha 1 Ic), IIa), IIId), IVb) za každé správné přiřazení po 1 bodu; celkem Úloha 2 8 bodů 1. Sodík reaguje s vodou za vzniku hydroxidu sodného a dalšího produktu.
KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ) Úloha 1 Ic), IIa), IIId), IVb) za každé správné přiřazení po 1 bodu; celkem Úloha 2 8 bodů 1. Sodík reaguje s vodou za vzniku hydroxidu sodného a dalšího produktu.
Technologie pro úpravu bazénové vody
 Technologie pro úpravu GHC Invest, s.r.o. Korunovační 6 170 00 Praha 7 info@ghcinvest.cz Příměsi významné pro úpravu Anorganické látky přírodního původu - kationty kovů (Cu +/2+, Fe 2+/3+, Mn 2+, Ca 2+,
Technologie pro úpravu GHC Invest, s.r.o. Korunovační 6 170 00 Praha 7 info@ghcinvest.cz Příměsi významné pro úpravu Anorganické látky přírodního původu - kationty kovů (Cu +/2+, Fe 2+/3+, Mn 2+, Ca 2+,
Typy hnojiv. močovma kyanamid 1.2.2 dusíkaté vápno s 18%N celkový dusík, dusíkjako celkový; kyanamid vápenatý,
 Příloha č. 3 k vyhlášce č. 474/2000 Sb. Typy hnojiv Druh hnojiva: 1. Minerální jednosložková hnojiva a) dusíkatá hnojiva obsah živin typ,formya další požadavky výroby 1.1.1 ledek vápenatý 15%N celkový
Příloha č. 3 k vyhlášce č. 474/2000 Sb. Typy hnojiv Druh hnojiva: 1. Minerální jednosložková hnojiva a) dusíkatá hnojiva obsah živin typ,formya další požadavky výroby 1.1.1 ledek vápenatý 15%N celkový
Základy analýzy potravin Přednáška 1
 ANALÝZA POTRAVIN Význam a využití kontrola jakosti surovin, výrobků jakost výživová jakost technologická jakost hygienická autenticita, identita potravinářských materiálů hodnocení stravy (diety) Analytické
ANALÝZA POTRAVIN Význam a využití kontrola jakosti surovin, výrobků jakost výživová jakost technologická jakost hygienická autenticita, identita potravinářských materiálů hodnocení stravy (diety) Analytické
Modul 02 - Přírodovědné předměty
 Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 - Přírodovědné předměty Hana Gajdušková 12.skupina
Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 - Přírodovědné předměty Hana Gajdušková 12.skupina
PRŮMYSLOVÁ HNOJIVA PESTICIDY
 PRŮMYSLOVÁ HNOJIVA PESTICIDY Rostliny potřebují ke svému růstu a vývoji řadu prvků Nezbytné prvky jsou: C N P K Ca Mg S Fe Stopové prvky, součástí rostlinných enzymů: B Zn Cu Co Mn Mo Hnojiva Směsi pro
PRŮMYSLOVÁ HNOJIVA PESTICIDY Rostliny potřebují ke svému růstu a vývoji řadu prvků Nezbytné prvky jsou: C N P K Ca Mg S Fe Stopové prvky, součástí rostlinných enzymů: B Zn Cu Co Mn Mo Hnojiva Směsi pro
1 mol (ideálního) plynu, zaujímá za normálních podmínek objem 22,4 litru. , Cl 2 , O 2
 10.výpočty z rovnic praktické provádění výpočtů z rovnic K výpočtu chemických rovnic je důležité si shrnout tyto poznatky: Potřebujem znát vyjadřování koncentrací, objemový zlomek, molární zlomek, molární
10.výpočty z rovnic praktické provádění výpočtů z rovnic K výpočtu chemických rovnic je důležité si shrnout tyto poznatky: Potřebujem znát vyjadřování koncentrací, objemový zlomek, molární zlomek, molární
Digitální učební materiály III/ 2- Inovace a zkvalitnění výuky prostřednictvím ICT. VY_32_INOVACE_129_Sloučeniny Na+Ca_ prac_ list
 Název školy Číslo projektu STŘEDNÍ ODBORNÁ ŠKOLA a STŘEDNÍ ODBORNÉ UČILIŠTĚ, Česká Lípa, 28. října 2707, příspěvková organizace CZ.1.07/1.5.00/34.0880 Název projektu Klíčová aktivita Digitální učební materiály
Název školy Číslo projektu STŘEDNÍ ODBORNÁ ŠKOLA a STŘEDNÍ ODBORNÉ UČILIŠTĚ, Česká Lípa, 28. října 2707, příspěvková organizace CZ.1.07/1.5.00/34.0880 Název projektu Klíčová aktivita Digitální učební materiály
Chemie. Mgr. Petra Drápelová Mgr. Jaroslava Vrbková. Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou
 Chemie Mgr. Petra Drápelová Mgr. Jaroslava Vrbková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH ROVNIC VY_32_INOVACE_03_3_18_CH Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH
Chemie Mgr. Petra Drápelová Mgr. Jaroslava Vrbková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH ROVNIC VY_32_INOVACE_03_3_18_CH Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH
Oxidační číslo je rovno náboji, který by atom získal po p idělení všech vazebných elektronových párů atomům s větší elektronegativitou.
 NÁZVOSLOVÍ Oxidační číslo je rovno náboji, který by atom získal po p idělení všech vazebných elektronových párů atomům s větší elektronegativitou. -II +III -II +I O N O H Oxidační čísla se značí ímskými
NÁZVOSLOVÍ Oxidační číslo je rovno náboji, který by atom získal po p idělení všech vazebných elektronových párů atomům s větší elektronegativitou. -II +III -II +I O N O H Oxidační čísla se značí ímskými
1.1 Suroviny síry Průmyslově využitelné suroviny pro zisk síry nebo jejích sloučenin nebo dalších složek obsažených v příslušných minerálech výskyt:
 1. Chemie a technologie sloučenin síry 1.1 Suroviny síry Průmyslově využitelné suroviny pro zisk síry nebo jejích sloučenin nebo dalších složek obsažených v příslušných minerálech výskyt: Elementární síra:
1. Chemie a technologie sloučenin síry 1.1 Suroviny síry Průmyslově využitelné suroviny pro zisk síry nebo jejích sloučenin nebo dalších složek obsažených v příslušných minerálech výskyt: Elementární síra:
Negativní vliv energetického využití biomasy Ing. Marek Baláš, Ph.D.
 Negativní vliv energetického využití biomasy Ing. Marek Baláš, Ph.D. Osnova 2 Legislativa Biomasa druhy složení Emise vznik, množství, vlastnosti, dopad na ŽP a zdraví, opatření CO SO 2 NO x Chlor TZL
Negativní vliv energetického využití biomasy Ing. Marek Baláš, Ph.D. Osnova 2 Legislativa Biomasa druhy složení Emise vznik, množství, vlastnosti, dopad na ŽP a zdraví, opatření CO SO 2 NO x Chlor TZL
Chemické veličiny, vztahy mezi nimi a chemické výpočty
 SBÍRKA ŘEŠENÝCH PŘÍKLADŮ PRO PROJEKT PŘÍRODNÍ VĚDY AKTIVNĚ A INTERAKTIVNĚ CZ.1.07/1.1.24/01.0040 Chemické veličiny, vztahy mezi nimi a chemické výpočty Mgr. Jana Žůrková, 2013, 20 stran Obsah 1. Veličiny
SBÍRKA ŘEŠENÝCH PŘÍKLADŮ PRO PROJEKT PŘÍRODNÍ VĚDY AKTIVNĚ A INTERAKTIVNĚ CZ.1.07/1.1.24/01.0040 Chemické veličiny, vztahy mezi nimi a chemické výpočty Mgr. Jana Žůrková, 2013, 20 stran Obsah 1. Veličiny
Prvky 14. Skupiny (Tetrely)
 Prvky 14. Skupiny (Tetrely) 19.1.2011 p 2 prvky C nekov Si, Ge polokov Sn, Pb kov ns 2 np 2 Na vytvoření kovalentních vazeb ve sloučeninách poskytují 2, nebo 4 elektrony Všechny prvky jsou pevné látky
Prvky 14. Skupiny (Tetrely) 19.1.2011 p 2 prvky C nekov Si, Ge polokov Sn, Pb kov ns 2 np 2 Na vytvoření kovalentních vazeb ve sloučeninách poskytují 2, nebo 4 elektrony Všechny prvky jsou pevné látky
Výroba stavebních hmot
 Výroba stavebních hmot 1.Typy stavebních hmot Pojiva = anorganické hmoty, které mohou vázat kamenivo dohromady (tvrdnou s vodou nebo na vzduchu) hydraulická tvrdnou na vzduchu nebo ve vodě (např. cement)
Výroba stavebních hmot 1.Typy stavebních hmot Pojiva = anorganické hmoty, které mohou vázat kamenivo dohromady (tvrdnou s vodou nebo na vzduchu) hydraulická tvrdnou na vzduchu nebo ve vodě (např. cement)
J. Kubíček FSI Brno 2018
 J. Kubíček FSI Brno 2018 Fosfátování je povrchová úprava, kdy se na povrch povlakovaného kovu vylučují nerozpustné fosforečnany. Povlak vzniká reakcí iontů z pracovní lázně s ionty rozpuštěnými z povrchu
J. Kubíček FSI Brno 2018 Fosfátování je povrchová úprava, kdy se na povrch povlakovaného kovu vylučují nerozpustné fosforečnany. Povlak vzniká reakcí iontů z pracovní lázně s ionty rozpuštěnými z povrchu
Obsah soli v potravinách a její spotřeba ve stravě obyvatelstva ČR. Lucie Grossová, DiS.
 Obsah soli v potravinách a její spotřeba ve stravě obyvatelstva ČR Lucie Grossová, DiS. Charakteristika soli Chlorid sodný (NaCl), běžně označován jako kuchyňská či jedlá sůl, je chemická sloučenina chlóru
Obsah soli v potravinách a její spotřeba ve stravě obyvatelstva ČR Lucie Grossová, DiS. Charakteristika soli Chlorid sodný (NaCl), běžně označován jako kuchyňská či jedlá sůl, je chemická sloučenina chlóru
Jednotné pracovní postupy zkoušení krmiv STANOVENÍ OBSAHU DRASLÍKU, SODÍKU, HOŘČÍKU A VÁPNÍKU METODOU FAAS/FAES
 Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU DRASLÍKU, SODÍKU, HOŘČÍKU A VÁPNÍKU METODOU FAAS/FAES 1 Účel a rozsah Tato metoda umožňuje stanovení draslíku, sodíku, hořčíku a vápníku v premixech
Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU DRASLÍKU, SODÍKU, HOŘČÍKU A VÁPNÍKU METODOU FAAS/FAES 1 Účel a rozsah Tato metoda umožňuje stanovení draslíku, sodíku, hořčíku a vápníku v premixech
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost.
 Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Klíčová aktivita III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Klíčová aktivita III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
Speciální ZŠ a MŠ Adresa. U Červeného kostela 110, TEPLICE Číslo op. programu CZ Název op. programu
 Subjekt Speciální ZŠ a MŠ Adresa U Červeného kostela 110, 415 01 TEPLICE Číslo op. programu CZ. 1. 07 Název op. programu OP Vzdělávání pro konkurenceschopnost Číslo výzvy 21 Název výzvy Žádost o fin. podporu
Subjekt Speciální ZŠ a MŠ Adresa U Červeného kostela 110, 415 01 TEPLICE Číslo op. programu CZ. 1. 07 Název op. programu OP Vzdělávání pro konkurenceschopnost Číslo výzvy 21 Název výzvy Žádost o fin. podporu
DUM VY_52_INOVACE_12CH01
 Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH01 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH01 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
Předmět: CHEMIE Ročník: 8. ŠVP Základní škola Brno, Hroznová 1. Výstupy předmětu
 Chemie ukázka chemického skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce práce s dostupnými a běžně používanými látkami (směsmi). Na základě piktogramů žák posoudí nebezpečnost
Chemie ukázka chemického skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce práce s dostupnými a běžně používanými látkami (směsmi). Na základě piktogramů žák posoudí nebezpečnost
11. Zásobení rostlin živinami a korekce nedostatku
 11. Zásobení rostlin živinami a korekce nedostatku = kapitola,,jak poznáme nedostatek které živiny a jak a čím hnojíme - Diagnostika nedostatku: o Vizuální o Chemická analýza biomasy o Histologické a biochemické
11. Zásobení rostlin živinami a korekce nedostatku = kapitola,,jak poznáme nedostatek které živiny a jak a čím hnojíme - Diagnostika nedostatku: o Vizuální o Chemická analýza biomasy o Histologické a biochemické
Anorganické sloučeniny opakování Smart Board
 Anorganické sloučeniny opakování Smart Board VY_52_INOVACE_210 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 8.,9. Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
Anorganické sloučeniny opakování Smart Board VY_52_INOVACE_210 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 8.,9. Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
Kovy II. hlavní skupiny (alkalických zemin + Be,, Mg)
 Kovy II. hlavní skupiny (alkalických zemin + Be,, Mg) I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N O F Ne 3 Na Mg (n-1) d Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co
Kovy II. hlavní skupiny (alkalických zemin + Be,, Mg) I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N O F Ne 3 Na Mg (n-1) d Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co
Chemie - 1. ročník. očekávané výstupy ŠVP. Žák:
 očekávané výstupy RVP témata / učivo Chemie - 1. ročník Žák: očekávané výstupy ŠVP přesahy, vazby, mezipředmětové vztahy průřezová témata 1.1., 1.2., 1.3., 7.3. 1. Chemie a její význam charakteristika
očekávané výstupy RVP témata / učivo Chemie - 1. ročník Žák: očekávané výstupy ŠVP přesahy, vazby, mezipředmětové vztahy průřezová témata 1.1., 1.2., 1.3., 7.3. 1. Chemie a její význam charakteristika
2 Cu + S Cu 2 S n(cu)=2mol n(cu 2 S)=1mol M(Cu)=63,5 g mol M(Cu 2 S)=159 g mol
 n... látkové množství látky (mol) M... molární hmotnost látky (g/mol) m... hmotnost látky (m) III. Výpočty z chemických rovnic chemické rovnice umožňují vypočítat množství jednotlivých látek, které se
n... látkové množství látky (mol) M... molární hmotnost látky (g/mol) m... hmotnost látky (m) III. Výpočty z chemických rovnic chemické rovnice umožňují vypočítat množství jednotlivých látek, které se
Ukázky z pracovních listů 1) Vyber, který ion je: a) ve vodném roztoku barevný b) nejstabilnější c) nejlépe oxidovatelný
 Ukázky z pracovních listů 1) Vyber, který ion je: a) ve vodném roztoku barevný b) nejstabilnější c) nejlépe oxidovatelný Fe 3+ Fe 3+ Fe 3+ Fe 2+ Fe 6+ Fe 2+ Fe 6+ Fe 2+ Fe 6+ 2) Vyber správné o rtuti:
Ukázky z pracovních listů 1) Vyber, který ion je: a) ve vodném roztoku barevný b) nejstabilnější c) nejlépe oxidovatelný Fe 3+ Fe 3+ Fe 3+ Fe 2+ Fe 6+ Fe 2+ Fe 6+ Fe 2+ Fe 6+ 2) Vyber správné o rtuti:
Kyselina dusičná. jedna z nejdůležitějších chemikálií
 Kyselina dusičná jedna z nejdůležitějších chemikálií Výroba: minulost - surovinou pro průmyslovou výrobu dusičnan sodný (ledek sodný, guano) současnost - katalytické spalování amoniaku (první výrobní jednotka
Kyselina dusičná jedna z nejdůležitějších chemikálií Výroba: minulost - surovinou pro průmyslovou výrobu dusičnan sodný (ledek sodný, guano) současnost - katalytické spalování amoniaku (první výrobní jednotka
DUM č. 19 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 19 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 19 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
Příklady úspěšných projektů čistší produkce (Cleaner Production) Výroba: kyseliny sírové mikrokorundu
 Příklady úspěšných projektů čistší produkce (Cleaner Production) Výroba: kyseliny sírové mikrokorundu Ing. Miroslav Richter, PhD., EUR ING Fakulta životního prostředí Univerzity J.E.Purkyně v Ústí n.l.
Příklady úspěšných projektů čistší produkce (Cleaner Production) Výroba: kyseliny sírové mikrokorundu Ing. Miroslav Richter, PhD., EUR ING Fakulta životního prostředí Univerzity J.E.Purkyně v Ústí n.l.
Otázky a jejich autorské řešení
 Otázky a jejich autorské řešení Otázky: 1a Co jsou to amfoterní látky? a. látky krystalizující v krychlové soustavě b. látky beztvaré c. látky, které se chovají jako kyselina nebo jako zásada podle podmínek
Otázky a jejich autorské řešení Otázky: 1a Co jsou to amfoterní látky? a. látky krystalizující v krychlové soustavě b. látky beztvaré c. látky, které se chovají jako kyselina nebo jako zásada podle podmínek
Složení soustav (roztoky, koncentrace látkového množství)
 VZOROVÉ PŘÍKLADY Z CHEMIE A DOPORUČENÁ LITERATURA pro přípravu k přijímací zkoušce studijnímu oboru Nanotechnologie na VŠB TU Ostrava Doporučená literatura z chemie: Prakticky jakákoliv celostátní učebnice
VZOROVÉ PŘÍKLADY Z CHEMIE A DOPORUČENÁ LITERATURA pro přípravu k přijímací zkoušce studijnímu oboru Nanotechnologie na VŠB TU Ostrava Doporučená literatura z chemie: Prakticky jakákoliv celostátní učebnice
Ústřední komise Chemické olympiády. 52. ročník 2015/2016. ŠKOLNÍ KOLO kategorie D. časová náročnost 60 min ŘEŠENÍ ŠKOLNÍHO TESTU
 Ústřední komise Chemické olympiády 52. ročník 2015/2016 ŠKOLNÍ KOLO kategorie D časová náročnost 60 min ŘEŠENÍ ŠKOLNÍHO TESTU KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ) Vaše odpovědi a výsledky zapisujte do
Ústřední komise Chemické olympiády 52. ročník 2015/2016 ŠKOLNÍ KOLO kategorie D časová náročnost 60 min ŘEŠENÍ ŠKOLNÍHO TESTU KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ) Vaše odpovědi a výsledky zapisujte do
Jednotné pracovní postupy ÚKZÚZ Zkoušení hnojiv 2. vydání Brno 2015
 Číslo Název postupu postupu ÚKZÚZ 20001.1 Stanovení obsahu vlhkosti gravimetricky a dopočet sušiny Zdroj 20010.1 Stanovení obsahu popela a spalitelných látek gravimetricky 20020.1 Stanovení obsahu chloridů
Číslo Název postupu postupu ÚKZÚZ 20001.1 Stanovení obsahu vlhkosti gravimetricky a dopočet sušiny Zdroj 20010.1 Stanovení obsahu popela a spalitelných látek gravimetricky 20020.1 Stanovení obsahu chloridů
DIGITÁLNÍ UČEBNÍ MATERIÁL
 DIGITÁLNÍ UČEBNÍ MATERIÁL Číslo projektu CZ.1.07/1.5.00/34.0763 Název školy SOUpotravinářské, Jílové u Prahy, Šenflukova 220 Název materiálu INOVACE_32_ZPV-CH 1/04/02/17 Autor Obor; předmět, ročník Tematická
DIGITÁLNÍ UČEBNÍ MATERIÁL Číslo projektu CZ.1.07/1.5.00/34.0763 Název školy SOUpotravinářské, Jílové u Prahy, Šenflukova 220 Název materiálu INOVACE_32_ZPV-CH 1/04/02/17 Autor Obor; předmět, ročník Tematická
