Chemie a technologie sloučenin dusíku Výskyt dusíku a jeho sloučenin
|
|
|
- Dagmar Doležalová
- před 9 lety
- Počet zobrazení:
Transkript
1 Chemie a technologie sloučenin dusíku 1.0. Výskyt dusíku a jeho sloučenin V atmosféře je 79 % obj. dusíku. Zároveň se v atmosféře vyskytují stopová množství oxidů dusíku souhrnně označovaných jako NO x jedná se o oxid dusný N 2 O, dusnatý NO a dusičitý NO 2. Pocházejí za spalovacích procesů a zároveň vznikají v zóně blesků při bouřkách přímou syntézou ze vzdušného dusíku a kyslíku. N 2 + O 2 2 NO NO + ½ O 2 NO 2 V půdě a vodách se vyskytují ionty dusitanové NO 2 - a dusičnanové NO 3 - vznikající nitrifikací amonných iontů působením baktérií a depozicí kyselých dešťů. Část dusičnanových iontů v půdě také vzniká z půdního vzduchu syntézou z kyslíku a dusíku působením azobakteru žijícího na kořenech motýlokvětých rostlin N O 2 2 NO e - Amonné NH + 4 přítomné v půdě a ve vodách pocházející z rozkladu bílkovin, aminokyselin a hydrolýzy močoviny. Vázaný dusík je přítomen v uhlí a ropě ve formě heterocyklických sloučenin. Jediným značně omezeným zdrojem vázaného dusíku byl přírodní chilský ledek obsahující jako základní složku NaNO 3. Zavedením průmyslové karbonizace uhlí při výrobě svítiplynu a koksu byl z absorpčních pracích vod při čištění surového plynu získáván desorpcí amoniak VÝROBA AMONIAKU Výrobu amoniaku můžeme rozdělit do několika po sobě následujících kroků, a to na přípravu syntézního plynu, kompresi syntézního plynu, vlastní syntézu amoniaku, 2.1 Příprava syntézního plynu Syntézní plyn je směsí vodíku a dusíku. Připravuje se částečnou oxidací látky obsahující uhlík (zejména zemní plyn, ropné frakce nebo uhlí). Jestliže kyslík potřebný k oxidaci je dodán ve formě vodní páry a reakce probíhá na katalyzátoru, je proces nazýván parní reforming. Jestliže je kyslík dodáván vzduchem a není užit katalyzátor, proces se nazývá částečná (parciální) oxidace. Parní reforming je vhodný zejména v případě, kdy vstupní surovinou je zemní plyn, tj. metan, nebo nafta. Proces je založen na reakcích CH 4 + H 2 O CO + 3H 2
2 a CO + H 2 O CO 2 + H 2 a jeho výsledkem je směs plynů H 2, CO, CO 2, H 2 O a CH 4. Z metanu jsou nejprve odstraněny sloučeniny obsahující síru, protože by v dalším působily jako katalytické jedy. Plyn je smíšen s 1 až 2% vodíku, stlačen na 2 MPa a zahřát na 350 až 400 C. Sloučeniny síry jsou tak hydrogenovány a následně absorbovány na ZnO. Odsířený plyn je smíšen s 1 až 2% vodíku, stlačen na 2 MPa a zahřát na 350 až 400 C. Sloučeniny síry jsou tak hydrogenovány a následně absorbovány na ZnO. Odsířený plyn je potom smíšen s přebytkem páry, předehřát na 1000 C, stlačen na 4 MPa a v reaktoru naplněném niklovým katalyzátorem proběhne první reakce, která je endotermní. Plyn, který po průchodu reaktorem obsahuje kolem 10 až 30% nezreagovaného metanu se smísí s takovým množstvím předehřátého vzduchu, aby výsledná směs obsahovala stechiometrický poměr dusíku a vodíku. Kyslík dodaný do směsi se odstraní spálením části plynné směsi v hořáku. Teplota plynu dosáhne cca 1200 C. Horký plyn postupuje potom do dalšího reaktoru obsahujícího katalyzátor, ve kterém konverze metanu proběhne téměř úplně. Ve směsi opouštějící reaktor zůstane maximálně 0.3 % CH 4. Částečná oxidace je založena na současném průběhu exotermní reakce a endotermní reakce C + 1/2 O 2 CO C + H 2 O CO + H 2 Provedení je takové, že uhelný prach smíšený s parou a vzduchem je v hořácích částečně spálen. Teplota dosáhne cca 1500 C, kdy začne probíhat i druhá reakce. Podobně probíhá parciální oxidace těžkých mazutových olejů (TMO). Plyn po parním reformingu nebo částečné oxidaci obsahuje 10 až 50% CO, který je v syntéze NH 3 nežádoucí a je třeba jej odstranit konverzí s vodní párou. Plyn smíšený s vodní parou reaguje na katalyzátoru CO + H 2 O CO 2 + H 2 Reakce je vedena dvoustupňově. Po 1. stupni, ve kterém je použit Fe-Cr katalyzátor a teplota 350 C, zůstane ještě kolem 3% nezreagovaného CO. Proto plyn postupuje do druhého stupně, kde na Cu-Zn katalyzátoru při 200 C zreaguje téměř veškerý CO, takže ve vystupující směsi obsah CO nepřesahuje 0.2 obj.%. Syntézní plyn nyní obsahuje značné množství CO 2, které je nutno odstranit. To se provede vypráním v protiproudé koloně, kde CO 2 je za tlaku absorbován v horkém roztoku K 2 CO 3 nebo v trietanolaminu. Rozpouštědlo je mimo kolonu regenerováno snížením tlaku a zvýšením teploty a použito znovu jako nástřik na absorpční kolonu. K 2 CO 3 + CO 2 + H 2 O 2 KHCO 3 V posledním stupni čištění syntézního plynu je třeba odstranit zbytková množství CO, CO 2, O 2 a H 2 O. To se nejjednodušeji provede tzv. metanizací na Ni katalyzátoru při 300 C a tlaku 3 MPa, kdy proběhne reakce CO + 3 H 2 CH 4 + H 2 O
3 CO H 2 CH H 2 O Plyn je následně ochlazen a protiproudně vypírán kapalným dusíkem při -190 C a tlaku 8 MPa. Takto vyčištěný syntézní plyn lze již použít na syntézu amoniaku. 2.2 Syntéza amoniaku Syntézní plyn je připravován vždy při nižším tlaku než při jakém je vedena syntéza. Proto je třeba vyčištěný plyn zkomprimovat. V zásadě dělíme syntézy amoniaku podle tlaku užitého při syntéze na postupy: nízkotlaké (10-30 MPa), středotlaké (kolem 50 MPa), vysokotlaké (100 MPa). Nově budované jednotky jsou vesměs nízkotlaké. Pro představu o komprimovaných množstvích plynu - na výrobu 1000 t NH 3 /den je třeba stlačit kolem m 3 plynu/hod. Rovnováha reakce popisující syntézu amoniaku z prvků N H 2 2 NH 3 je výrazně posunuta doprava jen při velmi nízkých teplotách a velmi vysokých tlacích. Katalyzátor však umožní dosáhnout přijatelných výtěžků i při 350 C. Za těchto podmínek je stupeň konverze syntézního plynu po průchodu reaktorem kolem 25%. Proto je po průchodu plynu reaktorem vzniklý NH 3 z reakční směsi izolován, je přidán nový syntézní plyn a opakuje se průchod reaktorem. V syntézním okruhu se však hromadí inertní plyny, zejména He a Ar, a aby jejich obsah byl udržován na jisté konstantní hladině, musí být část plynu ze syntézního okruhu pravidelně odtahována Reaktor, kde probíhá vlastní syntéza na katalyzátoru, musí být konstruován tak, aby bylo možno odvést značné reakční teplo a udržet teplotu plynu kolem 400 C. Odvodu reakčního tepla se dosáhne buď nepřímým nebo přímým chlazením reaktoru VÝROBA HLAVNÍCH AMONNÝCH SLOUČENIN Mezi průmyslově důležité amonné sloučeniny řadíme NH 4 H 2 PO 4, (NH 4 ) 2 HPO 4, NH 4 Cl, NH 4 NO 3 a (NH 4 ) 2 SO 4. Výroba chloridu amonného obvykle navazuje na výrobu sody Solvayovým postupem. 3.1 Dusičnan amonný Dusičnan amonný, nazývaný také ledek amonný, je produkován v množství kolem 20 mil. t ročně. Použití nachází především jako dusíkaté hnojivo, které kryje přibližně 25% světové spotřeby dusíku a dále při výrobě průmyslových trhavin. NH 4 NO 3 je bílá krystalická látka, která je hygroskopická, tzn. při styku s atmosférou přibírá vlhkost. Tuhá fáze se může vyskytovat v pěti strukturních modifikací stálých v různých teplotních intervalech. Ve vodě je NH 4 NO 3 velmi dobře rozpustný. 50 až 70% vodný roztok NH 4 NO 3 ochotně absorbuje amoniak a proto je často používán k vypírání NH 3 z plynů.
4 Za normálních podmínek je tuhý NH 4 NO 3 stálý. Podléhá však termickému rozkladu, jehož mechanismus je závislý na teplotě. Při 200 C probíhá rozklad podle rovnice NH 4 NO 3 N 2 O + 2 H 2 O zatímco nad 230 C podle rovnice Při detonaci je rozkladná reakce 4 NH 4 NO 3 3 N NO H 2 O NH 4 NO 3 N 2 + 1/2O 2 + 2H 2 O Rozklad je katalyzován H 3 O + ionty, chloridy a těžkými kovy. NH 4 NO 3 se vyrábí neutralizací 50 až 60% HNO 3 plynným amoniakem. Při neutralizaci se uvolní značné množství tepla, které se využije k odpaření vody z reakční směsi. Neutralizace se vede za normálního nebo zvýšeného tlaku. Při procesu za normálního tlaku jsou HNO 3 a NH 3 současně uváděny do difusoru reaktoru, viz. obr Ve vnějším mezikruží reaktoru roztok prudce vře, zatímco v difusoru je var potlačen. Roztok se varem odpařuje, takže výsledná koncentrace odváděného roztoku (taveniny) je 95 až 97%. Při neutralizaci je třeba udržovat konstantní ph roztoku. Při tlakové neutralizaci jsou předehřátá HNO 3 a NH 3 rozstřikovány do reaktoru, v němž je udržován tlak 0.5 MPa a teplota 170 až 180 C. V reaktoru je umístěn tepelný výměník, který ochlazuje reakční směs a současně vyrábí páru. Roztok z reaktoru o koncentraci 75% je dále zahuštěn na filmové odparce na koncentraci 95 až 97%. Tavenina NH 4 NO 3 z odparky je uvedena do vakua a tím se obsah vody sníží pod 0.5%. Téměř bezvodá tavenina se zpracuje buď v krystalizátoru za vzniku drobných krystalků, na chladicím pásu za vzniku šupinek, na granulačním talíři za vzniku kuliček o velikosti 7 až 12 mm, nebo se tavenina tzv.priluje. Prilování je proces, kde se tavenina rozstřikuje do prázdné věže o výšce až 70 m. Proti padajícím kapkám taveniny postupuje studený vzduch, který taveninu ochladí natolik, že na dno věže dopadají tuhé, ale stále ještě teplé, kuličky. Velikost kuliček je určena velikostí kapek, na které se tavenina rozstřikuje. Pokud je prilována tavenina s obsahem cca 5% vody, dostaneme vlhké kuličky, které po vysušení jsou značně porézní. Dusičnan amonný byl považován za bezpečnou anorganickou látku až do doby kdy došlo k výbuchu skladiště v Oppau a dvou lodí dopravujících dusičnan amonný. Tuhý NH 4 NO 3 a jeho horké koncentrované roztoky mohou být přivedeny k výbuchu účinkem rázové vlny, zejména obsahuje-li dusičnan více jak 0.4% organické látky. Porézní kuličky dusičnanu napuštěné 6% nafty představují tzv. bezpečnostní trhavinu používanou zejména při důlních pracích především proto, že teplota výbuchu je natolik nízká, že nedojde k zážehu eventuelně přítomných důlních plynů. Pro tyto vlastnosti musí být NH 4 NO 3 používaný jako hnojivo deflegmován přídavkem anorganické inertní sloučeniny jako je: vápenec - CaCO 3 (ledek amonný s vápencem LAV) dolomit CaCO3.MgCO 3 (ledek amonný s dolomitem LAD) magnezit MgCO 3 (ledek amonný s magnezitem LAM) Směs obsahující méně než 80% NH 4 NO 3, pod 0.4 % organických látek a nejméně 18% CaCO 3 je nevýbušná, tzn. nelze ji přivést k výbuchu rázovou vlnou a ani jinou iniciací.
5 DAM 390 je průmyslově vyráběné dusíkaté kapalné hnojivo. Jedná se o vodný roztok dusičnanu amonného s přídavkem močoviny.obsahuje 390 g N/l. 3.2 Síran amonný Síran amonný nachází použití především jako hnojivo zejména pro rýži, čaj a gumovníky. Jeho význam jako hnojiva však neustále klesá a dnes představuje jen kolem 6% celkové spotřeby dusíku pro hnojení. V průmyslu je síran amonný používán k výrobě peroxosíranů, do protihořlavých přípravků, hasicích prášků, v textilním a sklářském průmyslu. Spotřeby síranu amonného se pohybuje kolem 4 mil.t/rok. Síran amonný je bílá krystalická látka, která se za atmosférického tlaku při tavení rozkládá na NH 3 a NH 4 HSO 4. Do 80 C je však tlak NH 3 nad tuhou fází prakticky nulový. Nad 300 C se síran amonný rozkládá na N 2, SO 2, SO 3, H 2 O a NH 3. Síran amonný se vyrábí buď neutralizací kyseliny sírové amoniakem nebo reakcí sádry s amoniakem a CO 2 ve vodné suspenzi. Při neutralizaci kyseliny sírové amoniakem se uvolní tolik tepla, že při použití kyseliny o koncentraci nejméně 70% se veškerá voda z reakční směsi tímto teplem odpaří. Reakce je vedena v tzv. saturátorech. Odpařováním vody v saturátoru vznikají krystaly síranu, které sedimentují ke dnu odkud jsou odtahovány jako krystalová suspenze na odstředivku. Matečný roztok z odstředivky je vracen do saturátoru. V místech nedostatku kyseliny sírové se síran amonný vyrábí reakcí sádrovce s NH 3 a CO 2 ve vodné suspenzi CaSO 4.2H 2 O + NH 3 + CO 2 + H 2 O (NH 4 ) 2 SO 4 + CaCO H 2 O Do suspenze jemně rozemletého sádrovce se uvádí NH 3 a CO 2 v kaskádě míchaných reaktorů. Suspenze z posledního reaktoru natéká např. na rotační filtr, kde se oddělí tuhý CaCO 3 a matečný roztok se zahustí ke krystalizaci v odparce. Krystaly jsou z krystalové kaše odebírané z odparky odtředěny a vysušeny. Síran amonný také odpadá při výrobě některých organických komodit, jako akrylonitril, metylmetakrylát a zejména kaprolaktam, který slouží k výrobě nylonu. Ve vyspělých zemích se proto síran amonný většinou nevyrábí, ale získává se z uvedených výrob Fosforečnany amonné Neutralizací kyseliny fosforečné amoniakem postupně dostaneme dihydrogenfosforečnan amonný (MAF) H 3 PO 4 + NH 3 NH 4 H 2 PO 4 hydrogenforforečnan amonný (DAF) H 3 PO NH 3 (NH 4 ) 2 HPO 4 a fosforečnan amonný (TAF) H 3 PO NH 3 (NH 4 ) 3 PO 4 TAF není stabilní nad 20 C a proto není použitelný jako hnojivo. MAF a DAF jako hnojivo jsou používány buď jako takové v tuhé nebo kapalné formě anebo ve směsi s jinými hnojivy. Pro hnojiva se obě sloučeniny vyrábí z nečištěné extrakční kyseliny fosforečné v granulované nebo práškové formě. Pro jiná použití se sloučeniny izolují krystalizací.
6 MAF se vyrábí uváděním amoniaku do kyseliny fosforečné o minimální koncentraci 42% P 2 O 5 v míchaném reaktoru za atmosférického tlaku. Vzniklá suspenze krystalů MAF a DAF o celkovém molárním poměru N/P 1.4 se převede do mixéru, kde se přídavkem amoniaku upraví molární poměr na 1. Vlivem reakčního a krystalizačního tepla se většina vody odpaří, tuhý produkt se sítuje, nadsítný podíl se v drtiči rozmělní a vrací zpět na síto. Jiný způsob výroby spočívá v neutralizaci H 3 PO 4 (45-55 % P 2 O 5 ) za tlaku tak, aby výsledný molární poměr N/P = 1. Výsledný roztok je vysušen v rozprašovací sušárně za vzniku kuliček obsahující 6 až 8% vlhkosti, viz obr DAF má jako hnojivo podstatně větší význam než MAF a je tudíž vyráběn v 5x větším množství než MAF. Amoniak reaguje s kyselinou v neutralizátoru tak, aby molární poměr N/P = 1.4. Reakční teplo uvede suspenzi k varu a část vody se odpaří. Horká suspenze s obsahem vody 20% je nastřikována do granulátoru na fluidní lože recyklovaného DAF a současně do spodu lože je uváděn amoniak v takovém množství, aby výsledný poměr N/P dosáhl 2. Reakčním teplem se odpaří další voda. Granule jsou dále sušeny, sítovány a ochlazeny. Nadsítný podíl je vracen přes drtič do fluidního lože. 4. Výroba kyseliny dusičné Kyselina dusičná (KD) má vedle čpavku klíčové postavení v chemii dusíku. Její spotřeba postupně stoupala s rozvojem zpracovatelských odvětví. Současná světová produkce KD přesahuje 40 mil. tun/rok v přepočtu na 100 %-ní kyselinu. Rozdělení spotřeby kyseliny dusičné ve světě: - 75 % dusičnan amonný (z toho 85 % průmyslová hnojiva, 15 % výbušniny), - 10 % výroba vláken a plastů na bázi kyseliny adipové, - 10 % nitrované organické sloučeniny (trhaviny, výroba barviv a laků), - 5 % povrchové úpravy kovů, hlavně vysoce legovaných ocelí. Podobná struktura spotřeby KD je i v ČR, kde je vyráběna pouze v závodech Lovochemie, a.s. Lovosice, VCHZ, a.s. Parbubice a Moravských chemických závodech, a.s. Ostrava. Historický vývoj výrobních postupů Rozklad chilského ledku kyselinou sírovou je nejstarším výrobním postupem zavedeným do průmyslové praxe ve druhé polovině 19. stol., zvládnutím dále uvedených syntéz se přestal v průmyslu používat: NaNO 3 + H 2 SO 4 HNO 3 + NaHSO 4 Rozklad byl prováděn kyselinou sírovou s koncentrací % při teplotách C. Dusičnan sodný a kyselina sírová musely být v uvedeném molárním poměru 1 : 1, aby nevznikal síran sodný - přebytek kyseliny sírové způsobuje vysoké zahřívání reakční směsi až na teploty kolem 400 o C a rozklad kyseliny dusičné. Výtěžky kyseliny dusičné i přesto byly nízké. Z tohoto důvodu, společně s vysokou cenou chilského ledku, byla cena vyrobené KD vysoká. S ohledem na strategický význam KD pro národní ekonomiky a obranyschopnost států (viz. použití) byly hledány technologicky schůdné výrobní postupy nezávislé na dovozu chilského ledku. V roce 1905 byl u firmy Norsk Hydro zaveden tzv. obloukový postup výroby kyseliny dusičné. Jeho autory byli Kristian Birkeland a Samuel Eyde. Klíčovou technologickou operací výroby KD je příprava oxidu dusnatého: O 2 + N 2 2 NO H o 298 = + 180,58 kj
7 Syntéza byla realizována přímým slučováním vzdušného kyslíku a dusíku v elektrickém oblouku střídavého proudu v magnetickém poli za teploty až C. Výtěžnost oxidu dusnatého byla velmi nízká, jeho koncentrace za obloukovou pecí se pohybovala mezi 1,5-2,0 obj.% NO. Důležitou podmínkou dosažení této koncentrace bylo prudké ochlazení směsi plynů na teploty pod 1000 o C, aby nedošlo ke zpětnému rozkladu NO na výchozí složky. Výroba oxidu dusnatého a dále kyseliny dusičné tímto postupem byla vysoce náročná na spotřebu elektřiny. Nároky na objem reakčních prostor při práci s málo koncentrovanými nitrosními plyny (směs oxidů dusnatého a dusičitého) v dalších fázích výroby byly značné. Oxidaci oxidu dusnatého na oxid dusičitý a jeho absorpci ve vodě vystihují následující chemické rovnice: 2 NO + O 2 2 NO 2 H o 291 = -112,6 kj 2 NO 2 N 2 O 4 H = -56,9 kj NO + NO 2 N 2 O 3 H = -40,2 kj N 2 O 3 + H 2 O 2 HNO 2 H = -55,68 kj 2 NO 2 + H 2 O HNO 3 + HNO 2 H o 291 = -116,1 kj 3 HNO 2 HNO NO + H 2 O H = +75,9 kj Oxidace NO a dimerizace NO 2 probíhají velmi rychle při nízkých teplotách. Totéž platí o absorpci oxidů dusíku ve vodě, resp. zředěné kyselině dusičné. Navíc většina uvedených chemických reakcí je exotermních a složky systému se reakcemi zahřívají. Proto je nezbytné intenzivní chlazení celého oxidačně absorpčního systému vodou. Chlazení je zajištěno vodou cirkulující trubkovými výměníky vloženými v oxidačně absorpčních věžích. Oxidačně absorpční systémy výroben kyseliny dusičné je nutné trvale chladit na teploty nižší než 50 o C. Jelikož při oxidaci dle dříve uvedených chemických reakcích dochází ke snižování objemu reakční směsi, je z hlediska termodynamiky (reakční rovnováhy) i kinetiky procesu (reakčních rychlostí) významný parciální tlak reagujících složek. Je výhodné pracovat při oxidaci a absorpci za zvýšeného tlaku. Termický způsob je analogií obloukového způsobu byl termický způsob výroby oxidu dusnatého založený na spalování zemního plynu v přebytku vzduchu: CH O 2 CO H 2 O N 2 + O 2 2 NO Uvedené reakce probíhají při teplotách 2100 o C. Koncentrace NO za spalovací pecí se pohybovala od 1,5-2,0 % obj. Účinnost přeměny dusíku na oxid dusnatý se tedy ani u termického postupu díky termodynamickým podmínkám nezměnila. Vznikající NO byl po ochlazení adsorbován na silikagelu a oxidován vzdušným kyslíkem na NO 2. Desorpcí po snížení tlaku byly získány nitrosní plyny o cca 4x vyšší koncentraci, než byla za spalovací pecí. Absorpce a další oxidace NO na NO 2 je popsána stechiometrickými rovnicemi v b Termický postup byl realizován v USA firmou Wisconsin Alumini Research Fundation mezi válkami. Z důvodu vysoké energetické náročnosti a nízké účinnosti se rovněž neujal a byl zcela nahrazen katalytickou oxidací čpavku. Výroba NO katalytickou oxidací čpavku - je v současnosti jedinou průmyslově používanou technologií výroby kyseliny dusičné. Katalytickou výrobu NO ze čpavku vystihuje rovnice: 4 NH O 2 4 NO + 6 H 2 O H o 291 = - 907,28 kj
8 Vedlejšími reakcemi může vznikat N 2 a N 2 O. Vedle doby styku katalyzátoru s reakční směsí se uplatňuje také jeho chemické složení. Nejlépe se v tomto směru osvědčila platina se 7,5-10 % rhodia. Katalyzátor je vyráběn ve formě jemné sítoviny s průměrem drátků 0,05-0,09 mm a s ok/cm 2. V kontaktním reaktoru je oxidován - spalován čpavek ve směsi se vzduchem. Vzduch před vstupem do přípravy směsi se čpavkem je vícestupňovou filtrací odprašován zpravidla je používána kombinace několika typů filtračních materiálů např. netkané textilie, papír a keramické svíčky. Tím je zaručena vysoká čistota zpracovávaného vzduchu a dlouhodobě vysoká aktivita katalyzátoru, jehož katalyticky aktivní povrch je minimálně znečišťován prachem. Z takto vyčištěného vzduchu a rovněž filtrovaného plynného čpavku je připravována směs. V katalytickém reaktoru je zpracovávána směs vzduchu se čpavkem těsně pod mezí výbušnosti, t.j. pod 12 % obj. čpavku. Tímto je omezena dosažitelná koncentrace nitrozních plynů za kontaktním reaktorem. Jedná se o technologicky náročnou operaci, jejíž bezpečný průběh je zajištěn vysokým stupněm automatizace přípravy reakční směsi. Analyzátory obsahu čpavku v připravované směsi se vzduchem přímo blokují přívod čpavku do směšovače pomocí rychlouzavíracích armatur. Za atmosférického tlaku bývají v kontaktním reaktoru těsně nad sebou zpravidla 3 síta o průměru mm. Pokud se tlak při spalování zvyšuje, roste počet sít až na 20 při tlaku 1,5 MPa. Úměrně tomu se ale zvyšují ztráty platiny na 1 t vyrobené HNO 3. Filtrací nitrosních plynů za katalytickými síty na vláknitých skleněných nebo keramických rohožích jsou ztráty platiny snižovány. Při katalytické oxidaci amoniaku vzduchem za atmosférického tlaku se pracuje při teplotách o C, za zvýšeného tlaku při teplotách o C. Při tlakovém spalování je vyčištěný vzduch nejprve stlačen turbokompresorem na provozní tlak a pak je teprve smíchán se čpavkem. Důvodem je právě výbušnost směsi, která by mohla způsobit v případě poruchy a iniciace výbuchu poškození nebo zničení turbokompresoru. Stupeň konverze čpavku na oxid dusnatý se při atmosférickém spalování pohybuje do 98,0 %, při tlakovém spalování bývá do 96%. Doba kontaktu reakční směsi s katalyzátorem je vždy pod 0,001 sec. Za těchto podmínek probíhá katalytická oxidace čpavku vzduchem téměř selektivně za vzniku oxidu dusnatého s minimální tvorbou dusíku a oxidu dusného. Při spouštění katalytického reaktoru musí být platinový katalyzátor nahřát na provozní teplotu pomocným vodíkovým hořákem. Podle pracovního tlaku jsou rozlišovány následující typy výroben kyseliny dusičné: atmosférické - spalování i oxidačně-absorpční systém pracují za atmosférického tlaku (nyní se již nepoužívají), kombinované - spalování probíhá za tlaku atmosférického, oxidace s absorpcí za tlaku zvýšeného na cca 0,35 MPa, dvoutlaké - spalování probíhá za nižšího přetlaku než oxidace s absorpcí, tlakové - rovnotlaké - nízko (do 0,4 MPa), středo (do 0,8 MPa) a vysokotlaké (do 1,2 MPa). V celém systému je prakticky stejný tlak s rozdíly danými jen hydraulickými ztrátami v technologickém systému výrobny KD. Zvyšování tlaku je výhodné pro růst účinnosti absorpce a tím stupně využití vázaného dusíku. Koncentrace a emise NO x za absorpcí mohou vyhovovat zákonným emisním limitům. Nevýhodou vyššího tlaku při oxidaci čpavku je potřeba většího množství platiny do kontaktního tělesa pro vyšší měrné zatížení reakční zóny - lože katalyzátoru a vyšší pracovní teplota katalyzátoru. To vede i k jeho vyšším ztrátám. Výhodou je menší objem aparatury a menší tepelné ztráty. S ohledem na účinnost absorpce a čistotu koncových plynů byly postupně nahrazovány absorpční kolony s kroužkovou výplní porcelánových nebo ocelových Raschigových kroužků kolonami pracujícími s pěnovým režimem na sítových patrech.
9 Za atmosférického tlaku v oxidačně absorpčním systému byla vyráběna kyselina dusičná jen s koncentrací pod 50%. Koncentrace NO x za absorpcí byly 0,5 0,8 % obj. To vedlo k vyšší měrné spotřebě čpavku, vyšší ceně produkované kyseliny a potřebě intenzivnějšího čištění koncových plynů (viz dále). V tlakových oxidačně absorpčních věžích klesá koncentrace NOx pod 0,2 %obj. Je běžně vyráběna kyselina dusičná s koncentrací v rozmezí %. V naprosté většině procesů voda obsažená v kyselině dusičné její zpracování prodražuje. Proto se prosadily právě tlakové systémy umožňující výrobu koncentrovanější kyseliny, jak již bylo uvedeno. Na dočištění koncových plynů od oxidů dusíku byla využívána: a) - alkalická vypírka v NaOH nebo Na 2 CO 3, kdy vznikala směs prakticky nevyužitelných dusičnanů a dusitanů sodných: 2 NaOH + 2 NO + 1/2 O 2 2 NaNO 2 + H 2 O 2 NaOH + 2 NO 2 + 1/2 O 2 2 NaNO 3 + H 2 O Na 2 CO 3 + NO + NO 2 2 NaNO 2 + CO 2 Na 2 CO NO 2 + 1/2 O 2 2 NaNO 3 + CO 2 b) - totální redukce oxidů dusíku pomocí přebytku vodíku, metanu nebo oxidu uhelnatého (svítiplynu) na paladiu naneseném na alumině jako katalyzátoru při o C: 2 NO + 2 H 2 N H 2 O 2 NO H 2 N H 2 O Nevýhodou totální redukce je vyšší spotřeba redukčního činidla způsobená kyslíkem přítomným v koncových nitrosních plynech. c) - selektivní redukcí oxidů dusíku čpavkem na vanadiovém nebo paladiovém katalyzátoru při teplotách o C: 6 NO + 4 NH 3 5 N H 2 O 6 NO NH 3 7 N H 2 O Totální redukce a selektivní katalytická redukce umožňují snížení koncentrace NO x na výstupu z výroben kyseliny dusičné hluboko pod 100 ppm. Tím je zajištěno plnění zákonných emisních limitů. 5. Další sloučeniny dusíku amidy - vznikají reakcí amoniaku s alkalickými kovy nebo kovy alkalických zemin: NH 3 + Na NaNH 2 + ½ H 2 amoniakáty reakcí vodných roztoků solí s amoniakem nebo čpavkovou vodou vznikají komplexní sloučeniny např. stříbrné, měďné a měďnaté: AgCl + NH 3 [Ag(NH 3 ) 3 ]Cl nitridy reakcí oxidů nebo chloridů kovů s amoniakem, případně přímým slučováním kovů s dusíkem nebo amoniakem za teplot nad 500 o C a výše vznikají nitridy kovů
10 MeCl x + y NH 3 MeN y + 3y HCl x Me + y NH 3 Me x N y + 3y/2 H 2 močovina je vyráběna přímou syntézou ze čpavku a oxidu uhličitého za tlaku 20 MPa a teploty kolem 180 o C, kdy v prvním kroku vzniká tavenina karbaminanu amonného a pak ve druhém kroku dochází k jeho dehydrataci s odpařováním vody a následnou granulací vzniklé taveniny prilingem: 2 NH 3 + CO 2 NH 2 COO NH 4 NH 2 COO NH 4 CO (NH 2 ) 2 + H 2 O hydrogen uhličitan amonný je vyráběn za zvýšeného tlaku absorpcí oxidu uhličitého ve čpavkové vodě: NH 3 + CO 2 + H 2 O NH 4 HCO 3 Používán je pro řadu konverzních reakcí vedoucích k uhličitanům nebo hydrogenuhličitanům. Je používán při výrobě sody dle Solvaye.
Průmysl dusíku. amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin. NaClO NaOH CO(NH 2 ) 2.
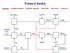 Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
Tematický blok 2 Zdroje znečišťování ovzduší Chemický průmysl Ing. Miroslav Richter, Ph.D., EUR ING miroslav.richter@ujep.cz
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Tematický blok 2 Zdroje znečišťování ovzduší Chemický průmysl Ing. Miroslav Richter, Ph.D., EUR ING miroslav.richter@ujep.cz
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Tematický blok 2 Zdroje znečišťování ovzduší Chemický průmysl Ing. Miroslav Richter, Ph.D., EUR ING miroslav.richter@ujep.cz
Kyselina dusičná. jedna z nejdůležitějších chemikálií
 Kyselina dusičná jedna z nejdůležitějších chemikálií Výroba: minulost - surovinou pro průmyslovou výrobu dusičnan sodný (ledek sodný, guano) současnost - katalytické spalování amoniaku (první výrobní jednotka
Kyselina dusičná jedna z nejdůležitějších chemikálií Výroba: minulost - surovinou pro průmyslovou výrobu dusičnan sodný (ledek sodný, guano) současnost - katalytické spalování amoniaku (první výrobní jednotka
Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np:
 PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
Tematický blok 2 Zdroje znečišťování ovzduší Chemický průmysl Ing. Miroslav Richter, Ph.D., EUR ING miroslav.richter@ujep.cz
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Tematický blok 2 Zdroje znečišťování ovzduší Chemický průmysl Ing. Miroslav Richter, Ph.D., EUR ING miroslav.richter@ujep.cz
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Tematický blok 2 Zdroje znečišťování ovzduší Chemický průmysl Ing. Miroslav Richter, Ph.D., EUR ING miroslav.richter@ujep.cz
Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0
 Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
Zplyňování biomasy. Sesuvný generátor. Autotermní zplyňování Autotermní a alotermní zplyňování
 Zplyňování = termochemická přeměna uhlíkatého materiálu v pevném či kapalném skupenství na výhřevný energetický plyn pomocí zplyňovacích médií a tepla. Produktem je plyn obsahující výhřevné složky (H 2,
Zplyňování = termochemická přeměna uhlíkatého materiálu v pevném či kapalném skupenství na výhřevný energetický plyn pomocí zplyňovacích médií a tepla. Produktem je plyn obsahující výhřevné složky (H 2,
DUM č. 2 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 2 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 2 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
Omezování plynných emisí. Ochrana ovzduší ZS 2012/2013
 Omezování plynných emisí Ochrana ovzduší ZS 2012/2013 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Omezování plynných emisí Ochrana ovzduší ZS 2012/2013 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
3. Soda a potaš Ing. Miroslav Richter, Ph.D., EUR ING
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE 3. Soda a potaš Ing. Miroslav Richter, Ph.D., EUR ING Výroby sody a potaše Suroviny, Přehled výrobních technologií
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE 3. Soda a potaš Ing. Miroslav Richter, Ph.D., EUR ING Výroby sody a potaše Suroviny, Přehled výrobních technologií
Průmyslová hnojiva biogenní prvky
 Průmyslová hnojiva biogenní prvky - kyslík - základní složka organické hmoty (CO 2 ) - uhlík - základní složka organické hmoty (CO 2 ) - vodík - základní složka organické hmoty - dusík -součást bílkovin
Průmyslová hnojiva biogenní prvky - kyslík - základní složka organické hmoty (CO 2 ) - uhlík - základní složka organické hmoty (CO 2 ) - vodík - základní složka organické hmoty - dusík -součást bílkovin
1.1 Suroviny síry Průmyslově využitelné suroviny pro zisk síry nebo jejích sloučenin nebo dalších složek obsažených v příslušných minerálech výskyt:
 1. Chemie a technologie sloučenin síry 1.1 Suroviny síry Průmyslově využitelné suroviny pro zisk síry nebo jejích sloučenin nebo dalších složek obsažených v příslušných minerálech výskyt: Elementární síra:
1. Chemie a technologie sloučenin síry 1.1 Suroviny síry Průmyslově využitelné suroviny pro zisk síry nebo jejích sloučenin nebo dalších složek obsažených v příslušných minerálech výskyt: Elementární síra:
Příklady úspěšných projektů čistší produkce (Cleaner Production) Výroba: kyseliny sírové mikrokorundu
 Příklady úspěšných projektů čistší produkce (Cleaner Production) Výroba: kyseliny sírové mikrokorundu Ing. Miroslav Richter, PhD., EUR ING Fakulta životního prostředí Univerzity J.E.Purkyně v Ústí n.l.
Příklady úspěšných projektů čistší produkce (Cleaner Production) Výroba: kyseliny sírové mikrokorundu Ing. Miroslav Richter, PhD., EUR ING Fakulta životního prostředí Univerzity J.E.Purkyně v Ústí n.l.
Omezování plynných emisí. Ochrana ovzduší ZS 2010/2011
 Omezování plynných emisí Ochrana ovzduší ZS 2010/2011 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Omezování plynných emisí Ochrana ovzduší ZS 2010/2011 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Dusík a fosfor. Dusík
 5.9.010 Dusík a fosfor Dusík lyn Bezbarvý, bez chuti a zápachu Vyskytuje se v dvouatomových molekulách N Molekuly dusíku extremně stabilní říprava: reakce dusitanů s amonnými ionty NH N N ( ( ( ( Výroba:
5.9.010 Dusík a fosfor Dusík lyn Bezbarvý, bez chuti a zápachu Vyskytuje se v dvouatomových molekulách N Molekuly dusíku extremně stabilní říprava: reakce dusitanů s amonnými ionty NH N N ( ( ( ( Výroba:
TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ)
 TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ) 3. část ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Zpracoval: Tým autorů EVECO Brno, s.r.o. ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Množství SO 2, HCl,
TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ) 3. část ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Zpracoval: Tým autorů EVECO Brno, s.r.o. ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Množství SO 2, HCl,
DUM č. 4 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 4 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 4 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
Bilan a ce c zák á l k ad a ní pojm j y m aplikace zákonů o zachování čehokoli 10.10.2008 3
 Výpočtový seminář z Procesního inženýrství podzim 2008 Bilance Materiálové a látkové 10.10.2008 1 Tématické okruhy bilance - základní pojmy bilanční schéma způsoby vyjadřování koncentrací a přepočtové
Výpočtový seminář z Procesního inženýrství podzim 2008 Bilance Materiálové a látkové 10.10.2008 1 Tématické okruhy bilance - základní pojmy bilanční schéma způsoby vyjadřování koncentrací a přepočtové
NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE. Ing. Stanislav HONUS
 NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE Ing. Stanislav HONUS ORGANICKÝ MATERIÁL Spalování Chemické přeměny Chem. přeměny ve vodním prostředí Pyrolýza Zplyňování Chemické Biologické Teplo
NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE Ing. Stanislav HONUS ORGANICKÝ MATERIÁL Spalování Chemické přeměny Chem. přeměny ve vodním prostředí Pyrolýza Zplyňování Chemické Biologické Teplo
Denitrifikace. Ochrana ovzduší ZS 2012/2013
 Denitrifikace Ochrana ovzduší ZS 2012/2013 1 Úvod Pojem oxidy dusíku NO NO 2 Další formy NO x Vznik NO x 2 Vlastnosti NO Oxid dusnatý Vlastnosti M mol,no = 30,01 kg/kmol V mol,no,n = 22,41 m 3 /kmol ρ
Denitrifikace Ochrana ovzduší ZS 2012/2013 1 Úvod Pojem oxidy dusíku NO NO 2 Další formy NO x Vznik NO x 2 Vlastnosti NO Oxid dusnatý Vlastnosti M mol,no = 30,01 kg/kmol V mol,no,n = 22,41 m 3 /kmol ρ
KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení. Ing. Miroslav Richter, PhD.
 KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení Ing. Miroslav Richter, PhD., EUR ING 2014 Materiálové bilance 3.5.1 Do tkaninového filtru vstupuje 10000
KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení Ing. Miroslav Richter, PhD., EUR ING 2014 Materiálové bilance 3.5.1 Do tkaninového filtru vstupuje 10000
TECHNOLOGIE OCHRANY OVZDUŠÍ
 TECHNOLOGIE OCHRANY OVZDUŠÍ Přednáška č. 5 Přednášející: Ing. Marek Staf, Ph.D. tel. 0 444 458; e-mail marek.staf@vscht.cz budova A, ústav 16, č. dveří 16 Snímek 1. Osnova přednášky Suchá vápencová metoda
TECHNOLOGIE OCHRANY OVZDUŠÍ Přednáška č. 5 Přednášející: Ing. Marek Staf, Ph.D. tel. 0 444 458; e-mail marek.staf@vscht.cz budova A, ústav 16, č. dveří 16 Snímek 1. Osnova přednášky Suchá vápencová metoda
Ohlašovací prahy pro úniky a přenosy pro ohlašování do IRZ/E-PRTR
 Celkový dusík Základní informace Ohlašovací prahy pro úniky a přenosy pro ohlašování do IRZ/E-PRTR Základní charakteristika Použití Zdroje úniků Dopady na životní prostředí Dopady na zdraví člověka, rizika
Celkový dusík Základní informace Ohlašovací prahy pro úniky a přenosy pro ohlašování do IRZ/E-PRTR Základní charakteristika Použití Zdroje úniků Dopady na životní prostředí Dopady na zdraví člověka, rizika
SOLI. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: 12. 4. 2013. Ročník: osmý
 SOLI Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 12. 4. 2013 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Anorganické sloučeniny 1 Anotace: Žáci se seznámí s vlastnostmi solí,
SOLI Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 12. 4. 2013 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Anorganické sloučeniny 1 Anotace: Žáci se seznámí s vlastnostmi solí,
Ing. Jiří Charvát, Ing. Pavel Kolář Z 13 NOVÉ SMĚRY A PERSPEKTIVY SANACE HORNINOVÉHO PROSTŘEDÍ PO CHEMICKÉ TĚŽBĚ URANU NA LOŽISKU STRÁŽ
 Ing. Jiří Charvát, Ing. Pavel Kolář Z 13 NOVÉ SMĚRY A PERSPEKTIVY SANACE HORNINOVÉHO PROSTŘEDÍ PO CHEMICKÉ TĚŽBĚ URANU NA LOŽISKU STRÁŽ Chemická těžba uranu byla v o. z. TÚU Stráž pod Ralskem provozována
Ing. Jiří Charvát, Ing. Pavel Kolář Z 13 NOVÉ SMĚRY A PERSPEKTIVY SANACE HORNINOVÉHO PROSTŘEDÍ PO CHEMICKÉ TĚŽBĚ URANU NA LOŽISKU STRÁŽ Chemická těžba uranu byla v o. z. TÚU Stráž pod Ralskem provozována
III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Kolik energie by se uvolnilo, kdyby spalování ethanolu probíhalo při teplotě o 20 vyšší? Je tato energie menší nebo větší než při teplotě 37 C?
 TERMOCHEMIE Reakční entalpie při izotermním průběhu reakce, rozsah reakce 1 Kolik tepla se uvolní (nebo spotřebuje) při výrobě 2,2 kg acetaldehydu C 2 H 5 OH(g) = CH 3 CHO(g) + H 2 (g) (a) při teplotě
TERMOCHEMIE Reakční entalpie při izotermním průběhu reakce, rozsah reakce 1 Kolik tepla se uvolní (nebo spotřebuje) při výrobě 2,2 kg acetaldehydu C 2 H 5 OH(g) = CH 3 CHO(g) + H 2 (g) (a) při teplotě
integrované povolení
 V rámci aktuálního znění výrokové části integrovaného povolení jsou zapracovány dosud vydané změny příslušného integrovaného povolení. Uvedený dokument má pouze informativní charakter a není závazný. Aktuální
V rámci aktuálního znění výrokové části integrovaného povolení jsou zapracovány dosud vydané změny příslušného integrovaného povolení. Uvedený dokument má pouze informativní charakter a není závazný. Aktuální
Metody gravimetrické
 Klíčový požadavek - kvantitativní vyloučení stanovované složky z roztoku - málorozpustná sloučenina - SRÁŽECÍ ROVNOVÁHY VYLUČOVACÍ FORMA se převede na (sušení, žíhání) CHEMICKY DEFINOVANÝ PRODUKT - vážitelný
Klíčový požadavek - kvantitativní vyloučení stanovované složky z roztoku - málorozpustná sloučenina - SRÁŽECÍ ROVNOVÁHY VYLUČOVACÍ FORMA se převede na (sušení, žíhání) CHEMICKY DEFINOVANÝ PRODUKT - vážitelný
Technické plyny. kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny)
 Technické plyny kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny) Kapalný vzduch složení vzduchu Před zkapalněním odstranění nežádoucích složek, např. vodní pára, CO 2, prach Zkapalňování
Technické plyny kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny) Kapalný vzduch složení vzduchu Před zkapalněním odstranění nežádoucích složek, např. vodní pára, CO 2, prach Zkapalňování
5. Nekovy sı ra. 1) Obecná charakteristika nekovů. 2) Síra a její vlastnosti
 5. Nekovy sı ra 1) Obecná charakteristika nekovů 2) Síra a její vlastnosti 1) Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu. Jsou to prvky uspořádané
5. Nekovy sı ra 1) Obecná charakteristika nekovů 2) Síra a její vlastnosti 1) Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu. Jsou to prvky uspořádané
Kyselina fosforečná Suroviny: Výroba: termický způsob extrakční způsob
 Kyselina fosforečná bezbarvá krystalická sloučenina snadno rozpustná ve vodě komerčně dodávané koncentrace 75% H 3 PO 4 s 54,3% P 2 O 5 80% H 3 PO 4 s 58.0% P 2 O 5 85% H 3 PO 4 s 61.6% P 2 O 5 po kyselině
Kyselina fosforečná bezbarvá krystalická sloučenina snadno rozpustná ve vodě komerčně dodávané koncentrace 75% H 3 PO 4 s 54,3% P 2 O 5 80% H 3 PO 4 s 58.0% P 2 O 5 85% H 3 PO 4 s 61.6% P 2 O 5 po kyselině
Fosfor a sloučeniny fosforu. Suroviny. Sloučeniny. kalcinace pro oddělení organických. Kyselina trihydrogenfosforečná H3PO4
 Fosfor a sloučeniny fosforu Sloučeniny Fosfor bílý Kyselina trihydrogenfosforečná H3PO4 Suroviny Apatit Ca5 (PO4)3(F, OH, Cl) fluoroapatity úpravy mletí promývání sítování magnetické oddělování oxidů železa
Fosfor a sloučeniny fosforu Sloučeniny Fosfor bílý Kyselina trihydrogenfosforečná H3PO4 Suroviny Apatit Ca5 (PO4)3(F, OH, Cl) fluoroapatity úpravy mletí promývání sítování magnetické oddělování oxidů železa
integrované povolení
 V rámci aktuálního znění výrokové části integrovaného povolení jsou zapracovány dosud vydané změny příslušného integrovaného povolení. Uvedený dokument má pouze informativní charakter a není závazný. Aktuální
V rámci aktuálního znění výrokové části integrovaného povolení jsou zapracovány dosud vydané změny příslušného integrovaného povolení. Uvedený dokument má pouze informativní charakter a není závazný. Aktuální
7) Uveď příklad chemické reakce, při níž se sloučí dva prvky za vzniku sloučeniny. (3) hoření vodíku s kyslíkem a vzniká voda
 Chemické reakce a děje Chemické reakce 1) Jak se chemické reakce odlišují od fyzikálních dějů? (2) změna vlastností látek, změna vazeb mezi atomy 2) Co označujeme v chemických reakcích jako reaktanty a
Chemické reakce a děje Chemické reakce 1) Jak se chemické reakce odlišují od fyzikálních dějů? (2) změna vlastností látek, změna vazeb mezi atomy 2) Co označujeme v chemických reakcích jako reaktanty a
Směšovací poměr a emise
 Směšovací poměr a emise Hmotnostní poměr mezi palivem a okysličovadlem - u motorů provozovaných v atmosféře, je okysličovadlem okolní vzduch Složení vzduchu: (objemové podíly) - 78% dusík N 2-21% kyslík
Směšovací poměr a emise Hmotnostní poměr mezi palivem a okysličovadlem - u motorů provozovaných v atmosféře, je okysličovadlem okolní vzduch Složení vzduchu: (objemové podíly) - 78% dusík N 2-21% kyslík
POPIS VYNÁLEZU K AUTORSKÉMU OSVĚDČENÍ (И) В, G 01 P 17/00. (54) Způeob získávání eoli prvkťl vzácných zemin
 ČESKOSLOVENSKA SOCIALISTICKÁ REPUBLIKA ( 19 ) POPIS VYNÁLEZU K AUTORSKÉMU OSVĚDČENÍ (61) (23) Výstavnf priorita (22) Přihlášeno 12 09 86 (2») PV 8176-86.P (И) В, (51) Int. CI.4 G 01 P 17/00 ÚFTAD PRO VYNÁLEZY
ČESKOSLOVENSKA SOCIALISTICKÁ REPUBLIKA ( 19 ) POPIS VYNÁLEZU K AUTORSKÉMU OSVĚDČENÍ (61) (23) Výstavnf priorita (22) Přihlášeno 12 09 86 (2») PV 8176-86.P (И) В, (51) Int. CI.4 G 01 P 17/00 ÚFTAD PRO VYNÁLEZY
Paliva. nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování
 Paliva Paliva nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování Dělení paliv podle skupenství pevná uhlí, dřevo kapalná benzín,
Paliva Paliva nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování Dělení paliv podle skupenství pevná uhlí, dřevo kapalná benzín,
Ústřední komise Chemické olympiády. 42. ročník. KRAJSKÉ KOLO Kategorie D. SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut
 Ústřední komise Chemické olympiády 42. ročník 2005 2006 KRAJSKÉ KOLO Kategorie D SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut Institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy
Ústřední komise Chemické olympiády 42. ročník 2005 2006 KRAJSKÉ KOLO Kategorie D SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut Institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy
Inovace bakalářského studijního oboru Aplikovaná chemie CZ.1.07/2.2.00/ Výpočty z chemických vzorců
 Výpočty z chemických vzorců 1. Hmotnost kyslíku je 80 g. Vypočítejte : a) počet atomů kyslíku ( 3,011 10 atomů) b) počet molů kyslíku (2,5 mol) c) počet molekul kyslíku (1,505 10 24 molekul) d) objem (dm
Výpočty z chemických vzorců 1. Hmotnost kyslíku je 80 g. Vypočítejte : a) počet atomů kyslíku ( 3,011 10 atomů) b) počet molů kyslíku (2,5 mol) c) počet molekul kyslíku (1,505 10 24 molekul) d) objem (dm
DIGITÁLNÍ UČEBNÍ MATERIÁL
 DIGITÁLNÍ UČEBNÍ MATERIÁL Číslo projektu CZ.1.07/1.5.00/34.0763 Název školy SOUpotravinářské, Jílové u Prahy, Šenflukova 220 Název materiálu INOVACE_32_ZPV-CH 1/04/02/17 Autor Obor; předmět, ročník Tematická
DIGITÁLNÍ UČEBNÍ MATERIÁL Číslo projektu CZ.1.07/1.5.00/34.0763 Název školy SOUpotravinářské, Jílové u Prahy, Šenflukova 220 Název materiálu INOVACE_32_ZPV-CH 1/04/02/17 Autor Obor; předmět, ročník Tematická
KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ)
 KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ) Úloha 1 Ic), IIa), IIId), IVb) za každé správné přiřazení po 1 bodu; celkem Úloha 2 8 bodů 1. Sodík reaguje s vodou za vzniku hydroxidu sodného a dalšího produktu.
KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ) Úloha 1 Ic), IIa), IIId), IVb) za každé správné přiřazení po 1 bodu; celkem Úloha 2 8 bodů 1. Sodík reaguje s vodou za vzniku hydroxidu sodného a dalšího produktu.
Úlohy: 1) Vypočítejte tepelné zabarvení dané reakce z následujících dat: C 2 H 4(g) + H 2(g) C 2 H 6(g)
 Úlohy: 1) Vypočítejte tepelné zabarvení dané reakce z následujících dat: C 2 H 4(g) + H 2(g) C 2 H 6(g) C 2 H 4(g) + 3O 2(g ) 2CO 2(g) +2H 2 O (l) H 0 298,15 = -1410,9kJ.mol -1 2C 2 H 6(g) + 7O 2(g) 4CO
Úlohy: 1) Vypočítejte tepelné zabarvení dané reakce z následujících dat: C 2 H 4(g) + H 2(g) C 2 H 6(g) C 2 H 4(g) + 3O 2(g ) 2CO 2(g) +2H 2 O (l) H 0 298,15 = -1410,9kJ.mol -1 2C 2 H 6(g) + 7O 2(g) 4CO
NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV:VY_32_INOVACE_102_Soli AUTOR: Igor Dubovan ROČNÍK, DATUM: 9., 15. 9.
 NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV:VY_32_INOVACE_102_Soli AUTOR: Igor Dubovan ROČNÍK, DATUM: 9., 15. 9. 2011 VZDĚL. OBOR, TÉMA: Chemie, Soli ČÍSLO PROJEKTU: OPVK
NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV:VY_32_INOVACE_102_Soli AUTOR: Igor Dubovan ROČNÍK, DATUM: 9., 15. 9. 2011 VZDĚL. OBOR, TÉMA: Chemie, Soli ČÍSLO PROJEKTU: OPVK
Spektrofotometrické stanovení fosforečnanů ve vodách
 Spektrofotometrické stanovení fosforečnanů ve vodách Úkol: Spektrofotometricky stanovte obsah fosforečnanů ve vodě Chemikálie: 0,07165 g dihydrogenfosforečnan draselný KH 2 PO 4 75 ml kyselina sírová H
Spektrofotometrické stanovení fosforečnanů ve vodách Úkol: Spektrofotometricky stanovte obsah fosforečnanů ve vodě Chemikálie: 0,07165 g dihydrogenfosforečnan draselný KH 2 PO 4 75 ml kyselina sírová H
Vzdělávací obsah vyučovacího předmětu
 Vzdělávací obsah vyučovacího předmětu Chemie 9. ročník Zpracovala: Mgr. Michaela Krůtová ANORGANICKÉ SLOUČENINY KYSELINY porovná vlastnosti a použití vybraných prakticky významných kyselin orientuje se
Vzdělávací obsah vyučovacího předmětu Chemie 9. ročník Zpracovala: Mgr. Michaela Krůtová ANORGANICKÉ SLOUČENINY KYSELINY porovná vlastnosti a použití vybraných prakticky významných kyselin orientuje se
zpracování těžkých frakcí na motorová paliva (mazut i vakuový zbytek)
 Ropa štěpné procesy zpracování těžkých frakcí na motorová paliva (mazut i vakuový zbytek) typy štěpných procesů: - termické krakování - katalytické krakování - hydrogenační krakování (hydrokrakování) podmínky
Ropa štěpné procesy zpracování těžkých frakcí na motorová paliva (mazut i vakuový zbytek) typy štěpných procesů: - termické krakování - katalytické krakování - hydrogenační krakování (hydrokrakování) podmínky
Ch - Hydroxidy VARIACE
 Ch - Hydroxidy Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl kompletně vytvořen,
Ch - Hydroxidy Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl kompletně vytvořen,
Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy
 Název: xidy dusíku Autor: Mgr. Štěpán Mička Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, fyzika, Ročník: 3. Tématický celek: Systematická anorganická
Název: xidy dusíku Autor: Mgr. Štěpán Mička Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, fyzika, Ročník: 3. Tématický celek: Systematická anorganická
Ústřední komise Chemické olympiády. 55. ročník 2018/2019 OKRESNÍ KOLO. Kategorie D. Teoretická část Řešení
 Ústřední komise Chemické olympiády 55. ročník 2018/2019 OKRESNÍ KOLO Kategorie D Teoretická část Řešení Úloha 1 Bezpečnostní předpisy MarsCity II 16 bodů 1) Vybrané činnosti: a) Zvracení na mramorovou
Ústřední komise Chemické olympiády 55. ročník 2018/2019 OKRESNÍ KOLO Kategorie D Teoretická část Řešení Úloha 1 Bezpečnostní předpisy MarsCity II 16 bodů 1) Vybrané činnosti: a) Zvracení na mramorovou
Amoniak. 1913 průmyslová výroba syntetického amoniaku
 Amoniak 1913 průmyslová výroba syntetického amoniaku využití 20 % výroba dusíkatých hnojiv 80 % nejrůznější odvětví průmyslu (plasty, vlákna, výbušiny, hydrazin, aminy, amidy, nitrily a další organické
Amoniak 1913 průmyslová výroba syntetického amoniaku využití 20 % výroba dusíkatých hnojiv 80 % nejrůznější odvětví průmyslu (plasty, vlákna, výbušiny, hydrazin, aminy, amidy, nitrily a další organické
ÚPRAVA VODY V ENERGETICE. Ing. Jiří Tomčala
 ÚPRAVA VODY V ENERGETICE Ing. Jiří Tomčala Úvod Voda je v elektrárnách po palivu nejdůležitější surovinou Její množství v provozních systémech elektráren je mnohonásobně větší než množství spotřebovaného
ÚPRAVA VODY V ENERGETICE Ing. Jiří Tomčala Úvod Voda je v elektrárnách po palivu nejdůležitější surovinou Její množství v provozních systémech elektráren je mnohonásobně větší než množství spotřebovaného
Směsi a čisté látky, metody dělení
 Směsi a čisté látky, metody dělení LÁTKY Chemicky čisté látky Sloučeniny Chemické prvky Homogenní Roztoky pevné kapalné plynné Směsi Heterogenní Suspenze Emulze Pěna Aerosol Chemicky čisté látky: prvky
Směsi a čisté látky, metody dělení LÁTKY Chemicky čisté látky Sloučeniny Chemické prvky Homogenní Roztoky pevné kapalné plynné Směsi Heterogenní Suspenze Emulze Pěna Aerosol Chemicky čisté látky: prvky
Co víme o nekatalytické redukci oxidů dusíku
 Co víme o nekatalytické redukci oxidů dusíku Ing. Pavel Machač, CSc., email: pavel.machac@vscht.cz, tel.: (40) 0 444 46 Ing. Jana Vávrová, email: jana1.vavrova@vscht.cz, tel.: (40) 74 971 991 VŠCHT Praha,
Co víme o nekatalytické redukci oxidů dusíku Ing. Pavel Machač, CSc., email: pavel.machac@vscht.cz, tel.: (40) 0 444 46 Ing. Jana Vávrová, email: jana1.vavrova@vscht.cz, tel.: (40) 74 971 991 VŠCHT Praha,
NEGATIVNÍ PŮSOBENÍ PROVOZU AUTOMOBILOVÝCH PSM NA ŽIVOTNÍ PROSTŘEDÍ
 NEGATIVNÍ PŮSOBENÍ PROVOZU AUTOMOBILOVÝCH PSM NA ŽIVOTNÍ PROSTŘEDÍ Provoz automobilových PSM je provázen produkcí škodlivin, které jsou emitovány do okolí: škodliviny chemické (výfuk.škodliviny, kontaminace),
NEGATIVNÍ PŮSOBENÍ PROVOZU AUTOMOBILOVÝCH PSM NA ŽIVOTNÍ PROSTŘEDÍ Provoz automobilových PSM je provázen produkcí škodlivin, které jsou emitovány do okolí: škodliviny chemické (výfuk.škodliviny, kontaminace),
Chemie. Mgr. Petra Drápelová Mgr. Jaroslava Vrbková. Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou
 Chemie Mgr. Petra Drápelová Mgr. Jaroslava Vrbková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH ROVNIC VY_32_INOVACE_03_3_18_CH Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH
Chemie Mgr. Petra Drápelová Mgr. Jaroslava Vrbková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH ROVNIC VY_32_INOVACE_03_3_18_CH Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH
H H C C C C C C H CH 3 H C C H H H H H H
 Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Ing. Radim Staněk, prof. Ing. Jana Zábranská CSc. Čištění odpadních vod z výroby nitrocelulózy
 Ing. Radim Staněk, prof. Ing. Jana Zábranská CSc. Čištění odpadních vod z výroby nitrocelulózy 20.10.2017 1 Nitrocelulóza Synthesia, a.s. Pardubice vyrábí jako jeden ze svých stěžejních produktů nitrocelulózu.
Ing. Radim Staněk, prof. Ing. Jana Zábranská CSc. Čištění odpadních vod z výroby nitrocelulózy 20.10.2017 1 Nitrocelulóza Synthesia, a.s. Pardubice vyrábí jako jeden ze svých stěžejních produktů nitrocelulózu.
Vodík jako alternativní ekologické palivo. palivové články a vodíkové hospodářství
 Vodík jako alternativní ekologické palivo palivové články a vodíkové hospodářství Charakteristika vodíku vodík je nejrozšířenějším prvkem ve vesmíru na Zemi je třetím nejrozšířenějším prvkem po kyslíku
Vodík jako alternativní ekologické palivo palivové články a vodíkové hospodářství Charakteristika vodíku vodík je nejrozšířenějším prvkem ve vesmíru na Zemi je třetím nejrozšířenějším prvkem po kyslíku
kde k c(no 2) = 2, m 6 mol 2 s 1. Jaká je hodnota rychlostní konstanty v rychlostní rovnici ? V [k = 1, m 6 mol 2 s 1 ]
![kde k c(no 2) = 2, m 6 mol 2 s 1. Jaká je hodnota rychlostní konstanty v rychlostní rovnici ? V [k = 1, m 6 mol 2 s 1 ] kde k c(no 2) = 2, m 6 mol 2 s 1. Jaká je hodnota rychlostní konstanty v rychlostní rovnici ? V [k = 1, m 6 mol 2 s 1 ]](/thumbs/98/135866737.jpg) KINETIKA JEDNODUCHÝCH REAKCÍ Různé vyjádření reakční rychlosti a rychlostní konstanty 1 Rychlost reakce, rychlosti přírůstku a úbytku jednotlivých složek Rozklad kyseliny dusité je popsán stechiometrickou
KINETIKA JEDNODUCHÝCH REAKCÍ Různé vyjádření reakční rychlosti a rychlostní konstanty 1 Rychlost reakce, rychlosti přírůstku a úbytku jednotlivých složek Rozklad kyseliny dusité je popsán stechiometrickou
Soli kyslíkatých kyselin
 Soli kyslíkatých kyselin Temacká oblast : Chemie anorganická chemie Datum vytvoření: 19. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Soli důležitých anorganických
Soli kyslíkatých kyselin Temacká oblast : Chemie anorganická chemie Datum vytvoření: 19. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Soli důležitých anorganických
Pozn.: Pokud není řečeno jinak jsou pod pojmem procenta míněna vždy procenta hmotnostní.
 Sebrané úlohy ze základních chemických výpočtů Tento soubor byl sestaven pro potřeby studentů prvního ročníku chemie a příbuzných předmětů a nebyl nikterak revidován. Prosím omluvte případné chyby, překlepy
Sebrané úlohy ze základních chemických výpočtů Tento soubor byl sestaven pro potřeby studentů prvního ročníku chemie a příbuzných předmětů a nebyl nikterak revidován. Prosím omluvte případné chyby, překlepy
HOŘČÍK KOVY ALKALICKÝCH ZEMIN. Pozn. Elektronová konfigurace valenční vrstvy ns 2
 HOŘČÍK KOVY ALKALICKÝCH ZEMIN Pozn. Elektronová konfigurace valenční vrstvy ns 2 Hořčík Vlastnosti: - stříbrolesklý, měkký, kujný kov s nízkou hustotou (1,74 g.cm -3 ) - diagonální podobnost s lithiem
HOŘČÍK KOVY ALKALICKÝCH ZEMIN Pozn. Elektronová konfigurace valenční vrstvy ns 2 Hořčík Vlastnosti: - stříbrolesklý, měkký, kujný kov s nízkou hustotou (1,74 g.cm -3 ) - diagonální podobnost s lithiem
Laboratorní cvičení z kinetiky chemických reakcí
 Laboratorní cvičení z kinetiky chemických reakcí LABORATORNÍ CVIČENÍ 1. Téma: Ovlivňování průběhu reakce změnou koncentrace látek. podmínek průběhu reakce. Jednou z nich je změna koncentrace výchozích
Laboratorní cvičení z kinetiky chemických reakcí LABORATORNÍ CVIČENÍ 1. Téma: Ovlivňování průběhu reakce změnou koncentrace látek. podmínek průběhu reakce. Jednou z nich je změna koncentrace výchozích
Sloučeniny dusíku a fosforu
 VY_32_IOVACE_30_BE13.notebook Sloučeniny dusíku a fosforu Temacká oblast : Chemie anorganická chemie Datum vytvoření: 25. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný
VY_32_IOVACE_30_BE13.notebook Sloučeniny dusíku a fosforu Temacká oblast : Chemie anorganická chemie Datum vytvoření: 25. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný
ZŠ ÚnO, Bratří Čapků 1332
 Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 2 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 2 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Obsah Chemická reakce... 2 PL:
 Obsah Chemická reakce... 2 PL: Vyčíslení chemické rovnice - řešení... 3 Tepelný průběh chemické reakce... 4 Rychlost chemických reakcí... 4 Rozdělení chemických reakcí... 4 1 Chemická reakce děj, při němž
Obsah Chemická reakce... 2 PL: Vyčíslení chemické rovnice - řešení... 3 Tepelný průběh chemické reakce... 4 Rychlost chemických reakcí... 4 Rozdělení chemických reakcí... 4 1 Chemická reakce děj, při němž
10. Chemické reaktory
 10. Chemické reaktory V každé chemické technologii je základní/nejvýznamnější zařízení pro provedení chemické reakce chemický reaktor. Celý technologický proces se skládá v podstatě ze tří typů zařízení:
10. Chemické reaktory V každé chemické technologii je základní/nejvýznamnější zařízení pro provedení chemické reakce chemický reaktor. Celý technologický proces se skládá v podstatě ze tří typů zařízení:
Dusík a jeho sloučeniny
 Dusík a jeho sloučeniny Mgr. Jana Pertlová Copyright istudium, 2008, http://www.istudium.cz Žádná část této publikace nesmí být publikována a šířena žádným způsobem a v žádné podobě bez výslovného svolení
Dusík a jeho sloučeniny Mgr. Jana Pertlová Copyright istudium, 2008, http://www.istudium.cz Žádná část této publikace nesmí být publikována a šířena žádným způsobem a v žádné podobě bez výslovného svolení
CHO cvičení, FSv, ČVUT v Praze
 2. Chemické rovnice Chemická rovnice je schématický zápis chemického děje (reakce), který nás informuje o reaktantech (výchozích látkách), produktech, dále o stechiometrii reakce tzn. o vzájemném poměru
2. Chemické rovnice Chemická rovnice je schématický zápis chemického děje (reakce), který nás informuje o reaktantech (výchozích látkách), produktech, dále o stechiometrii reakce tzn. o vzájemném poměru
CHEMICKÉ VÝPOČTY HMOTNOST REAKTANTŮ A PRODUKTŮ PŘI CHEMICKÉ REAKCI PROJEKT EU PENÍZE ŠKOLÁM OPERAČNÍ PROGRAM VZDĚLÁVÁNÍ PRO KONKURENCESCHOPNOST
 CHEMICKÉ VÝPOČTY HMOTNOST REAKTANTŮ A PRODUKTŮ PŘI CHEMICKÉ REAKCI PROJEKT EU PENÍZE ŠKOLÁM OPERAČNÍ PROGRAM VZDĚLÁVÁNÍ PRO KONKURENCESCHOPNOST VÝPOČET HMOTNOSTI REAKTANTŮ A PRODUKTŮ PŘI CHEMICKÉ REAKCI
CHEMICKÉ VÝPOČTY HMOTNOST REAKTANTŮ A PRODUKTŮ PŘI CHEMICKÉ REAKCI PROJEKT EU PENÍZE ŠKOLÁM OPERAČNÍ PROGRAM VZDĚLÁVÁNÍ PRO KONKURENCESCHOPNOST VÝPOČET HMOTNOSTI REAKTANTŮ A PRODUKTŮ PŘI CHEMICKÉ REAKCI
Získávání lithia a rubidia z cinvalditových odpadů po těžbě Sn-W rud na Cínovci
 Získávání lithia a rubidia z cinvalditových odpadů po těžbě Sn-W rud na Cínovci doc. Ing. Jitka Jandová, CSc. Ústav kovových materiálů a korozního inženýrství, Vysoká škola chemicko-technologická v Praze
Získávání lithia a rubidia z cinvalditových odpadů po těžbě Sn-W rud na Cínovci doc. Ing. Jitka Jandová, CSc. Ústav kovových materiálů a korozního inženýrství, Vysoká škola chemicko-technologická v Praze
CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK
 CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK Význam stechiometrických koeficientů 2 H 2 (g) + O 2 (g) 2 H 2 O(l) Počet reagujících částic 2 molekuly vodíku reagují s 1 molekulou kyslíku za vzniku
CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK Význam stechiometrických koeficientů 2 H 2 (g) + O 2 (g) 2 H 2 O(l) Počet reagujících částic 2 molekuly vodíku reagují s 1 molekulou kyslíku za vzniku
 Základní anorganické výroby PRŮMYSLVÁ ANRGANICKÁ CHEMIE Voda Výroba Filtrace Úprava dstraňování nečistot Vodík Výroba vodíku Petrochemie Elektrochemie Peroxid vodíku a anorganické peroxosloučeniny Dusík
Základní anorganické výroby PRŮMYSLVÁ ANRGANICKÁ CHEMIE Voda Výroba Filtrace Úprava dstraňování nečistot Vodík Výroba vodíku Petrochemie Elektrochemie Peroxid vodíku a anorganické peroxosloučeniny Dusík
ÚVOD. Hlízkové bakterie Bobovité Mořští. Bradyrhyzobium japonicum Jetel luční ptáci
 ÚVOD Hlízkové bakterie Bobovité Mořští Bradyrhyzobium japonicum Jetel luční ptáci Guano je mineralizovaný trus mořských ptáků, živících se rybami. GUANO Běžná dávka kombinovaného hnojiva je 300-500 kg
ÚVOD Hlízkové bakterie Bobovité Mořští Bradyrhyzobium japonicum Jetel luční ptáci Guano je mineralizovaný trus mořských ptáků, živících se rybami. GUANO Běžná dávka kombinovaného hnojiva je 300-500 kg
STANOVENÍ CHLORIDŮ. Odměrné argentometrické stanovení chloridů podle Mohra
 STANOVENÍ CHLORIDŮ Odměrné argentometrické stanovení chloridů podle Mohra Cíl práce Stanovte titr odměrného standardního roztoku dusičnanu stříbrného titrací 5 ml standardního srovnávacího roztoku chloridu
STANOVENÍ CHLORIDŮ Odměrné argentometrické stanovení chloridů podle Mohra Cíl práce Stanovte titr odměrného standardního roztoku dusičnanu stříbrného titrací 5 ml standardního srovnávacího roztoku chloridu
TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ)
 TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ) 6. část DIOXINY A FURANY Zpracoval: Tým autorů EVECO Brno, s.r.o. DIOXINY A FURANY DIOXINY PCDD: je obecný název pro skupinu toxických
TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ) 6. část DIOXINY A FURANY Zpracoval: Tým autorů EVECO Brno, s.r.o. DIOXINY A FURANY DIOXINY PCDD: je obecný název pro skupinu toxických
Registrační číslo projektu: CZ.1.07/1.4.00/21.2939. Název projektu: Investice do vzdělání - příslib do budoucnosti
 Registrační číslo projektu: CZ.1.07/1.4.00/21.2939 Název projektu: Investice do vzdělání - příslib do budoucnosti Číslo přílohy: VY_číslo šablony_inovace_číslo přílohy Autor Datum vytvoření vzdělávacího
Registrační číslo projektu: CZ.1.07/1.4.00/21.2939 Název projektu: Investice do vzdělání - příslib do budoucnosti Číslo přílohy: VY_číslo šablony_inovace_číslo přílohy Autor Datum vytvoření vzdělávacího
3. FILTRACE. Obecný princip filtrace. Náčrt. vstup. suspenze. filtrační koláč. výstup
 3. FILTRACE Filtrace je jednou ze základních technologických operací, je to jedna ze základních jednotkových operací. Touto operací se oddělují pevné částice od tekutiny ( směs tekutiny a pevných částic
3. FILTRACE Filtrace je jednou ze základních technologických operací, je to jedna ze základních jednotkových operací. Touto operací se oddělují pevné částice od tekutiny ( směs tekutiny a pevných částic
METODY ČIŠTĚNÍ ORGANICKÝCH LÁTEK
 METODY ČIŠTĚNÍ ORGANICKÝCH LÁTEK Chemické sloučeniny se připravují z jiných chemických sloučenin. Tento děj se nazývá chemická reakce, kdy z výchozích látek (reaktantů) vznikají nové látky (produkty).
METODY ČIŠTĚNÍ ORGANICKÝCH LÁTEK Chemické sloučeniny se připravují z jiných chemických sloučenin. Tento děj se nazývá chemická reakce, kdy z výchozích látek (reaktantů) vznikají nové látky (produkty).
Koloběh látek v přírodě - koloběh dusíku
 Koloběh látek v přírodě - koloběh dusíku Globální oběh látek v přírodě se žádná látka nevyskytuje stále na jednom místě díky různým činitelům (voda, vítr..) se látky dostávají do pohybu oběhu - cyklu N
Koloběh látek v přírodě - koloběh dusíku Globální oběh látek v přírodě se žádná látka nevyskytuje stále na jednom místě díky různým činitelům (voda, vítr..) se látky dostávají do pohybu oběhu - cyklu N
NOVÉ NÁMĚTY PRO DEMONSTRAČNÍ POKUSY. Ondřej Maca, Tereza Kudrnová
 NOVÉ NÁMĚTY PRO DEMONSTRAČNÍ POKUSY Ondřej Maca, Tereza Kudrnová HUSTÝ DÝM 1) pro koho: 1. ročník čtyřletého gymnázia 2) zařazení do učiva: vlastnosti látek; halogeny; pentely 3) pomůcky: zkumavka se zátkou,
NOVÉ NÁMĚTY PRO DEMONSTRAČNÍ POKUSY Ondřej Maca, Tereza Kudrnová HUSTÝ DÝM 1) pro koho: 1. ročník čtyřletého gymnázia 2) zařazení do učiva: vlastnosti látek; halogeny; pentely 3) pomůcky: zkumavka se zátkou,
Chemické výpočty 11. Stechiometrické výpočty (včetně reakcí s ideálními plyny); reakce s přebytkem výchozí látky
 Chemické výpočty 11 Stechiometrické výpočty (včetně reakcí s ideálními plyny); reakce s přebytkem výchozí látky Ing. Martin Pižl Skupina koordinační chemie místnost A213 E-mail: martin.pizl@vscht.cz Web:
Chemické výpočty 11 Stechiometrické výpočty (včetně reakcí s ideálními plyny); reakce s přebytkem výchozí látky Ing. Martin Pižl Skupina koordinační chemie místnost A213 E-mail: martin.pizl@vscht.cz Web:
Problematika koncentrací Hg ve spalinách vzniklých po spalování pevných fosilních paliv
 ÚJV Řež, a. s. Divize ENERGOPROJEKT PRAHA Problematika koncentrací Hg ve spalinách vzniklých po spalování pevných fosilních paliv Lukáš Pilař Konference Technologie pro elektrárny a teplárny na tuhá paliva
ÚJV Řež, a. s. Divize ENERGOPROJEKT PRAHA Problematika koncentrací Hg ve spalinách vzniklých po spalování pevných fosilních paliv Lukáš Pilař Konference Technologie pro elektrárny a teplárny na tuhá paliva
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace
 Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Bezpečnostní inženýrství - Chemické procesy -
 Bezpečnostní inženýrství - Chemické procesy - M. Jahoda Nebezpečí a prevence chemických procesů 2 Chemické reakce Tepelné efekty exotermní procesy (teplo se uvolňuje => nutnost chlazení) endotermní procesy
Bezpečnostní inženýrství - Chemické procesy - M. Jahoda Nebezpečí a prevence chemických procesů 2 Chemické reakce Tepelné efekty exotermní procesy (teplo se uvolňuje => nutnost chlazení) endotermní procesy
Ropa Kondenzované uhlovodíky
 Nejdůležitější surovina pro výrobu organických sloučenin Nejvýznamnější surovina světové ekonomiky Výroba energie Chemické zpracování - 15 % Cena a zásoby ropy (70-100 let) Ropné krize Nutnost hledání
Nejdůležitější surovina pro výrobu organických sloučenin Nejvýznamnější surovina světové ekonomiky Výroba energie Chemické zpracování - 15 % Cena a zásoby ropy (70-100 let) Ropné krize Nutnost hledání
ŘEŠENÍ KONTROLNÍHO TESTU ŠKOLNÍHO KOLA
 Ústřední komise Chemické olympiády 48. ročník 2011/2012 ŠKOLNÍ KOLO kategorie C ŘEŠENÍ KONTROLNÍHO TESTU ŠKOLNÍHO KOLA KONTROLNÍ TEST ŠKOLNÍHO KOLA (60 BODŮ) Úloha 1 Neznámý nerost 21 bodů 1. Barva plamene:
Ústřední komise Chemické olympiády 48. ročník 2011/2012 ŠKOLNÍ KOLO kategorie C ŘEŠENÍ KONTROLNÍHO TESTU ŠKOLNÍHO KOLA KONTROLNÍ TEST ŠKOLNÍHO KOLA (60 BODŮ) Úloha 1 Neznámý nerost 21 bodů 1. Barva plamene:
Příklad Sestavte rovnice následujících dějů: reakce hydroxidu sodného s kyselinou tetrahydrogendifosforečnou 4NaOH + H 4 P 2 O 7 Na 4 P 2 O 7
 Příklad 2.2.9. Sestavte rovnice následujících dějů: reakce hydroxidu sodného s kyselinou tetrahydrogendifosforečnou 4NaOH + H 4 P 2 O 7 Na 4 P 2 O 7 + 4H 2 O reakce dimerního oxidu antimonitého s kyselinou
Příklad 2.2.9. Sestavte rovnice následujících dějů: reakce hydroxidu sodného s kyselinou tetrahydrogendifosforečnou 4NaOH + H 4 P 2 O 7 Na 4 P 2 O 7 + 4H 2 O reakce dimerního oxidu antimonitého s kyselinou
Technická specifikace přístrojů k zadávací dokumentaci Plynové chromatografy a analyzátory k pokusným jednotkám pro projekt UniCRE
 Příloha č. 2 Technická specifikace přístrojů k zadávací dokumentaci Plynové chromatografy a analyzátory k pokusným jednotkám pro projekt UniCRE Část B AN1, AN2 Analyzátor pro stanovení oxidu uhelnatého,
Příloha č. 2 Technická specifikace přístrojů k zadávací dokumentaci Plynové chromatografy a analyzátory k pokusným jednotkám pro projekt UniCRE Část B AN1, AN2 Analyzátor pro stanovení oxidu uhelnatého,
ZŠ ÚnO, Bratří Čapků 1332
 Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 1 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 1 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
IV. Chemické rovnice A. Výpočty z chemických rovnic 1
 A. Výpočty z chemických rovnic 1 4. CHEMICKÉ ROVNICE A. Výpočty z chemických rovnic a. Výpočty hmotností reaktantů a produktů b. Výpočty objemů reaktantů a produktů c. Reakce látek o různých koncentracích
A. Výpočty z chemických rovnic 1 4. CHEMICKÉ ROVNICE A. Výpočty z chemických rovnic a. Výpočty hmotností reaktantů a produktů b. Výpočty objemů reaktantů a produktů c. Reakce látek o různých koncentracích
POKYNY FAKTORY OVLIVŇUJÍCÍ RYCHLOST REAKCÍ
 POKYNY Prostuduj si teoretický úvod a následně vypracuj postupně všechny zadané úkoly zkontroluj si správné řešení úkolů podle řešení FAKTORY OVLIVŇUJÍCÍ RYCHLOST REAKCÍ 1) Vliv koncentrace reaktantů čím
POKYNY Prostuduj si teoretický úvod a následně vypracuj postupně všechny zadané úkoly zkontroluj si správné řešení úkolů podle řešení FAKTORY OVLIVŇUJÍCÍ RYCHLOST REAKCÍ 1) Vliv koncentrace reaktantů čím
Tvorba škodlivin při spalování
 Tvorba škodlivin při spalování - Při spalování dochází ke vzniku řady škodlivin - Je třeba spalovací proces vést tak, aby se minimalizoval vznik škodlivin (byly dodrženy emisní limity) - Emisní limity
Tvorba škodlivin při spalování - Při spalování dochází ke vzniku řady škodlivin - Je třeba spalovací proces vést tak, aby se minimalizoval vznik škodlivin (byly dodrženy emisní limity) - Emisní limity
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost.
 Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Klíčová aktivita III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Klíčová aktivita III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
Složení soustav (roztoky, koncentrace látkového množství)
 VZOROVÉ PŘÍKLADY Z CHEMIE A DOPORUČENÁ LITERATURA pro přípravu k přijímací zkoušce studijnímu oboru Nanotechnologie na VŠB TU Ostrava Doporučená literatura z chemie: Prakticky jakákoliv celostátní učebnice
VZOROVÉ PŘÍKLADY Z CHEMIE A DOPORUČENÁ LITERATURA pro přípravu k přijímací zkoušce studijnímu oboru Nanotechnologie na VŠB TU Ostrava Doporučená literatura z chemie: Prakticky jakákoliv celostátní učebnice
Prvky V.A a VI.A skupiny
 Prvky V.A a VI.A skupiny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Duben 2010 Mgr. Alena Jirčáková Prvky V.A skupiny - vlastnosti - Prvky s pěti
Prvky V.A a VI.A skupiny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Duben 2010 Mgr. Alena Jirčáková Prvky V.A skupiny - vlastnosti - Prvky s pěti
Ch - Chemické reakce a jejich zápis
 Ch - Chemické reakce a jejich zápis Autor: Mgr. Jaromír Juřek Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE Tento dokument byl
Ch - Chemické reakce a jejich zápis Autor: Mgr. Jaromír Juřek Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE Tento dokument byl
ZÁKLADNÍ CHEMICKÉ POJMY A ZÁKONY
 ZÁKLADNÍ CHEMICKÉ POJMY A ZÁKONY Klíčová slova: relativní atomová hmotnost (A r ), relativní molekulová hmotnost (M r ), Avogadrova konstanta (N A ), látkové množství (n, mol), molární hmotnost (M, g/mol),
ZÁKLADNÍ CHEMICKÉ POJMY A ZÁKONY Klíčová slova: relativní atomová hmotnost (A r ), relativní molekulová hmotnost (M r ), Avogadrova konstanta (N A ), látkové množství (n, mol), molární hmotnost (M, g/mol),
