Dusík a sloučeniny dusíku. 1. Amoniak NH3. Sloučeniny. Haber Bosch Mitaschův postup. amonné soli chladivo. močovina anorganické a organické syntézy
|
|
|
- Iva Slavíková
- před 5 lety
- Počet zobrazení:
Transkript
1 Dusík a sloučeniny dusíku Sloučeniny Amoniak NH3 Kyselina dusičná HNO3 Kyanovodík Močovina Hydroxylamin ( kaprolaktam polyamid 6) 1. Amoniak NH3 Použití: výroba HNO3 plasty a vlákna močovina anorganické a organické syntézy amonné soli chladivo Metoda: Syntéza NH3 ze syntézního plynu (N2 + 3 H2) Haber Bosch Mitaschův postup 1904 Haber: výzkum rovnováhy mezi N2, H2, NH BASF: Haber, Bosch, Mitasch 1
2 1.1 Metoda Syntéza NH3 ze syntézního plynu (N2 + 3 H2) N2 + 3 H2 2 NH3 Hr 0 = 91,8 kj/mol 1 t NH m 3 H Nm 3 N2 1. Termodynamické a kinetické posouzení Td: T: exotermická reakce + K a = f (T) + Chatelierův princip akce a reakce T výtěžek p: ϕ = 2 kontrakce objemu p (cnh3)eq Kin: rychlost vyžaduje katalyzátor ; katalyzátory aktivní pro T > 400 C T > 400 C z hlediska rovnováhy nepříznivé T: kompromis mezi TD a KIN 2
3 2. Další faktory: Recirkulace nezreag. syn.plynu XNH3 = % při 1 průchodu konvertorem Koncentrace inertů Objemová rychlost plynu w w = Vg / m 3 katalyzátoru w : XNH3, m NH3, náklady na dopravu, tepelná bilance optimální rychlost = fce (produkce, výrobní náklady) Cena náklady na kompresi cena vysokotlakých zařízení 3
4 3. Shrnutí Syntéza NH3 příznivě ovlivňuje: vysoký tlak nízká teplota aktivní katalyzátor odstraňování vytvořeného NH3 z rovnovážné směsi přítomnost inertů 4
5 4. Provozní parametry: t = C C p = MPa MPa ekonomicky optimální MPa konverze při 1 průchodu konvertorem XNH3 = % recirkulace nezreag. syn.plynu objemová rychlost: p = 30 MPa w = Nm 3 /m 3 kat.h 5. Odlišnosti výrob: použitý katalyzátor výroba syntézního plynu 5
6 6. Schéma syntézy výroba synt. plynu H2 CO N2 odstranění CO konverze CO CO2 absorpce v roztoku Cu 1+, N2 (l) absorpce H2O (l), etanolamin, potaš odstranění CO2 event. H2S čistění syn.plynu (odstranění kyslíkatých složek) N2 + 3H2 konverze na NH3 odvod s inerty oddělování NH3 sklad NH3 6
7 7. Katalyzátor Katalyzátor: Fe α + promotory (oxidické materiály) syntézní plyn < 10 ppm kyslíkatých sloučenin: životnost 5 a více let Promotory: zvyšují aktivitu katalyzátoru, životnost zmenšují sklon k otravě K2CO3 zvyšuje aktivitu, ale snižuje teplotní stálost Al2O3 CaO SiO2 chrání před slinováním a tím zvyšují stálost vůči tepelnému namáhání CaO odstraňuje citlivost na sirné a chlorové sloučeniny oxidy Li, Be, V 7
8 Katalytické jedy Druh Účinek Regenerace sloučeniny kyslíku blokace aktivních míst chemisorpcí redukce čistým syntézním plynem sloučeniny síry, fosforu, arsenu blokace aktivních míst chemisorpcí nevratná otrava CO, CO2, O2 blokace aktivních míst chemisorpcí reakce s H2 (exo lokální přehřátí slinutí) nevratná otrava voda blokace aktivních míst chemisorpcí Fe oxidy uhlovodíky (metan), inerty rušivé působení na difusi N2 a H2 póry katalyzátoru 8
9 Výroba katalyzátoru vytavení směsi magnetitu (Fe3O4) s promotory (elektrické tavící pece, obloukové pece, 1500 C) rychlé ochlazení drcení sítování (frakce 6 10 mm, někde 1 2 mm) redukce Fe3O4 Fe α Redukce Fe3O4 Fe α A. redukce přímo v reaktoru syntézním plynem Fe3O4 + 4 H2 3 Fe + 4 H2O B. částečná předredukce mimo reaktor Ad A. p = 7 30 MPa, t = C, oxidické promotory se neredukují a snižují rychlost redukce koncentraci H2O nutno udržovat na nízké hodnotě (zabránění předčasnému stárnutí) nutno vysoké rychlosti plynů Ad B. Nutno stabilizovat v dusíkové atmosféře s 0,2 % O2, dochází k částečné oxidaci, k redukce dojde v reaktoru. 9
10 Typické složení katalyzátoru (na začátku reakce) % hm. Fe3O4 94,3 K2O3 0,8 Al2O3 2,3 CaO 1,7 MgO 0,5 SiO2 0,4 10
11 1.2 Suroviny syntézní plyn: směs 3 H2 + N2 Dusík N2: frakční destilace zkapalněného vzduchu dusík ze vzduchu (odstranění O2 reakcí s oxidovatelnými látkami) Vodík H2: zemní plyn, nafta (parní reforming) ropné produkty (např. těžký topný olej) (parciální oxidace) zplyňování uhlí (parciální oxidace) 11
12 1.3 Výroba vodíku A. Parní reforming zemního plynu a nafty obecně: CnH2n+2 + n H2O n CO + (2n + 1) H2 CH4 + H2O CO + 3 H2 B. Parciální oxidace těžkého topného oleje popis: podstechiometrické/stechiometrické množství kyslíku, které nestačí na úplné spálení obecně: 2 CnH2n+2 + n O2 2n CO + 2.(n + 1) H2 Shell, Texaco C. Parciální oxidace uhlí (zplyňování uhlí) redukce vody C + H2O H2 + CO částečné spálení uhlíku 2 C + O2 2 CO Lurgi Koppers Totzek Winkler 12
13 1.5 Postup výroby A. Středotlaké postupy p = MPa B. Vysokotlaké postupy p = 100 MPa A. Středotlaké postupy 30 MPa 500 C XNH3 = % NH3 (l) čerstvý syntézní plyn komprese vodní/ vzduchový chladič NH3 (l) chladič C 3 % NH3 reaktor oddělený NH3 z předch. cyklu NH3 (g) 13
14 Oddělení amoniaku kondenzace při nižší teplotě vodní/vzduchový chladič amoniakový chladič ; odparem NH3 (l) odpařený amoniak se buď spotřebuje v navazující výrobě nebo se opět zkapalní Skladování amoniaku NH3 (l) t = 33 C (p 100 kpa), t = 5 5 C, t = okolí B. Vysokotlaké postupy Claudeho postup 100 MPa 600 C XNH3 až 40 % oddělení NH3 : při použitém tlaku stačí vodní chladič materiál reaktoru: 60 % Ni, 28 % Cr, 2 % Mn, 2 % W, 0,4 % C 14
15 Blokové schéma syntézy NH3 postupem parního reformování zemní plyn nafta H2 (g) Hydrogenační odsíření oddělení C, kat. CoO, NiO + MoO3 síry sirné sloučeniny H2S absorpce na ZnO H2O (g) ohřev C primární Primární reforming C, p = 4 MPa reforming zbytkový CH4 Ni kat.: NiO Al2O3, NiO MgO Al2O3 7 9 % mol. kat.jedy: síra, arsen, halogeny sekundární Sekundární reforming konverze zbytků metanu reforming C, kat Cr2O3, teplo spálením části ZP zbytkový CH4 0,5 % mol. 15
16 VT konverze odstranění CO CO2 NT konverze zbytkový CO 3 4 % obj. Vysokoteplotní konverze - odstranění CO CO2 CO + H2O CO2 + H2 exotermická reakce C kat. Fe2O3 Cr2O3, kat. Co Mo (necitlivé k síře) Nízkoteplotní konverze - odstranění CO CO C, zbytkový CO kat. CuO ZnO (citlivý na síru, obsah S < 0,1 ppm) < 0,3 % obj. oddělení Oddělení CO2 preferována chemická absorpce CO2 CO2 < 0,01 0,1 % obj. oddělení Oddělení kyslíkatých sloučenin, zbytků CO a CO2 kyslík.sl. methanizací 16
17 H2 74 %, N2 24,7 %, CH4 1 %, Ar 0,3 %, CO + CO2 5 ppm syntéza NH3 oddělení NH3 sklad 17
18 Blokové schéma syntézy NH3 postupem parciální oxidace těžký topný olej kyslík z destilace vzduchu, dusík na vypírku a syntézu O2 (g) Parciální oxidace nedokonalé spalování O2 parciální C, 3 4 MPa, bez katalyzátoru oxidace V: není třeba odsíření N: musí být třeba zdroj O2, vedlejší produkt: saze VT konverze odstranění CO CO2 zbytkový CO 3 4 % obj. Vysokoteplotní konverze - odstranění CO CO C, kat. Co Mo (necitlivé k síře) oddělení Oddělení CO2 a H2S CO2 a H2S fyzikální absorpce fyzikálněchemická absorpce 18
19 N2 (l) odstranění Vypírka kapalným dusíkem odstranění zbytků CO zbytků CO kat. Fe2O3 Cr2O3, kat. Co Mo (necitlivé k síře) N2 (g) syntéza NH3 Syntéza NH3 oddělení NH3 Oddělení NH3 sklad 19
20 A. Odstranění CO2 a H2S A1. Fyzikální absorpce A2. Chemická absorpce A3. Fyzikálněchemická absorpce A1. Fyzikální absorpce metanol (proces Rectisol) regenerace: expanze stripování při vyšší teplotě vypírka: H2S + CO2 selektivita: nejdříve H2S malé množství MeOH propylenkarbonát (proces Fluor Solvent) poté CO2 velké množství MeOH N-methylpyrolidon (proces Purisol) polyetyhlenglykoldimethyleter (proces Selexol) 20
21 A2. Chemická absorpce aminy mono-, di- atriethanolamin, methyldiethanolamin, diisopropanolamin) monomethylaminopropionan draselný (proces Alkazid) uhličitan draselný A3. Fyzikálněchemická absorpce vodný roztok diisopropanol amin + sulfolan (proces Sulfinol (Shell)) Použití Plyn bez H2S (parní reforming) chemická absorpce Plyn s H2S (parciální oxidace) fyzikální absorpce fyzikálněchemická absorpce 21
22 B. Odstranění kyslíkatých sloučenin CO, CO2 B1. Pouze vysokoteplotní konverze Vypírka měděnými roztoky (již se nepoužívá ; náklady, ekologie (úniky mědi do životního prostředí) Vypírka kapalným dusíkem (kolona, 190 C, tlak až 8 MPa) předtím nutno odstranit zbytky H2O, stopy CO2, CH4 a ostatních uhlovodíků nutno zabránit vzniku ledu v koloně H2O a CO2 na zeolitech, uhlovodíky se zkondenzují B2. VT a NT konverze zbytkový obsah CO: 0,1 0,3 obj. Methanizace (hydrogenace na metan) C, 3 MPa, Ni katalyzátor CO + 3 H2 CH4 + H2O + CO2 + 4 H2 CH4 + 2 H2O odstranění vody ochlazením = plyn: < 10 ppm sloučenin uhlíku cca 1,3 % obj. inertů (CH4, Ar) 22
23 1.6 Reaktory Rozdělení podle výměny tepla Rozdělení podle kontrukce s vnitřním sdílením tepla trubkové (souprodé, protiproudé) s externím sdílením tepla patrové (etážové) nepřímá výměna přímá výměna Ohřev syntézního plynu uvnitř katalyzátorové vrstvy dávkovaného do oběhu vně katalyzátorové vrstvy Trubkové reaktory Katalyzátor v trubkách. Vně trubek syntézní plyn ; nepřímá výměna tepla vnitřním sdílením. Chlazení vnější strany reaktoru studeným syntézním plynem proudícím ve štěrbině mezi katalyzátorem a stěnou reaktoru. 23
24 Patrové (etážové) reaktory 3 až 5 vrstev Chlazení studeným plynem dávkovaným mezi vrstvy (vnitřní sdílení přímou výměnou) ; (Kellog, quench reaktory). Chlazení výměníky vestavěnými mezi vrstvy (externí sdílení nepřímou výměnou) ; lze využít pro výrobu páry (OSW, Uhde) Quench reaktory princip: prudké ochlazení hlavního proudu plynu smícháním v několika místech s částí chladícího plynu (quench cooling) Materiál reaktoru tepelně zušlechtěné oceli obsahující Cr a Mo odolnost proti vodíku za tlaku, nedochází k oduhličení a křehnutí, vzniku interkrystalických trhlin 24
25 Konstrukce tlakových těles (průměr 2 m, výška 30 m) Kované nádoby s plnou stěnou Vícevrstvé nádoby vrstvy navinuty na vnitřní trubku (jádro) (tl mm) Výhody: chemickému působení vystaveno pouze jádro navinuté vrstvy mohou být z konstrukčních ocelí výrobně jednodušší BASF šroubovité navinutí profilovaného ocelového pásu za červeného žáru ; profilování zapadá do sebe 25
26 2. Kyselina dusičná HNO3 Použití: výroba průmyslová hnojiva dusičnany barviva plasty a vlákna léčiva výbušiny pesticidy metalurgie (moření oceli) Produkce: slabá kyselina % např. hnojiva vysokokoncentrovaná kyselina % nitrace v org.ch. Vlastnosti: azeotrop 69,2 % HNO3 Metody: současnost: katalytická oxidace vzdušným kyslíkem historie: Výroba HNO3 z chilského ledku rozklad NaNO3 pomocí H2SO4 Výroba HNO3 z N2 a O2 přes NO přímá syntéza z N2 a O2 v el. oblouku 26
27 2.1 Metoda Katalytická oxidace NH3 vzdušným kyslíkem Ostwaldův postup (1902) 3 stupňový proces 1. Oxidace NH3 NO katalyzovaná reakce 4 NH3 (g) + 5 O2 (g) 4 NO (g) + 6 H2O (g) Hr 0 = 904 kj/mol 2. Oxidace NO NO2, N2O4 2 NO (g) + O2 (g) 2 NO2 (g) Hr 0 = 114 kj/mol 2 NO2 (g) N2O4 (g) Hr 0 = 57 kj/mol 3. Absorpce a vznik HNO3 N2O4 (g) N2O4 (l) Hr 0 = 28,4 kj/mol 3/2 N2O4 (l) + H2O (l) 2 HNO3 (l) + NO (g) Hr 0 = 9,34 kj/mol sumárně: 4 NH3 (g) + 8 O2 (g) 4 HNO3 (g) + 4 H2O (g) 27
28 1. Termodynamické a kinetické posouzení: 1.1 Oxidace NH3 NO Katalytická oxidace (spalování) NH3 vzdušným kyslíkem (v přebytku). Výtěžek NO: až 98 %, výstup NO: % Žádoucí reakce (1) 4 NH3 (g) + 5 O2 (g) 4 NO (g) + 6 H2O (g) Hr 0 = 904 kj/mol Nežádoucí reakce (2) 4 NH3 (g) + 3 O2 (g) 2 N2 (g) + 6 H2O (g) Hr 0 = 1268 kj/mol (3) 4 NH3 (g) + 4 O2 (g) 2 N2O (g) + 6 H2O (g) Hr 0 = 1105 kj/mol (4) 4 NH3 (g) + 6 NO (g) 5 N2 (g) + 6 H2O (g) Hr 0 = 1810 kj/mol 28
29 Výtěžek NO závisí na: teplota tlak složení reakční směsi složení a vlastnosti katalyzátoru doba styku směsi s katalyzátorem Vliv teploty T do jisté hranice se výtěžek zvyšuje vyšší teploty vyšší ztráta katalyzátoru nižší teploty vznik dusíku (reakce (2), (4)) pracovní teploty: C ( C) p T 29
30 1.1.2 Vliv tlaku vyšší tlaky: nižší investiční náklady (menší aparáty) vyšší ztráty katalyzátoru nižší výtěžek ale vyšší výkon ( 0,2 0,9 MPa) nižší tlaky vyšší výtěžek NO 100 kpa % 500 kpa % kpa.. 94 % Vliv složení reakční směsi % přebytek O2 proti stechiometrii (tj. směs cnh3 9,5 11,5 % obj.) vysoký výtěžek reakce (1), potlačení reakce (3) a zejména (2) cnh3 ve směsi NH3 vzduch = fce (tlak) ; 9,5 13 % obj., vyšší tlaky pod 11 % cnh3 < dolní mez výbušnosti ; mez výbušnosti = fce (tlak) cmez p (100 kpa 15 % obj.) 30
31 1.1.4 Vliv doby styku směsi s katalyzátorem reakční doba reakce (1): s preference (1): okamžité odvádění reakčních zplodin vyšší rychlost proudění doba styku: (1 2) x 10 4 s 10 3 s kratší doba styku: neuplatňuje se reakce (4) delší doba styku: uplatňuje se reakce (2) 31
32 1.1.5 Katalyzátor Katalyzátor: sestava několika sít nad sebou (až 50) ; p w počet sít tkaná síta Pt Rh (90 : 10, 95 : 5) Pt Rh Pd (90 : 5 : 5) průměr 4 m, ok/cm 2 životnost: 3 18 měsíců tloušťka drátu: 0,06 mm ; 0,072 mm (vyšší tlaky) Katal. jedy: PH3, H2S, oleje, prach Ztráty platiny (0,05 0,35) g / 1 t 100 % HNO3 p T ztráty mechanický otěr odpaření intermediárně vzniklého PtO2 (světle červený žár) zachycení platiny: až 80 % Pt kouskový mramor palladium zlaté sítě 32
33 2. Oxidace NO NO2, N2O4 2.1 Oxidace NO sekundárním vzduchem (5) 2 NO (g) + O2 (g) 2 NO2 (g) Hr 0 = 114 kj/mol Vliv teploty: T reakční rychlost!!!!!! T k Vliv tlaku: ϕ = 1 kontrakce objemu p výtěžek Reakce (5) je nejpomalejší určuje výslednou rychlost reakce 2.2 Tvorba dimeru N2O4 (6) 2 NO2 (g) N2O4 (g) Hr 0 = 57 kj/mol Vliv teploty: tvorba dimeru t < 150 C ; výtěžek T p Vliv tlaku: ϕ = 1 kontrakce objemu p výtěžek 33
34 3. Absorpce a vznik HNO3 N2O4 (g) N2O4 (l) Hr 0 = 28,4 kj/mol 3/2 N2O4 (l) + H2O (l) 2 HNO3 (l) + NO (g) Hr 0 = 9,34 kj/mol Vliv teploty: T absorpce Vliv tlaku: p absorpce koncentrace HNO3 Výsledky nižší tlaky vyšší tlaky využití nitrózních plynů 92 % (100 kpa) 98 % dosažená koncentrace HNO % (100 kpa) 65 % (0,8 MPa) Pozn. Vysoké koncentrace HNO3 odplyny. NOX. 34
35 Absorpce NO2 N2O4 ve vodě závisí na : teplota co nejnižší tlak co nejvyšší ; p absorpce, NOX v odplynech, konc. HNO3 doba zdržení co nejvyšší velké reakční objemy přestup hmoty typ pater množství dodané vody p množství dod.vody, absorpce, NOX v odplynech Množství dodané vody řídí se žádanou koncentrací HNO3 65 % HNO3 přidaná voda: 0,20 m 3 / t 65 % HNO3 přidaná voda: 0 m 3 / t ; pouze kyselý kondenzát 35
36 2.2 Schéma výroby NH3 (l) vzduch odpařovač filtr + kompresory filtr předehřívač reaktor Reaktor NH3 NO plyn proudí shora dolů utilizační Utilizační výměník výměník využití tepla pro výrobu páry ; výstupní teplota 150 C 36
37 sekundární vzduch chladiče kompresor Chladiče výstupní teplota C kyselý kondenzát Kompresor nitrózních plynů oxidační kolona kyselý kondenzát ox. absorpční odplyny H2O (l) kolony odstranění NOX expanzní turbína komín vzduch denitrační odplyny Denitrační kolona kolona odstranění rozpuštěných nitrózních plynů profukem vzduchu sklad 37
38 2.3 Výrobní postupy A. Rozdělení podle provozního tlaku nízkotlaké (N) kpa středotlaké (S) kpa vysokotlaké (V) kpa B. Rozdělení podle tlaků ve spalovací a oxidačně absorpční části rovnotlaké stejné tlaky v obou částech 0,3 0,6 MPa (S, V) kombinované (dual pressure) rozdílné tlaky v obou částech spalovací část 0,4 0,6 MPa (S) ox.abs. část 0,8 1 MPa (V) 38
39 Utilizační kotel chlazení reakčních plynů ; využití tepla pro vznik páry. O2 v reakčních plynech oxidace NO NO2 (p NO2 ) kondenzace vody + absorpce vznik kyselého kondenzátu (2 50 % HNO3) Absorpční kolony velkoprostorové kolony skrápěné vodou nebo kyselým kondenzátem průtok: plyn tok zezdola nahoru, kapalina zezhora dolů typy kolon: kloboučková patra sítová patra náplňové kolony více vrstev, mezi vrstvami volný prostor náplň: Raschigovy kroužky vliv tlaku: N: několik kolon S, V: 1 2 kolony Pozn. V1MPa = 1/10 V0,46 MPa 1 kolona materiály: Cr Ni 39
40 Denitrační kolona odstranění nitrózních plynů rozpuštěných v HNO3 profukem vzduchu odvod plynů do absorpce Materiály zředěná HNO3 : nerezavějící ocel (18 % Cr, 10 % Ni, Mo, Ti) méně: ferosillicium, kamenina, PVC > 90 % HNO3 : čistý hliník 40
41 Porovnání N N spalování (N) : ox -abs. kolony (N) za utilizačním výměníku 150 C odplyny > ppm NOX složení (% obj.): NO, H2O, chno3 NOX 2 5 O2, zbytek N2, vzácné plyny, NO2 nutno zařízení na čištění odplynů S V spalování (S) OA kolony (S): velké výtěžky NO odplyny 500 ppm NOX Evropa malé ztráty katalyzátoru OA kolony (V) nízké náklady na kompresi řešení absorpčně-emisního problému V1MPa = 1/10 V0,46 MPa 1 kolona odplyny 150 ppm NOX (< 200 ppm) S V Výhody: Nevýhody: relativně nízké investiční náklady menší výtěžek NO USA malá spotřeba plochy vyšší spotřeba katalyzátoru uspokojivé hodnoty emisí vyšší spotřeba energie (komprese) náklady na kompresi/celkem 1/2 41
42 2.4 Výroba koncentrované kyseliny % A. Přímé postupy (variace syntézy HNO3) B. Nepřímé postupy (odvodnění zředěné kyseliny) A. Přímá syntéza N2O4 (l) + 1/2 O 2 (g) + H2O (l) 2 HNO3 (l) Hr 0 = 39,3 kj/mol A1. Hoko proces (Uhde) oxidace N2O4 čistým kyslíkem v přítomnosti H2O (l)/ zředěné kyseliny při vysokém tlaku (5 MPa) A2. SABAR proces (McKee) Strong Acid by Azeotrope Rectification absorpce NO2 N2O4 v azeotropické kyselině (68 69 %) pod tlakem (0,5 1,3 MPa) za tvorby nadazeotropické kyseliny a její destilace 42
43 B. Nepřímé postupy (odvodnění zředěné kyseliny) B1. Extrakční destilace s koncentrovanou H2SO4 středně konc. HNO3 Nevýhody: korozní problémy + konc. destilace destilát: 99 % HNO 3 H2SO4 zbytek: zředěná H2SO4 konc. koncentrace za nízkého tlaku zředěná H 2SO4 H2SO4 B2. Extrakční destilace s 72 % roztokem Mg(NO3)2 středně konc. HNO % destilace destilát: 99 % HNO 3 Mg(NO3)2 zbytek: zředěný Mg(NO3)2 72 % koncentrace za nízkého tlaku zředěný Mg(NO 3)2 Mg(NO3)2 43
44 2.5 Čištění odplynů Odplyny z výroby HNO3 Ox. abs. část Odplyny cnox 1 t 100 % HNO3 : N > ppm až m 3 vodou nasycených odplynů S 500 ppm obj. složení: 97 % N2, 2 4 % O2, 1 % vzácné plyny, 150 > ppm NOX (cca % NO2) V < 200 ppm Možnosti snížení množství odplynů a NOX : Efektivní chlazení Velký reakční objem Optimální patra Použití kyslíku ekonomicky neúnosné.!!! Dodatečné odstranění NOX je často nákladnější než zdokonalení absorpce!!! Pozn. NO bezbarvý ; NO2 hnědá barva žlutohnědý kouř 44
45 Metody čištění Mokré postupy absorpce (alkalická vypírka) Suché postupy termická redukce katalytická redukce adsorpce A. Mokré postupy A1. Alkalická vypírka vodný roztok NaOH, NH3, močoviny, sody NOX v odplynech : 100 ppm Nevýhody: problém využití produktů: dusičnany, dusitany soda: Na2CO3 + NO + NO2 = 2 NaNO2 + CO2 Na2CO3 + 2 NO2 = NaNO3 + NaNO2 + CO2 oxidace dusitanu: 3 NaNO2 + 2 HNO3 = 3 NaNO3 + H2O + 2 NO 45
46 B. Suché postupy B1. Termická redukce redukční spalování NOX s uhlovodíky (zemní plyn, H2, topný olej) nebo CO teplota: T > C Nevýhody: nákladné (vyšší obsah O2 vyšší spotřeba uhlovodíků, CO) sekundární emise uhlovodíků nebo CO B2. Katalytická redukce B2.1 Katalytická redukce uhlovodíky katalytické spalování NOX s uhlovodíky ; NOX N2 teplota: T = C Nevýhody: nákladné (vyšší obsah O2 vyšší spotřeba uhlovodíků, CO) rychlá otrava katalyzátoru sekundární emise uhlovodíků nebo CO 46
47 B2.2 Katalytická redukce amoniakem katalytické spalování NOX s amoniakem ; NOX N2 Katalyzátor: oxidy, drahé kovy 4 NH3 + 6 NO = 5 N2 + 6 H2O 8 NH3 + 6 NO2 = 7 N H2O BASF: katalyzátor V2O5 2 NH3 + NO + NO2 = 2 N2 + 3 H2O C event. 4 NH3 + O2 + 4 NO = 4 N2 + 6 H2O obsah nitrozních plynů < 200 ppm, obsah NH3 v koncovém plynu ppm Výhody: nákladově příznivá vhodná pro S, nevhodná pro N používá se u S S, umožňuje konkurovat S V B3. Adsorpce NOX adsorpce NOX na molekulárních sítech (zeolitech) při nízkých teplotách desorpce při vyšších teplotách ( C), uvolněné NOX zpět do výroby 47
48 3. Kyanovodík HCN Použití: organické syntézy anorganické sloučeniny výroba monomerů (kyselina adipová, nylon, methylester kyseliny metakrylové) Vlastnosti: bezbarvá kapalina hořkomandlového zápachu, dokonale mísitelná s vodou čistý HCN snadno polymeruje (polymerizace silně exotermní, až expolívního charakteru stabilizace pomocí H3PO4 nebo SO2) Metody: 1. Katalytická oxidační reakce amoniaku s uhlovodíky (amoxidace) 2. Dehydrogenační reakce amoniaku s uhlovodíky (amodehydrogenace) 3. Dehydratace formamidu HCONH2 48
49 3.1 Metody 1. Katalytická oxidační reakce amoniaku s uhlovodíky (amoxidace) Andrussonův postup (amoxidace metanu) CH4 + NH3 + 3/2 O2 = HCN + 3 H2O Hr 0 = 473 kj/mol 2. Dehydrogenační reakce amoniaku s uhlovodíky (amodehydrogenace) BMA proces (Blausäure Methan Amonnia ; Degussa) (amodehydrogenace metanu) CH4 + NH3 = HCN + 3 H2 Hr 0 = kj/mol 3. Dehydratace formamidu HCONH2 NH3 + CO = HCONH2 HCONH2 = HCN + H2O Hr 0 = kj/mol 49
50 3.2 Výrobní postupy 1. Katalytická oxidační reakce amoniaku s uhlovodíky (amoxidace) Andrussonův postup (amoxidace metanu) CH4 + NH3 + 3/2 O2 = HCN + 3 H2O Hr 0 = 473 kj/mol oxidace směsi NH3 + CH4 vzdušným kyslíkem na rozžhavené Pt (Pt-Rh) síťce popis: reakce za normálního tlaku při teplotě C, krátká doba zdržení na katalyzátoru rychlé ochlazení pro zamezení rozkladu HCN vypírka nezreagovaného amoniaku pomocí H2SO4 absorpce HCN do vody destilace vodného roztoku HCN pro získání koncentrovanějšího roztoku 50
51 2. Dehydrogenační reakce amoniaku s uhlovodíky (amodehydrogenace) BMA proces (Blausäure Methan Amonnia ; Degussa) (amodehydrogenace metanu) CH4 + NH3 = HCN + 3 H2 Hr 0 = kj/mol popis: reakce na povrchu trubek ze slinutého korundu potažených vrstvou Pt, Rh, nebo Pt-Al vzniklý HCN je prostý CO2 3. Dehydratace formamidu HCONH2 vznik formamidu v metanolovém roztoku při tlaku 2 10 MPa a teplotě C rozklad formamidu rozklad za sníženého tlaku při teplotě C v ocelových kontaktních reaktorech za přítomnosti katalyzátoru katalyzátor: fosforečnany Fe nebo Al s promotory: příměsi Mg, Ca, Zn, Mn koncentrace HCN z reaktoru: % obj. lze přímo zkapalnit. 51
52 4. Močovina Použití: dusíkaté hnojivo přísada do krmiv organické syntézy 4.1 Metoda Tlaková syntéza amoniaku a CO2 1. stupeň: tvorba karbaminanu amonného 2 NH3 (l) + CO2 (g) = NH2COONH4 (l) Hr 0 = 117 kj/mol 2. stupeň: rozklad karbaminanu amonného NH2COONH4 (l) = H2NCONH2 (l) + H2O (l) Hr 0 = + 15,5 kj/mol 52
53 Termodynamické a kinetické posouzení 1. stupeň teplota TD: exotermická reakce + K a = f (T) + Chatelier T výtěžek KIN: T r tlak ϕ = 2 kontrakce objemu p výtěžek kvantitativní reakce složení reakční směsi přebytek amoniaku ; NH3 : CO2 = 4,5 : 1 (mol) inerty inerty výtěžek pracovní podmínky p 20 MPa T = C 2. stupeň teplota TD: endo T výtěžek KIN: T r složení reakční směsi karbamin ( proto přebytek NH3 v 1. stupni) voda 53
54 4.2 Výrobní postupy Bez recirkulace XNH3 30 % S recirkulací NH3 XNH3 50 % S recirkulací NH3 a CO2 S recirkulací a stripováním CO2 Radek
Průmysl dusíku. amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin. NaClO NaOH CO(NH 2 ) 2.
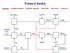 Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
Amoniak. 1913 průmyslová výroba syntetického amoniaku
 Amoniak 1913 průmyslová výroba syntetického amoniaku využití 20 % výroba dusíkatých hnojiv 80 % nejrůznější odvětví průmyslu (plasty, vlákna, výbušiny, hydrazin, aminy, amidy, nitrily a další organické
Amoniak 1913 průmyslová výroba syntetického amoniaku využití 20 % výroba dusíkatých hnojiv 80 % nejrůznější odvětví průmyslu (plasty, vlákna, výbušiny, hydrazin, aminy, amidy, nitrily a další organické
Kyselina dusičná. jedna z nejdůležitějších chemikálií
 Kyselina dusičná jedna z nejdůležitějších chemikálií Výroba: minulost - surovinou pro průmyslovou výrobu dusičnan sodný (ledek sodný, guano) současnost - katalytické spalování amoniaku (první výrobní jednotka
Kyselina dusičná jedna z nejdůležitějších chemikálií Výroba: minulost - surovinou pro průmyslovou výrobu dusičnan sodný (ledek sodný, guano) současnost - katalytické spalování amoniaku (první výrobní jednotka
Fosfor a sloučeniny fosforu. Suroviny. Sloučeniny. kalcinace pro oddělení organických. Kyselina trihydrogenfosforečná H3PO4
 Fosfor a sloučeniny fosforu Sloučeniny Fosfor bílý Kyselina trihydrogenfosforečná H3PO4 Suroviny Apatit Ca5 (PO4)3(F, OH, Cl) fluoroapatity úpravy mletí promývání sítování magnetické oddělování oxidů železa
Fosfor a sloučeniny fosforu Sloučeniny Fosfor bílý Kyselina trihydrogenfosforečná H3PO4 Suroviny Apatit Ca5 (PO4)3(F, OH, Cl) fluoroapatity úpravy mletí promývání sítování magnetické oddělování oxidů železa
Zplyňování biomasy. Sesuvný generátor. Autotermní zplyňování Autotermní a alotermní zplyňování
 Zplyňování = termochemická přeměna uhlíkatého materiálu v pevném či kapalném skupenství na výhřevný energetický plyn pomocí zplyňovacích médií a tepla. Produktem je plyn obsahující výhřevné složky (H 2,
Zplyňování = termochemická přeměna uhlíkatého materiálu v pevném či kapalném skupenství na výhřevný energetický plyn pomocí zplyňovacích médií a tepla. Produktem je plyn obsahující výhřevné složky (H 2,
Technické plyny. kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny)
 Technické plyny kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny) Kapalný vzduch složení vzduchu Před zkapalněním odstranění nežádoucích složek, např. vodní pára, CO 2, prach Zkapalňování
Technické plyny kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny) Kapalný vzduch složení vzduchu Před zkapalněním odstranění nežádoucích složek, např. vodní pára, CO 2, prach Zkapalňování
Omezování plynných emisí. Ochrana ovzduší ZS 2012/2013
 Omezování plynných emisí Ochrana ovzduší ZS 2012/2013 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Omezování plynných emisí Ochrana ovzduší ZS 2012/2013 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Omezování plynných emisí. Ochrana ovzduší ZS 2010/2011
 Omezování plynných emisí Ochrana ovzduší ZS 2010/2011 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Omezování plynných emisí Ochrana ovzduší ZS 2010/2011 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
zpracování těžkých frakcí na motorová paliva (mazut i vakuový zbytek)
 Ropa štěpné procesy zpracování těžkých frakcí na motorová paliva (mazut i vakuový zbytek) typy štěpných procesů: - termické krakování - katalytické krakování - hydrogenační krakování (hydrokrakování) podmínky
Ropa štěpné procesy zpracování těžkých frakcí na motorová paliva (mazut i vakuový zbytek) typy štěpných procesů: - termické krakování - katalytické krakování - hydrogenační krakování (hydrokrakování) podmínky
Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška Rafinace pohonných hmot, zpracování sulfanu, výroba vodíku
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška Rafinace pohonných hmot, zpracování sulfanu, výroba vodíku
Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0
 Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N VÝROBA MTBE
 CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N409059 VÝROBA MTBE Fyzikální a chemické vlastnosti Suroviny Reakce Technologie Dvoustupňová výroba Jednostupňová výroba Charakteristiky technologií Zdroje
CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N409059 VÝROBA MTBE Fyzikální a chemické vlastnosti Suroviny Reakce Technologie Dvoustupňová výroba Jednostupňová výroba Charakteristiky technologií Zdroje
TERMICKÉ PROCESY PŘI VYUŽITÍ ALTERNATIVNÍCH SUROVIN. Most, 13.6.2013 Autor: Doc. Ing. J.LEDERER, CSc.
 TERMICKÉ PROCESY PŘI VYUŽITÍ ALTERNATIVNÍCH SUROVIN Most, 13.6.2013 Autor: Doc. Ing. J.LEDERER, CSc. OBSAH PRINCIPY POUŽÍVANÝCH TERMOCHEMICKÝCH PROCESŮ VELKOKAPACITNÍ REALIZACE TERMOCHEMICKÝCH PROCESŮ
TERMICKÉ PROCESY PŘI VYUŽITÍ ALTERNATIVNÍCH SUROVIN Most, 13.6.2013 Autor: Doc. Ing. J.LEDERER, CSc. OBSAH PRINCIPY POUŽÍVANÝCH TERMOCHEMICKÝCH PROCESŮ VELKOKAPACITNÍ REALIZACE TERMOCHEMICKÝCH PROCESŮ
Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np:
 PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
Kyselina fosforečná Suroviny: Výroba: termický způsob extrakční způsob
 Kyselina fosforečná bezbarvá krystalická sloučenina snadno rozpustná ve vodě komerčně dodávané koncentrace 75% H 3 PO 4 s 54,3% P 2 O 5 80% H 3 PO 4 s 58.0% P 2 O 5 85% H 3 PO 4 s 61.6% P 2 O 5 po kyselině
Kyselina fosforečná bezbarvá krystalická sloučenina snadno rozpustná ve vodě komerčně dodávané koncentrace 75% H 3 PO 4 s 54,3% P 2 O 5 80% H 3 PO 4 s 58.0% P 2 O 5 85% H 3 PO 4 s 61.6% P 2 O 5 po kyselině
TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ)
 TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ) 5. část TĚKAVÉ ORGANICKÉ SLOUČENINY A PACHOVÉ LÁTKY Zpracoval: Tým autorů EVECO Brno, s.r.o. TĚKAVÉ ORGANICKÉ SLOUČENINY Těkavé organické
TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ) 5. část TĚKAVÉ ORGANICKÉ SLOUČENINY A PACHOVÉ LÁTKY Zpracoval: Tým autorů EVECO Brno, s.r.o. TĚKAVÉ ORGANICKÉ SLOUČENINY Těkavé organické
11. Zemní plyn jako energetická a chemická surovina. Ing. Tomáš Hlinčík, Ph.D.
 11. Zemní plyn jako energetická a chemická surovina Ing. Tomáš Hlinčík, Ph.D. Zpracování zemního plynu Nepřímá přeměna methanu syntézní plyn (chemikálie, paliva) - výroba vodíku pro syntézu amoniaku -
11. Zemní plyn jako energetická a chemická surovina Ing. Tomáš Hlinčík, Ph.D. Zpracování zemního plynu Nepřímá přeměna methanu syntézní plyn (chemikálie, paliva) - výroba vodíku pro syntézu amoniaku -
Kolik energie by se uvolnilo, kdyby spalování ethanolu probíhalo při teplotě o 20 vyšší? Je tato energie menší nebo větší než při teplotě 37 C?
 TERMOCHEMIE Reakční entalpie při izotermním průběhu reakce, rozsah reakce 1 Kolik tepla se uvolní (nebo spotřebuje) při výrobě 2,2 kg acetaldehydu C 2 H 5 OH(g) = CH 3 CHO(g) + H 2 (g) (a) při teplotě
TERMOCHEMIE Reakční entalpie při izotermním průběhu reakce, rozsah reakce 1 Kolik tepla se uvolní (nebo spotřebuje) při výrobě 2,2 kg acetaldehydu C 2 H 5 OH(g) = CH 3 CHO(g) + H 2 (g) (a) při teplotě
Ropa Kondenzované uhlovodíky
 Nejdůležitější surovina pro výrobu organických sloučenin Nejvýznamnější surovina světové ekonomiky Výroba energie Chemické zpracování - 15 % Cena a zásoby ropy (70-100 let) Ropné krize Nutnost hledání
Nejdůležitější surovina pro výrobu organických sloučenin Nejvýznamnější surovina světové ekonomiky Výroba energie Chemické zpracování - 15 % Cena a zásoby ropy (70-100 let) Ropné krize Nutnost hledání
 Základní anorganické výroby PRŮMYSLVÁ ANRGANICKÁ CHEMIE Voda Výroba Filtrace Úprava dstraňování nečistot Vodík Výroba vodíku Petrochemie Elektrochemie Peroxid vodíku a anorganické peroxosloučeniny Dusík
Základní anorganické výroby PRŮMYSLVÁ ANRGANICKÁ CHEMIE Voda Výroba Filtrace Úprava dstraňování nečistot Vodík Výroba vodíku Petrochemie Elektrochemie Peroxid vodíku a anorganické peroxosloučeniny Dusík
Síra a sloučeniny síry. 1. Síra S. Sloučeniny. rekuperace síry z jiných průmyslových surovin a produktů. vulkanizační přísady. Kyselina sírová H2SO4
 Síra a sloučeniny síry Sloučeniny Kyselina sírová H2SO4 Oxidy síry Sirouhlík CS2 (viskózní vlákna) 1. Síra S Zdroje: těžba elementární síry rekuperace síry z jiných průmyslových surovin a produktů (např.
Síra a sloučeniny síry Sloučeniny Kyselina sírová H2SO4 Oxidy síry Sirouhlík CS2 (viskózní vlákna) 1. Síra S Zdroje: těžba elementární síry rekuperace síry z jiných průmyslových surovin a produktů (např.
Bezpečnostní inženýrství - Chemické procesy -
 Bezpečnostní inženýrství - Chemické procesy - M. Jahoda Nebezpečí a prevence chemických procesů 2 Chemické reakce Tepelné efekty exotermní procesy (teplo se uvolňuje => nutnost chlazení) endotermní procesy
Bezpečnostní inženýrství - Chemické procesy - M. Jahoda Nebezpečí a prevence chemických procesů 2 Chemické reakce Tepelné efekty exotermní procesy (teplo se uvolňuje => nutnost chlazení) endotermní procesy
Chemické procesy v ochraně životního prostředí
 Chemické procesy v ochraně životního prostředí 1. Vliv výroby energie na životní prostředí 2. Zpracování výfukových plynů ze spalovacích motorů 3. Zachycování oxidů síry ve spalinách 4. Výroba paliv pro
Chemické procesy v ochraně životního prostředí 1. Vliv výroby energie na životní prostředí 2. Zpracování výfukových plynů ze spalovacích motorů 3. Zachycování oxidů síry ve spalinách 4. Výroba paliv pro
Dusík a jeho sloučeniny
 Dusík a jeho sloučeniny Mgr. Jana Pertlová Copyright istudium, 2008, http://www.istudium.cz Žádná část této publikace nesmí být publikována a šířena žádným způsobem a v žádné podobě bez výslovného svolení
Dusík a jeho sloučeniny Mgr. Jana Pertlová Copyright istudium, 2008, http://www.istudium.cz Žádná část této publikace nesmí být publikována a šířena žádným způsobem a v žádné podobě bez výslovného svolení
6.Úprava a čistění vod pro průmyslové a speciální účely
 6.Úprava a čistění vod pro průmyslové a speciální účely Ivan Holoubek Zdeněk Horsák RECETOX, Masaryk University, Brno, CR holoubek@recetox.muni.cz; http://recetox.muni.cz Inovace tohoto předmětu je spolufinancována
6.Úprava a čistění vod pro průmyslové a speciální účely Ivan Holoubek Zdeněk Horsák RECETOX, Masaryk University, Brno, CR holoubek@recetox.muni.cz; http://recetox.muni.cz Inovace tohoto předmětu je spolufinancována
Příklady úspěšných projektů čistší produkce (Cleaner Production) Výroba: kyseliny sírové mikrokorundu
 Příklady úspěšných projektů čistší produkce (Cleaner Production) Výroba: kyseliny sírové mikrokorundu Ing. Miroslav Richter, PhD., EUR ING Fakulta životního prostředí Univerzity J.E.Purkyně v Ústí n.l.
Příklady úspěšných projektů čistší produkce (Cleaner Production) Výroba: kyseliny sírové mikrokorundu Ing. Miroslav Richter, PhD., EUR ING Fakulta životního prostředí Univerzity J.E.Purkyně v Ústí n.l.
Škola: Gymnázium, Brno, Slovanské náměstí 7 III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
H H C C C C C C H CH 3 H C C H H H H H H
 Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Bezpečnost chemických výrob N111001
 Bezpečnost chemických výrob N111 Petr Zámostný místnost: A-72a tel.: 4222 e-mail: petr.zamostny@vscht.cz Rizika spojená s hořlavými látkami Povaha procesů hoření a výbuchu Požární charakteristiky látek
Bezpečnost chemických výrob N111 Petr Zámostný místnost: A-72a tel.: 4222 e-mail: petr.zamostny@vscht.cz Rizika spojená s hořlavými látkami Povaha procesů hoření a výbuchu Požární charakteristiky látek
NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE. Ing. Stanislav HONUS
 NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE Ing. Stanislav HONUS ORGANICKÝ MATERIÁL Spalování Chemické přeměny Chem. přeměny ve vodním prostředí Pyrolýza Zplyňování Chemické Biologické Teplo
NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE Ing. Stanislav HONUS ORGANICKÝ MATERIÁL Spalování Chemické přeměny Chem. přeměny ve vodním prostředí Pyrolýza Zplyňování Chemické Biologické Teplo
Dusík a fosfor. Dusík
 5.9.010 Dusík a fosfor Dusík lyn Bezbarvý, bez chuti a zápachu Vyskytuje se v dvouatomových molekulách N Molekuly dusíku extremně stabilní říprava: reakce dusitanů s amonnými ionty NH N N ( ( ( ( Výroba:
5.9.010 Dusík a fosfor Dusík lyn Bezbarvý, bez chuti a zápachu Vyskytuje se v dvouatomových molekulách N Molekuly dusíku extremně stabilní říprava: reakce dusitanů s amonnými ionty NH N N ( ( ( ( Výroba:
III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Třífázové trubkové reaktory se zkrápěným ložem katalyzátoru. Předmět: Vícefázové reaktory Jméno: Veronika Sedláková
 Třífázové trubkové reaktory se zkrápěným ložem katalyzátoru Předmět: Vícefázové reaktory Jméno: Veronika Sedláková 3-fázové reakce Autoklávy (diskontinuální) Trubkové reaktory (kontinuální) Probublávané
Třífázové trubkové reaktory se zkrápěným ložem katalyzátoru Předmět: Vícefázové reaktory Jméno: Veronika Sedláková 3-fázové reakce Autoklávy (diskontinuální) Trubkové reaktory (kontinuální) Probublávané
Ing.Hugo Kittel, CSc., MBA, ČeR a.s. Kralupy n.vlt. Presentace vypracovaná pro ČAPPO Praha 2.10.2002
 Ing.Hugo Kittel, CSc., MBA, ČeR a.s. Kralupy n.vlt Presentace vypracovaná pro ČAPPO Praha 2.10.2002 GTL (Gas-to-Liquid) představuje obecný pojem používaný pro technologie konverze plynu na kapalné produkty
Ing.Hugo Kittel, CSc., MBA, ČeR a.s. Kralupy n.vlt Presentace vypracovaná pro ČAPPO Praha 2.10.2002 GTL (Gas-to-Liquid) představuje obecný pojem používaný pro technologie konverze plynu na kapalné produkty
Výměna tepla může probíhat vedením (kondukcí), prouděním (konvekcí) nebo sáláním (zářením).
 10. VÝMĚNÍKY TEPLA Výměníky tepla jsou zařízení, ve kterých se jeden proud ohřívá a druhý ochlazuje sdílením tepla. Nezáleží přitom na konečném cíli operace, tj. zda chceme proud ochladit nebo ohřát, ani
10. VÝMĚNÍKY TEPLA Výměníky tepla jsou zařízení, ve kterých se jeden proud ohřívá a druhý ochlazuje sdílením tepla. Nezáleží přitom na konečném cíli operace, tj. zda chceme proud ochladit nebo ohřát, ani
Amoniak průmyslová výroba syntetického amoniaku
 Amoniak 1913 průmyslová výroba syntetického amoniaku využití 20 % výroba dusíkatých hnojiv 80 % nejrůznější odvětví průmyslu (plasty, vlákna, výbušiny, hydrazin, aminy, amidy, nitrily a další organické
Amoniak 1913 průmyslová výroba syntetického amoniaku využití 20 % výroba dusíkatých hnojiv 80 % nejrůznější odvětví průmyslu (plasty, vlákna, výbušiny, hydrazin, aminy, amidy, nitrily a další organické
1.1 Suroviny síry Průmyslově využitelné suroviny pro zisk síry nebo jejích sloučenin nebo dalších složek obsažených v příslušných minerálech výskyt:
 1. Chemie a technologie sloučenin síry 1.1 Suroviny síry Průmyslově využitelné suroviny pro zisk síry nebo jejích sloučenin nebo dalších složek obsažených v příslušných minerálech výskyt: Elementární síra:
1. Chemie a technologie sloučenin síry 1.1 Suroviny síry Průmyslově využitelné suroviny pro zisk síry nebo jejích sloučenin nebo dalších složek obsažených v příslušných minerálech výskyt: Elementární síra:
Negativní vliv energetického využití biomasy Ing. Marek Baláš, Ph.D.
 Negativní vliv energetického využití biomasy Ing. Marek Baláš, Ph.D. Osnova 2 Legislativa Biomasa druhy složení Emise vznik, množství, vlastnosti, dopad na ŽP a zdraví, opatření CO SO 2 NO x Chlor TZL
Negativní vliv energetického využití biomasy Ing. Marek Baláš, Ph.D. Osnova 2 Legislativa Biomasa druhy složení Emise vznik, množství, vlastnosti, dopad na ŽP a zdraví, opatření CO SO 2 NO x Chlor TZL
Inovace bakalářského studijního oboru Aplikovaná chemie CZ.1.07/2.2.00/ Výpočty z chemických vzorců
 Výpočty z chemických vzorců 1. Hmotnost kyslíku je 80 g. Vypočítejte : a) počet atomů kyslíku ( 3,011 10 atomů) b) počet molů kyslíku (2,5 mol) c) počet molekul kyslíku (1,505 10 24 molekul) d) objem (dm
Výpočty z chemických vzorců 1. Hmotnost kyslíku je 80 g. Vypočítejte : a) počet atomů kyslíku ( 3,011 10 atomů) b) počet molů kyslíku (2,5 mol) c) počet molekul kyslíku (1,505 10 24 molekul) d) objem (dm
Úlohy: 1) Vypočítejte tepelné zabarvení dané reakce z následujících dat: C 2 H 4(g) + H 2(g) C 2 H 6(g)
 Úlohy: 1) Vypočítejte tepelné zabarvení dané reakce z následujících dat: C 2 H 4(g) + H 2(g) C 2 H 6(g) C 2 H 4(g) + 3O 2(g ) 2CO 2(g) +2H 2 O (l) H 0 298,15 = -1410,9kJ.mol -1 2C 2 H 6(g) + 7O 2(g) 4CO
Úlohy: 1) Vypočítejte tepelné zabarvení dané reakce z následujících dat: C 2 H 4(g) + H 2(g) C 2 H 6(g) C 2 H 4(g) + 3O 2(g ) 2CO 2(g) +2H 2 O (l) H 0 298,15 = -1410,9kJ.mol -1 2C 2 H 6(g) + 7O 2(g) 4CO
Registrační číslo projektu: CZ.1.07/1.4.00/21.2939. Název projektu: Investice do vzdělání - příslib do budoucnosti
 Registrační číslo projektu: CZ.1.07/1.4.00/21.2939 Název projektu: Investice do vzdělání - příslib do budoucnosti Číslo přílohy: VY_číslo šablony_inovace_číslo přílohy Autor Datum vytvoření vzdělávacího
Registrační číslo projektu: CZ.1.07/1.4.00/21.2939 Název projektu: Investice do vzdělání - příslib do budoucnosti Číslo přílohy: VY_číslo šablony_inovace_číslo přílohy Autor Datum vytvoření vzdělávacího
Bilan a ce c zák á l k ad a ní pojm j y m aplikace zákonů o zachování čehokoli 10.10.2008 3
 Výpočtový seminář z Procesního inženýrství podzim 2008 Bilance Materiálové a látkové 10.10.2008 1 Tématické okruhy bilance - základní pojmy bilanční schéma způsoby vyjadřování koncentrací a přepočtové
Výpočtový seminář z Procesního inženýrství podzim 2008 Bilance Materiálové a látkové 10.10.2008 1 Tématické okruhy bilance - základní pojmy bilanční schéma způsoby vyjadřování koncentrací a přepočtové
Autokláv reaktor pro promíchávané vícefázové reakce
 Vysoká škola chemicko technologická v Praze Ústav organické technologie (111) Autokláv reaktor pro promíchávané vícefázové reakce Vypracoval : Bc. Tomáš Sommer Předmět: Vícefázové reaktory (prof. Ing.
Vysoká škola chemicko technologická v Praze Ústav organické technologie (111) Autokláv reaktor pro promíchávané vícefázové reakce Vypracoval : Bc. Tomáš Sommer Předmět: Vícefázové reaktory (prof. Ing.
Perspektivní metody. PROČ sušení pevných paliv? Většina dodané energie se ztrácí. Klasická metoda sušení horkými spalinami
 Perspektivní metody sušení pevných paliv Klasická metoda sušení horkými spalinami Uzavřený mlecí okruh PROČ sušení pevných paliv? zvýšení výhřevnosti snazší vzněcování spalování při vyšší teplotě menší
Perspektivní metody sušení pevných paliv Klasická metoda sušení horkými spalinami Uzavřený mlecí okruh PROČ sušení pevných paliv? zvýšení výhřevnosti snazší vzněcování spalování při vyšší teplotě menší
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115
 Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: CZ.1.07/1.5.00/34.0410 Číslo šablony: 23 Název materiálu: Ročník: Identifikace materiálu: Jméno autora: Předmět: Tématický celek:
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: CZ.1.07/1.5.00/34.0410 Číslo šablony: 23 Název materiálu: Ročník: Identifikace materiálu: Jméno autora: Předmět: Tématický celek:
Složení soustav (roztoky, koncentrace látkového množství)
 VZOROVÉ PŘÍKLADY Z CHEMIE A DOPORUČENÁ LITERATURA pro přípravu k přijímací zkoušce studijnímu oboru Nanotechnologie na VŠB TU Ostrava Doporučená literatura z chemie: Prakticky jakákoliv celostátní učebnice
VZOROVÉ PŘÍKLADY Z CHEMIE A DOPORUČENÁ LITERATURA pro přípravu k přijímací zkoušce studijnímu oboru Nanotechnologie na VŠB TU Ostrava Doporučená literatura z chemie: Prakticky jakákoliv celostátní učebnice
Třífázové trubkové reaktory se zkrápěným ložem katalyzátoru. Roman Snop
 Třífázové trubkové reaktory se zkrápěným ložem katalyzátoru Roman Snop Charakteristika Zkrápěné reaktory jsou nejvhodněji aplikovatelné na provoz heterogenně katalyzovaných reakcí. Nacházejí uplatnění
Třífázové trubkové reaktory se zkrápěným ložem katalyzátoru Roman Snop Charakteristika Zkrápěné reaktory jsou nejvhodněji aplikovatelné na provoz heterogenně katalyzovaných reakcí. Nacházejí uplatnění
Denitrifikace. Ochrana ovzduší ZS 2012/2013
 Denitrifikace Ochrana ovzduší ZS 2012/2013 1 Úvod Pojem oxidy dusíku NO NO 2 Další formy NO x Vznik NO x 2 Vlastnosti NO Oxid dusnatý Vlastnosti M mol,no = 30,01 kg/kmol V mol,no,n = 22,41 m 3 /kmol ρ
Denitrifikace Ochrana ovzduší ZS 2012/2013 1 Úvod Pojem oxidy dusíku NO NO 2 Další formy NO x Vznik NO x 2 Vlastnosti NO Oxid dusnatý Vlastnosti M mol,no = 30,01 kg/kmol V mol,no,n = 22,41 m 3 /kmol ρ
Zplyňování. Ing. Martin Lisý, PhD. Energetický ústav VUT v Brně Fakulta strojního inženýrství
 Zplyňování Ing. Martin Lisý, PhD. Energetický ústav VUT v Brně Fakulta strojního inženýrství Projekt je spolufinancován Evropským sociálním fondem a Statním rozpočtem ČR Technologie zpracování biomasy
Zplyňování Ing. Martin Lisý, PhD. Energetický ústav VUT v Brně Fakulta strojního inženýrství Projekt je spolufinancován Evropským sociálním fondem a Statním rozpočtem ČR Technologie zpracování biomasy
Směšovací poměr a emise
 Směšovací poměr a emise Hmotnostní poměr mezi palivem a okysličovadlem - u motorů provozovaných v atmosféře, je okysličovadlem okolní vzduch Složení vzduchu: (objemové podíly) - 78% dusík N 2-21% kyslík
Směšovací poměr a emise Hmotnostní poměr mezi palivem a okysličovadlem - u motorů provozovaných v atmosféře, je okysličovadlem okolní vzduch Složení vzduchu: (objemové podíly) - 78% dusík N 2-21% kyslík
TECHNOLOGIE OCHRANY OVZDUŠÍ
 TECHNOLOGIE OCHRANY OVZDUŠÍ Přednáška č. 7 Přednášející: Ing. Marek Staf, Ph.D. tel. 220 444 458; e-mail marek.staf@vscht.cz budova A, ústav 216, č. dveří 162 Snímek 1. Osnova přednášky Původ emisí N 2
TECHNOLOGIE OCHRANY OVZDUŠÍ Přednáška č. 7 Přednášející: Ing. Marek Staf, Ph.D. tel. 220 444 458; e-mail marek.staf@vscht.cz budova A, ústav 216, č. dveří 162 Snímek 1. Osnova přednášky Původ emisí N 2
TECHNOLOGIE OCHRANY OVZDUŠÍ
 TECHNOLOGIE OCHRANY OVZDUŠÍ Přednáška č. 7 Přednášející: Ing. Marek Staf, Ph.D. tel. 220 444 458; e-mail marek.staf@vscht.cz budova A, ústav 216, č. dveří 162 Snímek 1. Osnova přednášky Původ emisí N 2
TECHNOLOGIE OCHRANY OVZDUŠÍ Přednáška č. 7 Přednášející: Ing. Marek Staf, Ph.D. tel. 220 444 458; e-mail marek.staf@vscht.cz budova A, ústav 216, č. dveří 162 Snímek 1. Osnova přednášky Původ emisí N 2
Paliva. nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování
 Paliva Paliva nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování Dělení paliv podle skupenství pevná uhlí, dřevo kapalná benzín,
Paliva Paliva nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování Dělení paliv podle skupenství pevná uhlí, dřevo kapalná benzín,
TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ)
 TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ) 3. část ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Zpracoval: Tým autorů EVECO Brno, s.r.o. ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Množství SO 2, HCl,
TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ) 3. část ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Zpracoval: Tým autorů EVECO Brno, s.r.o. ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Množství SO 2, HCl,
KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení. Ing. Miroslav Richter, PhD.
 KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení Ing. Miroslav Richter, PhD., EUR ING 2014 Materiálové bilance 3.5.1 Do tkaninového filtru vstupuje 10000
KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení Ing. Miroslav Richter, PhD., EUR ING 2014 Materiálové bilance 3.5.1 Do tkaninového filtru vstupuje 10000
Model dokonalého spalování pevných a kapalných paliv Teoretické základy spalování. Teoretické základy spalování
 Spalování je fyzikálně chemický pochod, při kterém probíhá organizovaná příprava hořlavé směsi paliva s okysličovadlem a jejich slučování (hoření) za intenzivního uvolňování tepla, což způsobuje prudké
Spalování je fyzikálně chemický pochod, při kterém probíhá organizovaná příprava hořlavé směsi paliva s okysličovadlem a jejich slučování (hoření) za intenzivního uvolňování tepla, což způsobuje prudké
DUM č. 2 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 2 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 2 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace
 Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE. Spalování paliv Spalovací turbíny Ing. Jan Andreovský Ph.D.
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Spalování paliv Spalovací turbíny Ing. Jan Andreovský Ph.D. Spalovací turbíny Základní informace Historie a vývoj Spalovací
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Spalování paliv Spalovací turbíny Ing. Jan Andreovský Ph.D. Spalovací turbíny Základní informace Historie a vývoj Spalovací
Předmět: CHEMIE Ročník: 8. ŠVP Základní škola Brno, Hroznová 1. Výstupy předmětu
 Chemie ukázka chemického skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce práce s dostupnými a běžně používanými látkami (směsmi). Na základě piktogramů žák posoudí nebezpečnost
Chemie ukázka chemického skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce práce s dostupnými a běžně používanými látkami (směsmi). Na základě piktogramů žák posoudí nebezpečnost
Energetické zhodnocení komunálního odpadu, plastů, kalů ČOV, kyselých kalů, gudrónov, gumy a biomasy
 Energetické zhodnocení komunálního odpadu, plastů, kalů ČOV, kyselých kalů, gudrónov, gumy a biomasy obsah Prezentace cíl společnosti Odpadní komodity a jejich složení Nakládání s komunálním odpadem Thermo-katalitická
Energetické zhodnocení komunálního odpadu, plastů, kalů ČOV, kyselých kalů, gudrónov, gumy a biomasy obsah Prezentace cíl společnosti Odpadní komodity a jejich složení Nakládání s komunálním odpadem Thermo-katalitická
Prvky 8. B skupiny. FeCoNi. FeCoNi. FeCoNi 17.12.2011
 FeCoNi Prvky 8. B skupiny FeCoNi Valenční vrstva: x [vzácný plyn] ns 2 (n-1)d 6 x [vzácný plyn] ns 2 (n-1)d 7 x [vzácný plyn] ns 2 (n-1)d 8 Tomáš Kekrt 17.12.2011 SRG Přírodní škola o. p. s. 2 FeCoNi Fe
FeCoNi Prvky 8. B skupiny FeCoNi Valenční vrstva: x [vzácný plyn] ns 2 (n-1)d 6 x [vzácný plyn] ns 2 (n-1)d 7 x [vzácný plyn] ns 2 (n-1)d 8 Tomáš Kekrt 17.12.2011 SRG Přírodní škola o. p. s. 2 FeCoNi Fe
V. Soustavy s chemickou reakcí
 V. Soustavy s chemickou reakcí 1 5. Soustavy s chemickou reakcí 5.1 Základní pojmy 5.2 Rozdělení reakcí 5.3 Reakční kinetika 5.3.1 Podmínky pro zreagování dvou molekul 5.3.2 Mechanismy reakce 5.3.3 Rychlost
V. Soustavy s chemickou reakcí 1 5. Soustavy s chemickou reakcí 5.1 Základní pojmy 5.2 Rozdělení reakcí 5.3 Reakční kinetika 5.3.1 Podmínky pro zreagování dvou molekul 5.3.2 Mechanismy reakce 5.3.3 Rychlost
Tematický blok 2 Zdroje znečišťování ovzduší Chemický průmysl Ing. Miroslav Richter, Ph.D., EUR ING miroslav.richter@ujep.cz
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Tematický blok 2 Zdroje znečišťování ovzduší Chemický průmysl Ing. Miroslav Richter, Ph.D., EUR ING miroslav.richter@ujep.cz
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Tematický blok 2 Zdroje znečišťování ovzduší Chemický průmysl Ing. Miroslav Richter, Ph.D., EUR ING miroslav.richter@ujep.cz
ÚPRAVA VODY V ENERGETICE. Ing. Jiří Tomčala
 ÚPRAVA VODY V ENERGETICE Ing. Jiří Tomčala Úvod Voda je v elektrárnách po palivu nejdůležitější surovinou Její množství v provozních systémech elektráren je mnohonásobně větší než množství spotřebovaného
ÚPRAVA VODY V ENERGETICE Ing. Jiří Tomčala Úvod Voda je v elektrárnách po palivu nejdůležitější surovinou Její množství v provozních systémech elektráren je mnohonásobně větší než množství spotřebovaného
ANORGANICKÁ ORGANICKÁ
 EMIE ANORGANIKÁ ORGANIKÁ 1 EMIE ANORGANIKÁ Anorganické látky Oxidy: O, O 2.. V neživé přírodě.. alogenidy: Nal.. ydroxidy: NaO Uhličitany: ao 3... Kyseliny: l. ydrogenuhličitany: NaO 3. 2 EMIE ORGANIKÁ
EMIE ANORGANIKÁ ORGANIKÁ 1 EMIE ANORGANIKÁ Anorganické látky Oxidy: O, O 2.. V neživé přírodě.. alogenidy: Nal.. ydroxidy: NaO Uhličitany: ao 3... Kyseliny: l. ydrogenuhličitany: NaO 3. 2 EMIE ORGANIKÁ
Co víme o nekatalytické redukci oxidů dusíku
 Co víme o nekatalytické redukci oxidů dusíku Ing. Pavel Machač, CSc., email: pavel.machac@vscht.cz, tel.: (40) 0 444 46 Ing. Jana Vávrová, email: jana1.vavrova@vscht.cz, tel.: (40) 74 971 991 VŠCHT Praha,
Co víme o nekatalytické redukci oxidů dusíku Ing. Pavel Machač, CSc., email: pavel.machac@vscht.cz, tel.: (40) 0 444 46 Ing. Jana Vávrová, email: jana1.vavrova@vscht.cz, tel.: (40) 74 971 991 VŠCHT Praha,
Ústřední komise Chemické olympiády. 55. ročník 2018/2019 OKRESNÍ KOLO. Kategorie D. Teoretická část Řešení
 Ústřední komise Chemické olympiády 55. ročník 2018/2019 OKRESNÍ KOLO Kategorie D Teoretická část Řešení Úloha 1 Bezpečnostní předpisy MarsCity II 16 bodů 1) Vybrané činnosti: a) Zvracení na mramorovou
Ústřední komise Chemické olympiády 55. ročník 2018/2019 OKRESNÍ KOLO Kategorie D Teoretická část Řešení Úloha 1 Bezpečnostní předpisy MarsCity II 16 bodů 1) Vybrané činnosti: a) Zvracení na mramorovou
Sloučeniny dusíku a fosforu
 VY_32_IOVACE_30_BE13.notebook Sloučeniny dusíku a fosforu Temacká oblast : Chemie anorganická chemie Datum vytvoření: 25. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný
VY_32_IOVACE_30_BE13.notebook Sloučeniny dusíku a fosforu Temacká oblast : Chemie anorganická chemie Datum vytvoření: 25. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný
Vysokoteplotní karbonátová smyčka moderní metoda odstraňování CO 2 ze spalin
 Vysokoteplotní karbonátová smyčka moderní metoda odstraňování CO 2 ze spalin Karel Ciahotný Marek Staf Tomáš Hlinčík Veronika Vrbová Viktor Tekáč Ivo Jiříček ICCT Mikulov 2015 shrnutí doposud získaných
Vysokoteplotní karbonátová smyčka moderní metoda odstraňování CO 2 ze spalin Karel Ciahotný Marek Staf Tomáš Hlinčík Veronika Vrbová Viktor Tekáč Ivo Jiříček ICCT Mikulov 2015 shrnutí doposud získaných
Fotokatalytická oxidace acetonu
 Fotokatalytická oxidace acetonu Hana Žabová 5. ročník Doc. Ing. Bohumír Dvořák, CSc Osnova 1. ÚVOD 2. CÍL PRÁCE 3. FOTOKATALYTICKÁ OXIDACE Mechanismus Katalyzátor Nosič-typy Aparatura 4. VÝSLEDKY 5. ZÁVĚR
Fotokatalytická oxidace acetonu Hana Žabová 5. ročník Doc. Ing. Bohumír Dvořák, CSc Osnova 1. ÚVOD 2. CÍL PRÁCE 3. FOTOKATALYTICKÁ OXIDACE Mechanismus Katalyzátor Nosič-typy Aparatura 4. VÝSLEDKY 5. ZÁVĚR
3. Soda a potaš Ing. Miroslav Richter, Ph.D., EUR ING
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE 3. Soda a potaš Ing. Miroslav Richter, Ph.D., EUR ING Výroby sody a potaše Suroviny, Přehled výrobních technologií
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE 3. Soda a potaš Ing. Miroslav Richter, Ph.D., EUR ING Výroby sody a potaše Suroviny, Přehled výrobních technologií
Parní turbíny Rovnotlaký stupeň
 Parní turbíny Dominanci parních turbín v energetickém průmyslu vyvolaly provozní a ekonomické výhody,zejména: Menší investiční náklady, hmotnost a obestavěný prostor, vztažený na jednotku výkonu. Možnost
Parní turbíny Dominanci parních turbín v energetickém průmyslu vyvolaly provozní a ekonomické výhody,zejména: Menší investiční náklady, hmotnost a obestavěný prostor, vztažený na jednotku výkonu. Možnost
Biologické odsiřování bioplynu. Ing. Dana Pokorná, CSc.
 Biologické odsiřování bioplynu Ing. Dana Pokorná, CSc. Sulfan problematická složka bioplynu Odkud se sulfan v bioplynu bere? Organická síra proteiny s inkorporovanou sírou Odpady a odpadní vody z průmyslu
Biologické odsiřování bioplynu Ing. Dana Pokorná, CSc. Sulfan problematická složka bioplynu Odkud se sulfan v bioplynu bere? Organická síra proteiny s inkorporovanou sírou Odpady a odpadní vody z průmyslu
Energetické využití odpadu. 200 let První brněnské strojírny
 200 let První brněnské strojírny Řešení využití odpadů v nové produktové linii PBS Spalování odpadů Technologie spalování vytříděného odpadu, kontaminované dřevní hmoty Depolymerizace a možnosti využití
200 let První brněnské strojírny Řešení využití odpadů v nové produktové linii PBS Spalování odpadů Technologie spalování vytříděného odpadu, kontaminované dřevní hmoty Depolymerizace a možnosti využití
Elektrárny část II. Tepelné elektrárny. Ing. M. Bešta
 Tepelné elektrárny 1) Kondenzační elektrárny uhelné K výrobě elektrické energie se využívá tepelné energie uvolněné z uhlí spalováním. Teplo uvolněné spalováním se využívá k výrobě přehřáté (ostré) páry.
Tepelné elektrárny 1) Kondenzační elektrárny uhelné K výrobě elektrické energie se využívá tepelné energie uvolněné z uhlí spalováním. Teplo uvolněné spalováním se využívá k výrobě přehřáté (ostré) páry.
Chemie a technologie sloučenin dusíku. 1.0. Výskyt dusíku a jeho sloučenin
 Chemie a technologie sloučenin dusíku 1.0. Výskyt dusíku a jeho sloučenin V atmosféře je 79 % obj. dusíku. Zároveň se v atmosféře vyskytují stopová množství oxidů dusíku souhrnně označovaných jako NO x
Chemie a technologie sloučenin dusíku 1.0. Výskyt dusíku a jeho sloučenin V atmosféře je 79 % obj. dusíku. Zároveň se v atmosféře vyskytují stopová množství oxidů dusíku souhrnně označovaných jako NO x
Učební osnova předmětu Chemická technologie
 Učební osnova předmětu Chemická technologie Studijní obor: Aplikovaná chemie Zaměření: Forma vzdělávání: ochrana životního prostředí analytická chemie chemická technologie denní Celkový počet vyučovacích
Učební osnova předmětu Chemická technologie Studijní obor: Aplikovaná chemie Zaměření: Forma vzdělávání: ochrana životního prostředí analytická chemie chemická technologie denní Celkový počet vyučovacích
Vodík jako alternativní ekologické palivo. palivové články a vodíkové hospodářství
 Vodík jako alternativní ekologické palivo palivové články a vodíkové hospodářství Charakteristika vodíku vodík je nejrozšířenějším prvkem ve vesmíru na Zemi je třetím nejrozšířenějším prvkem po kyslíku
Vodík jako alternativní ekologické palivo palivové články a vodíkové hospodářství Charakteristika vodíku vodík je nejrozšířenějším prvkem ve vesmíru na Zemi je třetím nejrozšířenějším prvkem po kyslíku
Spalování zemního plynu
 Kotel na odpadní teplo pro PPC Kotel na odpadní teplo pro PPC Označení KNOT (Doc. Kolovratník) HRSG = Heat Recovery Steam Generator Funkce dochladit spaliny odcházející z plynové turbíny vyrobit páru pro
Kotel na odpadní teplo pro PPC Kotel na odpadní teplo pro PPC Označení KNOT (Doc. Kolovratník) HRSG = Heat Recovery Steam Generator Funkce dochladit spaliny odcházející z plynové turbíny vyrobit páru pro
5. Nekovy sı ra. 1) Obecná charakteristika nekovů. 2) Síra a její vlastnosti
 5. Nekovy sı ra 1) Obecná charakteristika nekovů 2) Síra a její vlastnosti 1) Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu. Jsou to prvky uspořádané
5. Nekovy sı ra 1) Obecná charakteristika nekovů 2) Síra a její vlastnosti 1) Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu. Jsou to prvky uspořádané
Ohlašovací prahy pro úniky a přenosy pro ohlašování do IRZ/E-PRTR
 Celkový dusík Základní informace Ohlašovací prahy pro úniky a přenosy pro ohlašování do IRZ/E-PRTR Základní charakteristika Použití Zdroje úniků Dopady na životní prostředí Dopady na zdraví člověka, rizika
Celkový dusík Základní informace Ohlašovací prahy pro úniky a přenosy pro ohlašování do IRZ/E-PRTR Základní charakteristika Použití Zdroje úniků Dopady na životní prostředí Dopady na zdraví člověka, rizika
Technologie výroby elektrárnách. Základní schémata výroby
 Technologie výroby elektrárnách Základní schémata výroby Kotle pro výroby elektřiny Získávání tepelné energie chemickou reakcí fosilních paliv: C + O CO + 33910kJ / kg H + O H 0 + 10580kJ / kg S O SO 10470kJ
Technologie výroby elektrárnách Základní schémata výroby Kotle pro výroby elektřiny Získávání tepelné energie chemickou reakcí fosilních paliv: C + O CO + 33910kJ / kg H + O H 0 + 10580kJ / kg S O SO 10470kJ
Kyslík a vodík. Bezbarvý plyn, bez chuti a zápachu, asi 14krát lehčí než vzduch. Běžně tvoří molekuly H2. hydridy (např.
 1 Kyslík a vodík Kyslík Vlastnosti Bezbarvý reaktivní plyn, bez zápachu, nejčastěji tvoří molekuly O2. Kapalný kyslík je modrý. S jinými prvky tvoří sloučeniny oxidy (např. CO, CO2, SO2...) Výskyt Nejrozšířenější
1 Kyslík a vodík Kyslík Vlastnosti Bezbarvý reaktivní plyn, bez zápachu, nejčastěji tvoří molekuly O2. Kapalný kyslík je modrý. S jinými prvky tvoří sloučeniny oxidy (např. CO, CO2, SO2...) Výskyt Nejrozšířenější
Destilace
 Výpočtový ý seminář z Procesního inženýrství podzim 2007 Destilace 18.9.2008 1 Tématické okruhy destilace - základní pojmy rovnováha kapalina - pára jednostupňová destilace rektifikace 18.9.2008 2 Destilace
Výpočtový ý seminář z Procesního inženýrství podzim 2007 Destilace 18.9.2008 1 Tématické okruhy destilace - základní pojmy rovnováha kapalina - pára jednostupňová destilace rektifikace 18.9.2008 2 Destilace
Termochemie. Katedra materiálového inženýrství a chemie A Ing. Martin Keppert Ph.D.
 Termochemie Ing. Martin Keppert Ph.D. Katedra materiálového inženýrství a chemie keppert@fsv.cvut.cz A 329 http://tpm.fsv.cvut.cz/ Termochemie: tepelné jevy při chemických reakcích Chemická reakce: CH
Termochemie Ing. Martin Keppert Ph.D. Katedra materiálového inženýrství a chemie keppert@fsv.cvut.cz A 329 http://tpm.fsv.cvut.cz/ Termochemie: tepelné jevy při chemických reakcích Chemická reakce: CH
STEJNOSMĚRNÝ PROUD Galvanické články TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY.
 STEJNOSMĚRNÝ PROUD Galvanické články TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY. Galvanické články Většina kovů ponořených do vody nebo elektrolytu
STEJNOSMĚRNÝ PROUD Galvanické články TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY. Galvanické články Většina kovů ponořených do vody nebo elektrolytu
Ročník VIII. Chemie. Období Učivo téma Metody a formy práce- kurzívou. Kompetence Očekávané výstupy. Průřezová témata. Mezipřed.
 Úvod IX. -ukázka chem.skla přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce-práce s dostupnými a běžně používanými látkami, hodnocení jejich rizikovosti, posoudí bezpečnost vybraných
Úvod IX. -ukázka chem.skla přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce-práce s dostupnými a běžně používanými látkami, hodnocení jejich rizikovosti, posoudí bezpečnost vybraných
INECO průmyslová ekologie, s.r.o. Zkušební laboratoř INECO průmyslová ekologie s.r.o. náměstí Republiky 2996, Dvůr Králové nad Labem
 Laboratoř plní požadavky na periodická měření emisí dle ČSN P CEN/TS 15675:2009 u zkoušek a odběrů vzorků označených u pořadového čísla symbolem E. Laboratoř je způsobilá aktualizovat normy identifikující
Laboratoř plní požadavky na periodická měření emisí dle ČSN P CEN/TS 15675:2009 u zkoušek a odběrů vzorků označených u pořadového čísla symbolem E. Laboratoř je způsobilá aktualizovat normy identifikující
CHO cvičení, FSv, ČVUT v Praze
 2. Chemické rovnice Chemická rovnice je schématický zápis chemického děje (reakce), který nás informuje o reaktantech (výchozích látkách), produktech, dále o stechiometrii reakce tzn. o vzájemném poměru
2. Chemické rovnice Chemická rovnice je schématický zápis chemického děje (reakce), který nás informuje o reaktantech (výchozích látkách), produktech, dále o stechiometrii reakce tzn. o vzájemném poměru
3. Oxid uhlenatý. 1. Syntézní plyn. 5. Formaldehyd. 4. Metanol. 2. Vodík. Základní organické sloučeniny
 Základní organické sloučeniny 1. Syntézní plyn 2. Vodík 3. Oxid uhlenatý 4. Metanol 5. Formaldehyd 1 1. Syntézní plyn směs CO a H2 v různém poměru k syntéze některých organických poloproduktů metanol,
Základní organické sloučeniny 1. Syntézní plyn 2. Vodík 3. Oxid uhlenatý 4. Metanol 5. Formaldehyd 1 1. Syntézní plyn směs CO a H2 v různém poměru k syntéze některých organických poloproduktů metanol,
Metody separace CO2. L. Veselý, P. Slouka, CTU in Prague 8.4.2015
 Metody separace CO2 L. Veseý, P. Souka, CTU in Prague 8.4.2015 Separace CO2 Obecné metody Zákadní druhy separace CO2 v pokročié fázi vývoje. Účinnost separace se iší pode zvoené technoogie Obvyke počítáno
Metody separace CO2 L. Veseý, P. Souka, CTU in Prague 8.4.2015 Separace CO2 Obecné metody Zákadní druhy separace CO2 v pokročié fázi vývoje. Účinnost separace se iší pode zvoené technoogie Obvyke počítáno
NEGATIVNÍ PŮSOBENÍ PROVOZU AUTOMOBILOVÝCH PSM NA ŽIVOTNÍ PROSTŘEDÍ
 NEGATIVNÍ PŮSOBENÍ PROVOZU AUTOMOBILOVÝCH PSM NA ŽIVOTNÍ PROSTŘEDÍ Provoz automobilových PSM je provázen produkcí škodlivin, které jsou emitovány do okolí: škodliviny chemické (výfuk.škodliviny, kontaminace),
NEGATIVNÍ PŮSOBENÍ PROVOZU AUTOMOBILOVÝCH PSM NA ŽIVOTNÍ PROSTŘEDÍ Provoz automobilových PSM je provázen produkcí škodlivin, které jsou emitovány do okolí: škodliviny chemické (výfuk.škodliviny, kontaminace),
KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ)
 KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ) Úloha 1 Ic), IIa), IIId), IVb) za každé správné přiřazení po 1 bodu; celkem Úloha 2 8 bodů 1. Sodík reaguje s vodou za vzniku hydroxidu sodného a dalšího produktu.
KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ) Úloha 1 Ic), IIa), IIId), IVb) za každé správné přiřazení po 1 bodu; celkem Úloha 2 8 bodů 1. Sodík reaguje s vodou za vzniku hydroxidu sodného a dalšího produktu.
Tvorba škodlivin při spalování
 Tvorba škodlivin při spalování - Při spalování dochází ke vzniku řady škodlivin - Je třeba spalovací proces vést tak, aby se minimalizoval vznik škodlivin (byly dodrženy emisní limity) - Emisní limity
Tvorba škodlivin při spalování - Při spalování dochází ke vzniku řady škodlivin - Je třeba spalovací proces vést tak, aby se minimalizoval vznik škodlivin (byly dodrženy emisní limity) - Emisní limity
Problematika ropných látek
 Problematika ropných látek vlastní ropné látky + aditiva ropných výrobků Forma: volné ropné látky emulze vodný roztok Přímý vliv na člověka (ekzémy i karcinomy) Vliv na životní prostředí vytvoření olejového
Problematika ropných látek vlastní ropné látky + aditiva ropných výrobků Forma: volné ropné látky emulze vodný roztok Přímý vliv na člověka (ekzémy i karcinomy) Vliv na životní prostředí vytvoření olejového
Zpracování ropy doc. Ing. Josef Blažek, CSc. 3. přednáška
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 3. přednáška Termické a katalytické krakování a hydrokrakování těžkých
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 3. přednáška Termické a katalytické krakování a hydrokrakování těžkých
PRŮMYSLOVÉ PROCESY. Přenos hmoty Kolony
 PRŮMYSLOVÉ PROCESY Přenos hmoty Kolony Prof. Ing. Tomáš Jirout, Ph.D. (e-mail: Tomas.Jirout@fs.cvut.cz, tel.: 2 2435 2681) DESTILACE Teoretický úvod Rovnováha neomezeně mísitelných kapalin A. Ideální chování
PRŮMYSLOVÉ PROCESY Přenos hmoty Kolony Prof. Ing. Tomáš Jirout, Ph.D. (e-mail: Tomas.Jirout@fs.cvut.cz, tel.: 2 2435 2681) DESTILACE Teoretický úvod Rovnováha neomezeně mísitelných kapalin A. Ideální chování
VÝROBA PÁRY. Výroba cukru se vyznačuje vysokou spotřebou páry a mechanické energie spotřeba elektrické energie kwh/t řepy
 VÝROBA PÁRY Výroba cukru se vyznačuje vysokou spotřebou páry a mechanické energie spotřeba elektrické energie - 20-30 kwh/t řepy Využití páry k výrobě elektrické energie k čtyř až pěti stupňovému odpařování
VÝROBA PÁRY Výroba cukru se vyznačuje vysokou spotřebou páry a mechanické energie spotřeba elektrické energie - 20-30 kwh/t řepy Využití páry k výrobě elektrické energie k čtyř až pěti stupňovému odpařování
1. V jakých typech sloučenin se železo v přírodě nachází? 2. Jmenujte příklad jedné železné rudy (název a vzorec):
 ŽELEZO - cvičení 1. V jakých typech sloučenin se železo v přírodě nachází? 2. Jmenujte příklad jedné železné rudy (název a vzorec): 1. V jakých typech sloučenin se železo v přírodě nachází? V oxidech,
ŽELEZO - cvičení 1. V jakých typech sloučenin se železo v přírodě nachází? 2. Jmenujte příklad jedné železné rudy (název a vzorec): 1. V jakých typech sloučenin se železo v přírodě nachází? V oxidech,
