PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
|
|
|
- Miroslava Novotná
- před 8 lety
- Počet zobrazení:
Transkript
1 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1
2 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 50 mg micafunginum (ve formě micafunginum natricum). Po rekonstituci obsahuje jeden ml 10 mg micafunginum (ve formě micafunginum natricum). Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Prášek pro infuzní roztok. Bílý kompaktní prášek. 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikace Mycamine je indikován pro: Dospělí, dospívající 16 let a starší pacienti: - Léčba invazivní kandidózy. - Léčba ezofageální kandidózy u pacientů, u nichž je vhodná intravenózní terapie. - Profylaxe kandidových infekcí u pacientů podstupujících alogenní transplantaci hematopoetických kmenových buněk nebo u pacientů, u nichž se předpokládá neutropenie (absolutní počet neutrofilů < 500 buněk / µl) po dobu 10 nebo více dní. Děti (včetně novorozenců) a dospívající < 16 let věku: - Léčba invazivní kandidózy. - Profylaxe kandidových infekcí u pacientů podstupujících alogenní transplantaci hematopoetických kmenových buněk nebo u pacientů, u nichž se předpokládá neutropenie (absolutní počet neutrofilů < 500 buněk / µl) po dobu 10 nebo více dní. Rozhodnutí o použití přípravku Mycamine by mělo zohlednit potenciální riziko vzniku nádorů jater (viz bod 4.4). Mycamine by se měl proto používat pouze v případě, že nejsou vhodná jiná antimykotika. 4.2 Dávkování a způsob podání Je třeba vzít v úvahu úřední/národní pokyny týkající se správného použití antimykotických přípravků. Léčbu přípravkem Mycamine má zahajovat pouze lékař se zkušenostmi s léčbou mykotických infekcí. Před zahájením léčby se odeberou vzorky na mykotickou kultivaci a další potřebná laboratorní vyšetření (včetně histopatologie), aby mohly být izolovány a určeny příčinné organismy. Léčba může být zahájena dříve, než jsou k dispozici výsledky kultivace a dalších laboratorních vyšetření. Po získání těchto výsledků však má být antimykotická léčba odpovídajícím způsobem upravena. Dávkování Dávkovací režim přípravku Mycamine závisí na tělesné hmotnosti pacienta, jak je uvedeno v následujících tabulkách: 2
3 Použití u dospělých, dospívajících 16 let věku a starších pacientů Indikace Tělesná hmotnost > 40 kg Tělesná hmotnost 40 kg Léčba invazivní kandidózy 100 mg/den* 2 mg/kg/den* Léčba ezofageální kandidózy 150 mg/den 3 mg/kg/den Profylaxe kandidových infekcí 50 mg/den 1 mg/kg/den * Jestliže není odpověď pacienta dostatečná, např. přetrvávají-li pozitivní kultivace nebo nelepší-li se klinický stav, lze dávku zvýšit na 200 mg/den u pacientů s tělesnou hmotností > 40 kg resp. na 4 mg/kg/den u pacientů s tělesnou hmotností 40 kg. Trvání léčby Invazivní kandidóza: Léčba kandidové infekce by měla trvat minimálně 14 dní. V antimykotické léčbě by se mělo pokračovat nejméně jeden týden poté, co byly dvě po sobě následující hemokultury negativní, a po odeznění klinických příznaků a symptomů infekce. Ezofageální kandidóza: Pro léčbu ezofageální kandidózy by měl být Mycamine podáván nejméně jeden týden po odeznění klinických příznaků a symptomů. Profylaxe kandidových infekcí: Pro profylaxi kandidových infekcí by měl být Mycamine podáván ještě nejméně jeden týden po dosažení normálních hodnot počtu neutrofilů. Použití u dětí (včetně novorozenců) a dospívajících < 16 let věku Indikace Tělesná hmotnost > 40 kg Tělesná hmotnost 40 kg Léčba invazivní kandidózy 100 mg/den* 2 mg/kg/den* Profylaxe kandidových infekcí 50 mg/den 1 mg/kg/den * Jestliže není odpověď pacienta dostatečná, např. přetrvávají-li pozitivní kultivace nebo nelepší-li se klinický stav, lze dávku zvýšit na 200 mg/den u pacientů s tělesnou hmotností > 40 kg resp. na 4 mg/kg/den u pacientů s tělesnou hmotností 40 kg. Trvání léčby Invazivní kandidóza: Léčba kandidové infekce by měla trvat minimálně 14 dní. V antimykotické léčbě by se mělo pokračovat nejméně jeden týden poté, co byly dvě po sobě následující hemokultury negativní, a po odeznění klinických příznaků a symptomů infekce. Profylaxe kandidových infekcí: Pro profylaxi kandidových infekcí by měl být Mycamine podáván ještě nejméně jeden týden po dosažení normálních hodnot počtu neutrofilů. Zkušenosti s použitím přípravku Mycamine u pacientů mladších než 2 roky jsou omezené. Aspekty rasy/pohlaví Není zapotřebí žádná úprava dávkování v závislosti na pohlaví nebo rase (viz bod 5.2). Pacienti s poruchou funkce jater U pacientů s mírnou nebo středně závažnou poruchou funkce jater není zapotřebí žádná úprava dávkování (viz bod 5.2). V současné době nejsou k dispozici dostatečné údaje o použití přípravku Mycamine u pacientů se závažnou poruchou funkce jater a jeho použití se u těchto pacientů nedoporučuje (viz bod 4.4 a 5.2). Pacienti s poruchou funkce ledvin U pacientů s poruchou funkce ledvin není zapotřebí žádná úprava dávkování (viz bod 5.2). Způsob podání 3
4 Po rekonstituci a naředění má být roztok podán formou intravenózní infuze trvající přibližně 1 hodinu. Rychlejší infuze může vést k častějším reakcím z uvolnění histaminu. Pokyny k rekonstituci viz bod Kontraindikace Hypersenzitivita na léčivou látku, jiné echinokandiny nebo na kteroukoli pomocnou látku uvedenou v bodě Zvláštní upozornění a opatření pro použití Účinky na játra: U potkanů byl po léčebném období 3 měsíců nebo delším pozorován vznik ložisek alterovaných hepatocytů (FAH) a hepatocelulárních nádorů. Předpokládaný práh pro vývoj nádoru u potkanů leží přibližně v rozmezí klinické expozice. Význam tohoto nálezu pro terapeutické použití u pacientů není možné vyloučit. Funkce jater by měla být během léčby mikafunginem pozorně monitorována. Pro minimalizaci rizika adaptivní regenerace a možného následného vzniku nádoru jater se doporučuje časné přerušení léčby, pokud se objeví významné a přetrvávající zvýšení hladin ALT/AST. Při léčbě mikafunginem je třeba pečlivě sledovat poměr přínosu a rizika, a to zejména u pacientů se závažnou poruchou jaterní funkce nebo chronickým jaterním onemocněním, o němž je známo, že představuje preneoplastický stav, jako je pokročilá jaterní fibróza, cirhóza, virová hepatitida, neonatální jaterní onemocnění nebo kongenitální enzymatické defekty, nebo při podávání souběžné léčby, která může mít hepatotoxické anebo genotoxické účinky. Léčba mikafunginem byla spojována s významným poškozením jaterní funkce (zvýšení ALT, AST nebo celkového bilirubinu > 3-násobek horní hranice normy) u zdravých dobrovolníků i pacientů. U některých pacientů byly hlášeny závažnější jaterní dysfunkce, hepatitida nebo jaterní selhání, včetně fatálních případů. Pediatričtí pacienti mladší 1 roku věku by mohli být náchylnější k jaternímu poškození (viz bod 4.8). Anafylaktická reakce Během podávání mikafunginu se mohou vyskytnout anafylaktické/anafylaktoidní reakce včetně šoku. Pokud tyto reakce nastanou, musí být infuze mikafunginu přerušena a podána vhodná léčba. Kožní reakce Byly hlášeny exfoliativní kožní reakce jako je Stevens-Johnsonův syndrom a toxická epidermální nekrolýza. Pokud se u pacientů objeví vyrážka, je třeba je pečlivě sledovat a pokud se léze zhoršují, podávání mikafunginu ukončit. Hemolýza U pacientů léčených mikafunginem byly hlášeny vzácné případy hemolýzy včetně akutní intravaskulární hemolýzy a hemolytické anémie. Pacienti, u nichž se během léčby mikafunginem vyvinou klinické nebo laboratorní projevy hemolýzy, by měli být pozorně sledováni s ohledem na příznaky zhoršení těchto stavů a měl by být zhodnocen poměr přínosu a rizika pokračující terapie mikafunginem. Účinek na ledviny Mikafungin může způsobovat poruchy ledvin, selhání ledvin a abnormality ve funkčních testech ledvin. Pacienti by měli být důkladně monitorováni s ohledem na zhoršení funkce ledvin. Interakce s jinými léčivými přípravky K současnému podávání mikafunginu a amfotericinu B deoxycholátu by se mělo přistupovat jen pokud prospěch jasně převažuje nad rizikem a za pečlivého monitorování toxicity amfotericinu B deoxycholátu (viz bod 4.5). 4
5 U pacientů užívajících sirolimus, nifedipin nebo itrakonazol v kombinaci s přípravkem Mycamine by měla být sledována toxicita sirolimu, nifedipinu nebo itrakonazolu a je-li třeba, je nutno dávku sirolimu, nifedipinu nebo itrakonazolu snížit (viz bod 4.5). Pediatrická populace Incidence některých nežádoucích účinků byla vyšší u pediatrických pacientů než u dospělých pacientů (viz bod 4.8). 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce U mikafunginu existuje nízká pravděpodobnost interakcí s léky metabolizovanými izoenzymem CYP3A. Byly provedeny studie interakce léku na zdravých lidských subjektech za účelem posouzení pravděpodobnosti interakce mezi mikafunginem a mykofenolát mofetilem, cyklosporinem, takrolimem, prednisolonem, sirolimem, nifedipinem, flukonazolem, ritonavirem, rifampicinem, itrakonazolem, vorikonazolem a amfotericinem B. V těchto studiích nebyly pozorovány žádné známky změněné farmakokinetiky mikafunginu. Při současném podávání těchto léků nejsou zapotřebí žádné úpravy dávkování mikafunginu. Hodnota expozice (AUC) pro itrakonazol, sirolimus a nifedipin se v přítomnosti mikafunginu mírně zvýšila (22 %, 21 % resp. 18 %). Současné podávání mikafunginu a amfotericinu B deoxycholátu bylo spojeno s 30 % nárůstem expozice amfotericinu B deoxycholátu. Vzhledem k možnému klinickému významu této skutečnosti by se měly tyto přípravky současně podávat jen pokud prospěch jasně převažuje nad rizikem a za pečlivého monitorování toxicity amfotericinu B deoxycholátu (viz bod 4.4). U pacientů užívajících sirolimus, nifedipin nebo itrakonazol v kombinaci s přípravkem Mycamine by měla být sledována toxicita sirolimu, nifedipinu nebo itrakonazolu a je-li třeba, je nutno dávku sirolimu, nifedipinu nebo itrakonazolu snížit (viz bod 4.4) Těhotenství a kojení Těhotenství Žádné údaje o podávání mikafunginu těhotným ženám nejsou k dispozici. Ve studiích na zvířatech přecházel mikafungin placentární bariérou a byla pozorována reprodukční toxicita (viz bod 5.3). Potenciální riziko pro člověka není známé. Mycamine se proto nemá v těhotenství podávat, pokud to není nezbytně nutné. Kojení Není známo, zda se mikafungin vylučuje do lidského mateřského mléka. Studie na zvířatech ukázaly vylučování mikafunginu do mateřského mléka. Rozhodnutí o tom, zda pokračovat či přerušit kojení nebo pokračovat či přerušit terapii přípravkem Mycamine, by mělo být provedeno s ohledem na přínos kojení pro dítě a přínos léčby přípravkem Mycamine pro matku. Fertilita Ve studiích na zvířatech byla pozorována testikulární toxicita (viz bod 5.3). Mikafungin může mít potenciál ovlivňovat u člověka mužskou fertilitu. 4.7 Účinky na schopnost řídit a obsluhovat stroje Studie hodnotící účinky na schopnost řídit a používat stroje nebyly provedeny. Nicméně se mohou objevit nežádoucí reakce, které by mohly ovlivňovat schopnost řídit a obsluhovat stroje (viz bod 4.8). 4.8 Nežádoucí účinky 5
6 Souhrn bezpečnostního profilu Bezpečnostní profil mikafunginu je založen na výsledcích klinických studií u celkem 3028 pacientů: šlo o 2002 pacientů s kandidovými infekcemi (včetně kandidémie, invazivní kandidózy a ezofageální kandidózy), 375 pacientů s invazivní aspergilózou (především refrakterní infekce) a 651 případů profylaxe systémových mykotických infekcí. Pacienti léčení mikafunginem v klinických studiích představují kriticky nemocnou populaci pacientů, která vyžaduje podávání většího počtu léčivých přípravků včetně antineoplastické chemoterapie, silných systémových imunosupresiv a širokospektrých antibiotik. Tito pacienti trpěli širokou škálou komplikovaných stavů, jako jsou hematologická nádorová onemocnění a infekce HIV, nebo byli po transplantaci či byli léčeni na jednotkách intenzivní péče. Z profylaktických důvodů byli mikafunginem léčeni pacienti, kteří podstoupili transplantaci hematopoetických kmenových buněk a kterým hrozilo vysoké riziko mykotických infekcí. Celkově zaznamenalo 32,2 % pacientů nežádoucí účinky. Nejčastěji hlášenými nežádoucími účinky byly nevolnost (2,8 %), zvýšené hladiny alkalické fosfatázy v krvi (2,7 %), flebitida (2,5 %, především u HIV pozitivních pacientů s periferními nitrožilními katétry), zvracení (2,5 %) a zvýšené hladiny aspartátaminotransferázy (2,3 %). Při analýze údajů o bezpečnosti podle pohlaví nebo rasy nebyly zjištěny žádné klinicky významné rozdíly. Seznam nežádoucích účinků v tabulce V následující tabulce jsou uvedeny nežádoucí účinky, uspořádané podle tříd orgánových systémů a podle terminologie MedDRA. V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti. Třída orgánových systémů Poruchy krve a lymfatického systému Poruchy imunitního systému Endokrinní poruchy Poruchy metabolismu a výživy Psychiatrické poruchy Poruchy nervového systému Srdeční poruchy Časté 1/100 až < 1/10 leukopenie, neutropenie, anémie hypokalémie, hypomagnezémie, hypokalcémie bolest hlavy Méně časté 1/1000 až < 1/100 pancytopenie, trombocytopenie, eozinofílie, hypoalbuminémie anafylaktická / anafylaktoidní reakce (viz bod 4.4), hypersenzitivita hyperhidróza hyponatrémie, hyperkalémie, hypofosfatémie, anorexie insomnie, úzkost, zmatenost somnolence, třes, závrať, dysgeusie tachykardie, palpitace, bradykardie Cévní poruchy flebitida hypotenze, hypertenze, návaly Vzácné 1/10000 až < 1/1000 hemolytická anémie, hemolýza (viz bod 4.4) Není známo (z dostupných údajů nelze určit) diseminovaná intravaskulární koagulace šok 6
7 Třída orgánových systémů Respirační, hrudní a mediastinální poruchy Gastrointestinální poruchy Poruchy jater a žlučových cest Poruchy kůže a podkožní tkáně Poruchy ledvin a močových cest Celkové poruchy a reakce v místě aplikace Vyšetření Časté 1/100 až < 1/10 nevolnost, zvracení, průjem, bolest břicha zvýšená hladina alkalické fosfatázy v krvi, zvýšená hladina aspartátaminotransferá zy, zvýšená hladina alaninaminotransferáz y, zvýšená hladina bilirubinu v krvi (včetně hyperbilirubinémie), abnormální výsledky jaterních testů vyrážka pyrexie, zimnice Méně časté 1/1000 až < 1/100 dyspnea dyspepsie, zácpa jaterní selhání (viz bod 4.4), zvýšená hladina gamaglutamyltransferázy, žloutenka, cholestáza, hepatomegalie, hepatitida kopřivka, svědění, erytém zvýšení kreatininu v krvi, zvýšení močoviny v krvi, zhoršení selhání ledvin trombóza v místě vpichu, zánět v místě podání infuze, bolest v místě vpichu, periferní otok zvýšení krevní laktát dehydrogenázy v krvi Vzácné 1/10000 až < 1/1000 Není známo (z dostupných údajů nelze určit) hepatocelulární poškození včetně fatálních případů (viz bod 4.4) toxické kožní erupce, erythema multiforme, Stevens- Johnsonův syndrom, toxická epidermální nekrolýza (viz bod 4.4) porucha funkce ledvin (viz bod 4.4), akutní selhání ledvin Popis vybraných nežádoucích účinků Možné pseudoalergické symptomy V klinických studiích byly hlášeny symptomy jako vyrážka a zimnice. Závažnost těchto symptomů byla většinou lehká až středně závažná a symptomy nevyžadovaly omezení léčby. Závažné nežádoucí účinky (např. anafylaktoidní reakce 0,2 %, 6/3028) byly při léčbě mikafunginem hlášeny méně často a pouze u pacientů se závažnými zdravotními stavy (např. pokročilým AIDS, zhoubnými nádory) vyžadujícími současné podávání většího počtu léků. Nežádoucí hepatální účinky 7
8 Celková incidence nežádoucích hepatálních účinků v klinických studiích u pacientů léčených mikafunginem dosáhla 8,6 % (260/3028). Většina těchto nežádoucích hepatálních účinků byla mírná a středně závažná. Nejčastějšími nežádoucími účinky byly zvýšené hladiny AP (2,7 %), AST (2,3 %), ALT (2,0 %), bilirubinu (1,6 %) a abnormální výsledky jaterních testů (1,5 %). Několik pacientů (1,1 %; 0,4 % závažných) přerušilo léčbu kvůli jaterní příhodě. Méně často se vyskytovaly případy závažné hepatální dysfunkce (viz bod 4.4). Reakce v místě vpichu Žádná z nežádoucích reakcí v místě vpichu nevyžadovala omezení léčby. Pediatrická populace Incidence některých nežádoucích účinků (uvedených v tabulce níže) byla vyšší u pediatrických pacientů než u dospělých. Dále pak se u pediatrických pacientů ve věku < 1 rok objevovalo asi dvakrát častěji zvýšení hladin ALT, AST a AP, než u starších pediatrických pacientů (viz bod 4.4). Nejpravděpodobnější příčinou těchto rozdílů byl rozdílný základní stav ve srovnání s dospělými nebo staršími pediatrickými pacienty pozorovaný v klinických studiích. V době vstupu do studie byl podíl pediatrických pacientů s neutropenií několikrát vyšší než u dospělých pacientů (40,2 % a 7,3 % dětí, resp. dospělých), a totéž platilo u pacientů s alogenní HSCT (29,4 % a 13,4 %) a hematologickou malignitou (29,1 % a 8,7 %). Poruchy krve a lymfatického systému časté trombocytopenie Srdeční poruchy časté Cévní poruchy časté tachykardie hypertenze, hypotenze Poruchy jater a žlučových cest časté hyperbilirubinémie, hepatomegalie Poruchy ledvin a močových cest časté akutní selhání ledvin, zvýšení močoviny v krvi Hlášení podezření na nežádoucí účinky Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V*. 4.9 Předávkování V klinických studiích byly dospělým pacientům podávány opakované denní dávky do výše 8 mg/kg (maximální celková dávka 896 mg) bez hlášené toxicity, která by vyžadovala omezení dávky. V jednom případě bylo u novorozence hlášeno chybné dávkování 7,8 mg/kg/den po dobu 7 dní. Nebyly zaznamenány žádné nežádoucí účinky související s takto vysokou dávkou. Nejsou zkušenosti s předávkováním mikafunginem. V případě předávkování je třeba přijmout obecná podpůrná opatření a zahájit symptomatickou léčbu. Mikafungin je z velké části vázán na bílkoviny a není dialyzovatelný. 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1 Farmakodynamické vlastnosti Farmakoterapeutická skupina: Antimykotika pro systémové použití, jiná antimykotika pro systémové použití. Kód ATC: J02AX05 8
9 Mechanismus účinku Mikafungin nekompetitivně inhibuje syntézu 1,3-β-D-glukanu, který je hlavní složkou buněčné stěny plísní. 1,3-β-D-glukan není přítomen v buňkách savců. Mikafungin vykazuje fungicidní účinky proti většině organismů rodu Candida a významně inhibuje aktivně rostoucí hyfy rodu Aspergillus. FK/FD vztahy Na zvířecích modelech kandidózy byla pozorována korelace mezi expozicí mikafunginu dělenou MIC (AUC/MIC) a účinností definovaná jako požadovaný poměr k prevenci progresivního růstu plísní. Pro C. albicans a C. glabrata byl požadován poměr ~2400 a ~1300. Tyto poměry jsou dosažitelné v doporučených terapeutických dávkách přípravku Mycamine pro běžné rozložení divokých typů Candida spp. Mechanismus rezistence Jako u všech antimikrobiálních látek byly zaznamenány případy snížené citlivosti a rezistence a zkříženou rezistenci s jinými echinokandiny nelze vyloučit. Snížená citlivost na echinokandiny byla spojována s mutacemi kódování genů Fks1 a Fks 2 pro hlavní podjednotku glukan-syntázy. Breakpoints EUCAST breakpoints Candida species MIC breakpoint (mg/l) C (Citlivé) >R (Rezistentní) Candida albicans Candida glabrata Candida parapsilosis Candida tropicalis 1 Nedostatečná evidence Candida krusei 1 Nedostatečná evidence Candida guilliermondii 1 Nedostatečná evidence Other Candida spp. Nedostatečná evidence 1 MICs pro C. tropicalis jsou o 1-2 dvojnásobné stupně ředění vyšší než pro C. albicans a C. glabrata. Úspěšný výsledek byl v klinické studii numericky mírně nižší pro C. tropicalis než pro C. albicans v obou dávkách (100 a 150 mg denně). Přesto, rozdíl nebyl statisticky významný a zda tento výsledek znamená relevantní klinický rozdíl není známo. MICs pro C. krusei jsou o 3 dvojnásobné stupně ředění vyšší než pro C. albicans a pro C.guilliermondii jsou vyšší o 8 dvojnásobných stupňů ředění. Navíc, tyto druhy zahrnoval v klinických studiích pouze malý počet případů. To znamená, že je nedostatečná evidence ukazující zda populace divokého typu těchto patogenů mohou být považovány za citlivé k mikafunginu. Informace z klinických studií Kandidémie a invazivní kandidóza: Mikafungin (100 mg/den nebo 2 mg/kg/den) byl stejně účinný a lépe tolerovaný než liposomální amfotericin B (3 mg/kg) jako léčba první volby pro kandidémii a invazivní kandidózu v randomizované dvojitě zaslepené mezinárodní studii non-inferiority. Mikafungin a liposomální amfotericin B byly podávány průměrně po dobu 15 dnů (rozmezí od 4 do 42 dnů u dospělých a 12 až 42 dnů u dětí). Non-inferiorita byla prokázána u dospělých pacientů a podobné nálezy byly prokázány pro pediatrické subpopulace (včetně novorozenců a nezralých kojenců). Nálezy účinnosti byly konzistentní nezávisle na vyvolávajícím druhu kandidy, primárním místě infekce a neutropenickém stavu (viz tabulka). Mikafungin ukázal menší průměrný maximální pokles glomerulární filtrace stanovené během léčby (p<0,001) a nižší incidenci reakcí souvisejících s infuzí (p=0,001) než liposomální amfotericin B. Celková úspěšnost léčby v souboru per protocol, studie invazivní kandidózy Mikafungin Lipozomální Rozdíl v % 9
10 amfotericin B [95 % CI] N n (%) N n (%) Dospělí pacienti Celková úspěšnost léčby (89,6) (89,5) 0.1 [-5,9; 6,1] Celková úspěšnost léčby podle stavu neutropenie Výchozí stav s neutropenií (75,0) (80,0) 0,7 [-5,3; 6,7] Výchozí stav bez neutropenie (91,6) (90,3) Pediatričtí pacienti Celková úspěšnost léčby (72,9) (76,0) -2,7 [-17,3; 11,9] Děti do 2 let věku (80,8) (77,4) Nezralí kojenci 10 7 (70,0) 9 6 (66,7) Novorozenci (0 dnů až 7 7 (100) 5 4 (80) < 4 týdny) Děti od 2 do 15 let (63,6) (73,7) Dospělí a děti v kombinaci, celková úspěšnost léčby dle druhu Candida Candida albicans (89,2) (90,8) Non-albicans (všechny druhy) : (88,1) (87,9) C. tropicalis (91,5) (96,1) C. parapsilosis (85,4) (79,5) C. glabrata (82,6) (82,4) C. krusei 9 8 (88,9) 7 6 (85,7) Úspěšnost mikafunginu minus úspěšnost lipozomálního amfotericinu B a oboustranný 95 % interval spolehlivosti pro rozdíl v celkové míře úspěšnosti na základě normální aproximace na velkém vzorku. Upraveno podle míry neutropénie; primární cíl studie. Na pediatrické populaci nebylo možné vzhledem k její velikosti provést testy non-inferiority. Klinická účinnost byla také sledována (< 5 pacientů) u následujících druhů kandidy: C. guilliermondii, C. famata, C. lusitaniae, C. utilis, C. inconspicua a C. dubliniensis. Ezofageální kandidóza: V randomizované, dvojitě zaslepené studii porovnávající mikafungin s flukonazolem při léčbě první volby ezofageální kandidózy dostalo 518 pacientů nejméně jednu dávku studovaného léku. Střední doba trvání léčby činila u obou skupin 14 dní a střední denní dávka činila 150 mg u mikafunginu (N = 260) a 200 mg u flukonazolu (N = 258). Endoskopický stupeň 0 (endoskopické vyléčení) na konci léčby byl pozorován u 87,7 % (228/260) a 88,0 % (227/258) pacientů ve skupině s mikafunginem, resp. flukonazolem (95 % interval spolehlivosti pro rozdíl: [- 5,9 %, 5,3 %]). Dolní mez intervalu spolehlivosti 95 % byla nad předdefinovanou hranicí noninferiority -10 %, což prokázalo non-inferioritu. Charakter a incidence nežádoucích účinků byly v léčebných skupinách obdobné. Profylaxe: Mikafungin byl účinnější než flukonazol v prevenci invazivní mykotické infekce u populace pacientů s vysokým rizikem rozvoje systémové mykotické infekce (pacienti podstupující transplantaci hematopoetických kmenových buněk [HSCT] v randomizované dvojitě zaslepené multicentrické studii). Úspěšnost léčby byla definována jako absence prokázané, pravděpodobné nebo suspektní systémové mykotické infekce do skončení léčby a absence prokázané nebo pravděpodobné systémové mykotické infekce do konce studie. Většina pacientů (97 %, N=882) měla ve výchozím stavu neutropenii (< 200 neutrofilů/µl). Medián trvání neutropenie byl 13 dnů. Fixní denní dávka pro mikafungin byla 50 mg (1,0 mg/kg) a 400 mg (8 mg/kg) pro flukonazol. Průměrná doba léčby byla 19 dnů u mikafunginu a 18 dnů u flukonazolu u dospělé populace (N=798) a 23 dnů pro obě léčebná ramena pediatrické populace (N=84). Úspěšnost léčby byla statisticky významně vyšší u mikafunginu než u flukonazolu (1,6 % proti 2,4 % vzplanutí infekcí). Vzplanutí infekce způsobené rodem Aspergillus bylo pozorováno u 1 proti 7 pacientům a prokázané nebo pravděpodobné vzplanutí kandidové infekce bylo pozorováno u 4 proti 2 pacientům ve skupinách s mikafunginem a flukonazolem. Další vzplanutí infekce byla způsobena rody Fusarium (1 resp. 2 pacienti) a Zygomycetes (1 resp. 0 pacientů). Charakter a incidence nežádoucích účinků byly v léčebných skupinách obdobné. 5.2 Farmakokinetické vlastnosti Absorpce Mikafungin je intravenózně podávané léčivo. 10
11 Farmakokinetika je v rozmezí denních dávek od 12,5 mg do 200 mg a od 3 mg/kg do 8 mg/kg lineární. Neexistují žádné důkazy systémové kumulace při opakovaném podávání a ustáleného stavu se obvykle dosáhne do 4 až 5 dnů. Distribuce Po intravenózním podání vykazují koncentrace mikafunginu biexponenciální pokles. Lék se rychle distribuuje do tkání. V systémovém oběhu se mikafungin ve značné míře váže na plazmatické bílkoviny (> 99 %), především na albumin. Vazba na albumin je nezávislá na koncentraci mikafunginu ( µg/ml). Distribuční objem v ustáleném stavu (Vss) činil přibližně litrů. Biotransformace Hlavní sloučeninou cirkulující v systémovém oběhu je mikafungin v nezměněné podobě. Bylo prokázáno, že mikafungin je metabolizován na několik sloučenin. Z těch byly v systémovém oběhu detekovány tyto metabolity mikafunginu: M-1 (katecholová forma), M-2 (metoxy forma M1) a M-5 (hydroxylace postranního řetězce). Expozice těmto metabolitům je nízká a metabolity nepřispívají k celkové účinnosti mikafunginu. I když je mikafungin in vitro substrátem pro CYP3A, hydroxylace enzymem CYP3A není hlavní cestou metabolismu mikafunginu in vivo. Eliminace Průměrný terminální poločas činí přibližně hodin a zůstává neměnný v rozmezí dávek do 8 mg/kg, a to při jednorázovém i opakovaném podání. Celková clearance činila u zdravých subjektů a dospělých pacientů 0,15 0,3 ml/min/kg a není závislá na dávce po jednorázovém ani po opakovaném podávání. Po intravenózním podání radioaktivně značené dávky 14 C-mikafunginu (25 mg) zdravým dobrovolníkům bylo během 28 dní vyloučeno 11,6 % radioaktivity v moči a 71,0 % ve stolici. Tyto údaje ukazují, že eliminace mikafunginu probíhá hlavně extrarenální cestou. V plazmě byly detekovány metabolity M-1 a M-2 pouze ve stopových koncentracích a hojnější metabolit M-5 představoval 6,5 % mateřské sloučeniny. Zvláštní populace Pediatrická populace: U dětských pacientů byly hodnoty AUC v rozpětí dávek 0,5 4 mg/kg úměrné dávcena clearance měla vliv hmotnost, přičemž průměrné hodnoty clearance upravené podle tělesné hmotnosti byly 1,35 krát vyšší u mladších dětí (4 měsíce až 5 let) a 1,14 krát vyšší u pediatrických pacientů ve věku 6 až 11 let. Starší děti (12-16 let) měly průměrné hodnoty podobné hodnotám stanoveným u dospělých pacientů. Průměrná hodnota clearance u nedonošených dětí (gestační stáří přibližně 26 týdnů) je přibližně 5 x vyšší než u dospělých. Starší osoby: Po podání jedné infuze 50 mg mikafunginu trvající 1 hodinu byla farmakokinetika u starších osob (ve věku let) podobná farmakokinetice u mladých subjektů (20 24 let). U starších osob není zapotřebí provádět úpravu dávkování. Pacienti s poruchou funkce jater: Ve studii provedené u pacientů se středně závažným poškozením jater (Child-Pughovo skóre 7 9) (n=8) se farmakokinetika mikafunginu významně nelišila od zdravých subjektů (n=8). Proto není u pacientů s mírným až středně závažným poškozením jater zapotřebí provádět úpravu dávkování. Ve studii provedené u pacientů se závažným poškozením jater (Child-Pughovo skóre 10-12) (n=8) byly ve srovnání se zdravými dobrovolníky (n=8) pozorovány nižší plazmatické koncentrace mikafunginu a vyšší plazmatické koncentrace hydroxylovaného metabolitu (M-5). Tyto údaje nejsou dostatečné jako podklad pro doporučené dávkování u pacientů s těžkým poškozením jater. Pacienti s poruchou funkce ledvin: Závažné poškození funkce ledvin (glomerulární filtrace - [GFR] < 30 ml/min) nemělo významný vliv na farmakokinetiku mikafunginu. U pacientů s poškozením ledvin není zapotřebí provádět úpravu dávkování. 11
12 Pohlaví / rasa: Pohlaví a rasa (bělošská, černošská a asijská) neměly významný vliv na farmakokinetické parametry mikafunginu. V závislosti na pohlaví nebo rase není zapotřebí provádět úpravu dávkování. 5.3 Předklinické údaje vztahující se k bezpečnosti Vznik ložisek alterovaných hepatocytů (FAH) a hepatocelulárních nádorů u potkanů byl závislý na dávce i trvání léčby mikafunginem. FAH zaznamenaná po léčbě trvající 13 týdnů nebo déle přetrvávala po 13-týdenním období vysazení a rozvinula se v hepatocelulární nádory po období bez léčby, které pokrývalo délku života potkanů. Žádné standardní studie kancerogenity nebyly provedeny, ale vznik FAH byl hodnocen u samic potkanů po až 20 a 18 měsících od ukončení 3 resp. 6-měsíční léčby. V obou studiích byla pozorována zvýšená incidence/počet hepatocelulárních nádorů po 18 a 20 měsíčním období bez léčby u skupiny s vysokou dávkou 32 mg/kg/den a také u skupiny s nízkou dávkou (i když ne statisticky významně). Plazmatická expozice na předpokládané prahové úrovni pro vývoj nádoru u potkanů (tzn. dávka, kdy nebyly detekovány FAH ani nádory jater) byla ve stejném rozmezí jako klinická expozice. Relevance hepatokancerogenního potenciálu mikafunginu pro terapeutické použití u člověka není známa. Toxikologie mikafunginu po opakované nitrožilní dávce u potkanů a/nebo psů ukázala nežádoucí ovlivnění jater, močového traktu, červených krvinek a samčích reprodukčních orgánů. Úroveň expozice, při níž se tyto účinky neobjevovaly (NOAEL), byla ve stejném rozmezí jako je klinická hladina expozice nebo nižší. Z toho lze odvodit, že můžeme vznik těchto nežádoucích účinků očekávat při klinickém použití mikafunginu u člověka. Ve standardních farmakologických testech bezpečnosti byly kardiovaskulární účinky a účinky spojené s uvolněním histaminu zjevné a jevily se jako časově závislé na nadprahových koncentracích. Prodloužení doby trvání infuze mající za následek snížení maximální plazmatické koncentrace vedlo ke zmírnění těchto účinků. Ve studiích toxicity po opakovaném podávání u potkanů se hepatotoxicita projevila zvýšením hodnot jaterních enzymů a degenerativními změnami hepatocytů, které byly doprovázeny známkami kompenzační regenerace. Účinky na játra psů zahrnovaly zvýšení hmotnosti a centrilobulární hypertrofii. Degenerativní změny hepatocytů nebyly pozorovány. U potkanů byla v 26-týdenních studiích opakovaného podávání pozorována vakuolizace epitelu ledvinných pánviček a též vakuolizace a ztluštění (hyperplazie) epitelu močového měchýře. V druhé 26-týdenní studii se hyperplazie buněk přechodného epitelu v močovém měchýři vyskytovala v mnohem nižší míře. Nálezy se ukázaly jako reverzibilní během kontrolního období 18 měsíců. Doba podávání mikafunginu v těchto studií na potkanech (6 měsíců) převyšuje obvyklou délku podávání mikafunginu u pacientů (viz bod 5.1). Mikafungin hemolyzoval králičí krev in vitro. U potkanů byly pozorovány příznaky hemolytické anémie po opakovaném bolusu mikafunginu. Ve studiích opakovaného podávání u psů nebyla pozorována hemolytická anémie. V reprodukčních studiích a studiích vývojové toxicity byla zaznamenána snížená porodní váha štěňat. U králíků se vyskytl jeden potrat při dávce 32 mg/kg/den. Samci potkanů léčení intravenózně po dobu 9 týdnů vykazovali vakuolizaci epitelových buněk kanálků nadvarlete, zvýšení hmotnosti nadvarlete a snížený počet spermií (o 15 %), nicméně ve studiích trvajících 13 a 26 týdnů se tyto změny neobjevily. U dospělých psů byly po delší léčbě (39 týdnů), ale nikoliv po 13 týdnech léčby, pozorovány atrofie semenotvorných tubulů s vakuolizací semenotvorného epitelu a pokles počtů spermií v nadvarlatech. U mladých psů nevyvolala 39-týdenní léčba vznik na dávce závislých lézí ve varlatech a nadvarlatech na konci léčby, ale po 13 týdnech bez léčby byl pozorován na dávce závislý nárůst těchto lézí v léčených uzdravujících se skupinách. Ve studii fertility a časného embryonálního vývoje u potkanů nebylo pozorováno žádné narušení samčí a samičí fertility. 12
13 Mikafungin neměl při posuzování standardními in vitro a in vivo testy, včetně jedné in vitro studie neplánované DNA syntézy s využitím potkaních hepatocytů, mutagenní ani klastogenní účinky. 6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek Monohydrát laktózy Kyselina citronová (k úpravě ph) Hydroxid sodný (k úpravě ph) 6.2 Inkompatibility Tento léčivý přípravek se nesmí mísit nebo podávat ve společné infuzi s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě Doba použitelnosti Neporušená injekční lahvička: 3 roky. Rekonstituovaný koncentrát v injekční lahvičce: Po rekonstituci 5 % roztokem glukózy (50 mg/ml) na infuzi nebo 0,9 % roztokem chloridu sodného (9 mg/ml) na infuzi byla chemická a fyzikální stabilita prokázána po dobu 48 hodin při teplotě 25 C. Naředěný infuzní roztok: Po naředění 0,9 % roztokem chloridu sodného (9 mg/ml) na infuzi nebo 5 % roztokem glukózy (50 mg/ml) na infuzi byla chemická a fyzikální stabilita prokázána na dobu 96 hodin při teplotě 25 C a ochraně před světlem. Mycamine neobsahuje žádné konzervační látky. Z mikrobiologického hlediska by měly být rekonstituované a zředěné roztoky použity okamžitě. Není-li roztok použit okamžitě, doba a podmínky uchovávání přípravku před použitím jsou v odpovědnosti uživatele a normálně by doba neměla být delší než 24 hodin při teplotě 2 až 8 C, pokud rekonstituce a ředění neproběhly za kontrolovaných a validovaných aseptických podmínek. 6.4 Zvláštní opatření pro uchovávání Neotevřené injekční lahvičky: Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání. Podmínky uchovávání po rekonstituci a naředění léčivého přípravku viz bod Druh obalu a velikost balení Skleněná injekční lahvička typu I o objemu 10 ml s pryžovou zátkou z izobutylenizoprénu (laminovaného PTFE) a snímatelným víčkem. Lahvička je obalena fólií, která chrání před UV zářením. Dodává se v baleních po 1 injekční lahvičce. 6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. 13
14 Mycamine se nesmí mísit nebo podávat ve společné infuzi s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny níže. Rekonstituce a ředění přípravku Mycamine se provádí aseptickou technikou za pokojové teploty takto: 1. Z injekční lahvičky je nutno sejmout plastové víčko a zátku vydezinfikovat alkoholem. 2. Do každé lahvičky je třeba po její vnitřní stěně sterilně a pomalu vstříknout 5 ml 0,9 % roztoku chloridu sodného (9 mg/ml) na infuzi nebo 5 % roztoku glukózy (50 mg/ml) na infuzi (odebraného z lahve/sáčku o objemu 100 ml). I když koncentrát bude pěnit, je třeba vykonat vše pro snížení množství vzniklé pěny na minimum. Je třeba rekonstituovat tolik lahviček přípravku Mycamine, aby se získala požadovaná dávka v mg (viz tabulka níže). 3. S lahvičkou je nutno pomalu zakroužit. NETŘEPAT. Prášek se zcela rozpustí. Koncentrát by měl být použit okamžitě. Lahvička je určena pouze pro jedno použití. Nepoužitý rekonstituovaný koncentrát proto okamžitě vyhoďte. 4. Všechen rekonstituovaný koncentrát z každé lahvičky je třeba natáhnout a vrátit do infuzního sáčku/láhve, z níž byl roztok k rekonstituci původně odebrán. Naředěný infuzní roztok by měl být použit okamžitě. Po naředění výše popsaným postupem byla chemická a fyzikální stabilita prokázána na dobu 96 hodin při teplotě 25 C a ochraně před světlem. 5. Infuzní sáček/láhev by se měl opatrně otočit vzhůru dnem, aby se naředěný roztok rozptýlil, ale NESMÍ se s ním/ní třepat, aby nedošlo k napěnění. Roztok nepoužívejte, je-li zakalený nebo obsahuje-li sraženinu. 6. Infuzní sáček/láhev obsahující naředěný infuzní roztok by měl/a být vložen/a do uzavíratelného neprůhledného sáčku, který jej/ji bude chránit před světlem. Příprava infuzního roztoku Dávka (mg) Vhodná velikost lahvičky přípravku Mycamine (mg/lahvička) Objem chloridu sodného (0,9 %) nebo glukózy (5 %), pro přidání do lahvičky Objem (koncentrace) rekonstituovaného prášku Standardní infuze (doplněná do 100 ml) Konečná koncentrace 50 1 x 50 5 ml cca. 5 ml (10 mg/ml) 0,5 mg/ml x ml cca. 5 ml (20 mg/ml) 1,0 mg/ml x x 50 5 ml cca. 10 ml 1,5 mg/ml x ml cca. 10 ml 2,0 mg/ml Po rekonstituci a naředění by měl být roztok podán nitrožilní infuzí trvající asi 1 hodinu. 7. DRŽITEL ROZHODNUTÍ O REGISTRACI Astellas Pharma Europe B.V. Sylviusweg BE Leiden Nizozemsko 8. REGISTRAČNÍ ČÍSLO(A) EU/1/08/448/ DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE Datum první registrace : 25. dubna 2008 Datum posledního prodloužení registrace: 20.prosince
15 10. DATUM REVIZE TEXTU Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky na adrese 15
16 1. NÁZEV PŘÍPRAVKU Mycamine 100 mg prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 100 mg micafunginum (ve formě micafunginum natricum). Po rekonstituci obsahuje jeden ml 20 mg micafunginum (ve formě micafunginum natricum). Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Prášek pro infuzní roztok. Bílý kompaktní prášek. 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikace Mycamine je indikován pro: Dospělí, dospívající 16 let a starší pacienti: - Léčba invazivní kandidózy. - Léčba ezofageální kandidózy u pacientů, u nichž je vhodná intravenózní terapie. - Profylaxe kandidových infekcí u pacientů podstupujících alogenní transplantaci hematopoetických kmenových buněk nebo u pacientů, u nichž se předpokládá neutropenie (absolutní počet neutrofilů < 500 buněk / µl) po dobu 10 nebo více dní. Děti (včetně novorozenců) a dospívající < 16 let věku: - Léčba invazivní kandidózy. - Profylaxe kandidových infekcí u pacientů podstupujících alogenní transplantaci hematopoetických kmenových buněk nebo u pacientů, u nichž se předpokládá neutropenie (absolutní počet neutrofilů < 500 buněk / µl) po dobu 10 nebo více dní. Rozhodnutí o použití přípravku Mycamine by mělo zohlednit potenciální riziko vzniku nádorů jater (viz bod 4.4). Mycamine by se měl proto používat pouze v případě, že nejsou vhodná jiná antimykotika. 4.2 Dávkování a způsob podání Je třeba vzít v úvahu úřední/národní pokyny týkající se správného použití antimykotických přípravků. Léčbu přípravkem Mycamine má zahajovat pouze lékař se zkušenostmi s léčbou mykotických infekcí. Před zahájením léčby se odeberou vzorky na mykotickou kultivaci a další potřebná laboratorní vyšetření (včetně histopatologie), aby mohly být izolovány a určeny příčinné organismy. Léčba může být zahájena dříve, než jsou k dispozici výsledky kultivace a dalších laboratorních vyšetření. Po získání těchto výsledků však má být antimykotická léčba odpovídajícím způsobem upravena. Dávkování Dávkovací režim přípravku Mycamine závisí na tělesné hmotnosti pacienta, jak je uvedeno v následujících tabulkách: 16
17 Použití u dospělých, dospívajících 16 let věku a starších pacientů Indikace Tělesná hmotnost > 40 kg Tělesná hmotnost 40 kg Léčba invazivní kandidózy 100 mg/den* 2 mg/kg/den* Léčba ezofageální kandidózy 150 mg/den 3 mg/kg/den Profylaxe kandidových infekcí 50 mg/den 1 mg/kg/den * Jestliže není odpověď pacienta dostatečná, např. přetrvávají-li pozitivní kultivace nebo nelepší-li se klinický stav, lze dávku zvýšit na 200 mg/den u pacientů s tělesnou hmotností > 40 kg resp. na 4 mg/kg/den u pacientů s tělesnou hmotností 40 kg. Trvání léčby Invazivní kandidóza: Léčba kandidové infekce by měla trvat minimálně 14 dní. V antimykotické léčbě by se mělo pokračovat nejméně jeden týden poté, co byly dvě po sobě následující hemokultury negativní, a po odeznění klinických příznaků a symptomů infekce. Ezofageální kandidóza: Pro léčbu ezofageální kandidózy by měl být Mycamine podáván nejméně jeden týden po odeznění klinických příznaků a symptomů. Profylaxe kandidových infekcí: Pro profylaxi kandidových infekcí by měl být Mycamine podáván ještě nejméně jeden týden po dosažení normálních hodnot počtu neutrofilů. Použití u dětí (včetně novorozenců) a dospívajících < 16 let věku Indikace Tělesná hmotnost > 40 kg Tělesná hmotnost 40 kg Léčba invazivní kandidózy 100 mg/den* 2 mg/kg/den* Profylaxe kandidových infekcí 50 mg/den 1 mg/kg/den * Jestliže není odpověď pacienta dostatečná, např. přetrvávají-li pozitivní kultivace nebo nelepší-li se klinický stav, lze dávku zvýšit na 200 mg/den u pacientů s tělesnou hmotností > 40 kg resp. na 4 mg/kg/den u pacientů s tělesnou hmotností 40 kg. Trvání léčby Invazivní kandidóza: Léčba kandidové infekce by měla trvat minimálně 14 dní. V antimykotické léčbě by se mělo pokračovat nejméně jeden týden poté, co byly dvě po sobě následující hemokultury negativní, a po odeznění klinických příznaků a symptomů infekce. Profylaxe kandidových infekcí: Pro profylaxi kandidových infekcí by měl být Mycamine podáván ještě nejméně jeden týden po dosažení normálních hodnot počtu neutrofilů. Zkušenosti s použitím přípravku Mycamine u pacientů mladších než 2 roky jsou omezené. Aspekty rasy/pohlaví Není zapotřebí žádná úprava dávkování v závislosti na pohlaví nebo rase (viz bod 5.2). Pacienti s poruchou funkce jater U pacientů s mírnou nebo středně závažnou poruchou funkce jater není zapotřebí žádná úprava dávkování (viz bod 5.2). V současné době nejsou k dispozici dostatečné údaje o použití přípravku Mycamine u pacientů se závažnou poruchou funkce jater a jeho použití se u těchto pacientů nedoporučuje (viz bod 4.4 a 5.2). Pacienti s poruchou funkce ledvin U pacientů s poruchou funkce ledvin není zapotřebí žádná úprava dávkování (viz bod 5.2). Způsob podání 17
18 Po rekonstituci a naředění má být roztok podán formou intravenózní infuze trvající přibližně 1 hodinu. Rychlejší infuze může vést k častějším reakcím z uvolnění histaminu. Pokyny k rekonstituci viz bod Kontraindikace Hypersenzitivita na léčivou látku, jiné echinokandiny nebo na kteroukoli pomocnou látku uvedenou v bodě Zvláštní upozornění a opatření pro použití Účinky na játra: U potkanů byl po léčebném období 3 měsíců nebo delším pozorován vznik ložisek alterovaných hepatocytů (FAH) a hepatocelulárních nádorů. Předpokládaný práh pro vývoj nádoru u potkanů leží přibližně v rozmezí klinické expozice. Význam tohoto nálezu pro terapeutické použití u pacientů není možné vyloučit. Funkce jater by měla být během léčby mikafunginem pozorně monitorována. Pro minimalizaci rizika adaptivní regenerace a možného následného vzniku nádoru jater se doporučuje časné přerušení léčby, pokud se objeví významné a přetrvávající zvýšení hladin ALT/AST. Při léčbě mikafunginem je třeba pečlivě sledovat poměr přínosu a rizika, a to zejména u pacientů se závažnou poruchou jaterní funkce nebo chronickým jaterním onemocněním, o němž je známo, že představuje preneoplastický stav, jako je pokročilá jaterní fibróza, cirhóza, virová hepatitida, neonatální jaterní onemocnění nebo kongenitální enzymatické defekty, nebo při podávání souběžné léčby, která může mít hepatotoxické anebo genotoxické účinky. Léčba mikafunginem byla spojována s významným poškozením jaterní funkce (zvýšení ALT, AST nebo celkového bilirubinu > 3-násobek horní hranice normy) u zdravých dobrovolníků i pacientů. U některých pacientů byly hlášeny závažnější jaterní dysfunkce, hepatitida nebo jaterní selhání, včetně fatálních případů. Pediatričtí pacienti mladší 1 roku věku by mohli být náchylnější k jaternímu poškození (viz bod 4.8). Anafylaktická reakce Během podávání mikafunginu se mohou vyskytnout anafylaktické/anafylaktoidní reakce včetně šoku. Pokud tyto reakce nastanou, musí být infuze mikafunginu přerušena a podána vhodná léčba. Kožní reakce Byly hlášeny exfoliativní kožní reakce jako je Stevens-Johnsonův syndrom a toxická epidermální nekrolýza. Pokud se u pacientů objeví vyrážka, je třeba je pečlivě sledovat a pokud se léze zhoršují, podávání mikafunginu ukončit. Hemolýza U pacientů léčených mikafunginem byly hlášeny vzácné případy hemolýzy včetně akutní intravaskulární hemolýzy a hemolytické anémie. Pacienti, u nichž se během léčby mikafunginem vyvinou klinické nebo laboratorní projevy hemolýzy, by měli být pozorně sledováni s ohledem na příznaky zhoršení těchto stavů a měl by být zhodnocen poměr přínosu a rizika pokračující terapie mikafunginem. Účinek na ledviny Mikafungin může způsobovat poruchy ledvin, selhání ledvin a abnormality ve funkčních testech ledvin. Pacienti by měli být důkladně monitorováni s ohledem na zhoršení funkce ledvin. Interakce s jinými léčivými přípravky K současnému podávání mikafunginu a amfotericinu B deoxycholátu by se mělo přistupovat jen pokud prospěch jasně převažuje nad rizikem a za pečlivého monitorování toxicity amfotericinu B deoxycholátu (viz bod 4.5). 18
19 U pacientů užívajících sirolimus, nifedipin nebo itrakonazol v kombinaci s přípravkem Mycamine by měla být sledována toxicita sirolimu, nifedipinu nebo itrakonazolu a je-li třeba, je nutno dávku sirolimu, nifedipinu nebo itrakonazolu snížit (viz bod 4.5). Pediatrická populace Incidence některých nežádoucích účinků byla vyšší u pediatrických pacientů než u dospělých pacientů (viz bod 4.8). 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce U mikafunginu existuje nízká pravděpodobnost interakcí s léky metabolizovanými izoenzymem CYP3A. Byly provedeny studie interakce léku na zdravých lidských subjektech za účelem posouzení pravděpodobnosti interakce mezi mikafunginem a mykofenolát mofetilem, cyklosporinem, takrolimem, prednisolonem, sirolimem, nifedipinem, flukonazolem, ritonavirem, rifampicinem, itrakonazolem, vorikonazolem a amfotericinem B. V těchto studiích nebyly pozorovány žádné známky změněné farmakokinetiky mikafunginu. Při současném podávání těchto léků nejsou zapotřebí žádné úpravy dávkování mikafunginu. Hodnota expozice (AUC) pro itrakonazol, sirolimus a nifedipin se v přítomnosti mikafunginu mírně zvýšila (22 %, 21 % resp. 18 %). Současné podávání mikafunginu a amfotericinu B deoxycholátu bylo spojeno s 30 % nárůstem expozice amfotericinu B deoxycholátu. Vzhledem k možnému klinickému významu této skutečnosti by se měly tyto přípravky současně podávat jen pokud prospěch jasně převažuje nad rizikem a za pečlivého monitorování toxicity amfotericinu B deoxycholátu (viz bod 4.4). U pacientů užívajících sirolimus, nifedipin nebo itrakonazol v kombinaci s přípravkem Mycamine by měla být sledována toxicita sirolimu, nifedipinu nebo itrakonazolu a je-li třeba, je nutno dávku sirolimu, nifedipinu nebo itrakonazolu snížit (viz bod 4.4) Těhotenství a kojení Těhotenství Žádné údaje o podávání mikafunginu těhotným ženám nejsou k dispozici. Ve studiích na zvířatech přecházel mikafungin placentární bariérou a byla pozorována reprodukční toxicita (viz bod 5.3). Potenciální riziko pro člověka není známé. Mycamine se proto nemá v těhotenství podávat, pokud to není nezbytně nutné. Kojení Není známo, zda se mikafungin vylučuje do lidského mateřského mléka. Studie na zvířatech ukázaly vylučování mikafunginu do mateřského mléka. Rozhodnutí o tom, zda pokračovat či přerušit kojení nebo pokračovat či přerušit terapii přípravkem Mycamine, by mělo být provedeno s ohledem na přínos kojení pro dítě a přínos léčby přípravkem Mycamine pro matku. Fertilita Ve studiích na zvířatech byla pozorována testikulární toxicita (viz bod 5.3). Mikafungin může mít potenciál ovlivňovat u člověka mužskou fertilitu. 4.7 Účinky na schopnost řídit a obsluhovat stroje Studie hodnotící účinky na schopnost řídit a používat stroje nebyly provedeny. Nicméně se mohou objevit nežádoucí reakce, které by mohly ovlivňovat schopnost řídit a obsluhovat stroje (viz bod 4.8). 4.8 Nežádoucí účinky 19
20 Souhrn bezpečnostního profilu Bezpečnostní profil mikafunginu je založen na výsledcích klinických studií u celkem 3028 pacientů: šlo o 2002 pacientů s kandidovými infekcemi (včetně kandidémie, invazivní kandidózy a ezofageální kandidózy), 375 pacientů s invazivní aspergilózou (především refrakterní infekce) a 651 případů profylaxe systémových mykotických infekcí. Pacienti léčení mikafunginem v klinických studiích představují kriticky nemocnou populaci pacientů, která vyžaduje podávání většího počtu léčivých přípravků včetně antineoplastické chemoterapie, silných systémových imunosupresiv a širokospektrých antibiotik. Tito pacienti trpěli širokou škálou komplikovaných stavů, jako jsou hematologická nádorová onemocnění a infekce HIV, nebo byli po transplantaci či byli léčeni na jednotkách intenzivní péče. Z profylaktických důvodů byli mikafunginem léčeni pacienti, kteří podstoupili transplantaci hematopoetických kmenových buněk a kterým hrozilo vysoké riziko mykotických infekcí. Celkově zaznamenalo 32,2 % pacientů nežádoucí účinky. Nejčastěji hlášenými nežádoucími účinky byly nevolnost (2,8 %), zvýšené hladiny alkalické fosfatázy v krvi (2,7 %), flebitida (2,5 %, především u HIV pozitivních pacientů s periferními nitrožilními katétry), zvracení (2,5 %) a zvýšené hladiny aspartátaminotransferázy (2,3 %). Při analýze údajů o bezpečnosti podle pohlaví nebo rasy nebyly zjištěny žádné klinicky významné rozdíly. Seznam nežádoucích účinků v tabulce V následující tabulce jsou uvedeny nežádoucí účinky, uspořádané podle tříd orgánových systémů a podle terminologie MedDRA. V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti. Třída orgánových systémů Poruchy krve a lymfatického systému Poruchy imunitního systému Endokrinní poruchy Poruchy metabolismu a výživy Psychiatrické poruchy Poruchy nervového systému Srdeční poruchy Časté 1/100 až < 1/10 leukopenie, neutropenie, anémie hypokalémie, hypomagnezémie, hypokalcémie bolest hlavy Méně časté 1/1000 až < 1/100 pancytopenie, trombocytopenie, eozinofílie, hypoalbuminémie anafylaktická / anafylaktoidní reakce (viz bod 4.4), hypersenzitivita hyperhidróza hyponatrémie, hyperkalémie, hypofosfatémie, anorexie insomnie, úzkost, zmatenost somnolence, třes, závrať, dysgeusie tachykardie, palpitace, bradykardie Cévní poruchy flebitida hypotenze, hypertenze, návaly Vzácné 1/10000 až < 1/1000 hemolytická anémie, hemolýza (viz bod 4.4) Není známo (z dostupných údajů nelze určit) diseminovaná intravaskulární koagulace šok 20
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 50 mg micafunginum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 50 mg micafunginum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 50 mg micafunginum (ve formě micafunginum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 50 mg micafunginum (ve formě micafunginum
Pokyny pro podávání přípravku a sledování pacienta
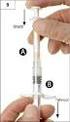 Pokyny pro podávání přípravku a sledování pacienta Informace pro lékaře a zdravotní sestry Červenec 2011 2 Úvod Tato příručka je určena předepisujícím lékařům a zdravotním sestrám a poskytuje praktický
Pokyny pro podávání přípravku a sledování pacienta Informace pro lékaře a zdravotní sestry Červenec 2011 2 Úvod Tato příručka je určena předepisujícím lékařům a zdravotním sestrám a poskytuje praktický
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mycamine 50 mg Jedna injekční
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mycamine 50 mg Jedna injekční
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mycamine 50 mg Jedna injekční
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mycamine 50 mg Jedna injekční
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mycamine 50 mg Jedna injekční
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mycamine 50 mg Jedna injekční
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 400 mg + 40 mg. čípky PROCTO-GLYVENOL. 50 mg/g + 20 mg/g. rektální krém
 sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
Příbalová informace: informace pro uživatele. Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok Micafunginum
 Příbalová informace: informace pro uživatele Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok Micafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příbalová informace: informace pro uživatele Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok Micafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. ECALTA 100 mg prášek pro přípravu infuzního roztoku s rozpouštědlem.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ECALTA 100 mg prášek pro přípravu infuzního roztoku s rozpouštědlem. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička obsahuje anidulafunginum 100 mg.
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ECALTA 100 mg prášek pro přípravu infuzního roztoku s rozpouštědlem. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička obsahuje anidulafunginum 100 mg.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
Příbalová informace: informace pro uživatele. Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok micafunginum
 Příbalová informace: informace pro uživatele Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok micafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příbalová informace: informace pro uživatele Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok micafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp. zn. sukls230046/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp. zn. sukls230046/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 5 mg/ml injekční roztok pro skot a prasata
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Praxbind doporučení pro podávání (SPC)
 Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Infuzní roztok. Roztok je čirý, bezbarvý až slabě narůžověle-oranžový. Vnímání zabarvení se může lišit. Teoretická osmolarita: 305 mosm/l ph: 4,5 5,5
 Sp.zn.sukls176520/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Paracetamol B. Braun 10 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml infuzního roztoku obsahuje paracetamolum
Sp.zn.sukls176520/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Paracetamol B. Braun 10 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml infuzního roztoku obsahuje paracetamolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls195317/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin-POS 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls195317/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin-POS 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini
Gynekologie: Metroragie, primární menoragie nebo menoragie související s nitroděložním tělískem bez prokazatelné organické příčiny.
 Sp.zn.sukls81671/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclonamine 500 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg. Léčivý přípravek obsahuje
Sp.zn.sukls81671/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclonamine 500 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg. Léčivý přípravek obsahuje
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU VPRIV 200 U prášek pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 200 jednotek* (U) velaglucerasum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU VPRIV 200 U prášek pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 200 jednotek* (U) velaglucerasum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6046/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucosolvan long effect Tvrdé tobolky s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6046/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucosolvan long effect Tvrdé tobolky s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných látek viz bod 6.1.
 Sp. zn. sukls155368/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Silkis mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných
Sp. zn. sukls155368/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Silkis mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls40560/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 1mg/ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje loratadinum 1 mg. Pomocná látka se známým účinkem:
sp.zn.sukls40560/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 1mg/ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje loratadinum 1 mg. Pomocná látka se známým účinkem:
Pomocné látky se známým účinkem: prostý sirup 67%, usušená tekutá glukosa.
 sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls63588/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se známým účinkem:
sp.zn.sukls63588/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se známým účinkem:
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Příloha III. Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls40230/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU AMBROSAN 15 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje ambroxoli hydrochloridum 15 mg. Pomocné látky se
sp.zn.sukls40230/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU AMBROSAN 15 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje ambroxoli hydrochloridum 15 mg. Pomocné látky se
Souhrn údajů o přípravku
 sp.zn. sukls22891/2008 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Salofalk 500, čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: jeden čípek obsahuje mesalazinum 500 mg Úplný seznam pomocných
sp.zn. sukls22891/2008 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Salofalk 500, čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: jeden čípek obsahuje mesalazinum 500 mg Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls83386/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam pomocných látek viz
sp.zn. sukls83386/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam pomocných látek viz
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.sukls10638/2011 a příloha k sp.zn. sukls246529/2010, sukls242130/2011, sukls46873/2012
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.sukls10638/2011 a příloha k sp.zn. sukls246529/2010, sukls242130/2011, sukls46873/2012 1. NÁZEV PŘÍPRAVKU Ewofex 120 mg potahované tablety SOUHRN
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.sukls10638/2011 a příloha k sp.zn. sukls246529/2010, sukls242130/2011, sukls46873/2012 1. NÁZEV PŘÍPRAVKU Ewofex 120 mg potahované tablety SOUHRN
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
Bezpečnost a účinnost přípravku Neoclarityn 5 mg potahované tablety u dětí mladších 12 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
 1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
Pomocná látka se známým účinkem: Jedna tableta obsahuje 75 mg monohydrátu laktosy. Úplný seznam pomocných látek viz bod 6.1.
 sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls106353/2011
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls106353/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRVKU Lopacut 2 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls106353/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRVKU Lopacut 2 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LEVOPRONT sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: levodropropizinum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LEVOPRONT sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: levodropropizinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls115710/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLYPRESSIN 1 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule s 8,5 ml
Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls115710/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLYPRESSIN 1 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule s 8,5 ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls243839/2011 a sp.zn.: sukls113646/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum 10,0 mg (odpovídá
sp.zn.: sukls243839/2011 a sp.zn.: sukls113646/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum 10,0 mg (odpovídá
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
 Sp.zn.sukls137614/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
Sp.zn.sukls137614/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje famotidinum 10 mg. Pomocné
sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje famotidinum 10 mg. Pomocné
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum
 sp.zn.sukls149832/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek
sp.zn.sukls149832/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému
Příbalová informace: informace pro pacienta AXETINE 750 mg AXETINE 1,5 g Prášek pro injekční/infuzní roztok Cefuroximum
 sp.zn.sukls53459/2016 Příbalová informace: informace pro pacienta AXETINE 750 mg AXETINE 1,5 g Prášek pro injekční/infuzní roztok Cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp.zn.sukls53459/2016 Příbalová informace: informace pro pacienta AXETINE 750 mg AXETINE 1,5 g Prášek pro injekční/infuzní roztok Cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Desloratadin STADA 5 mg jsou modré, kulaté, bikonvexní potahované tablety o průměru přibližně 6,5 mm.
 Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
s energií 172 kev (91 %) a 246 kev (94 %). Vnitřní konverzí vzniká záření rentgenové s energií 23 kev a 26 kev.
 sp.zn. sukls101319/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Indium (In111) Chloride 370 MBq/ml, radionuklidový prekurzor, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Obsah lahvičky k datu a
sp.zn. sukls101319/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Indium (In111) Chloride 370 MBq/ml, radionuklidový prekurzor, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Obsah lahvičky k datu a
Granule pro perorální roztok. Bílé až téměř bílé granule v jednodávkovém sáčku.
 Sp.zn.sukls70977/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Fosfomycin LadeePharma 3 g Granule pro perorální roztok 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fosfomycinum trometamoli. Jeden jednodávkový
Sp.zn.sukls70977/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Fosfomycin LadeePharma 3 g Granule pro perorální roztok 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fosfomycinum trometamoli. Jeden jednodávkový
Příloha II. Vědecké závěry a zdůvodnění změny v registraci
 Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
INFLECTRA SCREENINGOVÝ LIST. a výběru pacientů pro všechny schválené indikace. Obsahuje pokyny ke správnému screeningu
 Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
Starší pacienti: Pro tuto věkovou skupinu nejsou žádná zvláštní doporučení ohledně dávky.
 Sp.zn. sukls59988/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ERAZABAN 10% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Docosanolum 100 mg v 1 g krému. Pomocné látky: 50 mg propylenglykolu / 1 g krému
Sp.zn. sukls59988/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ERAZABAN 10% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Docosanolum 100 mg v 1 g krému. Pomocné látky: 50 mg propylenglykolu / 1 g krému
Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg.
 Sp.zn.sukls97430/2013 1.NÁZEV LÉČIVÉHO PŘÍPRAVKU Tannex 2 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg. Pomocná látka se známým účinkem:
Sp.zn.sukls97430/2013 1.NÁZEV LÉČIVÉHO PŘÍPRAVKU Tannex 2 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg. Pomocná látka se známým účinkem:
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta. PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum)
 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum) Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum) Přečtěte si pozorně celou příbalovou informaci dříve,
Celkové shrnutí vědeckého hodnocení přípravku Kytril a souvisejících názvů (viz příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÉ INFORMACE PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 11 Vědecké závěry Celkové
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÉ INFORMACE PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 11 Vědecké závěry Celkové
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls30063/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU. Chondrostad 1500 mg
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls30063/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Chondrostad 1500 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje 1884,0 mg
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls30063/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Chondrostad 1500 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje 1884,0 mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Muscoril cps. Jedna tvrdá tobolka obsahuje thiocolchicosidum 4 mg. Jedna ampule (2 ml) obsahuje thiocolchicosidum 4 mg.
 sp.zn. sukls129911/2014 Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou.
sp.zn. sukls129911/2014 Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou.
1. NÁZEV PŘÍPRAVKU. Orgalutran 0,25 mg/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 1. NÁZEV PŘÍPRAVKU Orgalutran 0,25 mg/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Předplněná injekční stříkačka obsahuje 0,25 mg ganirelixum v 0,5 ml vodného roztoku. Léčivá látka ganirelixum
1. NÁZEV PŘÍPRAVKU Orgalutran 0,25 mg/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Předplněná injekční stříkačka obsahuje 0,25 mg ganirelixum v 0,5 ml vodného roztoku. Léčivá látka ganirelixum
Světle červené, ploché, kulaté, skvrnité tablety, na jedné straně označené písmenem K.
 1. NÁZEV PŘÍPRAVKU Aerius 2,5 mg tablety dispergovatelné v ústech 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg. Pomocné látky se známým
1. NÁZEV PŘÍPRAVKU Aerius 2,5 mg tablety dispergovatelné v ústech 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg. Pomocné látky se známým
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Feligen CRP Lyofilizát pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lyofilizovaná složka Léčivé
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Feligen CRP Lyofilizát pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lyofilizovaná složka Léčivé
Sp.zn.sukls88807/2015
 Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Úplný seznam pomocných látek viz bod 6.1. Čirý žluto-hnědý sirup s charakteristickou příchutí medu a citronu.
 Sp.zn.sukls121997/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU OlynMuco s příchutí medu a citronu 20 mg/ml 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Tento přípravek obsahuje guaifenesinum 20 mg v 1 ml.
Sp.zn.sukls121997/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU OlynMuco s příchutí medu a citronu 20 mg/ml 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Tento přípravek obsahuje guaifenesinum 20 mg v 1 ml.
V gynekologii: Metrorhagie, primární nebo nitroděložními tělísky způsobená menorhagie s vyloučením organických příčin.
 sp.zn. sukls131149/2012 a sp.zn. sukls119721/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU l. NÁZEV PŘÍPRAVKU Dicynone 500 Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg.
sp.zn. sukls131149/2012 a sp.zn. sukls119721/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU l. NÁZEV PŘÍPRAVKU Dicynone 500 Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls196586/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SMECTA prášek pro perorální suspenzi 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 sáček obsahuje: Léčivá látka: Diosmectitum 3,000 g Pomocné
sp.zn.: sukls196586/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SMECTA prášek pro perorální suspenzi 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 sáček obsahuje: Léčivá látka: Diosmectitum 3,000 g Pomocné
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SANDOMIGRAN 0,5 mg obalené tablety 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SANDOMIGRAN 0,5 mg obalené tablety 2. KVALITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls211402/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje alfuzosini hydrochloridum10
sp. zn. sukls211402/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje alfuzosini hydrochloridum10
sp.zn.: sukls7967/2011
 sp.zn.: sukls7967/2011 Souhrn údajů o přípravku. 1. NÁZEV PŘÍPRAVKU sáčky 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ Jedna tobolka obsahuje léčivou látku: Lysatum bacteriale OM 85 cryodesicatum, odpovídá
sp.zn.: sukls7967/2011 Souhrn údajů o přípravku. 1. NÁZEV PŘÍPRAVKU sáčky 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ Jedna tobolka obsahuje léčivou látku: Lysatum bacteriale OM 85 cryodesicatum, odpovídá
Jedna obalená tableta obsahuje Valerianae extractum siccum (3-6:1), extrahováno ethanolem 70% (V/V) 445 mg.
 Sp.zn.sukls16435/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU PERSEN mono obalená tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje Valerianae extractum siccum (3-6:1),
Sp.zn.sukls16435/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU PERSEN mono obalená tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje Valerianae extractum siccum (3-6:1),
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 200 mg (= 82,0 mg alaninum; 134,6 mg glutaminum)
 sp.zn. sukls108778/2012 1. NÁZEV PŘÍPRAVKU Dipeptiven Koncentrát pro přípravu infuzního roztoku SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu pro přípravu infuzního
sp.zn. sukls108778/2012 1. NÁZEV PŘÍPRAVKU Dipeptiven Koncentrát pro přípravu infuzního roztoku SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu pro přípravu infuzního
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls76878/2017 1. NÁZEV PŘÍPRAVKU SMECTA 3 g prášek pro perorální suspenzi SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje diosmectitum 3 g. Pomocné látky
sp. zn. sukls76878/2017 1. NÁZEV PŘÍPRAVKU SMECTA 3 g prášek pro perorální suspenzi SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje diosmectitum 3 g. Pomocné látky
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ECALTA 100 mg prášek pro koncentrát pro infuzní roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička obsahuje anidulafunginum 100 mg. Rekonstituovaný
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ECALTA 100 mg prášek pro koncentrát pro infuzní roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička obsahuje anidulafunginum 100 mg. Rekonstituovaný
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls85525/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GAVISCON LIQUID PEPPERMINT 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Natrii alginas Natrii hydrogencarbonas Calcii carbonas 500,0 mg/10
sp. zn. sukls85525/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GAVISCON LIQUID PEPPERMINT 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Natrii alginas Natrii hydrogencarbonas Calcii carbonas 500,0 mg/10
Kvasinkové infekce kůže, zvláště způsobené rodem Candida (např. Candida albicans).
 sp.zn. sukls69332/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Terbistad 1% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g krému obsahuje 10 mg terbinafini hydrochloridum. Pomocné látky se známým
sp.zn. sukls69332/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Terbistad 1% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g krému obsahuje 10 mg terbinafini hydrochloridum. Pomocné látky se známým
LAGOSA 150 mg Obalené tablety
 sp.zn. sukls198252/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LAGOSA 150 mg Obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Cardui mariae fructus extractum siccum (35-40:1) 204 mg (odpovídá
sp.zn. sukls198252/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LAGOSA 150 mg Obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Cardui mariae fructus extractum siccum (35-40:1) 204 mg (odpovídá
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls86344/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VENORUTON FORTE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta Venorutonu Forte obsahuje 500 mg oxerutinum (O-beta-hydroxyethyl-rutosid).
sp.zn. sukls86344/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VENORUTON FORTE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta Venorutonu Forte obsahuje 500 mg oxerutinum (O-beta-hydroxyethyl-rutosid).
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls40230/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU AMBROSAN 30 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje ambroxoli hydrochloridum 30 mg. Pomocné látky se
sp.zn.sukls40230/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU AMBROSAN 30 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje ambroxoli hydrochloridum 30 mg. Pomocné látky se
