Barviva založená na anthrachinonu, kypová barviva a polycyklická kypová barviva - typické reakce
|
|
|
- Viktor Dostál
- před 6 lety
- Počet zobrazení:
Transkript
1 Barviva založená na anthrachinonu, kypová barviva a polycyklická kypová barviva - typické reakce a tato barviva a pigmenty, kterých je nepřeberné množství, uplatníme zobecňující hledisko, to je, že je probereme z pohledu typických reakcí a způsobu jejich provedení, které vedou k jejich výrobě. 1 Elektrofilní substituce 1.1 itrace itrace 9,10-anthrachinonu má základní pravidlo, které lze dokumentovat i kvantově chemickým výpočtem hustoty elektronů na jednotlivých atomech (obrázek TR.1), které říká, že pozice 1 je slabě upřednostněna pro atak elektrofilu v porovnání s pozicí 2. Z tohoto důvodu při nitraci 9,10-anthrachinonu vzniká větší množství 2- nitroanthrachinonu. 0,983 e- 0,897 e- 2 H 3 2 +( ) brázek TR.1 itrace 9,10-anthrachinonu áboj na jednotlivých atomech je vypočítán PPP metodou itrace probíhá těžko (přítomnost dvou elektron-akceptorních skupin v molekule), takže vedle obou hlavních produktů vznikají i dinitroderiváty. Technologický způsob izolace jednotlivých izomerů není dosud vyřešen a proto tato cesta vedoucí přes redukci k 1- a 2-aminoanthrachinonům byla zastavena. Důležitý polotovar 1-nitro-2-methylanthrachinon se nitruje mnohem snadněji a selektivněji, kde nitrace se provádí v mírně koncentrovaném oleu. itrace 1-hydroxyanthrachinonu do polohy 4 se provádí ve 100% kyselině sírové (nitrační směs) za přídavku kyseliny borité, která s kyselinou sírovou tvoří estery. Úloha H 3 B 3 je popsána v dalším textu (okolo obrázku TR.16). Izolace produktů se provádí zředěním reakčních směsí vodou a následnou filtrací vysrážených produktů.
2 1.2 Sulfonace Sulfonace anthrachinonu je velmi zajímavá v tom, že při použití 20%-tního olea dostáváme pouze 2-sulfoanthrachinon. ikdo doposud neví, proč neprobíhá sulfonace do polohy 1 (nepomůže ani změna reakčních podmínek). Sulfonace se provádí nastavením výchozích podmínek tak, aby došlo k sulfonaci pouze poloviny anthrachinonu. Monoderivát se oddělí od vedlejších 2,6- a 2,7-disulfokyselin vysolením a a izoluje se jako sodná sůl. Jelikož je ale 1-sulfoanthrachinon polotovarem pro přibližně 70-80% všech anthrachinonových a polycyklických barviv, připravuje se sulfonací za přítomnosti Hg 2+ iontů, kde mechanismus není přesně znám (obrázek TR.2). Katalytická účinnost síranu rtuťnatého se vysvětluje vznikem přechodné sloučeniny rtuti, kde rychlost tvorby 1-sulfokyseliny je přímo úměrná koncentraci HgS 4 (platí pro nízká katalytická množství). 145o, 4 hodiny 20% oleum S 3 H HgS 4 20% oleum 145o, 4 hodiny HgS 3 H S 3 H brázek TR.2 Sulfonace 9,10-anthrachinonu dpadní vody z výroby 1-sulfoanthrachinonu musí být samozřejmě velmi pečlivě čištěny, což je ale ekonomicky nákladný proces. Izolace z reakční směsi obsahující menší množství ještě 1,5- a 1,8-disulfokyseliny se provádí převedením na draselnou sůl. Další následná sulfonace vede k disulfonovým kyselinám anthrachinonu, přičemž nikdy nevstupují dvě sulfoskupiny do stejného jádra (v tomto případě zákony elektrofilní aromatické substituce platí sulfoskupina je silný elektron-akceptor). Technologicky důležitá je také sulfonace pečením, která se provádí obdobně jako v benzenové řadě přímým zahříváním sulfátu aminu nebo v některém neutrálním rozpouštědle. Místo kyseliny sírové lze použít i kyselinu chlorsulfonovou (obrázek TR.3)..HS 3 -H S 3 H brázek TR.3 Sulfonace 1-aminoanthrachinonu pečením
3 Stran vlastností, sulfoskupina v poloze 1 je všeobecně reaktivnější než v poloze 2 a odštěpuje se zahříváním se zředěnými minerálními kyselinami i působením redukovadel. Je-li však v sousedství 2-sulfoskupiny hydroxyl, stává se 2- sulfoskupina reaktivnější než Friedl-raftsovy reakce Tyto reakce se technologicky využívají k přípravě substituovaných anthrachinonů, například pro výrobu 1,4-dichloranthrachinonu (obrázek TR.4), kde první krok syntézy je elektrofilní aromatická substituce (provádí se zahříváním např. v nitrobenzenu, kde se získá derivát kyseliny benzoylbenzoové), následovaná cyklizací, obvykle v kyselině sírové. 1. stupeň + Al 3 H + 2. stupeň Al 3 - -H 2 H brázek TR.4 Syntéza 1,4-dichlor-9,10-anthrachinonu aprosto obdobně se připravují i hydroxyderiváty, například 1,2,3-trihydroxy- 9,10-anthrachinon (obrázek TR.5). + H H H Al 3 H H H brázek TR.5 Syntéza 1,2,3-trihydroxy-9,10-anthrachinonu
4 Do této podkapitoly dále spadá tzv. Schollova reakce, která se například používá při syntéze benzanthronu, významného polotovaru pro syntézu kypových barviv a pigmentů. V této syntéze se vychází z 1-benzoylnaftalenu v přítomnosti Al 3 a stop vody, která usnadňuje protonaci výchozí sloučeniny (obrázek TR.6). Jedná se o kombinaci cyklizace a dehydrogenace. H H H +? - Al3 + H tavení s Al 3 při 150 o brázek TR.6 Schollova syntéza benzanthronu Velmi obdobně se připravuje 7,14-dibenzpyrenchinon (a posléze jeho dibromderivát pod označením.i. Vat range 1), kde jednotlivé reakční kroky jsou cyklizace a oxidace (obrázek TR.7). Al 3 /a 2 brázek TR.7 Schollova syntéza 7,14-dibenzpyrenchinonu Z 1,1 -dinaftyl-8,8 -dikarboxylových kyselin za Friedel-raftsových podmínek (Al 3 nebo H 2 S 4 ) se připravují tzv. antanthrony, ze kterých se pak dihalogenací připravují kypové oranže a červeně (obrázek TR.8).
5 H H brázek TR.8 Příprava antanthronu Antanthron sám je nedůležitý, ale dichlorderivát je Indanthrenová brilantní oranž GK a dibromderivát je Indanthrenová brilantní oranž RK, které mají vysoké stálosti na světle (st. 7-8). Technologicky lze proces výroby vést tak, že cyklizace a bromace se provádí v jednom technologickém stupni působením volného bromu na reakční směs v monohydrátu a oleu za přítomnosti fosforu (reakční teplota je 65 o ). 2 ukleofilní substituce 2.1 ormální nukleofilní aromatická substituce Tato substituce (adičně - eliminační mechanismus) je usnadněna přítomností elektron-akceptorních skupin v molekule zpracovávaného substrátu. Technologicky nejdůležitějším příkladem je výroba 1-aminoanthrachinonu (obrázek TR.9). S 3 H 30% H 4 H 175o brázek TR.9 Příprava 1-aminoanthrachinonu z 1-sulfoanthrachinonu Pracuje se ve vodě pod tlakem v autoklávu. Během reakce vzniká siřičitan (H 4 ) 2 S 3, který se oxiduje na sulfát, aby se zabránilo redukci aminoantrachinonu. xidace se provádí obvykle nitrobenzenem nebo kyselinou nitrobenzensulfonovou. o se týče sulfoskupiny v pozici 2, je také labilní a lze ji relativně snadno substituovat. Takže ze sodné sole 2-sulfoanthrachinonu lze zcela obdobně připravit 2-aminoanthrachinon.
6 Analogicky je možné připravit alkyl i arylaminoanthrachinony (obrázek TR.10). S 3 a H 3 H H 3 -ahs 3 brázek TR.10 Příprava 1-methylaminoanthrachinonu z 1-sulfoanthrachinonu Aminoanthrachinony se připravují také z hydroxyderivátů působením amoniaku za mírného přetlaku. Tímto způsobem se především připravuje 1,4- diaminoanthrachinon z tzv. chinizarinu (obrázek TR.11). H H brázek TR.11 Příprava 1,4-diaminoanthrachinonu
7 2.2 ukleofilní aromatická substituce za přítomnosti oxidačních činidel Používá se především pro výrobu polysubstituovaných derivátů anthrachinonu. Vzhledem k tomu, že se vychází z monosubstituovaného derivátu, je nutné substituovat také jeden vodík, lépe řečeno H -, takže je nutná oxidace. Z hlediska reakčního prostředí, existují dva procesy, alkalické a kyselé. apříklad 1,2-dihydroxyanthrachinon se vyrábí alkalickým tavením, kde existují dva způsoby, které se liší použitím oxidačního činidla (obrázek TR.12). S 3 a tavení ah/k 3 tavení S 3 H KH/2 a a K K 2 2 H H brázek TR.12 Příprava 1,2-dihydroxyanthrachinonu Povšimněme si, že při použití slabší alkálie musíme použít silnější oxidační činidlo. Mechanismus této reakce je nejistý, je například nabízen v literatuře*. Reakce tohoto typu nazýváme jako pseudo-hydridové substituce. * Zollinger H: olor hemistry, Second Edition, VH Weinheim, Podobným způsobem lze vyrábět 1,4-diaminoanthrachinon v autoklávu (obrázek TR.13), kde jako oxidační činidlo se používá burel. S 3 H 30%H 4 H 200o Mn 2 brázek TR.13 Příprava 1,4-diaminoanthrachinonu Za kyselých podmínek probíhá tzv. Bohn-Schmidtova reakce. pět se jedná o pseudo-hydridovou substituci. Tato reakce probíhá pouze na antrachinonech, které mají minimálně jednu H skupinu a to v pozici 1. Příkladem je výroba 1,2,4- trihydroxyanthrachinonu (obrázek TR.14).
8 H H oleum H H Mn 2 H brázek TR.14 Příprava 1,2,4-trihydroxyanthrachinonu Pokud chceme, aby další hydroxylová skupina byla na druhém benzenovém jádře, použijeme kyselinu boritou, která tvoří s kyselinou sírovou směsný anhydrid (obrázek TR.15). H H oleum H H B(S 3 H) 3 28o H brázek TR.15 Příprava 1,2,5-trihydroxyanthrachinonu Mechanismus této reakce je opět diskutován ve výše uvedené knize. Polyhydroxyanthrachinony jsou mořidlová barviva, která např. s Al 3+, Fe 3+, r 3+, atd. tvoří laky na celulosovém vlákně. Kyselina boritá zjevně chrání jádro, na kterém jsou přítomny již H skupiny, před další oxidací. Toho se např. využívá i při nitracích alizarinu (obrázek TR.16). H H H 2 S 4 /H 3 H H H 2 H H H 2 S 4 /H 3 /H 3 B 3 H H brázek TR.16 itrace alizarinu 2 Samozřejmě z hlediska mechanismu patří tato nitrace do kapitoly 1.1. (elektrofilní substituce).
9 2.3 ukleofilní aromatická substituce na leuko formách anthrachinonů ukleofilní aromatické substituce v anthrachinonové řadě se také provádí v jejich redukované (leuko) formě. Jedná se o proces, kde prvním krokem je redukce anthrachinonového derivátu následovaná normální nukleofilní substitucí na aromatickém jádře. Posledním krokem je pak zpětná oxidace na příslušný anthrachinon. Tímto způsobem se například vyrábí alkyl a aryl deriváty 1,4- diaminoanthrachinonu (obrázek TR.17). H H red. ox. H H H H R 1 -H 2 H H HR 1 H HR 1 R 2 H HR 1 ox. HR 1 H -H 2 H HR 2 HR 2 brázek TR.17 Příprava 1,4-dialkylaminoanthrachinonu (resp. 1,4-diarylaminoanthrachinonu) Reakce probíhá ve dvou stupních, takže lze připravit deriváty různě alkylované (arylované). Je velmi zajímavé, že pro aromatické aminy (chceme připravit arylované aminoanthrachinony) Ar probíhá reakce pouze v přítomnosti kyseliny borité! Výše uvedené sloučeniny se používají jako velmi stabilní disperzní barviva (modře a zeleně). Pokud budeme opačně provádět výměnu aminoskupiny za hydroxylovou skupinu, potom v kyselém prostředí se pracuje také přes leuko formy. aopak v alkalickém prostředí nastává hladké odštěpování aminoskupiny a její nahrazování hydroxylem přímo u příslušného aminoanthrachinonu (tato reakce ovšem z hlediska mechanismu patří do kapitoly 2.1.). 2.4 ukleofilní aromatická substituce za přítomnosti katalyzátoru Do této podkapitoly patří tzv. Ullmannovy reakce. Jedná se o nukleofilní substituce halogenů, které jsou katalyzovány mědí. Reaktivita halogenů stoupá v pořadí Ar < ArBr < ArJ. ejdůležitějším příkladem je výroba kyselých modří (případně reaktivních barviv) z tzv. kyseliny bromaminové (obrázek TR.18).
10 Br S 3 H X ph=8 + H 2 u + /u 2+ X=H 3,H 3,S 3 H,etc. modř H S 3 H X brázek TR.18 Příprava vodorozpustných anthrachinonových modří Mědí nebo měďnatými solemi se také katalyzuje příprava 2- aminoanthrachinonu z 2-chlor derivátu (obrázek TR.19). Je zajímavé, že tato reakce probíhá za přítomnosti oxidačních činidel, kde jeho role není úplně zřejmá. H 3 -H brázek TR.19 Příprava 2-aminoanthrachinonu Výměna halogenu za hydroxylovou skupinu v anthrachinonové řadě probíhá jak kysele, tak i alkalicky. Alkalický způsob je použitelý pro 1 i 2 halogenderiváty. ěkdy se přidává měď jako katalyzátor. Výměna však není obvykle korektní, dochází k záměně substituentů nebo současně probíhá i oxidace (obrázek TR.20). H H brázek TR.20 Vznik alizarinu z chlorderivátů aproti tomu práce v kyselém prostředí je specifická pro výměnu pouze v poloze 1 (obrázek TR.21). 1-hlorderivát se zahřívá s kyselinou sírovou a boritou. Zde se žádný katalyzátor nepřidává, takže tato reakce by spíše patřila do kapitoly 2.1. H H H brázek TR.21 Vznik 2-chlorchinizarinu
11 3 yklizační reakce Výše anelovaná kypová barviva (minimálně 4 kondenzovaná aromatická, nebo heterocyklická jádra) se připravují cyklizačními reakcemi. Prakticky všechny cyklizační reakce jsou charakterizovány tvorbou vazby mezi dvěma methinovými skupinami (-H=) dvou sousedících aromatických kruhů, nebo se jedná o reakci mezi methinovou skupinou a primární aminoskupinou. Formálně se jedná o eliminaci dvou H atomů (deprotonace a přesun hydridu). xidačním činidlem je v mnoha případech výchozí anthrachinonová sloučenina nebo vznikající produkt. Platí ovšem, že vznikající hydrochinon (leuko forma) je pak zpětně oxidována vzduchem, nebo nějakým oxidačním činidlem. Z hlediska reakčního prostředí a způsobu provedení lze cyklizace provádět v tavenině, nebo organickém rozpouštědle, často také v kyselině sírové. Jisté typy cyklizací lze provádět i ve vodném prostředí. Tavení za přítomnosti oxidačního činidla je asi o nejdůležitější proces v této kapitole. apříklad indanthron (.I. Vat Blue 4) se vyrábí z 2-aminoanthrachinonu (obrázek TR.22). H 2 KH/K 3 H 3 a 200o H H brázek TR.22 Výroba indanthronu Přímá chlorace chlorem v kyselině sírové pak vede ke vzniku 3,3 dichlorindanthronu, což je velmi stálá kypová modř. Provedeme-li tavení za vyšší teploty, získáme flavanthron (.I. Vat Yellow 1) (obrázek TR.23). H 2 KH/K 3 270o brázek TR.23 Výroba flavanthronu
12 Velmi podobně se z benzanthronu vyrábí violanthron (.I. Vat Blue 20) (obrázek TR.24), pouze oxidačním činidlem je zde vzdušný kyslík. KH/KAc + 240o brázek TR.24 Výroba violanthronu yklizace v organických rozpouštědlech je další možností. Používají se vysokovroucí rozpouštědla, například dichlor a trichlorbenzen, butanoly a podobně. apříklad pyranthron (.I. Vat range 9) se vyrábí z 1-chloro-2- methylanthrachinonu (obrázek TR.25) vařením nejprve v o-dichlorbenzenu za přítomnosti pyridinu a katalýzy u. Vzniklý intermediát se pak cyklizuje v 2-butanolu odštěpením vody. dštěpení vody lze provést i jinými činidly, např. octanem sodným (v tavenině) při 240 o. H 3 H 3 u prášek H 3 H 3 KH isobutanol brázek TR.25 Výroba pyranthronu Použití butanolů pro reakce, kde odpadá voda je výhodné v tom smyslu, že butanol vytváří s vodou azeotrop, takže v průběhu reakce můžeme odvádět destilací reakční vodu. yklizaci jako Fridel-raftsovu reakci můžeme ukázati na příkladu výroby pyranthronu přímo z pyrenu (obrázek TR.26).
13 + 2 Al 3-2H Al 3-2H 2 pyranthron brázek TR.26 Výroba pyranthronu z pyrenu Z hlediska vlastního mechanismu patří tato syntéza také do kapitoly 1.3 (elektrofilní aromatické subsituce). Velmi důležité jsou výroby karbazolových barviv, kde cyklizační reakce se také provádí v organických rozpouštědlech. ejvýznačnějším barvivem této skupiny je stanthrenová hněď BR, která vzniká kondenzací 1,4-diaminoanthrachinonu s 1- chloranthrachinonem v nitrobenzenu za přítomnosti mědi (katalyzátor) a octanu sodného (neutralizuje vzniklý H, poznámka: pokud bychom neprovedli neutralizaci, reakce by se zastavila v důsledku vzniku nereaktivní amoniové sloučeniny reakcí Ar- + H = ArH ). Z hlediska mechanismu se jedná o Ullmannovu reakci. Vzniklý trianthrachinondiimid ce cyklizuje např. chloridem titaničitým v o- dichlorbenzenu nebo v sulfolanu (cyklopentanmethylensulfon - výborné rozpouštědlo). Surové barvivo se čistí oxidací chlornanem sodným (obrázek TR.27). H H + 2 H H brázek TR.27 Výroba stanthrenové hnědi BR Řada cyklizačních reakcí se provádí v kyselině sírové, která má vynikající dehydratační vlastnosti (je samozřejmě také zdrojem protonů). Pěkným příkladem použití kyseliny sírové při cyklizační reakci je výroba antathronu (obrázek TR.8).
14 Paralelní reakcí k cyklizaci může být také desulfonace. Takto vznikají například anthrachinonakridony a to z 1-arylaminoanthrachinonů za kyselých podmínek (Al 3 nebo H 2 S 4 ), kupříkladu Vat Blue 21 (obrázek TR.28), kde se vychází z bromaminové kyseliny. Vlastní cyklizace a desulfonace se provádí ve 100%-tní kyselině sírové. Br S 3 H + F 3 H voda u + /u 2+ ph=8 H S 3 H H S 3 H 100% H 2 S 4 F 3 H H H F 3 F 3 6 H 5 H H -H H F 3 F 3 brázek TR.28 Výroba Vat Blue 21 Jako cyklizační reakce můžou sloužit také kondenzace mezi aminy a karboxylovými skupinami, které lze provádět ve vodě. apříklad imidy peri,peri tetracarboxylových kyselin se připravují kondenzací (.I. Vat Red 23) (obrázek TR.29).
15 H H H 3 2H 3-2H 2 H H H 3 brázek TR.28 Výroba Vat Red 23 Methylamin se do reakce nasazuje jako vodný roztok a vodu použít jako reakční prostředí. Zahřívá se pod zpětným chladičem, protože H 3 těká s vodní parou. V laboratoři, nebo v provozech vybavených rozpouštědlovým hospodářstvím je ale lepší provádět reakci např. v butanolu, který jak už bylo řečeno, azeotropickou destilací odvede z reakční směsi jak vodu pocházející z roztoku methylaminu, tak i reakční vodu. Zamezí se tím vzniku vedlejších produktů pocházejících například z hydrolýzy imidu. Kondenzací o-fenylendiaminu s anhydridem naftalentetrakarboxylové kyseliny vznikají aroylenbenzimidazoly. Vznikají dva izomery (trans a cis), které je možné rozdělit (obrázek TR.29). stanthrenové bordó RR 2 + H H H H + stanthrenová oranž GR brázek TR.29 Výroba kypového šarlatu dohronady stanthrenový šarlat R Dalším příkladem kondenzace je příprava 4- a 5-aminoanhrapyrimidinů, které jsou polotovary pro výrobu kypových žlutí. apříklad 1,4-diaminoanthrachinon se kondenzuje ve vodě s formaldehydem a amoniakem při 90 o (obrázek TR.30). áslednou benzoylací 4-chlorbenzoylchloridem vzniká kypová žluť Indanthren Gelb 7GK.
16 H 2 H/H 3 -H H brázek TR.30 Výroba Indanthren Gelb 7GK
Výroby založené na nukleofilní substituci. Nu: + R-LG R-Nu + LG: R X + Nu - R Nu + X - Nukleofil Nu Produkt R Nu Název reakce
 Výroby založené na nukleofilní substituci V organické i anorganické chemii je nukleofilní substituce jedna ze základních tříd chemických reakcí, kde elektron nějakého nukleofilu Nu: napadá kladně, či částečně
Výroby založené na nukleofilní substituci V organické i anorganické chemii je nukleofilní substituce jedna ze základních tříd chemických reakcí, kde elektron nějakého nukleofilu Nu: napadá kladně, či částečně
Organická chemie (KATA) rychlý souhrn a opakování
 Organická chemie (KATA) rychlý souhrn a opakování Molekulové orbitaly hybridizace N a O Polarita vazby, induktivní efekt U kovalentní vazby mezi rozdílnými atomy, nebude elektronový pár oběma atomy sdílen
Organická chemie (KATA) rychlý souhrn a opakování Molekulové orbitaly hybridizace N a O Polarita vazby, induktivní efekt U kovalentní vazby mezi rozdílnými atomy, nebude elektronový pár oběma atomy sdílen
Karboxylové kyseliny
 Karboxylové kyseliny Názvosloví pokud je karboxylováskupina součástířetězce, sloučenina mákoncovku -ovákyselina. Pokud je mimo řetězec má sloučenina koncovku karboxylová kyselina. butanová kyselina cyklohexankarboxylová
Karboxylové kyseliny Názvosloví pokud je karboxylováskupina součástířetězce, sloučenina mákoncovku -ovákyselina. Pokud je mimo řetězec má sloučenina koncovku karboxylová kyselina. butanová kyselina cyklohexankarboxylová
Karboxylové kyseliny a jejich funkční deriváty
 Karboxylové kyseliny a jejich funkční deriváty Úvod Karboxylové kyseliny jsou nejdůležitější organické kyseliny. Jejich funkční skupina je karboxylová skupina a tento název je složen ze slov karbonyl a
Karboxylové kyseliny a jejich funkční deriváty Úvod Karboxylové kyseliny jsou nejdůležitější organické kyseliny. Jejich funkční skupina je karboxylová skupina a tento název je složen ze slov karbonyl a
H H C C C C C C H CH 3 H C C H H H H H H
 Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
OCH/OC2. Heterocyklické sloučeniny
 CH/C2 Heterocyklické sloučeniny 1 ázvosloví 5-ti členné heterocykly 6-ti členné heterocykly 2 ázvosloví earomatické (nasycené) heterocykly. 3 Aromaticita heterocyklů 4 Aromaticita heterocyklů 5 Rezonanční
CH/C2 Heterocyklické sloučeniny 1 ázvosloví 5-ti členné heterocykly 6-ti členné heterocykly 2 ázvosloví earomatické (nasycené) heterocykly. 3 Aromaticita heterocyklů 4 Aromaticita heterocyklů 5 Rezonanční
AROMATICKÉ SLOUČENINY - REAKTIVITA TYPICKÉ REAKCE AROMATICKÝCH SLOUČENIN - SUBSTITUCE ELEKTROFILNÍ AROMATICKÁ
 TYPICKÉ EAKCE AMATICKÝC SLUČENIN - SUBSTITUCE ELEKTFILNÍ AMATICKÁ + E E E - E mechanismus substituce elekrofilní aromatické komplex komplex produkt SE Ar E reakční koordináta C 3 + BF 4 3 C C 3 3 C aromatické
TYPICKÉ EAKCE AMATICKÝC SLUČENIN - SUBSTITUCE ELEKTFILNÍ AMATICKÁ + E E E - E mechanismus substituce elekrofilní aromatické komplex komplex produkt SE Ar E reakční koordináta C 3 + BF 4 3 C C 3 3 C aromatické
Charakteristika Teorie kyselin a zásad. Příprava kyselin Vlastnosti + typické reakce. Významné kyseliny. Arrheniova teorie Teorie Brönsted-Lowryho
 Petra Ustohalová 1 harakteristika Teorie kyselin a zásad Arrheniova teorie Teorie Brönsted-Lowryho Příprava kyselin Vlastnosti + typické reakce Fyzikální a chemické Významné kyseliny 2 Látky, které ve
Petra Ustohalová 1 harakteristika Teorie kyselin a zásad Arrheniova teorie Teorie Brönsted-Lowryho Příprava kyselin Vlastnosti + typické reakce Fyzikální a chemické Významné kyseliny 2 Látky, které ve
Substituce na aromatickém jádře S E Ar, S N Ar. Elektrofilní aromatická substituce S E Ar
 Substituce na aromatickém jádře S E Ar, S N Ar Už jsme viděli příklady benzenových jader, které jsou substituované ruznými skupinami, např. halogeny, hydroxy skupinou apod. Ukážeme si tedy, jak se tyto
Substituce na aromatickém jádře S E Ar, S N Ar Už jsme viděli příklady benzenových jader, které jsou substituované ruznými skupinami, např. halogeny, hydroxy skupinou apod. Ukážeme si tedy, jak se tyto
1. ročník Počet hodin
 SOUSTAVY LÁTEK A JEJICH SLOŽENÍ rozdělení přírodních látek a vlastnosti chemických látek soustavy látek a jejich složení STAVBA ATOMU historie pohledu na atom složení a struktura atomu stavba atomu VELIČINY
SOUSTAVY LÁTEK A JEJICH SLOŽENÍ rozdělení přírodních látek a vlastnosti chemických látek soustavy látek a jejich složení STAVBA ATOMU historie pohledu na atom složení a struktura atomu stavba atomu VELIČINY
Vlastnosti. Pozor! H 3 C CH 3 H CH 3
 Alkeny Vlastnosti C n 2n obsahují dvojné vazby uhlíky v sp 2 hybridizaci násobná vazba vzniká překryvem 2p orbitalů obou atomů uhlíku nad a pod prostorem obsazeným vazbou aby k překryvu mohlo dojít, musí
Alkeny Vlastnosti C n 2n obsahují dvojné vazby uhlíky v sp 2 hybridizaci násobná vazba vzniká překryvem 2p orbitalů obou atomů uhlíku nad a pod prostorem obsazeným vazbou aby k překryvu mohlo dojít, musí
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto FUNKČNÍ DEIVÁTY KABXYLVÝH KYSELIN X KABXYLVÉ KYSELINY funkční deriváty + H reakce na vazbě vodík kyslík hydroxylové skupiny reakce probíhající
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto FUNKČNÍ DEIVÁTY KABXYLVÝH KYSELIN X KABXYLVÉ KYSELINY funkční deriváty + H reakce na vazbě vodík kyslík hydroxylové skupiny reakce probíhající
Příklady k semináři z organické chemie OCH/SOCHA. Doc. RNDr. Jakub Stýskala, Ph.D.
 Příklady k semináři z organické chemie /SA Doc. RNDr. Jakub Stýskala, Ph.D. Příklady k procvičení 1. Které monochlorované deriváty vzniknou při radikálové chloraci následující sloučeniny. Který z nich
Příklady k semináři z organické chemie /SA Doc. RNDr. Jakub Stýskala, Ph.D. Příklady k procvičení 1. Které monochlorované deriváty vzniknou při radikálové chloraci následující sloučeniny. Který z nich
SEMINÁRNÍ PRÁCE. Jméno: Obor: 1. Pojmenujte následující sloučeniny:
 SEMIÁRÍ PRÁE Jméno: bor: 1. Pojmenujte následující sloučeniny: 1 3 4 5 6 S 3 7 8 9 S 3 10 11. akreslete strukturním vzorcem následující sloučeniny: a pentannitril b propyl-4-oxocyklohexankarboxylát c 5-amino-1,7-dimethylbicyklo[..1]hept--en-7-karbonitril
SEMIÁRÍ PRÁE Jméno: bor: 1. Pojmenujte následující sloučeniny: 1 3 4 5 6 S 3 7 8 9 S 3 10 11. akreslete strukturním vzorcem následující sloučeniny: a pentannitril b propyl-4-oxocyklohexankarboxylát c 5-amino-1,7-dimethylbicyklo[..1]hept--en-7-karbonitril
Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np:
 PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
ALKOHOLY, FENOLY A ETHERY. b. Jaké zdroje cukru znáte a jak se nazývají produkty jejich kvašení?
 ALKOLY, FENOLY A ETHERY Kvašení 1. S použitím literatury nebo internetu odpovězte na následující otázky: a. Jakým způsobem v přírodě vzniká etanol? Napište rovnici. b. Jaké zdroje cukru znáte a jak se
ALKOLY, FENOLY A ETHERY Kvašení 1. S použitím literatury nebo internetu odpovězte na následující otázky: a. Jakým způsobem v přírodě vzniká etanol? Napište rovnici. b. Jaké zdroje cukru znáte a jak se
Aminy a další dusíkaté deriváty
 Aminy a další dusíkaté deriváty Aminy jsou sloučeniny příbuzné amoniaku, u kterých jsou nahrazeny jeden, dva nebo všechny tři atomy vodíku alkylovými nebo arylovými skupinami. Aminy mají stejně jako amoniak,
Aminy a další dusíkaté deriváty Aminy jsou sloučeniny příbuzné amoniaku, u kterých jsou nahrazeny jeden, dva nebo všechny tři atomy vodíku alkylovými nebo arylovými skupinami. Aminy mají stejně jako amoniak,
HYDROXYDERIVÁTY. Alkoholy Fenoly Bc. Miroslava Wilczková
 HYDROXYDERIVÁTY Alkoholy Fenoly Bc. Miroslava Wilczková HYDROXYDERIVÁTY Alkoholy -OH skupina vázána na uhlíkový atom alifatického řetězce Fenoly -OH skupina vázána na uhlíku, který je součástí aromatického
HYDROXYDERIVÁTY Alkoholy Fenoly Bc. Miroslava Wilczková HYDROXYDERIVÁTY Alkoholy -OH skupina vázána na uhlíkový atom alifatického řetězce Fenoly -OH skupina vázána na uhlíku, který je součástí aromatického
17. DUSÍKATÉ DERIVÁTY, EL. POSUNY
 17. DUSÍKATÉ DERIVÁTY, EL. POSUNY Jaký typ chemické vazby obsahují všechny dusíkaté deriváty? Do kterých skupin dělíme dusíkaté deriváty? Nitrosloučeniny 1) Charakterizuj nitrosloučeniny z hlediska přítomnosti
17. DUSÍKATÉ DERIVÁTY, EL. POSUNY Jaký typ chemické vazby obsahují všechny dusíkaté deriváty? Do kterých skupin dělíme dusíkaté deriváty? Nitrosloučeniny 1) Charakterizuj nitrosloučeniny z hlediska přítomnosti
Experimentální biologie Bc. chemie
 Experimentální biologie Bc. chemie 1. značte prvek s největší elektronegativitou: a) draslík b) chlor c) uhlík d) vápník e) fluor 3. Mezi p prvky nepatří: a) P b) As c) Fe d) B e) Si 4. Radioaktivní záření
Experimentální biologie Bc. chemie 1. značte prvek s největší elektronegativitou: a) draslík b) chlor c) uhlík d) vápník e) fluor 3. Mezi p prvky nepatří: a) P b) As c) Fe d) B e) Si 4. Radioaktivní záření
Karbonylové sloučeniny
 Karbonylové sloučeniny více než 120 o 120 o C O C C d + d - C O C sp 2 C sp 2 R C O H R 1 C O R 2 1.aldehydy, ketony Nu E R C O R C O 2. karboxylové kyseliny a funkční deriváty O H 3. deriváty kys. uhličité
Karbonylové sloučeniny více než 120 o 120 o C O C C d + d - C O C sp 2 C sp 2 R C O H R 1 C O R 2 1.aldehydy, ketony Nu E R C O R C O 2. karboxylové kyseliny a funkční deriváty O H 3. deriváty kys. uhličité
TEST + ŘEŠENÍ. PÍSEMNÁ ČÁST PŘIJÍMACÍ ZKOUŠKY Z CHEMIE bakalářský studijní obor Bioorganická chemie 2010
 30 otázek maximum: 60 bodů TEST + ŘEŠEÍ PÍSEMÁ ČÁST PŘIJÍMACÍ ZKUŠKY Z CEMIE bakalářský studijní obor Bioorganická chemie 2010 1. apište názvy anorganických sloučenin: (4 body) 4 BaCr 4 kyselina peroxodusičná
30 otázek maximum: 60 bodů TEST + ŘEŠEÍ PÍSEMÁ ČÁST PŘIJÍMACÍ ZKUŠKY Z CEMIE bakalářský studijní obor Bioorganická chemie 2010 1. apište názvy anorganických sloučenin: (4 body) 4 BaCr 4 kyselina peroxodusičná
Organická chemie pro biochemiky II část 14 14-1
 rganická chemie pro biochemiky II část 14 14-1 oxidace a redukce mají v organické chemii trochu jiný charakter než v chemii anorganické obvykle u jde o adici na systém s dvojnou vazbou či štěpení vazby
rganická chemie pro biochemiky II část 14 14-1 oxidace a redukce mají v organické chemii trochu jiný charakter než v chemii anorganické obvykle u jde o adici na systém s dvojnou vazbou či štěpení vazby
Úvod Obecný vzorec alkoholů je R-OH.
 Alkoholy a fenoly Úvod becný vzorec alkoholů je R-. Názvosloví alkoholů a fenolů Běžná jména alkoholů se odvozují od alifatického zbytku připojeného k hydroxylové skupině, ke kterému se přidá slovo alkohol.
Alkoholy a fenoly Úvod becný vzorec alkoholů je R-. Názvosloví alkoholů a fenolů Běžná jména alkoholů se odvozují od alifatického zbytku připojeného k hydroxylové skupině, ke kterému se přidá slovo alkohol.
Aromacké uhlovodíky reakce
 Aromacké uhlovodíky reakce Temacká oblast : Chemie organická chemie Datum vytvoření: 20. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Reakce výroby nesubstuovaných
Aromacké uhlovodíky reakce Temacká oblast : Chemie organická chemie Datum vytvoření: 20. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Reakce výroby nesubstuovaných
Škola: Gymnázium, Brno, Slovanské náměstí 7 III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Reakce v organické chemii
 Reakce v organické chemii Temacká oblast : Chemie organická chemie Datum vytvoření: 25. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Základní typy reakcí organických
Reakce v organické chemii Temacká oblast : Chemie organická chemie Datum vytvoření: 25. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Základní typy reakcí organických
OCH/OC2. Karbonylové sloučeniny 2
 OCH/OC2 Karbonylové sloučeniny 2 1 Reaktivita karbonylových sloučenin Nukleofilní adice na karbonylovou skupinu A N vody vznik hydrátů A N alkoholů tvorba acetalů a ketalů A N HCN vznik kyanhydrinů A N
OCH/OC2 Karbonylové sloučeniny 2 1 Reaktivita karbonylových sloučenin Nukleofilní adice na karbonylovou skupinu A N vody vznik hydrátů A N alkoholů tvorba acetalů a ketalů A N HCN vznik kyanhydrinů A N
Reakce aldehydů a ketonů s N-nukleofily
 Reakce aldehydů a ketonů s N-nukleofily bdobně jako aminy se adují na karbonyl i jiné dusíkaté nukleofily: 2,4-dinitrofenylhydrazin aceton 2,4dinitrofenylhydrazon 2,4-dinitrofenylhydrazon acetaldehydu
Reakce aldehydů a ketonů s N-nukleofily bdobně jako aminy se adují na karbonyl i jiné dusíkaté nukleofily: 2,4-dinitrofenylhydrazin aceton 2,4dinitrofenylhydrazon 2,4-dinitrofenylhydrazon acetaldehydu
Obsah. 2. Mechanismus a syntetické využití nejdůležitějších organických reakcí 31 2.1. Adiční reakce 31 2.1.1. Elektrofilní adice (A E
 Obsah 1. Typy reakcí, reakčních komponent a jejich roztřídění 6 1.1. Formální kritérium pro klasifikaci reakcí 6 1.2. Typy reakčních komponent a způsob jejich vzniku jako další kriterium pro klasifikaci
Obsah 1. Typy reakcí, reakčních komponent a jejich roztřídění 6 1.1. Formální kritérium pro klasifikaci reakcí 6 1.2. Typy reakčních komponent a způsob jejich vzniku jako další kriterium pro klasifikaci
6. Vyberte látku, která má nepolární charakter: 1b. a) voda b) diethylether c) kyselina bromovodíková d) ethanol e) sulfan
 1. Ionizace je: 1b. a) vysrážení iontů z roztoku b) vznik iontových vazeb c) solvatace iontů d) vznik iontů z elektroneutrálních sloučenin e) elektrolýza sloučenin 2. Počet elektronů v orbitalech s,p,d,f
1. Ionizace je: 1b. a) vysrážení iontů z roztoku b) vznik iontových vazeb c) solvatace iontů d) vznik iontů z elektroneutrálních sloučenin e) elektrolýza sloučenin 2. Počet elektronů v orbitalech s,p,d,f
Organická chemie 2 Anotace Cíle Osnova předmětu
 Organická chemie 2 Anotace Organická chemie je zaměřena na sloučeniny uhlíku, jejich klasifikaci, názvosloví, strukturu a vlastnosti, jejich použití v praxi. Obsahem druhé části je chemie kyslíkatých derivátů
Organická chemie 2 Anotace Organická chemie je zaměřena na sloučeniny uhlíku, jejich klasifikaci, názvosloví, strukturu a vlastnosti, jejich použití v praxi. Obsahem druhé části je chemie kyslíkatých derivátů
nano.tul.cz Inovace a rozvoj studia nanomateriálů na TUL
 Inovace a rozvoj studia nanomateriálů na TUL nano.tul.cz Tyto materiály byly vytvořeny v rámci projektu ESF OP VK: Inovace a rozvoj studia nanomateriálů natechnické univerzitě vliberci Kde jsme aminy již
Inovace a rozvoj studia nanomateriálů na TUL nano.tul.cz Tyto materiály byly vytvořeny v rámci projektu ESF OP VK: Inovace a rozvoj studia nanomateriálů natechnické univerzitě vliberci Kde jsme aminy již
1. nitrosloučeniny R-NO 2 CH 3 -NO aminosloučeniny R-NH 2 CH 3 -NH 2
 DUSÍKATÉ DERIVÁTY UHLOVODÍKŮ Dusíkaté deriváty uhlovodíků obsahují ve svých molekulách atom dusíku vázaný přímo na atom uhlíku. Atom dusíku přitom bývá součástí funkční skupiny, podle níž dusíkaté deriváty
DUSÍKATÉ DERIVÁTY UHLOVODÍKŮ Dusíkaté deriváty uhlovodíků obsahují ve svých molekulách atom dusíku vázaný přímo na atom uhlíku. Atom dusíku přitom bývá součástí funkční skupiny, podle níž dusíkaté deriváty
Kyslíkaté deriváty. 1) Hydroxyderiváty: a) Alkoholy b) Fenoly. řešení. Dle OH = hydroxylová skupina
 Kyslíkaté deriváty řešení 1) Hydroxyderiváty: a) Alkoholy b) Fenoly Dle = hydroxylová skupina 1 Hydroxyderiváty Alifatické alkoholy: náhrada 1 nebo více atomů H. hydroxylovou skupinou (na 1 atom C vázaná
Kyslíkaté deriváty řešení 1) Hydroxyderiváty: a) Alkoholy b) Fenoly Dle = hydroxylová skupina 1 Hydroxyderiváty Alifatické alkoholy: náhrada 1 nebo více atomů H. hydroxylovou skupinou (na 1 atom C vázaná
OCH/OC2. Karbonylové sloučeniny 1
 OCH/OC2 Karbonylové sloučeniny 1 1 Rozdělení Aldehyd Keton Karboxylová kyselina Acylhalogenid Ester Anhydrid Amid Azid Hydrazid Hydroxamová kyselina Lakton Laktam 2 Rozdělení Deriváty kyseliny uhličité
OCH/OC2 Karbonylové sloučeniny 1 1 Rozdělení Aldehyd Keton Karboxylová kyselina Acylhalogenid Ester Anhydrid Amid Azid Hydrazid Hydroxamová kyselina Lakton Laktam 2 Rozdělení Deriváty kyseliny uhličité
Organická chemie 1 - sylabus
 Organická chemie 1 - sylabus Anotace Organická chemie je zaměřena na sloučeniny uhlíku, jejich klasifikaci, názvosloví, strukturu a vlastnosti, jejich použití v praxi. Obsahem první části jsou obecné principy
Organická chemie 1 - sylabus Anotace Organická chemie je zaměřena na sloučeniny uhlíku, jejich klasifikaci, názvosloví, strukturu a vlastnosti, jejich použití v praxi. Obsahem první části jsou obecné principy
Hydroxysloučeniny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Únor
 Hydroxysloučeniny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Únor 2011 Mgr. Alena Jirčáková Hydroxysloučeniny Dělení hydroxysloučenin: Deriváty
Hydroxysloučeniny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Únor 2011 Mgr. Alena Jirčáková Hydroxysloučeniny Dělení hydroxysloučenin: Deriváty
PÍSEMNÁ ČÁST PŘIJÍMACÍ ZKOUŠKY Z CHEMIE bakalářský studijní obor Bioorganická chemie 2011
 Kód uchazeče:... Datum:... PÍSEMNÁ ČÁST PŘIJÍMACÍ ZKUŠKY Z CHEMIE bakalářský studijní obor Bioorganická chemie 2011 30 otázek maximum: 60 bodů čas: 60 minut 1. Napište názvy anorganických sloučenin: (4
Kód uchazeče:... Datum:... PÍSEMNÁ ČÁST PŘIJÍMACÍ ZKUŠKY Z CHEMIE bakalářský studijní obor Bioorganická chemie 2011 30 otázek maximum: 60 bodů čas: 60 minut 1. Napište názvy anorganických sloučenin: (4
ZŠ ÚnO, Bratří Čapků 1332
 Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Základní chemické pojmy
 MZ CHEMIE 2015 MO 1 Základní chemické pojmy Atom, molekula, prvek, protonové číslo. Sloučenina, chemicky čistá látka, směs, dělení směsí. Relativní atomová hmotnost, molekulová hmotnost, atomová hmotnostní
MZ CHEMIE 2015 MO 1 Základní chemické pojmy Atom, molekula, prvek, protonové číslo. Sloučenina, chemicky čistá látka, směs, dělení směsí. Relativní atomová hmotnost, molekulová hmotnost, atomová hmotnostní
POROVNÁNÍ ÚČINNOSTI SRÁŽENÍ REAKTIVNÍCH AZOBARVIV POUŽITÍM IONTOVÉ KAPALINY A NÁSLEDNÁ FLOKULACE AZOBARVIV S Al 2 (SO 4 ) 3.18H 2 O S ÚPRAVOU ph
 POROVNÁNÍ ÚČINNOSTI SRÁŽENÍ REAKTIVNÍCH AZOBARVIV POUŽITÍM IONTOVÉ KAPALINY A NÁSLEDNÁ FLOKULACE AZOBARVIV S Al 2 (SO 4 ) 3.18H 2 O S ÚPRAVOU ph Ing. Jana Martinková Ing. Tomáš Weidlich, Ph.D. prof. Ing.
POROVNÁNÍ ÚČINNOSTI SRÁŽENÍ REAKTIVNÍCH AZOBARVIV POUŽITÍM IONTOVÉ KAPALINY A NÁSLEDNÁ FLOKULACE AZOBARVIV S Al 2 (SO 4 ) 3.18H 2 O S ÚPRAVOU ph Ing. Jana Martinková Ing. Tomáš Weidlich, Ph.D. prof. Ing.
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace
 Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Chemické rovnice. Úprava koeficientů oxidoredukčních rovnic
 Úprava koeficientů oxidoredukčních rovnic Má-li být zápis chemické rovnice úplný (a použitelný například pro výpočty), musejí být počty molekul látek v chemické rovnici vyjádřeny takovými stechiometrickými
Úprava koeficientů oxidoredukčních rovnic Má-li být zápis chemické rovnice úplný (a použitelný například pro výpočty), musejí být počty molekul látek v chemické rovnici vyjádřeny takovými stechiometrickými
Reakce alkanů 75. mechanismem), iniciované světlem nebo radikálovými iniciátory: Oxidace kyslíkem, hoření, tvorba hydroperoxidů.
 eakce alkanů 75 5. eakce alkanů Alkany poskytují především radikálové reakce (často probíhající řetězovým mechanismem), iniciované světlem nebo radikálovými iniciátory: alogenace pomocí X 2 ; bromaci lze
eakce alkanů 75 5. eakce alkanů Alkany poskytují především radikálové reakce (často probíhající řetězovým mechanismem), iniciované světlem nebo radikálovými iniciátory: alogenace pomocí X 2 ; bromaci lze
ORGANICKÁ CHEMIE I pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Vyučující na semináři...
 ORGANICKÁ CEMIE I pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Vyučující na semináři... Počet bodů v části A:... Počet bodů v části B:... Počet bodů celkem:...
ORGANICKÁ CEMIE I pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Vyučující na semináři... Počet bodů v části A:... Počet bodů v části B:... Počet bodů celkem:...
4. ročník - seminář Vzdělávací obor - Člověk a příroda
 Gymnázium, Milevsko, Masarykova 183 Školní vzdělávací program (ŠVP) pro vyšší stupeň osmiletého studia a čtyřleté studium Vyučovací předmět - Chemie 4. ročník - seminář Vzdělávací obor - Člověk a příroda
Gymnázium, Milevsko, Masarykova 183 Školní vzdělávací program (ŠVP) pro vyšší stupeň osmiletého studia a čtyřleté studium Vyučovací předmět - Chemie 4. ročník - seminář Vzdělávací obor - Člověk a příroda
1)uhlovodík musí být cyklický, všechny atomy musí být v jedné rovině
 Otázka: Areny Předmět: Chemie Přidal(a): I. Prokopová 3 podmínky: 1)uhlovodík musí být cyklický, všechny atomy musí být v jedné rovině 2) musí existovat minimálně dvě možnosti uspořádání π elektronů 3)
Otázka: Areny Předmět: Chemie Přidal(a): I. Prokopová 3 podmínky: 1)uhlovodík musí být cyklický, všechny atomy musí být v jedné rovině 2) musí existovat minimálně dvě možnosti uspořádání π elektronů 3)
5. CHEMICKÉ REAKCE. KLASIFIKACE CHEMICKÝCH REAKCÍ a) Podle vnějších změn Reakce skládání = SYNTÉZY z jednodušších -> složitější 2H 2 + O 2 -> 2H 2 O
 Na www.studijni-svet.cz zaslal(a): Kikusska94 5. CHEMICKÉ REAKCE Je děj při kterém v molekulách reagujících látek dochází k zániku některých vazeb a ke vzniku vazeb nových. Produkty rekce mají jiné chemické
Na www.studijni-svet.cz zaslal(a): Kikusska94 5. CHEMICKÉ REAKCE Je děj při kterém v molekulách reagujících látek dochází k zániku některých vazeb a ke vzniku vazeb nových. Produkty rekce mají jiné chemické
Inovace bakalářského studijního oboru Aplikovaná chemie
 Inovace bakalářského studijního oboru Aplikovaná chemie http://aplchem.upol.cz Z.1.07/2.2.00/15.0247 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. ALKYNY
Inovace bakalářského studijního oboru Aplikovaná chemie http://aplchem.upol.cz Z.1.07/2.2.00/15.0247 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. ALKYNY
2.4 AROMATICKÉ UHLOVODÍKY
 2.4 AROMATICKÉ UHLOVODÍKY Označení aromatické uhlovodíky sice historicky souvisí s charakteristickým zápachem mnohých z nich (např. benzen páchne po dehtu, toluen zapáchá jako toluánský balzám či benzaldehyd
2.4 AROMATICKÉ UHLOVODÍKY Označení aromatické uhlovodíky sice historicky souvisí s charakteristickým zápachem mnohých z nich (např. benzen páchne po dehtu, toluen zapáchá jako toluánský balzám či benzaldehyd
atomová hmotnost S + O 2 -> SO 2 Fe + S -> FeS
 PRVKY ŠESTÉ SKUPINY - CHALKOGENY Mezi chalkogeny (nepřechodné prvky 6.skupiny) zařazujeme kyslík, síru, selen, tellur a radioaktivní polonium. Společnou vlastností těchto prvků je šest valenčních elektronů
PRVKY ŠESTÉ SKUPINY - CHALKOGENY Mezi chalkogeny (nepřechodné prvky 6.skupiny) zařazujeme kyslík, síru, selen, tellur a radioaktivní polonium. Společnou vlastností těchto prvků je šest valenčních elektronů
Jednou z nejdůležitějších skupin derivátů uhlovodíků jsou sloučeniny obsahující jednovazné hydroxylové skupiny OH, proto hydroxyderiváty:
 ALKOHOLY, FENOLY A ANALOGICKÉ SIRNÉ SLOUČENINY Jednou z nejdůležitějších skupin derivátů uhlovodíků jsou sloučeniny obsahující jednovazné hydroxylové skupiny OH, proto hydroxyderiváty: Obecný vzorec hydroxysloučenin
ALKOHOLY, FENOLY A ANALOGICKÉ SIRNÉ SLOUČENINY Jednou z nejdůležitějších skupin derivátů uhlovodíků jsou sloučeniny obsahující jednovazné hydroxylové skupiny OH, proto hydroxyderiváty: Obecný vzorec hydroxysloučenin
Ústřední komise Chemické olympiády. 55. ročník 2018/2019 TEST ŠKOLNÍHO KOLA. Kategorie E ŘEŠENÍ
 Ústřední komise Chemické olympiády 55. ročník 2018/2019 TEST ŠKOLNÍHO KOLA Kategorie E ŘEŠENÍ ANORGANICKÁ CHEMIE 16 BODŮ Úloha 1 Vlastnosti sloučenin manganu a chromu 8 bodů 1) Elektronová konfigurace:
Ústřední komise Chemické olympiády 55. ročník 2018/2019 TEST ŠKOLNÍHO KOLA Kategorie E ŘEŠENÍ ANORGANICKÁ CHEMIE 16 BODŮ Úloha 1 Vlastnosti sloučenin manganu a chromu 8 bodů 1) Elektronová konfigurace:
Chemie - Sexta, 2. ročník
 - Sexta, 2. ročník Chemie Výchovné a vzdělávací strategie Kompetence komunikativní Kompetence k řešení problémů Kompetence sociální a personální Kompetence občanská Kompetence k podnikavosti Kompetence
- Sexta, 2. ročník Chemie Výchovné a vzdělávací strategie Kompetence komunikativní Kompetence k řešení problémů Kompetence sociální a personální Kompetence občanská Kompetence k podnikavosti Kompetence
1 mol (ideálního) plynu, zaujímá za normálních podmínek objem 22,4 litru. , Cl 2 , O 2
 10.výpočty z rovnic praktické provádění výpočtů z rovnic K výpočtu chemických rovnic je důležité si shrnout tyto poznatky: Potřebujem znát vyjadřování koncentrací, objemový zlomek, molární zlomek, molární
10.výpočty z rovnic praktické provádění výpočtů z rovnic K výpočtu chemických rovnic je důležité si shrnout tyto poznatky: Potřebujem znát vyjadřování koncentrací, objemový zlomek, molární zlomek, molární
S Y N T H E S I A Příloha č.6 k OS 65/6 Identifikace a hodnocení rizik. Zdroje rizika ohrožující život a zdraví osob v prostoru výrobních technologií
 Strana: 1 z: 8 Zdroje rizika ohrožující život a zdraví osob v prostoru výrobních technologií Nitrace E 11, E 14 Nitrační kyseliny F 1 F 10, E 3 Stabilizace E 9, E 12, E 4 SBU Nitrocelulóza Oddělení výroby
Strana: 1 z: 8 Zdroje rizika ohrožující život a zdraví osob v prostoru výrobních technologií Nitrace E 11, E 14 Nitrační kyseliny F 1 F 10, E 3 Stabilizace E 9, E 12, E 4 SBU Nitrocelulóza Oddělení výroby
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: Číslo DUMu: VY_32_INOVACE_10_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné
 Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 12.02.2013 Číslo DUMu: VY_32_INOVACE_10_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Obecná
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 12.02.2013 Číslo DUMu: VY_32_INOVACE_10_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Obecná
Chemie. 5. K uvedeným vzorcům (1 5) přiřaďte tvar struktury (A D) jejich molekuly. 1) CO 2 2) SO 2 3) SO 3 4) NH 3 5) BF 3.
 Chemie 1. Analýzou vzorku bylo zjištěno, že vzorek o hmotnosti 25 g obsahuje 15,385 g mědi, 3,845 g síry a zbytek připadá na kyslík. Který empirický vzorec uvedeným výsledkům analýzy odpovídá? A r (Cu)
Chemie 1. Analýzou vzorku bylo zjištěno, že vzorek o hmotnosti 25 g obsahuje 15,385 g mědi, 3,845 g síry a zbytek připadá na kyslík. Který empirický vzorec uvedeným výsledkům analýzy odpovídá? A r (Cu)
Alkeny. Alkeny. Největšíprůmyslový význam majíethen (ethylen) a propen (propylen) jako suroviny pro další přeměny nebo pro polymerace
 Alkeny Dvojná vazba je tvořena jednou vazbou sigma a jednou vazbou pí. Dvojná vazba je kratší než vazba jednoduchá a všechny čtyři atomy vázané na dvojnou vazbu leží v jedné rovině. Fyzikální vlastnosti
Alkeny Dvojná vazba je tvořena jednou vazbou sigma a jednou vazbou pí. Dvojná vazba je kratší než vazba jednoduchá a všechny čtyři atomy vázané na dvojnou vazbu leží v jedné rovině. Fyzikální vlastnosti
Radikály jsou zároveň velmi reaktivní - stabilních radikálů, které lze izolovat a skladovat, není příliš mnoho.
 Radikálové reakce se odlišují od reakcí, se kterými jsme se dosud setkali. Při zápisu mechanismů nebudeme přesunovat elektronové páry, ale pouze jeden elektron. To se mimojiné projeví na způsobu, jak takové
Radikálové reakce se odlišují od reakcí, se kterými jsme se dosud setkali. Při zápisu mechanismů nebudeme přesunovat elektronové páry, ale pouze jeden elektron. To se mimojiné projeví na způsobu, jak takové
Rozdělení uhlovodíků
 Rozdělení uhlovodíků 1/8 Alkany a cykloalkany Obecné vzorce: alkany C n H 2n+2, cykloalkany C n H 2n, kde n je přirozené číslo Homologický přírustek: - CH 2 - Alkany přímé ( n - alkany) rozvětvené Primární,
Rozdělení uhlovodíků 1/8 Alkany a cykloalkany Obecné vzorce: alkany C n H 2n+2, cykloalkany C n H 2n, kde n je přirozené číslo Homologický přírustek: - CH 2 - Alkany přímé ( n - alkany) rozvětvené Primární,
Přílohy. NÁZEV: Molekulární modely ve výuce organické chemie na gymnáziu. AUTOR: Milan Marek. KATEDRA: Katedra chemie a didaktiky chemie
 NÁZEV: Molekulární modely ve výuce organické chemie na gymnáziu AUTOR: Milan Marek KATEDRA: Katedra chemie a didaktiky chemie Přílohy Příloha 1 Přehled vzorců a modelů Příloha 2 Nástěnné transparenty modelů
NÁZEV: Molekulární modely ve výuce organické chemie na gymnáziu AUTOR: Milan Marek KATEDRA: Katedra chemie a didaktiky chemie Přílohy Příloha 1 Přehled vzorců a modelů Příloha 2 Nástěnné transparenty modelů
VY_32_INOVACE_29_HBENO5
 Alkany reakce Temacká oblast : Chemie organická chemie Datum vytvoření: 15. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Výroba alkanů. Reakvita alkanů, důležité
Alkany reakce Temacká oblast : Chemie organická chemie Datum vytvoření: 15. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Výroba alkanů. Reakvita alkanů, důležité
Karboxylové kyseliny
 Karboxylové kyseliny Učební text, Hb 2008 Obsahují jednu nebo více charakteristických karboxylových skupin COOH. Název vznikl kombinací karboxyl = karbonyl + hydroxyl Obecný vzorec např. R-COOH, HOOC-R-COOH,
Karboxylové kyseliny Učební text, Hb 2008 Obsahují jednu nebo více charakteristických karboxylových skupin COOH. Název vznikl kombinací karboxyl = karbonyl + hydroxyl Obecný vzorec např. R-COOH, HOOC-R-COOH,
UHLOVODÍKY ALKANY (...)
 UHLOVODÍKY ALKANY (...) alifatické nasycené uhlovodíky nerozvětvené i rozvětvené mezi atomy uhlíku pouze jednoduché vazby (σ vazby), mezi nimi úhel 109 28 název: kmen + an obecný vzorec C n H 2n + 2 tvoří
UHLOVODÍKY ALKANY (...) alifatické nasycené uhlovodíky nerozvětvené i rozvětvené mezi atomy uhlíku pouze jednoduché vazby (σ vazby), mezi nimi úhel 109 28 název: kmen + an obecný vzorec C n H 2n + 2 tvoří
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 KARBONYLOVÉ SLOUČENINY = látky, které obsahují karbonylovou skupinu Aldehydy mají skupinu C=O na konci řetězce, aldehydická skupina má potom tvar... Názvosloví aldehydů: V systematickém názvu je zakončení
KARBONYLOVÉ SLOUČENINY = látky, které obsahují karbonylovou skupinu Aldehydy mají skupinu C=O na konci řetězce, aldehydická skupina má potom tvar... Názvosloví aldehydů: V systematickém názvu je zakončení
16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší?
 16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší? 4) Urči typy konstituční izomerie. 5) Co je tautomerie
16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší? 4) Urči typy konstituční izomerie. 5) Co je tautomerie
3. ročník Vzdělávací obor - Člověk a příroda
 Gymnázium, Milevsko, Masarykova 183 Školní vzdělávací program (ŠVP) pro vyšší stupeň osmiletého studia a čtyřleté studium Vyučovací předmět - Chemie 3. ročník Vzdělávací obor - Člověk a příroda Očekávané
Gymnázium, Milevsko, Masarykova 183 Školní vzdělávací program (ŠVP) pro vyšší stupeň osmiletého studia a čtyřleté studium Vyučovací předmět - Chemie 3. ročník Vzdělávací obor - Člověk a příroda Očekávané
Reaktivita karboxylové funkce
 eaktivita karboxylové funkce - M efekt, - I efekt - I efekt < + M efekt - I efekt kyslíku eaktivita: 1) itlivost na působení bází - tvorba solí karboxylových kyselin (také většina nukleofilů zde působí
eaktivita karboxylové funkce - M efekt, - I efekt - I efekt < + M efekt - I efekt kyslíku eaktivita: 1) itlivost na působení bází - tvorba solí karboxylových kyselin (také většina nukleofilů zde působí
MATURITNÍ OTÁZKY Z CHEMIE
 MATURITNÍ OTÁZKY Z CHEMIE 1 Složení a struktura atomu Vývoj představ o složení a struktuře atomu, elektronový obal atomu, modely atomu, pojem orbital, typy orbitalů, jejich znázorňování a pravidla pro
MATURITNÍ OTÁZKY Z CHEMIE 1 Složení a struktura atomu Vývoj představ o složení a struktuře atomu, elektronový obal atomu, modely atomu, pojem orbital, typy orbitalů, jejich znázorňování a pravidla pro
1. Jeden elementární záporný náboj 1,602.10-19 C nese částice: a) neutron b) elektron c) proton d) foton
 varianta A řešení (správné odpovědi jsou podtrženy) 1. Jeden elementární záporný náboj 1,602.10-19 C nese částice: a) neutron b) elektron c) proton d) foton 2. Sodný kation Na + vznikne, jestliže atom
varianta A řešení (správné odpovědi jsou podtrženy) 1. Jeden elementární záporný náboj 1,602.10-19 C nese částice: a) neutron b) elektron c) proton d) foton 2. Sodný kation Na + vznikne, jestliže atom
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ
 SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch
 Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch Atom, složení a struktura Chemické prvky-názvosloví, slučivost Chemické sloučeniny, molekuly Chemická vazba
Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch Atom, složení a struktura Chemické prvky-názvosloví, slučivost Chemické sloučeniny, molekuly Chemická vazba
Gymnázium Vysoké Mýto nám. Vaňorného 163, Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto H 3 C Vymezení arenů V aromatickém cyklu dochází k průniku orbitalů kolmých k rovině cyklu. Vzniká tzv. delokalizovaná vazba π. Stabilita benzenu
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto H 3 C Vymezení arenů V aromatickém cyklu dochází k průniku orbitalů kolmých k rovině cyklu. Vzniká tzv. delokalizovaná vazba π. Stabilita benzenu
12.CHALKOGENY A HALOGENY
 12.CHALKOGENY A HALOGENY Chalkogeny ( česky se jedná o prvky ) 1) Popiš obecnou charakteristiku dané skupiny (počet valenčních elektronů, obecná elektronová konfigurace valenční vrstvy, způsoby dosažení
12.CHALKOGENY A HALOGENY Chalkogeny ( česky se jedná o prvky ) 1) Popiš obecnou charakteristiku dané skupiny (počet valenčních elektronů, obecná elektronová konfigurace valenční vrstvy, způsoby dosažení
Substituční deriváty karboxylových kyselin
 Substituční deriváty karboxylových kyselin Vznikají substitucemi v, ke změnám v karboxylové funkční skupině. Poloha nové skupiny se často ve spojení s triviálními názvy označuje řeckými písmeny: Mají vlastnosti
Substituční deriváty karboxylových kyselin Vznikají substitucemi v, ke změnám v karboxylové funkční skupině. Poloha nové skupiny se často ve spojení s triviálními názvy označuje řeckými písmeny: Mají vlastnosti
Ethery, thioly a sulfidy
 Ethery, thioly a sulfidy Úvod becný vzorec alkoholů je R--R. Ethery Názvosloví etherů Názvy etherů obsahují jména alkylových a arylových sloučenin ze kterých tvořeny v abecedním pořadí následované slovem
Ethery, thioly a sulfidy Úvod becný vzorec alkoholů je R--R. Ethery Názvosloví etherů Názvy etherů obsahují jména alkylových a arylových sloučenin ze kterých tvořeny v abecedním pořadí následované slovem
Aromáty. Aromáty. Jak bylo uvedeno v kapitole o názvosloví, jinak nakreslená molekula není jiná látka, tj. Všechny uvedené obrázky jsou TOLUEN
 Pokud je konjugovaný systém kruhový, vede konjugace k tomu, že se zcela ztratírozdíly mezi jednotlivými atomy a vazbami (dvojná x jednoduchá). Aby byl systém aromatický, musíkroměvýše uvedených (je cyklický
Pokud je konjugovaný systém kruhový, vede konjugace k tomu, že se zcela ztratírozdíly mezi jednotlivými atomy a vazbami (dvojná x jednoduchá). Aby byl systém aromatický, musíkroměvýše uvedených (je cyklický
16.5.2010 Halogeny 1
 16.5.010 Halogeny 1 16.5.010 Halogeny Prvky VII.A skupiny: F, Cl, Br, I,(At) Obecnávalenčníkonfigurace:ns np 5 Pro plné zaplnění valenční vrstvy potřebují 1 e - - nejčastější sloučeniny s oxidačním číslem
16.5.010 Halogeny 1 16.5.010 Halogeny Prvky VII.A skupiny: F, Cl, Br, I,(At) Obecnávalenčníkonfigurace:ns np 5 Pro plné zaplnění valenční vrstvy potřebují 1 e - - nejčastější sloučeniny s oxidačním číslem
Průmysl dusíku. amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin. NaClO NaOH CO(NH 2 ) 2.
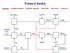 Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
Seminář z chemie. Charakteristika vyučovacího předmětu
 Seminář z chemie Časová dotace: 2 hodiny ve 3. ročníku, 4 hodiny ve 4. Ročníku Charakteristika vyučovacího předmětu Seminář je zaměřený na přípravu ke školní maturitě z chemie a k přijímacím zkouškám na
Seminář z chemie Časová dotace: 2 hodiny ve 3. ročníku, 4 hodiny ve 4. Ročníku Charakteristika vyučovacího předmětu Seminář je zaměřený na přípravu ke školní maturitě z chemie a k přijímacím zkouškám na
5. Nekovy sı ra. 1) Obecná charakteristika nekovů. 2) Síra a její vlastnosti
 5. Nekovy sı ra 1) Obecná charakteristika nekovů 2) Síra a její vlastnosti 1) Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu. Jsou to prvky uspořádané
5. Nekovy sı ra 1) Obecná charakteristika nekovů 2) Síra a její vlastnosti 1) Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu. Jsou to prvky uspořádané
Oxidace a redukce. Hoření = slučování s kyslíkem = oxidace. 2 Mg + O 2 2 MgO S + O 2 SO 2. Redukce = odebrání kyslíku
 Oxidace a redukce Hoření = slučování s kyslíkem = oxidace 2 Mg + O 2 2 MgO S + O 2 SO 2 Redukce = odebrání kyslíku Fe 2 O 3 + 3 C 2 Fe + 3 CO CuO + H 2 Cu + H 2 O 1 Oxidace a redukce Širší pojem oxidace
Oxidace a redukce Hoření = slučování s kyslíkem = oxidace 2 Mg + O 2 2 MgO S + O 2 SO 2 Redukce = odebrání kyslíku Fe 2 O 3 + 3 C 2 Fe + 3 CO CuO + H 2 Cu + H 2 O 1 Oxidace a redukce Širší pojem oxidace
1.1.2 VLASTNOSTI HALOGENDERIVÁTŮ, U KTERÝCH NENÍ HALOGEN VÁZÁN NA AROMATICKÉM JÁDŘE
 .. VLASTSTI ALGEDEIVÁTŮ, U KTEÝ EÍ ALGE VÁZÁ A AMATIKÉM JÁDŘE... Fyzikální vlastnosti Těkavost odpovídá molekulové hmotnosti. Kapalné halogenderiváty jsou aprotickými rozpouštědly polárnějšími než uhlovodíky....
.. VLASTSTI ALGEDEIVÁTŮ, U KTEÝ EÍ ALGE VÁZÁ A AMATIKÉM JÁDŘE... Fyzikální vlastnosti Těkavost odpovídá molekulové hmotnosti. Kapalné halogenderiváty jsou aprotickými rozpouštědly polárnějšími než uhlovodíky....
7) Uveď příklad chemické reakce, při níž se sloučí dva prvky za vzniku sloučeniny. (3) hoření vodíku s kyslíkem a vzniká voda
 Chemické reakce a děje Chemické reakce 1) Jak se chemické reakce odlišují od fyzikálních dějů? (2) změna vlastností látek, změna vazeb mezi atomy 2) Co označujeme v chemických reakcích jako reaktanty a
Chemické reakce a děje Chemické reakce 1) Jak se chemické reakce odlišují od fyzikálních dějů? (2) změna vlastností látek, změna vazeb mezi atomy 2) Co označujeme v chemických reakcích jako reaktanty a
SHRNUTÍ A ZÁKLADNÍ POJMY UČEBNICE ZÁKLADY CHEMIE 1
 SHRNUTÍ A ZÁKLADNÍ POJMY UČEBNICE ZÁKLADY CHEMIE 1 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu -
SHRNUTÍ A ZÁKLADNÍ POJMY UČEBNICE ZÁKLADY CHEMIE 1 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu -
téma: Halogeny-úvod autor: Ing. František Krejčí, CSc. cíl praktika: žáci si osvojí znalosti z chemie halogenů doba trvání: 2 h
 téma: Halogeny-úvod cíl praktika: žáci si osvojí znalosti z chemie halogenů pomůcky: psací potřeby popis aktivit: Žáci si osvojí problematiku halogenů, popíší jejich elektronovou konfiguraci a z ní vyvodí
téma: Halogeny-úvod cíl praktika: žáci si osvojí znalosti z chemie halogenů pomůcky: psací potřeby popis aktivit: Žáci si osvojí problematiku halogenů, popíší jejich elektronovou konfiguraci a z ní vyvodí
Halogenderiváty. Halogenderiváty
 Názvosloví Halogeny jsou v názvu vždy v předponě. Trichlormethan mátriviálnínázev CHLOROFORM Podle připojení halogenu je dělíme na primární sekundární a terciární Br Vazba mezi uhlíkem a halogenem je polarizovaná
Názvosloví Halogeny jsou v názvu vždy v předponě. Trichlormethan mátriviálnínázev CHLOROFORM Podle připojení halogenu je dělíme na primární sekundární a terciární Br Vazba mezi uhlíkem a halogenem je polarizovaná
Organická chemie II. Acylderiváty I. Zdeněk Friedl. Kapitola 21. Solomons & Fryhle: Organic Chemistry 8th Ed., Wiley 2004
 rganická chemie II Zdeněk Friedl Kapitola 21 Acylderiváty I Solomons & Fryhle: rganic Chemistry 8th Ed., Wiley 2004 Karboxylové kyseliny, funkční deriváty karboxylových kyselin fyzikální vlastnosti karboxylových
rganická chemie II Zdeněk Friedl Kapitola 21 Acylderiváty I Solomons & Fryhle: rganic Chemistry 8th Ed., Wiley 2004 Karboxylové kyseliny, funkční deriváty karboxylových kyselin fyzikální vlastnosti karboxylových
Organická chemie 3.ročník studijního oboru - kosmetické služby.
 Organická chemie 3.ročník studijního oboru - kosmetické služby. T-7 Funkční a substituční deriváty karboxylových kyselin Zpracováno v rámci projektu Zlepšení podmínek ke vzdělávání Registrační číslo projektu:
Organická chemie 3.ročník studijního oboru - kosmetické služby. T-7 Funkční a substituční deriváty karboxylových kyselin Zpracováno v rámci projektu Zlepšení podmínek ke vzdělávání Registrační číslo projektu:
Složení látek a chemická vazba Číslo variace: 1
 Složení látek a chemická vazba Číslo variace: 1 Zkoušecí kartičku si PODEPIŠ a zapiš na ni ČÍSLO VARIACE TESTU (číslo v pravém horním rohu). Odpovědi zapiš na zkoušecí kartičku, do testu prosím nepiš.
Složení látek a chemická vazba Číslo variace: 1 Zkoušecí kartičku si PODEPIŠ a zapiš na ni ČÍSLO VARIACE TESTU (číslo v pravém horním rohu). Odpovědi zapiš na zkoušecí kartičku, do testu prosím nepiš.
Chemie NÁRODNÍ SROVNÁVACÍ ZKOUŠKY DUBNA 2017
 NÁRODNÍ SROVNÁVACÍ ZKOUŠKY Chemie T DUBNA 2017 : 29. dubna 2017 D : 348 : 30 M. M. : 30,0 : 29,0 M. : 9,7 % S : -10,0 M. : -2,0 : 13,5 Zopakujte si základní informace ke zkoušce: n Test obsahuje 30 úloh.
NÁRODNÍ SROVNÁVACÍ ZKOUŠKY Chemie T DUBNA 2017 : 29. dubna 2017 D : 348 : 30 M. M. : 30,0 : 29,0 M. : 9,7 % S : -10,0 M. : -2,0 : 13,5 Zopakujte si základní informace ke zkoušce: n Test obsahuje 30 úloh.
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 16, 566 01 Vysoké Mýto Alkeny Vlastnosti dvojné vazby Hybridizace uhlíku vázaného dvojnou vazbou je sp. Valenční úhel který svírají vazby na uhlíkovém atomu je přibližně
Gymnázium Vysoké Mýto nám. Vaňorného 16, 566 01 Vysoké Mýto Alkeny Vlastnosti dvojné vazby Hybridizace uhlíku vázaného dvojnou vazbou je sp. Valenční úhel který svírají vazby na uhlíkovém atomu je přibližně
Úvod do studia organické chemie
 Úvod do studia organické chemie 1828... Wöhler... uměle připravil močovinu Organická chemie - chemie sloučenin uhlíku a vodíku, případně dalších prvků (O, N, X, P, S) Příčiny stability uhlíkových řetězců:
Úvod do studia organické chemie 1828... Wöhler... uměle připravil močovinu Organická chemie - chemie sloučenin uhlíku a vodíku, případně dalších prvků (O, N, X, P, S) Příčiny stability uhlíkových řetězců:
18. Reakce v organické chemii
 1) homolýza, heterolýza 2) substituce, adice, eliminace, přesmyk 3) popis mechanismů hlavních typů reakcí (S R, A E, A R ) 4) příklady 18. Reakce v organické chemii 1) Homolýza, heterolýza KLASIFIKACE
1) homolýza, heterolýza 2) substituce, adice, eliminace, přesmyk 3) popis mechanismů hlavních typů reakcí (S R, A E, A R ) 4) příklady 18. Reakce v organické chemii 1) Homolýza, heterolýza KLASIFIKACE
Chemie NÁRODNÍ SROVNÁVACÍ ZKOUŠKY KVĚTNA 2017
 NÁRODNÍ SROVNÁVACÍ ZKOUŠKY Chemie T KVĚTNA 2017 : 29. května 2017 D : 282 P P P : 30 M. M. : 30,0 : 28,7 M. : 9,7 % S : -10,0 M. P : -0,7 : 15,1 Zopakujte si základní informace ke zkoušce: n Test obsahuje
NÁRODNÍ SROVNÁVACÍ ZKOUŠKY Chemie T KVĚTNA 2017 : 29. května 2017 D : 282 P P P : 30 M. M. : 30,0 : 28,7 M. : 9,7 % S : -10,0 M. P : -0,7 : 15,1 Zopakujte si základní informace ke zkoušce: n Test obsahuje
Škola: Gymnázium, Brno, Slovanské náměstí 7 III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 VY_32_INOVACE_C.3.01 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT
VY_32_INOVACE_C.3.01 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT
Škola: Gymnázium, Brno, Slovanské náměstí 7 III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
