Změna skupenství - přehled Převzato z materiálů ZŠ Ondřejov -
|
|
|
- Radovan Bařtipán
- před 10 lety
- Počet zobrazení:
Transkript
1 Změna skupenství - přehled Převzato z materiálů ZŠ Ondřejov - Skupenství látek Látky se vyskytují ve třech skupenstvích pevné, kapalné, plynné. Základní vlastnosti látek podle skupenství (opakování ze 6. třídy): Látky pevné můžeme určovat tvrdost, křehkost, pružnost, tvárnost, barvu, špatně mění svůj tvar (výjimkou jsou sypké látky, které mění svůj tvar snadno jako kapaliny, proti kapalinám nemusí mít hladinu vždy vodorovně). Kapaliny snadno mění svůj tvar, jsou téměř nestlačitelné, snad se dají dělit, mají hladinu vždy vodorovně, jsou tekuté. Plyny dají se snadno stlačit, vždy vyplní celou nádobu, dají se snadno dělit, jsou tekuté. Uspořádání částic podle skupenství: Pevné látky Částice mají pevná místa a nemohou se od sebe vzdálit. Pevné látky dobře drží svůj tvar. Částice jsou blízko u sebe, není mezi nimi téměř žádné volné místo. Z toho také plyne, že mají stálý objem. Krystalické látky částice jsou uspořádány do pravidelné mřížky, ve které se opakuje jeden vzor (sůl, led, diamant, tuha, kovy). Látky, ve kterých nejsou molekuly pravidelně uspořádány, jsou například plasty a sklo. Kapaliny Částice jsou blízko sebe tak, že se kapalina nedá téměř stlačit. V kapalinách po sobě částice volně kloužou, nemají žádné pevné místo. Molekuly jsou neuspořádané. Plyny Částice se volně pohybují, narážejí do sebe i na stěny nádoby. Síla, kterou tlačí vzduch v pneumatice na její stěny, je způsobena těmito nárazy částic vzduchu na stěny. Pokud plyn stlačíme, částice narážejí na stěnu častěji. Podobně je častější narážení, když plyn zahřejeme. Zvyšujeme tak tlak. 1) Jak se nazývají tři skupenství vody? 2) V čem se shodují a v čem se od sebe liší led, voda a vodní pára? 3) Popiš následující příklady změn skupenství: vločka po dopadu na teplou ruku, kapka vody stříknutá na rozpálenou žehličku, ledová kostka vhozená do limonády, orosení skleničky, do které nalijeme vychlazenou minerálku. 4) Při vaření vody na čaj pozorujeme u ústí čajové konvice bílý obláček. V jakém skupenství je v tomto obláčku voda? Tání a tuhnutí Tání V pevné látce jsou částice pevně uspořádány, každá částice má svoje místo, kolem kterého kmitá. Když pevnou látku zahříváme, částice kmitají rychleji. Při dostatečném zvýšení teploty se částice ze své pevné polohy utrhnou a začnou se volně pohybovat. V tento okamžik se začne pevná látka měnit na kapalnou. Tomuto ději říkáme tuhnutí a říkáme, že látka taje. Teplota tání teplota, při které se pevná látka začne měnit na kapalnou. Tuhnutí Když kapalnou látku chladíme, začne se při určité teplotě tuhnout a měnit se na látku pevnou. Částice, které se volně pohybovaly, se při snižování teploty pohybují stále pomaleji až se k sobě přitáhnou a usadí se v určité poloze, kolem které pak kmitají. Z kapaliny se stává látka pevná. Tomuto ději říkáme tuhnutí, látka tuhne. Teplota tuhnutí teplota, při které se kapalná látka začne měnit na pevnou. Teplota tání a tuhnutí je u krystalických látek stejná. Co se děje při tání? Pokus: Dáme do kádinky led a zahříváme. V okamžiku, kdy začne led tát, naměříme teplotu 0 C. Teplota zůstane 0 C po celou dobu, kdy je
2 v kádince ještě nějaký led. Jakmile je všechen led přeměněn na vodu, začne se teplota zvyšovat. Teplota se během přeměny nezvyšuje, všechno dodávané teplo se spotřebuje na změnu skupenství. Graf průběhu tání ledu teplota stoupá až do bodu 0 C. V čase t 1 až t 2 se mění led na vodu, tzn. že v této době existuje voda ve skupenství pevném i kapalném. Skupenské teplo tání Skupenské teplo tání je množství energie, které se spotřebuje na roztátí pevné látky. Látka tuto energii pohlcuje. Když látka tuhne, tak tuto energii vydává. Kolik tepla se spotřebuje, závisí na druhu látky, její hmotnosti a tlaku. Měrné skupenské teplo tání Měrné skupenské teplo tání je množství tepla, které přijme 1 kg pevné látky při teplotě tání, aby se změnila na kapalinu téže látky stejné teploty při normálním tlaku (1, Pa) Měrné skupenské teplo značíme lt jednotky J/kg, kj/kg Příklad: Teplota tání ledu je 0 C a měrné skupenské teplo tání ledu je 334 kj/kg. To znamená, že na přeměnu 1 kg ledu o 0 C na vodu o teplotě 0 C spotřebujeme 334 kj tepla. Teplota tání zinku je 420 C a měrné skupenské teplo tání zinku je 102 kj/kg. To znamená, že na přeměnu 1 kg zinku v pevném skupenství o teplotě 420 C na kapalný zinek o teplotě 420 C spotřebujeme 120 kj tepla. Diskuze grafu tání olova Popis časových úseků: AB olovo je ve skupenství pevném, pevná látka se zahřívá, zvyšuje se teplota BC olovo je ve skupenství pevném i kapalném, látka se mění z pevné na kapanou, teplota se nemění CD olovo je ve skupenství kapalném, kapalina se zahřívá, zvyšuje se teplota Popis skupenství v jednotlivých bodech: X1 skupenství pevné X2 skupenství pevné a kapalné X3 skupenství kapalné 1) Co je teplota tání a tuhnutí? 2) Co se děje pří tání látky? Co se děje při tuhnutí látky? 3) Co je měrné skupenské teplo látky? Co je skupenské teplo látky? 4) Najdi v tabulkách teplotu tání a měrné skupenské teplo látek: hliník, měď, rtuť, stříbro, wolfram. 5) Vysvětli, co znamená, že cín má měrné skupenské teplo tání 60 kj/kg. 6) V jakém skupenství (pevném nebo kapalném) je při teplotě 1000 C při normálním tlaku hliník, měď, platina, stříbro, zlato? 7) Uspořádej následující kovy podle vzrůstající teploty tání při normálním tlaku: cín, hliník, olovo, železo, stříbro. Rozhodni, které z kovů lze tavit v hliníkové nádobě? 8) V mrazničce se časem udělá vrstva sněhu a ledu. Odkud se bere? Jakou změnou skupenství vzniká? Jakou změnou skupenství se odstraňuje? Proč je třeba ji odstranit? Jak můžeme, co nejvíce zpomalit její tvoření? 9) Jakou nejnižší teplotu můžeme měřit rtuťovým teploměrem? Jakou lihovým? 10) Můžeme roztavit zinek v hliníkové lžíci? Vysvětli. 11) Můžeme roztavit olovo v cínovém kelímku? Vysvětli. 12) Roztaví se pevný cín, jestliže ho vhodíme do roztaveného olova? Vysvětli. 13) Popiš grafy: a) Jedná se o graf tání mědi doplň hodnotu teploty do grafu a popiš skupenství olova ve vyznačených bodech. b) Urči, o jakou se jedná látku. Popiš skupenství látky ve vyznačených bodech. Graf a) Graf b) Skupenské teplo tání Skupenské teplo tání Skupenské teplo tání je množství tepla, které musíme dodat látce v pevném skupenství při teplotě tání, aby se změnila na kapalinu o stejné teplotě.
3 Měrné skupenské teplo tání Měrné skupenské teplo tání je množství tepla, které přijme 1 kg pevné látky při teplotě tání, aby se změnila na kapalinu téže látky stejné teploty při normálním tlaku (1, Pa) Měrné skupenské teplo značíme lt jednotky J/kg, kj/kg Příklad: měrné skupenské teplo niklu je 300 kj/kg (lt = 300 kj/kg), to znamená, že na roztavení 1 kg niklu při teplotě tání spotřebujeme 300 kj tepla, abychom získali stejné množství niklu v kapalném stavu při stejné teplotě za normálního tlaku. Výpočet skupenského tepla tání Skupenské teplo tání značíme Lt a vypočítáme ho ze vztahu Lt = m. lt Kde m je hmotnost a lt je měrné skupenské teplo tání. Příklad 1: Urči teplo, které musíme dodat 2,5 kg železa zahřátého teplotu tání, aby roztálo. m = 2,5 kg lt = 289 kj/kg Lt =? (kj) Lt = m. lt Lt = 2, Lt = 722,5 kj Na roztavení 2,5 kg železa při teplotě tání potřebujeme 722,5 kj tepla. Příklad 2: Do sklenice s vodou byly vhozeny 3 kostky ledu, každá kostka měla hmotnost 50 g a měly teplotu -10 C. Kolik tepla odebraly kostky ledu vodě v okamžiku, kdy všechny roztály. Příklad rozdělíme na dvě části množství tepla, které přijme led, než dosáhne teploty tání, a množství tepla, které spotřebuje na roztátí. m = 150 g = 0,15 kg m = 150 g = 0,15 kg c = 2,09 kj/kg. C lt = 334 kj/kg Q =? (kj) Lt =? (kj) Q = c.m. (t2 t1) Lt = m. lt Q = 2,09. 0, Lt = 0, Q = 3,135 kj Lt = 50,1 kj Qc = Q + Lt = 3, ,1 = 53,235 kj Kostky ledu ubraly vodě 53,235 kj tepla. 1) Co je měrné skupenské teplo látky? Co je skupenské teplo látky? 2) Najdi hodnotu měrného skupenského tepla stříbra a vysvětli, co hodnota vyjadřuje. 3) Kolik tepla se spotřebuje na roztátí 600 g ledu o teplotě 0 C při normálním tlaku na vodu o teplotě 0 C? 4) Kolik tepla se spotřebuje na roztátí 32 kg železa při teplotě tání při normálním tlaku při přeměně na kapalinu o stejné teplotě? 5) Kolik tepla se uvolní při tuhnutí 700 g hliníku při teplotě tání a normálním tlaku, jestliže se přemění na pevnou látku o stejné teplotě. 6) Kolik tepla potřebujeme na roztavení 350 g železa za normálního tlaku při teplotě tání? 7) Kolik tepla za normálního tlaku potřebujeme na přeměnu měděné kostky o teplotě 22 C a hmotnosti 500 g na kapalinu? 8) Kolik tepla se uvolní, když se 2,5 l vody o teplotě 5 C změní na led o teplotě -5 C. 9) Nakresli graf přeměny křemíku z pevné látky na kapalinu. Vypařování a kapalnění Jak schne vyprané prádlo pověšené venku na šňůře? Uschne vlastně vždy, jedině nesmí pršet. To znamená, že uschne při jakékoliv teplotě. Doba, za kterou prádlo uschne, je ale různá. Závisí na tom, zda svítí slunce nebo je pod mrakem, zda je vlhký den nebo větrný den. Co je vypařování a co se děje při vypařování? Vypařování je přeměna kapalné látky na plynnou. Molekuly se v látkách stále pohybují. Některé molekuly na povrchu dosáhnou velké rychlosti a uvolní se. Překonají přitažlivou sílu a odletí. Při vypařování vzniká plyn. Tento plyn nazýváme pára nebo páry. Např. páry lihu, páry rtuti, vodní pára. Na čem závisí rychlost vypařování? Na teplotě čím vyšší teplota, tím je vypařování rychlejší. Při vyšší teplotě se pohybují molekuly rychleji, proto částice dříve dosáhnou vyšší rychlosti a překonají přitažlivé síly. Můžete si ověřit kápněte kapku na plotýnku vařiče, chvíli pozorujte. Vypařování bude těžko pozorovatelné. Pokud plotýnku vařiče zapnete, můžete pozorovat, jak kapka vypařováním začne mizet.
4 Na větru při větru je vypařování rychlejší. Za bezvětří se molekuly utrhnou, ale některé se opět vrátí, za větru, se molekuly utrhnou a díky větru odletí a nevrací se zpět. Můžete ověřit udělej si dvě čáry vlhkou houbou na tabuli, jednu nech v klidu a na druhou foukej studeným fénem vzduch. Fénovaná čára uschne rychleji. Na povrchu čím větší povrch, tím je vypařování rychlejší. Molekuly se utrhnou z povrchu, čím větší povrch, tím více molekul se může utrhnout. Můžete si ověřit namoč dvě stejná trička, jedno zmačkej do klubíčka, druhé pověs na šňůru. Pověšené tričko uschne mnohem rychleji, smotané tričko uschne na povrchu, ale uvnitř je stále mokré. Na druhu látky záleží na tom, jaké jsou přitažlivé síly mezi molekulami příslušné látky. Látky těkavé, jako například éter, se vypařují velmi rychle. Proč se látky při vypařování ochlazují? Pokud si nasliníte prst a budete na něj foukat, ze strany odkud foukáte, pocítíte chlad. Pokud chcete zjistit, odkud fouká vítr, stačí mít vlhký prst a podle toho, kde cítíme chlad, určíme směr větru. Za horkého letního dne, pokud si namočíme naše šaty, pociťujeme chlad. Pokud chci v láhvi uchovat studenou vodu, obalím ji mokrým hadrem. Z hadru se vypařuje voda a láhev se ochlazuje. K ochlazování dochází tím, že látka při vypařování ztrácí rychlejší molekuly (ty se odtrhnou) a zůstávají ty pomalejší. Teplota látky je dána pohybem molekul, proto po odtržení rychlejších, chladne. Co je kapalnění? Změna plynné látky na kapalnou se nazývá kapalnění. Při kapalnění dochází k tomu, že se molekuly shlukují a začínají vytvářet kapičky. Aby se molekuly mohly shluknout, je třeba mít dostatečně nízkou teplotu. Nejčastěji se setkáváme s kapalněním vodní páry. Všechny obláčky, které pozorujeme nad hrncem, při dýchání v chladu, nejsou vlastně pára, ale je to vysrážená mlha. Vzniká tam, kde se vzduch dostatečně ochladí. Můžeme pozorovat, když vyndáme skleničku z ledničky je dostatečně studená a na jejím povrchu se vysráží pára obsažená ve vzduchu. Kapalnění se cizím slovem nazývá kondenzace. 1) Když chceme poznat, odkud fouká vítr, navlhčíme prst. Jak poznáme směr větru? 2) Jak nejrychleji usušíte barevný nátěr, prádlo v sušičce, vlasy po koupání? 3) Jak se dá urychlit chladnutí horkého čaje? 4) Vysvětli co je vypařování a co se při něm děje. 5) Na čem závisí rychlost vypařování? Vysvětli jednotlivé závislosti. 6) Proč cítíme při vypařování chlad? Uveď nějaké příklady. 7) Co je kondenzace? 8) Vysvětli slovo pára. 9) Proč se v zimě při vstupu z venkovního prostředí do vytopené místnosti zamlžují brýle? Var - Jaký je rozdíl mez vypařováním a varem? Vypařování i var je změna skupenství kapalného na plynné. Vypařování se děje při každé teplotě, kapalina se vypařuje z povrchu. Rychlost vypařování závisí na teplotě, čím vyšší teplota tím rychleji se kapalina vypařuje. Když kapalina dosáhne určité teploty, začne se pára uvolňovat z celého objemu, tzn. ne jen z povrchu, ale i uvnitř. Když vaříme vodu, můžeme pozorovat bubliny v okamžiku, kdy nastává var, unikají bublinky ze zdola nahoru. Co je to var a na čem závisí? Var je vypařování z celého objemu. Uvnitř kapaliny se tvoří bubliny, které se nafukují, zvětšují se a stoupají k hladině. Teplota varu je teplota, při které dochází k varu. Tato teplota závisí na tlaku vzduchu a druhu kapaliny. Teploty varu uvedené v tabulkách jsou za normálního tlaku ( Pa). Npař. Voda má teplotu varu 100 C, etanol 78,3 C, rtuť 357 C, olovo C. Jak se mění teplota varu při změně atmosférického tlaku? Za normálního tlaku je teplota varu vody 100 C. Pokud má voda nižší teplotu, bublinky vody nepřetlačí tlak působící shora. Atmosférický tlak vlastně bublinu zamáčkne. Pokud teplotu zvyšuju, zvyšuje se i tlak bublin, které po dosažení 100 C přetlačí atmosférický tlak a začnou stoupat vzhůru a uvolňovat se ve formě páry.
5 Pokud je tlak vzduchu na hladinu menší, je třeba i menší tlak uvnitř bublin vzduchu, aby se dostaly na povrch. Z toho plyne, že i teplota varu je v tento okamžik nižší, protože tlak uvnitř bublin závisí na teplotě. Pokud by na hladinu vody nic netlačilo, vařila by se voda i při pokojové teplotě. Pokud jsme na horách, začne se nám voda vařit dříve než v nížině. Musíme však vařit věci déle, protože je vlastně vaříme při nižší teplotě. Pokus: Dáme kádinku s vodou o pokojové teplotě do vývěvy. Začneme vyčerpávat vzduch. Po chvíli se začnou z kádinky s vodou uvolňovat bublinky z celého objemu, voda se vaří. Pokud je tlak vzduchu na hladinu větší než normální atmosférický tlak, potřebují i bubliny, které se vytváření, větší tlak, aby se mohly dostat nad hladinu. Potřebujeme tedy vyšší teplotu, aby se zvýšil tlak bublin. Voda se tedy vaří v tomto případě při vyšší teplotě. Toho se využívá v tlakovém hrnci. V něm vytváříme vyšší tlak, var proto nastává při vyšší teplotě. Vyšší teplota je výhodná, protože jídlo se uvaří dříve. Skupenské teplo varu Skupenské teplo varu je množství tepla, které musíme dodat látce v kapalném skupenství při teplotě varu, aby se změnila na plyn o stejné teplotě. Měrné skupenské teplo varu Měrné skupenské teplo varu je množství tepla, které přijme 1 kg kapalné látky při teplotě varu, aby se změnila na plyn téže látky stejné teploty při normálním tlaku (1, Pa). Měrné skupenské teplo varu značíme lv jednotky J/kg, kj/kg Příklad: měrné skupenské teplo varu vody je kj/kg (lv = kj/kg), to znamená, že na přeměnu 1 kg vody při teplotě varu spotřebujeme kj tepla, abychom získali stejné množství vody v plynném stavu při stejné teplotě za normálního tlaku. Výpočet skupenského tepla varu Skupenské teplo varu značíme Lv a vypočítáme ho ze vztahu Lv = m. lv Kde m je hmotnost a lv je měrné skupenské teplo varu. Příklad 1: Roman si dal vařit půl litru vody na čaj do konvice. Odešel k sobě do pokoje. Když se vrátil, voda se už dlouho vařila a v konvici zůstalo je 0,3 l vody. Kolik tepla se zbytečně spotřebovalo? m = 0,2 kg lv = kj/kg Lv =? (kj) Lv = m. lv Lt = 0, Lt = 451,2 kj Zbytečně se spotřebovalo 451,2 kj tepla. 1) Najdi v tabulkách, při jaké teplotě se začne vařit voda v nadmořské výšce m. 2) V chemické továrně se zahřívá voda při talku 490 kpa. Pomocí tabulek zjisti, při jaké teplotě se začne vařit. 3) Proč lidé na horách musí polévku vařit déle než v nížině? 4) Co má větší vnitřní energii: led o teplotě 0 C nebo voda o stejné teplotě? Proč? 5) Voda v nádobě má 100 C, ale přesto není ve varu. Kdy tento jev může nastat? Vysvětli. 6) Jaký je rozdíl mezi vypařováním a varem? 7) Na čem závisí teplota varu? Proč? 8) Vyhledej v tabulkách teplotu varu při normálním tlaku u látek: kyslík, glycerol, zinek, rtuť, chrom. 9) Vyhledej v tabulkách měrné skupenské teplo varu látek z úlohy 8. 10) Kolik tepla potřebujeme dodat 2 kg vařící vody při normálním tlaku, aby se změnila na páru. Porovnej s teplem, které musíme dodat 12 kg ledu při teplotě tání., aby roztál při normálním tlaku. 11) Kolik tepla je potřeba k přeměně 100 g rtuti při teplotě varu na páru při normálním tlaku. Sublimace a desublimace, graf závislosti teploty na čase Sublimace Jedná se o změnu pevného skupenství přímo na plynné. Příkladem je například sušení prádla za mrazu, sníh se vypařuje. Desublimace Jedná se o změnu plynného skupenství přímo na pevné. Příkladem je například vznik jinovatky. Schéma zachycující změny mezi skupenstvími
6 Graf závislosti teploty na čase Graf zachycuje změnu teploty při zahřívání rtuti. Časový úsek t0 až t1: teplota se zvyšuje, pevná látka se ohřívá až na bod tání Časový úsek t1 až t2: teplota se nemění, všechna energie se spotřebuje na změnu skupenství pevné látky na kapalinu tání Časový úsek t2 až t3: teplota se zvyšuje, kapalina se ohřívá až na bod varu Časový úsek t3 až t4: teplota se nemění, všechna energie se potřebuje na změnu skupenství kapalina na plyn var Časový úsek od t4: teplota se zvyšuje, ohřívá se plyn Popis skupenství v jednotlivých bodech: A pevné B pevné a kapalné probíhá změna skupenství za teploty tání C kapalina právě se všechna pevná rtuť změnila na kapalinu D kapalina E kapalina a plyn probíhá změna skupenství kapaliny na plyn za teploty varu F plyn Příklad: V tabulce doplň hodnoty pro jednotlivé látky a posuď pro uvedené teploty, v jakém je látka skupenství 1) Narýsuj a popiš graf závislosti teploty na čase pro olovo. 2) V zimě vzniká na oknech námraza ledové květy. Z které strany je led? Odkud se tam bere? Jakou změnou skupenství vzniká? Proč vzniká na jednoduchých oknech a málokdy na dvojitých? 3) Popiš následující grafy závislosti teploty na čase a urči, o jakou se jedná látku. 4) V tabulce doplň hodnoty pro jednotlivé látky a posuď pro uvedené teploty, v jakém je látka skupenství
7 Vlastnosti vody Jak se mění objem látek při tuhnutí Většina látek při tuhnutí zmenší svůj objem. Molekuly se při tuhnutí uspořádají těsně vedle sebe a látka má tudíž menší objem. Například hodíme-li kuličku parafínu do rozteklého parafínu, klesá ke dnu. Molekuly vody se při tuhnutí uspořádají velmi neúsporně. Voda tedy při tuhnutí zvětší svůj objem. Led ve vodě plave. Anomálie vody Jedná se o zvláštní vlastnost vody. Její hustota je největší při 4 C. Voda má tedy nejmenší objem právě při 4 C. Kdyby voda neměla tuto zvláštní vlastnost, promrzly by jezera a moře až ke dnu. Ale díky této vlastnosti je u dna vždy teplota 4 C. Proč je anomálie vody důležitá Bez této vlastnosti vody by nebyl možný život v jezerech, řekách, mořích atp. Kdy nám anomálie vody vadí Pokud zamrznou vodovodní trubky, popraskají. Vodovodní trubky musí být dostatečně pod zemí. V domech, kde se v zimě netopí, je třeba vodu vypustit. V zimě na silnicích, voda zatéká do skulin, potom zmrzne a silnice popraská. Pokud se dostane voda do omítky a zmrzne, omítka je poškozená. Proč jsou zmrazené jahody jiného tvaru než čerstvé Buňky obsahují velké množství vody, ta po zmražení zvětší svůj objem. Stěny buněk se roztrhají a jahoda nedrží původní tvar. Rozbitými buněčnými stěnami vytéká šťáva. 1) Když v domě nejsou v pořádku okapy, dostává se dešťová voda do omítky. Co se může stát, když promočená omítka v zimě zmrzne? 2) Kde všude by bylo potřeba v zimě použít nemrznoucí směs, tedy směs, která má teplotu tuhnutí menší než 0 C? 3) Proč má led menší hustotu než voda? Jaký to pro nás má význam? 4) Jak se mění objem většiny látek při tuhnutí? 5) Vysvětli pojem anomálie vody. Jaké jsou klady a jaké zápory této vlastnosti vody?
Vnitřní energie pevné látky < Vnitřní energie kapaliny < Vnitřní energie plynu (nejmenší energie)
 Změny skupenství Při změně tělesa z pevné látky na kapalinu nebo z kapaliny na plyn se jeho vnitřní energie zvyšuje musíme dodávat teplo (zahřívat). Při změně tělesa z plynu na kapalinu, nebo z kapaliny
Změny skupenství Při změně tělesa z pevné látky na kapalinu nebo z kapaliny na plyn se jeho vnitřní energie zvyšuje musíme dodávat teplo (zahřívat). Při změně tělesa z plynu na kapalinu, nebo z kapaliny
F8 - Změny skupenství Číslo variace: 1
 F8 - Změny skupenství Číslo variace: 1 1. K vypařování kapaliny dochází: při každé teplotě v celém jejím objemu pouze při teplotě 100 C v celém objemu kapaliny pouze při normální teplotě a normálním tlaku
F8 - Změny skupenství Číslo variace: 1 1. K vypařování kapaliny dochází: při každé teplotě v celém jejím objemu pouze při teplotě 100 C v celém objemu kapaliny pouze při normální teplotě a normálním tlaku
Název DUM: Změny skupenství v příkladech
 Základní škola národního umělce Petra Bezruče, Frýdek-Místek, tř. T. G. Masaryka 454 Zpracováno v rámci OP VK - EU peníze školám Jednička ve vzdělávání CZ.1.07/1.4.00/21.2759 Název DUM: Změny skupenství
Základní škola národního umělce Petra Bezruče, Frýdek-Místek, tř. T. G. Masaryka 454 Zpracováno v rámci OP VK - EU peníze školám Jednička ve vzdělávání CZ.1.07/1.4.00/21.2759 Název DUM: Změny skupenství
Digitální učební materiál
 Evidenční číslo materiálu: 516 Digitální učební materiál Autor: Mgr. Pavel Kleibl Datum: 22. 1. 2013 Ročník: 8. Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Fyzika Tematický okruh: Energie Téma:
Evidenční číslo materiálu: 516 Digitální učební materiál Autor: Mgr. Pavel Kleibl Datum: 22. 1. 2013 Ročník: 8. Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Fyzika Tematický okruh: Energie Téma:
F - Změny skupenství látek
 F - Změny skupenství látek Určeno jako učební text pro studenty dálkového studia a jako shrnující text pro studenty denního studia. VARIACE 1 Tento dokument byl kompletně vytvořen, sestaven a vytištěn
F - Změny skupenství látek Určeno jako učební text pro studenty dálkového studia a jako shrnující text pro studenty denního studia. VARIACE 1 Tento dokument byl kompletně vytvořen, sestaven a vytištěn
TEPELNÉ JEVY. Mgr. Jan Ptáčník - GJVJ - Fyzika - Tercie
 TEPELNÉ JEVY Mgr. Jan Ptáčník - GJVJ - Fyzika - Tercie Vnitřní energie tělesa Každé těleso se skládá z látek. Látky se skládají z částic. neustálý neuspořádaný pohyb kinetická energie vzájemné působení
TEPELNÉ JEVY Mgr. Jan Ptáčník - GJVJ - Fyzika - Tercie Vnitřní energie tělesa Každé těleso se skládá z látek. Látky se skládají z částic. neustálý neuspořádaný pohyb kinetická energie vzájemné působení
SKUPENSTVÍ LÁTEK Prima - Fyzika
 SKUPENSTVÍ LÁTEK Prima - Fyzika Skupenství látek Pevné skupenství Skupenství látek Skupenství látek Pevné skupenství Kapalné skupenství Skupenství látek Pevné skupenství Kapalné skupenství Plynné skupenství
SKUPENSTVÍ LÁTEK Prima - Fyzika Skupenství látek Pevné skupenství Skupenství látek Skupenství látek Pevné skupenství Kapalné skupenství Skupenství látek Pevné skupenství Kapalné skupenství Plynné skupenství
23_ 2 24_ 2 25_ 2 26_ 4 27_ 5 28_ 5 29_ 5 30_ 7 31_
 Obsah 23_ Změny skupenství... 2 24_ Tání... 2 25_ Skupenské teplo tání... 2 26_ Anomálie vody... 4 27_ Vypařování... 5 28_ Var... 5 29_ Kapalnění... 5 30_ Jak určíš skupenství látky?... 7 31_ Tepelné motory:...
Obsah 23_ Změny skupenství... 2 24_ Tání... 2 25_ Skupenské teplo tání... 2 26_ Anomálie vody... 4 27_ Vypařování... 5 28_ Var... 5 29_ Kapalnění... 5 30_ Jak určíš skupenství látky?... 7 31_ Tepelné motory:...
VÝUKOVÝ MATERIÁL. 0301 Ing. Yvona Bečičková Tematická oblast. Termika Číslo a název materiálu VY_32_INOVACE_0301_0215 Anotace
 VÝUKOVÝ MATERIÁL Identifikační údaje školy Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166, 407 47 Varnsdorf, IČO: 18383874 www.vosassvdf.cz, tel. +420412372632
VÝUKOVÝ MATERIÁL Identifikační údaje školy Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166, 407 47 Varnsdorf, IČO: 18383874 www.vosassvdf.cz, tel. +420412372632
CELKOVÉ OPAKOVÁNÍ UČIVA + ZÁPIS DO ŠKOLNÍHO SEŠITU část 03 VNITŘNÍ ENERGIE, TEPLO.
 CELKOVÉ OPAKOVÁNÍ UČIVA + ZÁPIS DO ŠKOLNÍHO SEŠITU část 03 VNITŘNÍ ENERGIE, TEPLO. 01) Složení látek opakování učiva 6. ročníku: Všechny látky jsou složeny z částic nepatrných rozměrů (tj. atomy, molekuly,
CELKOVÉ OPAKOVÁNÍ UČIVA + ZÁPIS DO ŠKOLNÍHO SEŠITU část 03 VNITŘNÍ ENERGIE, TEPLO. 01) Složení látek opakování učiva 6. ročníku: Všechny látky jsou složeny z částic nepatrných rozměrů (tj. atomy, molekuly,
SKUPENSKÉ PŘEMĚNY POJMY K ZOPAKOVÁNÍ. Testové úlohy varianta A
 Škola: Autor: DUM: Vzdělávací obor: Tematický okruh: Téma: Masarykovo gymnázium Vsetín Mgr. Jitka Novosadová MGV_F_SS_3S3_D11_Z_OPAK_T_Skupenske_premeny_T Člověk a příroda Fyzika Skupenské přeměny Opakování
Škola: Autor: DUM: Vzdělávací obor: Tematický okruh: Téma: Masarykovo gymnázium Vsetín Mgr. Jitka Novosadová MGV_F_SS_3S3_D11_Z_OPAK_T_Skupenske_premeny_T Člověk a příroda Fyzika Skupenské přeměny Opakování
1) Skupenství fáze, forma, stav. 2) 3 druhy skupenství (1 látky): pevné (led) kapalné (voda) plynné (vodní pára)
 SKUPENSTVÍ 1) Skupenství fáze, forma, stav 2) 3 druhy skupenství (1 látky): pevné (led) kapalné (voda) plynné (vodní pára) 3) Pevné látky nemění tvar, objem částice blízko sebe, pohybují se kolem urč.
SKUPENSTVÍ 1) Skupenství fáze, forma, stav 2) 3 druhy skupenství (1 látky): pevné (led) kapalné (voda) plynné (vodní pára) 3) Pevné látky nemění tvar, objem částice blízko sebe, pohybují se kolem urč.
LOGO. Změny skupenství
 Změny skupenství Látka existuje ve třech skupenstvích Pevném Kapalném Plynném Látka může přecházet z jednoho skupenství do druhého. Existují tedy tyto změny skupenství: Změny skupenství plyn sublimace
Změny skupenství Látka existuje ve třech skupenstvích Pevném Kapalném Plynném Látka může přecházet z jednoho skupenství do druhého. Existují tedy tyto změny skupenství: Změny skupenství plyn sublimace
V izolované soustavě nedochází k výměně tepla s okolím. Dokonalá izolovaná soustava neexistuje, nejvíce se jí blíží kalorimetr nebo termoska.
 Teplo a vnitřní energie pracovní list Vnitřní energie Všechny tělesa se skládají z částic, které vykonávají neustálý a neuspořádaný pohyb a které na sebe navzájem silově působí. Částice uvnitř všech těles
Teplo a vnitřní energie pracovní list Vnitřní energie Všechny tělesa se skládají z částic, které vykonávají neustálý a neuspořádaný pohyb a které na sebe navzájem silově působí. Částice uvnitř všech těles
V izolované soustavě nedochází k výměně tepla s okolím. Dokonalá izolovaná soustava neexistuje, nejvíce se jí blíží kalorimetr nebo termoska.
 Teplo a vnitřní energie pracovní list Vnitřní energie Všechny tělesa se skládají z částic, které vykonávají neustálý a neuspořádaný pohyb a které na sebe navzájem silově působí. Částice uvnitř všech těles
Teplo a vnitřní energie pracovní list Vnitřní energie Všechny tělesa se skládají z částic, které vykonávají neustálý a neuspořádaný pohyb a které na sebe navzájem silově působí. Částice uvnitř všech těles
ZMĚNY SKUPENSTVÍ LÁTEK
 ZMĚNY SKUPENSTVÍ LÁTEK TÁNÍ A TUHNUTÍ - OSNOVA Kapilární jevy příklad Skupenské přeměny látek Tání a tuhnutí Teorie s video experimentem Příklad KAPILÁRNÍ JEVY - OPAKOVÁNÍ KAPILÁRNÍ JEVY - PŘÍKLAD Jak
ZMĚNY SKUPENSTVÍ LÁTEK TÁNÍ A TUHNUTÍ - OSNOVA Kapilární jevy příklad Skupenské přeměny látek Tání a tuhnutí Teorie s video experimentem Příklad KAPILÁRNÍ JEVY - OPAKOVÁNÍ KAPILÁRNÍ JEVY - PŘÍKLAD Jak
3.2 Látka a její skupenství
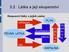 3.2 Látka a její skupenství Skupenství látky a jejich změny sublimace PEVNÁ LÁTKA tání desublimace tuhnutí PLYN vy pa řo vá ní KAPALINA zka pal ňo vá ní Látka a změna vnitřní energie Změna vnitřní energie
3.2 Látka a její skupenství Skupenství látky a jejich změny sublimace PEVNÁ LÁTKA tání desublimace tuhnutí PLYN vy pa řo vá ní KAPALINA zka pal ňo vá ní Látka a změna vnitřní energie Změna vnitřní energie
EU PENÍZE ŠKOLÁM Operační program Vzdělávání pro konkurenceschopnost
 ZÁKLADNÍ ŠKOLA OLOMOUC příspěvková organizace MOZARTOVA 48, 779 00 OLOMOUC tel.: 585 427 142, 775 116 442; fax: 585 422 713 e-mail: kundrum@centrum.cz; www.zs-mozartova.cz Projekt: ŠKOLA RADOSTI, ŠKOLA
ZÁKLADNÍ ŠKOLA OLOMOUC příspěvková organizace MOZARTOVA 48, 779 00 OLOMOUC tel.: 585 427 142, 775 116 442; fax: 585 422 713 e-mail: kundrum@centrum.cz; www.zs-mozartova.cz Projekt: ŠKOLA RADOSTI, ŠKOLA
Vnitřní energie, práce a teplo
 Vnitřní energie, práce a teplo Míček upustíme z výšky na podlahu o Míček padá zvětšuje se, zmenšuje se. Celková mechanická energie se - o Míček se od země odrazí a stoupá vzhůru zvětšuje se, zmenšuje se.
Vnitřní energie, práce a teplo Míček upustíme z výšky na podlahu o Míček padá zvětšuje se, zmenšuje se. Celková mechanická energie se - o Míček se od země odrazí a stoupá vzhůru zvětšuje se, zmenšuje se.
b) Máte dvě stejná tělesa, jak se pozná, že částice jednoho se pohybují rychleji než částice druhého?
 TEPLO OPAKOVÁNÍ a) Co jsou částice a jak se pohybují? b) Máte dvě stejná tělesa, jak se pozná, že částice jednoho se pohybují rychleji než částice druhého? c) Co je vnitřní energie? d) Proč se těleso při
TEPLO OPAKOVÁNÍ a) Co jsou částice a jak se pohybují? b) Máte dvě stejná tělesa, jak se pozná, že částice jednoho se pohybují rychleji než částice druhého? c) Co je vnitřní energie? d) Proč se těleso při
Těleso. Těleso je osoba, rostlina, zvíře nebo věc, které můžeme přisoudit tvar, rozměry, polohu.
 Těleso a látka Těleso Těleso je osoba, rostlina, zvíře nebo věc, které můžeme přisoudit tvar, rozměry, polohu. Z více těles, z více látek.. domácí úkol - 2 experimenty difuze v chladné vodě krystalizace
Těleso a látka Těleso Těleso je osoba, rostlina, zvíře nebo věc, které můžeme přisoudit tvar, rozměry, polohu. Z více těles, z více látek.. domácí úkol - 2 experimenty difuze v chladné vodě krystalizace
Řešení: Fázový diagram vody
 Řešení: 1) Menší hustota ledu v souladu s Archimédovým zákonem zapříčiňuje plování jedu ve vodě. Vodní nádrže a toky tudíž zamrzají shora (od hladiny). Kdyby hustota ledu byla větší než hustota vody, docházelo
Řešení: 1) Menší hustota ledu v souladu s Archimédovým zákonem zapříčiňuje plování jedu ve vodě. Vodní nádrže a toky tudíž zamrzají shora (od hladiny). Kdyby hustota ledu byla větší než hustota vody, docházelo
Tepelná výměna - proudění
 Tepelná výměna - proudění Proč se při míchání horkého nápoje ve sklenici lžičkou nápoj rychleji ochladí - Při větrání místnosti (zejména v zimě) pozorujeme, že chladný vzduch se hromadí při zemi. Vysvětlete
Tepelná výměna - proudění Proč se při míchání horkého nápoje ve sklenici lžičkou nápoj rychleji ochladí - Při větrání místnosti (zejména v zimě) pozorujeme, že chladný vzduch se hromadí při zemi. Vysvětlete
Zavádění inovativních metod a výukových materiálů do přírodovědných předmětů na Gymnáziu v Krnově
 Zavádění inovativních metod a výukových materiálů do přírodovědných předmětů na Gymnáziu v Krnově 06_6_ Změny skupenství látek Ing. Jakub Ulmann 6 Změny skupenství látek 6.1 Tání 6.2 Tuhnutí 6.3 Změna
Zavádění inovativních metod a výukových materiálů do přírodovědných předmětů na Gymnáziu v Krnově 06_6_ Změny skupenství látek Ing. Jakub Ulmann 6 Změny skupenství látek 6.1 Tání 6.2 Tuhnutí 6.3 Změna
ZMĚNY SKUPENSTVÍ LÁTEK ČÁST 01
 ZMĚNY SKUPENSTVÍ LÁTEK ČÁST 01 A) Výklad: Změny skupenství látky Látka se může vyskytovat ve třech různých skupenstvích PEVNÉM, KAPALNÉM nebo PLYNNÉM. Např. voda (H 2 O)- může se vyskytovat jako krystalický
ZMĚNY SKUPENSTVÍ LÁTEK ČÁST 01 A) Výklad: Změny skupenství látky Látka se může vyskytovat ve třech různých skupenstvích PEVNÉM, KAPALNÉM nebo PLYNNÉM. Např. voda (H 2 O)- může se vyskytovat jako krystalický
ABSOLVENTSKÁ PRÁCE ZÁKLADNÍ ŠKOLA, ŠKOLNÍ 24, BYSTRÉ 9. ROČNÍK. Změny skupenství. Filip Skalský, David Řehůřek
 ABSOLVENTSKÁ PRÁCE ZÁKLADNÍ ŠKOLA, ŠKOLNÍ 24, 569 92 BYSTRÉ 9. ROČNÍK Změny skupenství Filip Skalský, David Řehůřek ŠKOLNÍ ROK 2011/2012 Prohlašujeme, že jsme absolventskou práci vypracovali samostatně
ABSOLVENTSKÁ PRÁCE ZÁKLADNÍ ŠKOLA, ŠKOLNÍ 24, 569 92 BYSTRÉ 9. ROČNÍK Změny skupenství Filip Skalský, David Řehůřek ŠKOLNÍ ROK 2011/2012 Prohlašujeme, že jsme absolventskou práci vypracovali samostatně
FYZIKA 6. ročník 1_Látka a těleso _Vlastnosti látek _Vzájemné působení těles _Gravitační síla... 4 Gravitační pole...
 FYZIKA 6. ročník 1_Látka a těleso... 2 2_Vlastnosti látek... 3 3_Vzájemné působení těles... 4 4_Gravitační síla... 4 Gravitační pole... 5 5_Měření síly... 5 6_Látky jsou složeny z částic... 6 7_Uspořádání
FYZIKA 6. ročník 1_Látka a těleso... 2 2_Vlastnosti látek... 3 3_Vzájemné působení těles... 4 4_Gravitační síla... 4 Gravitační pole... 5 5_Měření síly... 5 6_Látky jsou složeny z částic... 6 7_Uspořádání
Kalorimetrická rovnice, skupenské přeměny
 Základní škola Nový Bor, náměstí Míru 128, okres Česká Lípa, příspěvková organizace e mail: info@zsnamesti.cz; www.zsnamesti.cz; telefon: 487 722 010; fax: 487 722 378 Registrační číslo: CZ.1.07/1.4.00/21.3267
Základní škola Nový Bor, náměstí Míru 128, okres Česká Lípa, příspěvková organizace e mail: info@zsnamesti.cz; www.zsnamesti.cz; telefon: 487 722 010; fax: 487 722 378 Registrační číslo: CZ.1.07/1.4.00/21.3267
DUM č. 12 v sadě. 10. Fy-1 Učební materiály do fyziky pro 2. ročník gymnázia
 projekt GML Brno Docens DUM č. 12 v sadě 10. Fy-1 Učební materiály do fyziky pro 2. ročník gymnázia Autor: Vojtěch Beneš Datum: 03.05.2014 Ročník: 1. ročník Anotace DUMu: Kapaliny, změny skupenství Materiály
projekt GML Brno Docens DUM č. 12 v sadě 10. Fy-1 Učební materiály do fyziky pro 2. ročník gymnázia Autor: Vojtěch Beneš Datum: 03.05.2014 Ročník: 1. ročník Anotace DUMu: Kapaliny, změny skupenství Materiály
Měření měrného skupenského tepla tání ledu
 KATEDRA EXPERIMENTÁLNÍ FYZIKY PŘÍRODOVĚDECKÁ FAKULTA UNIVERZITY PALACKÉHO V OLOMOUCI FYZIKÁLNÍ PRAKTIKUM Z MOLEKULOVÉ FYZIKY A TERMODYNAMIKY Měření měrného skupenského tepla tání ledu Úvod Tání, měrné
KATEDRA EXPERIMENTÁLNÍ FYZIKY PŘÍRODOVĚDECKÁ FAKULTA UNIVERZITY PALACKÉHO V OLOMOUCI FYZIKÁLNÍ PRAKTIKUM Z MOLEKULOVÉ FYZIKY A TERMODYNAMIKY Měření měrného skupenského tepla tání ledu Úvod Tání, měrné
KAPALINY. Mgr. Jan Ptáčník - GJVJ - Fyzika - Sekunda
 KAPALINY Mgr. Jan Ptáčník - GJVJ - Fyzika - Sekunda Vlastnosti molekul kapalin V neustálém pohybu Ve stejných vzdálenostech, nejsou ale vázány Působí na sebe silami: odpudivé x přitažlivé Vlastnosti kapalin
KAPALINY Mgr. Jan Ptáčník - GJVJ - Fyzika - Sekunda Vlastnosti molekul kapalin V neustálém pohybu Ve stejných vzdálenostech, nejsou ale vázány Působí na sebe silami: odpudivé x přitažlivé Vlastnosti kapalin
34_Mechanické vlastnosti kapalin... 2 Pascalův zákon _Tlak - příklady _Hydraulické stroje _PL: Hydraulické stroje - řešení...
 34_Mechanické vlastnosti kapalin... 2 Pascalův zákon... 2 35_Tlak - příklady... 2 36_Hydraulické stroje... 3 37_PL: Hydraulické stroje - řešení... 4 38_Účinky gravitační síly Země na kapalinu... 6 Hydrostatická
34_Mechanické vlastnosti kapalin... 2 Pascalův zákon... 2 35_Tlak - příklady... 2 36_Hydraulické stroje... 3 37_PL: Hydraulické stroje - řešení... 4 38_Účinky gravitační síly Země na kapalinu... 6 Hydrostatická
(test version, not revised) 24. listopadu 2010
 Změny skupenství (test version, not revised) Petr Pošta pposta@karlin.mff.cuni.cz 24. listopadu 2010 Obsah Tání Tuhnutí Sublimace a desublimace Vypařování a var. Kondenzace Sytá pára Fázový diagram Vodní
Změny skupenství (test version, not revised) Petr Pošta pposta@karlin.mff.cuni.cz 24. listopadu 2010 Obsah Tání Tuhnutí Sublimace a desublimace Vypařování a var. Kondenzace Sytá pára Fázový diagram Vodní
Termika. Nauka o teple se zabývá měřením teploty, tepla a tepelnými ději.
 Termika Nauka o teple se zabývá měřením teploty, tepla a tepelnými ději. 1. Vnitřní energie Brownův pohyb a difúze látek prokazují, že částice látek jsou v neustálém neuspořádaném pohybu. Proto mají kinetickou
Termika Nauka o teple se zabývá měřením teploty, tepla a tepelnými ději. 1. Vnitřní energie Brownův pohyb a difúze látek prokazují, že částice látek jsou v neustálém neuspořádaném pohybu. Proto mají kinetickou
Voda. Pevné: sníh, led, kroupy, jinovatka, námraza Kapalné Plynné: vodní pára
 Voda Voda je jednou z podmínek pro život. je tekutina bez barvy, chuti a zápachu. na Zemi stále koluje, mění skupenství. vznikla v prehistorickém období a už nevzniká. má chemický vzorec H2O. je obsažena
Voda Voda je jednou z podmínek pro život. je tekutina bez barvy, chuti a zápachu. na Zemi stále koluje, mění skupenství. vznikla v prehistorickém období a už nevzniká. má chemický vzorec H2O. je obsažena
Na libovolnou plochu o obsahu S v atmosférickém vzduchu působí kolmo tlaková síla, kterou vypočítáme ze vztahu: F = pa. S
 MECHANICKÉ VLASTNOSTI PLYNŮ. Co už víme o plynech? Vlastnosti ply nů: 1) jsou snadno stlačitelné a rozpínavé 2) nemají vlastní tvar ani vlastní objem 3) jsou tekuté 4) jsou složeny z částic, které se neustále
MECHANICKÉ VLASTNOSTI PLYNŮ. Co už víme o plynech? Vlastnosti ply nů: 1) jsou snadno stlačitelné a rozpínavé 2) nemají vlastní tvar ani vlastní objem 3) jsou tekuté 4) jsou složeny z částic, které se neustále
Ch - Rozlišování látek
 Ch - Rozlišování látek Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl kompletně
Ch - Rozlišování látek Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl kompletně
Mechanické vlastnosti kapalin a plynů. opakování
 Mechanické vlastnosti kapalin a plynů opakování 1 Jakým směrem se šíří tlak? 2 Chlapci si zhotovili model hydraulického lisu podle obrázku. Na písty ručních stříkaček působí stejnou silou. Který chlapec
Mechanické vlastnosti kapalin a plynů opakování 1 Jakým směrem se šíří tlak? 2 Chlapci si zhotovili model hydraulického lisu podle obrázku. Na písty ručních stříkaček působí stejnou silou. Který chlapec
VÝUKOVÝ MATERIÁL zpracovaný v rámci projektu
 VÝUKOVÝ MATERIÁL zpracovaný v rámci projektu Číslo projektu Škola Šablona klíčové aktivity V/2 Sada Fyzika 6+7 CZ.1.07/1.4.00/21.1825 Základní škola s rozšířenou výukou výtvarné výchovy, Teplice, Koperníkova
VÝUKOVÝ MATERIÁL zpracovaný v rámci projektu Číslo projektu Škola Šablona klíčové aktivity V/2 Sada Fyzika 6+7 CZ.1.07/1.4.00/21.1825 Základní škola s rozšířenou výukou výtvarné výchovy, Teplice, Koperníkova
Energie. Název sady DUM. Člověk a příroda. Vzdělávací oblast. Fyzika. Autor, datum vytvoření Mgr. Zbyněk Šostý, 2012. interaktivní tabule
 Název DUM: Skupenství látek Název sady DUM Číslo DUM Vzdělávací oblast Vzdělávací obor Energie VY_32_INOVACE_14_S1 12 Člověk a příroda Fyzika Ročník 8. Autor, datum vytvoření Mgr. Zbyněk Šostý, 2012 Doporučená
Název DUM: Skupenství látek Název sady DUM Číslo DUM Vzdělávací oblast Vzdělávací obor Energie VY_32_INOVACE_14_S1 12 Člověk a příroda Fyzika Ročník 8. Autor, datum vytvoření Mgr. Zbyněk Šostý, 2012 Doporučená
Termodynamika 2. UJOP Hostivař 2014
 Termodynamika 2 UJOP Hostivař 2014 Skupenské teplo tání/tuhnutí je (celkové) teplo, které přijme pevná látka při přechodu na kapalinu během tání nebo naopak Značka Veličina Lt J Nedochází při něm ke změně
Termodynamika 2 UJOP Hostivař 2014 Skupenské teplo tání/tuhnutí je (celkové) teplo, které přijme pevná látka při přechodu na kapalinu během tání nebo naopak Značka Veličina Lt J Nedochází při něm ke změně
Teplota. fyzikální veličina značka t
 Teplota fyzikální veličina značka t Je to vlastnost předmětů a okolí, kterou je člověk schopen vnímat a přiřadit jí pocity studeného, teplého či horkého. Jak se tato vlastnost jmenuje? Teplota Naše pocity
Teplota fyzikální veličina značka t Je to vlastnost předmětů a okolí, kterou je člověk schopen vnímat a přiřadit jí pocity studeného, teplého či horkého. Jak se tato vlastnost jmenuje? Teplota Naše pocity
Vnitřní energie, práce a teplo
 Vnitřní energie, práce a teplo Zákon zachování mechanické energie V izolované soustavě těles je v každém okamžiku úhrnná mechanická energie stálá. Mění se navzájem jen potenciální energie E p a kinetická
Vnitřní energie, práce a teplo Zákon zachování mechanické energie V izolované soustavě těles je v každém okamžiku úhrnná mechanická energie stálá. Mění se navzájem jen potenciální energie E p a kinetická
Vnitřní energie, teplo, změny skupenství Pracovní listy pro samostatnou práci
 Vnitřní energie, teplo, změny skupenství Pracovní listy pro samostatnou práci Oblast: Člověk a příroda Předmět: Fyzika Tematický okruh: Tělesa, látky a síla Ročník: 8. Klíčová slova: změny skupenství,
Vnitřní energie, teplo, změny skupenství Pracovní listy pro samostatnou práci Oblast: Člověk a příroda Předmět: Fyzika Tematický okruh: Tělesa, látky a síla Ročník: 8. Klíčová slova: změny skupenství,
Molekulová fyzika a termika
 Molekulová fyzika a termika Fyzika 1. ročník Vzdělávání pro konkurenceschopnost Inovace výuky oboru Informační technologie MěSOŠ Klobouky u Brna Mgr. Petr Kučera 1 Obsah témat v kapitole Molekulová fyzika
Molekulová fyzika a termika Fyzika 1. ročník Vzdělávání pro konkurenceschopnost Inovace výuky oboru Informační technologie MěSOŠ Klobouky u Brna Mgr. Petr Kučera 1 Obsah témat v kapitole Molekulová fyzika
12. Termomechanika par, Clausiova-Clapeyronova rovnice, parní tabulky, základni termodynamické děje v oblasti par
 1/18 12. Termomechanika par, Clausiova-Clapeyronova rovnice, parní tabulky, základni termodynamické děje v oblasti par Příklad: 12.1, 12.2, 12.3, 12.4, 12.5, 12.6, 12.7, 12.8, 12.9, 12.10, 12.11, 12.12,
1/18 12. Termomechanika par, Clausiova-Clapeyronova rovnice, parní tabulky, základni termodynamické děje v oblasti par Příklad: 12.1, 12.2, 12.3, 12.4, 12.5, 12.6, 12.7, 12.8, 12.9, 12.10, 12.11, 12.12,
STRUKTURA PEVNÝCH LÁTEK A KAPALIN
 STRUKTURA PEVNÝCH LÁTEK A KAPALIN 19. ZMĚNY SKUPENSTVÍ, FÁZOVÝ DIAGRAM Autor: Ing. Eva Jančová DESS SOŠ a SOU spol. s r. o. SKUPENSTVÍ - Skupenství neboli stav je konkrétní forma látky, charakterizovaná
STRUKTURA PEVNÝCH LÁTEK A KAPALIN 19. ZMĚNY SKUPENSTVÍ, FÁZOVÝ DIAGRAM Autor: Ing. Eva Jančová DESS SOŠ a SOU spol. s r. o. SKUPENSTVÍ - Skupenství neboli stav je konkrétní forma látky, charakterizovaná
SBÍRKA ŘEŠENÝCH FYZIKÁLNÍCH ÚLOH
 SBÍRKA ŘEŠENÝCH FYZIKÁLNÍCH ÚLOH MECHANIKA MOLEKULOVÁ FYZIKA A TERMIKA ELEKTŘINA A MAGNETISMUS KMITÁNÍ A VLNĚNÍ OPTIKA FYZIKA MIKROSVĚTA TERMODYNAMICKÁ TEPLOTNÍ STUPNICE, TEPLOTA 1) Převeďte hodnoty v
SBÍRKA ŘEŠENÝCH FYZIKÁLNÍCH ÚLOH MECHANIKA MOLEKULOVÁ FYZIKA A TERMIKA ELEKTŘINA A MAGNETISMUS KMITÁNÍ A VLNĚNÍ OPTIKA FYZIKA MIKROSVĚTA TERMODYNAMICKÁ TEPLOTNÍ STUPNICE, TEPLOTA 1) Převeďte hodnoty v
5.7 Vlhkost vzduchu 5.7.5 Absolutní vlhkost 5.7.6 Poměrná vlhkost 5.7.7 Rosný bod 5.7.8 Složení vzduchu 5.7.9 Měření vlhkosti vzduchu
 Fázové přechody 5.6.5 Fáze Fázové rozhraní 5.6.6 Gibbsovo pravidlo fází 5.6.7 Fázový přechod Fázový přechod prvního druhu Fázový přechod druhého druhu 5.6.7.1 Clausiova-Clapeyronova rovnice 5.6.8 Skupenství
Fázové přechody 5.6.5 Fáze Fázové rozhraní 5.6.6 Gibbsovo pravidlo fází 5.6.7 Fázový přechod Fázový přechod prvního druhu Fázový přechod druhého druhu 5.6.7.1 Clausiova-Clapeyronova rovnice 5.6.8 Skupenství
VNITŘNÍ ENERGIE. Mgr. Jan Ptáčník - GJVJ - Fyzika - 2. ročník - Termika
 VNITŘNÍ ENERGIE Mgr. Jan Ptáčník - GJVJ - Fyzika - 2. ročník - Termika Zákon zachování energie Ze zákona zachování mechanické energie platí: Ek + Ep = konst. Ale: Vnitřní energie tělesa Každé těleso má
VNITŘNÍ ENERGIE Mgr. Jan Ptáčník - GJVJ - Fyzika - 2. ročník - Termika Zákon zachování energie Ze zákona zachování mechanické energie platí: Ek + Ep = konst. Ale: Vnitřní energie tělesa Každé těleso má
Závislost odporu kovového vodiče na teplotě
 4.2.1 Závislost odporu kovového vodiče na teplotě Předpoklady: 428, délková a objemová roztažnost napětí [V] 1,72 3,43 5,18 6,86 8,57 1,28 proud [A],,47,69,86,11,115,127,14,12,1 Proud [A],8,6,4,2 2 4 6
4.2.1 Závislost odporu kovového vodiče na teplotě Předpoklady: 428, délková a objemová roztažnost napětí [V] 1,72 3,43 5,18 6,86 8,57 1,28 proud [A],,47,69,86,11,115,127,14,12,1 Proud [A],8,6,4,2 2 4 6
TÉMA: Molekulová fyzika a tepelné děje v plynech VNITŘNÍ ENERGIE TĚLESA
 U.. vnitřní energie tělesa ( termodynamické soustavy) je celková kinetická energie neuspořádaně se pohybujících částic tělesa ( molekul, atomů, iontů) a celková potenciální energie vzájemné polohy těchto
U.. vnitřní energie tělesa ( termodynamické soustavy) je celková kinetická energie neuspořádaně se pohybujících částic tělesa ( molekul, atomů, iontů) a celková potenciální energie vzájemné polohy těchto
VÝUKOVÝ MATERIÁL Ing. Yvona Bečičková Tematická oblast. Termika Číslo a název materiálu VY_32_INOVACE_0301_0220 Anotace
 VÝUKOVÝ MATERIÁL Identifikační údaje školy Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166, 407 47 Varnsdorf, IČO: 18383874 www.vosassvdf.cz, tel. +420412372632
VÝUKOVÝ MATERIÁL Identifikační údaje školy Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166, 407 47 Varnsdorf, IČO: 18383874 www.vosassvdf.cz, tel. +420412372632
Půdní voda. *vyplňuje póry v půdách. *nevytváří souvislou hladinu. *je důležitá pro růst rostlin.
 PODPOVRCHOVÁ VODA Půdní voda *vyplňuje póry v půdách. *nevytváří souvislou hladinu. *je důležitá pro růst rostlin. Podzemní voda hromadí se na horninách, které jsou málo propustné pro vodu vytváří souvislou
PODPOVRCHOVÁ VODA Půdní voda *vyplňuje póry v půdách. *nevytváří souvislou hladinu. *je důležitá pro růst rostlin. Podzemní voda hromadí se na horninách, které jsou málo propustné pro vodu vytváří souvislou
PŘÍRODA - VLASTNOSTI LÁTEK. Anotace: Materiál je určen k výuce věd ve 3. ročníku ZŠ. Seznamuje žáky s vlastnostmi látek a jejich měřením.
 PŘÍRODA - VLASTNOSTI LÁTEK Anotace: Materiál je určen k výuce věd ve 3. ročníku ZŠ. Seznamuje žáky s vlastnostmi látek a jejich měřením. Vlastnosti látek všechny věci kolem nás jsou složeny z látek tyto
PŘÍRODA - VLASTNOSTI LÁTEK Anotace: Materiál je určen k výuce věd ve 3. ročníku ZŠ. Seznamuje žáky s vlastnostmi látek a jejich měřením. Vlastnosti látek všechny věci kolem nás jsou složeny z látek tyto
STRUKTURA KAPALIN STRUKTURA KAPALIN
 Předmět: Ročník: Vytvořil: Datum: FYZIKA PRVNÍ MGR. JÜTTNEROVÁ 18. 5. 2013 Název zpracovaného celku: STRUKTURA KAPALIN STRUKTURA KAPALIN Struktura kapalin, povrchová vrstva kapaliny: Každá molekula kapaliny
Předmět: Ročník: Vytvořil: Datum: FYZIKA PRVNÍ MGR. JÜTTNEROVÁ 18. 5. 2013 Název zpracovaného celku: STRUKTURA KAPALIN STRUKTURA KAPALIN Struktura kapalin, povrchová vrstva kapaliny: Každá molekula kapaliny
Molekulová fyzika a termika:
 Molekulová fyzika a termika: 1. Měření teploty: 2. Délková roztažnost a Objemová roztažnost látek 3. Bimetal 4. Anomálie vody 5. Částicová stavba látek, vlastnosti látek 6. Atomová hmotnostní konstanta
Molekulová fyzika a termika: 1. Měření teploty: 2. Délková roztažnost a Objemová roztažnost látek 3. Bimetal 4. Anomálie vody 5. Částicová stavba látek, vlastnosti látek 6. Atomová hmotnostní konstanta
II. VNITŘNÍ ENERGIE, PRÁCE A TEPLO
 II. VNITŘNÍ ENERGIE, PRÁCE A TEPLO 2.1 Vnitřní energie tělesa a) celková energie (termodynamické) soustavy E tvořena kinetickou energií E k jejího makroskopického pohybu jako celku potenciální energií
II. VNITŘNÍ ENERGIE, PRÁCE A TEPLO 2.1 Vnitřní energie tělesa a) celková energie (termodynamické) soustavy E tvořena kinetickou energií E k jejího makroskopického pohybu jako celku potenciální energií
R9.1 Molární hmotnost a molární objem
 Fyzika pro střední školy I 73 R9 M O L E K U L O V Á F Y Z I K A A T E R M I K A R9.1 Molární hmotnost a molární objem V čl. 9.5 jsme zavedli látkové množství jako fyzikální veličinu, která charakterizuje
Fyzika pro střední školy I 73 R9 M O L E K U L O V Á F Y Z I K A A T E R M I K A R9.1 Molární hmotnost a molární objem V čl. 9.5 jsme zavedli látkové množství jako fyzikální veličinu, která charakterizuje
Chemie. Mgr. Petra Drápelová Mgr. Jaroslava Vrbková. Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou
 Chemie Mgr. Petra Drápelová Mgr. Jaroslava Vrbková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou Složení látek VY_32_INOVACE_03_3_02_CH Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou SLOŽENÍ LÁTEK Fyzikálním kritériem
Chemie Mgr. Petra Drápelová Mgr. Jaroslava Vrbková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou Složení látek VY_32_INOVACE_03_3_02_CH Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou SLOŽENÍ LÁTEK Fyzikálním kritériem
6. Jaký je výkon vařiče, který ohřeje 1 l vody o 40 C během 5 minut? Měrná tepelná kapacita vody je W)
 TEPLO 1. Na udržení stále teploty v místnosti se za hodinu spotřebuje 4,2 10 6 J tepla. olik vody proteče radiátorem ústředního topení za hodinu, jestliže má voda při vstupu do radiátoru teplotu 80 ºC
TEPLO 1. Na udržení stále teploty v místnosti se za hodinu spotřebuje 4,2 10 6 J tepla. olik vody proteče radiátorem ústředního topení za hodinu, jestliže má voda při vstupu do radiátoru teplotu 80 ºC
Mol. fyz. a termodynamika
 Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
KAPALINY. Mgr. Jan Ptáčník - GJVJ - Fyzika - Termika - 2. ročník
 KAPALINY Mgr. Jan Ptáčník - GJVJ - Fyzika - Termika - 2. ročník Kapaliny Krátkodosahové uspořádání molekul. Molekuly kmitají okolo rovnovážných poloh. Při zvýšení teploty se zmenšuje doba setrvání v rovnovážné
KAPALINY Mgr. Jan Ptáčník - GJVJ - Fyzika - Termika - 2. ročník Kapaliny Krátkodosahové uspořádání molekul. Molekuly kmitají okolo rovnovážných poloh. Při zvýšení teploty se zmenšuje doba setrvání v rovnovážné
4IS09F8 změna skupenství.notebook. Registrační číslo projektu: CZ.1.07/1.4.00/21.3075. Šablona: III/2. Sada: VY_32_INOVACE_4IS Pořadové číslo: 09
 Registrační číslo projektu: CZ.1.07/1.4.00/21.3075 Šablona: III/2 Sada: VY_32_INOVACE_4IS Pořadové číslo: 09 Ověření ve výuce Třída: 8.A Datum: 20.2.2013 1 Změna skupenství Předmět: Fyzika Ročník: 8. ročník
Registrační číslo projektu: CZ.1.07/1.4.00/21.3075 Šablona: III/2 Sada: VY_32_INOVACE_4IS Pořadové číslo: 09 Ověření ve výuce Třída: 8.A Datum: 20.2.2013 1 Změna skupenství Předmět: Fyzika Ročník: 8. ročník
Termodynamika - určení měrné tepelné kapacity pevné látky
 I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 3 Termodynamika - určení měrné
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 3 Termodynamika - určení měrné
MOLEKULOVÁ FYZIKA A TERMODYNAMIKA
 MOLEKULOVÁ FYZIKA A TERMODYNAMIKA 2 metody zkoumání látek na základě vnějších projevů: I. KINETICKÁ TEORIE LÁTEK -studium vlastností látek na základě vnitřní struktury, pohybu a vzájemného působení jednotlivých
MOLEKULOVÁ FYZIKA A TERMODYNAMIKA 2 metody zkoumání látek na základě vnějších projevů: I. KINETICKÁ TEORIE LÁTEK -studium vlastností látek na základě vnitřní struktury, pohybu a vzájemného působení jednotlivých
Fyzikální vzdělávání. 1. ročník. Učební obor: Kuchař číšník Kadeřník. Implementace ICT do výuky č. CZ.1.07/1.1.02/02.0012 GG OP VK
 Fyzikální vzdělávání 1. ročník Učební obor: Kuchař číšník Kadeřník 1 2 Termika 2.1Teplota, teplotní roztažnost látek 2.2 Teplo a práce, přeměny vnitřní energie tělesa 2.3 Tepelné motory 2.4 Struktura pevných
Fyzikální vzdělávání 1. ročník Učební obor: Kuchař číšník Kadeřník 1 2 Termika 2.1Teplota, teplotní roztažnost látek 2.2 Teplo a práce, přeměny vnitřní energie tělesa 2.3 Tepelné motory 2.4 Struktura pevných
LOGO. Struktura a vlastnosti kapalin
 Struktura a vlastnosti kapalin Povrchová vrstva kapaliny V přírodě velmi často pozorujeme, že se povrch kapaliny, např. vody, chová jako pružná blána, která unese např. hmyz Vysvětlení: Molekuly kapaliny
Struktura a vlastnosti kapalin Povrchová vrstva kapaliny V přírodě velmi často pozorujeme, že se povrch kapaliny, např. vody, chová jako pružná blána, která unese např. hmyz Vysvětlení: Molekuly kapaliny
ARCHIMÉDŮV ZÁKON. Archimédův zákon
 ARCHIMÉDŮV ZÁKON. Už víme, že v kapalině zvedneme těleso s menší námahou než na vzduchu. Na ponořené těleso totiž působí svisle vzhůru vztlaková síla, která těleso nadlehčuje (působí proti gravitační síle).
ARCHIMÉDŮV ZÁKON. Už víme, že v kapalině zvedneme těleso s menší námahou než na vzduchu. Na ponořené těleso totiž působí svisle vzhůru vztlaková síla, která těleso nadlehčuje (působí proti gravitační síle).
POZNÁMKA: V USA se používá ještě Fahrenheitova teplotní stupnice. Převodní vztahy jsou vzhledem k volbě základních bodů složitější: 9 5
 TEPLO, TEPLOTA Tepelný stav látek je charakterizován veličinou termodynamická teplota T Jednotkou je kelvin T K Mezi Celsiovou a Kelvinovou teplotní stupnicí existuje převodní vztah T 73,5C t POZNÁMKA:
TEPLO, TEPLOTA Tepelný stav látek je charakterizován veličinou termodynamická teplota T Jednotkou je kelvin T K Mezi Celsiovou a Kelvinovou teplotní stupnicí existuje převodní vztah T 73,5C t POZNÁMKA:
Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH. atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na +
 OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
Teplotní roztažnost. Teorie. Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti
 Teplotní roztažnost Teorie Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti Teplotní roztažnost souvisí se změnou rozměru zahřívaného těles Při zahřívání se tělesa zvětšují, při ochlazování
Teplotní roztažnost Teorie Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti Teplotní roztažnost souvisí se změnou rozměru zahřívaného těles Při zahřívání se tělesa zvětšují, při ochlazování
Názvosloví Kvalita Výroba Kondenzace Teplosměnná plocha
 Názvosloví Kvalita Výroba Kondenzace Teplosměnná plocha Názvosloví páry Pro správné pochopení funkce parních systémů musíme znát základní pojmy spojené s párou. Entalpie Celková energie, příslušná danému
Názvosloví Kvalita Výroba Kondenzace Teplosměnná plocha Názvosloví páry Pro správné pochopení funkce parních systémů musíme znát základní pojmy spojené s párou. Entalpie Celková energie, příslušná danému
Transportní jevy v plynech Reálné plyny Fázové přechody Kapaliny
 Transportní jevy v plynech Reálné plyny Fázové přechody Kapaliny Hustota toku Zatím jsme studovali pouze soustavy, které byly v rovnovážném stavu není-li soustava v silovém poli, je hustota částic stejná
Transportní jevy v plynech Reálné plyny Fázové přechody Kapaliny Hustota toku Zatím jsme studovali pouze soustavy, které byly v rovnovážném stavu není-li soustava v silovém poli, je hustota částic stejná
Základní poznatky. Teplota Vnitřní energie soustavy Teplo
 Molekulová fyzika a termika Základní poznatky Základní poznatky Teplota Vnitřní energie soustavy Teplo Termika = část fyziky zabývající se studiem vlastností látek a jejich změn souvisejících s teplotou
Molekulová fyzika a termika Základní poznatky Základní poznatky Teplota Vnitřní energie soustavy Teplo Termika = část fyziky zabývající se studiem vlastností látek a jejich změn souvisejících s teplotou
Archimédův zákon I
 3.1.11 Archimédův zákon I Předpoklady: 030110 Pomůcky: pingpongový míček, měděná kulička, skleněný válec s víčkem od skleničky, vajíčko, sůl, tři kádinky, barvy na duhu, průhledná brčka Př. 1: Do vody
3.1.11 Archimédův zákon I Předpoklady: 030110 Pomůcky: pingpongový míček, měděná kulička, skleněný válec s víčkem od skleničky, vajíčko, sůl, tři kádinky, barvy na duhu, průhledná brčka Př. 1: Do vody
Laboratorní práce č. 2: Určení měrného skupenského tepla tání ledu
 Přírodní vědy moderně a interaktivně FYZIKA 1. ročník šestiletého studia Laboratorní práce č. 2: Určení měrného skupenského tepla tání ledu ymnázium Přírodní vědy moderně a interaktivně FYZIKA 1. ročník
Přírodní vědy moderně a interaktivně FYZIKA 1. ročník šestiletého studia Laboratorní práce č. 2: Určení měrného skupenského tepla tání ledu ymnázium Přírodní vědy moderně a interaktivně FYZIKA 1. ročník
Fyzika je přírodní věda, která zkoumá a popisuje zákonitosti přírodních jevů.
 Fyzika je přírodní věda, která zkoumá a popisuje zákonitosti přírodních jevů. Násobky jednotek název značka hodnota kilo k 1000 mega M 1000000 giga G 1000000000 tera T 1000000000000 Tělesa a látky Tělesa
Fyzika je přírodní věda, která zkoumá a popisuje zákonitosti přírodních jevů. Násobky jednotek název značka hodnota kilo k 1000 mega M 1000000 giga G 1000000000 tera T 1000000000000 Tělesa a látky Tělesa
Termika termika - teplota, teplo a práce termodynamické zákony tepelná vodivost - tepelná kapacita skupenské teplo
 Termika termika - teplota, teplo a práce termodynamické zákony tepelná vodivost - tepelná kapacita skupenské teplo teplo, teplota, práce, tepelná vodivost Teplo část vnitřní energie tělesa = součet kinetické
Termika termika - teplota, teplo a práce termodynamické zákony tepelná vodivost - tepelná kapacita skupenské teplo teplo, teplota, práce, tepelná vodivost Teplo část vnitřní energie tělesa = součet kinetické
Vnitřní energie. Teplo. Tepelná výměna.
 Vnitřní energie. Teplo. Tepelná výměna. A) Výklad: Vnitřní energie vnitřní energie označuje součet celkové kinetické energie částic (tj. rotační + vibrační + translační energie) a celkové polohové energie
Vnitřní energie. Teplo. Tepelná výměna. A) Výklad: Vnitřní energie vnitřní energie označuje součet celkové kinetické energie částic (tj. rotační + vibrační + translační energie) a celkové polohové energie
1.6.4 Vaříme. Předpoklady: 010603. Pomůcky: vařič (nejlépe plynový nebo plynový kahan), teploměr Vernier, PC, kastrůlek,
 1.6.4 Vaříme Předpoklady: 010603 Pomůcky: vařič (nejlépe plynový nebo plynový kahan), teploměr Vernier, PC, kastrůlek, Pedagogická poznámka: Naměření pokusu by nemělo trvat déle než 20 minut. 20 minut
1.6.4 Vaříme Předpoklady: 010603 Pomůcky: vařič (nejlépe plynový nebo plynový kahan), teploměr Vernier, PC, kastrůlek, Pedagogická poznámka: Naměření pokusu by nemělo trvat déle než 20 minut. 20 minut
ZÁKLADNÍ ŠKOLA KOLÍN II., KMOCHOVA 943 škola s rozšířenou výukou matematiky a přírodovědných předmětů
 ZÁKLADNÍ ŠKOLA KOLÍN II., KMOCHOVA 943 škola s rozšířenou výukou matematiky a přírodovědných předmětů Autor Číslo materiálu Mgr. Vladimír Hradecký 8_F_1_13 Datum vytvoření 2. 11. 2011 Druh učebního materiálu
ZÁKLADNÍ ŠKOLA KOLÍN II., KMOCHOVA 943 škola s rozšířenou výukou matematiky a přírodovědných předmětů Autor Číslo materiálu Mgr. Vladimír Hradecký 8_F_1_13 Datum vytvoření 2. 11. 2011 Druh učebního materiálu
VÝUKOVÝ MATERIÁL VÝUKOVÝ MATERIÁL
 VÝUKOVÝ MATERIÁL VÝUKOVÝ MATERIÁL Identifikační údaje školy Číslo projektu Název projektu Číslo a název šablony Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166,
VÝUKOVÝ MATERIÁL VÝUKOVÝ MATERIÁL Identifikační údaje školy Číslo projektu Název projektu Číslo a název šablony Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166,
Úlohy z fyziky 8. ROČNÍK
 Úlohy z fyziky Úlohy jsou čerpány z publikace Tématické prověrky z učiva fyziky základní školy autorů Jiřího Bohuňka a Evy Hejnové s ilustracemi Martina Maška (vydavatelství Prometheus 2005), která odpovídá
Úlohy z fyziky Úlohy jsou čerpány z publikace Tématické prověrky z učiva fyziky základní školy autorů Jiřího Bohuňka a Evy Hejnové s ilustracemi Martina Maška (vydavatelství Prometheus 2005), která odpovídá
Doprovodné otázky pro studenty, kvízy, úkoly aj.
 Doprovodné otázky pro studenty, kvízy, úkoly aj. Otázky: 1. Jak se projeví menší hustota ledu v porovnání s vodou při zamrzání vodních nádrží a toků? 2. Jaký jev se nazývá anomálie vody? 3. Vysvětlete
Doprovodné otázky pro studenty, kvízy, úkoly aj. Otázky: 1. Jak se projeví menší hustota ledu v porovnání s vodou při zamrzání vodních nádrží a toků? 2. Jaký jev se nazývá anomálie vody? 3. Vysvětlete
STRUKTURA A VLASTNOSTI KAPALIN
 STRUKTURA A VLASTNOSTI KAPALIN Struktura kapalin je něco mezi plynem a pevnou látkou Částice kmitají ale mohou se také přemísťovat Zvýšením teploty se a tím se zvýší tekutost kapaliny Malé vzdálenosti
STRUKTURA A VLASTNOSTI KAPALIN Struktura kapalin je něco mezi plynem a pevnou látkou Částice kmitají ale mohou se také přemísťovat Zvýšením teploty se a tím se zvýší tekutost kapaliny Malé vzdálenosti
POKUSY SE SUCHÝM LEDEM
 POKUSY SE SUCHÝM LEDEM Václav Piskač, Brno 2013 Suchý led je pevné skupenství oxidu uhličitého. Suchý led se mu říká proto, že při atmosferickém tlaku nemá kapalné skupenství (k tomu se ještě o něco níže
POKUSY SE SUCHÝM LEDEM Václav Piskač, Brno 2013 Suchý led je pevné skupenství oxidu uhličitého. Suchý led se mu říká proto, že při atmosferickém tlaku nemá kapalné skupenství (k tomu se ještě o něco níže
Změna skupenství, Tání a tuhnutí, Sublimace a desublimace Vypařování a kapalnění Sytá pára, Fázový diagram, Vodní pára
 Zěny skupenství átek Zěna skupenství, Tání a tuhnutí, Subiace a desubiace Vypařování a kapanění Sytá pára, Fázový diagra, Vodní pára Zěna skupenství = fyzikání děj, při které se ění skupenství átky Skupenství
Zěny skupenství átek Zěna skupenství, Tání a tuhnutí, Subiace a desubiace Vypařování a kapanění Sytá pára, Fázový diagra, Vodní pára Zěna skupenství = fyzikání děj, při které se ění skupenství átky Skupenství
Změna objemu těles při zahřívání teplotní roztažnost
 Změna objemu těles při zahřívání teplotní roztažnost 6. třída - Teplota Změna objemu pevných těles při zahřívání Vezmeme plastové pravítko, prkénko a dva hřebíky. Hřebíky zatlučeme do prkénka tak, aby
Změna objemu těles při zahřívání teplotní roztažnost 6. třída - Teplota Změna objemu pevných těles při zahřívání Vezmeme plastové pravítko, prkénko a dva hřebíky. Hřebíky zatlučeme do prkénka tak, aby
Zavádění inovativních metod a výukových materiálů do přírodovědných předmětů na Gymnáziu v Krnově. 06_5_ Struktura a vlastnosti kapalin
 Zavádění inovativních metod a výukových materiálů do přírodovědných předmětů na Gymnáziu v Krnově 06_5_ Struktura a vlastnosti kapalin Ing. Jakub Ulmann 5 Struktura a vlastnosti kapalin 5.1 Povrchové napětí
Zavádění inovativních metod a výukových materiálů do přírodovědných předmětů na Gymnáziu v Krnově 06_5_ Struktura a vlastnosti kapalin Ing. Jakub Ulmann 5 Struktura a vlastnosti kapalin 5.1 Povrchové napětí
III/2 Inovace a zkvalitnění výuky prostřednictvím ICT. Pracovní list č.3 k prezentaci Křivky chladnutí a ohřevu kovů
 Číslo projektu CZ.1.07/1.5.00/34.0514 Číslo a název šablony klíčové aktivity III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Tematická oblast Strojírenská technologie, vy_32_inovace_ma_22_06 Autor
Číslo projektu CZ.1.07/1.5.00/34.0514 Číslo a název šablony klíčové aktivity III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Tematická oblast Strojírenská technologie, vy_32_inovace_ma_22_06 Autor
EU peníze středním školám digitální učební materiál
 EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
1/ Vlhký vzduch
 1/5 16. Vlhký vzduch Příklad: 16.1, 16.2, 16.3, 16.4, 16.5, 16.6, 16.7, 16.8, 16.9, 16.10, 16.11, 16.12, 16.13, 16.14, 16.15, 16.16, 16.17, 16.18, 16.19, 16.20, 16.21, 16.22, 16.23 Příklad 16.1 Teplota
1/5 16. Vlhký vzduch Příklad: 16.1, 16.2, 16.3, 16.4, 16.5, 16.6, 16.7, 16.8, 16.9, 16.10, 16.11, 16.12, 16.13, 16.14, 16.15, 16.16, 16.17, 16.18, 16.19, 16.20, 16.21, 16.22, 16.23 Příklad 16.1 Teplota
VÝUKOVÝ MATERIÁL. 0301 Ing. Yvona Bečičková Termika VY_32_INOVACE_0301_0212 Teplotní roztažnost látek. Fyzika 2. ročník, učební obory Bez příloh
 VÝUKOVÝ MATERIÁL Identifikační údaje školy Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166, 407 47 Varnsdorf, IČO: 18383874 www.vosassvdf.cz, tel. +420412372632
VÝUKOVÝ MATERIÁL Identifikační údaje školy Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166, 407 47 Varnsdorf, IČO: 18383874 www.vosassvdf.cz, tel. +420412372632
FYZIKA 6. ročník 2. část
 FYZIKA 6. ročník 2. část 23_Hmotnost tělesa... 2 24_Rovnoramenné váhy.... 3 25_Hustota... 4 26_Výpočet hustoty látky... 4 27_Výpočet hustoty látky příklady... 6 28_Výpočet hmotnosti tělesa příklady...
FYZIKA 6. ročník 2. část 23_Hmotnost tělesa... 2 24_Rovnoramenné váhy.... 3 25_Hustota... 4 26_Výpočet hustoty látky... 4 27_Výpočet hustoty látky příklady... 6 28_Výpočet hmotnosti tělesa příklady...
SEZNAM POKUSŮ TEPLO 1 NÁVODY NA POKUSY MĚŘENÍ TEPLOT. Měření teplot. Používání teploměru. (1.1.) Kalibrace teploměru. (1.2.
 TEPLO TA1 419.0008 TEPLO 1 SEZNAM POKUSŮ MĚŘENÍ TEPLOT Měření teplot. Používání teploměru. (1.1.) Kalibrace teploměru. (1.2.) KALORIMETRIE Teplotní rovnováha. (2.1.) Studium kalorimetru. (2.2.) Křivka
TEPLO TA1 419.0008 TEPLO 1 SEZNAM POKUSŮ MĚŘENÍ TEPLOT Měření teplot. Používání teploměru. (1.1.) Kalibrace teploměru. (1.2.) KALORIMETRIE Teplotní rovnováha. (2.1.) Studium kalorimetru. (2.2.) Křivka
T e p l o - přehled Převzato z materiálů ZŠ Ondřejov -
 T e p l o - přehled Převzato z materiálů ZŠ Ondřejov - http://www.zsondrejov.cz/vyuka/ Opakování částice Molekuly, atomy, ionty, elektrony, protony, neutrony. Částice se nestále pohybují, pohyb se nazývá
T e p l o - přehled Převzato z materiálů ZŠ Ondřejov - http://www.zsondrejov.cz/vyuka/ Opakování částice Molekuly, atomy, ionty, elektrony, protony, neutrony. Částice se nestále pohybují, pohyb se nazývá
Fyzikální praktikum 1
 Fyzikální praktikum 1 FJFI ČVUT v Praze Úloha: č. 5 - Kalibrace teploměru, skupenské teplo Jméno: Ondřej Finke Datum měření: 6.10.2014 Kruh: FE Skupina: 4 Klasifikace: 1. Pracovní úkoly 1.1 - Kalibrace
Fyzikální praktikum 1 FJFI ČVUT v Praze Úloha: č. 5 - Kalibrace teploměru, skupenské teplo Jméno: Ondřej Finke Datum měření: 6.10.2014 Kruh: FE Skupina: 4 Klasifikace: 1. Pracovní úkoly 1.1 - Kalibrace
Fyzikální učebna vybavená audiovizuální technikou, interaktivní tabule, fyzikální pomůcky
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Fyzika (FYZ) Molekulová fyzika, termika 2. ročník, sexta 2 hodiny týdně Fyzikální učebna vybavená audiovizuální technikou, interaktivní tabule, fyzikální pomůcky
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Fyzika (FYZ) Molekulová fyzika, termika 2. ročník, sexta 2 hodiny týdně Fyzikální učebna vybavená audiovizuální technikou, interaktivní tabule, fyzikální pomůcky
LOGO. Molekulová fyzika
 Molekulová fyzika Molekulová fyzika Molekulová fyzika vysvětluje fyzikální jevy na základě znalosti jejich částicové struktury. Jejím základem je kinetická teorie látek (KTL). KTL obsahuje tři tvrzení:
Molekulová fyzika Molekulová fyzika Molekulová fyzika vysvětluje fyzikální jevy na základě znalosti jejich částicové struktury. Jejím základem je kinetická teorie látek (KTL). KTL obsahuje tři tvrzení:
