vzhledem k postižení jaterních funkcí a rozsahu tumoru je však možná jen u necelé třetiny pacientů.
|
|
|
- Vojtěch Svoboda
- před 9 lety
- Počet zobrazení:
Transkript
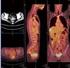
1 Transarteriální chemoembolizace hepatocelulárního karcinomu MUDr. Jarmila Laštovičková, ZRIR IKEM Transarteriální chemoembolizace (TACE) je stále častěji užívanou metodou paliativní léčby u pacientů s hypervaskularizovanými maligními tumory jater, u nichž není možná resekce. Spojuje efekt ischemizace nádoru s vysokými lokálními koncentracemi chemoterapeutika. Cílem TACE před transplantací jater je kontrolovat růst tumoru v období, kdy jsou pacienti zařazeni na čekací listině, snížit riziko rekurence tumoru po provedené transplantaci a v některých případech umožnit zařazení pacientů původně přesahujících kritéria k OLTx na čekací listinu po zmenšení tumoru. Hepatocelulární karcinom (HCC) je onemocnění, jehož incidence v posledních desetiletích celosvětově výrazně narůstá. V % vzniká HCC u pacientů s jaterní cirhózou na podkladě hepatitidy (HBV a HCV) nebo zvýšené konzumace alkoholu. Neléčený HCC má velmi špatnou prognózu s meridiánem přežití 6 9 měsíců. Metodou první volby v léčbě HCC je resekce tumoru, vzhledem k postižení jaterních funkcí a rozsahu tumoru je však možná jen u necelé třetiny pacientů. Transarteriální chemoembolizace (TACE) představuje metodu paliativní léčby hepatocelulárního karcinomu (HCC), která spojuje efekt ischemizace nádoru s lokálním cytotoxickým efektem chemoterapeutika. Využívá toho, že zatímco normální jaterní parenchym získává většinu zásobující krve (60 80 %) z portálního řečiště, maligní nádory jater jsou téměř výhradně zásobeny větvemi hepatické artérie. TACE je indikována jako standardní léčba u pacientů s neresekabilním hypervaskularizovaným středně pokročilým tumorem bez vaskulární invaze nebo extrahepatálních metastáz. TACE má statis- Sytící se ložisko tumoru na CT vyšetření Angiografie a. hepatica a superelektivní katetrizace přívodné tepny ložiska tumoru Angiografie a. hepatica a superelektivní katetrizace přívodné tepny ložiska tumoru 26
2 ticky významně lepší výsledky přežití pacientů než prostá embolizace. Výhodou TACE je dosažení vysoké koncentrace chemoterapeutika v tumoru, která v netoxických dávkách není možná při systémové chemoterapii. Je známo, že jak hypoxie, tak toxický efekt protinádorového léčiva omezují rozvoj neovaskularizace. Jako konvenční TACE (c-tace) je označována chemoembolizace emulzí lipiodolu s chemoterapeutikem, jako DEB-TACE aplikace drug-eluting bead (částic uvolňujících léčivo) s navázaným chemoterapeutikem. Konvenční TACE však bývá často kritizována jako nestandardizovaný výkon (různá chemoterapeutika a dávky, různý embolizační materiál). DEB-TACE dovoluje standardizaci techniky s delším kontaktem chemoterapeutika s nádorovými buňkami. Z částic užívaných k chemoembolizaci máme na našem pracovišti zkušenosti s DC Beads. Je to léčivo uvolňující embolizační systém, který byl vyvinut pro dosažení vysoké koncentrace léčiva v tumoru při zachování nízké koncentrace v systémové cirkulaci. DC Beads jsou měkké sférické biokompatibilní neresorbovatelné hydrogelové částice na bázi polyvinylalkoholu, schopné navázat antracyclinové deriváty v předem určené dávce. V terapii HCC se jako chemoterapeutikum užívá doxorubicin, jehož doporučená bezpečná dávka je mg pro pacienta (50 75 mg/ m 2 povrchu těla). Léčivo se z vazby na částice uvolňuje více než 14 dnů po aplikaci, maximální koncentrace je dosaženo třetí den po chemoembolizaci a na vysokých hodnotách se hladina chemoterapeutika v tumoru udržuje minimálně 7 dnů. Výběr velikosti částic se řídí vaskularizací tumoru a přítomností a-v zkratů. Dnes jsou nejčastěji používány částice velikosti nebo μm. Studie na zvířatech prokázala při použití malých částic rozsáhlé nekrózy, při použití velkých částic byly nekrózy méně komplexní. Aplikace malých částic s využitím efektu toxické i ischemické nekrózy je doporučována při superselektivním uložení katetru, ale není vhodná, pokud katetr není zaveden dostatečně selektivně. Při DEB-TACE nebyly pozorovány žádné komplikace systémové toxicity doxorubicinu. V randomizované prospektivní studii byla prokázána neoddiskutovatelná role ischemie v rozvoji nekrózy tumoru a pozitivní efekt lokálně aplikovaného chemoterapeutika navázaného na DC Beads u pacientů ve středně pokročilém stadiu HCC. V další randomizované multicentrické studii byla srovnávána i c-tace a DEB-TACE. Mezi oběma skupinami pacientů nebyl nalezen statisticky významný rozdíl v efektu léčby, i když trend k lepším výsledkům u DEB TACE byl patrný. Statisticky významná u DEB-TACE byla však redukce poškození jaterních buněk a nežádoucích vedlejších účinků doxorubicinu. Transplantace jater je dnes standardní léčebnou metodou pro pacienty s akutním i chronickým ireverzibilním jaterním selháním a některými poruchami metabolismu. Nádorová onemocnění jsou kontraindikací transplantace, jedinou výjimku představují právě některé nádory jater, z nichž nejčastější je hepatocelulární karcinom (HCC). Ortotopická transplantace jater pak nemocným nabízí nejen kauzální léčbu HCC, ale současně i základního jaterního inzerce Po TACE se ložisko nesytí Kontrolní CT za měsíc po výkonu s nekrotickým ložiskem
3 onemocnění. U pacientů s HCC v časném stadiu v terénu cirhózy s nemožností resekce tumoru zařazených na čekací listinu k transplantaci jater je stále častěji užívána transarteriální chemoembolizace. Jejím úkolem je omezit růst tumoru a vaskulární invazi během čekání pacienta na transplantaci a zabránit vyřazení pacientů z čekací listiny a dále jako neoadjuvantní terapie zlepšit potransplantační výsledky snížením rizika rekurence nádorového onemocnění. V některých případech je cílem TACE zmenšením nádorových ložisek umožnit zařazení na čekací listinu pacientovi, který původně nesplňoval kritéria pro transplantaci. Přestože užití TACE v předtransplantačním období u pacientů s HCC je obecně akceptováno, neexistuje dosud žádná randomizovaná kontrolovaná studie, která by srovnávala pacienty transplantované pro HCC bez neoadjuvantní terapie a s ní. Transarteriální chemoembolizace se provádí v místním znecitlivění z třísla, z femorální tepny. Preformovaným katerem je sondován trunku coeliacus a provedena selektivní katetrizace větve hepatické tepny zásobující tumor. Pokud je prováděna DEB-TACE chemoembolizačními částicemi DC Beads (Biocompatibles UK), je nutné před vlastním výkonem na částice dle protokolu navázat doxorubicin (1 dávka DC Beads je smíchána s 25 ml doxorubicinu (2 mg/ml), který se během 9 hodin naváže na částice z 98 %). Před vlastní aplikací je odstraněna přebytečná tekutina (zbylý objem nemá být menší než 5 ml) a přidána neionická kontrastní látka v odpovídajícím množství. Dávka doxorubicinu při jedné aplikaci je obvykle mg. Cílem chemoembolizace je dosažení zástavy toku v tumoru a přívodné tepně. Kontrolní CT vyšetření se provádí za 4 6 týdnů po výkonu. U DEB-TACE se hodnotí rozsah nekrózy nádoru. Udává se, že výrazný klinický benefit z TACE mají pacienti, kteří jsou na čekací listině k transplantaci déle než 6 měsíců. Literatura: 1. Laštovičková J, Peregrin H. Transarteriální chemoembolizace hepatocelulárního karcinomu u pacientů indikovaných k transplantaci jater. Ces Radiol 2010; 64(2): Llovet JM, Real MI, Montana X, et al. Arterial embolisation or chemoembolisation versus symptomatic treatment in patiens with unresectable hepatocellural carcinoma: a randomised controlled trial. Lancet 2002; 359: Malagari K. Drug-eluting particles in the treatment of HCC: chemoembolization with doxorubicin-loaded DC Bead Expert Rev. Anticancer ther. 2008; 8 (10): Malagari K, Pomoni M, Kelekis A, et al. Prospective randomized Comparison of Chemoembolization with Doxorubicin-Eluting Beds and Bland Embolization with BeadBlock for Hepatocellular Carcinoma. Cardiovasc Intervent Radiol 2009; published online: 24 November Lammer J, Malagari K, Vogl T, et al. Prospective Randomized Study of Doxorubicin-Eluting.Bead Embolization in the Treatment of Hepatocellular Carcinoma: Results of the PRECISION V Study. Cardiovasc Intervent Radiol 2009; published on line: 12 November Oliverius M, Studeník P. Transplantace jater pro hepatocelulární karcinom. Folia Gastroenterol Hepatol 2005; 3 (1): Golzarian J, Sun S, Sharafuddin MJ. Vascular Embolotherapy. Springer-Verlag Berlin Heidelberg 2006; Llovet JM, Futer J, Bruix J. The Barcelona Approach: Diagnosis, Staging, and Treatment of Hepatocellular Carcinoma Liver Transplantation 2004; 2 (10): Llovet JM, Real MI, Montana X, et al. Arterial embolisation or chemoembolisation versus symptomatic treatment in patiens with unresectable hepatocellural carcinoma: a randomised controlled trial. Lancet 2002; 359: Malagari K. Drug-eluting particles in the treatment of HCC: chemoembolization with doxorubicin-loaded DC Bead Expert Rev. Anticancer ther. 2008; 8 (10): Malagari K, Pomoni M, Kelekis A, et al. Prospective randomized Comparison of Chemoembolization with Doxorubicin-Eluting Beds and Bland Embolization with BeadBlock for Hepatocellular Carcinoma. Cardiovasc Intervent Radiol 2009; published online: 24 November Lammer J, Malagari K, Vogl T, et al. Prospective Randomized Study of Doxorubicin-Eluting.Bead Embolization in the Treatment of Hepatocellular Carcinoma: Results of the PRECISION V Study. Cardiovasc Intervent Radiol 2009; published on line: 12 November Mazzaferro V, Regalia E, Doci R, et al. Liver transplantation for the treatment of small hepatocellular carcinomas in patiens with cirrhosis. N Engl J med 1996; 334: Belghiti J, Carr BI, Greig PD, et al. Treatment before Liver Transplantation for HCC. Annals of Surgical Oncology 2008; 15 (4): Kim DJ, Choi MS, Lee JH, et al. Milan kriteria are useful predictors for favorable outcomes in hepatocellular carcinoma patiens undergoing liver transplantation after transarterial chemoembolization. World J Gastroenterol 2006; 12(43): Hoffman K, Glimm H, Radeleff B, et al. Prospective, randomized, double-blind, multi-center, Phase III clinical study on transarterial chemoembolization (TACE) combined with Sorafenib versus TACE plus placebo in patiens with hepatocellular cancer before liver transplantation. BMC Cancor 2008; 8:
4 Spolupráce lékárny pri ˇ lécbe ˇ ˇ hepatocelulárního karcinomu Mgr. Petr Palouš, Oddělení přípravy cytostatik Fakultní Thomayerovy nemocnice s poliklinikou v Praze Tereza Tesařová, farmaceutická asistentka K zajímavým přípravám na Oddělení přípravy cytostatik ve Fakultní Thomayerově nemocnici s poliklinikou patří příprava chemoembolizačních částic s navázaným cytostatikem. Jedná se o technologicky náročný postup, který bychom vám na tomto místě chtěli blíže představit. DC Beads měkké sférické biokompatibilní neresorbovatelné hydrogelové, záporně nabité částice vyrobené z polyvinylalkoholu jsou schopné prostřednictvím sulfonových skupin vázat kladně nabitá cytostatika doxorubicin (využívá se k léčbě hypervaskularizovaného hepatocelulárního karcinomu primárního i metastatického) nebo irrinotekan (k léčbě metastázujícího kolorektálního karcinomu). Chemoembolizační polymerové částice DC Beads jsou výrobkem britské společnosti Biocompatibles UK, zastoupené na našem trhu firmou Vamex. Produkt je vyráběn ve čtyřech velikostech a pro snadnou identifikaci má každý rozměr svoji charakteristickou barvu obalu: μm (žlutá), μm (modrá), μm (červená) a μm (zelená). Každá ampulka obsahuje 6 ml sterilního fyziologického roztoku, ve kterém jsou dispergovány 2 ml částic. Pro spolupráci s pracovištěm IKEM používáme výhradně částice o velikosti μm a μm. Vázaným cytostatikem bývá doxorubicin v koncentraci 2 mg/ml. Vlastní příprava probíhá následovně: Na základě požadavku kliniky připraví farmaceut průvodku se stručným návodem přípravy a vytiskne signaturu se všemi údaji, umožňujícími snadnou identifikaci produktu. Průvodku, signaturu a 50ml stříkačku vloží do košíku a přidá ampulku s chemoembolizačními částicemi požadované velikosti. Jako cytostatikum se přidá ampule doxorubicinu (25 ml/50 mg). K natáhnutí roztoků do stříkačky používáme speciální jehlu s odnímatelným filtrem. Takto připravený košík ošetříme dezinfekčním roztokem na povrchy, s obsahem ethanolu a propanolu (Desprej). a odešleme materiálovou propustí do čistých prostor s izolátory. Farmaceu- 29
5 tický asistent zkontroluje správnost údajů na průvodce a signatuře. Do košíku přidá zatavený sáček se sterilním igelitovým obalem a košík vloží do vstupní komory izolátoru. Po 2 minutách provede následně tyto kroky: 1. Z jehly se odstraní filtr a farmaceutický asistent natáhne celý objem ampule s částicemi injekční stříkačkou. 2. Na jehlu nasadí filtr a stříkačku obrátí jehlou kolmo vzhůru tak, aby se částice mohly usadit na jejím pístu. Po jejich sedimentaci pomalu vytlačí připravující pracovník roztok ze stříkačky. Filtr jehly propustí pouze čistý roztok, částice zůstávají ve stříkačce. 3. Do stříkačky s částicemi se poté natáhne několik ml koncentrovaného roztoku doxorubicinu (2 mg/ ml). Opatrnou manipulací se stříkačkou otáčí, aby došlo k rovnoměrnému promísení roztoku cytostatika s částicemi. Po promísení se dotáhne zbytek cytostatika v celkovém objemu 25 ml. K navázání více jak 98 % doxorubicinu na částice dochází u velikosti μm po 5 hodinách, u velikosti μm po 9 hodinách. Příprava musí být prováděna v dostatečném časovém předstihu. 4. Asistent sejme jehlu ze stříkačky a uzavře ji stoperem. Takto připravený roztok je v izolátoru označen signaturou a vložen do sterilního igelitového sáčku. 5. Po opuštění čistých prostor farmaceut zkontroluje celistvost balení, barvu roztoku, těsnost uzavření a sáček zataví. 6. Takto může být transportován na oddělení a skladován při teplotě 2 8 C po dobu nutnou k navázání částic. 7. V čase aplikace se ze stříkačky odstraní zbytkový objem tak, aby ve stříkačce zůstalo nejméně 5 ml roztoku. 8. Přidá se neionická kontrastní látka a roztok se aplikuje. Skladován v této podobě může být v chladu po dobu 24 hodin. Cílem chemoembolizace je omezit nebo zcela zastavit výživu tumoru ucpáním přívodné cévy. Kombinace ischemizace nádoru s lokálním cytotoxickým účinkem chemoterapeutika tak přináší lepší výsledky než samotná systémová aplikace cytostatik. Literatura: 1. Technologické postupy OPC FTN. 2. Informační materiály fy Biocompatibles, UK. inzerce Lunaldin nový lék pro pacienty s průlomovou bolestí Novou možností léčby pro pacienty trpící průlomovou bolestí je přípravek Lunaldin s unikátní technologií FAST (fast acting sublingual technology) jedná se o rychle působící sublingvální mukoadhezivní tabletu s obsahem fentanylu, jež byla cíleně vyvinuta pro léčbu pacientů s tímto typem bolesti. Průlomová bolest je definována jako náhlé, přechodné a krátkodobé vzplanutí silné bolesti, u pacientů s dobře kontrolovanou základní bolestí léčenou opioidy. Průměrná doba do nástupu maximální intenzity bolesti je 3 5 minut a délka epizod je v průměru minut. Při použití perorálního morfinu, nastupuje analgetický účinek nejdříve za minut. U velké skupiny pacientů se tak nezachytí rychlý nástup ataky průlomové bolesti. Zároveň účinek přetrvává po dobu více jak 4 hodin, což může vést k potenciaci nežádoucích účinků spolu se základní analgezií. Optimální lék pro léčbu průlomové bolesti by naopak měl mít rychlý nástup účinku a rychlé odeznění působení, silný analgetický efekt, možnost jednoduché neinvazivní aplikace a spolehlivý bezpečnostní profil. Lunaldin je podáván pod jazyk, kde je produkováno velké množství slin, což umožňuje velmi rychlé (10 15s) rozpuštění tabletky a to i u pacientů s výraznou hyposalivací. Tableta je složena z nosiče, účinné látky a mukoadhezivní složky. Po rozpadu tabletky na předem definované jednotky dochází k přilnutí těchto jednotek ke sliznici. Sublinguální sliznice se vyznačuje vysokou vaskularizací a permeabilitou, což umožňuje rychlou absorpci a rychlou distribuci účinné látky. Nástup analgetického účinku Lunaldinu je tak již po několika minutách. Přípravek je dostupný v silách od 100 do 800 μg, což usnadňuje snadnou titraci a individualizaci léčby dle potřeb pacientů. Pro snadnější orientaci mají tabletky různé tvary. Výhodami přípravku Lunaldin jsou zejména rychlá absorpce (díky technologii FAST), rychlý nástup účinku (v klinických studiích byl statisticky významný rozdíl ve srovnání s placebem zaznamenán po 10 minutách od podání, trend ke snížení intenzity bolesti již po 5 minutách od podání), možnost optimalizace a individualizace léčby (široká titrační škála μg umožňuje individualizaci dávky) a jednoduchá aplikace (pacienta není nutné polohovat, lék si může aplikovat kdykoliv samostatně a může jej užívat i při obtížích s polykáním). Průlomová bolest je častým problém u pacientů s chronickou nádorovou bolestí, byť kontrolovanou opioidy. V současné době máme k jejímu tlumení k dispozici pouze s.c. podávaný morfin v čase potřeby nebo intranasální fentanyl. Sublingvální tableta s rychlým nástupem účinku a v několika sílách, umožňujících snadné titrování účinné dávky, vyplňuje mezeru na trhu, která vznikla ukončením distribuce tablet Sevredolu. Komentář: PharmDr. Irena Netíková, Ph.D.
6 Rychlá úleva od bolesti Řešení pro pacienty s průlomovou bolestí ZKRÁCENÁ INFORMACE O PŘÍPRAVKU Lunaldin 100 (200, 300, 400, 600, 800) mikrogramů sublingvální tablety Složení: fentanylum 100 µg, 200 µg, 300 µg, 400 µg, 600 µg, 800 µg Indikace: Zvládnutí průlomové bolesti u dospělých pacientů užívajících opiáty vzhledem ke chronickým bolestem vyvolaným nádorem. Dávkování: Lunaldin lze podávat pouze pacientům, kteří jsou považováni za tolerantní vůči své opiátové terapii chronické nádorové bolesti. Pacienty lze považovat za tolerantní, pokud užívají přinejmenším 60 mg perorálního morfinu denně, 25 µg transdermálního fentanylu za hodinu, nebo analgeticky ekvivalentní dávku jiného opiátu týden nebo déle. Lunaldin sublingvální tablety podávejte přímo pod jazyk, a to co nejhlouběji. Tablety není vhodné polykat; je nutno je ponechat pod jazykem do úplného rozpuštění bez kousání nebo sání, bez jídla a pití, dokud se sublingvální tableta zcela nerozpustí. U pacientů, kteří mají sucho v ústech, lze sliznici před užitím Lunaldinu zvlhčit vodou. Optimální dávku stanovte titrací směrem nahoru, dle individuálních potřeb pacienta. Všichni pacienti musí terapii zahájit jedinou 100 µg sublingvální tabletou. Pokud se do minut od podání jediné tablety nedostaví přiměřená analgezie, lze podat doplňkovou (druhou) 100 µg tabletu. Pokud se do minut od podání první dávky nedostaví přiměřená analgezie, je třeba zvážit při příští epizodě průlomové bolesti zvýšení dávky na následující vyšší lékovou sílu. V dávkách 400 µg a vyšších je vhodné nahradit u dodatečné (druhé) tablety sílu 100 µg za 200 µg. Při jediné epizodě průlomové bolesti během titrační fáze nepodávejte více než dvě (2) sublingvální tablety.přechod z jiných fentanylových přípravků nelze provést v dávce 1:1, a to vzhledem k různým absorpčním profilům. Při titraci je nutno vzít v potaz klinické potřeby pacienta, věk a přidružená onemocnění. Viz úplná informace o léku. Kontraindikace: Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku. Použití Lunaldinu je kontraindikováno u pacientů bez předchozí zkušenosti s opiáty hrozí riziko životu nebezpečné respirační deprese. Těžká respirační deprese nebo těžká obstrukce plic. Upozornění: Před zahájením terapie je důležité stabilizovat užívání dlouhodobě působících opiátů. Je třeba opatrnosti u pacientů: s chronickým obstrukčním plicním onemocněním nebo jinými potížemi, které zvyšují náchylnost na respirační deprese, se zvýšenou citlivostí na nitrolební účinky hyperkapnie, se zraněním hlavy, s bradyarytmiemi, s hypovolémií a hypotenzí, u starších pacientů a u pacientů s dysfunkcí jater nebo ledvin. Viz úplná informace o léku. Interakce: fentanyl je třeba podávat opatrně s inhibitory CYP3A4. s jinými látkami tlumícími činnost CNS,. Nedoporučuje se současné užívání inhibitorů MAO, alkoholu a částečných agonistů a antagonistů opiátů (například buprenorfin, nalbufin, pentazocin). Viz úplná informace o léku. Těhotenství a kojení: Fentanyl by neměl být během těhotenství podáván, pokud to není nezbytně nutné. Fentanyl nepoužívejte během porodu (ani císařským řezem). Kojícím ženám pouze v případě, pokud přínos jasně převýší potenciální rizika pro matku i dítě. Účinky na schopnost řídit a obsluhovat stroje: pacienti mají být upozorněni, že nemají řídit ani obsluhovat stroje, pokud budou během léčby trpět závratí, budou ospalí nebo budou mít rozmazané nebo dvojité vidění. Nežádoucí účinky: Nejzávažnějšími nežádoucími účinky při užívání opiátů jsou respirační deprese, hypotenze a šok. Jiné velmi běžně hlášené nežádoucí účinky jsou: nevolnost, zvracení, zácpa, bolesti hlavy, spavost, únava a závratě, pocení. Uchovávání: Uchovávejte při teplotě do 25 C. a v původním obalu, aby byl přípravek chráněn před vlhkostí. Balení: dětské bezpečnostní blistry uložené v papírové krabičce. Obal jednotlivých lékových sil je barevně odlišen. Velikost balení: balení 10 nebo 30 sublingválních tablet. Na trhu nemusí být všechny velikosti balení. Držitel registrace: Gedeon Richter Plc., Gyömrői út , Budapešť, Maďarsko. Datum poslední revize textu: Výdej přípravku je vázán na lékařský předpis. Přípravek je hrazen z prostředků veřejného zdravotního pojištění. Dříve než přípravek předepíšete, seznamte se prosím se Souhrnem informací o přípravku. Tato zkrácená informace je platná ke dni tisku materiálu Další informace o přípravku získáte na adrese společnosti Gedeon Richter Marketing ČR, s.r.o., Na Strži 65, Praha 4, tel. recepce , fax: , info@richtergedeon.cz, www. richtergedeon.cz. Lékařský informační servis:
původní práce Souhrn Laštovičková J, Peregrin J. Transarterial chemoembolisation of the hepatocellular carcinoma in patients indicated to liver
 Transarteriální chemoembolizace hepatocelulárního karcinomu u pacientů indikovaných k transplantaci jater Transarterial chemoembolisation of the hepatocellular carcinoma in patients indicated to liver
Transarteriální chemoembolizace hepatocelulárního karcinomu u pacientů indikovaných k transplantaci jater Transarterial chemoembolisation of the hepatocellular carcinoma in patients indicated to liver
Edukační materiály PRŮVODCE VYDÁVÁNÍM PRO LÉKÁRNÍKA. sublingvální tableta. 67, 133, 267, 400, 533, 800 mikrogramů.
 Edukační materiály sublingvální tableta 67, 133, 267, 400, 533, 800 mikrogramů fentanyli citras PRŮVODCE VYDÁVÁNÍM PRO LÉKÁRNÍKA Informace pro lékárníka. Před výdejem přípravku Vellofent si, prosím, přečtěte
Edukační materiály sublingvální tableta 67, 133, 267, 400, 533, 800 mikrogramů fentanyli citras PRŮVODCE VYDÁVÁNÍM PRO LÉKÁRNÍKA Informace pro lékárníka. Před výdejem přípravku Vellofent si, prosím, přečtěte
Downstaging hepatocelulárního karcinomu transplantation. hepatocelulárního karcinomu před
 Downstaging hepatocelulárního karcinomu před transplantací jater Downstaging of hepatocellular carcinoma before liver transplantation původní práce Jarmila Laštovičková Jan H. Peregrin Základna radiodiagnostiky
Downstaging hepatocelulárního karcinomu před transplantací jater Downstaging of hepatocellular carcinoma before liver transplantation původní práce Jarmila Laštovičková Jan H. Peregrin Základna radiodiagnostiky
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
po 5 letech ... s excelentním kosmetickým výsledkem 2
 ... s excelentním kosmetickým výsledkem 2 pred lécbou 6. týden 12. týden po 1 roku po 3 letech po 5 letech Správný výber pro Vaše pacienty se superficiálními BCC - krátkodobá lécba s velice dobrým kosmetickým
... s excelentním kosmetickým výsledkem 2 pred lécbou 6. týden 12. týden po 1 roku po 3 letech po 5 letech Správný výber pro Vaše pacienty se superficiálními BCC - krátkodobá lécba s velice dobrým kosmetickým
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum
 Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
7. PRIMÁRNÍ NÁDORY JATER
 7. PRIMÁRNÍ NÁDORY JATER Primární karcinomy jater vznikají z hepatocytů (hepatocelulární karcinom HCC) nebo z nitrojaterních žlučovodů (intrahepatální cholangiokarcinom ICC). 7.1 Hepatocelulární karcinom
7. PRIMÁRNÍ NÁDORY JATER Primární karcinomy jater vznikají z hepatocytů (hepatocelulární karcinom HCC) nebo z nitrojaterních žlučovodů (intrahepatální cholangiokarcinom ICC). 7.1 Hepatocelulární karcinom
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
Astma a alergie v roce 2010 a novinky pro rok 2011
 Dne 30. 11. 2010 od 17:30 hodin Restaurace Větruše Fibichova 392 Ústí nad Labem Moderuje: Doc. MUDr. Vít Petrů, CSc. 17:30 Úvodní slovo Doc. MUDr. Vít Petrů, CSc. 17:45 Astma kazuistiky a novinky v léčbě
Dne 30. 11. 2010 od 17:30 hodin Restaurace Větruše Fibichova 392 Ústí nad Labem Moderuje: Doc. MUDr. Vít Petrů, CSc. 17:30 Úvodní slovo Doc. MUDr. Vít Petrů, CSc. 17:45 Astma kazuistiky a novinky v léčbě
6. PRIMÁRNÍ NÁDORY JATER, ŽLUČNÍKU A ŽLUČOVÝCH CEST (C22-24)
 6. PRIMÁRNÍ NÁDORY JATER, ŽLUČNÍKU A ŽLUČOVÝCH CEST (C22-24) Primární karcinomy jater vznikají z hepatocytů (hepatocelulární karcinom HCC) z nitrojaterních žlučovodů (intrahepatální cholangiokarcinom ICC).
6. PRIMÁRNÍ NÁDORY JATER, ŽLUČNÍKU A ŽLUČOVÝCH CEST (C22-24) Primární karcinomy jater vznikají z hepatocytů (hepatocelulární karcinom HCC) z nitrojaterních žlučovodů (intrahepatální cholangiokarcinom ICC).
KONTROLNÍ SEZNAM ČINNOSTÍ PRO PŘEDEPISUJÍCÍ LÉKÁRNÍKY
 KONTROLNÍ SEZNAM ČINNOSTÍ PRO PŘEDEPISUJÍCÍ LÉKÁRNÍKY Seznam činností pro lékárníka vydávajícího přípravek Instanyl nosní sprej s jednou dávkou Následující činnosti musejí být provedeny před tím, než je
KONTROLNÍ SEZNAM ČINNOSTÍ PRO PŘEDEPISUJÍCÍ LÉKÁRNÍKY Seznam činností pro lékárníka vydávajícího přípravek Instanyl nosní sprej s jednou dávkou Následující činnosti musejí být provedeny před tím, než je
KONTROLNÍ SEZNAM ČINNOSTÍ PRO PŘEDEPISUJÍCÍ LÉKAŘE
 KONTROLNÍ SEZNAM ČINNOSTÍ PRO PŘEDEPISUJÍCÍ LÉKAŘE Seznam činností pro lékaře předepisující přípravek Instanyl nosní sprej s jednou dávkou Následující činnosti musejí být provedeny před tím, než je přípravek
KONTROLNÍ SEZNAM ČINNOSTÍ PRO PŘEDEPISUJÍCÍ LÉKAŘE Seznam činností pro lékaře předepisující přípravek Instanyl nosní sprej s jednou dávkou Následující činnosti musejí být provedeny před tím, než je přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls195423/2011 1. NÁZEV PŘÍPRAVKU Lunaldin 100 mikrogramů sublingvální tablety Lunaldin 200 mikrogramů sublingvální tablety Lunaldin 300 mikrogramů
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls195423/2011 1. NÁZEV PŘÍPRAVKU Lunaldin 100 mikrogramů sublingvální tablety Lunaldin 200 mikrogramů sublingvální tablety Lunaldin 300 mikrogramů
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 400 mg + 40 mg. čípky PROCTO-GLYVENOL. 50 mg/g + 20 mg/g. rektální krém
 sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
Edukační materiály. KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře
 Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Úzkost u seniorů. Stres, úzkost a nespavost ve stáří. Úzkost a poruchy chování ve stáří. Sborník přednášek z Jarního sympozia 2011
 Úzkost u seniorů Stres, úzkost a nespavost ve stáří MUDr. Petr Hrubeš Hradec Králové Úzkost a poruchy chování ve stáří MUDr. Vanda Franková Dobřany Sborník přednášek z Jarního sympozia 2011 Moderní trendy
Úzkost u seniorů Stres, úzkost a nespavost ve stáří MUDr. Petr Hrubeš Hradec Králové Úzkost a poruchy chování ve stáří MUDr. Vanda Franková Dobřany Sborník přednášek z Jarního sympozia 2011 Moderní trendy
EDUKAČNÍ MATERIÁLY. KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
Celkové shrnutí vědeckého hodnocení přípravku Atacand Plus a související názvy (viz Příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÝCH INFORMACÍ PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 14 Vědecké závěry Celkové
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÝCH INFORMACÍ PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 14 Vědecké závěry Celkové
7. PRIMÁRNÍ NÁDORY JATER
 7. PRIMÁRNÍ NÁDORY JATER Primární karcinomy jater vznikají z hepatocytů (hepatocelulární karcinom HCC) nebo z nitrojaterních žlučovodů (intrahepatální cholangiokarcinom ICC). 7.1 Hepatocelulární karcinom
7. PRIMÁRNÍ NÁDORY JATER Primární karcinomy jater vznikají z hepatocytů (hepatocelulární karcinom HCC) nebo z nitrojaterních žlučovodů (intrahepatální cholangiokarcinom ICC). 7.1 Hepatocelulární karcinom
INFORMACE: INFORMACE PRO UŽIVATELE. DIPIDOLOR, 7,5 mg/ml, injekční roztok Piritramidum
 INFORMACE: INFORMACE PRO UŽIVATELE DIPIDOLOR, 7,5 mg/ml, injekční roztok Piritramidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
INFORMACE: INFORMACE PRO UŽIVATELE DIPIDOLOR, 7,5 mg/ml, injekční roztok Piritramidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 OZNAČENÍ NA OBALU ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Text na krabičku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU suspenze Paracetamolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum 120 mg v 5 ml suspenze 3. SEZNAM
OZNAČENÍ NA OBALU ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Text na krabičku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU suspenze Paracetamolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum 120 mg v 5 ml suspenze 3. SEZNAM
PŘED POUŽITÍM SI PŘEČTĚTE PŘÍBALOVOU INFORMACI. COLDREX MAXGRIP CITRON je určený pro perorální podání ve formě teplého nápoje.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU (krabička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU prášek pro přípravu perorálního roztoku Paracetamolum, Phenylephrini hydrochloridum, Acidum ascorbicum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU (krabička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU prášek pro přípravu perorálního roztoku Paracetamolum, Phenylephrini hydrochloridum, Acidum ascorbicum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH
Deprese u seniorů. Pohled geriatra na depresi u seniorů. Léčba deprese ve stáří zdroj uspokojení i frustrace lékaře
 Deprese u seniorů Pohled geriatra na depresi u seniorů Doc. MUDr. Iva Holmerová, Ph.D. Praha Léčba deprese ve stáří zdroj uspokojení i frustrace lékaře Prim. MUDr. Richard Krombholz Praha Sborník přednášek
Deprese u seniorů Pohled geriatra na depresi u seniorů Doc. MUDr. Iva Holmerová, Ph.D. Praha Léčba deprese ve stáří zdroj uspokojení i frustrace lékaře Prim. MUDr. Richard Krombholz Praha Sborník přednášek
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Kelapril 5mg 7x14tbl.
 Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Opakované resekce jater pro metastázy kolorektálního karcinomu
 Opakované resekce jater pro metastázy kolorektálního karcinomu Visokai V., Lipská L., Mráček M., Levý M. Chirurgická klinika 1. LF UK a Fakultní Thomayerovy nemocnice v Praze přednosta Doc. MUDr. V. Visokai,
Opakované resekce jater pro metastázy kolorektálního karcinomu Visokai V., Lipská L., Mráček M., Levý M. Chirurgická klinika 1. LF UK a Fakultní Thomayerovy nemocnice v Praze přednosta Doc. MUDr. V. Visokai,
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU Lahev s obsahem 300 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Levetiracetam UCB 100 mg/ml, perorální roztok levetiracetamum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU Lahev s obsahem 300 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Levetiracetam UCB 100 mg/ml, perorální roztok levetiracetamum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
PŘÍLOHA III ZMĚNY PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Poznámka:
 PŘÍLOHA III ZMĚNY PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Změny v souhrnu údajů o přípravku a příbalové informaci možná bude následně třeba nechat (v případě potřeby
PŘÍLOHA III ZMĚNY PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Změny v souhrnu údajů o přípravku a příbalové informaci možná bude následně třeba nechat (v případě potřeby
KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin. Informace pro lékaře EU
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Listopad 2016 Informace pro lékaře EU Tento léčivý přípravek podléhá dalšímu
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Listopad 2016 Informace pro lékaře EU Tento léčivý přípravek podléhá dalšímu
Od opia k melatoninu aneb Práce s nespavým pacientem
 Soubor pøednášek ze semináøe Od opia k melatoninu aneb Práce s nespavým pacientem Semináøe se konají na 14 místech ÈR v období únor duben 2009 1. Péèe o pacienta s nespavostí Diagnostika a nefarmakologická
Soubor pøednášek ze semináøe Od opia k melatoninu aneb Práce s nespavým pacientem Semináøe se konají na 14 místech ÈR v období únor duben 2009 1. Péèe o pacienta s nespavostí Diagnostika a nefarmakologická
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
Jeden sáček obsahuje 5 g sacharosy a 118 mg sodíku. Obsahuje zdroj fenylalaninu. Obsahuje oranžovou žluť (E110) a azorubin (E122).
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU (krabička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU prášek pro perorální roztok Paracetamolum, Phenylephrini hydrochloridum, Acidum ascorbicum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU (krabička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU prášek pro perorální roztok Paracetamolum, Phenylephrini hydrochloridum, Acidum ascorbicum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných látek viz bod 6.1.
 Sp. zn. sukls155368/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Silkis mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných
Sp. zn. sukls155368/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Silkis mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných
Informace pro zdravotnické odborníky
 EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
CZ PAR. QUETIAPINI FUMARAS Seroquel. UK/W/0004/pdWS/001 NL/W/0004/pdWS/001
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
NeuroBloc. botulinový toxin typu B injekční roztok, U/ml
 NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
6. PRIMÁRNÍ NÁDORY JATER, ŽLUČNÍKU A ŽLUČOVÝCH CEST (C22-24)
 6. PRIMÁRNÍ NÁDORY JATER, ŽLUČNÍKU A ŽLUČOVÝCH CEST (C22-24) Primární karcinomy jater vznikají z hepatocytů (hepatocelulární karcinom HCC) nebo z nitrojaterních žlučovodů (intrahepatální cholangiokarcinom
6. PRIMÁRNÍ NÁDORY JATER, ŽLUČNÍKU A ŽLUČOVÝCH CEST (C22-24) Primární karcinomy jater vznikají z hepatocytů (hepatocelulární karcinom HCC) nebo z nitrojaterních žlučovodů (intrahepatální cholangiokarcinom
Časná a pozdní toxicita léčby lymfomů. David Belada FN a LF UK v Hradci Králové
 Časná a pozdní toxicita léčby lymfomů David Belada FN a LF UK v Hradci Králové Co je to toxicita léčby? Toxicita léčby lymfomů Jaký je rozdíl mezi časnou a pozdní toxicitou? Dá se toxicita předvídat? Existuje
Časná a pozdní toxicita léčby lymfomů David Belada FN a LF UK v Hradci Králové Co je to toxicita léčby? Toxicita léčby lymfomů Jaký je rozdíl mezi časnou a pozdní toxicitou? Dá se toxicita předvídat? Existuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Chemoembolizace jaterní
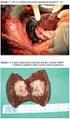 Chemoembolizace jaterní - principem je navázání cytostatika na koloidní nosič o velikosti přesahující průměr jaterní kapiláry, přičemž tyto částice musí být pomalu vstřebatelné, koloidní nosič dočasně
Chemoembolizace jaterní - principem je navázání cytostatika na koloidní nosič o velikosti přesahující průměr jaterní kapiláry, přičemž tyto částice musí být pomalu vstřebatelné, koloidní nosič dočasně
Nebido EDUKAČNÍ MATERIÁL. Jak úspěšně aplikovat přípravek. (testosterone undecanoate)
 EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls13958/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU Zofran Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls13958/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ondansetronum, 16 mg v jednom čípku. 3. LÉKOVÁ
1. NÁZEV PŘÍPRAVKU Zofran Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls13958/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ondansetronum, 16 mg v jednom čípku. 3. LÉKOVÁ
Bezpečnost a účinnost přípravku Neoclarityn 5 mg potahované tablety u dětí mladších 12 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
 1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
Duras P, Šlauf F, Novák M, Ferda J, Skalický. T, Liška V, Sutnar A, Třeška V. Transarterial
 Transarteriální chemoembolizace jater pomocí částic uvolňujících léčivo naše zkušenosti Transarterial chemoembolization using drug eluting beads our experience původní práce Petr Duras 1 František Šlauf
Transarteriální chemoembolizace jater pomocí částic uvolňujících léčivo naše zkušenosti Transarterial chemoembolization using drug eluting beads our experience původní práce Petr Duras 1 František Šlauf
Přecitlivělost na léčivé látky nebo na kteroukoliv z pomocných látek uvedených v bodě 6.1.
 sp.zn.: sukls50035/2010, sukls106419/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 g Selachiorum
sp.zn.: sukls50035/2010, sukls106419/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 g Selachiorum
PŘÍLOHA II VĚDECKÉ ZÁVĚRY
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY 22 Vědecké závěry Podkladové informace Přípravek Durogesic je transdermální náplast obsahující fentanyl, což je silné syntetické opioidní analgetikum, které patří do skupiny piperidinových
PŘÍLOHA II VĚDECKÉ ZÁVĚRY 22 Vědecké závěry Podkladové informace Přípravek Durogesic je transdermální náplast obsahující fentanyl, což je silné syntetické opioidní analgetikum, které patří do skupiny piperidinových
Bevacizumab u starších pacientů s kolorektálním karcinomem
 Bevacizumab u starších pacientů s kolorektálním karcinomem MUDr. Tomáš Büchler, PhD. Onkologické oddělení Fakultní Thomayerovy nemocnice a Onkologická klinika 1. lékařské fakulty UK a VFN, Praha XIV. Staškovy
Bevacizumab u starších pacientů s kolorektálním karcinomem MUDr. Tomáš Büchler, PhD. Onkologické oddělení Fakultní Thomayerovy nemocnice a Onkologická klinika 1. lékařské fakulty UK a VFN, Praha XIV. Staškovy
Paracetamol Actavis 250 mg Paracetamol Actavis 500 mg Paracetamol Actavis 1000 mg potahované tablety paracetamolum
 ÚDAJE ÚVÁDĚNÉ NA VNĚJŠÍM A VNITŘNÍM OBALU Krabička na blistry 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Paracetamol Actavis 250 mg Paracetamol Actavis 500 mg Paracetamol Actavis 1000 mg potahované tablety paracetamolum
ÚDAJE ÚVÁDĚNÉ NA VNĚJŠÍM A VNITŘNÍM OBALU Krabička na blistry 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Paracetamol Actavis 250 mg Paracetamol Actavis 500 mg Paracetamol Actavis 1000 mg potahované tablety paracetamolum
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
U pacientů, kteří mají sucho v ústech, lze sliznici před užitím přípravku Lunaldin zvlhčit vodou.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Lunaldin 100 mikrogramů sublingvální tablety Lunaldin 200 mikrogramů sublingvální tablety Lunaldin 300 mikrogramů sublingvální tablety Lunaldin 400 mikrogramů
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Lunaldin 100 mikrogramů sublingvální tablety Lunaldin 200 mikrogramů sublingvální tablety Lunaldin 300 mikrogramů sublingvální tablety Lunaldin 400 mikrogramů
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU SKLÁDAČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Butamirati citras, guaifenesinum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Butamirati citras 4 mg, guaifenesinum 100 mg
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU SKLÁDAČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Butamirati citras, guaifenesinum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Butamirati citras 4 mg, guaifenesinum 100 mg
Desloratadin STADA 5 mg jsou modré, kulaté, bikonvexní potahované tablety o průměru přibližně 6,5 mm.
 Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA Pro dospělé a dospívající od 14 let 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna šumivá tableta obsahuje acetylcysteinum 600 mg. 3. SEZNAM POMOCNÝCH LÁTEK Obsahuje
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA Pro dospělé a dospívající od 14 let 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna šumivá tableta obsahuje acetylcysteinum 600 mg. 3. SEZNAM POMOCNÝCH LÁTEK Obsahuje
Celkové shrnutí vědeckého hodnocení přípravku Kytril a souvisejících názvů (viz příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÉ INFORMACE PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 11 Vědecké závěry Celkové
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÉ INFORMACE PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 11 Vědecké závěry Celkové
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
 ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU Obal na tablety se 400 mg potahovanými tabletami 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ibuprofen Dr.Max 400 mg potahované tablety ibuprofenum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU Obal na tablety se 400 mg potahovanými tabletami 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ibuprofen Dr.Max 400 mg potahované tablety ibuprofenum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Vývoj nových léčiv. Preklinický výzkum Klinický výzkum
 Vývoj nových léčiv Preklinický výzkum Klinický výzkum Úvod Léčivo = nejprověřenější potravina vstupující do organismu Ideální léčivo kvalitní, účinné, bezpečné a dostupné Financování výzkumu léčiv souvislost
Vývoj nových léčiv Preklinický výzkum Klinický výzkum Úvod Léčivo = nejprověřenější potravina vstupující do organismu Ideální léčivo kvalitní, účinné, bezpečné a dostupné Financování výzkumu léčiv souvislost
Praxbind doporučení pro podávání (SPC)
 Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Časná a pozdní toxicita léčby lymfomů, životní styl po léčbě lymfomu. David Belada FN a LF UK v Hradci Králové
 Časná a pozdní toxicita léčby lymfomů, životní styl po léčbě lymfomu David Belada FN a LF UK v Hradci Králové 1.Toxicita léčby lymfomů Co je to toxicita léčby? Jaký je rozdíl mezi časnou a pozdní toxicitou?
Časná a pozdní toxicita léčby lymfomů, životní styl po léčbě lymfomu David Belada FN a LF UK v Hradci Králové 1.Toxicita léčby lymfomů Co je to toxicita léčby? Jaký je rozdíl mezi časnou a pozdní toxicitou?
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha II. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 21 Vědecké závěry Celkové závěry vědeckého hodnocení přípravků Oxynal a Targin a souvisejících názvů (viz příloha I) Podkladové
Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 21 Vědecké závěry Celkové závěry vědeckého hodnocení přípravků Oxynal a Targin a souvisejících názvů (viz příloha I) Podkladové
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Paracetamol/Guaifenesin/Phenylephrine Hydrochloride Perrigo 500mg/200mg/10mg, prášek pro perorální roztok
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Paracetamol/Guaifenesin/Phenylephrine Hydrochloride Perrigo 500mg/200mg/10mg, prášek pro perorální roztok paracetamolum, guaifenesinum,
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Paracetamol/Guaifenesin/Phenylephrine Hydrochloride Perrigo 500mg/200mg/10mg, prášek pro perorální roztok paracetamolum, guaifenesinum,
Příloha III. Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok
 www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1.NÁZEV PŘÍPRAVKU: AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok 2.KVALITATIVNÍ A KVANTITATIVNÍ
www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1.NÁZEV PŘÍPRAVKU: AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok 2.KVALITATIVNÍ A KVANTITATIVNÍ
CZ PAR. QUETIAPINI FUMARAS Seroquel. NL/W/0004/pdWS/002
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury NL/W/0004/pdWS/002 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA ZMĚNA V SmPC
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury NL/W/0004/pdWS/002 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA ZMĚNA V SmPC
Nové léčebné možnosti v léčbě mnohočetného myelomu GROUP. Roman Hájek 3.9.2005. Lednice
 Nové léčebné možnosti v léčbě mnohočetného myelomu CZECH CMG M Y E L O M A GROUP ČESKÁ MYELOMOVÁ SKUPINA ČESKÁ MYELOMOVÁ SKUPINA CZECH CMG M Y E L O M A NADAČNÍ FOND GROUP Roman Hájek 3.9.2005 Lednice
Nové léčebné možnosti v léčbě mnohočetného myelomu CZECH CMG M Y E L O M A GROUP ČESKÁ MYELOMOVÁ SKUPINA ČESKÁ MYELOMOVÁ SKUPINA CZECH CMG M Y E L O M A NADAČNÍ FOND GROUP Roman Hájek 3.9.2005 Lednice
sublingvální tableta 67, 133, 267, 400, 533, 800 mikrogramů PRŮVODCE UŽÍVÁNÍM PŘÍPRAVKU VELLOFENT PRO PACIENTA A PEČOVATELE
 sublingvální tableta 67,, 67, 00,, 800 mikrogramů PRŮVODCE UŽÍVÁNÍM PŘÍPRAVKU VELLOFENT PRO PACIENTA A PEČOVATELE Tento průvodce obsahuje důležité informace pro pacienty a pečující osoby ohledně průlomové
sublingvální tableta 67,, 67, 00,, 800 mikrogramů PRŮVODCE UŽÍVÁNÍM PŘÍPRAVKU VELLOFENT PRO PACIENTA A PEČOVATELE Tento průvodce obsahuje důležité informace pro pacienty a pečující osoby ohledně průlomové
Nano World Cancer Day 2014
 31. ledna 2014 Celoevropská akce ETPN pořádaná současně ve 13 členských zemích Evropské unie Rakousko (Štýrský Hradec), Česká republika (Praha), Finsko (Helsinky), Francie (Paříž), Německo (Erlangen),
31. ledna 2014 Celoevropská akce ETPN pořádaná současně ve 13 členských zemích Evropské unie Rakousko (Štýrský Hradec), Česká republika (Praha), Finsko (Helsinky), Francie (Paříž), Německo (Erlangen),
LÉČBA BOLESTI - POHLED SÚKL NA KLINICKÁ HODNOCENÍ
 Léčba bolesti pohled SÚKL na klinická hodnocení 1 LÉČBA BOLESTI - POHLED SÚKL NA KLINICKÁ HODNOCENÍ MUDr. Alice Němcová MUDr. Alena Trunečková Léčba bolesti pohled SÚKL na klinická hodnocení 2 Klinická
Léčba bolesti pohled SÚKL na klinická hodnocení 1 LÉČBA BOLESTI - POHLED SÚKL NA KLINICKÁ HODNOCENÍ MUDr. Alice Němcová MUDr. Alena Trunečková Léčba bolesti pohled SÚKL na klinická hodnocení 2 Klinická
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU XATRAL UNO tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Alfuzosini hydrochloridum 10 mg v jedné tabletě. Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU XATRAL UNO tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Alfuzosini hydrochloridum 10 mg v jedné tabletě. Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls196586/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SMECTA prášek pro perorální suspenzi 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 sáček obsahuje: Léčivá látka: Diosmectitum 3,000 g Pomocné
sp.zn.: sukls196586/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SMECTA prášek pro perorální suspenzi 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 sáček obsahuje: Léčivá látka: Diosmectitum 3,000 g Pomocné
STUDIE 2014 KLINIKA ONKOLOGIE A RADIOTERAPIE AKTIVNÍ NÁBOR PACIENTŮ
 STUDIE 2014 KLINIKA ONKOLOGIE A RADIOTERAPIE AKTIVNÍ NÁBOR PACIENTŮ KARCINOM PRSU Spoluzkoušející: MUDr.Iva Slánská, MUDr.Peter Priester,MUDr.Adam Paulík Název studie : PH3-01 Studie Present Prevence recidivy
STUDIE 2014 KLINIKA ONKOLOGIE A RADIOTERAPIE AKTIVNÍ NÁBOR PACIENTŮ KARCINOM PRSU Spoluzkoušející: MUDr.Iva Slánská, MUDr.Peter Priester,MUDr.Adam Paulík Název studie : PH3-01 Studie Present Prevence recidivy
Bc. PharmDr. Ivana Minarčíková, Ph.D. www. farmakoekonomie.cz www.elekarnice.cz
 Bc. PharmDr. Ivana Minarčíková, Ph.D. www. farmakoekonomie.cz www.elekarnice.cz CÍL: alkoholem způsobená jaterní cirhóza alkoholem vyvolaná transplantace jater alkoholem způsobená pankreatitida Vyčíslení
Bc. PharmDr. Ivana Minarčíková, Ph.D. www. farmakoekonomie.cz www.elekarnice.cz CÍL: alkoholem způsobená jaterní cirhóza alkoholem vyvolaná transplantace jater alkoholem způsobená pankreatitida Vyčíslení
sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014
 sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYTELASE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ambenonii chloridum 10 mg v 1 tabletě. Pomocné látky
sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYTELASE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ambenonii chloridum 10 mg v 1 tabletě. Pomocné látky
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
Sp.zn.sukls185381/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls185381/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MINOXIDIL LAVINELI 5% kožní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Minoxidilum 50 mg/ml (5% w/v). Jeden střik spreje MINOXIDIL
Sp.zn.sukls185381/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MINOXIDIL LAVINELI 5% kožní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Minoxidilum 50 mg/ml (5% w/v). Jeden střik spreje MINOXIDIL
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls111315/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Protradon 100 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje tramadoli hydrochloridum 100 mg. Úplný seznam
sp. zn. sukls111315/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Protradon 100 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje tramadoli hydrochloridum 100 mg. Úplný seznam
Simdax Příbalová informace
 Simdax Příbalová informace Příbalová informace: Informace pro uživatele Simdax 2,5 mg/ml koncentrát pro přípravu infuzního roztoku (Levosimendanum) Přečtěte si pozorně celou příbalovou informaci dříve,
Simdax Příbalová informace Příbalová informace: Informace pro uživatele Simdax 2,5 mg/ml koncentrát pro přípravu infuzního roztoku (Levosimendanum) Přečtěte si pozorně celou příbalovou informaci dříve,
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU {Krabička na blistry a lahvičky z HDPE } 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Orlistat Sandoz 60mg Orlistatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna tvrdá tobolka obsahuje orlistatum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU {Krabička na blistry a lahvičky z HDPE } 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Orlistat Sandoz 60mg Orlistatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna tvrdá tobolka obsahuje orlistatum
Jeden ml injekčního roztoku obsahuje granisetronum 1 mg (ve formě hydrochloridu)
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 3 mg/3 ml 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml injekčního roztoku obsahuje granisetronum 1 mg (ve formě hydrochloridu) 3. SEZNAM
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 3 mg/3 ml 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml injekčního roztoku obsahuje granisetronum 1 mg (ve formě hydrochloridu) 3. SEZNAM
Klinická dozimetrie v NM 131. I-MIBG terapie neuroblastomu
 Klinická dozimetrie v NM 131 I-MIBG terapie neuroblastomu Prchalová D., Solný P., Kráčmerová T. Klinika nukleární medicíny a endokrinologie 2. LF UK a FN Motol 7. Konference radiologické fyziky Harrachov,
Klinická dozimetrie v NM 131 I-MIBG terapie neuroblastomu Prchalová D., Solný P., Kráčmerová T. Klinika nukleární medicíny a endokrinologie 2. LF UK a FN Motol 7. Konference radiologické fyziky Harrachov,
Pomocná látka se známým účinkem: Jedna tableta obsahuje 75 mg monohydrátu laktosy. Úplný seznam pomocných látek viz bod 6.1.
 sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Fludeoxythymidine ( 18 F) 1 8 GBq k datu a hodině kalibrace voda na injekci, chlorid sodný 9 mg/ml
 Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Poznámka: Tyto úpravy souhrnu údajů o přípravku a
 PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku přijetí rozhodnutí Komisí. Poté,
PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku přijetí rozhodnutí Komisí. Poté,
Definice průlomové bolesti (Breakthrough pain)
 Definice průlomové bolesti (Breakthrough pain) Za průlomovou bolest považujeme náhlé, přechodné a krátkodobé vzplanutí bolesti, které se nejčastěji objevuje u pacientů s trvalou léčbou opioidy Průlomová
Definice průlomové bolesti (Breakthrough pain) Za průlomovou bolest považujeme náhlé, přechodné a krátkodobé vzplanutí bolesti, které se nejčastěji objevuje u pacientů s trvalou léčbou opioidy Průlomová
Chirocaine 5 mg/ml Chirocaine 7,5 mg/ml injekční roztok (Levobupivacaini hydrochloridum)
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Chirocaine 5 mg/ml Chirocaine 7,5 mg/ml injekční roztok (Levobupivacaini hydrochloridum) V příbalové informaci naleznete: 1. Co je přípravek Chirocaine a k
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Chirocaine 5 mg/ml Chirocaine 7,5 mg/ml injekční roztok (Levobupivacaini hydrochloridum) V příbalové informaci naleznete: 1. Co je přípravek Chirocaine a k
STERILNÍ JEN NA JEDNO POUŽITÍ NEPYROGENNÍ
 0086 TM Systém pro dodávání léků při embolizaci NÁVOD PRO POUŽITÍ DC Bead Systém pro dodávání léků při embolizaci STERILNÍ JEN NA JEDNO POUŽITÍ NEPYROGENNÍ Česky NÁVOD PRO POUŽITÍ DC Bead Systém pro dodávání
0086 TM Systém pro dodávání léků při embolizaci NÁVOD PRO POUŽITÍ DC Bead Systém pro dodávání léků při embolizaci STERILNÍ JEN NA JEDNO POUŽITÍ NEPYROGENNÍ Česky NÁVOD PRO POUŽITÍ DC Bead Systém pro dodávání
