Nežádoucí účinky léků specifické pro dětský věk
|
|
|
- Milan Horáček
- před 8 lety
- Počet zobrazení:
Transkript
1 137 Nežádoucí účinky léků specifické pro dětský věk Petra Langerová 1, Jiřina Zapletalová 2, Karel Urbánek 1 1 Ústav farmakologie LF UP a FN Olomouc 2 Dětská klinika LF UP a FN Olomouc Dobrá znalost nežádoucích účinků léčiv (NÚL) je klíčová pro jejich bezpečné používání. NÚL jsou častým klinickým problémem jak u dospělých, tak u pediatrických pacientů. Vyskytují se u více než 9 % hospitalizovaných dětí a jsou důvodem přijetí až ve 4 % případů. Toxicita léčiv může mít v dětství specifický charakter. Zejména novorozenci jsou k jejím projevům náchylnější než jiné věkové kategorie pacientů. Až 70 % léků v pediatrické populaci je předepisováno způsobem, který není schválen regulačními autoritami. Riziko výskytu nežádoucích účinků při tomto podávání je 3,6x vyšší za hospitalizace a 2х vyšší v ambulantní péči. Většina NÚL u dětí je shodná s nežádoucími účinky u dospělých, proto jsou v článku uvedeny pouze nejtypičtější syndromy specifické pro dětský věk Reyův syndrom, grey syndrom, poruchy růstu kostí, zubů a pojivových tkání, poruchy tělesného růstu, psychiatrické syndromy a další nežádoucí účinky s odlišnými charakteristikami u dětí. Klíčová slova: děti, nežádoucí účinky léčiv, Reyův syndrom, chloramfenikol, grey syndrom, chinolony, tetracykliny, poruchy růstu, psychiatrické syndromy, postanestetický neklid. Adverse drug reactions specific to childhood Good knowledge of adverse drug reactions (ADRs) is crucial for safe use of medication. ADRs are a common clinical problem in both pediatric and adult medicine that can lead to significant morbidity. More than 9 % of hospitalized children suffer some adverse reactions to therapy and up to 4 % of all their hospital admissions are caused by ADRs. The toxicity of many medicines in children is different to that seen in adults. Indeed, there are some groups of pediatric patients, such as neonates, in whom drug toxicity appears to be relatively common. About 70 % of drugs prescribed to the pediatric population are prescribed off-label. The risk of adverse drug reactions with such prescribing is 3,6-fold higher in the hospital setting and 2-fold higher in the outpatient setting compared to on-label prescribing. Most of the ADRs in children are similar to ADRs in adults. In this paper, ADRs specific for the pediatric population are discussed: Reye s syndrome, Gray baby syndrome, quinolone arthropathy, tooth discoloration, growth disorders, psychiatric disorders and others. Key words: children, adverse drug reactions, Reye s syndrome, chloramphenicol, grey syndrome, quinolones, tetracyclines, growth disorders, psychiatric disorders, acute agitation. Klin Farmakol Farm 2011; 25(3): Úvod a historie Nežádoucí účinky léčiv jsou častým klinickým problémem jak u dospělých, tak u pediatrických pacientů. Vyskytují se u více než 9 % hospitalizovaných dětí a jsou důvodem přijetí až ve 4 % případů. Toxicita léčiv může být v dětství odlišná, zejména novorozenci jsou k ní mnohem náchylnější. Provádění studií vyhodnocujících výskyt nežádoucích účinků léčiv u dětí je obtížné. Většinou se jedná pouze o retrospektivní analýzy a kazuistiky, u kterých je hodnocení příčinné souvislosti nežádoucího účinku a podání léčiva problematické. Jednou z prvních identifikovaných toxicit byla methemoglobinemie po anilinovém barvivu, kterým byl na dětských plenách označován jejich výrobce. U 17 novorozenců byla následně popsána cyanóza. Mezníkem v terapii bakteriálních infekcí bylo zavedení sulfonamidů v roce Ty jsou však obtížně rozpustné ve vodě, a proto bylo problematické vytvořit lékovou formu pro děti. V roce 1937 se jako rozpouštědlo začal používat diethylenglykol, a to aniž by si výrobce uvědomil, že je toxický. Způsobil smrt více než 76 dětí a dospělých ve Spojených státech amerických. Podobné tragédie se bohužel vyskytly i později. Diethylenglykol se používal také jako rozpouštědlo pro paracetamol a zapříčinil smrt 46 nigerijských dětí, 51 dětí z Bangladéše a 85 na Haiti. V roce 1984 byl z trhu stažen preparát intravenózního vitaminu E, který způsobil smrt 38 novorozenců. Důvodem bylo nejspíše nevhodné emulzifikační činidlo (1). Vliv nezralosti eliminačních systémů na výskyt NÚL u dětí Výběr správného léčiva pro dítě nebo adolescenta je podmíněn znalostmi odlišností ve farmakokinetice. Pokud se zaměříme na funkce jednotlivých orgánů, důležité je především zhodnocení renálních funkcí a s tím související schopnosti eliminace léčiv. Glomerulární filtrace (GF) je nedostatečně vyvinutá zejména v prvních šesti měsících života. Nejprogresivnější vývoj nastává v prvních 2 týdnech postnatálního života a pokračuje v průběhu 8 12 měsíců po porodu. Hodnoty odpovídající 50 % dospělé GF je dosaženo ve 48. postmenstruačním týdnu. (Postmenstruační věk je přesnějším parametrem k hodnocení maturačních změn, než věk postnatální.) V jednom roce věku GF dítěte odpovídá 90 % GF dospělého. Tubulární sekrece je nedostatečná po dobu 12 měsíců. Hodnot srovnatelných s dospělým organizmem je dosaženo až od 24. měsíce života. Do té doby musíme počítat s rizikem kumulace léčiv nebo aktivních metabolitů vylučovaných ledvinami a také s jejich prodlouženým eliminačním poločasem. Ten je nejdelší v prvních třech měsících života. V tomto období se proto doporučuje prodloužit dávkovací intervaly a/nebo redukovat udržovací dávky. Co se gastrointestinálního systému týče, u dětí do 7 let je zpomalená peristaltika a prodloužené vyprazdňování žaludku. U novorozenců je v žaludku vyšší ph (>4). Tyto odlišnosti mají vliv na absorpci léčiv a je třeba počítat s možným zpožděním nástupu účinku při perorálním podávání. U novorozenců a kojenců je také nutno počítat se sníženým množstvím tělesného tuku
2 138 Hlavní téma a svaloviny a s větším objemem celkové tělesné vody. Distribuční objem hydrofilních léčiv je větší. Taktéž jsou nezralé enzymy metabolizující léčiva cytochrom P450 i enzymy II. fáze. Proto je prodloužen poločas eliminace mnoha léčiv a snížena jejich plazmatická clearance. U dětí mezi rokem je naopak enzymatická aktivita vyšší než u dospělých, clearance je zvýšená a poločas zkrácený. Adolescenti již mají tuto enzymatickou aktivitu stejnou jako dospělí (2, 3). Nicméně změněný metabolizmus se u některých léčiv jeví jako protektivní a chrání organizmus před jejich toxickými účinky. Příkladem může být paracetamol. Děti jsou v případě předávkování k jeho hepatotoxickým účinkům odolnější a smrt jako následek jednorázového předávkování je u nich velmi vzácná (4). Výskyt nežádoucích účinků léčiv v dětském věku Znalosti o incidenci nežádoucích účinků léků u dětí jsou poměrně omezené. Jedním z důvodů je skutečnost, že mnoho z nich nebylo klinicky testováno pro použití v pediatrických indikacích. Důvodem je fakt, že provádění těchto klinických studií je mnohem náročnější než u dospělých. Počty subjektů vhodných pro zařazení do klinického hodnocení jsou často velmi malé a také získávání informovaného souhlasu bývá obtížnější. V pediatrické farmakoterapii je proto mnoho léků předepisováno nebo podáváno způsobem, který není schválen regulačními autoritami. Takto podávaná léčiva mohou zvyšovat riziko nežádoucích účinků, které je v těchto případech až 3,6х vyšší za hospitalizace a 2х vyšší v ambulantní péči (5, 6). Nejčastěji se vyskytujícími projevy bývají změny na kůži (rash, urtika) a gastrointestinální obtíže (průjem, nauzea a zvracení). Mohou se však objevit i systémové reakce. Nejčastěji používaná léčiva jsou zároveň těmi, která zapříčiňují nejvíce nežádoucích účinků. Jedná se hlavně o vakcíny, antibiotika, antipyretika, nesteroidní antiflogistika a léčiva k terapii nachlazení a léky zažívacího traktu (7). Kimland, a kol. se ve své práci zabývají frekvencí nežádoucích účinků u dětí a adolescentů do 16 let věku, které byly hlášeny ve Švédsku mezi lety 1987 a Z celkové populace 1,7 milionu jedinců byly NÚL zaznamenány v případech. Nejčastěji se jednalo o reakci v místě podání (24 %), dále pak o horečku (12 %) a exantém (6,7 %). Nejčastěji to byly reakce po vakcinaci (63,8 %), následovaly NÚL antibiotik k systémovému užití (10,1 %). Závažných nežádoucích účinků bylo 13 %, smrt nastala u 0,14 % (7). Jennifer Le, a kol. provedli retrospektivní kohortovou studii v letech Zahrnovala pediatrické pacienty, kteří prodělali nežádoucí účinek léku ve specializované nemocnici. Zaznamenali výskyt celkem 1087 NÚL u pediatrických pacientů, a to nejčastěji po antibioticích (33 %), opioidech (12 %), antikonvulzivech (11 %) a anxiolyticích (10 %). Z antibiotik se jednalo zejména o peniciliny, cefalosporiny a vankomycin. Projevy NÚL byly u nich obvykle mírné. Závažné reakce byly častěji zaznamenány u antikonvulziv a protinádorových léčiv. Jednotlivá léčiva, která v této studii způsobovala NÚL nejčastěji, byla: vankomycin, morfin, fentanyl, metoklopramid, lorazepam, asparagináza a kyselina valproová. Z orgánových systémů pak nežádoucí účinky léčiv nejvíce postihovaly kůži (37 %), kardiovaskulární systém (23 %) a CNS (16 %) (8). Aktuálně publikovaná retrospektivní analýza dat z let zahrnovala téměř 3,5 milionů nežádoucích účinků hlášených a uvedených v databázi VigiBase (WHO global individual case safety report database). Nežádoucí účinky byly posuzovány podle toho, zda se vyskytly u jedince do 18 let věku (těch bylo 7,7 %) 2х V, nebo staršího a tyto dvě skupiny byly navzájem srovnávány. Vyloučeny byly reakce na vakcíny a také hlášení, u kterých nebyl uveden věk subjektu. Největší procentuální rozdíl ve výskytu děti vs dospělí byl u antiinfektiv (33 % vs. 15 %), respiračních léčiv (11 % vs. 5 %) a dermatologických léčiv (12 % vs. 7 %). U dětí se nejčastěji jednalo o kožní reakce (35 % oproti 23 % u dospělých). Z vyvolávajících léčiv se na prvním místě umístilo antibiotikum amoxicilin a centrálně působící inhibitor zpětného vychytávání noradrenalinu, používaný u poruch pozornosti, atomoxetin. Reakce na antibiotika jsou však obecně zaznamenávány častěji v nižším věku z toho důvodu, že po jednou prodělané nežádoucí reakci se pacienti danému antibiotiku obvykle vyhýbají (9). Nežádoucí účinky léčiv specifické pro dětský věk Většina nežádoucích účinků léčiv u dětí je shodná s nežádoucími účinky u dospělých, proto se dále zaměříme pouze na nejtypičtější syndromy specifické pro dětský věk. V současné době se nejzávažnější níže uvedené syndromy vyskytují velmi vzácně, protože léčiva způsobující takto závažné nežádoucí účinky se používají u dětí už jen v ojedinělých případech. Reyův syndrom Reyův syndrom je vzácné a závažné onemocnění, které se vyskytuje zejména u dětí a adolescentů. Jeho vznik nejčastěji souvisí s podáním kyseliny acetylsalicylové při virovém onemocnění. Průměrná mortalita se pohybuje kolem 40 % a je o něco vyšší u chlapců. Syndrom byl popsán v roce 1963 australským patologem R. D. Reyem, nicméně ojedinělé případy byly zdokumentovány již dříve. Jedná se o kombinaci jaterního postižení a nezánětlivé encefalopatie, často spojené s edémem mozku. Projevy Reyova syndromu se objevují obvykle 3 5 dnů po proběhlém virovém onemocnění a souvisejí s podáním kyseliny acetylsalicylové nebo jiného antipyretika. První příznaky syndromu zahrnují zvracení, dezorientaci, ztrátu vědomí a mohou se vyskytnout i epileptické záchvaty. Přítomna bývá i hepatomegalie. V laboratorním vyšetření dominují nálezy charakteristické pro hepatopatii: zvýšené transaminázy, ale nikoliv bilirubin, dále prodloužený protrombinový čas, hypoglykemie a hyperamonemie. Příčinou sníženého odstraňování amoniaku z krve je porucha jaterního dusíkatého metabolizmu. Amoniak je neurotoxický, při vysokých koncentracích v plazmě vzniká jaterní encefalopatie. Za nejčastější infekční agens prodělaného onemocnění jsou považovány viry chřipky A a B, varicella-zoster a parainfluenza. Častá je však souvislost i s viry způsobujícími spalničky, dále adenoviry, coxsackie viry, CMV, EBV, HIV, HAV, HBV a rotaviry. Ojediněle se může jednat i o bakteriální patogeny, a to zejména mykoplazmata, chlamydie, salmonelly a shigelly. Nejvyšší incidence syndromu ve Spojených státech amerických byla zaznamenána v roce 1980 a jednalo se o 555 případů. Následoval zákaz používání salicylátů do 18 let věku a od této doby již výskyt Reyova syndromu neustále klesal. Nyní se pohybuje mezi 0,2 1,2 případy na jeden milion dětí mladších 18 let. Nicméně role aspirinu v patogenezi Reyova syndromu je stále nejasná. Syndrom se může vyskytnout i po jiných léčivech antiemeticích, kyselině valproové, pivampicilinu, tetracyklinech a zidovudinu. Také nesteroidní protizánětlivé léky, zejména diklofenak, mohou syndrom zapříčinit nebo zhoršit jeho projevy. Doporučenými antipyretiky v pediatrické populaci tedy zůstává pouze paracetamol a ibuprofen. Žádná ze studií neurčuje bezpečný věk pro užití salicylátů v případě virového onemocnění. Mezi 15. a 17. rokem se Reyův syndrom objevuje již jen v 8 % všech pacientů s Reyovým syndromem a od 18. roku věku pak už v méně než 1 %. Oproti tomu nejvyšší výskyt byl u dětí mezi 1. a 4. (46 %) a 10. a 14. rokem (27 %). Aspirinu a preparáty obsahující aspirinu by proto neměly být užívány během horečnatých onemocnění u osob mladších 19 Klinická farmakologie a farmacie 2011; 25(3)
3 139 let. Terapie Reyova syndromu je symptomatická. Používá se mannitol a dexametazon, kontraindikována jsou všechna nesteroidní antirevmatika, která mohou průběh stavu zhoršovat. Prognóza závisí na závažnosti orgánového poškození a intenzitě léčby (10, 11, 12, 13). Grey syndrom Dalším, v současné době již nezaznamenávaným, nežádoucím účinkem typickým pro dětský věk je tzv. grey syndrom (Gray baby syndrome, šedý syndrom), který se může vyskytnout při podávání širokospektrého antibiotika chloramfenikolu. Dochází k němu důsledkem insuficience glukuronidačních reakcí u dítěte, což vede k akumulaci toxických chloramfenikolových metabolitů. UDP-glukuronyl transferáza je v kojeneckém věku, zejména u nedonošených novorozenců, nezralá a neschopná chloramfenikol metabolizovat. S tím pak souvisí i nedostatečná renální exkrece tohoto léčiva, u kterého nedošlo ke konjugaci. Mezi příznaky patří zvracení, dechové potíže, abdominální distenze, popelavě šedá cyanóza, slabost a kardiovaskulární kolaps. Mulhall, et al. ve své studii sledoval v období mezi březnem 1978 a srpnem 1981 celkem 64 novorozenců ze 12 nemocnic, kterým byl podáván chloramfenikol z důvodu život ohrožujících infekcí. U 10 z nich se projevily symptomy chloramfenikolové toxicity. Celkem 9 z těchto 10 dětí byla podávána předepsaná dávka a pouze jedno bylo předávkováno. U 5 dětí se projevily symptomy grey syndromu, u 4 reverzibilní hematologická reakce a jedno dítě bylo označeno jako velmi šedé ( very grey ). Maximální sérové koncentrace chloramfenikolu u těchto deseti dětí byly od 28 do 180 mg/l a údolní koncentrace od 19 do 47 mg/l. Nejvyšší plazmatické koncentrace se vyskytovaly u nejmladších dětí 9 z těchto 10 dětí bylo mladších než 9 dnů. Sérová koncentrace chloramfenikolu nad doporučeným terapeutickým rozmezím (15 25 mg/l) byla ovšem pozorována i u dalších 27 novorozenců (dva z nich byli dokonce předávkováni desetinásobně), ale u žádného z nich se příznaky toxicity nevyskytly. Chloramfenikol je nyní kontraindikován u novorozenců. Autoři doporučují provádět monitorování plazmatických koncentrací, pokud by podávání chloramfenikolu bylo nevyhnutelné. Plazmatické koncentrace by měly být udržovány mezi 15 a 25 mg/l. Žádné z dětí, u kterého bylo toto rozmezí dodrženo, nemělo klinické příznaky toxicity (14). Poruchy vývoje kostí, zubů a pojivových tkání Tetracykliny nepatří v pravém slova smyslu mezi toxická antibiotika, nicméně se ukládají v rostoucích zubech a růstových zónách chrupavek. Je dobře známo, že pokud se podávají dětem v době tvorby dentice, dochází k dysplazii skloviny, hypoplazii a tvorbě žlutých fasetovaných zubů s vysokým sklonem ke kazivosti. Tyto poruchy vznikají v důsledku tvorby kalciových komplexů v dentici. K depozici léčiva v zubech a kostech nejspíše dochází vlivem chelátotvorných schopností tetracyklinů a tvorby tetracyklin-kalcium orthofosfátového komplexu. Tetracykliny zároveň velmi dobře prostupují placentární bariéru, a jelikož mineralizace deciduální dentice začíná ve 4. měsíci intrauterinního vývoje, jsou kontraindikovány v těhotenství. Dyskolorace zubů u dětí, jejichž matky užívaly tetracykliny v graviditě, je popsána v 50 % případů a riziko je nejvyšší, pokud byly podávány ve třetím trimestru. Podávání tetracyklinových antibiotik dětem může také způsobit poruchy růstu. Všechny se kumulují v kostech, nejméně však doxycyklin. Tetracyklinová antibiotika jsou dle SPC kontraindikována u dětí do 8 let věku. Nicméně údaje se z různých zdrojů liší, někteří autoři uvádějí do 12 let (15), jiní až do 16 let (16, 17, 18). Často diskutovanou otázkou je podávání fluorochinolonů u dětí. Jsou kontraindikovány v těhotenství a laktaci, ale také u dětí a adolescentů, a to z důvodu prokázaného poškození růstových chrupavek u mláďat několika druhů laboratorních zvířat. U štěňat byly prokázány léze a puchýře nezralých chrupavek a mikroskopicky pozorována ztráta proteoglykanů, dále degenerované nebo nekrotické chondrocyty a desintegrovaná extracelulární matrix jako typický znak toxického efektu. Nicméně tento striktní postoj k jejich užívání je velmi často kritizován. Někteří autoři, považují riziko chinolony indukované artropatie za irelevantní a požadují rozšíření jejich používání v pediatrické populaci. V indikovaných případech je za lék první volby považován ciprofloxacin. Diskuze na toto téma ještě více vzplanula po zavedení tzv. respiračních chinolonů, účinných na penicilin rezistentní pneumokoky, jako jsou levofloxacin a moxifloxacin. V posledních letech proto byly přínosy a rizika této léčby posuzovány v řadě klinických studií (15, 19). Touto otázkou se ve své práci zabýval i Burkhardt, et al. Do obsáhlého přehledu na toto téma zahrnul celkem dětských pacientů. Dochází však k závěru, že vznik artropatie po podání fluorochinolonů, který je prokázán u mláďat zvířat, není u dětí a adolescentů dokazatelný (20). Taktéž Hampel, et al. se zabývali tímto tématem a do své práce zahrnuli dětí a adolescentů léčených chinolony ve léčebných cyklech. Artralgie se vyskytla ve 31 případech, z toho se však ve 28 případech jednalo o pacienty s cystickou fibrózou. Intenzita potíží byla zdokumentována ve 29 případech a byla hodnocena jako mírná u 9 pacientů, střední u 16 a těžká u 4. U 25 pacientů artralgie zcela odezněla, a to včetně zmíněných těžkých případů. Zdravotní stav jednoho z pacientů se zlepšil a potíže dalšího zůstaly nezměněny. U ostatních nebyly k dispozici informace o následném stavu. Výskyt artropatie u pacientů s cystickou fibrózou je odhadován mezi 4 a 7 %, proto případná diagnóza chinolonové artropatie je u nich obtížná (21). I přesto, že chondrotoxicita nebyla prokázána v klinických studiích, nejsou chinolony u dětí běžně indikovány. Výjimku tvoří těžké případy cystické fibrózy a jiné vitální indikace (16). Poruchy tělesného růstu Poruchy růstu byly ojediněle popsány při podávání řady léčiv, například methylfenidátu, kotrimoxazolu, deferoxaminu a při dlouhodobém podávání interferonu α. Kortikosteroidy jsou svým nežádoucím účinkem na tělesný růst typické. Především systémově podávané narušují normální růst. Inhibují osteoblasty a stimulují osteoklasty. Zároveň snižují resorpci vápníku ve střevě a zvyšují sekreci vápníku a fosforu v ledvinách. Vysoké dávky snižují lineární růst kosti (epifýzy dlouhých kostí). Při onemocněních pojiva a nespecifických střevních zánětech je obvykle porucha růstu následkem chronického zánětu léčbou glukokortikoidy pouze potencována. Vysoké dávky a dlouhodobé užívání kortikosteroidů snižují růstovou rychlost, a tím negativně ovlivňují dospělou výšku. Bezpečná dávka s ohledem na tělesný růst není dosud známa a za významnější je považována kumulativní dávka než dávka denní. Růstový catch-up v době steroidních prázdnin (například při remisi onemocnění, v době alternativní léčby) může být významným prediktorem adultní výšky (22, 23, 24). Existují různé názory na vliv inhalačních glukokortikoidů (ICS), které mají omezenou biologickou dostupnost. Některé studie tuto závislost při podávání nízkých dávek nepotvrdily, a to ani v případě, že se jednalo o dlouhodobé podávání; jiné zase dokládají, že inhalační kortikoidy, zejména však ve vysokých dávkách, mají na růstové parametry vliv (16, 17). Metaanalýza, uveřejněná v roce 2000 v časopise Pediatrics, se zabývala právě vlivem inhalačních steroidů na
4 140 Hlavní téma lineární růst u dětí s astma bronchiale. Studie byly rozděleny dle léčivých přípravků. Do skupiny s beklometasonem byly zahrnuty 4 studie s celkovým počtem 450 subjektů a dokládaly pokles v lineárním růstu o 1,51 cm/rok. Skupina s flutikasonem zahrnovala pouze 1 studii u 183 subjektů a taktéž potvrdila snížení růstu, a to o 0,43 cm za rok (25). Nicméně nejasné zůstává, zda je tento účinek dlouhodobý a zda ovlivňuje dospělou výšku pacienta. Práce Agertofta, a kol. dokládá, že děti s astma bronchiale léčené dlouhodobě budesonidem dosáhly normální dospělé výšky (26). Další metaanalýza, zabývající se tělesným růstem při terapii inhalačními kortikosteroidy, zahrnovala 18 studií a více než dětí (0 17 let). Jednalo se o 13 dvojitě zaslepených placebem kontrolovaných a 5 kontrolovaných léčbou bez ICS. Závěrem bylo, že budesonid a beklometason krátkodobě (1 2 roky) suprimují tělesný růst více než flutikason, zpomalují kostní zrání, a tím oddalují začátek puberty (zejména u chlapců). Prepubertální decelerace tělesného růstu je však dočasná a žádný z ICS nemá vliv na dospělou výšku. Je třeba brát v potaz, že kortikosteroidy jsou nejefektivnější dlouhodobou léčbou astmatu. Možná rizika léčby ICS jsou vyvážena jejich benefitem. Navíc špatně léčené nebo těžké astma samo o sobě negativně ovlivňuje tělesný růst. Nicméně dávka ICS použitá u astmatu by měla být ta nejnižší umožňující jeho dobrou kontrolu. Bezpečná denní dávka při dlouhodobé léčbě lehkého nebo středně těžkého perzistujícího astmatu u dětí starších 5 let je ųg budesonidu nebo jeho ekvivalentu. Vysoké dávky ICS u těžkého astmatu mají signifikantně menší negativní vliv na růst než systémové kortikosteroidy. Co se vlivu na kostní tkáň týče, nemáme zatím k dispozici studie, které by prokázaly u dětí signifikantně vyšší riziko fraktur při léčbě ICS a ani longitudinální kontrolované studie trvající 2 5 let neprokázaly snížení kostní denzity. ICS mohou snižovat nárůst kostní hmoty u chlapců během puberty (27). Psychiatrické syndromy Vlivem léků na vývoj lidské psychiky se zabývá obor behaviorální teratologie. Je založen na studiu chování, které je důležitým nástrojem k identifikaci potenciálně neurotoxických komponent v průběhu lidského vývoje. Expozice léčivu v raném věku může být predisponujícím faktorem pro následnou poruchu chování (28). Diskutovanou otázkou je i používání psychofarmak u dětí a adolescentů, a to zejména SSRI antidepresiv v souvislosti s možným zvýšením rizika suicidií. Přínos těchto léčiv se liší dle diagnózy a je kontroverzní v terapii těžkých depresí. Sertralin a fluvoxamin jsou používány k terapii obsesivně kompulzivních poruch. Kromě zmíněných indikací nejsou SSRI pro pediatrickou populaci schválena. Práce Schneeweisse, a kol. hodnotí 9 let trvající kohortovou studii, ve které autoři sledovali bezpečnost antidepresiv u dětí a adolescentů s ohledem na riziko suicidií. V 78 % subjekty medikovaly antidepresiva skupiny SSRI paroxetin v 25 %, citalopram v 17 % a sertralin v 17 % z celkového počtu; fluvoxamin pak v 5 %, inhibitory MAO v 0,2 % a tricyklická antidepresiva v 7 %. U celkového počtu dětí užívajících antidepresiva bylo během prvního roku sledování popsáno 266 pokusů o sebevraždu a 3 dokonané sebevraždy. V následujících letech to bylo 27 pokusů nebo dokonaných suicidií na osoboroků a nebyly rozdíly mezi jednotlivými léčivy. Toto zjištění potvrzuje rozhodnutí FDA (Food and drug administration) zahrnout všechna antidepresiva na černou listinu pro zvýšené riziko sebevražd (29). Angela J. Dean, a kol. posuzovali vliv doporučení vydaného v červnu 2003 omezit preskripci antidepresiv u dětí. Ve sledovaném období skutečně došlo ke snížení množství předpisu těchto léčiv v pediatrické populaci. V dospělé populaci však zaznamenali nárůst. Je však třeba i přesto zdůraznit, že léčba deprese je nutná i u dětí. Otázkou zůstává, jak nežádoucím účinkům antidepresiv předcházet. Autoři se ve svém doporučení opírají o posuzování poměru risk-benefit u jednotlivých pacientů a následné pečlivé sledování takto léčeného dítěte. Strach z NÚL by neměl vést k nedostatečné terapii deprese ( under treatment ) (30). Postanestetický neklid se ukazuje být dalším z častých polékových psychiatrických syndromů. Jedná se o poruchu vědomí a pozornosti s dezorientací a alterací percepce, spojenou s hyperreflexií a motorickým neklidem bezprostředně po celkové anestezii (31). Etiologie není zatím přesně známa. Může být vyvolán mnoha celkovými anestetiky, jeho incidence se však zřejmě zvyšuje s častějším používáním sevofluranu. V pooperačním období je u dětí velmi často pozorován jak postanestetický neklid (emergence delirium, emergence agitation, postanesthetic excitement), tak pooperační bolest. Symptomy mohou být velmi podobné, a proto je někdy obtížné tyto stavy rozlišit. Incidence postanestetického neklidu se pohybuje mezi 12 a 30 % a projevy trvají obvykle méně než 10 minut, ale mohou přetrvávat i 45 minut. Příznaky jsou neklid, kopání, vytrhávání si intravenózních kanyl, drénů, katétrů, trhání oblečení a s tím související zvýšené krvácení, případně poranění zdravotnického personálu. Typ chirurgického výkonu, analgetická terapie v průběhu operace, volba lokálních anestetik a podání opioidních analgetik neovlivňují riziko pooperační agitace. Terapie je založena na podávání opioidních analgetik, která uleví od bolesti a zároveň zajistí zklidnění dítěte. Pokud nemá dítě zajištěno intravenózní vstup, v literatuře je uváděna možnost využití intranazální aplikace fentanylu. Nicméně v České republice je přípravek k intranazálnímu podání (vyráběný pod názvem Instanyl ) registrován pouze k terapii průlomové bolesti u nádorových onemocnění a pro použití u dětí a dospívajících do 18 let není schválen vzhledem k nedostatečným údajům o bezpečnosti a účinnosti (32, 33). Relativně nově zjištěnou příčinou psychiatrických poruch je podávání montelukastu, který je u dětí používán poměrně často k terapii astma bronchiale. Wallerstedt, a kol. analyzovali všechny hlášené nežádoucí účinky v databázi SWEDIS, které se vyskytly u pacientů do 18 let věku užívajících montelukast. V letech jich z celkového počtu 103 bylo právě 48 psychiatrických a téměř polovina se vyskytla u dětí do 3 let věku. Nejčastěji se jednalo o noční můry, úzkost, agresivitu, poruchy spánku (zejména insomnii), podrážděnost, halucinace a hyperaktivitu. Jen některé z nich jsou však uvedeny v SPC jako možné nežádoucí účinky tohoto léku (34). Nežádoucí účinky s odlišnými charakteristikami u dětí Jedním z nejčastějších idiosynkrastických nežádoucích účinků léčiv je hepatotoxicita. Je také jedním z nejobávanějších nežádoucích účinků antikonvulziv. Vyskytuje se častěji v mladších věkových skupinách a velká většina pacientů, kteří zemřeli na selhání jater způsobené antikonvulzivy, byly děti léčené valproátem sodným. Retrospektivní americká studie prokázala, že vysoce rizikové byly děti mladší 3 let, děti s polyfarmacií a s mentální retardací (35). U antiepileptik jsou časté i kožní nežádoucí reakce. Vyskytují se minimálně u 5 % dětí léčených karbamazepinem a fenytoinem (36). Skutečná incidence však není známa. Většina reakcí je sice mírných, nicméně je zde i riziko Stevens-Johnsonova syndromu nebo toxické epidermální nekrolýzy (37). Závažné kožní reakce při terapii lamotriginem jsou pozorovány u 1 z dospělých pacientů. U dětí je incidence uváděna 1 : 100 až 1 : 330 a je častější, pokud je lamotrigin podáván v kombinaci s vyššími dávkami valproátu (38, 39). Klinická farmakologie a farmacie 2011; 25(3)
5 141 Propofol je velmi oblíbeným celkovým anestetikem, které se používá i pro své sedativní účinky. Bylo však popsáno 10 případů úmrtí u dětí jako následek závažné metabolické acidózy. Příčina jejího vzniku není známa, ale víme, že dávka propofolu u těchto pacientů byla vyšší než 4 mg/kg/hod po dobu nejméně 48 hodin (40). Také riziko útlumu dechu vlivem opioidních analgetik a sedativ je významně vyšší u dětí než u dospělých (1). Závěr Většina nežádoucích účinků léčiv u dětí a adolescentů se neliší od těch u dospělé populace. Existují však i polékové syndromy specifické pro tuto věkovou skupinu, na které bychom neměli zapomínat. Ne každé léčivo vhodné pro dospělého pacienta je vhodné i pro dítě. Řada léčiv není na dětech klinicky testována, a přesto se v běžné praxi používají. Pokud lékař nemá k dispozici léčivo pro dítě registrované, nezbývá mu, než se řídit zkušenostmi a dostupnými odbornými doporučeními. Pokud dojde k výskytu takového nežádoucího účinku, je velmi důležité i jeho hlášení a následné zpracování dostupných údajů ve farmakovigilančních systémech. Pochopení této problematiky by mělo přispět k používání účelné farmakoterapie a k prevenci výskytu závažných nežádoucích účinků. Literatura 1. Imti Choonara I, Rieder MJ. Drug Toxicity and Adverse Drug Reactions in Children. Paediatric and Perinatal Drug Therapy, 2002; 5(1): Van den Anker JN. Developmental pharmacology. Dev Disabil Res Rev. 2010; 16(3): Rhodin MM, Anderson BJ, Peters AM, Coulthard MG, Wilkins B, et al. Human renal function maturation: a quantitative description using weight and postmenstrual age. Pediatr Nephrol. 2009; 24(1): Johnson TN. The development of drug metabolising enzymes and their influence on the susceptibility to adverse drug reactions in children. Toxicology. 2003; 192(1): Clavenna A, Bonati M. Adverse drug reactions in childhood: a review of prospective studies and safety alerts. Arch Dis Child. 2009; 94(9): Napoleone E. Children and ADRs (Adverse Drug Reactions). Ital J Pediatr. 2010; 36: Kimland E, Rane A, Ufer M, Panagiotidis G. Paediatric adverse drug reactions reported in Sweden from 1987 to Pharmacoepidemiol Drug Saf. 2005; 14(7): Le J, Nguyen T, Law AV, Hodding J. Adverse drug reactions among children over a 10-year period. Pediatrics. 2006; 118(2): Star K, Norén GN, Nordin K, Edwards IR. Suspected Adverse Drug Reactions Reported For Children Worldwide: An Exploratory Study Using VigiBase. Drug Saf. 2011; 34(5): Gosalakkal JA, Kamoji V. Reye syndrome and reye-like syndrome. Pediatr Neurol. 2008; 39(3): Beutler AI, Chesnut GT, Mattingly JC, Jamieson B. FPIN s Clinical Inquiries. Aspirin use in children for fever or viral syndromes. Am Fam Physician. 2009; 80(12): Pugliese A, Beltramo T, Torre D. Reye s and Reye s-like syndromes. Cell Biochem Funct. 2008; 26(7): Thomas L. Clinical Laboratory Diagnostics: Use and Assessment of Clinical Laboratory Results. TH-Books-Verl.-Ges., Frankfurt/Main, Mulhall A, de Louvois J, Hurley R. Chloramphenicol toxicity in neonates: its incidence and prevention. Caldwell PH, Murphy SB, Butow PN, Craig JC. Clinical trials in children. Lancet. 2004; 364(9436): Kriška M, a kol. Riziko liekov v medicinskej praxi. Prvé vydanie. Bratislava; Slovak Academic Press, spol. s.r.o., Dukes MNG, Aronson JK, eds. Meyler s Side Effects of Drugs. 14th ed. New York; Elesevier, Sweetman SC ed. Martindale: The Complete Drug Reference. 35th ed. London; Pharmaceutical Press, Brunton LL, Lazo JS, Parker KL. Godman & Gilman s The Pharmacological Basis of Therapeutics. 11th ed. New York; McGraw-Hill Companies, Sendzik J, Lode H, Stahlmann R. Quinolone-induced arthropathy: an update focusing on new mechanistic and clinical data. Int J Antimicrob Agents. 2009; 33(3): Burkhardt JE, Walterspiel JN, Schaad UB. Quinolone arthropathy in animals versus children. Clin Infect Dis. 1997; 25(5): Hampel B, Hullmann R, Schmidt H. Ciprofloxacin in pediatrics: worldwide clinical experience based on compassionate use-safety report. Pediatr Infect Dis J. 1997; 16(1): Hoes JN, Jacobs JW, Boers M, Boumpas D, Buttgereit F. EULAR evidence-based recommendations on the management of systemic glucocorticoid therapy in rheumatic diseases. Ann Rheum Dis. 2007; 66(12): Heuschkel R, Salvestrini C, Beattie RM, Hildebrand H, Walters T, Griffiths A. Guidelines for the management of growth failure in childhood inflammatory bowel disease. Inflamm Bowel Dis. 2008; 14(6): Koblížek V, Sedlák V. Použití inhalačních kortikosteroidů u různých typů bronchiálních obstrukcí. Klin Farmakol Farm 2010; 24(2): Sharek PJ, Bergman DA. The effect of inhaled steroids on the linear growth of children with asthma: a meta-analysis. Pediatrics. 2000; 106(1): Agertoft L, Pedersen S. Effect of long-term treatment with inhaled budesonide on adult height in children with asthma. N Engl J Med. 2000; 343(15): Rachelefsky G. Inhaled corticosteroids and asthma control in children: assessing impairment and risk. Pediatrics. 2009; 123(1): Grant LD. Research Strategies for Behavioral Teratology Studies. Environmental Health Perspectives 1976; 18: Schneeweiss S, Patrick AR, Solomon DH, Dormuth CR, Miller M, Mehta J, Lee JC, Wang PS. Comparative safety of antidepressant agents for children and adolescents regarding suicidal acts. Pediatrics. 2010; 125(5): Angela J. Dean PhD, Anna Hendy BPharm, Treasure Mc- Guire PhD. Antidepressants in children and adolescents-changes in utilisation after safety warnings. Pharmacoepidemiol Drug Saf. 2007; 16: Sikich N, Lerman J. Development and psychometric evaluation of the pediatric anesthesia emergence delirium scale. Anesthesiology. 2004; 100(5): Manworren RC, Paulos CL, Pop R. Treating children for acute agitation in the PACU: differentiating pain and emergence delirium. J Perianesth Nurs. 2004; 19(3): Bajwa SA, Costi D, Cyna AM. A comparison of emergence delirium scales following general anesthesia in children. Paediatr Anaesth. 2010; 20(8): Wallerstedt SM, Brunlöf G, Sundström A, Eriksson AL. Montelukast and psychiatric disorders in children. Pharmacoepidemiol Drug Saf. 2009; 18(9): Dreifuss FE, Santilli N, Langer DH, Sweeney KP, Moline KA, Menander KB. Valproic acid hepatic fatalities: a retrospective review. Neurology 1987; 37: Konishi T, Naganuma Y, Hongo K, Murakami M, Yamatani M, Okada T. Carbamazepine induced skin rash in children with epilepsy. Eur J Pediatr 1993; 152: Shear NH, Spielberg SP. Anticonvulsant hypersensitivity syndrome. In vitro assessment of risk. J Clin Invest 1988; 82: Mitchell P. Paediatric lamotrigine use hit by rash reports. Lancet 1997; 349: Besag F, McShane T, Neville B, Robinson R. Factors associated with serious skin reactions in children aged 12 years and under taking lamotrigine. Dev Med Child Neurol 1999; 41: Bray RJ. Propofol infusion syndrome in children. Paediatric Anaesthesia 1998; 8: MUDr. Petra Langerová Ústav farmakologie LF UP a FN Olomouc Hněvotínská 3, Olomouc petra.langerova@fnol.cz
Příloha II. Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC
 Příloha II Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC 68 Vědecké závěry Koordinační skupina pro vzájemné uznávání
Příloha II Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC 68 Vědecké závěry Koordinační skupina pro vzájemné uznávání
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls157416/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls157416/2011 1. NÁZEV PŘÍPRAVKU Aspirin 100 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tableta obsahuje léčivou látku:
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls157416/2011 1. NÁZEV PŘÍPRAVKU Aspirin 100 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tableta obsahuje léčivou látku:
Karbapenemy v intenzivní péči K. Urbánek
 Karbapenemy v intenzivní péči K. Urbánek Ústav farmakologie Lékařská fakulta Univerzity Palackého a Fakultní nemocnice Olomouc Rozdělení Skupina I Skupina II ertapenem, panipenem, tebipenem omezený účinek
Karbapenemy v intenzivní péči K. Urbánek Ústav farmakologie Lékařská fakulta Univerzity Palackého a Fakultní nemocnice Olomouc Rozdělení Skupina I Skupina II ertapenem, panipenem, tebipenem omezený účinek
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls111315/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Protradon 100 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje tramadoli hydrochloridum 100 mg. Úplný seznam
sp. zn. sukls111315/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Protradon 100 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje tramadoli hydrochloridum 100 mg. Úplný seznam
PARALEN 500 tablety. Doporučené dávkování paracetamolu; VĚK HMOTNOST Jednotlivá dávka Max. denní dávka 21-25 kg
 Příloha č. 2 k opravě sdělení sp.zn. sukls226519/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg.
Příloha č. 2 k opravě sdělení sp.zn. sukls226519/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg.
Klostridiová kolitida na chirurgickém pracovišti
 Klostridiová kolitida na chirurgickém pracovišti Urbánek L., Kratochvílová J., Žák J. I. chirurgická klinika Oddělení hygieny a epidemiologie Fakultní nemocnice u svaté Anny v Brně Klostridiová kolitida
Klostridiová kolitida na chirurgickém pracovišti Urbánek L., Kratochvílová J., Žák J. I. chirurgická klinika Oddělení hygieny a epidemiologie Fakultní nemocnice u svaté Anny v Brně Klostridiová kolitida
Příloha č. 2 k rozhodnutí o opravě prodloužení registrace č.j.: sukls37854/2001 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o opravě prodloužení registrace č.j.: sukls37854/2001 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU P A R A L E N 125 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta
Příloha č. 2 k rozhodnutí o opravě prodloužení registrace č.j.: sukls37854/2001 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU P A R A L E N 125 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
CZ PAR. QUETIAPINI FUMARAS Seroquel. NL/W/0004/pdWS/002
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury NL/W/0004/pdWS/002 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA ZMĚNA V SmPC
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury NL/W/0004/pdWS/002 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA ZMĚNA V SmPC
Antibiotická léčba v graviditě. Olga Džupová Klinika infekčních nemocí 3. LF UK a FN Na Bulovce Praha
 Antibiotická léčba v graviditě Olga Džupová Klinika infekčních nemocí 3. LF UK a FN Na Bulovce Praha Antibiotika v graviditě patří mezi nejčastěji předepisované léky Indikace: infekce běžné i v ostatní
Antibiotická léčba v graviditě Olga Džupová Klinika infekčních nemocí 3. LF UK a FN Na Bulovce Praha Antibiotika v graviditě patří mezi nejčastěji předepisované léky Indikace: infekce běžné i v ostatní
Léčba astma bronchiale
 Léčba astma bronchiale Karel Urbánek, Ústav farmakologie LF UP v Olomouc 26. října 2011 Astma Úvod 2 agonisté Xantiny Antimuskarinika Kortikoidy Stabilizátory mastocytů a antileukotrieny Astma Chronické
Léčba astma bronchiale Karel Urbánek, Ústav farmakologie LF UP v Olomouc 26. října 2011 Astma Úvod 2 agonisté Xantiny Antimuskarinika Kortikoidy Stabilizátory mastocytů a antileukotrieny Astma Chronické
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
Lékové interakce kyseliny acetylsalicylové, NSA a paracetamolu
 Lékové interakce kyseliny acetylsalicylové, NSA a paracetamolu MUDr. Michal Prokeš PharmDr. Josef Suchopár WWW.INFOPHARM.CZ Lékové interakce kyseliny acetylsalicylové (ASA) ASA zvyšuje: Krvácivost při
Lékové interakce kyseliny acetylsalicylové, NSA a paracetamolu MUDr. Michal Prokeš PharmDr. Josef Suchopár WWW.INFOPHARM.CZ Lékové interakce kyseliny acetylsalicylové (ASA) ASA zvyšuje: Krvácivost při
Psychofarmaka a gravidita. MUDr. Zdeňka Vyhnánková
 Psychofarmaka a gravidita MUDr. Zdeňka Vyhnánková ZÁKLADNÍ PRAVIDLA PRO FARMAKOTERAPII V TĚHOTENSTVÍ nemoc většinou znamená větší riziko než léčba indikace by měla být podložená a ne alibistická většina
Psychofarmaka a gravidita MUDr. Zdeňka Vyhnánková ZÁKLADNÍ PRAVIDLA PRO FARMAKOTERAPII V TĚHOTENSTVÍ nemoc většinou znamená větší riziko než léčba indikace by měla být podložená a ne alibistická většina
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Betalaktamy v intenzivní péči z pohledu farmakologa
 Betalaktamy v intenzivní péči z pohledu farmakologa K. Urbánek Ústav farmakologie Lékařská fakulta Univerzity Palackého a Fakultní nemocnice Olomouc Přehled karbapenemů Karbapenemová antibiotika Skupina
Betalaktamy v intenzivní péči z pohledu farmakologa K. Urbánek Ústav farmakologie Lékařská fakulta Univerzity Palackého a Fakultní nemocnice Olomouc Přehled karbapenemů Karbapenemová antibiotika Skupina
2018 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 Evropské přehodnocení fluorochinolonů nová doporučení k omezení používání MUDr. Eva Jirsová SÚKL Fluorochinolony hlavní pozitiva Velmi dobře účinné proti širokému spektru bakterií Dobře pronikají do buněk
Evropské přehodnocení fluorochinolonů nová doporučení k omezení používání MUDr. Eva Jirsová SÚKL Fluorochinolony hlavní pozitiva Velmi dobře účinné proti širokému spektru bakterií Dobře pronikají do buněk
CZ PAR. QUETIAPINI FUMARAS Seroquel. UK/W/0004/pdWS/001 NL/W/0004/pdWS/001
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
DODATKY, KTERÉ MAJÍ BÝT DOPLNĚNY DO PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH NIMESULID (SYSTÉMOVÉ FORMULACE)
 PŘÍLOHA III 1 DODATKY, KTERÉ MAJÍ BÝT DOPLNĚNY DO PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH NIMESULID (SYSTÉMOVÉ FORMULACE) Dodatky jsou psány kurzívou a podtrženě, vymazané
PŘÍLOHA III 1 DODATKY, KTERÉ MAJÍ BÝT DOPLNĚNY DO PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH NIMESULID (SYSTÉMOVÉ FORMULACE) Dodatky jsou psány kurzívou a podtrženě, vymazané
Očkování chronicky nemocných
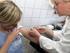 Očkování chronicky nemocných Jan Smetana Roman Chlíbek Renáta Šošovičková 1 Fakulta vojenského zdravotnictví UO Hradec Králové Komu je očkování určeno (pomineme význam plošné vakcinace) 2 1. Osoby se zvýšeným
Očkování chronicky nemocných Jan Smetana Roman Chlíbek Renáta Šošovičková 1 Fakulta vojenského zdravotnictví UO Hradec Králové Komu je očkování určeno (pomineme význam plošné vakcinace) 2 1. Osoby se zvýšeným
ŽIVOTNÍ CYKLUS LÉKŮ KLINICKÉ HODNOCENÍ STUDIE. Kateřina Kopečková FN Motol, Praha
 ŽIVOTNÍ CYKLUS LÉKŮ KLINICKÉ HODNOCENÍ STUDIE Kateřina Kopečková FN Motol, Praha Klinická hodnocení LP Nedílnou součásti vývoje léčiva Navazují na preklinický výzkum Pacienti jsou subjekty hodnocení V
ŽIVOTNÍ CYKLUS LÉKŮ KLINICKÉ HODNOCENÍ STUDIE Kateřina Kopečková FN Motol, Praha Klinická hodnocení LP Nedílnou součásti vývoje léčiva Navazují na preklinický výzkum Pacienti jsou subjekty hodnocení V
Fluorochinolonová antibiotika omezení používání potvrzeno
 Fluorochinolonová antibiotika omezení používání potvrzeno Důležité upozornění k omezení používání fluorochinolonových antibiotik v klinické praxi. Prosím, věnujte mu pozornost. Děkuji Míša Matoušková Fluorochinolonová
Fluorochinolonová antibiotika omezení používání potvrzeno Důležité upozornění k omezení používání fluorochinolonových antibiotik v klinické praxi. Prosím, věnujte mu pozornost. Děkuji Míša Matoušková Fluorochinolonová
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
Příloha III. Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls30500/2010 1. NÁZEV PŘÍPRAVKU Zolsana 10 mg SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Zolpidemi tartras 10 mg v jedné potahované
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls30500/2010 1. NÁZEV PŘÍPRAVKU Zolsana 10 mg SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Zolpidemi tartras 10 mg v jedné potahované
 Farmakoterapie v těhotenstvt hotenství osnova realita a současný stav teratogeny, teratogenní působení LČ rizika vybrané skupiny léčiv potraviny po zvláštní výživu závěr realita a současný stav - ČR neexistence
Farmakoterapie v těhotenstvt hotenství osnova realita a současný stav teratogeny, teratogenní působení LČ rizika vybrané skupiny léčiv potraviny po zvláštní výživu závěr realita a současný stav - ČR neexistence
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
PŘÍLOHA III DODATKY K SOUHRN ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACI
 PŘÍLOHA III DODATKY K SOUHRN ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACI 1 DODATKY MAJÍ BÝT ZAŘAZENY DO ODPOVÍDAJÍCÍCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH MOXIFLOXACIN Následující
PŘÍLOHA III DODATKY K SOUHRN ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACI 1 DODATKY MAJÍ BÝT ZAŘAZENY DO ODPOVÍDAJÍCÍCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH MOXIFLOXACIN Následující
Farmakokinetika antibiotik v perioperačním období
 Farmakokinetika antibiotik v perioperačním období K. Urbánek Ústav farmakologie Lékařská fakulta Univerzity Palackého a Fakultní nemocnice Olomouc Antibiotická profylaxe Aplikace antibiotik s cílem snížit
Farmakokinetika antibiotik v perioperačním období K. Urbánek Ústav farmakologie Lékařská fakulta Univerzity Palackého a Fakultní nemocnice Olomouc Antibiotická profylaxe Aplikace antibiotik s cílem snížit
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
 Sp.zn.sukls137614/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
Sp.zn.sukls137614/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
NOCICEPTIVNÍ NEUROPATICKÁ
 BOLEST Typy bolesti 1. NOCICEPTIVNÍ zprostředkovávají ji nociceptivní receptory, to znamená, že vychází z nervových zakončení bolesti zad, kloubů, 2. NEUROPATICKÁ bolest z nervového systému, např. při
BOLEST Typy bolesti 1. NOCICEPTIVNÍ zprostředkovávají ji nociceptivní receptory, to znamená, že vychází z nervových zakončení bolesti zad, kloubů, 2. NEUROPATICKÁ bolest z nervového systému, např. při
Výskyt rotavirových onemocnění v České republice v letech , EpiDat Michaela Špačková, Martin Gašpárek
 Výskyt rotavirových onemocnění v České republice v letech 1997-2017, EpiDat Michaela Špačková, Martin Gašpárek Oddělení epidemiologie infekčních nemocí, Národní referenční centrum pro analýzu epidemiologických
Výskyt rotavirových onemocnění v České republice v letech 1997-2017, EpiDat Michaela Špačková, Martin Gašpárek Oddělení epidemiologie infekčních nemocí, Národní referenční centrum pro analýzu epidemiologických
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls2006/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL Rapide potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls2006/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL Rapide potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
Phenylephrini hydrochloridum Acidum ascorbicum. Pomocné látky se známým účinkem: sacharóza 3725 mg/sáček, sodík 116 mg/sáček.
 sp. zn. sukls189078/2015 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU COLDREX MaxGrip Citron prášek pro perorální roztok v sáčku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje: Paracetamolum
sp. zn. sukls189078/2015 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU COLDREX MaxGrip Citron prášek pro perorální roztok v sáčku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje: Paracetamolum
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Optimální dávkování paracetamolu při léčbě bolesti a horečky
 Aktuální farmakoterapie 171 Optimální dávkování paracetamolu při léčbě bolesti a horečky prof. MUDr. Miloslav Kršiak, DrSc. 1, prof. MUDr. Jan Švihovec, DrSc. 2, prof. Igor Zupanets, MD, PhD. 3, prof.
Aktuální farmakoterapie 171 Optimální dávkování paracetamolu při léčbě bolesti a horečky prof. MUDr. Miloslav Kršiak, DrSc. 1, prof. MUDr. Jan Švihovec, DrSc. 2, prof. Igor Zupanets, MD, PhD. 3, prof.
2. Kvalitativní a kvantitativní složení Léčivé látky: Acidum acetylsalicylicum
 sp.zn.sukls153805/2014 Souhrn údajů o přípravku 1. Název přípravku Acylcoffin 2. Kvalitativní a kvantitativní složení Léčivé látky: Acidum acetylsalicylicum Coffeinum Pomocné látky viz 6.1. 450 mg 50 mg
sp.zn.sukls153805/2014 Souhrn údajů o přípravku 1. Název přípravku Acylcoffin 2. Kvalitativní a kvantitativní složení Léčivé látky: Acidum acetylsalicylicum Coffeinum Pomocné látky viz 6.1. 450 mg 50 mg
CZ PAR QUETIAPINUM. Seroquel. UK/W/0004/pdWS/001. NL/W/0004/pdWS/001
 CZ PAR Název (léčivá látka/ přípravek) Číslo procedury QUETIAPINUM Seroquel UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZVY PŘÍPRAVKŮ KLINICKÝCH STUDIÍ INN DRŽITELÉ PŘÍPRAVKŮ KLINICKÝCH STUDIÍ SCHVÁLENÉ
CZ PAR Název (léčivá látka/ přípravek) Číslo procedury QUETIAPINUM Seroquel UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZVY PŘÍPRAVKŮ KLINICKÝCH STUDIÍ INN DRŽITELÉ PŘÍPRAVKŮ KLINICKÝCH STUDIÍ SCHVÁLENÉ
CHONDROITIN SULFÁT: postavení v léčbě osteoartrózy
 CHONDROITIN SULFÁT: postavení v léčbě osteoartrózy J Vyhláška č. 446/2004 Sb., kterou se stanoví požadavky na doplňky stravy a na obohacování potravin potravními doplňky 4 Označování doplňků stravy Podle
CHONDROITIN SULFÁT: postavení v léčbě osteoartrózy J Vyhláška č. 446/2004 Sb., kterou se stanoví požadavky na doplňky stravy a na obohacování potravin potravními doplňky 4 Označování doplňků stravy Podle
SOUHRN ÚDAJU O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.: sukls21791/2006 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL BABY ČÍPKY 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje paracetamolum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.: sukls21791/2006 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL BABY ČÍPKY 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje paracetamolum
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Implementace laboratorní medicíny do systému vzdělávání na Univerzitě Palackého v Olomouci. reg. č.: CZ.1.07/2.2.00/
 Implementace laboratorní medicíny do systému vzdělávání na Univerzitě Palackého v Olomouci reg. č.: CZ.1.07/2.2.00/28.0088 KLINICKÁ MIKROBIOLOGIE Klinická mikrobiologie je medicínský obor - pojítko mezi
Implementace laboratorní medicíny do systému vzdělávání na Univerzitě Palackého v Olomouci reg. č.: CZ.1.07/2.2.00/28.0088 KLINICKÁ MIKROBIOLOGIE Klinická mikrobiologie je medicínský obor - pojítko mezi
Chronická bolest léčení a diagnostika z pohledu současných možností. MUDr. Dana Vondráčková Centrum léčby bolesti FNB
 Chronická bolest léčení a diagnostika z pohledu současných možností MUDr. Dana Vondráčková Centrum léčby bolesti FNB Základní dělení bolesti Akutní bolest Přirozený fyziologický jev Ochranná funkce Vegetativní
Chronická bolest léčení a diagnostika z pohledu současných možností MUDr. Dana Vondráčková Centrum léčby bolesti FNB Základní dělení bolesti Akutní bolest Přirozený fyziologický jev Ochranná funkce Vegetativní
KLINICKÉ A LABORATORNÍ CHARAKTERISTIKY ROTAVIROVÝCH A NOROVIROVÝCH INFEKCÍ. Helena Ambrožová 1. infekční klinika 2. LF UK a NNB
 KLINICKÉ A LABORATORNÍ CHARAKTERISTIKY ROTAVIROVÝCH A NOROVIROVÝCH INFEKCÍ Helena Ambrožová 1. infekční klinika 2. LF UK a NNB X. Hradecké vakcinologické dny, Hradec Králové 4.10.2014 Rotaviry - charakteristika
KLINICKÉ A LABORATORNÍ CHARAKTERISTIKY ROTAVIROVÝCH A NOROVIROVÝCH INFEKCÍ Helena Ambrožová 1. infekční klinika 2. LF UK a NNB X. Hradecké vakcinologické dny, Hradec Králové 4.10.2014 Rotaviry - charakteristika
Psychiatrická komorbidita pacientů léčených v souvislosti s užíváním návykových látek
 Psychiatrická komorbidita pacientů léčených v souvislosti s užíváním návykových látek Podle údajů ÚZIS (2004) bylo v r. 2003 v psychiatrických léčebnách a odděleních nemocnic uskutečněno celkem 4 636 hospitalizací
Psychiatrická komorbidita pacientů léčených v souvislosti s užíváním návykových látek Podle údajů ÚZIS (2004) bylo v r. 2003 v psychiatrických léčebnách a odděleních nemocnic uskutečněno celkem 4 636 hospitalizací
Eva Krejčí. Antibiotické středisko, Zdravotní ústav se sídlem v Ostravě Lékařská fakulta Ostravské univerzity
 Eva Krejčí Antibiotické středisko, Zdravotní ústav se sídlem v Ostravě Lékařská fakulta Ostravské univerzity Jeden z problémů v pediatrické péči, jenž budou řešit naši nástupci, bude narůstající rezistence
Eva Krejčí Antibiotické středisko, Zdravotní ústav se sídlem v Ostravě Lékařská fakulta Ostravské univerzity Jeden z problémů v pediatrické péči, jenž budou řešit naši nástupci, bude narůstající rezistence
Alkohol - s léky na spaní - s léky na bakteriální infekce - s léky na vaginální infekce
 Alkohol -s léky na spaní (hypnogen, stilnox, zolpidem) zvýší tlumivý efekt léků, utlumím pozornost, zvýší ospalost, útlum -s léky na bakteriální infekce (biseptol, cotrimaxol, ) tato kombinace blokuje
Alkohol -s léky na spaní (hypnogen, stilnox, zolpidem) zvýší tlumivý efekt léků, utlumím pozornost, zvýší ospalost, útlum -s léky na bakteriální infekce (biseptol, cotrimaxol, ) tato kombinace blokuje
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Phenylephrini hydrochloridum Acidum ascorbicum ethylcelluloso obductum (odpovídá acidum ascorbicum 58,5 mg)
 sp. zn. sukls189077/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU COLDREX HORKÝ NÁPOJ CITRON S MEDEM prášek pro perorální roztok v sáčku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje:
sp. zn. sukls189077/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU COLDREX HORKÝ NÁPOJ CITRON S MEDEM prášek pro perorální roztok v sáčku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje:
Obsah 1 Úvod 2 Variabilita lékové odpovědi 3 Klinické využití určování koncentrace léčiv
 Obsah 1 Úvod... 11 2 Variabilita lékové odpovědi... 14 2.1 Faktory variability... 14 2.2 Vliv onemocnění... 17 2.2.1 Chronické srdeční selhání... 17 2.2.2 Snížená funkce ledvin... 18 2.2.3 Snížená funkce
Obsah 1 Úvod... 11 2 Variabilita lékové odpovědi... 14 2.1 Faktory variability... 14 2.2 Vliv onemocnění... 17 2.2.1 Chronické srdeční selhání... 17 2.2.2 Snížená funkce ledvin... 18 2.2.3 Snížená funkce
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Informace pro zdravotnické odborníky
 EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
Trendy rizik lékových interakcí u klientů Zdravotní pojišťovny Škoda v letech 2001-2005
 Trendy rizik lékových interakcí u klientů Zdravotní pojišťovny Škoda v letech 21-25 Prokeš M, Vitásek Z, Kolář J WWW.INFOPHARM.CZ Zdravotní pojišťovna Škoda ZPŠ a její klienti PRAHA Počet klientů ZPŠ:
Trendy rizik lékových interakcí u klientů Zdravotní pojišťovny Škoda v letech 21-25 Prokeš M, Vitásek Z, Kolář J WWW.INFOPHARM.CZ Zdravotní pojišťovna Škoda ZPŠ a její klienti PRAHA Počet klientů ZPŠ:
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Markéta Bodzašová FN Brno KARIM
 Markéta Bodzašová FN Brno KARIM Analgosedace jako nezbytná součást péče o kriticky nemocného Cíle outcome pacienta Změna přístupu v hloubce analgosedace a volbě medikace Spojena s problematikou deliria
Markéta Bodzašová FN Brno KARIM Analgosedace jako nezbytná součást péče o kriticky nemocného Cíle outcome pacienta Změna přístupu v hloubce analgosedace a volbě medikace Spojena s problematikou deliria
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 5 mg/ml injekční roztok pro skot a prasata
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUMIREX
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUMIREX 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Fluoxetini hydrochloridum 22,36 mg (odp. 20 mg fluoxetinu) v 1 tobolce. Pomocné látky viz 6.1. 3. LÉKOVÁ FORMA
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUMIREX 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Fluoxetini hydrochloridum 22,36 mg (odp. 20 mg fluoxetinu) v 1 tobolce. Pomocné látky viz 6.1. 3. LÉKOVÁ FORMA
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls30063/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU. Chondrostad 1500 mg
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls30063/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Chondrostad 1500 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje 1884,0 mg
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls30063/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Chondrostad 1500 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje 1884,0 mg
PNEUMOKOKOVÉ INFEKCE A MOŽNOSTI PREVENCE aneb CO MŮŽE ZPŮSOBIT PNEUMOKOK
 PNEUMOKOKOVÉ INFEKCE A MOŽNOSTI PREVENCE aneb CO MŮŽE ZPŮSOBIT PNEUMOKOK Očkování! Nejvýznamnější možnost prevence infekčních chorob! Lepší infekční chorobě předcházet než ji léčit! Významný objev v medicíně,
PNEUMOKOKOVÉ INFEKCE A MOŽNOSTI PREVENCE aneb CO MŮŽE ZPŮSOBIT PNEUMOKOK Očkování! Nejvýznamnější možnost prevence infekčních chorob! Lepší infekční chorobě předcházet než ji léčit! Významný objev v medicíně,
Rozbory preskripce ATB: Je třeba zohlednit věk pacientů?
 Rozbory preskripce : Je třeba zohlednit věk pacientů? Prokeš, INFOPHARM a.s., Němec, VZP ČR Máme v ČR problém s rezistencí na? Rezistence na fluorochinolony v Evropě 2004 1 Základní principy snižování
Rozbory preskripce : Je třeba zohlednit věk pacientů? Prokeš, INFOPHARM a.s., Němec, VZP ČR Máme v ČR problém s rezistencí na? Rezistence na fluorochinolony v Evropě 2004 1 Základní principy snižování
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy o bezpečnosti (PSUR) pro ibuprofen, ibuprofen-lysin
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy o bezpečnosti (PSUR) pro ibuprofen, ibuprofen-lysin
Příloha IV. Vědecké závěry
 Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
Příloha II. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 21 Vědecké závěry Celkové závěry vědeckého hodnocení přípravků Oxynal a Targin a souvisejících názvů (viz příloha I) Podkladové
Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 21 Vědecké závěry Celkové závěry vědeckého hodnocení přípravků Oxynal a Targin a souvisejících názvů (viz příloha I) Podkladové
Neuroaxiální analgezie - základy anatomie a fyziologie. Pavel Svoboda Nemocnice sv. Zdislavy, a.s.; Mostiště Domácí hospic sv. Zdislavy, a.s.
 Neuroaxiální analgezie - základy anatomie a fyziologie Pavel Svoboda Nemocnice sv. Zdislavy, a.s.; Mostiště Domácí hospic sv. Zdislavy, a.s.; Třebíč II. brněnský den klinické farmacie, 11. února 2016 Obsah
Neuroaxiální analgezie - základy anatomie a fyziologie Pavel Svoboda Nemocnice sv. Zdislavy, a.s.; Mostiště Domácí hospic sv. Zdislavy, a.s.; Třebíč II. brněnský den klinické farmacie, 11. února 2016 Obsah
Sp.zn.sukls88807/2015
 Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Intoxikace metanolem a odběr orgánů. Peter Sklienka KARIM FN Ostrava
 Intoxikace metanolem a odběr orgánů Peter Sklienka KARIM FN Ostrava Intoxikace a odběr orgánů Problém transplantace orgánů od intoxikovaných dárců: Legislativa Orgánově specifická toxicita Možný transfer
Intoxikace metanolem a odběr orgánů Peter Sklienka KARIM FN Ostrava Intoxikace a odběr orgánů Problém transplantace orgánů od intoxikovaných dárců: Legislativa Orgánově specifická toxicita Možný transfer
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Vědecké závěry a podrobné vysvětlení vědeckého zdůvodnění rozdílů oproti doporučení výboru PRAC
 Příloha II Vědecké závěry a zdůvodnění změny podmínek podmíněných registrací a podrobné vysvětlení vědeckého zdůvodnění rozdílů oproti doporučení výboru PRAC 85 Vědecké závěry a podrobné vysvětlení vědeckého
Příloha II Vědecké závěry a zdůvodnění změny podmínek podmíněných registrací a podrobné vysvětlení vědeckého zdůvodnění rozdílů oproti doporučení výboru PRAC 85 Vědecké závěry a podrobné vysvětlení vědeckého
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tableta obsahuje: 5 mg zolpidemi tartras, což odpovídá zolpidemum 4,019 mg.
 Sp.zn. sukls19085/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Adorma 5 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: 5 mg zolpidemi tartras, což odpovídá zolpidemum
Sp.zn. sukls19085/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Adorma 5 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: 5 mg zolpidemi tartras, což odpovídá zolpidemum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls171755/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VIKLAREN 10 mg/g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g gelu obsahuje10 mg diclofenacum natricum. Úplný seznam pomocných látek
sp.zn. sukls171755/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VIKLAREN 10 mg/g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g gelu obsahuje10 mg diclofenacum natricum. Úplný seznam pomocných látek
Chyby, mýty a omyly v léčbě bolesti Tomáš Gabrhelík
 Chyby, mýty a omyly v léčbě bolesti Tomáš Gabrhelík ARO KNTB Zlín KARIM FN a LF UP v Olomouci Cíle léčby akutní bolesti Cílem je kvalitní analgezie (VAS 0-3) při minimálních NÚ Respektovat signální ochranný
Chyby, mýty a omyly v léčbě bolesti Tomáš Gabrhelík ARO KNTB Zlín KARIM FN a LF UP v Olomouci Cíle léčby akutní bolesti Cílem je kvalitní analgezie (VAS 0-3) při minimálních NÚ Respektovat signální ochranný
PŘÍLOHA III ZMĚNY PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Poznámka:
 PŘÍLOHA III ZMĚNY PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Změny v souhrnu údajů o přípravku a příbalové informaci možná bude následně třeba nechat (v případě potřeby
PŘÍLOHA III ZMĚNY PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Změny v souhrnu údajů o přípravku a příbalové informaci možná bude následně třeba nechat (v případě potřeby
Farmakokinetika. Farmakokinetika (pharmacon + kinetikos) Farmakodynamika. 26. února Popisuje osud léčiva v těle Co dělá tělo s lékem
 Ústav farmakologie LF UP v Olomouc 26. února 29 Základní pojmy (pharmacon + kinetikos) Popisuje osud léčiva v těle Co dělá tělo s lékem Základní pojmy Farmakodynamika Popisuje účinek léku na organismus
Ústav farmakologie LF UP v Olomouc 26. února 29 Základní pojmy (pharmacon + kinetikos) Popisuje osud léčiva v těle Co dělá tělo s lékem Základní pojmy Farmakodynamika Popisuje účinek léku na organismus
ANTIBIOTICKÁ LÉČBA INFEKCÍ MOČOVÝCH CEST PŘI RENÁLNÍ INSUFICIENCI. Alena Linhartová Thomayerova nemocnice, Praha
 ANTIBIOTICKÁ LÉČBA INFEKCÍ MOČOVÝCH CEST PŘI RENÁLNÍ INSUFICIENCI Alena Linhartová Thomayerova nemocnice, Praha IMC symptomatické (kolonizace invaze zánět) signifikantní bakteriurie, pyurie, klinické příznaky
ANTIBIOTICKÁ LÉČBA INFEKCÍ MOČOVÝCH CEST PŘI RENÁLNÍ INSUFICIENCI Alena Linhartová Thomayerova nemocnice, Praha IMC symptomatické (kolonizace invaze zánět) signifikantní bakteriurie, pyurie, klinické příznaky
Aurorix 150 mg: Jedna potahovaná tableta obsahuje moclobemidum 150 mg. Aurorix 300 mg: Jedna potahovaná tableta obsahuje moclobemidum 300 mg
 sp.zn. sukls76854/2014 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU AURORIX 150 mg AURORIX 300 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Aurorix 150 mg: Jedna potahovaná tableta obsahuje
sp.zn. sukls76854/2014 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU AURORIX 150 mg AURORIX 300 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Aurorix 150 mg: Jedna potahovaná tableta obsahuje
Citlivost a rezistence mikroorganismů na antimikrobiální léčiva
 Citlivost a rezistence mikroorganismů na antimikrobiální léčiva Sylva Janovská Univerzita Pardubice Fakulta chemicko-technologická Katedra biologických a biochemických věd Centralizovaný rozvojový projekt
Citlivost a rezistence mikroorganismů na antimikrobiální léčiva Sylva Janovská Univerzita Pardubice Fakulta chemicko-technologická Katedra biologických a biochemických věd Centralizovaný rozvojový projekt
SOUHRN ÚDAJU O PŘÍPRAVKU
 1 sp. zn. sukls29142/2016 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Panadol Junior čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje paracetamolum 250 mg. Úplný seznam pomocných látek
1 sp. zn. sukls29142/2016 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Panadol Junior čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje paracetamolum 250 mg. Úplný seznam pomocných látek
Příloha II. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 406 Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci Ibuprofen je nesteroidní protizánětlivé léčivo (NSAID)
Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 406 Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci Ibuprofen je nesteroidní protizánětlivé léčivo (NSAID)
HIV (z klinického pohledu)
 HIV (z klinického pohledu) David Jilich HIV centrum, Nemocnice Na Bulovce, Praha 11.12. 2014 Vývoj situace ve světě Changes in incidance rate 2001 to 2009 zdroj: UNAIDS Zákadní charakteristika virová infekce
HIV (z klinického pohledu) David Jilich HIV centrum, Nemocnice Na Bulovce, Praha 11.12. 2014 Vývoj situace ve světě Changes in incidance rate 2001 to 2009 zdroj: UNAIDS Zákadní charakteristika virová infekce
PYELONEFRITIDA A INTERSTICIÁLNÍ NEFRITIDY
 PYELONEFRITIDA A INTERSTICIÁLNÍ NEFRITIDY Doc. MUDr. Květoslava Dostálová, CSc. Ústav patologické fyziologie LF UP Název projektu: Tvorba a ověření e-learningového prostředí pro integraci výuky preklinických
PYELONEFRITIDA A INTERSTICIÁLNÍ NEFRITIDY Doc. MUDr. Květoslava Dostálová, CSc. Ústav patologické fyziologie LF UP Název projektu: Tvorba a ověření e-learningového prostředí pro integraci výuky preklinických
RESPIRAČNÍ INFEKCE. Milan Kolář
 RESPIRAČNÍ INFEKCE Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci Nejčastějšími bakteriálními původci infekcí horních a dolních cest dýchacích v komunitním prostředí jsou kmeny: Streptococcus
RESPIRAČNÍ INFEKCE Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci Nejčastějšími bakteriálními původci infekcí horních a dolních cest dýchacích v komunitním prostředí jsou kmeny: Streptococcus
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls225294/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka Jedna potahovaná
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls225294/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka Jedna potahovaná
1. Náplň oboru 3 A Klasifikace a názvy léčiv 4
 Obsah V A Obecné principy klinické farmakologie 1. Náplň oboru 3 A Klasifikace a názvy léčiv 4 2. Farmakokinetické principy 7 2.1. Příklady zjednodušených farmakokinetických výpočtů 9 2.1.1. Optimalizace
Obsah V A Obecné principy klinické farmakologie 1. Náplň oboru 3 A Klasifikace a názvy léčiv 4 2. Farmakokinetické principy 7 2.1. Příklady zjednodušených farmakokinetických výpočtů 9 2.1.1. Optimalizace
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Epilepsie a epileptické záchvaty. Petr Marusič, Martin Tomášek, Hana Krijtová Centrum pro epilepsie Motol Neurologická klinika 2.
 Epilepsie a epileptické záchvaty Petr Marusič, Martin Tomášek, Hana Krijtová Centrum pro epilepsie Motol Neurologická klinika 2. LF UK a FN Motol Epilepsie Jedno z nejčastějších onemocnění CNS Prevalence:
Epilepsie a epileptické záchvaty Petr Marusič, Martin Tomášek, Hana Krijtová Centrum pro epilepsie Motol Neurologická klinika 2. LF UK a FN Motol Epilepsie Jedno z nejčastějších onemocnění CNS Prevalence:
LÉČBA BOLESTI - POHLED SÚKL NA KLINICKÁ HODNOCENÍ
 Léčba bolesti pohled SÚKL na klinická hodnocení 1 LÉČBA BOLESTI - POHLED SÚKL NA KLINICKÁ HODNOCENÍ MUDr. Alice Němcová MUDr. Alena Trunečková Léčba bolesti pohled SÚKL na klinická hodnocení 2 Klinická
Léčba bolesti pohled SÚKL na klinická hodnocení 1 LÉČBA BOLESTI - POHLED SÚKL NA KLINICKÁ HODNOCENÍ MUDr. Alice Němcová MUDr. Alena Trunečková Léčba bolesti pohled SÚKL na klinická hodnocení 2 Klinická
2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje 15 mg nebo 30 mg nebo 45 mg mirtazapinum. Pomocné látky viz bod 6.1.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mirtawin 15 mg Mirtawin 30 mg Mirtawin 45 mg 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje 15 mg nebo 30 mg nebo 45 mg mirtazapinum.
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mirtawin 15 mg Mirtawin 30 mg Mirtawin 45 mg 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje 15 mg nebo 30 mg nebo 45 mg mirtazapinum.
Jedna obalená tableta obsahuje acidum acetylsalicylicum 500 mg.
 Sp.zn.sukls259906/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Aspirin 500 mg obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje acidum acetylsalicylicum 500 mg.
Sp.zn.sukls259906/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Aspirin 500 mg obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje acidum acetylsalicylicum 500 mg.
NEFARMAKOLOGICKÉ PŘÍSTUPY OVLIVNĚNÍ BOLESTI NOVOROZENCE
 NEFARMAKOLOGICKÉ PŘÍSTUPY OVLIVNĚNÍ BOLESTI NOVOROZENCE to make neonatal (intensive) care more humane Jan Malý Dětská klinika LF UK a FN Hradec Králové DOPORUČENÍ AAP 2006 zavedení rutinních postupů vedoucích
NEFARMAKOLOGICKÉ PŘÍSTUPY OVLIVNĚNÍ BOLESTI NOVOROZENCE to make neonatal (intensive) care more humane Jan Malý Dětská klinika LF UK a FN Hradec Králové DOPORUČENÍ AAP 2006 zavedení rutinních postupů vedoucích
Familiární středomořská (Mediterranean) horečka (Fever)
 www.printo.it/pediatric-rheumatology/cz/intro Familiární středomořská (Mediterranean) horečka (Fever) Verze č 2016 2. DIAGNÓZA A LÉČBA 2.1 Jak se nemoc diagnostikuje? Obecně se uplatňuje následující postup:
www.printo.it/pediatric-rheumatology/cz/intro Familiární středomořská (Mediterranean) horečka (Fever) Verze č 2016 2. DIAGNÓZA A LÉČBA 2.1 Jak se nemoc diagnostikuje? Obecně se uplatňuje následující postup:
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU. PARALEN 125 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 125 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 125 mg. Úplný seznam pomocných látek viz bod 6.1. 3. LÉKOVÁ
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 125 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 125 mg. Úplný seznam pomocných látek viz bod 6.1. 3. LÉKOVÁ
Osud xenobiotik v organismu. M. Balíková
 Osud xenobiotik v organismu M. Balíková JED-NOXA-DROGA-XENOBIOTIKUM Látka, která po vstřebání do krve vyvolá chorobné změny v organismu Toxické účinky: a) přechodné b) trvale poškozující c) fatální Vzájemné
Osud xenobiotik v organismu M. Balíková JED-NOXA-DROGA-XENOBIOTIKUM Látka, která po vstřebání do krve vyvolá chorobné změny v organismu Toxické účinky: a) přechodné b) trvale poškozující c) fatální Vzájemné
Fitness for anaesthesia
 Fitness for anaesthesia Richard Pradl KARIM FN a LF UK Plzeň ČSARIM, Plzeň 2015 04/10/2015 Cílem předoperačního hodnocení stavu pacienta je pokles morbidity spojené s operačním výkonem, zvýšení efektivity
Fitness for anaesthesia Richard Pradl KARIM FN a LF UK Plzeň ČSARIM, Plzeň 2015 04/10/2015 Cílem předoperačního hodnocení stavu pacienta je pokles morbidity spojené s operačním výkonem, zvýšení efektivity
Indikace přípravku Zetamac v ordinaci praktického lékaře
 Indikace přípravku Zetamac v ordinaci praktického lékaře MUDr. Igor Karen 13.10. 2009 Zetamac léková forma azithromycinum 2g granule s prodlouženým uvolňováním pro přípravu perorální suspenze s příchutí
Indikace přípravku Zetamac v ordinaci praktického lékaře MUDr. Igor Karen 13.10. 2009 Zetamac léková forma azithromycinum 2g granule s prodlouženým uvolňováním pro přípravu perorální suspenze s příchutí
