Technologie chemických výrob. Technologie chemických výrob
|
|
|
- Marcel Dušek
- před 6 lety
- Počet zobrazení:
Transkript
1 Technologie chemických výrob Technologie chemických výrob Literatura: Technologie chemických látek / František Hovorka, Obecná chemická technologie, Jan Neiser, 1988 Chemická technológia,stanislav Mocik, 1979 Industrial Inorganic Chemistry, Karl H. Büchel et. Al, 2000 Industrial Organic Chemistry, K. Weissermel, H.-J. Arpe, 2003 Voda Voda Lidské tělo obsahuje % vody. Průměrná spotřeba vody v domácnostech na obyvatele za 1 den v ČR litrů litrů litrů Průměrná spotřeba vody v domácnostech na obyvatele za 1 den na světě je 40 litrů 70 1
2 Dělení vody podle místa výskytu v přírodě Srážková voda Povrchová voda Podzemní voda Minerální voda Přírodní podzemní voda pro které platí jedno s kritérií: mineralizace minimálně 1 gram / litr obsah CO 2 minimálně 1 gram / litr obsah H 2 S minimálně 1 gram / litr obsah Fe 2+ minimálně 10 miligramů na litr zvýšené množství pro zdraví významného chemického prvku (I, F, S, H 2 SiO 3 aj,) teplota vývěru přesahuje 20 C vykazuje radioaktivitu 1500 bq/l způsobenou radonem ( 222 Rn) Mořská voda Obsah solí kovů s větším oxidačním číslem než 1. Karbonátová tvrdost (přechodná) způsobená hydrogenuhličitany, lze ji odstranit varem Nekarbonátová tvrdost (trvalá) Způsobená převážně síranem, dusičnanem, chloridem vápenatým a hořečnatým. Celková tvrdost přechodná + trvalá Tvrdost vody Druh vody Měkká Průměrně tvrdá Tvrdá Velmi tvrdá Celková tvrdost (mmol.l -1 ) <1 1,0 až 1,5 1,5 až 3,0 >3 Stanovení znečištění vody organickými látkami Chemická Spotřeba Kyslíku (CHSK) Množství kyslíku (mg.l -1 ) spotřebovaného k oxidaci přítomných organických látek ve vodě pomocí oxidačních činidel (KMnO 4, K 2 Cr 2 O 7 ). Biochemická Spotřeba Kyslíku (BSK) Množství kyslíku (mg.l -1 ) spotřebovaného mikroorganismy na biochemické reakce. Rozdělení vody podle způsobu použití Pitná voda Užitková voda Odpadní voda První úpravny na pitnou vodu: v městě Paisley, Skotsko 1804 John Gibb Paříž James Simpson pískový filtr 2
3 Pitná voda a její úprava Vychází se z co nejméně znečistěné vody (povrchové vody) Požadavky na pitnou vodu jsou dány zákonem č.258/2000 Sb. o ochraně veřejného zdraví, vyhláška č. 252/2004 Zdravotně nezávadná, příjemná chuť, teplota 8 až 12 C, tvrdost 1,5 až 2,2 mmol.l -1 Výroba pitné vody Odstranění hrubých nečistot Odstranění drobných sedimentujících částic Chlorace Odstranění jemných nesedimentujících částic rychlá filtrace Ozonizace Čištění pomocí aktivního uhlí Odstranění železa a manganu Desinfekce Odstranění hrubých nečistot česlice rošty a síta Odstranění drobných sedimentujících částic 1) Sedimentace pomocí Dorrových usazováků 3
4 Odstranění drobných sedimentujících částic 2) Dorrovův řebenový usazováků Suspenze se zde přivádí do středu zespod (1). Částečky kalu klesají ke dnu. Pojížděcí plošina (9) je spojena jednak s hřebly pro kal (4) a současně se stěračem plovoucích nečistot (5), které jsou odtahovány (7). Vyčiřená kapalina odtéká přepadem (6) a usazený kal se z kalové jímky (3) odvádí podobným způsobem jako z kuželového usazováku (8). Odstranění jemných nesedimentujících částic čiření Čiření přidáním síranu hlinitého (při ph 6,5 7,5) nebo železitého (při ph 8,5) vznikají příslušné nerozpustné hydroxidy - vločkový mrak zachycení nesedimentující koloidní částice včetně mikroorganismů - koagulace Fe 2 (SO 4 ) H 2 O 2 Fe(OH) H 2 SO 4 Al 2 (SO 4 ) H 2 O 2 Al(OH) H 2 SO 4 Odstranění vločkového mraku Odstranění drobných sedimentujících částic 2) Pomalá filtrace Pískové filtry o ploše více jak 2000 m 2 4
5 2) Tlaková filtrace Odstranění drobných sedimentujících částic Odstranění železa a manganu Hydrogenuhličitany a sírany Fe 2+ a Mn 2+ způsobují -trpkou chuť, zabarvení, tvorba bakterií Odstranění železa provzdušněním: 4 Fe(HCO 3 ) 2 + O H 2 O 4 Fe(OH) CO 2 4 FeSO 4 + O H 2 O + 4 Ca(OH) 2 4 Fe(OH) CaSO 4 Odstranění železa a manganu Odstranění manganu provzdušněním: 2 Mn(HCO 3 ) 2 + O H 2 O 2 Mn(OH) CO 2 2 MnSO 4 + O H 2 O 2 Mn(OH) H 2 SO 4 Odstranění manganu pomocí manganových filtrů: Čištění pomocí aktivního uhlí Odstranění neutrálních organických látek jako jsou fenoly, halogenuhlovodíky a minerální oleje 4 KMnO H 2 O 4 KOH + 4 MnO(OH) O 2 Mn(HCO 3 ) 2 + MnO(OH) 2 + H 2 O 2 Mn(OH) CO 2 MnSO 4 + MnO(OH) H 2 O 2 Mn(OH) 3 + H 2 SO 4 5
6 Desinfekce = likvidace mikroorganismů 1) Chlorace nebo chloraminace Účinná látka je chlor a atomární kyslík Cl 2 + H 2 O HCl + HClO HClO H + + ClO - Zbytková koncetrace chloru u spotřebitele je 0,1 až 0,3 mg.l -1 - odstranění mikroorganismů - oxidace Mg 2+ a Mn 2+ - chlorace síranu ammoného - chlorace uhlovodíků na halogenuhlovodíky - nežádoucí 2)Ozonizace Desinfekce = likvidace mikroorganismů Účinná látka je atomární kyslík, který vzniká zaváděním ozonu do vody (0,2 až 3 g na m 3 ) 3)Ozařování ultrafialovým zářením 4)Olygodinamie kovů Katadynový filtr písek nebo aktivní uhlí nasycené stříbrem Získávání pitné vody z mořské vody Voda pokrývá 71 % zemského povrchu, z toho tvoří 97 % mořská voda. Mořská voda obsahuje 3,5 hm. % rozpuštěných solí. Pitná voda musí obsahovat méně než 0,1 hm.% rozpuštěných solí. Získávání pitné vody z mořské vody Vakuová destilace (60%) Reverzní osmóza (35%) Elektrodialýza (5%) Membránové procesy V Saudské Arábii bylo v roce 1995 připraveno z mořské vody 1, m 3 pitné vody. 6
7 Vakuová destilace Několikastupňová mžiková destilace MSF destilace Multistage flash (MSF) evaporation Membránové procesy Deskový modul pro reversní osmózu Uspořádání s dutými vlákny Reverzní osmóza Reverzní osmóza Použitý tlak 2 7 MPa 7
8 Elektrodialýza Elektrodialýza Typy membrán - Homogenní - Heterogenní Užitková voda a její úprava Způsoby úpravy jsou závislé na účelu použití užitkové vody Stejné operace jako při úpravě pitné vody + další Změkčování vody Odplynění vody Změkčování vody Termické změkčování Odstranění hydrogenuhličitanu vápenatého ohřevem v tlakové nádobě na teplotu 105 C. vznik nerozpustného uhličitanu Chemické vysrážení Srážedla: 5-10% roztoky Na 2 CO 3, směs Ca(OH) 2 a Na 2 CO 3, NaOH doba srážení je 1 h při C Ca(HCO 3 ) 2 + Ca(OH) 2 2 CaCO H 2 O Ca(HCO 3 ) NaOH CaCO 3 + Na 2 CO H 2 O CaSO 4 + Na 2 CO 3 CaCO 3 + Na 2 SO 4 Mg(HCO 3 ) Ca(OH) 2 Mg(OH) CaCO H 2 O Mg(HCO 3 ) NaOH Mg(OH) Na 2 CO H 2 O Zbytková tvrdost, 3 Ca Na 3 PO 4 Ca 3 (PO 4 ) Na + 3 Mg Na 3 PO 4 Mg 3 (PO 4 ) Na + 8
9 Změkčování vody Výměna iontů Iontoměniče polymerní pryskyřice s iontoměnnými skupinami Odplynění vody Je-li užitková voda používána jako napájecí, pro parní kotle. Za vysokých teplot dochází ke korozi zařízení vlivem rozpuštěného kyslíku Rozpustnost plynů ve vodě klesá s rostoucí teplotou Odstraňování kyslíku v desorpční koloně za sníženého tlaku Chemické odstraňování pomocí hydrazinu (pro vysokotlaké parní kotle) katexy vyměňují kationty (-SO 3 H, -SO 3 Na, COOH) regenerace promýváním s roztokem HCl nebo NaCl anexy vyměňují anionty (N + (R) 4, pyridiniové skupiny N 2 H 4 + O 2 2 H 2 O + N 2 Odpadní voda a její čištění Způsoby čištění závisí na druhu odpadní vody Splaškové odpadní vody - splaškové odpadní vody - průmyslové odpadní vody 9
10 Splaškové odpadní vody Splaškové odpadní vody Aerobní biologické čištění C org + O 2 CO 2 N org + 4 H + NH 4 + P org + 2 O 2 PO 4 3- Anaerobní biologické čištění Průmyslové odpadní vody Technické plyny 10
11 Vodík Nejrozšířenější prvek ve vesmíru (75 hm.%) Devátý nejrozšířenější prvek na zemi (1% 1 hm.%) Světová spotřeba (1996, m 3 ~ t) Většina vyrobeného vodíku je přímo zpracována výrobcem, pouze asi 5% je obchodováno Výroba vodíku Parní reforming zemního plynu a nízkovroucích uhlovodíků Parciální oxidace těžkých uhlovodíků (mazut, vakuový zbytek) Zplyňování hnědého a černého uhlí Elektrolýza vody a roztoků chlorid 80% světové produkce USA, Evropa 16% JAR, Indie 3% Zplyňování hnědého a černého uhlí Tímto způsobem před 2. světovou válkou vyrábělo přes 90% vodíku (dnes jen 16%) C + H 2 O H 2 + CO C + ½O 2 CO Tepelně samonosná reakce, 30% uhlí je spáleno k dosažení požadované teploty (800 až C) Parní reforming zemního plynu a nízkovroucích uhlovodíků CH 4 + H 2 O 3 H 2 + CO 2C n H 2n+2 + nh 2 O (2n+1) H 2 + nco CH O 2 CO H 2 O (exotermní dodává teplo) Rovnováha se posunuje ve prospěch vzniku vodíku: Se vzrůstající teplotou bez katalyzátoru reakce probíhá až nad 1200 C katalýza pomocí NiO na nosiči (Al 2 O 3, MgO) (sloučeniny síry se předem odstraňují katalytické jedy) teplo se dodává přes stěny (max. 900 C) a částečným spálením methanu Reakci předchází odstranění sloučenin obsahujících síru hydrogenací na CoO při 400 C vzniká H 2 S (sorpce na ZnO) 11
12 Parní reforming zemního plynu a nízkovroucích uhlovodíků Parciální oxidace těžkých uhlovodíků (mazut, vakuový zbytek) C, 3MPa štěpení uhlovodíků 2C n H 2n+2 + no 2 2(n+1) H 2 + 2nCO Získanou plynnou směs je možno použít k dalším výrobám (amoniak, aldehydy, olefiny). Pro získání čistého vodíku je nutno směs dále zpracovat. Výhody: není nutné odstranění síry; nevýhody: je potřeba výrobna kyslíku 4-odstranění amoniaku, kyanovodíku, CO 2 5- absorpce do roztoku aminopropanoátu draselného a následná desorpce- výstup 48% CO, 51% H 2 a 1% CO 2 1-kompresor 2-trubkový katalytický reaktor (výhřev spalinami na 900 C, 4 MPa) -výstup 5-9 obj.% CH 4 3-adiabatický katalytický reaktor (1000 C)- výstup obsah methanu (0,5 obj.%) 4-kotle na výrobu páry 5-separátory páry (zásobní nádrž vody Přeměna CO Na vstupu směs CO a H 2 Vysokoteplotní konverze = 350 až 380 C, Fe 2 O 3 a Cr 2 O 3 na výstupu 4 % CO Nízkotepelná konverze = 200 až 250 C, CuO, ZnO (velmi citlivé na přítomnost síry 0,1 ppm) na výstupu > 0,3% CO CO + H 2 O H 2 + CO 2 Odstraňování H 2 S a CO 2 Fyzikální - vypírka methanolem při -30 C (odstranění CO 2, H 2 S, HCN) Chemická ethanolaminy, uhličitan a hydroxid draselný (odstranění CO 2, CO) Sorpce probíhá vždy za zvýšeného tlaku (3-10 MPa) Plyny jsou s roztoku uvolňovány v desorpční koloně, a to buď snížením tlaku nebo stripováním 12
13 Odstraňování H 2 S a CO 2 Absopce / Desorpce Pohlcování / uvolňování rozpustných plynů přes fázové rozhraní do / z kapaliny Fyzikální či chemická absorbce Absorpční kolony: S rozprašováním kapaliny Probublávané Patrové Plněné Odlučovače kapek Vypírací (stripovací) kolona Stripování je proces, kterým jsou z kapaliny odháněny proudem procházejícíh o plynu těkavé látky. Výroba vodíku elektrolýzou vody Velmi nákladná účinnost ~20%, měrná spotřeba na výrobu 1Nm 3 je ~ 5 kwh. Získává se velmi čistý vodík požití v potravinářství Teplota 80 C, rozkladné napětí 2 V. H 2 O H 2 + ½ O 2 Další zdroje: Získávání vodíku při elektrolýze NaCl. 13
14 56% výroba amoniaku Použití vodíku Kyslík a dusík Dusík Kyslík 25% rafinérské procesy (hydrokrakování) 12% hydrogenace (ztužování tuků, výroba anilínu) Hustota (0 C, atm. tlak) 1,429 g/l 1,251g/l Bod varu -183 C -196 C Použití 7% ostatní (metalurgie, elektronika, sváření, palivo) Kyslík a dusík Zkapalňování vzduch Vysokotlaký, 20MPa Středotlaký, 2 až 4 MPa Kyslík Dusík Hustota (0 C, atm. tlak) 1,429 g/l 1,251g/l Bod varu -183 C -196 C Použití Oxidační procesy Výroba amoniaku Řezání a svařování kovů Medicinální kyslík Chladící médium Potravinářství 1 litr kapalného O 2 odpovídá840 litrům plyného O 2 (20 C, atm.t.). Cena kyslíku (2001) byla 0.21 $/kg. 14
15 Destilace vzduchu? Destilace vzduchu Získává se Dusík s čistotou 99% Kyslík s čistotou 98,8% Vzácné plyny?? Získává se Dusík s čistotou 99% Kyslík s čistotou 98,8% Vzácné plyny Ar Doprava plynů Doprava plynů Ventilátory doprava plynů s velmi malým poměrem stlačení Dmychadla velká množství dopravovaného plynu, malý přetlak Kompresory stlačování plynů na větší tlak Vývěvy snižování tlaku 15
16 Doprava plynů Doprava plynů Dvoustupňová rotační olejová vývěva Doprava plynů Jednostuňová olejová rotační vývěva sací filtr separátor (odlučuje olej ze stlač. vzduchu) společný chladič oleje a stlač. vzduchu olejový filtr termostat oleje rotor lamela ventil minimálního tlaku olej pojišťovací ventil 16
17 Membránová vývěva Doprava plynů Kompresory Copeland-Scroll spirálové Doprava kapalin Odstředivá čerpadla 17
18 Doprava kapalin Hydrostatická čerpadla Pístové čerpadlo Zubové čerpadlo Suroviny: Průmysl síry Odpadní síra (plyny doprovázející zpracování zemního plynu, ropy uhlí) Naleziště elementární síry Sulfidické rudy (FeS 2 ) Průmysl síry Suroviny: Celosvětová produkce elementární síry je 34x10 6 tun (1993). Z toho 17x10 6 tun ze zemního plynu 11x10 6 tun z ropy 5x10 6 tun vytěžená elementární síra Světové zásoby síry 25x10 9 tun. Průmysl síry Použití: Výroba kyseliny sírové 85% SO 2, CS 2, vulkanizační činidlo, P 2 O 5, barviva 18
19 Fraschův způsob těžby síry Dnes na ústupu (pouze na dvou místech na světě) 160 C, 2,5 MPa Získávání síry z H 2 S Separace H 2 S ze syntézního plynu: Fyzikální - vypírka methanolem při -30 C (odstranění CO 2, H 2 S, HCN) Chemická ethanolaminy, uhličitan a hydroxid draselný (odstranění CO 2, CO) Sorpce probíhá vždy za zvýšeného tlaku (3-10 MPa) Plyny jsou s roztoku uvolňovány v desorpční koloně, kdy je roztok rozprašován za snížení tlaku (atm.) Separace H 2 S ze syntézního plynu Získávání síry z H 2 S Konverze 60% Kat. Co Mo, 300 C 2 H 2 S + O 2 S H 2 O 2 H 2 S + SO 2 3/8 S H 2 O Kat. Al 2 O 3, 220 C Výtěžek síry > 95% 19
20 Výroba kyseliny sírové Světové produkce: 135 x 10 6 tun 100% kyseliny v roce 1993 Trend: mírný pokles Výroba kyseliny sírové Příprava oxidu siřičitého: Spalování síry (60% světové produkce) Pražení sulfidických rud Tepelný rozklad síranů Tepelný rozklad odpadní kyseliny sírové Oxidace SO 2 na SO 3 Reakce SO 3 s vodou Spalování síry Příprava oxidu siřičitého S + O 2 SO 2 Příprava oxidu siřičitého Pražení sulfidických rud Z pyritu, fluidní pec 4 FeS O 2 8 SO Fe 2 O 3 Tepelný rozklad síranů 2 FeSO 4.7H 2 O 2 FeSO 4.H 2 O + 12 H 2 O 2 FeSO 4.H 2 O Fe 2 O 3 + 2SO 2 + ½ O H 2 O Kapalná síra (150 C, t.t.115 C) se filtruje Rozprašuje se suchým vzduchem do pece při 800 C Dvojnásobný přebytek vzduch Odchází 10%ní SO 2 ve směsi s kyslíkem a dusíkem Tepelný rozklad odpadní kyseliny sírové 2 H 2 SO 4 2SO 2 + O H 2 O 20
21 Čištění oxidu siřičitého Příprava oxidu sírového Suché čištění Odstranění prachových částic Elektrostatické odlučovače, cyklony, usazovací nádrže, filtry Mokré čištění Prach, As 2 O 3, mlha kyseliny sírové Skrápění zřednou a následně koncentrovanou kyselinou sírovou SO 2 + 1/2 O 2 SO 3 Katalyzátor V 2 O 5 nanesený na křemelině umístěný v patrovém reaktoru (4 patra) Teplota zážehu ~400 C Kontaktní způsob (konverze 98 %) Dvoukontaktní způsob (konverze 99,7 %) Absorbce oxidu sírového Použití kyseliny sírové Výroba anorganických chemikálií Hnojiva, HF, síran hlinitý, oxid titaničitý Výroba organických produktů Barviva, výbušniny, mýdla, detergenty, plasty Tuzemští výrobci: Spolana Neratovice a Precheza Přerov V roce 2004 se v ČR vyrobilo t kyseliny sírové. 21
22 Použití kyseliny sírové Průmysl dusíku Amoniak, kyselina dusičná Močovina, dusičnany, dusitany, amonné soli, dusíkaté vápno, hydrazin, hydroxylamin, aminy, nitrosloučeniny Přírodní zdroje: ledky, plyny z karbonizace uhlí Přírodní dusík Amoniak Světová produkce v roce 1993 byla 112 miliónů tun. Výroba: Reakcí N 2 + H 2 (syntézní plyn) (stejně je nazývána směs CO + H 2 pro syntézu organických sloučenin) Při zpracování uhlí (1%<) 1913 Haberova Boschova metoda Výroba amoniaku N H 2 2 NH 3 ΔHo = 92.4 kjmol -1 exotermní reakce zmenšuje se objem plynu C, MPa konverze v jednom kroku ~20% T ( C) Keq x x x x x x
23 Katalyzátor - α-fe 1) tavení, drcení, třídění Výroba amoniaku magnetitu (Fe 3 O 4 ) při 1500 C v elektrické peci tavení s promotory K 2 CO 3 (zvýšení aktivity), CaO (odolnost proti katalytickým jedům), Al 2 O 3, SiO 2 (tepelná stálost), pórovitý katalyzátor Velikost částic 6 10 mm Katalyzátor - α-fe Výroba amoniaku Katalytické jedy Nevratné změny (síra, arsen) Vratné (CO, CO 2, O 2 ) 2)redukce Fe 3 O H 2 3 Fe + 4 H 2 O C, 7-30 MPa Moderní reaktory obsahují až 100 tun katalyzátoru. Při obsahu znečušťujících oxidů nižší než 10 ppm je životnost katalyzátoru 5 let Výroba amoniaku Čištění syntézního plynu (myšleno N 2 +H 2 ) Fyzikální - vypírka methanolem při -30 C (odstranění především H 2 S, případně HCN) Chemická ethanolaminy, uhličitan a hydroxid draselný (odstranění CO 2, CO) Dočišťování Absorpce v kapalném dusíku (odstranění CO 2, H 2 O, uhlovodíků) (z 3 % na 0,1 %) Hydrogenace katalyzovaná Ni (3 MPa, 300 C), (z 0,1 % na 0,0005 %) CO + 3H 2 CH 4 + CO 2 Výroba amoniaku Složení syntézního plynu pro výrobu amoniaku H 2. 74,0% N 2..24,7% CH 4..1,0% Ar ,3% CO + CO ppm CO 2 + 4H 2 O CH 4 + CO 2 23
24 Výroba amoniaku Výroba amoniaku 1913 Haberova Boschova metoda Středotlaký způsob 30MPa, 500 C Reaktor trubkový nebo etážový 24
25 Haberova Boschova metoda Fritz Haber Carl Bosch Použití amoniaku 80% - meziprodukt při výrobě kyseliny dusičné a dusíkatých hnojiv Výroba hydrazinu, chloraminu, hydroxylaminu, kaprolaktamu Chladící médium Potenciální motorové palivo Léčba po zasažení kyselým jedem Použití Kyselina dusičná Výroba dusičnanů a dvousložkových hnojiv Dusičnan sodný, oxidovadlo ve sklářství Složka nitrační směsi Koncentrovaná až 100% Výroba v ČR - Lovochemie, a.s., Lovosice, VCHZ Synthesia Pardubice 25
26 Výroba kyseliny dusičné Oxidace amoniaku na NO Dvě fáze: 1) Oxidace amoniaku na NO 2) Oxidace NO na NO 2 a jeho absorpce ve vodě Nežádoucí reakce 4 NH O 2 4 NO + 6 H 2 O ΔH=-904 kj.mol -1 4 NH O 2 2 N H 2 O 4 NH O 2 2 N 2 O + 6 H 2 O Plyn na vstupu = vzduch + amoniak (~10%) Plyn na výstupu = 12% NO + 20% H 2 O + 5%O 2, zbytek N 2 kondenzuje při ochlazení plynu na 20 C Oxidace amoniaku na NO Oxidace amoniaku na NO 4 NH O 2 4 NO + 6 H 2 O ΔH=-904 kj.mol -1 Nežádoucí reakce 4 NH O 2 2 N H 2 O 4 NH O 2 2 N 2 O + 6 H 2 O K potlačení nežádoucích reakcí lze dosáhnout kombinací několika faktorů: Vhodnou dobou kontaktu plynu s katalyzátorem (~ s) Složení katalyzátoru (Pt s 5% Pd a Rh, síta z tenkých drátů 0,06 mm) Teplota ( C, vyšší teplota ztráty Pt, běžně 0,1g na 1t 100% HNO 3 ) Tlak (atm. až 1,2 MPa, vyšší tlak přispívá k oxidaci NO a NO 2 ) 26
27 Oxidace NO na NO 2 a jeho absorpce ve vodě Oxidace amoniaku na NO Oxidace NO 2 na N 2 O 4 Získává se 50-70%ní HNO 3 Koncentraci lze zvýšit zvýšením tlaku a snížením teploty použité při absorpčním procesu sekundární vzduch 12 oxidační kolony 2 NO + O 2 2 NO 2 ΔH=-114 kj.mol -1 2NO 2 N 2 O 4 ΔH=-57 kj.mol -1 absorpční kolony N 2 O 4 + H 2 O HNO 3 + HNO 2 ΔH=-65 kj.mol -1 3 HNO 2 HNO NO + H 2 O 9, 12 oxidační kolony, 10, 11 absorpční kolony Výroba 100%ní kyseliny dusičné N 2 O 4 + H 2 O + ½ O 2 2 HNO 3 (75 C, 5 MPa) zkapalnění NH 2 OH Hydroxylamin Výroba např. redukcí oxidu dusnatého: 4 NH O 2 4 NO + 6 H 2 O 2 NO + 3 H 2 + H 2 SO 4 (NH 3 OH) 2 SO 4 Hydroxylamonium disulfát Použití: Více než 97% na výrobu kaprolaktamu 27
28 Uhličitan sodný Světová produkce v roce 1993 byla 31x10 6 tun. Přírodní zdroje trona Na 2 CO 3 NaHCO 3 2H 2 O (35% světové produkce) Monohydrátový a semikarbonátový proces Kalcinace = tepelné zpracování rud a dalších materiálů vedoucích k jejich tepelnému rozkladu, fázovému přechodu nebo odstranění těkavých složek. Syntetická výroba Výroba uhličitanu sodného Způsob podle Solvaye Karbonatace nasyceného roztoku NaCl NH 3 + CO 2 + H 2 O NH 4 HCO 3 NH 4 HCO 3 + NaCl NaHCO 3 + NH 4 Cl Krystalizací se oddělí nejméně rozpustný NaHCO 3 Kalcinace (175 C) 2 NaHCO 3 Na 2 CO 3 + CO 2 + H 2 O Z odpadního chloridu amonného se recykluje amoniak 2 NH 4 Cl + Ca(OH) 2 2 NH 3 + CaCl H 2 O 28
Technologie chemických výrob 2012
 Technologie chemických výrob Technologie chemických výrob Literatura: Technologie chemických látek / František Hovorka, 2005 http://vydavatelstvi.vscht.cz/katalog/eprodukce/ Obecná chemická technologie,
Technologie chemických výrob Technologie chemických výrob Literatura: Technologie chemických látek / František Hovorka, 2005 http://vydavatelstvi.vscht.cz/katalog/eprodukce/ Obecná chemická technologie,
Průmysl dusíku. amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin. NaClO NaOH CO(NH 2 ) 2.
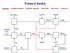 Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
ÚPRAVA VODY V ENERGETICE. Ing. Jiří Tomčala
 ÚPRAVA VODY V ENERGETICE Ing. Jiří Tomčala Úvod Voda je v elektrárnách po palivu nejdůležitější surovinou Její množství v provozních systémech elektráren je mnohonásobně větší než množství spotřebovaného
ÚPRAVA VODY V ENERGETICE Ing. Jiří Tomčala Úvod Voda je v elektrárnách po palivu nejdůležitější surovinou Její množství v provozních systémech elektráren je mnohonásobně větší než množství spotřebovaného
1932 H. C. 1934 M.L.E.
 Vodík Historie 1671 Robert Boyle uvolnění vodíku rozpouštěním Fe v HCl nebo H 2 SO 4 1766 Henry Cavendish podrobný popis vlastností 1932 H. C. Urey objev deuteria 1934 M.L.E. Oliphant, P. Harteck a E.
Vodík Historie 1671 Robert Boyle uvolnění vodíku rozpouštěním Fe v HCl nebo H 2 SO 4 1766 Henry Cavendish podrobný popis vlastností 1932 H. C. Urey objev deuteria 1934 M.L.E. Oliphant, P. Harteck a E.
III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Technické plyny. kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny)
 Technické plyny kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny) Kapalný vzduch složení vzduchu Před zkapalněním odstranění nežádoucích složek, např. vodní pára, CO 2, prach Zkapalňování
Technické plyny kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny) Kapalný vzduch složení vzduchu Před zkapalněním odstranění nežádoucích složek, např. vodní pára, CO 2, prach Zkapalňování
Úprava podzemních vod
 Úprava podzemních vod 1 Způsoby úpravy podzemních vod Neutralizace = odkyselování = stabilizace vody odstranění CO 2 a úprava vody do vápenato-uhličitanové rovnováhy Odstranění plynných složek z vody (Rn,
Úprava podzemních vod 1 Způsoby úpravy podzemních vod Neutralizace = odkyselování = stabilizace vody odstranění CO 2 a úprava vody do vápenato-uhličitanové rovnováhy Odstranění plynných složek z vody (Rn,
3. Soda a potaš Ing. Miroslav Richter, Ph.D., EUR ING
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE 3. Soda a potaš Ing. Miroslav Richter, Ph.D., EUR ING Výroby sody a potaše Suroviny, Přehled výrobních technologií
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE 3. Soda a potaš Ing. Miroslav Richter, Ph.D., EUR ING Výroby sody a potaše Suroviny, Přehled výrobních technologií
VY_32_INOVACE_06A_06 Voda a životní prostředí ANOTACE
 ŠKOLA: AUTOR: NÁZEV: TEMA: ČÍSLO PROJEKTU: Gymnázium Chomutov, Mostecká 3000, příspěvková organizace Mgr. Monika ŠLÉGLOVÁ VY_32_INOVACE_06A_06 Voda a životní prostředí NEKOVY CZ.1.07/1.5.00/34.0816 DATUM
ŠKOLA: AUTOR: NÁZEV: TEMA: ČÍSLO PROJEKTU: Gymnázium Chomutov, Mostecká 3000, příspěvková organizace Mgr. Monika ŠLÉGLOVÁ VY_32_INOVACE_06A_06 Voda a životní prostředí NEKOVY CZ.1.07/1.5.00/34.0816 DATUM
6.Úprava a čistění vod pro průmyslové a speciální účely
 6.Úprava a čistění vod pro průmyslové a speciální účely Ivan Holoubek Zdeněk Horsák RECETOX, Masaryk University, Brno, CR holoubek@recetox.muni.cz; http://recetox.muni.cz Inovace tohoto předmětu je spolufinancována
6.Úprava a čistění vod pro průmyslové a speciální účely Ivan Holoubek Zdeněk Horsák RECETOX, Masaryk University, Brno, CR holoubek@recetox.muni.cz; http://recetox.muni.cz Inovace tohoto předmětu je spolufinancována
Hygienické zabezpečení pitné vody
 Hygienické zabezpečení pitné vody Hygienické zabezpečení je posledním krokem při úpravě vody na vodu pitnou. Z fyzikálně chemických metod se využívají účinky tepla, ultrafialového záření, oligodynamického
Hygienické zabezpečení pitné vody Hygienické zabezpečení je posledním krokem při úpravě vody na vodu pitnou. Z fyzikálně chemických metod se využívají účinky tepla, ultrafialového záření, oligodynamického
Amoniak. 1913 průmyslová výroba syntetického amoniaku
 Amoniak 1913 průmyslová výroba syntetického amoniaku využití 20 % výroba dusíkatých hnojiv 80 % nejrůznější odvětví průmyslu (plasty, vlákna, výbušiny, hydrazin, aminy, amidy, nitrily a další organické
Amoniak 1913 průmyslová výroba syntetického amoniaku využití 20 % výroba dusíkatých hnojiv 80 % nejrůznější odvětví průmyslu (plasty, vlákna, výbušiny, hydrazin, aminy, amidy, nitrily a další organické
Inovace bakalářského studijního oboru Aplikovaná chemie CZ.1.07/2.2.00/ Výpočty z chemických vzorců
 Výpočty z chemických vzorců 1. Hmotnost kyslíku je 80 g. Vypočítejte : a) počet atomů kyslíku ( 3,011 10 atomů) b) počet molů kyslíku (2,5 mol) c) počet molekul kyslíku (1,505 10 24 molekul) d) objem (dm
Výpočty z chemických vzorců 1. Hmotnost kyslíku je 80 g. Vypočítejte : a) počet atomů kyslíku ( 3,011 10 atomů) b) počet molů kyslíku (2,5 mol) c) počet molekul kyslíku (1,505 10 24 molekul) d) objem (dm
Omezování plynných emisí. Ochrana ovzduší ZS 2012/2013
 Omezování plynných emisí Ochrana ovzduší ZS 2012/2013 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Omezování plynných emisí Ochrana ovzduší ZS 2012/2013 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Technologie pro úpravu bazénové vody
 Technologie pro úpravu GHC Invest, s.r.o. Korunovační 6 170 00 Praha 7 info@ghcinvest.cz Příměsi významné pro úpravu Anorganické látky přírodního původu - kationty kovů (Cu +/2+, Fe 2+/3+, Mn 2+, Ca 2+,
Technologie pro úpravu GHC Invest, s.r.o. Korunovační 6 170 00 Praha 7 info@ghcinvest.cz Příměsi významné pro úpravu Anorganické látky přírodního původu - kationty kovů (Cu +/2+, Fe 2+/3+, Mn 2+, Ca 2+,
Zplyňování biomasy. Sesuvný generátor. Autotermní zplyňování Autotermní a alotermní zplyňování
 Zplyňování = termochemická přeměna uhlíkatého materiálu v pevném či kapalném skupenství na výhřevný energetický plyn pomocí zplyňovacích médií a tepla. Produktem je plyn obsahující výhřevné složky (H 2,
Zplyňování = termochemická přeměna uhlíkatého materiálu v pevném či kapalném skupenství na výhřevný energetický plyn pomocí zplyňovacích médií a tepla. Produktem je plyn obsahující výhřevné složky (H 2,
Úprava podzemních vod ODKYSELOVÁNÍ
 Úprava podzemních vod ODKYSELOVÁNÍ 1 Způsoby úpravy podzemních vod Neutralizace = odkyselování = stabilizace vody odstranění CO 2 a úprava vody do vápenato-uhličitanové rovnováhy Odstranění plynných složek
Úprava podzemních vod ODKYSELOVÁNÍ 1 Způsoby úpravy podzemních vod Neutralizace = odkyselování = stabilizace vody odstranění CO 2 a úprava vody do vápenato-uhličitanové rovnováhy Odstranění plynných složek
Registrační číslo projektu: CZ.1.07/1.4.00/21.2939. Název projektu: Investice do vzdělání - příslib do budoucnosti
 Registrační číslo projektu: CZ.1.07/1.4.00/21.2939 Název projektu: Investice do vzdělání - příslib do budoucnosti Číslo přílohy: VY_číslo šablony_inovace_číslo přílohy Autor Datum vytvoření vzdělávacího
Registrační číslo projektu: CZ.1.07/1.4.00/21.2939 Název projektu: Investice do vzdělání - příslib do budoucnosti Číslo přílohy: VY_číslo šablony_inovace_číslo přílohy Autor Datum vytvoření vzdělávacího
Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH. atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na +
 OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
Martin Hynouš hynous@ghcinvest.cz gsm: 603 178 866
 Martin Hynouš hynous@ghcinvest.cz gsm: 603 178 866 1. VODA 2. LEGISLATIVA 3. TECHNOLOGIE 4. CHEMIE H 2 0 nejběţnější sloučenina na světě tvoří přibliţně 71% veškerého povrchu Země je tvořena 2 atomy vodíku
Martin Hynouš hynous@ghcinvest.cz gsm: 603 178 866 1. VODA 2. LEGISLATIVA 3. TECHNOLOGIE 4. CHEMIE H 2 0 nejběţnější sloučenina na světě tvoří přibliţně 71% veškerého povrchu Země je tvořena 2 atomy vodíku
HOŘČÍK KOVY ALKALICKÝCH ZEMIN. Pozn. Elektronová konfigurace valenční vrstvy ns 2
 HOŘČÍK KOVY ALKALICKÝCH ZEMIN Pozn. Elektronová konfigurace valenční vrstvy ns 2 Hořčík Vlastnosti: - stříbrolesklý, měkký, kujný kov s nízkou hustotou (1,74 g.cm -3 ) - diagonální podobnost s lithiem
HOŘČÍK KOVY ALKALICKÝCH ZEMIN Pozn. Elektronová konfigurace valenční vrstvy ns 2 Hořčík Vlastnosti: - stříbrolesklý, měkký, kujný kov s nízkou hustotou (1,74 g.cm -3 ) - diagonální podobnost s lithiem
Ústřední komise Chemické olympiády. 55. ročník 2018/2019 OKRESNÍ KOLO. Kategorie D. Teoretická část Řešení
 Ústřední komise Chemické olympiády 55. ročník 2018/2019 OKRESNÍ KOLO Kategorie D Teoretická část Řešení Úloha 1 Bezpečnostní předpisy MarsCity II 16 bodů 1) Vybrané činnosti: a) Zvracení na mramorovou
Ústřední komise Chemické olympiády 55. ročník 2018/2019 OKRESNÍ KOLO Kategorie D Teoretická část Řešení Úloha 1 Bezpečnostní předpisy MarsCity II 16 bodů 1) Vybrané činnosti: a) Zvracení na mramorovou
Kyselina dusičná. jedna z nejdůležitějších chemikálií
 Kyselina dusičná jedna z nejdůležitějších chemikálií Výroba: minulost - surovinou pro průmyslovou výrobu dusičnan sodný (ledek sodný, guano) současnost - katalytické spalování amoniaku (první výrobní jednotka
Kyselina dusičná jedna z nejdůležitějších chemikálií Výroba: minulost - surovinou pro průmyslovou výrobu dusičnan sodný (ledek sodný, guano) současnost - katalytické spalování amoniaku (první výrobní jednotka
Udržitelný rozvoj v průmyslových prádelnách
 Leonardo da Vinci Project Udržitelný rozvoj v průmyslových prádelnách Modul 1 Voda v prádelnách Kapitola 3b Změkčování vody Modul 1 Voda v prádelnách Kapitola 3 Změkčování vody 1 Obsah Tvrdost vody (opakování)
Leonardo da Vinci Project Udržitelný rozvoj v průmyslových prádelnách Modul 1 Voda v prádelnách Kapitola 3b Změkčování vody Modul 1 Voda v prádelnách Kapitola 3 Změkčování vody 1 Obsah Tvrdost vody (opakování)
DUM č. 2 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 2 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 2 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
H H C C C C C C H CH 3 H C C H H H H H H
 Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ)
 TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ) 3. část ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Zpracoval: Tým autorů EVECO Brno, s.r.o. ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Množství SO 2, HCl,
TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ) 3. část ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Zpracoval: Tým autorů EVECO Brno, s.r.o. ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Množství SO 2, HCl,
Anorganické sloučeniny opakování Smart Board
 Anorganické sloučeniny opakování Smart Board VY_52_INOVACE_210 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 8.,9. Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
Anorganické sloučeniny opakování Smart Board VY_52_INOVACE_210 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 8.,9. Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
Ropa Kondenzované uhlovodíky
 Nejdůležitější surovina pro výrobu organických sloučenin Nejvýznamnější surovina světové ekonomiky Výroba energie Chemické zpracování - 15 % Cena a zásoby ropy (70-100 let) Ropné krize Nutnost hledání
Nejdůležitější surovina pro výrobu organických sloučenin Nejvýznamnější surovina světové ekonomiky Výroba energie Chemické zpracování - 15 % Cena a zásoby ropy (70-100 let) Ropné krize Nutnost hledání
ŘEŠENÍ KONTROLNÍHO TESTU ŠKOLNÍHO KOLA
 Ústřední komise Chemické olympiády 48. ročník 2011/2012 ŠKOLNÍ KOLO kategorie C ŘEŠENÍ KONTROLNÍHO TESTU ŠKOLNÍHO KOLA KONTROLNÍ TEST ŠKOLNÍHO KOLA (60 BODŮ) Úloha 1 Neznámý nerost 21 bodů 1. Barva plamene:
Ústřední komise Chemické olympiády 48. ročník 2011/2012 ŠKOLNÍ KOLO kategorie C ŘEŠENÍ KONTROLNÍHO TESTU ŠKOLNÍHO KOLA KONTROLNÍ TEST ŠKOLNÍHO KOLA (60 BODŮ) Úloha 1 Neznámý nerost 21 bodů 1. Barva plamene:
Úlohy: 1) Vypočítejte tepelné zabarvení dané reakce z následujících dat: C 2 H 4(g) + H 2(g) C 2 H 6(g)
 Úlohy: 1) Vypočítejte tepelné zabarvení dané reakce z následujících dat: C 2 H 4(g) + H 2(g) C 2 H 6(g) C 2 H 4(g) + 3O 2(g ) 2CO 2(g) +2H 2 O (l) H 0 298,15 = -1410,9kJ.mol -1 2C 2 H 6(g) + 7O 2(g) 4CO
Úlohy: 1) Vypočítejte tepelné zabarvení dané reakce z následujících dat: C 2 H 4(g) + H 2(g) C 2 H 6(g) C 2 H 4(g) + 3O 2(g ) 2CO 2(g) +2H 2 O (l) H 0 298,15 = -1410,9kJ.mol -1 2C 2 H 6(g) + 7O 2(g) 4CO
PŘEDMLUVA...ii. OBSAH...ii 1. ÚVOD...1
 OBSAH PŘEDMLUVA...ii OBSAH...ii 1. ÚVOD...1 2. CHEMIE PŘÍRODNÍCH A PITNÝCH V O D... 3 2.1. Voda jako chemické individuum...3 2.2. LAtky obsažené ve vodě...4 2.3. Koncentrace latek a jeji vyjadřování...
OBSAH PŘEDMLUVA...ii OBSAH...ii 1. ÚVOD...1 2. CHEMIE PŘÍRODNÍCH A PITNÝCH V O D... 3 2.1. Voda jako chemické individuum...3 2.2. LAtky obsažené ve vodě...4 2.3. Koncentrace latek a jeji vyjadřování...
DUM č. 4 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 4 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 4 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
Omezování plynných emisí. Ochrana ovzduší ZS 2010/2011
 Omezování plynných emisí Ochrana ovzduší ZS 2010/2011 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Omezování plynných emisí Ochrana ovzduší ZS 2010/2011 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Kyselina fosforečná Suroviny: Výroba: termický způsob extrakční způsob
 Kyselina fosforečná bezbarvá krystalická sloučenina snadno rozpustná ve vodě komerčně dodávané koncentrace 75% H 3 PO 4 s 54,3% P 2 O 5 80% H 3 PO 4 s 58.0% P 2 O 5 85% H 3 PO 4 s 61.6% P 2 O 5 po kyselině
Kyselina fosforečná bezbarvá krystalická sloučenina snadno rozpustná ve vodě komerčně dodávané koncentrace 75% H 3 PO 4 s 54,3% P 2 O 5 80% H 3 PO 4 s 58.0% P 2 O 5 85% H 3 PO 4 s 61.6% P 2 O 5 po kyselině
Voda vlastnosti, rozložení v hydrosféře, chemické rozbory vody
 Voda vlastnosti, rozložení v hydrosféře, chemické rozbory vody Význam vody: chemická sloučenina podmiňující život na Zemi (všechny formy života závisejí na vodě např. má vliv na klima krajiny) koloběh
Voda vlastnosti, rozložení v hydrosféře, chemické rozbory vody Význam vody: chemická sloučenina podmiňující život na Zemi (všechny formy života závisejí na vodě např. má vliv na klima krajiny) koloběh
základní podmínka života - 60 % zemského povrchu nejdůležitější surovina všech průmyslových odvětví - rozpouštědlo - ochlazování, ohřev (l, g)
 Voda základní podmínka života - 60 % zemského povrchu nejdůležitější surovina všech průmyslových odvětví - rozpouštědlo - ochlazování, ohřev (l, g) zdroje vody: podzemní voda (prameny, studny) povrchová
Voda základní podmínka života - 60 % zemského povrchu nejdůležitější surovina všech průmyslových odvětví - rozpouštědlo - ochlazování, ohřev (l, g) zdroje vody: podzemní voda (prameny, studny) povrchová
Vliv znečisťujících látek ve vodě na účinnost praní
 Leonardo da Vinci Project Udržitelný rozvoj v průmyslových prádelnách Modul 6 Energie v prádelnách Kapitola 1 Vliv znečisťujících látek ve vodě na účinnost praní Modul 6 Speciální aspekty Kapitola 1 Vliv
Leonardo da Vinci Project Udržitelný rozvoj v průmyslových prádelnách Modul 6 Energie v prádelnách Kapitola 1 Vliv znečisťujících látek ve vodě na účinnost praní Modul 6 Speciální aspekty Kapitola 1 Vliv
Zdroje a příprava vody
 Leonardo da Vinci Project Udržitelný rozvoj v průmyslových prádelnách Modul 1 Voda v prádelnách Kapitola 3 Zdroje a příprava vody Modul 1 Voda v prádelnách Kapitola 3 Zdroje a příprava vody 1 Obsah Role
Leonardo da Vinci Project Udržitelný rozvoj v průmyslových prádelnách Modul 1 Voda v prádelnách Kapitola 3 Zdroje a příprava vody Modul 1 Voda v prádelnách Kapitola 3 Zdroje a příprava vody 1 Obsah Role
Gymnázium Jana Pivečky a Střední odborná škola Slavičín. III/2 Inovace a zkvalitnění výuky prostřednictvím ITC
 Název projektu Číslo projektu Název školy Autor Název šablony Inovace výuky prostřednictvím šablon pro SŠ CZ.1.07/1.5.00/34.0748 Gymnázium Jana Pivečky a Střední odborná škola Slavičín Mgr. Veronika Prchlíková
Název projektu Číslo projektu Název školy Autor Název šablony Inovace výuky prostřednictvím šablon pro SŠ CZ.1.07/1.5.00/34.0748 Gymnázium Jana Pivečky a Střední odborná škola Slavičín Mgr. Veronika Prchlíková
Chemické procesy v ochraně životního prostředí
 Chemické procesy v ochraně životního prostředí 1. Vliv výroby energie na životní prostředí 2. Zpracování výfukových plynů ze spalovacích motorů 3. Zachycování oxidů síry ve spalinách 4. Výroba paliv pro
Chemické procesy v ochraně životního prostředí 1. Vliv výroby energie na životní prostředí 2. Zpracování výfukových plynů ze spalovacích motorů 3. Zachycování oxidů síry ve spalinách 4. Výroba paliv pro
CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK
 CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK Význam stechiometrických koeficientů 2 H 2 (g) + O 2 (g) 2 H 2 O(l) Počet reagujících částic 2 molekuly vodíku reagují s 1 molekulou kyslíku za vzniku
CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK Význam stechiometrických koeficientů 2 H 2 (g) + O 2 (g) 2 H 2 O(l) Počet reagujících částic 2 molekuly vodíku reagují s 1 molekulou kyslíku za vzniku
Příklad Sestavte rovnice následujících dějů: reakce hydroxidu sodného s kyselinou tetrahydrogendifosforečnou 4NaOH + H 4 P 2 O 7 Na 4 P 2 O 7
 Příklad 2.2.9. Sestavte rovnice následujících dějů: reakce hydroxidu sodného s kyselinou tetrahydrogendifosforečnou 4NaOH + H 4 P 2 O 7 Na 4 P 2 O 7 + 4H 2 O reakce dimerního oxidu antimonitého s kyselinou
Příklad 2.2.9. Sestavte rovnice následujících dějů: reakce hydroxidu sodného s kyselinou tetrahydrogendifosforečnou 4NaOH + H 4 P 2 O 7 Na 4 P 2 O 7 + 4H 2 O reakce dimerního oxidu antimonitého s kyselinou
Ch - Hydroxidy VARIACE
 Ch - Hydroxidy Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl kompletně vytvořen,
Ch - Hydroxidy Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl kompletně vytvořen,
ZŠ ÚnO, Bratří Čapků 1332
 Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 2 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 2 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np:
 PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
Dokážeme ji připravit opravdu čistou???
 Dokážeme ji připravit opravdu čistou??? VODA - Dokážeme ji připravit opravdu čistou??? pitná Voda průmyslová užitková odpadní srážková Metody úpravy (obecně) aerace mechanická separace nečistot, filtrace
Dokážeme ji připravit opravdu čistou??? VODA - Dokážeme ji připravit opravdu čistou??? pitná Voda průmyslová užitková odpadní srážková Metody úpravy (obecně) aerace mechanická separace nečistot, filtrace
DUM VY_52_INOVACE_12CH01
 Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH01 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH01 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
1.1 Suroviny síry Průmyslově využitelné suroviny pro zisk síry nebo jejích sloučenin nebo dalších složek obsažených v příslušných minerálech výskyt:
 1. Chemie a technologie sloučenin síry 1.1 Suroviny síry Průmyslově využitelné suroviny pro zisk síry nebo jejích sloučenin nebo dalších složek obsažených v příslušných minerálech výskyt: Elementární síra:
1. Chemie a technologie sloučenin síry 1.1 Suroviny síry Průmyslově využitelné suroviny pro zisk síry nebo jejích sloučenin nebo dalších složek obsažených v příslušných minerálech výskyt: Elementární síra:
1H 1s. 8O 1s 2s 2p - - - - - - H O H
 OXIDAČNÍ ČÍSLO 1H 1s 8O 1s 2s 2p 1H 1s - - - - + - - + - - + - - H O H +I -II +I H O H - - - - Elektronegativita: Oxidační číslo vodíku: H +I Oxidační číslo kyslíku: O -II Platí téměř ve všech sloučeninách.
OXIDAČNÍ ČÍSLO 1H 1s 8O 1s 2s 2p 1H 1s - - - - + - - + - - + - - H O H +I -II +I H O H - - - - Elektronegativita: Oxidační číslo vodíku: H +I Oxidační číslo kyslíku: O -II Platí téměř ve všech sloučeninách.
Složení soustav (roztoky, koncentrace látkového množství)
 VZOROVÉ PŘÍKLADY Z CHEMIE A DOPORUČENÁ LITERATURA pro přípravu k přijímací zkoušce studijnímu oboru Nanotechnologie na VŠB TU Ostrava Doporučená literatura z chemie: Prakticky jakákoliv celostátní učebnice
VZOROVÉ PŘÍKLADY Z CHEMIE A DOPORUČENÁ LITERATURA pro přípravu k přijímací zkoušce studijnímu oboru Nanotechnologie na VŠB TU Ostrava Doporučená literatura z chemie: Prakticky jakákoliv celostátní učebnice
Ústřední komise Chemické olympiády. 42. ročník. KRAJSKÉ KOLO Kategorie D. SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut
 Ústřední komise Chemické olympiády 42. ročník 2005 2006 KRAJSKÉ KOLO Kategorie D SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut Institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy
Ústřední komise Chemické olympiády 42. ročník 2005 2006 KRAJSKÉ KOLO Kategorie D SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut Institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy
Zdroje a příprava vody
 Leonardo da Vinci Project Udržitelný rozvoj v průmyslových prádelnách Modul 1 Používání vody Kapitola 3 Zdroje a příprava vody Modul 1 Používání vody Kapitola 3 Zdroje a příprava vody 1 Obsah Role vody
Leonardo da Vinci Project Udržitelný rozvoj v průmyslových prádelnách Modul 1 Používání vody Kapitola 3 Zdroje a příprava vody Modul 1 Používání vody Kapitola 3 Zdroje a příprava vody 1 Obsah Role vody
Paliva. nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování
 Paliva Paliva nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování Dělení paliv podle skupenství pevná uhlí, dřevo kapalná benzín,
Paliva Paliva nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování Dělení paliv podle skupenství pevná uhlí, dřevo kapalná benzín,
Základy analýzy potravin Přednáška 1
 ANALÝZA POTRAVIN Význam a využití kontrola jakosti surovin, výrobků jakost výživová jakost technologická jakost hygienická autenticita, identita potravinářských materiálů hodnocení stravy (diety) Analytické
ANALÝZA POTRAVIN Význam a využití kontrola jakosti surovin, výrobků jakost výživová jakost technologická jakost hygienická autenticita, identita potravinářských materiálů hodnocení stravy (diety) Analytické
KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ)
 KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ) Úloha 1 Ic), IIa), IIId), IVb) za každé správné přiřazení po 1 bodu; celkem Úloha 2 8 bodů 1. Sodík reaguje s vodou za vzniku hydroxidu sodného a dalšího produktu.
KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ) Úloha 1 Ic), IIa), IIId), IVb) za každé správné přiřazení po 1 bodu; celkem Úloha 2 8 bodů 1. Sodík reaguje s vodou za vzniku hydroxidu sodného a dalšího produktu.
Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0
 Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
Fosfor a sloučeniny fosforu. Suroviny. Sloučeniny. kalcinace pro oddělení organických. Kyselina trihydrogenfosforečná H3PO4
 Fosfor a sloučeniny fosforu Sloučeniny Fosfor bílý Kyselina trihydrogenfosforečná H3PO4 Suroviny Apatit Ca5 (PO4)3(F, OH, Cl) fluoroapatity úpravy mletí promývání sítování magnetické oddělování oxidů železa
Fosfor a sloučeniny fosforu Sloučeniny Fosfor bílý Kyselina trihydrogenfosforečná H3PO4 Suroviny Apatit Ca5 (PO4)3(F, OH, Cl) fluoroapatity úpravy mletí promývání sítování magnetické oddělování oxidů železa
Škola: Gymnázium, Brno, Slovanské náměstí 7 III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Metody gravimetrické
 Klíčový požadavek - kvantitativní vyloučení stanovované složky z roztoku - málorozpustná sloučenina - SRÁŽECÍ ROVNOVÁHY VYLUČOVACÍ FORMA se převede na (sušení, žíhání) CHEMICKY DEFINOVANÝ PRODUKT - vážitelný
Klíčový požadavek - kvantitativní vyloučení stanovované složky z roztoku - málorozpustná sloučenina - SRÁŽECÍ ROVNOVÁHY VYLUČOVACÍ FORMA se převede na (sušení, žíhání) CHEMICKY DEFINOVANÝ PRODUKT - vážitelný
Vzdělávací oblast: Člověk a příroda. Vyučovací předmět: Chemie. Třída: tercie. Očekávané výstupy. Poznámky. Přesahy. Žák: Průřezová témata
 Vzdělávací oblast: Člověk a příroda Vyučovací předmět: Chemie Třída: tercie Očekávané výstupy Uvede příklady chemického děje a čím se zabývá chemie Rozliší tělesa a látky Rozpozná na příkladech fyzikální
Vzdělávací oblast: Člověk a příroda Vyučovací předmět: Chemie Třída: tercie Očekávané výstupy Uvede příklady chemického děje a čím se zabývá chemie Rozliší tělesa a látky Rozpozná na příkladech fyzikální
KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení. Ing. Miroslav Richter, PhD.
 KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení Ing. Miroslav Richter, PhD., EUR ING 2014 Materiálové bilance 3.5.1 Do tkaninového filtru vstupuje 10000
KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení Ing. Miroslav Richter, PhD., EUR ING 2014 Materiálové bilance 3.5.1 Do tkaninového filtru vstupuje 10000
Linka na úpravu odpadů stabilizace / neutralizace
 CELIO a.s. CZU00168 Linka na úpravu odpadů stabilizace / neutralizace Původce musí doložit výluh č. III. Kód Název odpadu Přijetí 01 03 04 N Hlušina ze zpracování sulfidické rudy obsahující kyseliny nebo
CELIO a.s. CZU00168 Linka na úpravu odpadů stabilizace / neutralizace Původce musí doložit výluh č. III. Kód Název odpadu Přijetí 01 03 04 N Hlušina ze zpracování sulfidické rudy obsahující kyseliny nebo
1 mol (ideálního) plynu, zaujímá za normálních podmínek objem 22,4 litru. , Cl 2 , O 2
 10.výpočty z rovnic praktické provádění výpočtů z rovnic K výpočtu chemických rovnic je důležité si shrnout tyto poznatky: Potřebujem znát vyjadřování koncentrací, objemový zlomek, molární zlomek, molární
10.výpočty z rovnic praktické provádění výpočtů z rovnic K výpočtu chemických rovnic je důležité si shrnout tyto poznatky: Potřebujem znát vyjadřování koncentrací, objemový zlomek, molární zlomek, molární
CHO cvičení, FSv, ČVUT v Praze
 2. Chemické rovnice Chemická rovnice je schématický zápis chemického děje (reakce), který nás informuje o reaktantech (výchozích látkách), produktech, dále o stechiometrii reakce tzn. o vzájemném poměru
2. Chemické rovnice Chemická rovnice je schématický zápis chemického děje (reakce), který nás informuje o reaktantech (výchozích látkách), produktech, dále o stechiometrii reakce tzn. o vzájemném poměru
zadání příkladů 10. výsledky příkladů 7. 3,543 litru kyslíku
 zadání Jaký bude objem vodíku při tlaku 105 kpa a teplotě 15 stupňů Celsia, který vznikne reakcí 8 gramů zinku s nadbytkem kyseliny trihydrogenfosforečné? Jaký bude objem vodíku při tlaku 97 kpa a teplotě
zadání Jaký bude objem vodíku při tlaku 105 kpa a teplotě 15 stupňů Celsia, který vznikne reakcí 8 gramů zinku s nadbytkem kyseliny trihydrogenfosforečné? Jaký bude objem vodíku při tlaku 97 kpa a teplotě
Základní fyzikálně-chemické procesy úpravy podzemních a povrchových vod pro hromadné zásobování pitnou vodou
 Základní fyzikálně-chemické procesy úpravy podzemních a povrchových vod pro hromadné zásobování pitnou vodou Ing.Jan Haering Problematika vodních filtrů a úpravy pitné vody v místě spotřeby. 15.11.2005,
Základní fyzikálně-chemické procesy úpravy podzemních a povrchových vod pro hromadné zásobování pitnou vodou Ing.Jan Haering Problematika vodních filtrů a úpravy pitné vody v místě spotřeby. 15.11.2005,
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115
 Číslo projektu: Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo šablony: 31 Název materiálu: Ročník: Identifikace materiálu: Jméno autora: Předmět: Tématický celek: Anotace: CZ.1.07/1.5.00/3.0
Číslo projektu: Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo šablony: 31 Název materiálu: Ročník: Identifikace materiálu: Jméno autora: Předmět: Tématický celek: Anotace: CZ.1.07/1.5.00/3.0
Název odpadu. 010307 N Jiné odpady z fyzikálního a chemického zpracování rudných nerostů obsahující nebezpečné látky x
 5. Stabilizace CELIO a.s. Název odpadu 010304 N Hlušina ze zpracování sulfidické rudy obsahující kyseliny nebo kyselinotvorné látky x 010305 N Jiná hlušina obsahující nebezpečné látky x 010307 N Jiné odpady
5. Stabilizace CELIO a.s. Název odpadu 010304 N Hlušina ze zpracování sulfidické rudy obsahující kyseliny nebo kyselinotvorné látky x 010305 N Jiná hlušina obsahující nebezpečné látky x 010307 N Jiné odpady
Vyjmenujte tři základní stavební částice látek: a) b) c)
 OPAKOVÁNÍ Vyjmenujte tři základní stavební částice látek: a) b) c) Vyjmenujte tři základní stavební částice látek: a) atom b) molekula c) ion Vyjmenujte skupenství, ve kterých se může látka nacházet: a)
OPAKOVÁNÍ Vyjmenujte tři základní stavební částice látek: a) b) c) Vyjmenujte tři základní stavební částice látek: a) atom b) molekula c) ion Vyjmenujte skupenství, ve kterých se může látka nacházet: a)
Chemikálie pro úpravu bazénové vody, privátní a veřejná správa. GHC Invest, s.r.o. Korunovační 6 170 00 Praha 7
 Chemikálie pro úpravu bazénové vody, privátní a veřejná správa GHC Invest, s.r.o. Korunovační 6 170 00 Praha 7 I tak může vypadat voda v bazénu bez použití správných chemických přípravků. Stejný bazén
Chemikálie pro úpravu bazénové vody, privátní a veřejná správa GHC Invest, s.r.o. Korunovační 6 170 00 Praha 7 I tak může vypadat voda v bazénu bez použití správných chemických přípravků. Stejný bazén
Chemické názvosloví anorganických sloučenin 2
 Chemické názvosloví anorganických sloučenin 2 Tříprvkové sloučeniny Autorem materiálu a všech jeho částí, není-li uvedeno jinak, je. Mgr. Vlastimil Vaněk. Dostupné z Metodického portálu www.rvp.cz, ISSN:
Chemické názvosloví anorganických sloučenin 2 Tříprvkové sloučeniny Autorem materiálu a všech jeho částí, není-li uvedeno jinak, je. Mgr. Vlastimil Vaněk. Dostupné z Metodického portálu www.rvp.cz, ISSN:
Biologické odsiřování bioplynu. Ing. Dana Pokorná, CSc.
 Biologické odsiřování bioplynu Ing. Dana Pokorná, CSc. Sulfan problematická složka bioplynu Odkud se sulfan v bioplynu bere? Organická síra proteiny s inkorporovanou sírou Odpady a odpadní vody z průmyslu
Biologické odsiřování bioplynu Ing. Dana Pokorná, CSc. Sulfan problematická složka bioplynu Odkud se sulfan v bioplynu bere? Organická síra proteiny s inkorporovanou sírou Odpady a odpadní vody z průmyslu
Hydrochemie Oxid uhličitý a jeho iontové formy, ph, NK
 1 Oxid uhličitý - CO 2 původ: atmosférický - neznečištěný vzduch 0,03 obj. % CO 2 biogenní aerobní a anaerobní rozklad OL hlubinný magma, termický rozklad uhličitanových minerálů, rozklad uhličitanových
1 Oxid uhličitý - CO 2 původ: atmosférický - neznečištěný vzduch 0,03 obj. % CO 2 biogenní aerobní a anaerobní rozklad OL hlubinný magma, termický rozklad uhličitanových minerálů, rozklad uhličitanových
NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV:VY_32_INOVACE_102_Soli AUTOR: Igor Dubovan ROČNÍK, DATUM: 9., 15. 9.
 NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV:VY_32_INOVACE_102_Soli AUTOR: Igor Dubovan ROČNÍK, DATUM: 9., 15. 9. 2011 VZDĚL. OBOR, TÉMA: Chemie, Soli ČÍSLO PROJEKTU: OPVK
NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV:VY_32_INOVACE_102_Soli AUTOR: Igor Dubovan ROČNÍK, DATUM: 9., 15. 9. 2011 VZDĚL. OBOR, TÉMA: Chemie, Soli ČÍSLO PROJEKTU: OPVK
Ing. Radim Staněk, prof. Ing. Jana Zábranská CSc. Čištění odpadních vod z výroby nitrocelulózy
 Ing. Radim Staněk, prof. Ing. Jana Zábranská CSc. Čištění odpadních vod z výroby nitrocelulózy 20.10.2017 1 Nitrocelulóza Synthesia, a.s. Pardubice vyrábí jako jeden ze svých stěžejních produktů nitrocelulózu.
Ing. Radim Staněk, prof. Ing. Jana Zábranská CSc. Čištění odpadních vod z výroby nitrocelulózy 20.10.2017 1 Nitrocelulóza Synthesia, a.s. Pardubice vyrábí jako jeden ze svých stěžejních produktů nitrocelulózu.
Vzdělávací obsah vyučovacího předmětu
 Vzdělávací obsah vyučovacího předmětu Chemie 9. ročník Zpracovala: Mgr. Michaela Krůtová ANORGANICKÉ SLOUČENINY KYSELINY porovná vlastnosti a použití vybraných prakticky významných kyselin orientuje se
Vzdělávací obsah vyučovacího předmětu Chemie 9. ročník Zpracovala: Mgr. Michaela Krůtová ANORGANICKÉ SLOUČENINY KYSELINY porovná vlastnosti a použití vybraných prakticky významných kyselin orientuje se
TEORETICKÁ ČÁST (70 BODŮ)
 TEORETICKÁ ČÁST (70 BODŮ) Úloha 1 Válka mezi živly 7 bodů 1. Doplňte text: Sloučeniny obsahující kation draslíku (draselný) zbarvují plamen fialově. Dusičnan tohoto kationtu má vzorec KNO 3 a chemický
TEORETICKÁ ČÁST (70 BODŮ) Úloha 1 Válka mezi živly 7 bodů 1. Doplňte text: Sloučeniny obsahující kation draslíku (draselný) zbarvují plamen fialově. Dusičnan tohoto kationtu má vzorec KNO 3 a chemický
Vysvětlivky: Důležité pojmy
 Leonardo da Vinci Project Udržitelný rozvoj při procesech komerčního praní Modul 1 Voda v prádelnách Kapitola 7 Vysvětlivky: Důležité pojmy Module 1 Voda v prádelnách Kapitola 7 Slovník důležitých pojmů
Leonardo da Vinci Project Udržitelný rozvoj při procesech komerčního praní Modul 1 Voda v prádelnách Kapitola 7 Vysvětlivky: Důležité pojmy Module 1 Voda v prádelnách Kapitola 7 Slovník důležitých pojmů
ZŠ ÚnO, Bratří Čapků 1332
 Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace
 Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
autoři a obrázky: Mgr. Hana a Radovan Sloupovi
 EKOLOGIE autoři a obrázky: Mgr. Hana a Radovan Sloupovi 1. Určitě jsi v nabídkových letácích elektroniky zaregistroval zkratku PHE. Jde o poplatek za ekologickou likvidaci výrobku. Částka takto uvedená
EKOLOGIE autoři a obrázky: Mgr. Hana a Radovan Sloupovi 1. Určitě jsi v nabídkových letácích elektroniky zaregistroval zkratku PHE. Jde o poplatek za ekologickou likvidaci výrobku. Částka takto uvedená
DESINFEKCE A VYUŽITÍ CHLORDIOXIDU PŘI ÚPRAVĚ BAZÉNOVÉ VODY
 DESINFEKCE A VYUŽITÍ CHLORDIOXIDU PŘI ÚPRAVĚ BAZÉNOVÉ VODY.1Úvod Autor: Ing. František Svoboda Csc. Zvážení rizik tvorby vedlejších produktů desinfekce (DBP) pro úpravu konkrétní vody je podmíněno návrhem
DESINFEKCE A VYUŽITÍ CHLORDIOXIDU PŘI ÚPRAVĚ BAZÉNOVÉ VODY.1Úvod Autor: Ing. František Svoboda Csc. Zvážení rizik tvorby vedlejších produktů desinfekce (DBP) pro úpravu konkrétní vody je podmíněno návrhem
ČIŠTĚNÍ TECHNOLOGICKÝCH VOD A VÝPUSTNÉ PROFILY CHÚ
 Věra Ježová a František Toman V 1 ČIŠTĚNÍ TECHNOLOGICKÝCH VOD A VÝPUSTNÉ PROFILY CHÚ 11.9.2013 DIAMO, státní podnik, odštěpný závod GEAM Dolní Rožínka, závod Chemická úpravna 1 Technologická voda na CHÚ
Věra Ježová a František Toman V 1 ČIŠTĚNÍ TECHNOLOGICKÝCH VOD A VÝPUSTNÉ PROFILY CHÚ 11.9.2013 DIAMO, státní podnik, odštěpný závod GEAM Dolní Rožínka, závod Chemická úpravna 1 Technologická voda na CHÚ
Název odpadu. 010307 N Jiné odpady z fyzikálního a chemického zpracování rudných nerostů obsahující nebezpečné látky x
 3. S NO CELIO a.s. Název odpadu 010304 N Hlušina ze zpracování sulfidické rudy obsahující kyseliny nebo kyselinotvorné látky x 010305 N Jiná hlušina obsahující nebezpečné látky x 010307 N Jiné odpady z
3. S NO CELIO a.s. Název odpadu 010304 N Hlušina ze zpracování sulfidické rudy obsahující kyseliny nebo kyselinotvorné látky x 010305 N Jiná hlušina obsahující nebezpečné látky x 010307 N Jiné odpady z
Směsi a čisté látky, metody dělení
 Směsi a čisté látky, metody dělení LÁTKY Chemicky čisté látky Sloučeniny Chemické prvky Homogenní Roztoky pevné kapalné plynné Směsi Heterogenní Suspenze Emulze Pěna Aerosol Chemicky čisté látky: prvky
Směsi a čisté látky, metody dělení LÁTKY Chemicky čisté látky Sloučeniny Chemické prvky Homogenní Roztoky pevné kapalné plynné Směsi Heterogenní Suspenze Emulze Pěna Aerosol Chemicky čisté látky: prvky
Oxidační číslo je rovno náboji, který by atom získal po p idělení všech vazebných elektronových párů atomům s větší elektronegativitou.
 NÁZVOSLOVÍ Oxidační číslo je rovno náboji, který by atom získal po p idělení všech vazebných elektronových párů atomům s větší elektronegativitou. -II +III -II +I O N O H Oxidační čísla se značí ímskými
NÁZVOSLOVÍ Oxidační číslo je rovno náboji, který by atom získal po p idělení všech vazebných elektronových párů atomům s větší elektronegativitou. -II +III -II +I O N O H Oxidační čísla se značí ímskými
Předmět: CHEMIE Ročník: 8. ŠVP Základní škola Brno, Hroznová 1. Výstupy předmětu
 Chemie ukázka chemického skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce práce s dostupnými a běžně používanými látkami (směsmi). Na základě piktogramů žák posoudí nebezpečnost
Chemie ukázka chemického skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce práce s dostupnými a běžně používanými látkami (směsmi). Na základě piktogramů žák posoudí nebezpečnost
POKYNY FAKTORY OVLIVŇUJÍCÍ RYCHLOST REAKCÍ
 POKYNY Prostuduj si teoretický úvod a následně vypracuj postupně všechny zadané úkoly zkontroluj si správné řešení úkolů podle řešení FAKTORY OVLIVŇUJÍCÍ RYCHLOST REAKCÍ 1) Vliv koncentrace reaktantů čím
POKYNY Prostuduj si teoretický úvod a následně vypracuj postupně všechny zadané úkoly zkontroluj si správné řešení úkolů podle řešení FAKTORY OVLIVŇUJÍCÍ RYCHLOST REAKCÍ 1) Vliv koncentrace reaktantů čím
ZŠ ÚnO, Bratří Čapků 1332
 Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 1 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 1 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Prvky V.A a VI.A skupiny
 Prvky V.A a VI.A skupiny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Duben 2010 Mgr. Alena Jirčáková Prvky V.A skupiny - vlastnosti - Prvky s pěti
Prvky V.A a VI.A skupiny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Duben 2010 Mgr. Alena Jirčáková Prvky V.A skupiny - vlastnosti - Prvky s pěti
 Typy chemických reakcí prezentace VY_52_INOVACE_213 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 8, 9 Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
Typy chemických reakcí prezentace VY_52_INOVACE_213 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 8, 9 Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
16.5.2010 Halogeny 1
 16.5.010 Halogeny 1 16.5.010 Halogeny Prvky VII.A skupiny: F, Cl, Br, I,(At) Obecnávalenčníkonfigurace:ns np 5 Pro plné zaplnění valenční vrstvy potřebují 1 e - - nejčastější sloučeniny s oxidačním číslem
16.5.010 Halogeny 1 16.5.010 Halogeny Prvky VII.A skupiny: F, Cl, Br, I,(At) Obecnávalenčníkonfigurace:ns np 5 Pro plné zaplnění valenční vrstvy potřebují 1 e - - nejčastější sloučeniny s oxidačním číslem
Ústřední komise Chemické olympiády. 53. ročník 2016/2017. TEORETICKÁ ČÁST OKRESNÍHO KOLA kategorie D. ZADÁNÍ: 70 BODŮ časová náročnost: 90 minut
 Ústřední komise Chemické olympiády 53. ročník 2016/2017 TEORETICKÁ ČÁST OKRESNÍHO KOLA kategorie D ZADÁNÍ: 70 BODŮ časová náročnost: 90 minut Úloha 1 Je přítomen lignin? 19 bodů Při zpracování dřeva pro
Ústřední komise Chemické olympiády 53. ročník 2016/2017 TEORETICKÁ ČÁST OKRESNÍHO KOLA kategorie D ZADÁNÍ: 70 BODŮ časová náročnost: 90 minut Úloha 1 Je přítomen lignin? 19 bodů Při zpracování dřeva pro
Pozn.: Pokud není řečeno jinak jsou pod pojmem procenta míněna vždy procenta hmotnostní.
 Sebrané úlohy ze základních chemických výpočtů Tento soubor byl sestaven pro potřeby studentů prvního ročníku chemie a příbuzných předmětů a nebyl nikterak revidován. Prosím omluvte případné chyby, překlepy
Sebrané úlohy ze základních chemických výpočtů Tento soubor byl sestaven pro potřeby studentů prvního ročníku chemie a příbuzných předmětů a nebyl nikterak revidován. Prosím omluvte případné chyby, překlepy
Kvalitativní analýza - prvková. - organické
 METODY - chemické MATERIÁLY - anorganické - organické CHEMICKÁ ANALÝZA ANORGANICKÉHO - iontové reakce ve vodných roztocích rychlý, jednoznačný a často kvantitativní průběh kationty, anionty CHEMICKÁ ANALÝZA
METODY - chemické MATERIÁLY - anorganické - organické CHEMICKÁ ANALÝZA ANORGANICKÉHO - iontové reakce ve vodných roztocích rychlý, jednoznačný a často kvantitativní průběh kationty, anionty CHEMICKÁ ANALÝZA
DUM VY_52_INOVACE_12CH19
 Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH19 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH19 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
SOLI. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: 12. 4. 2013. Ročník: osmý
 SOLI Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 12. 4. 2013 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Anorganické sloučeniny 1 Anotace: Žáci se seznámí s vlastnostmi solí,
SOLI Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 12. 4. 2013 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Anorganické sloučeniny 1 Anotace: Žáci se seznámí s vlastnostmi solí,
Chemické veličiny, vztahy mezi nimi a chemické výpočty
 SBÍRKA ŘEŠENÝCH PŘÍKLADŮ PRO PROJEKT PŘÍRODNÍ VĚDY AKTIVNĚ A INTERAKTIVNĚ CZ.1.07/1.1.24/01.0040 Chemické veličiny, vztahy mezi nimi a chemické výpočty Mgr. Jana Žůrková, 2013, 20 stran Obsah 1. Veličiny
SBÍRKA ŘEŠENÝCH PŘÍKLADŮ PRO PROJEKT PŘÍRODNÍ VĚDY AKTIVNĚ A INTERAKTIVNĚ CZ.1.07/1.1.24/01.0040 Chemické veličiny, vztahy mezi nimi a chemické výpočty Mgr. Jana Žůrková, 2013, 20 stran Obsah 1. Veličiny
