Ne všechny kontaminanty piva a pivovarských provozů však musí pivo nutně kazit. Druh L. brevis zahrnuje jak kmeny pivo kazící i nekazící.
|
|
|
- Vlastimil Jelínek
- před 8 lety
- Počet zobrazení:
Transkript
1 1. ÚVOD Pivo je slabě alkoholický nápoj vyráběný ze sladu, chmele a vody řízenou činností pivovarských kvasinek. Látky odvozené z chmele udělují pivu typickou hořkou chuť a vůni, podílejí se významně na stabilitě pivní pěny a vyznačují se antibakteriálními vlastnostmi. V běžných podmínkách provozů sladoven a pivovarů není možné zabránit vnikání kontaminujících mikroorganizmů do zařízení a surovin. Tyto mikroorganizmy se pak v určitých pro ně příznivých podmínkách mohou množit a jejich metabolická aktivita se projeví zhoršením kvality hotového piva. Kvalita a trvanlivost piva je tedy závislá na jeho mikrobiologické čistotě a čistotě přepravných nádob. V hotovém pivu však většina mikroorganizmů není schopna přežívat. Hlavním faktorem mikrobiologické stability piva je silně redukovaný obsah kyslíku (< 1 ppm). Pivo je tedy v podstatě anaerobním prostředím. Nepříznivě působí na kontaminující mikroorganizmy nízké ph (3,8 4,7), přítomnost hořkých chmelových látek (17-55 mg/l), obsah alkoholu (3,5 1 % w/v), obsah CO 2 (přibližně,5 % w/v) a nízká teplota, při které pivo dokváší (2 4 C). Hotové pivo obsahuje jen velmi nízké koncentrace utilizovatelných živin (Jespersen a Jakobsen, 1996). Nejčastější a nejzávažnější kontaminací pivovarské výroby jsou baktérie mléčného kvašení, především zástupci rodů Lactobacillus a Pediococcus (Hollerová a Kubizniaková, 22; Sakamoto a Konings, 23; Vaughan a kol., 25). Jako grampozitivní jsou tyto mikroorganizmy přirozeně citlivé k působení hořkých chmelových látek. Některé kmeny však vykazují toleranci k chmelovým látkám a jsou schopny v pivu růst. Tvorbou zákalu a produkcí metabolitů způsobují nežádoucí senzorické změny, a pokud není jejich přítomnost včas odhalena, mohou pivo úplně znehodnotit. Při mikrobiologické kontrole piva a pivovarských provozů je nejčastěji izolován druh Lactobacillus brevis. Podílí se na více než 5 % případů mikrobiálního kažení piva (Yasui a Yoda, 1997; Hayashi a kol., 21; Hollerová a Kubizniaková, 22; Sakamoto a Konings, 23; Thelen a kol., 24). Způsobuje zakalení piva a produkcí kyseliny mléčné a octové negativně ovlivňuje jeho senzorické vlastnosti. Lactobacillus brevis je charakteristický svou schopností fermentovat dextriny a škrob a způsobuje tak tzv. superatenuaci, neboli hlubší prokvašení piva (Jespersen a Jakobsen, 1996; Vaughan a kol., 25). 1
2 Ne všechny kontaminanty piva a pivovarských provozů však musí pivo nutně kazit. Druh L. brevis zahrnuje jak kmeny pivo kazící i nekazící. Dosud jedinou spolehlivou metodou odlišení pivo kazících a nekazících bakterií je provedení tzv. forcing testu, při kterém se sleduje růst vyizolovaných bakterií v pasterovaném pivu. Lahve se zaočkovaným pivem se uchovávají v temnu při pokojové teplotě a sleduje se tvorba zákalu. V přítomnosti většiny pivo kazících kmenů dochází k zakalení piva do tří týdnů od inokulace, avšak některé izoláty vytvářejí zákal až během osmého týdne kultivace (Hollerová a Kubizniaková, 22). Vzhledem k časté izolaci L. brevis jako hlavního původce kažení piva byly antibakteriální účinky hořkých chmelových látek a mechanizmy rezistence studovány u tohoto druhu detailněji (Simpson, 1993; Simpson a Hughes, 1993; Simpson a kol., 1993; Simpson a Fernandez, 1994; Sami a kol., 1997a; Hayashi a kol., 21; Sakamoto a kol., 21; Sakamoto a Konings, 22; Sakamoto a kol., 22; Suzuki a kol., 22; Suzuki a kol., 25b). Přesto dosud nebyly účinky hořkých chmelových látek na L. brevis a další grampozitivní bakterie ani mechanizmy rezistence bakterií k těmto látkám objasněny. 2
3 1.1. Taxonomické zařazení a obecná charakteristika Čeleď Lactobacillaceae Čeleď Lactobacillaceae zahrnuje rovné nebo mírně zakřivené grampozitivní tyčky nebo kokotyčky. Jsou chemoorganotrofní, vyznačují se striktně fermentativním typem metabolizmu a v kultivačním prostředí vyžadují přítomnost růstových faktorů. Ve vztahu ke kyslíku jsou laktobacily anaerobní, fakultativně anaerobní nebo mikroaerofilní. Rostou v rozmezí teplot 15-4 C. Někteří zástupci jsou však schopni růst při 5 C, tzv. termofilní laktobacily s horní hranici až 55 C. Většinou jsou nepohybliví, neprodukují pigmenty, a reakce na katalázu bývá zpravidla negativní. Obsah G+C je zpravidla menší než 5 %. Do čeledi Lactobacillaceae jsou řazeny rody Lactobacillus, Paralactobacillus a Pediococcus Charakteristika rodu Lactobacillus Bakterie rodu Lactobacillus jsou grampozitivní, fakultativně anaerobní nebo mikroaerofilní tyčky nebo kokotyčky se striktně fermentativním typem metabolizmu. Netvoří spory, většinou jsou nepohyblivé a neprodukují pigmenty. Laktobacily se vyznačují komplexními nutričními požadavky. V kultivačním médiu vyžadují přítomnost cukrů, aminokyselin, peptidů, esterů mastných kyselin, solí, derivátů nukleových kyselin a vitamínů skupiny B. Reakce na katalázu bývá zpravidla negativní. Buňky laktobacilů mají většinou tvar tyčky, mohou být však tvarově značně variabilní. Délka buněk i jejich tvar je závislý na stáří kultury, složení kultivačního média, tenzi kyslíku apod. Vyskytují se většinou jednotlivě, tvorba řetízků je méně častá. Obsah G+C se pohybuje v rozmezí %. Druhy rodu Lactobacillus lze podle fermentace hexóz, pentóz a glukonátů rozdělit do tří fyziologických skupin. Druhy řazené do první skupiny jsou obligátně homofermentativní. Hexózy jsou Embden-Meyerhof-Parnas (EMP) dráhou fermentovány téměř výlučně (>9 %) na kyselinu mléčnou. Protože organizmy zařazené do této skupiny nemají enzym fosfoketolázu, nemohou fermentovat pentózy a glukonáty. Druhá skupina zahrnuje zástupce fakultativně heterofermentativní. Hexózy fermentují na kyselinu mléčnou (>9 %) EMP 3
4 dráhou, pentózy a často i glukonáty zkvašují pomocí indukovatelné fosfoketolázy na kyselinu octovou, mravenčí a etanol. V přítomnosti glukózy jsou enzymy fosfoglukonátové dráhy reprimovány. Druhy řazené do třetí skupiny jsou obligátně heterofermentativní, nemají enzym fruktóza-1,6-difosfát-aldolázu. Hexózy tedy fermentují fosfoketolázovou dráhou na kyselinu mléčnou, octovou, etanol a CO 2. Pentózy zkvašují stejnou metabolickou drahou na kyselinu mléčnou a octovou. V případě obligátně heterofermentativních laktobacilů je fosfoketoláza konstitutivně exprimovaným enzymem. Kromě cukrů mohou laktobacily využívat jako zdroje energie nebo jako akceptory elektronů řadu jiných látek, např. citrát, malát, pyruvát, tartrát, chinolát, glycerol, nitrát, nitrit apod. (Wood a Holzapfel, 1995). Laktobacily vykazují růst v rozmezí teplot 15-4 C. Některé jsou schopny růst i při 5 C (L. sake), naproti tomu tzv. termofilní laktobacily mají horní hranici 55 C (Lactobacillus delbrueckii ssp. delbrueckii). Teplotní optimum většiny zástupců je 28 3 C. Ve vztahu k ph jsou laktobacily acidotolerantní až acidofilní. Optimální počáteční hodnota ph média je 6,4-4,5. Tvorbou kyselin snižují ph prostředí až pod hodnotu 4,. Produkované kyseliny, mléčná a octová, jsou při nízkém ph jen málo disociované a spolu s dalšími produkovanými nízkomolekulárními látkami (H 2 O 2, CO 2, diacetyl, bakteriociny) působí mikrobistaticky až mikrobicidně na ostatní mikroorganizmy v prostředí (Ammor a kol., 26). Laktobacily mohou tvořit D- i L-formu kyseliny mléčné nebo racemickou směs obou izomerů, v závislosti na přítomnosti specifické NAD + -dependentní laktátdehydrogenázy. Optimálního růstu laktobacilů je dosaženo za mikroaerofilních nebo anaerobních podmínek. Většina laktobacilů je však ke kyslíku značně tolerantní. Na agarových plotnách vytvářejí hladké, lesklé, bezbarvé kolonie s pravidelnými okraji, o průměru 2-5 mm. V tekutých médiích je růst zpravidla rovnoměrný v celém objemu. Zástupci rodu Lactobacillus jsou citliví k většině antibiotik působících na grampozitivní bakterie, s vyjímkou vankomycinu, k němuž mohou vykazovat zvýšenou přirozenou rezistenci (Mathur a Singh, 25; Rönka a kol., 23). Některé druhy a kmeny mohou produkovat bakteriociny (Görner a Valík, 24). Laktobacily se běžně vyskytují v mléce, mléčných produktech, masných výrobcích, pekařském droždí, siláži, kravském hnoji, v bachoru přežvýkavců či jako častá komenzální mikroflóra pochvy, trávicího traktu a ústní dutiny člověka a zvířat. Méně často kolonizují povrch rostlin. Hojně jsou však nacházeny na rozkládajícím se rostlinném materiálu 4
5 (obzvláště na ovoci). Některé druhy laktobacilů se používají se ve formě čistých zákvasných kultur při výrobě jogurtů, acidofilního mléka, tvarohu, sýrů, kynutého těsta, rostlinných a masných fermentovaných produktů a při fermentaci zápar. Významně se však také mohou projevovat při kažení potravin, zejména piva, vína, ovocných šťáv, mléčných a masných výrobků nebo marinovaných ryb (Görner a Valík, 24) Lactobacillus brevis Buňky L. brevis mají tvar tyček až kokotyček se zaoblenými konci. Velikost buněk je většinou 1,5-1 µm na délku a,5-1,2 µm na šířku. Buňky mohou být rovné nebo zakřivené, v závislosti na stáří kultury a podmínkách kultivace. Některé kmeny se mohou v kultuře vyskytovat jako směs krátkých a dlouhých buněk. Tvorba řetízků je méně častá. Optimálního růstu těchto bakterií je dosaženo při teplotě 3 C a ph v rozmezí 4,-6,. Obsah G+C se pohybuje v rozmezí %. L. brevis je řazen do třetí fyziologické skupiny rodu Lactobacillus, neobsahuje tedy fruktóza-1,6difosfát-aldolázu, klíčový enzym glykolytické dráhy. Fermentace hexóz (glukózy, méně často galaktózy) probíhá po fosfoglukonátové dráze (obr. 1), kdy je aktivovaná hexóza dehydrogenována za vzniku 6-fosfoglukonátu, který je následně dehydrogenací a dekarboxylací převeden na pentóza-5-fosfát. Ten je fosfoketolázou štěpen na glyceraldehyd- 3-fosfát (GAP) a acetylfosfát, přičemž GAP je přeměňován až na kyselinu mléčnou. Acetylfosfát je z energetického hlediska klíčovým intermediátem fosfoketolázové dráhy. Pokud není dostupný jiný akceptor elektronů, je acetylfosfát redukován přes acetyl-coa a acetaldehyd na etanol, čímž dojde v podstatě ke ztrátě acetylfosfátu, protože ten může být využit při fosforylaci na úrovni substrátu k syntéze ATP. To je možné pouze v případě, že je přítomen externí akceptor elektronů (např. acetaldehyd, α-ketoglutarát, fruktóza, fumarát). Lactobacillus brevis může využívat také glycerol jako akceptor elektronů při anaerobní kofermentaci s glukózou. Glycerol je nejprve dehydratován na 3-hydroxypropionaldehyd, který se dále redukuje na 1,3-propandiol. Konečnými produkty této metabolické dráhy jsou tedy kyseliny mléčná, octová, CO 2 a 1,3-propandiol. 5
6 Obr. 1. Fosfoketolázová dráha fermentace hexóz a pentóz. Klíčovým enzymem je fosfoketoláza, která katalyzuje štěpení xylulóza-5-fosfátu na glyceraldehyd-3-fosfát a acetyl-fosfát. Pentózy jsou fermentovány po konverzi na xylulóza-5-fosfát (Flickinger a Drew, 1999). Pentózy (fruktóza, ribóza, arabinóza, méně často xylóza) jsou zkvašovány na kyselinu mléčnou a octovou. Netvoří se CO 2 a vzhledem k tomu, že nejsou nutné dehydrogenační kroky k dosažení intermediátu xylulóza-5-fosfátu, není acetylfosfát redukován na etanol, ale za vzniku kyseliny octové dává vznik 1 ATP fosforylací na úrovni substrátu. Při kvašení pentóz tedy vzniká ekvimolární množství kyseliny mléčné a octové. U L. brevis však byly pozorovány vyjímky v metabolizmu fruktózy, kdy docházelo k indukci fruktóza-1,6-difosfátaldolázy a fermentace fruktózy probíhala po glykolytické dráze (Salminen a Wright, 1998). Při fermentaci glukonátů je před fosfoketolázovou reakcí nutný dehydrogenační krok. Jistá část acetylfosfátu tedy musí být redukována na etanol, aby byla udržena redoxní 6
7 rovnováha. Z disacharidů jsou buňky L. brevis schopny využívat maltózu a melibiózu. Celobiózu a trehalózu nefermentují. Z trisacharidů mohou některé kmeny využívat rafinózu. Lactobacillus brevis je schopný provádět reduktivní deaminaci argininu. Arginin přitom neslouží jako jediný zdroj energie, ale je katabolyzován souběžně s fermentovatelnými cukry. Bezprostředně po vstupu argininu do buňky dochází k jeho hydrolýze na citrulin a amoniak. Ornitin karbamoyltransferáza katalyzuje fosforolytické štěpení citrulinu na karbamoylfosfát a ornitin. Z karbamoylfosfátu vzniká 1 ATP fosforylací na úrovni substrátu za tvorby NH 3 a CO 2. Jako konečné produkty metabolizmu argininu tedy vznikají ornitin, NH 3 a CO 2 v poměru 1:2:1 (Wood a Holzapfel, 1995; Salminen a Wright, 1998) Schopnost kmenů L. brevis kazit pivo Vzhledem k růstovým požadavkům bakterií mléčného kvašení je pro bakterie adaptované na hořké chmelové látky mladina ideálním prostředím pro růst. V průběhu hlavního kvašení klesá obsah rozpuštěného kyslíku, snižuje se hodnota ph a pivovarské kvasinky uvolňují do prostředí značné množství vitamínů, aminokyselin a dalších látek, které stimulují růst bakterií mléčného kvašení. Pivo během dokvášení v ležáckých tancích je vhodným prostředím pro růst laktobacilů a pediokoků. Při rozvoji kontaminace se uplatňuje několik významných faktorů. Je to především teplota dokvašování, stupeň prokvašení piva a hladina počáteční kontaminace. Zvýšením teploty dokvašovaní nad 5 C vzrůstá významně počet kontaminujících mikroorganizmů. Piva s vyšším ph, málo prokvašená, s vyšším obsahem aminokyselin a zkvasitelných cukrů a s nižším obsahem CO 2 jsou více náchylná k rozvoji kontaminant. Riziko bakteriálního kažení piva je větší v pivovarech, které produkují nepasterované pivo (Šavel, 198; Drdák a kol., 1996; Vaughan a kol., 25). Nejčastěji detekovanou kontaminantou pivovarských provozů je druh Lactobacillus brevis, který zahrnuje kmeny pivo kazící i nekazící. Zakalení piva způsobené masivním pomnožením buněk L. brevis je patrné na obr. 2. Tyto bakterie negativně ovlivňují chuť a vůni piva produkcí kyseliny mléčné a octové. Typická pro L. brevis je schopnost fermentovat dextriny a škrob, což vede k hlubšímu prokvašení piva (Vaughan a kol., 25) 7
8 Obr. 2. Zákal piva způsobený kontaminací L. brevis (Vaughan a kol., 25) Jedinou metodou odlišení pivo kazících a nekazících kmenů je provedení tzv. forcing testu, při kterém se bakterie vyizolované z piva a pivovarského provozu očkují do sterilního pasterovaného piva a jejich růst je sledován po dobu až osmi týdnů. Typická pro L. brevis je právě schopnost kazit pivo do tří týdnů od inokulace (Hollerová a Kubizniaková, 22; Sakamoto a Konings, 23; Yansanjav, 23). 8
9 1.2. Hořké chmelové látky Jednou ze surovin pro výrobu piva je chmel (Humulus lupulus). Nejdůležitější látkou chmele je lupulin obsažený v chmelových hlávkách (šišticích). Hlavními složkami lupulinu jsou chmelové pryskyřice, silice a třísloviny. Kromě těchto látek jsou součástí lupulinu látky doprovodné (organické kyseliny, vosky, tuky, minerální látky, dusíkaté látky), které mají z pivovarského hlediska malý význam. Chmelové pryskyřice lze na základě rozpustnosti v hexanu dělit na měkké (rozpustné) a tvrdé (nerozpustné). Složky tzv. měkkých pryskyřic, α-kyseliny (humulony) a β-kyseliny (lupulony), dodávají pivu charakteristickou hořkost, podílejí se významně na stabilitě pivní pěny a vyznačují se antimikrobiálními účinky. Struktura těchto látek je uvedena na obrázku 3. Tvrdé pryskyřice vznikají z α-hořkých kyselin při dozrávání a přezrávání chmelových šištic (Horejsek a Zich, 199). α-kyselina β-kyselina R: -CH 2 CH(CH 3 ) 2 humulon lupulon -CH(CH 3 ) 2 kohumulon kolupulon -CH(CH 3 )CH 2 CH 3 adhumulon adlupulon Obr. 3. Struktura α- a β-hořkých kyselin. Molekuly chmelových kyselin obsahují základní aromatické jádro, které je ve všech polohách substituováno. Na aromatické jádro α-kyselin jsou navázány tři hydrofobní řetězce, molekuly β-kyselin obsahují čtyři hydrofobní postranní řetězce. Jednotlivé analogy α- a β-kyselin se liší pouze postranním řetězcem u druhého uhlíku cyklického jádra (Krofta a Tichá, 1997). 9
10 Humulony (α-hořké kyseliny) jsou jen velmi málo rozpustné ve vodě (a tedy i v mladině a pivu), ale během chmelovaru ve slabě kyselém vodném prostředí (mladina) izomerují za vzniku cis- a trans-izo-α-kyselin (obr. 4), které jsou ve vodě rozpustné a vykazují silnou organoleptickou hořkost. Lupulony (β-hořké kyseliny) neobsahují α-hydroxyketonový zbytek a nemohou proto podstoupit stejný izomerační proces jako α- kyseliny (Moir, 2). Izomerují jen v nepatrné míře a jejich vliv na hořkost piva je tedy mnohem menší. V molekule β-kyselin je další hydrofobní postranní řetězec příčinou špatné rozpustnosti ve vodném prostředí (Kosař a Procházka, 2). α-kyselina trans-izo-α-kyselina cis-izo-α-kyselina Obr. 4. Izomerace α-hořkých kyselin. Relativní množství cis- a trans-izomerů je závislé na podmínkách izomerace. Pokud izomerace probíhá varem v mladině nebo v alkalickém roztoku obsahujícím jednomocné kationty (Na +, K + ), pak výsledná směs obsahuje 75% cis- a 25% trans-izo-αkyselin. V přítomnosti dvojmocných kationtů (Mg 2+, Ca 2+ ), které silně katalyzují izomerační reakci chmele, vznikají cis- a trans-izomery v poměru 5:5 (Moir, 2). Chmelové silice jsou směsí víceméně lehce těkavých terpenových sloučenin, které jsou, s částečným přispěním těkavých produktů vznikajících při rozkladu pryskyřic, zodpovědné za charakteristickou vůni chmele. Třísloviny, jejichž obsah v průběhu dozrávání chmele klesá, přispívají k pěnivosti piva a podílejí se různou měrou na jeho chuti a vůni. 1
11 α-hořké kyseliny Humulony jsou z pivovarského hlediska nejdůležitější složkou chmele. V hotovém pivu jsou přítomny v koncentraci mg/l. Kyselou povahu těchto slabých nekarboxylových kyselin způsobuje enolová skupina na třetím uhlíku cyklického jádra. Senzoricky jsou v čistém stavu bez chutě a bez vůně a teprve varem izomerují na cyklopententrionové deriváty nazývané izo-α-hořké kyseliny (Basařová a Čepička, 1985). Humulony jsou směsí několika analogů, které se liší postranním řetězcem na druhém uhlíku aromatického jádra. Nejvíce jsou zastoupeny humulon, kohumulon a adhumulon. Pivu udělují hořkost jejich analogy: izohumulon, izokohumulon a izoadhumulon. Pro každou izo-α-kyselinu existují stereoizomery (cis a trans), v pivu je tedy šest izo-α-kyselin (Krofta a Tichá, 1997). Izomerace α-hořkých kyselin je nepochybně nejdůležitější reakcí chemie chmele. Jedná se o velmi složitý chemický proces, při kterém vznikají v menším množství i jiné produkty, např. allo-, abeo- a anti-izo-α-hořké kyseliny. Při běžných podmínkách chmelovaru je účinnost izomerace nízká (cca 3 %), což je způsobeno kyselou povahou sladiny (ph 5,2) a tvorbou sraženiny během chmelovaru a kvašení. Ve formě hlávkového chmele nebo chmelových pelet jsou tedy α-hořké kyseliny relativně málo využity. Proto jsou chmelové šištice častěji nahrazovány chmelovými extrakty, které se získávají převodem látek chmele do rozpouštědel, jejich následným odpařením a zakoncentrováním preparátu. Tyto preparáty jsou lépe uskladnitelné než sušený hlávkový, popř. lisovaný chmel, snadno se dávkují a nejsou náchylné ke ztrátě kvality během skladování (Kosař a Procházka, 2; Moir, 2). Pro zlepšení senzorické hořkosti, stability a pěnivosti piva se používají chmelové izoextrakty, připravované alkalickou izomerací chmelových extraktů za katalytického působení dvojmocných kationtů. Izoextrakty lze aplikovat při zkrácené době varu nebo pro tzv. studené chmelení piva (Kosař a Procházka, 2). Hlavní výhodou používání izomerizovaných chmelových extraktů, ve srovnání s hlávkovým nebo granulovaným chmelem a chmelovými extrakty, je zlepšení kontroly výsledné hořkosti piva (Moir, 2). Katalytickou redukcí izo-α-kyselin se chemicky připravují dihydroizo-α-kyseliny, které mají karbonylovou skupinu na izohexenylovém postranním řetězci redukovanou na sekundární alkohol. Hydrogenací dvojných vazeb postranních řetězců v molekule izo-αkyselin se připravují tetrahydroizo-α-kyseliny, které se vyznačují vysokou světelnou 11
12 stabilitou, výrazně zlepšují stabilitu pěny a vykazují ve srovnání s ostatními chmelovými deriváty nejvyšší hořkost (Ting a Goldstein, 1996; Moir, 2). Nejhlubší hydrogenace vede ke vzniku hexahydroizo-α-kyselin. Použití izoextraktů a redukovaných izo-α-kyselin je v řadě zemí technologicky a legislativně omezeno (Kosař a Procházka, 2) Mechanizmus působení α-hořkých kyselin na grampozitivní bakterie Účinek chmelových derivátů může být mikrobistatický i mikrobicidní, v závislosti na použité koncentraci a době expozice. Hop inhibují růst grampozitivních bakterií a některých hub (Larson a kol., 1996). Mechanizmus antimikrobiálního účinku Hop však nebyl dosud spolehlivě objasněn. Podle Simpsona (1993a) hořké chmelové látky v nedisociované formě inhibují růst grampozitivních bakterií. Vystupují jako protonofory, tedy zvyšují permeabilitu lipidové dvojvrstvy biologických membrán pro protony. V nedisociované formě přejdou membránou a v cytoplazmě působením ph vyššího, než je hodnota pk a Hop, disociují na anionty a protony (obr. 5). antibakteriální forma neaktivní forma Obr. 5. Disociace trans-izohumulonu (Sakamoto a Konings, 22) Anionty tvoří s dvojmocnými kationty neutrálně nabité komplexy, které pasivně opouštějí buňku. Dochází tedy k elektroneutrální výměně protonů za buněčné dvojmocné kationty, jako je Mn 2+ nebo Mg 2+. V citlivých buňkách způsobují uvolněné protony snížení ph i vedoucí k narušení transmembránového protonového gradientu protonové hnací síly 12
13 (PMF). Dochází k inhibici příjmu živin řízeného PMF a k hladovění buňky. Fernandez a Simpson ve své studii (1993) uvádějí, že esenciální význam pro antimikrobiální aktivitu Hop může mít β-triketonová skupina v molekule těchto látek. Simpson a Smith (1992) se ve své práci zabývali studiem vlivu jednomocných a dvojmocných kationtů na antibakteriální aktivitu trans-izohumulonu. Autoři pozorovali, že přítomnost jednomocných kationtů (K +, Na +, Rb +, NH 4+ ) v kultivačním médiu stimuluje antimikrobiální aktivitu trans-izohumulonu. Jednotlivé ionty se mezi sebou ve svém účinku lišily. Tyto rozdíly mohou být způsobeny účinkem iontů na fyziologii buněk nebo jejich interakcemi s trans-izohumulonem a buněčným povrchem bakterií. Trans-izohumulon nemůže vázat ionty K +, pokud v médiu nejsou přítomny dvojmocné kationty (Mn 2+, Mg 2+, Ni 2+ a Ca 2+ ) nebo trojmocné kationty (Li 3+, Al 3+ ). Schopnost chmelových látek vázat současně dva nebo více kationtů má zřejmě zásadní význam při jejich antibakteriálním působení. Je možné, že v přítomnosti iontů K + se zvyšuje schopnost trans-izohumulonu přenášet kationty Mn 2+ a H + přes buněčnou membránu bakterií. Tato skutečnost však dosud nebyla objasněna. Inhibice aktivity H + -ATPázy působením Hop nebyla pozorována (Simpson a Smith, 1992; Simpson a Hughes, 1993; Simpson a kol., 1993) Rezistence L. brevis k působení α-hořkých kyselin Rezistence k hořkým chmelovým látkám je stabilní vlastnost, fenotypově i genotypově, a je známa pouze u bakterií mléčného kvašení, které se vyznačují schopností růst v pivu. Nejčastějším původcem mikrobiálního kažení piva je druh L. brevis, který zahrnuje kmeny pivo kazící i nekazící. Stupeň rezistence k Hop se u jednotlivých kmenů L. brevis liší. Kmeny rezistentní k trans-izohumulonu vykazují rezistenci i k ostatním izo-α-kyselinám. Lze tedy předpokládat společný mechanizmus (mechanizmy) rezistence bakterií k působení různých Hop (Fernandez a Simpson, 1993; Simpson, 1993b). Bakterie rezistentní k působení trans-izohumulonu nevykazují rezistenci k ostatním ionoforům (např. nigericin, monezin), slabým kyselinám (sorbová, benzoová), etanolu nebo antibiotikům (ampicilin, vankomycin). Kmeny citlivé a rezistentní k Hop nelze odlišit na základě morfologie buněk a kolonií (kultivovaných aerobně i anaerobně), nebo schopnosti 13
14 růst při různých hodnotách ph (většina kmenů roste v rozmezí ph 4,-7,). Nebyla také pozorována souvislost mezi rezistencí k Hop a utilizací cukrů, produkcí metabolitů, požadavky na hořčík, citlivostí k peroxidovým radikálům ani expresí buněčných proteinů (Fernandez a Simpson, 1993). Na základě znalostí mechanizmů rezistence bakterií k různým antimikrobiálním látkám a výsledků studií zabývajících se účinky Hop na bakterie, lze některé mechanizmy zcela vyloučit. Citlivé a rezistentní kmeny se neliší v množství trans-izohumulonu, který se váže na buňku. Rezistence tedy nespočívá ve schopnosti buněk zabránit Hop dosáhnout cílového místa, což je v případě trans-izohumulonu a ostatních Hop pravděpodobně cytoplazmatická membrána. Jedním z mechanizmů rezistence může být schopnost buněk měnit lipidové složení cytoplazmatické membrány tak, aby se snížila schopnost transizohumulonu přejít membránou do cytoplazmy. Tato možnost je uváděna v literatuře, nicméně nebyla dosud prokázána (Sakamoto a Konings, 22; Sakamoto a Konings, 23). Dále je zřejmé, že buňky rezistentních kmenů nejsou schopné inaktivovat trans-izohumulon enzymatickou modifikací. Enzymy k tomu potřebné by musely být lokalizované v buněčné stěně, nebo by je buňky exkretovaly do média (Simpson a Fernandez, 1994). Hop, podle studie Simpsona (1993a), fungují jako protonofory a způsobují narušení transmembránového gradientu protonů. Bakteriální buňka může odpovídat syntézou většího množství membránové H + -ATPázy a tedy zvýšeným vylučováním protonů. Autor proto předpokládá, že kmeny, které pivo kazí, si udržují gradient ph, kdežto u nekazících kmenů dochází ke snížení ph i pod fyziologickou mez a buňka odumírá. Na výsledné rezistenci se také může podílet větší pufrační kapacita cytoplazmy v buňkách rezistentních kmenů (Simpson a Fernandez, 1994; Cloete, 23). Kmeny pivo kazící a nekazící se neliší produkty polymerázové řetězové reakce s využitím sekvencí 5S a 16S rdna. Rovněž metodou RAPD-PCR nelze dospět ke spolehlivému odlišení kmenů citlivých a rezistentních (Hayashi a kol., 21). Se schopností L. brevis kazit pivo nekoreluje přítomnost proteinů S-vrstvy a při použití antiséra proti L. brevis 578, který pivo kazí, byly pozorovány reakce s 23 z 24 kmenů kazících a se 2 z 13 kmenů nekazících. Avšak antisérum proti antigenům L. brevis 578 bylo možno použít na odlišení pivo kazících a nekazících kmenů rodu Pediococcus (Yasui a Yoda, 1997). 14
15 Tsuchiya a kol. (2) ve své práci získali monoklonální protilátky specifické pro antigeny přítomné v buněčné stěně kmenů L. brevis, L. lindneri a Pediococcus damnosus schopných kazit pivo. Při použití tří monoklonárních protilátek bylo možné specificky odlišit pivo kazící kmeny od nekazících. U L. brevis však docházelo ke snižování reaktivity s protilátkami, pokud byly bakterie kultivovány v médiu bez izohumulonů. Autoři předpokládají, že pokud se kmeny schopné kazit pivo kultivují v médiu bez hořkých chmelových látek, nejsou povrchové antigeny specifické pro kazící kmeny exprimovány. Jistá souvislost byla pozorována mezi schopností Lactobacillus brevis kazit pivo a D-laktátdehydrogenázou (D-LDH). Takahashi a kol. (1999) ve své práci studovali vlastnosti D-LDH u šedesáti kmenů L. brevis, z nichž 44 kmenů vykazovalo schopnost kazit pivo. Všechny kmeny bylo možno rozdělit do pěti skupin (A-E) na základě pohyblivosti jejich D-laktátdehydrogenázy v polyakrylamidovém gelu. D-LDH jednotlivých skupin se od sebe nelišily molekulovou hmotností (stanovené pomocí SDS-PAGE a gelové filtrace), ale rozdíly byly pozorovány v teplotním optimu, izoelektrickém bodě a ph optimu. Ze 44 kmenů L. brevis kazících pivo, jich 4 bylo možné zařadit do skupiny B. Teplotní optimum D-LHD této skupiny bylo 5 C, tedy významně nižší než v ostatních skupinách (6 C). Rezistence k hořkým chmelovým látkám je stabilní vlastnost, kódovaná chromozomální DNA. U kmene L. brevis BSO31, který vykazoval rezistenci k hořkým látkám chmele, nedošlo ke změně rezistence k Hop po eliminaci všech plazmidů nebo mutacemi indukovanými UV-zářením (Fernandez a Simpson, 1993; Simpson 1993b). Přesto se možností, že na výsledné rezistenci má významný podíl produkt genu hora lokalizovaného na plazmidech, zabývá velký počet studiií, např. Sami a kol., 1997a; Sami a kol., 1997b; Hayashi a kol., 21; Sakamoto a kol., 21; Sakamoto a Konings, 22; Sakamoto a kol., 22; Sakamoto a Konings, 23; Suzuki a kol., 25b; Suzuki a kol., 25c. Autoři těchto prací předpokládají, že gen hora kóduje membránový protein, který funguje jako multidrogový přenašeč ABC-typu (ABC=ATP-binding cassette), jehož aminokyselinová sekvence je z 53 % identická se sekvencí multidrogové pumpy LmrA identifikované u Lactococcus lactis. Dosud však nebylo prokázáno, že se produkt genu hora přímo podílí na vylučování Hop z rezistentních buněk. Hayashi a kol. (21) provedli Southernův přenos a hora-pcr, a gen hora byl detekován u 13 z celkového počtu 15 kmenů L. brevis, které pivo nekazí. Ve stejné studii byla zvažována možnost, že se na rezistenci podílí produkt genu hita ( hop-inducible cation 15
16 transporter ). Tento gen byl nalezen u všech pivo kazících kmenů L. brevis použitých v této studii a u 6 z 15 kmenů, které nevykazovaly schopnost kazit pivo. Podle studie Iijima a kol. (26) k rezistenci k Hop přispívá produkt genu horc, který funguje jako PMF-dependentní multidrogový přenašeč. Obr. 6. Možné mechanizmy rezistence L. brevis k hořkým chmelovým kyselinám. U buněk citlivých chmelové kyseliny v nedisociované formě (Hop-H) přejdou membránou do cytoplazmy, kde disociují vlivem vyššího ph i na protony a anionty (Hop - ). Anionty tvoří neutrálně nabité komplexy s buněčnými dvojmocnými kationty a volně difundují z buňky (Hop-Mn-Hop). Uvolněné protony způsobí snížení ph i vedoucí k narušení transmembránového gradientu protonů ( ph) a následně i protonové hnací síly (pmf). Rezistentní buňka pravděpodobně používá několik mechanizmů proti působení Hop: (a) nedisociované chmelové kyseliny mohou být z membrány vypuzeny ATP-řízeným multidrogovým přenašečem HorA (Sakamoto a kol., 21), (b) existují pravděpodobně i multidrogové přenašeče řízené protonovou hnací silou (Suzuki a kol., 22; Suzuki a kol. 25a), (c) zvýšenou aktivitou H + -ATPázy dochází k vylučování protonů uvolněných při disociaci chmelových kyselin. Rezistentní buňky mohou mít větší zásobu ATP než buňky citlivé (Sakamoto a Konings, 23). Všechny dosud předpokládané mechanizmy rezistence k Hop by vyžadovaly nepochybně velké množství energie. Hotové pivo je prostředí chudé na živiny, neboť většinu jich při hlavním kvašení spotřebují kulturní kvasinky. Hořké chmelové látky fungují jako 16
17 protonofory a inhibují příjem živin (Simpson, 1993a). Přesto některé kmeny L. brevis jsou schopny v pivu růst a množit se. Suzuki a kol. (25a) prokázali, že buňky L. brevis ABBC45 při růstu v pivu utilizovaly citrát, pyruvát, malát, arginin a v menší míře i tyrozin. Transport některých živin do buněk může být nezávislý na PMF, nebo se za určitých podmínek může dokonce na tvorbě jedné nebo obou složek protonové hnací síly podílet. Vzhledem ke skutečnosti, že Hop inhibují příjem živin řízený PMF (leucin, maltotrióza), by mohla schopnost bakterií získávat energii ze zmíněných substrátů transportovaných do buněk systémy nezávislými na PMF (malát, arginin, atd.) významně přispívat k rezistenci k Hop, nebo tedy obecně ke schopnosti bakterií růst v pivu (Suzuki a kol., 25a) Regulace ph i u L. brevis Optimální růst bakterií nastává ve specifickém rozmezí ph, v závislosti na druhu bakterie. Není to však ph prostředí, které bezprostředně ovlivňuje růst a metabolizmus buněk, ale ph intracelulární. Homeostáze ph i je kritická pro kontrolu mnoha buněčných procesů, jako je přepis DNA, syntéza proteinů, aktivita enzymů a transport živin z prostředí do buňky (Poolman a kol., 1987; Nannen a Hutkins, 199; Breeuwer a kol., 1996; Cotter a Hill, 23). Různé organizmy využívají různé pasivní a aktivní mechanizmy k regulaci ph i. Fermentativní mikroorganizmy obecně vykazují schopnost růstu v širším rozmezí hodnot ph i než organizmy s respiratorním typem metabolizmu. S vyjímkou alkalifilních organizmů, hodnota ph i je nižší než ph prostředí. Pro Lactobacillus brevis a bakterie mléčného kvašení obecně je charakteristická produkce organických kyselin, která způsobuje snížení ph prostředí až pod hodnotu 3,5. Homeostáze ph i je tedy pro růst a množení těchto bakterií esenciální (Booth, 1985; Konings, 22). Biologické membrány jsou jen velmi málo propustné pro protony a ostatní ionty. K udržení ph-homeostáze částečně přispívá i relativně vysoká pufrační kapacita cytoplazmy, daná obsahem postranních bílkovinných řetězců v cytoplazmě a zásobou glutamátu a polyaminů (Hill a kol., 1995). Pravděpodobně nejdůležitějším homeostatickým systémem acidotolerantních fermentujících bakterií, mezi které patří L. brevis, je H + -ATPáza. Tento membránově vázaný 17
18 enzym se skládá ze dvou hlavních jednotek: hydrofilní katalytické F 1 -jednotky a hydrofobní jednotky F, která funguje jako membránový kanál pro translokaci protonů (Cotter a kol., 2; Corcoran a kol., 25). U respirujících mikroorganizmů ATPáza katalyzuje syntézu ATP oxidativní fosforylací na membráně, nebo anaerobně generuje PMF za spotřeby ATP. Fermentující mikroorganizmy syntetizují ATP pouze fosforylací na úrovni substrátu. H + -ATPáza u těchto organizmů vylučuje protony z cytoplazmy do extracelulárního prostředí. Je to činnost vyžadující energii ve formě ATP, neboť vylučování protonů se děje z prostředí méně kyselého (buňka) do prostředí více kyselého (vnějšího prostředí), tedy proti koncentračnímu spádu (Kobayashi, 1985; Nannen a Hutkins, 1991; Hutkins a Nannen, 1993; Yamamoto a kol., 1996; Futai a kol., 2; Matsumoto a kol., 24). H + -ATPázy izolované z různých mikroorganizmů vykazují odlišná ph optima. Z Lactobacillus casei izolovaná ATPáza vykazovala optimum ph 5, a z Lactobacillus plantarum 5,5, zatímco optimální činnosti enzymu u Lactococcus lactis bylo dosaženo při ph 7,5 (Siegumfeldt a kol., 2). Vystavení buněk Lactobacillus acidophilus vlivu nízkého ph ex vedlo ke zvýšení množství ATPáza-specifické mrna. Je tedy zřejmé, že regulace množství H + -ATPázy v membráně se děje na úrovni transkripce (Azcarate-Peril a kol., 24; Corcoran a kol., 25). Významně se může na ph-homeostázi bakterií podílet aktivita K + -ATPázy. Výměnou K + za H + dochází ke konverzi elektrického potenciálu generovaného K + -ATPázou na transmembránový gradient protonů. Tato výměna iontů tedy zajišťuje udržení ph a podílí se tak na regulaci intracelulárního ph (van de Guchte a kol., 22). Jako protonové pumpy regulující ph i za určitých podmínek fungují sekundární transportní systémy katalyzující výměnu prekurzor/produkt. Pokud je konečný produkt strukturálně podobný svému prekurzoru, může být tento prekurzor transportován do buňky stejným transportním systémem, jakým je produkt vylučován do prostředí. Takový přenos je pro buňku energeticky výhodný, neboť řídící silou pro transport obou látek je jejich gradient. Za jistých podmínek může výměna prekurzor/produkt přispívat k metabolizmu generací obou složek protonové hnací síly. V případě, že je výměna prekurzor/produkt elektrogenní, dochází ke vzniku transmembránového potenciálu. Pokud jsou při tvorbě produktu spotřebovány protony, alkalizuje se cytoplazma a tvoří se gradient protonů na membráně (Konings, 22). Nejvíce prostudované jsou transportní systémy založené na dekarboxylačních reakcích aminokyselin (obr. 7). Aminokyselina je transportována do buňky, kde je specifickým 18
19 enzymem dekarboxylována. Při reakci se spotřebuje proton a produkt reakce je stejným přenašečem vyloučen z buňky do prostředí (van de Guchte a kol., 22; Merrell a Camilli, 22). Aktivita glutamát- a aspartát-dekarboxylázového systému byla detekována u Lactobacillus sp. (Higuchi a kol., 1997; Konings, 22) a konkrétně i u druhu Lactobacillus brevis (Ueno a kol., 1997; Yokoyama a kol., 22; Park a Oh, 26). Glutamátdekarboxyláza je pyridoxal-5 -fosfát dependentní enzym, který katalyzuje ireverzibilní dekarboxylaci L-glutamátu na γ-aminobutyrát (GABA). Podíl na regulaci ph i byl zjištěn dále u transportního systému histidin/histamin Lactobacillus buchneri (Azcarate-Peril a kol., 24). Elektroneutrální výměna arginin/ornitin u L. brevis přispívá k tvorbě energie a podílí se na regulaci ph i. Arginin je metabolizován na ornitin, NH 3 a CO 2 v poměru 1:2:1. Aktivita arginin-deaminázy podléhá přísné regulaci; nejvyšší aktivita byla detekována při snížení ph ex pod 5,. Z karbamoylfosfátu fosforylací na úrovni substrátu vzniká 1 ATP. Amoniak reaguje s H + a zabraňuje tak snižování ph pod fyziologickou mez (van de Guchte a kol., 22; Konings, 22). A B Obr. 7. Transportní systémy přispívající k udržení ph-homeostáze bakterií mléčného kvašení. A: Elektroneutrální výměna arginin/ornitin u Lactococcus lactis, B: Elektrogenní antiport histidin/histamin u Lactobacillus buchneri; His-monokationt, Ha + -dikationt histaminu (Konings, 22) 19
20 Dalším mechanizmem, který se za jistých podmínek může podílet na udržení gradientu protonů na membráně bez spotřeby ATP může být u Lactobacillus brevis transport laktátu z buňky (obr. 8). Hodnota pk a kyseliny mléčné je 3,9. V buňce se tedy za fyziologického ph i vyskytuje zcela disociována. Do prostředí je exkretována ve formě aniontu sekundárním trasportem, a to symportem s protony. Při hodnotách ph kolem 6, dochází k translokaci více než jednoho protonu na molekulu laktátového aniontu, přenos je tedy elektrogenní a generuje se PMF. Při nížším ph ex je stechiometrie přenosu rovna jedné, transport je elektroneutrální, PMF se netvoří. Elektrogenní efflux konečného produktu symportem s protony byl pozorován i v případě acetátu (Konings a kol., 1997; Konings, 22). Obr. 8. Elektrogenní transport laktátu (Konings, 22) Při poklesu ph ex pod optimální hodnotu si neutrofilní bakterie (např. rod Lactococcus, E. coli) udržují ph i blízké neutrálnímu tvorbou silného protonového gradientu. Pro L. brevis a ostatní acidotolerantní fermentující bakterie je vytváření silného gradientu protonů energeticky nevýhodné. Vyvinuly si proto jinou strategii; jejich ph i klesá s klesajícím ph prostředí během růstu. Udržují si tedy konstantní ph spíše než konstantní ph i. Vysoký protonový gradient navíc vede k akumulaci aniontů organických kyselin, které mají nepříznivý vliv na buněčnou fyziologii (O Sullivan a Condon, 1997; Siegumfeldt a kol., 1999; Siegumfeldt a kol., 2; Van de Guchte a kol., 22). 2
21 Fluorescein jako indikátor ph i Měření ph i lze provést několika způsoby. Metoda 31 P nukleární magnetické rezonance vyžaduje vzorky o vysoké hustotě buněk. Navíc je nutné nákladné přístrojové vybavení. Při měření distribuce radioaktivně značených slabých kyselin a zásad mají na sledované buňky slabé kyseliny negativní vliv. Obě zmíněné metody mají limitované časové rozlišení. V posledních letech jsou vyvíjeny fluorescenční metody pro měření ph i, při nichž se využívají acidobazické fluorescenční indikátory. Intenzita fluorescence závislá na ph je pak měřena např. metodou průtokové cytometrie, spektroflurimetrie nebo FRIM (Breeuwer a kol., 1996; Glaasker a kol., 1996; Leyval akol., 1997; Breeuwer a Abee, 2a; Breeuwer aabee, 2b). Fluorescenční indikátory jsou obecně dvojího druhu: 1) vykazují spektrální posun v závislosti na přítomnosti dané látky, jejíž koncentraci lze následně určit z poměru intenzit při různých excitačních nebo emisních vlnových délkách, 2) nebo se jedná o indikátory, které vykazují zvýšení intenzity fluorescence v přítomnosti dané látky, aniž by docházelo ke spektrálnímu posunu. Strukturálně je ph-senzitivita způsobená rekonfigurací π-elektronového systému fluoroforů, která nastává při protonaci. Fluorescein a jeho deriváty obsahují jako funkční skupiny fenol a karboxylovou skupinu, které jsou ve vodném roztoku při ph nad 9, zcela ionizovány. Acidifikací tohoto dianiontu se nejdříve protonuje fenol s pk a přibližně 6,4 za vzniku monoaniontu. Dalším okyselením se protonuje karboxylová skupina (pk a <5,) a vzniká tak neutrální forma fluoresceinu s pk a okolo 2,1. Kvantový výtěžek klesá v řadě: dianiont (,93), monoaniont (,37), neutrální forma (,31) a kationt (,18). Snižování intenzity fluorescence koreluje se snižováním ph měřeného systému, tedy s tvorbou protonovaných forem fluoresceinu. Vlnová délka a tvar emisního spektra nevykazují významnou závislost na ph. 21
22 ph-senzitivní sonda cfda-se Nefluorescenční derivát karboxyfluoresceinu, cfda-se (karboxyfluoresceindiacetát- N-sukcinimidyl ester), je nejčastěji používán ve formě směsi 5- a 6-izomerů, neboť oba izomery vykazují identické ph-dependentní spektra s pk a ~6,5. Pro kvantitativní měření ph je nutné použít indikátor, jehož pk a je v rozmezí ph měřeného systému. Sonda cfda-se je tedy použitelná pro měření ph i v rozmezí 6,-9, (Shabala a kol., 21; Halm a kol., 24). Barvení fluoresceinem je založeno na skutečnosti, že pouze živé buňky s neporušenou cytoplazmatickou membránou a esterázovou aktivitou jsou schopné akumulovat fluorescenční sondu. Pro usnadnění penetrace karboxyfluoresceinu do bakteriální buňky lze použít nefluorescenční ester cfda-se. Dvě postranní acetátové skupiny v molekule cfda-se umožňují snadný vstup sondy do buňky, kde jsou následně odstraněny buněčnými esterázami. Vzniklý karboxyfluorescein se prostřednictvím sukcinimidylových skupin váže k volným NH 2 skupinám v molekulách intracelulárních proteinů. Takto vytvořené ph-senzitivní konjugáty nemohou procházet membránou z buňky do prostředí. Dochází tedy k ukotvení sondy uvnitř buněk. Buňky se musí barvit v prostředí bez aminokyselin, aby nedocházelo k reakcím fluoroforů s aminoskupinami již v médiu (Breeuwer a Abee, 24). Sonda se používá nejčastěji v koncentraci,5-1 µm, podle typu buněk a aplikace (Budde a Jakobsen, 2; Rechinger a Siegumfeldt, 21; Hornbaek a kol., 22; van Kan, 22; Yansanjav, 23; Wang a kol., 24). V některých studiích se uvádějí koncentrace 3 µm a dokonce vyšší. Cytotoxicita nebyla pozorována (Bracey a kol., 1998; Bunthof a kol., 1999; Shabala a kol., 21). Měření intracelulárního ph buněk obarvených cfda-se je nejčastěji prováděno spektrofluorimetricky nebo metodou FRIM. Obě metody jsou založené na tom, že cfda-se je ratiometrická ph sonda, která nevykazuje žádnou citlivost na ph při excitaci 435 nm a maximální při 49 nm. Intenzita fluorescence obarvených buněk je měřena při excitačních vlnových délkách 49 a 435 nm rychlým přepínáním monochromátoru mezi zmíněnými vlnovými délkami. Emise je zaznamenávána při vlnové délce 525 nm. Výpočet koncentračně-nezávislého poměru mezi ph-senzitivním a ph-nesenzitivním signálem (R 49/435 ) se provádí podílem intenzity fluorescence při excitaci 49 nm a 435 nm. Výpočet poměru R 49/435 předem 22
23 vylučuje možné artefakty způsobené rozdíly v koncentraci barviva. Kalibrace fluorescenčního indikátoru na přesnou hodnotu ph se provádí přímo ve studovaném systému s použitím ionoforů (např. nigericinu, valinomycinu) k vyrovnání vnitřního a vnějšího ph. Hodnota ph i se pak získá odečtením z kalibrační křivky (Lee a kol., 24). Při spektrofluorimetrickém stanovení itracelulárního ph je měřena celková intenzita fluorescence suspenze obarvených buněk v kyvetě. Na konci každého měření je vhodné kalibrovat ph i a ph ex přídavkem valinomycinu a nigericinu k měřenému systému. Fluorescence pozadí se stanoví tak, že se obarvené buňky zfiltrují přes membránu s velikostí pórů,22 µm a změří se intenzita fluorescence filtrátu (Breeuwer a Abee, 24). FRIM je metoda mikroskopická, kde intenzita fluorescence je měřena na úrovni jednotlivých imobilizovaných buněk v mikroskopickém preparátu, přičemž buňky jsou vybírány náhodně při vlnové délce 435 nm (ph-nesenzitivní). Emitovaná fluorescence ( nm) se zaznamenává CCD-kamerou a analýza obrazu se provádí po ukončení mikroskopického pozorování. Oblasti bez buněk se odečtou jako pozadí. Výpočet poměru mezi ph-senzitivním a ph-nesenzitivním signálem (R 49/435 ) se provádí pro každou sledovanou buňku podílem intenzity jednotlivých pixelů obrazu při 49 nm intenzitou odpovídajících pixelů obrazu při 435 nm (Budde a Jakobsen, 2; Lee a kol., 24). 23
24 2. CÍLE DIPLOMOVÉ PRÁCE Charakteristika růstu Lactobacillus brevis v přítomnosti různých koncentrací Tetra Studium faktorů ovlivňujících antibakteriální aktivitu Tetra Aplikace ph-senzitivní sondy pro odlišení pivo kazících a nekazících kmenů L. brevis 24
25 3. MATERIÁL 3.1. Použité mikroorganizmy Kmeny Lactobacillus brevis použité pro vypracování předložené diplomové práce poskytl Výzkumný ústav pivovarský a sladařský v Praze. Kmeny byly uchovávány na šikmém agaru (MRS) při teplotě +4 C a každé tři týdny byly přeočkovány na čerstvé médium Charakteristika použitých kmenů Všechny studované kmeny L. brevis jsou izoláty z pivovarské výroby. Schopností kazit pivo se vyznačují kmeny L. brevis 18, 22, 29, 31, 37, 39, 42, 52, 55 a 56. Kmeny L. brevis 4, 11, 12, 13, 14, 15, 28, 32, 33, 47, 5, 61 a 62 nemají schopnost kazit pivo. Kmeny L. brevis kazící pivo, budou v textu označeny symbolem * za číslem kmene Kultivační média a použité roztoky MRS bujón médium (Oxoid) g destilovaná voda...1 ml ph 6,2 ±,2 při teplotě 25 C sterilizace po dobu 15 minut při teplotě 121 C a tlaku 11 kpa MRS agar médium (Oxoid) g agar... 1 g destilovaná voda...1 ml sterilizace po dobu 15 minut při teplotě 121 C a tlaku 11 kpa 25
26 mmrs bujón médium (Fluka) g destilovaná voda...1 ml sterilizace po dobu 15 minut při teplotě 121 C a tlaku 11 kpa YC-Tetra (YakimaChief, Inc., USA) 1 % (w/v) vodný roztok hořečnatých solí tetrahydroizo-α-kyselin Dimetylsulfoxid, pro molekulární biologii (Sigma-Aldrich, Německo) Etylenglykol (Sigma-Aldrich, Německo) Acetylaceton (Katedra organické chemie, MU, Brno) M-Tetra (Katedra organické chemie, MU, Brno) 1 % etanolový roztok 3-metoxy-tetrahydroizo-α-kyselin Roztoky pro fluorescenční mikroskopii a spektrofluorimetrii: 5(6)-karboxyfluoresceindiacetát-N-sukcinimidyl ester (Fluka Chemie, Sigma-Aldrich, Německo) Poly-L-lyzin (Sigma-Aldrich, Německo),1% (w/v) vodný roztok s,1% timerozalem Pufr fosfátový (,67 M) a) KH 2 PO ,78 g deionizovaná voda...1 ml b) Na 2 HPO 4 12H 2 O... 11,876 g deionizovaná voda...1 ml pufry a) a b) smísit v poměru 6:4; ph upraveno na hodnotu 6,64 pomocí 1 M HCl sterilizace po dobu 15 minut při teplotě 121 C a tlaku 11 kpa 26
27 Pufr HEPES (,5 M) HEPES...1,194 g deionizovaná voda...1 ml ph upraveno na hodnotu 6, a 7,2 pomocí 1 M NaOH a 1M HCl D-glukóza bezvodá, p.a. (Lach-Ner) 3.3. Laboratorní sklo V experimentech bylo používáno laboratorní sklo Simax. Sterilizace byla prováděna autoklávováním po dobu 6 minut při tlaku 2 kpa Použité přístroje a software Bioscreen C Microbiology Reader (Labsystems, Finsko) Biohazard EN Clean Air (Schoeller Instruments, ČR) Termostat Aqualytic (Liebherr, Švýcarsko) Třepačka Promax 22 (Heidolph, Německo) Centrifuga MLW K7D (Německo) Centrifuga EBA 12 R (Hettich Zentrifugen, Německo) Spekol 11 (Carl Zeiss, Jena, Německo) Váhy APX-2 (Denver Instruments, USA) Váhy Satorius Excellence E 2D (Gottlingen AG, Německo) Chladničky Calex, Gorenje Mraznička Gorenje Sušárna HS 122 A Termostat BT 12 (Laboratorní přístroje, Praha) ph-metr (Sentron Titan, ČR) Deionizátor vody Demiwa 3 ros (Watek, ČR) 27
28 Autokláv PS 2 A (Chirana, ČR) Autokláv Sanyo (Japonsko) Přístrojové vybavení a software pro fluorescenční mikroskopii: Fluorescenční mikroskop Carl Zeiss Axiovert 1S (Carl Zeiss, Německo) Chlazená kamera CCD Micro Max s kvantovou účinností 3% (Applied Precision) Rtuťová výbojka 1W Motorizovaný stolek (Ludl Electronic Products Ltd., USA): mechanický posuv osy x, piezoelektrický posuv osy y (Physik Instrumente, Německo) Konfokální jednotka CARV na bázi rotujícího Nipkowova disku (Atto Instruments) Sestava filtrů 86v2 Sedat Quad (Chroma Technology Corp.) Mikroskopické komůrky Lab-Tek TM II. Chambered Coverglass (Nunc) Software Fish 2. (Fakulta informatiky, MU) Přístrojové vybavení a software pro spektroflorimetrii: Luminiscenční spektrometr LS 5 B (Perkin-Elmer Instruments) Software FL WINLAB, verze 4..2, Default ratio data collection method (Perkin-Elmer Instruments) 28
29 4. METODY 4.1. Kultivační podmínky Příprava inokula Inokulum bylo připraveno naočkováním přibližně 1 8 buněk ze zásobního šikmého agaru (MRS) do 2 ml sterilního MRS-bujónu v Ehrlenmayerových baňkách o objemu 1 ml. Kultivace probíhala v termostatu při teplotě +3 C po dobu 24 hodin Příprava buněčné suspenze Suspenze buněk se připravila zaočkováním 1 ml 24-hodinového inokula do 1 ml MRS-bujónu v Ehrlenmayerových baňkách o objemu 25 ml. Kultivace probíhala v termostatu při teplotě +3 C za intenzivního třepání (12 rpm) po dobu 24 hodin. Pro sledování růstu buněk v přítomnosti Tetra, M-Tetra a acetylacetonu pomocí přístroje Bioscreen byla připravena suspenze zcentrifugováním 24-hodinové třepané kultury při 5 rpm, 4 C po dobu 2 minut a promytím v MRS-bujónu. Hustota suspenze byla nastavena na Spekolu 11 na hodnotu OD 62 =,55, tj. přibližně 1 6 CFU/ml. Pro barvení buněk cfda-se byla 24-hodinová třepaná kultura zcentrifugována a promyta fosfátovým pufrem nebo pufrem HEPES a získaný sediment buněk byl v daném pufru naředěn na koncentraci přibližně 1 1 CFU/ml Stanovení MIC Tetra pro kmeny L. brevis Stanovení minimální inhibiční koncentrace (MIC) se nejčastěji používá pro posouzení aktivity antimikrobiální látky. Hodnota MIC je rozpětí koncentrací dané látky, která již inhibuje a ještě neinhibuje růst testovaného organizmu. Pro stanovení MIC Tetra pro studované kmeny L. brevis se připravila řada koncentrací 1 % vodného roztoku Tetra v MRS-bujónu. Do sterilních Wassermannových zkumavek s různými koncentracemi hořkých chmelových látek (2 ml) bylo pipetováno po,1 ml 24-hodinového inokula. Kultivace probíhala v termostatu při +3 C po dobu pěti dnů. Jednou za 24 hodin se nárůst buněk 29
30 zjišťoval sledováním tvorby zákalu a sedimentu. Hodnota MIC byla stanovena jako rozmezí koncentrací, při nichž buňky ještě rostly a již nerostly. Zkumavka s 2 ml MRS-bujónu a se zaočkovaným mikroorganizmem byla použita jako kontrola Růst buněk L. brevis v přítomnosti Tetra Růst buněk v přítomnosti různých koncentrací Tetra se sledoval pomocí přístroje Bioscreen C (Labsystems, Finsko) a softwaru BioLink. Dvě mikrotitrační destičky (tj. 2 jamek) byly rozvrženy tak, aby růst každého kmene mohl být sledován nejméně ve třech opakováních v přítomnosti pěti koncentrací Tetra. Rozmezí těchto koncentrací bylo zvoleno na základě výsledků při stanovení MIC ve Wassermannových zkumavkách. Každá jamka obsahovala 3 µl živného média s danou koncentrací Tetra a 3 µl buněčné suspenze. Jako pozitivní kontrola sloužilo živné médium s bakteriální suspenzí bez chmelových látek. Samotné živné médim bez buněk a jamky obsahující pouze různé koncentrace Tetra sloužily jako negativní kontrola a zároveň kontrola sterility práce. Růst buněk se sledoval při kultivační teplotě +3 C po dobu pěti dnů (12 hodin). Měření zákalu při vlnové délce 6 nm probíhalo každých 2 minut. Vzorky byly protřepávány každých 1 minut po dobu 2 sekund. Po ukončení měření se získaná data exportovala do MS Excel Stanovení růstových konstant Z naměřených hodnot optické denzity během exponenciální fáze růstových křivek ze tří nezávislých experimentů byly vypočteny růstové konstanty jednotlivých kmenů L. brevis pro dané koncentrace Tetra a M-Tetra. Průměrná rychlost dělení.r = 1/log2 (logx 2 -logx 1 )/t 2 -t 1 Průměrná generační doba G = 1/R Specifická růstová rychlost..µ =,693/G X 2 -konečná hodnota OD 6 v čase t 2 X 1 -počáteční hodnota OD 6 v čase t 1 3
31 4.4. Vliv ph na antibakteriální aktivitu Tetra Vliv ph kultivačního média na antibakteriální aktivitu chmelových látek byl u vybraných kmenů L. brevis sledován pomocí přístroje Bioscreen C. Řady deseti koncentrací Tetra byly připraveny ředěním zásobního roztoku Tetra v MRS-bujónu s ph 4,; 5, a 6,. Měření optické denzity při vlnové délce 6 nm probíhalo při teplotě +3 C ve 2-ti minutových intervalech. Vzorky byly protřepávány každých deset minut po dobu 2 sekund. Po 12 hodinách bylo měření ukončeno a data exportována do MS Excel Růst vybraných kmenů L. brevis v mmrs-bujónu v přítomnosti Tetra Simpson a Smith ve své práci (1992) sledovali vliv trans-izohumulonu na buňky Lactobacillus brevis IFO 396 v modifikovaném MRS-bujónu bez Tween 8 (mmrs). Autoři uvádí, že Tween 8 neutralizuje účinky Hop na bakterie. Pravděpodobným mechanizmem je snížení koncentrace volných nedisociovaných molekul Hop způsobené jejich vychytáním micelami Tween 8. Růst vybraných kmenů L. brevis v přítomnosti Tetra v mmrs-bujónu (Fluka) byl sledován pomocí přístroje Bioscreen C při teplotě +3 C po dobu 12 hodin. Měření optické denzity při vlnové délce 6 nm probíhalo každých dvacet minut. Vzorky byly protřepávány každých deset minut po dobu 2 s. Buňky byly kultivovány v mmrs-bujónu s různou počáteční hodnotou ph v přítomnosti deseti koncentrací Tetra. 31
32 4.6. Sledování účinků Tetra na buňky L. brevis po aplikaci ph-senzitivní sondy cfda-se Barvení buněk cfda-se Barvení fluoresceinem je založeno na tom, že pouze živé buňky s neporušenou cytoplazmatickou membránou a esterázovou aktivitou jsou schopné akumulovat fluorescenční sondu. Pro zajištění vstupu sondy do bakteriální buňky je vhodné použít nefluorescenční ester cfda-se. Dvě postranní acetátové skupiny v molekule cfda-se umožňují její snadnou penetraci do buňky. V cytoplazmě jsou tyto skupiny odstraněny buněčnými esterázami. Dále se předpokládá, že vzniklý karboxyfluorescein se prostřednictvím sukcinimidylových skupin váže k volným NH 2 skupinám v molekulách intracelulárních proteinů. Buňky se tedy musí barvit v prostředí bez aminů, aby nedocházelo k reakcím fluoroforů s aminokyselinami v médiu (falešně pozitivní výsledek). Po inkubaci buněk v přítomnosti cfda-se a glukózy se buňky promyjí, aby došlo k odstranění sondy, která zůstala vázána na povrchu buněk a v médiu. Inkubací obarvených a promytých buněk v přítomnosti 1 mm glukózy a jejich následným promytím se zajistí vyloučení nenavázané sondy z buněk. Pro barvení se použila vždy 24-hodinová kultura L. brevis, kultivovaná v MRS-bujónu při 3 C. Postup barvení buněk: centrifugace (1 ot./1 min/4 C) 2x promytí buněk ve fosfátovém pufru (ph 6,64) naředění buněk ve fosfátovém pufru (ph 6,64) na hodnotu do OD 62 =,6 přidání cfda-se (1 mm) do konečné koncentrace 1 µm a glukózy do konečné koncentrace 1 mm inkubace v termostatu při 37 C po dobu 3 minut centrifugace a promytí buněk ve fosfátovém pufru (ph 6,64) naředění buněk ve fosfátovém pufru (ph 6,64) přidání glukózy do konečné koncentrace 1 mm 32
33 inkubace v termostatu při 3 C po dobu 3 minut promytí (2x) a naředění buněk ve fosfátovém pufru (ph 6,64) přidání glukózy do konečné koncentrace 1 mm inkubace v termostatu při 3 C po dobu 3 minut Obarvené buňky je nutné do doby analýzy udržovat v ledové lázni a temnu Příprava preparátu Jako adhezivní činidlo pro imobilizaci buněk se použil,1 % (w/v) vodný roztok poly- L-lyzinu. Před přípravou preparátu bylo nutné mikroskopické komůrky (Lab-Tek II., Nunc) vyčistit 7 % etanolem, opláchnout destilovanou vodou a dobře vysušit. Do středu komůrky bylo napipetováno 5 µl poly-l-lyzinu. Takto vytvořená kapka se nechala zaschnout v termostatu při 37 C po dobu 3 minut. Na povrch zpolymerovaného lyzinu se napipetovalo 4 µl suspenze obarvených buněk. Po deseti minutách potřebných k adhezi buněk do struktury poly-l-lyzinu byla odpipetována přebytečná buněčná suspenze. Na kapku polymeru s adherovanými buňkami se přidalo 4 µl fosfátového pufru (ph 6,64) s 1 mm glukózou. Takto připravený preparát byl ihned použit pro mikroskopii Fluorescenční mikroskopie Vliv Tetra na buňky L. brevis obarvené cfda-se byl sledován pomocí fluorescenčního mikroskopu Carl Zeiss Axiovert 1S s excitačním filtrem 48-5 nm a emisním filtrem nm. Po náhodném výběru buněk v preparátu byla upravena doba expozice a stupeň zesílení signálu na kameře podle intenzity fluorescence obarvených buněk. Po získání snímku v čase nula byla k buňkám napipetována Tetra do konečné koncentrace 5 µg/ml a další snímky byly získávány v časových intervalech 2 minut. Zaostřování preparátu bylo prováděno manuálně. Po padesáti minutách byla mikroskopie ukončena a uložené snímky byly dále zpracovávány pomocí softwaru Fish
34 4.7. Spektrofluorimetrie Barvení buněk cfda-se Postup barvení viz. kapitola Buňky byly promývány, barveny a analyzovány v pufru HEPES Spektrofluorimetrie Při spektrofluorimetrických analýzách je měřena celková intenzita fluorescence suspenze obarvených buněk v kyvetě. Vzorek byl připravil napipetováním 2 ml 5 mm pufru HEPES s 1 mm glukózou a 1 µl suspenze obarvených buněk L. brevis do vyčištěné křemíkové kyvety. Výsledná hustota buněčné suspenze je přibližně 1 6. Excitace fluorescence obarvených buněk byla prováděna rychlým přepínáním monochromátoru mezi excitačními vlnovými délkami 49 a 435 nm, s šířkami pásů 5 nm. Emise při vlnové délce 525 nm, s šířkou pásu 2 nm, byla zaznamenávána pomocí spektrofluorimetru Perkin-Elmer LS 5B. Po dosažení stabilní intenzity fluorescence bylo k suspenzi buněk přidáváno 7 µl zásobního roztoku Tetra (7,5 mg/ml) v časových intervalech 5, 1, 15, 2 a 25 minut. Po třiceti minutách bylo měření ukončeno. Výpočet koncentračně-nezávislého poměru mezi ph-senzitivním a ph-nesenzitivním signálem (R 49/435 ) byl proveden podílem intenzity fluorescence při excitaci 49 nm a 435 nm pomocí softwaru FL WINLAB Version 4..2, Perkin-Elmer metodou Ratio Data Collection. Získaná data byla převedena do MS Excel. 34
35 4.8. Růst vybraných kmenů L. brevis v přítomnosti M-Tetra Podle studií Simpsona (1993a, 1993b) hořké chmelové látky v nedisociované formě inhibují růst grampozitivních bakterií (obr. 5). Pro potvrzení či vyloučení tohoto mechanizmu působení Hop byl nejkyselejší vodík v molekule Tetra s použitím diazometanu deprotonován a nahrazen metylovou skupinou (obr. 9B). A B Obr. 9. Struktura molekul derivátů hořkých chmelových látek: A. tetrahydroizo-α-kyselina (Tetra); B. 3-metoxy-tetrahydroizo-α-kyselina (M-Tetra) Růst buněk L. brevis v přítomnosti M-Tetra byl sledován pomocí přístroje Bioscreen C. Rozmezí deseti koncentrací M-Tetra bylo zvoleno na základě výsledků stanovení MIC a sledování růstu v přítomnosti Tetra. Jako kontrola pro každý kmen sloužilo stejné rozmezí koncentrací Tetra. Měření optické denzity při 6 nm ve 2-ti minutových intervalech probíhalo při teplotě +3 C. Vzorky byly protřepávány každých deset minut po dobu 2 sekund. Po 12 hodinách bylo měření ukončeno a výsledky exportovány do MS Excel. 35
36 4.9. Růst vybraných kmenů L. brevis v přítomnosti acetylacetonu Fernandez a Simpson (1993) ve své studii zvažují možnost, že pro antibakteriální aktivitu Hop může být esenciální β-triketonová skupina v molekule Hop. Molekula acetylacetonu obsahuje dvě ketonové skupiny ve stejné vzájemné poloze jako v molekule Tetra (obr. 1). Růst buněk vybraných kmenů L. brevis byl sledován v přítomnosti deseti koncentrací acetylacetonu. Koncentrace acetylacetonu byly zvoleny na základě výsledků sledování růstu buněk v přítomnosti Tetra tak, aby počet molekul acetylacetonu odpovídal počtu molekul Tetra při různých koncentracích Tetra. Obr. 1. A. Struktura molekuly Tetra; B. Acetylaceton Pro stanovení vlivu acetylacetonu narůst buněk kmenů L. brevis se postupovalo stejně, jako je dokumentováno v kapitole
Lactobacillus brevis kazit pivo
 Genetický základ schopnosti Lactobacillus brevis kazit pivo Mgr. Dagmar Matoulková, Mikrobiologie VÚPS Ing. Karel Sigler, DrSc., Mikrobiologický ústav AVČR 23. pivovarskosladařské dny, České Budějovice,
Genetický základ schopnosti Lactobacillus brevis kazit pivo Mgr. Dagmar Matoulková, Mikrobiologie VÚPS Ing. Karel Sigler, DrSc., Mikrobiologický ústav AVČR 23. pivovarskosladařské dny, České Budějovice,
Fermentace. Na fermentaci je založena řada potravinářských výrob. výroba kysaného zelí lihovarnictvní pivovarnictví. mlékárenství.
 Fermentace Rozklad organických látek ( hlavně cukrů) za účasti mikrobiálních enzymů za vzniku metabolických produktů, které člověk cíleně využívá ke svému prospěchu - výroba, konzervace potravin. Fermentace
Fermentace Rozklad organických látek ( hlavně cukrů) za účasti mikrobiálních enzymů za vzniku metabolických produktů, které člověk cíleně využívá ke svému prospěchu - výroba, konzervace potravin. Fermentace
Průmyslová mikrobiologie a genové inženýrství
 Průmyslová mikrobiologie a genové inženýrství Nepatogenní! mikroorganismus (virus, bakterie, kvasinka, plíseň) -kapacita produkovat žádaný produkt -relativně stabilní růstové charakteristiky Médium -substrát
Průmyslová mikrobiologie a genové inženýrství Nepatogenní! mikroorganismus (virus, bakterie, kvasinka, plíseň) -kapacita produkovat žádaný produkt -relativně stabilní růstové charakteristiky Médium -substrát
14. Biotechnologie. 14.4 Výroba kvasné kyseliny octové. 14.6 Výroba kyseliny citronové. 14.2 Výroba kvasného etanolu. 14.1 Výroba sladu a piva
 14. Biotechnologie 14.1 Výroba sladu a piva 14.2 Výroba kvasného etanolu 14.3 Výroba droždí 14.4 Výroba kvasné kyseliny octové 14.5 Výroba kyseliny mléčné 14.6 Výroba kyseliny citronové 14.7 Výroba antibiotik
14. Biotechnologie 14.1 Výroba sladu a piva 14.2 Výroba kvasného etanolu 14.3 Výroba droždí 14.4 Výroba kvasné kyseliny octové 14.5 Výroba kyseliny mléčné 14.6 Výroba kyseliny citronové 14.7 Výroba antibiotik
Energetický metabolizmus buňky
 Energetický metabolizmus buňky Buňky vyžadují neustálý přísun energie pro tvorbu a udržování biologického pořádku (život). Tato energie pochází z energie chemických vazeb v molekulách potravy (energie
Energetický metabolizmus buňky Buňky vyžadují neustálý přísun energie pro tvorbu a udržování biologického pořádku (život). Tato energie pochází z energie chemických vazeb v molekulách potravy (energie
5. Příjem, asimilace a fyziologické dopady anorganického dusíku. 5. Příjem, asimilace a fyziologické dopady anorganického dusíku
 5. Příjem, asimilace a fyziologické dopady anorganického dusíku Zdroje dusíku dostupné v půdě: Amonné ionty + Dusičnany = největší zdroj dusíku v půdě Organický dusík (aminokyseliny, aminy, ureidy) zpracování
5. Příjem, asimilace a fyziologické dopady anorganického dusíku Zdroje dusíku dostupné v půdě: Amonné ionty + Dusičnany = největší zdroj dusíku v půdě Organický dusík (aminokyseliny, aminy, ureidy) zpracování
Oxidace proteinů, tuků a cukrů jako zdroj energie v živých organismech
 Citrátový cyklus Oxidace proteinů, tuků a cukrů jako zdroj energie v živých organismech 1. stupeň: OXIDACE cukrů, tuků a některých aminokyselin tvorba Acetyl-CoA a akumulace elektronů v NADH a FADH 2 2.
Citrátový cyklus Oxidace proteinů, tuků a cukrů jako zdroj energie v živých organismech 1. stupeň: OXIDACE cukrů, tuků a některých aminokyselin tvorba Acetyl-CoA a akumulace elektronů v NADH a FADH 2 2.
LNÍ VLASTNOSTI ENÍ ANTIMIKROBIÁLN ČESKÁ REPUBLIKA. CHUMCHALOVÁ J. a PLOCKOVÁ M. Ústav technologie mléka a tuků
 ANTIMIKROBIÁLN LNÍ VLASTNOSTI BAKTERIÍ MLÉČNÉHO KVAŠEN ENÍ CHUMCHALOVÁ J. a PLOCKOVÁ M. Ústav technologie mléka a tuků ČESKÁ REPUBLIKA OBSAH Charakterizace bakterie mléčného kvašení (BMK) Organické kyseliny
ANTIMIKROBIÁLN LNÍ VLASTNOSTI BAKTERIÍ MLÉČNÉHO KVAŠEN ENÍ CHUMCHALOVÁ J. a PLOCKOVÁ M. Ústav technologie mléka a tuků ČESKÁ REPUBLIKA OBSAH Charakterizace bakterie mléčného kvašení (BMK) Organické kyseliny
Zkušební okruhy k přijímací zkoušce do magisterského studijního oboru:
 Biotechnologie interakce, polarita molekul. Hydrofilní, hydrofobní a amfifilní molekuly. Stavba a struktura prokaryotní a eukaryotní buňky. Viry a reprodukce virů. Biologické membrány. Mikrobiologie -
Biotechnologie interakce, polarita molekul. Hydrofilní, hydrofobní a amfifilní molekuly. Stavba a struktura prokaryotní a eukaryotní buňky. Viry a reprodukce virů. Biologické membrány. Mikrobiologie -
MTI Cvičení č. 2 Pasážování buněk / Jana Horáková
 MTI Cvičení č. 2 Pasážování buněk 15.11./16.11.2016 Jana Horáková Doporučená literatura M. Vejražka: Buněčné kultury http://bioprojekty.lf1.cuni.cz/3381/sylabyprednasek/textova-verze-prednasek/bunecnekultury-vejrazka.pdf
MTI Cvičení č. 2 Pasážování buněk 15.11./16.11.2016 Jana Horáková Doporučená literatura M. Vejražka: Buněčné kultury http://bioprojekty.lf1.cuni.cz/3381/sylabyprednasek/textova-verze-prednasek/bunecnekultury-vejrazka.pdf
Metabolismus, taxonomie a identifikace bakterií. Karel Holada khola@lf1.cuni.cz
 Metabolismus, taxonomie a identifikace bakterií Karel Holada khola@lf1.cuni.cz Klíčová slova Obligátní aeroby Obligátní anaeroby Aerotolerantní b. Fakultativní anaeroby Mikroaerofilní b. Kapnofilní bakterie
Metabolismus, taxonomie a identifikace bakterií Karel Holada khola@lf1.cuni.cz Klíčová slova Obligátní aeroby Obligátní anaeroby Aerotolerantní b. Fakultativní anaeroby Mikroaerofilní b. Kapnofilní bakterie
METABOLISMUS SACHARIDŮ
 METABOLISMUS SACHARIDŮ PRINCIP Rozštěpené sacharidy vstřebávání střevní sliznicí do krevního oběhu dopraveny vrátnicovou žílou do jater. V játrech enzymaticky hexózy štěpeny na GLUKÓZU vyplavována do krve
METABOLISMUS SACHARIDŮ PRINCIP Rozštěpené sacharidy vstřebávání střevní sliznicí do krevního oběhu dopraveny vrátnicovou žílou do jater. V játrech enzymaticky hexózy štěpeny na GLUKÓZU vyplavována do krve
Biochemie dusíkatých látek při výrobě vína
 Biochemie dusíkatých látek při výrobě vína Ing. Michal Kumšta www.zf.mendelu.cz Ústav vinohradnictví a vinařství kumsta@mendelu.cz Vzdělávací aktivita je součástí projektu CZ.1.07/2.4.00/31.0089 Projekt
Biochemie dusíkatých látek při výrobě vína Ing. Michal Kumšta www.zf.mendelu.cz Ústav vinohradnictví a vinařství kumsta@mendelu.cz Vzdělávací aktivita je součástí projektu CZ.1.07/2.4.00/31.0089 Projekt
Výskyt a typizace mléčných bakterií v baleném mase
 Výskyt a typizace mléčných bakterií v baleném mase 1 Štegnerová, H., 2 Nápravníková, E., 2 Steinhauserová, I., 1 Švec, P. 1 MU PřF, Česká sbírka mikroorganismů (CCM) 2 VFU, FVHE, Ústav hygieny a technologie
Výskyt a typizace mléčných bakterií v baleném mase 1 Štegnerová, H., 2 Nápravníková, E., 2 Steinhauserová, I., 1 Švec, P. 1 MU PřF, Česká sbírka mikroorganismů (CCM) 2 VFU, FVHE, Ústav hygieny a technologie
Izolace nukleových kyselin
 Izolace nukleových kyselin Požadavky na izolaci nukleových kyselin V nativním stavu z přirozeného materiálu v dostatečném množství požadované čistotě. Nukleové kyseliny je třeba zbavit všech látek, které
Izolace nukleových kyselin Požadavky na izolaci nukleových kyselin V nativním stavu z přirozeného materiálu v dostatečném množství požadované čistotě. Nukleové kyseliny je třeba zbavit všech látek, které
CHEMIE. Pracovní list č. 12 žákovská verze Téma: Závislost rychlosti kvašení na teplotě. Mgr. Lenka Horutová
 www.projektsako.cz CHEMIE Pracovní list č. 12 žákovská verze Téma: Závislost rychlosti kvašení na teplotě Lektor: Mgr. Lenka Horutová Projekt: Student a konkurenceschopnost Reg. číslo: CZ.1.07/1.1.07/03.0075
www.projektsako.cz CHEMIE Pracovní list č. 12 žákovská verze Téma: Závislost rychlosti kvašení na teplotě Lektor: Mgr. Lenka Horutová Projekt: Student a konkurenceschopnost Reg. číslo: CZ.1.07/1.1.07/03.0075
Mnohobuněčné kvasinky
 Laboratoř buněčné biologie PROJEKT Mnohobuněčné kvasinky Libuše Váchová ve spolupráci s laboratoří Prof. Palkové (PřFUK) Do laboratoře přijímáme studenty se zájmem o vědeckou práci Kontakt: vachova@biomed.cas.cz
Laboratoř buněčné biologie PROJEKT Mnohobuněčné kvasinky Libuše Váchová ve spolupráci s laboratoří Prof. Palkové (PřFUK) Do laboratoře přijímáme studenty se zájmem o vědeckou práci Kontakt: vachova@biomed.cas.cz
DÝCHÁNÍ. uložená v nich fotosyntézou, je z nich uvolňována) Rostliny tedy mohou po určitou dobu žít bez fotosyntézy
 Dýchání 2/38 DÝCHÁNÍ Asimiláty vzniklé v rostlinných buňkách fotosyntézou mají různé funkce: stavební, zásobní, enzymatické aj. Zásobní látky jsou v případě potřeby využívány (energie, uložená v nich fotosyntézou,
Dýchání 2/38 DÝCHÁNÍ Asimiláty vzniklé v rostlinných buňkách fotosyntézou mají různé funkce: stavební, zásobní, enzymatické aj. Zásobní látky jsou v případě potřeby využívány (energie, uložená v nich fotosyntézou,
Diagnostické metody v lékařské mikrobiologii
 Diagnostické metody v lékařské mikrobiologii Výuková prezentace z: Lékařské mikrobiologie Jan Smíšek ÚLM 3. LF UK 2009 Princip identifikace Soubor znaků s rozdílnou diskriminační hodnotou Základní problémy
Diagnostické metody v lékařské mikrobiologii Výuková prezentace z: Lékařské mikrobiologie Jan Smíšek ÚLM 3. LF UK 2009 Princip identifikace Soubor znaků s rozdílnou diskriminační hodnotou Základní problémy
5. Bioreaktory. Schematicky jsou jednotlivé typy bioreaktorů znázorněny na obr. 5.1. Nejpoužívanějšími bioreaktory jsou míchací tanky.
 5. Bioreaktory Bioreaktor (fermentor) je nejdůležitější částí výrobní linky biotechnologického procesu. Jde o nádobu různého objemu, ve které probíhá biologický proces. Dochází zde k růstu buněk a tvorbě
5. Bioreaktory Bioreaktor (fermentor) je nejdůležitější částí výrobní linky biotechnologického procesu. Jde o nádobu různého objemu, ve které probíhá biologický proces. Dochází zde k růstu buněk a tvorbě
Nové metody v průtokové cytometrii. Vlas T., Holubová M., Lysák D., Panzner P.
 Nové metody v průtokové cytometrii Vlas T., Holubová M., Lysák D., Panzner P. Průtoková cytometrie Analytická metoda využívající interakce částic a záření. Technika se vyvinula z počítačů částic Počítače
Nové metody v průtokové cytometrii Vlas T., Holubová M., Lysák D., Panzner P. Průtoková cytometrie Analytická metoda využívající interakce částic a záření. Technika se vyvinula z počítačů částic Počítače
Chemie 2018 CAUS strana 1 (celkem 5)
 Chemie 2018 CAUS strana 1 (celkem 5) 1. Vápník má atomové číslo 20, hmotnostní 40. Kolik elektronů obsahuje kationt Ca 2+? a) 18 b) 20 c) 40 d) 60 2. Kolik elektronů ve valenční sféře má atom Al? a) 1
Chemie 2018 CAUS strana 1 (celkem 5) 1. Vápník má atomové číslo 20, hmotnostní 40. Kolik elektronů obsahuje kationt Ca 2+? a) 18 b) 20 c) 40 d) 60 2. Kolik elektronů ve valenční sféře má atom Al? a) 1
Otázka: Metabolismus. Předmět: Biologie. Přidal(a): Furrow. - přeměna látek a energie
 Otázka: Metabolismus Předmět: Biologie Přidal(a): Furrow - přeměna látek a energie Dělení podle typu reakcí: 1.) Katabolismus reakce, při nichž z látek složitějších vznikají látky jednodušší (uvolňuje
Otázka: Metabolismus Předmět: Biologie Přidal(a): Furrow - přeměna látek a energie Dělení podle typu reakcí: 1.) Katabolismus reakce, při nichž z látek složitějších vznikají látky jednodušší (uvolňuje
METABOLISMUS SACHARIDŮ
 METABOLISMUS SAHARIDŮ A. Odbourávání sacharidů - nejdůležitější zdroj energie pro heterotrofy - oxidací sacharidů až na. získávají aerobní organismy energii ve formě. - úplná oxidace glukosy: složitý proces
METABOLISMUS SAHARIDŮ A. Odbourávání sacharidů - nejdůležitější zdroj energie pro heterotrofy - oxidací sacharidů až na. získávají aerobní organismy energii ve formě. - úplná oxidace glukosy: složitý proces
pátek, 24. července 15 BUŇKA
 BUŇKA ŽIVOČIŠNÁ BUŇKA mitochondrie ribozom hrubé endoplazmatické retikulum cytoplazma plazmatická membrána mikrotubule lyzozom hladké endoplazmatické retikulum Golgiho aparát jádro jadérko chromatin volné
BUŇKA ŽIVOČIŠNÁ BUŇKA mitochondrie ribozom hrubé endoplazmatické retikulum cytoplazma plazmatická membrána mikrotubule lyzozom hladké endoplazmatické retikulum Golgiho aparát jádro jadérko chromatin volné
Mendělejevova tabulka prvků
 Mendělejevova tabulka prvků V sušině rostlin je obsaženo přibližně 45% uhlíku, 42% kyslíku, 6,5% vodíku, 1,5% dusíku a 5% minerálních prvků. Tzv. organogenní prvky (C, O, H, N) představují tedy 95% veškerých
Mendělejevova tabulka prvků V sušině rostlin je obsaženo přibližně 45% uhlíku, 42% kyslíku, 6,5% vodíku, 1,5% dusíku a 5% minerálních prvků. Tzv. organogenní prvky (C, O, H, N) představují tedy 95% veškerých
Aminokyseliny, peptidy a bílkoviny
 Aminokyseliny, peptidy a bílkoviny Dělení aminokyselin Z hlediska obsahu v živé hmotě Z hlediska významu ve výživě Z chemického hlediska Z hlediska rozpustnosti Dělení aminokyselin Z hlediska obsahu v
Aminokyseliny, peptidy a bílkoviny Dělení aminokyselin Z hlediska obsahu v živé hmotě Z hlediska významu ve výživě Z chemického hlediska Z hlediska rozpustnosti Dělení aminokyselin Z hlediska obsahu v
Enterotoxiny Staphylococcus aureus. Jana Kotschwarová Andrea Koťová
 Enterotoxiny Staphylococcus aureus Jana Kotschwarová Andrea Koťová Obsah Charakteristika Staphylococcus aureus Vlastnosti Faktory virulence Enterotoxiny Patogeneze Výskyt Metody stanovení Prevence výskytu
Enterotoxiny Staphylococcus aureus Jana Kotschwarová Andrea Koťová Obsah Charakteristika Staphylococcus aureus Vlastnosti Faktory virulence Enterotoxiny Patogeneze Výskyt Metody stanovení Prevence výskytu
Jana Fauknerová Matějčková
 Jana Fauknerová Matějčková převody jednotek výpočet ph ph vodných roztoků ph silných kyselin a zásad ph slabých kyselin a zásad, disociační konstanta, pk ph pufrů koncentace 1000mg př. g/dl mg/l = = *10000
Jana Fauknerová Matějčková převody jednotek výpočet ph ph vodných roztoků ph silných kyselin a zásad ph slabých kyselin a zásad, disociační konstanta, pk ph pufrů koncentace 1000mg př. g/dl mg/l = = *10000
Inovace profesní přípravy budoucích učitelů chemie
 Inovace profesní přípravy budoucích učitelů chemie I n v e s t i c e d o r o z v o j e v z d ě l á v á n í CZ.1.07/2.2.00/15.0324 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem
Inovace profesní přípravy budoucích učitelů chemie I n v e s t i c e d o r o z v o j e v z d ě l á v á n í CZ.1.07/2.2.00/15.0324 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem
Metoda Live/Dead aneb využití fluorescenční mikroskopie v bioaugmentační praxi. Juraj Grígel Inovativní sanační technologie ve výzkumu a praxi
 Metoda Live/Dead aneb využití fluorescenční mikroskopie v bioaugmentační praxi Juraj Grígel Inovativní sanační technologie ve výzkumu a praxi Co je to vlastně ta fluorescence? Některé látky (fluorofory)
Metoda Live/Dead aneb využití fluorescenční mikroskopie v bioaugmentační praxi Juraj Grígel Inovativní sanační technologie ve výzkumu a praxi Co je to vlastně ta fluorescence? Některé látky (fluorofory)
METABOLISMUS SLOUČENINY S MAKROERGNÍMI VAZBAMI
 METABOLISMUS SLOUČENINY S MAKROERGNÍMI VAZBAMI Obsah Formy organismů Energetika reakcí Metabolické reakce Makroergické sloučeniny Formy organismů Autotrofní x heterotrofní organismy Práce a energie Energie
METABOLISMUS SLOUČENINY S MAKROERGNÍMI VAZBAMI Obsah Formy organismů Energetika reakcí Metabolické reakce Makroergické sloučeniny Formy organismů Autotrofní x heterotrofní organismy Práce a energie Energie
Vliv teploty. Mezofilní mik. Termoofilní mik. Psychrofilní mik. 0 C 10 C 20 C 30 C 40 C 50 C 60 C 70 C teplota
 Vliv teploty Jeden z hlavních faktorů ovlivňující téměř všechny životní pochody mik. Každý mik. žije v určitém teplotním rozmezí je dáno: Minimální teplotou nejnižší teplota, při které mik. roste a množí
Vliv teploty Jeden z hlavních faktorů ovlivňující téměř všechny životní pochody mik. Každý mik. žije v určitém teplotním rozmezí je dáno: Minimální teplotou nejnižší teplota, při které mik. roste a množí
Struktura proteinů. - testík na procvičení. Vladimíra Kvasnicová
 Struktura proteinů - testík na procvičení Vladimíra Kvasnicová Mezi proteinogenní aminokyseliny patří a) kyselina asparagová b) kyselina glutarová c) kyselina acetoctová d) kyselina glutamová Mezi proteinogenní
Struktura proteinů - testík na procvičení Vladimíra Kvasnicová Mezi proteinogenní aminokyseliny patří a) kyselina asparagová b) kyselina glutarová c) kyselina acetoctová d) kyselina glutamová Mezi proteinogenní
Výskyt bakterií Pectinatus v prostředí pivovaru
 Výskyt bakterií Pectinatus v prostředí pivovaru Dagmar Matoulková, Karel Kosař Výzkumný ústav pivovarský a sladařský, a.s. 24. Pivovarsko-sladařské dny Brno, 8.-9.9.2011 2 Obsah prezentace 1) Rod Pectinatus
Výskyt bakterií Pectinatus v prostředí pivovaru Dagmar Matoulková, Karel Kosař Výzkumný ústav pivovarský a sladařský, a.s. 24. Pivovarsko-sladařské dny Brno, 8.-9.9.2011 2 Obsah prezentace 1) Rod Pectinatus
Minerální výživa na extrémních půdách. Půdy silně kyselé, alkalické, zasolené a s vysokou koncentrací těžkých kovů
 Minerální výživa na extrémních půdách Půdy silně kyselé, alkalické, zasolené a s vysokou koncentrací těžkých kovů Procesy vedoucí k acidifikaci půd Zvětrávání hornin s následným vymýváním kationtů (draslík,
Minerální výživa na extrémních půdách Půdy silně kyselé, alkalické, zasolené a s vysokou koncentrací těžkých kovů Procesy vedoucí k acidifikaci půd Zvětrávání hornin s následným vymýváním kationtů (draslík,
DYNAMIKA BAKTERIÁLNÍHO RŮSTU
 Úvod DYNAMIKA BAKTERIÁLNÍHO RŮSTU Bakterie mohou přežívat za velice rozdílných podmínek prostředí Jednotlivé druhy však rostou za limitovaných podmínek prostředí Bakteriální kolonie V přírodě existují
Úvod DYNAMIKA BAKTERIÁLNÍHO RŮSTU Bakterie mohou přežívat za velice rozdílných podmínek prostředí Jednotlivé druhy však rostou za limitovaných podmínek prostředí Bakteriální kolonie V přírodě existují
ing. Vladimír Dráb Výzkumný ústav mlékárenský Praha, Sbírka mlékárenských mikroorganismů Laktoflora, CCDM, ČR
 ing. Vladimír Dráb Výzkumný ústav mlékárenský Praha, Sbírka mlékárenských mikroorganismů Laktoflora, CCDM, ČR Sýry patřído skupiny fermentovaných potravin stejnějako pivo, víno, chléb, kysanézelí, rybíomáčka
ing. Vladimír Dráb Výzkumný ústav mlékárenský Praha, Sbírka mlékárenských mikroorganismů Laktoflora, CCDM, ČR Sýry patřído skupiny fermentovaných potravin stejnějako pivo, víno, chléb, kysanézelí, rybíomáčka
Zkouška inhibice růstu řas
 Zkouška inhibice růstu řas VYPRACOVALI: TEREZA DVOŘÁKOVÁ JINDŘICH ŠMÍD Porovnáváme : Zkouška inhibice růstu sladkovodních řas Scenedesmus subspicatus a Senastrum capricornutum : sekce C.3. Zkouška inhibice
Zkouška inhibice růstu řas VYPRACOVALI: TEREZA DVOŘÁKOVÁ JINDŘICH ŠMÍD Porovnáváme : Zkouška inhibice růstu sladkovodních řas Scenedesmus subspicatus a Senastrum capricornutum : sekce C.3. Zkouška inhibice
Nutriční aspekty konzumace mléčných výrobků
 Nutriční aspekty konzumace mléčných výrobků Prof. MVDr. Lenka VORLOVÁ, Ph.D. a kolektiv FVHE VFU Brno Zlín, 2012 Mléčné výrobky mají excelentní postavení mezi výrobky živočišného původu - vyšší biologická
Nutriční aspekty konzumace mléčných výrobků Prof. MVDr. Lenka VORLOVÁ, Ph.D. a kolektiv FVHE VFU Brno Zlín, 2012 Mléčné výrobky mají excelentní postavení mezi výrobky živočišného původu - vyšší biologická
Chemické výpočty II. Vladimíra Kvasnicová
 Chemické výpočty II Vladimíra Kvasnicová Převod jednotek pmol/l nmol/l µmol/l mmol/l mol/l 10-12 10-9 10-6 10-3 mol/l µg mg g 10-6 10-3 g µl ml dl L 10-6 10-3 10-1 L Cvičení 12) cholesterol (MW=386,7g/mol):
Chemické výpočty II Vladimíra Kvasnicová Převod jednotek pmol/l nmol/l µmol/l mmol/l mol/l 10-12 10-9 10-6 10-3 mol/l µg mg g 10-6 10-3 g µl ml dl L 10-6 10-3 10-1 L Cvičení 12) cholesterol (MW=386,7g/mol):
NOVÉ TRENDY V MIKROBIOLOGII SÝRŮ
 NOVÉ TRENDY V MIKROBIOLOGII SÝRŮ Milada Plocková, Petra Žáčková Ústav technologie mléka a tuků, VŠCHT Praha, Technická 5, 166 28 Praha 6, Česká republika Cíl: Zlepšení produkce a jakosti sýrů ovlivněním:
NOVÉ TRENDY V MIKROBIOLOGII SÝRŮ Milada Plocková, Petra Žáčková Ústav technologie mléka a tuků, VŠCHT Praha, Technická 5, 166 28 Praha 6, Česká republika Cíl: Zlepšení produkce a jakosti sýrů ovlivněním:
Ukázky: CCM katalog Anaerostat + generátor anaerobní atmosféry Plastové kličky Termostat se třepačkou. Očkovánía kultivace
 Ukázky: CCM katalog Anaerostat + generátor anaerobní atmosféry Plastové kličky Termostat se třepačkou Očkovánía kultivace Bakteriálnídruh = jasněvymezenáskupina navzájem příbuzných kmenů, zahrnujících
Ukázky: CCM katalog Anaerostat + generátor anaerobní atmosféry Plastové kličky Termostat se třepačkou Očkovánía kultivace Bakteriálnídruh = jasněvymezenáskupina navzájem příbuzných kmenů, zahrnujících
16a. Makroergické sloučeniny
 16a. Makroergické sloučeniny Makroergickými sloučeninami v biochemii nazýváme skupinu látek umožňujících uvolnění značného množství energie v jednoduché reakci. Nelze je definovat prostě jako sloučeniny
16a. Makroergické sloučeniny Makroergickými sloučeninami v biochemii nazýváme skupinu látek umožňujících uvolnění značného množství energie v jednoduché reakci. Nelze je definovat prostě jako sloučeniny
Druhy a složení potravin
 Druhy a složení potravin Přednáška 9+10 Doc. MVDr. Bohuslava Tremlová, Ph.D. Magisterský studijní program Veterinární hygiena a ekologie Obsah přednášky: Změny potravin při skladování Trvanlivost potravin,
Druhy a složení potravin Přednáška 9+10 Doc. MVDr. Bohuslava Tremlová, Ph.D. Magisterský studijní program Veterinární hygiena a ekologie Obsah přednášky: Změny potravin při skladování Trvanlivost potravin,
Metabolismus bílkovin. Václav Pelouch
 ZÁKLADY OBECNÉ A KLINICKÉ BIOCHEMIE 2004 Metabolismus bílkovin Václav Pelouch kapitola ve skriptech - 3.2 Výživa Vyvážená strava člověka musí obsahovat: cukry (50 55 %) tuky (30 %) bílkoviny (15 20 %)
ZÁKLADY OBECNÉ A KLINICKÉ BIOCHEMIE 2004 Metabolismus bílkovin Václav Pelouch kapitola ve skriptech - 3.2 Výživa Vyvážená strava člověka musí obsahovat: cukry (50 55 %) tuky (30 %) bílkoviny (15 20 %)
Sylabus pro předmět Biochemie pro jakost
 Sylabus pro předmět Biochemie pro jakost Kód předmětu: BCHJ Název v jazyce výuky: Biochemie pro Jakost Název česky: Biochemie pro Jakost Název anglicky: Biochemistry Počet přidělených ECTS kreditů: 6 Forma
Sylabus pro předmět Biochemie pro jakost Kód předmětu: BCHJ Název v jazyce výuky: Biochemie pro Jakost Název česky: Biochemie pro Jakost Název anglicky: Biochemistry Počet přidělených ECTS kreditů: 6 Forma
Regulace metabolických drah na úrovni buňky
 Regulace metabolických drah na úrovni buňky EB Obsah přednášky Obecné principy regulace metabolických drah na úrovni buňky regulace zajištěná kompartmentací metabolických dějů změna absolutní koncentrace
Regulace metabolických drah na úrovni buňky EB Obsah přednášky Obecné principy regulace metabolických drah na úrovni buňky regulace zajištěná kompartmentací metabolických dějů změna absolutní koncentrace
Biologické odstraňování nutrientů
 Biologické odstraňování nutrientů Martin Pivokonský 8. přednáška, kurz Znečišťování a ochrana vod Ústav pro životní prostředí PřF UK Ústav pro hydrodynamiku AV ČR, v. v. i. Tel.: 221 951 909 E-mail: pivo@ih.cas.cz
Biologické odstraňování nutrientů Martin Pivokonský 8. přednáška, kurz Znečišťování a ochrana vod Ústav pro životní prostředí PřF UK Ústav pro hydrodynamiku AV ČR, v. v. i. Tel.: 221 951 909 E-mail: pivo@ih.cas.cz
FOTOSYNTÉZA. Princip, jednotlivé fáze
 FOTOSYNTÉZA Princip, jednotlivé fáze FOTOSYNTETICKÉ PIGMENTY - chlorofyl a modrozelený - chlorofyl b žlutozelený + karoteny, xantofyly žluté a oranžové zbarvení CHLOROFYL a, b CHLOROFYL a - nejdůležitější
FOTOSYNTÉZA Princip, jednotlivé fáze FOTOSYNTETICKÉ PIGMENTY - chlorofyl a modrozelený - chlorofyl b žlutozelený + karoteny, xantofyly žluté a oranžové zbarvení CHLOROFYL a, b CHLOROFYL a - nejdůležitější
Ukázky z pracovních listů z biochemie pro SŠ A ÚVOD
 Ukázky z pracovních listů z biochemie pro SŠ A ÚVD 1) Doplň chybějící údaje. Jak se značí makroergní vazba? Kolik je v ATP makroergních vazeb? Co je to ADP Kolik je v ADP makroergních vazeb 1) Pojmenuj
Ukázky z pracovních listů z biochemie pro SŠ A ÚVD 1) Doplň chybějící údaje. Jak se značí makroergní vazba? Kolik je v ATP makroergních vazeb? Co je to ADP Kolik je v ADP makroergních vazeb 1) Pojmenuj
IZOLACE, SEPARACE A DETEKCE PROTEINŮ I. Vlasta Němcová, Michael Jelínek, Jan Šrámek
 IZOLACE, SEPARACE A DETEKCE PROTEINŮ I Vlasta Němcová, Michael Jelínek, Jan Šrámek Studium aktinu, mikrofilamentární složky cytoskeletu pomocí dvou metod: detekce přímo v buňkách - fluorescenční barvení
IZOLACE, SEPARACE A DETEKCE PROTEINŮ I Vlasta Němcová, Michael Jelínek, Jan Šrámek Studium aktinu, mikrofilamentární složky cytoskeletu pomocí dvou metod: detekce přímo v buňkách - fluorescenční barvení
Fyziologie buňky. RNDr. Zdeňka Chocholoušková, Ph.D.
 Fyziologie buňky RNDr. Zdeňka Chocholoušková, Ph.D. Přeměna látek v buňce = metabolismus Výměna látek mezi buňkou a prostředím Buňka = otevřený systém probíhá výměna látek i energií s prostředím Některé
Fyziologie buňky RNDr. Zdeňka Chocholoušková, Ph.D. Přeměna látek v buňce = metabolismus Výměna látek mezi buňkou a prostředím Buňka = otevřený systém probíhá výměna látek i energií s prostředím Některé
Eva Benešová. Dýchací řetězec
 Eva Benešová Dýchací řetězec Dýchací řetězec Během oxidace látek vstupujících do různých metabolických cyklů (glykolýza, CC, beta-oxidace MK) vznikají NADH a FADH 2, které následně vstupují do DŘ. V DŘ
Eva Benešová Dýchací řetězec Dýchací řetězec Během oxidace látek vstupujících do různých metabolických cyklů (glykolýza, CC, beta-oxidace MK) vznikají NADH a FADH 2, které následně vstupují do DŘ. V DŘ
3 Acidobazické reakce
 3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
Lékařská chemie a biochemie modelový vstupní test ke zkoušce
 Lékařská chemie a biochemie modelový vstupní test ke zkoušce 1. Máte pufr připravený smísením 150 ml CH3COOH o c = 0,2 mol/l a 100 ml CH3COONa o c = 0,25 mol/l. Jaké bude ph pufru, pokud přidáme 10 ml
Lékařská chemie a biochemie modelový vstupní test ke zkoušce 1. Máte pufr připravený smísením 150 ml CH3COOH o c = 0,2 mol/l a 100 ml CH3COONa o c = 0,25 mol/l. Jaké bude ph pufru, pokud přidáme 10 ml
5. Lipidy a biomembrány
 5. Lipidy a biomembrány Obtížnost A Co je chybného na často slýchaném konstatování: Biologická membrána je tvořena dvojvrstvou fosfolipidů.? Jmenujte alespoň tři skupiny látek, které se podílejí na výstavbě
5. Lipidy a biomembrány Obtížnost A Co je chybného na často slýchaném konstatování: Biologická membrána je tvořena dvojvrstvou fosfolipidů.? Jmenujte alespoň tři skupiny látek, které se podílejí na výstavbě
Projekt realizovaný na SPŠ Nové Město nad Metují
 Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 Přírodovědné předměty Hana Gajdušková 1 Viry
Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 Přírodovědné předměty Hana Gajdušková 1 Viry
Energie fotonů je předávána molekulám chlorofylu A, který se zachyceným fotonem excituje (uvolní se energeticky bohatý elektron).
 Otázka: Fotosyntéza a biologické oxidace Předmět: Biologie Přidal(a): Ivana Černíková FOTOSYNTÉZA = fotosyntetická asimilace: Jediný proces, při němž vzniká v přírodě kyslík K přeměně jednoduchých látek
Otázka: Fotosyntéza a biologické oxidace Předmět: Biologie Přidal(a): Ivana Černíková FOTOSYNTÉZA = fotosyntetická asimilace: Jediný proces, při němž vzniká v přírodě kyslík K přeměně jednoduchých látek
Nukleové kyseliny. Nukleové kyseliny. Genetická informace. Gen a genom. Složení nukleových kyselin. Centrální dogma molekulární biologie
 Centrální dogma molekulární biologie ukleové kyseliny 1865 zákony dědičnosti (Johann Gregor Transkripce D R Translace rotein Mendel) Replikace 1869 objev nukleových kyselin (Miescher) 1944 nukleové kyseliny
Centrální dogma molekulární biologie ukleové kyseliny 1865 zákony dědičnosti (Johann Gregor Transkripce D R Translace rotein Mendel) Replikace 1869 objev nukleových kyselin (Miescher) 1944 nukleové kyseliny
3 Acidobazické reakce
 3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
Určení koncentrace proteinu fluorescenční metodou v mikrotitračních destičkách
 Určení koncentrace proteinu fluorescenční metodou v mikrotitračních destičkách Teorie Stanovení celkových proteinů Celkové množství proteinů lze stanovit pomocí několika metod; například: Hartree-Lowryho
Určení koncentrace proteinu fluorescenční metodou v mikrotitračních destičkách Teorie Stanovení celkových proteinů Celkové množství proteinů lze stanovit pomocí několika metod; například: Hartree-Lowryho
ZŠ ÚnO, Bratří Čapků 1332
 Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Řasový test ekotoxicity na mikrotitračních destičkách
 Řasový test ekotoxicity na mikrotitračních destičkách 1 Účel Řasové testy toxicity slouží k testování možných toxických účinků látek a vzorků na vodní producenty. Zelené řasy patří do skupiny necévnatých
Řasový test ekotoxicity na mikrotitračních destičkách 1 Účel Řasové testy toxicity slouží k testování možných toxických účinků látek a vzorků na vodní producenty. Zelené řasy patří do skupiny necévnatých
První testový úkol aminokyseliny a jejich vlastnosti
 První testový úkol aminokyseliny a jejich vlastnosti Vysvětlete co znamená pojem α-aminokyselina Jaký je rozdíl mezi D a L řadou aminokyselin Kolik je základních stavebních aminokyselin a z čeho jsou odvozeny
První testový úkol aminokyseliny a jejich vlastnosti Vysvětlete co znamená pojem α-aminokyselina Jaký je rozdíl mezi D a L řadou aminokyselin Kolik je základních stavebních aminokyselin a z čeho jsou odvozeny
Pivovarské kvasinky a reakce na stres
 Pivovarské kvasinky a reakce na stres K. Sigler 1, D. Matoulková 2 1 Mikrobiologický ústav AV ČR, v.v.i., Praha 2 Výzkumný ústav pivovarský a sladařský, a.s. Praha Stresy působící na kvasinky během pivovarského
Pivovarské kvasinky a reakce na stres K. Sigler 1, D. Matoulková 2 1 Mikrobiologický ústav AV ČR, v.v.i., Praha 2 Výzkumný ústav pivovarský a sladařský, a.s. Praha Stresy působící na kvasinky během pivovarského
Fluorescence (luminiscence)
 Fluorescence (luminiscence) Patří mezi luminiscenční metody fotoluminiscence. Luminiscence efekt, kdy excitované molekuly či atomy vyzařují světlo při přechodu z excitovaného do základního stavu. Podle
Fluorescence (luminiscence) Patří mezi luminiscenční metody fotoluminiscence. Luminiscence efekt, kdy excitované molekuly či atomy vyzařují světlo při přechodu z excitovaného do základního stavu. Podle
BIOLOGICKÉ ODBOURÁNÍ KYSELIN. Baroň M.
 BIOLOGICKÉ ODBOURÁNÍ KYSELIN Baroň M. Biologické odbourání kyselin, jablečno-mléčná či malolaktická (od malic acid = kyselina jablečná, lactic acid = kyselina mléčná) fermentace je proces, při němž dochází
BIOLOGICKÉ ODBOURÁNÍ KYSELIN Baroň M. Biologické odbourání kyselin, jablečno-mléčná či malolaktická (od malic acid = kyselina jablečná, lactic acid = kyselina mléčná) fermentace je proces, při němž dochází
Kultivační metody stanovení mikroorganismů
 Kultivační metody stanovení mikroorganismů Základní rozdělení půd Syntetická, definovaná media, jednoduché sloučeniny, známé sloţení Komplexní media, vycházejí z ţivočišných nebo rostlinných tkání a pletiv,
Kultivační metody stanovení mikroorganismů Základní rozdělení půd Syntetická, definovaná media, jednoduché sloučeniny, známé sloţení Komplexní media, vycházejí z ţivočišných nebo rostlinných tkání a pletiv,
TRANSPORT PŘES MEMBRÁNY, MEMBRÁNOVÝ POTENCIÁL, OSMÓZA
 TRANSPORT PŘES MEMBRÁNY, MEMBRÁNOVÝ POTENCIÁL, OSMÓZA 1 VÝZNAM TRANSPORTU PŘES MEMBRÁNY V MEDICÍNĚ Příklad: Membránový transportér: CFTR (cystic fibrosis transmembrane regulator) Onemocnění: cystická fibróza
TRANSPORT PŘES MEMBRÁNY, MEMBRÁNOVÝ POTENCIÁL, OSMÓZA 1 VÝZNAM TRANSPORTU PŘES MEMBRÁNY V MEDICÍNĚ Příklad: Membránový transportér: CFTR (cystic fibrosis transmembrane regulator) Onemocnění: cystická fibróza
1) Pojem biotechnologický proces a jeho fázování 2) Suroviny pro fermentaci 3) Procesy sterilizace 4) Bioreaktory a fermentory 5) Procesy kultivace,
 1) Pojem biotechnologický proces a jeho fázování 2) Suroviny pro fermentaci 3) Procesy sterilizace 4) Bioreaktory a fermentory 5) Procesy kultivace, růstové parametry buněčných kultur 2 Biomasa Extracelulární
1) Pojem biotechnologický proces a jeho fázování 2) Suroviny pro fermentaci 3) Procesy sterilizace 4) Bioreaktory a fermentory 5) Procesy kultivace, růstové parametry buněčných kultur 2 Biomasa Extracelulární
Stanovení kvality humusu spektrofotometricky
 Stanovení kvality humusu spektrofotometricky Definice humusu Synonymum k půdní organické hmotě Odumřelá organická hmota v různém stupni rozkladu a syntézy, jejíž část je vázána na minerální podíl Rozdělení
Stanovení kvality humusu spektrofotometricky Definice humusu Synonymum k půdní organické hmotě Odumřelá organická hmota v různém stupni rozkladu a syntézy, jejíž část je vázána na minerální podíl Rozdělení
glukóza *Ivana FELLNEROVÁ, PřF UP Olomouc*
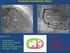 Prezentace navazuje na základní znalosti Biochemie, stavby a transportu přes y Doplňující prezentace: Proteiny, Sacharidy, Stavba, Membránový transport, Symboly označující animaci resp. video (dynamická
Prezentace navazuje na základní znalosti Biochemie, stavby a transportu přes y Doplňující prezentace: Proteiny, Sacharidy, Stavba, Membránový transport, Symboly označující animaci resp. video (dynamická
Bakterie mléčného kvašení jako původci kažení masných výrobků. Co je to zkažená potravina? Faktory ovlivňující mikrobiální kažení
 Bakterie mléčného kvašení jako původci kažení masných výrobků Josef Kameník, Marta Dušková FVHE, Veterinární a farmaceutická univerzita Brno Co je to zkažená potravina? Zkáza potraviny (zkažení) = jakákoli
Bakterie mléčného kvašení jako původci kažení masných výrobků Josef Kameník, Marta Dušková FVHE, Veterinární a farmaceutická univerzita Brno Co je to zkažená potravina? Zkáza potraviny (zkažení) = jakákoli
Hořčík. Příjem, metabolismus, funkce, projevy nedostatku
 Hořčík Příjem, metabolismus, funkce, projevy nedostatku Příjem a pohyb v rostlině Příjem jako ion Mg 2+, pasivní, iont. kanály Mobilní ion v xylému i ve floému, možná retranslokace V místě funkce vázán
Hořčík Příjem, metabolismus, funkce, projevy nedostatku Příjem a pohyb v rostlině Příjem jako ion Mg 2+, pasivní, iont. kanály Mobilní ion v xylému i ve floému, možná retranslokace V místě funkce vázán
Moderní nástroje pro zobrazování biologicky významných molekul pro zajištění zdraví. René Kizek
 Moderní nástroje pro zobrazování biologicky významných molekul pro zajištění zdraví René Kizek 12.04.2013 Fluorescence je fyzikálně chemický děj, který je typem luminiscence. Luminiscence se dále dělí
Moderní nástroje pro zobrazování biologicky významných molekul pro zajištění zdraví René Kizek 12.04.2013 Fluorescence je fyzikálně chemický děj, který je typem luminiscence. Luminiscence se dále dělí
Hodnocení pekařského droždí
 Hodnocení pekařského droždí Čistá mikrobiální kultura kvasinek Saccharomyces Cerevisiae Hanzen Vyrábí se aerobní fermentací melasové zápary Díky kvasným schopnostem zajišťují kvasinky nakynutí těsta ovlivňují
Hodnocení pekařského droždí Čistá mikrobiální kultura kvasinek Saccharomyces Cerevisiae Hanzen Vyrábí se aerobní fermentací melasové zápary Díky kvasným schopnostem zajišťují kvasinky nakynutí těsta ovlivňují
Produkce kyselin v metabolismu Těkavé: 15,000 mmol/den kyseliny uhličité, vyloučena plícemi jako CO 2 Netěkavé kyseliny (1 mmol/kg/den) jsou vyloučeny
 Vnitřní prostředí a acidobazická rovnováha 13.12.2004 Vnitřní prostředí Sestává z posuzování složení extracelulární tekutiny z hlediska izohydrie (= optimální koncentrace ph) izoionie (= optimální koncentrace
Vnitřní prostředí a acidobazická rovnováha 13.12.2004 Vnitřní prostředí Sestává z posuzování složení extracelulární tekutiny z hlediska izohydrie (= optimální koncentrace ph) izoionie (= optimální koncentrace
prokaryotní Znaky prokaryoty
 prokaryotní buňka Znaky prokaryoty Základní stavební jednotka bakterií a sinic Mikroskopická velikost viditelné pouze v optickém mikroskopu Buňka neobsahuje organely Obsahuje pouze 1 biomembránu cytoplazmatickou
prokaryotní buňka Znaky prokaryoty Základní stavební jednotka bakterií a sinic Mikroskopická velikost viditelné pouze v optickém mikroskopu Buňka neobsahuje organely Obsahuje pouze 1 biomembránu cytoplazmatickou
Molekulární biotechnologie č.9. Cílená mutageneze a proteinové inženýrství
 Molekulární biotechnologie č.9 Cílená mutageneze a proteinové inženýrství Gen kódující jakýkoliv protein lze izolovat z přírody, klonovat, exprimovat v hostitelském organismu. rekombinantní protein purifikovat
Molekulární biotechnologie č.9 Cílená mutageneze a proteinové inženýrství Gen kódující jakýkoliv protein lze izolovat z přírody, klonovat, exprimovat v hostitelském organismu. rekombinantní protein purifikovat
Střední škola gastronomie, hotelnictví a lesnictví Bzenec náměstí Svobody 318. Profilová část maturitní zkoušky
 Střední škola gastronomie, hotelnictví a lesnictví Bzenec náměstí Svobody 318 Obor: 29 42 M / 01 Analýza potravin Období: jarní 2015 Profilová část maturitní zkoušky 1. Povinná volitelná zkouška Předmět:
Střední škola gastronomie, hotelnictví a lesnictví Bzenec náměstí Svobody 318 Obor: 29 42 M / 01 Analýza potravin Období: jarní 2015 Profilová část maturitní zkoušky 1. Povinná volitelná zkouška Předmět:
Biologické odstraňování nutrientů
 Biologické odstraňování nutrientů Martin Pivokonský, Jana Načeradská 8. přednáška, kurz Znečišťování a ochrana vod Ústav pro životní prostředí PřF UK Ústav pro hydrodynamiku AV ČR, v. v. i. Nutrienty v
Biologické odstraňování nutrientů Martin Pivokonský, Jana Načeradská 8. přednáška, kurz Znečišťování a ochrana vod Ústav pro životní prostředí PřF UK Ústav pro hydrodynamiku AV ČR, v. v. i. Nutrienty v
Název školy: Střední odborná škola stavební Karlovy Vary Sabinovo náměstí 16, 360 09 Karlovy Vary Autor: Hana Turoňová Název materiálu:
 Název školy: Střední odborná škola stavební Karlovy Vary Sabinovo náměstí 16, 360 09 Karlovy Vary Autor: Hana Turoňová Název materiálu: VY_32_INOVACE_04_BUŇKA 1_P1-2 Číslo projektu: CZ 1.07/1.5.00/34.1077
Název školy: Střední odborná škola stavební Karlovy Vary Sabinovo náměstí 16, 360 09 Karlovy Vary Autor: Hana Turoňová Název materiálu: VY_32_INOVACE_04_BUŇKA 1_P1-2 Číslo projektu: CZ 1.07/1.5.00/34.1077
Metabolismus mikroorganismů
 Metabolismus mikroorganismů Metabolismus organismů Souvisí s metabolismem polysacharidů, bílkovin, nukleových kyselin a lipidů Cytoplazma, mitochondrie (matrix, membrána) H 3 PO 4 Polysacharidy Pentózový
Metabolismus mikroorganismů Metabolismus organismů Souvisí s metabolismem polysacharidů, bílkovin, nukleových kyselin a lipidů Cytoplazma, mitochondrie (matrix, membrána) H 3 PO 4 Polysacharidy Pentózový
2) Připravte si 7 sad po pěti zkumavkách. Do všech zkumavek pipetujte 0.2 ml roztoku BAPNA o různé koncentraci podle tabulky.
 CVIČENÍ Z ENZYMOLOGIE 1) Stanovení Michaelisovy konstanty trypsinu pomocí chromogenního substrátu. Aktivita trypsinu se určí změřením rychlosti hydrolýzy chromogenního substrátu BAPNA (Nα-benzoyl-L-arginin-p-nitroanilid)
CVIČENÍ Z ENZYMOLOGIE 1) Stanovení Michaelisovy konstanty trypsinu pomocí chromogenního substrátu. Aktivita trypsinu se určí změřením rychlosti hydrolýzy chromogenního substrátu BAPNA (Nα-benzoyl-L-arginin-p-nitroanilid)
Jednotné pracovní postupy zkoušení krmiv STANOVENÍ OBSAHU PROBIOTICKÝCH BAKTERIÍ RODU ENTEROCOCCUS
 Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU PROBIOTICKÝCH BAKTERIÍ RODU ENTEROCOCCUS 1 Rozsah a účel Postup slouží ke stanovení počtu probiotických bakterií v doplňkových látkách, premixech
Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU PROBIOTICKÝCH BAKTERIÍ RODU ENTEROCOCCUS 1 Rozsah a účel Postup slouží ke stanovení počtu probiotických bakterií v doplňkových látkách, premixech
Brno e) Správná odpověď není uvedena. c) KHPO4. e) Správná odpověď není uvedena. c) 49 % e) Správná odpověď není uvedena.
 Brno 2019 1. Vyberte vzoreček hydrogenfosforečnanu draselného. a) K2HP4 d) K3P4 b) K(HP4)2 c) KHP4 2. Vyjádřete hmotnostní procenta síry v kyselině thiosírové. Ar(S) = 32, Ar() = 16, Ar(H) = 1 a) 28 %
Brno 2019 1. Vyberte vzoreček hydrogenfosforečnanu draselného. a) K2HP4 d) K3P4 b) K(HP4)2 c) KHP4 2. Vyjádřete hmotnostní procenta síry v kyselině thiosírové. Ar(S) = 32, Ar() = 16, Ar(H) = 1 a) 28 %
Chemické složení buňky
 Chemické složení buňky Chemie života: založena především na sloučeninách uhlíku téměř výlučně chemické reakce probíhají v roztoku nesmírně složitá ovládána a řízena obrovskými polymerními molekulami -chemickými
Chemické složení buňky Chemie života: založena především na sloučeninách uhlíku téměř výlučně chemické reakce probíhají v roztoku nesmírně složitá ovládána a řízena obrovskými polymerními molekulami -chemickými
Anorganické látky v buňkách - seminář. Petr Tůma některé slidy převzaty od V. Kvasnicové
 Anorganické látky v buňkách - seminář Petr Tůma některé slidy převzaty od V. Kvasnicové Zastoupení prvků v přírodě anorganická hmota kyslík (O) 50% křemík (Si) 25% hliník (Al) 7% železo (Fe) 5% vápník
Anorganické látky v buňkách - seminář Petr Tůma některé slidy převzaty od V. Kvasnicové Zastoupení prvků v přírodě anorganická hmota kyslík (O) 50% křemík (Si) 25% hliník (Al) 7% železo (Fe) 5% vápník
Prezentace navazuje na základní znalosti z biochemie (lipidy, proteiny, sacharidy) Dynamický fluidní model membrány 2008/11
 RNDr. Ivana Fellnerová, Ph.D. Katedra zoologie PřF UP Olomouc Prezentace navazuje na základní znalosti z biochemie (lipidy, proteiny, sacharidy) Rozšiřuje přednášky: Stavba cytoplazmatické membrány Membránový
RNDr. Ivana Fellnerová, Ph.D. Katedra zoologie PřF UP Olomouc Prezentace navazuje na základní znalosti z biochemie (lipidy, proteiny, sacharidy) Rozšiřuje přednášky: Stavba cytoplazmatické membrány Membránový
Propojení metabolických drah. Alice Skoumalová
 Propojení metabolických drah Alice Skoumalová Metabolické stavy 1. Resorpční fáze po dobu vstřebávání živin z GIT (~ 2 h) glukóza je hlavní energetický zdroj 2. Postresorpční fáze mezi jídly (~ 2 h po
Propojení metabolických drah Alice Skoumalová Metabolické stavy 1. Resorpční fáze po dobu vstřebávání živin z GIT (~ 2 h) glukóza je hlavní energetický zdroj 2. Postresorpční fáze mezi jídly (~ 2 h po
10. Minerální výživa rostlin na extrémních půdách
 10. Minerální výživa rostlin na extrémních půdách Extrémní půdy: Kyselé Alkalické Zasolené Kontaminované těžkými kovy Kyselé půdy Procesy vedoucí k acidifikaci (abnormálnímu okyselení): Zvětrávání hornin
10. Minerální výživa rostlin na extrémních půdách Extrémní půdy: Kyselé Alkalické Zasolené Kontaminované těžkými kovy Kyselé půdy Procesy vedoucí k acidifikaci (abnormálnímu okyselení): Zvětrávání hornin
COSY + - podmínky měření a zpracování dat ztráta rozlišení ve spektru. inphase dublet, disperzní. antiphase dublet, absorpční
 y x COSY 90 y chem. posuv J vazba 90 x : : inphase dublet, disperzní inphase dublet, disperzní antiphase dublet, absorpční antiphase dublet, absorpční diagonální pík krospík + - - + podmínky měření a zpracování
y x COSY 90 y chem. posuv J vazba 90 x : : inphase dublet, disperzní inphase dublet, disperzní antiphase dublet, absorpční antiphase dublet, absorpční diagonální pík krospík + - - + podmínky měření a zpracování
Střední škola gastronomie, hotelnictví a lesnictví Bzenec náměstí Svobody 318. Profilová část maturitní zkoušky
 Střední škola gastronomie, hotelnictví a lesnictví Bzenec náměstí Svobody 318 Obor: 29 42 M / 01 Analýza potravin Období: jarní 2015 Profilová část maturitní zkoušky 1. Povinná volitelná zkouška Předmět:
Střední škola gastronomie, hotelnictví a lesnictví Bzenec náměstí Svobody 318 Obor: 29 42 M / 01 Analýza potravin Období: jarní 2015 Profilová část maturitní zkoušky 1. Povinná volitelná zkouška Předmět:
1. Metodika. Protokol č. F1-4 Metodika: Srovnávací analýza efektivity přípravy rekombinantního proteinu ve fermentoru
 Protokol č.: F1-4 Datum: 20.12.2010 Metodika: analýza efektivity přípravy výběr z výsledků ze zkušebních provozů výroby antigenů. Vypracoval: Ing. Václav Filištein, Mgr. Tereza Chrudimská, Spolupracující
Protokol č.: F1-4 Datum: 20.12.2010 Metodika: analýza efektivity přípravy výběr z výsledků ze zkušebních provozů výroby antigenů. Vypracoval: Ing. Václav Filištein, Mgr. Tereza Chrudimská, Spolupracující
Fotosyntéza (2/34) = fotosyntetická asimilace
 Fotosyntéza (2/34) = fotosyntetická asimilace FOTO - protože k fotosyntéze je třeba fotonů Jedná se tedy o zachycování sluneční energie a přeměnu jednoduchých anorganických látek (CO 2 a H 2 O) na složitější
Fotosyntéza (2/34) = fotosyntetická asimilace FOTO - protože k fotosyntéze je třeba fotonů Jedná se tedy o zachycování sluneční energie a přeměnu jednoduchých anorganických látek (CO 2 a H 2 O) na složitější
Plasma a většina extracelulární
 Acidobazická rovnováha Tato prezentace je přístupná online Fyziologické ph Plasma a většina extracelulární tekutiny ph = 7,40 ± 0,02 Význam stálého ph Na ph závisí vlastnosti bílkovin aktivita enzymů struktura
Acidobazická rovnováha Tato prezentace je přístupná online Fyziologické ph Plasma a většina extracelulární tekutiny ph = 7,40 ± 0,02 Význam stálého ph Na ph závisí vlastnosti bílkovin aktivita enzymů struktura
KOMPLEXY EUROPIA(III) LUMINISCENČNÍ VLASTNOSTI A VYUŽITÍ V ANALYTICKÉ CHEMII. Pavla Pekárková
 KOMPLEXY EUROPIA(III) LUMINISCENČNÍ VLASTNOSTI A VYUŽITÍ V ANALYTICKÉ CHEMII Pavla Pekárková Katedra analytické chemie, Přírodovědecká fakulta, Masarykova univerzita, Kotlářská 2, 611 37 Brno E-mail: 78145@mail.muni.cz
KOMPLEXY EUROPIA(III) LUMINISCENČNÍ VLASTNOSTI A VYUŽITÍ V ANALYTICKÉ CHEMII Pavla Pekárková Katedra analytické chemie, Přírodovědecká fakulta, Masarykova univerzita, Kotlářská 2, 611 37 Brno E-mail: 78145@mail.muni.cz
BIOLOGICKÁ MEMBRÁNA Prokaryontní Eukaryontní KOMPARTMENTŮ
 BIOMEMRÁNA BIOLOGICKÁ MEMBRÁNA - všechny buňky na povrchu plazmatickou membránu - Prokaryontní buňky (viry, bakterie, sinice) - Eukaryontní buňky vnitřní členění do soustavy membrán KOMPARTMENTŮ - za
BIOMEMRÁNA BIOLOGICKÁ MEMBRÁNA - všechny buňky na povrchu plazmatickou membránu - Prokaryontní buňky (viry, bakterie, sinice) - Eukaryontní buňky vnitřní členění do soustavy membrán KOMPARTMENTŮ - za
H H C C C C C C H CH 3 H C C H H H H H H
 Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
