Základní techniky práce s tkáňovými kulturami
|
|
|
- Ivo Urban
- před 8 lety
- Počet zobrazení:
Transkript
1 Základní techniky práce s tkáňovými kulturami Výzkum v lékařské biochemii ani v dalších biomedicínských oborech se v současnosti a změnu nelze v dohledné době vůbec očekávat neobejde bez experimentů na živých organismech. Pokusy na laboratorních zvířatech jsou však nákladné a z mnoha důvodů náročné (časově, personálně, požadavky na vybavení, komplikují je interindividuální rozdíly mezi zvířaty, ale i intraindividuální proměnlivost celého organismu např. cirkadiánní a roční biologické rytmy). Pominout nelze ani diskutovanou etickou stránku pokusů se živými zvířaty. V některých případech také není výhodné dělat pokus na celém organismu, orgánu či tkáni, ale je třeba zkoumat vlastnosti pouze určitého typu buněk. V posledních desetiletích si proto nelze základní medicínský výzkum představit bez dalšího experimentálního nástroje: tkáňových kultur. Úkolem tohoto praktického cvičení je seznámit se s některými technikami běžnými při práci s buněčnými kulturami. Historie tkáňových kultur začíná už na konci devatenáctého století: kolem roku 1885 Roux dokázal po určitou dobu udržet živé explantované kuřecí embryonální buňky v uměle připraveném médiu a několik dalších autorů dosáhlo v té době podobných výsledků. Nedařilo se však, aby se buňky dělily jako za podmínek in vivo. Ještě na konci 19. století se také podařilo zmrazit živé buňky a opět je rozmrazit, čehož se začalo využívat při inseminaci dobytka. Na přelomu 19. a 20. století dokázal Ross Harrison, že z nervové tkáně vyňaté z žabích embryí a uzavřené do komůrky s lymfou žáby vyrůstají nově vytvořené axony. Konečně ve čtyřicátých letech 20. století se objevily první úspěšné pokusy o založení buněčné kultury, v níž by se buňky množily a která by přežívala po delší, byť omezenou dobu. Techniky tkáňových kultur se postupně zdokonalovaly a výsledky začínaly být stále spolehlivější. Od osmdesátých let se tak tkáňové kultury staly běžným nástrojem nejen pro výzkum, ale začaly se používat i průmyslově k výrobě protilátek, některých léků a chemikálií. Zcela nepostradatelné jsou tyto metody pro molekulární biologii, vývoj nových léčiv apod. Práce s tkáňovými kulturami se v některých ohledech liší od ostatních technik používaných v biochemii. V první řadě je nutné, aby veškeré používané pomůcky a chemikálie byly sterilní a aby neobsahovaly některé toxické látky, které je jinak ve stopových množstvích běžně kontaminují. Kromě obvyklého vybavení jsou navíc nutné některé speciální přístroje a pomůcky. Proto jsou tyto techniky poměrně nákladné a vyžadují zvlášť vybudované laboratoře a vyškolený personál. Principiálně má práce s každou buněčnou linií několik fází: 1. izolace buněčného kmene 2. udržování buněčné linie a její expanze 3. využití namnožených buněk v pokusu. Většina buněčných linií má omezenou životnost, tj. podléhá stárnutí a po určité době se buňky přestanou dělit. Pouze některé tkáňové kultury jsou nesmrtelné zpravidla jde o buňky získané z nádorů nebo uměle imortalizované vnesením vhodných genů. V tom případě se hovoří o kontinuálních buněčných liniích. I v nich si buňky obvykle zachovávají schopnost regulace buněčného dělení. Pokud ji ztratí a dělí se nekontrolovaně, mluvíme o transformované buněčné linii. Velká většina buněčných linií vyžaduje k růstu vhodný povrch (dnes nejčastěji polystyren) adherentní kultury, jen některé typy buněk dokáží přežívat a dělit se v suspenzi. Buňky se pěstují v kultivačních nádobách (lahvích, Petriho miskách apod.) ve speciálních kultivačních médiích. Ta obsahují potřebné ionty, pufry, zdroje energie, aminokyseliny, vitamíny, růstové faktory a další pomocné látky. Směs potřebných růstových faktorů, stopových prvků a dalších látek potřebných v nízkých koncentracích se obvykle dodává přídavkem fetálního telecího séra. Pro optimální růst je třeba tkáňové kultury pěstovat ve sterilním prostředí se stálou teplotou kolem 37 C a zvlhčenou atmosférou se zvýšeným obsahem oxidu uhličitého. Nasazením buněk izolovaných z pokusného zvířete (nebo vzácněji např. z bioptického vzorku) vzniká tzv. primokultura. Buňky se postupně dělí, až v ideálním případě vytvoří na povrchu kultivační nádoby souvislou (konfluentní) jednoduchou vrstvu (monolayer). Pokud nejde o buňky transformované, přestane se konfluentní kultura déle rozrůstat. Je-li potřeba s buněčnou linií dále pracovat, uvolní se zpravidla krátce před dosažením konfluence buňky od povrchu kultivační nádoby (mechanicky, pomocí některých enzymů trypsinu, kolagenázy, dispázy, nebo pomocí chelátorů dvojmocných iontů EDTA, citrát), vzniklá suspenze se naředí a nasadí do nových kultivačních nádob. Celý postup se označuje jako pasáž, nové kultuře se říká subkultura.
2 Izolace buněk Je zřejmé, že první podmínkou pro založení tkáňové kultury je izolace buněk, které se budou pěstovat. Výchozím materiálem přitom bývá orgán sterilně odebraný z pokusného zvířete, vzácněji bioptický vzorek či např. punktát kostní dřeně nebo vzorek periferní krve. Je-li výchozím materiálem solidní orgán, jsou v zásadě dvě možnosti, jak z něj vytvořit buněčnou kulturu: 1. tkáň se rozřeže na malé částečky, které se ponoří do kultivačního média. Buňky pak z částeček vyrůstají a šíří se po povrchu kultivační nádoby 2. tkáň se rozvolní na jednotlivé buňky, ať už mechanicky homogenizátorem, nebo šetrněji např. enzymatickým natrávením (trypsinem, kolagenázou, pronázou, dispázou, elastázou apod.). Oběma způsoby však vzniká směs mnoha buněčných typů, ze které je nutné žádanou subpopulaci izolovat. Buď lze využít různé odolnosti jednotlivých typů buněk vůči různým podmínkám, jejich náročnosti na složení kultivačního média, citlivosti vůči toxickým látkám apod., nebo lze buňky rozdělit podle jejich fyzikálních vlastností, nejčastěji podle hustoty nebo rychlosti sedimentace. K izolaci buněk podle hustoty (izopyknická sedimentace) se používá centrifugace buněčné suspenze ve zkumavce naplněné médiem, které má v různých vzdálenostech ode dna různou denzitu tzv. dělení na gradientu hustoty. Hustota gradientu se může měnit buď plynule (spojité gradienty), nebo skokem (nespojité gradienty). K vytvoření spojitého gradientu se dnes nejčastěji používá částeček oxidu křemičitého potažených polyvinylpyrrolidonem (obchodní název Percoll ). Pokud se směs částic o různé velikosti centrifuguje při vysokých otáčkách, rozdělí se podle denzity. Médium u dna zkumavky má pak vyšší hustotu než médium u hladiny. Na povrch gradientu se nanese buněčná suspenze a celý sloupec se znovu centrifuguje, tentokrát při podstatně nižších otáčkách. Buňky klesnou až na úroveň, kde mají stejnou hustotu jako médium. Odebráním vhodné části sloupce lze izolovat jeden určitý buněčný typ. Jinou možností, jak připravit spojitý gradient, je postupné míšení dvou roztoků, jednoho s vyšší a druhého s nižší hustotou, přičemž poměř obou roztoků se plynule mění a výslednou směsí se plní centrifugační zkumavka. Technicky jednodušší je příprava nespojitých gradientů. V tomto případě se na sebe jednoduše navrství roztoky o různých hustotách. Další vrstvu opět tvoří buněčná suspenze. Po centrifugaci se buňky rozdělí mezi jednotlivá rozhraní roztoků tak, že každý buněčný typ zůstane mezi roztokem s vyšší a nižší hustotou, než je hustota buněk. K přípravě diskontinuálních gradientů se používá celá řada chemikálií. Nejčastěji jde o sacharidy, od snadno dostupné sacharózy až po polysacharidy (např. mnohočetně rozvětvený kopolymer sacharózy a epichlorhydrinu s přesně definovanou molekulární hmotností, obchodní název Ficoll ). Lepší dělení buněk i výtěžek než izopyknická sedimentace poskytuje tzv. centrifugační elutriace, která umožňuje pomocí speciálního zařízení rozdělit buňky podle rychlosti sedimentace, tj. nejen podle hustoty, ale i objemu. Tato metoda je však technicky mnohem složitější a vyžaduje zvláštní vybavení. Identifikace buněk Po založení nové buněčné linie je zpravidla nutné ověřit, že kultura skutečně obsahuje požadovaný typ buněk některé buněčné typy, které by eventuálně kontaminovaly primokulturu třeba jen v malém množství, mohou ostatní buňky tzv. přerůst a zcela je vytlačit. Prvním krokem při identifikaci buněk je nepochybně sledování morfologie buněk, to však nebývá zcela spolehlivé: jednak většina buněk mění vzhled v průběhu růstu kultury, jednak řada buněčných typů vypadá velmi podobně a prakticky je od sebe nelze mikroskopicky odlišit. Proto je nutné použít dalších metod: 1. imunochemické metody průkaz antigenů specifických pro určitý typ buněk patří mezi nejspolehlivější a měly by být metodou volby
3 2. analýza exprimovaných enzymů a izoenzymů některé buňky vykazují typickou enzymatickou aktivitu, případně obsahují určité specifické izoenzymy. K průkazu se používají charakteristické reakce, specifické inhibitory, imunochemické, elektroforetické a chromatografické metody. U zavedených kultur je čas od času nutné ověřit, že se stále pracuje s původní linií jednak může v důsledku stárnutí linie dojít k výrazné změně kultivovaných buněk (dediferenciace či naopak diferenciace, různé transformace buněk), jednak může být při nesprávné laboratorní praxi kultura kontaminována jinou linií, která ji následně přeroste. Takové ověření se označuje jako autentizace tkáňové kultury a používají se k ní kromě metod zmíněných výše i některé molekulární techniky (DNA-fingerprinting, analýza mikrosatelitních sekvencí apod.). Stanovení počtu buněk, jejich viability a metabolické aktivity Řada postupů při práci s tkáňovými kulturami vyžaduje přesné stanovení počtu buněk ve vzorku. V praxi se běžně používají dvě metody přímého stanovení počtu buněk: ruční počítání v kalibrované komůrce pod světelným mikroskopem a poloautomatické počítání pomocí průtokového počítače částic. Počítání buněk v komůrce je nejjednodušší a mnohdy i nejpřesnější metoda. U nás se obvykle používá Bürkerova komůrka. Na jednom mikroskopickém sklíčku jsou vybroušená dvě pole hluboká přesně 0,1 mm, na jejichž dně je síťovitý obrazec (vzdálenosti jednotlivých čar jsou uvedeny na obrázku). Bürkerova komůrka počítací pole a pohled z boku 0,2 mm 1 mm 0,05 mm Je-li třeba znát počet živých a mrtvých buněk ve vzorku, přidá se k buněčné suspenzi před počítáním barvivo, které neprochází intaktní buněčnou membránou, nebo je z intracelulárního prostoru aktivně transportováno ven. Nejčastěji se používá roztoku trypanové modři. Živé buňky zůstanou bezbarvé, zatímco mrtvé buňky, u nichž je porušena integrita buněčné membrány a jejích transportních mechanismů, se rychle zbarví na modro. Trypanová modř Při použití průtokového počítače částic lze přístroj doplnit dalšími čidly, která blíže určí charakter buněk. Nejčastěji se měří elektrické vlastnosti částic nebo se sleduje jejich interakce s laserovým paprskem. Tyto techniky se označují jako průtoková cytometrie a rutinně se používají v klinické biochemii a hematologii např. ke stanovení krevního obrazu, vyšetření kostní dřeně nebo močového sedimentu.
4 Používají se i další metody určení počtu buněk: denzitometrie obarvené buněčné kultury (barviva užívaná v histologii, metylénová modř, Janusova zeleň) stanovení DNA ve vzorku stanovení celkové bílkoviny ve vzorku stanovení aktivity některých enzymů (hexózaaminidáza) Zvláštní postavení mezi těmito technikami zaujímá MTT test. MTT (3-[4,5-dimetylthiazol-2-yl]-2,5- difenyltetrazolium bromid) je mitochondriálními dehydrogenázami redukováno na barevný formazan. Rychlost tvorby formazanu odpovídá aktivitě dýchacího řetězce a odráží tak metabolickou aktivitu buňky. MTT oxidovaná forma MTT formazan
5 Praktické úlohy Izolace agranulocytů z periferní krve Izotonický roztok sacharózy 1083 g.l -1 (osmolarita nastavena chloridem sodným na 300 mosm.l -1, zahuštěno přídavkem 3 % želatiny, obarveno na modro potravinářským barvivem E-132) Izotonický roztok sacharózy 1077 g.l -1 (osmolarita nastavena chloridem sodným na 300 mosm.l -1, zahuštěno přídavkem 3 % želatiny, obarveno na žluto potravinářským barvivem E-102) Fyziologický roztok (chlorid sodný 0,9 g.l -1 ) LeucoPHAN Heparinizovaná krev ředěná 1:1 fyziologickým roztokem Princip: Na diskontinuálním gradientu s médii o hustotě 1083 a 1077 g.l -1 se krvinky při centrifugaci rozdělí tak, že erytrocyty sedimentují na dno zkumavky, granulocyty klesnou na rozhraní obou médií a agranulocyty s destičkami zůstanou nad méně hustým roztokem. Přítomnost leukocytů v izolované suspenzi prokážeme pomocí komerčního testu LeukoPHAN. Leukocytární esterázy štěpí ester indoxylu, který následně reaguje s diazotovanou solí za vzniku barevného konjugátu. Postup: 1. Do polypropylenové centrifugační zkumavky se odměří 3 ml roztoku s hustotou 1083 g.l -1. Nad něj se opatrně převrství 3 ml roztoku s hustotou 1077 g.l -1. Oba roztoky se nesmějí smíchat. 2. Nad gradient se opatrně nanese 6 ml ředěné krve 3. Centrifugace 20 minut při 2000 ot/min. 4. Plastovou Pasteurovou pipetou se odsaje plazma nad gradientem, přičemž se ponechá asi 7 mm vrstva plazmy nad horním okrajem gradientu. 5. Do skleněné zkumavky se plastovou Pasteurovou pipetou odebere část sloupce mezi 7 mm nad a 7 mm pod okrajem gradientu. Tato frakce obsahuje agranulocyty a trombocyty. 6. Přítomnost leukocytů ve frakci se prokáže pomocí LeukoPHANu políčko po ponoření zfialoví. 7. Frakce agranulocytů s destičkami se ponechá pro další pokusy.
6 Stanovení počtu buněk a jejich viability Trypanová modř 0,4 % v izotonickém fosfátovém pufru ph 7,4 (jed!) Princip: Trypanová modř je z živých buněk aktivně transportována přes buněčnou membránu. Po smísení buněčné suspenze s roztokem tohoto barviva proto živé buňky zůstávají světlé, zatímco mrtvé se obarví na modro. Postup: 1. K 0,5 ml dobře promíchané buněčné suspenze se přidá 0,5 ml roztoku trypanové modři. 2. Po 5 až 15 minutách se suspenze dobře promíchá a pomocí 50 µl automatické pipety se jí naplní obě poloviny Bürkerovy komůrky. Je třeba aplikovat takové množství vzorku, aby se komůrka právě naplnila, roztok nesmí přetékat do okolních žlábků. 3. Pod světelným mikroskopem se při nejmenším zvětšení počítají zvlášť živé (bezbarvé) a mrtvé (modré) buňky. Počítá se nejprve 5 čtverců (4 rohové a středový) 1 1 mm v jedné polovině komůrky. Je-li celkový počet buněk menší než 100, počítají se buňky i v dalších 5 čtvercích ve druhé polovině komůrky. Za hranici čtverce se považuje prostřední linka z trojité čáry. Z buněk, které leží na okraji čtverce, se počítají ty, které se i jen dotýkají levého nebo horního okraje, a naopak se nepočítají buňky, které se i jen dotýkají pravého nebo dolního okraje. 4. Počet buněk se vypočítá podle vzorce P = (N D 1000) / (H S) kde P je počet buněk na 1 ml suspenze N je celkový počet buněk D = 2 (ředění suspenze) H = 0,1 (hloubka komůrky v mm) S je počet čtverců 5. Vypočítá se podíl živých buněk v procentech.
7 Stanovení metabolické aktivity buněk MTT testem MTT (3-[4,5-dimetylthiazol-2-yl]-2,5-difenyltetrazolium bromid) 5 g.l -1 v izotonickém fosfátovém pufru ph 7,4 (zdraví škodlivé) extrakční pufr (20 % lauroylsíran sodný v 50% dimetylformamidu, ph 4,7, zdraví škodlivé) Princip: Žluté MTT se mitochondriálními enzymy dýchacího řetězce redukuje na fialový formazanový derivát, který zůstává uvnitř buněk ve formě nerozpustných granulí. Po přidání detergentu (lauroylsíran sodný, SDS) a okyselení se barvivo z buněk uvolní a rozpustí, takže vznikne čirý roztok vhodný k fotometrickému stanovení. Postup: 1. K 0,5 ml promíchané buněčné suspenze se přidá 100 µl roztoku MTT a inkubuje se 45 minut při 37 C. 2. K suspenzi se přidá 0,5 ml extrakčního pufru, směs se promíchá a inkubuje se 10 minut při 37 C. 3. Změří se absorbance při 595 nm proti destilované vodě.
Cvičení č. 2: Pasážování buněk. 1) Teoretický základ
 Cvičení č. 2: Pasážování buněk 1) Teoretický základ Kultivace buněk in vitro (ve zkumavce) - Snaha o napodobení podmínek v organismu - Používání jednorázového spotřebního materiálu a speciálních chemikálií
Cvičení č. 2: Pasážování buněk 1) Teoretický základ Kultivace buněk in vitro (ve zkumavce) - Snaha o napodobení podmínek v organismu - Používání jednorázového spotřebního materiálu a speciálních chemikálií
Cvičení č. 2: Pasážování buněk. 1) Teoretický základ
 Cvičení č. 2: Pasážování buněk 1) Teoretický základ Kultivace buněk in vitro (ve zkumavce) - Snaha o napodobení podmínek v organismu - Používání jednorázového spotřebního materiálu a speciálních chemikálií
Cvičení č. 2: Pasážování buněk 1) Teoretický základ Kultivace buněk in vitro (ve zkumavce) - Snaha o napodobení podmínek v organismu - Používání jednorázového spotřebního materiálu a speciálních chemikálií
MTI Cvičení č. 2 Pasážování buněk / Jana Horáková
 MTI Cvičení č. 2 Pasážování buněk 15.11./16.11.2016 Jana Horáková Doporučená literatura M. Vejražka: Buněčné kultury http://bioprojekty.lf1.cuni.cz/3381/sylabyprednasek/textova-verze-prednasek/bunecnekultury-vejrazka.pdf
MTI Cvičení č. 2 Pasážování buněk 15.11./16.11.2016 Jana Horáková Doporučená literatura M. Vejražka: Buněčné kultury http://bioprojekty.lf1.cuni.cz/3381/sylabyprednasek/textova-verze-prednasek/bunecnekultury-vejrazka.pdf
LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 3. TESTY ŽIVOTASCHOPNOSTI A POČÍTÁNÍ BUNĚK
 LRR/BUBCV CVIČEÍ Z BUĚČÉ BILGIE 3. TESTY ŽIVTASCHPSTI A PČÍTÁÍ BUĚK TERETICKÝ ÚVD: Při práci s buňkami je jedním ze základních sledovaných parametrů stanovení jejich životaschopnosti (viability). Tímto
LRR/BUBCV CVIČEÍ Z BUĚČÉ BILGIE 3. TESTY ŽIVTASCHPSTI A PČÍTÁÍ BUĚK TERETICKÝ ÚVD: Při práci s buňkami je jedním ze základních sledovaných parametrů stanovení jejich životaschopnosti (viability). Tímto
Praktický kurz Monitorování toxicity vybraných cytostatik pomocí MTT testu a real-time monitoringu xcelligence.
 Praktický kurz Monitorování toxicity vybraných cytostatik pomocí MTT testu a real-time monitoringu xcelligence. Počítání buněk, příprava speciální xcell destičky, napipetování buněk Vyučující: Mgr. Monika
Praktický kurz Monitorování toxicity vybraných cytostatik pomocí MTT testu a real-time monitoringu xcelligence. Počítání buněk, příprava speciální xcell destičky, napipetování buněk Vyučující: Mgr. Monika
Téma: Testy životaschopnosti a Počítání buněk
 LRR/BUBV vičení z buněčné biologie Úloha č. 3 Téma: Testy životaschopnosti a Počítání Úvod: Při práci s buňkami je jedním ze základních sledovaných parametrů stanovení jejich životaschopnosti (viability).
LRR/BUBV vičení z buněčné biologie Úloha č. 3 Téma: Testy životaschopnosti a Počítání Úvod: Při práci s buňkami je jedním ze základních sledovaných parametrů stanovení jejich životaschopnosti (viability).
Izolace nukleových kyselin
 Izolace nukleových kyselin Požadavky na izolaci nukleových kyselin V nativním stavu z přirozeného materiálu v dostatečném množství požadované čistotě. Nukleové kyseliny je třeba zbavit všech látek, které
Izolace nukleových kyselin Požadavky na izolaci nukleových kyselin V nativním stavu z přirozeného materiálu v dostatečném množství požadované čistotě. Nukleové kyseliny je třeba zbavit všech látek, které
RNA Blue REAGENS PRO RYCHLOU PŘÍPRAVU ČISTÉ A NEDEGRADOVANÉ RNA (katalogové číslo R011, R012, R013)
 RNA Blue REAGENS PRO RYCHLOU PŘÍPRAVU ČISTÉ A NEDEGRADOVANÉ RNA (katalogové číslo R011, R012, R013) Upozornění: RNA Blue obsahuje fenol a další toxické komponenty. Při kontaktu s kůží je nutné omytí velkým
RNA Blue REAGENS PRO RYCHLOU PŘÍPRAVU ČISTÉ A NEDEGRADOVANÉ RNA (katalogové číslo R011, R012, R013) Upozornění: RNA Blue obsahuje fenol a další toxické komponenty. Při kontaktu s kůží je nutné omytí velkým
STANOVENÍ CYTOTOXICITY LÉČIV IN VITRO (XTT ASSAY)
 STANOVENÍ CYTOTOXICITY LÉČIV IN VITRO (XTT ASSAY) LENKA BRŮČKOVÁ Univerzita Pardubice Fakulta chemicko-technologická Katedra biologických a biochemických věd Centralizovaný rozvojový projekt MŠMT č. C29:
STANOVENÍ CYTOTOXICITY LÉČIV IN VITRO (XTT ASSAY) LENKA BRŮČKOVÁ Univerzita Pardubice Fakulta chemicko-technologická Katedra biologických a biochemických věd Centralizovaný rozvojový projekt MŠMT č. C29:
Přímé stanovení celkového počtu buněk kvasinek pomocí Bürkerovy komůrky Provedení vitálního testu
 Přímé stanovení celkového počtu buněk kvasinek pomocí Bürkerovy komůrky Provedení vitálního testu Otázky k zamyšlení: Bude se jednat o přímé nebo nepřímé stanovení počtu buněk? Stanovujeme počet živých
Přímé stanovení celkového počtu buněk kvasinek pomocí Bürkerovy komůrky Provedení vitálního testu Otázky k zamyšlení: Bude se jednat o přímé nebo nepřímé stanovení počtu buněk? Stanovujeme počet živých
Prezentace navazuje na základní znalosti z biochemie (lipidy, proteiny, sacharidy) Dynamický fluidní model membrány 2008/11
 RNDr. Ivana Fellnerová, Ph.D. Katedra zoologie PřF UP Olomouc Prezentace navazuje na základní znalosti z biochemie (lipidy, proteiny, sacharidy) Rozšiřuje přednášky: Stavba cytoplazmatické membrány Membránový
RNDr. Ivana Fellnerová, Ph.D. Katedra zoologie PřF UP Olomouc Prezentace navazuje na základní znalosti z biochemie (lipidy, proteiny, sacharidy) Rozšiřuje přednášky: Stavba cytoplazmatické membrány Membránový
2) Připravte si 3 sady po šesti zkumavkách. Do všech zkumavek pipetujte 0.2 ml roztoku BAPNA o různé koncentraci podle tabulky.
 CVIČENÍ Z ENZYMOLOGIE 1) Stanovení Michaelisovy konstanty trypsinu pomocí chromogenního substrátu. Aktivita trypsinu se určí změřením rychlosti hydrolýzy chromogenního substrátu BAPNA (Nα-benzoyl-L-arginin-p-nitroanilid)
CVIČENÍ Z ENZYMOLOGIE 1) Stanovení Michaelisovy konstanty trypsinu pomocí chromogenního substrátu. Aktivita trypsinu se určí změřením rychlosti hydrolýzy chromogenního substrátu BAPNA (Nα-benzoyl-L-arginin-p-nitroanilid)
3.02 Dělení směsí, aneb i separace může být legrace (filtrace). Projekt Trojlístek
 3. Separační metody 3.02 Dělení směsí, aneb i separace může být legrace (filtrace). Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2.
3. Separační metody 3.02 Dělení směsí, aneb i separace může být legrace (filtrace). Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2.
Příprava krevního roztěru
 Příprava krevního roztěru Správně Příliš tlustý Moc krve Nerovnoměrný tah Třásla se ruka Krev se srážela Mastné sklíčko Barvení roztěrů Standardním barvením pro krevní nátěry je tzv. panoptické barvení
Příprava krevního roztěru Správně Příliš tlustý Moc krve Nerovnoměrný tah Třásla se ruka Krev se srážela Mastné sklíčko Barvení roztěrů Standardním barvením pro krevní nátěry je tzv. panoptické barvení
Protokol č. 7 Pozorování živých a mrtvých buněk kvasinek Vitální test
 Protokol č. 7 Pozorování živých a mrtvých buněk kvasinek Vitální test Cíl cvičení: Bude se jednat o přímé nebo nepřímé stanovení počtu buněk? Stanovujeme počet živých nebo mrtvých buněk? Jak odlišíme živé
Protokol č. 7 Pozorování živých a mrtvých buněk kvasinek Vitální test Cíl cvičení: Bude se jednat o přímé nebo nepřímé stanovení počtu buněk? Stanovujeme počet živých nebo mrtvých buněk? Jak odlišíme živé
Izolace genomové DNA ze savčích buněk, stanovení koncentrace DNA pomocí absorpční spektrofotometrie
 Izolace genomové DNA ze savčích buněk, stanovení koncentrace DNA pomocí absorpční spektrofotometrie IZOLACE GENOMOVÉ DNA Deoxyribonukleová kyselina (DNA) představuje základní genetický materiál většiny
Izolace genomové DNA ze savčích buněk, stanovení koncentrace DNA pomocí absorpční spektrofotometrie IZOLACE GENOMOVÉ DNA Deoxyribonukleová kyselina (DNA) představuje základní genetický materiál většiny
POČÍTÁNÍ BUNĚK. Část mřížky Bürkerovy komůrky. Výška prostoru, v němž jsou buňky nad mřížkou počítány, je 0,1 µm
 POČÍTÁNÍ BUNĚK Potřeba spočítat množství buněk vzniká při řešení mnoha biologických otázek. Mnohé z nich mívají rovněž klinický význam (zejména v hematologii je zjišťování počtů krvinek každodenním rutinním
POČÍTÁNÍ BUNĚK Potřeba spočítat množství buněk vzniká při řešení mnoha biologických otázek. Mnohé z nich mívají rovněž klinický význam (zejména v hematologii je zjišťování počtů krvinek každodenním rutinním
Erytrocyty. Hemoglobin. Krevní skupiny a Rh faktor. Krevní transfúze. Somatologie Mgr. Naděžda Procházková
 Erytrocyty. Hemoglobin. Krevní skupiny a Rh faktor. Krevní transfúze. Somatologie Mgr. Naděžda Procházková Formované krevní elementy: Buněčné erytrocyty, leukocyty Nebuněčné trombocyty Tvorba krevních
Erytrocyty. Hemoglobin. Krevní skupiny a Rh faktor. Krevní transfúze. Somatologie Mgr. Naděžda Procházková Formované krevní elementy: Buněčné erytrocyty, leukocyty Nebuněčné trombocyty Tvorba krevních
ÚSTAV LÉKAŘSKÉ BIOCHEMIE A LABORATORNÍ DIAGNOSTIKY 1. LF UK. Vyšetření moči
 ÚSTAV LÉKAŘSKÉ BIOCHEMIE A LABORATORNÍ DIAGNOSTIKY 1. LF UK Vyšetření moči močový sediment, stanovení sodíku, opakování Praktické cvičení z lékařské biochemie Všeobecné lékařství Martin Vejražka, Lenka
ÚSTAV LÉKAŘSKÉ BIOCHEMIE A LABORATORNÍ DIAGNOSTIKY 1. LF UK Vyšetření moči močový sediment, stanovení sodíku, opakování Praktické cvičení z lékařské biochemie Všeobecné lékařství Martin Vejražka, Lenka
ZÁVĚREČNÝ PROTOKOL O TESTOVÁNÍ BIOAKTIVNÍCH VLASTNOSTÍ LÁTKY CYTOPROTECT
 MIKROBIOLOGICKÝ ÚSTAV Akademie věd České republiky Vídeňská 1083, 420 20 Praha 4 Krč Imunologie a gnotobiologie ZÁVĚREČNÝ PROTOKOL O TESTOVÁNÍ BIOAKTIVNÍCH VLASTNOSTÍ LÁTKY CYTOPROTECT Zadání: Na základě
MIKROBIOLOGICKÝ ÚSTAV Akademie věd České republiky Vídeňská 1083, 420 20 Praha 4 Krč Imunologie a gnotobiologie ZÁVĚREČNÝ PROTOKOL O TESTOVÁNÍ BIOAKTIVNÍCH VLASTNOSTÍ LÁTKY CYTOPROTECT Zadání: Na základě
Metody separace buněk Funkční testy lymfocytů. RNDr. Jan Lašťovička, CSc. RNDr. Daniela Rožková, PhD. Ústav imunologie 2.
 Metody separace buněk Funkční testy lymfocytů RNDr. Jan Lašťovička, CSc. RNDr. Daniela Rožková, PhD. Ústav imunologie 2.LF UK a FN Motol Metody izolace buněk Historické shrnutí - První pokusy kolem r.
Metody separace buněk Funkční testy lymfocytů RNDr. Jan Lašťovička, CSc. RNDr. Daniela Rožková, PhD. Ústav imunologie 2.LF UK a FN Motol Metody izolace buněk Historické shrnutí - První pokusy kolem r.
Seminář izolačních technologií
 Seminář izolačních technologií Zpracoval: Karel Bílek a Kateřina Svobodová Podpořeno FRVŠ 2385/2007 a 1305/2009 Úpravy a aktualizace: Pavla Chalupová ÚMFGZ MZLU v Brně 1 Lokalizace jaderné DNA 2 http://www.paternityexperts.com/basicgenetics.html
Seminář izolačních technologií Zpracoval: Karel Bílek a Kateřina Svobodová Podpořeno FRVŠ 2385/2007 a 1305/2009 Úpravy a aktualizace: Pavla Chalupová ÚMFGZ MZLU v Brně 1 Lokalizace jaderné DNA 2 http://www.paternityexperts.com/basicgenetics.html
53. ročník 2016/2017
 Ústřední komise Chemické olympiády 53. ročník 2016/2017 OKRESNÍ KOLO kategorie D ŘEŠENÍ PRAKTICKÉ ČÁSTI časová náročnost: 90 minut Úloha 1 Yamadův univerzální indikátor 30 bodů Úkoly: 1. Doplněná Tabulka
Ústřední komise Chemické olympiády 53. ročník 2016/2017 OKRESNÍ KOLO kategorie D ŘEŠENÍ PRAKTICKÉ ČÁSTI časová náročnost: 90 minut Úloha 1 Yamadův univerzální indikátor 30 bodů Úkoly: 1. Doplněná Tabulka
POSTUPY PRÁCE. 1.1 Stanovení počtu erytrocytů
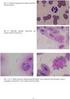 POSTUPY PRÁCE 1.1 Stanovení počtu erytrocytů Potřeby: banička, Hayemův roztok, mikropipety 25 l a 4 950 l, kapátka, podložní sklíčko, Bürkerova komůrka, krev, emetní miska, čtverečky buničité vaty. Postup
POSTUPY PRÁCE 1.1 Stanovení počtu erytrocytů Potřeby: banička, Hayemův roztok, mikropipety 25 l a 4 950 l, kapátka, podložní sklíčko, Bürkerova komůrka, krev, emetní miska, čtverečky buničité vaty. Postup
IZOLACE DNA (KIT DNeasy Plant Mini)
 17.1 Izolace DNA (kit DNeasy Plant Mini) Strana 1 IZOLACE DNA (KIT DNeasy Plant Mini) 1 Účel a rozsah Postup slouží k získání deoxyribonukleové kyseliny (DNA) ze vzorku pomocí komerčního kitu DNeasy Plant
17.1 Izolace DNA (kit DNeasy Plant Mini) Strana 1 IZOLACE DNA (KIT DNeasy Plant Mini) 1 Účel a rozsah Postup slouží k získání deoxyribonukleové kyseliny (DNA) ze vzorku pomocí komerčního kitu DNeasy Plant
TEORETICKÝ ÚVOD. Počítání buněk
 Jméno: Obor: Datum provedení: TEORETICKÝ ÚVOD Počítání buněk Jednou z nezbytných dovedností při práci s biologickým materiálemk je stanovení počtu buněk ve vzorku. V současné době se v praxi k počítání
Jméno: Obor: Datum provedení: TEORETICKÝ ÚVOD Počítání buněk Jednou z nezbytných dovedností při práci s biologickým materiálemk je stanovení počtu buněk ve vzorku. V současné době se v praxi k počítání
Laboratorní úloha Diluční měření průtoku
 Laboratorní úloha Diluční měření průtoku pro předmět lékařské přístroje a zařízení 1. Teorie Diluční měření průtoku patří k velmi používaným nepřímým metodám v biomedicíně. Využívá se zejména tehdy, kdy
Laboratorní úloha Diluční měření průtoku pro předmět lékařské přístroje a zařízení 1. Teorie Diluční měření průtoku patří k velmi používaným nepřímým metodám v biomedicíně. Využívá se zejména tehdy, kdy
1. Definice a historie oboru molekulární medicína. 3. Základní laboratorní techniky v molekulární medicíně
 Obsah Předmluvy 1. Definice a historie oboru molekulární medicína 1.1. Historie molekulární medicíny 2. Základní principy molekulární biologie 2.1. Historie molekulární biologie 2.2. DNA a chromozomy 2.3.
Obsah Předmluvy 1. Definice a historie oboru molekulární medicína 1.1. Historie molekulární medicíny 2. Základní principy molekulární biologie 2.1. Historie molekulární biologie 2.2. DNA a chromozomy 2.3.
MagPurix Blood DNA Extraction Kit 200
 MagPurix Blood DNA Extraction Kit 200 Kat. č. ZP02001-48 Doba zpracování: 50-60 minut pro MagPurix 12S 50-70 minut pro MagPurix 24 Použití Souprava MagPurix Blood DNA Extraction Kit 200 je určena pro izolátor
MagPurix Blood DNA Extraction Kit 200 Kat. č. ZP02001-48 Doba zpracování: 50-60 minut pro MagPurix 12S 50-70 minut pro MagPurix 24 Použití Souprava MagPurix Blood DNA Extraction Kit 200 je určena pro izolátor
Polymorfismus délky restrikčních fragmentů (RFLP)
 ÚSTAV LÉKAŘSKÉ BIOCHEMIE A LABORATORNÍ DIAGNOSTIKY 1. LF UK Polymorfismus délky restrikčních fragmentů (RFLP) Praktické cvičení z lékařské biochemie Všeobecné lékařství Martin Vejražka 2017/18 Obsah POLYMORFISMUS
ÚSTAV LÉKAŘSKÉ BIOCHEMIE A LABORATORNÍ DIAGNOSTIKY 1. LF UK Polymorfismus délky restrikčních fragmentů (RFLP) Praktické cvičení z lékařské biochemie Všeobecné lékařství Martin Vejražka 2017/18 Obsah POLYMORFISMUS
Jednotné pracovní postupy zkoušení krmiv STANOVENÍ OBSAHU DEKOCHINÁTU METODOU HPLC
 Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU DEKOCHINÁTU METODOU HPLC 1 Rozsah a účel Tato metoda specifikuje podmínky pro stanovení dekochinátu metodou vysokoúčinné kapalinové chromatografie
Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU DEKOCHINÁTU METODOU HPLC 1 Rozsah a účel Tato metoda specifikuje podmínky pro stanovení dekochinátu metodou vysokoúčinné kapalinové chromatografie
Konečná zpráva hodnocení různých způsobů přípravy vzorků pro AMPLICOR HPV test firmy Roche
 Konečná zpráva hodnocení různých způsobů přípravy vzorků pro AMPLICOR HPV test firmy Roche Charakteristika testu: Set AMPLICOR HPV vyráběný firmou Roche je určený pro detekci vysoko-rizikových typů lidských
Konečná zpráva hodnocení různých způsobů přípravy vzorků pro AMPLICOR HPV test firmy Roche Charakteristika testu: Set AMPLICOR HPV vyráběný firmou Roche je určený pro detekci vysoko-rizikových typů lidských
Metody testování humorální imunity
 Metody testování humorální imunity Co je to humorální imunita? Humorální = látková Buněčné produkty Nespecifická imunita příklady:» Lysozym v slinách, slzách» Sérové proteiny (proteiny akutní fáze)» Komplementový
Metody testování humorální imunity Co je to humorální imunita? Humorální = látková Buněčné produkty Nespecifická imunita příklady:» Lysozym v slinách, slzách» Sérové proteiny (proteiny akutní fáze)» Komplementový
Imunochemické metody. na principu vazby antigenu a protilátky
 Imunochemické metody na principu vazby antigenu a protilátky ANTIGEN (Ag) specifická látka (struktura) vyvolávající imunitní reakci a schopná vazby na protilátku PROTILÁTKA (Ab antibody) molekula bílkoviny
Imunochemické metody na principu vazby antigenu a protilátky ANTIGEN (Ag) specifická látka (struktura) vyvolávající imunitní reakci a schopná vazby na protilátku PROTILÁTKA (Ab antibody) molekula bílkoviny
2) Připravte si 7 sad po pěti zkumavkách. Do všech zkumavek pipetujte 0.2 ml roztoku BAPNA o různé koncentraci podle tabulky.
 CVIČENÍ Z ENZYMOLOGIE 1) Stanovení Michaelisovy konstanty trypsinu pomocí chromogenního substrátu. Aktivita trypsinu se určí změřením rychlosti hydrolýzy chromogenního substrátu BAPNA (Nα-benzoyl-L-arginin-p-nitroanilid)
CVIČENÍ Z ENZYMOLOGIE 1) Stanovení Michaelisovy konstanty trypsinu pomocí chromogenního substrátu. Aktivita trypsinu se určí změřením rychlosti hydrolýzy chromogenního substrátu BAPNA (Nα-benzoyl-L-arginin-p-nitroanilid)
1. Příloha 1 Návod úlohy pro Pokročilé praktikum z biochemie I
 1. Příloha 1 Návod úlohy pro Pokročilé praktikum z biochemie I Vazba bromfenolové modři na sérový albumin Princip úlohy Albumin má unikátní vlastnost vázat menší molekuly mnoha typů. Díky struktuře, tvořené
1. Příloha 1 Návod úlohy pro Pokročilé praktikum z biochemie I Vazba bromfenolové modři na sérový albumin Princip úlohy Albumin má unikátní vlastnost vázat menší molekuly mnoha typů. Díky struktuře, tvořené
Řasový test ekotoxicity na mikrotitračních destičkách
 Řasový test ekotoxicity na mikrotitračních destičkách 1 Účel Řasové testy toxicity slouží k testování možných toxických účinků látek a vzorků na vodní producenty. Zelené řasy patří do skupiny necévnatých
Řasový test ekotoxicity na mikrotitračních destičkách 1 Účel Řasové testy toxicity slouží k testování možných toxických účinků látek a vzorků na vodní producenty. Zelené řasy patří do skupiny necévnatých
RNDr. Ivana Fellnerová, Ph.D. Katedra zoologie PřF UP Olomouc 2008/11. *Ivana FELLNEROVÁ, PřF UP Olomouc*
 RNDr. Ivana Fellnerová, Ph.D. Katedra zoologie PřF UP Olomouc 2008/11 Prezentace navazuje na základní znalosti z biochemie (lipidy, proteiny, sacharidy) Rozšiřuje přednášky: Stavba cytoplazmatické membrány
RNDr. Ivana Fellnerová, Ph.D. Katedra zoologie PřF UP Olomouc 2008/11 Prezentace navazuje na základní znalosti z biochemie (lipidy, proteiny, sacharidy) Rozšiřuje přednášky: Stavba cytoplazmatické membrány
DIAGNOSTIKA INFEKČNÍCH CHOROB KULTIVACE V LABORATORNÍCH PODMÍNKÁCH
 STŘEDNÍ ZDRAVOTNICKÁ ŠKOLA A VYŠŠÍ ODBORNÁ ŠKOLA ZDRAVOTNICKÁ ŽĎÁR NAD SÁZAVOU DIAGNOSTIKA INFEKČNÍCH CHOROB KULTIVACE V LABORATORNÍCH PODMÍNKÁCH MGR. IVA COUFALOVÁ DIAGNOSTIKA INFEKČNÍCH CHOROB KULTIVACE
STŘEDNÍ ZDRAVOTNICKÁ ŠKOLA A VYŠŠÍ ODBORNÁ ŠKOLA ZDRAVOTNICKÁ ŽĎÁR NAD SÁZAVOU DIAGNOSTIKA INFEKČNÍCH CHOROB KULTIVACE V LABORATORNÍCH PODMÍNKÁCH MGR. IVA COUFALOVÁ DIAGNOSTIKA INFEKČNÍCH CHOROB KULTIVACE
HbA1c. Axis - Shield. Společnost je zapsána v obchodním rejstříku Městského soudu v Praze, odd. C vložka 1299
 Lékařská technika a speciální zdravotní materiál Společnost je zapsána v obchodním rejstříku Městského soudu v Praze, odd. C vložka 1299 Obchodní 110, 251 70 Praha Čestlice Tel. +420 296 328 300 Fax. +420
Lékařská technika a speciální zdravotní materiál Společnost je zapsána v obchodním rejstříku Městského soudu v Praze, odd. C vložka 1299 Obchodní 110, 251 70 Praha Čestlice Tel. +420 296 328 300 Fax. +420
KREVNÍ ELEMENTY, PLAZMA. Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje
 KREVNÍ ELEMENTY, PLAZMA Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Leden 2010 Mgr. Jitka Fuchsová KREV Červená, neprůhledná, vazká tekutina Skládá
KREVNÍ ELEMENTY, PLAZMA Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Leden 2010 Mgr. Jitka Fuchsová KREV Červená, neprůhledná, vazká tekutina Skládá
IZOLACE, SEPARACE A DETEKCE PROTEINŮ I. Vlasta Němcová, Michael Jelínek, Jan Šrámek
 IZOLACE, SEPARACE A DETEKCE PROTEINŮ I Vlasta Němcová, Michael Jelínek, Jan Šrámek Studium aktinu, mikrofilamentární složky cytoskeletu pomocí dvou metod: detekce přímo v buňkách - fluorescenční barvení
IZOLACE, SEPARACE A DETEKCE PROTEINŮ I Vlasta Němcová, Michael Jelínek, Jan Šrámek Studium aktinu, mikrofilamentární složky cytoskeletu pomocí dvou metod: detekce přímo v buňkách - fluorescenční barvení
Protokol 04. pšeničná bílkovina. masné výrobky. zkrácená verze
 1 Popis vzorku Podle protokolu č. 04 lze vyšetřit vzorky různých druhů masných výrobků na přítomnost pšeničné bílkoviny. 2 Detekční limit vyšetření Přítomnost pšeničné bílkoviny lze spolehlivě prokázat,
1 Popis vzorku Podle protokolu č. 04 lze vyšetřit vzorky různých druhů masných výrobků na přítomnost pšeničné bílkoviny. 2 Detekční limit vyšetření Přítomnost pšeničné bílkoviny lze spolehlivě prokázat,
Hematologická vyšetření krve. Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje
 Hematologická vyšetření krve Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Bc. Hrušková Jindřiška duben 2009 Hematologická vyšetření Provádí je hematologicko-transfúzní
Hematologická vyšetření krve Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Bc. Hrušková Jindřiška duben 2009 Hematologická vyšetření Provádí je hematologicko-transfúzní
Imunologické metody fagocytóza, stanovení oxidačního metabolismu, chemiluminiscence, baktericidní test
 Imunologické metody fagocytóza, stanovení oxidačního metabolismu, chemiluminiscence, baktericidní test Fagocytóza Jeden z evolučně nejstarších obranných mechanismů Součást přirozené imunity Schopnost buněk
Imunologické metody fagocytóza, stanovení oxidačního metabolismu, chemiluminiscence, baktericidní test Fagocytóza Jeden z evolučně nejstarších obranných mechanismů Součást přirozené imunity Schopnost buněk
Úloha č. 1 Odměřování objemů, ředění roztoků Strana 1. Úkol 1. Ředění roztoků. Teoretický úvod - viz návod
 Úloha č. 1 Odměřování objemů, ředění roztoků Strana 1 Teoretický úvod Uveďte vzorec pro: výpočet směrodatné odchylky výpočet relativní chyby měření [%] Použitý materiál, pomůcky a přístroje Úkol 1. Ředění
Úloha č. 1 Odměřování objemů, ředění roztoků Strana 1 Teoretický úvod Uveďte vzorec pro: výpočet směrodatné odchylky výpočet relativní chyby měření [%] Použitý materiál, pomůcky a přístroje Úkol 1. Ředění
(III.) Sedimentace červených krvinek. červených krvinek. (IV.) Stanovení osmotické rezistence. Fyziologie I - cvičení
 (III.) Sedimentace červených krvinek (IV.) Stanovení osmotické rezistence červených krvinek Fyziologie I cvičení Fyziologický ústav LF MU, 2015 Michal Hendrych, Tibor Stračina Sedimentace erytrocytů fyzikální
(III.) Sedimentace červených krvinek (IV.) Stanovení osmotické rezistence červených krvinek Fyziologie I cvičení Fyziologický ústav LF MU, 2015 Michal Hendrych, Tibor Stračina Sedimentace erytrocytů fyzikální
ZÁSADY SPRÁVNÉ LABORATORNÍ PRAXE VYBRANÁ USTANOVENÍ PRAKTICKÉ APLIKACE
 ZÁSADY SPRÁVNÉ LABORATORNÍ PRAXE VYBRANÁ USTANOVENÍ PRAKTICKÉ APLIKACE Zabezpečování jakosti v laboratorní praxi je významnou součástí práce každé laboratoře. Problematiku jakosti řeší řada předpisů, z
ZÁSADY SPRÁVNÉ LABORATORNÍ PRAXE VYBRANÁ USTANOVENÍ PRAKTICKÉ APLIKACE Zabezpečování jakosti v laboratorní praxi je významnou součástí práce každé laboratoře. Problematiku jakosti řeší řada předpisů, z
strojů umožň lní vstupní infiltraci Mgr. Silvie Dudová, RNDr. Iva Burešová, Drahomíra Kyjovská
 Možnosti a změny při p i zpracování vzorků kostní dřeně po aktivaci přístrojp strojů umožň žňujících ch selekci MM buněk k ve vysoké čistotě i při p i minimáln lní vstupní infiltraci Mgr. Silvie Dudová,
Možnosti a změny při p i zpracování vzorků kostní dřeně po aktivaci přístrojp strojů umožň žňujících ch selekci MM buněk k ve vysoké čistotě i při p i minimáln lní vstupní infiltraci Mgr. Silvie Dudová,
Příprava půd pro diskovou difuzní metodu EUCAST a pro vyšetření hodnot MIC bujonovou mikrodiluční metodou. Změny proti předchozí verzi (v. 4.
 Version 5.0 January 2017 Příprava půd pro diskovou difuzní metodu EUCAST a pro vyšetření hodnot MIC bujonovou mikrodiluční metodou. Změny proti předchozí verzi (v. 4.0) A. Půdy pro diskovou difuzní metodu
Version 5.0 January 2017 Příprava půd pro diskovou difuzní metodu EUCAST a pro vyšetření hodnot MIC bujonovou mikrodiluční metodou. Změny proti předchozí verzi (v. 4.0) A. Půdy pro diskovou difuzní metodu
LTK.615 PŘÍBALOVÝ LETÁK
 LTK.615 PŘÍBALOVÝ LETÁK Pro diagnostické použití in vitro PI-LT.615-CZ-V4 Informace o použití Účel použití Zkumavky Leucosep jsou určeny k odběru a separaci periferních mononukleárních buněk (PBMC) z plné
LTK.615 PŘÍBALOVÝ LETÁK Pro diagnostické použití in vitro PI-LT.615-CZ-V4 Informace o použití Účel použití Zkumavky Leucosep jsou určeny k odběru a separaci periferních mononukleárních buněk (PBMC) z plné
Aspartátaminotransferáza (AST)
 1 Aspartátaminotransferáza (AST) AST je buněčný enzym přítomný v řadě tkání, jako jsou srdce, kosterní svaly, ledviny, mozek, játra, pankreas či erytrocyty. Vyskytuje se ve dvou izoformách, cytoplazmatické
1 Aspartátaminotransferáza (AST) AST je buněčný enzym přítomný v řadě tkání, jako jsou srdce, kosterní svaly, ledviny, mozek, játra, pankreas či erytrocyty. Vyskytuje se ve dvou izoformách, cytoplazmatické
5. Bioreaktory. Schematicky jsou jednotlivé typy bioreaktorů znázorněny na obr. 5.1. Nejpoužívanějšími bioreaktory jsou míchací tanky.
 5. Bioreaktory Bioreaktor (fermentor) je nejdůležitější částí výrobní linky biotechnologického procesu. Jde o nádobu různého objemu, ve které probíhá biologický proces. Dochází zde k růstu buněk a tvorbě
5. Bioreaktory Bioreaktor (fermentor) je nejdůležitější částí výrobní linky biotechnologického procesu. Jde o nádobu různého objemu, ve které probíhá biologický proces. Dochází zde k růstu buněk a tvorbě
Vybraná vyšetření u pacientů s diabetes mellitus
 ÚSTAV LÉKAŘSKÉ BIOCHEMIE A LABORATORNÍ DIAGNOSTIKY 1. LF UK Vybraná vyšetření u pacientů s diabetes mellitus Praktické cvičení z lékařské biochemie Všeobecné lékařství Martin Vejražka 2018/19 Obsah 1.
ÚSTAV LÉKAŘSKÉ BIOCHEMIE A LABORATORNÍ DIAGNOSTIKY 1. LF UK Vybraná vyšetření u pacientů s diabetes mellitus Praktické cvičení z lékařské biochemie Všeobecné lékařství Martin Vejražka 2018/19 Obsah 1.
Ž i v o t n o s t (= životaschopnost = vitalita = viabilita)
 Ž i v o t n o s t (= životaschopnost = vitalita = viabilita) počet živých buněk. 100 = ---------------------------------------- [%] počet všech buněk V y u ž i t í : při kultivaci buněk pro různé účely
Ž i v o t n o s t (= životaschopnost = vitalita = viabilita) počet živých buněk. 100 = ---------------------------------------- [%] počet všech buněk V y u ž i t í : při kultivaci buněk pro různé účely
1. Metodika. Protokol č. F1-4 Metodika: Srovnávací analýza efektivity přípravy rekombinantního proteinu ve fermentoru
 Protokol č.: F1-4 Datum: 20.12.2010 Metodika: analýza efektivity přípravy výběr z výsledků ze zkušebních provozů výroby antigenů. Vypracoval: Ing. Václav Filištein, Mgr. Tereza Chrudimská, Spolupracující
Protokol č.: F1-4 Datum: 20.12.2010 Metodika: analýza efektivity přípravy výběr z výsledků ze zkušebních provozů výroby antigenů. Vypracoval: Ing. Václav Filištein, Mgr. Tereza Chrudimská, Spolupracující
KREV. Autor: Mgr. Anna Kotvrdová 29. 8. 2012
 KREV Autor: Mgr. Anna Kotvrdová 29. 8. 2012 KREV Vzdělávací oblast: Somatologie Tematický okruh: Krev Mezioborové přesahy a vazby: Ošetřovatelství, Klinická propedeutika, První pomoc, Biologie, Vybrané
KREV Autor: Mgr. Anna Kotvrdová 29. 8. 2012 KREV Vzdělávací oblast: Somatologie Tematický okruh: Krev Mezioborové přesahy a vazby: Ošetřovatelství, Klinická propedeutika, První pomoc, Biologie, Vybrané
Název školy: Střední odborná škola stavební Karlovy Vary Sabinovo náměstí 16, 360 09 Karlovy Vary Autor: Hana Turoňová Název materiálu:
 Název školy: Střední odborná škola stavební Karlovy Vary Sabinovo náměstí 16, 360 09 Karlovy Vary Autor: Hana Turoňová Název materiálu: VY_32_INOVACE_12_TĚLNÍ TEKUTINY_P1-2 Číslo projektu: CZ 1.07/1.5.00/34.1077
Název školy: Střední odborná škola stavební Karlovy Vary Sabinovo náměstí 16, 360 09 Karlovy Vary Autor: Hana Turoňová Název materiálu: VY_32_INOVACE_12_TĚLNÍ TEKUTINY_P1-2 Číslo projektu: CZ 1.07/1.5.00/34.1077
Jednotné pracovní postupy zkoušení krmiv STANOVENÍ OBSAHU KVASINEK RODU SACCHAROMYCES
 Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU KVASINEK RODU SACCHAROMYCES 1 Rozsah a účel Metodika slouží ke stanovení počtu probiotických kvasinek v doplňkových látkách, premixech a krmivech.
Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU KVASINEK RODU SACCHAROMYCES 1 Rozsah a účel Metodika slouží ke stanovení počtu probiotických kvasinek v doplňkových látkách, premixech a krmivech.
Cvičení 5: VYŠETŘENÍ KRVE Jméno: PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU - KREVNÍ NÁTĚR
 Cvičení 5: VYŠETŘENÍ KRVE Jméno: Skupina: PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU - KREVNÍ NÁTĚR Praktický úkol: 1. K jedné straně podložního skla kápněte malou kapku savčí krve. 2. Před kapku přiložte
Cvičení 5: VYŠETŘENÍ KRVE Jméno: Skupina: PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU - KREVNÍ NÁTĚR Praktický úkol: 1. K jedné straně podložního skla kápněte malou kapku savčí krve. 2. Před kapku přiložte
MUKOADHEZIVNÍ ORÁLNÍ FILMY
 Návod na cvičení pro skupinu č. 1 MUKOADHEZIVNÍ ORÁLNÍ FILMY Cílem praktické části cvičení je příprava a hodnocení dvou druhů MOF: MOF-A: 4 % sodná sůl karboxymethylcelulosy (NaCMC), 3 % glycerol, ad 100
Návod na cvičení pro skupinu č. 1 MUKOADHEZIVNÍ ORÁLNÍ FILMY Cílem praktické části cvičení je příprava a hodnocení dvou druhů MOF: MOF-A: 4 % sodná sůl karboxymethylcelulosy (NaCMC), 3 % glycerol, ad 100
CZ.1.07/1.5.00/ Člověk a příroda
 GYMNÁZIUM TÝN NAD VLTAVOU, HAVLÍČKOVA 13 Číslo projektu Číslo a název šablony klíčové aktivity Tematická oblast CZ.1.07/1.5.00/34.0437 III/2- Inovace a zkvalitnění výuky prostřednictvím IVT Člověk a příroda
GYMNÁZIUM TÝN NAD VLTAVOU, HAVLÍČKOVA 13 Číslo projektu Číslo a název šablony klíčové aktivity Tematická oblast CZ.1.07/1.5.00/34.0437 III/2- Inovace a zkvalitnění výuky prostřednictvím IVT Člověk a příroda
OBĚHOVÁ SOUSTAVA TĚLNÍ TEKUTINY
 OBĚHOVÁ SOUSTAVA TĚLNÍ TEKUTINY obr. č. 1 TĚLNÍ TEKUTINY tkáňový mok, krev a míza = tekutá tkáň funkce: zajišťují stálost vnitřního prostředí úprava koncentrace rozpuštěných látek, ph, teploty TĚLNÍ TEKUTINY
OBĚHOVÁ SOUSTAVA TĚLNÍ TEKUTINY obr. č. 1 TĚLNÍ TEKUTINY tkáňový mok, krev a míza = tekutá tkáň funkce: zajišťují stálost vnitřního prostředí úprava koncentrace rozpuštěných látek, ph, teploty TĚLNÍ TEKUTINY
Biochemická laboratoř
 Biochemická laboratoř školní rok 2013/14 Ing. Jarmila Krotká 3. LF UK, Klinická biochemie, bakalářské studium Hlavní úkol biochemické laboratoře Na základě požadavku lékaře vydat co nejdříve správný výsledek
Biochemická laboratoř školní rok 2013/14 Ing. Jarmila Krotká 3. LF UK, Klinická biochemie, bakalářské studium Hlavní úkol biochemické laboratoře Na základě požadavku lékaře vydat co nejdříve správný výsledek
urychlit sedimentaci pevných částic v hustota, viskozita
 Centrifugace Literatura Centrifugace Důvodem použití centrifug je nutnost urychlit sedimentaci pevných částic v kapalném prostředí. Nasedimentacimávliv 1. vlastnost látky: velikost, tvar, hustota 2. vlastnost
Centrifugace Literatura Centrifugace Důvodem použití centrifug je nutnost urychlit sedimentaci pevných částic v kapalném prostředí. Nasedimentacimávliv 1. vlastnost látky: velikost, tvar, hustota 2. vlastnost
Jednotné pracovní postupy zkoušení krmiv STANOVENÍ OBSAHU SELENU METODOU ICP-OES
 Strana 1 STANOVENÍ OBSAHU SELENU METODOU ICP-OES 1 Rozsah a účel Postup specifikuje podmínky pro stanovení celkového obsahu selenu v minerálních krmivech a premixech metodou optické emisní spektrometrie
Strana 1 STANOVENÍ OBSAHU SELENU METODOU ICP-OES 1 Rozsah a účel Postup specifikuje podmínky pro stanovení celkového obsahu selenu v minerálních krmivech a premixech metodou optické emisní spektrometrie
Základy fotometrie, využití v klinické biochemii
 Základy fotometrie, využití v klinické biochemii Základní vztahy ve fotometrii transmitance (propustnost): T = I / I 0 absorbance: A = log (I 0 / I) = log (1 / T) = log T Lambertův-Beerův zákon A l = e
Základy fotometrie, využití v klinické biochemii Základní vztahy ve fotometrii transmitance (propustnost): T = I / I 0 absorbance: A = log (I 0 / I) = log (1 / T) = log T Lambertův-Beerův zákon A l = e
Anotace: Materiál je určen k výuce přírodopisu v 8. ročníku ZŠ. Seznamuje žáky se základními pojmy a informacemi o složení a funkci tělních tekutin.
 Anotace: Materiál je určen k výuce přírodopisu v 8. ročníku ZŠ. Seznamuje žáky se základními pojmy a informacemi o složení a funkci tělních tekutin. Materiál je plně funkční pouze s použitím internetu.
Anotace: Materiál je určen k výuce přírodopisu v 8. ročníku ZŠ. Seznamuje žáky se základními pojmy a informacemi o složení a funkci tělních tekutin. Materiál je plně funkční pouze s použitím internetu.
Víme, co vám nabízíme
 PDF vygenerováno: 30.12.2016 5:20: Katalog / Laboratorní pomůcky / ace / Nástavce a filtrační špičky na injekční stříkačky Nástavec filtrační na injekční stříkačky MACHEREY-NAGEL Jednoúčelové nástavce
PDF vygenerováno: 30.12.2016 5:20: Katalog / Laboratorní pomůcky / ace / Nástavce a filtrační špičky na injekční stříkačky Nástavec filtrační na injekční stříkačky MACHEREY-NAGEL Jednoúčelové nástavce
VÝZNAM NĚKTERÝCH FAKTORŮ PREANALYTICKÉ FÁZE V MOLEKULÁRNÍ BIOLOGII
 VÝZNAM NĚKTERÝCH FAKTORŮ PREANALYTICKÉ FÁZE V MOLEKULÁRNÍ BIOLOGII Plíšková L., Hrochová K., Kutová R. Ústav klinické biochemie a diagnostiky FN Hradec Králové PREANALYTICKÁ FÁZE V MOLEKULÁRNÍ BIOLOGII
VÝZNAM NĚKTERÝCH FAKTORŮ PREANALYTICKÉ FÁZE V MOLEKULÁRNÍ BIOLOGII Plíšková L., Hrochová K., Kutová R. Ústav klinické biochemie a diagnostiky FN Hradec Králové PREANALYTICKÁ FÁZE V MOLEKULÁRNÍ BIOLOGII
Zkumavky Leucosep LTK.615 PŘÍBALOVÁ INFORMACE. Pro diagnostické použití in vitro PI-LT.615-CZ-V3
 Zkumavky Leucosep LTK.615 PŘÍBALOVÁ INFORMACE Pro diagnostické použití in vitro PI-LT.615-CZ-V3 Informace pro použití Použití Zkumavky Leucosep jsou určeny k odběru a separaci periferních mononukleárních
Zkumavky Leucosep LTK.615 PŘÍBALOVÁ INFORMACE Pro diagnostické použití in vitro PI-LT.615-CZ-V3 Informace pro použití Použití Zkumavky Leucosep jsou určeny k odběru a separaci periferních mononukleárních
Zkouška inhibice růstu řas
 Zkouška inhibice růstu řas VYPRACOVALI: TEREZA DVOŘÁKOVÁ JINDŘICH ŠMÍD Porovnáváme : Zkouška inhibice růstu sladkovodních řas Scenedesmus subspicatus a Senastrum capricornutum : sekce C.3. Zkouška inhibice
Zkouška inhibice růstu řas VYPRACOVALI: TEREZA DVOŘÁKOVÁ JINDŘICH ŠMÍD Porovnáváme : Zkouška inhibice růstu sladkovodních řas Scenedesmus subspicatus a Senastrum capricornutum : sekce C.3. Zkouška inhibice
urychlit sedimentaci pevných částic v hustota, viskozita
 Centrifugace Literatura Centrifugace Důvodem použití centrifug je nutnost urychlit sedimentaci pevných částic v kapalném prostředí. Nasedimentacimávliv 1. vlastnost látky: velikost, tvar, hustota 2. vlastnost
Centrifugace Literatura Centrifugace Důvodem použití centrifug je nutnost urychlit sedimentaci pevných částic v kapalném prostředí. Nasedimentacimávliv 1. vlastnost látky: velikost, tvar, hustota 2. vlastnost
PŘEHLED OBECNÉ HISTOLOGIE
 PŘEDMLUVA 8 1. ZÁKLADY HISTOLOGICKÉ TECHNIKY 9 1.1 Světelný mikroskop a příprava vzorků pro vyšetření (D. Horký) 9 1.1.1 Světelný mikroskop 9 1.1.2 Zásady správného mikroskopování 10 1.1.3 Nejčastější
PŘEDMLUVA 8 1. ZÁKLADY HISTOLOGICKÉ TECHNIKY 9 1.1 Světelný mikroskop a příprava vzorků pro vyšetření (D. Horký) 9 1.1.1 Světelný mikroskop 9 1.1.2 Zásady správného mikroskopování 10 1.1.3 Nejčastější
Krev a míza. Napsal uživatel Zemanová Veronika Pondělí, 01 Březen 2010 12:07
 Krev je součástí vnitřního prostředí organizmu, je hlavní mimobuněčnou tekutinou. Zajišťuje životní pochody v buňkách, účastní se pochodů, jež vytvářejí a udržují stálé vnitřní prostředí v organizmu, přímo
Krev je součástí vnitřního prostředí organizmu, je hlavní mimobuněčnou tekutinou. Zajišťuje životní pochody v buňkách, účastní se pochodů, jež vytvářejí a udržují stálé vnitřní prostředí v organizmu, přímo
STANOVENÍ MYKOTOXINŮ V OBILOVINÁCH METODOU ELISA
 Národní referenční laboratoř Strana 1 STANOVENÍ MYKOTOXINŮ V OBILOVINÁCH METODOU ELISA 1 Účel a rozsah Metoda specifikuje podmínky pro stanovení přítomnosti, případně obsahu jednotlivých mykotoxinů metodou
Národní referenční laboratoř Strana 1 STANOVENÍ MYKOTOXINŮ V OBILOVINÁCH METODOU ELISA 1 Účel a rozsah Metoda specifikuje podmínky pro stanovení přítomnosti, případně obsahu jednotlivých mykotoxinů metodou
Jednotné pracovní postupy zkoušení krmiv STANOVENÍ OBSAHU MYKOTOXINŮ METODOU LC-MS - FUMONISIN B 1 A B 2
 Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU MYKOTOXINŮ METODOU LC-MS - FUMONISIN B 1 A B 2 1 Rozsah a účel Metoda je vhodná pro stanovení fumonisinů B 1 a B 2 v krmivech. 2 Princip Fumonisiny
Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU MYKOTOXINŮ METODOU LC-MS - FUMONISIN B 1 A B 2 1 Rozsah a účel Metoda je vhodná pro stanovení fumonisinů B 1 a B 2 v krmivech. 2 Princip Fumonisiny
CS Úřední věstník Evropské unie L 54/89
 26.2.2009 CS Úřední věstník Evropské unie L 54/89 c) při vlnové délce mezi 230 a 320 nm se nesmí spektrum vzestupné části, vrcholu a sestupné části píku zkoušeného vzorku lišit od ostatních částí spektra
26.2.2009 CS Úřední věstník Evropské unie L 54/89 c) při vlnové délce mezi 230 a 320 nm se nesmí spektrum vzestupné části, vrcholu a sestupné části píku zkoušeného vzorku lišit od ostatních částí spektra
Jednotné pracovní postupy zkoušení krmiv STANOVENÍ OBSAHU 5-VINYL - 2-THIOOXAZOLIDONU (GOITRINU) METODOU GC
 Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU 5-VINYL - 2-THIOOXAZOLIDONU (GOITRINU) METODOU GC 1 Rozsah a účel Metoda specifikuje podmínky pro stanovení vinylthiooxazolidonu (dále VOT) v krmivech.
Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU 5-VINYL - 2-THIOOXAZOLIDONU (GOITRINU) METODOU GC 1 Rozsah a účel Metoda specifikuje podmínky pro stanovení vinylthiooxazolidonu (dále VOT) v krmivech.
Jednotné pracovní postupy zkoušení krmiv STANOVENÍ OBSAHU KOBALTU METODOU ICP-MS
 Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU KOBALTU METODOU ICP-MS 1 Rozsah a účel Metoda specifikuje podmínky pro stanovení celkového obsahu kobaltu v krmivech metodou hmotnostní spektrometrie
Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU KOBALTU METODOU ICP-MS 1 Rozsah a účel Metoda specifikuje podmínky pro stanovení celkového obsahu kobaltu v krmivech metodou hmotnostní spektrometrie
SPC NH_OKL 02 Metody hematologie
 Strana č./celkem stran: 1/9 Obsah Anti-Xa aktivita LMWH ( anti-xa aktivita nízkomolekulárního heparinu)... 1 AT Antitrombin... 2 APTT (aktivovaný parciální tromboplastinový test) poměr... 2 D - dimery...
Strana č./celkem stran: 1/9 Obsah Anti-Xa aktivita LMWH ( anti-xa aktivita nízkomolekulárního heparinu)... 1 AT Antitrombin... 2 APTT (aktivovaný parciální tromboplastinový test) poměr... 2 D - dimery...
Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti ELEKTROMIGRAČNÍ METODY
 Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti ELEKTROMIGRAČNÍ METODY ELEKTROFORÉZA K čemu to je? kritérium čistoty preparátu stanovení molekulové hmotnosti makromolekul stanovení izoelektrického
Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti ELEKTROMIGRAČNÍ METODY ELEKTROFORÉZA K čemu to je? kritérium čistoty preparátu stanovení molekulové hmotnosti makromolekul stanovení izoelektrického
Cvičení 4: CHEMICKÉ SLOŽENÍ BUŇKY, PROKARYOTA Jméno: PROKARYOTA PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU ROZTĚR BAKTERIÍ
 Cvičení 4: CHEMICKÉ SLOŽENÍ BUŇKY, PROKARYOTA Jméno: Skupina: PROKARYOTA PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU ROZTĚR BAKTERIÍ Praktický úkol: bakterie (koky, tyčky) vyžíhejte bakteriologickou kličku
Cvičení 4: CHEMICKÉ SLOŽENÍ BUŇKY, PROKARYOTA Jméno: Skupina: PROKARYOTA PŘÍPRAVA TRVALÉHO PREPARÁTU SUCHOU CESTOU ROZTĚR BAKTERIÍ Praktický úkol: bakterie (koky, tyčky) vyžíhejte bakteriologickou kličku
Moderní nástroje pro zobrazování biologicky významných molekul pro zajištění zdraví. René Kizek
 Moderní nástroje pro zobrazování biologicky významných molekul pro zajištění zdraví René Kizek 12.04.2013 Fluorescence je fyzikálně chemický děj, který je typem luminiscence. Luminiscence se dále dělí
Moderní nástroje pro zobrazování biologicky významných molekul pro zajištění zdraví René Kizek 12.04.2013 Fluorescence je fyzikálně chemický děj, který je typem luminiscence. Luminiscence se dále dělí
SPC NH_OKL 02 Metody hematologie
 Strana č./celkem stran: 1/8 Obsah Anti-Xa aktivita LMWH ( anti-xa aktivita nízkomolekulárního heparinu)... 1 AT Antitrombin... 2 APTT (aktivovaný parciální tromboplastinový test) poměr... 2 D - dimery...
Strana č./celkem stran: 1/8 Obsah Anti-Xa aktivita LMWH ( anti-xa aktivita nízkomolekulárního heparinu)... 1 AT Antitrombin... 2 APTT (aktivovaný parciální tromboplastinový test) poměr... 2 D - dimery...
Bunka a bunecné interakce v patogeneze tkánového poškození
 Bunka a bunecné interakce v patogeneze tkánového poškození bunka - stejná genetická výbava - funkce (proliferace, produkce látek atd.) závisí na diferenciaci diferenciace tkán - specializovaná produkce
Bunka a bunecné interakce v patogeneze tkánového poškození bunka - stejná genetická výbava - funkce (proliferace, produkce látek atd.) závisí na diferenciaci diferenciace tkán - specializovaná produkce
5.06 Teichmanovy krystaly (důkaz krve). Projekt Trojlístek
 5. Forenzní chemie (chemie v kriminalistice) 5.06 Teichmanovy krystaly (důkaz krve). Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2.
5. Forenzní chemie (chemie v kriminalistice) 5.06 Teichmanovy krystaly (důkaz krve). Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2.
METODY VYŠETŘOVÁNÍ BUNĚČNÉ IMUNITY. Veřejné zdravotnictví
 METODY VYŠETŘOVÁNÍ BUNĚČNÉ IMUNITY Veřejné zdravotnictví METODY VYŠETŘOVÁNÍ BUNĚČNÉ IMUNITY průtoková cytometrie metody stanovení funkční aktivity lymfocytů testy fagocytárních funkcí Průtoková cytometrie
METODY VYŠETŘOVÁNÍ BUNĚČNÉ IMUNITY Veřejné zdravotnictví METODY VYŠETŘOVÁNÍ BUNĚČNÉ IMUNITY průtoková cytometrie metody stanovení funkční aktivity lymfocytů testy fagocytárních funkcí Průtoková cytometrie
Test aktivity a cytotoxicity lymfocytů
 Test aktivity a cytotoxicity lymfocytů Teorie: Proliferace je jedním z fyziologických jevů buněčné aktivace. Existuje několik způsobů zjišťování aktivity lymfocytů. Jedna z nejznámějších je použitím radioaktivně
Test aktivity a cytotoxicity lymfocytů Teorie: Proliferace je jedním z fyziologických jevů buněčné aktivace. Existuje několik způsobů zjišťování aktivity lymfocytů. Jedna z nejznámějších je použitím radioaktivně
Jednotné pracovní postupy zkoušení krmiv STANOVENÍ OBSAHU PROBIOTICKÝCH BAKTERIÍ RODU ENTEROCOCCUS
 Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU PROBIOTICKÝCH BAKTERIÍ RODU ENTEROCOCCUS 1 Rozsah a účel Postup slouží ke stanovení počtu probiotických bakterií v doplňkových látkách, premixech
Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU PROBIOTICKÝCH BAKTERIÍ RODU ENTEROCOCCUS 1 Rozsah a účel Postup slouží ke stanovení počtu probiotických bakterií v doplňkových látkách, premixech
Laboratorní cvičení z kinetiky chemických reakcí
 Laboratorní cvičení z kinetiky chemických reakcí LABORATORNÍ CVIČENÍ 1. Téma: Ovlivňování průběhu reakce změnou koncentrace látek. podmínek průběhu reakce. Jednou z nich je změna koncentrace výchozích
Laboratorní cvičení z kinetiky chemických reakcí LABORATORNÍ CVIČENÍ 1. Téma: Ovlivňování průběhu reakce změnou koncentrace látek. podmínek průběhu reakce. Jednou z nich je změna koncentrace výchozích
Biologický materiál je tvořen vzorky tělních tekutin, tělesných sekretů, exkretů a tkání.
 Otázka: Druhy biologického materiálu Předmět: Biologie Přidal(a): moni.ka Druhy biologického materiálu Biologický materiál je tvořen vzorky tělních tekutin, tělesných sekretů, exkretů a tkání. Tělní tekutiny
Otázka: Druhy biologického materiálu Předmět: Biologie Přidal(a): moni.ka Druhy biologického materiálu Biologický materiál je tvořen vzorky tělních tekutin, tělesných sekretů, exkretů a tkání. Tělní tekutiny
Neutralizace kyseliny zásadou
 Neutralizace kyseliny zásadou Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 15 minut Pomůcky a) chemikálie - kyselina chlorovodíková - hydroxid sodný
Neutralizace kyseliny zásadou Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 15 minut Pomůcky a) chemikálie - kyselina chlorovodíková - hydroxid sodný
Životaschopnost. (= vitalita = viabilita) počet živých buněk. 100 = [%] počet všech buněk
![Životaschopnost. (= vitalita = viabilita) počet živých buněk. 100 = [%] počet všech buněk Životaschopnost. (= vitalita = viabilita) počet živých buněk. 100 = [%] počet všech buněk](/thumbs/94/120369223.jpg) Životaschopnost (= vitalita = viabilita) počet živých buněk. 100 = ---------------------------------------- [%] počet všech buněk Využití: při kultivaci buněk pro různé účely (hodnocení cytotoxického účinku,
Životaschopnost (= vitalita = viabilita) počet živých buněk. 100 = ---------------------------------------- [%] počet všech buněk Využití: při kultivaci buněk pro různé účely (hodnocení cytotoxického účinku,
Projekt: Digitální učební materiály ve škole, registrační číslo projektu CZ.1.07/1.5.00/34.0527
 Projekt: Digitální učební materiály ve škole, registrační číslo projektu CZ.1.07/1.5.00/34.0527 Příjemce: Střední zdravotnická škola a Vyšší odborná škola zdravotnická, Husova 3, 371 60 České Budějovice
Projekt: Digitální učební materiály ve škole, registrační číslo projektu CZ.1.07/1.5.00/34.0527 Příjemce: Střední zdravotnická škola a Vyšší odborná škola zdravotnická, Husova 3, 371 60 České Budějovice
VETERINÁRNÍ A FARMACEUTICKÁ UNIVERZITA BRNO FAKULTA VETERINÁRNÍ HYGIENY A EKOLOGIE ÚSTAV EKOLOGIE A CHOROB ZVĚŘE, RYB A VČEL
 VETERINÁRNÍ A FARMACEUTICKÁ UNIVERZITA BRNO FAKULTA VETERINÁRNÍ HYGIENY A EKOLOGIE ÚSTAV EKOLOGIE A CHOROB ZVĚŘE, RYB A VČEL Standardní operační postup - SOP 02 Terestrické testy ekotoxicity Stanovení
VETERINÁRNÍ A FARMACEUTICKÁ UNIVERZITA BRNO FAKULTA VETERINÁRNÍ HYGIENY A EKOLOGIE ÚSTAV EKOLOGIE A CHOROB ZVĚŘE, RYB A VČEL Standardní operační postup - SOP 02 Terestrické testy ekotoxicity Stanovení
NOVÉ NÁMĚTY PRO DEMONSTRAČNÍ POKUSY. Ondřej Maca, Tereza Kudrnová
 NOVÉ NÁMĚTY PRO DEMONSTRAČNÍ POKUSY Ondřej Maca, Tereza Kudrnová HUSTÝ DÝM 1) pro koho: 1. ročník čtyřletého gymnázia 2) zařazení do učiva: vlastnosti látek; halogeny; pentely 3) pomůcky: zkumavka se zátkou,
NOVÉ NÁMĚTY PRO DEMONSTRAČNÍ POKUSY Ondřej Maca, Tereza Kudrnová HUSTÝ DÝM 1) pro koho: 1. ročník čtyřletého gymnázia 2) zařazení do učiva: vlastnosti látek; halogeny; pentely 3) pomůcky: zkumavka se zátkou,
Makrofágy a parazitární infekce
 Makrofágy a parazitární infekce Funkce makrofágů Profesionální fagocyty https://www.youtube.com/watch?v=w0-0bqoge2e Antigen-prezentující buňky (asociace s MHC II glykoproteiny) Producenti cytokinů (IL-12,
Makrofágy a parazitární infekce Funkce makrofágů Profesionální fagocyty https://www.youtube.com/watch?v=w0-0bqoge2e Antigen-prezentující buňky (asociace s MHC II glykoproteiny) Producenti cytokinů (IL-12,
Molekulárně biologické metody v mikrobiologii. Mgr. Martina Sittová Jaro 2014
 Molekulárně biologické metody v mikrobiologii Mgr. Martina Sittová Jaro 2014 Harmonogram 1. den Izolace DNA 2. den Měření koncentrace DNA spektrofotometricky, real-time PCR 3. den Elektroforéza Molekulární
Molekulárně biologické metody v mikrobiologii Mgr. Martina Sittová Jaro 2014 Harmonogram 1. den Izolace DNA 2. den Měření koncentrace DNA spektrofotometricky, real-time PCR 3. den Elektroforéza Molekulární
Krev hem, hema sanquis
 Krev Krev hem, hema - řec., sanquis - lat. Opakování: Vnitřní prostředí člověka - musí být stálé. Tekutiny sloužící metabolismu: - krev (přenos plynů, živin atd.) - tkáňový mok (metabolismus buněk) - lymfa
Krev Krev hem, hema - řec., sanquis - lat. Opakování: Vnitřní prostředí člověka - musí být stálé. Tekutiny sloužící metabolismu: - krev (přenos plynů, živin atd.) - tkáňový mok (metabolismus buněk) - lymfa
