Písomná informácia pre používateľa
|
|
|
- Kateřina Vlčková
- před 7 lety
- Počet zobrazení:
Transkript
1 Písomná informácia pre používateľa Injekčná suspenzia Injekčná suspenzia v naplnenej injekčnej striekačke Očkovacia látka proti kliešťovej encefalitíde (tick borne encephalitis -TBE) (celovírusová, inaktivovaná) Pozorne si prečítajte celú písomnú informáciu skôr, ako dostanete túto očkovaciu látku, pretože obsahuje pre vás dôležité informácie. Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali. Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára alebo lekárnika. Tento liek bol predpísaný vám. Nedávajte ho nikomu inému. Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii pre používateľa. Pozri časť 4. V tejto písomnej informácii pre používateľa sa dozviete: 1 Čo je Injekčná suspenzia a na čo sa používa 2 Čo potrebujete vedieť predtým, ako použijete Injekčnú suspenziu 3 Ako používať Injekčnú suspenziu 4 Možné vedľajšie účinky 5 Ako uchovávať Injekčnú suspenziu 6 Obsah balenia a ďalšie informácie 1. Čo je Injekčná suspenzia a na čo sa používa Injekčná suspenzia je očkovacia látka, ktorá sa používa na prevenciu ochorenia spôsobeného vírusom kliešťovej encefalitídy (tick borne encephalitis - TBE). Je vhodná pre osoby vo veku 16 rokov a staršie. Pôsobením očkovacej látky si telo vytvára svoju vlastnú ochranu (protilátky) pred vírusom. Nechráni pred inými vírusmi a baktériami (niektoré z nich sú tiež prenášané uhryznutím kliešťom), ktoré môžu spôsobiť podobné príznaky. Vírus kliešťovej encefalitídy môže spôsobiť veľmi závažné infekcie mozgu alebo miechy a obalu mozgu. Tieto infekcie sa často začínajú bolesťou hlavy a vysokou teplotou. U niektorých ľudí a v najzávažnejších formách môžu niekedy viesť k strate vedomia, kóme a smrti. Vírus môžu prenášať kliešte. Človek sa nakazí po uhryznutí kliešťom. Možnosť uhryznutia kliešťami, ktoré prenášajú vírus, je veľmi vysoká v rozsiahlych častiach Európy, ako aj strednej a východnej Ázie. Riziko nakazenia sa kliešťovou encefalitídou je u ľudí, ktorí žijú alebo dovolenkujú v týchto častiach sveta. Nie vždy sa kliešte spozorujú na koži a uhryznutia môžu zostať bez povšimnutia. Tak ako všetky očkovacie látky, Injekčná suspenzia nemusí úplne chrániť všetkých zaočkovaných. Jedna dávka očkovacej látky vás pravdepodobne nebude chrániť pred infekciou. Na dosiahnutie optimálnej ochrany potrebujete 3 dávky (viac informácií si pozrite v časti 3). Ochrana netrvá celý život. Sú potrebné pravidelné posilňovacie dávky (viac informácií si pozrite tiež v časti 3). Nie sú k dispozícii údaje o postexpozičnej profylaxii (očkovanie po uhryznutí kliešťom). 1
2 2. Čo potrebujete vedieť predtým, ako použijete Injekčnú suspenziu Nepoužívajte Injekčnú suspenziu ak ste alergický (precitilivený) na liečivo, na ktorúkoľvek z ďalších zložiek, formaldehyd alebo protamíniumsulfát (tieto látky boli použité počas výrobného procesu) alebo na antibiotiká, ako sú neomycín a gentamycín. Napríklad ste mali kožnú vyrážku, opuch tváre a hrdla, dýchacie ťažkosti, modré sfarbenie jazyka alebo pier, nízky krvný tlak a kolaps. ak ste niekedy mali ťažkú alergickú reakciu po zjedení vajca alebo kuracieho mäsa. ak máte akútne ochorenie s horúčkou alebo bez horúčky, možno budete musieť počkať pred tým, ako dostanete Injekčnú suspenziu. Váš lekár vás môže požiadať, aby ste počkali na injekciu až dovtedy, kým sa nebudete cítiť lepšie. Upozornenia a opatrenia Porozprávajte sa so svojím lekárom skôr, ako dostanete očkovaciu látku: keď máte autoimunitné ochorenie (ako je reumatoidná artritída alebo skleróza multiplex) keď máte slabý imunitný systém (a preto nedokážete dobre bojovať proti infekciám) keď sa u vás protilátky nevytvárajú dobre keď užívate lieky proti rakovine keď užívate lieky nazývané kortikosteroidy (ktoré znižujú zápal) keď máte mozgové ochorenie keď viete, že máte alergiu na latex keď máte neurologické poruchy alebo záchvaty. Ak sa vás niektorý z uvedených stavov týka, očkovacia látka nemusí byť pre vás vhodná. Prípadne vám lekár môže podať očkovaciu látku, ale bude chcieť urobiť krvný test, aby si preveril, či očkovacia látka účinkuje. Iné lieky a Injekčná suspenzia Ak užívate alebo ste v poslednom čase užívali ešte iné lieky, vrátane liekov, ktorých výdaj nie je viazaný na lekársky predpis, oznámte to, prosím, svojmu lekárovi alebo lekárnikovi. Váš lekár vám poradí, či môžete dostať Injekčnú suspenziu v rovnakom čase ako iné očkovacie látky. Ak ste v poslednom čase dostali inú očkovaciu látku, váš lekár rozhodne o tom kedy a do akého miesta podať očkovaciu látku Injekčná suspenzia. Ak podstupujete imunosupresívnu liečbu, Injekčná suspenzia vás nemusí úplne ochrániť. Povedzte svojmu lekárovi, ak ste sa niekedy nakazili vírusom žltej zimnice, japonskej encefalitídy, horúčky dengue alebo ak ste boli proti týmto vírusom zaočkovaný. Je to kvôli tomu, že v krvi môžete mať protilátky, ktoré môžu reagovať s vírusom kliešťovej encefalitídy (TBE) používaným v testoch na meranie hladín protilátok. Výsledky týchto testov by potom mohli byť nesprávne. Tehotenstvo, dojčenie a plodnosť Skôr ako dostanete túto injekciu, informujte vášho lekára: keď môžete byť tehotná alebo keď tehotenstvo plánujete, keď dojčíte. Váš lekár sa s vami porozpráva o možných rizikách a prínosoch. Účinok Injekčnej suspenzie počas tehotenstva alebo dojčenia nie je známy. Môže sa však podať, ak je riziko infekcie vysoké. Vedenie vozidla a obsluha strojov Nie je pravdepodobné, že by očkovacia látka mala vplyv na schopnosť osoby viesť vozidlo alebo obsluhovať stroje. Môžete mať však problémy so zrakom alebo môžete pociťovať závrat. 2
3 Injekčná suspenzia obsahuje draslík a sodík. Draslík a sodík sú prítomné v hladinách, ktoré sú nižšie ako 1 mmol na dávku, t.j. v podstate bez draslíka a bez sodíka. 3. Ako používať Injekčnú suspenziu Injekčná suspenzia sa zvyčajne podáva ako injekcia do svalu ramena. Očkovacia látka sa nesmie podať do krvnej cievy. Injekčná suspenzia sa nesmie podať osobám mladším ako 16 rokov. Pre túto vekovú skupinu sa odporúča očkovacia látka proti TBE pre deti. Lekár má zaznamenať podanie očkovacej látky a číslo podanej šarže. Prvá očkovacia schéma Prvá očkovacia schéma pozostáva z troch dávok Injekčnej suspenzie: 1. Váš lekár rozhodne o tom, kedy podať prvú dávku. 2. Druhá injekcia bude podaná o 1 až 3 mesiace neskôr. Môže sa podať po dvoch týždňoch po prvej dávke, ak budete potrebovať rýchlu ochranu. 3. Tretia injekcia bude podaná po 5 až 12 mesiacoch po druhej injekcii. Najlepšie je podať prvú a druhú dávku v zime. Je to kvôli tomu, že kliešť začína byť aktívny na jar. Vďaka tomu sa u vás vyvinie dostatočná ochrana skôr, ako sa začne sezóna kliešťov. Tretia dávka ukončuje základnú očkovaciu schému. Za ideálnych okolností sa má očkovacia schéma ukončiť podaním tretej dávky očkovacej látky v rovnakej sezóne kliešťov alebo najneskôr pred začiatkom nasledujúcej sezóny kliešťov. Poskytuje ochranu až po dobu troch rokov. Ak medzi 3 dávkami necháte uplynúť príliš veľa času, nemusí sa u vás dosiahnuť úplná ochrana pred infekciou. Základná imunizácia Dávka Obvyklá schéma Zrýchlená imunizačná schéma 1. dávka 0,5 ml Zvolený dátum Zvolený dátum 2. dávka 0,5 ml 1 až 3 mesiace po prvom 14 dní po prvom očkovaní očkovaní 3. dávka 0,5 ml 5 až 12 mesiacov po druhom očkovaní Podanie posilňovacích dávok očkovacej látky 5 až 12 mesiacov po druhom očkovaní Osoby vo veku od 16 do 60 rokov Ak ste mladší ako 60 rokov, prvú posilňovaciu dávku budete potrebovať po 3 rokoch po tretej dávke. Ďalšie posilňovacie dávky sa majú podávať každých 5 rokov. Osoby vo veku nad 60 rokov (staršie osoby) Zvyčajne budete potrebovať, aby boli posilňovacie dávky prvá a ďalšie posilňovacie dávky podané s časovým odstupom troch rokov. Posilňovacie dávky od 16 do Dávka Načasovanie 60 rokov Prvá posilňovacia dávka 0,5 ml 3 roky po tretej dávke Následné posilňovacie dávky 0,5 ml 5 rokov po poslednom očkovaní Posilňovacie dávky nad 60 rokov Dávka Načasovanie 3
4 Všetky posilňovacie dávky 0,5 ml 3 roky po poslednom očkovaní Osoby s oslabeným imunitným systémom (vrátane osôb podrobujúcich sa imunosupresívnej liečbe) Váš lekár môže zvážiť vykonanie kontroly hladiny protilátok vo vašej krvi po štyroch týždňoch po druhej dávke a podať ďalšiu dávku, ak sa v tom čase nezistí žiadna imunitná odpoveď. To isté platí pre všetky nasledujúce dávky. Ak použijete viac Injekčnej suspenzie ako máte Je veľmi nepravdepodobné, že by došlo k predávkovaniu, pretože lekár injekciu podá z jednodávkovej injekčnej striekačky. Ak máte ďalšie otázky týkajúce sa použitia tejto očkovacej látky, opýtajte sa svojho lekára alebo lekárnika. 4. Možné vedľajšie účinky Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého. Ak začnete pociťovať akýkoľvek vedľajší účinok ako závažný alebo ak spozorujete vedľajšie účinky, ktoré nie sú uvedené v tejto písomnej informácii pre používateľa, povedzte to, prosím, svojmu lekárovi. Nasledujúce frekvencie (častosti výskytu) sa použili pri hodnotení vedľajších účinkov: Veľmi časté: Časté: Menej časté: Zriedkavé: Veľmi zriedkavé: môžu postihovať viac ako 1 z 10 osôb môžu postihovať menej ako 1 z 10 osôb môžu postihovať menej ako 1 zo 100 osôb môžu postihovať menej ako 1 z 1000 osôb môžu postihovať menej ako 1 z osôb Tak ako u všetkých očkovacích látok, môže dôjsť k závažným alergickým reakciám. Sú veľmi zriedkavé, ale k dispozícii musí byť vždy zodpovedajúca liečba a lekársky dohľad. Príznaky závažných alergických reakcií zahŕňajú: opuch pier, ústnej dutiny, hrdla (ktorý môže spôsobiť ťažkosti pri prehĺtaní alebo dýchaní), vyrážku a opuch rúk, nôh a členkov, stratu vedomia spôsobenú poklesom krvného tlaku. Tieto prejavy alebo príznaky sa zvyčajne objavia veľmi rýchlo po podaní injekcie, a keď je osoba ešte na klinike alebo v ordinácii lekára. Ak sa niektoré z týchto príznakov vyskytnú po tom, ako opustíte miesto, kde vám bola injekcia podaná, musíte sa OKAMŽITE obrátiť na lekára. Nasledujúce vedľajšie účinky boli hlásené: Veľmi časté vedľajšie účinky Bolesť v mieste vpichu Časté vedľajšie účinky Bolesť hlavy Nevoľnosť Bolesť svalov a kĺbov Pocit únavy alebo pocit choroby 4
5 Menej časté vedľajšie účinky Opuch lymfatických žliaz Vracanie Horúčka Modrina v mieste vpichu Zriedkavé vedľajšie účinky Alergické reakcie Spavosť Nevoľnosť pri cestovaní Hnačka Bolesť brucha Začervenanie, stvrdnutie tkaniva, opuch, pálenie, mravčenie a pocit tepla v mieste vpichu Boli hlásené aj nasledujúce vedľajšie účinky z obdobia po uvedení na trh so zriedkavou frekvenciou výskytu: Pásový opar Aktivácia autoimunitných ochorení, napr. skleróza multiplex Alergické reakcie Neurologické poruchy, ako sú encefalomyelitída, zápal centrálnej nervovej sústavy (Guillain- Barrého syndróm) a miechy (meylitída, transverzná myelitída) Zápal mozgu, záchvaty, zápal mozgových blán (vrstiev obaľujúcich mozog) Prejavy podráždenia mozgových blán ako napríklad bolesť a stuhnutosť šije Neurologické príznaky ako sú ochrnutie tváre, paralýza, zápal nervov, neobvyklé alebo znížené vnímanie ako mravčenie alebo necitlivosť, bodavá alebo pulzujúca bolesť pozdĺž jedného alebo viacerých nervov, zápal očného nervu Závrat Poruchy/poškodenie videnia, precitlivenosť na svetlo, bolesť v oku Zvonenie v ušiach Rýchly tlkot srdca Skrátený dych Kožné reakcie (vyrážková a/alebo svrbivá pokožka), dermatitída, začervenanie kože, zvýšené potenie, zápal kože Bolesť chrbta, opuch kĺbov, bolesť šije, stuhnutosť šije a kostrového svalstva, bolesť v rukách a v nohách Triaška, ochorenie podobné chrípke, slabosť, opuch, neistá chôdza, nahromadenie tekutiny pod kožou Bolesť kĺbov v blízkosti miesta vpichu, uzliny a zápal v mieste vpichu Hlásenie vedľajších účinkov Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii pre používateľa. Vedľajšie účinky môžete hlásiť aj priamo prostredníctvom národného systému hlásenia uvedeného v Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti tohto lieku. 5. Ako uchovávať Injekčnú suspenziu Uchovávajte v chladničke (2 C - 8 C). Injekčnú striekačku uchovávajte vo vonkajšom obale na ochranu pred svetlom. Neuchovávajte v mrazničke. Nepoužívajte Injekčnú suspenziu, ak spozorujete akékoľvek viditeľné cudzorodé častice alebo miesta, kde suspenzia vyteká. 5
6 Uchovávajte mimo dohľadu a dosahu detí. Nepoužívajte Injekčnú suspenziu po dátume exspirácie, ktorý je uvedený na škatuli. Dátum exspirácie sa vzťahuje na posledný deň v mesiaci. Lieky sa nesmú likvidovať odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie. 6. Obsah balenia a ďalšie informácie Čo Injekčná suspenzia obsahuje Liečivo je: vírus kliešťovej encefalitídy (kmeň Neudörfl). Jedna dávka (0,5 mililitrov) očkovacej látky obsahuje 2,4 mikrogramov inaktivovaného vírusu kliešťovej encefalitídy (kmeň Neudörfl), ktorý je pomnožený na bunkách kuracích embryí. Ďalšie zložky sú: ľudský albumín, chlorid sodný, dihydrát hydrogenfosforečnanu sodného, dihydrogenfosforečnan draselný, sacharóza a voda na injekciu. Hydroxid hlinitý (hydratovaný) je obsiahnutý v tejto očkovacej látke ako adsorbent. Adsorbenty sú látky obsiahnuté v niektorých očkovacích látkach na urýchlenie, zlepšenie a/alebo predĺženie ochranných účinkov očkovacej látky. Ako vyzerá Injekčná suspenzia a obsah balenia Injekčná suspenzia sa dodáva ako 0,5 mililitrová (jednodávková) injekčná suspenzia v naplnenej injekčnej striekačke s pripojenou alebo bez pripojenej ihly. Balenie Tip Cap (naplnená injekčná striekačka bez pripojenej ihly) môže obsahovať dve ihly rôznej veľkosti. Všetky ihly sú sterilné a určené len na jednorazové použitie. Sú dostupné veľkosti balenia s 1, 10, 20 alebo 100 naplnenými injekčnými striekačkami. Nie všetky veľkosti balenia musia byť uvedené na trh. Suspenzia je po pretrepaní sivobiela a mliečna. Držiteľ rozhodnutia o registrácii a výrobca Držiteľ rozhodnutia o registrácii PFIZER EU PFE MA EEIG Pfizer, Ramsgate Road, Sandwich, Kent, CT13 9NJ, Spojené kráľovstvo Výrobca Pfizer Manufacturing Austria GmbH Uferstrasse Orth an der Donau Rakúsko 6
7 Liek je schválený v členských štátoch Európskeho hospodárskeho priestoru (EHP) pod nasledovnými názvami: Belgicko Bulharko FSME-IMMUN 0.5 ml Česko Dánsko Nemecko FSME-IMMUN Erwachsene Estónsko Grécko TicoVac 0.5 ml Francúzsko ADULTES Írsko TicoVac 0.5 ml Island FSME-IMMUN Vuxen Taliansko Lotyšsko Litva Luxembursko Maďarsko felnőtteknek Holandsko Nórsko TicoVac Rakúsko FSME-Immun 0,5 ml Poľsko FSME-IMMUN 0.5 ml Portugalsko Rumunsko FSME-IMMUN 0.5 ml suspensie injectabila in seringa preumpluta Slovinsko Slovensko Injekčná suspenzia Fínsko TicoVac Švédsko FSME-IMMUN Vuxen Spojené kráľovstvo TicoVac 0.5 ml Táto písomná informácia pre používateľa bola naposledy aktualizovaná v 04/
8 Nasledujúca informácia je určená len pre lekárov a zdravotníckych pracovníkov: Pred podaním musí očkovacia látka dosiahnuť izbovú teplotu. Pred podaním dobre pretrepte, aby sa suspenzia očkovacej látky dôkladne premiešala. Po pretrepaní je Injekčná suspenzia sivobiela, opaleskujúca, homogénna suspenzia. Pred podaním sa očkovacia látka musí opticky skontrolovať na prítomnosť cudzorodých častíc a/alebo zmenu fyzikálneho vzhľadu. V prípade ich výskytu sa očkovacia látka nesmie použiť. Nepoužitý liek alebo odpad vzniknutý z lieku má byť zlikvidovaný v súlade s národnými požiadavkami. Kryt ihly odstráňte nasledovným spôsobom: 1. Uchopte injekčnú striekačku v dolnej časti krytu ihly, fixovaného na sklenenú časť (Obrázok 1). 2. Druhou rukou uchopte hornú časť krytu ihly medzi palec a ukazovák a otočte tak, aby sa zlomil spoj (skontrolujte či je odlomený) (Obrázok 2). 3. Pohybom smerom nahor odstráňte oddelenú časť krytu ihly (Obrázok 3). Po odstránení krytu ihly sa musí Injekčná suspenzia okamžite použiť. Aby nedošlo k strate sterility a/alebo upchatiu ihly, striekačka sa nesmie nechať bez ochranného krytu dlhšiu dobu. Preto sa má ochranný kryt ihly odstrániť až po pretrepaní a bezprostredne pred použitím. Informácia pre podanie striekačkou bez pripojenej ihly: Po odstránení ochranného krytu striekačky ihneď pripojte ihlu a pred podaním odstráňte ochranný kryt ihly. V prípade, že ihla bola pripojená k striekačke, vakcína musí byť okamžite podaná. 8
Písomná informácia pre používateľa. HAVRIX 1440 Dosis adulta HAVRIX 720 Junior monodose
 Písomná informácia pre používateľa HAVRIX 1440 Dosis adulta HAVRIX 720 Junior monodose Injekčná suspenzia Očkovacia látka proti hepatitíde A (inaktivovaná, adsorbovaná) Pozorne si prečítajte celú písomnú
Písomná informácia pre používateľa HAVRIX 1440 Dosis adulta HAVRIX 720 Junior monodose Injekčná suspenzia Očkovacia látka proti hepatitíde A (inaktivovaná, adsorbovaná) Pozorne si prečítajte celú písomnú
(tolkapón) tablety DENNÍK PACIENTA. Pomôže vám dodržiavať pravidelné vyšetrenia funkcie pečene počas prvého roku užívania
 (tolkapón) tablety DENNÍK PACIENTA Pomôže vám dodržiavať pravidelné vyšetrenia funkcie pečene po prvého roku užívania INFORMÁCIE O PACIENTOVI 03 PRED UŽITÍM TASMARU SI, PROSÍM, PREČÍTAJTE NASLEDOVNÉ INFORMÁCIE
(tolkapón) tablety DENNÍK PACIENTA Pomôže vám dodržiavať pravidelné vyšetrenia funkcie pečene po prvého roku užívania INFORMÁCIE O PACIENTOVI 03 PRED UŽITÍM TASMARU SI, PROSÍM, PREČÍTAJTE NASLEDOVNÉ INFORMÁCIE
Písomná informácia pre používateľa
 Schválený text k rozhodnutiu o zmene, ev. číslo: 2015/04584-ZME Písomná informácia pre používateľa Encepur adults 0,5 ml injekčnej suspenzie naplnenej v injekčnej striekačke Očkovacia látka proti kliešťovej
Schválený text k rozhodnutiu o zmene, ev. číslo: 2015/04584-ZME Písomná informácia pre používateľa Encepur adults 0,5 ml injekčnej suspenzie naplnenej v injekčnej striekačke Očkovacia látka proti kliešťovej
Informácie o liečbe Gilenyou (fingolimod), ktoré je dôležité si pamätať
 Informácie o liečbe Gilenyou (fingolimod), ktoré je dôležité si pamätať Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že
Informácie o liečbe Gilenyou (fingolimod), ktoré je dôležité si pamätať Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV. Hidrasec pre deti 30 mg granulát na perorálnu suspenziu. Racekadotril
 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Hidrasec pre deti 30 mg granulát na perorálnu suspenziu Racekadotril Pozorne si prečítajte celú písomnú informáciu predtým, než začnete užívať tento liek, pretože obsahuje
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Hidrasec pre deti 30 mg granulát na perorálnu suspenziu Racekadotril Pozorne si prečítajte celú písomnú informáciu predtým, než začnete užívať tento liek, pretože obsahuje
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA. Septolete extra 1,5 mg/ml + 5 mg/ml orálna roztoková aerodisperzia Benzydamíniumchlorid/Cetylpyridíniumchlorid
 Schválený text k rozhodnutiu o registrácii, ev. č.: 2014/01794-REG PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA Septolete extra 1,5 mg/ml + 5 mg/ml orálna roztoková aerodisperzia Benzydamíniumchlorid/Cetylpyridíniumchlorid
Schválený text k rozhodnutiu o registrácii, ev. č.: 2014/01794-REG PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA Septolete extra 1,5 mg/ml + 5 mg/ml orálna roztoková aerodisperzia Benzydamíniumchlorid/Cetylpyridíniumchlorid
Písomná informácia pre používateľa. DALACIN V 2 % vaginálny krém klindamycín
 Schválený text k rozhodnutiu o zmene, ev. č.: 2011/05682, 2013/05546 Písomná informácia pre používateľa DALACIN V 2 % vaginálny krém klindamycín Pozorne si prečítajte celú písomnú informáciu predtým, ako
Schválený text k rozhodnutiu o zmene, ev. č.: 2011/05682, 2013/05546 Písomná informácia pre používateľa DALACIN V 2 % vaginálny krém klindamycín Pozorne si prečítajte celú písomnú informáciu predtým, ako
Písomná informácia pre používateľa. DALACIN V 2 % vaginálny krém. klindamycín
 Písomná informácia pre používateľa DALACIN V 2 % vaginálny krém klindamycín Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete používať tento liek, pretože obsahuje pre vás dôležité informácie.
Písomná informácia pre používateľa DALACIN V 2 % vaginálny krém klindamycín Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete používať tento liek, pretože obsahuje pre vás dôležité informácie.
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA. Zinkorot tablety Liečivo: dihydrát zinkumorotátu
 Schválený text k rozhodnutiu o prevode, ev.č. 2012/07128 Príloha č. 3 k notifikácii zmeny v registrácii lieku, ev.č. 2012/07129 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA Zinkorot tablety Liečivo: dihydrát zinkumorotátu
Schválený text k rozhodnutiu o prevode, ev.č. 2012/07128 Príloha č. 3 k notifikácii zmeny v registrácii lieku, ev.č. 2012/07129 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA Zinkorot tablety Liečivo: dihydrát zinkumorotátu
Príloha III. Úpravy súhrnu charakteristických vlastností lieku, označenie na obale a písomná informácia je výsledkom postupu preskúmania.
 Príloha III Úprava príslušným častí súhrnu charakteristických vlastností lieku a písomnej informácii pre používateľa Poznámka: Úpravy súhrnu charakteristických vlastností lieku, označenie na obale a písomná
Príloha III Úprava príslušným častí súhrnu charakteristických vlastností lieku a písomnej informácii pre používateľa Poznámka: Úpravy súhrnu charakteristických vlastností lieku, označenie na obale a písomná
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Injekční suspenze v předplněné injekční stříkačce Vakcína proti klíšťové encefalitidě (celý inaktivovaný virus) Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro uživatele Injekční suspenze v předplněné injekční stříkačce Vakcína proti klíšťové encefalitidě (celý inaktivovaný virus) Přečtěte si pozorně celou příbalovou informaci
FSME-IMMUN 0,5 ml Injekční suspenze v předplněné injekční stříkačce Vakcína proti klíšťové encefalitidě (celý inaktivovaný virus)
 Příbalová informace: informace pro uživatele Injekční suspenze v předplněné injekční stříkačce Vakcína proti klíšťové encefalitidě (celý inaktivovaný virus) Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro uživatele Injekční suspenze v předplněné injekční stříkačce Vakcína proti klíšťové encefalitidě (celý inaktivovaný virus) Přečtěte si pozorně celou příbalovou informaci
Postupy pri aplikácii pandemickej vakcíny
 Postupy pri aplikácii pandemickej vakcíny Praktická realizácia očkovacieho výkonu v ambulantnej praxi lekára patrí k štandardným výkonom v rámci poskytovania liečebno-preventívnej starostlivosti. Dôležité
Postupy pri aplikácii pandemickej vakcíny Praktická realizácia očkovacieho výkonu v ambulantnej praxi lekára patrí k štandardným výkonom v rámci poskytovania liečebno-preventívnej starostlivosti. Dôležité
Příbalová informace: informace pro uživatele
 sp. zn. sukls197981/2016 Příbalová informace: informace pro uživatele FSME-IMMUN 0,25 ml Injekční suspenze v předplněné injekční stříkačce Vakcína proti klíšťové encefalitidě (celý inaktivovaný virus)
sp. zn. sukls197981/2016 Příbalová informace: informace pro uživatele FSME-IMMUN 0,25 ml Injekční suspenze v předplněné injekční stříkačce Vakcína proti klíšťové encefalitidě (celý inaktivovaný virus)
Písomná informácia pre používateľa. DALACIN C 150 mg DALACIN C 300 mg tvrdé kapsuly. klindamycín
 Písomná informácia pre používateľa DALACIN C 150 mg DALACIN C 300 mg tvrdé kapsuly klindamycín Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre
Písomná informácia pre používateľa DALACIN C 150 mg DALACIN C 300 mg tvrdé kapsuly klindamycín Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre
Lieky a pacienti s bolesťou
 Dozadu Na začiatok Ďalej Lieky a pacienti s bolesťou Kúpite si občas v lekárni lieky na bolesť alebo vám ich pravidelne predpisuje lekár? Čítajte ďalej a zistite, či pri liečbe občasnej alebo chronickej
Dozadu Na začiatok Ďalej Lieky a pacienti s bolesťou Kúpite si občas v lekárni lieky na bolesť alebo vám ich pravidelne predpisuje lekár? Čítajte ďalej a zistite, či pri liečbe občasnej alebo chronickej
Příbalová informace: informace pro uživatele
 Sp. zn. sukls87782/2016 Příbalová informace: informace pro uživatele FSME-IMMUN 0,25 ml Injekční suspenze v předplněné injekční stříkačce Vakcína proti klíšťové encefalitidě (celý inaktivovaný virus) Přečtěte
Sp. zn. sukls87782/2016 Příbalová informace: informace pro uživatele FSME-IMMUN 0,25 ml Injekční suspenze v předplněné injekční stříkačce Vakcína proti klíšťové encefalitidě (celý inaktivovaný virus) Přečtěte
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FSME-IMMUN 0,5 ml BAXTER Injekční suspenze v předplněné injekční stříkačce Vakcína proti klíšťové encefalitidě (celý inaktivovaný virus) Přečtěte si pozorně
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FSME-IMMUN 0,5 ml BAXTER Injekční suspenze v předplněné injekční stříkačce Vakcína proti klíšťové encefalitidě (celý inaktivovaný virus) Přečtěte si pozorně
(REF: ARV-HA-3 / REF: ARV-HA-1)
 Hyaluronát sodný 2% (REF: ARV-HA-3 / REF: ARV-HA-1) OBSAH, ref. ARV-HA-3 OBSAH, ref. ARV-HA-1 3 ArthroVisc injekčné striekačky 1 ArthroVisc injekčná striekačka 3 zarážky prsta 1 zarážka prsta Ver.4.X /
Hyaluronát sodný 2% (REF: ARV-HA-3 / REF: ARV-HA-1) OBSAH, ref. ARV-HA-3 OBSAH, ref. ARV-HA-1 3 ArthroVisc injekčné striekačky 1 ArthroVisc injekčná striekačka 3 zarážky prsta 1 zarážka prsta Ver.4.X /
Příbalová informace: informace pro uživatele
 Sp.zn. sukls175775/2013 Příbalová informace: informace pro uživatele FSME-IMMUN 0,5 ml BAXTER Injekční suspenze v předplněné injekční stříkačce Vakcína proti klíšťové encefalitidě (celý inaktivovaný virus)
Sp.zn. sukls175775/2013 Příbalová informace: informace pro uživatele FSME-IMMUN 0,5 ml BAXTER Injekční suspenze v předplněné injekční stříkačce Vakcína proti klíšťové encefalitidě (celý inaktivovaný virus)
Príloha III. Úprava relevantných častí Súhrnu charakteristických vlastností lieku a Písomnej informácie pre používateľa
 Príloha III Úprava relevantných častí Súhrnu charakteristických vlastností lieku a Písomnej informácie pre používateľa Poznámka: Tento súhrn charakteristických vlastností lieku, označenia obalov a písomnej
Príloha III Úprava relevantných častí Súhrnu charakteristických vlastností lieku a Písomnej informácie pre používateľa Poznámka: Tento súhrn charakteristických vlastností lieku, označenia obalov a písomnej
PRÍLOHA III DODATKY K SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNEJ INFORMÁCII PRE POUŽÍVATEĽOV
 PRÍLOHA III DODATKY K SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNEJ INFORMÁCII PRE POUŽÍVATEĽOV Tieto zmeny v SPC a písomnej informácii pre používateľov sú platné v čase Rozhodnutia Komisie. Po
PRÍLOHA III DODATKY K SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNEJ INFORMÁCII PRE POUŽÍVATEĽOV Tieto zmeny v SPC a písomnej informácii pre používateľov sú platné v čase Rozhodnutia Komisie. Po
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls72023/2010
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls72023/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FSME-IMMUN 0,5 ml BAXTER Injekční suspenze v předplněné injekční stříkačce Vakcína proti
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls72023/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FSME-IMMUN 0,5 ml BAXTER Injekční suspenze v předplněné injekční stříkačce Vakcína proti
Písomná informácia pre používateľku. Escepran 25 mg filmom obalené tablety exemestan
 Príloha č.2 k notifikácii o zmene, ev.č.: 2016/02506-Z1B Písomná informácia pre používateľku Escepran 25 mg filmom obalené tablety exemestan Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete
Príloha č.2 k notifikácii o zmene, ev.č.: 2016/02506-Z1B Písomná informácia pre používateľku Escepran 25 mg filmom obalené tablety exemestan Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls72022/2010
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls72022/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FSME-IMMUN 0,25 ml BAXTER Injekční suspenze v předplněné injekční stříkačce Vakcína proti
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls72022/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FSME-IMMUN 0,25 ml BAXTER Injekční suspenze v předplněné injekční stříkačce Vakcína proti
ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV
 ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV 25 PRÍLOHY K DOPLNENIU RELEVANTNÝCH SEKCII SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU LIEKOV OBSAHUJÚCICH
ANNEX III ZMENY V SÚHRNE CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU A PÍSOMNÝCH INFORMÁCIÁCH PRE POUŽÍVATEĽOV 25 PRÍLOHY K DOPLNENIU RELEVANTNÝCH SEKCII SÚHRNU CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU LIEKOV OBSAHUJÚCICH
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele FSME-IMMUN 0,25 ml Injekční suspenze v předplněné injekční stříkačce Vakcína proti klíšťové encefalitidě (celý inaktivovaný virus) Přečtěte si pozorně celou
Příbalová informace: informace pro uživatele FSME-IMMUN 0,25 ml Injekční suspenze v předplněné injekční stříkačce Vakcína proti klíšťové encefalitidě (celý inaktivovaný virus) Přečtěte si pozorně celou
Písomná informácia pre používateľku. Lutinus 100 mg vaginálne tablety progesteronum
 Príloha č. 2 k notifikácii o zmene v registrácii lieku, ev.č. 2011/08448-Z1B Písomná informácia pre používateľku Lutinus 100 mg vaginálne tablety progesteronum Pozorne si prečítajte celú písomnú informáciu
Príloha č. 2 k notifikácii o zmene v registrácii lieku, ev.č. 2011/08448-Z1B Písomná informácia pre používateľku Lutinus 100 mg vaginálne tablety progesteronum Pozorne si prečítajte celú písomnú informáciu
Písomná informácia pre používateľa. DALACIN C 150 mg DALACIN C 300 mg tvrdé kapsuly. klindamycín
 Písomná informácia pre používateľa DALACIN C 150 mg DALACIN C 300 mg tvrdé kapsuly klindamycín Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre
Písomná informácia pre používateľa DALACIN C 150 mg DALACIN C 300 mg tvrdé kapsuly klindamycín Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre
Písomná informácia pre používateľa. Zinnat 125 mg Zinnat 250 mg Zinnat 500 mg filmom obalené tablety. cefuroxím (vo forme cefuroxím-axetilu)
 Písomná informácia pre používateľa Zinnat 125 mg Zinnat 250 mg Zinnat 500 mg filmom obalené tablety cefuroxím (vo forme cefuroxím-axetilu) Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete
Písomná informácia pre používateľa Zinnat 125 mg Zinnat 250 mg Zinnat 500 mg filmom obalené tablety cefuroxím (vo forme cefuroxím-axetilu) Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete
Príjem v zahraničí. povinnosť podať daňové priznanie
 Príjem v zahraničí povinnosť podať daňové priznanie KEDY SA MUSÍ PODAŤ DAŇOVÉ PRIZNANIE? Podľa 32 zákona č. 595/2003 Z.z. o dani z príjmov, občan, ktorý je daňový rezident Slovenskej republiky a mal príjmy
Príjem v zahraničí povinnosť podať daňové priznanie KEDY SA MUSÍ PODAŤ DAŇOVÉ PRIZNANIE? Podľa 32 zákona č. 595/2003 Z.z. o dani z príjmov, občan, ktorý je daňový rezident Slovenskej republiky a mal príjmy
Pozorne si prečítajtecelú písomnú informáciu, pretože obsahuje pre Vás dôležité informácie.
 PRÍLOHA Č 2 k NOTIFIKÁCIi ZMENy v registrácii LIeKU, EV. Č. 2011/02367 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Voltaren Rapid 25 mg mäkké kapsuly diclofenacum kalicum Pozorne si prečítajtecelú písomnú informáciu,
PRÍLOHA Č 2 k NOTIFIKÁCIi ZMENy v registrácii LIeKU, EV. Č. 2011/02367 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Voltaren Rapid 25 mg mäkké kapsuly diclofenacum kalicum Pozorne si prečítajtecelú písomnú informáciu,
Písomná informácia pre používateľa. STADATUSSIN perorálny roztok 1,35 mg/ml. pentoxyverín
 Schválený text k rozhodnutiu o registrácii, ev. č.: 2015/04605-REG Písomná informácia pre používateľa STADATUSSIN perorálny roztok 1,35 mg/ml pentoxyverín Pozorne si prečítajte celú písomnú informáciu
Schválený text k rozhodnutiu o registrácii, ev. č.: 2015/04605-REG Písomná informácia pre používateľa STADATUSSIN perorálny roztok 1,35 mg/ml pentoxyverín Pozorne si prečítajte celú písomnú informáciu
Písomná informácia pre používateľa. Vermox 100 mg, tablety. mebendazol
 Písomná informácia pre používateľa Vermox 100 mg, tablety mebendazol Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre vás dôležité informácie.
Písomná informácia pre používateľa Vermox 100 mg, tablety mebendazol Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre vás dôležité informácie.
MAVENCLAD. Príručka pre pacientov Verzia 1.3, 18. jún 2017
 MAVENCLAD Príručka pre pacientov Verzia 1.3, 18. jún 2017 Dôležité informácie pre pacientov začínajúcich liečbu MAVENCLADOM OBSAH Úvod k MAVENCLADU Ako sa podáva MAVENCLAD? Vedľajšie účinky a možné riziká
MAVENCLAD Príručka pre pacientov Verzia 1.3, 18. jún 2017 Dôležité informácie pre pacientov začínajúcich liečbu MAVENCLADOM OBSAH Úvod k MAVENCLADU Ako sa podáva MAVENCLAD? Vedľajšie účinky a možné riziká
Písomná informácia pre používateľa. Nalgesin S 275 mg filmom obalené tablety sodná soľ naproxénu
 Príloha č. 2 k notifikácii o zmene, ev.č.: 2016/01606-Z1B Písomná informácia pre používateľa Nalgesin S 275 mg filmom obalené tablety sodná soľ naproxénu Pozorne si prečítajte celú písomnú informáciu predtým,
Príloha č. 2 k notifikácii o zmene, ev.č.: 2016/01606-Z1B Písomná informácia pre používateľa Nalgesin S 275 mg filmom obalené tablety sodná soľ naproxénu Pozorne si prečítajte celú písomnú informáciu predtým,
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV. Voltaren Rapid 25 mg mäkké kapsuly diclofenacum kalicum
 Príloha č. 1 k notifikácii zmeny v registrácii lieku, ev. č. 2013/01689 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Voltaren Rapid 25 mg mäkké kapsuly diclofenacum kalicum Pozorne si prečítajte celú písomnú informáciu,
Príloha č. 1 k notifikácii zmeny v registrácii lieku, ev. č. 2013/01689 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Voltaren Rapid 25 mg mäkké kapsuly diclofenacum kalicum Pozorne si prečítajte celú písomnú informáciu,
4.vydanie Barometer rodinných podnikov v Európe. September 2015
 4.vydanie Barometer rodinných podnikov v Európe September 2015 Hlavné zistenia Rodinné firmy v Európe sa stále stretávajú s výzvami, ale vďaka ich schopnosti prispôsobiť sa zmenám na trhu, vnímajú svoju
4.vydanie Barometer rodinných podnikov v Európe September 2015 Hlavné zistenia Rodinné firmy v Európe sa stále stretávajú s výzvami, ale vďaka ich schopnosti prispôsobiť sa zmenám na trhu, vnímajú svoju
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV. Voltaren Actigo Extra 25 mg obalené tablety diclofenacum kalicum
 Schválený text k rozhodnutiu o zmene, ev. č.: 2012/07309 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Voltaren Actigo Extra 25 mg obalené tablety diclofenacum kalicum Pozorne si prečítajte celú písomnú informáciu,
Schválený text k rozhodnutiu o zmene, ev. č.: 2012/07309 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Voltaren Actigo Extra 25 mg obalené tablety diclofenacum kalicum Pozorne si prečítajte celú písomnú informáciu,
Písomná informácia pre používateľa. Voltaren Actigo Extra 25 mg obalené tablety. diklofenak, draselná soľ
 Písomná informácia pre používateľa Voltaren Actigo Extra 25 mg obalené tablety diklofenak, draselná soľ Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje
Písomná informácia pre používateľa Voltaren Actigo Extra 25 mg obalené tablety diklofenak, draselná soľ Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje
Písomná informácia pre používateľa. Repatha 140 mg injekčný roztok naplnený v injekčnom pere evolokumab
 Písomná informácia pre používateľa Repatha 140 mg injekčný roztok naplnený v injekčnom pere evolokumab Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti.
Písomná informácia pre používateľa Repatha 140 mg injekčný roztok naplnený v injekčnom pere evolokumab Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti.
Písomná informácia pre používateľa. Norvasc 5 mg tablety Norvasc 10 mg tablety amlodipín
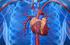 Písomná informácia pre používateľa Norvasc 5 mg tablety Norvasc 10 mg tablety amlodipín Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek pretože obsahuje pre vás dôležité
Písomná informácia pre používateľa Norvasc 5 mg tablety Norvasc 10 mg tablety amlodipín Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek pretože obsahuje pre vás dôležité
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV
 Príloha č.2 k notifikácii zmeny v registrácii lieku ev.č.: 2012/02800 Príloha č.1 k notifikácii zmeny v registrácii lieku, ev.č.: 2013/00497 Nolpaza 40 mg prášok na injekčný roztok pantoprazol PÍSOMNÁ
Príloha č.2 k notifikácii zmeny v registrácii lieku ev.č.: 2012/02800 Príloha č.1 k notifikácii zmeny v registrácii lieku, ev.č.: 2013/00497 Nolpaza 40 mg prášok na injekčný roztok pantoprazol PÍSOMNÁ
Písomná informácia pre používateľa. ARTHROTEC FORTE sodná soľ diklofenaku a misoprostol
 Schválený text k rozhodnutiu o zmene, ev. č.: 2013/05544 Písomná informácia pre používateľa ARTHROTEC FORTE sodná soľ diklofenaku a misoprostol Pozorne si prečítajte celú písomnú informáciu predtým, ako
Schválený text k rozhodnutiu o zmene, ev. č.: 2013/05544 Písomná informácia pre používateľa ARTHROTEC FORTE sodná soľ diklofenaku a misoprostol Pozorne si prečítajte celú písomnú informáciu predtým, ako
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV. LIPANTHYL SUPRA 215 mg filmom obalené tablety fenofibrát
 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV LIPANTHYL SUPRA 215 mg filmom obalené tablety fenofibrát Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre Vás
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV LIPANTHYL SUPRA 215 mg filmom obalené tablety fenofibrát Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre Vás
Písomná informácia pre používateľa. Sorvasta 15 mg. Sorvasta 10 mg. Sorvasta 20 mg Sorvasta 30 mg Sorvasta 40 mg. filmom obalené tablety.
 Príloha č.2 k notifikácii o zmene, ev. č: 2013/02835 Písomná informácia pre používateľa Sorvasta 5 mg Sorvasta 10 mg Sorvasta 15 mg Sorvasta 20 mg Sorvasta 30 mg Sorvasta 40 mg filmom obalené tablety rosuvastatín
Príloha č.2 k notifikácii o zmene, ev. č: 2013/02835 Písomná informácia pre používateľa Sorvasta 5 mg Sorvasta 10 mg Sorvasta 15 mg Sorvasta 20 mg Sorvasta 30 mg Sorvasta 40 mg filmom obalené tablety rosuvastatín
Písomná informácia pre používateľa. Alutard SQ jedy hmyzu ALK 801 Apis mellifera (Včela medonosná) ALK 802 Vespula spp. (Druh osa)
 Príloha č. 3 k notifikácii o zmene, ev.č.: 2015/05256-Z1B Písomná informácia pre používateľa Alutard SQ jedy hmyzu ALK 801 Apis mellifera (Včela medonosná) ALK 802 Vespula spp. (Druh osa) Injekčná suspenzia
Príloha č. 3 k notifikácii o zmene, ev.č.: 2015/05256-Z1B Písomná informácia pre používateľa Alutard SQ jedy hmyzu ALK 801 Apis mellifera (Včela medonosná) ALK 802 Vespula spp. (Druh osa) Injekčná suspenzia
Odmietanie očkovania v ambulancii všeobecného lekára pre deti a dorast
 Odmietanie očkovania v ambulancii všeobecného lekára pre deti a dorast Európsky imunizačný týždeň 2014 15.4.2014 MUDr. Marta Špániková, všeobecný lekár pre deti a dorast, Petržalka Očkovanie v ambulancii
Odmietanie očkovania v ambulancii všeobecného lekára pre deti a dorast Európsky imunizačný týždeň 2014 15.4.2014 MUDr. Marta Špániková, všeobecný lekár pre deti a dorast, Petržalka Očkovanie v ambulancii
B. PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA
 B. PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA 42 Písomná informácia pre používateľa Repatha 140 mg injekčný roztok naplnený v injekčnej striekačke evolokumab Tento liek je predmetom ďalšieho monitorovania. To
B. PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA 42 Písomná informácia pre používateľa Repatha 140 mg injekčný roztok naplnený v injekčnej striekačke evolokumab Tento liek je predmetom ďalšieho monitorovania. To
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV. Brumare 0,5 mg/ml nosová roztoková aerodisperzia. xylometazolíniumchlorid
 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Brumare 0,5 mg/ml nosová roztoková aerodisperzia xylometazolíniumchlorid Pozorne si prečítajte celú písomnú informáciu, pretože obsahuje dôležité informácie pre Vaše
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Brumare 0,5 mg/ml nosová roztoková aerodisperzia xylometazolíniumchlorid Pozorne si prečítajte celú písomnú informáciu, pretože obsahuje dôležité informácie pre Vaše
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele VAQTA Adult 50 U/ml injekční suspenze v předplněné injekční stříkačce Očkovací látka proti hepatitidě typu A, inaktivovaná, adsorbovaná Pro dospělé Přečtěte
Příbalová informace: informace pro uživatele VAQTA Adult 50 U/ml injekční suspenze v předplněné injekční stříkačce Očkovací látka proti hepatitidě typu A, inaktivovaná, adsorbovaná Pro dospělé Přečtěte
Pan-európsky prieskum verejnej mienky o ochrane zdravia a bezpečnosti pri práci Reprezentatívne výsledky za 27 členských štátov Európskej únie
 Pan-európsky prieskum verejnej mienky o ochrane zdravia a bezpečnosti pri práci Reprezentatívne výsledky za 2 členských štátov Európskej únie Balík obsahuje výsledky za EÚ 2 a za Slovensko Návrh prieskumu
Pan-európsky prieskum verejnej mienky o ochrane zdravia a bezpečnosti pri práci Reprezentatívne výsledky za 2 členských štátov Európskej únie Balík obsahuje výsledky za EÚ 2 a za Slovensko Návrh prieskumu
Stelara (ustekinumab) informácie o lieku pre pacientov
 Stelara (ustekinumab) informácie o lieku pre pacientov Dátum vypracovania: Október 2017 Túto brožúru si pozorne prečítajte spolu s Písomnou informáciou pre používateľa. Brožúra obsahuje dôležité informácie
Stelara (ustekinumab) informácie o lieku pre pacientov Dátum vypracovania: Október 2017 Túto brožúru si pozorne prečítajte spolu s Písomnou informáciou pre používateľa. Brožúra obsahuje dôležité informácie
Písomná informácia pre používateľa. Enap Injekčný roztok Enalaprilát
 Príloha č. 2 k notifikácii o zmene, ev. č.: 2013/05984 Písomná informácia pre používateľa Enap Injekčný roztok Enalaprilát Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete používať tento
Príloha č. 2 k notifikácii o zmene, ev. č.: 2013/05984 Písomná informácia pre používateľa Enap Injekčný roztok Enalaprilát Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete používať tento
Písomná informácia pre používateľa. LIPANTHYL SUPRA 160 mg filmom obalené tablety (fenofibratum)
 Písomná informácia pre používateľa LIPANTHYL SUPRA 160 mg filmom obalené tablety (fenofibratum) Pozorne si prečítajte celú písomnú informáciu predtým, než začnete užívať tento liek, pretože obsahuje pre
Písomná informácia pre používateľa LIPANTHYL SUPRA 160 mg filmom obalené tablety (fenofibratum) Pozorne si prečítajte celú písomnú informáciu predtým, než začnete užívať tento liek, pretože obsahuje pre
Základné ukazovatele vývoja národného hospodárstva
 Základné ukazovatele vývoja národného hospodárstva Národné hospodárstvo (NH) komplex jednotlivých oblastí ekonomických činností v danej krajine tvoria ho všetky subjekty trhu všetkých odvetví a sfér hospodárskeho
Základné ukazovatele vývoja národného hospodárstva Národné hospodárstvo (NH) komplex jednotlivých oblastí ekonomických činností v danej krajine tvoria ho všetky subjekty trhu všetkých odvetví a sfér hospodárskeho
Písomná informácia pre používateľa. LIPANTHYL NT 145 mg filmom obalené tablety. fenofibrát
 Písomná informácia pre používateľa LIPANTHYL NT 145 mg filmom obalené tablety fenofibrát Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre vás dôležité
Písomná informácia pre používateľa LIPANTHYL NT 145 mg filmom obalené tablety fenofibrát Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre vás dôležité
PRÍLOHA I SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 PRÍLOHA I SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1 1. NÁZOV VETERINÁRNEHO LIEKU Eurican Herpes 205 lyofilizát a riedidlo na prípravu emulzie na injekčné použitie. 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
PRÍLOHA I SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1 1. NÁZOV VETERINÁRNEHO LIEKU Eurican Herpes 205 lyofilizát a riedidlo na prípravu emulzie na injekčné použitie. 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Písomná informácia pre používateľa. Marixino 10 mg filmom obalené tablety memantínchlorid
 Písomná informácia pre používateľa Marixino 10 mg filmom obalené tablety memantínchlorid Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre vás dôležité
Písomná informácia pre používateľa Marixino 10 mg filmom obalené tablety memantínchlorid Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre vás dôležité
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA. LIPANTHYL SUPRA 215 mg filmom obalené tablety. fenofibrát
 PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA LIPANTHYL SUPRA 215 mg filmom obalené tablety fenofibrát Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre vás
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA LIPANTHYL SUPRA 215 mg filmom obalené tablety fenofibrát Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre vás
PRÍLOHA I SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 PRÍLOHA I SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1 1. NÁZOV VETERINÁRNEHO LIEKU ProteqFlu-Te injekčná suspenzia pre kone 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE 1 dávka (1 ml) obsahuje: Účinné látky:
PRÍLOHA I SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 1 1. NÁZOV VETERINÁRNEHO LIEKU ProteqFlu-Te injekčná suspenzia pre kone 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE 1 dávka (1 ml) obsahuje: Účinné látky:
DALI, pomoc a riešenia
 DALI, pomoc a riešenia Obsah Úvod do DALI (vecí, ktoré by ste mali vedieť)... 1 Čo je DALI?... 1 Čo je posolstvom DALI?... 1 Základné pravidlá pre DALI a HELVAR výrobky a systémy... 2 Riešenie problémov:
DALI, pomoc a riešenia Obsah Úvod do DALI (vecí, ktoré by ste mali vedieť)... 1 Čo je DALI?... 1 Čo je posolstvom DALI?... 1 Základné pravidlá pre DALI a HELVAR výrobky a systémy... 2 Riešenie problémov:
Písomná informácia pre používateľa. Flixotide 250 Inhaler N. Flixotide 125 Inhaler N. flutikazónpropionát
 Príloha č. 1 k notifikácii o zmene, ev. č.: 2017/03054-ZP; 2017/03053-ZP; 2017/03052-ZP Písomná informácia pre používateľa Flixotide 50 Inhaler N Flixotide 125 Inhaler N Flixotide 250 Inhaler N inhalačná
Príloha č. 1 k notifikácii o zmene, ev. č.: 2017/03054-ZP; 2017/03053-ZP; 2017/03052-ZP Písomná informácia pre používateľa Flixotide 50 Inhaler N Flixotide 125 Inhaler N Flixotide 250 Inhaler N inhalačná
sp.zn.: sukls244138/2011
 sp.zn.: sukls244138/2011 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE VAQTA Adult 50 U/ml injekční suspenze v předplněné injekční stříkačce Očkovací látka proti hepatitidě typu A, inaktivovaná, adsorbovaná
sp.zn.: sukls244138/2011 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE VAQTA Adult 50 U/ml injekční suspenze v předplněné injekční stříkačce Očkovací látka proti hepatitidě typu A, inaktivovaná, adsorbovaná
B. PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA
 B. PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA 33 Písomná informácia pre používateľa Imlygic 10 6 plakotvorných jednotiek (PFU)/ml injekčný roztok Imlygic 10 8 plakotvorných jednotiek (PFU)/ml injekčný roztok talimogén
B. PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA 33 Písomná informácia pre používateľa Imlygic 10 6 plakotvorných jednotiek (PFU)/ml injekčný roztok Imlygic 10 8 plakotvorných jednotiek (PFU)/ml injekčný roztok talimogén
Písomná informácia pre používateľa. Betaklav 500 mg/125 mg filmom obalené tablety Betaklav 875 mg/125 mg filmom obalené tablety
 Príloha č.3 k notifikácii o zmene, ev.č.: 2017/01485-Z1B Písomná informácia pre používateľa Betaklav 500 mg/125 mg filmom obalené tablety Betaklav 875 mg/125 mg filmom obalené tablety amoxicilín/kyselina
Príloha č.3 k notifikácii o zmene, ev.č.: 2017/01485-Z1B Písomná informácia pre používateľa Betaklav 500 mg/125 mg filmom obalené tablety Betaklav 875 mg/125 mg filmom obalené tablety amoxicilín/kyselina
Ako zvýšiť zaočkovanosť proti chrípke? Krištúfková Z Bratislava
 Ako zvýšiť zaočkovanosť proti chrípke? Krištúfková Z. 25.4. 2009 Bratislava Cieľ SZO Na svetovom zdravotnom zhromaždení v roku 2003 bola prijatá rezolúcia k prevencii a kontrole chrípky dosiahnuť zaočkovanosť
Ako zvýšiť zaočkovanosť proti chrípke? Krištúfková Z. 25.4. 2009 Bratislava Cieľ SZO Na svetovom zdravotnom zhromaždení v roku 2003 bola prijatá rezolúcia k prevencii a kontrole chrípky dosiahnuť zaočkovanosť
Vaxigrip bude Vás nebo Vaše dítě chránit proti třem virovým kmenům obsaženým ve vakcíně asi za 2-3 týdny po očkování.
 Sp.zn.sukls71847/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vaxigrip, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (inaktivovaná, štěpený virion) Přečtěte si pozorně celou
Sp.zn.sukls71847/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vaxigrip, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (inaktivovaná, štěpený virion) Přečtěte si pozorně celou
Písomná informácia pre používateľa. Jext 150 mikrogramov Jext 300 mikrogramov. injekčný roztok naplnený v injekčnom pere.
 Príloha č. 2 k notifikácii o zmene, ev. č. : 2016/00200-Z1A Písomná informácia pre používateľa Jext 150 mikrogramov Jext 300 mikrogramov injekčný roztok naplnený v injekčnom pere adrenalín Pozorne si prečítajte
Príloha č. 2 k notifikácii o zmene, ev. č. : 2016/00200-Z1A Písomná informácia pre používateľa Jext 150 mikrogramov Jext 300 mikrogramov injekčný roztok naplnený v injekčnom pere adrenalín Pozorne si prečítajte
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
 Schválený text k rozhodnutiu o zmene, ev.č.: 2013/07585-ZME 1. NÁZOV LIEKU Igantibe 200 IU/ml, injekčný roztok SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Liečivo:
Schválený text k rozhodnutiu o zmene, ev.č.: 2013/07585-ZME 1. NÁZOV LIEKU Igantibe 200 IU/ml, injekčný roztok SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU 2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Liečivo:
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls161540/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE INFLUVAC Injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (povrchový
Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls161540/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE INFLUVAC Injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (povrchový
Písomná informácia pre používateľa. Vizarsin 100 mg filmom obalené tablety sildenafil
 Písomná informácia pre používateľa Vizarsin 100 mg filmom obalené tablety sildenafil Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre vás dôležité
Písomná informácia pre používateľa Vizarsin 100 mg filmom obalené tablety sildenafil Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre vás dôležité
Písomná informácia pre používateľa. Ebixa 10 mg filmom obalené tablety Memantínchlorid
 Písomná informácia pre používateľa Ebixa 10 mg filmom obalené tablety Memantínchlorid Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre vás dôležité
Písomná informácia pre používateľa Ebixa 10 mg filmom obalené tablety Memantínchlorid Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre vás dôležité
Písomná informácia pre používateľa (pre veľkosti balenia 7 a 14 gastrorezistentných tabliet) Nolpaza 20 mg gastrorezistentné tablety pantoprazol
 Schválený text k rozhodnutiu o predĺžení, ev.č.: 2009/10456 Príloha č.2 k notifikácii o zmene, ev.č.: 2010/07311 Príloha č.3 k notifikácii o zmene, ev.č.: 2011/00609 Príloha č.1 k notifikácii o zmene,
Schválený text k rozhodnutiu o predĺžení, ev.č.: 2009/10456 Príloha č.2 k notifikácii o zmene, ev.č.: 2010/07311 Príloha č.3 k notifikácii o zmene, ev.č.: 2011/00609 Príloha č.1 k notifikácii o zmene,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 sp. zn. sukls122237/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Fluarix, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený virion, inaktivovaná) Přečtěte si pozorně
sp. zn. sukls122237/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Fluarix, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený virion, inaktivovaná) Přečtěte si pozorně
Písomná informácia pre používateľa. Asolfena 5 mg Asolfena 10 mg filmom obalené tablety. solifenacíniumsukcinát
 Schválený text k rozhodnutiu o predĺžení, ev. č.: 2014/07689-PRE, 2014/07690-PRE Písomná informácia pre používateľa Asolfena 5 mg Asolfena 10 mg filmom obalené tablety solifenacíniumsukcinát Pozorne si
Schválený text k rozhodnutiu o predĺžení, ev. č.: 2014/07689-PRE, 2014/07690-PRE Písomná informácia pre používateľa Asolfena 5 mg Asolfena 10 mg filmom obalené tablety solifenacíniumsukcinát Pozorne si
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls97832/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE INFLUVAC Suspenze pro injekci v předplněné injekční stříkačce Vakcína proti chřipce (povrchový
Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls97832/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE INFLUVAC Suspenze pro injekci v předplněné injekční stříkačce Vakcína proti chřipce (povrchový
Hepatitída a diabetici
 Hepatitída a diabetici 1 SSVPL SLS MEDIFÓRUM 2011 2 Hepatitídy v číslach Situácia v SR v roku 2010: VHA 1453 ochorení VHB 112 ochorení ( 51 x zákrok v zdravotníckom zariadení, z toho 27 x nozokomiálny
Hepatitída a diabetici 1 SSVPL SLS MEDIFÓRUM 2011 2 Hepatitídy v číslach Situácia v SR v roku 2010: VHA 1453 ochorení VHB 112 ochorení ( 51 x zákrok v zdravotníckom zariadení, z toho 27 x nozokomiálny
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV. Norvasc 5 mg a 10 mg tablety. amlodipín
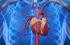 PRÍLOHA Č. 1 K NOTIFIKÁCII O ZMENY V REGISTRÁCII, EV.Č. 2012/02361, 2012/02362. PRÍLOHA Č. 3 K NOTIFIKÁCII O ZMENY V REGISTRÁCII, EV.Č. 2011/07598. PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Norvasc 5 mg a 10
PRÍLOHA Č. 1 K NOTIFIKÁCII O ZMENY V REGISTRÁCII, EV.Č. 2012/02361, 2012/02362. PRÍLOHA Č. 3 K NOTIFIKÁCII O ZMENY V REGISTRÁCII, EV.Č. 2011/07598. PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Norvasc 5 mg a 10
Písomná informácia pre používateľa. Nolpaza 20 mg gastrorezistentné tablety. pantoprazol. Dlhodobá úľava od pálenia záhy.
 Príloha č. 1 k notifikácii o zmene, ev.č.: 2015/02929-ZIB, 2017/01390-ZIA Príloha č. 2 k notifikácii o zmene, ev.č.: 2014/02083-ZIB, 2015/06378-ZIB, 2016/05801-ZIB, 2017/01800-Z1B Písomná informácia pre
Príloha č. 1 k notifikácii o zmene, ev.č.: 2015/02929-ZIB, 2017/01390-ZIA Príloha č. 2 k notifikácii o zmene, ev.č.: 2014/02083-ZIB, 2015/06378-ZIB, 2016/05801-ZIB, 2017/01800-Z1B Písomná informácia pre
Práca s on-line dotazníkom
 1 1 Práca s on-line dotazníkom Práca s on-line dotazníkom Postup pri vypĺňaní Nalogujte sa na stránku: http://www.checker-soft.com/gfkslovakia/c_login.php Zadajte pridelený login a heslo V objednaných
1 1 Práca s on-line dotazníkom Práca s on-line dotazníkom Postup pri vypĺňaní Nalogujte sa na stránku: http://www.checker-soft.com/gfkslovakia/c_login.php Zadajte pridelený login a heslo V objednaných
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV
 Príloha č. 2 k notifikácii o zmene v registrácii lieku, ev.č.: 2012/08201-Z1B PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Rolpryna SR 2 mg tablety s predĺženým uvoľňovaním Rolpryna SR 4 mg tablety s predĺženým
Príloha č. 2 k notifikácii o zmene v registrácii lieku, ev.č.: 2012/08201-Z1B PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Rolpryna SR 2 mg tablety s predĺženým uvoľňovaním Rolpryna SR 4 mg tablety s predĺženým
Písomná informácia pre používateľa. RELPAX 20 mg RELPAX 40 mg RELPAX 80 mg filmom obalené tablety. eletriptániumbromid
 Schválený text k rozhodnutiu o zmene, ev.č.: 2013/05394 Písomná informácia pre používateľa RELPAX 20 mg RELPAX 40 mg RELPAX 80 mg filmom obalené tablety eletriptániumbromid Pozorne si prečítajte celú písomnú
Schválený text k rozhodnutiu o zmene, ev.č.: 2013/05394 Písomná informácia pre používateľa RELPAX 20 mg RELPAX 40 mg RELPAX 80 mg filmom obalené tablety eletriptániumbromid Pozorne si prečítajte celú písomnú
Písomná informácia pre používateľa. Augmentin 1 g 875 mg/125 mg filmom obalené tablety. amoxicilín/kyselina klavulánová
 Písomná informácia pre používateľa Augmentin 1 g 875 mg/125 mg filmom obalené tablety amoxicilín/kyselina klavulánová Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek,
Písomná informácia pre používateľa Augmentin 1 g 875 mg/125 mg filmom obalené tablety amoxicilín/kyselina klavulánová Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek,
Písomná informácia pre používateľa. Panadol Novum 500 mg filmom obalené tablety. paracetamol
 Písomná informácia pre používateľa Panadol Novum 500 mg filmom obalené tablety paracetamol Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre vás
Písomná informácia pre používateľa Panadol Novum 500 mg filmom obalené tablety paracetamol Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje pre vás
Písomná informácia pre používateľa. COLDREX MAXGRIP LESNÉ OVOCIE mg/10 mg/70 mg prášok na perorálny roztok
 Príloha č. 2 k notifikácii o zmene, ev. č.: 2016/04414-ZIB Príloha č. 3 k notifikácii o zmene, ev. č.: 2016/02481-ZIA Písomná informácia pre používateľa COLDREX MAXGRIP LESNÉ OVOCIE 1 000 mg/10 mg/70 mg
Príloha č. 2 k notifikácii o zmene, ev. č.: 2016/04414-ZIB Príloha č. 3 k notifikácii o zmene, ev. č.: 2016/02481-ZIA Písomná informácia pre používateľa COLDREX MAXGRIP LESNÉ OVOCIE 1 000 mg/10 mg/70 mg
PÍSOMNÁ INFORMÁCIA PRE POUŢÍVATEĽOV. Nalgesin S Sodná soľ naproxénu
 Príloha č. 3 k notifikácii zmeny v registrácii, ev.č.: 2012/04252 PÍSOMNÁ INFORMÁCIA PRE POUŢÍVATEĽOV Nalgesin S Sodná soľ naproxénu Pozorne si prečítajte celú písomnú informáciu, pretoţe obsahuje pre
Príloha č. 3 k notifikácii zmeny v registrácii, ev.č.: 2012/04252 PÍSOMNÁ INFORMÁCIA PRE POUŢÍVATEĽOV Nalgesin S Sodná soľ naproxénu Pozorne si prečítajte celú písomnú informáciu, pretoţe obsahuje pre
M R2454 SK
 M32 1993R2454 SK 01.01.2013 017.001 959 M32 1993R2454 SK 01.01.2013 017.001 960 M32 1993R2454 SK 01.01.2013 017.001 961 1993R2454 SK 01.01.2013 017.001 965 M32 VYSVETLIVKY K TLAČIVÁM ŽIADOSTÍ O ZJEDNODUŠENÉ
M32 1993R2454 SK 01.01.2013 017.001 959 M32 1993R2454 SK 01.01.2013 017.001 960 M32 1993R2454 SK 01.01.2013 017.001 961 1993R2454 SK 01.01.2013 017.001 965 M32 VYSVETLIVKY K TLAČIVÁM ŽIADOSTÍ O ZJEDNODUŠENÉ
Písomná informácia pre používateľa. ACCUPRO 5 ACCUPRO 10 ACCUPRO 20 filmom obalené tablety chinapril
 Písomná informácia pre používateľa ACCUPRO 5 ACCUPRO 10 ACCUPRO 20 filmom obalené tablety chinapril Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje
Písomná informácia pre používateľa ACCUPRO 5 ACCUPRO 10 ACCUPRO 20 filmom obalené tablety chinapril Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretože obsahuje
POWLI Fig. A Copyright 2014 VARO
 POWLI421 1 7 6 2 3 4 5 Fig. A Copyright 2014 VARO www.varo.com POWLI421 Fig 1 Copyright 2014 VARO www.varo.com LED BATERKA 1,5 W POWLI421 POWLI421 SK 1 POPIS (OBR. A) 1. Otočná hlava 2. Hlavný vypínač
POWLI421 1 7 6 2 3 4 5 Fig. A Copyright 2014 VARO www.varo.com POWLI421 Fig 1 Copyright 2014 VARO www.varo.com LED BATERKA 1,5 W POWLI421 POWLI421 SK 1 POPIS (OBR. A) 1. Otočná hlava 2. Hlavný vypínač
Písomná informácia pre používateľa. BISACODYL-K 5 mg obalené tablety. bisakodyl
 Príloha č. 2 k notifikácii o zmene, ev. č.: 2015/07420-ZIB Písomná informácia pre používateľa BISACODYL-K 5 mg obalené tablety bisakodyl Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete
Príloha č. 2 k notifikácii o zmene, ev. č.: 2015/07420-ZIB Písomná informácia pre používateľa BISACODYL-K 5 mg obalené tablety bisakodyl Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete
Příbalová informace: informace pro uživatele Engerix-B 20 µg. antigenum tegiminis hepatitidis B injekční suspenze
 sp.zn. sukls204563/2014 Příbalová informace: informace pro uživatele Engerix-B 10 µg Engerix-B 20 µg antigenum tegiminis hepatitidis B injekční suspenze Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn. sukls204563/2014 Příbalová informace: informace pro uživatele Engerix-B 10 µg Engerix-B 20 µg antigenum tegiminis hepatitidis B injekční suspenze Přečtěte si pozorně celou příbalovou informaci dříve,
Písomná informácia pre používateľa. Dutrys 0,5 mg mäkké kapsuly. dutasterid
 Príloha č.1 k notifikácii o zmene, ev.č.: 2016/06850-Z1B Písomná informácia pre používateľa Dutrys 0,5 mg mäkké kapsuly dutasterid Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať
Príloha č.1 k notifikácii o zmene, ev.č.: 2016/06850-Z1B Písomná informácia pre používateľa Dutrys 0,5 mg mäkké kapsuly dutasterid Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať
Expozičný scenár a karta bezpečnostných údajov- povinnosti, možnosti a termíny
 Expozičný scenár a karta bezpečnostných údajov- povinnosti, možnosti a termíny Komunikácia v rámci dodávateľského reťazca registrované látky informácie o chemickej bezpečnosti boli zosumarizované registrujúcimi
Expozičný scenár a karta bezpečnostných údajov- povinnosti, možnosti a termíny Komunikácia v rámci dodávateľského reťazca registrované látky informácie o chemickej bezpečnosti boli zosumarizované registrujúcimi
Písomná informácia pre používateľa. XANAX SR 0,5 mg XANAX SR 1 mg XANAX SR 2 mg XANAX SR 3 mg tablety s predĺženým uvoľňovaním.
 Schválený text k rozhodnutiu o zmene, ev. č.: 2013/06308-ZME, 2014/01325-ZME Príloha č. 2 k notifikácii o zmene, ev. č.: 2012/00418-Z1B, 2016/01028-Z1B Písomná informácia pre používateľa XANAX SR 0,5 mg
Schválený text k rozhodnutiu o zmene, ev. č.: 2013/06308-ZME, 2014/01325-ZME Príloha č. 2 k notifikácii o zmene, ev. č.: 2012/00418-Z1B, 2016/01028-Z1B Písomná informácia pre používateľa XANAX SR 0,5 mg
Coldrex HotRem Citron por.plv.sol.10ks-sáčky
 Coldrex HotRem Citron por.plv.sol.10ks-sáčky Príloha č. 3 k notifikácii o zmene, ev.č. 2013/02567 Písomná informácia pre používateľa COLDREX Horúci nápoj Čierne ríbezle COLDREX Horúci nápoj Citrón prášok
Coldrex HotRem Citron por.plv.sol.10ks-sáčky Príloha č. 3 k notifikácii o zmene, ev.č. 2013/02567 Písomná informácia pre používateľa COLDREX Horúci nápoj Čierne ríbezle COLDREX Horúci nápoj Citrón prášok
Písomná informácia pre používateľa. Vasilip 10 Vasilip 20 Vasilip 40 simvastatín
 Príloha č.2 k notifikácii o zmene, ev. č.: 2013/03422 Písomná informácia pre používateľa Vasilip 10 Vasilip 20 Vasilip 40 simvastatín Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete
Príloha č.2 k notifikácii o zmene, ev. č.: 2013/03422 Písomná informácia pre používateľa Vasilip 10 Vasilip 20 Vasilip 40 simvastatín Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete
Písomná informácia pre používateľa. UNASYN IM/IV 1,5 g prášok na injekčný a infúzny roztok. sodná soľ sulbaktámu / sodná soľ ampicilínu
 Písomná informácia pre používateľa UNASYN IM/IV 1,5 g prášok na injekčný a infúzny roztok sodná soľ sulbaktámu / sodná soľ ampicilínu Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete
Písomná informácia pre používateľa UNASYN IM/IV 1,5 g prášok na injekčný a infúzny roztok sodná soľ sulbaktámu / sodná soľ ampicilínu Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete
Písomná informácia pre používateľa. Cordipin retard 20 mg tablety s predĺženým uvoľňovaním Nifedipín
 Príloha č. 2 k notifikácii o zmene, ev. č.: 2013/07191 Písomná informácia pre používateľa Cordipin retard 20 mg tablety s predĺženým uvoľňovaním Nifedipín Pozorne si prečítajte celú písomnú informáciu
Príloha č. 2 k notifikácii o zmene, ev. č.: 2013/07191 Písomná informácia pre používateľa Cordipin retard 20 mg tablety s predĺženým uvoľňovaním Nifedipín Pozorne si prečítajte celú písomnú informáciu
