VIII Polymerizace cyklických sloučenin (monomerů)
|
|
|
- Blanka Šmídová
- před 9 lety
- Počet zobrazení:
Transkript
1 VIII Polymerizace cyklických sloučenin (monomerů) H. Schejbalová & I. Stibor, str I. Prokopová, str D. Lukáš
2 Vzdělávací záměr Uvést tři příklady polymeračních reakcí cyklických sloučenin. Zopakovat principy polymeračních reakcí (aniont a kationtaktivních polymerací). Uvést vlastnosti a použití produktů. Představit Bayerovu teorii pnutí, ideální valenční úhel. Předpověď skutečného úhlu pro rovinné cykloalkany molekuly. 2
3 3
4 S&S, Polymerace cyklických sloučenin Řada lineárních polymerů vzniká polymerací cyklických sloučenin. Otevření cyklu probíhá snadno u: pyridin, purin a furan (i) heterocyklických sloučenin (ii) se 3, 4 a 8-mi člennými cykly. (9-ti členné cykly podle Prokopové) U těchto cyklů je největší pnutí v kruhu vyplývající z deformace valenčních úhlů. Poynámka: Heterocyklické sloučeniny jsou organické cyklické látky, které mimo atomů uhlíku obsahují v cyklu i jiné atomy, tzv. heteroatomy Viz dále: Bayerova teorie pnutí v cyklu. Adolf von Baeyer za její formulaci obdržel Nobelovu cenu, 1905.
5 Příklady heterocyklických sloučenin Otevření cyklu probíhá snadno u následujících heterocyklických sloučenin: Cyklické ethery (obsahují ve svých molekulách dvojvaznou skupinu O, na kterou se vážou dva uhlovodíkové Ethylenoxid Laktony (cyklické vnitřní estery hydroxykarboxylových kyselin vznikající intramolekulární reakcí karboxylové funkce s příslušnou hydroxylovou skupinou). 5
6 Příklady heterocyklických sloučenin Laktamy (cyklické amidy aminokyselin), sloučeniny obsahující v kruhu amidickou skupinu CONH nebo CONR. Amidová skupina -C(=O)-N< - kaprolaktam Cyklické siloxany (obsahují v molekule vazbu Si-O-Si) Okta methyl tetra siloxan 6
7 Cyklické ethery PEO - Příklad polymeru vzniklého reakcí cyklického etheru Ethylenoxid Polyethylenoxid Polyethylenoxid (poly(ethylenoxid), (PEO), též známý jako polyethylenglykol (poly(ethylenglykol)), (PEG), nebo polyoxyethylen (POE). Obchodní chráněný název. PEO je základem řady projímadel. Makrogol (polyethylenglykol) se prodává jako přípravek dostupný bez předpisu v práškové formě pod obchodními názvy SoftLax, Miralax, Glycoprep, Movicol 7
8 Cyklické ethery Vlastnosti PEO PEO jsou kapaliny nebo nízkotající tuhé látky, v závislosti na molární hmotnosti. Rozpustný ve vodě. Elektronová hustota cyklo-propan a polyethylen oxid. PEO se připravují polymerizací ethylenoxidu a jsou komerčně dostupné v široké škále molárních hmotností, od 300 g/mol do g/mol. Různé formy PEO se využívají také jako iniciátory polymerizačního procesu a-f3.gif 8
9 Cyklické ethery Aniontová a kationtová polymerace PEO s otevřením kruhu Aniontová polymerace Kationtová polymerace 9
10 Cyklické ethery Aniontová polymerace PEO s otevřením kruhu Při ataku iontového iniciátoru se vazba uhlík-heteroatom polarizuje do té míry, že může dojít k jejímu heterolytickému štěpení a k otevření kruhu, jak ukazuje příklad aniontové polymerace. R
11 Cyklické estery PCL - Příklad polymeru vzniklého reakcí cyklického esteru - kaprolakton Cyklický ester Patří do skupiny laktonů Polykaprolakton (PCL) Polykaprolakton (PCL), je biologicky odbouratelný polyester s nízkou teplotou tání přibližně 60 C a teplotou skelného přechodu asi -60 C. PCL degraduje hydrolýzou esterových vazeb za fyziologických podmínek (jako je tomu v lidském těle). Používá se jako biomateriál pro implantáty. Jeho rychlost degradace v organismu je nižší než u polylaktidu. 11
12 Laktamy PA, Polymerace Polyamidu 6 otevřením kruhu - kaprolaktamu n - kaprolaktam Polyamid 6 (PA6) Nylon 6 (polyamid 6) je syntetizován polymerací cyklického - kaprolaktamu. -kaprolaktam má 6 uhlíků, odtud označení polyamid 6. Je-li kaprolaktam zahříván na teplotu přibližně 533 K v inertní atmosféře dusíku po dobu asi 4-5 hodin, kruh se otevře a probíhá polymerace. 12
13 Laktamy PA, Poznámky k názvu - kaprolaktamu Kaprolaktam byl prvně popsán na konci devatenáctého století, kydy byl připraven cyklizací ε-aminokapronové kyseliny. ε-aminokapronová kyselina kapronová kyselina = kyselina hexanová 13
14 Laktamy PA6, Silon a Otto Wichterle Silon je polyamidové vlákno typu 6, které se pod tímto názvem do začátku 90. let minulého století vyrábělo v Československu. Vynálezce Otto Wichterle v roce 1940 vypracoval výrobní postup ve zlínské laboratoři firmy Baťa k přípravě kaprolaktamu, základní sloučeniny k výrobě polyamidu 6. V roce 1941 pak byla na pokusném zařízení vyrobena první příze, ze které se zhotovily vzorky ponožek a punčoch. Nový materiál se měl původně jmenovat winop - podle tří spolupracovníků: Wichterle, Novotný Procházka. Průmyslová výroba silonu v podniku stejného jména v Plané nad Lužnicí byla zahájena v roce V 80. letech se zde vyrábělo až 800 tun filamentů ročně (několikanásobně větší množství polyamidových vláken se vyrábělo pod názvem chemlon na Slovensku), v současné době se však polyamidová vlákna v ČR nevyrábí. 14
15 PDMS, Polymerace Poly dimethyl siloxanu otevřením kruhu okta methyl tetra siloxanu n Okta methyl tetra siloxan Poly dimethyl siloxan (PDMS) = dimethicon Připomínka: Siloxany obsahují v molekule vazbu Si-O-Si. 15
16 PDMS, Vlastnosti a použití Poly dimethyl siloxanu Polydimethylsiloxan (PDMS), patří do skupiny polymerních organokřemičitých sloučenin, které se běžně označují jako silikon. PDMS je nejrozšířenější organický polymer obsahující křemík. PDMS je opticky čistý, inertní, netoxický a nehořlavý. Aplikace PMDS sahají od kontaktních čoček po prostředky zdravotnické techniky v podobě elastomerů, implantátů. Je přítomen také v šamponech (jako dimethicone dělá vlasy lesklé a kluzké), potravinách (odpěňovač), těsnění. Používá se v mazacích olejích a pro výrobu tepelně odolných dlaždic. 16
17 A. U. Daniels,Swiss Med Wkly. 2012;142:w PDMS, použití Poly dimethyl siloxanu Všechny stávající prsní implantáty obsahují silikonový pryžový vak z PDMS vyplněný silikonovým gelem. Gel (z lat. Gelatus = zmrazené, nehybný) jsou zpravidla polymerní sítě obsahující rozpouštědlo (kapalinu). Prsní implantát skládající se ze silikonového gelu a silikonového kaučuku, vyráběný francouzskou společností Poly Implant Prosthese (PIP). Současné prsní implantáty zjevně nejsou dokonalé. Mají omezenou bio-životnost (10 let). To může vést k potřebě dalšího chirurgického zákroku. 17
18 PDMS, Vlasová kosmetika a Poly dimethyl siloxan = Dimethicon Dimethicon(e) je běžně obsažen v řadě produktů vlasové kosmetiky. Dodá vlasům lesk, texturu, vlasy jsou snadněji upravitelné. Vytváří iluzi zdravých a krásných vlasů. Problém nastává při dlouhodobém používání vlasové kosmetiky s obsahem dimethiconu., protože dochází díky jeho nerozpustnosti ve vodě k nahromadění dimethiconu ve vlasech. Vlasy začínají vypadat nevzhledně a jsou na první dojem těžší. Náprava: Umytí vlasů čistícím šampónem. Čistící šampóny obsahují vyšší množství kyselin a účinných aktivních látek k odstranění zbytků produktů po stylingu, chloru a dalších nežádoucích látek. Čistící šampóny se díky svému účinnějšímu složení doporučuje používat jen jednou za měsíc. V případě častějšího používání může dojít k vysušení vlasů. 18
19 Prokopová VŠCHT, pravidla polymerace cyklických sloučenin Při vzniku makromolekul polymerizací cyklických monomerů nevzniká, na rozdíl od polymerizace nenasycených monomerů, žádný nový typ chemické vazby. O tom, zda vůbec, případně jak snadno, může cyklická sloučenina polymerizovat, rozhodují faktory (i) termodynamické a (ii) kinetické. 19
20 Prokopová VŠCHT, Termodynamické faktory pro polymeraci cyklických sloučenin (i) Termodynamické faktory Z termodynamického hlediska je schopnost cyklického monomeru přecházet v lineární řetězce závislá na relativní stabilitě cyklické molekuly a polymerního řetězce. Termodynamická stabilita cyklických monomerů klesá se vzrůstajícím pnutím v cyklu. Největší pnutí je v tří- a čtyř-členných cyklech. V pěti-, šesti- a sedmi-členných cyklech pnutí strmě klesá a pak zase vzrůstá v cyklech s osmi až jedenácti členy. S dále vzrůstající velikostí kruhu pnutí klesá. 20
21 Prokopová VŠCHT, Bayerova teorie pnutí Johann Friedrich Wilhelm Adolf von Baeyer ( ) Německý chemik, který syntetizoval indigo. Cyklické alkany Za vysvětlení stability cyklických sloučenin v důsledku pnutí v cyklu (Bayerova teorie pnutí) obdržel Adolf von Baeyer v roce 1905 Nobelovu cenu. Pnutí v cyklu destabilizuje molekulu, což se projevuje její vyšší reaktivitou a zvýšením spalného tepla. 21
22 Prokopová VŠCHT, Pnutí v cyklu Pnutím v cyklu, v rámci organické chemie, rozumíme typ nestability, vznikající v důsledku abnormálních (nepřirozených) hodnot úhlů mezi vazbami v molekule. Pnutí v cyklu je nejčastěji sledováno v máločlenných cyklech, jako jsou cyclopropany a cyclobutany kde se C-C-C úhly podstatně liší od ideálních hodnot, tj. cca 109. Pnutí v cyklu je důsledkem současného působení několika jevů: úhlového napětí, deformačního napětí konformace (Pitzerovo pnutí) deformace trans-cyklické (neboli van der Waalsovo napět). Sp 3 hybridizace orbitalů 22
23 Prokopová VŠCHT, Bayerova teorie pnutí Modře úhel mezi vazbami v dané molekule. Zeleně ideální úhel mezi vazbami. 180 o (360 o /5)=108 Fialově Rozdíl hodnot mezi ideálním a skutečným úhlem mezi vazbami v molekule. 23
24 Prokopová VŠCHT, energie pnutí tabulka hodnot Energie pnutí v cyklických alkánech v závislosti na velikosti jejich řetězce, podle [4]. Velikost řetězce Energie pnutí (kcal/mol) 1 kcal=4,2 kj Velikost řetězce Energie pnutí (kcal/mol) =115,5 kj/mol =110,46 kj/mol =26,04 kj/mol =0,42 kj/mol =26,04 kj/mol =40,74 kj/mol [4] Anslyn, Eric V., and Dennis A. Dougherty. "Chapter 2: Strain and Stability." Modern Physical Organic Chemistry. Sausalito, CA: University Science, Print. 24
25 Prokopová VŠCHT, teoretická polymerace cykloalkanů - tabulka hodnot G H T S Příklad pro cyklo-propan: kj -113-(273+25)*(-69.1*0.001)=
26 Energie pnutí v cyklu [kcal/mol] Prokopová VŠCHT, energie pnutí - graf Energie pnutí v cyklických alkanech v závislosti na velikosti jejich řetězce podle [4]. Cyklohexan: 120 o Velikost řetězce 26
27 Prokopová VŠCHT, nulová energie pnutí v cyklohexanu Molekula cyklohexanu není rovinná. Úhel mezi vazbami C-C-C je v ní ideální, cca
28 Prokopová VŠCHT, teoretické hodnoty G převedení cyloalkanů na polymery Pnutí v cyklu samo o sobě ovšem není dostačující podmínkou pro polymerizaci cyklických monomerů; současně musí být splněna podmínka dostatečné aktivace monomeru pro otevření cyklu a vznik lineárních molekul. Dokládá to příklad cykloalkanů: Pro řadu jejich homologů byly ze spalných tepel a spalného tepla poly(methylenu) vypočteny hodnoty H k, S k a G k (Tab. 7-10) odpovídající jejich teoretickému převedení na polymer. Index k vyjadřuje, že hodnoty byly vypočítány pro polymerizaci kapalného monomeru (l) za vzniku krystalického polymeru (c) (srov ) 28
29 Prokopová VŠCHT, Gibbsova volná energie Volná entalpie, jinak řečeno Gibbsova volná energie nebo krátce Gibbsova energie, je jedním z termodynamických potenciálů. Gibbsova energie G je stavová funkce. Popisuje chemické i fyzikální děje za podmínek konstantního tlaku a konstantní teploty, kdy entropie jako kritérium samovolnosti děje je nedostačující. Rovnice vyjadřující vztah Gibbsovy volné energie byla formulována Gibbsem v roce G H T S G H T S 29
30 Prokopová VŠCHT, cykloalkany nepolymerizují Z hodnot G k v Tab by bylo možno soudit, že s výjimkou šestičlenného cyklu jsou všechny ostatní cykloalkany z termodynamického hlediska polymerizovatelné. Zatím však nebyl nalezen iniciační systém, který by v cykloalkanech aktivoval vazbu C-C tak, aby došlo k jejímu přerušení. Proto cykloalkany nepolymerizují. 30
31 Prokopová VŠCHT, mapa rozložení elektronové hustoty v cyklohexanu 002manual/node383.html Total electron density map for benzene Celkové hodnoty elektronové hustoty elektronová hustota je největší na vnějším obvodu molekuly. Šest modrých oblastí (atomy uhlíku), odpovídá oblastem s nejvyšší elektronovou hustotou. Ethylenoxid benzene 31
32 Prokopová VŠCHT, heteroatom nebo dvojná vazba Pro převedení cyklického monomeru do aktivovaného stavu je nutná přítomnost buď heteroatomu, nebo násobné vazby v cyklu. Při ataku iontového iniciátoru se vazba uhlík-heteroatom polarizuje do té míry, že může dojít k jejímu heterolytickému štěpení a k otevření kruhu. Radikálové iniciátory takovou reakci nemohou vyvolat, a proto jsou k iniciaci polymerizace s otevřením kruhu nevhodné. Pokud jsou v cyklické molekule monomeru násobné vazby, je možná polymerizace účinkem komplexních katalyzátorů, jak bylo ukázáno v předchozím odstavci (7.7.5). 32
33 Prokopová VŠCHT, role entropie Svou roli ovšem hraje i změna entropie při polymerizaci, a to zvláště u velkých cyklů, které jsou v podstatě bez pnutí. Například polymerizace cyklických siloxanů probíhají bez tepelného zabarvení a jsou řízeny změnou entropie. Při přeměně cyklus-řetězec vzrůstá stupeň volnosti systému, a v důsledku toho vzrůstá entropie v polymerizačním systému (+ S). G H T S 33
34 Prokopová VŠCHT, rovnováha polymerizace-depolymerizace Je nutno zmínit, že substituce na cyklické molekule monomeru zpravidla vede ke snížení polymerizační schopnosti monomeru. Ve srovnání s polymerizací vinylových monomerů je stropní teplota polymerizace cyklických monomerů nízká. Řada těchto polymerizací je proto komplikována ustavením rovnováhy polymerizace-depolymerizace (řetězec-cyklus). Rovnováha není jednoznačně posunuta ve prospěch polymeru. Například při hydrolytické polymerizaci hexano-6-laktamu prováděné při 260 C, obsahuje rovnovážný produkt polymerizace 90 hmot.% polymeru, 7 hmot.% monomeru a 3 hmot.% oligomerů. IUPAC name: poly(hexano-6-lactam) 34
35 Domácí úlohy: 1. Cyklo-propan, cyklo-butan a cyklo-pentan mají planární/rovinné molekuly. Jaký je u nich úhel mezi C-C-C vazbami? Jaká je u nich odchylka od ideálního mezi-vazebného úhlu? 2. Přiřaďte názvy následujícím chemickým vzorcům organických sloučenin: a) b) c) 35
36 3. Přiřaďte chemický vzorec následujícím polymerům: a) Polyethylenoxid b) Polyamid 6 c) Poly dimethyl siloxan 4. Vysvětlete stabilitu cyklických sloučenin v důsledku pnutí v cyklu pomocí Bayerovy teorie pnutí. 5. Zakreslete schematický energii pnutí v cyklických alkanech v závislosti na velikosti jejich řetězce. 36
37 Vyřazené slajdy. 37
38 V molekulách s méně než pěti atomy v cyklu jsou hlavním důvodem pnutí velké deformace vazebných úhlů. U cyklů s osmi a více členy jsou důvodem pnutí interakce mezi atomy vodíku, nebo substituenty na uhlíkových atomech cyklu. V pěti- a sedmi- členných cyklech je v porovnání s šesti-člennými slabé pnutí, které souvisí s torzním pnutím vyvolaným zákrytovou konformací C-H vazby na sousedících členech cyklu. 38
39 The molecular orbitals (MOs) of molecules can be constructed by linear combination of atomic orbitals (LCAO). Though the exact Schrödinger equation is unsolvable for many electron systems such as molecules, the solution can be numerically approximated by ab initio or density functional (DFT) theory. t.cgi?filename= als/molecular/benzene.html 39
40 Prokopová VŠCHT, heteroatom nebo dvojná vazba Přítomnost heteroatomů v cyklických molekulách ovlivňuje jejich stabilitu; korelaci mezi polymerizovatelností a velikostí cyklů s různými typy heteroatomů je však obtížné generalizovat. Z termodynamického hlediska polymerizovatelnosti bývá za rozhodující faktor považováno pnutí v cyklu, které určuje polymerizační entalpii H. 40
Polymerizace. Polytransformace
 vznik makromolekuly Polymerizace Polytransformace Podmínky vzniku makromolekuly Podmínky vzniku makromolekuly 1) chemická podmínka Výchozí nízkomolekulární látka(y) musí být z pohledu polymerní reakce
vznik makromolekuly Polymerizace Polytransformace Podmínky vzniku makromolekuly Podmínky vzniku makromolekuly 1) chemická podmínka Výchozí nízkomolekulární látka(y) musí být z pohledu polymerní reakce
VII.6.4 Polykondenzace Lineární polymery. H. Schejbalová & I. Stibor, str I. Prokopová, str D. Lukáš 2013
 VII.6.4 Polykondenzace Lineární polymery H. Schejbalová & I. Stibor, str. 172. I. Prokopová, str. 157. D. Lukáš 2013 1 Vzdělávací záměr 1. Polykondenzace uvést obecný průběh stupňovité reakce 2. Příklady
VII.6.4 Polykondenzace Lineární polymery H. Schejbalová & I. Stibor, str. 172. I. Prokopová, str. 157. D. Lukáš 2013 1 Vzdělávací záměr 1. Polykondenzace uvést obecný průběh stupňovité reakce 2. Příklady
Autor: Tomáš Galbička Téma: Alkany a cykloalkany Ročník: 2.
 Alkany uhlovodíky s otevřeným řetězcem a pouze jednoduchými vazbami vazby sigma, největší výskyt elektronů na spojnici jader v názvu mají koncovku an Cykloalkany uhlovodíky s uzavřeným řetězcem a pouze
Alkany uhlovodíky s otevřeným řetězcem a pouze jednoduchými vazbami vazby sigma, největší výskyt elektronů na spojnici jader v názvu mají koncovku an Cykloalkany uhlovodíky s uzavřeným řetězcem a pouze
3. Konformační analýza alkanů a cykloalkanů
 Konformační analýza alkanů a cykloalkanů 45 3. Konformační analýza alkanů a cykloalkanů Konformace je prostorové uspořádání molekuly vzniklé rotací kolem jednoduché vazby. Konformer je konformace v lokálním
Konformační analýza alkanů a cykloalkanů 45 3. Konformační analýza alkanů a cykloalkanů Konformace je prostorové uspořádání molekuly vzniklé rotací kolem jednoduché vazby. Konformer je konformace v lokálním
VIII. 6.5 Polyadice. H. Schejbalová & I. Stibor, str. 179. I. Prokopová, str. 181. D. Lukáš 2013
 VIII. 6.5 Polyadice H. Schejbalová & I. Stibor, str. 179. I. Prokopová, str. 181. D. Lukáš 2013 1 Vzdělávací záměr 1. Polyadice obecný průběh polyadice, odlišnosti od polykondenzace. 2. Syntéza polyuretanů
VIII. 6.5 Polyadice H. Schejbalová & I. Stibor, str. 179. I. Prokopová, str. 181. D. Lukáš 2013 1 Vzdělávací záměr 1. Polyadice obecný průběh polyadice, odlišnosti od polykondenzace. 2. Syntéza polyuretanů
Polymery lze rozdělit podle několika kritérií. Podle původu rozlišujeme polymery přírodní a syntetické. Přírodní polymery jsou:
 MAKROMOLEKULÁRNÍ LÁTKY (POLYMERY) Makromolekuly jsou molekulové systémy složené z velkého počtu atomů vázaných chemickými vazbami do dlouhých řetězců. Tyto řetězce tvoří pravidelně se opakující části,
MAKROMOLEKULÁRNÍ LÁTKY (POLYMERY) Makromolekuly jsou molekulové systémy složené z velkého počtu atomů vázaných chemickými vazbami do dlouhých řetězců. Tyto řetězce tvoří pravidelně se opakující části,
Alkany a cykloalkany
 Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Září 2010 Mgr. Alena Jirčáková Charakteristika alkanů: Malá reaktivita, odolné chemickým činidlům Nasycené
Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Září 2010 Mgr. Alena Jirčáková Charakteristika alkanů: Malá reaktivita, odolné chemickým činidlům Nasycené
Typy molekul, látek a jejich vazeb v organismech
 Typy molekul, látek a jejich vazeb v organismech Typy molekul, látek a jejich vazeb v organismech Organismy se skládají z molekul rozličných látek Jednotlivé látky si organismus vytváří sám z jiných látek,
Typy molekul, látek a jejich vazeb v organismech Typy molekul, látek a jejich vazeb v organismech Organismy se skládají z molekul rozličných látek Jednotlivé látky si organismus vytváří sám z jiných látek,
Test vlastnosti látek a periodická tabulka
 DUM Základy přírodních věd DUM III/2-T3-2-08 Téma: Test vlastnosti látek a periodická tabulka Střední škola Rok: 2012 2013 Varianta: A Zpracoval: Mgr. Pavel Hrubý Mgr. Josef Kormaník TEST Test vlastnosti
DUM Základy přírodních věd DUM III/2-T3-2-08 Téma: Test vlastnosti látek a periodická tabulka Střední škola Rok: 2012 2013 Varianta: A Zpracoval: Mgr. Pavel Hrubý Mgr. Josef Kormaník TEST Test vlastnosti
Opakování
 Slabé vazebné interakce Opakování Co je to atom? Opakování Opakování Co je to atom? Atom je nejmenší částice hmoty, chemicky dále nedělitelná. Skládá se z atomového jádra obsahujícího protony a neutrony
Slabé vazebné interakce Opakování Co je to atom? Opakování Opakování Co je to atom? Atom je nejmenší částice hmoty, chemicky dále nedělitelná. Skládá se z atomového jádra obsahujícího protony a neutrony
H H C C C C C C H CH 3 H C C H H H H H H
 Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Seminář chemie (SCH) Náplň: Obecná chemie, anorganická chemie, chemické výpočty, základy analytické chemie Třída: 3. ročník a septima Počet hodin: 2 hodiny týdně Pomůcky: Vybavení odborné učebny,
Předmět: Seminář chemie (SCH) Náplň: Obecná chemie, anorganická chemie, chemické výpočty, základy analytické chemie Třída: 3. ročník a septima Počet hodin: 2 hodiny týdně Pomůcky: Vybavení odborné učebny,
Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch
 Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch Atom, složení a struktura Chemické prvky-názvosloví, slučivost Chemické sloučeniny, molekuly Chemická vazba
Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch Atom, složení a struktura Chemické prvky-názvosloví, slučivost Chemické sloučeniny, molekuly Chemická vazba
ZŠ ÚnO, Bratří Čapků 1332
 Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Skupenské stavy látek. Mezimolekulární síly
 Skupenské stavy látek Mezimolekulární síly 1 Interakce iont-dipól Např. hydratační (solvatační) interakce mezi Na + (iont) a molekulou vody (dipól). Jde o nejsilnější mezimolekulární (nevazebnou) interakci.
Skupenské stavy látek Mezimolekulární síly 1 Interakce iont-dipól Např. hydratační (solvatační) interakce mezi Na + (iont) a molekulou vody (dipól). Jde o nejsilnější mezimolekulární (nevazebnou) interakci.
Názvosloví Konformace Isomerie. Uhlíky: primární (1 o ) sekundární (2 o ) terciární (3 o ) kvartérní (4 o )
 ALKANY 1 Názvosloví Konformace Isomerie Uhlíky: primární (1 o ) sekundární (2 o ) terciární (3 o ) kvartérní (4 o ) 2 Alkany (resp. cykloalkany) jsou nejzákladnější organické sloučeniny složené pouze z
ALKANY 1 Názvosloví Konformace Isomerie Uhlíky: primární (1 o ) sekundární (2 o ) terciární (3 o ) kvartérní (4 o ) 2 Alkany (resp. cykloalkany) jsou nejzákladnější organické sloučeniny složené pouze z
(-NH-CO-) Typy polyamidů
 POLYAMIDY (NYLONY) Typy polyamidů (-NH-CO-) AB typ Ty jsou vyráběny polymerací laktamů nebo ω- aminokyselin, kde A označuje aminovou skupinu a B karboxylovou skupinu a obě jsou částí stejné monomerní molekuly.
POLYAMIDY (NYLONY) Typy polyamidů (-NH-CO-) AB typ Ty jsou vyráběny polymerací laktamů nebo ω- aminokyselin, kde A označuje aminovou skupinu a B karboxylovou skupinu a obě jsou částí stejné monomerní molekuly.
Tento materiál byl vytvořen v rámci projektu Operačního programu
 Tento materiál byl vytvořen v rámci projektu Operačního programu Projekt MŠMT ČR Číslo projektu Název projektu Klíčová aktivita Vzdělávání pro konkurenceschopnost EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.3349
Tento materiál byl vytvořen v rámci projektu Operačního programu Projekt MŠMT ČR Číslo projektu Název projektu Klíčová aktivita Vzdělávání pro konkurenceschopnost EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.3349
1. ročník Počet hodin
 SOUSTAVY LÁTEK A JEJICH SLOŽENÍ rozdělení přírodních látek a vlastnosti chemických látek soustavy látek a jejich složení STAVBA ATOMU historie pohledu na atom složení a struktura atomu stavba atomu VELIČINY
SOUSTAVY LÁTEK A JEJICH SLOŽENÍ rozdělení přírodních látek a vlastnosti chemických látek soustavy látek a jejich složení STAVBA ATOMU historie pohledu na atom složení a struktura atomu stavba atomu VELIČINY
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 16, 566 01 Vysoké Mýto Alkeny Vlastnosti dvojné vazby Hybridizace uhlíku vázaného dvojnou vazbou je sp. Valenční úhel který svírají vazby na uhlíkovém atomu je přibližně
Gymnázium Vysoké Mýto nám. Vaňorného 16, 566 01 Vysoké Mýto Alkeny Vlastnosti dvojné vazby Hybridizace uhlíku vázaného dvojnou vazbou je sp. Valenční úhel který svírají vazby na uhlíkovém atomu je přibližně
CHEMIE - Úvod do organické chemie
 Název školy Číslo projektu Autor Název šablony Název DUMu Stupeň a typ vzdělávání Vzdělávací oblast Vzdělávací obor Vzdělávací okruh Druh učebního materiálu Cílová skupina Anotace SŠHS Kroměříž CZ.1.07/1.5.00/34.0911
Název školy Číslo projektu Autor Název šablony Název DUMu Stupeň a typ vzdělávání Vzdělávací oblast Vzdělávací obor Vzdělávací okruh Druh učebního materiálu Cílová skupina Anotace SŠHS Kroměříž CZ.1.07/1.5.00/34.0911
10. Energie a její transformace
 10. Energie a její transformace Energie je nejdůležitější vlastností hmoty a záření. Je obsažena v každém kousku hmoty i ve světelném paprsku. Je ve vesmíru a všude kolem nás. S energií se setkáváme na
10. Energie a její transformace Energie je nejdůležitější vlastností hmoty a záření. Je obsažena v každém kousku hmoty i ve světelném paprsku. Je ve vesmíru a všude kolem nás. S energií se setkáváme na
Vlastnosti. Pozor! H 3 C CH 3 H CH 3
 Alkeny Vlastnosti C n 2n obsahují dvojné vazby uhlíky v sp 2 hybridizaci násobná vazba vzniká překryvem 2p orbitalů obou atomů uhlíku nad a pod prostorem obsazeným vazbou aby k překryvu mohlo dojít, musí
Alkeny Vlastnosti C n 2n obsahují dvojné vazby uhlíky v sp 2 hybridizaci násobná vazba vzniká překryvem 2p orbitalů obou atomů uhlíku nad a pod prostorem obsazeným vazbou aby k překryvu mohlo dojít, musí
Organická chemie 3.ročník studijního oboru - kosmetické služby.
 Organická chemie 3.ročník studijního oboru - kosmetické služby. T-6 ALKANY Zpracováno v rámci projektu Zlepšení podmínek ke vzdělávání Registrační číslo projektu: CZ.1.07/1.5.00/34.0639 ŠABLONA III / 2
Organická chemie 3.ročník studijního oboru - kosmetické služby. T-6 ALKANY Zpracováno v rámci projektu Zlepšení podmínek ke vzdělávání Registrační číslo projektu: CZ.1.07/1.5.00/34.0639 ŠABLONA III / 2
Úvod do studia organické chemie
 Úvod do studia organické chemie 1828... Wöhler... uměle připravil močovinu Organická chemie - chemie sloučenin uhlíku a vodíku, případně dalších prvků (O, N, X, P, S) Příčiny stability uhlíkových řetězců:
Úvod do studia organické chemie 1828... Wöhler... uměle připravil močovinu Organická chemie - chemie sloučenin uhlíku a vodíku, případně dalších prvků (O, N, X, P, S) Příčiny stability uhlíkových řetězců:
Chemie 2018 CAUS strana 1 (celkem 5)
 Chemie 2018 CAUS strana 1 (celkem 5) 1. Vápník má atomové číslo 20, hmotnostní 40. Kolik elektronů obsahuje kationt Ca 2+? a) 18 b) 20 c) 40 d) 60 2. Kolik elektronů ve valenční sféře má atom Al? a) 1
Chemie 2018 CAUS strana 1 (celkem 5) 1. Vápník má atomové číslo 20, hmotnostní 40. Kolik elektronů obsahuje kationt Ca 2+? a) 18 b) 20 c) 40 d) 60 2. Kolik elektronů ve valenční sféře má atom Al? a) 1
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Organická chemie, biochemie 3. ročník a septima 2 hodiny týdně Školní tabule, interaktivní tabule, tyčinkové a kalotové modely molekul, zpětný
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Organická chemie, biochemie 3. ročník a septima 2 hodiny týdně Školní tabule, interaktivní tabule, tyčinkové a kalotové modely molekul, zpětný
Teorie chemické vazby a molekulární geometrie Molekulární geometrie VSEPR
 Geometrie molekul Lewisovy vzorce poskytují informaci o tom které atomy jsou spojeny vazbou a o jakou vazbu se jedná (topologie molekuly). Geometrické uspořádání molekuly je charakterizováno: Délkou vazeb
Geometrie molekul Lewisovy vzorce poskytují informaci o tom které atomy jsou spojeny vazbou a o jakou vazbu se jedná (topologie molekuly). Geometrické uspořádání molekuly je charakterizováno: Délkou vazeb
Podmínky vzniku makromolekuly
 Podmínky vzniku makromolekuly Vznik makromolekuly Podmínky vzniku makromolekuly 1) chemická podmínka Výchozí nízkomolekulární látka(y) musí být z pohledu polymerní reakce nejméně dvoufunkční 2) termodynamická
Podmínky vzniku makromolekuly Vznik makromolekuly Podmínky vzniku makromolekuly 1) chemická podmínka Výchozí nízkomolekulární látka(y) musí být z pohledu polymerní reakce nejméně dvoufunkční 2) termodynamická
Řetězová polymerizace
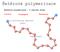 Řetězová polymerizace Řetězové polymerizace 3 odlišné kroky iiciace Propagace Terminace Initiating species Chain Step-Growth Iontové polymerizace aniontové, kationtové v závislosti na typu rostoucího aktivního
Řetězová polymerizace Řetězové polymerizace 3 odlišné kroky iiciace Propagace Terminace Initiating species Chain Step-Growth Iontové polymerizace aniontové, kationtové v závislosti na typu rostoucího aktivního
TEST + ŘEŠENÍ. PÍSEMNÁ ČÁST PŘIJÍMACÍ ZKOUŠKY Z CHEMIE bakalářský studijní obor Bioorganická chemie 2010
 30 otázek maximum: 60 bodů TEST + ŘEŠEÍ PÍSEMÁ ČÁST PŘIJÍMACÍ ZKUŠKY Z CEMIE bakalářský studijní obor Bioorganická chemie 2010 1. apište názvy anorganických sloučenin: (4 body) 4 BaCr 4 kyselina peroxodusičná
30 otázek maximum: 60 bodů TEST + ŘEŠEÍ PÍSEMÁ ČÁST PŘIJÍMACÍ ZKUŠKY Z CEMIE bakalářský studijní obor Bioorganická chemie 2010 1. apište názvy anorganických sloučenin: (4 body) 4 BaCr 4 kyselina peroxodusičná
Fyzikální chemie. ochrana životního prostředí analytická chemie chemická technologie denní. Platnost: od 1. 9. 2009 do 31. 8. 2013
 Učební osnova předmětu Fyzikální chemie Studijní obor: Aplikovaná chemie Zaměření: Forma vzdělávání: Celkový počet vyučovacích hodin za studium: Analytická chemie Chemická technologie Ochrana životního
Učební osnova předmětu Fyzikální chemie Studijní obor: Aplikovaná chemie Zaměření: Forma vzdělávání: Celkový počet vyučovacích hodin za studium: Analytická chemie Chemická technologie Ochrana životního
Substituční deriváty karboxylových kyselin
 Substituční deriváty karboxylových kyselin Vznikají substitucemi v, ke změnám v karboxylové funkční skupině. Poloha nové skupiny se často ve spojení s triviálními názvy označuje řeckými písmeny: Mají vlastnosti
Substituční deriváty karboxylových kyselin Vznikají substitucemi v, ke změnám v karboxylové funkční skupině. Poloha nové skupiny se často ve spojení s triviálními názvy označuje řeckými písmeny: Mají vlastnosti
PÍSEMNÁ ČÁST PŘIJÍMACÍ ZKOUŠKY Z CHEMIE bakalářský studijní obor Bioorganická chemie 2011
 Kód uchazeče:... Datum:... PÍSEMNÁ ČÁST PŘIJÍMACÍ ZKUŠKY Z CHEMIE bakalářský studijní obor Bioorganická chemie 2011 30 otázek maximum: 60 bodů čas: 60 minut 1. Napište názvy anorganických sloučenin: (4
Kód uchazeče:... Datum:... PÍSEMNÁ ČÁST PŘIJÍMACÍ ZKUŠKY Z CHEMIE bakalářský studijní obor Bioorganická chemie 2011 30 otázek maximum: 60 bodů čas: 60 minut 1. Napište názvy anorganických sloučenin: (4
Teorie hybridizace. Vysvětluje vznik energeticky rovnocenných kovalentních vazeb a umožňuje předpovědět prostorový tvar molekul.
 Chemická vazba co je chemická vazba charakteristiky chemické vazby jak vzniká vazba znázornění chemické vazby kovalentní a koordinační vazba vazba σ a π jednoduchá, dvojná a trojná vazba polarita vazby
Chemická vazba co je chemická vazba charakteristiky chemické vazby jak vzniká vazba znázornění chemické vazby kovalentní a koordinační vazba vazba σ a π jednoduchá, dvojná a trojná vazba polarita vazby
MAKROMOLEKULÁRNÍ LÁTKY
 MAKROMOLEKULÁRNÍ LÁTKY 1. Základní pojmy - makromolekulární látky = molekulové systémy složené z velkého počtu atomů, které jsou vázány chemickou vazbou do dlouhých řetězců - řetězce jsou tvořeny stavebními
MAKROMOLEKULÁRNÍ LÁTKY 1. Základní pojmy - makromolekulární látky = molekulové systémy složené z velkého počtu atomů, které jsou vázány chemickou vazbou do dlouhých řetězců - řetězce jsou tvořeny stavebními
Tabulace učebního plánu. Obecná chemie. Vzdělávací obsah pro vyučovací předmět : Ročník: 1.ročník a kvinta
 Tabulace učebního plánu Vzdělávací obsah pro vyučovací předmět : CHEMIE Ročník: 1.ročník a kvinta Obecná Bezpečnost práce Názvosloví anorganických sloučenin Zná pravidla bezpečnosti práce a dodržuje je.
Tabulace učebního plánu Vzdělávací obsah pro vyučovací předmět : CHEMIE Ročník: 1.ročník a kvinta Obecná Bezpečnost práce Názvosloví anorganických sloučenin Zná pravidla bezpečnosti práce a dodržuje je.
Organická chemie. názvosloví acyklických uhlovodíků
 Organická chemie názvosloví acyklických uhlovodíků Obsah definice vlastnosti organických sloučenin prvkové složen ení organických sloučenin vazby v molekulách org. sloučenin rozdělen lení organických sloučenin
Organická chemie názvosloví acyklických uhlovodíků Obsah definice vlastnosti organických sloučenin prvkové složen ení organických sloučenin vazby v molekulách org. sloučenin rozdělen lení organických sloučenin
rtuť při 0 o C = 470 mn m 1 15,45 17,90 19,80 21,28
 zkapalněné plyny - velmi nízké; např. helium 0354 mn m při teplotě 270 C vodík 2 mn m při teplotě 253 C roztavené kovy - velmi vysoké; např. měď při teplotě tání = 00 mn m organické látky při teplotě 25
zkapalněné plyny - velmi nízké; např. helium 0354 mn m při teplotě 270 C vodík 2 mn m při teplotě 253 C roztavené kovy - velmi vysoké; např. měď při teplotě tání = 00 mn m organické látky při teplotě 25
Základní chemické pojmy
 MZ CHEMIE 2015 MO 1 Základní chemické pojmy Atom, molekula, prvek, protonové číslo. Sloučenina, chemicky čistá látka, směs, dělení směsí. Relativní atomová hmotnost, molekulová hmotnost, atomová hmotnostní
MZ CHEMIE 2015 MO 1 Základní chemické pojmy Atom, molekula, prvek, protonové číslo. Sloučenina, chemicky čistá látka, směs, dělení směsí. Relativní atomová hmotnost, molekulová hmotnost, atomová hmotnostní
Makromolekulární látky
 Makromolekulární látky Učební texty k výuce chemie školní rok 2016/2017 Makromolekuly látky složené z velkého počtu atomů vázaných chemickými vazbami do dlouhých řetězců látky s velkou relativní molekulovou
Makromolekulární látky Učební texty k výuce chemie školní rok 2016/2017 Makromolekuly látky složené z velkého počtu atomů vázaných chemickými vazbami do dlouhých řetězců látky s velkou relativní molekulovou
15,45 17,90 19,80 21,28. 24,38 28,18 27,92 28,48 dichlormethan trichlormethan tetrachlormethan kys. mravenčí kys. octová kys. propionová kys.
 zkapalněné plyny - velmi nízké; např. helium 0354 mn m při teplotě 270C vodík 2 mn m při teplotě 253C roztavené kovy - velmi vysoké; např. měď při teplotě tání = 00 mn m rtuť při 0 o C = 470 mn m organické
zkapalněné plyny - velmi nízké; např. helium 0354 mn m při teplotě 270C vodík 2 mn m při teplotě 253C roztavené kovy - velmi vysoké; např. měď při teplotě tání = 00 mn m rtuť při 0 o C = 470 mn m organické
VLASTNOSTI VLÁKEN. 3. Tepelné vlastnosti vláken
 VLASNOSI VLÁKEN 3. epelné vlastnosti vláken 3.. Úvod epelné vlastnosti vláken jsou velice důležité, neboť jsou rozhodující pro volbu vhodných parametrů zpracování i použití vláken. Závisí na chemickém
VLASNOSI VLÁKEN 3. epelné vlastnosti vláken 3.. Úvod epelné vlastnosti vláken jsou velice důležité, neboť jsou rozhodující pro volbu vhodných parametrů zpracování i použití vláken. Závisí na chemickém
Inovace profesní přípravy budoucích učitelů chemie
 Inovace profesní přípravy budoucích učitelů chemie I n v e s t i c e d o r o z v o j e v z d ě l á v á n í CZ.1.07/2.2.00/15.0324 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem
Inovace profesní přípravy budoucích učitelů chemie I n v e s t i c e d o r o z v o j e v z d ě l á v á n í CZ.1.07/2.2.00/15.0324 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem
Rozdělení uhlovodíků
 Rozdělení uhlovodíků 1/8 Alkany a cykloalkany Obecné vzorce: alkany C n H 2n+2, cykloalkany C n H 2n, kde n je přirozené číslo Homologický přírustek: - CH 2 - Alkany přímé ( n - alkany) rozvětvené Primární,
Rozdělení uhlovodíků 1/8 Alkany a cykloalkany Obecné vzorce: alkany C n H 2n+2, cykloalkany C n H 2n, kde n je přirozené číslo Homologický přírustek: - CH 2 - Alkany přímé ( n - alkany) rozvětvené Primární,
HYDROXYDERIVÁTY. Alkoholy Fenoly Bc. Miroslava Wilczková
 HYDROXYDERIVÁTY Alkoholy Fenoly Bc. Miroslava Wilczková HYDROXYDERIVÁTY Alkoholy -OH skupina vázána na uhlíkový atom alifatického řetězce Fenoly -OH skupina vázána na uhlíku, který je součástí aromatického
HYDROXYDERIVÁTY Alkoholy Fenoly Bc. Miroslava Wilczková HYDROXYDERIVÁTY Alkoholy -OH skupina vázána na uhlíkový atom alifatického řetězce Fenoly -OH skupina vázána na uhlíku, který je součástí aromatického
ARENY. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: Ročník: devátý
 Autor: Mgr. Stanislava Bubíková ARENY Datum (období) tvorby: 13. 9. 2012 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci se seznámí s areny. V rámci tohoto
Autor: Mgr. Stanislava Bubíková ARENY Datum (období) tvorby: 13. 9. 2012 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci se seznámí s areny. V rámci tohoto
Ing. Hana Zmrhalová. Název školy: Autor: Název: VY_32_INOVACE_20_CH 9. Číslo projektu: Téma: Anotace: Datum: Základní škola Městec Králové
 Název školy: Autor: Základní škola Městec Králové Ing. Hana Zmrhalová Název: VY_32_INOVACE_20_CH 9 Číslo projektu: Téma: Anotace: CZ.1.07/1.4.00/21.2313 ORGANICKÁ CHEMIE PLASTY A SYNTETICKÁ VLÁKNA Prezentace,
Název školy: Autor: Základní škola Městec Králové Ing. Hana Zmrhalová Název: VY_32_INOVACE_20_CH 9 Číslo projektu: Téma: Anotace: CZ.1.07/1.4.00/21.2313 ORGANICKÁ CHEMIE PLASTY A SYNTETICKÁ VLÁKNA Prezentace,
Termodynamika (td.) se obecně zabývá vzájemnými vztahy a přeměnami různých druhů
 Termodynamika (td.) se obecně zabývá vzájemnými vztahy a přeměnami různých druhů energií (mechanické, tepelné, elektrické, magnetické, chemické a jaderné) při td. dějích. Na rozdíl od td. cyklických dějů
Termodynamika (td.) se obecně zabývá vzájemnými vztahy a přeměnami různých druhů energií (mechanické, tepelné, elektrické, magnetické, chemické a jaderné) při td. dějích. Na rozdíl od td. cyklických dějů
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Reakce a činidla v organické chemii I v organické chemii platí, že reakce je děj při němž dochází ke změně složení a vlastností látek. Při reakcích
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Reakce a činidla v organické chemii I v organické chemii platí, že reakce je děj při němž dochází ke změně složení a vlastností látek. Při reakcích
Uhlovodíky modelování pomocí soupravy základní struktury
 Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.1.28/02.0055 Uhlovodíky modelování pomocí soupravy základní struktury (laboratorní práce) Označení: EU-Inovace-Ch-9-03 Předmět: Chemie
Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.1.28/02.0055 Uhlovodíky modelování pomocí soupravy základní struktury (laboratorní práce) Označení: EU-Inovace-Ch-9-03 Předmět: Chemie
TERMOCHEMIE, TERMOCHEMICKÉ ZÁKONY, TERMODYNAMIKA, ENTROPIE
 TERMOCHEMIE, TERMOCHEMICKÉ ZÁKONY, TERMODYNAMIKA, ENTROPIE Chemická reakce: Jestliže se za vhodných podmínek vyskytnou 2 látky schopné spolu reagovat, nastane chemická reakce. Při ní z výchozích látek
TERMOCHEMIE, TERMOCHEMICKÉ ZÁKONY, TERMODYNAMIKA, ENTROPIE Chemická reakce: Jestliže se za vhodných podmínek vyskytnou 2 látky schopné spolu reagovat, nastane chemická reakce. Při ní z výchozích látek
Organická chemie 3.ročník studijního oboru - kosmetické služby.
 Organická chemie 3.ročník studijního oboru - kosmetické služby. T-7 Funkční a substituční deriváty karboxylových kyselin Zpracováno v rámci projektu Zlepšení podmínek ke vzdělávání Registrační číslo projektu:
Organická chemie 3.ročník studijního oboru - kosmetické služby. T-7 Funkční a substituční deriváty karboxylových kyselin Zpracováno v rámci projektu Zlepšení podmínek ke vzdělávání Registrační číslo projektu:
2.3 CHEMICKÁ VAZBA. Molekula bílého fosforu P 4 a kyseliny sírové H 2 SO 4. Předpona piko p je dílčí jednotkou a udává velikost m.
 2.3 CHEMICKÁ VAZBA Spojováním dvou a více atomů vznikají molekuly. Jestliže dochází ke spojování výhradně atomů téhož chemického prvku, pak se jedná o molekuly daného prvku (vodíku H 2, dusíku N 2, ozonu
2.3 CHEMICKÁ VAZBA Spojováním dvou a více atomů vznikají molekuly. Jestliže dochází ke spojování výhradně atomů téhož chemického prvku, pak se jedná o molekuly daného prvku (vodíku H 2, dusíku N 2, ozonu
Mol. fyz. a termodynamika
 Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
o Řetězové polymerizace o Stupňovité polymerizace Základní typy polymerizací
 vznik makromolekuly Vznik makromolekuly Základní typy polymerizací o Řetězové polymerizace radikálové iontové: aniontové, kationtové polymerizace za otevření kruhu koordinační polymerizace o Stupňovité
vznik makromolekuly Vznik makromolekuly Základní typy polymerizací o Řetězové polymerizace radikálové iontové: aniontové, kationtové polymerizace za otevření kruhu koordinační polymerizace o Stupňovité
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 ORGANIKÁ EMIE = chemie sloučenin látek obsahujících vazby Organické látky = všechny uhlíkaté sloučeniny kromě..., metal... and metal... Zdroje organických sloučenin = živé organismy nebo jejich fosílie:
ORGANIKÁ EMIE = chemie sloučenin látek obsahujících vazby Organické látky = všechny uhlíkaté sloučeniny kromě..., metal... and metal... Zdroje organických sloučenin = živé organismy nebo jejich fosílie:
Nauka o materiálu. Přednáška č.10 Difuze v tuhých látkách, fáze a fázové přeměny
 Nauka o materiálu Přednáška č.10 Difuze v tuhých látkách, fáze a fázové přeměny Difuze v tuhých látkách Difuzí nazýváme přesun atomů nebo iontů na vzdálenost větší než je meziatomová vzdálenost. Hnací
Nauka o materiálu Přednáška č.10 Difuze v tuhých látkách, fáze a fázové přeměny Difuze v tuhých látkách Difuzí nazýváme přesun atomů nebo iontů na vzdálenost větší než je meziatomová vzdálenost. Hnací
Obsah. 2. Mechanismus a syntetické využití nejdůležitějších organických reakcí 31 2.1. Adiční reakce 31 2.1.1. Elektrofilní adice (A E
 Obsah 1. Typy reakcí, reakčních komponent a jejich roztřídění 6 1.1. Formální kritérium pro klasifikaci reakcí 6 1.2. Typy reakčních komponent a způsob jejich vzniku jako další kriterium pro klasifikaci
Obsah 1. Typy reakcí, reakčních komponent a jejich roztřídění 6 1.1. Formální kritérium pro klasifikaci reakcí 6 1.2. Typy reakčních komponent a způsob jejich vzniku jako další kriterium pro klasifikaci
Struktura polymerů. Příprava (výroba).struktura vlastnosti. Materiálové inženýrství (Nauka o materiálu) Základní představy: přírodní vs.
 Struktura polymerů Základní představy: přírodní vs. syntetické V.Švorčík, vaclav.svorcik@vscht.cz celulóza přírodní kaučuk Příprava (výroba).struktura vlastnosti Materiálové inženýrství (Nauka o materiálu)
Struktura polymerů Základní představy: přírodní vs. syntetické V.Švorčík, vaclav.svorcik@vscht.cz celulóza přírodní kaučuk Příprava (výroba).struktura vlastnosti Materiálové inženýrství (Nauka o materiálu)
OCH/OC2. Heterocyklické sloučeniny
 CH/C2 Heterocyklické sloučeniny 1 ázvosloví 5-ti členné heterocykly 6-ti členné heterocykly 2 ázvosloví earomatické (nasycené) heterocykly. 3 Aromaticita heterocyklů 4 Aromaticita heterocyklů 5 Rezonanční
CH/C2 Heterocyklické sloučeniny 1 ázvosloví 5-ti členné heterocykly 6-ti členné heterocykly 2 ázvosloví earomatické (nasycené) heterocykly. 3 Aromaticita heterocyklů 4 Aromaticita heterocyklů 5 Rezonanční
EU peníze středním školám digitální učební materiál
 EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
Uhlovodíky Ch_026_Uhlovodíky_Uhlovodíky Autor: Ing. Mariana Mrázková
 Registrační číslo projektu: CZ.1.07/1.1.38/02.0025 Název projektu: Modernizace výuky na ZŠ Slušovice, Fryšták, Kašava a Velehrad Tento projekt je spolufinancován z Evropského sociálního fondu a státního
Registrační číslo projektu: CZ.1.07/1.1.38/02.0025 Název projektu: Modernizace výuky na ZŠ Slušovice, Fryšták, Kašava a Velehrad Tento projekt je spolufinancován z Evropského sociálního fondu a státního
Gymnázium Vysoké Mýto nám. Vaňorného 163, Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto H 3 C Vymezení arenů V aromatickém cyklu dochází k průniku orbitalů kolmých k rovině cyklu. Vzniká tzv. delokalizovaná vazba π. Stabilita benzenu
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto H 3 C Vymezení arenů V aromatickém cyklu dochází k průniku orbitalů kolmých k rovině cyklu. Vzniká tzv. delokalizovaná vazba π. Stabilita benzenu
MATERIÁLY A TECHNOLOGIE 1 PAVEL ČERNÝ
 MATERIÁLY A TECHNOLOGIE 1 PAVEL ČERNÝ Co vás napadne, když se řekne plast? Proč právě plasty? skupina syntetických materiálů slovo plast ze slova plastický, tvárný, formovatelný název plyne z chemické
MATERIÁLY A TECHNOLOGIE 1 PAVEL ČERNÝ Co vás napadne, když se řekne plast? Proč právě plasty? skupina syntetických materiálů slovo plast ze slova plastický, tvárný, formovatelný název plyne z chemické
PLASTY A SYNTETICKÁ VLÁKNA
 PLASTY A SYNTETICKÁ VLÁKNA Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 15. 1. 2013 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Chemie a společnost 1 Anotace: Žáci se seznámí
PLASTY A SYNTETICKÁ VLÁKNA Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 15. 1. 2013 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Chemie a společnost 1 Anotace: Žáci se seznámí
Výukový materiál v rámci projektu OPVK 1.5 Peníze středním školám. 4. ročník
 VY_32_INOVACE_CHK4_5560 ŠAL Výukový materiál v rámci projektu OPVK 1.5 Peníze středním školám Číslo projektu: CZ.1.07/1.5.00/34.0883 Název projektu: Rozvoj vzdělanosti Číslo šablony: III/2 Datum vytvoření:
VY_32_INOVACE_CHK4_5560 ŠAL Výukový materiál v rámci projektu OPVK 1.5 Peníze středním školám Číslo projektu: CZ.1.07/1.5.00/34.0883 Název projektu: Rozvoj vzdělanosti Číslo šablony: III/2 Datum vytvoření:
Typy vzorců v organické chemii
 Typy vzorců v organické chemii Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Březen 2010 Mgr. Alena Jirčáková Typy vzorců v organické chemii Zápis
Typy vzorců v organické chemii Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Březen 2010 Mgr. Alena Jirčáková Typy vzorců v organické chemii Zápis
MATURITNÍ OTÁZKY Z CHEMIE
 MATURITNÍ OTÁZKY Z CHEMIE 1 Složení a struktura atomu Vývoj představ o složení a struktuře atomu, elektronový obal atomu, modely atomu, pojem orbital, typy orbitalů, jejich znázorňování a pravidla pro
MATURITNÍ OTÁZKY Z CHEMIE 1 Složení a struktura atomu Vývoj představ o složení a struktuře atomu, elektronový obal atomu, modely atomu, pojem orbital, typy orbitalů, jejich znázorňování a pravidla pro
Složení a struktura atomu Charakteristika elementárních částic. Modely atomu. Izotopy a nuklidy. Atomové jádro -
 MATURITNÍ OKRUHY Z CHEMIE Obecná chemie Složení a struktura atomu Charakteristika elementárních částic. Modely atomu. Izotopy a nuklidy. Atomové jádro - hmotnostní úbytek, vazebná energie jádra, jaderné
MATURITNÍ OKRUHY Z CHEMIE Obecná chemie Složení a struktura atomu Charakteristika elementárních částic. Modely atomu. Izotopy a nuklidy. Atomové jádro - hmotnostní úbytek, vazebná energie jádra, jaderné
Polovodiče, křemík (silikony), germanium, arsen Druh učebního materiálu: Prezentace s interaktivitou Časová náročnost:
 Masarykova základní škola Klatovy, tř. Národních mučedníků 185, 339 01 Klatovy; 376312154, fax 376326089 E-mail: skola@maszskt.investtel.cz; internet: www.maszskt.investtel.cz Kód přílohy vzdělávací VY_32_INOVACE_CH8SA_01_03_15
Masarykova základní škola Klatovy, tř. Národních mučedníků 185, 339 01 Klatovy; 376312154, fax 376326089 E-mail: skola@maszskt.investtel.cz; internet: www.maszskt.investtel.cz Kód přílohy vzdělávací VY_32_INOVACE_CH8SA_01_03_15
2. Polarita vazeb, rezonance, indukční a mezomerní
 32 Polarita vazeb a reaktivita 2. Polarita vazeb, rezonance, indukční a mezomerní efekty ktetové pravidlo je užitečné pro prvky druhé periody (,, ) a halogeny. Formální náboj atomu určíme jako rozdíl počtu
32 Polarita vazeb a reaktivita 2. Polarita vazeb, rezonance, indukční a mezomerní efekty ktetové pravidlo je užitečné pro prvky druhé periody (,, ) a halogeny. Formální náboj atomu určíme jako rozdíl počtu
Zákony ideálního plynu
 5.2Zákony ideálního plynu 5.1.1 Ideální plyn 5.1.2 Avogadrův zákon 5.1.3 Normální podmínky 5.1.4 Boyleův-Mariottův zákon Izoterma 5.1.5 Gay-Lussacův zákon 5.1.6 Charlesův zákon 5.1.7 Poissonův zákon 5.1.8
5.2Zákony ideálního plynu 5.1.1 Ideální plyn 5.1.2 Avogadrův zákon 5.1.3 Normální podmínky 5.1.4 Boyleův-Mariottův zákon Izoterma 5.1.5 Gay-Lussacův zákon 5.1.6 Charlesův zákon 5.1.7 Poissonův zákon 5.1.8
HOŘENÍ A VÝBUCH. Ing. Hana Věžníková, Ph. D.
 HOŘENÍ A VÝBUCH Ing. Hana Věžníková, Ph. D. 1 HOŘENÍ A VÝBUCH Definice hoření Vysvětlení procesu hoření Základní podmínky pro hoření Co jsou hořlavé látky (hořlaviny) a jak je lze klasifikovat Chemické
HOŘENÍ A VÝBUCH Ing. Hana Věžníková, Ph. D. 1 HOŘENÍ A VÝBUCH Definice hoření Vysvětlení procesu hoření Základní podmínky pro hoření Co jsou hořlavé látky (hořlaviny) a jak je lze klasifikovat Chemické
Gymnázium, Milevsko, Masarykova 183 Školní vzdělávací program (ŠVP) pro vyšší stupeň osmiletého studia a čtyřleté studium 4.
 Vyučovací předmět - Chemie Vzdělávací obor - Člověk a příroda Gymnázium, Milevsko, Masarykova 183 Školní vzdělávací program (ŠVP) pro vyšší stupeň osmiletého studia a čtyřleté studium 4. ročník - seminář
Vyučovací předmět - Chemie Vzdělávací obor - Člověk a příroda Gymnázium, Milevsko, Masarykova 183 Školní vzdělávací program (ŠVP) pro vyšší stupeň osmiletého studia a čtyřleté studium 4. ročník - seminář
2.4 Stavové chování směsí plynů Ideální směs Ideální směs reálných plynů Stavové rovnice pro plynné směsi
 1. ZÁKLADNÍ POJMY 1.1 Systém a okolí 1.2 Vlastnosti systému 1.3 Vybrané základní veličiny 1.3.1 Množství 1.3.2 Délka 1.3.2 Délka 1.4 Vybrané odvozené veličiny 1.4.1 Objem 1.4.2 Hustota 1.4.3 Tlak 1.4.4
1. ZÁKLADNÍ POJMY 1.1 Systém a okolí 1.2 Vlastnosti systému 1.3 Vybrané základní veličiny 1.3.1 Množství 1.3.2 Délka 1.3.2 Délka 1.4 Vybrané odvozené veličiny 1.4.1 Objem 1.4.2 Hustota 1.4.3 Tlak 1.4.4
MAKROMOLEKULÁRNÍ CHEMIE
 MAKROMOLEKULÁRNÍ Doporučená literatura: CHEMIE OCH/MMC/MMCH doc.rndr. Jakub Stýskala, Ph.D. 1. Nálepa K.: Stručné základy chemie a fyziky polymerů, UPOL, 1990 2. Vollmert B: Základy makromolekulární chemie,
MAKROMOLEKULÁRNÍ Doporučená literatura: CHEMIE OCH/MMC/MMCH doc.rndr. Jakub Stýskala, Ph.D. 1. Nálepa K.: Stručné základy chemie a fyziky polymerů, UPOL, 1990 2. Vollmert B: Základy makromolekulární chemie,
Karboxylové kyseliny a jejich funkční deriváty
 Karboxylové kyseliny a jejich funkční deriváty Úvod Karboxylové kyseliny jsou nejdůležitější organické kyseliny. Jejich funkční skupina je karboxylová skupina a tento název je složen ze slov karbonyl a
Karboxylové kyseliny a jejich funkční deriváty Úvod Karboxylové kyseliny jsou nejdůležitější organické kyseliny. Jejich funkční skupina je karboxylová skupina a tento název je složen ze slov karbonyl a
Energie v chemických reakcích
 Energie v chemických reakcích Energetická bilance reakce CH 4 + Cl 2 = CH 3 Cl + HCl rozštěpení vazeb vznik nových vazeb V chemických reakcích dochází ke změně vazeb mezi atomy. Vazebná energie uvolnění
Energie v chemických reakcích Energetická bilance reakce CH 4 + Cl 2 = CH 3 Cl + HCl rozštěpení vazeb vznik nových vazeb V chemických reakcích dochází ke změně vazeb mezi atomy. Vazebná energie uvolnění
Charakteristika Teorie kyselin a zásad. Příprava kyselin Vlastnosti + typické reakce. Významné kyseliny. Arrheniova teorie Teorie Brönsted-Lowryho
 Petra Ustohalová 1 harakteristika Teorie kyselin a zásad Arrheniova teorie Teorie Brönsted-Lowryho Příprava kyselin Vlastnosti + typické reakce Fyzikální a chemické Významné kyseliny 2 Látky, které ve
Petra Ustohalová 1 harakteristika Teorie kyselin a zásad Arrheniova teorie Teorie Brönsted-Lowryho Příprava kyselin Vlastnosti + typické reakce Fyzikální a chemické Významné kyseliny 2 Látky, které ve
TERMOMECHANIKA 1. Základní pojmy
 1 FSI VUT v Brně, Energetický ústav Odbor termomechaniky a techniky prostředí prof. Ing. Milan Pavelek, CSc. TERMOMECHANIKA 1. Základní pojmy OSNOVA 1. KAPITOLY Termodynamická soustava Energie, teplo,
1 FSI VUT v Brně, Energetický ústav Odbor termomechaniky a techniky prostředí prof. Ing. Milan Pavelek, CSc. TERMOMECHANIKA 1. Základní pojmy OSNOVA 1. KAPITOLY Termodynamická soustava Energie, teplo,
OPVK CZ.1.07/2.2.00/
 OPVK CZ.1.07/2.2.00/28.0184 Základní principy vývoje nových léčiv OCH/ZPVNL Mgr. Radim Nencka, Ph.D. ZS 2012/2013 Molekulární interakce SAR Možné interakce jednotlivých funkčních skupin 1. Interakce alkoholů
OPVK CZ.1.07/2.2.00/28.0184 Základní principy vývoje nových léčiv OCH/ZPVNL Mgr. Radim Nencka, Ph.D. ZS 2012/2013 Molekulární interakce SAR Možné interakce jednotlivých funkčních skupin 1. Interakce alkoholů
DERIVÁTY UHLOVODÍKŮ, HALOGENDERIVÁTY
 DERIVÁTY UHLOVODÍKŮ, HALOGENDERIVÁTY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 26. 9. 2012 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci
DERIVÁTY UHLOVODÍKŮ, HALOGENDERIVÁTY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 26. 9. 2012 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci
Seminář z chemie. Charakteristika vyučovacího předmětu
 Seminář z chemie Časová dotace: 2 hodiny ve 3. ročníku, 4 hodiny ve 4. Ročníku Charakteristika vyučovacího předmětu Seminář je zaměřený na přípravu ke školní maturitě z chemie a k přijímacím zkouškám na
Seminář z chemie Časová dotace: 2 hodiny ve 3. ročníku, 4 hodiny ve 4. Ročníku Charakteristika vyučovacího předmětu Seminář je zaměřený na přípravu ke školní maturitě z chemie a k přijímacím zkouškám na
Škola: Gymnázium, Brno, Slovanské náměstí 7 III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Termochemie se zabývá tepelným zabarvením chemických reakcí Vychází z 1. termodynamického zákona. U změna vnitřní energie Q teplo W práce
 Termochemie Termochemie se zabývá tepelným zabarvením chemických reakcí Vychází z 1. termodynamického zákona U = Q + W U změna vnitřní energie Q teplo W práce Teplo a práce dodané soustavě zvyšují její
Termochemie Termochemie se zabývá tepelným zabarvením chemických reakcí Vychází z 1. termodynamického zákona U = Q + W U změna vnitřní energie Q teplo W práce Teplo a práce dodané soustavě zvyšují její
Chemie - 3. ročník. přesahy, vazby, mezipředmětové vztahy průřezová témata. očekávané výstupy RVP. témata / učivo. očekávané výstupy ŠVP.
 očekávané výstupy RVP témata / učivo Chemie - 3. ročník Žák: očekávané výstupy ŠVP přesahy, vazby, mezipředmětové vztahy průřezová témata 1.1., 1.2., 1.3., 1.4., 2.1. 1. Látky přírodní nebo syntetické
očekávané výstupy RVP témata / učivo Chemie - 3. ročník Žák: očekávané výstupy ŠVP přesahy, vazby, mezipředmětové vztahy průřezová témata 1.1., 1.2., 1.3., 1.4., 2.1. 1. Látky přírodní nebo syntetické
Výpočet stechiometrického a sumárního vzorce
 Výpočet stechiometrického a sumárního vzorce Stechiometrický (empirický) vzorec vyjadřuje základní složení sloučeniny udává, z kterých prvků se sloučenina skládá a v jakém poměru jsou atomy těchto prvků
Výpočet stechiometrického a sumárního vzorce Stechiometrický (empirický) vzorec vyjadřuje základní složení sloučeniny udává, z kterých prvků se sloučenina skládá a v jakém poměru jsou atomy těchto prvků
02 Nevazebné interakce
 02 Nevazebné interakce Nevazebné interakce Druh chemické vazby Určují 3D konfiguraci makromolekul, účastní se mnoha biologických procesů, zodpovědné za uspořádání molekul v krystalu Síla nevazebných interakcí
02 Nevazebné interakce Nevazebné interakce Druh chemické vazby Určují 3D konfiguraci makromolekul, účastní se mnoha biologických procesů, zodpovědné za uspořádání molekul v krystalu Síla nevazebných interakcí
Mezimolekulové interakce
 Mezimolekulové interakce Interakce molekul reaktivně vzniká či zaniká kovalentní vazba překryv elektronových oblaků, mění se vlastnosti nereaktivně vznikají molekulové komplexy slabá, nekovalentní, nechemická,
Mezimolekulové interakce Interakce molekul reaktivně vzniká či zaniká kovalentní vazba překryv elektronových oblaků, mění se vlastnosti nereaktivně vznikají molekulové komplexy slabá, nekovalentní, nechemická,
Autoři: Pavel Zachař, David Sýkora Ukázky spekter k procvičování na semináři: Tento soubor je pouze prvním ilustrativním seznámením se základními prin
 Autoři: Pavel Zachař, David Sýkora Ukázky spekter k procvičování na semináři: Tento soubor je pouze prvním ilustrativním seznámením se základními principy hmotnostní spektrometrie a v žádném případě nezahrnuje
Autoři: Pavel Zachař, David Sýkora Ukázky spekter k procvičování na semináři: Tento soubor je pouze prvním ilustrativním seznámením se základními principy hmotnostní spektrometrie a v žádném případě nezahrnuje
Uhlíkové struktury vázající ionty těžkých kovů
 Uhlíkové struktury vázající ionty těžkých kovů 7. června/june 2013 9:30 h 17:30 h Laboratoř metalomiky a nanotechnologií, Mendelova univerzita v Brně a Středoevropský technologický institut Budova D, Zemědělská
Uhlíkové struktury vázající ionty těžkých kovů 7. června/june 2013 9:30 h 17:30 h Laboratoř metalomiky a nanotechnologií, Mendelova univerzita v Brně a Středoevropský technologický institut Budova D, Zemědělská
3. ročník Vzdělávací obor - Člověk a příroda
 Gymnázium, Milevsko, Masarykova 183 Školní vzdělávací program (ŠVP) pro vyšší stupeň osmiletého studia a čtyřleté studium Vyučovací předmět - Chemie 3. ročník Vzdělávací obor - Člověk a příroda Očekávané
Gymnázium, Milevsko, Masarykova 183 Školní vzdělávací program (ŠVP) pro vyšší stupeň osmiletého studia a čtyřleté studium Vyučovací předmět - Chemie 3. ročník Vzdělávací obor - Člověk a příroda Očekávané
Chemie Ch3 volitelný předmět pro 4. ročník
 Chemie Ch3 volitelný předmět pro 4. ročník Charakteristika vyučovacího předmětu Vyučovací předmět vychází ze vzdělávací oblasti Člověk a příroda, vzdělávacího oboru Chemie. Mezipředmětové přesahy a vazby
Chemie Ch3 volitelný předmět pro 4. ročník Charakteristika vyučovacího předmětu Vyučovací předmět vychází ze vzdělávací oblasti Člověk a příroda, vzdělávacího oboru Chemie. Mezipředmětové přesahy a vazby
17. Organické názvosloví
 17. Organické názvosloví 1) základní info 2) základní principy názvosloví uhlovodíků a organických sloučenin 3) izomerie a formy izomerie 4) řešení praktických příkladů 1) Základní info * Organická chemie
17. Organické názvosloví 1) základní info 2) základní principy názvosloví uhlovodíků a organických sloučenin 3) izomerie a formy izomerie 4) řešení praktických příkladů 1) Základní info * Organická chemie
ALKOHOLY, FENOLY A ETHERY. b. Jaké zdroje cukru znáte a jak se nazývají produkty jejich kvašení?
 ALKOLY, FENOLY A ETHERY Kvašení 1. S použitím literatury nebo internetu odpovězte na následující otázky: a. Jakým způsobem v přírodě vzniká etanol? Napište rovnici. b. Jaké zdroje cukru znáte a jak se
ALKOLY, FENOLY A ETHERY Kvašení 1. S použitím literatury nebo internetu odpovězte na následující otázky: a. Jakým způsobem v přírodě vzniká etanol? Napište rovnici. b. Jaké zdroje cukru znáte a jak se
