Cisplatina a gemcitabin s placebem nebo bevacizumabem v léčbě první linie u nedlaždicobuněčného nemalobuněčného karcinomu plic studie fáze III: AVAiL
|
|
|
- Vojtěch Mašek
- před 8 lety
- Počet zobrazení:
Transkript
1 ročník 1 číslo 2 2. června 200 Jou r n a l o f Clinical On c o l o g y původní sdělení Cisplatina a gemcitabin s placebem nebo bevacizumabem v léčbě první linie u nedlaždicobuněčného nemalobuněčného karcinomu plic studie fáze III: AVAiL Martin Reck, Joachim von Pawel, Petr Zatloukal, Rodryg Ramlau, Vera Gorbounova, Vera Hirsh, Natasha Leighl, Jörg Mezger, Venice Archer, Nicola Moore a Christian Manegold Krankenhaus Grosshansdorf, Grosshansdorf; Asklepios Fachkliniken Mnichov Gauting, Mnichov Gauting; St. Vincentius Kliniken, Karlsruhe; Heidelberg University Medical Center, Mannheim, Německo; 3. lékařská fakulta Univerzity Karlovy, IPVZ, Praha, Česká republika; Wielkopolskie Centrum Chorob Pluc i Gruzlicy, Poznaň, Polsko; Cancer Research Center, Moskva, Rusko; McGill University Health Centre Royal Victoria Hospital, Montreal, Quebec; Princess Margaret Hospital, Toronto, Ontario, Kanada, a F. Hoffmann-La Roche Ltd, Basilej, Švýcarsko. Podáno 20. září 200; přijato 20. října 200; publikováno online před tiskem na 2. února 200. Podpořeno firmou F. Hoffmann La Roche Ltd. Práce byla zčásti prezentována na 43. výročním setkání ASCO (American Society of Clinical Oncology), 1. až. června 200 v Chicagu, IL, a na 12. světové konferenci o plicním karcinomu, 2. až. září 200 v Seoulu v Jižní Koreji. Prohlášení autorů o možném střetu zájmů a podíl jednotlivých autorů na přípravě článku se nacházejí na jeho konci. Adresa pro korespondenci: Martin Reck, MD, Department of Thoracic Oncology, Hospital Grosshansdorf, Wohrendamm 0, 222 Grosshansdorf, Germany; e mail: dr.martin.reck@web.de. 200 by American Society of Clinical Oncology X/0/20 122/$20.00 S o u h r n Cíl Bevacizumab, monoklonální protilátka proti receptoru pro vaskulární endoteliální růstový faktor, zlepšuje v kombinaci s carboplatinou a paclitaxelem přežití u pacientů s pokročilým nedlaždicobuněčným nemalobuněčným plicním karcinomem (non small cell lung cancer, NSCLC). Tato randomizovaná studie fáze III zkoumala účinnost a bezpečnost terapie bevacizumabem v kombinaci s chemo terapií cisplatinou a gemcitabinem (cisplatin/gemcitabine, CG). Pacienti a metody Pacienti byli náhodně rozděleni do léčebných skupin, kde jim bylo podáno až šest cyklů chemoterapie s cisplatinou v dávce 0 mg/m 2 a gemcitabinem v dávce 1 20 mg/m 2 buď v kombinaci s nízkou dávkou bevacizumabu (, mg/kg), vysokou dávkou bevacizumabu (1 mg/kg) nebo s placebem každé tři týdny až do známek progrese onemocnění. Studie nebyla navržena tak, aby obě různé dávky bevacizumabu srovnávala přímo. Primární cíl byl pozměněn z celkové délky přežití (overall survival, OS) na délku přežití bez známek progrese onemocnění (progression free survival, PFS). Mezi únorem 200 a srpnem 200 bylo randomizováno pacientů (placebová skupina n = 34; skupina s nízkou dávkou bevacizumabu n = 34; skupina s vysokou dávkou bevacizumabu n = 31). Výsledky Délka přežití bez známek progrese onemocnění byla výrazně prodloužena; poměr rizika byl pro PFS ve skupině s nízkou dávkou bevacizumabu v porovnání s placebem 0, (střední délka PFS, měsíců vs.,1 měsíců pro placebo; p = 0,003) a ve skupině s vysokou dávkou bevacizumabu 0,2 (střední délka PFS, měsíců vs.,1 měsíců pro placebo; p = 0,03). Počet objektivních léčebných odpovědí byl 20,1 % v placebové skupině, 34,1 % ve skupině s nízkou dávkou a 30,4 % ve skupině s vysokou dávkou bevacizumabu. Doba sledování pacientů nebyla dostatečná pro analýzu celkového přežití. Incidence nežádoucích účinků stupně 3 a vyššího byla obdobná ve všech větvích. Míra výskytu plicního krvácení stupně 3 byla 1, % pro všechny větve přesto, že % pacientů užívalo antikoagulancia. Závěr Kombinace bevacizumabu (, nebo 1 mg/kg) s chemoterapií CG signifikantně zlepšuje PFS a zvyšuje míru objektivní léčebné odpovědi. Bevacizumab v kombinaci s chemoterapií na bázi platinových derivátů poskytuje pacientům s pokročilým NSCLC, kteří jsou vhodnými kandidáty léčby touto monoklonální protilátkou, významný klinický prospěch. J Clin Oncol 2: by American Society of Clinical Oncology DOI: /JCO Úvod Vaskulární endoteliální růstový faktor (vascular endothelial growth factor, VEGF) podporuje angiogenezi, která představuje kritický proces pro progresi nádorového onemocnění. 1 4 U nemalobuněčného karcinomu plic (non small cell lung cancer, NSCLC) je zvýšená exprese VEGF častým jevem a je spojena s nepříznivým klinickým průběhem. Bevacizumab, humanizovaná monoklonální anti VEGF protilátka, prokázal významný klinický účinek v léčbě první a druhé linie u kolorektálního karcinomu a v léčbě první linie u nedlaždicobuněčného NSCLC, metastatického karcinomu prsu a karcinomu ledvin. 10 Ve fázi II randomizované studie se třemi větvemi srovnávající u pacientů s pokročilým NSCLC chemoterapii carboplatinou a paclitaxelem (carboplatina/paclitaxel, CP) s chemo terapií CP v kombinaci s bevacizumabem (, m/kg nebo 1 mg/kg každé tři týdny) bylo ve větvi s bevacizumabem v dávce 1 mg/kg zaznamenáno významné prodloužení doby do progrese onemocnění, 11 což vedlo skupinu ECOG (Eastern Cooperative Onco- 200 by American Society of Clinical Oncology Journal of Clinical Oncology, Vol 2, No (March 10), 200: pp
2 Cisplatina a gemcitabin s placebem nebo bevacizumabem v léčbě první linie u NSCLC logy Group) k výběru dávky 1 mg/kg pro fázi III studie E4 u pacientů s NSCLC. Plicní krvácení bylo ve výše uvedené studii fáze II 11 pozorováno u čtyř ze 13 pacientů léčených bevacizumabem, přičemž jejich tumory vykazovaly převážně dlaždicobuněčnou histologii. Toto zjištění vedlo k vyřazení nemocných s dlaždicobuněčnými karcinomy plic z většiny klinických studií s bevacizumabem u NSCLC. Studie E4 demonstrovala u pacientů s nedlaždicobuněčným NSCLC značný klinický prospěch kombinované léčby chemoterapií CP a bevacizumabem v porovnání se samotnou chemoterapií, kdy poměr rizika (HR) byl 0, pro přežití bez známek progrese onemocnění (progression free survival, PFS) a 0, pro celkové přežití (overall survival, OS). Bezpečnost léčby byla přijatelná, závažné (stupeň tři až pět) plicní krvácení se vyskytlo u osmi (1, %) pacientů léčených bevacizumabem. Námi předkládaná studie sleduje léčbu bevacizumabem v kombinaci s cisplatinou a gemcitabinem (cisplatina/gemcitabin, CG), chemo terapeutickým režimem u NSCLC často používaným a účinným. Do dnešního dne zatím žádná velká klinická studie nevyhodnocovala bezpečnost a účinnost bevacizumabu v kombinaci s cisplatinou a gemcitabinem. Rozhodli jsme se proto opětovně porovnat obě dávkovací schémata bevacizumabu v kombinaci s uvedeným chemoterapeutickým režimem proti placebu se stejnou chemoterapií. Pacienti a metody Pacienti Vhodnými kandidáty byli nemocní, kteří měli histologicky nebo cytologicky verifikovaný, pokročilý (stadium IIIB s metastatickým postižením supraklavikulárních lymfatických uzlin nebo maligním pleurálním či perikardiálním výpotkem, nebo stadium IV) či recidivující nedlaždicobuněčný NSCLC. Další vstupní kritéria zahrnovala věk 1 let, výkonnostní status 0 až 1 dle ECOG (Eastern Cooperative Oncology Group) a přiměřené hematologické, jaterní a renální laboratorní parametry. Vylučovací kritéria pak zahrnovala smíšené nemalobuněčné malobuněčné tumory nebo smíšené adenoskvamózní karcinomy s predominantně dlaždicobuněčnou komponentou, anamnézu hemoptýzy stupně 2 a výše ( polovina čajové lžičky jasně červené krve v průběhu jedné epizody), metastázy do CNS, anamnézu trombofilního stavu nebo hemoragické diatézy, antikoagulační terapii v době náboru (v průběhu studie byla umožněna plná antikoagulace pro léčbu žilní trombózy), současné a nedávné užívání aspirinu (> 32 mg/den), klinicky závažné kardiovaskulární onemocnění, nekontrolovanou hypertenzi, nehojící se rány, ulcerace nebo fraktury, paliativní radioterapii kostních metastáz mimo hrudník v průběhu dvou týdnů před zahájením léčby, chirurgický výkon v průběhu čtyř týdnů před zahájením léčby a těhotenství nebo laktaci. Ze studie byli rovněž vyloučeni pacienti, jejichž nádory (na základě zhodnocení radiodiagnostických nálezů) těsně sousedily s nebo invadovaly do velkých cév. Ačkoli byla v protokolu studie uvedena příslušná doporučení, spoléhalo se při interpretaci snímků a hodnocení lokalizace nádoru na zkušenosti výzkumníků a radiologů. Protokol studie byl schválen místními etickými komisemi a studie probíhala v souladu s Helsinskou deklarací a směrnicemi pro dobrou klinickou praxi International Conference on Harmonization Tripartite Guideline. Uspořádání studie Vybraní pacienti byli centralizovanou randomizační procedurou rozděleni do léčebných skupin chemoterapie CG v kombinaci s bevacizumabem (, nebo 1 mg/kg) nebo chemoterapie CG v kombinaci s placebem v nízké či vysoké dávce (obr. 1). Vzhledem k tomu, že byla k dispozici pouze jedna velikost ampulek bevacizumabu, byla pro zachování zaslepenosti léčby ve studii rozdělena placebová větev na skupinu s nízkou a vysokou dávkou; centra nebyla informována o tom, zda podávají bevacizumab nebo placebo, ale znala rozdělení pacientů podle dávek. Pacienti zařazení do větví s vysokou a nízkou dávkou placeba byli pro všechny další analýzy sloučeni do jedné placebové skupiny. Obrázek 1. Schéma studie. CG, cisplatina plus gemcitabin; NSCLC, nemalobuněčný karcinom plic (non small cell lung cancer); PD, progresivní onemocnění (progressive disease). Stratifikační faktory zahrnovaly region, stadium (IIIB, IV nebo recidiva), výkonnostní status dle ECOG (0 nebo 1) a pohlaví. Cisplatina byla aplikována intravenózně v dávce 0 mg/m 2 první den chemoterapie a gemcitabin byl podáván intravenózně v dávce 1 20 mg/m 2 první a osmý den cyklu. Chemoterapie byla opakována každé tři týdny v celkovém počtu až šesti cyklů za předpokladu, že se neobjevily známky progrese onemocnění nebo nedošlo k projevům neakceptovatelné toxicity terapie. Zaslepená léčba, tj. placebo nebo bevacizumab, byla podávána intravenózně současně s chemoterapií každé tři týdny, vždy první den chemoterapeutického cyklu. Zaslepení rozdělení do léčebných skupin bylo zachováno i u všech pacientů, kteří vystoupili ze studie v průběhu chemoterapie spolu s bevacizumabem/placebem v důsledku progrese onemocnění. U pacientů, kteří dokončili šest cyklů chemoterapie kombinované s léčbou bevacizumabem/placebem bylo zachování zaslepenosti studie různé kvůli změnám v protokolu. Před uskutečněním změn v protokolu bylo pacientům zařazeným do větví s bevacizumabem umožněno pokračovat v monoterapii bevacizumabem ve stejné dávce, jaká jim byla při úvodní randomizaci přidělena. Nemocní v placebové skupině pak již byli pouze sledováni a žádná další léčba jim až do doby progrese onemocnění podávána nebyla. Úprava protokolu vyloučila volitelné odslepení po ukončení šesti cyklů terapie. Pacienti zařazení do studie po zavedení uvedených změn protokolu již pokračovali v zaslepené monoterapii bevacizumabem nebo placebem každé tři týdny až do objevení se známek progrese onemocnění nebo projevů neakceptovatelné toxicity léčby (obr. 2). Přestup z placebové větve do větve s bevacizumabem nebyl povolen v žádném časovém období studie. Bevacizumab a placebo poskytla firma F. Hoffmann La Roche Ltd (Basilej, Švýcarsko). Hodnocení bezpečnosti a účinnosti Po vstupním vyhodnocení byl charakter nádoru posuzován každé tři cykly (přibližně každých devět týdnů) v průběhu celé léčby v rámci studie. Jestliže pacient odstoupil od studie z jiného důvodu než progrese onemocnění, bylo následné posuzování nádoru prováděno každé dva měsíce až do doby progrese. Reakce nádoru na léčbu byla výzkumníky hodnocena podle směrnic RECIST (Response Evaluation Criteria in Solid Tumors). 12 Za průběžné hodnocení nezaslepených bezpečnostních údajů byl odpovědný nezávislý orgán Data and Safety Monitoring Board. Nežádoucí účinky byly odstupňovány s použitím směrnic National Cancer Institute Common Toxicity Criteria for Adverse Events verze 3.0 a kódovány podle Medical Dictionary for Regulatory Activities. Byla rovněž shromažďována laboratorní data, jež byla dále poskytována členům Data and Safety Monitoring Board. Statistická analýza Primárním sledovaným cílem bylo nestratifikované PFS, které bylo definováno jako doba od randomizace do prvních dokumentovaných známek progrese onemocnění (podle Response Evaluation Criteria in Solid Tumors) nebo do úmrtí. Sekundární cíle zahrnovaly míru objektivní léčebné odpovědi, trvání odpovědi a celkovou délku přežití. Pacienti, kteří přerušili léčbu v rámci studie z jiného důvodu než progrese onemocnění nebo úmrtí, byli i nadále sledováni k zachycení progrese. Pacienti bez dokumentované progrese onemocnění nebo úmrtí byli při posledním hodnocení nádoru cenzorováni. Pro primární analýzu účinnosti byla vybrána populace podle by American Society of Clinical Oncology
3 Reck et al. Obrázek 2. Souhrnný přehled rozdělení pacientů (podle randomizace). Léčba ve studii (trial treatment, TT) zahrnovala bevacizumab nebo placebo v kombinaci s chemoterapií cisplatinou a gemcitabinem (CG). (*) Dokončení všech částí TT podle plánu v protokolu. ( ) Nemocní, kteří předčasně ukončili chemoterapii, mohli pokračovat do další fáze studie, která zahrnovala monoterapii bevacizumabem nebo placebem či observaci. ( ) Placebo, n = 1; observace, n = 10. původního léčebného záměru (intent to treat population), jež byla definována všemi pacienty, kteří byli ve studii randomizováni. Studie byla původně zahájena s dvoustupňovou adaptivní strukturou a jako primární cíl byla stanovena celková délka přežití. Po prvním stupni byla na základě průběžné analýzy bezpečnosti a účinnosti (PFS) jedna větev s bevacizumabem vyřazena, což změnilo strukturu studie na dvouvětvovou, srovnávající chemoterapii CG plus placebo s chemoterapií CG v kombinaci s vybranou dávkou bevacizumabu. Po příznivých výsledcích studie E4 ohledně OS 13 byl design naší studie upraven tak, že došlo ke změně primárního cíle z OS na PFS. Toto rozhodnutí bylo učiněno z důvodu zabezpečení dokončení studie, urychlení doplnění údajů o účinnosti a tím zajištění rychlé dostupnosti potenciálně účinné léčebné možnosti pro pacienty s tímto onemocněním a též z důvodu vyloučení rizika zkreslení konečného cíle, tj. OS při zvyšujícím se užívání terapií druhé linie (včetně přestupů pacientů z placebové větve do větve s bevacizumabem mimo protokol). Kromě toho bylo přijato i jednostupňové uspořádání srovnávající chemoterapii CG v kombinaci se dvěma různými dávkami bevacizumabu proti chemoterapii CG plus placebo, ačkoli studie nebyla strukturována tak, aby umožnila přímé porovnání obou větví s bevacizumabem. Průběžná analýza byla provedena pouze s cílem zhodnotit bezpečnost. Na základě přínosu ve formě prodloužení PFS pozorovaného ve studii E4 (HR = 0,; střední délka PFS 4, měsíce ve skupině s placebem oproti,4 měsíce ve skupině s bevacizumabem), byla finální analýza PFS v naší studii naplánována po 430 událostech nebo po dosažení střední délky sledování u všech nemocných v trvání minimálně sedmi měsíců. Všechny výpočty byly prováděny s použitím log rank testu a zahrnovaly oboustranné hodnoty p s hladinou významnosti α = 0,0 a silou testu 0 %. Všechny analýzy, které jsou zde uváděny, byly realizovány po uzávěrce dat. října 200, přičemž do tohoto data bylo zaznamenáno PFS událostí a 3 úmrtí. Na základě přínosu v podobě delšího přežití pozorovaného ve studii E4 (HR = 0,; střední délka OS 10,2 měsíců ve skupině s placebem oproti 12, měsíců ve skupině s bevacizumabem) 13 je v naší studii plánováno provedení analýzy OS po 0 úmrtích, což je dostatečné k zajištění 0% síly oboustranného log rank testu na hladině významnosti α = 0,0. Distribuce událostí v čase byla odhadnuta s použitím Kaplanovy Meierovy metody. Abychom se vyhnuli mnohonásobnému testování, byl nejprve užit log rank test na shodu přes všechna strata a teprve v případě zamítnutí shody byl aplikován srovnávací test na dvojice PFS. Další plánované analýzy zahrnovaly cenzorování PFS u jiné (mimo protokol) protinádorové terapie podávané před progresí onemocnění, míru terapeutické odpovědi a trvání léčebné odpovědi. Pro porovnání míry objektivních léčebných odpovědí byl proveden χ 2 test se Schoutenovou korekcí. VÝSLEDKY Charakteristika pacientů Mezi únorem 200 a srpnem 200 bylo ve 10 centrech ve 20 zemích Evropy, východní Asie, Austrálie, Střední a Jižní Ameriky a v Kanadě randomizováno pacientů. Z tohoto množství jich bylo celkem 34 přiděleno do skupiny léčené chemoterapií CG a placebem, 34 bylo zařazeno do skupiny léčené chemoterapií CG a nízkou dávkou bevacizumabu a 31 nemocných bylo léčeno chemoterapií CG v kombinaci s vysokou dávkou bevacizumabu. Z celkového počtu randomizovaných pacientů nebyla nemocným podána žádná studijní léčba z důvodu nedodržení kritérií pro výběr vhodných kandidátů (n = 2), zrušení informovaného souhlasu (n = 1), nežádoucích reakcí (n = ) a dalších důvodů (n = ). Tabulka 1 uvádí vybrané demografické a vstupní charakteristiky všech randomizovaných pacientů, které byly mezi léčebnými rameny vzájemně vyvážené. Léčba Ve skupině s placebem a vysokou dávkou bevacizumabu byl střední počet chemoterapeutických cyklů pět a ve skupině s nízkou dávkou bevacizumabu šest (tab. 2). Rovněž střední počet cyklů terapie bevacizumabem nebo placebem byl pět v placebové skupině a skupině s vysokou dávkou bevacizumabu a šest ve větvi s nízkou dávkou bevacizumabu. V porovnání s placebovou skupinou byla ve větvích s bevacizumabem pozorována lehce vyšší míra ukončení léčby v důsledku nežádoucích účinků (2 % ve skupině s chemoterapií CG a nízkou dávkou bevacizumabu a 30 % ve skupině s chemoterapií CG a vysokou dávkou bevacizumabu oproti % v placebové větvi). Obrázek 2 ukazuje, že šest cyklů terapie v rámci studie dokončilo 4 % až 4 % pacientů, z čehož 3 % až 42 % pokračovalo do dalšího období monoterapie nebo sledování. Devadesát čtyři procent nemocných vhodných k monoterapii bevacizumabem tak sedmým cyklem zahájilo udržovací terapii touto protilátkou. V porovnání s placebovou větví a větví s nízkou dávkou bevacizumabu byla ve skupině s vysokou dávkou bevacizumabu ve větší míře zahajována neprotokolární protinádorová léčba (nonprotocol antineoplastic therapy, NPT) před známkami progrese onemocnění ( % vs. %). 200 by American Society of Clinical Oncology Journal of Clinical Oncology
4 Cisplatina a gemcitabin s placebem nebo bevacizumabem v léčbě první linie u NSCLC charakteristika Tabulka 1. souhrn klíčových demografických charakteristik (populace podle původního léčebného záměru) placebo cg (n 34) Bevacizumab, mg/kg cg (n 34) Bevacizumab 1 mg/kg cg (n 31) počet pacientů % počet pacientů % počet pacientů % věk, roky střední rozsah pohlaví mužské Ženské ecog ps stadium onemocnění iiib bez výpotku iiib s výpotkem iv recidivující region Západní evropa/austrálie/kanada východní evropa východní asie střední/jižní amerika Ztráta tělesné hmotnosti % vstupně diagnóza Histologicky cytologicky Histologická klasifikace adenokarcinom velkobuněčný karcinom smíšený tumor s převažující adenokarcinomovou komponentou další poznámka. ve studii nebylo v žádném případě umožněno, aby byli zařazeni pacienti předléčení chemoterapií nebo jinou systémovou protinádorovou léčbou; předchozí chirurgický výkon nebo radioterapie byly povoleny. Zkratky: cg, cisplatina plus gemcitabin; ecog, eastern cooperative oncology group; ps, stav výkonnosti (performance status). Jestliže byla u konkrétního pacienta k dispozici jak cytologická, tak histologická diagnóza, byla použita diagnóza histologická. Analýza účinnosti Přežití bez známek progrese onemocnění, tj. primární cíl studie, bylo v obou skupinách s bevacizumabem v porovnání s placebem signifikantně delší. Poměr rizika (HR) pro PFS byl ve skupině s nízkou dávkou bevacizumabu proti placebu 0, (p = 0,003; střední délka PFS, vs.,1 měsíců, v uvedeném pořadí) a ve skupině s vysokou dávkou bevacizumabu 0,2 (p = 0,03; střední délka PFS, vs.,1 měsíců; obr. 3). Ačkoli se relativní léčebný účinek obou dávek bevacizumabu proti placebu zdál být podobný, studie nebyla dostatečně vybavena k tomu, aby přímo porovnávala obě dávky. Bevacizumab navíc prokázal účinnost napříč mnoha podskupinami nemocných (obr. 4). V porovnání s placebem byla rovněž v obou větvích s bevacizumabem pozorována výrazně vyšší míra objektivní léčebné odpovědi; v placebové skupině byla míra objektivní odpovědi 20,1 %, ve větvi s nízkou dávkou bevacizumabu 34,1 % (p < 0,0001) a ve větvi s vysokou dávkou bevacizumabu 30,4 % (p = 0,00). Střední délka trvání léčebné odpovědi byla v placebové skupině 4, měsíců, ve skupině s nízkou dávkou bevacizumabu,1 a ve větvi s vysokou dávkou bevacizumabu,1 měsíců. V rámci primární analýzy PFS ve studii AVAiL (Avastin in Lung) byli všichni pacienti, kteří v době ukončení sběru dat nebyli mrtví nebo nevykazovali známky progrese onemocnění, při posledním posouzení tumorózního nálezu cenzorováni, a to i v případě, že podstoupili další linii léčby. Předem plánovaná analýza senzitivity byla provedena s cílem kompenzovat případný zavádějící účinek aplikace NPT před progresí onemocnění. Pacienti, u nichž nedošlo ke sledované příhodě před zahájením NPT, byli při posledním hodnocení nádoru ještě před započetím NPT cenzorováni. V rámci této analýzy senzitivity byl v porovnání s placebem HR pro skupinu s nízkou dávkou bevacizumabu 0, (% CI; 0, 0,3; p = 0,0001) a pro skupinu s vysokou dávkou bevacizumabu 0,4 (% CI; 0,0 0,0; p = 0,002). Podklady pro analýzu sekundárního cíle, tj. OS (overall survival celková délka přežití), jsou v současnosti neúplné vzhledem k omezené době sledování. V době finální analýzy PFS byla zaznamenána jen polovina (n = 3) z potřebného počtu 0 úmrtí. Bezpečnost Všichni randomizovaní pacienti, kterým byla podána alespoň jedna dávka studijní léčby (bezpečnostní populace safety population) byli zařazeni do analýzy bezpečnosti. Jakýkoli pacient, kterému byl při jedné nebo více příležitostech chybně podán bevacizumab, byl přiřazen k příslušné větvi s bevacizumabem. Většina nežádoucích účinků (adverse events, AE), která byla v průběhu studie hlášena, byla stupně jedna nebo dva. Tabulka by American Society of Clinical Oncology
5 Reck et al. Tabulka 2. expozice bevacizumabu a chemoterapii podle jednotlivých léčebných větví (bezpečnostní populace), expozice npt a status pacientů v okamžiku ukončení sběru klinických dat (. října 200; itt populace) expozice a status střední počet chemoterapeutických cyklů střední počet léčebných cyklů s bevacizumabem/placebem střední délka trvání léčby bevacizumabem/placebem, měsíce počet cyklů u pacientů s iniciální chemoterapií placebo cg (n 32) Bevacizumab, mg/kg cg (n 330) Bevacizumab 1 mg/kg cg (n 32) počet pacientů % počet pacientů % počet pacientů % 3, počet cyklů u pacientů podstupující udržovací léčbu bevacizumabem po ukončení chemoterapie status pacientů podstoupivší npt před progresí onemocnění podstoupivší npt před nebo po zjištění progrese onemocnění Živí v průběhu léčby Živí při dalším sledování Zkratky: npt, neprotokolární protinádorová chemoterapie (nonprotocol antineoplastic therapy); itt, podle původního léčebného záměru (intent to treat); cg, cisplatina plus gemcitabin. devadesát čtyři procent vhodných pacientů pokračovalo sedmým cyklem v monoterapii bevacizumabem. 4, 4,4 uvádí seznam závažných AE ( stupeň 3). Celková incidence nežádoucích účinků stupně tři a výše byla obdobná napříč všemi větvemi (tab. 3). Celková incidence závažných AE byla vyšší ve větvi s chemo terapií CG a vysokou dávkou bevacizumabu (44 %) v porovnání se skupinou, kde byla podávána chemoterapie CG a placebo (3 %) a skupinou léčenou chemoterapií CG a nízkou dávkou bevacizumabu (3 %). Výskyt hypertenze, zvracení, neutropenie, krvácení a proteinurie stupně tři byl lehce vyšší ve větvích s bevacizumabem než v placebové skupině. Febrilní neutropenie se vyskytla u dvou procent nemocných v každé z obou větví s bevacizuma- Tabulka 3. souhrný přehled vybraných závažných (stupeň 3) ae, zvláště sledovaných závažných ae a epizod plicního krvácení (bezpečnostní populace) ae placebo cg (n 32) Bevacizumab, mg/kg cg (n 330) Bevacizumab 1 mg/kg cg (n 32) počet pacientů % počet pacientů % počet pacientů % pacienti s 1 závažným (stupeň 3) ae neutropenie trombocytopenie 2 anémie astenie Zvracení Hypertenze Zvláště sledované závažné ae Krvácení proteinurie perforace gastrointestinálního traktu ischemické příhody Žilní tromboembolické příhody Hemoptýza (všechny stupně) 1,2,0 32, plicní krvácení (stupeň 3) 2 0, 1, 3 0, Fatální plicní krvácení 1 0,3 4 1,2 3 0, Zkratky: ae, nežádoucí účinek (adverse event); cg, cisplatina plus gemcitabin. Febrilní neutropenie se vyskytla u čtyř (1 %) pacientů v placebové skupině, pěti (2 %) pacientů ve skupině s nízkou dávkou bevacizumabu a u sedmi (2 %) nemocných ve větvi s vysokou dávkou bevacizumabu. Zahrnuje příhody označované jako ischemie nebo infarkt myokardu, mozkový infarkt, cerebrovaskulární příhoda, mozková ischemie, ischemický iktus a periferní arteriální trombóza by American Society of Clinical Oncology Journal of Clinical Oncology
6 Cisplatina a gemcitabin s placebem nebo bevacizumabem v léčbě první linie u NSCLC Přežití bez známek progrese onemocnění (pravděpodobnost) Přežití bez známek progrese onemocnění (pravděpodobnost) Čas (měsíce) Čas (měsíce) Obrázek 3. Grafické zobrazení odhadu přežití bez známek progrese onemocnění (populace podle původního léčebného záměru) podle Kaplanovy Meierovy metody pro (A) větev se, mg/kg bevacizumabu (Bev) a pro (B) rameno s 1 mg/kg bevacizumabu v porovnání s placebem. CG, cisplatina plus gemcitabin; HR, poměr rizika. bem v porovnání s jedním procentem pacientů v placebové skupině. Ačkoli byl výskyt těžké hypertenze vyšší ve větvi s vysokou dávkou bevacizumabu, klinicky závažné situace nebyly časté (dvě hypertenzní krize ve větvi s nízkou dávkou bevacizumabu a jedna hypertenzní krize ve skupině s vysokou dávkou). Epizody plicního krvácení stupně tři a více byly pozorovány u dvou pacientů ve skupině s CG a placebem, u pěti pacientů ve větvi s CG a nízkou dávkou bevacizumabu a u tří nemocných ve větvi s CG a vysokou dávkou bevacizumabu (tab. 3). Čtyři z těchto deseti epizod se objevily u pacientů s centrálně lokalizovanými tumory, což odpovídá proporcionálnímu zastoupení nemocných s centrálními nádory (3 %) v celkové studované populaci. Navíc, ačkoli byla celková míra výskytu trombocytopenie stupně tři a čtyři % až 2 %, byla pouze jedna epizoda plicního krvácení z deseti sdružena s nějakým stupněm trombocytopenie. Devět procent pacientů sledované populace bylo po zahájení studie terapeuticky antikoagulováno buďto warfarinem, nebo nízkomolekulárním heparinem; u těchto pacientů nebylo pozorováno žádné plicní krvácení. Procento přerušené léčby v důsledku AE bylo lehce vyšší ve větvích s bevacizumabem (2 % ve skupině s nízkou dávkou a 30 % ve skupině s vysokou dávkou bevacizumabu) v porovnání s placebovou skupinou ( %). Míra úmrtnosti v důsledku AE byla bez ohledu na příčinnou souvislost v placebové skupině 4 %, ve skupině s nízkou dávkou bevacizumabu 4 % a % ve větvi s vysokou dávkou bevacizumabu. Obrázek 4. Graf zobrazující poměry rizika pro přežití bez známek progrese onemocnění podle podskupin pro každou z větví s bevacizumabem v porovnání s placebem. CG, cisplatina plus gemcitabin; ECOG, Eastern Cooperative Oncology Group. Nejčastější příčinou smrti byla progrese choroby. Nejčastější příčinou úmrtí bez vztahu k progresi onemocnění bylo kardiopulmonální selhání, respirační selhání, hemoptýza a plicní embolizace. Jedno úmrtí, ve větvi s vysokou dávkou bevacizumabu, bylo spojeno s febrilní neutropenií. DISKUSE Výsledky prezentované rozsáhlé mezinárodní randomizované studie fáze III dále přispívají k narůstajícímu počtu důkazů o tom, že kom by American Society of Clinical Oncology 1
7 Reck et al. binace bevacizumabu se standardní chemoterapií na bázi platinových derivátů poskytuje pacientům s pokročilým nedlaždicobuněčným NSCLC významný klinický prospěch. Naše studie kombinující bevacizumab s chemoterapií CG demonstrovala signifikantní zlepšení primárního cíle, tj. PFS, a sekundárních cílů, počtu léčebných odpovědí a trvání léčebné odpovědi. Tyto závěry jsou v souladu se dvěma předchozími randomizovanými klinickými studiemi, které hodnotily léčbu bevacizumabem v kombinaci s chemoterapií CP u nepředléčených pacientů v pokročilém stadiu NSCLC.,11 Výsledky byly shodné napříč většinou vstupních charakteristik. V naší studii byl bevacizumab po dokončení kombinované léčby s chemoterapií CG podáván dále v monoterapii až do doby progrese onemocnění. Vzhledem k tomu, že VEGF je klíčový proangiogenní mediátor, je kontinuální inhibice VEGF zásadním krokem v prevenci revaskularizace anebo neovaskularizace nádoru, což je proces nutný pro jeho další růst. 14 Pacienti zařazení do prezentované studie vykazovali v porovnání s dalšími randomizovanými studiemi s bevacizumabem u NSCLC řadu příznivých prognostických parametrů. Celkově byla studovaná populace mladší, ve středním věku až 0 let proti 3 rokům ve studii E4, a také zahrnovala přibližně % pacientů ve stadiu IIIB bez výpotku, proti 0 % ve studii E4. Výběrová kritéria navíc vyřazovala nádory, které těsně naléhaly na velké cévy nebo do nich invadovaly, což mohlo vést k selekci prognosticky příznivější populace. Uvedené rozdíly mohou vysvětlit relativně dlouhou (,1 měsíců) střední dobu PFS v kontrolní skupině. Je třeba zmínit, že chemoterapie CG je v Evropě díky svému příznivému profilu účinnosti a tolerance standardně používaným chemoterapeutickým režimem. 1,1 V klinické studii fáze III, která srovnávala čtyři standardní dvojkombinace chemoterapeutik, byl nejdelší čas do progrese onemocnění pozorován u chemoterapie CG, 1 ačkoli v celkovém přežití nebyl mezi jednotlivými režimy zaznamenán signifikantní rozdíl. Střední délka PFS pozorovaná v naší studii ve větvi s chemoterapií CG a placebem, je ve shodě s výsledky dalších velkých randomizovaných studií; v nedávné studii fáze III s erlotinibem v kombinaci s CG byla ve větvi s chemoterapií CG a placebem zaznamenána střední délka PFS,4 měsíců. 1 Bezpečnost léčby se v této studii jevila podobně jako v předchozích klinických studiích s bevacizumabem u NSCLC.,11 Nežádoucí účinky, které se častěji vyskytovaly ve větvích s bevacizumabem, zahrnovaly neutropenii (včetně jedné fatální příhody), astenii, zvracení, hypertenzi, proteinurii a krvácení. Ve studii nebyla pozorována zvýšená incidence arteriálních či žilních tromboembolických příhod nebo perforací gastrointestinálního traktu. Ve větvích s bevacizumabem byl zaznamenán zvýšený výskyt závažného plicního krvácení včetně sedmi fatálních příhod. Celková míra výskytu plicního krvácení však byla nižší, než byla zaznamenána v předchozí studii fáze II s bevacizumabem v kombinaci s chemoterapií CP 11 a podobná jako ve fázi III studie E4, a to navzdory použití plné antikoagulační léčby u přibližně devíti procent pacientů ve studii. Jedinými nežádoucími účinky sdruženými s užíváním bevacizumabu, jež se zdály závislými na dávce, byly hypertenze a proteinurie. Žádná nová bezpečnostní rizika zaznamenána nebyla. Plánované zrušení jedné z větví s bevacizumabem podle původního návrhu se neuskutečnilo kvůli změně v uspořádání studie poté, co byly zveřejněny výsledky studie E4. Tato změna pak poskytla možnost k vyhodnocení účinnosti a bezpečnosti dvou různých dávek bevacizumabu. Výsledky ukazují podobnou účinnost (ve smyslu PFS a míry léčebné odpovědi) a podobný bezpečnostní profil v obou větvích (, mg/kg a 1 mg/kg) s bavacizumabem, ačkoli studie nebyla koncipována tak, aby bylo možno činit jakékoli závěry z přímého srovnání obou skupin s bevacizumabem. Když byl vzat v úvahu možný zavádějící vliv NPT podávané před dokumentovanou progresí nemoci, tj. když byli při posledním hodnocení tumorózního nálezu všichni nemocní, kteří pak dostávali NPT, ještě před jejím zahájením cenzorováni, což byl postup identický s primární analýzou PFS ve studii E4, byly poměry rizika (HR) pro větve s bevacizumabem (, mg/kg: HR = 0,; % CI; 0, 0,3; a 1 mg/kg: HR = 0,4; % CI; 0,0 0,0) ve studii AVAiL srovnatelné s HR pro populaci podle původního léčebného záměru zaznamenanými ve studii E4 (HR = 0,; % CI, 0, 0,). Souhrnně lze konstatovat, že studie AVAiL je druhou rozsáhlou randomizovanou studií fáze III, která prokázala, že kombinace bevacizumabu se standardní chemoterapií signifikantně zlepšuje klinické výsledky u pacientů s pokročilým nedlaždicobuněčným NSCLC. Pozitivní výsledky studií AVAiL a E4 poskytují další důkazy o tom, že bevacizumab může být efektivně kombinován s různými chemoterapeutickými režimy. Uvedené závěry naznačují, že bevacizumab v kombinaci s chemoterapií na bázi platinových derivátů poskytuje nemocným s pokročilým nedlaždicobuněčným NSCLC, kteří jsou vhodnými kandidáty pro léčbu touto protilátkou, reálný klinický prospěch. Prohlášení autorů o možném střetu zájmů Všichni autoři vyplnili toto prohlášení; následující autoři udali finanční nebo jiný zájem, který je relevantní pro látku posuzovanou v tomto článku. Určité vztahy označené písmenem U jsou ty, za něž nebyla obdržena žádná kompenzace; vztahy označené písmenem C byly kompenzovány. Pro detailní popis kategorií prohlášení nebo pro více informací o politice střetu zájmů ASCO odkazujeme čtenáře na Author Disclosure Declaration a kapitolu Disclosures of Potential Conflicts of Interest v informacích pro autory. Zaměstnání nebo vedoucí pozice: Venice Archer, F. Hoffmann La Roche (C); Nicola Moore, F. Hoffmann La Roche (C) Funkce konzultanta nebo poradce: Martin Reck, F. Hoffmann La Roche (C), Boehringer Ingelheim (C); Rodryg Ramlau, F. Hoffmann La Roche (C); Vera Hirsh, F. Hoffmann La Roche (C), AstraZeneca (C), Eli Lilly & Co (C), Amgen Inc (C), Abraxis (C) Vlastnictví akcií: Nicola Moore, F. Hoffmann La Roche Honoráře: Martin Reck, F. Hoffmann La Roche, Eli Lilly & Co, Boehringer Ingelheim, Bayer Healthcare; Petr Zatloukal, F. Hoffmann La Roche, Eli Lilly & Co; Rodryg Ramlau, F. Hoffmann La Roche; Natasha Leighl, F. Hoffmann La Roche; Christian Manegold, F. Hoffmann La Roche, Eli Lilly & Co Financování výzkumu: Nikdo Znalecký posudek: Nikdo Jiná odměna: Nikdo Podíl autorů na článku Koncepce a návrh: Christian Manegold Zajištění studijních materiálů nebo pacientů: Martin Reck, Joachim von Pawel, Petr Zatloukal, Rodryg Ramlau, Vera Gorbounova, Vera Hirsh, Natasha Leighl, Jörg Mezger, Christian Manegold Sběr a kompletace dat: Martin Reck, Joachim von Pawel, Petr Zatloukal, Rodryg Ramlau, Vera Hirsh, Natasha Leighl, Jörg Mezger, Venice Archer, Christian Manegold Analýza a interpretace dat: Martin Reck, Rodryg Ramlau, Jörg Mezger, Venice Archer, Nicola Moore Psaní rukopisu: Martin Reck, Natasha Leighl, Jörg Mezger, Venice Archer, Nicola Moore, Christian Manegold Konečné schválení rukopisu: Martin Reck, Joachim von Pawel, Petr Zatloukal, Rodryg Ramlau, Vera Gorbounova, Vera Hirsh, Natasha Leighl, Jörg Mezger, Venice Archer, Nicola Moore, Christian Manegold by American Society of Clinical Oncology Journal of Clinical Oncology
8 Cisplatina a gemcitabin s placebem nebo bevacizumabem v léčbě první linie u NSCLC LITERATURA 1. Ferrara N: Role of vascular endothelial growth factor in physiologic and pathologic angiogenesis: Therapeutic implications. Semin Oncol 2:10 14, Ferrara N, Gerber HP, LeCouter J: The biology of VEGF and its receptors. Nat Med :, Folkman J, Merler E, Abernathy C, et al: Isolation of a tumor factor responsible for angiogenesis. J Exp Med 133:2 2, Bergers G, Benjamin LE: Tumorigenesis and the angiogenic switch. Nat Rev Cancer 3: , Ferrara N, Hillan KJ, Gerber HP, et al: Discovery and development of bevacizumab, an anti VEGF antibody for treating cancer. Nat Rev Drug Discov 3:31 400, Hurwitz H, Fehrenbacher L, Novotny W, et al: Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med 30:3 42, Miller KD, Wang M, Gralow J, et al: A randomized phase III trial of paclitaxel versus paclitaxel plus bevacizumab as first line therapy for locally recurrent or metastatic breast cancer: A trial coordinated by the Eastern Cooperative Oncology Group (E2100). Breast Cancer Res Treat 4:S, 200 (abstr 3). Sandler A, Gray R, Perry MC, et al: Paclitaxelcarboplatin alone or with bevacizumab for non smallcell lung cancer. N Engl J Med 3:242 20, 200. Hainsworth JD, Sosman JA, Spigel DR, et al: Treatment of metastatic renal cell carcinoma with a combination of bevacizumab and erlotinib. J Clin Oncol :, Giantonio BJ, Catalano PJ, Meropol NJ, et al: Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: Results from the Eastern Cooperative Oncology Group Study E3200. J Clin Oncol 2:13 144, Johnson DH, Fehrenbacher L, Novotny WF, et al: Randomized phase II trial comparing bevacizumab plus carboplatin and paclitaxel with carboplatin and paclitaxel alone in previously untreated locally advanced or metastatic non small cell lung cancer. J Clin Oncol 22: , Therasse P, Arbuck SG, Eisenhauer EA, et al: New guidelines to evaluate the response to treatment in solid tumors: European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada. J Natl Cancer Inst 2:20 21, Sandler AB, Gray R, Brahmer J, et al: Randomized phase II/III trial of paclitaxel (P) plus carboplatin (C) with or without bevacizumab (NSC # 04) in patients with advanced non squamous non smallcell lung cancer (NSCLC): An Eastern Cooperative Oncology Group (ECOG) trial E4. J Clin Oncol :2s, 200 (abstr LBA4) 14. Mancuso MR, Davis R, Norberg SM, et al: Rapid vascular regrowth in tumors after reversal of VEGF inhibition. J Clin Invest 11: , Smit EF, van Meerbeeck JP, Lianes P, et al: Three arm randomized study of two cisplatin based regimens and paclitaxel plus gemcitabine in advanced non small cell lung cancer: A phase III trial of the European Organization for Research and Treatment of Cancer Lung Cancer Group EORTC 0. J Clin Oncol 21:30 31, Le Chevalier T, Scagliotti G, Natale R, et al: Efficacy of gemcitabine plus platinum chemotherapy compared with other platinum containing regimens in advanced non small cell lung cancer: A meta analysis of survival outcomes. Lung Cancer 4: 0, Schiller JH, Harrington D, Belani CP, et al: Comparison of four chemotherapy regimens for advanced non small cell lung cancer. N Engl J Med 34:2, Gatzemeier U, Pluzanska A, Szczesna A, et al: Phase III study of erlotinib in combination with cisplatin and gemcitabine in advanced non smallcell lung cancer: The Tarceva Lung Cancer Investigation Trial. J Clin Oncol 2:14 12, 200 Poděkování Děkujeme Yfke Hager z Gardiner-Caldwell Communications for medical za pomoc při psaní by American Society of Clinical Oncology 3
9 ERRATA The November 20, 200, article by Spearman et al entitled, Clinically Applicable Models to Characterize BRCA1 and BRCA2 Variants of Uncertain Significance (J Clin Oncol 2:33-400, 200) contained an error. The study support received by Fergus J. Couch was inadvertently omitted, and should have been acknowledged as follows: Supported by the National Institutes of Health, National Cancer Institute, Bay Area Breast Spore Career Development Award No. P0 CA201 (A.E.T.), Mayers Summer fellowships (A.D.S.), internal funds from the Ohio State University Comprehensive Cancer Center (A.E.T.), Mayo Clinic Breast Grant No. SPORE P0 CA11201 (F.J.C.), the National Institutes of Health Grant No. R01 CA111 (F.J.C.), and the American Cancer Society Grant No. RSG CCE (F.J.C.). DOI: /JCO The January 1, 200, article by Olivotto et al entitled, Intervals Longer Than 20 Weeks From Breast-Conserving Surgery to Radiation Therapy Are Associated With Inferior Outcome for Women With Early-Stage Breast Cancer Who Are Not Receiving Chemotherapy (J Clin Oncol 2:1-, 200) contained errors. In parts B, C and D of Figures 2 and 3, the comparison curves (yellow lines) were labeled as -12 weeks, whereas they should have been labeled as 12-1 weeks in part B, 1-20 weeks in part C, and weeks in part D. In the legend for Figure 3, the P values were incorrect and should have been P. for part A, P.14 for part B, P. for part C, P.00 for part D, as given in the figure. DOI: /JCO The March 10, 200, article by Reck et al, entitled, Phase III Trial of Cisplatin Plus Gemcitabine With Either Placebo or Bevacizumab As First-Line Therapy for Nonsquamous Non Small-Cell Lung Cancer: AVAiL (J Clin Oncol 2:122-14, 200) contained errors. In Table 3, the footnote for neutropenia was given as: *Febrile neutropenia occurred in one (0.3%), two (0.%), and two (0.%) patients in the placebo, low-dose bevacizumab, and high-dose bevacizumab arms, respectively. Whereas it should have been: *Febrile neutropenia occurred in four (1%), five (2%), and seven (2%) patients in the placebo, low-dose bevacizumab, and high-dose bevacizumab arms, respectively. The online version has been corrected in departure from the print. DOI: /JCO by American Society of Clinical Oncology 241
Udržovací léčba: zamířeno na anti-vegf léčbu Alan Sandler
 Udržovací léčba: zamířeno na anti-vegf léčbu Alan Sandler Department of Hematology/Oncology Oregon Health and Science University Knight Cancer Institute Portland, OR, USA Medián OS (měsíce) Studie v 1.linii
Udržovací léčba: zamířeno na anti-vegf léčbu Alan Sandler Department of Hematology/Oncology Oregon Health and Science University Knight Cancer Institute Portland, OR, USA Medián OS (měsíce) Studie v 1.linii
Bevacizumab u starších pacientů s kolorektálním karcinomem
 Bevacizumab u starších pacientů s kolorektálním karcinomem MUDr. Tomáš Büchler, PhD. Onkologické oddělení Fakultní Thomayerovy nemocnice a Onkologická klinika 1. lékařské fakulty UK a VFN, Praha XIV. Staškovy
Bevacizumab u starších pacientů s kolorektálním karcinomem MUDr. Tomáš Büchler, PhD. Onkologické oddělení Fakultní Thomayerovy nemocnice a Onkologická klinika 1. lékařské fakulty UK a VFN, Praha XIV. Staškovy
R.A. Burger, 1 M.F. Brady, 2 J. Rhee, 3 M.A. Sovak, 3 H. Nguyen, 3 M.A. Bookman 4
 NEZÁVISLÉ RADIOLOOGICKÉ HODNOCENÍ STUDIE FÁZE III GOG218 S BEVACIZUMABEM (BEV) V PRIMÁRNÍ LÉČBĚ POKROČILÉHO EPITELOVÉHO NÁDORU VAJEČNÍKŮ, PRIMÁRNÍHO NÁDORU PERITONEA NEBO VEJCOVODŮ. R.A. Burger, 1 M.F.
NEZÁVISLÉ RADIOLOOGICKÉ HODNOCENÍ STUDIE FÁZE III GOG218 S BEVACIZUMABEM (BEV) V PRIMÁRNÍ LÉČBĚ POKROČILÉHO EPITELOVÉHO NÁDORU VAJEČNÍKŮ, PRIMÁRNÍHO NÁDORU PERITONEA NEBO VEJCOVODŮ. R.A. Burger, 1 M.F.
Východiska. Čtvrtá nejčastější příčina úmrtí na nádorová onemocní u žen, v celém světě je ročně nových onemocnění a úmrtí
 ICON7: studie fáze III Gynaecologic Cancer InterGroup (GCIG) s přidáním bevacizumabu ke standardní chemoterapii u žen s nově diagnostikovaným epitelovým nádorem vaječníků, primárním nádorem pobřišnice
ICON7: studie fáze III Gynaecologic Cancer InterGroup (GCIG) s přidáním bevacizumabu ke standardní chemoterapii u žen s nově diagnostikovaným epitelovým nádorem vaječníků, primárním nádorem pobřišnice
Hodnocení segmentu centrové léčby z dat plátců zdravotní péče. Společné pracoviště ÚZIS ČR a IBA MU
 Hodnocení segmentu centrové léčby z dat plátců zdravotní péče Společné pracoviště ÚZIS ČR a IBA MU Realita současné české medicíny: úspěšné výsledky léčby = podstatné prodlužování doby života pacienta
Hodnocení segmentu centrové léčby z dat plátců zdravotní péče Společné pracoviště ÚZIS ČR a IBA MU Realita současné české medicíny: úspěšné výsledky léčby = podstatné prodlužování doby života pacienta
Chemoterapie pokročil kolorektáln. karcinomu
 Chemoterapie pokročil ilého kolorektáln lního karcinomu Jindřich ich FínekF Chemoterapie pokročil ilého kolorektáln lního karcinomu v prvé linii Incidence ve světě Incidence a mortalita v ČR Stádia onemocnění
Chemoterapie pokročil ilého kolorektáln lního karcinomu Jindřich ich FínekF Chemoterapie pokročil ilého kolorektáln lního karcinomu v prvé linii Incidence ve světě Incidence a mortalita v ČR Stádia onemocnění
3.3 KARCINOM SLINIVKY BŘIŠNÍ
 3.3 KARCINOM SLINIVKY BŘIŠNÍ Epidemiologie Zhoubné nádory pankreatu se vyskytují převážně ve vyšším věku po 60. roce života, převážně u mužů. Zhoubné nádory pankreatu Incidence a mortalita v České republice
3.3 KARCINOM SLINIVKY BŘIŠNÍ Epidemiologie Zhoubné nádory pankreatu se vyskytují převážně ve vyšším věku po 60. roce života, převážně u mužů. Zhoubné nádory pankreatu Incidence a mortalita v České republice
SYSTÉMOVÁ LÉČBA NÁDORŮ MOČOVÉHO MĚCHÝŘE
 SYSTÉMOVÁ LÉČBA NÁDORŮ MOČOVÉHO MĚCHÝŘE Jana Katolická FN u svaté Anny, Brno CZ/ONCO/617/0088 1 UROTELIÁLNÍ KARCINOM MOČOVÉHO MĚCHÝŘE CHEMOSENZITIVNÍ ONEMOCNĚNÍ. V době stanovení diagnózy je 15 % lokálně
SYSTÉMOVÁ LÉČBA NÁDORŮ MOČOVÉHO MĚCHÝŘE Jana Katolická FN u svaté Anny, Brno CZ/ONCO/617/0088 1 UROTELIÁLNÍ KARCINOM MOČOVÉHO MĚCHÝŘE CHEMOSENZITIVNÍ ONEMOCNĚNÍ. V době stanovení diagnózy je 15 % lokálně
Klinická data bevacizumabu v úvodní léčbě karcinomu vaječníků: GOG-0218
 Klinická data bevacizumabu v úvodní léčbě karcinomu vaječníků: GOG-0218 Professor Bradley J. Monk Division of Gynecologic Oncology Department of Obstetrics and Gynecology Creighton University School of
Klinická data bevacizumabu v úvodní léčbě karcinomu vaječníků: GOG-0218 Professor Bradley J. Monk Division of Gynecologic Oncology Department of Obstetrics and Gynecology Creighton University School of
TULUNG - AVASTIN. Klinický registr pacientů s nemalobuněčným karcinomem plic. Stav registru k datu 26. 3. 2012
 TULUNG - AVASTIN Klinický registr pacientů s nemalobuněčným karcinomem plic Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr Brabec Mgr.
TULUNG - AVASTIN Klinický registr pacientů s nemalobuněčným karcinomem plic Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr Brabec Mgr.
TULUNG - AVASTIN. Klinický registr pacientů s nemalobuněčným karcinomem plic. Stav registru k datu 17. 9. 2012
 TULUNG - AVASTIN Klinický registr pacientů s nemalobuněčným karcinomem plic Stav registru k datu 17. 9. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr Brabec Mgr.
TULUNG - AVASTIN Klinický registr pacientů s nemalobuněčným karcinomem plic Stav registru k datu 17. 9. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr Brabec Mgr.
2. ZHOUBNÝ NOVOTVAR BRONCHU A PLÍCE (C34)
 2. ZHOUBNÝ NOVOTVAR BRONCHU A PLÍCE (C34) 2.1 Nemalobuněčný karcinom Podání chemoterapie s radikálním léčebným záměrem (průkazné prodloužení života) 2.1.1 Nádory klinického stádia IIA a IIB pokud jsou
2. ZHOUBNÝ NOVOTVAR BRONCHU A PLÍCE (C34) 2.1 Nemalobuněčný karcinom Podání chemoterapie s radikálním léčebným záměrem (průkazné prodloužení života) 2.1.1 Nádory klinického stádia IIA a IIB pokud jsou
Registr Avastin Nemalobuněčný karcinom plic
 Registr Avastin Nemalobuněčný karcinom plic Formulář: Vstupní parametry Rok narození Věk Pohlaví Kouření o Kuřák o Bývalý kuřák o Nekuřák Hmotnost pacienta v době diagnózy (kg) Hmotnost pacienta v době
Registr Avastin Nemalobuněčný karcinom plic Formulář: Vstupní parametry Rok narození Věk Pohlaví Kouření o Kuřák o Bývalý kuřák o Nekuřák Hmotnost pacienta v době diagnózy (kg) Hmotnost pacienta v době
Lékový registr ALIMTA
 Lékový registr Pravidelný report Maligní pleurální mezoteliom (MPM) Stav registru k datu 19. 10. 2015 Pneumoonkologická centra zapojená v projektu Alimta 1. FN Brno Jihlavská 20, 625 00 Brno - Bohunice
Lékový registr Pravidelný report Maligní pleurální mezoteliom (MPM) Stav registru k datu 19. 10. 2015 Pneumoonkologická centra zapojená v projektu Alimta 1. FN Brno Jihlavská 20, 625 00 Brno - Bohunice
Metastatický renální karcinom Andrašina Tomáš
 Metastatický renální karcinom Andrašina Tomáš Department of Radiology and Nuclear Medicine, University Hospital Brno and Medical Faculty, Masaryk University, Brno, Czech Republic Renální karcinom 25-30
Metastatický renální karcinom Andrašina Tomáš Department of Radiology and Nuclear Medicine, University Hospital Brno and Medical Faculty, Masaryk University, Brno, Czech Republic Renální karcinom 25-30
Režimy s nízkým rizikem FN riziko do 10 % Režimy se středním rizikem FN riziko 10 19% Režimy s vysokým rizikem FN riziko 20 a více procent
 Portál DIOS verze II Druhá verze portálu DIOS a jeho elektronické knihovny chemorežimů přináší nové informace a nové nástroje týkající se problematiky toxicity chemoterapie. Jde především o problematiku
Portál DIOS verze II Druhá verze portálu DIOS a jeho elektronické knihovny chemorežimů přináší nové informace a nové nástroje týkající se problematiky toxicity chemoterapie. Jde především o problematiku
Registr Herceptin Karcinom prsu
 I. Primární diagnostika Registr Herceptin Karcinom prsu Vstupní parametry Rok narození Věk Kód zdravotní pojišťovny (výběr) o 111 o 201 o 205 o 207 o 209 o 211 o 213 o 217 o 222 Datum stanovení diagnózy
I. Primární diagnostika Registr Herceptin Karcinom prsu Vstupní parametry Rok narození Věk Kód zdravotní pojišťovny (výběr) o 111 o 201 o 205 o 207 o 209 o 211 o 213 o 217 o 222 Datum stanovení diagnózy
Biologická léčba karcinomu prsu. Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN)
 Biologická léčba karcinomu prsu Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN) Cílená léčba Ca prsu Trastuzumab (HercepNn) AnN HER2 neu pronlátka LapaNnib (Tyverb)
Biologická léčba karcinomu prsu Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN) Cílená léčba Ca prsu Trastuzumab (HercepNn) AnN HER2 neu pronlátka LapaNnib (Tyverb)
Lékový registr ALIMTA
 Lékový registr Pravidelný report Maligní pleurální mezoteliom (MPM) Stav registru k datu 31. 3. 2014 Pneumoonkologická centra zapojená v projektu Alimta 1. FN Brno Jihlavská 20, 625 00 Brno - Bohunice
Lékový registr Pravidelný report Maligní pleurální mezoteliom (MPM) Stav registru k datu 31. 3. 2014 Pneumoonkologická centra zapojená v projektu Alimta 1. FN Brno Jihlavská 20, 625 00 Brno - Bohunice
Interaktivní nástroje pro výuku léčebných standardů cytostatické léčby zhoubných nádorů Portál DIOS
 Interaktivní nástroje pro výuku léčebných standardů cytostatické léčby zhoubných nádorů Portál DIOS Klimeš D., Dušek L., Kubásek J., Fínek J., Petruželka L., Zoláková A., Vyzula R. Historie projektu Snaha
Interaktivní nástroje pro výuku léčebných standardů cytostatické léčby zhoubných nádorů Portál DIOS Klimeš D., Dušek L., Kubásek J., Fínek J., Petruželka L., Zoláková A., Vyzula R. Historie projektu Snaha
TARCEVA klinický registr
 TARCEVA klinický registr Karcinom pankreatu Stav k datu 10. 4. 2011 Registr Tarceva je podporován výzkumným ý grantem firmy Roche. Česká onkologická společnost Institut biostatistiky a analýz Stav registru
TARCEVA klinický registr Karcinom pankreatu Stav k datu 10. 4. 2011 Registr Tarceva je podporován výzkumným ý grantem firmy Roche. Česká onkologická společnost Institut biostatistiky a analýz Stav registru
Analytický report projektu AVASTIN klinický registr
 Analytický report projektu AVASTIN klinický registr Karcinom prsu Stav k datu 10. 4. 2011 Registr Avastin je podporován výzkumným ý grantem firmy Roche. Česká Institut t onkologická biostatistiky společnost
Analytický report projektu AVASTIN klinický registr Karcinom prsu Stav k datu 10. 4. 2011 Registr Avastin je podporován výzkumným ý grantem firmy Roche. Česká Institut t onkologická biostatistiky společnost
Pokračovací udržovací léčba pemetrexedemu u nemocných s nemalobuněčným karcinomem plic v České republice
 Pokračovací udržovací léčba pemetrexedemu u nemocných s nemalobuněčným karcinomem plic v České republice Jana Skřičková, Kateřina Fröhlich 2, Matyáš Kuhn 2, Zbyněk Bortlíček 2, Karel Hejduk 2, Miloš Pešek
Pokračovací udržovací léčba pemetrexedemu u nemocných s nemalobuněčným karcinomem plic v České republice Jana Skřičková, Kateřina Fröhlich 2, Matyáš Kuhn 2, Zbyněk Bortlíček 2, Karel Hejduk 2, Miloš Pešek
VÝSLEDKY. Účastnící se pacienti měli riziko kardiovaskulárních onemocnění
 Účinek linagliptinu na kardiovaskulární zdraví a funkci ledvin u pacientů s diabetem 2. typu, kteří mají riziko kardiovaskulárního onemocnění (studie CARMELINA, 1218.22) Lidé s riziko kardiovaskulárního
Účinek linagliptinu na kardiovaskulární zdraví a funkci ledvin u pacientů s diabetem 2. typu, kteří mají riziko kardiovaskulárního onemocnění (studie CARMELINA, 1218.22) Lidé s riziko kardiovaskulárního
STRUKTURA REGISTRU MPM
 STRUKTURA REGISTRU MPM 1. Vstupní parametry 1. Kouření (výběr) 1. Kuřák 2. Bývalý kuřák (rok před stanovením DG - dle WHO) 3. Nekuřák 4. Neuvedeno 2. Výška [cm] (reálné číslo) 3. Hmotnost pacienta v době
STRUKTURA REGISTRU MPM 1. Vstupní parametry 1. Kouření (výběr) 1. Kuřák 2. Bývalý kuřák (rok před stanovením DG - dle WHO) 3. Nekuřák 4. Neuvedeno 2. Výška [cm] (reálné číslo) 3. Hmotnost pacienta v době
Lze předvídat výsledek léčby bevacizumabem u metastatického kolorektálního karcinomu na základě stavu onkogenu K-ras? Komentář
 Lze předvídat výsledek léčby bevacizumabem u metastatického kolorektálního karcinomu na základě stavu onkogenu K-ras? MUDr. Jiří Tomášek Komentář MUDr. Pavel Vítek, Ph.D. Lze předvídat výsledek léčby
Lze předvídat výsledek léčby bevacizumabem u metastatického kolorektálního karcinomu na základě stavu onkogenu K-ras? MUDr. Jiří Tomášek Komentář MUDr. Pavel Vítek, Ph.D. Lze předvídat výsledek léčby
Nové chemoterapeutické režimy u karcinomu prsu. Miloš Holánek, Ji í Vysko il KKOP, MOÚ Brno
 Nové chemoterapeutické režimy u karcinomu prsu Miloš Holánek, Jií Vyskoil KKOP, MOÚ Brno Úvod Terapeutické modality u karcinomu prsu: - chirurgická léba -hormonoterapie -radioterapie - chemoterapie - cílená
Nové chemoterapeutické režimy u karcinomu prsu Miloš Holánek, Jií Vyskoil KKOP, MOÚ Brno Úvod Terapeutické modality u karcinomu prsu: - chirurgická léba -hormonoterapie -radioterapie - chemoterapie - cílená
Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky
 Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky Prof. MUDr. Jitka Abrahámová, DrSc Onkologická klinika TN a 1. LF UK KOC (NNB + VFN + TN) St Gallén 2011 Rozsah onemocnění T, N, M ER, PgR
Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky Prof. MUDr. Jitka Abrahámová, DrSc Onkologická klinika TN a 1. LF UK KOC (NNB + VFN + TN) St Gallén 2011 Rozsah onemocnění T, N, M ER, PgR
ŽIVOTNÍ CYKLUS LÉKŮ KLINICKÉ HODNOCENÍ STUDIE. Kateřina Kopečková FN Motol, Praha
 ŽIVOTNÍ CYKLUS LÉKŮ KLINICKÉ HODNOCENÍ STUDIE Kateřina Kopečková FN Motol, Praha Klinická hodnocení LP Nedílnou součásti vývoje léčiva Navazují na preklinický výzkum Pacienti jsou subjekty hodnocení V
ŽIVOTNÍ CYKLUS LÉKŮ KLINICKÉ HODNOCENÍ STUDIE Kateřina Kopečková FN Motol, Praha Klinická hodnocení LP Nedílnou součásti vývoje léčiva Navazují na preklinický výzkum Pacienti jsou subjekty hodnocení V
Česká myelomová skupina
 Česká myelomová skupina 1996-2002 Klinická studie 2002 Klinická studie 4W Udržovací léčba interferonem alfa (IFN) versus udržovací léčba kombinací IFN a dexametazon po provedení autologní transplantace
Česká myelomová skupina 1996-2002 Klinická studie 2002 Klinická studie 4W Udržovací léčba interferonem alfa (IFN) versus udržovací léčba kombinací IFN a dexametazon po provedení autologní transplantace
Radioterapie po radikální prostatektomii
 Radioterapie po radikální prostatektomii Štěpán Veselý Urologická klinika UK 2. LF a FN Motol, Praha ART po RRP - ART (aplikace u high-risk do 90 dnů po operaci) high-risk: - pozitivní chirurgické okraje
Radioterapie po radikální prostatektomii Štěpán Veselý Urologická klinika UK 2. LF a FN Motol, Praha ART po RRP - ART (aplikace u high-risk do 90 dnů po operaci) high-risk: - pozitivní chirurgické okraje
CORECT - VECTIBIX. Klinický registr pacientů s metastatickým kolorektálním karcinomem. Stav registru k datu
 CORECT - VECTIBIX Klinický registr pacientů s metastatickým kolorektálním karcinomem Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr
CORECT - VECTIBIX Klinický registr pacientů s metastatickým kolorektálním karcinomem Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr
Pravidelný report projektu BREAST - Avastin
 Pravidelný report projektu BREAST - Avastin Stav k datu 10. 10. 2011 Analýza dat: Mgr. Zbyněk Bortlíček Informační technologie: RNDr. Daniel Klimeš, Ph.D. Management projektu: Ing. Petr Brabec, Mgr. Karel
Pravidelný report projektu BREAST - Avastin Stav k datu 10. 10. 2011 Analýza dat: Mgr. Zbyněk Bortlíček Informační technologie: RNDr. Daniel Klimeš, Ph.D. Management projektu: Ing. Petr Brabec, Mgr. Karel
CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT IKARUS. Neintervenční epidemiologická studie
 CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT Neintervenční epidemiologická studie PROTOKOL PROJEKTU Verze: 4.0 Datum: 26.09.2006 Strana 2 PROTOKOL PROJEKTU
CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT Neintervenční epidemiologická studie PROTOKOL PROJEKTU Verze: 4.0 Datum: 26.09.2006 Strana 2 PROTOKOL PROJEKTU
TARCEVA klinický registr
 TARCEVA klinický registr Karcinom pankreatu Stav k datu 10. 10. 2011 Analýza dat: Mgr. Zbyněk Bortlíček Informační technologie: RNDr. Daniel Klimeš, Ph.D. Management projektu: Ing. Petr Brabec, Mgr. Karel
TARCEVA klinický registr Karcinom pankreatu Stav k datu 10. 10. 2011 Analýza dat: Mgr. Zbyněk Bortlíček Informační technologie: RNDr. Daniel Klimeš, Ph.D. Management projektu: Ing. Petr Brabec, Mgr. Karel
Možnosti léčby CRPC s časem přibývají
 Možnosti léčby CRPC s časem přibývají Jana Katolická Onkologicko-chirurgické oddělení Fakultní nemocnice u Sv. Anny Mnoho studií - jen čtyři nové léky Enzalutamid Abirateron + prednison Cabazitaxel Radium-223
Možnosti léčby CRPC s časem přibývají Jana Katolická Onkologicko-chirurgické oddělení Fakultní nemocnice u Sv. Anny Mnoho studií - jen čtyři nové léky Enzalutamid Abirateron + prednison Cabazitaxel Radium-223
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Avastin 25 mg/ml koncentrát pro přípravu infuzního roztoku. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 25 mg bevacizumabu. Jedna injekční
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Avastin 25 mg/ml koncentrát pro přípravu infuzního roztoku. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 25 mg bevacizumabu. Jedna injekční
RNDr. Eva Janoušová doc. RNDr. Ladislav Dušek, Dr.
 Analýza dat pro Neurovědy RNDr. Eva Janoušová doc. RNDr. Ladislav Dušek, Dr. Jaro 2014 Institut biostatistiky Janoušová, a analýz Dušek: Analýza dat pro neurovědy Blok 8 Jak analyzovat přežití pacientů.
Analýza dat pro Neurovědy RNDr. Eva Janoušová doc. RNDr. Ladislav Dušek, Dr. Jaro 2014 Institut biostatistiky Janoušová, a analýz Dušek: Analýza dat pro neurovědy Blok 8 Jak analyzovat přežití pacientů.
Presidio Ospedaliero di Livorno
 Aprile Jasná perspektiva role inhibitorů tyrozinkinázy (TKI) EGFR Piano Generale Istituto Toscano di Tumori Emergenza Presidio Ospedaliero di Livorno Livorno-Italy Viale Alfieri 36 Federico Cappuzzo Ospedale
Aprile Jasná perspektiva role inhibitorů tyrozinkinázy (TKI) EGFR Piano Generale Istituto Toscano di Tumori Emergenza Presidio Ospedaliero di Livorno Livorno-Italy Viale Alfieri 36 Federico Cappuzzo Ospedale
Biologická léčba nemalobuněčného karcinomu plic
 292 Biologická léčba nemalobuněčného karcinomu plic Petr Zatloukal Klinika pneumologie a hrudní chirurgie, 3. LF UK Praha a FN Na Bulovce Institut postgraduálního vzdělávání ve zdravotnictví, Praha Léčba
292 Biologická léčba nemalobuněčného karcinomu plic Petr Zatloukal Klinika pneumologie a hrudní chirurgie, 3. LF UK Praha a FN Na Bulovce Institut postgraduálního vzdělávání ve zdravotnictví, Praha Léčba
Avastin v léčbě karcinomu prsu
 PŘEHLED Avastin v léčbě karcinomu prsu Avastin in the Treatment of Breast Cancer Petráková K. Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno Souhrn Pacientky s metastatickým karcinomem
PŘEHLED Avastin v léčbě karcinomu prsu Avastin in the Treatment of Breast Cancer Petráková K. Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno Souhrn Pacientky s metastatickým karcinomem
Jak dlouho léčit tromboembolickou nemoc? MUDr. Petr Kessler Odd. hematologie a transfuziologie Nemocnice Pelhřimov
 Jak dlouho léčit tromboembolickou nemoc? MUDr. Petr Kessler Odd. hematologie a transfuziologie Nemocnice Pelhřimov 1995 Six weeks versus six months. 40% provokovaných trombóz Schulman Six weeks versus.
Jak dlouho léčit tromboembolickou nemoc? MUDr. Petr Kessler Odd. hematologie a transfuziologie Nemocnice Pelhřimov 1995 Six weeks versus six months. 40% provokovaných trombóz Schulman Six weeks versus.
Kasuistiky. Professor Bradley J. Monk
 Kasuistiky Professor Bradley J. Monk Division of Gynecologic Oncology Department of Obstetrics and Gynecology Creighton University School of Medicine at St. Joseph s Hospital and Medical Center, a Member
Kasuistiky Professor Bradley J. Monk Division of Gynecologic Oncology Department of Obstetrics and Gynecology Creighton University School of Medicine at St. Joseph s Hospital and Medical Center, a Member
MUŽI ŽENY CELKEM abs. na 100 000 abs. na 100 000 abs. na 100 000 C34 incidence 4660 93,0 1632 31,0 6292 62,0 mortalita 3907 78,0 1272 24,0 5179 50,0
 2.1. Nemalobuněčný bronchogenní karcinom Epidemiologie Zhoubné nádory plic jsou ve vyspělých zemích světa jednou z nejvýznamnějších skupin nádorových onemocnění. V našich podmínkách jsou ZN plic u mužů
2.1. Nemalobuněčný bronchogenní karcinom Epidemiologie Zhoubné nádory plic jsou ve vyspělých zemích světa jednou z nejvýznamnějších skupin nádorových onemocnění. V našich podmínkách jsou ZN plic u mužů
DVĚ STUDIE UKAZUJÍ VÝRAZNĚ PŘÍZNIVÉ VÝSLEDKY CHEMOTERAPIE ZALOŽENÉ NA Eloxatinu V KOMBINACI S BEVACIZUMABEM U POKROČILÉHO KOLOREKTÁLNÍHO KARCINOMU
 DVĚ STUDIE UKAZUJÍ VÝRAZNĚ PŘÍZNIVÉ VÝSLEDKY CHEMOTERAPIE ZALOŽENÉ NA Eloxatinu V KOMBINACI S BEVACIZUMABEM U POKROČILÉHO KOLOREKTÁLNÍHO KARCINOMU Pozitivní výsledky studií TREE-2 a ECOG 3200 oznámeny
DVĚ STUDIE UKAZUJÍ VÝRAZNĚ PŘÍZNIVÉ VÝSLEDKY CHEMOTERAPIE ZALOŽENÉ NA Eloxatinu V KOMBINACI S BEVACIZUMABEM U POKROČILÉHO KOLOREKTÁLNÍHO KARCINOMU Pozitivní výsledky studií TREE-2 a ECOG 3200 oznámeny
Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu
 Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu Marta Krejčí XIII. MM workshop a setkání CMG, Mikulov 11.4.2015 Doplněk č. 1 k doporučení z 9/2012: Diagnostika
Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu Marta Krejčí XIII. MM workshop a setkání CMG, Mikulov 11.4.2015 Doplněk č. 1 k doporučení z 9/2012: Diagnostika
M. Babjuk Urologická klinika 2.LF UK a FN Motol
 Operační léčba jako součást multimodálního přístupu k léčbě vysocerizikového karcinomu prostaty M. Babjuk Urologická klinika 2.LF UK a FN Motol Synopse Definice Výsledky a místo operační léčby Kombinace
Operační léčba jako součást multimodálního přístupu k léčbě vysocerizikového karcinomu prostaty M. Babjuk Urologická klinika 2.LF UK a FN Motol Synopse Definice Výsledky a místo operační léčby Kombinace
Počty pacientů v lékových registrech Herceptin, Avastin, Tarceva, Lapatinib (Tyverb), Erbitux a Renis
 Počty pacientů v lékových registrech Herceptin, Avastin, Tarceva, Lapatinib (Tyverb), Erbitux a Renis Průběžná zpráva - stav k datu 1. 10. 2009 R. Vyzula, M. Šticha, P. Brabec, L. Dušek Celkový přehled
Počty pacientů v lékových registrech Herceptin, Avastin, Tarceva, Lapatinib (Tyverb), Erbitux a Renis Průběžná zpráva - stav k datu 1. 10. 2009 R. Vyzula, M. Šticha, P. Brabec, L. Dušek Celkový přehled
ANALÝZA VÝSLEDKŮ LÉČBY HERCEPTINEM
 ANALÝZA VÝSLEDKŮ LÉČBY HERCEPTINEM Statistická analýza dat k 30. 4. 2006 AUTOŘI: R. Vyzula, D. Némethová, O. Coufal I. ZÁKLADNÍ POPIS SOUBORU I.1. Počet pacientek v jednotlivých centrech Celkový počet
ANALÝZA VÝSLEDKŮ LÉČBY HERCEPTINEM Statistická analýza dat k 30. 4. 2006 AUTOŘI: R. Vyzula, D. Némethová, O. Coufal I. ZÁKLADNÍ POPIS SOUBORU I.1. Počet pacientek v jednotlivých centrech Celkový počet
Nežádoucí příhody v klinické studii CMG 2002
 Nežádoucí příhody v klinické studii 2002 Období 4/2002 12/2004 Kamila Havlíková Klinická studie 2002 Nežádoucí příhoda - Adverse Event (AE) Nepříznivá změna zdravotního stavu postihující subjekt hodnocení,
Nežádoucí příhody v klinické studii 2002 Období 4/2002 12/2004 Kamila Havlíková Klinická studie 2002 Nežádoucí příhoda - Adverse Event (AE) Nepříznivá změna zdravotního stavu postihující subjekt hodnocení,
2. ZHOUBNÝ NOVOTVAR BRONCHU A PLÍCE (C34)
 2. ZHOUBNÝ NOVOTVAR BRONCHU A PLÍCE (C34) 2.1 Nemalobuněčný karcinom 1. linie: 2.1.1 Nádory klinického stadia IIA a IIB pokud jsou kontraindikace chirurgické léčby. U těchto nemocných se chemoterapie kombinuje
2. ZHOUBNÝ NOVOTVAR BRONCHU A PLÍCE (C34) 2.1 Nemalobuněčný karcinom 1. linie: 2.1.1 Nádory klinického stadia IIA a IIB pokud jsou kontraindikace chirurgické léčby. U těchto nemocných se chemoterapie kombinuje
RENIS - Votrient. Klinický registr pacientů s renálním karcinomem. Stav registru k datu 26. 3. 2012
 RENIS - Votrient Klinický registr pacientů s renálním karcinomem Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr Brabec Mgr. Zbyněk
RENIS - Votrient Klinický registr pacientů s renálním karcinomem Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr Brabec Mgr. Zbyněk
Kongres medicíny pro praxi IFDA Praha, Míčovna Pražský hrad 24.října 2015
 Kongres medicíny pro praxi IFDA Praha, Míčovna Pražský hrad 24.října 2015 Glifloziny v terapii DM 2 Zkušenosti z praxe MUDr. Barbora Doležalová IDE CR s.r.o., Chrudim Univerzita Pardubice, Fakulta zdravotnických
Kongres medicíny pro praxi IFDA Praha, Míčovna Pražský hrad 24.října 2015 Glifloziny v terapii DM 2 Zkušenosti z praxe MUDr. Barbora Doležalová IDE CR s.r.o., Chrudim Univerzita Pardubice, Fakulta zdravotnických
Velcade První výsledky z IHOK FN Brno. Luděk Pour. Roman Hájek, Marta Krejčí,Andrea Křivanová, Lenka Zahradová, Zdeněk Adam CMG
 Velcade První výsledky z IHOK FN Brno Luděk Pour Roman Hájek, Marta Krejčí,Andrea Křivanová, Lenka Zahradová, Zdeněk Adam CZECH CMG M Y E L O M A GROUP Č ESKÁ MYELOMOVÁ SKUPINA Velcade = bortezomib Nobelova
Velcade První výsledky z IHOK FN Brno Luděk Pour Roman Hájek, Marta Krejčí,Andrea Křivanová, Lenka Zahradová, Zdeněk Adam CZECH CMG M Y E L O M A GROUP Č ESKÁ MYELOMOVÁ SKUPINA Velcade = bortezomib Nobelova
Nové léčebné možnosti v terapii metastazujícího karcinomu žaludku
 Nové léčebné možnosti v terapii metastazujícího karcinomu žaludku Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1. LF UK a TN KOC (NNB+VFN+TN) Žaludek pravidla klasifikace Klasifikace se používá
Nové léčebné možnosti v terapii metastazujícího karcinomu žaludku Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1. LF UK a TN KOC (NNB+VFN+TN) Žaludek pravidla klasifikace Klasifikace se používá
Pomalidomid první rok léčby v ČR
 C Z E C H G R O U P CZECH GROUP 1 Pomalidomid první rok léčby v ČR Luděk Pour IHOK FN Brno XIII. Výroční setkání CMG 10. 4. 2015 Mikulov C M G M Y E L O M A Č E S K Á M YE LO M O VÁ S K U P IN A CMG ČESKÁ
C Z E C H G R O U P CZECH GROUP 1 Pomalidomid první rok léčby v ČR Luděk Pour IHOK FN Brno XIII. Výroční setkání CMG 10. 4. 2015 Mikulov C M G M Y E L O M A Č E S K Á M YE LO M O VÁ S K U P IN A CMG ČESKÁ
20. ZHOUBNÉ NOVOTVARY HLAVY A KRKU (C00-14, C30-32)
 20. ZHOUBNÉ NOVOTVARY HLAVY A KRKU (C00-14, C30-32) Léčba nádorů hlavy a krku je velmi komplexní. Volba léčebné strategie závisí na lokalizaci primárního nádoru a jeho histologickém typu, přítomnosti regionálních
20. ZHOUBNÉ NOVOTVARY HLAVY A KRKU (C00-14, C30-32) Léčba nádorů hlavy a krku je velmi komplexní. Volba léčebné strategie závisí na lokalizaci primárního nádoru a jeho histologickém typu, přítomnosti regionálních
Praxe hodnocení cílené biologické léčby zhoubných nádorů v ČR a její edukační obsah
 Praxe hodnocení cílené biologické léčby zhoubných nádorů v ČR a její edukační obsah R. Vyzula, P. Brabec, L. Dušek, J. Fínek Stav k datu 30. 10. 2010 Informační a edukační obsah sledování cílené léčby
Praxe hodnocení cílené biologické léčby zhoubných nádorů v ČR a její edukační obsah R. Vyzula, P. Brabec, L. Dušek, J. Fínek Stav k datu 30. 10. 2010 Informační a edukační obsah sledování cílené léčby
Kardioembolický iktus. MUDr.Martin Kuliha Komplexní cerebrovaskulární centrum FN Ostrava
 Kardioembolický iktus MUDr.Martin Kuliha Komplexní cerebrovaskulární centrum FN Ostrava Kardioembolická etiologie icmp! 20% ischemických CMP jsou kardioembolické etiologie! Embolie z levého srdce nebo
Kardioembolický iktus MUDr.Martin Kuliha Komplexní cerebrovaskulární centrum FN Ostrava Kardioembolická etiologie icmp! 20% ischemických CMP jsou kardioembolické etiologie! Embolie z levého srdce nebo
STRUKTURA REGISTRU BREAST
 Vstupní parametry a diagnostika STRUKTURA REGISTRU BREAST 1. Vstupní parametry 1. Kód zdravotní pojišťovny (výběr) 1. 111 2. 201 3. 205 4. 207 5. 209 6. 211 7. 213 8. 217 - do 1.10.2012 9. 222 - do 1.10.2009
Vstupní parametry a diagnostika STRUKTURA REGISTRU BREAST 1. Vstupní parametry 1. Kód zdravotní pojišťovny (výběr) 1. 111 2. 201 3. 205 4. 207 5. 209 6. 211 7. 213 8. 217 - do 1.10.2012 9. 222 - do 1.10.2009
Časná diagnostika zhoubných nádorů prostaty u rizikových skupin mužů. R. Zachoval, M. Babjuk ČUS ČLS JEP
 Časná diagnostika zhoubných nádorů prostaty u rizikových skupin mužů R. Zachoval, M. Babjuk ČUS ČLS JEP Základní předpoklady úspěšného screeningu Cíl screeningu: Snížení mortality Zachování QoL vyjádřené
Časná diagnostika zhoubných nádorů prostaty u rizikových skupin mužů R. Zachoval, M. Babjuk ČUS ČLS JEP Základní předpoklady úspěšného screeningu Cíl screeningu: Snížení mortality Zachování QoL vyjádřené
Přípravek BI ve srovnání s přípravkem Humira u pacientů se středně těžkou až těžkou ložiskovou lupénkou
 Přípravek ve srovnání s přípravkem u pacientů se středně těžkou až těžkou ložiskovou lupénkou Toto je shrnutí klinické studie, které se účastnili pacienti s ložiskovou lupénkou. Je vypracováno pro širokou
Přípravek ve srovnání s přípravkem u pacientů se středně těžkou až těžkou ložiskovou lupénkou Toto je shrnutí klinické studie, které se účastnili pacienti s ložiskovou lupénkou. Je vypracováno pro širokou
Vliv způsobu podání bortezomibu na účinnost a bezpečnost léčby pacientů s mnohočetným myelomem. MUDr. P. Pavlíček FN KV a 3.
 Vliv způsobu podání bortezomibu na účinnost a bezpečnost léčby pacientů s mnohočetným myelomem MUDr. P. Pavlíček FN KV a 3. LF UK Praha Tato prezentace vznikla s finanční podporou společnosti Johnson &
Vliv způsobu podání bortezomibu na účinnost a bezpečnost léčby pacientů s mnohočetným myelomem MUDr. P. Pavlíček FN KV a 3. LF UK Praha Tato prezentace vznikla s finanční podporou společnosti Johnson &
Personalizovaná medicína Roche v oblasti onkologie. Olga Bálková, Roche s.r.o., Diagnostics Division Pracovní dny, Praha, 11.
 Personalizovaná medicína Roche v oblasti onkologie Olga Bálková, Roche s.r.o., Diagnostics Division Pracovní dny, Praha, 11. listopadu 2013 Personalizovaná vs standardní péče Cílená léčba Spojení diagnostiky
Personalizovaná medicína Roche v oblasti onkologie Olga Bálková, Roche s.r.o., Diagnostics Division Pracovní dny, Praha, 11. listopadu 2013 Personalizovaná vs standardní péče Cílená léčba Spojení diagnostiky
Přípravek Avastin se společně s jinými protinádorovými léčivými přípravky používá u dospělých k léčbě těchto typů rakoviny:
 EMA/175824/2015 EMEA/H/C/000582 Souhrn zprávy EPAR určený pro veřejnost bevacizumabum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European Public Assessment Report, EPAR) pro přípravek.
EMA/175824/2015 EMEA/H/C/000582 Souhrn zprávy EPAR určený pro veřejnost bevacizumabum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European Public Assessment Report, EPAR) pro přípravek.
Léčba DLBCL s nízkým rizikem
 Léčba DLBCL s nízkým rizikem Jan Hudeček Klinika hematológie a transfuziológie JLF UK a UNM, Martin Lymfómové fórum 2014 Bratislava, 21. 23. 3. 2014 Difuzní velkobuněčný B-lymfom (DLBCL) heterogenní skupina
Léčba DLBCL s nízkým rizikem Jan Hudeček Klinika hematológie a transfuziológie JLF UK a UNM, Martin Lymfómové fórum 2014 Bratislava, 21. 23. 3. 2014 Difuzní velkobuněčný B-lymfom (DLBCL) heterogenní skupina
9. ZHOUBNÝ NOVOTVAR OVARIÍ A TUBY (C56-57)
 9. ZHOUBNÝ NOVOTVAR OVARIÍ A TUBY (C56-57) 9.1 Epiteliální 9.1.1 Chemoterapie jako součást primární léčby Po chirurgické léčbě epiteliálních ovariálních ZN nutno považovat primární chemoterapii za kurativní.
9. ZHOUBNÝ NOVOTVAR OVARIÍ A TUBY (C56-57) 9.1 Epiteliální 9.1.1 Chemoterapie jako součást primární léčby Po chirurgické léčbě epiteliálních ovariálních ZN nutno považovat primární chemoterapii za kurativní.
Studie afatinibu v porovnání s metotrexátem u pacientů s rakovinou hlavy a krku, která se po předchozí léčbě vrátila nebo začala šířit
 Studie afatinibu v porovnání s metotrexátem u pacientů s rakovinou hlavy a krku, která se po předchozí léčbě vrátila nebo začala šířit Toto je shrnutí klinické studie, které se účastnili pacienti s rakovinou
Studie afatinibu v porovnání s metotrexátem u pacientů s rakovinou hlavy a krku, která se po předchozí léčbě vrátila nebo začala šířit Toto je shrnutí klinické studie, které se účastnili pacienti s rakovinou
Novinky v léčbě. Úvod: Srdeční selhání epidemie 21. století. Prof. MUDr. Jindřich Špinar, CSc., FESC Interní kardiologická klinika FN Brno
 Novinky v léčbě Úvod: Srdeční selhání epidemie 21. století Prof. MUDr. Jindřich Špinar, CSc., FESC Interní kardiologická klinika FN Brno PARADIGM-HF: Design studie Randomizace n=8442 Dvojitě slepá Léčebná
Novinky v léčbě Úvod: Srdeční selhání epidemie 21. století Prof. MUDr. Jindřich Špinar, CSc., FESC Interní kardiologická klinika FN Brno PARADIGM-HF: Design studie Randomizace n=8442 Dvojitě slepá Léčebná
The Cost Study of First- line Treatment of Metastatic Colorectal Carcinoma with Bevacizumab- containing Regimen in the Czech Republic
 PŮVODNÍ PRÁCE Analýza nákladů na 1. linii léčby metastatického kolorektálního karcinomu při podání režimů s bevacizumabem data z reálné klinické praxe v České republice The Cost Study of First- line Treatment
PŮVODNÍ PRÁCE Analýza nákladů na 1. linii léčby metastatického kolorektálního karcinomu při podání režimů s bevacizumabem data z reálné klinické praxe v České republice The Cost Study of First- line Treatment
Nežádoucí příhody v klinické studii CMG 2002
 Nežádoucí příhody v klinické studii 2002 Období 4/2002 3/2006 Kamila Havlíková Klinická studie 2002 Požadavky na hlášení v průběhu klinického hodnocení Povinnosti zkoušejícího: neprodleně (do 15 dnů) hlásit
Nežádoucí příhody v klinické studii 2002 Období 4/2002 3/2006 Kamila Havlíková Klinická studie 2002 Požadavky na hlášení v průběhu klinického hodnocení Povinnosti zkoušejícího: neprodleně (do 15 dnů) hlásit
INTERIM ANALÝZA. Klinické studie
 INTERIM ANALÝZA Strana 1 INTERIM ANALÝZA Klinické studie Sledování účinku Prostatus oils (speciální směs rostlinných olejů) u pacientů s benigním zvětšením prostaty a nadnormativním zvýšením hladiny PSA
INTERIM ANALÝZA Strana 1 INTERIM ANALÝZA Klinické studie Sledování účinku Prostatus oils (speciální směs rostlinných olejů) u pacientů s benigním zvětšením prostaty a nadnormativním zvýšením hladiny PSA
IMUNOTERAPIE NÁDORŮ MOČOVÉHO MĚCHÝŘE. Michaela Matoušková
 IMUNOTERAPIE NÁDORŮ MOČOVÉHO MĚCHÝŘE Michaela Matoušková IMUNOTERAPIE ZN Z UROTELU lokalizovaná onemocnění - BCG VAKCÍNA pokročilá onemocnění BCG VAKCÍNA po instilaci vazba BCG k fibronektinu produkovanému
IMUNOTERAPIE NÁDORŮ MOČOVÉHO MĚCHÝŘE Michaela Matoušková IMUNOTERAPIE ZN Z UROTELU lokalizovaná onemocnění - BCG VAKCÍNA pokročilá onemocnění BCG VAKCÍNA po instilaci vazba BCG k fibronektinu produkovanému
AKTUÁLNÍ VÝSLEDKY KLINICKÝCH STUDIÍ
 SEKCE NÁDORY PRSU PŮVODNÍ SDĚLENÍ AKTUÁLNÍ VÝSLEDKY KLINICKÝCH STUDIÍ Letošní konference ASCO 2017 přinesla řadu zajímavých výsledků a naději na opětovné zlepšení přežití pacientů so solidními nádory,
SEKCE NÁDORY PRSU PŮVODNÍ SDĚLENÍ AKTUÁLNÍ VÝSLEDKY KLINICKÝCH STUDIÍ Letošní konference ASCO 2017 přinesla řadu zajímavých výsledků a naději na opětovné zlepšení přežití pacientů so solidními nádory,
Bevacizumab v primární léčbě karcinomu vaječníků
 Bevacizumab v primární léčbě karcinomu vaječníků Karcinom vaječníků je sedmou nejčastější příčinou úmrtí žen na nádorové onemocnění Počet nových případů za rok 1. Prs 1. Prs 1 383 523 458 367 Počet úmrtí
Bevacizumab v primární léčbě karcinomu vaječníků Karcinom vaječníků je sedmou nejčastější příčinou úmrtí žen na nádorové onemocnění Počet nových případů za rok 1. Prs 1. Prs 1 383 523 458 367 Počet úmrtí
KLINICKÁ ČÁST DOKUMENTACE + nejčastější nedostatky
 Klinická část dokumentace KLINICKÁ ČÁST DOKUMENTACE + nejčastější nedostatky MUDr. Alena Trunečková Klinická část dokumentace KLINICKÁ ČÁST DOKUMENTACE Protokol Náležitosti dokumentu Fáze KH - úskalí Designy
Klinická část dokumentace KLINICKÁ ČÁST DOKUMENTACE + nejčastější nedostatky MUDr. Alena Trunečková Klinická část dokumentace KLINICKÁ ČÁST DOKUMENTACE Protokol Náležitosti dokumentu Fáze KH - úskalí Designy
Statistická analýza dat k
 ANALÝZA VÝSLEDKŮ LÉČBY AVASTINEM Statistická analýza dat k 30. 9. 2006 R. Vyzula, D. Némethová, A. Svobodník et al. I ZÁKLADNÍ POPIS SOUBORU I.1. Počet pacientů v jednotlivých centrech Celkový počet zařazených
ANALÝZA VÝSLEDKŮ LÉČBY AVASTINEM Statistická analýza dat k 30. 9. 2006 R. Vyzula, D. Némethová, A. Svobodník et al. I ZÁKLADNÍ POPIS SOUBORU I.1. Počet pacientů v jednotlivých centrech Celkový počet zařazených
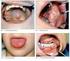
Elecsys SCC první zkušenosti z rutinní praxe. Ing. Pavla Eliášová Oddělení klinické biochemie Masarykova nemocnice v Ústí nad Labem
 Elecsys SCC první zkušenosti z rutinní praxe Ing. Pavla Eliášová Oddělení klinické biochemie Masarykova nemocnice v Ústí nad Labem Antigen SCC Glykoprotein s molekulovou hmotností 42 kd dva základní typy
Elecsys SCC první zkušenosti z rutinní praxe Ing. Pavla Eliášová Oddělení klinické biochemie Masarykova nemocnice v Ústí nad Labem Antigen SCC Glykoprotein s molekulovou hmotností 42 kd dva základní typy
Profil nemocn ch vhodn ch k léãbû chemobioterapií
 Profil nemocn ch vhodn ch k léãbû chemobioterapií MUDr. Marta Holíková / Oddûlení klinické onkologie Krajské nemocnice, Liberec Většina pacientů s kolorektálním karcinomem (CRC) stadia I nebo II je trvale
Profil nemocn ch vhodn ch k léãbû chemobioterapií MUDr. Marta Holíková / Oddûlení klinické onkologie Krajské nemocnice, Liberec Většina pacientů s kolorektálním karcinomem (CRC) stadia I nebo II je trvale
Standard. Zhoubné nádory pankreatu Incidence a mortalita v České republice (2014) ZN slinivky břišní MUŽI ŽENY CELKEM
 /7. Epidemiologie: Karcinom slinivky břišní je celosvětově čtvrtou nejčastější příčinou úmrtí na nádorové onemocnění a Česká republika je druhou zemí s nejvyšší incidencí tohoto onemocnění. Incidence karcinomu
/7. Epidemiologie: Karcinom slinivky břišní je celosvětově čtvrtou nejčastější příčinou úmrtí na nádorové onemocnění a Česká republika je druhou zemí s nejvyšší incidencí tohoto onemocnění. Incidence karcinomu
22. ZHOUBNÝ NOVOTVAR MOČOVÉHO MĚCHÝŘE (C67)
 22. ZHOUBNÝ NOVOTVAR MOČOVÉHO MĚCHÝŘE (C67) 22.1 Stadium 0a (TaN0M0), stadium I (T1N0M0) 22.1.1 Základem léčby je transuretrální resekce (TUR). Doporučována je jednorázová intravezikální aplikace chemoterapeutika
22. ZHOUBNÝ NOVOTVAR MOČOVÉHO MĚCHÝŘE (C67) 22.1 Stadium 0a (TaN0M0), stadium I (T1N0M0) 22.1.1 Základem léčby je transuretrální resekce (TUR). Doporučována je jednorázová intravezikální aplikace chemoterapeutika
ProGastrin-Releasing Peptide (ProGRP) u nemocných s malobuněčným karcinomem plic
 ProGastrin-Releasing Peptide (ProGRP) u nemocných s malobuněčným karcinomem plic FONS Symposium klinické biochemie Pardubice, 23.9. 25.9.202 M. Tomíšková, J. Skřičková, I. Klabenešová, M. Dastych 2 Klinika
ProGastrin-Releasing Peptide (ProGRP) u nemocných s malobuněčným karcinomem plic FONS Symposium klinické biochemie Pardubice, 23.9. 25.9.202 M. Tomíšková, J. Skřičková, I. Klabenešová, M. Dastych 2 Klinika
Rocheáda v rozhodování aneb testování HPV ve screeningu cervikálního karcinomu 2013
 Rocheáda v rozhodování aneb testování HPV ve screeningu cervikálního karcinomu 2013 Igor Blanárik, Olga Bálková, Roche s.r.o., Diagnostics Division Konference AACL, Praha, 22. března 2013 Detekce HPV a
Rocheáda v rozhodování aneb testování HPV ve screeningu cervikálního karcinomu 2013 Igor Blanárik, Olga Bálková, Roche s.r.o., Diagnostics Division Konference AACL, Praha, 22. března 2013 Detekce HPV a
Čím se zabývala tato studie? Proč byla studie potřebná? Jaké léky byly hodnoceny? BI
 Toto je souhrn klinické studie u pacientů s idiopatickou plicní fibrózou, což je vzácný typ onemocnění plic. Je uveden v jazyce, který je obecně srozumitelný pro čtenáře. Patří sem informace o tom, jak
Toto je souhrn klinické studie u pacientů s idiopatickou plicní fibrózou, což je vzácný typ onemocnění plic. Je uveden v jazyce, který je obecně srozumitelný pro čtenáře. Patří sem informace o tom, jak
Analýza dat z klinického registru RenIS České onkologické společnosti ČLS JEP shrnutí výsledků pro elektronický report
 Účinnost a bezpečnost přípravku Afinitor (everolimus) v léčbě pacientů s pokročilým karcinomem ledviny v podmínkách reálné klinické praxe v České republice Analýza dat z klinického registru RenIS České
Účinnost a bezpečnost přípravku Afinitor (everolimus) v léčbě pacientů s pokročilým karcinomem ledviny v podmínkách reálné klinické praxe v České republice Analýza dat z klinického registru RenIS České
INPULSIS -ON: Dlouhodobá bezpečnost nintedanibu u pacientů s idiopatickou plicní fibrózou (IPF)
 INPULSIS -ON: Dlouhodobá bezpečnost nintedanibu u pacientů s idiopatickou plicní fibrózou (IPF) Toto je shrnutí klinické studie, které se účastnili pacienti IPF. Je vypracováno pro širokou veřejnost. Obsahuje
INPULSIS -ON: Dlouhodobá bezpečnost nintedanibu u pacientů s idiopatickou plicní fibrózou (IPF) Toto je shrnutí klinické studie, které se účastnili pacienti IPF. Je vypracováno pro širokou veřejnost. Obsahuje
PŘEHLED KLINICKÝCH AKTIVIT
 PŘEHLED KLINICKÝCH AKTIVIT CLINICAL TRIAL 4W 7 th Annual Report Multicentrická randomizovaná studie 4W Datum zahájení studie : 15. 4. 1996 Datum ukončení náběru: 3. 2002 Datum zjištění mediánu přežití:
PŘEHLED KLINICKÝCH AKTIVIT CLINICAL TRIAL 4W 7 th Annual Report Multicentrická randomizovaná studie 4W Datum zahájení studie : 15. 4. 1996 Datum ukončení náběru: 3. 2002 Datum zjištění mediánu přežití:
1. Nádory hlavy a krku
 1. Nádory hlavy a krku Rozdělení zhoubných nádorů (ZN) hlavy a krku podle anatomických oblastí: 1. ZN paranasálních dutin 2. ZN rtu a dutiny ústní 3. ZN hltanu (nasofarynx, orofarynx, hypofanynx) 4. ZN
1. Nádory hlavy a krku Rozdělení zhoubných nádorů (ZN) hlavy a krku podle anatomických oblastí: 1. ZN paranasálních dutin 2. ZN rtu a dutiny ústní 3. ZN hltanu (nasofarynx, orofarynx, hypofanynx) 4. ZN
Léčba MM LP Revlimid v ČR - aktuální analýza dat RMG
 Léčba MM LP Revlimid v ČR - aktuální analýza dat RMG Statistická analýza 262 pacientů Vladimír Maisnar za II. interní klinika OKH FN a LF UK Hradec Králové Léčba MM LP Revlimid v ČR Látka patřící do skupiny
Léčba MM LP Revlimid v ČR - aktuální analýza dat RMG Statistická analýza 262 pacientů Vladimír Maisnar za II. interní klinika OKH FN a LF UK Hradec Králové Léčba MM LP Revlimid v ČR Látka patřící do skupiny
Urychlení úpravy krvetvorby poškozené cytostatickou terapií (5-fluorouracil a cisplatina) p.o. aplikací IMUNORu
 Urychlení úpravy krvetvorby poškozené cytostatickou terapií (5-fluorouracil a cisplatina) p.o. aplikací IMUNORu Úvod Myelosuprese (poškození krvetvorby) patří mezi nejčastější vedlejší účinky chemoterapie.
Urychlení úpravy krvetvorby poškozené cytostatickou terapií (5-fluorouracil a cisplatina) p.o. aplikací IMUNORu Úvod Myelosuprese (poškození krvetvorby) patří mezi nejčastější vedlejší účinky chemoterapie.
Výsledky léčby kombinačními režimy s Revlimidem v ČR - trojkombinace. MUDr. Evžen Gregora OKH FNKV, Praha Mikulov 2010
 Výsledky léčby kombinačními režimy s Revlimidem v ČR - trojkombinace MUDr. Evžen Gregora OKH FNKV, Praha Mikulov 21 1 REVLIMID - Lenalidomid imunomodulátor účinější než thalidomid inhibice TNF-α stimulace
Výsledky léčby kombinačními režimy s Revlimidem v ČR - trojkombinace MUDr. Evžen Gregora OKH FNKV, Praha Mikulov 21 1 REVLIMID - Lenalidomid imunomodulátor účinější než thalidomid inhibice TNF-α stimulace
Příloha IV. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha IV Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 132 Vědecké závěry Výbor CHMP zvážil níže uvedené doporučení výboru PRAC ze dne 5. prosince 2013 s ohledem na postup podle
Příloha IV Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 132 Vědecké závěry Výbor CHMP zvážil níže uvedené doporučení výboru PRAC ze dne 5. prosince 2013 s ohledem na postup podle
Kongres medicíny pro praxi IFDA Praha, Hotel Hilton 27.září 2014
 Kongres medicíny pro praxi IFDA Praha, Hotel Hilton 27.září 2014 Co znamená cílená terapie karcinomu plic v roce 2014? František Salajka Plicní klinika FN Hradec Králové Co může pneumoonkologické centrum
Kongres medicíny pro praxi IFDA Praha, Hotel Hilton 27.září 2014 Co znamená cílená terapie karcinomu plic v roce 2014? František Salajka Plicní klinika FN Hradec Králové Co může pneumoonkologické centrum
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Systémová léčba lokálně pokročilých a metastatických GEP-NET
 Systémová léčba lokálně pokročilých a metastatických GEP-NET Jiří Tomášek Masarykův onkologický ústav, Brno Vzácné nádory a raritní stavy v oblasti GITu Seminář pro onkology, gastroenterology,radiology
Systémová léčba lokálně pokročilých a metastatických GEP-NET Jiří Tomášek Masarykův onkologický ústav, Brno Vzácné nádory a raritní stavy v oblasti GITu Seminář pro onkology, gastroenterology,radiology
BRONCHOGENNÍ KARCINOM
 Nádory plic, pleury a mediastina: BRONCHOGENNÍ KARCINOM Jiří Ferda, Eva Ferdová, Hynek Mírka, Boris Kreuzberg Klinika zobrazovacích metod LFUK a FN v Plzni Epidemiologie Nejčastější malignita v celosvětovém
Nádory plic, pleury a mediastina: BRONCHOGENNÍ KARCINOM Jiří Ferda, Eva Ferdová, Hynek Mírka, Boris Kreuzberg Klinika zobrazovacích metod LFUK a FN v Plzni Epidemiologie Nejčastější malignita v celosvětovém
Fitness for anaesthesia
 Fitness for anaesthesia Richard Pradl KARIM FN a LF UK Plzeň ČSARIM, Plzeň 2015 04/10/2015 Cílem předoperačního hodnocení stavu pacienta je pokles morbidity spojené s operačním výkonem, zvýšení efektivity
Fitness for anaesthesia Richard Pradl KARIM FN a LF UK Plzeň ČSARIM, Plzeň 2015 04/10/2015 Cílem předoperačního hodnocení stavu pacienta je pokles morbidity spojené s operačním výkonem, zvýšení efektivity
Úloha laboratorní medicíny v komplexní léčbě nádorových onemocnění. Bohuslav Melichar Onkologická klinika LF UP a FN Olomouc
 Úloha laboratorní medicíny v komplexní léčbě nádorových onemocnění Bohuslav Melichar Onkologická klinika LF UP a FN Olomouc Léčba nádorových onemocnění je multidisciplinárním problémem Základem léčby je
Úloha laboratorní medicíny v komplexní léčbě nádorových onemocnění Bohuslav Melichar Onkologická klinika LF UP a FN Olomouc Léčba nádorových onemocnění je multidisciplinárním problémem Základem léčby je
RADIOTERAPIE. karcinom prostaty s vysokým rizikem
 RADIOTERAPIE karcinom prostaty s vysokým rizikem K. Odrážka Oddělení klinické a radiační onkologie Multiscan s.r.o., Pardubická krajská nemocnice a.s. 1. a 3. LF UK v Praze IPVZ Praha POOPERAČNÍ RT Indikace
RADIOTERAPIE karcinom prostaty s vysokým rizikem K. Odrážka Oddělení klinické a radiační onkologie Multiscan s.r.o., Pardubická krajská nemocnice a.s. 1. a 3. LF UK v Praze IPVZ Praha POOPERAČNÍ RT Indikace
Výsledky léčby Waldenströmovy makroglobulinemie na IHOK FN Brno
 C Z E C H G R O U P C Z E C H G R O U P Výsledky léčby Waldenströmovy makroglobulinemie na IHOK FN Brno Luděk Pour IHOK FN Brno 10-11.4. 2015 XIII. Roční setkání CMG C M G Č E S K Á M YE LO M O VÁ S K
C Z E C H G R O U P C Z E C H G R O U P Výsledky léčby Waldenströmovy makroglobulinemie na IHOK FN Brno Luděk Pour IHOK FN Brno 10-11.4. 2015 XIII. Roční setkání CMG C M G Č E S K Á M YE LO M O VÁ S K
