Prvky VI. hlavní skupiny (O, S, Se, Te,, Po)
|
|
|
- Vlastimil Dušek
- před 9 lety
- Počet zobrazení:
Transkript
1 Prvky VI. hlavní skupiny (O, S, Se, Te,, Po)
2 I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N O F Ne 3 Na Mg (n-1) d Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Lr Rf Ha La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No
3 Vlastnosti prvků VI. hlavní skupiny konfigurace ns 2 np 4 Kyslík se výrazně vlastnostmi odlišuje, S a Se nekovy, Te (a Po) kovy, typická mocenství -II, +IV a +VI X t.t. ( C) O 3, S 2, Se 2, Te 2, Po 1,76
4 Kyslík Scheele, Priestley, objev kyslíku 1775 Lavoisier poznal, že kyslík je prvek, pád flogistonové teorie 1877 kyslík poprvé zkapalněn
5 Výskyt Nejhojnější prvek zemské kůry (49,5 hmotn. %) Volný a minerály (oxidy, křemičitany, hlinitokřemičitany, fosforečnany atd.) Živé organizmy - biogenní prvek Nejvíce zastoupený izotop 16 O (stopy 17 O a 18 O)
6 Plynný kyslík Řád vazby 2, ale dva nepárové elektrony v protivazebných molekulových π orbitalech molekula je paramagnetická
7 MO diagram molekuly kyslíku
8 Oxidační stavy kyslík je po fluoru druhý nejelektronegativnější prvek, proto ve všech sloučeninách (mimo nevýznamných s fluorem, např. OF 2 ) má oxidačníčíslo -II
9 Příprava Příprava Tepelný rozklad oxidů 2 HgO 2 HgO + O 2 Rozklad peroxidů 5 H 2 O KMnO H 2 SO 4 5 O 2 + K 2 SO MnSO H 2 O Tepelný rozklad kyslíkatých solí 2 KClO 3 2 KCI + O 2 Elektrolýza 4 OH 2 H 2 O + O e - (anoda)
10 Výroba a použití Výroba destilace kapalného vzduchu dělení na molekulových sítech Použití výroba železa a oceli (vysoké pece) výroba syntézního plynu výroba skla řezání a sváření
11 Oxidy probírány u jednotlivých prvků, charakter závisí na rozdílu elektronegativit (iontové až kovalentní polární)
12 lomená molekula O 3 Ozon
13 Ozon Příprava Ozonizátory (tichý elektrický výboj v plynném kyslíku), také UV záření O 2 2 O O + O 2 O 3 po zkapalnění se frakční destilací získá 10% O 3
14 Ozon Použití dezinfekce pitné vody organické syntézy (kyselina peroxooctová, ozonidy) konzervárenský průmysl
15 Peroxid vodíku H 2 O 2 bezbarvá kapalina s extrémními oxidačními schopnostmi, dodává se jako 30% roztok ve vodě
16 Peroxid vodíku Příprava BaO 2 + H 2 SO 4 BaSO 4 + H 2 O 2 H 2 S 2 O H 2 O 2 H 2 SO 4 + H 2 O 2 Výroba přes deriváty antrachinonu
17 Peroxid vodíku Vlastnosti rozklad 2 H 2 O 2 2 H 2 O + O 2 oxidace SO H 2 O 2 SO H 2 O redukce Ag 2 O + H 2 O 2 2 Ag + H 2 O + O 2
18 Peroxid vodíku Použití Oxidační činidlo Výroba peroxosloučenin (peroxoboritany, peroxofosforečnany) Hyperoxidy - KO 2 Komplexy s H 2 O 2 (náhrada za H 2 O) K 2 Cr 2 O H 2 O 2 + H 2 SO 4 2CrO(O 2 ) 2 + K 2 SO H 2 O modrý peroxokomplex Cr (+VI)
19 Chalkogeny síra známa od prehistorických dob (zmínky i v Bibli) 1777 Lavoisier zjistil elementární podstatu síry 1782 Reichestein připravil tellur ze zlatonosných rud z Rumunska, o 35 let později izolován selen 1898 Marie Curie-Sklodowská izolovala polonium (a radium) ze zbytků jáchymovského smolince
20 Výskyt Síra 16. nejrozšířenější prvek v zemské kůře (0,05 %), ale vyskytuje se i ryzí (sopky) a tvořířadu nápadných a hojných minerálů (sulfidů a síranů), nejběžnější pyrit FeS 2 a sádrovec CaSO 4. 2 H 2 O Živé organizmy - biogenní prvek
21 Výskyt Selen a tellur obsah v zemské kůře nízký ( %, blíží se zlatu), minerály vzácné, hlavně doprovázejí síru v sulfidech Polonium radioaktivní prvek, velmi vzácný, součást rozpadovéřady (t 1/2 = 138 dní)
22 Síra Žlutá krystalická látka, několik alotropických modifikací, ve všech molekuly S 8, v plynném stavu podle teploty S 8, S 6, S 4 a S 2
23 Příprava Síra je jednou z přírodních forem, současně je jednou z výchozích surovin pro přípravu sloučenin síry Důležitá reakce při vzniku síry v přírodě 2 H 2 S + SO 2 3 S + 2 H 2 O Hoření síry S + O 2 SO 2 bez katalyzátorů nevzniká SO 3
24 Výroba Výroba a použití síry těžba síry z podzemních ložisek přehřátou parou (např. Tarnobrzeg) oxid siřičitý vzniká pražením sulfidů na vzduchu 4 FeS O 2 2 Fe 2 O SO 2 Použití výroba kyseliny sírové vulkanizace kaučuku
25 Oxidační stavy síra má v hlavních sloučeninách oxidačníčíslo -II (sulfan, sulfidy), +IV (oxid siřičitý, siřičitany) a +VI (oxid sírový, sírany), malé množství méně významných sloučenin (SCl 2 ) má oxidační číslo +II
26 Sulfany H 2 S x x = 1 6 prvníčlen sirovodík H 2 S, lomená molekula (obdoba H 2 O), jedovatý plyn nepříjemného zápachu, příprava reakcí zředěné H 2 SO 4 s FeS v Kippově přístroji H 2 SO 4 + FeS FeSO 4 + H 2 S
27 Sulfan H 2 S sirovodík ve vodě se rozpouští na sirovodíkovou vodu, v roztoku se chová jako slabá kyselina H 2 S + H 2 O HS - + H 3 O + HS - + H 2 O S 2- + H 3 O + soli hydrogensulfidy a sulfidy
28 Vyšší sulfany H 2 S x příprava S 2 Cl H 2 S H 2 S HCl působením roztoku bílého sulfidu amonného na síru vzniká žlutý sulfid amonný S x + (NH 4 ) 2 S (NH 4 ) 2 S x+1
29 Sulfidy hydrogensulfidy a sulfidy alkálií a alkalických zemin, dobře rozpustné ve vodě sulfidy ostatních kovů ve vodě nerozpustné, některé vodou hydrolyzují (Al 2 S 3, Cr 2 S 3, SiS 2 )
30 Sulfidy Sulfidy těžkých kovů vznikají reakcí rozpustných solí kovů se sulfanem, reakcí s bílým sulfidem amonným, redukcí síranů uhlíkem nebo přímou reakcí prvků Na rozdílech v podmínkách vzniku a v rozpustnosti produktů založen dříve používaný sirovodíkový způsob analytického dělení kationtů
31 Sulfidy Sulfidy As 3+, Sb 3+, Ag +, Sn 2+, Hg 2+ a Pb 2+ a Cd 2+ se srážejí již v kyselém prostředí, Fe 2+, Mn 2+, Ni 2+, Co 2+, Zn 2+ až v zásaditém (amoniakálním), sulfidy As 3+, Sb 3+ a Sn 2+ se rozpouštějí v roztoku bílého sulfidu amonného
32 Sulfidy Velmi rozšířené minerály, hlavně těžkých kovů (PbS, ZnS, CuFeS 2 atd.) Pyrit FeS 2 je disulfid železnatý, obsahuje aniont S 2-2 Při jejich zpracování je vždy nutné je převést na oxidy 2 CuS + 3 O 2 2 CuO + 2 SO 2
33 Sulfan a sulfidy Sulfan a sulfidy mají redukční vlastnosti a podle podmínek se mohou oxidovat na síru, oxid siřičitý nebo sírany H 2 S + Br 2 S + 2 HBr ZnS + 8 HNO 3 ZnSO NO H 2 O
34 Halogenidy síry Vznikářada halogenidů, ale bromidy a jodidy jsou nestálé a nevýznamné Důležité halogenidy SF 6, SF 4 a S 2 Cl 2
35 Fluorid sírový SF 6 mimořádně chemicky inertní plyn vznikající reakcí fluoru se sírou, použití v rozvaděčích
36 Fluorid siřičitý SF 4 vysoce chemicky reaktivní plyn vznikající reakcí fluoru se sírou, použití v syntézách, jedovatý
37 Chloridy síry S 2 Cl 2 a SCl 2 vysoce chemicky reaktivní kapaliny vznikající reakcí chloru s roztavenou sírou použití v syntézách S S Cl a pro rozpouštění síry Cl
38 Oxidy síry SO 2 silně toxický plyn vznikající spalováním síry, pražením sulfidů nebo rozkladem siřičitanů, průmyslové znečistění atmosféry Na 2 SO 3 + H 2 SO 4 Na 2 SO 4 + H 2 O + SO 2
39 Oxidy síry SO 2 s vodou reaguje za vzniku kyseliny siřičité H 2 SO 3, s hydroxidy za vzniku siřičitanů, vůči oxidačním činidlům vystupuje jako redukční látka 5 SO KMnO H 2 O K 2 SO MnSO H 2 SO 4
40 Oxidy síry SO 3 pevná, snadno těkající látka, t.t. 17 C vzniká oxidací SO 2 pouze v přítomnosti katalyzátorů, průmyslově NO nebo V 2 O 5
41 Oxidy síry SO 3 anhydrid kyseliny sírové, rozpouští se v koncentrované kyselině sírové na oleum, má slabé oxidační vlastnosti mezistupeň výroby kyseliny sírové
42 Oxokyseliny síry Oxokyselin síry je několik řad v důsledku schopnosti síry tvořit vazby S O, S S i S H Mimo základních kyselin H 2 SO 3 a H 2 SO 4 jsou průměrné oxidační stupně síry formální
43 Kyselina siřičitá Reakcí SO 2 s vodou vzniká nestálá kyselina siřičitá H 2 SO 3 s redukčními vlastnostmi, známá pouze v roztoku nebo jako soli Je to slabá kyselina a tvoří dvěřady solí hydrogensiřičitany a siřičitany
44 Kyselina disiřičitá Kondenzací kyseliny siřičité nebo hydrogensiřičitanů vznikají nestálá slabá kyselina disiřičitá H 2 S 2 O 5 respektive disiřičitany
45 Kyselina dithioničitá Reakcí SO 2 se zinkem v kyselém prostředí vzniká kyselina dithioničitá H 2 S 2 O 4 se silně redukčními vlastnostmi 2 SO 2 + Zn ZnS 2 O 4 dithioničitany se používají jako redukční prostředek v chemii a textilním průmyslu
46 Kyselina sírová Reakcí SO 3 s vodou vzniká stálá kyselina sírová H 2 SO 4, je to silná kyselina a tvoří dvě řady solí: hydrogensírany a sírany Koncentrovaná za tepla má slabé oxidační vlastnosti
47 Výroba kyseliny sírové spalování síry na SO 2 oxidace SO 2 na SO 3 starší nitrosní způsob nový kontaktní způsob reakce SO 3 s vodou (přes oleum, jinak vzniká mlha)
48 Oxidace SO 2 na SO 3 nitrosní způsob homogenní katalýza 2 NO + O 2 2 NO 2 SO 2 + NO 2 SO 3 + NO kontaktní způsob 2 SO 2 + O 2 2 SO 3 (400 C, katalyzátor V 2 O 5 )
49 Oleum Reakcí SO 3 s koncentrovanou kyselinou sírovou vzniká oleum, což je směs kyselin disírové, trisírové a tetrasírové Oleum se dodává s koncentrací 20 % SO 3 v H 2 SO 4 nebo se ředí na 98% H 2 SO 4
50 Kyselina disírová Reakcí SO 3 s kyselinou sírovou vzniká kyselina disírová H 2 S 2 O 7, ve vodě hydrolyzuje na kyselinu sírovou Hydrogensírany po zahřátí lehce kondenzují na disírany, které po rozpuštění ve vodě tvoří zpět hydrogensírany
51 Kyselina thiosírová Kyselina thiosírová H 2 S 2 O 3 je nestálá, její soli thiosírany jsou poměrně stálé Příprava 2 NaHS + 4 NaHSO 3 3 Na 2 S 2 O H 2 O
52 Kyselina thiosírová Thiosírany mají několik důležitých reakcí Rozklad v kyselém prostředí S 2 O H + H 2 O + SO 2 + S Tvorba komplexu s Ag + (ustalovač) S 2 O Ag + [Ag(S 2 O 3 )] - Reakce s jodem (vznik tetrathionanu) S 2 O I 2 S 4 O I -
53 Kyseliny polythionové Řada kyselin H 2 S x O 6 x = 2 až 6 Relativně stálé kyseliny v neutrálním a alkalickém prostředí, byly izolovány soli hlavně alkálií a alkalických zemin dithionová tetrathionová
54 Kyselina peroxosírová Anodickou oxidací kyseliny sírové se vyrábí kyselina peroxosírová H 2 SO 5, která vzniká i reakcemi kyseliny sírové nebo chlorsírové s peroxidem vodíku HSO 3 Cl + H 2 O 2 H 2 SO 5 + HCl
55 Kyselina peroxodisírová Obdobně se anodickou oxidací kyseliny sírové za upravených podmínek vyrábí kyselina peroxodisírová H 2 S 2 O 8,
56 Kyseliny peroxosírové Kyseliny peroxosírové a jejich soli peroxosírany a peroxodisírany jsou silnější oxidační prostředky než peroxid vodíku, v přítomnosti Ag + jako katalyzátoru oxiduje peroxodisíran sloučeniny manganu až na manganistan 3 H 2 S 2 O MnO H 2 O 2 HMnO H 2 SO 4
57 Deriváty oxokyselin síry Chlorid thionylu SOCl 2 Odvozen od kyseliny siřičité náhradou dvou skupin OH halogenem, kapalina Výroba SO 2 + PCl 5 SOCl 2 + POCl 3 Používá se při chemických syntézách, jako rozpouštědlo a pro dehydrataci SOCl 2 + H 2 O SO HCl
58 Deriváty oxokyselin síry Chlorid sulfurylu SO 2 Cl 2 Odvozen od kyseliny sírové náhradou dvou skupin OH halogenem, kapalina velmi citlivá na vodu Výroba SO 2 + Cl 2 SO 2 Cl 2 Používá se při chemických syntézách, jako rozpouštědlo a pro chloraci
59 Deriváty oxokyselin síry Kyselina chlorsulfonová HSO 3 Cl Odvozena od kyseliny sírové náhradou jedné skupiny OH halogenem, kapalina bouřlivě reagující s vodou, v organické chemii důležité chlorsulfonační činidlo
60 Selen a tellur Získávání selenu a telluru Zdrojem vždy odpady jiných výrob, kaly po rafinaci mědi nebo výrobě kyseliny sírové, prach po pražení sulfidických rud hlavně mědi, olova a stříbra Cu 2 Se + Na 2 CO O 2 2 CuO + Na 2 SeO 3 + CO 2 H 2 SeO SO 2 + H 2 O Se + 2 H 2 SO 4
61 Použití selenu a telluru Selen barvení a odbarvování skla Cd(S,Se), xerografie, fotoelektrické přístroje Tellur speciální slitiny, katalyzátory
62 Selen a jeho sloučeniny Selen tvoří několik alotropických modifikací, nejběžnějšíčervený selen (struktura jako síra s molekulami Se 8 ) a kovový selen Většina sloučenin je velmi podobných sloučeninám síry, pouze sloučeniny +IV jsou podstatně stabilnější než +VI
63 Selen a jeho sloučeniny Selan H 2 Se obdoba sulfanu, ale nestálá a lehce se oxidující na selen Oxidy SeO 2 a SeO 3 jsou pevné látky, anhydridy kyselin H 2 SeO 3 a H 2 SeO 4, (obdoba kyselin siřičité a sírové)
64 Selen a jeho sloučeniny Soli kyselin seleničitany a selenany (obdoba siřičitanů a síranů) Kyselina seleničitá a seleničitany jsou stabilní, kyselina selenová a selenany mají velmi silné oxidační účinky (rozpouští i Au, Pd a Pt) 2 Au + 6 H 2 SeO 4 Au 2 (SeO 4 ) H 2 SeO H 2 O
65 Tellur a jeho sloučeniny Tellur tvoří kovovou modifikaci, tellan H 2 Te je nestálý, oxid TeO 2 je ve vodě nerozpustný, významnou sloučeninou je kyselina hexahydrogentellurová H 6 TeO 6, slabá kyselina složité struktury, s oxidačními vlastnostmi, soli tellurany
atomová hmotnost S + O 2 -> SO 2 Fe + S -> FeS
 PRVKY ŠESTÉ SKUPINY - CHALKOGENY Mezi chalkogeny (nepřechodné prvky 6.skupiny) zařazujeme kyslík, síru, selen, tellur a radioaktivní polonium. Společnou vlastností těchto prvků je šest valenčních elektronů
PRVKY ŠESTÉ SKUPINY - CHALKOGENY Mezi chalkogeny (nepřechodné prvky 6.skupiny) zařazujeme kyslík, síru, selen, tellur a radioaktivní polonium. Společnou vlastností těchto prvků je šest valenčních elektronů
Modul 02 - Přírodovědné předměty
 Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 - Přírodovědné předměty Hana Gajdušková Výskyt
Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 - Přírodovědné předměty Hana Gajdušková Výskyt
ACH 02 VZÁCNÉPLYNY. Katedra chemie FP TUL www.kch.tul.cz VZÁCNÉ PLYNY
 VZÁCNÉPLYNY ACH 02 Katedra chemie FP TUL www.kch.tul.cz VZÁCNÉ PLYNY 1 VZÁCNÉ PLYNY 2 Vzácné plyny 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 I II III IV V VI VII VIII I II III IV V VI VII VIII s 2 p
VZÁCNÉPLYNY ACH 02 Katedra chemie FP TUL www.kch.tul.cz VZÁCNÉ PLYNY 1 VZÁCNÉ PLYNY 2 Vzácné plyny 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 I II III IV V VI VII VIII I II III IV V VI VII VIII s 2 p
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Periodická soustava prvků Chemické prvky V současné době známe 104 chemických prvků. Většina z nich se vyskytuje v přírodě. Jen malá část byla
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Periodická soustava prvků Chemické prvky V současné době známe 104 chemických prvků. Většina z nich se vyskytuje v přírodě. Jen malá část byla
DUM č. 14 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 14 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 14 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
Chalkogeny. Obecné informace o skupině. tellur a polonium Chalkogeny = rudotvorné prvky. Elektronová konfigurace ns 2 np 4.
 Chalkogeny Martin Dojiva becné informace o skupině Do této t to skupiny patří kyslík, k, síra, s selen, tellur a polonium Chalkogeny = rudotvorné prvky Ve valenční vrstvě obsahují 6 elektronů Elektronová
Chalkogeny Martin Dojiva becné informace o skupině Do této t to skupiny patří kyslík, k, síra, s selen, tellur a polonium Chalkogeny = rudotvorné prvky Ve valenční vrstvě obsahují 6 elektronů Elektronová
VZÁCNÉ PLYNY ACH 02. Katedra chemie FP TUL
 VZÁCNÉ PLYNY ACH 02 Katedra chemie FP TUL www.kch.tul.cz VZÁCNÉ PLYNY VZÁCNÉ PLYNY Xenon Radon Vzácné plyny 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 I II III IV V VI VII VIII I II III IV V VI VII
VZÁCNÉ PLYNY ACH 02 Katedra chemie FP TUL www.kch.tul.cz VZÁCNÉ PLYNY VZÁCNÉ PLYNY Xenon Radon Vzácné plyny 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 I II III IV V VI VII VIII I II III IV V VI VII
Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354
 Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Předmět: LRR/CHPB1/Chemie pro biology 1 Kyslík, Chalkogeny Mgr. Karel Doležal Dr. Cíl přednášky: seznámit posluchače s chemií
Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Předmět: LRR/CHPB1/Chemie pro biology 1 Kyslík, Chalkogeny Mgr. Karel Doležal Dr. Cíl přednášky: seznámit posluchače s chemií
Kovy II. hlavní skupiny (alkalických zemin + Be,, Mg)
 Kovy II. hlavní skupiny (alkalických zemin + Be,, Mg) I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N O F Ne 3 Na Mg (n-1) d Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co
Kovy II. hlavní skupiny (alkalických zemin + Be,, Mg) I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N O F Ne 3 Na Mg (n-1) d Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 09.04.2013 Číslo DUMu: VY_32_INOVACE_02_Ch_ACH
 Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 09.04.2013 Číslo DUMu: VY_32_INOVACE_02_Ch_ACH Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Anorganická
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 09.04.2013 Číslo DUMu: VY_32_INOVACE_02_Ch_ACH Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Anorganická
Základy analýzy potravin Přednáška 1
 ANALÝZA POTRAVIN Význam a využití kontrola jakosti surovin, výrobků jakost výživová jakost technologická jakost hygienická autenticita, identita potravinářských materiálů hodnocení stravy (diety) Analytické
ANALÝZA POTRAVIN Význam a využití kontrola jakosti surovin, výrobků jakost výživová jakost technologická jakost hygienická autenticita, identita potravinářských materiálů hodnocení stravy (diety) Analytické
1234,93 K, 961,78 C teplota varu 2435 K, 2162 C Skupina
 Stříbro Stříbro Stříbro latinsky Argentum Značka Ag protonové číslo 47 relativní atomová hmotnost 107,8682 Paulingova elektronegativita 1,93 elektronová konfigurace [Kr]] 4d 5s 1 teplota tánít 1234,93
Stříbro Stříbro Stříbro latinsky Argentum Značka Ag protonové číslo 47 relativní atomová hmotnost 107,8682 Paulingova elektronegativita 1,93 elektronová konfigurace [Kr]] 4d 5s 1 teplota tánít 1234,93
5. Nekovy sı ra. 1) Obecná charakteristika nekovů. 2) Síra a její vlastnosti
 5. Nekovy sı ra 1) Obecná charakteristika nekovů 2) Síra a její vlastnosti 1) Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu. Jsou to prvky uspořádané
5. Nekovy sı ra 1) Obecná charakteristika nekovů 2) Síra a její vlastnosti 1) Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu. Jsou to prvky uspořádané
VY_32_INOVACE_30_HBEN11
 Sloučeniny síry Temacká oblast : Chemie anorganická chemie Datum vytvoření: 15. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Sloučeniny síry sulfan, oxidy a
Sloučeniny síry Temacká oblast : Chemie anorganická chemie Datum vytvoření: 15. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Sloučeniny síry sulfan, oxidy a
1H 1s. 8O 1s 2s 2p - - - - - - H O H
 OXIDAČNÍ ČÍSLO 1H 1s 8O 1s 2s 2p 1H 1s - - - - + - - + - - + - - H O H +I -II +I H O H - - - - Elektronegativita: Oxidační číslo vodíku: H +I Oxidační číslo kyslíku: O -II Platí téměř ve všech sloučeninách.
OXIDAČNÍ ČÍSLO 1H 1s 8O 1s 2s 2p 1H 1s - - - - + - - + - - + - - H O H +I -II +I H O H - - - - Elektronegativita: Oxidační číslo vodíku: H +I Oxidační číslo kyslíku: O -II Platí téměř ve všech sloučeninách.
ACH 03 ALKALICKÉ KOVY. Katedra chemie FP TUL
 ACH 03 ALKALICKÉ KOVY Katedra chemie FP TUL www.kch.tul.cz ALKALICKÉ KOVY s 1 Li I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N O F Ne 3 Na Mg (n-1) d Al Si P S Cl Ar
ACH 03 ALKALICKÉ KOVY Katedra chemie FP TUL www.kch.tul.cz ALKALICKÉ KOVY s 1 Li I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N O F Ne 3 Na Mg (n-1) d Al Si P S Cl Ar
III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Chalkogeny. Prvky 16.skupiny: Kyslík:
 Chalkogeny Prvky 16.skupiny: Do skupiny chalkogenů patří kyslík, síra, selen, tellur a polonium, které se nacházejí v 16.skupině. Mají 6 valenčních elektronů (ns 2 np 4 ). Kyslík a síra jsou nekovy, selen
Chalkogeny Prvky 16.skupiny: Do skupiny chalkogenů patří kyslík, síra, selen, tellur a polonium, které se nacházejí v 16.skupině. Mají 6 valenčních elektronů (ns 2 np 4 ). Kyslík a síra jsou nekovy, selen
Síra a její sloučeniny
 Síra a její sloučeniny Mgr. Jana Pertlová Copyright istudium, 2008, http://www.istudium.cz Žádná část této publikace nesmí být publikována a šířena žádným způsobem a v žádné podobě bez výslovného svolení
Síra a její sloučeniny Mgr. Jana Pertlová Copyright istudium, 2008, http://www.istudium.cz Žádná část této publikace nesmí být publikována a šířena žádným způsobem a v žádné podobě bez výslovného svolení
Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np:
 PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
Prvky V.A a VI.A skupiny
 Prvky V.A a VI.A skupiny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Duben 2010 Mgr. Alena Jirčáková Prvky V.A skupiny - vlastnosti - Prvky s pěti
Prvky V.A a VI.A skupiny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Duben 2010 Mgr. Alena Jirčáková Prvky V.A skupiny - vlastnosti - Prvky s pěti
Kovy a metody jejich výroby
 Kovy a metody jejich výroby Kovy v periodické tabulce Základní vlastnosti kovů 80 % prvků v přírodě jsou kovy, v PSP stoupá kovový charakter směrem DOLEVA Vlastnosti: Fyzikální kovový lesk kujnost a tažnost
Kovy a metody jejich výroby Kovy v periodické tabulce Základní vlastnosti kovů 80 % prvků v přírodě jsou kovy, v PSP stoupá kovový charakter směrem DOLEVA Vlastnosti: Fyzikální kovový lesk kujnost a tažnost
Otázky a jejich autorské řešení
 Otázky a jejich autorské řešení Otázky: 1a Co jsou to amfoterní látky? a. látky krystalizující v krychlové soustavě b. látky beztvaré c. látky, které se chovají jako kyselina nebo jako zásada podle podmínek
Otázky a jejich autorské řešení Otázky: 1a Co jsou to amfoterní látky? a. látky krystalizující v krychlové soustavě b. látky beztvaré c. látky, které se chovají jako kyselina nebo jako zásada podle podmínek
Selen, tellur, polonium
 Selen, tellur, polonium Se příprava Se - obvykle se nepřipravuje, neboť je k dispozici. H 2 SeO 3 + 4 HI = Se + I 2 + 3 H 2 O Te a Po se v laboratoři nepřipravují H 2 SeO 3 + 2 SO 2 = Se + 2 H 2 SO 4 Se,
Selen, tellur, polonium Se příprava Se - obvykle se nepřipravuje, neboť je k dispozici. H 2 SeO 3 + 4 HI = Se + I 2 + 3 H 2 O Te a Po se v laboratoři nepřipravují H 2 SeO 3 + 2 SO 2 = Se + 2 H 2 SO 4 Se,
DUM č. 15 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 15 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 15 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
tvorbou anionu tato schopnost je menší než u kyslíku
 Chalkogeny Elektronová konfigurace:. => valenčních elektronů => maximální oxidační číslo je Odlišnost vlastností O 2 a ostatních prvků způsobeny: vysokou elektronegativitou O neschopností O tvořit excitované
Chalkogeny Elektronová konfigurace:. => valenčních elektronů => maximální oxidační číslo je Odlišnost vlastností O 2 a ostatních prvků způsobeny: vysokou elektronegativitou O neschopností O tvořit excitované
P PRVKY L A TEX. 2 Halogeny. 3. až 8. hlavní skupina. posledním zaplňovaným orbitalem je orbital typu P. 7. hlavní skupina.
 L A TEX PPRVKY 3. až 8. hlavní skupina posledním zaplňovaným orbitalem je orbital typu P 8. hlavní skupina He, Ne, Ar, Kr, Xe, Rn málo reaktivní = velmi stabilní mají oktet 1 Vzácné plyny valenční vrstva:
L A TEX PPRVKY 3. až 8. hlavní skupina posledním zaplňovaným orbitalem je orbital typu P 8. hlavní skupina He, Ne, Ar, Kr, Xe, Rn málo reaktivní = velmi stabilní mají oktet 1 Vzácné plyny valenční vrstva:
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 08.04.2013 Číslo DUMu: VY_32_INOVACE_01_Ch_ACH
 Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 08.04.2013 Číslo DUMu: VY_32_INOVACE_01_Ch_ACH Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Anorganická
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 08.04.2013 Číslo DUMu: VY_32_INOVACE_01_Ch_ACH Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Anorganická
VI.A SKUPINA PS VY_32_INOVACE.MERKOVA.ANCHEM.03
 VI.A SKUPINA PS VY_3_INOVACE.MERKOVA.ANCHEM.03 Obecná charakteristika VI.A skupina PS zahrnuje prvky O,S,Se,Te,Po (ó slečno, sejměte též podkolenky) Mají 6 valenčních elektronů, z nichž 4 se nacházejí
VI.A SKUPINA PS VY_3_INOVACE.MERKOVA.ANCHEM.03 Obecná charakteristika VI.A skupina PS zahrnuje prvky O,S,Se,Te,Po (ó slečno, sejměte též podkolenky) Mají 6 valenčních elektronů, z nichž 4 se nacházejí
Škola: Gymnázium, Brno, Slovanské náměstí 7 III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0
 Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
Seminář z anorganické chemie
 Univerzita Jana Evangelisty Purkyně v Ústí nad Labem Přírodovědecká fakulta Studijní opora pro dvouoborové kombinované bakalářské studium Seminář z anorganické chemie Ing.Fišerová Cílem kurzu je seznámit
Univerzita Jana Evangelisty Purkyně v Ústí nad Labem Přírodovědecká fakulta Studijní opora pro dvouoborové kombinované bakalářské studium Seminář z anorganické chemie Ing.Fišerová Cílem kurzu je seznámit
Chemie = přírodní věda zkoumající složení a strukturu látek a jejich přeměny v látky jiné
 Otázka: Obecná chemie Předmět: Chemie Přidal(a): ZuzilQa Základní pojmy v chemii, periodická soustava prvků Chemie = přírodní věda zkoumající složení a strukturu látek a jejich přeměny v látky jiné -setkáváme
Otázka: Obecná chemie Předmět: Chemie Přidal(a): ZuzilQa Základní pojmy v chemii, periodická soustava prvků Chemie = přírodní věda zkoumající složení a strukturu látek a jejich přeměny v látky jiné -setkáváme
Složení látek a chemická vazba Číslo variace: 1
 Složení látek a chemická vazba Číslo variace: 1 Zkoušecí kartičku si PODEPIŠ a zapiš na ni ČÍSLO VARIACE TESTU (číslo v pravém horním rohu). Odpovědi zapiš na zkoušecí kartičku, do testu prosím nepiš.
Složení látek a chemická vazba Číslo variace: 1 Zkoušecí kartičku si PODEPIŠ a zapiš na ni ČÍSLO VARIACE TESTU (číslo v pravém horním rohu). Odpovědi zapiš na zkoušecí kartičku, do testu prosím nepiš.
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 20.04.2013 Číslo DUMu: VY_32_INOVACE_15_Ch_ACH
 Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 20.04.2013 Číslo DUMu: VY_32_INOVACE_15_Ch_ACH Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Anorganická
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 20.04.2013 Číslo DUMu: VY_32_INOVACE_15_Ch_ACH Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Anorganická
Gymnázium Chomutov, Mostecká 3000, příspěvková organizace Mgr. Monika ŠLÉGLOVÁ VY_32_INOVACE_06B_05_Vlastnosti kovů, hliník_test ANOTACE
 ŠKOLA: Gymnázium Chomutov, Mostecká 3000, příspěvková organizace AUTOR: Mgr. Monika ŠLÉGLOVÁ NÁZEV: VY_32_INOVACE_06B_05_Vlastnosti kovů, hliník_test TEMA: KOVY ČÍSLO PROJEKTU: CZ.1.07/1.5.00/34.0816 DATUM
ŠKOLA: Gymnázium Chomutov, Mostecká 3000, příspěvková organizace AUTOR: Mgr. Monika ŠLÉGLOVÁ NÁZEV: VY_32_INOVACE_06B_05_Vlastnosti kovů, hliník_test TEMA: KOVY ČÍSLO PROJEKTU: CZ.1.07/1.5.00/34.0816 DATUM
Inovace profesní přípravy budoucích učitelů chemie
 Inovace profesní přípravy budoucích učitelů chemie I n v e s t i c e d o r o z v o j e v z d ě l á v á n í CZ.1.07/2.2.00/15.0324 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem
Inovace profesní přípravy budoucích učitelů chemie I n v e s t i c e d o r o z v o j e v z d ě l á v á n í CZ.1.07/2.2.00/15.0324 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem
12.CHALKOGENY A HALOGENY
 12.CHALKOGENY A HALOGENY Chalkogeny ( česky se jedná o prvky ) 1) Popiš obecnou charakteristiku dané skupiny (počet valenčních elektronů, obecná elektronová konfigurace valenční vrstvy, způsoby dosažení
12.CHALKOGENY A HALOGENY Chalkogeny ( česky se jedná o prvky ) 1) Popiš obecnou charakteristiku dané skupiny (počet valenčních elektronů, obecná elektronová konfigurace valenční vrstvy, způsoby dosažení
Příklad Sestavte rovnice následujících dějů: reakce hydroxidu sodného s kyselinou tetrahydrogendifosforečnou 4NaOH + H 4 P 2 O 7 Na 4 P 2 O 7
 Příklad 2.2.9. Sestavte rovnice následujících dějů: reakce hydroxidu sodného s kyselinou tetrahydrogendifosforečnou 4NaOH + H 4 P 2 O 7 Na 4 P 2 O 7 + 4H 2 O reakce dimerního oxidu antimonitého s kyselinou
Příklad 2.2.9. Sestavte rovnice následujících dějů: reakce hydroxidu sodného s kyselinou tetrahydrogendifosforečnou 4NaOH + H 4 P 2 O 7 Na 4 P 2 O 7 + 4H 2 O reakce dimerního oxidu antimonitého s kyselinou
Vyšší odborná škola, Obchodní akademie a Střední odborná škola EKONOM, o. p. s. Litoměřice, Palackého 730/1
 DUM Základy přírodních věd DUM III/2-T3-11 Téma: Soli Střední škola ok: 2012 2013 Varianta: A Soli Zpracoval: Mgr. Pavel Hrubý Mgr. Josef Kormaník SOLI sůl je sloučenina, která se skládá z iontu kovu a
DUM Základy přírodních věd DUM III/2-T3-11 Téma: Soli Střední škola ok: 2012 2013 Varianta: A Soli Zpracoval: Mgr. Pavel Hrubý Mgr. Josef Kormaník SOLI sůl je sloučenina, která se skládá z iontu kovu a
Astat - radioaktivní pevná látka - krátký poločas rozpadu (8,3 hod) - nejstabilnější je izotop At 210. Sloučeniny
 Halogeny - název od řeckého hals = sůl (pro jejich schopnost tvořit velkou řadu solí) - prvky 17. skupiny - mají sedm valenčních elektronů - tvoří dvouatomové molekuly - jsou jedovaté s dráždivými účinky
Halogeny - název od řeckého hals = sůl (pro jejich schopnost tvořit velkou řadu solí) - prvky 17. skupiny - mají sedm valenčních elektronů - tvoří dvouatomové molekuly - jsou jedovaté s dráždivými účinky
III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Přechodné prvky, jejich vlastnosti a sloučeniny
 Přechodné prvky, jejich vlastnosti a sloučeniny - jsou to d-prvky, nazývají se také přechodné prvky - v PSP jsou umístěny mezi s a p prvky - nacházejí se ve 4. 7. periodě - atomy přechodných prvků mají
Přechodné prvky, jejich vlastnosti a sloučeniny - jsou to d-prvky, nazývají se také přechodné prvky - v PSP jsou umístěny mezi s a p prvky - nacházejí se ve 4. 7. periodě - atomy přechodných prvků mají
Registrační číslo projektu: CZ.1.07/1.4.00/21.2939. Název projektu: Investice do vzdělání - příslib do budoucnosti
 Registrační číslo projektu: CZ.1.07/1.4.00/21.2939 Název projektu: Investice do vzdělání - příslib do budoucnosti Číslo přílohy: VY_číslo šablony_inovace_číslo přílohy Autor Datum vytvoření vzdělávacího
Registrační číslo projektu: CZ.1.07/1.4.00/21.2939 Název projektu: Investice do vzdělání - příslib do budoucnosti Číslo přílohy: VY_číslo šablony_inovace_číslo přílohy Autor Datum vytvoření vzdělávacího
Ukázky z pracovních listů 1) Vyber, který ion je: a) ve vodném roztoku barevný b) nejstabilnější c) nejlépe oxidovatelný
 Ukázky z pracovních listů 1) Vyber, který ion je: a) ve vodném roztoku barevný b) nejstabilnější c) nejlépe oxidovatelný Fe 3+ Fe 3+ Fe 3+ Fe 2+ Fe 6+ Fe 2+ Fe 6+ Fe 2+ Fe 6+ 2) Vyber správné o rtuti:
Ukázky z pracovních listů 1) Vyber, který ion je: a) ve vodném roztoku barevný b) nejstabilnější c) nejlépe oxidovatelný Fe 3+ Fe 3+ Fe 3+ Fe 2+ Fe 6+ Fe 2+ Fe 6+ Fe 2+ Fe 6+ 2) Vyber správné o rtuti:
DUM č. 2 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 2 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 2 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
1) BEZKYSLÍKATÉ KYSELINY:
 KYSELINY Jsou to látky, které se ve vodě štěpí na kationty H + a anionty (radikály) kyseliny (např. Cl -, NO 3-, SO 4 2- ). 1) BEZKYSLÍKATÉ KYSELINY: (koncovka -vodíková) Kyselina fluorovod vodíková chlorovod
KYSELINY Jsou to látky, které se ve vodě štěpí na kationty H + a anionty (radikály) kyseliny (např. Cl -, NO 3-, SO 4 2- ). 1) BEZKYSLÍKATÉ KYSELINY: (koncovka -vodíková) Kyselina fluorovod vodíková chlorovod
16.5.2010 Halogeny 1
 16.5.010 Halogeny 1 16.5.010 Halogeny Prvky VII.A skupiny: F, Cl, Br, I,(At) Obecnávalenčníkonfigurace:ns np 5 Pro plné zaplnění valenční vrstvy potřebují 1 e - - nejčastější sloučeniny s oxidačním číslem
16.5.010 Halogeny 1 16.5.010 Halogeny Prvky VII.A skupiny: F, Cl, Br, I,(At) Obecnávalenčníkonfigurace:ns np 5 Pro plné zaplnění valenční vrstvy potřebují 1 e - - nejčastější sloučeniny s oxidačním číslem
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Oxidace a redukce jsou chemické reakce spojené s výměnou elektronů. Při oxidaci látka elektrony uvolňuje a její oxidační číslo se zvyšuje.
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Oxidace a redukce jsou chemické reakce spojené s výměnou elektronů. Při oxidaci látka elektrony uvolňuje a její oxidační číslo se zvyšuje.
Název školy: Číslo a název sady: klíčové aktivity: Jméno a příjmení autora: Mgr. Alexandra Šlegrová
 Název školy: Číslo a název projektu: Číslo a název šablony klíčové aktivity: Označení materiálu: Typ materiálu: Předmět, ročník, obor: Číslo a název sady: Téma: Jméno a příjmení autora: STŘEDNÍ ODBORNÁ
Název školy: Číslo a název projektu: Číslo a název šablony klíčové aktivity: Označení materiálu: Typ materiálu: Předmět, ročník, obor: Číslo a název sady: Téma: Jméno a příjmení autora: STŘEDNÍ ODBORNÁ
1 mol (ideálního) plynu, zaujímá za normálních podmínek objem 22,4 litru. , Cl 2 , O 2
 10.výpočty z rovnic praktické provádění výpočtů z rovnic K výpočtu chemických rovnic je důležité si shrnout tyto poznatky: Potřebujem znát vyjadřování koncentrací, objemový zlomek, molární zlomek, molární
10.výpočty z rovnic praktické provádění výpočtů z rovnic K výpočtu chemických rovnic je důležité si shrnout tyto poznatky: Potřebujem znát vyjadřování koncentrací, objemový zlomek, molární zlomek, molární
II. Chemické názvosloví
 II. Chemické názvosloví 1. Oxidy jsou dvouprvkové sloučeniny kyslíku a jiného prvku. Názvy oxidů jsou dvouslovné. Tvoří je podstatné jméno oxid (postaru kysličník) a přídavné jméno utvořené od názvu prvku
II. Chemické názvosloví 1. Oxidy jsou dvouprvkové sloučeniny kyslíku a jiného prvku. Názvy oxidů jsou dvouslovné. Tvoří je podstatné jméno oxid (postaru kysličník) a přídavné jméno utvořené od názvu prvku
Chemické názvosloví anorganických sloučenin 1
 Chemické názvosloví anorganických sloučenin 1 Dvouprvkové sloučeniny Dostupné z Metodického portálu www.rvp.cz, ISSN: 1802-4785, financovaného z ESF a státního rozpočtu ČR. Provozováno Výzkumným ústavem
Chemické názvosloví anorganických sloučenin 1 Dvouprvkové sloučeniny Dostupné z Metodického portálu www.rvp.cz, ISSN: 1802-4785, financovaného z ESF a státního rozpočtu ČR. Provozováno Výzkumným ústavem
DUM č. 19 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 19 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 19 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
Geochemie endogenních procesů 1. část
 Geochemie endogenních procesů 1. část geochemie = použití chemických nástrojů na studium Země a dalších planet Sluneční soustavy počátky v 15. století spjaté zejména s kvalitou vody a půdy rozmach a první
Geochemie endogenních procesů 1. část geochemie = použití chemických nástrojů na studium Země a dalších planet Sluneční soustavy počátky v 15. století spjaté zejména s kvalitou vody a půdy rozmach a první
Chalkogeny. Gymnázium a Jazyková škola s právem státní jazykové zkoušky Zlín
 Chalkogeny Temacká oblast : Chemie anorganická chemie Datum vytvoření: 11. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Chalkogeny charakteriska prvků, výskyt,
Chalkogeny Temacká oblast : Chemie anorganická chemie Datum vytvoření: 11. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Chalkogeny charakteriska prvků, výskyt,
Číslo projektu: CZ.1.07/1.5.00/34.0290. Ročník: 1. pro obory zakončené maturitní zkouškou
 Zlepšení podmínek pro vzdělávání na středních školách Operačního programu Vzdělávání pro konkurenceschopnost Název a adresa školy: Integrovaná střední škola Cheb, Obrněné brigády 6, 350 11 Cheb Číslo projektu:
Zlepšení podmínek pro vzdělávání na středních školách Operačního programu Vzdělávání pro konkurenceschopnost Název a adresa školy: Integrovaná střední škola Cheb, Obrněné brigády 6, 350 11 Cheb Číslo projektu:
Název školy: Číslo a název sady: klíčové aktivity: VY_32_INOVACE_131_Elektrochemická řada napětí kovů_pwp
 Název školy: Číslo a název projektu: Číslo a název šablony klíčové aktivity: Označení materiálu: Typ materiálu: Předmět, ročník, obor: Číslo a název sady: Téma: Jméno a příjmení autora: STŘEDNÍ ODBORNÁ
Název školy: Číslo a název projektu: Číslo a název šablony klíčové aktivity: Označení materiálu: Typ materiálu: Předmět, ročník, obor: Číslo a název sady: Téma: Jméno a příjmení autora: STŘEDNÍ ODBORNÁ
Redoxní reakce - rozdělení
 zdroj: http://xantina.hyperlink.cz/ Redoxní reakce - rozdělení Redoxní reakce můžeme rozdělit podle počtu atomů, které během reakce mění svá oxidační čísla. 1. Atomy dvou prvků mění svá oxidační čísla
zdroj: http://xantina.hyperlink.cz/ Redoxní reakce - rozdělení Redoxní reakce můžeme rozdělit podle počtu atomů, které během reakce mění svá oxidační čísla. 1. Atomy dvou prvků mění svá oxidační čísla
Vyšší odborná škola, Obchodní akademie a Střední odborná škola EKONOM, o. p. s. Litoměřice, Palackého 730/1
 DUM Základy přírodních věd DUM III/2-T30 Téma: Kyseliny Střední škola Rok: 2012 2013 Varianta: A Kyseliny Zpracoval: Mgr. Pavel Hrubý Mgr. Josef Kormaník VÝKLAD jsou to sloučeniny KYSELINY ve vodných roztocích
DUM Základy přírodních věd DUM III/2-T30 Téma: Kyseliny Střední škola Rok: 2012 2013 Varianta: A Kyseliny Zpracoval: Mgr. Pavel Hrubý Mgr. Josef Kormaník VÝKLAD jsou to sloučeniny KYSELINY ve vodných roztocích
Autorem materiálu je Ing. Dagmar Berková, Waldorfská škola Příbram, Hornická 327, Příbram, okres Příbram Inovace školy Příbram, EUpenizeskolam.
 Šablona č. I, sada č. 2 Vzdělávací oblast Vzdělávací obor Tematický okruh Téma Člověk a příroda Chemie Obecná a anorganická chemie Oxidy, sulfidy, halogenovodíky a halogenovodíkové kyseliny, redoxní reakce
Šablona č. I, sada č. 2 Vzdělávací oblast Vzdělávací obor Tematický okruh Téma Člověk a příroda Chemie Obecná a anorganická chemie Oxidy, sulfidy, halogenovodíky a halogenovodíkové kyseliny, redoxní reakce
Kuchyňská sůl = chlorid sodný. Modrá skalice = síran měďnatý SO 4. Potaš = uhličitan draselný K 2 CO 3
 SOLI Kuchyňská sůl Modrá skalice Potaš Kuchyňská sůl = chlorid sodný Na Cl Modrá skalice = síran měďnatý Cu SO 4 Potaš = uhličitan draselný K 2 CO 3 Chemické názvosloví solí Soli = sloučeniny odvozené
SOLI Kuchyňská sůl Modrá skalice Potaš Kuchyňská sůl = chlorid sodný Na Cl Modrá skalice = síran měďnatý Cu SO 4 Potaš = uhličitan draselný K 2 CO 3 Chemické názvosloví solí Soli = sloučeniny odvozené
Prvky VII. hlavní skupiny (F, Cl, Br,, I, At)
 Prvky VII. hlavní skupiny (F, Cl, Br,, I, At) I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N O F Ne 3 Na Mg (n-1) d Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn
Prvky VII. hlavní skupiny (F, Cl, Br,, I, At) I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N O F Ne 3 Na Mg (n-1) d Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn
VI. skupina PS, ns 2 np4 Kyslík, síra, selen, tellur, polonium
 VI. skupina PS, ns 2 np4 Kyslík, síra, selen, tellur, polonium O a S jsou nekovy (tvoří kovalentní vazby), Se, Te jsou polokovy, Po je typický kov O je druhý nejvíce elektronegativní prvek vytváření oktetové
VI. skupina PS, ns 2 np4 Kyslík, síra, selen, tellur, polonium O a S jsou nekovy (tvoří kovalentní vazby), Se, Te jsou polokovy, Po je typický kov O je druhý nejvíce elektronegativní prvek vytváření oktetové
Přílohy. Příloha 1. Mapa s výskytem dolů a pramenů s hladinami vod po r (Čadek et al. 1968) [Zadejte text.]
![Přílohy. Příloha 1. Mapa s výskytem dolů a pramenů s hladinami vod po r (Čadek et al. 1968) [Zadejte text.] Přílohy. Příloha 1. Mapa s výskytem dolů a pramenů s hladinami vod po r (Čadek et al. 1968) [Zadejte text.]](/thumbs/81/83251433.jpg) Přílohy Příloha 1 Mapa s výskytem dolů a pramenů s hladinami vod po r. 1895 (Čadek et al. 1968) Příloha 2 Komplexní rozbor vody z pramene Pravřídlo 2002 (Lázně Teplice) Chemické složení Kationty mg/l mmol/l
Přílohy Příloha 1 Mapa s výskytem dolů a pramenů s hladinami vod po r. 1895 (Čadek et al. 1968) Příloha 2 Komplexní rozbor vody z pramene Pravřídlo 2002 (Lázně Teplice) Chemické složení Kationty mg/l mmol/l
DUM č. 18 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 18 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 18 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
Síra. Výskyt. v přírodě se síra nachází v podobě elementární S 8. sírany (sádrovec CaSO 4 2H 2 O, baryt BaSO 4 aj.)
 Síra Výskyt v přírodě se síra nachází v podobě elementární S 8 vázaná: sírany (sádrovec CaSO 4 2H 2 O, baryt BaSO 4 aj.) sulfidy (sfalerit ZnS, galenit PbS, pyrit FeS 2 aj.) v atmosféře H 2 S, SO 2 součást
Síra Výskyt v přírodě se síra nachází v podobě elementární S 8 vázaná: sírany (sádrovec CaSO 4 2H 2 O, baryt BaSO 4 aj.) sulfidy (sfalerit ZnS, galenit PbS, pyrit FeS 2 aj.) v atmosféře H 2 S, SO 2 součást
Základní stavební částice
 Základní stavební částice ATOMY Au O H Elektroneutrální 2 H 2 atomy vodíku 8 Fe Ř atom železa IONTY Na + Cl - H 3 O + P idávat nebo odebírat se mohou jenom elektrony Kationty Kladn nabité Odevzdání elektron
Základní stavební částice ATOMY Au O H Elektroneutrální 2 H 2 atomy vodíku 8 Fe Ř atom železa IONTY Na + Cl - H 3 O + P idávat nebo odebírat se mohou jenom elektrony Kationty Kladn nabité Odevzdání elektron
Průvodka. CZ.1.07/1.5.00/34.0802 Zkvalitnění výuky prostřednictvím ICT. III/2 Inovace a zkvalitnění výuky prostřednictvím ICT. Pořadí DUMu v sadě 07
 Průvodka Číslo projektu Název projektu Číslo a název šablony klíčové aktivity CZ.1.07/1.5.00/34.0802 Zkvalitnění výuky prostřednictvím ICT III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Příjemce
Průvodka Číslo projektu Název projektu Číslo a název šablony klíčové aktivity CZ.1.07/1.5.00/34.0802 Zkvalitnění výuky prostřednictvím ICT III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Příjemce
Názvosloví anorganických sloučenin
 Názvosloví anorganických sloučenin Oxidační číslo udává náboj, kterým by byl atom prvku nabit, kdyby všechny elektrony vazeb v molekule patřily elektronegativnějším vazebným partnerům (atomům) udává náboj,
Názvosloví anorganických sloučenin Oxidační číslo udává náboj, kterým by byl atom prvku nabit, kdyby všechny elektrony vazeb v molekule patřily elektronegativnějším vazebným partnerům (atomům) udává náboj,
4. CHEMICKÉ ROVNICE. A. Vyčíslování chemických rovnic
 4. CHEMICKÉ ROVNICE A. Vyčíslování chemických rovnic Klíčová slova kapitoly B: Zachování druhu atomu, zachování náboje, stechiometrický koeficient, rdoxní děj Čas potřebný k prostudování učiva kapitoly
4. CHEMICKÉ ROVNICE A. Vyčíslování chemických rovnic Klíčová slova kapitoly B: Zachování druhu atomu, zachování náboje, stechiometrický koeficient, rdoxní děj Čas potřebný k prostudování učiva kapitoly
DUM č. 6 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 6 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 6 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
ANODA KATODA elektrolyt:
 Ukázky z pracovnívh listů 1) Naznač pomocí šipek, které částice putují k anodě a které ke katodě. Co je elektrolytem? ANODA KATODA elektrolyt: Zn 2+ Cl - Zn 2+ Zn 2+ Cl - Cl - Cl - Cl - Cl - Zn 2+ Cl -
Ukázky z pracovnívh listů 1) Naznač pomocí šipek, které částice putují k anodě a které ke katodě. Co je elektrolytem? ANODA KATODA elektrolyt: Zn 2+ Cl - Zn 2+ Zn 2+ Cl - Cl - Cl - Cl - Cl - Zn 2+ Cl -
Střední škola obchodu, řemesel a služeb Žamberk
 Střední škola obchodu, řemesel a služeb Žamberk Výukový materiál zpracovaný v rámci projektu EU Peníze SŠ Registrační číslo projektu: CZ.1.07/1.5.00/34.0130 Šablona: III/2 Ověřeno ve výuce dne: 12.3.2013
Střední škola obchodu, řemesel a služeb Žamberk Výukový materiál zpracovaný v rámci projektu EU Peníze SŠ Registrační číslo projektu: CZ.1.07/1.5.00/34.0130 Šablona: III/2 Ověřeno ve výuce dne: 12.3.2013
Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH. atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na +
 OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
DUM VY_52_INOVACE_12CH01
 Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH01 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH01 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
Alkalické kovy. Gymnázium a Jazyková škola s právem státní jazykové zkoušky Zlín
 Alkalické kovy Temacká oblast : Chemie anorganická chemie Datum vytvoření: 23. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Alkalické kovy vlastnos a výroba
Alkalické kovy Temacká oblast : Chemie anorganická chemie Datum vytvoření: 23. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Alkalické kovy vlastnos a výroba
Dusík a fosfor. Dusík
 5.9.010 Dusík a fosfor Dusík lyn Bezbarvý, bez chuti a zápachu Vyskytuje se v dvouatomových molekulách N Molekuly dusíku extremně stabilní říprava: reakce dusitanů s amonnými ionty NH N N ( ( ( ( Výroba:
5.9.010 Dusík a fosfor Dusík lyn Bezbarvý, bez chuti a zápachu Vyskytuje se v dvouatomových molekulách N Molekuly dusíku extremně stabilní říprava: reakce dusitanů s amonnými ionty NH N N ( ( ( ( Výroba:
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ
 SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
b) disulfid uhelnatý reaguje s kyslíkem za vzniku oxidu uhličitého o oxidu siřičitého
 1. Jaký chemický vzorec má voda? 2. Jaký je rozdíl mezi měkkou a tvrdou vodou? 3. Jaký je rozdíl mezi lehkou a těžkou vodou? 4. Který prvek je ve vzduchu zastoupen nejvíce? 5. Co mají společného pyrit,
1. Jaký chemický vzorec má voda? 2. Jaký je rozdíl mezi měkkou a tvrdou vodou? 3. Jaký je rozdíl mezi lehkou a těžkou vodou? 4. Který prvek je ve vzduchu zastoupen nejvíce? 5. Co mají společného pyrit,
Přehled zakončení názvů anorganických sloučenin a iontů
 Hodnota kladného oxidačního čísla Přehled zakončení názvů anorganických sloučenin a iontů Zakončení příd. jména binární sl. hydroxidu soli kationtu Zakončení přídavného jména kyseliny jejího aniontu Zakončení
Hodnota kladného oxidačního čísla Přehled zakončení názvů anorganických sloučenin a iontů Zakončení příd. jména binární sl. hydroxidu soli kationtu Zakončení přídavného jména kyseliny jejího aniontu Zakončení
Elektrochemický potenciál Standardní vodíková elektroda Oxidačně-redukční potenciály
 Elektrochemický potenciál Standardní vodíková elektroda Oxidačně-redukční potenciály Elektrochemie rovnováhy a děje v soustavách nesoucích elektrický náboj Krystal kovu ponořený do destilované vody + +
Elektrochemický potenciál Standardní vodíková elektroda Oxidačně-redukční potenciály Elektrochemie rovnováhy a děje v soustavách nesoucích elektrický náboj Krystal kovu ponořený do destilované vody + +
CZ.1.07/1.5.00/34.0880. pracovní list. Anorganická chemie. Síra. Mgr. Alexandra Šlegrová
 Název školy Číslo projektu STŘEDNÍ ODBORNÁ ŠKOLA a STŘEDNÍ ODBORNÉ UČILIŠTĚ, Česká Lípa, 28. října 2707, příspěvková organizace CZ.1.07/1.5.00/34.0880 Název projektu Klíčová aktivita Digitální učební materiály
Název školy Číslo projektu STŘEDNÍ ODBORNÁ ŠKOLA a STŘEDNÍ ODBORNÉ UČILIŠTĚ, Česká Lípa, 28. října 2707, příspěvková organizace CZ.1.07/1.5.00/34.0880 Název projektu Klíčová aktivita Digitální učební materiály
1932 H. C. 1934 M.L.E.
 Vodík Historie 1671 Robert Boyle uvolnění vodíku rozpouštěním Fe v HCl nebo H 2 SO 4 1766 Henry Cavendish podrobný popis vlastností 1932 H. C. Urey objev deuteria 1934 M.L.E. Oliphant, P. Harteck a E.
Vodík Historie 1671 Robert Boyle uvolnění vodíku rozpouštěním Fe v HCl nebo H 2 SO 4 1766 Henry Cavendish podrobný popis vlastností 1932 H. C. Urey objev deuteria 1934 M.L.E. Oliphant, P. Harteck a E.
Oxidační číslo je rovno náboji, který by atom získal po p idělení všech vazebných elektronových párů atomům s větší elektronegativitou.
 NÁZVOSLOVÍ Oxidační číslo je rovno náboji, který by atom získal po p idělení všech vazebných elektronových párů atomům s větší elektronegativitou. -II +III -II +I O N O H Oxidační čísla se značí ímskými
NÁZVOSLOVÍ Oxidační číslo je rovno náboji, který by atom získal po p idělení všech vazebných elektronových párů atomům s větší elektronegativitou. -II +III -II +I O N O H Oxidační čísla se značí ímskými
16. skupina chalkogeny prvky s 2 p 4
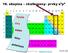 16. skupina chalkogeny prvky s 2 p 4 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 I II III IV V VI VII VIII I II III IV V VI VII VIII 1 1 H n s n p He 2 2 Li Be B C N O F Ne 3 3 Na Mg (n-1) d Al Si P S
16. skupina chalkogeny prvky s 2 p 4 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 I II III IV V VI VII VIII I II III IV V VI VII VIII 1 1 H n s n p He 2 2 Li Be B C N O F Ne 3 3 Na Mg (n-1) d Al Si P S
Modul 02 - Přírodovědné předměty
 Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 - Přírodovědné předměty Hana Gajdušková 12.skupina
Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 - Přírodovědné předměty Hana Gajdušková 12.skupina
DIGITÁLNÍ UČEBNÍ MATERIÁL. Ing. Alena Musilová ŠVP cukrář-cukrovinkář; ZPV chemie, 1. ročník ŠVP kuchař-číšník;zpv chemie, 1.
 DIGITÁLNÍ UČEBNÍ MATERIÁL Číslo projektu CZ.1.07/1.5.00/34.0763 Název školy SOUpotravinářské, Jílové u Prahy, Šenflukova 220 Název materiálu INOVACE_32_ZPV-CH 1/04/02/1 Autor Obor; předmět, ročník Tematická
DIGITÁLNÍ UČEBNÍ MATERIÁL Číslo projektu CZ.1.07/1.5.00/34.0763 Název školy SOUpotravinářské, Jílové u Prahy, Šenflukova 220 Název materiálu INOVACE_32_ZPV-CH 1/04/02/1 Autor Obor; předmět, ročník Tematická
Chemické názvosloví anorganických sloučenin 2
 Chemické názvosloví anorganických sloučenin 2 Tříprvkové sloučeniny Autorem materiálu a všech jeho částí, není-li uvedeno jinak, je. Mgr. Vlastimil Vaněk. Dostupné z Metodického portálu www.rvp.cz, ISSN:
Chemické názvosloví anorganických sloučenin 2 Tříprvkové sloučeniny Autorem materiálu a všech jeho částí, není-li uvedeno jinak, je. Mgr. Vlastimil Vaněk. Dostupné z Metodického portálu www.rvp.cz, ISSN:
ANODA KATODA elektrolyt:
 Ukázky z pracovních listů 1) Naznač pomocí šipek, které částice putují k anodě a které ke katodě. Co je elektrolytem? ANODA KATODA elektrolyt: Zn 2+ Cl - Zn 2+ Zn 2+ Cl - Cl - Cl - Cl - Cl - Zn 2+ Cl -
Ukázky z pracovních listů 1) Naznač pomocí šipek, které částice putují k anodě a které ke katodě. Co je elektrolytem? ANODA KATODA elektrolyt: Zn 2+ Cl - Zn 2+ Zn 2+ Cl - Cl - Cl - Cl - Cl - Zn 2+ Cl -
Triviální Voda (H 2 O) Amoniak Soda. Systematické. Většina názvů se skládá ze 2 slov Výjimka: např. chlorovodík např. jodid draselný (KI)
 Názvosloví anorganických sloučenin České názvosloví je jednoznačné Názvosloví anorganických sloučenin Triviální Voda (H 2 O) Amoniak Soda Systematické Většina názvů se skládá ze 2 slov Výjimka: např. chlorovodík
Názvosloví anorganických sloučenin České názvosloví je jednoznačné Názvosloví anorganických sloučenin Triviální Voda (H 2 O) Amoniak Soda Systematické Většina názvů se skládá ze 2 slov Výjimka: např. chlorovodík
Platinové kovy. Obecné vlastnosti. Ruthenium a osmium. Jméno: Jana Homolková UČO:
 Platinové kovy Obecné vlastnosti Patří zde prvky druhé a třetí triády 8. skupiny periodického systému. Prvky druhé triády (Ru, Rh, Pd) se nazývají lehké platinové kovy. Prvky třetí triády se nazývají (Os,
Platinové kovy Obecné vlastnosti Patří zde prvky druhé a třetí triády 8. skupiny periodického systému. Prvky druhé triády (Ru, Rh, Pd) se nazývají lehké platinové kovy. Prvky třetí triády se nazývají (Os,
EU peníze středním školám digitální učební materiál
 EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
Nekovové prvky této skupiny se vyznačuji pěknými krystaly
 16. skupina chalkogeny prvky s 2 p 4 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 1 kyslík 2 Li Be B C N F Ne 2 3 Na Mg (n-1) d Al i P
16. skupina chalkogeny prvky s 2 p 4 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 1 kyslík 2 Li Be B C N F Ne 2 3 Na Mg (n-1) d Al i P
Kvalitativní analýza - prvková. - organické
 METODY - chemické MATERIÁLY - anorganické - organické CHEMICKÁ ANALÝZA ANORGANICKÉHO - iontové reakce ve vodných roztocích rychlý, jednoznačný a často kvantitativní průběh kationty, anionty CHEMICKÁ ANALÝZA
METODY - chemické MATERIÁLY - anorganické - organické CHEMICKÁ ANALÝZA ANORGANICKÉHO - iontové reakce ve vodných roztocích rychlý, jednoznačný a často kvantitativní průběh kationty, anionty CHEMICKÁ ANALÝZA
DIGITÁLNÍ UČEBNÍ MATERIÁL. Název školy SOUpotravinářské, Jílové u Prahy, Šenflukova 220 Název materiálu INOVACE_32_ZPV-CH 1/04/02/16 Autor
 DIGITÁLNÍ UČEBNÍ MATERIÁL Číslo projektu CZ.1.07/1.5.00/34.0763 Název školy SOUpotravinářské, Jílové u Prahy, Šenflukova 220 Název materiálu INOVACE_32_ZPV-CH 1/04/02/16 Autor Obor; předmět, ročník Ing.
DIGITÁLNÍ UČEBNÍ MATERIÁL Číslo projektu CZ.1.07/1.5.00/34.0763 Název školy SOUpotravinářské, Jílové u Prahy, Šenflukova 220 Název materiálu INOVACE_32_ZPV-CH 1/04/02/16 Autor Obor; předmět, ročník Ing.
Gymnázium Jiřího Ortena, Kutná Hora. Pojmy Metody a formy Poznámky
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie 2. ročník a sexta 2 hodiny týdně Školní tabule, interaktivní tabule, tyčinkové a kalotové modely molekul, zpětný
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie 2. ročník a sexta 2 hodiny týdně Školní tabule, interaktivní tabule, tyčinkové a kalotové modely molekul, zpětný
Chemické rovnice. Úprava koeficientů oxidoredukčních rovnic
 Úprava koeficientů oxidoredukčních rovnic Má-li být zápis chemické rovnice úplný (a použitelný například pro výpočty), musejí být počty molekul látek v chemické rovnici vyjádřeny takovými stechiometrickými
Úprava koeficientů oxidoredukčních rovnic Má-li být zápis chemické rovnice úplný (a použitelný například pro výpočty), musejí být počty molekul látek v chemické rovnici vyjádřeny takovými stechiometrickými
ZŠ ÚnO, Bratří Čapků 1332
 Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 1 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 1 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
