PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ:
|
|
|
- Filip Pospíšil
- před 5 lety
- Počet zobrazení:
Transkript
1 PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ: OD DO Nové registrace: ADCETRIS 50 mg EU/1/12/794/001 D: TAKEDA GLOBAL RESEARCH AND DEVELOPMENT CENTRE (EUROPE) LTD., LONDÝN, Velká Británie S: Brentuximabum vedotinum 50 mg PP: Prášek pro koncentrát pro infuzní roztok. Bílý až téměř bílý koláč nebo prášek. Injekční lahvička ze skla typu I s pryžovou butylovou zátkou a hliníkovým/plastovým flip-off uzávěrem, obsahující 50 mg prášku. Balení s 1 injekční lahvičkou. B: INF PLV CSL 1X50MG/LAH VIA kód SÚKL: (001) ATC: L01XC12 PE: 36 ZS: Uchovávejte v chladničce (2 C - 8 C). Chraňte před mrazem. Uchovávejte injekční lahvičku v původním balení, aby byl přípravek chráněn před světlem. Podmínky uchováváni tohoto léčivého přípravku po jeho rekonstituci a naředěni jsou uvedeny v bod ZI: ADCETRIS je indikován k léčbě dospělých pacientů s relabujícím nebo refrakterním CD30+Hodgkinovým lymfomem (HL): 1. po autologní transplantaci kmenových buněk (ASCT) nebo 2. po nejméně dvou předchozích terapiích v případech, kdy ASCT nebo kombinovaná chemoterapie nepředstavuje léčebnou možnost. ADCETRIS je indikován k léčbě dospělých pacientů s relabujícím nebo refrakterním systémovým anaplastickým velkobuněčným lymfomem (salcl). CUPRYMINA 925 MBq/ml RADIONUKLIDOVÝ PREKURZOR EU/1/12/784/001 D: SPARKLE S.R.L., CASARANO, Itálie S: Cupri (64 cu) chloridum 925 MB (odp. Cuprum rg) PP: Radionuklidový prekurzor, roztok. Čirý, bezbarvý roztok neobsahující žádné částice. Roztok radionuklidového prekurzoru je zabalen v 10ml injekční lahvičce z bezbarvého skla typu I, která je uzavřena bromobutylovou kaučukovou zátkou a hliníkovým krytem. Jedna injekční lahvička obsahuje 1 až 3 ml roztoku (což odpovídá 925 až MBq v době kalibrace). Injekční lahvičky jsou zabaleny ve wolframovém obalu, který slouží jako ochranný kryt. Každé balení obsahuje 1 injekční lahvičku ve wolframovém obalu. B: RAD PRE MBQ/1-3MLEXP:H VIA kód SÚKL: (001) IS: Radiopharmaca
2 ATC: V10X ZS: Uchovávejte v původním obalu, který zabezpečuje ochranu před zářením. Uchovávání radiofarmak má být v souladu s vnitrostátními předpisy pro radioaktivní látky. ZI: Přípravek Cuprymina je radionuklidový prekurzor. Není určen k přímému podávání pacientům. Tento léčivý přípravek se musí používat pouze pro radioaktivní značení nosičových molekul, které byly speciálně vyvinuty a schváleny pro radioaktivní značení tímto radionuklidem. EYLEA 40 mg/ml EU/1/12/798/ D: BAYER PHARMA AG, BERLÍN, Německo S: Afliberceptum 3.6 mg v 90 µl PP: Injekční roztok (roztok). Roztok je čirý, bezbarvý až světle žlutý a isoosmotický. 90 mikrolitrů roztoku v předplněné injekční stříkačce (sklo typu I) označené černou dávkovací linkou, s pístovou zátkou (elastomerní pryž) a Luer lock adaptérem s víčkem jehly (elastomerní pryž). Velikost balení 1. B: IVI INJ SOL 1X90UL/3.6MG ISP kód SÚKL: (001) IVI INJ SOL 1X100UL/4MG VIA kód SÚKL: (002) IS: Ophthalmologica ATC: S01LA05 ZS: Uchovávejte v chladničce (2 C - 8 C). Chraňte před mrazem. Uchovávejte předplněnou injekční stříkačku v blistru a krabičce, aby byl přípravek chráněn před světlem. Před použitím může být neotevřený blistr přípravku Eylea uchováván při pokojové teplotě (do 25 C) po dobu až 24 hodin. Po otevření blistru pokračujte při aseptických podmínkách. ZI: Přípravek Eylea je indikován u dospělých k léčbě neovaskulární (vlhké) formy věkem podmíněné makulární degenerace (VPMD) (viz bod 5.1). FORXIGA 10 mg EU/1/12/795/ D: BRISTOL-MYERS SQUIBB/ASTRAZENECA EEIG, UXBRIDGE, Velká Británie S: Dapagliflozinum propandiolum monohydricum qs Dapagliflozinum 10 mg PP: Potahovaná tableta (tableta). Žluté bikonvexní potahované tablety tvaru diamantu s diagonálními rozměry přibližně 1,1 x 0,8 cm s vyraženým 10 na jedné straně a 1428 na druhé straně. Al/Al blistr. Velikost balení 14, 28 a 98 potahovaných tablet v neperforovaných kalendářních blistrech. Velikost balení 30x1 a 90x1 potahovaných tablet v perforovaných jednodávkových blistrech. B: POR TBL FLM 14X10MG BLI kód SÚKL: (006) POR TBL FLM 28X10MG BLI kód SÚKL: (007) POR TBL FLM 98X10MG BLI kód SÚKL: (008) POR TBL FLM 30X1X10MG BLI kód SÚKL: (009) POR TBL FLM 90X1X10MG BLI kód SÚKL: (010)
3 IS: Antidiabetica (včetně insulinu) ATC: A10BX09 PE: 36 ZI: Přípravek Forxiga je indikován k léčbě dospělých pacientů starších 18 let s diabetes mellitus 2. typu ke zlepšení kontroly glykémie jako: Monoterapie Pokud dieta a fyzická aktivita samotné neposkytují adekvátní kontrolu glykémie u pacientů, u kterých je podávání metforminu nevhodné v důsledku intolerance. Součást kombinované léčby V kombinaci s jinými léčivými přípravky, které snižují hladinu glukosy včetně insulinu, pokud tyto léčivé přípravky spolu s dietou a fyzickou aktivitou neposkytují adekvátní kontrolu glykémie (viz body 4.4, 4.5 a 5.1 k dostupným údajům pro různé kombinace). FORXIGA 5 mg EU/1/12/795/ D: BRISTOL-MYERS SQUIBB/ASTRAZENECA EEIG, UXBRIDGE, Velká Británie S: Dapagliflozinum propandiolum monohydricum qs Dapagliflozinum 5 mg PP: Potahovaná tableta (tableta). Žluté bikonvexní kulaté potahované tablety o průměru 0,7 cm s vyraženým 5 na jedné straně a 1427 na druhé straně. Al/Al blistr. Velikost balení 14, 28 a 98 potahovaných tablet v neperforovaných kalendářních blistrech. Velikost balení 30x1 a 90x1 potahovaných tablet v perforovaných jednodávkových blistrech. B: POR TBL FLM 14X5MG BLI kód SÚKL: (001) POR TBL FLM 28X5MG BLI kód SÚKL: (002) POR TBL FLM 98X5MG BLI kód SÚKL: (003) POR TBL FLM 30X1X5MG BLI kód SÚKL: (004) POR TBL FLM 90X1X5MG BLI kód SÚKL: (005) IS: Antidiabetica (včetně insulinu) ATC: A10BX09 PE: 36 ZI: Přípravek Forxiga je indikován k léčbě dospělých pacientů starších 18 let s diabetes mellitus 2. typu ke zlepšení kontroly glykémie jako: Monoterapie Pokud dieta a fyzická aktivita samotné neposkytují adekvátní kontrolu glykémie u pacientů, u kterých je podávání metforminu nevhodné v důsledku intolerance. Součást kombinované léčby V kombinaci s jinými léčivými přípravky, které snižují hladinu glukosy včetně insulinu, pokud tyto léčivé přípravky spolu s dietou a fyzickou aktivitou neposkytují adekvátní kontrolu glykémie (viz body 4.4, 4.5 a 5.1 k dostupným údajům pro různé kombinace). GLYBERA EU/1/12/791/001 D: UNIQURE BIOPHARMA B.V., AMSTERDAM, Nizozemsko S: Alipogenum tiparvovecum 3 gc v 1 ml PP: Injekční roztok. Čirý až lehce opalescentní bezbarvý roztok.
4 1 ml roztoku v 2ml injekční lahvičce (sklo) se silikonizovanou chlorobutylovou injekční zátkou a odklápěcím uzávěrem. Jeden předtvarovaný průhledný zatavený plastový obal obsahuje buď 2, nebo 3 jednotlivé injekční lahvičky se savým papírem. Poslední vnější krabička obsahuje různý počet plastových obalů v závislosti na dávce potřebné pro konkrétního pacienta. B: INJ SOL 1X1ML VIA kód SÚKL: (001) IS: Varia ATC: C10AX10 PE: 18 ZS: Injekční lahvičky uchovávejte a převážejte zmrazené při teplotě-25 C až -15 C. Uchovávejte injekční lahvičku ve vnější krabičce, aby byl přípravek chráněn před světlem. ZI: Přípravek Glybera je indikován u dospělých pacientů s diagnózou familiárního deficitu lipoproteinové lipázy (LPLD) a s výskytem závažné pankreatitidy nebo mnohočetných epizod pankreatitidy navzdory omezení příjmu tuků v potravě. Diagnóza LPLD musí být potvrzena genetickým vyšetřením. Tato indikace je omezena na pacienty s měřitelnými hladinami proteinu LPL (viz bod 4.4). PICATO 150 µg/g EU/1/12/796/001 D: LEO PHARMA A/S, BALLERUP, Dánsko S: Ingenoli mebutas 0.07 mg PP: Gel. Čirý bezbarvý gel. Jednodavkova laminatova tuba s vnitřni vrstvou z polyethylenu o vysoke hustotě (HDPE) a barierovou vrstvou z hliniku. Uzavěry z HDPE. Přípravek Picato, 150 mcg/g gel je k dostani v krabičce obsahujici tři tuby, přičemž jedna tuba obsahuje 0,47 g gelu. B: DRM GEL 3X0,47 GM TUB kód SÚKL: (001) IS: Dermatologica ATC: D06BX02 ZS: Uchovávejte v chladničce (2 C - 8 C). Po prvním otevření mají být tuby zlikvidovány. ZI: Přípravek Picato je indikován k topické léčbě nehyperkeratotické, nehypertrofické solární (aktinické) keratózy u dospělých. PICATO 500 µg/g EU/1/12/796/002 D: LEO PHARMA A/S, BALLERUP, Dánsko S: Ingenoli mebutas mg PP: Gel. Čirý bezbarvý gel. Jednodavkova laminatova tuba s vnitřni vrstvou z polyethylenu o vysoke hustotě (HDPE) a barierovou vrstvou z hliniku. Uzavěry z HDPE. Přípravek Picato, 500 mcg/g gel je k dostani v krabičce obsahujici dvě tuby, přičemž jedna tuba obsahuje 0,47 g gelu B: DRM GEL 2X0,47 GM TUB kód SÚKL: (002) IS: Dermatologica ATC: D06BX02 ZS: Uchovávejte v chladničce (2 C - 8 C).
5 Po prvním otevření mají být tuby zlikvidovány. ZI: Přípravek Picato je indikován k topické léčbě nehyperkeratotické, nehypertrofické solární (aktinické) keratózy u dospělých. XALKORI 200 mg EU/1/12/793/ D: PFIZER LTD., SANDWICH, KENT, Velká Británie S: Crizotinibum 200 mg PP: Tvrdá tobolka. Tvrdé želatinové tobolky, bílé a růžové barvy, neprůhledné, s potiskem Pfizer na víčku a označením CRZ 200 na těle. HDPE lahvičky s polypropylenovým uzávěrem, obsahují 60 tvrdých tobolek. PVC blistr s fólií obsahující 10 tvrdých tobolek. Každá krabička obsahuje 60 tvrdých tobolek B: POR CPS DUR 60X200MG BLI kód SÚKL: (001) POR CPS DUR 60X200MG TBC kód SÚKL: (002) ATC: L01XE16 ZI: Přípravek XALKORI je indikován k léčbě dospělých pacientů s již dříve léčeným pokročilým nemalobuněčným karcinomem plic (NSCLC) pozitivním na kinázu anaplastického lymfomu (ALK) XALKORI 250 mg EU/1/12/793/ D: PFIZER LTD., SANDWICH, KENT, Velká Británie S: Crizotinibum 250 mg PP: Tvrdá tobolka. Tvrdé želatinové tobolky, růžové barvy, neprůhledné, s potiskem Pfizer na víčku a označením CRZ 250 na těle. HDPE lahvičky s polypropylenovým uzávěrem, obsahují 60 tvrdých tobolek. PVC blistr s fólií obsahující 10 tvrdých tobolek. Každá krabička obsahuje 60 tvrdých tobolek B: POR CPS DUR 60X250MG BLI kód SÚKL: (003) POR CPS DUR 60X250MG TBC kód SÚKL: (004) ATC: L01XE16 ZI: Přípravek XALKORI je indikován k léčbě dospělých pacientů s již dříve léčeným pokročilým nemalobuněčným karcinomem plic (NSCLC) pozitivním na kinázu anaplastického lymfomu (ALK) ZOLEDRONIC ACID HOSPIRA 4 mg/100 ml EU/1/12/800/003 D: HOSPIRA UK LIMITED, ROYAL LEAMINGTON SPA, Velká Británie S: Acidum zoledronicum monohydricum qs (odp. Acidum zoledronicum 4 mg) v 100 ml PP: Infuzní roztok Čirý a bezbarvý roztok. 100ml polypropylenové vaky s polypropylenovým šroubovacím portem opatřeným uzávěrem, s polyester/polypropylenovým přebalem. Velikost balení
6 Přípravek Zoledronic Acid Hospira se dodává v balení, které obsahuje 1 vak. B: INF SOL 1X100ML/4MG VAK kód SÚKL: (003) ATC: M05BA08 Podmínky uchovávání po prvním otevření léčivého přípravku naleznete v bodě 6.3. ZI: Prevence kostních příhod (patologických zlomenin, kompresivních zlomenin obratlů, radiační nebo chirurgická léčba kostí, nebo hyperkalcemie vyvolané nádorovým onemocněním) u dospělých pacientů s pokročilým maligním onemocněním postihujícím kosti. - Léčba dospělých pacientů s hyperkalcemií vyvolanou nádorovým onemocněním (TIH). ZOLEDRONIC ACID HOSPIRA 4 mg/5 ml EU/1/12/800/ D: HOSPIRA UK LIMITED, ROYAL LEAMINGTON SPA, Velká Británie S: Acidum zoledronicum monohydricum qs (odp. Acidum zoledronicum 4 mg) v 5 ml PP: Koncentrát pro infuzní roztok 6 ml skleněná lahvička typu I nebo 5 ml plastová lahvička, s halobutylovou zátkou potaženou fluoropolymerem s hliníkovým uzávěrem a flip-off diskem. Přípravek Zoledronic Acid Hospira se dodává v balení, které obsahuje 1 injekční lahvičku. B: INF CNC SOL 1X5ML/4MG VIA kód SÚKL: (001) INF CNC SOL 1X5ML/4MG VIA kód SÚKL: (002) ATC: M05BA08 Podmínky uchovávání rekonstituovaného roztoku pro infuze jsou uvedeny v bodě 6.3. ZI: Prevence kostních příhod (patologických zlomenin, kompresivních zlomenin obratlů, radiační nebo chirurgická léčba kostí, nebo hyperkalcemie vyvolané nádorovým onemocněním) u dospělých pacientů s pokročilým maligním onemocněním postihujícím kosti. - Léčba dospělých pacientů s hyperkalcemií vyvolanou nádorovým onemocněním (TIH). ZOLEDRONIC ACID HOSPIRA 5 mg/100 ml EU/1/12/800/004 D: HOSPIRA UK LIMITED, ROYAL LEAMINGTON SPA, Velká Británie S: Acidum zoledronicum monohydricum qs (odp. Acidum zoledronicum 5 mg) v 100 ml PP: Infuzní roztok Čirý a bezbarvý roztok. 100ml polypropylenové vaky s polypropylenovým šroubovacím portem opatřeným uzávěrem, s polyester/polypropylenovým přebalem Přípravek Zoledronic Acid Hospira se dodává v balení, které obsahuje 1 vak. B: INF SOL 1X100ML/5MG VAK kód SÚKL: (004) ATC: M05BA08 Podmínky uchovávání po prvním otevření léčivého přípravku naleznete v bodě 6.3.
7 ZI: Prevence kostních příhod (patologických zlomenin, kompresivních zlomenin obratlů, radiační nebo chirurgická léčba kostí, nebo hyperkalcemie vyvolané nádorovým onemocněním) u dospělých pacientů s pokročilým maligním onemocněním postihujícím kosti. - Léčba dospělých pacientů s hyperkalcemií vyvolanou nádorovým onemocněním (TIH). Rozšíření registrace: DOCETAXEL KABI 20 mg/ ml EU/1/12/770/005 D: FRESENIUS KABI ONCOLOGY PLC., BORDON,HAMPSHIRE, Velká Británie S: Docetaxelum 20 mg v 1 ml PP: Koncentrát pro infuzní roztok (sterilní koncentrát). Popis přípravku: koncentrát je čirý, bezbarvý až slabě žlutý roztok. 6 ml čirá, bezbarvá skleněná injekční lahvička (Typ I) uzavřená flurotekovou pryžovou zátkou a zeleným hliníkovým flip-off uzávěrem, obsahující 1 ml koncentrátu. Každé balení obsahuje 1 injekční lahvičku. B: INF CNC SOL 1X1ML/20MG VIA kód SÚKL: (005) ATC: L01CD02 ZS: Uchovávejte při teplotě do 25 C. Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem. Podmínky uchovávání naředěného roztoku viz bod 6.3. ZI: Rakovina prsu DOCETAXEL KABI v kombinaci s doxorubicinem a cyklofosfamidem je indikován k adjuvantní léčbě u pacientů s: s operabilním karcinomem prsu s pozitivními uzlinami s operabilním karcinomem prsu s negativními uzlinami U pacientů s operabilním kacinomem prsu s negativními uzlinami je adjuvantní léčba omezena na pacienty, kteří jsou schopni chemoterapie podle mezinárodně uznávaných kritérií pro primární léčbu časného karcinomu prsu (viz bod 5.1). DOCETAXEL KABI v kombinaci s doxorubicinem je indikován k léčbě nemocných s lokálně pokročilým nebo metastazujícím karcinomem prsu, kteří nebyli pro toto onemocnění dosud léčení cytotoxickou léčbou. DOCETAXEL KABI v monoterapii je indikován k léčbě nemocných s lokálně pokročilým nebo metastazujícím karcinomem prsu po selhání předchozí cytotoxické léčby. Předchozí léčba by měla zahrnovat antracyklin nebo alkylační látku. DOCETAXEL KABI v kombinaci s trastuzumabem je indikován k léčbě nemocných s metastatickým karcinomem prsu, u něhož je prokázána nadměrná exprese HER2 a kteří dosud nebyli léčeni chemoterapií pro metastatické onemocnění. DOCETAXEL KABI v kombinaci s kapecitabinem je indikován k léčbě nemocných s lokálně pokročilým nebo metastazujícím karcinomem prsu po selhání předchozí cytotoxické léčby. Předchozí léčba by měla zahrnovat antracyklin.
8 Nemalobuněčný karcinom plic DOCETAXEL KABI je indikován k léčbě nemocných s lokálně pokročilým nebo metastazujícím nemalobuněčným karcinomem plic po selhání předchozí chemoterapie. DOCETAXEL KABI v kombinaci s cisplatinou je indikován k léčbě nemocných s neresekovatelným, lokálně pokročilým nebo metastazujícím nemalobuněčným karcinomem plic, kteří dosud proto toto onemocnění nebyli léčeni chemoterapií. Karcinom prostaty DOCETAXEL KABI v kombinaci s prednisonem nebo prednisolonem je indikován k léčbě nemocných s metastatickým karcinomem prostaty, neodpovídajícím na hormonální léčbu. Adenokarcinom žaludku DOCETAXEL KABI v kombinaci s cisplatinou a 5-fluorouracilem je indikován k léčbě nemocných s metastatickým adenokarcinomem žaludku včetně adenokarcinomu gastroesofageálního spojení, kteří dosud pro metastatické onemocnění nebyli léčeni chemoterapií. Karcinom hlavy a krku DOCETAXEL KABI je v kombinaci s cisplatinou a 5-fluorouracilem indikován k indukční léčbě pacientů s inoperabilním lokálně pokročilým dlaždicobuněčným karcinomem hlavy a krku. PRAVAFENIX 40 mg/160 mg EU/1/11/679/007 D: LABORATOIRES S.M.B. S.A., BRUSEL, Belgie S: Pravastatinum natricum 40 mg Fenofibratum 160 mg PP: Tvrdá tobolka Přípravek Pravafenix je tvrdá tobolka se světlezelenou spodní částí a olivově zelenou horní částí obsahující voskovitou bílobéžovou hmotu a tabletu. Balení s blistry z polyamid-aluminium-pvc/al, která obsahují 30, 60 a 90 tvrdých tobolek. Neprůsvitné bílé lahvičky z HDPE, které obsahují 14, 30, 60 a 90 tvrdých tobolek. B: POR CPS DUR 14 TBC kód SÚKL: (007) IS: Hypolipidaemica ATC: C10BA03 ZI: Přípravek Pravafenix je určen k léčbě dospělých pacientů s vysokým rizikem ischemické choroby srdeční se smíšenou dyslipidémií, pro niž je charakteristická vysoká hladina triglyceridů a nízká hladina HDL cholesterolu, přičemž hladina LDL cholesterolu je adekvátně upravována při monoterapii pravastatinem 40 mg. PREZISTA 100 mg/ml EU/1/06/380/006 D: JANSSEN-CILAG INTERNATIONAL N.V., BEERSE, Belgie S: Darunaviri ethanolas qs (odp. Darunavirum 20 g) v 200 ml PP: Perorální suspenze Bílá až téměř bílá neprůhledná suspenze Neprůhledná bílá 160ml lahvička z polyethylenu vysoké hustoty (HDPE) s obsahem 60 tablet opatřená polypropylenovým (PP) bezpečnostním uzávěrem. Jedna lahvička B: POR SUS 1X200ML LAG kód SÚKL: (006)
9 IS: Chemotherapeutica (včetně tuberkulostatik) ATC: J05AE10 ZI: Přípravek PREZISTA podávaný současně s nízkou dávkou ritonaviru je určen v kombinaci s dalšími antiretrovirovými léčivými přípravky k léčbě pacientů s infekcí způsobenou virem lidské imunodeficience (HIV-1) u dospělých pacientů a u již dříve léčených pediatrických pacientů ve věku od 3 let a s tělesnou hmotností alespoň 15 kg. Při rozhodování o zahájení léčby přípravkem PREZISTA současně s nízkou dávkou ritonaviru má být pečlivě posouzen dosavadní způsob léčby jednotlivých pacientů a schéma mutací souvisejících s různými látkami. K nasazení přípravku PREZISTA mají vést genotypové a fenotypové testy (jsou-li k dostupné) a anamnéza. RIBAVIRIN MYLAN 200 mg EU/1/10/634/ D: GENERICS [UK] LTD., POTTERS BAR, HERTFORDSHIRE, Velká Británie S: Ribavirinum 200 mg PP: Tvrdá tobolka Bílá neprůhledná tobolka se zeleným potiskem riba/200 a bílé neprůhledné víčko se zeleným potiskem riba/200. Přípravek Ribavirin Mylan je balený: V lahvičkách z polyethylenu s vysokou hustotou (HDPE) uzavřených šroubovacím polypropylenovým (PP) bezpečnostním uzávěrem. Velikost balení 84, 112, 140 a 168 tobolek. V krabičkách s PVC/Aclar/Al blistry. Velikost balení 56 a 168 tobolek. V krabičkách s perforovanými jednodávkovými PVC/Aclar/Al blistry. Velikost balení 56x1, 84x1, 112x1, 140x1 a 168x1 tobolka. B: POR CPS DUR 56X200MG BLI kód SÚKL: (005) POR CPS DUR 168X200MG BLI kód SÚKL: (006) POR CPS DUR 56X1X200MG BLI kód SÚKL: (007) POR CPS DUR 84X1X200MG BLI kód SÚKL: (008) POR CPS DUR 112X1X200MG BLI kód SÚKL: (009) POR CPS DUR 140X1X200MG BLI kód SÚKL: (010) POR CPS DUR 168X1X200MG BLI kód SÚKL: (011) IS: Chemotherapeutica (včetně tuberkulostatik) ATC: J05AB04 ZS: Lahvičky - Neuchovávejte při teplotě nad 30 C. Blistry - Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.. ZI: Přípravek Ribavirin Mylan je určen k léčbě chronické hepatitidy C a musí být užíván pouze jako součást kombinované léčby s interferonem alfa-2b (u dospělých, dětí (ve věku 3 let a starších) a u dospívajících). Nesmí se používat monoterapie ribavirinem. O používání přípravku Ribavirin s jinými formami interferonu (tj. ne alfa-2b) neexistují žádné informace o bezpečnosti nebo účinnosti. Seznamte se, prosím, také s informacemi Souhrnu údajů o přípravku příslušného přípravku obsahujícího interferon alfa-2b. Neléčení pacienti Dospělí pacienti: Přípravek Ribavirin Mylan je indikován v kombinaci s interferonem alfa 2-b pro léčbu dosud neléčených dospělých pacientů s chronickou hepatitidou C s výjimkou genotypu 1, bez jaterní dekompenzace, se zvýšenou alaninaminotransferázou (ALT), kteří jsou pozitivní na sérovou HCV-RNA (viz bod 4.4).
10 Děti a mladiství: Přípravek Ribavirin Mylan je indikován v kombinovaném režimu s interferonem alfa-2b k léčbě dosud neléčených dětí a mladistvých ve věku 3 roky a starší, kteří mají všechny typy chronické hepatitidy C s výjimkou genotypu 1, bez jaterní dekompenzace, a kteří jsou pozitivní na sérovou HCV-RNA. Při rozhodování, zda neodložit léčbu až do dospělosti je důležité vzít v úvahu, že kombinovaná terapie indukuje inhibici růstu. Vratnost inhibice růstu je nejistá. Rozhodnutí o léčbě je třeba hodnotit případ od případu (viz bod 4.4). Již dříve léčení pacienti, u kterých léčba selhala Dospělí pacienti: Přípravek Ribavirin Mylan je indikován v kombinaci s interferonem alfa-2b pro léčbu již dříve léčených pacientů s chronickou hepatitidou C, kteří již dříve reagovali (s normalizací ALT na konci léčby) na monoterapii interferonem alfa, avšak následně u nich došlo k recidivě (viz bod 5.1). REFACTO AF 250 IU EU/1/99/103/009 D: PFIZER LTD., SANDWICH, KENT, Velká Británie S: Moroctocogum alfa 250 ut PP: Prášek a rozpouštědlo pro injekční roztok v předplněné injekční stříkačce. Bílý až téměř bílý koláč/prášek ve vrchní části zásobníku předplněné injekční stříkačky. Čiré, bezbarvé rozpouštědlo ve spodní části zásobníku předplněné injekční stříkačky. 250 IU lyofilizovaného prášku ve vrchním zásobníku a 4 ml rozpouštědla ve spodním zásobníku předplněné injekční stříkačky (sklo typu 1) s pryžovými písty a zátkou, jeden vnější píst k zajištění současného chodu vnitřních pístů a polypropylenové perforované sterilní víčko, 1 sterilní infuzní souprava, alkoholem napuštěné tampony, náplast a gázový polštářek. Velikost balení: 1 souprava B: INJ PSO LQF 1X250UT ISP kód SÚKL: (009) IS: Anticoagulantia (fibrinolytica, antifibrinol.) ATC: B02BD02 PE: 36 ZS: Uchovávejte a převážejte chlazené (2 C - 8 C). Chraňte před mrazem. Uchovávejte předplněnou injekční stříkačku ve vnějším obalu, aby byla chráněna před světlem. Přípravek může byt jednorázově vyjmut z chladničky a uložen při pokojové teplotě. (do 25 C), maximálně na dobu 3 měsíců. Na konci tohoto období nesmí být přípravek vracen zpět do chladničky, ale musí byt spotřebován nebo zlikvidován. Podmínky uchováváni rekonstituovaného lečivého přípravku, viz bod 6.3. ZI: Léčení a prevence krvácení u pacientů s hemofilií A (vrozený nedostatek faktoru VIII). Přípravek ReFacto AF je vhodné pro použití u dospělých pacientů a u dětí všech věkových skupin, včetně novorozenců. Přípravek ReFacto AF neobsahuje von Willebrandův faktor, a proto není indikován u von Willebrandovy choroby. RIENSO 30 mg/ml EU/1/12/774/ D: TAKEDA GLOBAL RESEARCH AND DEVELOPMENT CENTRE (EUROPE) LTD., LONDÝN, Velká Británie S: Ferumoxytolum qs (odp. Ferrum-ion (3+) 510 mg) v 17 ml PP: Injekční roztok. Černý až červenohnědý roztok Osmolalita: mosm/kg
11 ph: 6,5 až 8,0 17 ml roztoku v injekční lahvičce (sklo typu I) se zátkou (chlorobutylová pryž) a hliníkovým pertlovým uzávěrem. K dispozici v baleních o velikosti 1, 2, 6 nebo 10 injekčních lahviček. B: INJ SOL 2X17ML/510MG VIA kód SÚKL: (003) INJ SOL 6X17ML/510MG VIA kód SÚKL: (004) IS: Antianaemica ATC: B03AC PE: 36 ZS: Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem Chraňte před mrazem ZI: Rienso je indikován k intravenózní léčbě anémie z nedostatku železa u dospělých pacientů s chronickým onemocněním ledvin (chronic kidney disease - CKD). Diagnóza nedostatku železa musí být stanovena na základě příslušných laboratorních testů (viz bod 4.2). SABERVEL 150 mg EU/1/12/765/008 D: PHARMATHEN S.A., PALLINI, Řecko S: Irbesartanum 150 mg PP: Potahovaná tableta. Bílá, konkávní, kulatá, potahovaná tableta o průměru 9 mm. Krabičky obsahující 28, 90 nebo 98 potahovaných tablet v PVC/PVDC-Al/PVDC blistrech. B: POR TBL FLM 98X150MG BLI kód SÚKL: (008) IS: Hypotensiva ATC: C09CA04 PE: 48 ZI: Přípravek Sabervel je indikován k léčbě esenciální hypertenze u dospělých. Také je indikován k léčbě onemocnění ledvin u dospělých pacientů s hypertenzí a diabetes mellitus 2. typu jako součást antihypertenzního léčebného režimu (viz bod 5.1). SABERVEL 300 mg EU/1/12/765/009 DR: O D: PHARMATHEN S.A., PALLINI, Řecko S: Irbesartanum 300 mg PP: Potahovaná tableta. Bílá, konkávní, kulatá, potahovaná tableta o průměru 11 mm. Krabičky obsahující 28, 90 nebo 98 potahovaných tablet v PVC/PVDC-Al/PVDC blistrech. B: POR TBL FLM 98X300MG BLI kód SÚKL: (009) IS: Hypotensiva ATC: C09CA04 PE: 48 ZI: Přípravek Sabervel je indikován k léčbě esenciální hypertenze u dospělých. Také je indikován k léčbě onemocnění ledvin u dospělých pacientů s hypertenzí a diabetes mellitus 2. typu jako součást antihypertenzního léčebného režimu (viz bod 5.1). SABERVEL 75 mg EU/1/12/765/007
12 D: PHARMATHEN S.A., PALLINI, Řecko S: Irbesartanum 75 mg PP: Potahovaná tableta. Bílá, konkávní, kulatá, potahovaná tableta o průměru 7 mm. Krabičky obsahující 28, 90 nebo 98 potahovaných tablet v PVC/PVDC-Al/PVDC blistrech. B: POR TBL FLM 98X75MG BLI kód SÚKL: (007) IS: Hypotensiva ATC: C09CA04 PE: 48 ZI: Přípravek Sabervel je indikován k léčbě esenciální hypertenze u dospělých. Také je indikován k léčbě onemocnění ledvin u dospělých pacientů s hypertenzí a diabetes mellitus 2. typu jako součást antihypertenzního léčebného režimu (viz bod 5.1). TEMOZOLOMIDE SUN 100 mg EU/1/11/697/ D: SUN PHARMACEUTICAL INDUSTRIES EUROPE B.V., HOOFDDORP, Nizozemsko S: Temozolomidum 100 mg PP: Tvrdá tobolka. Tvrdé želatinové tobolky s bílým neprůhledným víčkem a tělem, potištěné nápisem 892 a 100 mg na těle tobolky obsahujícím černý inkoust. Balení v lahvičce Temozolomid tvrdé tobolky jsou baleny v lahvičce z jantarového skla typu III s bílým polypropylenovým dětským bezpečnostním uzávěrem s vysoušedlem. Velikost balení: jedna lahvička obsahující 5 nebo 20 tvrdých tobolek. Temozolomid tvrdé tobolky jsou baleny v Al/Al jednodávkovém blistru, skládajícím se z OPA [orientovaný polyamid] / Al / PVC [polyvinyl chlorid] vrstvy a odlupovací Al fólie. Velikost balení: blistry jsou baleny do krabičky obsahující 5 nebo 20 tvrdých tobolek. B: POR CPS DUR 5X100MG BLI kód SÚKL: (017) POR CPS DUR 20X100MG BLI kód SÚKL: (018) ATC: L01AX03 PE: 12 ZS: Balení v lahvičce Uchovávejte v původním obalu. Lahvičku uchovávejte dobře uzavřenou, aby byl přípravekchráněn před vlhkostí. ZI: Přípravek Temozolomide SUN je určen k léčbě: - dospělých pacientů s nově diagnostikovaným multiformním glioblastomem souběžně s radioterapií (RT) a následně jako monoterapeutická léčba. - dětí ve věku od tří let, dospívajících a dospělých pacientů s maligním gliomem, jako je multiformní glioblastom nebo anaplastický astrocytom, u nichž se po standardní léčbě projevují recidivy nebo progrese. TEMOZOLOMIDE SUN 140 mg EU/1/11/697/
13 D: SUN PHARMACEUTICAL INDUSTRIES EUROPE B.V., HOOFDDORP, Nizozemsko S: Temozolomidum 140 mg PP: Tvrdá tobolka. Tvrdé želatinové tobolky s bílým neprůhledným víčkem a tělem, potištěné nápisem 929 a 140 mg na těle tobolky obsahujícím černý inkoust. Balení v lahvičce Temozolomid tvrdé tobolky jsou baleny v lahvičce z jantarového skla typu III s bílým polypropylenovým dětským bezpečnostním uzávěrem s vysoušedlem. Velikost balení: jedna lahvička obsahující 5 nebo 20 tvrdých tobolek. Temozolomid tvrdé tobolky jsou baleny v Al/Al jednodávkovém blistru, skládajícím se z OPA [orientovaný polyamid] / Al / PVC [polyvinyl chlorid] vrstvy a odlupovací Al fólie. Velikost balení: blistry jsou baleny do krabičky obsahující 5 nebo 20 tvrdých tobolek. B: POR CPS DUR 5X140MG BLI kód SÚKL: (019) POR CPS DUR 20X140MG BLI kód SÚKL: (020) ATC: L01AX03 PE: 12 ZS: Balení v lahvičce Uchovávejte v původním obalu. Lahvičku uchovávejte dobře uzavřenou, aby byl přípravekchráněn před vlhkostí. ZI: Přípravek Temozolomide SUN je určen k léčbě: - dospělých pacientů s nově diagnostikovaným multiformním glioblastomem souběžně s radioterapií (RT) a následně jako monoterapeutická léčba. - dětí ve věku od tří let, dospívajících a dospělých pacientů s maligním gliomem, jako je multiformní glioblastom nebo anaplastický astrocytom, u nichž se po standardní léčbě projevují recidivy nebo progrese. TEMOZOLOMIDE SUN 180 mg EU/1/11/697/ D: SUN PHARMACEUTICAL INDUSTRIES EUROPE B.V., HOOFDDORP, Nizozemsko S: Temozolomidum 180 mg PP: Tvrdá tobolka. Tvrdé želatinové tobolky s bílým neprůhledným víčkem a tělem, potištěné nápisem 930 a 180 mg na těle tobolky obsahujícím černý inkoust. Balení v lahvičce Temozolomid tvrdé tobolky jsou baleny v lahvičce z jantarového skla typu III s bílým polypropylenovým dětským bezpečnostním uzávěrem s vysoušedlem. Velikost balení: jedna lahvička obsahující 5 nebo 20 tvrdých tobolek. Temozolomid tvrdé tobolky jsou baleny v Al/Al jednodávkovém blistru, skládajícím se z OPA [orientovaný polyamid] / Al / PVC [polyvinyl chlorid] vrstvy a odlupovací Al fólie. Velikost balení: blistry jsou baleny do krabičky obsahující 5 nebo 20 tvrdých tobolek. B: POR CPS DUR 5X180MG BLI kód SÚKL: (021)
14 POR CPS DUR 20X180MG BLI kód SÚKL: (022) ATC: L01AX03 PE: 12 ZS: Balení v lahvičce Uchovávejte v původním obalu. Lahvičku uchovávejte dobře uzavřenou, aby byl přípravekchráněn před vlhkostí. ZI: Přípravek Temozolomide SUN je určen k léčbě: - dospělých pacientů s nově diagnostikovaným multiformním glioblastomem souběžně s radioterapií (RT) a následně jako monoterapeutická léčba. - dětí ve věku od tří let, dospívajících a dospělých pacientů s maligním gliomem, jako je multiformní glioblastom nebo anaplastický astrocytom, u nichž se po standardní léčbě projevují recidivy nebo progrese. TEMOZOLOMIDE SUN 20 mg EU/1/11/697/ D: SUN PHARMACEUTICAL INDUSTRIES EUROPE B.V., HOOFDDORP, Nizozemsko S: Temozolomidum 20 mg PP: Tvrdá tobolka. Tvrdé želatinové tobolky s bílým neprůhledným víčkem a tělem, potištěné nápisem 891 a 20 mg na těle tobolky obsahujícím černý inkoust. Balení v lahvičce Temozolomid tvrdé tobolky jsou baleny v lahvičce z jantarového skla typu III s bílým polypropylenovým dětským bezpečnostním uzávěrem s vysoušedlem. Velikost balení: jedna lahvička obsahující 5 nebo 20 tvrdých tobolek. Temozolomid tvrdé tobolky jsou baleny v Al/Al jednodávkovém blistru, skládajícím se z OPA [orientovaný polyamid] / Al / PVC [polyvinyl chlorid] vrstvy a odlupovací Al fólie. Velikost balení: blistry jsou baleny do krabičky obsahující 5 nebo 20 tvrdých tobolek. B: POR CPS DUR 5X20MG BLI kód SÚKL: (015) POR CPS DUR 20X20MG BLI kód SÚKL: (016) ATC: L01AX03 PE: 12 ZS: Balení v lahvičce Uchovávejte v původním obalu. Lahvičku uchovávejte dobře uzavřenou, aby byl přípravekchráněn před vlhkostí. ZI: Přípravek Temozolomide SUN je určen k léčbě: - dospělých pacientů s nově diagnostikovaným multiformním glioblastomem souběžně s radioterapií (RT) a následně jako monoterapeutická léčba. - dětí ve věku od tří let, dospívajících a dospělých pacientů s maligním gliomem, jako je multiformní glioblastom nebo anaplastický astrocytom, u nichž se po standardní léčbě projevují recidivy nebo progrese.
15 TEMOZOLOMIDE SUN 250 mg EU/1/11/697/ D: SUN PHARMACEUTICAL INDUSTRIES EUROPE B.V., HOOFDDORP, Nizozemsko S: Temozolomidum 250 mg PP: Tvrdá tobolka. Tvrdé želatinové tobolky s bílým neprůhledným víčkem a tělem, potištěné nápisem 893 a 250 mg na těle tobolky obsahujícím černý inkoust. Balení v lahvičce Temozolomid tvrdé tobolky jsou baleny v lahvičce z jantarového skla typu III s bílým polypropylenovým dětským bezpečnostním uzávěrem s vysoušedlem. Velikost balení: jedna lahvička obsahující 5 nebo 20 tvrdých tobolek. Temozolomid tvrdé tobolky jsou baleny v Al/Al jednodávkovém blistru, skládajícím se z OPA [orientovaný polyamid] / Al / PVC [polyvinyl chlorid] vrstvy a odlupovací Al fólie. Velikost balení: blistry jsou baleny do krabičky obsahující 5 nebo 20 tvrdých tobolek. B: POR CPS DUR 5X250MG BLI kód SÚKL: (023) POR CPS DUR 20X250MG BLI kód SÚKL: (024) ATC: L01AX03 PE: 12 ZS: Balení v lahvičce Uchovávejte v původním obalu. Lahvičku uchovávejte dobře uzavřenou, aby byl přípravek chráněn před vlhkostí. ZI: Přípravek Temozolomide SUN je určen k léčbě: - dospělých pacientů s nově diagnostikovaným multiformním glioblastomem souběžně s radioterapií (RT) a následně jako monoterapeutická léčba. - dětí ve věku od tří let, dospívajících a dospělých pacientů s maligním gliomem, jako je multiformní glioblastom nebo anaplastický astrocytom, u nichž se po standardní léčbě projevují recidivy nebo progrese. TEMOZOLOMIDE SUN 5 mg EU/1/11/697/ D: SUN PHARMACEUTICAL INDUSTRIES EUROPE B.V., HOOFDDORP, Nizozemsko S: Temozolomidum 5 mg PP: Tvrdá tobolka. Tvrdé želatinové tobolky s bílým neprůhledným víčkem a tělem, potištěné nápisem 890 a 5 mg na těle tobolky obsahujícím černý inkoust. Balení v lahvičce Temozolomid tvrdé tobolky jsou baleny v lahvičce z jantarového skla typu III s bílým polypropylenovým dětským bezpečnostním uzávěrem s vysoušedlem. Velikost balení: jedna lahvička obsahující 5 nebo 20 tvrdých tobolek. Temozolomid tvrdé tobolky jsou baleny v Al/Al jednodávkovém blistru, skládajícím se z OPA [orientovaný polyamid] / Al / PVC [polyvinyl chlorid] vrstvy a odlupovací Al fólie.
16 Velikost balení: blistry jsou baleny do krabičky obsahující 5 nebo 20 tvrdých tobolek. B: POR CPS DUR 5X5MG BLI kód SÚKL: (013) POR CPS DUR 20X5MG BLI kód SÚKL: (014) ATC: L01AX03 PE: 12 ZS: Balení v lahvičce Uchovávejte v původním obalu. Lahvičku uchovávejte dobře uzavřenou, aby byl přípravekchráněn před vlhkostí. ZI: Přípravek Temozolomide SUN je určen k léčbě: - dospělých pacientů s nově diagnostikovaným multiformním glioblastomem souběžně s radioterapií (RT) a následně jako monoterapeutická léčba. - dětí ve věku od tří let, dospívajících a dospělých pacientů s maligním gliomem, jako je multiformní glioblastom nebo anaplastický astrocytom, u nichž se po standardní léčbě projevují recidivy nebo progrese. TEYSUNO 15 mg/4,35mg/11,8 mg EU/1/11/669/005 D: NORDIC GROUP BV, HOOFDDORP, Nizozemsko S: Tegafurum 15 mg Gimeracilum 4.35 mg Oteracilum 11.8 mg (odp. Oteracilum kalicum 14.7 mg) PP: Tvrdá tobolka (tobolka). Tobolka má bílé neprůhledné tělo a neprůhledné hnědé víčko s potiskem TC448 šedou barvou. PCTFE/PVC/Al neprůhledné blistry obsahující buď 42 tobolek (3 blistry, 1 blistr obsahuje 14 tobolek), 84 tobolek (6 blistrů, 1 blistr obsahuje 14 tobolek) nebo 126 tobolek (9 blistrů, 1 blistr obsahuje 14 tobolek). B: POR CPS DUR 84 BLI kód SÚKL: (005) ATC: L01BC53 PE: 36 ZS: Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky pro uchovávání. ZI: Přípravek Teysuno je indikován pro dospělé k léčbě pokročilé rakoviny žaludku, podává se v kombinaci s cisplatinou (viz bod 5.1). VFEND 200 mg EU/1/02/212/027 D: PFIZER LTD., SANDWICH, KENT, Velká Británie S: Voriconazolum 200 mg PP: Prášek a rozpouštědlo pro infúzní roztok Prášek pro infúzní roztok. Bílý lyofilizovaný prášek. Rozpouštědlo pro infúzní roztok: Čirý roztok pro rozpouštění VFEND prášek a rozpouštědlo pro infúzní roztok se dodává v krabici obsahující: Jedna 30ml injekční lahvička pro jednorázové použití z čirého skla typu I s pryžovou zátkou a Al krytem s uzávěrem z umělé hmoty s přípravkem VFEND 200 mg, prášek
17 pro infúzní roztok. Jeden sterilní folií přebalený polypropylenový vak pro jednorázové použití, který obsahuje VFEND rozpouštědlo pro infúzní roztok v jednom oddíle (50 ml). 1 sterilní adapter na injekční lahvičku pro jednorázové použití. 1 sterilní stříkačka pro jednorázové použití. B: INF PSO LQF 1X200MG VIA kód SÚKL: (027) IS: Antimycotica (lokální i celková) ATC: J02AC03 PE: 36 ZS: Podmínky pro uchovávání po rekonstituci přípravku viz bod 6.3. Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání. ZI: Vorikonazol je širokospektré triazolové antimykotikum, indikované u dospělých a dětí ve věku 2 let a více v následujících případech: Léčba invazivní aspergilózy. Léčba kandidémie u pacientů bez neutropenie. Léčba závažných infekcí vyvolaných druhy Candida (včetně C. krusei) rezistentních vůči flukonazolu. Léčba závažných mykotických infekcí vyvolaných druhy Scedosporium a Fusarium. VFEND je nutno podávat primárně pacientům s progredujícími, potenciálně život ohrožujícími infekcemi.
ANASTROZOL MEDAC 1 mg POTAHOVANÁ TABLETA ESCITALOPRAM MYLAN 10 mg
 ANASTROZOL MEDAC 1 mg POTAHOVANÁ TABLETA 44/369/09-C DR: O RP: 44/1296/97-C D: MEDAC, GESELLSCHAFT FÜR KLINISCHE SPEZIALPRÄPARATE MBH, HAMBURG, Německo S: Anastrozolum 1 mg PP: Bílé kulaté bikonvexní potahované
ANASTROZOL MEDAC 1 mg POTAHOVANÁ TABLETA 44/369/09-C DR: O RP: 44/1296/97-C D: MEDAC, GESELLSCHAFT FÜR KLINISCHE SPEZIALPRÄPARATE MBH, HAMBURG, Německo S: Anastrozolum 1 mg PP: Bílé kulaté bikonvexní potahované
PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ: OD DO
 PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ: OD 1.5.2009 DO 31.5.2009 Nové léčivé přípravky: ELLAONE EU/1/09/522/001 D: LABORATOIRE HRA PHARMA, PARIS, Francie S:
PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ: OD 1.5.2009 DO 31.5.2009 Nové léčivé přípravky: ELLAONE EU/1/09/522/001 D: LABORATOIRE HRA PHARMA, PARIS, Francie S:
PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ:
 PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ: OD 1.5.2012 DO 31.5.2012 Nové registrace: CAPECITABINE ACCORD 150 mg EU/1/12/762/001-006 D: ACCORD HEALTHCARE LIMITED,
PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ: OD 1.5.2012 DO 31.5.2012 Nové registrace: CAPECITABINE ACCORD 150 mg EU/1/12/762/001-006 D: ACCORD HEALTHCARE LIMITED,
PP: Bílé podlouhlé potahované tablety, na jedné straně je vyraženo "Pfizer", na druhé straně "CDT 051". Blistr (polyamid/al/pvc)
 AMLODIPIN/ATORVASTATIN PFIZER 10 mg/10 mg POTAHOVANÉ TABLETY 83/621/11-C DR: OA RP: 83/617/05-C D: PFIZER, SPOL. S R.O., PRAHA, Česká republika S: Amlodipini besilas 13.87 mg (odp. Amlodipinum 10 mg) Atorvastatinum
AMLODIPIN/ATORVASTATIN PFIZER 10 mg/10 mg POTAHOVANÉ TABLETY 83/621/11-C DR: OA RP: 83/617/05-C D: PFIZER, SPOL. S R.O., PRAHA, Česká republika S: Amlodipini besilas 13.87 mg (odp. Amlodipinum 10 mg) Atorvastatinum
přípravku. Léčba anginy pectoris u pacientů již dříve stabilizovaných pomocí
 BLOKBIS 10 mg/100 mg 41/262/12-C DR: OK D: ASA PHARMA PLC, DUBLIN, Irsko S: Bisoprololi fumaras 10 mg Acidum acetylsalicylicum 100 mg PP: Bílé tvrdé tobolky s potiskem ASABIS 10/100, velikost 1 Polychlorotrifluoroetylen/PVC
BLOKBIS 10 mg/100 mg 41/262/12-C DR: OK D: ASA PHARMA PLC, DUBLIN, Irsko S: Bisoprololi fumaras 10 mg Acidum acetylsalicylicum 100 mg PP: Bílé tvrdé tobolky s potiskem ASABIS 10/100, velikost 1 Polychlorotrifluoroetylen/PVC
BETAPRES 5 mg/75 mg TOBOLKY
 BETAPRES 10 mg/75 mg TOBOLKY 41/985/10-C DR: OK D: PHARMACEUTICAL WORKS POLPHARMA SA, STAROGARD GDAŇSKI, Polsko S: Bisoprololi fumaras 10 mg Acidum acetylsalicylicum 75 mg PP: Bílé tvrdé tobolky s potiskem
BETAPRES 10 mg/75 mg TOBOLKY 41/985/10-C DR: OK D: PHARMACEUTICAL WORKS POLPHARMA SA, STAROGARD GDAŇSKI, Polsko S: Bisoprololi fumaras 10 mg Acidum acetylsalicylicum 75 mg PP: Bílé tvrdé tobolky s potiskem
PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ: OD DO
 PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ: OD 1.4.2011 DO 30.4.2011 Nové registrace: HALAVEN EU/1/11/678/001-002 D: EISAI EUROPE LTD, HATFIELD, Velká Británie
PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ: OD 1.4.2011 DO 30.4.2011 Nové registrace: HALAVEN EU/1/11/678/001-002 D: EISAI EUROPE LTD, HATFIELD, Velká Británie
Nově registrované přípravky v období: od do
 Nově registrované přípravky v období: od 10.7.2008 do 16.7.2008 Vysvětlivky: ATC - anatomicko-terapeuticko-chemická klasifikace PE - doba použitelnosti v měsících RP - registrační číslo odkazované registrace
Nově registrované přípravky v období: od 10.7.2008 do 16.7.2008 Vysvětlivky: ATC - anatomicko-terapeuticko-chemická klasifikace PE - doba použitelnosti v měsících RP - registrační číslo odkazované registrace
DR: OC RP: 99/118/005-EU1 D: PHARMATHEN S.A., PALLINI ATTIKIS, Řecko S: Leflunomidum 20 mg PP: Žluté, kulaté, bikonvexní, potahované tablety o
 LEFLON 20 mg 29/498/11-C DR: OC RP: 99/118/005-EU1 D: PHARMATHEN S.A., PALLINI ATTIKIS, Řecko S: Leflunomidum 20 mg PP: Žluté, kulaté, bikonvexní, potahované tablety o průměru 8,1 mm a s půlící rýhou na
LEFLON 20 mg 29/498/11-C DR: OC RP: 99/118/005-EU1 D: PHARMATHEN S.A., PALLINI ATTIKIS, Řecko S: Leflunomidum 20 mg PP: Žluté, kulaté, bikonvexní, potahované tablety o průměru 8,1 mm a s půlící rýhou na
DR: OE RP: NL D: SANDOZ S.R.O., PRAHA, Česká republika S: Ceftriaxonum dinatricum trihemihydricum mg
 CEFTRIAXON SANDOZ 1 g 15/634/08-C DR: OE RP: NL D: SANDOZ S.R.O., PRAHA, Česká republika S: Ceftriaxonum dinatricum trihemihydricum 1193.3 mg (odp. Ceftriaxonum 1000 mg) PP: Bílý až nažloutlý prášek. 15
CEFTRIAXON SANDOZ 1 g 15/634/08-C DR: OE RP: NL D: SANDOZ S.R.O., PRAHA, Česká republika S: Ceftriaxonum dinatricum trihemihydricum 1193.3 mg (odp. Ceftriaxonum 1000 mg) PP: Bílý až nažloutlý prášek. 15
ALZIL OROTAB 10 mg ALZIL OROTAB 5 mg
 ALZIL OROTAB 10 mg 06/535/10-C DR: OW RP: 06/122/98-C D: GLENMARK PHARMACEUTICALS S.R.O., PRAHA, Česká republika S: Donepezili hydrochloridum 10 mg (odp. Donepezilum 9.12 mg) PP: Bílé až téměř bílé, kulaté,
ALZIL OROTAB 10 mg 06/535/10-C DR: OW RP: 06/122/98-C D: GLENMARK PHARMACEUTICALS S.R.O., PRAHA, Česká republika S: Donepezili hydrochloridum 10 mg (odp. Donepezilum 9.12 mg) PP: Bílé až téměř bílé, kulaté,
CALCIUM PANTOTHENICUM ZENTIVA
 AGAPURIN SR 400 83/360/07-C D: ZENTIVA A.S., HLOHOVEC, Slovenská republika B: POR TBL PRO 20X400 MG BLI kód SÚKL: 0020026 POR TBL PRO 50X400 MG BLI kód SÚKL: 0020027 POR TBL PRO 100X400 MG BLI kód SÚKL:
AGAPURIN SR 400 83/360/07-C D: ZENTIVA A.S., HLOHOVEC, Slovenská republika B: POR TBL PRO 20X400 MG BLI kód SÚKL: 0020026 POR TBL PRO 50X400 MG BLI kód SÚKL: 0020027 POR TBL PRO 100X400 MG BLI kód SÚKL:
PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ:
 PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ: OD 1.7.2013 DO 31.7.2013 CAPECITABINE SUN 150 mg EU/1/13/831/001 D: SUN PHARMACEUTICAL INDUSTRIES EUROPE B.V., HOOFDDORP,
PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ: OD 1.7.2013 DO 31.7.2013 CAPECITABINE SUN 150 mg EU/1/13/831/001 D: SUN PHARMACEUTICAL INDUSTRIES EUROPE B.V., HOOFDDORP,
APO-PERINDO NEO 10 mg APO-PERINDO NEO 5 mg ATORVASTATIN PFIZER 10 mg POTAHOVANÉ TABLETY
 APO-PERINDO NEO 10 mg 58/299/12-C DR: O RP: 58/163/05-C D: APOTEX EUROPE B.V., LEIDEN, Nizozemsko S: Perindoprilum argininum 10 mg (odp. Perindoprilum 6.79 mg) PP: Zelené kulaté bikonvexní potahované tablety
APO-PERINDO NEO 10 mg 58/299/12-C DR: O RP: 58/163/05-C D: APOTEX EUROPE B.V., LEIDEN, Nizozemsko S: Perindoprilum argininum 10 mg (odp. Perindoprilum 6.79 mg) PP: Zelené kulaté bikonvexní potahované tablety
ESOMEPRAZOLE POLPHARMA
 ESOMEPRAZOLE POLPHARMA 40 mg 09/192/11-C DR: O RP: 09/409/05-C D: PHARMACEUTICAL WORKS POLPHARMA SA, STAROGARD GDAŇSKI, Polsko S: Esomeprazolum natricum 42.5 mg (odp. Esomeprazolum 40 mg) PP: Bílý až téměř
ESOMEPRAZOLE POLPHARMA 40 mg 09/192/11-C DR: O RP: 09/409/05-C D: PHARMACEUTICAL WORKS POLPHARMA SA, STAROGARD GDAŇSKI, Polsko S: Esomeprazolum natricum 42.5 mg (odp. Esomeprazolum 40 mg) PP: Bílý až téměř
GEMCITABINE VIPHARM 1 G
 ARTIZIA 0,075 mg/0,020 mg OBALENÉ TABLETY 17/851/09-C DR: O RP: 17/530/96-C D: ZENTIVA, K.S., PRAHA, Česká republika S: Gestodenum 0.075 mg Ethinylestradiolum 0.02 mg PP: Bílé kulaté bikonvexní lesklé
ARTIZIA 0,075 mg/0,020 mg OBALENÉ TABLETY 17/851/09-C DR: O RP: 17/530/96-C D: ZENTIVA, K.S., PRAHA, Česká republika S: Gestodenum 0.075 mg Ethinylestradiolum 0.02 mg PP: Bílé kulaté bikonvexní lesklé
AMOXICILIN SANDOZ 250 mg/5 ml
 AMOXICILIN SANDOZ 125 mg/5 ml 15/129/10-C DR: OWE D: SANDOZ GMBH, KUNDL, Rakousko S: Amoxicillinum trihydricum 1756.8 mg (odp. Amoxicillinum 1500 mg) PP: Bílý až slabě žlutý prášek s ovocnou vůní. 60 ml
AMOXICILIN SANDOZ 125 mg/5 ml 15/129/10-C DR: OWE D: SANDOZ GMBH, KUNDL, Rakousko S: Amoxicillinum trihydricum 1756.8 mg (odp. Amoxicillinum 1500 mg) PP: Bílý až slabě žlutý prášek s ovocnou vůní. 60 ml
DR: OW RP: 68/455/99-C
 EQUETA 100 mg 68/027/09-C DR: O RP: 68/455/99-C S: Quetiapini fumaras 115.13 mg (odp. Quetiapinum 100 mg) PP: Žluté, kulaté, bikonvexní potahované tablety s půlicí rýhou na jedné straně o průměru přibližně
EQUETA 100 mg 68/027/09-C DR: O RP: 68/455/99-C S: Quetiapini fumaras 115.13 mg (odp. Quetiapinum 100 mg) PP: Žluté, kulaté, bikonvexní potahované tablety s půlicí rýhou na jedné straně o průměru přibližně
ANASTROZOLE NICHE 1 mg POTAHOVANÉ TABLETY APO-GLIMEPIRID 1 mg
 ANASTROZOLE NICHE 1 mg POTAHOVANÉ TABLETY 44/895/09-C DR: O RP: 44/1296/97-C D: NICHE GENERICS LIMITED, HITCHIN, Velká Británie S: Anastrozolum 1 mg PP: Bílé, kulaté, bikonvexní, potahované tablety. S
ANASTROZOLE NICHE 1 mg POTAHOVANÉ TABLETY 44/895/09-C DR: O RP: 44/1296/97-C D: NICHE GENERICS LIMITED, HITCHIN, Velká Británie S: Anastrozolum 1 mg PP: Bílé, kulaté, bikonvexní, potahované tablety. S
APO-ATORVASTATIN 10 mg POTAHOVANÉ TABLETY 31/182/10-C DR: O RP: 31/233/99-C D: APOTEX EUROPE BV, LEIDEN, Nizozemsko S: Atorvastatinum calcicum
 APO-ATORVASTATIN 10 mg POTAHOVANÉ TABLETY 31/182/10-C DR: O RP: 31/233/99-C D: APOTEX EUROPE BV, LEIDEN, Nizozemsko S: Atorvastatinum calcicum propylenglycolum 11 mg (odp. Atorvastatinum 10 mg) PP: Bílé,
APO-ATORVASTATIN 10 mg POTAHOVANÉ TABLETY 31/182/10-C DR: O RP: 31/233/99-C D: APOTEX EUROPE BV, LEIDEN, Nizozemsko S: Atorvastatinum calcicum propylenglycolum 11 mg (odp. Atorvastatinum 10 mg) PP: Bílé,
PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ:
 PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ: OD 1.1.2012 DO 31.1.2012 Nové registrace: AMELUZ EU/1/11/740/001 D: BIOFRONTERA BIOSCIENCE GMBH, LEVERKUSEN, Německo
PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ: OD 1.1.2012 DO 31.1.2012 Nové registrace: AMELUZ EU/1/11/740/001 D: BIOFRONTERA BIOSCIENCE GMBH, LEVERKUSEN, Německo
AMBEX ANTABUS APO-PAROX ASICORD 1mg/ml KONCENTRÁT PRO INFUZNÍ ROZTOK BIOPAROX CALTRATE PLUS
 AMBEX 52/031/06-C D: WALMARK, A.S., TŘINEC, Česká republika B: POR TBL EFF 10X60MG TBC kód SÚKL: 0100425 POR TBL EFF 20X60MG TBC kód SÚKL: 0100426 ZR: Změna v označení na obalu ANTABUS 87/131/76-C D: ACTAVIS
AMBEX 52/031/06-C D: WALMARK, A.S., TŘINEC, Česká republika B: POR TBL EFF 10X60MG TBC kód SÚKL: 0100425 POR TBL EFF 20X60MG TBC kód SÚKL: 0100426 ZR: Změna v označení na obalu ANTABUS 87/131/76-C D: ACTAVIS
PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ:
 PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ: OD 1.8.2013 DO 31.8.2013 ATOSIBAN SUN EU/1/13/852/001 D: SUN PHARMACEUTICAL INDUSTRIES EUROPE B.V., HOOFDDORP, Nizozemsko
PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ: OD 1.8.2013 DO 31.8.2013 ATOSIBAN SUN EU/1/13/852/001 D: SUN PHARMACEUTICAL INDUSTRIES EUROPE B.V., HOOFDDORP, Nizozemsko
AMISULPRID SUBSTIPHARM 50 mg TABLETY
 AMISULPRID SUBSTIPHARM 100 mg TABLETY 68/461/10-C DR: O RP: 68/011/01-C D: SUBSTIPHARM DEVELOPPEMENT, PARIS, Francie S: Amisulpridum 100 mg PP: Bílé, kulaté, ploché zkosené tablety s půlicí rýhou na obou
AMISULPRID SUBSTIPHARM 100 mg TABLETY 68/461/10-C DR: O RP: 68/011/01-C D: SUBSTIPHARM DEVELOPPEMENT, PARIS, Francie S: Amisulpridum 100 mg PP: Bílé, kulaté, ploché zkosené tablety s půlicí rýhou na obou
DR: OE RP: DE. S: Allopurinolum 300 mg
 ALOPURINOL SANDOZ 100 mg 29/177/09-C DR: OE RP: DE D: SANDOZ S.R.O., PRAHA, Česká republika S: Allopurinolum 100 mg PP: Bílá kulatá bikonvexní tableta s půlící rýhou na jedné straně. Tabletu lze dělit
ALOPURINOL SANDOZ 100 mg 29/177/09-C DR: OE RP: DE D: SANDOZ S.R.O., PRAHA, Česká republika S: Allopurinolum 100 mg PP: Bílá kulatá bikonvexní tableta s půlící rýhou na jedné straně. Tabletu lze dělit
 CYCLOHEXAL 100 59/281/10-C DR: L D: HEXAL PHARMA AG, HOLZKIRCHEN, Německo S: Ciclosporinum 100 mg PP: Červenohnědé podlouhlé měkké tobolky (velikost 20) s laserem vytištěným logem Hexalu a "100", obsahující
CYCLOHEXAL 100 59/281/10-C DR: L D: HEXAL PHARMA AG, HOLZKIRCHEN, Německo S: Ciclosporinum 100 mg PP: Červenohnědé podlouhlé měkké tobolky (velikost 20) s laserem vytištěným logem Hexalu a "100", obsahující
ALVOMONT 5 mg ŽVÝKACÍ TABLETY
 ALVOMONT 10 mg POTAHOVANÉ TABLETY 14/420/11-C DR: O RP: 14/351/99-C D: ALVOGEN IPCO S.AR.L., LUXEMBOURG, Lucembursko S: Montelukastum natricum 10.4 mg (odp. Montelukastum 10 mg) PP: Světležluté až béžové,
ALVOMONT 10 mg POTAHOVANÉ TABLETY 14/420/11-C DR: O RP: 14/351/99-C D: ALVOGEN IPCO S.AR.L., LUXEMBOURG, Lucembursko S: Montelukastum natricum 10.4 mg (odp. Montelukastum 10 mg) PP: Světležluté až béžové,
DEPAKINE CHRONOSPHERE
 CELASKON 100 mg OCHUCENÉ TABLETY 86/339/10-C DR: L D: ZENTIVA, K.S., PRAHA, Česká republika S: Acidum ascorbicum 100 mg PP: Mramorované oranžovo-téměř bílé čočkovité tablety o průměru 9 mm. Bílá HDPE lahvička
CELASKON 100 mg OCHUCENÉ TABLETY 86/339/10-C DR: L D: ZENTIVA, K.S., PRAHA, Česká republika S: Acidum ascorbicum 100 mg PP: Mramorované oranžovo-téměř bílé čočkovité tablety o průměru 9 mm. Bílá HDPE lahvička
ANTISTAX 360 mg POTAHOVANÉ TABLETY
 ANTISTAX 180 mg POTAHOVANÉ TABLETY 94/378/09-C DR: S D: BOEHRINGER INGELHEIM INTERNATIONAL GMBH, INGELHEIM AM RHEIN, Německo S: Vitis viniferae folii extractum aquos.siccum 180 mg PP: Hnědavě červené,
ANTISTAX 180 mg POTAHOVANÉ TABLETY 94/378/09-C DR: S D: BOEHRINGER INGELHEIM INTERNATIONAL GMBH, INGELHEIM AM RHEIN, Německo S: Vitis viniferae folii extractum aquos.siccum 180 mg PP: Hnědavě červené,
 ALLOPURINOL TEVA 100 mg 29/598/10-C DR: OE RP: UK D: TEVA PHARMACEUTICALS CR, S.R.O., PRAHA, Česká republika S: Allopurinolum 100 mg PP: Bílé kulaté bikonvexní tablety, z jedné strany vyryto 4K1, z druhé
ALLOPURINOL TEVA 100 mg 29/598/10-C DR: OE RP: UK D: TEVA PHARMACEUTICALS CR, S.R.O., PRAHA, Česká republika S: Allopurinolum 100 mg PP: Bílé kulaté bikonvexní tablety, z jedné strany vyryto 4K1, z druhé
HYDROCORTISON VUAB 100 mg DR: O RP: 56/468/69-C D: VUAB PHARMA A.S., ROZTOKY, Česká republika S: Hydrocortisoni natrii succinas mg (odp.
 HYDROCORTISON VUAB 100 mg 56/690/10-C DR: O RP: 56/468/69-C D: VUAB PHARMA A.S., ROZTOKY, Česká republika S: Hydrocortisoni natrii succinas 133.7 mg (odp. Hydrocortisonum 100 mg) PP: Bílý až téměř bílý
HYDROCORTISON VUAB 100 mg 56/690/10-C DR: O RP: 56/468/69-C D: VUAB PHARMA A.S., ROZTOKY, Česká republika S: Hydrocortisoni natrii succinas 133.7 mg (odp. Hydrocortisonum 100 mg) PP: Bílý až téměř bílý
PRO PŘÍPRAVU PERORÁLNÍHO ROZTOKU
 BIOFENAC 100 mg POTAHOVANÉ TABLETY 29/445/11-C DR: OE RP: S D: IVOWEN LIMITED, CLONMEL, Irsko S: Aceclofenacum 100 mg PP: Bílé, kulaté, bikonvexní potahované tablety o průměru 8 mm, na jedné straně vyraženo
BIOFENAC 100 mg POTAHOVANÉ TABLETY 29/445/11-C DR: OE RP: S D: IVOWEN LIMITED, CLONMEL, Irsko S: Aceclofenacum 100 mg PP: Bílé, kulaté, bikonvexní potahované tablety o průměru 8 mm, na jedné straně vyraženo
D: APOTEX EUROPE B.V., LEIDEN, Nizozemsko B: POR TBL FLM 28X320MG BLI kód SÚKL: POR TBL FLM 98X320MG BLI kód SÚKL:
 ADDAMEL N 47/795/92-C D: FRESENIUS KABI AB, UPPSALA, Švédsko B: INF CNC SOL 20X10ML AMP kód SÚKL: 0058287 ZR: Aktualizace modulu 3 APO-VALSARTAN 160 mg 58/336/11-C D: APOTEX EUROPE B.V., LEIDEN, Nizozemsko
ADDAMEL N 47/795/92-C D: FRESENIUS KABI AB, UPPSALA, Švédsko B: INF CNC SOL 20X10ML AMP kód SÚKL: 0058287 ZR: Aktualizace modulu 3 APO-VALSARTAN 160 mg 58/336/11-C D: APOTEX EUROPE B.V., LEIDEN, Nizozemsko
AMITRIPTYLIN-SLOVAKOFARMA
 AMITRIPTYLIN-SLOVAKOFARMA 30/364/98-C D: ZENTIVA A.S., BRATISLAVA, Slovenská republika B: POR TBL FLM 20X28.3MG BLI kód SÚKL: 0087166 POR TBL FLM 50X28.3MG BLI kód SÚKL: 0087167 POR TBL FLM 100X28.3MG
AMITRIPTYLIN-SLOVAKOFARMA 30/364/98-C D: ZENTIVA A.S., BRATISLAVA, Slovenská republika B: POR TBL FLM 20X28.3MG BLI kód SÚKL: 0087166 POR TBL FLM 50X28.3MG BLI kód SÚKL: 0087167 POR TBL FLM 100X28.3MG
ACC INJEKT ACNATAC 10 mg/g + 0,25 mg/g GEL ALENDROGEN 70 mg ANASTRAD 1 mg POTAHOVANÁ TABLETA
 ACC INJEKT 52/507/96-C D: HEXAL AG, HOLZKIRCHEN, Německo B: INJ+INH SOL 5X3ML/300MG AMP kód SÚKL: 0103387 INJ+INH SOL 50X3ML/300MG AMP kód SÚKL: 0103388 INJ+INH SOL 100X3ML/300MG AMP kód SÚKL: 0103389
ACC INJEKT 52/507/96-C D: HEXAL AG, HOLZKIRCHEN, Německo B: INJ+INH SOL 5X3ML/300MG AMP kód SÚKL: 0103387 INJ+INH SOL 50X3ML/300MG AMP kód SÚKL: 0103388 INJ+INH SOL 100X3ML/300MG AMP kód SÚKL: 0103389
PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ:
 PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ: OD 1.4.2014 DO 30.4.2014 Nové registrace: ADEMPAS 0,5 mg EU/1/13/907/001-003 D: BAYER PHARMA AG, BERLÍN, Německo S:
PŘÍPRAVKY REGISTROVANÉ CENTRALIZOVANOU PROCEDUROU VLOŽENÉ DO DATABÁZE SÚKL V OBDOBÍ: OD 1.4.2014 DO 30.4.2014 Nové registrace: ADEMPAS 0,5 mg EU/1/13/907/001-003 D: BAYER PHARMA AG, BERLÍN, Německo S:
D: SOLVAY PHARMACEUTICALS B.V., WEESP, Nizozemsko B: POR TBL FLM 20X10MG BLI kód SÚKL:
 ACYCLOSTAD GALMED 46/337/98-C D: STADA ARZNEIMITTEL AG, BAD VILBEL, Německo B: DRM CRM 1X5 GM/250 MG TUB kód SÚKL: 0048464 DRM CRM 1X20 GM/1 GM TUB kód SÚKL: 0048465 ALPICORT 46/150/94-C D: DR. AUGUST
ACYCLOSTAD GALMED 46/337/98-C D: STADA ARZNEIMITTEL AG, BAD VILBEL, Německo B: DRM CRM 1X5 GM/250 MG TUB kód SÚKL: 0048464 DRM CRM 1X20 GM/1 GM TUB kód SÚKL: 0048465 ALPICORT 46/150/94-C D: DR. AUGUST
ASTEXANA 25 mg CLOPIMYL 75 mg
 ASTEXANA 25 mg 44/436/10-C D: VIPHARM S.A., OŻARÓW MAZOWIECKI, Polsko B: POR TBL FLM 30X25MG BLI kód SÚKL: 0147861 POR TBL FLM 90X25MG BLI kód SÚKL: 0147862 POR TBL FLM 100X25MG BLI kód SÚKL: 0147863 ZR:
ASTEXANA 25 mg 44/436/10-C D: VIPHARM S.A., OŻARÓW MAZOWIECKI, Polsko B: POR TBL FLM 30X25MG BLI kód SÚKL: 0147861 POR TBL FLM 90X25MG BLI kód SÚKL: 0147862 POR TBL FLM 100X25MG BLI kód SÚKL: 0147863 ZR:
DR: O RP: 49/263/00-C D: PRO.MED.CS PRAHA A.S., PRAHA, Česká republika S: Itopridi hydrochloridum 50 mg
 IDARUBICIN TEVA 1 mg/ml 44/579/10-C DR: OW RP: 44/651/92-C D: TEVA PHARMACEUTICALS CR, S.R.O., PRAHA, Česká republika S: Idarubicini hydrochloridum 5 mg v 5 ml PP: Čirý, červenooranžový roztok, bez viditelných
IDARUBICIN TEVA 1 mg/ml 44/579/10-C DR: OW RP: 44/651/92-C D: TEVA PHARMACEUTICALS CR, S.R.O., PRAHA, Česká republika S: Idarubicini hydrochloridum 5 mg v 5 ml PP: Čirý, červenooranžový roztok, bez viditelných
D: ZENTIVA K.S., PRAHA, Česká republika B: POR TBL FLM 100X10MG BLI kód SÚKL: POR TBL FLM 7X10MG BLI kód SÚKL:
 ERCEFURYL 200 mg CPS. 42/622/97-C D: SANOFI-AVENTIS, S.R.O., PRAHA, Česká republika B: POR CPS DUR 14X200MG BLI kód SÚKL: 0046405 ZR: Prodlouženo do 31.7.2012. FAMOSAN 20 mg 09/018/96-A/C B: POR TBL FLM
ERCEFURYL 200 mg CPS. 42/622/97-C D: SANOFI-AVENTIS, S.R.O., PRAHA, Česká republika B: POR CPS DUR 14X200MG BLI kód SÚKL: 0046405 ZR: Prodlouženo do 31.7.2012. FAMOSAN 20 mg 09/018/96-A/C B: POR TBL FLM
Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství. 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fanhdi 50 IU/ml Fanhdi
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství. 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fanhdi 50 IU/ml Fanhdi
Seminář Správné distribuční praxe Pokyn DIS-13 PharmDr. Kamil Kalousek Odbor informačních technologií Odd. Datové podpory SÚKL
 Seminář Správné distribuční praxe [ 1 ] Pokyn DIS-13 PharmDr. Kamil Kalousek Odbor informačních technologií Odd. Datové podpory SÚKL Hlášení dodávek, pokyn DIS-13 ver. 4 [ 2 ] [ 3 ] Právní základ Pokynu
Seminář Správné distribuční praxe [ 1 ] Pokyn DIS-13 PharmDr. Kamil Kalousek Odbor informačních technologií Odd. Datové podpory SÚKL Hlášení dodávek, pokyn DIS-13 ver. 4 [ 2 ] [ 3 ] Právní základ Pokynu
Informace o léčivech, padělcích a nelegálních přípravcích pro zdravotnické pracovníky a provozovatele květen 2017
 spisová zn. sukls143408/2017 Vyřizuje/linka E. Komrsková/213 Datum: 7. 6. 2017 Informace o léčivech, padělcích a nelegálních přípravcích pro zdravotnické pracovníky a provozovatele květen 2017 OPATŘENÍ
spisová zn. sukls143408/2017 Vyřizuje/linka E. Komrsková/213 Datum: 7. 6. 2017 Informace o léčivech, padělcích a nelegálních přípravcích pro zdravotnické pracovníky a provozovatele květen 2017 OPATŘENÍ
 GERATAM 1200 mg 06/868/92-B/C D: UCB PHARMA SA, BRUSEL, Belgie B: POR TBL FLM 20X1200MG BLI kód SÚKL: 0011240 POR TBL FLM 60X1200MG BLI kód SÚKL: 0011242 POR TBL FLM 100X1200MG BLI kód SÚKL: 0011243 ZR:
GERATAM 1200 mg 06/868/92-B/C D: UCB PHARMA SA, BRUSEL, Belgie B: POR TBL FLM 20X1200MG BLI kód SÚKL: 0011240 POR TBL FLM 60X1200MG BLI kód SÚKL: 0011242 POR TBL FLM 100X1200MG BLI kód SÚKL: 0011243 ZR:
Propofol MCT Fresenius 10 mg/ml: Jeden ml obsahuje propofolum 10 mg. Propofol MCT Fresenius 20 mg/ml: Jeden ml obsahuje propofolum 20 mg.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU 1x 50 ml předplněná injekční stříkačka 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Propofol MCT Fresenius 10 mg/ml injekční/infuzní emulze v předplněné injekční stříkačce Propofol MCT Fresenius
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU 1x 50 ml předplněná injekční stříkačka 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Propofol MCT Fresenius 10 mg/ml injekční/infuzní emulze v předplněné injekční stříkačce Propofol MCT Fresenius
Změny v registracích v období: od 20.12.2007 do 27.12.2007
 Změny v registracích v období: od 20.12.2007 do 27.12.2007 Vysvětlivky: PE - doba použitelnosti v měsících ZS - způsob skladování D - držitel rozhodnutí o registraci P - volná prodejnost S - složení rg
Změny v registracích v období: od 20.12.2007 do 27.12.2007 Vysvětlivky: PE - doba použitelnosti v měsících ZS - způsob skladování D - držitel rozhodnutí o registraci P - volná prodejnost S - složení rg
APO-VENLAFAXIN PROLONG
 ACC INJEKT 52/507/96-C D: HEXAL AG, HOLZKIRCHEN, Německo B: INJ SOL 5X3ML/300MG AMP kód SÚKL: 0103387 INJ SOL 50X3ML/300MG AMP kód SÚKL: 0103388 INJ SOL 100X3ML/300MG AMP kód SÚKL: 0103389 ZR: Změna názvu
ACC INJEKT 52/507/96-C D: HEXAL AG, HOLZKIRCHEN, Německo B: INJ SOL 5X3ML/300MG AMP kód SÚKL: 0103387 INJ SOL 50X3ML/300MG AMP kód SÚKL: 0103388 INJ SOL 100X3ML/300MG AMP kód SÚKL: 0103389 ZR: Změna názvu
CEFTAZIDIM STRAGEN 500 mg
 CEFTAZIDIM STRAGEN 1000 mg 15/067/08-C B: INJ PLV SOL 10X1G VIA kód SÚKL: 0024725 ZR: Registrace se zrušuje ke dni právní moci tohoto rozhodnutí (31.1.2010). CEFTAZIDIM STRAGEN 250 mg 15/065/08-C B: INJ
CEFTAZIDIM STRAGEN 1000 mg 15/067/08-C B: INJ PLV SOL 10X1G VIA kód SÚKL: 0024725 ZR: Registrace se zrušuje ke dni právní moci tohoto rozhodnutí (31.1.2010). CEFTAZIDIM STRAGEN 250 mg 15/065/08-C B: INJ
Přípravky, u kterých byla prodloužena platnost rozhodnutí o registraci v období: od do
 Přípravky, u kterých byla prodloužena platnost rozhodnutí o registraci v období: od 13.3.2008 do 19.3.2008 Vysvětlivky: D B (V) - držitel rozhodnutí o registraci - balení, kód SÚKL - zkratka výrobce a
Přípravky, u kterých byla prodloužena platnost rozhodnutí o registraci v období: od 13.3.2008 do 19.3.2008 Vysvětlivky: D B (V) - držitel rozhodnutí o registraci - balení, kód SÚKL - zkratka výrobce a
* Přípravek MabThera s.c. je indikován pouze k léčbě dospělých pacientů s non-hodgkinským lymfomem (NHL):
 Tyto edukační materiály týkající se bezpečného a účinného používání přípravku MabThera 1 400 mg roztoku pro subkutánní injekci (dále jen MabThera s.c.) je příručkou pro lékaře, zdravotní sestry a lékárníky.
Tyto edukační materiály týkající se bezpečného a účinného používání přípravku MabThera 1 400 mg roztoku pro subkutánní injekci (dále jen MabThera s.c.) je příručkou pro lékaře, zdravotní sestry a lékárníky.
Fludeoxythymidine ( 18 F) 1 8 GBq k datu a hodině kalibrace voda na injekci, chlorid sodný 9 mg/ml
 Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
AZIBIOT 500 mg BETADINE CAPECITABINE CIPLA 150 mg POTAHOVANÉ TABLETY CAPECITABINE CIPLA 500 mg POTAHOVANÉ TABLETY
 AZIBIOT 500 mg 15/409/07-C D: KRKA, D.D., NOVO MESTO, NOVO MESTO, Slovinsko B: POR TBL FLM 3X500MG BLI kód SÚKL: 0142164 ZR: Změny v souhrnu údajů o přípravku v souvislosti s aktualizací informací a průběžnou
AZIBIOT 500 mg 15/409/07-C D: KRKA, D.D., NOVO MESTO, NOVO MESTO, Slovinsko B: POR TBL FLM 3X500MG BLI kód SÚKL: 0142164 ZR: Změny v souhrnu údajů o přípravku v souvislosti s aktualizací informací a průběžnou
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE. Docetaxel Hospira 10 mg/ml koncentrát pro přípravu infuzního roztoku Docetaxelum
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls203596/2010 a příloha k sp. zn. sukls106715/2010 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Docetaxel Hospira 10 mg/ml koncentrát pro přípravu
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls203596/2010 a příloha k sp. zn. sukls106715/2010 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Docetaxel Hospira 10 mg/ml koncentrát pro přípravu
Zrušené registrace v období: od do
 Zrušené registrace v období: od 7.2.2008 do 26.3.2008 Vysvětlivky: D B ZR - držitel rozhodnutí o registraci - balení, kód SÚKL - změna v registraci AGAPURIN RETARD 83/031/83-S/C D: ZENTIVA A.S., HLOHOVEC,
Zrušené registrace v období: od 7.2.2008 do 26.3.2008 Vysvětlivky: D B ZR - držitel rozhodnutí o registraci - balení, kód SÚKL - změna v registraci AGAPURIN RETARD 83/031/83-S/C D: ZENTIVA A.S., HLOHOVEC,
Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku)
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ciprobay 200 Infuzní roztok ciprofloxacinum 2. OBSAH LÉČIVÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ciprobay 200 Infuzní roztok ciprofloxacinum 2. OBSAH LÉČIVÉ
Informace o léčivech, padělcích a nelegálních přípravcích pro zdravotnické pracovníky a provozovatele červenec 2019
 spisová zn. sukls200377/2019 Vyřizuje/linka E. Komrsková/213 Datum: 7.8.2019 Informace o léčivech, padělcích a nelegálních přípravcích pro zdravotnické pracovníky a provozovatele červenec 2019 OPATŘENÍ
spisová zn. sukls200377/2019 Vyřizuje/linka E. Komrsková/213 Datum: 7.8.2019 Informace o léčivech, padělcích a nelegálních přípravcích pro zdravotnické pracovníky a provozovatele červenec 2019 OPATŘENÍ
CAVE! Informační dopis pro zdravotnické pracovníky
 CAVE! Informační dopis pro zdravotnické pracovníky říjen 2017 Výpadek léčivého přípravku Trisenox (oxid arzenitý, koncentrát pro infuzní roztok 1 mg/ml): nahrazení léčivým přípravkem Phenasen (injekční
CAVE! Informační dopis pro zdravotnické pracovníky říjen 2017 Výpadek léčivého přípravku Trisenox (oxid arzenitý, koncentrát pro infuzní roztok 1 mg/ml): nahrazení léčivým přípravkem Phenasen (injekční
For Internal Use Only
 Souhrnná informace o přípravku NovoSeven stabilního při pokojové teplotě a návod na připravení roztoku Předmět: Poskytuje souhrnné informace, ke kterým došlo u přípravku NovoSeven stabilního
Souhrnná informace o přípravku NovoSeven stabilního při pokojové teplotě a návod na připravení roztoku Předmět: Poskytuje souhrnné informace, ke kterým došlo u přípravku NovoSeven stabilního
APO-ESCITALOPRAM 10 mg APO-ESCITALOPRAM 15 mg APO-ESCITALOPRAM 20 mg
 APO-ESCITALOPRAM 10 mg 30/415/09-C DR: O RP: 30/276/02-C D: APOTEX EUROPE BV, LEIDEN, Nizozemsko S: Escitaloprami oxalas 12.77 mg (odp. Escitalopramum 9.99 mg) PP: Bílé, kulaté, bikonvexní potahované tablety
APO-ESCITALOPRAM 10 mg 30/415/09-C DR: O RP: 30/276/02-C D: APOTEX EUROPE BV, LEIDEN, Nizozemsko S: Escitaloprami oxalas 12.77 mg (odp. Escitalopramum 9.99 mg) PP: Bílé, kulaté, bikonvexní potahované tablety
AMOXICILLIN/CLAVULANIC ACID AUROBINDO
 AMOXICILLIN/CLAVULANIC ACID AUROBINDO 500 mg/125 mg POTAHOVANÉ TABLETY 15/223/10-C DR: O RP: 15/141/84-B/C D: AUROBINDO PHARMA LIMITED, SOUTH RUISLIP, Velká Británie S: Amoxicillinum trihydricum 573.4
AMOXICILLIN/CLAVULANIC ACID AUROBINDO 500 mg/125 mg POTAHOVANÉ TABLETY 15/223/10-C DR: O RP: 15/141/84-B/C D: AUROBINDO PHARMA LIMITED, SOUTH RUISLIP, Velká Británie S: Amoxicillinum trihydricum 573.4
AKTIFERRIN COMPOSITUM
 ACICLOVIR AL KRÉM 46/336/98-C D: ALIUD PHARMA GMBH, LAICHINGEN, Německo B: DRM CRM 1X2GM/100MG TUB kód SÚKL: 0047714 DRM CRM 1X5GM/250MG TUB kód SÚKL: 0047715 ZR: Změna názvu a/nebo adresy držitele rozhodnutí
ACICLOVIR AL KRÉM 46/336/98-C D: ALIUD PHARMA GMBH, LAICHINGEN, Německo B: DRM CRM 1X2GM/100MG TUB kód SÚKL: 0047714 DRM CRM 1X5GM/250MG TUB kód SÚKL: 0047715 ZR: Změna názvu a/nebo adresy držitele rozhodnutí
APERIXON 0,35 mg TABLETY
 APERIXON 0,088 mg TABLETY 27/427/09-C DR: OC RP: EU/1/97/050/001-002 S: Pramipexoli dihydrochloridum monohydricum 0.125 mg (odp. Pramipexolum 0.088 mg) PP: Bílé, kulaté tablety, označené na jedné straně
APERIXON 0,088 mg TABLETY 27/427/09-C DR: OC RP: EU/1/97/050/001-002 S: Pramipexoli dihydrochloridum monohydricum 0.125 mg (odp. Pramipexolum 0.088 mg) PP: Bílé, kulaté tablety, označené na jedné straně
Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky
 Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky Prof. MUDr. Jitka Abrahámová, DrSc Onkologická klinika TN a 1. LF UK KOC (NNB + VFN + TN) St Gallén 2011 Rozsah onemocnění T, N, M ER, PgR
Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky Prof. MUDr. Jitka Abrahámová, DrSc Onkologická klinika TN a 1. LF UK KOC (NNB + VFN + TN) St Gallén 2011 Rozsah onemocnění T, N, M ER, PgR
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Vnitřní obal (štítek): Rozpouštědlo ve skleněné lahvičce, typ I, obsah 10 ml
 MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Vnitřní obal (štítek): Rozpouštědlo ve skleněné lahvičce, typ I, obsah 10 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ Voda na injekci 10 ml 2. ZPŮSOB
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Vnitřní obal (štítek): Rozpouštědlo ve skleněné lahvičce, typ I, obsah 10 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ Voda na injekci 10 ml 2. ZPŮSOB
Nově registrované přípravky v období: od do
 Nově registrované přípravky v období: od 14.2.2008 do 20.2.2008 Vysvětlivky: ATC - anatomicko-terapeuticko-chemická klasifikace PE - doba použitelnosti v měsících RP - registrační číslo odkazované registrace
Nově registrované přípravky v období: od 14.2.2008 do 20.2.2008 Vysvětlivky: ATC - anatomicko-terapeuticko-chemická klasifikace PE - doba použitelnosti v měsících RP - registrační číslo odkazované registrace
BOOSTRIX INJ. STŘÍKAČKA
 ATROPIN-POS 0,5% D: URSAPHARM S.R.O., ŘÍČANY, Česká republika B: OPH GTT SOL 1X10ML UGT kód SÚKL: 0163314 ZR: Prodlouženo do 31.1.2012. ATROPIN-POS 1% D: URSAPHARM S.R.O., ŘÍČANY, Česká republika B: OPH
ATROPIN-POS 0,5% D: URSAPHARM S.R.O., ŘÍČANY, Česká republika B: OPH GTT SOL 1X10ML UGT kód SÚKL: 0163314 ZR: Prodlouženo do 31.1.2012. ATROPIN-POS 1% D: URSAPHARM S.R.O., ŘÍČANY, Česká republika B: OPH
s energií 172 kev (91 %) a 246 kev (94 %). Vnitřní konverzí vzniká záření rentgenové s energií 23 kev a 26 kev.
 sp.zn. sukls101319/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Indium (In111) Chloride 370 MBq/ml, radionuklidový prekurzor, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Obsah lahvičky k datu a
sp.zn. sukls101319/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Indium (In111) Chloride 370 MBq/ml, radionuklidový prekurzor, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Obsah lahvičky k datu a
Nově registrované přípravky v období od do s ohledem na nabytí právní moci
 Nově registrované přípravky v období od 1.12.2013 do 31.12.2013 s ohledem na nabytí právní moci APO-ESCITALOPRAM 10 mg TABLETY DISPERGOVATELNÉ V ÚSTECH 30/470/13-C DR: O RP: 30/486/10-C D: APOTEX EUROPE
Nově registrované přípravky v období od 1.12.2013 do 31.12.2013 s ohledem na nabytí právní moci APO-ESCITALOPRAM 10 mg TABLETY DISPERGOVATELNÉ V ÚSTECH 30/470/13-C DR: O RP: 30/486/10-C D: APOTEX EUROPE
Informace o léčivech, padělcích a nelegálních přípravcích pro zdravotnické pracovníky a provozovatele červen 2017
 spisová zn. sukls167245/2017 Vyřizuje/linka E. Komrsková/213 Datum: 7.7.2017 Informace o léčivech, padělcích a nelegálních přípravcích pro zdravotnické pracovníky a provozovatele červen 2017 OPATŘENÍ PŘI
spisová zn. sukls167245/2017 Vyřizuje/linka E. Komrsková/213 Datum: 7.7.2017 Informace o léčivech, padělcích a nelegálních přípravcích pro zdravotnické pracovníky a provozovatele červen 2017 OPATŘENÍ PŘI
záření gama s energií 172 kev (91 %) a 246 kev (94 %). Vnitřní konverzí vzniká záření rentgenové s energií 23 kev a 26 kev.
 sp.zn. sukls50264/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Indium (In111) Chloride 370 MBq/ml, radionuklidový prekurzor, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Obsah lahvičky k datu a hodině
sp.zn. sukls50264/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Indium (In111) Chloride 370 MBq/ml, radionuklidový prekurzor, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Obsah lahvičky k datu a hodině
ADIPEX RETARD ALMIRAL GEL AMBEX AMIOHEXAL 200
 ADIPEX RETARD 08/052/91-S/C D: GEROT PHARMAZEUTIKA GMBH, VÍDEŇ, Rakousko B: POR CPS RML 100X15MG BLI kód SÚKL: 0097374 POR CPS RML 30X15MG BLI kód SÚKL: 0097375 ZR: Změna jména a/nebo adresy výrobce/dovozce
ADIPEX RETARD 08/052/91-S/C D: GEROT PHARMAZEUTIKA GMBH, VÍDEŇ, Rakousko B: POR CPS RML 100X15MG BLI kód SÚKL: 0097374 POR CPS RML 30X15MG BLI kód SÚKL: 0097375 ZR: Změna jména a/nebo adresy výrobce/dovozce
kod nazev doplnek uhr1_332 uhr1_333 lim1_332 lim1_333 cp_333 mfc_333
 kod nazev doplnek uhr1_332 uhr1_333 lim1_332 lim1_333 cp_333 mfc_333 0085350 ADVANTAN 1MG/G CRM 15G 47,41 46,03 L L 51,15 77,08 0203007 ADVANTAN 1MG/G CRM 15G 47,41 46,03 L L 51,15 77,08 0085460 ADVANTAN
kod nazev doplnek uhr1_332 uhr1_333 lim1_332 lim1_333 cp_333 mfc_333 0085350 ADVANTAN 1MG/G CRM 15G 47,41 46,03 L L 51,15 77,08 0203007 ADVANTAN 1MG/G CRM 15G 47,41 46,03 L L 51,15 77,08 0085460 ADVANTAN
Informace o léčivech, padělcích a nelegálních přípravcích pro zdravotnické pracovníky a provozovatele březen 2019
 spisová zn. sukls75291/2019 Vyřizuje/linka E. Komrsková/213 Datum: 4.4.2019 Informace o léčivech, padělcích a nelegálních přípravcích pro zdravotnické pracovníky a provozovatele březen 2019 OPATŘENÍ PŘI
spisová zn. sukls75291/2019 Vyřizuje/linka E. Komrsková/213 Datum: 4.4.2019 Informace o léčivech, padělcích a nelegálních přípravcích pro zdravotnické pracovníky a provozovatele březen 2019 OPATŘENÍ PŘI
Trihydrát octanu sodného Kyselina octová Chlorid sodný Hydroxid sodný a/nebo kyselina chlorovodíková pro úpravu ph Voda na injekci
 ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU VAK 250 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Brevibloc 10 mg/ml infuzní roztok Esmololi hydrochloridum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml obsahuje 10 mg esmololi hydrochloridum
ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU VAK 250 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Brevibloc 10 mg/ml infuzní roztok Esmololi hydrochloridum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml obsahuje 10 mg esmololi hydrochloridum
ALGIFEN NEO ANDROCUR-50 ARIONEX COMBI 100/25 mg POTAHOVANÁ TABLETA ARIONEX COMBI 50/12,5 mg POTAHOVANÁ TABLETA BETASERC 8 CALCIUM-SANDOZ FF 1000 mg
 ALGIFEN NEO 73/166/01-C D: TEVA CZECH INDUSTRIES S.R.O., OPAVA-KOMÁROV, Česká republika B: POR GTT SOL 1X25ML LGT kód SÚKL: 0050335 POR GTT SOL 1X10ML LGT kód SÚKL: 0057860 ZR: Změna zkoušek nebo limitů
ALGIFEN NEO 73/166/01-C D: TEVA CZECH INDUSTRIES S.R.O., OPAVA-KOMÁROV, Česká republika B: POR GTT SOL 1X25ML LGT kód SÚKL: 0050335 POR GTT SOL 1X10ML LGT kód SÚKL: 0057860 ZR: Změna zkoušek nebo limitů
Ibumyl Rapid 400 mg, potahované tablety Ibuprofenum (ve formě ibuprofenum lysinicum)
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA NA BLISTRY 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna tableta obsahuje ibuprofenum 400 mg (ve formě ibuprofenum lysinicum). 3. SEZNAM POMOCNÝCH LÁTEK 4. LÉKOVÁ FORMA
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA NA BLISTRY 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna tableta obsahuje ibuprofenum 400 mg (ve formě ibuprofenum lysinicum). 3. SEZNAM POMOCNÝCH LÁTEK 4. LÉKOVÁ FORMA
EDUKAČNÍ MATERIÁLY. KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
Ibandronic Acid Accord 2 mg koncentrát pro infuzní roztok Ibandronic Acid Accord 6 mg koncentrát pro infuzní roztok acidum ibandronicum
 Ibandronic Acid Accord 2 mg koncentrát pro infuzní roztok acidum ibandronicum Máte- Pokud se kterýkoli z než V 1. Ibandronic Acid Accord a k 2. Ibandronic Acid Accord používat 3. Ibandronic Acid Accord
Ibandronic Acid Accord 2 mg koncentrát pro infuzní roztok acidum ibandronicum Máte- Pokud se kterýkoli z než V 1. Ibandronic Acid Accord a k 2. Ibandronic Acid Accord používat 3. Ibandronic Acid Accord
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Glucosum monohydricum
 sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
Biologická léčba karcinomu prsu. Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN)
 Biologická léčba karcinomu prsu Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN) Cílená léčba Ca prsu Trastuzumab (HercepNn) AnN HER2 neu pronlátka LapaNnib (Tyverb)
Biologická léčba karcinomu prsu Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN) Cílená léčba Ca prsu Trastuzumab (HercepNn) AnN HER2 neu pronlátka LapaNnib (Tyverb)
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU, NEBO POKUD NENÍ VNĚJŠÍ OBAL NA VNITŘNÍM OBALU
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU, NEBO POKUD NENÍ VNĚJŠÍ OBAL NA VNITŘNÍM OBALU Papírová krabička; 1 injekční lahvička (2 ml) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml roztoku
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU, NEBO POKUD NENÍ VNĚJŠÍ OBAL NA VNITŘNÍM OBALU Papírová krabička; 1 injekční lahvička (2 ml) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml roztoku
Souhrn údajů o přípravku. 100 ml roztoku obsahuje: glucosum monohydricum 5,5 g ekv.glucosum anhydricum 5,0 g voda na injekci q.s. ad 100 ml ph 3,5 6,5
 Příloha č. 3 ke sdělení sp.zn. sukls24458/2011 a sukls24200/2011 Souhrn údajů o přípravku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 5% Glucose in Water for Injection Fresenius 10% Glucose in Water for Injection Fresenius
Příloha č. 3 ke sdělení sp.zn. sukls24458/2011 a sukls24200/2011 Souhrn údajů o přípravku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 5% Glucose in Water for Injection Fresenius 10% Glucose in Water for Injection Fresenius
Informace o léčivech, padělcích a nelegálních přípravcích pro zdravotnické pracovníky a provozovatele březen 2018
 spisová zn. sukls182235/2018 Vyřizuje/linka E. Komrsková/213 Datum: 6.4.2018 Informace o léčivech, padělcích a nelegálních přípravcích pro zdravotnické pracovníky a provozovatele březen 2018 OPATŘENÍ PŘI
spisová zn. sukls182235/2018 Vyřizuje/linka E. Komrsková/213 Datum: 6.4.2018 Informace o léčivech, padělcích a nelegálních přípravcích pro zdravotnické pracovníky a provozovatele březen 2018 OPATŘENÍ PŘI
KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin. Informace pro lékaře EU
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Listopad 2016 Informace pro lékaře EU Tento léčivý přípravek podléhá dalšímu
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Listopad 2016 Informace pro lékaře EU Tento léčivý přípravek podléhá dalšímu
D: WÖRWAG PHARMA GMBH & CO. KG, BÖBLINGEN, Německo B: POR TBL FLM 10X6.25MGL TBC kód SÚKL: POR TBL FLM 14X6.25MGL TBC kód SÚKL:
 BISACODYL-K D: KRKA, D.D., NOVO MESTO, Slovinsko B: POR TBL OBD 15X5MG BLI kód SÚKL: 0040250 POR TBL OBD 105X5MG BLI kód SÚKL: 0096620 ZR: Prodlouženo do 31.7.2011. CARVEDIGAMMA 12,5 mg D: WÖRWAG PHARMA
BISACODYL-K D: KRKA, D.D., NOVO MESTO, Slovinsko B: POR TBL OBD 15X5MG BLI kód SÚKL: 0040250 POR TBL OBD 105X5MG BLI kód SÚKL: 0096620 ZR: Prodlouženo do 31.7.2011. CARVEDIGAMMA 12,5 mg D: WÖRWAG PHARMA
Léčivé látky: fibrinogenum humanum, thrombinum humanum, aprotininum (syntetické), calcii chloridum
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU VNĚJŠÍ KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Prášky a rozpouštědla pro tkáňové lepidlo Léčivé látky: fibrinogenum humanum, thrombinum humanum, aprotininum (syntetické), calcii
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU VNĚJŠÍ KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Prášky a rozpouštědla pro tkáňové lepidlo Léčivé látky: fibrinogenum humanum, thrombinum humanum, aprotininum (syntetické), calcii
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 OZNAČENÍ NA OBALU ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Text na krabičku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU suspenze Paracetamolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum 120 mg v 5 ml suspenze 3. SEZNAM
OZNAČENÍ NA OBALU ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Text na krabičku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU suspenze Paracetamolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum 120 mg v 5 ml suspenze 3. SEZNAM
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Haemophilus influenzae type b polysaccharide
 sp. zn. sukls37951/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci jedna dávka (0,5 ml) obsahuje:
sp. zn. sukls37951/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci jedna dávka (0,5 ml) obsahuje:
Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls155530/2010 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE
 Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls155530/2010 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Docefim 20 mg/1 ml koncentrát pro přípravu infuzního roztoku docetaxelum Přečtěte si pozorně celou
Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls155530/2010 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Docefim 20 mg/1 ml koncentrát pro přípravu infuzního roztoku docetaxelum Přečtěte si pozorně celou
Příloha II. Vědecké závěry a zdůvodnění změny v registraci
 Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls59594/25009, a příloha k sp.zn.: sukls230271/2012 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls59594/25009, a příloha k sp.zn.: sukls230271/2012 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek
Edukační materiály. KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře
 Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Příbalová informace: informace pro pacienta. Docetaxel EGIS 20 mg/ml koncentrát pro infuzní roztok docetaxelum
 Příloha č. 1 k rozhodnutí o registrace sp. zn. sukls129845/2011 Příbalová informace: informace pro pacienta Docetaxel EGIS 20 mg/ml koncentrát pro infuzní roztok docetaxelum Přečtěte si pozorně celou příbalovou
Příloha č. 1 k rozhodnutí o registrace sp. zn. sukls129845/2011 Příbalová informace: informace pro pacienta Docetaxel EGIS 20 mg/ml koncentrát pro infuzní roztok docetaxelum Přečtěte si pozorně celou příbalovou
Příbalová informace: informace pro uživatele. Zoledronic acid medac 4 mg/100 ml infuzní roztok. Acidum zoledronicum
 Příbalová informace: informace pro uživatele Zoledronic acid medac 4 mg/100 ml infuzní roztok Acidum zoledronicum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tento přípravek podáván,
Příbalová informace: informace pro uživatele Zoledronic acid medac 4 mg/100 ml infuzní roztok Acidum zoledronicum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tento přípravek podáván,
Pokyny pro podávání přípravku a sledování pacienta
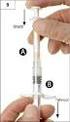 Pokyny pro podávání přípravku a sledování pacienta Informace pro lékaře a zdravotní sestry Červenec 2011 2 Úvod Tato příručka je určena předepisujícím lékařům a zdravotním sestrám a poskytuje praktický
Pokyny pro podávání přípravku a sledování pacienta Informace pro lékaře a zdravotní sestry Červenec 2011 2 Úvod Tato příručka je určena předepisujícím lékařům a zdravotním sestrám a poskytuje praktický
5% GLUCOSE IN WATER FOR INJECTION FRESENIUS 76/366/96-A/C D: FRESENIUS KABI ITALIA S.R.L., VERONA, Itálie B: INF SOL 1X100ML-SKL LAG kód SÚKL:
 5% GLUCOSE IN WATER FOR INJECTION FRESENIUS 76/366/96-A/C D: FRESENIUS KABI ITALIA S.R.L., VERONA, Itálie B: INF SOL 1X100ML-SKL LAG kód SÚKL: 0146609 INF SOL 1X250ML-SKL LAG kód SÚKL: 0146610 INF SOL
5% GLUCOSE IN WATER FOR INJECTION FRESENIUS 76/366/96-A/C D: FRESENIUS KABI ITALIA S.R.L., VERONA, Itálie B: INF SOL 1X100ML-SKL LAG kód SÚKL: 0146609 INF SOL 1X250ML-SKL LAG kód SÚKL: 0146610 INF SOL
Popis přípravku : Prášek: bílý lyofilizát. Rozpouštědlo: čirá bezbarvá tekutina
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls118033/2010
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls118033/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cardioxane prášek pro přípravu infuzního roztoku. 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls118033/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cardioxane prášek pro přípravu infuzního roztoku. 2. KVALITATIVNÍ A KVANTITATIVNÍ
 AIRATHON 4 mg GRANULE 14/452/11-C D: MERCK SHARP & DOHME B.V., HAARLEM, Nizozemsko B: POR GRA 7X4MG SCC kód SÚKL: 0187455 POR GRA 20X4MG SCC kód SÚKL: 0187456 POR GRA 28X4MG SCC kód SÚKL: 0187457 POR GRA
AIRATHON 4 mg GRANULE 14/452/11-C D: MERCK SHARP & DOHME B.V., HAARLEM, Nizozemsko B: POR GRA 7X4MG SCC kód SÚKL: 0187455 POR GRA 20X4MG SCC kód SÚKL: 0187456 POR GRA 28X4MG SCC kód SÚKL: 0187457 POR GRA
FLUDEOXYGLUKOSA INJ MBq/ml Injekční roztok
 sp.zn. sukls347612/2018 Příbalová informace: informace pro pacienta FLUDEOXYGLUKOSA INJ. 100-1500 MBq/ml Injekční roztok Fludeoxyglucosum ( 18 F) Přečtěte si pozorně celou příbalovou informaci dříve, než
sp.zn. sukls347612/2018 Příbalová informace: informace pro pacienta FLUDEOXYGLUKOSA INJ. 100-1500 MBq/ml Injekční roztok Fludeoxyglucosum ( 18 F) Přečtěte si pozorně celou příbalovou informaci dříve, než
