DOMÁCÍ CHEMICKÉ POKUSY (soubor pracovních listů)
|
|
|
- Pavel Kučera
- před 10 lety
- Počet zobrazení:
Transkript
1 Inovace profesní přípravy budoucích učitelů chemie CZ.1.07/2.2.00/ DOMÁCÍ CHEMICKÉ POKUSY (soubor pracovních listů) Doc. RNDr. Marie Solárová, Ph.D. Katedra chemie PřF OU Studijní materiál pro studenty učitelství chemie PřF UP v Olomouci 2011
2 OBSAH: Úvod Chemický pokus a jeho charakteristika Realizace chemického pokusu Přípravná fáze Realizační fáze Hodnotící fáze Bezpečnost práce při realizaci chemického pokusu Používání chemických látek a přípravků ve škole (demonstrační žákovské pokusy) Domácí chemické pokusy Pravidla pro realizaci domácího chemického pokusu Krátkodobý a dlouhodobý chemický pokus Výhody domácího chemického pokusu Nevýhody domácího chemického pokusu Krátkodobé domácí chemické pokusy Dlouhodobé domácí chemické pokusy Možnosti posilování klíčových kompetencí žáků pomocí domácích chemických pokusů Citovaná a doporučená literatura k realizaci domácích chemických pokusů
3 Úvod Chemie patří k vyučovacím předmětům, které mají k dispozici velké množství motivačních prvků pro zvýšení zájmu žáků a pochopení učiva. Jedním z nich je chemický pokus. Ten je jedním z nejvýznamnějších prvkem vyučovacích metod v chemii. Na základě pokusů se dosahuje skutečného poznání látek, jejich vlastností a pochopení vzájemných vztahů mezi nimi. Jestliže v rozvoji chemie jako vědy a v poznání přírody vůbec sehrály chemické pokusy důležitou roli, pak je zcela logické, že při vyučování základům chemické vědy ve škole sehrává experimentální činnost adekvátní úlohu. Současná škola se potýká s mnoha obtížemi, které brání zavádění chemického pokusu do výuky v prvé řadě se jedná o ekonomickou stránku a bezpečnost práce. Východiskem z této situace může být zavádění tzv. domácích pokusů (krátkodobých i dlouhodobých), které umožňují žákům provádět pokusy doma s chemikáliemi, které najdou v obchodě s potravinami, drogérii či lékárně. Cílem této práce je přiblížit studentům učitelství chemie možnosti, jak realizovat domácí pokusy v praxi. Závěr bude patřit praktické ukázce realizace vybraných domácích pokusů zaměřených na motivační otázky směřující k posilování klíčových kompetencí žáků. Marie Solárová 3
4 1 Chemický pokus a jeho charakteristika Chemický pokus by měl být základem každé vyučovací hodiny, která umožňuje jeho realizaci. Při realizaci chemického pokusu probíhá smyslové vnímání, přímé pozorování, abstraktní myšlení. Chemický pokus je modelem, pomocí kterého žáci získávají představu o průběhu chemického děje. Jako každý model, je i chemický pokus zjednodušením skutečnosti nebo naopak zvýrazněním určité podmínky či děje. Není možné prezentovat žákům autentický chemický děj probíhající v průmyslu či přírodě. Není v silách učitele v laboratorních podmínkách přesně danou situaci simulovat. Proto mluvíme o chemickém pokusu v podmínkách laboratoře, školní třídy či domácího prostředí. Absence školního pokusu vede k povrchnímu učení se žáků. Žák nevidí v učivu chemie spojení s praxí, nevnímá užitečnost a potřebu učit se chemická pravidla pro použití v běžném životě. Funkci chemického pokusu lze klasifikovat buď podle cíle vyučovací hodiny nebo fáze vyučovací hodiny Funkce chemického pokusu podle cíle vyučovací hodiny Vzhledem k výchovně vzdělávacím cílům vyučování chemie má chemický pokus dvojí funkci, a to funkci informativní a funkci formativní. 1. Informativní funkce zahrnuje soubor informací, které žáci získávají během realizace pokusu. 2. Formativní funkce s sebou nese určité psychologické aspekty, které mají vliv na duševní a intelektuální vývoj jedince Funkce chemického pokusu podle fáze vyučovací hodiny Chemický pokus plní mnoho funkcí, a to: názornosti, přiměřenosti, aplikační a fixační Citovaná a doporučená literatura 1. GANAJOVÁ, M. Vybrané kapitoly zo všeobecnej didaktiky chémie. UPJS: Košice, SOLÁROVÁ, M. Význam praktické výuky. NIDV: Praha, MOKREJŠOVÁ, O. Moderní výuka chemie. TRITON : Kroměříž,
5 2 Realizace chemického pokusu K tomu, aby plnil chemický pokus svou funkci, musí zahrnovat tři fáze přípravnou, realizační a hodnotící, jejichž dodržování zajistí efektivní průběh. Pokud učitel jednu z uvedených fází vynechá (jistě nelze očekávat, že by šlo o vynechání fáze realizační mám na mysli spíše zanedbání přípravy nebo zhodnocení pokusu po jeho průběhu), chemický pokus svou roli nesplní. V další části této kapitoly se budeme stručně jednotlivým fázím věnovat. 2.1 Přípravná fáze V rámci přípravné fáze musí učitel zvažovat několik faktorů, které jsou pro úspěšný průběh chemického pokusu nezbytné. Podle Ganajové (2009) je přípravná fáze určena: 1. Cílem učitel musí zvažovat aspekt vědomostní, zručnostní, návykový a v neposlední řadě i výchovný. 2. Určení chemické podstaty pokusu v této části učitel uvažuje, která z chemických reakcí by byla vzhledem k cílům a možnostem nejvhodnější. Při výběru musí hodnotit především z hlediska didaktického (výchozí a cílový stav vědomostí, zručností a návyků), ekonomického, časového, výraznosti pozorovaných efektů, dostupnosti chemikálií a pomůcek, bezpečnosti práce, chemické jednoduchosti a didaktických principů. 3. Určení způsobu realizace chemického pokusu učitel musí promyslet, jak bude chemický experiment realizovat (v reálu, pomocí videa, PC programů apod.). 4. Určení způsobu začlenění do učebního procesu rozhodování, ve které fázi bude chemický pokus realizován. 5. Příprava materiálu je vhodné vše nachystat s předstihem. 6. Pokyny pro žáky pokud učitel provádí pokus sám, musí si připravit komentář tak, aby žáci neztráceli pozornost, ale ani aby on sám svým komentářem žáky od pozorování pokusu neodpoutal. Pokud mají pokus provádět žáci, jsou pokyny pro ně zahrnuty do dílčích kroků, které žáci musí dodržovat. 5
6 2.1.1 Příprava organizace chemického pokusu Organizace v rámci přípravné fáze je důležitým krokem, který učitel nesmí opomenout. Pro ilustraci jsou uvedeny základní body: Výběr varianty pokusu, náročnost, pochopitelnost, názornost, bezpečnost. 2.2 Realizační fáze 1. V rámci realizační fáze musí učitel především konkretizovat cíle a chemický pokus realizovat postupnými kroky (současně musí usměrňovat pozornost a myšlenkové činnosti žáků, aktivovat žáky k částečným formulacím jejich odpovědí apod.). Při realizaci demonstračního pokusu musí učitel správně sestavit aparaturu (z pohledu žáků ve směru chemické reakce) a správně pokus komentovat (jeho projev musí být přiměřený, učitel nesmí komentovat průběh pokusu podmiňovacím způsobem, pokud to nevyžadují zvláštní okolnosti učitel neprozrazuje výsledek předem, při neúspěšné realizaci pokusu je nutno neúspěch zdůvodnit, nevnucovat žákovi to, co nevidí). 2.3 Hodnotící fáze Hodnotící fáze začíná ukončením pokusu. Žák si musí udělat závěr toho, co viděl a spojit s informacemi, které slyšel Citovaná a doporučená literatura 1. GANAJOVÁ, M. Vybrané kapitoly zo všeobecnej didaktiky chémie. UPJS: Košice, SOLÁROVÁ, M. Význam praktické výuky. NIDV: Praha, SOLÁROVÁ, M. Experiment ve výuce chemie. OU : Ostrava, elektronický text, KLEČKOVÁ, M. Chemické pokusy pro studenty středních škol. Alga Press: Olomouc, ISBN
7 3 Bezpečnost práce při realizaci chemického pokusu Při plánování a realizaci chemického pokusu je nezbytně nutné, aby učitel respektoval bezpečnost práce danou zákonem č. 356/2003 Sb. se všemi příslušnými vyhláškami a zákonnými normami Předpisy bezpečnosti práce Používání chemických látek je upraveno především těmito právními předpisy: Zákon č. 356/2003 Sb., o chemických látkách a chemických přípravcích a o změně některých zákonů. Zákon č. 440/2008 Sb., úplné znění zákona č. 356/2003 Sb., o chemic-kých látkách a chemických přípravcích a o změně některých zákonů, jak vyplývá z pozdějších změn Zákon č. 258/2000 Sb., o ochraně veřejného zdraví, ve znění pozdějších předpisů Vyhláška č. 288/2003 Sb., kterou se stanoví práce a pracoviště, které jsou zakázány těhotným ženám, matkám do konce devátého měsíce po porodu a mladistvým a podmínky, za nichž mohou mladiství výjimečně tyto práce konat z důvodu přípravy na povolání Zákon č. 237/2000 Sb., kterým se mění zákon č. 133/1985 Sb., o požární ochraně, ve znění pozdějších předpisů, ve znění zákona č. 267/2006 Sb. Zákon č. 185/2001 Sb., o odpadech a o změně některých dalších zákonů, ve znění pozdějších předpisů Nařízení vlády č. 11/2002 Sb., kterým se stanoví vzhled a umístění bezpečnostních značek a zavedení signálů, ve znění pozdějších předpisů 3.2 Používání chemických látek a přípravků ve škole (demonstrační a žákovské pokusy) V případě demonstrace používá chemickou látku osoba starší osmnácti let učitel, takže se na jednotlivé látky nevztahuje věkové omezení. Omezení při práci s chemickými látkami vyplývají z vyhlášky č. 288/2003 Sb., kterou se stanoví práce a pracoviště, které jsou zakázány těhotným ženám, matkám do konce devátého měsíce po porodu a mladistvým, a podmínky, za nichž mohou mladiství výjimečně tyto práce konat z důvodu přípravy na povolání. 7
8 Použití chemických látek a přípravků ve výuce pro žákovský experiment vychází z věkových omezení žáků, klasifikace používaných látek a z vyhlášky č.288/2003 Sb. Změna zákona č. 258/2000 Sb., o ochraně veřejného zdraví a o změně některých souvisejících zákonů atd. ( 44a) upravuje nakládání s chemickými látkami ve škole takto: žáci starší 15 let a mladší 18 let smějí nakládat s NCHLaP klasifikovanými jako toxické a žíravé jen v rámci přípravy na povolání pod přímým dozo-rem odpovědné osoby (tzn. i učitelem nechemikem) s chemickými látkami nebo přípravky klasifikovanými jako vysoce toxické mohou nakládat jen v rámci přípravy na povolání pod přímým dohledem osoby s odbornou způsobilostí (tzn. jen aprobovaným chemikem) Citovaná a doporučená literatura 1. ČECH, J. Pravidla o bezpečnosti, ochraně zdraví a životního prostředí při práci s nebezpečnými chemickými látkami a chemickými přípravky. Ostrava: DUŠEK, B. Chemický pokus a bezpečnost práce. Pedagogická orientace č. 2, SOLÁROVÁ, M. Chemické pokusy 1 Základy laboratorní techniky. Ostrava: Elektronický text 4. Zákon 356/2003 Sb. a výše citované zákony a vyhlášky. 8
9 4 Domácí chemické pokusy Domácím chemickým pokusem označujeme většinou takový pokus, který lze připravit i v domácích podmínkách (za použití látek běžně dostupných). Domácí chemický pokus však lze realizovat také ve školních podmínkách. Platí pro něj stejná pravidla a stejné zákonitosti jako pro klasický školní chemický pokus. Jak lze domácí chemický pokus realizovat? 4.1 Pravidla pro realizaci domácího chemického pokusu Realizace domácího chemického pokusu vyžaduje zvýšenou opatrnost. Učitel, který žákům zadá domácí pokus, musí respektovat jistá pravidla, a to: 1. Pravidlo bezpečnosti domácí pokus musí být zcela bezpečný a nezávadný. 2. Pravidlo výběru chemikálií výběr chemikálií musí být z nabídky domácích surovin, tj. potravin, výrobků z drogerie apod. 3. Pravidlo jednoduchosti pokus nesmí být náročný co do realizace ani obsahu. 4. Pravidlo jednoznačnosti pokus musí jasně sledovat svůj cíl. 5. Pravidlo chemického vnímání i když je pokus realizován z domácích surovin, nesmí se jeho chemická podstata vytratit. 4.2 Krátkodobý a dlouhodobý chemický pokus Některé chemické pokusy, které se dají realizovat v domácích podmínkách, trvají jen malou chvíli, jiné několik dní. Z tohoto hlediska dělíme pokusy na: krátkodobé jejich průběh je rychlý, výsledek reakce je vidět okamžitě dlouhodobé mají pomalý průběh (od 1 dne po několik týdnů) Příklady pokusů budou podrobně popsány níže. Pro oba typy platí ale pravidlo pečlivého zápisu (vypracování laboratorního protokolu) s chemickou analýzou probíhajícího děje. 4.3 Výhody domácího chemického pokusu Domácí chemický pokus má řadu výhod z pohledu: ekonomického domácí suroviny jsou vesměs levnější než chemikálie bezpečnostního domácí pokusy lze realizovat ze surovin běžně dostupných. Výjimkou je pouze HCL, kterou je nutno k realizaci pokusu ředit (upozornění je uvedeno pod každým pokusem uvedeným v této studijní opoře) 9
10 časového žák si může pokus provádět kdy chce myšlenkového pokus lze libovolně často opakovat, a tím průběh pokusu pochopit. 4.4 Nevýhody domácího chemického pokusu Výhody domácího chemického pokusu jsou popisovány v rámci celé této kapitoly. V rámci objektivity však je třeba se zmínit i o jeho nevýhodách. V prvé řadě se jedná o nepochopení podstaty pokusu. Pokud chemický pokus provádí žák ve třídě nebo v laboratoři, vždy je poblíž učitel, který mu s vysvětlením pomůže. Hrozí záměna chemikálií a tím pádem neúspěšný průběh pokusu. Pokud je pokus kvantitativní a žák nemá vhodné váhy, nemůže pokus dobře provádět. Provádět pokus bez dozoru učitele vyžaduje od žáka také pevnou vůli přinutit se pokus provést Citovaná a doporučená literatura 1. SOLÁROVÁ, M. Pokusy chemického jarmarku. PřF OU: Ostrava,
11 5 Krátkodobé domácí chemické pokusy Krátkodobé chemické pokusy lze realizovat, jak již bylo řečeno, pomocí chemikálií, které lze najít v kuchyni, drogerii nebo lékárně. Také chemické sklo, které se běžně používá v chemické laboratoři, lze nahradit sadou kuchyňského nádobí. Přehled některých krátkodobých domácích pokusů je uveden níže Cukrová duha Pomůcky: 4 ks malá sklenice, 1 větší (vyšší) sklenice, potravinářské barvivo, kuchyňská polévková lžíce Chemikálie: cukr, H 2 O Postup: Do čtyř malých skleniček postupně dáme 1, 2, 3 a 4 vrchovaté polévkové lžíce cukru. Do všech sklenic přidáme stejné objemy (2 polévkové lžíce) vody. Potom přidáme špetku potravinářského barviva (různé barvy) do každé ze sklenic a řádně promícháme. Pokus vznikne hustá kaše, přidáme malé množství vody (musíme přidat stejný objem vody do všech sklenic). Potom opatrně sléváme roztoky do velké sklenice (od nejkoncentrovanější po nejméně koncentrovanou) tak, aby se roztoky nepromíchaly. Závěr: Vznikne duha vytvořená v důsledku nemísitelnosti různě koncentrovaných roztoků. Vodní ohňostroj Pomůcky: vysoká sklenice, malá skleničky, vidlička Chemikálie: voda, potravinářské barvivo, olej Postup: Naplňte vysokou sklenici vodou až téměř k vrcholu. Nasypte trochu červeného potravinářského barviva do malé nádoby a přidejte trochu vody, aby se barvivo rozpustilo. Poté k barvivu přidejte trochu (1-2 polévkové lžíce) oleje. Totéž proveďte i s modrým potravinářským barvivem. Rozmíchejte olej a potravinářské barvivo vidličkou tak, aby se z velkých kapek staly malé. 11
12 Nalijte směs oleje a potravinářského barviva do vysoké sklenice. Nyní pozorujte, co se děje ve sklenici. Poznámka: Pokus je vhodný na zjišťování rozpustnosti látek v polárních a nepolárních rozpouštědlech Prskavky pod vodou Pomůcky: větší nádoba na vodu, zápalky, izolepa (raději širší) Chemikálie: prskavka Postup: Prskavku do 1/3 obalíme dosti silnou vrstvou izolepy tu část prskavky, která je pokryta reakční směsí (konec obalené části prskavky necháme volný, neobalený). Potom prskavku zapálíme a ponoříme do vody tak, aby byla ponořena jen obalená část prskavky. Prskavka hoří i pod vodou, po vyhoření směsi pod izolepou i nad vodou. Pokus ukazuje, že látky obsahující sloučeniny bohaté na kyslík hoří i pod vodou (prskavka obsahuje směs dusičnanů) Indikátorová hra s barvami Pomůcky: 4 baňky (skleniček stejné velikosti) Chemikálie: vývar z červeného zelí, ocet, nasycený roztok jedlé sody Postup: První baňku naplňte do výše 1 cm vodou a přikápněte několik ml kapek indikátoru. Do druhé baňky roztok jedlé sody, do třetí ocet a vodu (stejného objemu jako objem předcházející baňky. Poslední naplníme asi stejným objemem octa. Poznámka: Obsah baněk přeléváme postupně z jedné do druhé, bude barevná změna podle měnícího se ph roztoků Fyzikální vlastnosti vody a vzduchu Pomůcky: PET láhev, slánka, plastelína, větší skleněná nádoba, širší skleněná láhev, nafukovací balónek, nůžky, gumička, vysoká úzká sklenička, drát (provázek), velká sklenice (zavařovací 3 l) Chemikálie: led, voda, potravinářská barva 12
13 Postup: A Do 1/3 objemu PET láhve dejte rozdrcený led a láhev zašroubujte. Potřepejte s ní láhev se smrskne. B Skleněnou láhev propláchněte horkou vodou (sklo se zahřeje). Odstřihněte hrdlo balónku. Na hrdlo láhve nasuňte balónek. Postavte do nádoby s ledovou vodou. Co se stane? Zhášedlo plamene Pomůcky: PET láhev, talíř, svíčka Chemikálie: NaHCO 3, ocet Postup: Na talíř umístěte svíčku a zapalte ji. Do PET láhve dejte trochu octa a opatrně přisypte jedlou sodu. Po chvíli nakloňte láhev tak, aby nevytekl obsah láhve směrem k hořící svíčce. Pozorujte zhášení svíčky Pozorování hladiny CO 2 Pomůcky: vyšší sklenice nebo odměrný válec, svíčka na korkové zátce pověšená na drátku, aparatura na vyvíjení plynu, slánka, bublifuk Chemikálie: CaCO 3, HCl (w = 0,1) Postup: Z chemikálií připravte CO 2, který jímejte do sklenice (válce). Zapalte svíčku a opatrně ponořujte tak aby byla zřejmá hladina oxidu uhličitého. Ze sklenice lze i část oxidu uhličitého vylít a pokus zopakovat. Když je hladina CO 2 nízko, foukejte do sklenice mýdlové bubliny. Ty se usadí na hladině CO 2 Poznámka: HCl lze zakoupit v drogerii. Doporučenou koncentraci získáte přeléváním 1/3 objemu HCl do 2/3 objemu vody (kyselinu lijeme vždy do vody!!!) Nehořící nit Pomůcky: nit, stojan, kancelářská sponka, kádinka, kahan, skleněná tyčinka 13
14 Chemikálie: NaCl, voda Postup: Připravte za horka nasycený roztok NaCl. Do roztoku ponořte nit s kancelářskou sponkou (těžítko) a po 3 5 minutách opatrně vyjměte. Dejte na stojan dokonale vysušit. Potom opatrně zapalte. Nit shoří, ale krystalky NaCl drží pohromadě tak, že udrží i kancelářskou sponku Vlastnosti vybraných uhlovodíků a jejich derivátů Pomůcky: 9 zkumavek (skleniček s rovným dnem), porcelánová miska, kapátko, nálevka, špejle, gumové zátky, stojan (v případě zkumavek), 5 hodinových skel (v domácích podmínkách kompotových misek) Chemikálie: ethanol, n-hexan (popř. jiné organické rozpouštědlo nemísitelné s vodou), petrolej, glycerol, stolní olej, Alpa, potravinářské barvivo Postup: Připravte si čtyři zkumavky do stojanu (skleničky s rovným dnem), každou z nich naplňte do 1/3 vodou obarvenou pro názornost potravinářským barvivem. Přidejte cca 2 cm 3 zkoumané organické sloučeniny a protřepejte. Pozorujte jejich rozpustnost ve vodě. Do čtyř zkumavek (skleniček) vlijte po cca 3 cm 3 zkoumaného vzorku, do páté zkumavky odměřte cca 3 cm 3 destilované vody. Do všech zkumavek přidejte cca 1cm 3 stolního oleje, protřepejte obsahy zkumavek (skleniček), pozorujte. Připravte si pět hodinových skel (misek), na čtyři vlijte cca po 1cm 3 zkoumaného kapalného uhlovodíku (popř. jeho derivátu) a na páté sklo stejný objem destilované vody. Špejlí zapalte jednotlivé látky a pozorujte. Poznámka: Proveďte výhradně v přítomnosti rodičů nebo jiné dospělé osoby! Provádějte pouze v doporučeném množství!!! Svá pozorování zapište do tabulky. 14
15 Tabulka: Rozpustnost ve vodě Rozpustnost v oleji Hořlavost benzín n-hexan petrolej voda Otázky a úkoly: Dopište závěry k jednotlivým pokusům: - Sledované látky jsou kapaliny, které se ve vodě, protože... - Vybrané organické sloučeniny se v oleji...., protože... Srovnejte intenzitu hoření všech zkoumaných látek a dopište závěry: - Nejlépe hoří. - Nejhůř hoří.. 15
16 6 Dlouhodobé domácí chemické pokusy Dlouhodobý domácí chemický pokus je takový pokus, který neprobíhá okamžitě. Jeho realizace je obvykle v rozsahu 2 20 dnů, záleží na typu reakce, ale i na reakčních podmínkách (viz níže). Stejně jako pokusy krátkodobé, i dlouhodobé jsou uvedeny v následující ukázce Domácí příprava oxidu uhličitého Pomůcky: PET láhev o objemu 0,5 l, lepicí páska, nafukovací balónek Chemikálie: Zelenina brambor a mrkev, voda Postup: Mrkev a brambor nakrájejte na kostičky a dejte do PET láhve. Přidejte malou sklenici vody. Na PET láhev připevněte vyfouknutý balónek. Připevněný balónek v místě úchytu oblepte lepicí páskou tak, aby nedošlo k úniku vzduchu. Několik dní pokus pozorujte a zaznamenávejte změny. Závěr: Po několika dnech se začne balónek nafukovat vlivem CO 2, který je produktem fermentace Vliv ethylenu na dozrávání rajčat Doba přípravy pokusu: 5 minut Doba zrání: 6 dní Materiál: 3 nezralá rajčata, jablko, 2 mikrotenové sáčky Pracovní postup: Zabalte jedno rajče do mikroténového sáčku a zavažte. Druhé rajče zabalte do mikroténového sáčku společně s jablkem a opět zavažte. Třetí rajče nechejte nezabalené. Všechna tři rajčata umístěte do stínu, ale ne do tmy! Postupně pozorujte různou dobu dozrávání rajčat v závislosti na na způsobu uložení. Závěr: Ethylen je jediný plynný rostlinný hormon, který se snadno šíří a uvolňuje do okolí. Způsobuje stárnutí rostlin, opad listů, zrání plodů. 16
17 Obalení rajčete mikrotenovým sáčkem brání úniku ethylenu Uvnitř sáčku se zvyšuje koncentrace ethylenu urychlení zrání. Jablko + rajče = mnohem vyšší koncentrace ethylenu Působení dusíkatých hnojiv na růst kolonií baktérií Pomůcky: 2 sklenice se šroubovacím víčkem (stejných rozměrů), kompostová půda, filtrační papír, nůžky, fix Chemikálie: hnojivo síran amonný (NH 4 ) 2 SO 4, voda Doba trvání: dní (samotná manipulace 10 minut) Postup: Sklenice naplňte kompostovou půdou asi 3 cm vysoko. Na jeden půdní vzorek nasypte 50 g síranu amonného a oba vzorky provlhčete vodou. Sklenice si popište! Vystřihněte z filtračního papíru 2 proužky o rozměrech 2x6 cm a na každý půdní vzorek jeden papírek položte a přitiskněte. Sklenice uzavřete a nechte stát při pokojové teplotě. Během pokusu si pořiďte fotografie obou sklenic a porovnejte je s fotografiemi zachycujícími průběh pokusu u ostatních spolužáků Závěr: Cca po 13 dnech se papír na půdě bez hnojiva rozpadne vlivem baktérií, na půdě s hnojivem ne. 17
18 7 Možnosti posilování klíčových kompetencí žáků pomocí domácích chemických pokusů Posilování klíčových kompetencí je jedna z úloh současného školství. V rámcových vzdělávacích programech jsou klíčové kompetence, které mají být posilovány, vyjmenovány, ale jejich obsahu již není věnována taková pozornost, jakou by si zasloužily. Tyto otázky lze vhodně vložit do pracovních listů označeny symboly: kompetence komunikativní KK, kompetence pracovní KP, k učení KU, k řešení problémů KŘP). Pro ilustraci jsou uvedeny pracovní listy, jak je vypracovali studenti učitelství chemie (1. ročník navazujícího magisterského studia) jména studentů jsou uvedena u daného pracovního listu. PRACOVNÍ LIST 1 (autor T. Rejč) POSILOVÁNÍ KOMPETENCE K UČENÍ (KU) Úkol č. 1: Podle ph dělíme látky na (doplňte): ph < 7 ph = 7 ph > 7 Úkol č. 2: a) Doplňte texty k šipkám v obr. č. 1. b) Vyznačte na stupnici oblast charakterizující látky, které jsou kyselejší než látka, jejíž ph = 3. c) Vyznačte na stupnici oblast charakterizující látky, které mají větší zásaditost než látka, jejíž ph = 9. obr. č. 1 Úkol č. 3: Napište chemické vzorce a názvy iontů vzniklých při autoprotolýze vody. Úkol č. 4: Hledání chyb v textu: Zdeněk je mezi svými spolužáky znám svou chlubivostí a povrchností. Vždy má něco nej (nejlepší mobil, botasky, atd.) Tentokrát se snažil spolužáky omráčit tím, že jeho známý má ph-metr pracující s přesností na tři desetinná místa, čímž výrazně 18
19 překonává přesnost uváděnou v reklamě u výrobku DOVE, viz výše. Jako důkaz pravdivosti svého tvrzení, předložil Zdeněk kamarádům tuto tabulku se smyšlenými údaji z měření oním přístrojem: Číslo vzorku: Hodnota ph: 1-2, , , , ,310 Uveďte čísla vzorků, jejichž naměřené hodnoty pomohly spolužákům nachytat Zdeňka na hruškách a ukázat mu, že místo přesného přístroje předvedl pouze svoji neznalost teorie ph. POSILOVÁNÍ KOMPETENCE KOMUNIKATIVNÍ (KKOM) Úkol č. 5: Vysvětlete český význam pojmů: kation anion Úkol č. 6: Doplňovačka: a) Donorem (dárcem) protonů je (tj. látka, která je schopna poskytovat proton). b) Akceptorem (příjemcem) protonů je (tj. látka, která je schopna přijímat proton). c) Autoprotolýza je děj, při kterém dochází k předání d) mezi samotnými molekulami (protického) rozpouštědla. POSILOVÁNÍ KOMPETENCE K ŘEŠENÍ PROBLÉMŮ Úkol č. 7: Hádanka Neznámá známá : Dovol, abych se ti představila: - Jsem jedna z nejznámějších chemických látek, které znáš. - Provázím tě chemií od 8. ročníku ZŠ. - Jsem velmi užitečná i velmi nebezpečná. - Tvářím se hodně kysele. - Mé tělo je tvořeno třemi druhy součástek. - Málokterý prvek, který padne do mé náruče, mi odolá. - Nejsem lehká holka (na tričku mám číslo 98). Už mě poznáváš? Napiš moje jméno i chemický vzorec. POSILOVÁNÍ KOMPETENCE PRACOVNÍ Úkol č. 8: Domácí pokus: připravte si vlastní indikátor ke stanovení ph roztoků. (Postup: Nakrájejte cca 100g červeného zelí, vložte do hrnce s 200 ml vody a uvařte. Po ochlazení výluh fialové barvy sceďte a používejte jako indikátor.) Otestujte si, jak se váš indikátor zbarví v kyselém prostředí (např. ocet) a jak v zásaditém prostředí (např. soda) a výsledek pozorování zapište. 19
20 Úkol č. 9: a) Využijte znalosti z úkolu č. 8 a dopište barvy indikátoru z červeného zelí po přikápnutí do vodných roztoků následujících sloučenin: H 2 SO 4 NaOH HCl KOH b) Reklama uvádí u mýdla DOVE hodnotu ph = 5,5. - Jde v tomto případě o látku zásaditou, neutrální, nebo kyselou? - Jak se zbarví indikátor (z červeného zelí viz pokus) v tomto případě? - Mezi jaké látky (z hlediska ph) řadíme v chemii mýdla? - Je výrobek DOVE z chemického hlediska mýdlem? Úkol č. 10: Odpovězte na otázky k následujícímu demonstračnímu pokusu učitele. Učitel předvedl žákům pokus, při němž baňku s amoniakem uzavřel zátkou, kterou prochází skleněná, na konci uvnitř baňky zúžená, trubice. Vnější konec trubice ponořil do vodní lázně, s přídavkem fenolftaleinu (viz obr. č. 2). V důsledku rozpouštění amoniaku ve vodě začala voda proudit do baňky. a) Napište chemickou rovnici reakce amoniaku s vodou: b) Vysvětlete příčinu zbarvení fenolftaleinu v baňce na obrázku: Obr. č. 2 c) Popište, k jakému zbarvení by došlo, kdyby byl jako indikátor použit váš výluh z červeného zelí: Úkol č. 11: Nezapomínejte na bezpečnost práce v laboratoři! Popište, jak musí učitel bezpečně postupovat při ředění kyseliny sírové vodou a tento postup řádně odůvodněte. 20
21 PRACOVNÍ LIST 2 ( autorka M. Picková) Téma:... (napište řešení doplňovačky) D O Č H I Č H T X I L O U I D Ý Pozorně si přečtěte následující text a na základě pokynů vypracujte následující úkoly: Tři minuty před zvoněním na vyučovací hodinu chemie se odehrává následující rozhovor mezi žáky 2. A., Jakubem a Leontýnou. J: Zase chemie, kdo se to má neustále učit?!? Pořád samé rovnice, vyčíslování, vzorce, použití, výroba a ještě ke všemu ty otřesné domácí úkoly...domácí úkol Leo, byl domácí úkol? L: Byl. J: A jaký? L: Měli jsme si najít nějaké informace o jednom z bezbarvých plynů bez zápachu. Při nadýchání se jej ve větším množství ovšem působí štiplavě na sliznice a vytváří kyselou chuť. Je také konečným stupněm oxidace uhlíku (organických látek) a výsledkem hoření za dostatečného přístupu kyslíku. J: Leo, ty mě zase zkoušíš! Nenapínej mě, tolik. L: Kubo, mysli taky trochu. Ten plyn, o kterém mluvím při -78 C, přechází do tuhého skupenství a vzniká bílá tuhá látka, tzv. suchý led. Už víš? J: Vím. L: Aha, no a o kterou sloučeninu se jedná? J: O oxid uhličitý. A já Ti na oplátku povím, jak jej snadno vyrobit i doma to zvládneš. L: Jsem jedno velké ucho. J: Vezmeš si víčko od PET láhve a naplníš jej směsí kyseliny citrónové a jedlé sody, přibližně v poměru 1:1. Pak naliješ asi do ¾ sklenice vodu, a to víčko do ní vložíš. Vezmeš si talíř a sklenici i s víčkem rychle obrátíš a uvidíš, co se stane. L: To zní dobře, zkusím to. Po provedení domácího pokusu vyřešte následující úkoly: Úkol: Postupujte dle návodu z předposlední odpovědi a pokuste se připravit daný plyn. Pořiďte fotografii z provádění pokusu a přiložte ji jako přílohu k vypracovanému 21
22 Jakub Leontýně popsal, jak by připravila oxid uhličitý z domácích surovin. Vysvětlete, v čem spočívá podstata tohoto pokusu, a nezapomeňte připsat chemickou rovnici, která daný pokus vystihuje! (3 body) Představte si, že jste již připraveni k provedení pokusu a na poslední chvíli zjistíte, že nemáte doma kyselinu citrónovou. Jedlé sody naopak máte dostatek. S čím ji necháte reagovat v případě, že se Vám pro zmíněnou kyselinu nechce už jít do obchodu? (1 bod)... Oxid uhličitý je poměrně známou sloučeninou. V 17. století vlámský chemik Jan Baptist van Helmont zjistil, že při spalování dřevěného uhlí v uzavřené nádobě váha zbylého popele je menší, než původního uhlí. Vysvětlil to přeměnou části uhlí na neviditelnou substanci, kterou nazval plyn spiritus sylvestre. Dokázali byste přijít alespoň na další 2 možné způsoby, jak získat tento bezbarvý plyn? (2 body)... Jakožto průmyslově poměrně lehce dostupný plyn je oxid uhličitý využíván např. v Doplňte minimálně 3 oblasti, ve kterých má tato sloučenina své uplatnění. (1 bod) Jaký počet molekul CO 2 představuje 91,9 mol oxidu uhličitého? (2 body) Co znázorňuje následující graf? Stručně charakterizujte. (1 bod) 22
23 8 Citovaná a doporučená literatura k realizaci domácích chemických pokusů 1. ŠULCOVÁ, R. BÖHMOVÁ, H. Netradiční experimenty z organické a praktické chemie. Praha: UK, BLAKEYOVÁ, N. Hokusy pokusy. Praha: Albatros. 3. KOLEKTIV AUTORÚ. Velká kniha pokusů. Praha: SVOJTKA, RICHTR, V., KRAITR, M. Atraktivní chemické pokusy. Plzeň: PdF, SOLÁROVÁ, M. Chemické pokusy 2 Anorganická chemie. Ostrava: PřF, 2005, el. text. 6. SLANICAY, J. Chemické pokusy. PdF: Trnava, 2008, elektronický text 7. BÁRTA, M. Jak (ne)vyhodit školu do povětří. Didaktis, Brno BÁRTA, M. Jak (ne)vyhodit školu do povětří 2. Didaktis, Brno Prokša, M. Chémia a my. Bratislava: SPN, HOLÝ, I., RYCHTERA, J. Hry se svíčkou. Gaudeamus : Hradec Králové, Elektronické zdroje: 1. Zdroj: About.com:Chemistry [online]. [cit ]. Dostupný z: < (citováno dne ) 2. SMYČKA, J., BROŽKOVÁ, A.. Kuchařka biologických pokusů : Dostupné z: (citováno dne ) 3. MACENAUEROVÁ, J.Chemické pokusy - hravě i doma. Dostupné z: (citováno dne ) 4. HRUBÝ, M. Zajímavé chemické pokusy. Dostupné z: (citováno dne ) 5. (citováno dne ) 6. (citováno dne 1ž ) 7. (citováno dne ) 8. (citováno dne )
DOMÁCÍ CHEMICKÉ POKUSY
 Inovace profesní přípravy budoucích učitelů chemie CZ.1.07/2.2.00/15.0324 DOMÁCÍ CHEMICKÉ POKUSY Doc. RNDr. Marie Solárová, Ph.D. KCH PřF OU v Ostravě DOMÁCÍ CHEMICKÉ POKUSY Doc. RNDr. Marie Solárová,
Inovace profesní přípravy budoucích učitelů chemie CZ.1.07/2.2.00/15.0324 DOMÁCÍ CHEMICKÉ POKUSY Doc. RNDr. Marie Solárová, Ph.D. KCH PřF OU v Ostravě DOMÁCÍ CHEMICKÉ POKUSY Doc. RNDr. Marie Solárová,
Inovace výuky chemie. ph a neutralizace. Ch 8/09
 Inovace výuky chemie ph a neutralizace Ch 8/09 Vzdělávací oblast: Vzdělávací obor: Tematický okruh: Cílová skupina: Klíčová slova: Očekávaný výstup: Člověk a příroda Chemie Anorganické sloučeniny 8. ročník
Inovace výuky chemie ph a neutralizace Ch 8/09 Vzdělávací oblast: Vzdělávací obor: Tematický okruh: Cílová skupina: Klíčová slova: Očekávaný výstup: Člověk a příroda Chemie Anorganické sloučeniny 8. ročník
REAKCE V ORGANICKÉ CHEMII A BIOCHEMII
 REAKCE V ORGANICKÉ CHEMII A BIOCHEMII PaedDr. Ivana Töpferová Střední průmyslová škola, Mladá Boleslav, Havlíčkova 456 CZ.1.07/1.5.00/34.0861 MODERNIZACE VÝUKY Anotace: laboratorní práce z organické chemie
REAKCE V ORGANICKÉ CHEMII A BIOCHEMII PaedDr. Ivana Töpferová Střední průmyslová škola, Mladá Boleslav, Havlíčkova 456 CZ.1.07/1.5.00/34.0861 MODERNIZACE VÝUKY Anotace: laboratorní práce z organické chemie
ORGANICKÁ CHEMIE Laboratorní práce č. 3
 Téma: Hydroxyderiváty uhlovodíků ORGANICKÁ CHEMIE Laboratorní práce č. 3 Úkol 1: Dokažte přítomnost ethanolu ve víně. Ethanol bezbarvá kapalina, která je základní součástí alkoholických nápojů. Ethanol
Téma: Hydroxyderiváty uhlovodíků ORGANICKÁ CHEMIE Laboratorní práce č. 3 Úkol 1: Dokažte přítomnost ethanolu ve víně. Ethanol bezbarvá kapalina, která je základní součástí alkoholických nápojů. Ethanol
Laboratorní práce z chemie č. Téma: S-prvky
 Autor: Mgr. Lenka Fišerová Škola: Gymnázium, Kadaň, 5. května 620, po. Vytvořeno: listopad 2012 Kód: VY_32_INOVACE_13_05Fis_ChLPVG Předmět: CHEMIE Ročník:2. ročník VG Téma: S prvky Cíl: Prakticky ověřit
Autor: Mgr. Lenka Fišerová Škola: Gymnázium, Kadaň, 5. května 620, po. Vytvořeno: listopad 2012 Kód: VY_32_INOVACE_13_05Fis_ChLPVG Předmět: CHEMIE Ročník:2. ročník VG Téma: S prvky Cíl: Prakticky ověřit
Sešit pro laboratorní práci z chemie
 Sešit pro laboratorní práci z chemie téma: Příprava roztoků a měření ph autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační
Sešit pro laboratorní práci z chemie téma: Příprava roztoků a měření ph autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační
Název: Acidobazické indikátory
 Název: Acidobazické indikátory Autor: Mgr. Jiří Vozka, Ph.D. Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, biologie, fyzika Ročník: 3. (1. ročník vyššího
Název: Acidobazické indikátory Autor: Mgr. Jiří Vozka, Ph.D. Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, biologie, fyzika Ročník: 3. (1. ročník vyššího
ORGANICKÁ CHEMIE Laboratorní práce č. 2
 Téma: Uhlovodíky ORGANICKÁ CHEMIE Laboratorní práce č. 2 Pozn: Organické látky, jako jsou petrolej, hexan nebo naftalen, nepatří do umyvadla, ale do speciální nádoby na organický odpad!! Úkol 1: Zkoumejte
Téma: Uhlovodíky ORGANICKÁ CHEMIE Laboratorní práce č. 2 Pozn: Organické látky, jako jsou petrolej, hexan nebo naftalen, nepatří do umyvadla, ale do speciální nádoby na organický odpad!! Úkol 1: Zkoumejte
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í LABORATORNÍ PRÁCE Č. 6 PRÁCE S PLYNY
 LABORATORNÍ PRÁCE Č. 6 PRÁCE S PLYNY Mezi nejrozšířenější práce s plyny v laboratoři patří příprava a důkazy oxidu uhličitého CO 2, kyslíku O 2, vodíku H 2, oxidu siřičitého SO 2 a amoniaku NH 3. Reakcí
LABORATORNÍ PRÁCE Č. 6 PRÁCE S PLYNY Mezi nejrozšířenější práce s plyny v laboratoři patří příprava a důkazy oxidu uhličitého CO 2, kyslíku O 2, vodíku H 2, oxidu siřičitého SO 2 a amoniaku NH 3. Reakcí
REAKCE V ANORGANICKÉ CHEMII
 REAKCE V ANORGANICKÉ CHEMII PaedDr. Ivana Töpferová Střední průmyslová škola, Mladá Boleslav, Havlíčkova 456 CZ.1.07/1.5.00/34.0861 MODERNIZACE VÝUKY Anotace: laboratorní práce z anorganické chemie, realizace
REAKCE V ANORGANICKÉ CHEMII PaedDr. Ivana Töpferová Střední průmyslová škola, Mladá Boleslav, Havlíčkova 456 CZ.1.07/1.5.00/34.0861 MODERNIZACE VÝUKY Anotace: laboratorní práce z anorganické chemie, realizace
Funkce chemického pokusu ve výuce chemie
 Funkce chemického pokusu ve výuce Funkce vyplývají ze struktury pokusu a charakteristiky výuky a vzhledem k cílům výuky Informativní Formativní Metodologická Vyberte si každý jednu chemickou reakci (z
Funkce chemického pokusu ve výuce Funkce vyplývají ze struktury pokusu a charakteristiky výuky a vzhledem k cílům výuky Informativní Formativní Metodologická Vyberte si každý jednu chemickou reakci (z
DOCELA OBYČEJNÁ VODA
 Skupina č. Pracovali: Téma : DOCELA OBYČEJNÁ VODA Úloha č.1 Příprava destilované vody. Sestavte destilační aparaturu, do baňky nalijte vodu (s trochou modré skalice) a zahřívejte. Popište získaný destilát.
Skupina č. Pracovali: Téma : DOCELA OBYČEJNÁ VODA Úloha č.1 Příprava destilované vody. Sestavte destilační aparaturu, do baňky nalijte vodu (s trochou modré skalice) a zahřívejte. Popište získaný destilát.
Návod k laboratornímu cvičení. Efektní pokusy
 Návod k laboratornímu cvičení Efektní pokusy Úkol č. 1: Chemikova zahrádka Pomůcky: skleněná vana, lžička na chemikálie. Chemikálie: vodní sklo, síran zinečnatý ZnSO 4 (X i ), síran železnatý FeSO 4, chlorid
Návod k laboratornímu cvičení Efektní pokusy Úkol č. 1: Chemikova zahrádka Pomůcky: skleněná vana, lžička na chemikálie. Chemikálie: vodní sklo, síran zinečnatý ZnSO 4 (X i ), síran železnatý FeSO 4, chlorid
2.12 Vyvíjení CO 2 bublinky kolem nás. Projekt Trojlístek
 2. Vlastnosti látek a chemické reakce 2.12 Vyvíjení CO 2 bublinky kolem nás. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová
2. Vlastnosti látek a chemické reakce 2.12 Vyvíjení CO 2 bublinky kolem nás. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová
Obecná a anorganická chemie. Zásady a jejich neutralizace, amoniak
 Šablona č. I, sada č. 2 Vzdělávací oblast Vzdělávací obor Tematický okruh Člověk a příroda Chemie Obecná a anorganická chemie Téma Zásady a jejich neutralizace, amoniak Ročník 9. Anotace Aktivita slouží
Šablona č. I, sada č. 2 Vzdělávací oblast Vzdělávací obor Tematický okruh Člověk a příroda Chemie Obecná a anorganická chemie Téma Zásady a jejich neutralizace, amoniak Ročník 9. Anotace Aktivita slouží
Trojské trumfy. pražským školám BARVY U ŽIVOČICHŮ A ROSTLIN. projekt CZ.2.17/3.1.00/32718 EVROPSKÝ SOCIÁLNÍ FOND
 EVROPSKÝ SOCIÁLNÍ FOND PRAHA & EU INVESTUJEME DO VAŠÍ BUDOUCNOSTI Pracovní Didaktický list balíček č. 7 č. 9 Trojské trumfy pražským školám projekt CZ.2.17/3.1.00/32718 BARVY U ŽIVOČICHŮ A ROSTLIN A B?
EVROPSKÝ SOCIÁLNÍ FOND PRAHA & EU INVESTUJEME DO VAŠÍ BUDOUCNOSTI Pracovní Didaktický list balíček č. 7 č. 9 Trojské trumfy pražským školám projekt CZ.2.17/3.1.00/32718 BARVY U ŽIVOČICHŮ A ROSTLIN A B?
UNIVERZITA KARLOVA V PRAZE Přírodovědecká fakulta
 Červené zelí jako acidobazický indikátor Zdroj: http://www.scifun.org/homeexpts/homeexpts.html [34] Didaktický záměr: Objasnění pojmu ph a acidobazický indikátor. Popis: Žáci si připraví roztok acidobazického
Červené zelí jako acidobazický indikátor Zdroj: http://www.scifun.org/homeexpts/homeexpts.html [34] Didaktický záměr: Objasnění pojmu ph a acidobazický indikátor. Popis: Žáci si připraví roztok acidobazického
ODDĚLOVÁNÍ SLOŽEK SMĚSÍ, PŘÍPRAVA ROZTOKU URČITÉHO SLOŽENÍ
 ODDĚLOVÁNÍ SLOŽEK SMĚSÍ, PŘÍPRAVA ROZTOKU URČITÉHO SLOŽENÍ PaedDr. Ivana Töpferová Střední průmyslová škola, Mladá Boleslav, Havlíčkova 456 CZ.1.07/1.5.00/34.0861 MODERNIZACE VÝUKY Anotace: laboratorní
ODDĚLOVÁNÍ SLOŽEK SMĚSÍ, PŘÍPRAVA ROZTOKU URČITÉHO SLOŽENÍ PaedDr. Ivana Töpferová Střední průmyslová škola, Mladá Boleslav, Havlíčkova 456 CZ.1.07/1.5.00/34.0861 MODERNIZACE VÝUKY Anotace: laboratorní
Návod k laboratornímu cvičení. Vitamíny
 Úkol č. 1: Přítomnost vitaminu C v ovoci a zelenině Návod k laboratornímu cvičení Vitamíny Pomůcky: třecí miska s tloučkem, filtrační kruh, nálevka, filtrační papír, zkumavky, stojan na zkumavky Chemikálie:
Úkol č. 1: Přítomnost vitaminu C v ovoci a zelenině Návod k laboratornímu cvičení Vitamíny Pomůcky: třecí miska s tloučkem, filtrační kruh, nálevka, filtrační papír, zkumavky, stojan na zkumavky Chemikálie:
Ústřední komise Chemické olympiády. 55. ročník 2018/2019 KRAJSKÉ KOLO. Kategorie A ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ) Časová náročnost 120 minut
 Ústřední komise Chemické olympiády 55. ročník 2018/2019 KRAJSKÉ KOLO Kategorie A ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ) Časová náročnost 120 minut Úloha 1 Příprava Mohrovy soli 15 bodů Mezi podvojné soli patří
Ústřední komise Chemické olympiády 55. ročník 2018/2019 KRAJSKÉ KOLO Kategorie A ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ) Časová náročnost 120 minut Úloha 1 Příprava Mohrovy soli 15 bodů Mezi podvojné soli patří
Sešit pro laboratorní práci z chemie
 Sešit pro laboratorní práci z chemie téma: Důkaz C, H, N a halogenů v organických sloučeninách autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie
Sešit pro laboratorní práci z chemie téma: Důkaz C, H, N a halogenů v organických sloučeninách autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie
LP č. 5 - SACHARIDY. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: 28. 2. 2013. Ročník: devátý
 LP č. 5 - SACHARIDY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 28. 2. 2013 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci si prakticky vyzkouší
LP č. 5 - SACHARIDY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 28. 2. 2013 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci si prakticky vyzkouší
KARBOXYLOVÉ KYSELINY
 LABORATORNÍ PRÁCE Č. 28 KARBOXYLOVÉ KYSELINY PRINCIP Karboxylové kyseliny jsou látky, které ve své molekule obsahují jednu nebo více karboxylových skupin. Odvozují se od nich dva typy derivátů, substituční
LABORATORNÍ PRÁCE Č. 28 KARBOXYLOVÉ KYSELINY PRINCIP Karboxylové kyseliny jsou látky, které ve své molekule obsahují jednu nebo více karboxylových skupin. Odvozují se od nich dva typy derivátů, substituční
Kapalina, pevná látka, plyn
 Obsah Co je to chemie? Kapalina, pevná látka, plyn Kyselina, zásada K čemu je chemie dobrá? Jak to vypadá v laboratoři? Bezpečnost práce Chemické pokusy Co je to chemie? Kapalina, pevná látka, plyn Kyselina,
Obsah Co je to chemie? Kapalina, pevná látka, plyn Kyselina, zásada K čemu je chemie dobrá? Jak to vypadá v laboratoři? Bezpečnost práce Chemické pokusy Co je to chemie? Kapalina, pevná látka, plyn Kyselina,
Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii
 Datum: Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii Laboratorní cvičení č. Tlak vzduchu: Teplota vzduchu: Vitamíny Vlhkost vzduchu
Datum: Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii Laboratorní cvičení č. Tlak vzduchu: Teplota vzduchu: Vitamíny Vlhkost vzduchu
P + D PRVKY Laboratorní práce
 Téma: Reakce sloučenin zinku P + D PRVKY Laboratorní práce Pozn: Výsledky úkolu 1 zapisujte až po 14 dnech. Úkol 4 provádějte pouze pod dohledem učitele. Úkol 1: Připravte 5 gramů bílé skalice. Bílá skalice
Téma: Reakce sloučenin zinku P + D PRVKY Laboratorní práce Pozn: Výsledky úkolu 1 zapisujte až po 14 dnech. Úkol 4 provádějte pouze pod dohledem učitele. Úkol 1: Připravte 5 gramů bílé skalice. Bílá skalice
Ústřední komise Chemické olympiády. 50. ročník 2013/2014. OKRESNÍ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH
 Ústřední komise Chemické olympiády 50. ročník 2013/2014 OKRESNÍ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH TEORETICKÁ ČÁST (70 BODŮ) Informace pro hodnotitele Ve výpočtových úlohách jsou uvedeny dílčí výpočty
Ústřední komise Chemické olympiády 50. ročník 2013/2014 OKRESNÍ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH TEORETICKÁ ČÁST (70 BODŮ) Informace pro hodnotitele Ve výpočtových úlohách jsou uvedeny dílčí výpočty
NEUTRALIZAČNÍ ODMĚRNÁ ANALÝZA (TITRACE)
 NEUTRALIZAČNÍ ODMĚRNÁ ANALÝZA (TITRACE) Cíle a princip: Stanovit TITR (přesnou koncentraci) odměrného roztoku kyseliny nebo zásady pomocí známé přesné koncentrace již stanoveného odměrného roztoku. Podstatou
NEUTRALIZAČNÍ ODMĚRNÁ ANALÝZA (TITRACE) Cíle a princip: Stanovit TITR (přesnou koncentraci) odměrného roztoku kyseliny nebo zásady pomocí známé přesné koncentrace již stanoveného odměrného roztoku. Podstatou
Laboratorní cvičení z kinetiky chemických reakcí
 Laboratorní cvičení z kinetiky chemických reakcí LABORATORNÍ CVIČENÍ 1. Téma: Ovlivňování průběhu reakce změnou koncentrace látek. podmínek průběhu reakce. Jednou z nich je změna koncentrace výchozích
Laboratorní cvičení z kinetiky chemických reakcí LABORATORNÍ CVIČENÍ 1. Téma: Ovlivňování průběhu reakce změnou koncentrace látek. podmínek průběhu reakce. Jednou z nich je změna koncentrace výchozích
Ústřední komise Chemické olympiády. 53. ročník 2016/2017. KRAJSKÉ KOLO kategorie C. ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ) časová náročnost: 120 minut
 Ústřední komise Chemické olympiády 53. ročník 2016/2017 KRAJSKÉ KOLO kategorie C ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ) časová náročnost: 120 minut Zadání praktické části krajského kola ChO kat. C 2016/2017
Ústřední komise Chemické olympiády 53. ročník 2016/2017 KRAJSKÉ KOLO kategorie C ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ) časová náročnost: 120 minut Zadání praktické části krajského kola ChO kat. C 2016/2017
Neutralizace kyseliny zásadou
 Neutralizace kyseliny zásadou Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 15 minut Pomůcky a) chemikálie - kyselina chlorovodíková - hydroxid sodný
Neutralizace kyseliny zásadou Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 15 minut Pomůcky a) chemikálie - kyselina chlorovodíková - hydroxid sodný
Ústřední komise Chemické olympiády. 42. ročník. KRAJSKÉ KOLO Kategorie D. SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut
 Ústřední komise Chemické olympiády 42. ročník 2005 2006 KRAJSKÉ KOLO Kategorie D SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut Institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy
Ústřední komise Chemické olympiády 42. ročník 2005 2006 KRAJSKÉ KOLO Kategorie D SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut Institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy
P + D PRVKY Laboratorní práce
 Téma: Reakce sloučenin železa a kobaltu P + D PRVKY Laboratorní práce Úkol 1: Určete, které vlivy se podílí na korozi železa. Koroze je označení pro děj probíhající na povrchu některých kovů. Na jejím
Téma: Reakce sloučenin železa a kobaltu P + D PRVKY Laboratorní práce Úkol 1: Určete, které vlivy se podílí na korozi železa. Koroze je označení pro děj probíhající na povrchu některých kovů. Na jejím
2.01 Aerobní/anaerobní reakce aneb kvasinky v akci. Projekt Trojlístek
 2. Vlastnosti látek a chemické reakce 2.01 Aerobní/anaerobní reakce aneb kvasinky v akci. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie
2. Vlastnosti látek a chemické reakce 2.01 Aerobní/anaerobní reakce aneb kvasinky v akci. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie
Název: Kyselé a zásadité 1
 Název: Kyselé a zásadité 1 1) Co mají společného? Podívejte se na následující potraviny a zkuste zapřemýšlet, co mají společného: Společnou vlastností těchto potravin je: Které další látky jsou kyselé?
Název: Kyselé a zásadité 1 1) Co mají společného? Podívejte se na následující potraviny a zkuste zapřemýšlet, co mají společného: Společnou vlastností těchto potravin je: Které další látky jsou kyselé?
Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy
 Název: xidy dusíku Autor: Mgr. Štěpán Mička Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, fyzika, Ročník: 3. Tématický celek: Systematická anorganická
Název: xidy dusíku Autor: Mgr. Štěpán Mička Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, fyzika, Ročník: 3. Tématický celek: Systematická anorganická
Podstata krápníkových jevů. Ch 8/07
 Inovace výuky Chemie Podstata krápníkových jevů Ch 8/07 Vzdělávací oblast: Vzdělávací obor: Tematický okruh: Cílová skupina: Klíčová slova: Očekávaný výstup: Člověk a příroda Chemie Anorganické sloučeniny
Inovace výuky Chemie Podstata krápníkových jevů Ch 8/07 Vzdělávací oblast: Vzdělávací obor: Tematický okruh: Cílová skupina: Klíčová slova: Očekávaný výstup: Člověk a příroda Chemie Anorganické sloučeniny
Oborový workshop pro ZŠ CHEMIE
 PRAKTICKÁ VÝUKA PŘÍRODOVĚDNÝCH PŘEDMĚTŮ NA ZŠ A SŠ CZ.1.07/1.1.30/02.0024 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Oborový workshop pro ZŠ CHEMIE
PRAKTICKÁ VÝUKA PŘÍRODOVĚDNÝCH PŘEDMĚTŮ NA ZŠ A SŠ CZ.1.07/1.1.30/02.0024 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Oborový workshop pro ZŠ CHEMIE
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost.
 Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Klíčová aktivita III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Klíčová aktivita III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády. 46. ročník 2009/2010. KRAJSKÉ KOLO kategorie D
 Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády 46. ročník 2009/2010 KRAJSKÉ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH TEORETICKÁ ČÁST (60 bodů) Úloha 1 Vlastnosti prvků 26
Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády 46. ročník 2009/2010 KRAJSKÉ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH TEORETICKÁ ČÁST (60 bodů) Úloha 1 Vlastnosti prvků 26
ORGANICKÁ CHEMIE Laboratorní práce č. 4 Téma: Karbonylové sloučeniny, karboxylové kyseliny
 ORGANICKÁ CHEMIE Laboratorní práce č. 4 Téma: Karbonylové sloučeniny, karboxylové kyseliny Úkol 1: Připravte acetaldehyd. Karbonylová skupina aldehydů podléhá velmi snadno oxidaci až na skupinu karboxylovou.
ORGANICKÁ CHEMIE Laboratorní práce č. 4 Téma: Karbonylové sloučeniny, karboxylové kyseliny Úkol 1: Připravte acetaldehyd. Karbonylová skupina aldehydů podléhá velmi snadno oxidaci až na skupinu karboxylovou.
Název: Fyzikální a chemický děj Výukové materiály
 Název: Fyzikální a chemický děj Výukové materiály Téma: Fyzikální a chemický děj Úroveň: 2. stupeň ZŠ Tematický celek: Materiály a jejich přeměny Předmět (obor): chemie Doporučený věk žáků: 13 14 let Doba
Název: Fyzikální a chemický děj Výukové materiály Téma: Fyzikální a chemický děj Úroveň: 2. stupeň ZŠ Tematický celek: Materiály a jejich přeměny Předmět (obor): chemie Doporučený věk žáků: 13 14 let Doba
RUŠENÁ KRYSTALIZACE A SUBLIMACE
 LABORATORNÍ PRÁCE Č. 5 RUŠENÁ KRYSTALIZACE A SUBLIMACE KRYSTALIZACE PRINCIP Krystalizace je důležitý postup při získávání čistých tuhých látek z jejich roztoků. Tuhá látka se rozpustí ve vhodném rozpouštědle.
LABORATORNÍ PRÁCE Č. 5 RUŠENÁ KRYSTALIZACE A SUBLIMACE KRYSTALIZACE PRINCIP Krystalizace je důležitý postup při získávání čistých tuhých látek z jejich roztoků. Tuhá látka se rozpustí ve vhodném rozpouštědle.
Návod k laboratornímu cvičení. Alkoholy
 Úkol č. 1: Ověřování fyzikálních vlastností alkoholů Návod k laboratornímu cvičení Alkoholy Pomůcky: 3 velké zkumavky - A,B,C, hodinové sklíčko, kapátko nebo skleněná tyčinka Chemikálie: etanol (F), etan-1,2-
Úkol č. 1: Ověřování fyzikálních vlastností alkoholů Návod k laboratornímu cvičení Alkoholy Pomůcky: 3 velké zkumavky - A,B,C, hodinové sklíčko, kapátko nebo skleněná tyčinka Chemikálie: etanol (F), etan-1,2-
Ústřední komise Chemické olympiády. 55. ročník 2018/2019 KRAJSKÉ KOLO. Kategorie E ZADÁNÍ PRAKTICKÉ ČÁSTI (50 BODŮ)
 Ústřední komise Chemické olympiády 55. ročník 2018/2019 KRAJSKÉ KOLO Kategorie E ZADÁNÍ PRAKTICKÉ ČÁSTI (50 BODŮ) Úloha 1 Stanovení Bi 3+ a Zn 2+ ve směsi 50 bodů Chelatometricky lze stanovit ionty samostatně,
Ústřední komise Chemické olympiády 55. ročník 2018/2019 KRAJSKÉ KOLO Kategorie E ZADÁNÍ PRAKTICKÉ ČÁSTI (50 BODŮ) Úloha 1 Stanovení Bi 3+ a Zn 2+ ve směsi 50 bodů Chelatometricky lze stanovit ionty samostatně,
Téma : Uhlovodíky Areny Toluen a naftalen Název : Vlastnosti toluenu a naftalenu
 Téma : Uhlovodíky Areny Toluen a naftalen Název : Vlastnosti toluenu a naftalenu Typ pokusu : demonstrační Princip : Areny starším názvem aromatické uhlovodíky, vzaly tento svůj název podle své typické
Téma : Uhlovodíky Areny Toluen a naftalen Název : Vlastnosti toluenu a naftalenu Typ pokusu : demonstrační Princip : Areny starším názvem aromatické uhlovodíky, vzaly tento svůj název podle své typické
Červené zelí a červená řepa jako přírodní indikátory ph
 Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.128/02.0055 Červené zelí a červená řepa jako přírodní indikátory ph (laboratorní práce) Označení: EU-Inovace-BFCh-Ch-10 Předmět: Biologicko-fyzikálně
Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.128/02.0055 Červené zelí a červená řepa jako přírodní indikátory ph (laboratorní práce) Označení: EU-Inovace-BFCh-Ch-10 Předmět: Biologicko-fyzikálně
Vitamíny v potravinách
 Inovace výuky Chemie Vitamíny v potravinách Ch 9/06 Vzdělávací oblast: Vzdělávací obor: Tematický okruh: Cílová skupina: Klíčová slova: Očekávaný výstup: Člověk a příroda Chemie Přírodní látky 9. ročník
Inovace výuky Chemie Vitamíny v potravinách Ch 9/06 Vzdělávací oblast: Vzdělávací obor: Tematický okruh: Cílová skupina: Klíčová slova: Očekávaný výstup: Člověk a příroda Chemie Přírodní látky 9. ročník
POPIS VÝUKOVÉ AKTIVITY (METODICKÝ LIST):
 POPIS VÝUKOVÉ AKTIVITY (METODICKÝ LIST): Název výukové aktivity: Faraónův had dvěma způsoby Vyučovací předmět: Technický kroužek. Anotace: Úkolem žáků je vytvořit efektní pokusy založené na chemických
POPIS VÝUKOVÉ AKTIVITY (METODICKÝ LIST): Název výukové aktivity: Faraónův had dvěma způsoby Vyučovací předmět: Technický kroužek. Anotace: Úkolem žáků je vytvořit efektní pokusy založené na chemických
Návod k laboratornímu cvičení. Fenoly
 Návod k laboratornímu cvičení Fenoly Úkol č. 1: Příprava fenolátu sodného Pomůcky: váhy, kádinka, zkumavky Chemikálie: 10% roztok hydroxidu sodného NaOH (C), 5%roztok kyseliny chlorovodíkové HCl (C, X
Návod k laboratornímu cvičení Fenoly Úkol č. 1: Příprava fenolátu sodného Pomůcky: váhy, kádinka, zkumavky Chemikálie: 10% roztok hydroxidu sodného NaOH (C), 5%roztok kyseliny chlorovodíkové HCl (C, X
Návod k laboratornímu cvičení. Alkaloidy a steroidy
 Návod k laboratornímu cvičení Úkol č. 1: Sublimace kofeinu Alkaloidy a steroidy Pomůcky: 2 hodinová sklíčka, elektrický vařič, siťka, stojan s kruhem, filtrační papír Chemikálie: suché čajové lístky (černý,
Návod k laboratornímu cvičení Úkol č. 1: Sublimace kofeinu Alkaloidy a steroidy Pomůcky: 2 hodinová sklíčka, elektrický vařič, siťka, stojan s kruhem, filtrační papír Chemikálie: suché čajové lístky (černý,
Neutralizace, měření senzorem ph Vernier Laboratorní práce
 Neutralizace, měření senzorem ph Vernier Laboratorní práce VY_52_INOVACE_209 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 8.,9. Neutralizace, měření senzorem ph Vernier Laboratorní
Neutralizace, měření senzorem ph Vernier Laboratorní práce VY_52_INOVACE_209 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 8.,9. Neutralizace, měření senzorem ph Vernier Laboratorní
Název: Deriváty uhlovodíků karbonylové sloučeniny
 Název: Deriváty uhlovodíků karbonylové sloučeniny Autor: Mgr. Štěpán Mička Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, fyzika Ročník: 4. Tématický
Název: Deriváty uhlovodíků karbonylové sloučeniny Autor: Mgr. Štěpán Mička Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, fyzika Ročník: 4. Tématický
Měření ph nápojů a roztoků
 Měření ph nápojů a roztoků vzorová úloha (ZŠ) Jméno Třída.. Datum.. 1 Teoretický úvod Kyselý nebo zásaditý roztok? Proč je ocet považován za kyselý roztok? Ocet obsahuje nadbytek (oxoniových kationtů).
Měření ph nápojů a roztoků vzorová úloha (ZŠ) Jméno Třída.. Datum.. 1 Teoretický úvod Kyselý nebo zásaditý roztok? Proč je ocet považován za kyselý roztok? Ocet obsahuje nadbytek (oxoniových kationtů).
Kyseliny a zásady měření ph indikátory a senzorem ph Vernier Laboratorní práce
 Kyseliny a zásady měření ph indikátory a senzorem ph Vernier Laboratorní práce VY_52_INOVACE_204 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 8.,9. Kyseliny a zásady měření ph indikátory
Kyseliny a zásady měření ph indikátory a senzorem ph Vernier Laboratorní práce VY_52_INOVACE_204 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 8.,9. Kyseliny a zásady měření ph indikátory
Důkaz kyselin. Metodický list pro učitele. Časový harmonogram. a) doba na přípravu - 10 minut b) doba na provedení 10 minut.
 Důkaz kyselin Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení 10 minut Pomůcky a) chemikálie - kyselina dusičná - kyselina chlorovodíková - kyselina citronová
Důkaz kyselin Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení 10 minut Pomůcky a) chemikálie - kyselina dusičná - kyselina chlorovodíková - kyselina citronová
Název: Barvy chromu. Autor: Mgr. Jiří Vozka, Ph.D. Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy
 Název: Barvy chromu Autor: Mgr. Jiří Vozka, Ph.D. Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, biologie Ročník: 3. Tématický celek: Systematická anorganická
Název: Barvy chromu Autor: Mgr. Jiří Vozka, Ph.D. Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, biologie Ročník: 3. Tématický celek: Systematická anorganická
P + D PRVKY Laboratorní práce Téma: Reakce mědi, stříbra a jejich sloučenin
 P + D PRVKY Laboratorní práce Téma: Reakce mědi, stříbra a jejich sloučenin Úkol 1: Stanovte obsah vody v modré skalici. Modrá skalice patří mezi hydrát, což jsou látky, nejčastěji soli, s krystalicky
P + D PRVKY Laboratorní práce Téma: Reakce mědi, stříbra a jejich sloučenin Úkol 1: Stanovte obsah vody v modré skalici. Modrá skalice patří mezi hydrát, což jsou látky, nejčastěji soli, s krystalicky
Výukový materiál zpracován v rámci projektu. EU peníze školám. Registrační číslo projektu: CZ.1.07/1.5.00/34.0996
 Výukový materiál zpracován v rámci projektu EU peníze školám Registrační číslo projektu: CZ.1.07/1.5.00/34.0996 Šablona: III/2 č. materiálu: VY_INOVACE_CHE_417 Jméno autora: Třída/ročník: Mgr. Alena Krejčíková
Výukový materiál zpracován v rámci projektu EU peníze školám Registrační číslo projektu: CZ.1.07/1.5.00/34.0996 Šablona: III/2 č. materiálu: VY_INOVACE_CHE_417 Jméno autora: Třída/ročník: Mgr. Alena Krejčíková
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 10 Bílkoviny Pro potřeby projektu
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 10 Bílkoviny Pro potřeby projektu
NOVÉ NÁMĚTY PRO DEMONSTRAČNÍ POKUSY. Ondřej Maca, Tereza Kudrnová
 NOVÉ NÁMĚTY PRO DEMONSTRAČNÍ POKUSY Ondřej Maca, Tereza Kudrnová HUSTÝ DÝM 1) pro koho: 1. ročník čtyřletého gymnázia 2) zařazení do učiva: vlastnosti látek; halogeny; pentely 3) pomůcky: zkumavka se zátkou,
NOVÉ NÁMĚTY PRO DEMONSTRAČNÍ POKUSY Ondřej Maca, Tereza Kudrnová HUSTÝ DÝM 1) pro koho: 1. ročník čtyřletého gymnázia 2) zařazení do učiva: vlastnosti látek; halogeny; pentely 3) pomůcky: zkumavka se zátkou,
Název: Exotermický a endotermický děj
 Název: Exotermický a endotermický děj Téma: Exotermický a endotermický děj Úroveň: 2. stupeň ZŠ Tematický celek: Tradiční a nové způsoby využití energie Výukové materiály Předmět (obor): chemie Doporučený
Název: Exotermický a endotermický děj Téma: Exotermický a endotermický děj Úroveň: 2. stupeň ZŠ Tematický celek: Tradiční a nové způsoby využití energie Výukové materiály Předmět (obor): chemie Doporučený
53. ročník 2016/2017
 Ústřední komise Chemické olympiády 53. ročník 2016/2017 OKRESNÍ KOLO kategorie D ZADÁNÍ PRAKTICKÉ ČÁSTI časová náročnost: 90 minut Úloha 1 Yamadův univerzální indikátor 30 bodů Úvod Univerzální acidobazické
Ústřední komise Chemické olympiády 53. ročník 2016/2017 OKRESNÍ KOLO kategorie D ZADÁNÍ PRAKTICKÉ ČÁSTI časová náročnost: 90 minut Úloha 1 Yamadův univerzální indikátor 30 bodů Úvod Univerzální acidobazické
Sacharidy - důkaz organických látek v přírodních materiálech pomocí žákovské soupravy pro chemii
 Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.1.28/02.0055 Sacharidy - důkaz organických látek v přírodních materiálech pomocí žákovské soupravy pro chemii (laboratorní práce)
Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.1.28/02.0055 Sacharidy - důkaz organických látek v přírodních materiálech pomocí žákovské soupravy pro chemii (laboratorní práce)
Polysacharidy. Ch 9/05. Inovace výuky Chemie
 Inovace výuky Chemie Polysacharidy Ch 9/05 Vzdělávací oblast: Vzdělávací obor: Tematický okruh: Cílová skupina: Klíčová slova: Očekávaný výstup: Člověk a příroda Chemie Přírodní látky 9. ročník polysacharidy,
Inovace výuky Chemie Polysacharidy Ch 9/05 Vzdělávací oblast: Vzdělávací obor: Tematický okruh: Cílová skupina: Klíčová slova: Očekávaný výstup: Člověk a příroda Chemie Přírodní látky 9. ročník polysacharidy,
Název: Exotermní reakce
 Název: Exotermní reakce Autor: Mgr. Jiří Vozka, Ph.D. Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, fyzika Ročník: 3. Tématický celek: Kovy či redoxní
Název: Exotermní reakce Autor: Mgr. Jiří Vozka, Ph.D. Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, fyzika Ročník: 3. Tématický celek: Kovy či redoxní
Měření ph nápojů a roztoků
 Měření ph nápojů a roztoků vzorová úloha (SŠ) Jméno Třída.. Datum.. 1 Teoretický úvod Kyselý nebo zásaditý roztok? Proč je ocet považován za kyselý roztok? Ocet obsahuje nadbytek (oxoniových kationtů).
Měření ph nápojů a roztoků vzorová úloha (SŠ) Jméno Třída.. Datum.. 1 Teoretický úvod Kyselý nebo zásaditý roztok? Proč je ocet považován za kyselý roztok? Ocet obsahuje nadbytek (oxoniových kationtů).
Zadání 1. kola soutěže Kdo by se bál chemie? 2014/2015. Úloha 1: Detergenty
 Zadání 1. kola soutěže Kdo by se bál chemie? 2014/2015 Úloha 1: Detergenty 15 b Zadání: Každý den je používáme, bereme je jako samozřejmou součást všedního dne a vůbec si neuvědomujeme, že bychom bez nich
Zadání 1. kola soutěže Kdo by se bál chemie? 2014/2015 Úloha 1: Detergenty 15 b Zadání: Každý den je používáme, bereme je jako samozřejmou součást všedního dne a vůbec si neuvědomujeme, že bychom bez nich
Název: Nenewtonovská kapalina
 Název: Nenewtonovská kapalina Autor: Mgr. Jiří Vozka, Ph.D. Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, biologie, fyzika Ročník: 5. Tématický celek:
Název: Nenewtonovská kapalina Autor: Mgr. Jiří Vozka, Ph.D. Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, biologie, fyzika Ročník: 5. Tématický celek:
CHEMIE Pracovní list č.3 žákovská verze Téma: Acidobazická titrace Mgr. Lenka Horutová Student a konkurenceschopnost
 www.projektsako.cz CHEMIE Pracovní list č.3 žákovská verze Téma: Acidobazická titrace Lektor: Projekt: Reg. číslo: Mgr. Lenka Horutová Student a konkurenceschopnost CZ.1.07/1.1.07/03.0075 Teorie: Základem
www.projektsako.cz CHEMIE Pracovní list č.3 žákovská verze Téma: Acidobazická titrace Lektor: Projekt: Reg. číslo: Mgr. Lenka Horutová Student a konkurenceschopnost CZ.1.07/1.1.07/03.0075 Teorie: Základem
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost.
 Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Klíčová aktivita III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Klíčová aktivita III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
Konstruktivistická výuka
 Konstruktivistická výuka RNDr. Milan Šmídl, Ph.D. Úvod polovina 20. století (Švýcar Jean Piaget, u nás František Jiránek) popření transmisivního vyučování (monologické metody, hotové poznatky) Zamyslete
Konstruktivistická výuka RNDr. Milan Šmídl, Ph.D. Úvod polovina 20. století (Švýcar Jean Piaget, u nás František Jiránek) popření transmisivního vyučování (monologické metody, hotové poznatky) Zamyslete
3) Kvalitativní chemická analýza
 3) Kvalitativní chemická analýza Kvalitativní analýza je součástí analytické chemie a zabývá se zjišťováním, které látky (prvky, ionty, sloučeniny, funkční skupiny atd.) jsou obsaženy ve vzorku. Lze ji
3) Kvalitativní chemická analýza Kvalitativní analýza je součástí analytické chemie a zabývá se zjišťováním, které látky (prvky, ionty, sloučeniny, funkční skupiny atd.) jsou obsaženy ve vzorku. Lze ji
Charakteristika vyučovacího předmětu Chemie
 Charakteristika vyučovacího předmětu Chemie Obsahové, časové a organizační vymezení předmětu Chemie Obsah předmětu Chemie je zaměřen na praktické využití poznatků o chemických látkách, na znalost a dodržování
Charakteristika vyučovacího předmětu Chemie Obsahové, časové a organizační vymezení předmětu Chemie Obsah předmětu Chemie je zaměřen na praktické využití poznatků o chemických látkách, na znalost a dodržování
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost.
 Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Klíčová aktivita III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Klíčová aktivita III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
Bílkoviny (laboratorní práce)
 Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.128/02.0055 Bílkoviny (laboratorní práce) Označení: EU-Inovace-Ch-9-08 Předmět: chemie Cílová skupina: 9. třída Autor: Mgr. Simona
Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.128/02.0055 Bílkoviny (laboratorní práce) Označení: EU-Inovace-Ch-9-08 Předmět: chemie Cílová skupina: 9. třída Autor: Mgr. Simona
Zařazení do výuky Experiment je vhodné zařadit v rámci učiva chemie v 8. třídě (kyseliny, zásady, ph roztoků).
 Název: Dýchání do vody Úvod Někdy je celkem jednoduché si v chemické laboratoři nebo dokonce i doma připravit kyselinu. Pokud máte kádinku, popř. skleničku, a brčko, tak neváhejte a můžete to zkusit hned!
Název: Dýchání do vody Úvod Někdy je celkem jednoduché si v chemické laboratoři nebo dokonce i doma připravit kyselinu. Pokud máte kádinku, popř. skleničku, a brčko, tak neváhejte a můžete to zkusit hned!
Název: Redoxní titrace - manganometrie
 Název: Redoxní titrace - manganometrie Autor: RNDr. Markéta Bludská Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie a její aplikace, matematika Ročník:
Název: Redoxní titrace - manganometrie Autor: RNDr. Markéta Bludská Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie a její aplikace, matematika Ročník:
Pufry, pufrační kapacita. Oxidoredukce, elektrodové děje.
 ÚSTAV LÉKAŘSKÉ BIOCHEMIE A LABORATORNÍ DIAGNOSTIKY 1. LF UK Pufry, pufrační kapacita. Oxidoredukce, elektrodové děje. Praktické cvičení z lékařské biochemie Všeobecné lékařství Martin Vejražka, Tomáš Navrátil
ÚSTAV LÉKAŘSKÉ BIOCHEMIE A LABORATORNÍ DIAGNOSTIKY 1. LF UK Pufry, pufrační kapacita. Oxidoredukce, elektrodové děje. Praktické cvičení z lékařské biochemie Všeobecné lékařství Martin Vejražka, Tomáš Navrátil
Ústřední komise Chemické olympiády. 55. ročník 2018/2019 ŠKOLNÍ KOLO. Kategorie A ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ)
 Ústřední komise Chemické olympiády 55. ročník 2018/2019 ŠKOLNÍ KOLO Kategorie A ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ) PRAKTICKÁ ČÁST 40 BODŮ Autor Mgr. Filip Smrčka Masarykova univerzita, Brno prof. RNDr. Přemysl
Ústřední komise Chemické olympiády 55. ročník 2018/2019 ŠKOLNÍ KOLO Kategorie A ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ) PRAKTICKÁ ČÁST 40 BODŮ Autor Mgr. Filip Smrčka Masarykova univerzita, Brno prof. RNDr. Přemysl
1. Chemický turnaj. kategorie mladší žáci 30.11. 2012. Zadání úloh
 1. Chemický turnaj kategorie mladší žáci 30.11. 2012 Zadání úloh Vytvořeno v rámci projektu OPVK CZ.1.07/1.1.26/01.0034,,Zkvalitňování výuky chemie a biologie na GJO spolufinancovaného Evropským sociálním
1. Chemický turnaj kategorie mladší žáci 30.11. 2012 Zadání úloh Vytvořeno v rámci projektu OPVK CZ.1.07/1.1.26/01.0034,,Zkvalitňování výuky chemie a biologie na GJO spolufinancovaného Evropským sociálním
Ústřední komise Chemické olympiády. 55. ročník 2018/2019 NÁRODNÍ KOLO. Kategorie E. Zadání praktické části Úloha 2 (30 bodů)
 Ústřední komise Chemické olympiády 55. ročník 2018/2019 NÁRODNÍ KOLO Kategorie E Zadání praktické části Úloha 2 (30 bodů) PRAKTICKÁ ČÁST 30 BODŮ Úloha 2 Stanovení Cu 2+ spektrofotometricky 30 bodů Cu 2+
Ústřední komise Chemické olympiády 55. ročník 2018/2019 NÁRODNÍ KOLO Kategorie E Zadání praktické části Úloha 2 (30 bodů) PRAKTICKÁ ČÁST 30 BODŮ Úloha 2 Stanovení Cu 2+ spektrofotometricky 30 bodů Cu 2+
LP č. 3 - ESTERY. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: 27. 12. 2012. Ročník: devátý
 LP č. 3 - ESTERY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 27. 12. 2012 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci prakticky vyzkouší
LP č. 3 - ESTERY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 27. 12. 2012 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci prakticky vyzkouší
Vlastnosti kyseliny sírové
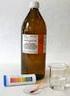 Vlastnosti kyseliny sírové Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 10 minut Pomůcky a) chemikálie - kyselina sírová - voda - kostka cukru b)
Vlastnosti kyseliny sírové Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 10 minut Pomůcky a) chemikálie - kyselina sírová - voda - kostka cukru b)
KVALITATIVNÍ ELEMENTÁRNÍ ANALÝZA ORGANICKÝCH LÁTEK
 LABORATORNÍ PRÁCE Č. 24 KVALITATIVNÍ ELEMENTÁRNÍ ANALÝZA ORGANICKÝCH LÁTEK PRINCIP Organická kvalitativní elementární analýza zkoumá chemické složení organických látek, zabývá se identifikací jednotlivých
LABORATORNÍ PRÁCE Č. 24 KVALITATIVNÍ ELEMENTÁRNÍ ANALÝZA ORGANICKÝCH LÁTEK PRINCIP Organická kvalitativní elementární analýza zkoumá chemické složení organických látek, zabývá se identifikací jednotlivých
Reakce kyselin a zásad
 seminář 6. 1. 2011 Chemie Reakce kyselin a zásad Známe několik teorií, které charakterizují definují kyseliny a zásady. Nejstarší je Arrheniova teorie, která je platná pro vodné prostředí, podle které
seminář 6. 1. 2011 Chemie Reakce kyselin a zásad Známe několik teorií, které charakterizují definují kyseliny a zásady. Nejstarší je Arrheniova teorie, která je platná pro vodné prostředí, podle které
LP č. 6 - BÍLKOVINY. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: 28. 2. 2013. Ročník: devátý
 LP č. 6 - BÍLKOVINY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 28. 2. 2013 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci prakticky ověří
LP č. 6 - BÍLKOVINY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 28. 2. 2013 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci prakticky ověří
Zjišťování vlastností různorodých látek pomocí žákovské soupravy pro chemii (laboratorní práce)
 Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.128/02.0055 Zjišťování í různorodých látek pomocí žákovské soupravy pro chemii (laboratorní práce) Označení: EU-Inovace-Ch-8-01 Předmět:
Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.128/02.0055 Zjišťování í různorodých látek pomocí žákovské soupravy pro chemii (laboratorní práce) Označení: EU-Inovace-Ch-8-01 Předmět:
STŘEDNÍ ODBORNÁ ŠKOLA a STŘEDNÍ ODBORNÉ UČILIŠTĚ, Česká Lípa, 28. října 2707, příspěvková organizace. Digitální učební materiály
 Název školy Číslo projektu Název projektu Klíčová aktivita Označení materiálu: Typ materiálu: Předmět, ročník, obor: Tematická oblast: Téma: Jméno a příjmení autora: STŘEDNÍ ODBORNÁ ŠKOLA a STŘEDNÍ ODBORNÉ
Název školy Číslo projektu Název projektu Klíčová aktivita Označení materiálu: Typ materiálu: Předmět, ročník, obor: Tematická oblast: Téma: Jméno a příjmení autora: STŘEDNÍ ODBORNÁ ŠKOLA a STŘEDNÍ ODBORNÉ
Název: Tajná písma. Výukové materiály. Téma: Organické a anorganické látky a indikátory. Úroveň: 2. stupeň ZŠ
 Název: Tajná písma Výukové materiály Téma: Organické a anorganické látky a indikátory Úroveň: 2. stupeň ZŠ Tematický celek: Vidět a poznat neviditelné Předmět (obor): chemie Doporučený věk žáků: 13 14
Název: Tajná písma Výukové materiály Téma: Organické a anorganické látky a indikátory Úroveň: 2. stupeň ZŠ Tematický celek: Vidět a poznat neviditelné Předmět (obor): chemie Doporučený věk žáků: 13 14
Pomůcky a materiál: plastelína, talíř, lžička, lžíce, sklenice, voda, Jar, zelené potravinářské barvivo, jedlá soda, ocet
 LÁVA Typ učiva: např. Anorganická chemie Časová náročnost: 15 minut Forma: např. ukázka/skupinová práce/práce ve dvojici Pomůcky a materiál: plastelína, talíř, lžička, lžíce, sklenice, voda, Jar, zelené
LÁVA Typ učiva: např. Anorganická chemie Časová náročnost: 15 minut Forma: např. ukázka/skupinová práce/práce ve dvojici Pomůcky a materiál: plastelína, talíř, lžička, lžíce, sklenice, voda, Jar, zelené
Návody pokusů k 2. laboratornímu cvičení Určeno pro žáky ZŠ
 Návody pokusů k 2. laboratornímu cvičení Určeno pro žáky ZŠ Obsah: 3. stanoviště analýza potravin...1 3.1 Škrob v potravinách...1 3.2 Stanovení ph vybraných potravin...2 3.3 Stanovení cukernatosti potravin...3
Návody pokusů k 2. laboratornímu cvičení Určeno pro žáky ZŠ Obsah: 3. stanoviště analýza potravin...1 3.1 Škrob v potravinách...1 3.2 Stanovení ph vybraných potravin...2 3.3 Stanovení cukernatosti potravin...3
Vodík, kyslík a jejich sloučeniny
 I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 8 Vodík, kyslík a jejich sloučeniny
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 8 Vodík, kyslík a jejich sloučeniny
Experiment C-15 DESTILACE 1
 Experiment C-15 DESTILACE 1 CÍL EXPERIMENTU Získání informací o třech klasických skupenstvích látek, změnách skupenství (jedné z fázových změn), křivkách ohřevu a ochlazování a destilační křivce. Prozkoumání
Experiment C-15 DESTILACE 1 CÍL EXPERIMENTU Získání informací o třech klasických skupenstvích látek, změnách skupenství (jedné z fázových změn), křivkách ohřevu a ochlazování a destilační křivce. Prozkoumání
Pracovně pedagogický koncept
 Pracovně pedagogický koncept Škola ZespółSzkółChemicznychWłocławek (PL) Druh studia Střední odborné vzdělání Obor studia Pracovník ochrany prostředí/technik v oblasti ochrany prostředí Oblast činnosti
Pracovně pedagogický koncept Škola ZespółSzkółChemicznychWłocławek (PL) Druh studia Střední odborné vzdělání Obor studia Pracovník ochrany prostředí/technik v oblasti ochrany prostředí Oblast činnosti
Inovace výuky - Přírodovědný seminář. Pokusy s vejci. Přs / 31, 32. vejce, skořápka, papírová blána, žloutek, bílek, uhličitan vápenatý
 Inovace výuky - Přírodovědný seminář Pokusy s vejci Přs / 31, 32 Vzdělávací oblast: Vzdělávací obor: Tematický okruh: Cílová skupina: Klíčová slova: Očekávaný výstup: Člověk a příroda Přírodopis Praktické
Inovace výuky - Přírodovědný seminář Pokusy s vejci Přs / 31, 32 Vzdělávací oblast: Vzdělávací obor: Tematický okruh: Cílová skupina: Klíčová slova: Očekávaný výstup: Člověk a příroda Přírodopis Praktické
Experiment C-16 DESTILACE 2
 Experiment C-16 DESTILACE 2 CÍL EXPERIMENTU Získání informací o třech klasických skupenstvích látek, změnách skupenství (jedné z fázových změn), křivkách ohřevu a ochlazování a destilační křivce. Prozkoumání
Experiment C-16 DESTILACE 2 CÍL EXPERIMENTU Získání informací o třech klasických skupenstvích látek, změnách skupenství (jedné z fázových změn), křivkách ohřevu a ochlazování a destilační křivce. Prozkoumání
Sada Látky kolem nás Kat. číslo 104.0020
 Sada Kat. číslo 104.0020 Strana 1 z 68 Strana 2 z 68 Sada pomůcek Obsah Pokyny k uspořádání pokusu... 4 Plán uspořádání... 5 Přehled jednotlivých součástí... 6, 7 Přehled drobných součástí... 8, 9 Popisy
Sada Kat. číslo 104.0020 Strana 1 z 68 Strana 2 z 68 Sada pomůcek Obsah Pokyny k uspořádání pokusu... 4 Plán uspořádání... 5 Přehled jednotlivých součástí... 6, 7 Přehled drobných součástí... 8, 9 Popisy
Kyselost a zásaditost vodných roztoků
 Kyselost a zásaditost vodných roztoků Autorem materiálu a všech jeho částí, není-li uvedeno jinak, je. Mgr. Vlastimil Vaněk. Dostupné z Metodického portálu www.rvp.cz, ISSN: 1802-4785, financovaného z
Kyselost a zásaditost vodných roztoků Autorem materiálu a všech jeho částí, není-li uvedeno jinak, je. Mgr. Vlastimil Vaněk. Dostupné z Metodického portálu www.rvp.cz, ISSN: 1802-4785, financovaného z
Pracovní list RYCHLOST METABOLISMU. Úloha 1: Stanovení optimálních podmínek pro metabolickou aktivitu kvasinek Saccharomyces cerevisiae
 Pracovní list RYCHLOST METABOLISMU Úloha 1: Stanovení optimálních podmínek pro metabolickou aktivitu kvasinek Saccharomyces cerevisiae Každý z vás si může vyzkoušet jednoduchý pokus: Do láhve dejte kousek
Pracovní list RYCHLOST METABOLISMU Úloha 1: Stanovení optimálních podmínek pro metabolickou aktivitu kvasinek Saccharomyces cerevisiae Každý z vás si může vyzkoušet jednoduchý pokus: Do láhve dejte kousek
