Biochemické parametry zony pellucidy prasečích oocytů během folikulogeneze
|
|
|
- Zdenka Němečková
- před 7 lety
- Počet zobrazení:
Transkript
1 Mendelova univerzita v Brně Agronomická fakulta Ústav chovu a šlechtění zvířat Biochemické parametry zony pellucidy prasečích oocytů během folikulogeneze Diplomová práce Vedoucí práce: Ing. Martin Hošek, Ph.D. Vypracovala: Bc. Denisa Vildová Brno 2014
2
3 ČESTNÉ PROHLÁŠENÍ Prohlašuji, že jsem diplomovou práci na téma Biochemické parametry zony pellucidy prasečích oocytů během folikulogeneze vypracovala samostatně a veškeré použité prameny a informace uvádím v seznamu použité literatury. Souhlasím, aby moje práce byla zveřejněna v souladu s 47b zákona č. 111/1998 Sb., o vysokých školách ve znění pozdějších předpisů a v souladu s platnou Směrnicí o zveřejňování vysokoškolských závěrečných prací. Jsem si vědoma, že se na moji práci vztahuje zákon č. 121/2000 Sb., autorský zákon, a že Mendelova univerzita v Brně má právo na uzavření licenční smlouvy a užití této práce jako školního díla podle 60 odst. 1 autorského zákona. Dále se zavazuji, že před sepsáním licenční smlouvy o využití díla jinou osobou (subjektem) si vyžádám písemné stanovisko univerzity, že předmětná licenční smlouva není v rozporu s oprávněnými zájmy univerzity, a zavazuji se uhradit případný příspěvek na úhradu nákladů spojených se vznikem díla, a to až do jejich skutečné výše. V Brně dne:.... podpis diplomanta
4 PODĚKOVÁNÍ Mé poděkování patří Ing. Martinu Hoškovi, Ph.D, bez jehož pomoci by tato diplomová práce nemohla vzniknout, Ing. Michalovi Ješetovi, Ph.D., za odborné vedení, trpělivost i za vynaložený čas. Dále bych chtěla poděkovat všem z Laboratoře reprodukčních biotechnologií, Výzkumného ústavu veterinárního lékařství, v.v.i. v Brně, kteří se na této práci podíleli, a mé rodině, která mě po celou dobu studia podporovala.
5 ABSTRAKT Polyspermické oplození je jedním z hlavních problémů při in vitro fertilizaci prasečích oocytů. Zona pellucida je extracelulární matrix, která obklopuje rostoucí savčí oocyty a je zodpovědná za polyspermický blok po oplození. Prasečí zona pellucida je tvořena třemi glykoproteiny označovanými jako ZP2, ZP3 a ZP4. Tato práce se zabývá modifikacemi ZP3 proteinu u oocytů s různou vývojovou kompetencí. Nebyl zjištěn žádný statistický průkazný rozdíl v expresi ZP3 proteinu u oocytů s nižší vývojovou kompetencí (velikost folikulů S), ve srovnání s oocyty s vyšší vývojovou kompetencí (velikost folikulů M). Byl však zjištěn statisticky průkazný rozdíl v acidifikaci ZP3 proteinu nezralých oocytů pocházejících z folikulů o velikosti S, ve srovnání s oocyty pocházejícími z folikulů o velikosti M. Navíc byl pomocí metody Western blot detekován band v oblasti > 50 kda, který by mohl mít zásadní roli během fertilizace oocytů. Klíčová slova: prasečí oocyty, zona pellucida, in vitro fertilizace, polyspermický blok, ZP3 protein ABSTRACT Polyspermic fertilization is one of major problems during in vitro fertilization of porcine oocytes. Zona pellucida is an extracellular matrix, that surrounds growing mammalian eggs and is responsible for polyspermy block after fertilization. Porcine zona pellucida is composed of three glycoproteins called ZP2, ZP3 and ZP4. This study is aimed to modifications of ZP3 protein of oocytes with different developmental competence. No significant differences were found in expression of ZP3 protein in oocytes with lower developmental competence (follicular size S), in compared to oocytes with higher developmental competence (follicular size M). However, it was found significant differences in acidification of ZP3 protein of immature oocytes removed from follicles of size S, in compared to oocytes removed from follicles of size M. Moreover, using Western blot analysis, it was detected band in area > 50 kda, which could play an essential role during fertilization of oocytes. Keywords: porcine oocytes, zona pellucida, in vitro fertilization, polyspermy block, ZP3 protein
6 OBSAH 1 Úvod Cíl Literární přehled Folikulogeneze a oogeneze Růst a vývoj folikulů Růst a vývoj oocytů Význam granulózních buněk a vodivých spojů (gap junction) Růstové faktory folikulogeneze a oogeneze Folikulogeneze v průběhu estrálního cyklu prasnice Neo-oogeneze Zrání oocytů Jaderné zrání První meiotický blok Regulační faktory znovuzahájení meiózy Druhý meiotický blok Dokončení meiózy Cytoplazmatické zrání Ovulace a oplození Ovulace Spermie v reprodukčním traktu prasnice Penetrace Aktivace oocytu a syngamie Zona pellucida Význam zony pellucidy Vznik zony pellucidy Složení zony pellucidy prasete... 31
7 ZP2 protein ZP3 protein ZP4 protein Úloha ZP proteinů během oplození a vzájemná interakce gamet Změny ZP proteinů během folikulogeneze, zrání a fertilizace Polyspermický blok Kortikální reakce ZP hardening Polyspermie in vivo vs. in vitro Materiál a metodika Dárkyně oocytů Získávání oocytů Zrání oocytů Imunohistochemická analýza Western blot Dvojrozměrná (2D) gelová elektroforéza Statistická analýza Výsledky Vizualizace ZP3 proteinu pomocí specifické protilátky Modifikace ZP3 proteinu během folikulogeneze Stanovení izoelektrického bodu ZP3 proteinu Diskuze Závěr Použitá literatura Seznam obrázků Seznam tabulek Seznam zkratek... 73
8 1 ÚVOD Prase domácí je bezesporu jedno z nejvýznamnějších hospodářských zvířat současnosti. Má mnohostranný způsob využití. Již od středověku bylo prase předmětem zkoumání a zajímali se o něj především lékaři. Díky značné podobnosti mnohých fyziologických funkcí člověku je dnes prase modelovým organismem a jeho význam v medicíně je o to větší, že se jeví jako nejvhodnější dárce pro xenotransplantace. Z hospodářského hlediska spočívá význam prasete především v produkci vepřového masa. V uplynulých desítkách let bylo šlechtění prasat zaměřeno hlavně na snižování obsahu intramuskulárního tuku a vysoký podíl libové svaloviny v jatečně upraveném těle. V dnešní době se šlechtění spíše orientuje na zvyšování reprodukční výkonnosti, charakterizované počtem odchovaných selat na prasnici za rok. Navyšování reprodukčního potenciálu se neobejde bez řádně aplikovaných biotechnických metod. Biotechnické metody vytváří jakýsi předpoklad, bez nichž by bylo požadovaných výsledků v reprodukci dosahováno jen stěží, např. inseminace prasnic je dnes běžně používaná biotechnická metoda v chovu. Intenzivní výzkum probíhá v oblasti in vitro fertilizace oocytů a in vitro produkce embryí. Zde ale narážíme hlavní a dosud nevyřešený problém, a to polyspermické oplození při in vitro fertilizaci prasečích oocytů. Polyspermie je nežádoucí jev, který je pro vývoj embrya letální. In vivo je polyspermii předcházeno redukcí počtu spermií v reprodukčním traktu samice a včasným vytvořením polyspermického bloku po oplození. V podmínkách in vitro však mechanismy tvorby tohoto bloku často selhávají a oocyt je pak oplozen více než jednou spermií najednou, čímž dochází k polyspermickému oplození a ke značným ztrátám embryí. Předmětem zájmu je tak zona pellucida extracelulární, nebuněčná matrix, která obklopuje cytoplazmatickou membránu rostoucích savčích oocytů a je zodpovědná za vznik polyspermického bloku po oplození oocytu. 8
9 2 CÍL Cílem práce byla charakteristika biochemických změn zony pellucidy prasečích oocytů během folikulogeneze, vyjádřená modifikacemi ZP3 proteinu u oocytů s různou vývojovou kompetencí. 9
10 3 LITERÁRNÍ PŘEHLED 3.1 Folikulogeneze a oogeneze V průběhu embryonálního vývoje se savčí oogonie, vzniklé z primordiálních zárodečných buněk, mitoticky dělí ve fetální vaječníky a vznikají oocyty, které vstupují do meiotického dělení (Miyano, 2005). Současně se zahájením meiózy, se z distálního konce kortikálních provazců vynořují jednotlivé primordiální folikuly (van den Hurk et Zhao, 2005). Vývoj oocytů je pak přirozeně zastaven v profázi I meiotického cyklu a následný růst a vývoj oocytů je spojen s folikulárním vývojem (Miyano, 2005) Růst a vývoj folikulů Primordiální folikuly, obklopující tyto oocyty, zůstávají v klidové fázi, dokud nejsou stimulovány k růstu (Luciano et al., 2012). Jejich počet je na vaječníku při narození konečný (Miyano, 2005). Spolu s oocyty musí podstoupit dlouhotrvající fázi růstu a vývoje (Gosden, 2002). Od puberty až do zániku pohlavní aktivity je z primordiálních folikulů kontinuálně vybírán malý počet oocytů, který vstoupí do růstové fáze (Miyano, 2005). Jakmile je folikul vybrán k růstu, dochází v oocytu k zahájení transkripce a translace a tento stav je udržován, dokud oocyt nedosáhne své konečné velikosti (Gosden, 2002). Většina oocytů ve vaječníku je však přítomna jako malé nerostoucí oocyty uvnitř primordiálních folikulů, a pak se na vaječníku vyskytuje malé procento rostoucích oocytů uvnitř folikulů, lišících se svou velikostí. Z celkových cca 420 tis. primordiálních folikulů se u prasete vyvíjí asi 84 tis. folikulů (Miyano, 2005) a fáze od počátku růstu primordiálních folikulů do konečné předovulační velikosti trvá přibližně 3 měsíce (Miyano, 2003). Předpokládá se, že růst folikulů začíná v takovém pořadí, v jakém jsou folikuly vytvořeny (van den Hurk et Zhao, 2005). Růstová fáze folikulu se skládá ze dvou odlišných po sobě jdoucích kroků. Za prvé, jde o přeměnu tvaru granulózních buněk z dlaždicových na kubické a expresi follistatinu, a za druhé, dochází ke zvýšení počtu granulózních buněk a růstu folikulu, který je doprovázen růstem velikosti oocytu (Braw-Tal, 2002). Po morfologických změnách granulózních buněk se folikuly vyvíjí aktivní proliferací těchto buněk (Miyano, 2005). 10
11 Změnou tvaru granulózních buněk z dlaždicových na kubické vzniká z primordiálního folikulu primární folikul a průměr oocytu se téměř nemění (van den Hurk et Zhao, 2005). Sekundární folikul je charakterizován vznikem druhé vrstvy granulózních buněk, počátečním ukládáním proteinů do matrix zony pellucidy a v cytoplazmě oocytu vznikají kortikální granula (Fair, 2003). V této době začíná folikul reagovat na gonadotropiny, roste a s ním roste i oocyt (van den Hurk et Zhao, 2005). Přechod na terciární (též Graafův nebo antrální) folikul je pak charakteristický pokračující proliferací a diferenciací buněk na theca interna a theca externa, bazální laminu a kumulární buňky a uvnitř vzniklé antrální dutiny se vytváří tekutina (Fair, 2003). Ta může sloužit jako důležitý zdroj regulačních či modulačních látek odvozených z krve nebo sekretu folikulárních buněk (např. gonadotropiny, steroidy, růstové faktory) a produkce folikulární tekutiny se postupně zintenzivňuje (van den Hurk et Zhao, 2005). Na konci růstové fáze folikulu celková transkripční aktivita klesá a jadérko oocytu je transformováno do neaktivního zbytku (Luciano et al., 2012) Růst a vývoj oocytů Proces formace oocytů zahrnuje sedm kroků: tvorbu primordiálních zárodečných buněk, migraci těchto buněk do základů budoucích gonád, kolonizaci gonád, diferenciaci zárodečných buněk na oogonie, proliferaci oogonií, zahájení meiózy a následné zastavení meiózy v diplotenní fázi profáze I. Aby bylo možné v meióze pokračovat, musí oocyt růst (van den Hurk et Zhao, 2005). Růstová fáze oocytu představuje řadu modifikací v množství, struktuře a rozložení jeho organel, stejně jako period transkripce, které jsou nezbytné k dosažení meiotické a vývojové kompetence (Luciano et al., 2012). Molekulární program je proto přesně načasován některé mrna jsou exprimovány po celou dobu oogeneze, zatímco jiné mrna jsou maskované až do doby meiotického zrání nebo do doby po něm (Gosden, 2002). Akumulace mrna, ribozomů a polypeptidů je rozhodující pro pozdější vývoj oocytu (Fair, 2003). Jak oocyty rostou, zvětšují svůj průměr, dochází k přerozdělování cytoplazmatických organel a objevuje se perivitelinní prostor organely jako jsou mitochondrie, Golgiho komplex, kortikální granula a jádro migrují na více periferní polohu (Fair, 2003). Malé nerostoucí oocyty prasete tak ze své původní velikosti 11
12 přibližně 30 μm dorostou do jejich finální velikosti okolo 120 μm (Miyano, 2005). Ve fázi, kdy oocyty již nerostou, syntéza mrna prakticky ustává a neobnoví se dříve, jak za 1 3 dny po oplození vajíčka (Gosden, 2002). Plně vyvinuté folikuly pak obsahují plně vzrostlé oocyty, reagují na cyklický nárůst gonádotropinů FSH (folikuly stimulujícího hormonu) a LH (luteinizačního hormonu) a oocyty mohou znovuzahájit meiózu (Miyano, 2005). Malé oocyty přítomné v primordiálních folikulech schopnost znovuzahájení meiózy nemají (Miyano, 2005). Primordiální folikuly však nejsou zcela tiché a existují důkazy o tom, že jejich zploštěné granulózní buňky občas vstupují do buněčného cyklu. Navíc změna na kubický tvar není nezbytným předpokladem pro vstup granulózních buněk do buněčného cyklu, ale když se stanou kubickými, vstupují do buněčného cyklu častěji (Braw-Tal, 2002). Obr. 1 Schématické znázornění folikulogeneze a oogeneze (převzato z Miyano, 2005). Růst a vývoj oocytů je neodmyslitelně spjat s folikulárním vývojem. Zahájením růstu primordiálních folikulů dochází i k zahájení růstu oocytů. Oocyty v sobě postupně hromadí a ukládají zásobní látky, zvětšují svůj objem a připravují se na znovuzahájení meiózy. Stadium terciárního folikulu je již citlivé na stimulaci gonadotropními hormony (FSH, LH) a s nárůstem předovulační vlny LH je zahájeno zrání oocytů Význam granulózních buněk a vodivých spojů (gap junction) Nezbytným předpokladem růstu oocytů, získaných z malých folikulů, je udržování kontaktu s jejich granulózními buňkami po dobu několika dnů, a to i v podmínkách in vitro (Gosden, 2002). Jak již bylo uvedeno, folikuly se vyvíjí aktivní proliferací těchto buněk (Miyano, 2005) a granulózní buňky produkují řadu růstových faktorů 12
13 a cytokinů, které mají prokazatelný nebo potenciální dopad na osud oocytu (Gosden, 2002). Proto oocyty závisí na obklopujících granulózních buňkách a také na buňkách thecy, které podporují jejich růst (Miyano, 2003). Na druhou stranu i oocyt aktivně ovlivňuje růst a diferenciaci svých granulózních buněk po dosažení prahové velikosti folikulu, oocyt potlačuje schopnost granulózních buněk podporovat další růst oocytu (van den Hurk et Zhao, 2005). Fair (2003) uvádí, že rychlost růstu oocytu je v přímém vztahu k počtu připojených granulózních buněk a Gosden (2002) podotýká, že zdravé embryo je jak odrazem kvality oocytu, tak kvality granulózních buněk. Folikulární buňky hrají také důležitou roli v regulaci meiotického bloku a znovuzahájení meiózy, její progresi do metafáze II (Eppig, 2001) a poskytují oocytu potřebné faktory pro dekondenzaci penetrované spermie a pro tvorbu samčího prvojádra (Hunter, 2000). Oocyt a jeho obklopující folikulární buňky sdílí komunikační systém vodivých spojů (gap junction), který proniká zonou pellucidou a usnadňuje přenos signálu stejně jako přenos živin do oocytu a z něj a mezi folikulárními buňkami (Fair, 2003). Tyto dva typy buněk jsou tak navzájem metabolicky propojeny a toto spojení se stává mnohem více intimní, když folikuly rostou (Gosden, 2002). Stavební kameny této komunikační sítě tvoří rodina proteinů connexin a jejich exprese je specifická aktuálnímu stavu granulózních buněk a fázi folikulogeneze (Fair, 2003). Charakter homologních a heterologních spojů se liší homologní spoje se vyskytují mezi granulózními buňkami navzájem a heterologní spoje se nachází mezi oocyty a granulózními buňkami (Gosden, 2002). Komunikace mezi oocyty a jejich somatickými buňkami je obousměrná (Miyano, 2003). Póry v běžných gap junction umožňují molekulární výměnu difuzí látek <1000 Da, včetně cukrů, aminokyselin, prekurzorů lipidů a nukleotidů. Toto je hlavní cesta vstupu látek do oocytu, ale oocyty jsou také aktivní v endocytóze (Gosden, 2002). Navíc signální faktory vyměňované mezi oocytem a obklopujícími granulózními či folikulárními buňkami jsou považovány za nezbytné pro indukci a regulaci diferenciace folikulárních kompartment ze specifické vývojové fáze folikulů do další, a tím i pro vývoj oocytu (van den Hurk et Zhao, 2005) Růstové faktory folikulogeneze a oogeneze Omezené znalosti o regulaci formování oocytů, jednotlivých krocích folikulogeneze a o požadovaných podmínkách pro rostoucí a zrající oocyty jsou hlavními příčinami 13
14 neúspěchu při získávání životaschopného potomstva v podmínkách in vitro. Především je známo málo informací o genech a faktorech, které regulují vznik a transport primordiálních zárodečných buněk, následný vznik oocytů a jejich uspořádání do primordiálních folikulů (van den Hurk et Zhao, 2005). V poslední době se také spekuluje o významu cévního zásobení, jehož morfologické změny by mohly mít zásadní podíl na regulaci růstu folikulů a jejich diferenciaci, a to zejména v posledních fázích antrálního vývoje, kdy je růst spojen s vyšším krevním zásobením (Martelli et al., 2009). Mezi hlavní růstové faktory, které hrají prominentní roli v oogenezi, aktivaci primordiálních folikulů a následném vývoji folikulů a oocytů patří c-kit receptor a jeho ligandy, inzulinu podobný růstový faktor I (IGF-I), IGF-I receptory a IGF-vazebné proteiny, členové rodiny transformačních růstových faktorů β (TGFβ) a zejména některé kostní morfogenetické proteiny (BMP). Např. je známo, že c-kit receptor a jeho ligandy hrají ústřední roli v řízení migrace a přežití primordiálních zárodečných buněk během embryonálního života (Fair, 2003) a kit-ligand (KL), produkovaný granulózními buňkami a vázající se na c-kit receptor, je jedním z nejznámějších růstových faktorů. Spontánní mutace příslušných genů má za následek, v závislosti na povaze mutace, nedostatek zárodečných buněk a zastavení vývoje oocytů (Gosden, 2002). Braw-Tal (2002) sestavila hypotetický model zahájení růstu folikulů, viz Obr. 2. Fáze I: Zahrnuje pomalou proliferaci granulózních buněk s následnou transformací tvaru buněk z dlaždicových na kubické. Tento krok by mohl být pod vlivem místně produkovaných inhibičních faktorů (activin A) a stimulačních signálů (např. KL a bfgf basic fibroblast growth factor). Fáze II: Ooocyty začínají růst a produkují růstové faktory GDF9/BMP15 (growth differentiation factor 9/ bone morphogenetic protein 15), nezbytné pro další proliferaci granulózních buněk. Granulózní buňky produkují KL, podporující růst oocytů, a follistatin, který chrání folikuly před možným inhibičním účinkem activinu A. Folikuly se tak stávají autonomní jednotkou, méně ovlivnitelnou lokálními stimuly. Výsledky Moniruzzaman et Miyano (2007) však naznačují, že KL u prasete nemusí být nutně asociován se zahájením růstu primordiálních folikulů, i když zvyšuje přežívání oocytů z těchto folikulů. V další práci pak Moniruzzaman et al. (2010) hovoří o tom, že primordiální oocyty u prepubertálních prasniček zůstávají spící díky trankripčnímu faktoru FOXO3 (forkhead box O3), který vytváří nerostoucí pool oocytů ve vaječníku. Záměrný knockdown tohoto faktoru aktivuje růstovou fázi oocytů. 14
15 Obr. 2 Hypotetický model zahájení růstu folikulů (převzato z Braw-Tal, 2002). Fáze I: Pod vlivem místně produkovaných inhibičních faktorů a stimulačních signálů dochází k proliferaci granulózních buněk a ke změně tvaru buněk z dlaždicových na kubické. Fáze II: Oocyt roste a produkuje růstové faktory umožňující další proliferaci granulózních buněk. Granulózní buňky pak produkují růstové faktory podporující růst oocytů a chránící folikuly před možnými inhibičními účinky. Gonadotropiny ovlivňují oocyty nepřímo, protože oocyt tyto receptory neexprimuje. FSH receptory jsou exprimovány granulózními buňkami, přinejmenším po fázi primordiálního tichého folikulu a když jsou tyto receptory odstraněny, folikuly jsou zastaveny na preantrálním stupni vývoje. LH receptory jsou lokalizovány v Graafovém folikulu, převážně v murálních granulózních buňkách (Gosden, 2002), a spouští biosyntézu thekálních androgenů, které jsou schopny stimulovat tvorbu FSH receptorů v granulózních buňkách a mohou tak zesilovat účinek FSH na sekundární folikuly (van den Hurk et Zhao, 2005). Tyto gonádotropní hormony mají zásadní vliv na osud oocytu, neboť určují počet selektovaných a počet ovulovaných folikulů (Knox, 2005). Estrogeny jsou kolem počátku formace folikulů silně snížené (ve srovnání s obdobím formace kortikálních provazců) a zdají se být nezávislé na produkci gonádotropinů, protože v té době ještě nedochází k expresi FSH a LH receptorů. Později je však produkce estrogenů stimulována hladinou FSH (van den Hurk et Zhao, 2005). 15
16 3.1.5 Folikulogeneze v průběhu estrálního cyklu prasnice Estrální cyklus prasete trvá přibližně dní a skládá se z folikulární fáze (5 7 dní) a luteální fáze (13 15 dní) (Soede et al., 2011). Folikulární fáze zahrnuje období před začátkem říje (proestrus) a období vlastní říje (estrus), zatímco luteální fáze zahrnuje období po skončení říje (metestrus) a klidové období (diestrus) trvající až do dalšího proestru (Louda et al., 2001). Během folikulární fáze se malé antrální folikuly vyvíjejí do velkých předovulačních folikulů a jsou ovulovány (Soede et al., 2011). Ze stovky folikulů, které tak začínají během estrálního cyklu svůj růst (Knox, 2005), může být ovulováno pouze oocytů, v závislosti na věku, výživě a ostatních faktorech (Soede et al., 2011). Toto může být způsob, jak zabránit vývojově nekompetentním oocytům být ovulovány, nebo se může jednat o způsob redukce nadměrného počtu oocytů na ovulaci (Knox, 2005). Během luteální fáze je vývoj folikulů méně výrazný, a to díky progesteronové inhibici gonadotropních hormonů a vyšší koncentraci estrogenu a inhibinu v době před ovulací. Tvorba časného antrálního poolu v této době má pravděpodobně zásadní vliv na dynamiku folikulů ve folikulární fázi (Soede et al., 2011). Jakmile je folikul přijat k růstu, buď bude dále růst, anebo degeneruje (Knox, 2005). Stadium terciárních folikulů je charakteristické náborem, selekcí a dominancí folikulů a pouze dominantní folikuly mohou dorůst do předovulační velikosti (van den Hurk et Zhao, 2005). Jak antrální folikuly zrají, stávají se viditelnými (> 1 mm). Knox (2005) klasifikoval viditelné folikuly na povrchu vaječníku jako malé (< 3 mm), střední (3 6,9 mm) a velké ( 7 mm). V den říje (den 0) se na vaječníku vyskytovalo přibližně 15 malých a středních folikulů a 15 velkých folikulů. V den 3 přibližně 30 malých, 5 středních folikulů a žádné velké folikuly. Na začátku folikulární fáze počet malých a středních folikulů rychle klesá, protože pool středních folikulů je selektován pro další růst. Po 16. dnu cyklu se na vaječníku vyskytuje přibližně terciárních folikulů, a pak jich degeneruje v procesu atrézie (Kim et al., 2012). Van den Hurk et Zhao (2005) hovoří o tom, že počet folikulů přijatých k dalšímu růstu je více jak 50. Během folikulárního růstu a vývoje tak selektivně zmizí více než 99 % folikulů (Kim et al., 2012) a povrch vaječníku během estrálního cyklu tvoří směs zdravých a artretických folikulů (Knox, 2005). 16
17 Následná selekce folikulů probíhá, u cyklujících prasniček, v přítomnosti žlutého tělíska (corpus luteum, CL). CL mění prokrvení tkání a může nepřímo ovlivnit růst folikulů, zejména produkcí progesteronu (Knox, 2005). Když je luteolýza CL již kompletní, koncentrace periferního progesteronu se sníží na původní hladinu a umožňuje vývoj velkých folikulů (Soede et al., 2011). Zbývající folikuly vstupují do atrézie. V estrogen-aktivních folikulech je míra atrézie nízká. Časným ukazatelem atrézie tak může být nízká hladina estrogenů v konkrétních folikulech (Knox, 2005), která je způsobená sníženou expresí aromatázy produkující účinný anti-apoptotický hormon estrandiol z thekálního androgenu (van den Hurk et Zhao, 2005). Navíc malé folikuly mají nedostatek LH receptorů a jsou závislé na FSH. Při poklesu koncentrace FSH podléhají atrézii (Soede et al., 2011). Folikuly, které v době selekce atrézii unikly, jsou nyní dostatečně zralé k požadované odpovědi na vzestup LH a mohou být ovulovány (Knox, 2005). Dominantní folikuly vylučují velké množství estradiolu a inhibinu a pod vlivem LH, navzdory snížení koncentrace FSH, za pár dní rychle zvětší svou velikost (van den Hurk et Zhao, 2005). Produkované estrogeny navozují říjové chování a změny na pohlavních orgánech samice. Velikost zralých Graafových folikulů je v průměru 5 11 mm (Říha et al., 2003). V době před ovulací produkce estrogenů dosahuje svého maxima a indukuje vzestup vlny LH. Ta iniciuje folikulární změny vedoucí k ovulaci a luteinizaci folikulární stěny (Soede et al., 2011). U krávy, ovce, kozy a klisny se pobíhá nábor, selekce a dominance v několika růstových vlnách (van den Hurk et Zhao, 2005). U prasete se vlny folikulárního vývoje do dominantního stadia nevyskytují (Soede et al., 2011). Existuje domněnka, že podmínky, které řídí vývoj a selekci folikulů pro ovulaci, nemusí kontrolovat pouze míru ovulace, ale také kvalitu oocytů. Ve většině případů míra ovulace není omezena (hodnoceno podle vyvíjejících se CL). Jakmile je však vyprodukováno oocytů, dochází k omezení velikosti vrhu selháním fertilizace, embryonálními a fetálními ztrátami v důsledku omezeného prostoru dělohy nebo dochází ke ztrátám plodů v důsledku probíhajícího onemocnění (Knox, 2005). 17
18 Obr. 3 Schématické znázornění folikulárního vývoje prasete, ovce, krávy a klisny (převzato z van den Hurk et Zhao, 2005). Aktivací primordiálních folikulů (ProF) vznikají primární folikuly (PrimF), které se vyvíjí do sekundárních folikulů (SekF). Rozvojem antrální dutiny v sekundárních folikulech vznikají terciární folikuly (TerF). Stadium terciárních folikulů je charakteristické bazálním růstem folikulů, kdy pouze část z nich je následně vybrána k dalšímu růstu. Selekcí těchto vybraných folikulů pak vznikají dominantní folikuly, které dorostou do předovulační velikosti a jsou ovulovány. Příjem terciárních folikulů k dalšímu růstu a jejich následný vývoj je závislý na gonadotropních hormonech Neo-oogeneze Centrální podstata biologie vaječníku savců, že počet oocytů je u dospělých samic konečný, byla v posledních letech napadána zastánci neo-oogeneze, kteří tvrdí, že na povrchu epitelu vaječníků nebo v kostní dřeni se nacházejí stále aktivní zárodečné kmenové buňky, které jsou transportovány přes oběhový systém do vaječníku a doplňují kvótu oocytů po narození. Neo-oogeneze by měla velký význam zejména pro ženskou plodnost. Existuje řada protichůdných názorů, ale většina klíčových teorií podporujících neo-oogenezi byla již vyvrácena. Nicméně, kvalifikovaná podpora neo-oogeneze byla pravděpodobně vyjádřena u myší (Notarianni, 2011). 18
19 3.2 Zrání oocytů Nezralé oocyty jsou zastaveny v profázi heterotypického dělení (v profázi I), v prvním meiotickém bloku a čekají na aktivační stimul nezbytný pro znovuzahájení meiózy. V podmínkách in vivo je to LH peak (Mehlmann, 2005). Zrání oocytů je konečnou fází oogeneze (Ohashi et al., 2013) a znamená vývoj oocytů od profáze I do metafáze druhého homeotypického dělení (MII). V MII nastává druhý meiotický blok, který trvá do doby, než dojde k oplození. Během zrání oocytů musí proběhnout jak jaderné, tak i cytoplazmatické zrání (Marques et al., 2007) Jaderné zrání Meióza je zahájena již v období fetálního vývoje, během procesu tvorby oocytů, a pak je přirozeně zastavena v diplotenní fázi profáze I (Hunter, 2000), která odpovídá fázi G2 buněčného cyklu (Dekel, 2005). Jádro oocytů je v této době silně zvětšené a nazývá se zárodečný váček (germinal vesicle, GV) (Iwashita et al., 1998). Jak oocyty rostou a zvětšují svůj objem, jádro zůstává stále v profázi I (Hirao et al., 1994). Oocyty exprimují mnoho genů a hromadí velké množství mrna a proteinů (Krisher, 2004), nezbytných pro znovuzahájení meiózy (Dode et Graves, 2003). Vývojová kompetence prasečích oocytů je ovlivněna velikostí folikulů (Krisher, 2004) a především velikostí oocytů (Lucas et al., 2002). K nabytí meiotické kompetence dochází v době vzniku antra folikulu a odpovídá době, kdy oocyt dosáhne prahové hladiny zracích promoting proteinů (Mehlmann, 2005). Vývojová a meiotická kompetence mohou být charakterizovány jako schopnost oocytů zrát, být oplozeny a dát fertilní potomstvo (Hulínská et al., 2011). Navzdory schopnosti plně dorostlého oocytu zrát, zůstává v profázi I a čeká na nárůst předovulační vlny LH (Mehlmann, 2005). Vlna LH aktivuje vícenásobné signální dráhy vedoucí ke zrání oocytu (Conti et al., 2012). V podmínkách in vitro dochází ke spontánnímu znovuzahájení meiózy při uvolnění oocytu z inhibičního prostředí folikulu (Lin et al., 2008). Hlavním zdrojem oocytů pro IVM (in vitro maturation) jsou vaječníky prepubertálních prasniček získané po porážce a pro běžné rutinní postupy jsou často aspirovány oocyty ze středně velkých folikulů (3 6 mm) (Abeydeera, 2002). Jaderné zrání těchto oocytů v podmínkách in vitro trvá cca 44 hodin (van den Hurk 19
20 et Zhao, 2005). Oocyty získané z velkých antrálních folikulů (> 8 mm) jsou schopné dokončit zrání již za 18 hodin IVM (Kwak et al., 2014) První meiotický blok Zastavení oocytů v prvním meiotickém bloku závisí na vysoké úrovni camp v oocytu. Cyklický adenosinmonofosfát (camp) ovlivňuje, přes proteinkinázu A (PKA), aktivitu proteinového kompexu MPF (maturation promoting factor též M-phase promoting factor) (Mehlmann, 2005). MPF je zodpovědný za přechod z G2 do M fáze buněčného cyklu (Jung et al., 1993). Vysoká hladina camp jej činí neaktivní a zabraňuje tak znovuzahájení meiózy (Mehlmann, 2005). V podmínkách in vitro nastane přechod z G2 do M fáze v prvních 24 hodinách zrání (Dode et Graves, 2003). Cyklický AMP vzniká ve folikulárních buňkách z adenosinmonofosfátu (ATP) prostřednictvím adenylátcyklázy (AC) a oocytu je předáván přes gap junctions. Na udržování vysoké hladiny camp v oocytu se podílí i cyklický guanosinmonofosfát (cgmp), který je stejně jako camp produkován okolními folikulárními buňkami, a inhibuje hydrolýzu camp fosfodiesterázou PDE3A (Adhikari et Liu, 2014). PDE3A hydrolyzuje jak camp, tak i cgmp. Rychlost hydrolýzy camp je však o jeden řád vyšší než u cgmp (Conti et al., 2012). Existuje domněnka, že camp může být syntetizovaný i samotným oocytem, např. přes G protein-coupled receptor (GPCR), přítomný v cytoplazmatické membráně oocytu (Adhikari et Liu, 2014). Předovulační vlna LH iniciuje v murálních granulózních buňkách expresi EGF-like proteinů (epidermal growth factor-like proteins) (Mehlmann, 2005), které podporují pokles hladiny cgmp v oocytu a napomáhají expanzi kumulárních buněk (Conti et al., 2012). LH vyvolává degradaci gap junctions v celém folikulu a zamezuje tím vstupu cgmp do oocytu. Zvyšuje se hydrolytická činnost PDE3A a ta vede k degradaci camp (Adhikari et Liu, 2014). Zároveň vlna LH eliminuje působení inhibičních faktorů, jako je např. OMI (oocyte maturation inhibitor), a odstraněním inhibičních látek dochází k aktivaci cyklinů, fosfatáz a kináz potřebných pro znovuzahájení meiózy (Hunter, 2000). Podle nejnovějších poznatků jsou však během prvního meiotického bloku aktivovány činností FSH/LH dva hlavní signály, odpovídající dvěma typům druhých poslům, camp a vápenatým iontům (Ca 2+ ). FSH/LH vyvolává mobilizaci Ca 2+ v kumulárních buňkách a stejně tak v oocytu. Význam mobilizace Ca 2+ v kumulárních 20
21 buňkách je nejasný, ale zvýšení koncentrace Ca 2+ v oocytu aktivuje signální dráhy zapojené do znovuzahájení meiózy a jedním z možných cílů je i inhibice adenylátcyklázy (Chen et al., 2013) Regulační faktory znovuzahájení meiózy Obnovení meiózy je doprovázeno podstatným zvýšením aktivity kináz v cytoplazmě oocytu. Stěžejním prvkem je MPF (M-phase promoting factor) (Hunter, 2000). Tento proteinový kompex se skládá ze dvou hlavních podjednotek, a to katalytické podjednotky CDK1 (cyclin-dependent kinase 1; také p34 cdc2 nebo Cdc2) a regulační podjednotky cyclinu B1 (Adhikari et Liu, 2014). Vysoká hladina camp uvnitř oocytu činila tento komplex neaktivní (pre-mpf), protože docházelo k fosforylaci CDK1 na pozici Thr14 a Tyr15. Poklesem hladiny camp dochází k defosforylaci na stejném místě a MPF komplex se stává aktivní (Nebreda et Ferby, 2000). Inhibiční fosforylace CDK1 jsou katalyzovány proteinkinázami Myt1/Wee1, zatímco defosforylace CDK1 závisí na Cdc25 fosfatáze (Conti et al., 2012). Tyto fosforylace a defosforylace jsou řízeny proteinkinázou A, která prostřednictvím neurčitého počtu kroků reguluje jak aktivitu Myt1/Wee1, tak i aktivitu Cdc25 fosfatázy. Aktivita PKA je ovlivňovaná hladinou camp (Mehlmann, 2005). Aktivní MPF zahajuje zrání oocytů a podněcuje vstup do M fáze prvního meiotického cyklu (Ogushi et al., 2005). Zrání je pod kontrolou CDK1 a MAP kináz (mitogen-activated protein kinase; MAPK) (Kanayama et al., 2002). Na zrání oocytů se podílí také Ca 2+ (Wang et Machaty, 2013). Členové rodiny MAP kináz jsou serin/threoninové proteinkinázy, které jsou aktivovány jejich fosforylací na specifické tyrosinové a threoninové zbytky (Dekel, 1996) prostřednictvím aktivační dráhy MEK-MAP-kinase pathway (Kanayama et al., 2002). U prasete jsou MAP kinázy aktivovány před nebo současně s aktivací MPF a vyskytují se ve dvou izoformách, a to ERK1 a ERK2 (Hunter, 2000). Vápník (Ca 2+ ) působí jako spínač aktivující nepřeberné množství na vápníku-závislých intracelulárních drah. CaMKII (calcium/calmodulin-dependent protein kinase II) je prostředníkem účinku Ca 2+ a je zapojena do znovuzahájení meiózy, uvolňování obou polárních tělísek (polar body, PB) a výstupu z druhého meiotického bloku. Inhibice CaMKII brání akumulaci cyclinu B1 a plné fosforylaci MAP kinázy 21
22 (Fan et al., 2003). Stejně tak narušení aktivační dráhy CaMKII vede ke zpoždění/inhibici meiotického cyklu a k inhibici prvního PB (Xu et al., 2009). CDK1 vyvolává rozpad zárodečného váčku (germinal vesicle breakdown, GVBD), kondenzaci chromatinu a tvorbu dělícího vřeténka (Ogushi et al., 2005). První meiotické dělení pokračuje přes metafázi I a je ukončeno tvorbou prvního PB (Dekel, 1996). PB obsahuje jednu sadu chromozomů a druhá je zachována v oocytu (Adhikari et Liu, 2014). Bezprostředně po meióze I následuje druhé meiotické dělení a pokračuje až do metafáze II, kde dochází k druhému meiotickému bloku trvajícímu do doby, než dojde k oplození (Dekel, 1996). Hladina MPF se během zrání výrazně zvýšila a dosáhla maxima v metafázi I, a pak během anafáze I a telofáze I poklesla. Zvýšila se opět v metafázi II (Ogushi et al., 2005). Pokles hladiny MPF současně s výstupem z metafáze I je nezbytný pro dokončení prvního meiotického dělení a uvolnění PB (Dekel, 2005). Přechodnému snížení CDK1 odpovídá i snížení cyclinu B1 (Ogushi et al., 2005). Následná reaktivace MPF potlačuje interfázi mezi dvěma meiotickými cykly a zajišťuje plynulý přechod do metafáze II (Dekel, 2005). Hladina MPF je udržována na vysoké úrovni až do oplození (Ogushi et al., 2005). MAP kináza se podílí na reorganizaci mikrotubulů do dělícího vřeténka v metafázi I a pravděpodobně fosforyluje některé substráty MPF v době poklesu jeho hladiny, čímž zabraňuje oocytu vstoupit do interfáze (Dekel, 1996). Inhibice MAP kinázy v době přechodu z meiózy I do meiózy II vede k selhání tvorby dělícího vřeténka a k neuvolnění prvního PB (Sun et Nagai, 2003). Hladina MAP kinázy se plynule zvyšuje do metafáze II a zůstává vysoká i během uvolnění prvního PB. MAP kináza je zodpovědná za druhý meiotický blok (Hunter, 2000) Druhý meiotický blok Haploidní oocyty se nacházejí v metafázi II, v druhém meiotickém bloku, a tento stav je udržován činností MAP kinázy (Dekel, 2005). Oocyt již uvolnil první PB a je považován za zralý (Sun et Nagai, 2003). Farmakologická inhibice MAP kinázy v této době vede k výstupu z druhého meiotického bloku s následnou inaktivací MPF. Partenogenetická aktivace elektrostimulací a vydělení druhého PB jsou silně narušeny (Tatemoto et Muto, 2001). 22
23 Vysoká hladina MPF a MAP kinázy působí v oocytu jako cytostatický faktor (cytostatic factor, CSF), který navozuje druhý meiotický blok (Sun et Nagai, 2003). CSF tak nepopisuje jedinou molekulu nebo protein (Tunquist et Maller, 2003), ale komplex molekul skládající se z několika typů proteinkináz (Fan et al., 2002). MPF je považovaný za důležitou součást CSF prasečích oocytů (Sun et Nagai, 2003). Náhlý pokles MPF aktivity po oplození je předpokladem pro výstup z druhého meiotického bloku. Nezbytná je také degradace cyclinu B1, který je během metafáze II do jisté míry neustále syntetizován a degradován (Fan et al., 2002). V tomto období je oocyt připraven na oplození (Dekel, 1996). Obr. 4 Schématické znázornění zrání oocytů (převzato z Adhikari et Liu, 2014). Oocyty jsou zadrženy v profázi I, v prvním meiotickém bloku, a jádro se v této době nazývá zárodečný váček (GV), chromozomy jsou dekondenzované. Předovulační vlna LH nebo mechanické uvolnění oocytu z folikulu vyvolává rozpad zárodečného váčku (GVBD), kondenzaci chromozomů a tvorbu dělícího vřeténka. Meióza pokračuje metafází I a dokončení prvního meiotického cyklu je doprovázeno uvolněním prvního polárního tělíska pod zonu pellucidu. Druhý meiotický cyklus pokračuje až do metafáze II a nastává druhý meiotický blok, který trvá do doby, než dojde k oplození nebo k partenogenetické aktivaci Dokončení meiózy Po fertilizaci nebo partenogenetické aktivaci oocyty pokračují v meióze, uvolní druhé PB a meióza je dokončena (Sun et Nagai, 2003). Hladina MPF se v důsledku zvýšení intraoocytární koncentrace Ca 2+ sníží a po inaktivaci MPF dochází i ke snížení hladiny MAP kinázy (Ogushi et al., 2005). Tyto procesy jsou indukovány CaMKII (Fan et al., 2003). Po elektrostimulaci prasečích oocytů dochází k inaktivaci MPF velmi rychle, zatímco k inaktivaci MAP kinázy je potřeba delší časový úsek (Tatemoto et Muto, 2001). K defosforylaci MAP kinázy dochází až v době, když jsou vytvořena obě prvojádra (Sun et Nagai, 2003). 23
24 3.2.2 Cytoplazmatické zrání Během jaderného zrání dochází k významným morfologickým změnám v cytoskeletu oocytu (Lin et al., 2008). Jaderné a cytoplazmatické zrání jsou dvě na sobě relativně nezávislé fyziologické události a předpoklady pro ně nejsou stejné (Coy et al., 1999), tj. dokončení jaderného zrání nemusí odpovídat dokončení cytoplazmatického zrání (Abeydeera, 2002). Cytoplazmatické zrání je však nezbytným předpokladem pro oplození oocytu a následný embryonální a fetální vývoj (Krisher, 2004). Cytoplazmatické zrání může být definováno jako schopnost oocytů dokončit oplození v podmínkách in vitro (Maedomari et al., 2007). Jeho význam spočívá v zabezpečení podmínek, které v případě oplození blokují polyspermii, dekondenzují penetrovanou spermii a vytváří samčí (male pronucleus, MPN) a samičí (female pronucleus, FPN) prvojádro a zahrnuje také redistribuci buněčných organel (van den Hurk et Zhao, 2005) a zvýšení intracelulárního obsahu Ca 2+ (Mao et al., 2012). Přestavba buněčných organel je jedním z klíčových faktorů zrání (Brevini et al., 2007). Oocyty ukládají zásobní látky a podstupují morfologické změny, které jsou nezbytné pro časný vývoj embrya (Marques et al., 2007). Mitochondrie, proteinové komplexy, mrna a další organely jsou pomocí sítě mikrofilament transportovány do oblastí potřebných pro jejich specifickou činnost (Brevini et al., 2007). Dochází ke zvýšení počtu mitochondrií, ke změně jejich morfologie, mění se ultrastruktura Golgiho komplexu, dochází k akumulaci ribozomů (Fulka et al., 1998), k akumulaci endoplazmatického retikula (Ohashi et al., 2013) a kortikální granula jsou organizována podél oolemmy oocytu (Dieleman et al., 2002). Bylo zjištěno, že u prasete je zrání oocytů, oplození i časný vývoj embrya spojen se změnami mitochondriální distribuce (Sun et al., 2001). Mitochondrie, jako hlavní producenti energie pro buňku ve formě ATP, migrují z periferie oocytu (u GV oocytů) do perinukleární pozice (MII), a to jak in vivo, tak in vitro. Migrace mitochondrií do středu buňky byla zjištěna u oocytů s vysokou vývojovou kompetencí, což může souviset s vysokou potřebou energie pro syngamii a následnou mitózu (Brevini et al., 2007). Zrání oocytů v podmínkách in vitro může způsobit neúplný pohyb mitochondrií a ovlivnit tak cytoplazmatické zrání oocytu (Torner et al., 2004). Podle Pawlak et al. (2012) se oocyty prepubertálních prasniček liší od oocytů cyklujících prasniček zrajících in vitro ve vybraných faktorech cytoplazmatického zrání. Transport kortikálních granul na periferii oocytu a obsah mitochondriální DNA nebyl 24
25 ovlivněn pohlavní dospělostí dárce, ale redistribuce mitochondrií byla pozorována pouze u oocytů cyklujících prasniček. Cytoplazmatické zrání je také často definováno jako schopnost oocytu tvořit po oplození samčí prvojádro (Dode et Graves, 2003). Tvorba MPN je problematická zejména při zrání oocytů v podmínkách in vitro. Některá IVM média jsou sice schopná dosáhnout jaderného zrání, ale už ne cytoplazmatického zrání (Marques et al., 2007). Z obecného hlediska je oocyt považován za zralý, když vyděluje první PB (jaderné zrání) a nachází se v druhém meiotickém bloku. Oocyty však mohou být vývojově nekompetentní kvůli nedostatku v některém z cytoplazmatických faktorů (Sun et Nagai, 2003) a po oplození se neúplnost cytoplazmatického zrání projeví jako neschopnost tvorby MPN (Dode et Graves, 2003). Tvorba MPN v podmínkách in vitro je tedy závislá na použitém IVM médiu a na faktorech, jako je např. systém zrání, obsah glutationu ve zracím médiu a individualita kance, ale tvorba MPN není ovlivněna množstvím spermií použitých na oocyt (Coy et al., 1999). 3.3 Ovulace a oplození Oplození je komplexní proces, při kterém samčí a samičí haploidní gamety splynou a dají vzniknout novému geneticky odlišnému jedinci. U savců oplození zahrnuje řadu po sobě jdoucích kroků, včetně migrace spermií přes samičí pohlavní ústrojí, penetraci spermií přes kumulární buňky, navázání na zonu pellucidu (ZP), akrozomální reakci, penetrace spermií skrz ZP a splynutí cytoplazmatických membrán spermie a oocytu. Oplození předchází ovulace zralého oocytu (Signorelli et al., 2012) Ovulace Poté, co je dokončen růst oocytů, folikuly stále pokračují v růstu, dokud nedosáhnou své prahové velikosti (Fissore et al., 2002). Růst folikulů je stimulován nárůstem předovulační vlny LH (van den Hurk et Zhao, 2005), která také vyvolává zrání oocytů (Mehlmann, 2005) a indukuje kaskádu procesů vedoucí k ovulaci (Eppig, 2001). Ovulace je konečnou fází folikulogeneze (Brännström et Enskog, 2002). Vlna LH stimuluje v předovulačních folikulech řadu proteolytických enzymů, které způsobují degradaci extracelulární matrix a zejména degradaci kolagenových vláken folikulární stěny. Zvyšuje se průtok krve a dochází k překrvení folikulu (Tsafriri et Reich, 1999). Tyto změny vedou ke zvýšení intrafolikulárního tlaku a k nižší pevnosti 25
26 folikulární stěny. Když už folikulární stěna nemůže zvýšený intrafolikulární tlak vyrovnat, dochází k prasknutí folikulu (Brännström et Enskog, 2002) a ovulaci zralého oocytu do peritoneální dutiny v blízkosti nálevky vejcovodu (Tanghe et al., 2002). V místě prasklého folikulu se vytváří corpus luteum. CL vzniká luteinizací murálních granulózních buněk, buněk thecy, kapilár a fibroblastů. Jeho hlavní funkcí je produkce progesteronu (Stocco et al., 2007). Během zrání oocytů dochází k expanzi kumulárních buněk (Chen et al., 2013). Kumulární buňky vylučují kyselinu hyaluronovou, která v hydratovaném stavu rozšiřuje mezery mezi kumulárními buňkami a vytváří lepkavou, mucinózní matrix (Eppig, 2001). Tyto komplexy kumulárních buněk a oocytů (cumulus-oocyte complexes, COC) napomáhají uvolňování oocytu během ovulace, usnadňují přijetí oocytu nálevkou vejcovodu a umožňují transport na místo oplození (Tanghe et al., 2002). Zvětšení objemu COC je důležité zejména u zvířat se širokou ampulí vejcovodu, neboť se zvyšuje pravděpodobnost setkání spermie s oocytem. COC jsou u prasete důležité i v době oplození odstranění kumulárních buněk snižuje míru fertilizace jak in vivo, tak in vitro (Van Soom et al., 2002) Spermie v reprodukčním traktu prasnice K přirozenému páření dochází asi hodin před ovulací (Rodriguez-Martinez et al., 2005), v období vlastní říje, kdy je samice svolná ke krytí kancem a vykazuje reflex nehybnosti (Louda et al., 2001). Kanec deponuje ejakulát do krčku děložního a ten rychle prochází do děložního lumen, který je výrazně zvětšený. Poslední frakce ejakulátu obsahuje látky, které sráží semennou plazmu, čímž zabraňují zpětnému odtoku ejakulátu do pochvy (Rodriguez-Martinez et al., 2005). Jen velmi málo spermií dosáhne při oplození ampule vejcovodu. Redukce počtu spermií in vivo je přirozený způsob, jak předcházet polyspermii, která je pro vývoj embrya letální (Bedford, 2008). Většina spermií je eliminována v děloze s výjimkou malých subpopulací spermií, které se rychle (během několika minut) přepravují kontrakcemi myometria směrem k uterotubarnímu rozhraní (Rodriguez-Martinez et al., 2005). Spermie jsou pak při své cestě za oocytem zadrženy v isthmus, v zúžené části vejcovodu, a to buď přilepením k epitelu nebo ponořením do intraluminální tekutiny, což způsobuje stabilizaci buněčných membrán a potlačení schopnosti kapacitace spermií až do doby blízko ovulaci (Hunter et Rodriguez-Martinez, 2004). Z isthmus 26
27 jsou spermie uvolňovány postupně, v menší míře i před ovulací, v souvislosti s postupnou indukcí kapacitace v horní části isthmus, po expozici vejcovodové tekutině (Rodriguez-Martinez et al., 2005). Kapacitace spermií je předfertilizační proces, který probíhá v reprodukčním traktu samice (Hunter et Rodriguez-Martinez, 2004) a umožňuje spermii navázat se na oocyt a podstoupit akrozomální reakci (Wassarman, 1999). Kapacitace zahrnuje odstranění inhibičních faktorů navázaných na spermie v ocasu nadvarlete a v isthmus (Rodriguez- Martinez et al., 2005) a zároveň dochází k přestavbám a/nebo modifikacím membránových proteinů a lipidů (Wassarman, 1999). Během kapacitace jsou ZP-vazebné proteiny spermie uspořádány ve funkční proteinové komplexy, které se nacházejí na apikálním hrotu hlavičky spermie, což je funkční oblast podílející se na primární vazbě k ZP (Boerke et al., 2008). Dochází k odstranění cholesterolu z membrány spermie, čímž se zvyšuje její tekutost a je více fúzogenní (Signorelli et al., 2012). A dochází také k hyperaktivaci spermií, která je nezbytná pro úspěšné oplození in vivo, protože umožňuje spermii dosáhnout místa oplození a pomáhá spermii při pronikání skrz kumulární buňky a zonu pellucidu. Hyperaktivované spermie plavou energeticky v kruzích, vlnění bičíku je asymetrické a bičík se otáčí častěji kolem své osy. Tento pohyb vykazuje většina spermií získaných z oviduktální ampule (Ho et Suarez, 2001). Kapacitace kančích spermií in vivo trvá, v závislosti na stavu spermií, 1 2 hodiny nebo více (Rodriguez-Martinez et al., 2005). Kapacitace spermií v podmínkách in vitro trvá cca 3 hodiny (Sun et Nagai, 2003) Penetrace Hyperaktivovaná spermie musí po nalezení COC proniknout dvěma bariérami kumulárními buňkami a zonou pellucidou. Akrozom je velká sekreční vezikula, která překrývá jádro spermie v apikální části hlavičky, je charakteristická vnější a vnitřní akrozomální membránou (Wassarman, 1999) a obsahuje hojné hydrolytické enzymy. Když spermie proniká kumulárními buňkami nebo ZP, dochází k procesu zvanému akrozomální reakce (AR). Vnější a vnitřní membrána na více místech splynou, což vede k uvolnění obsahu akrozomu. Uvolněné enzymy napomáhají penetraci skrz kumulární buňky a ZP (Chen et al., 2013). Podle starší teorie je AR vyvolána až kontaktem se ZP. Ale velké množství spermií prodělává AR již při penetraci přes kumulární buňky. Tyto falešně reagující spermie 27
28 napomáhají rozrušovat matrix kumulárních buněk, a tím uvolňují cestu akrozomneporušených spermiím (Chen et al., 2013). Akrozom-neporušená spermie se váže na ZP svými vazebnými proteiny (primární vazba) nacházejícími se na apikální části hlavičky a téměř okamžitě podstupuje spermie AR. Je obnažována řada intraakrozomálních proteinů s vysokou afinitou k ZP a dochází k sekundární, pevnější vazbě na ZP (Flesch et Gadella, 2000). Oscilačními pohyby penetruje spermie směrem k oocytu (Bedford, 2008) a uvolněné enzymy hydrolyzují a rozpouští ZP matrix lokálně, v bezprostřední směru pronikající spermie. Spermie penetrovaná skrz ZP se dostává do periviteliního prostoru a váže se k plazmatické membráně oocytu hrotem hlavičky. Po určité době dochází k fúzi membrán na ekvatoriální oblasti hlavičky spermie (viz Obr. 5) a spermie je začleněna do oocytu (Flesch et Gadella, 2000). Obr. 5 Schématické znázornění kančí spermie (převzato z Boerke et al., 2008). (A) Řez spermií: 1. plazmatická membrána, 2. vnější akrozomální membrána, 3. akrozomální vezikula, 4. vnitřní akrozomální membrána, 5. jaderný obal, 6. jádro, 7. krček, 8. mitochondrie, 9. proximální část bičíku, 10. prstenec, 11. vláknité pouzdro, 12. axonema a vnější hustá vlákna. (B) Pohled na hlavičku a střední část spermie: 13. apikální hrot, 14. preekvatoriální část, 15. ekvatoriální část, 16. postekvatoriální část. (C) Akrozomální reakce: 17. vezikuly vytvořené během AR mnohonásobnou fúzí vnější a vnitřní membrány; ekvatoriální část hlavičky spermie se na fúzích nepodílí. 28
29 3.3.4 Aktivace oocytu a syngamie Charakteristickým znakem fertilizace savčích oocytů je uvolňování Ca 2+ z intracelulárních zásob oocytu, nacházejících se v endoplazmatickém retikulu (ER). ER vytváří tenkou vrstvu pod plazmatickou membránou oocytu a tato vrstva se stává patrnější a širší, jak oocyt zraje (Ohashi et al., 2013). Fúze spermie s plazmatickou membránou oocytu vyvolává u prasete bezprostřední zvýšení Ca 2+ koncentrace následované opakovanými výkyvy koncentrace po dobu alespoň 3 hodin (Sun et Nagai, 2003). Tento jev se nazývá Ca 2+ oscilace a má zásadní význam v aktivaci oocytu (Ohashi et al., 2013). Aktivace oocytu zahrnuje změny, které zabraňují polyspermii (kortikální reakce), uvolňují oocyt z druhého meiotického bloku a vytváří samčí a samičí prvojádra (Horner et Wolfner, 2008). Tvorba samčího prvojádra je podporována intraoocytárním glutathionem, který redukuje disulfidické vazby a napomáhá tak rozvíjení chromatinu. Zatímco se MPN zvětšuje, oocyt dokončuje druhé meiotické dělení za uvolnění druhého PB. Obě prvojádra se k sobě přibližují a dochází k replikaci DNA. Následuje rozpad jaderných membrán, kondenzace chromozomů a tvorba mitotického vřeténka (Gilbert, 2000). Syngamie je dokončena vznikem nového jádra, které obsahuje jak samičí, tak samčí chromozomy (Schillo, 2009). 3.4 Zona pellucida Zona pellucida je extracelulární matrix, která obklopuje plazmatickou membránu rostoucích savčích oocytů a skládá se ze tří až čtyř různých glykoproteinů podle živočišného druhu (Hasegawa et al., 2006). Hraje důležitou roli během oplození oocytu a během časného embryonálního vývoje (Rankin et Dean, 2000) Význam zony pellucidy Zona pellucida zprostředkovává druhově specifickou vazbu mezi spermií a oocytem (Hasegawa et al., 2006) a je hlavní překážkou při mezidruhovém oplození. Odstraněním ZP z neoplozených oocytů dochází k obnažení cytoplazmatické membrány oocytu a tato překážka je prakticky eliminována (Wassarman, 1999). Vazba spermie na zonu pellucidu vyvolává akrozomální reakci, která je potřebná pro úspěšnou penetraci spermie skrz ZP a následnou fúzi s oocytem (Flesch et Gadella, 2000), a po proniknutí spermie do oocytu dochází k postfertilizačním změnám ZP, které jsou nezbytné 29
30 k zabránění vzniku polyspermie (Pastor et al., 2008). ZP je zodpovědná za polyspermický blok po oplození oocytu (Rankin et Dean, 2000). Zona pellucida chrání časné embryo během jeho migrace reprodukčním traktem samice (Hasegawa et al., 2006) embryo bez ZP přilne k epitelu vejcovodu, již nepokračuje ve svém vývoji a nakonec je vstřebáno (Rankin et Dean, 2000). ZP zabraňuje vzniku chimér mezi embryi (Bedford, 2008) a je také mechanickou bariérou proti invazním mikroorganismům či parazitům (Coy et al., 2008a). ZP je zachována až do stadia expandující blastocysty (Bedford, 2008) Vznik zony pellucidy Sekrece ZP glykoproteinů a jejich začlenění do extracelulární matrix bylo zkoumáno na myším modelu (Gupta et al., 2012). ZP glykoproteiny jsou exprimovány během růstové fáze oocytů v endoplazmatickém retikulu a přechází do Golgiho komplexu, kde jsou baleny do sekrečních vezikul. Vezikuly migrují k plazmatické membráně oocytu, se kterou splynou během exocytózy, a tím jsou glykoproteiny deponovány do extracelulárního prostoru (Wassarman et al., 2005). Do ZP matrix jsou glykoproteiny začleňovány na jejím nejvnitřnějším povrchu a ZP tedy houstne směrem zevnitř ven (Gupta et al., 2012). Bylo indentifikováno několik oblastí polypeptidů, které regulují sekreci, diferenciální migraci a začlenění glykoproteinů do ZP. Každý polypeptid obsahuje N-terminální sekvenci, ZP doménu, consensus furin cleavage site (CFCS) a transmembránovou doménu (TMD) nacházející se v blízkosti C-konce proteinu. TDM slouží k ukotvení glykoproteinů v sekrečních vezikulech k plazmatické membráně oocytu a CFCS slouží k uvolnění glykoproteinů do extracelulárního prostoru. ZP doména, společná pro celou řadu organismů a proteinů, umožňuje polymeraci glykoproteinů do dlouhých vláken. Delece ZP domény brání začlenění glykoproteinů do ZP (Wassarman et al., 2005). V raných fázích růstu se ZP glykoproteiny jeví jako vlákna, která jsou uspořádána do šestihranné matice s jednotnou velikostí pórů. Jak oocyt roste a jeho velikost se zvětšuje, póry splývají a vytváří jednotný plášť kolem oocytu se současným zvýšením počtu mikroklků. Tyto mikroklky přichází do styku s kumulárními buňkami a účastní se vzniku gap junction (Gupta et al., 2012). 30
31 Na sekreci ZP proteinů se u prasete podílí jak oocyt, tak jeho okolní folikulární buňky (Sinowatz et al., 2001a). K začleňování proteinů do ZP dochází ve stadiu sekundárních folikulů (Schillo, 2009) Složení zony pellucidy prasete Prasečí zona pellucida je silná přibližně 16 μm (Michelmann et al., 2007) a skládá se ze tří vysoce specifických glykoproteinů vázajících velké množství N- a O-glykanů (Rath et al., 2005). Tyto glykoproteiny vykazují značnou heterogenitu v důsledku rozsáhlých posttranslačních modifikací (Sinowatz et al., 2001a), jako jsou glykosylace a sulfatace (Rath et al., 2005), a v ZP jsou glykoproteiny zastoupeny přibližně ng (Michelmann et al., 2007). Přítomnost sacharidových zbytků je důležitá pro druhově specifickou vazbu mezi spermií a oocytem (Pastor et al., 2008). Počáteční nomenklatura ZP proteinů byla založena na zdánlivé molekulové hmotnosti myších ZP proteinů (Goudet et al., 2008), která se však nezdála užitečná (Rath et al., 2005), a později vzniklo několik dalších systémů názvosloví podle kódování genů. Bylo dokonce diskutováno, že prasečí ZP se neskládá ze tří, ale ze čtyř glykoproteinů a situace u prasat byla o to komplikovanější, jelikož bylo používáno několik názvosloví současně. Proto Goudet et al. (2008) na základě fylogenetických analýz vytvořili aktualizovaný seznam ZP genů a pseudogenů a podle jejich výsledků, jsou prasečí ZP glykoproteiny kódovány třemi podrodinami genů, označovanými jako ZPA/ZP2, ZPC/ZP3 a ZPB/ZP4. Gen ZP1 byl překlasifikován do podrodiny ZPA/ZP2, protože geny ZP1 a ZP2 kódují u prasete stejný protein. Prasečí ZP se tedy skládá ze tří glykoproteinů označovaných jako ZP2 (dříve ZPA a ZP1), ZP3 (dříve ZPC a ZP3α) a ZP4 (dříve ZPB a ZP3β) (Goudet et al., 2008) ZP2 protein Nezralý ZP2 protein se skládá z řetězce 716 aminokyselin (AA), obsahuje jednu ZP doménu a často je považován za sekundární spermatický receptor. Patří do ZPA podrodiny. Velikost čistého proteinu, bez připojených glykanových zbytků je 80 kda. Po odštěpení signálního polypeptidu (1 35 AA) z N-konce a odštěpení propeptidu (sekvence AA) z C-konce vzniká zralý protein o velikosti 603 AA. Během kortikální reakce je pak ZP2 protein proteolyticky štěpen v blízkosti N-konce 31
32 na dva fragmenty (30 kda fragment u N-konce), které zůstávají spojeny disulfidovou vazbou (UniProt, 2014a) ZP3 protein Nezralý ZP3 protein je tvořen sekvencí 421 AA, obsahuje jednu ZP doménu a je považován za primární spermatický receptor. Patří do ZPC podrodiny. U prasete vykazuje vazebnou aktivitu až v heterokomplexu s ZP4 proteinem, přičemž se nezdá, že by ZP3 měl vazebnou aktivitu sám o sobě. Velikost čistého ZP3 proteinu je 46 kda. Po odštěpení signálního polypeptidu (1 22 AA) ze sekvence nezralého proteinu a odštěpení propeptidu z C-konce ( AA) vzniká zralý protein o velikosti 310 AA (UniProt, 2014b). U prasete se ZP3 protein exprimovaný ve stadiu primordiálních a primárních folikulů nachází převážně v cytoplazmě oocytu. Ve stadiu sekundárních folikulů se na sekreci ZP3 proteinu podílí jak oocyt, tak jeho okolní folikulární buňky a ve stadiu terciárních folikulů se ZP3 a jeho transkripty nachází převážně v cytoplazmě buněk corona radiata, nejvnitřnější vrstvě kumulárních buněk. V tomto stadiu je syntéza ZP3 proteinu oocytem zastavena. Přínos folikulárních buněk na sekreci se v pozdějších fázích folikulogeneze zvyšuje, zatímco syntéza oocytem se snižuje (Sinowatz et al., 2001a) ZP4 protein Nezralý ZP4 protein se skládá z řetězce 536 AA, obsahuje jednu ZP doménu a u prasete je pravděpodobně primárním spermatickým receptorem v interakci se ZP3 proteinem. Patří do ZPB podrodiny a velikost čistého ZP4 proteinu je 60 kda. Signální peptid N-konce proteinu je pravděpodobně tvořen sekvencí 1 21 AA. Po jeho odštěpení a odštěpení propeptidu ( AA) z C-konce vzniká zralý ZP4 protein o velikosti 441 AA (UniProt, 2014c) Úloha ZP proteinů během oplození a vzájemná interakce gamet První kontakt mezi spermií a oocytem probíhá prostřednictvím zony pellucidy. Vazbou oplozeníschopné spermie na jednotlivé oligosacharidové řetězce ZP glykoproteinů dochází k rozpoznání gamet a signalizační kaskáda vede k akrozomální reakci, která 32
33 umožňuje spermii penetrovat skrz ZP. Do rozpoznání gamet jsou zapojeny ZP glykoproteiny a ZP-vazebné proteiny spermie (Töpfer-Petersen et al., 2008). Myší zona pellucida se skládá ze tří glykoproteinů označovaných jako ZP1, ZP2 a ZP3 (Wassarman et al., 2005). Bylo zjištěno, že myší spermie se váží nejdříve na ZP3 protein, který indukuje akrozomální reakci, a při pronikání spermie do oocytu udržuje spermie vazbu s oocytem skrz ZP2 (Hasegawa et al., 2006). ZP2 a ZP3 tvoří ve vzájemné interakci dlouhá vlákna, zatímco ZP1 je crosslinker, tj. spojuje jednotlivá vlákna navzájem; viz Obr. 6 (Wassarman et al., 2005). Pro navázání myší spermie na ZP3 je také nezbytná přítomnost O-vázaných glykanových řetězců na ZP3 a podle nedávných studií i přítomnost N-glykanů, které pravděpodobně slouží k rozpoznání gamet (Yonezawa et al., 2012). Obr. 6 Organizace ZP filament myší zony pellucidy (převzato z Wassarman et al., 2005). Myší ZP je tvořena třemi glykoproteiny označovanými ZP1, ZP2 a ZP3. Proteiny ZP2 a ZP3 tvoří dlouhá vlákna, zatímco ZP1 slouží jako crosslinker. U prasete jsou dlouhá vlákna tvořeny glykoproteiny ZP3 a ZP4, zatímco glykoprotein ZP2 je crosslinker (Michelmann et al., 2007). Odhaduje se, že molární poměr ZP2 : ZP3 : ZP4 je 1 : 6 : 6 (Kanai et al., 2008). ZP-vazebné proteiny kančích spermií vykazují vysokou afinitu k heterokomplexu ZP3-ZP4, ale již ne k volným ZP3 a ZP4 glykoproteinovým podjednotkám (Yurewicz et al., 1998). O-vázané glykany tohoto komplexu vazbu mezi spermií a oocytem inhibují, zatímco neutrální N-vázané sacharidové řetězce se na vazbě mezi spermií a oocytem podílejí (Yonezawa et al., 2012). Kyselé N-glykany (72 %) se na vazbě spermie-receptor pravděpodobně nepodílí (Sinowatz et al., 2001a). Rozpoznání gamet je zprostředkováno β-galaktosylovými zbytky N-glykanů (Töpfer-Petersen et al., 2008) a důležitou roli hrají i α-d-manosové zbytky zony pellucidy (Song et al., 2007) 33
34 a N-glykosylace N-acetylglukosaminových zbytků během zrání oocytů (Lay et al., 2013). Yonezawa et al. (2012) se zabývali otázkou, zda je za vazebnou aktivitu heterokomplexu ZP3-ZP4 zodpovědný ZP3 nebo ZP4 protein. Pomocí rekombinantních glykoproteinů (rzp3 a rzp4) exprimovaných v Sf9 buňkách přišli autoři k závěru, že za vazebnou aktivitu mezi spermií a oocytem je, na rozdíl od myší, zodpovědný ZP4 glykoprotein. Proč se vazebná činnost tohoto proteinu projeví až v heterokomplexu se ZP3 proteinem, musí být ještě vyjasněno. Zároveň autoři vyvozují závěr, že za rozpoznání gamet jsou u prasete zodpovědné právě N-glykany přítomné na ZP4. Podle Töpfer-Petersen et al. (2008) se kapacitovaná spermie nejprve naváže primární vazbou na neutrální N-glykany, dochází k akrozomální reakci a následně se spermie váže na polysulfatované glykany ZP přes pro/acrosin, p38 a jiné ZP-vazebné proteiny spermií, čímž je zprostředkována sekundární vazba spermií k ZP Změny ZP proteinů během folikulogeneze, zrání a fertilizace Jak již bylo uvedeno, prasečí zona pellucida se skládá ze tří glykoproteinů označovaných jako ZP2, ZP3 a ZP4 (Goudet et al., 2008). Jejich časoprostorová exprese se během folikulogeneze liší. Zatímco ZP3 a ZP4 glykoproteiny jsou u nezralých oocytů, získaných z terciárních folikulů (3 5 mm), lokalizovány v celé matrix zony, sekrece ZP2 proteinu se zdá být opožděná. Konfokální fluorescenční mikroskopie těchto oocytů odhalila výskyt ZP2 v cytoplazmě oocytu. Neúplná sekrece ZP2 v podmínkách in vitro může ovlivnit trojrozměrnou strukturu ZP a může tak být zodpovědná za vyšší výskyt polyspermie při IVF (in vitro fertilizaci) (Töpfer-Petersen et al., 2008). ZP glykoproteiny podstupují posttranslačními modifikacemi, což vede ke značné heterogenitě sacharidů v ZP matrix (Sinowatz et al., 2001a) a dělá všechny tři glykoproteiny relativně kyselé (Sinowatz et al., 2001b). Kyselé N-glykany mohou být sialylovány (řetězec obsahuje kyselinu sialovou) a/nebo jako ve většině případů sulfatovány (N-acetyllaktosamin opakování) (Sinowatz et al., 2001a). V primordiálních a primárních folikulech se kyselé skupiny nevyskytují, dochází zde k tvorbě neutrálních glykosidových zbytků, ale sekundární folikuly již kyselé skupiny obsahují, stejně jako neutrální. Pomocí lektinů zde byla prokázána přítomnost jak kyseliny sialové, 34
35 tak přítomnost sulfátových skupin. Kvalitativní složení glykosidových zbytků se tedy v průběhu folikulogeneze mění (Pastor et al., 2008). Lay et al. (2011) pomocí 2D gelové elektroforézy zjistili zvyšující se kyselost ZP glykoproteinů po zrání in vitro a přičítají tuto kyselost probíhajícím sialylacím a sulfatacím. Tato acidifikace přispívala u prasete ke schopnosti vázat spermie. Později Lay et al. (2013) zjistili, že během prvních 24 hodin zrání prasečích oocytů in vitro dochází k nové N-glykosylaci, která je zásadní pro navázání spermií na oocyt a indukci akrozomální reakce. Nicméně, indukce AR by mohla být vyvolána i již zmiňovanou sialylací a sulfatací. Kyselý posun ZP proteinů po zrání in vitro potvrdili i Rath et al. (2005). Dlouhou dobu zůstávalo nejasné, zda ZP podstupuje zrací proces spolu s oocytem (Töpfer-Petersen et al., 2008). Po proniknutí spermie do oocytu dochází k fyzikálněchemickým změnám vlastností ZP, a proto se zdálo logické, že by případné změny ZP morfologie mohly být patrné skenovacím elektronovým mikroskopem (SEM) (Michelmann et al., 2007). Tak, nezralé oocyty prepubertálních zvířat, získané z antrálních folikulů, vykazují houbovitý vzhled ZP s početnými a pravidelně uspořádanými malými póry, zatímco většina in vitro, tak in vivo zralých oocytů vykazují hladší povrch (Töpfer-Petersen et al., 2008). Tyto póry se zdají být větší na vnějším povrchu ZP a jejich velikost se snižuje dostředivě (Sinowatz et al., 2001b). Podle Michelmann et al. (2007) lze rozlišit čtyři různé druhy morfologie ZP bez ohledu na zralost a systém zrání (nezralé, zrající in vivo, nebo zrající in vitro po dobu 24 hodin a 48 hodin) a stejně tak u časných embryí, viz Obr. 7. Kvůli extrémní heterogenitě ZP autoři nemohli stanovit žádnou korelaci mezi různými systémy zrání a jednotlivými typy ZP. Nicméně, jejich výsledky se více méně shodují s předchozími tvrzeními, jelikož povrch jak in vivo, tak in vitro zralých oocytů byl více kompaktní. ZP tak prochází biochemickými změnami v konečné fázi zrání oocytů, před oplozením (Rath et al., 2005). Po fertilizaci, ZP je změněna exocytózou kortikálních granul, jejichž obsah je uvolněn do perivitelinního prostoru a dochází k tzv. ZP hardeningu, což je hlavní blok polyspermie (Rankin et Dean, 2000). ZP2, jako největší glykoprotein ZP, se tohoto bloku aktivně účastní nebo dokonce indukuje změny, které k tomuto bloku vedou (Töpfer-Petersen et al., 2008) dochází k proteolytickému štěpení ZP2 proteinu v blízkosti N-konce (Rankin et Dean, 2000). Oplození je také doprovázeno tvorbou disulfidických vazeb. Tyto vazby jsou pravděpodobně vytvořeny pro stabilizaci 35
36 změněné konformace proteinů, čím také přispívají k utužování ZP (Töpfer-Petersen et al., 2008) a jsou tak nezbytné pro ZP hardening a prevenci polyspermie (Rath et al., 2005). In vitro vyvíjející se embrya vykazují kompaktní, hladký povrch ZP, zatímco in vivo vyvíjející se embrya mají povrch opět porézní a kompaktním se stává postupně, jak embryo dosahuje stadia blastocyty (Michelmann et al., 2007). Obr. 7 Povrchová morfologie prasečích oocytů a časných embryí, vizualizovaná pomocí SEM (převzato z Michelmann et al., 2007). Typ I: Síťová struktura s četnými póry a hrbolatým povrchem. Typ II: Hrubý povrch s občasnými prasklinami a póry. Typ III: Relativně hladký povrch se síťovou strukturou a občasnými póry, nebo bez pórů. Typ IV: Hladký povrch bez síťové struktury a bez pórů. 3.5 Polyspermický blok Polyspermie je jedním z nevyřešených problémů při IVF prasečích oocytů zrajících v podmínkách in vitro (Wang et al., 1997), která je pro vývoj embrya letální (Bedford, 2008). Penetrace spermií nebo partenogenetická aktivace oocytů indukuje exocytózu kortikálních granul (cortical granules, CG), která vede ke vzniku polyspermického bloku. V závislosti na živočišném druhu je polyspermický bloku savců tvořen ZP nebo se nachází na plazmatické membráně oocytu a někdy obojí (Sun, 2003). U prasete dochází ke změnám ZP (Rankin et Dean, 2000). 36
37 3.5.1 Kortikální reakce Kortikální granula jsou specializovaná skupina sekrečních vezikulů o velikosti 0,2 0,6 μm, které vznikají v Golgiho komplexu (Ješeta et al., 2012) a obsahující specifické enzymy a glykoproteiny (Wang et al., 1997). U nezralých prasečích oocytů jsou CG náhodně rozptýlené v celé cytoplazmě oocytu (Tsai et al., 2011), ale jak pokračuje jaderné zrání od metafáze I do metafáze II, CG migrují ke kůře oocytu a vytváří souvislou vrstvu buněk pod plazmatickou membránou (Wang et al., 1997). Přerozdělování sekrečních vezikul je přípravný krok kortikální reakce (cortical reaction, CR), viz Obr. 8 (Tsai et al., 2011) a dochází také k navýšení jejich počtu. Migrace CG ke kůře je běžný jev jak v podmínkách in vivo, tak in vitro (Wang et al., 1997). Obr. 8 Schématické znázornění přerozdělení kortikálních granul po zrání oocytů (převzato z Wassarman, 1999). Kortikální granula jsou lokalizována pod oolemou oocytu, jako přípravný krok před kortikální reakcí. Oplodnění nezralých oocytů nevede k exocytóze CG (Ducibella, 1996). GV oocyty schopnost uvolnit obsah CG do perivitelinního prostoru nemají. Tato schopnost se vyvíjí od GVBD a není úplně vyvinuta až do MII fáze nebo do doby v blízkosti ovulace. Uvolnění obsahu CG je závislé na zvýšení intracelulárního Ca 2+ a na vápníku-závislých proteinech (Sun, 2003). Aktivačním stimulem je splynutí spermie s plazmatickou membránou oocytu, které aktivuje řadu intracelulárních signálních drah (Tsai et al., 2011). Spermie vnáší do oocytu specifickou fosfolipázu C-zeta (PLCζ), která vyvolává tvorbu dvou druhých poslů IP 3 a DAG (Tůmová et al., 2013). Inositol 1,4,5-trifosfát (IP 3 ) vzniká z fosfatidylinositol bifosfátu (PIP 2 ), váže se na receptory 37
38 endoplazmatického retikula a způsobuje uvolnění intracelulárního Ca 2+ do cytoplazmy oocytu a Ca 2+ oscilace (Tsai et al., 2011). Diacylglycerol (DAG) aktivuje proteinkinázu C (PKC), která je zodpovědná za exocytózu kortikálních granul (Sun, 2003). PKC patří do rodiny serin/threoninových kináz a je známo 12 různých izoforem (Tůmová et al., 2013). U prasete je exprimováno několik z nich a exocytóza CG je pravděpodobně regulována izoformou PKCα. CaMKII může sloužit jako spínač trandukčního signálu Ca 2+ (Sun, 2003). Předčasné exocytóze CG je zabráněno proteiny SNARE (soluble N-ethylmaleimide-sensitive factor attachment protein receptor) ve spolupráci s complexinem. Zvýšení Ca 2+ pravděpodobně vede k uvolnění complexinu ze SNARE komplexu a umožňuje tak masivní exocytózu CG. Dochází k fúzi CG s oolemou po celé délce oocytu a enzymatický obsah je uvolněn do perivitelinního prostoru (Tsai et al., 2011). Specifické glykosidázy a proteázy odstraňují sacharidové zbytky podílející se na vazbě mezi spermií a oocytem a dochází ke štěpení ZP proteinů, což vede k biochemickým změnám extracelulární matrix a k ZP hardeningu (Coy et Aviles, 2010). V podmínkách in vitro se ke zvýšení intracelulárního Ca 2+ používají např. elektrické impulzy, vápníkový ionofor a chemické látky se schopností ovlivňovat intracelulární uvolňování Ca 2+ (Tůmová et al., 2013). Nicméně, fyziologickou kaskádu interakce gamet lze také obejít pomocí intracytoplazmatické injekce spermie (intracytoplasmic sperm injection, ICSI). Surový extrakt izolovaný z kančího spermatu vyvolává okamžité zvýšení Ca 2+ koncentrace, následované Ca 2+ oscilacemi a CG exocytózou (Sun, 2003) ZP hardening ZP hardening je postfertilizační událost, která přispívá k bloku polyspermie a hodnotí se jako odolnost ZP vůči enzymatické proteolýze (Canovas et al., 2009). Štěpení pronázou je běžně používaný test k posouzení ZP hardeningu (Coy et al., 2008b). Konkrétní změny ZP, vyvolané kortikální reakcí, nebyly dosud plně popsány (Romar et al., 2012). U myši, po uvolnění obsahu CG do perivitelinního prostoru, dochází k proteolytickému štěpení ZP2 proteinu na dva fragmenty, které zůstávají spojeny disulfidovou vazbou (Burkart et al., 2012). Rozpustnost ZP se zhoršuje a dochází ke vzniku polyspermického bloku. U myši se na polyspermickém bloku podílí i oolema oocytu (Sun, 2003). Předpokládá se, že tyto změny ZP mohou maskovat reakční místa 38
39 pro navázání spermií nebo dochází k zesíťování (cross-linking) ZP, aby se zabránilo rozvíjení proteinů (Coy et Aviles, 2010). Mezi savci je proces štěpení ZP2 proteinu poměrně dobře zachován, viz Obr. 9. Na stejném principu je založen i ZP hardening u prasete (Burkart et al., 2012). Zralý ZP2 protein je štěpen v blízkosti N-terminálního konce (A168/D169) na dva fragmenty, které jsou spojeny disulfidovou vazbou (UniProt, 2014a). Nicméně, odolnost vůči pronázovému štěpení se u prasečích zygot produkovaných v podmínkách in vitro neprojevuje, což naznačuje, že kromě štěpení ZP2 se na ZP hardeningu u prasete podílí i jiné mechanismy, např. vejcovod (Coy et Aviles, 2010). Obr. 9 Proteolytické štěpení ZP2 proteinu (převzato z Burkart et al., 2012). Di-aminokyselinové (rámeček) proteolytické štěpné místo (šipka) N-terminální oblasti myšího ZP2 proteinu je zachováno u člověka, makaka, krávy, prasete, psa, kočky, králíka, křečka a krysy Polyspermie in vivo vs. in vitro Je obecně známo, že k polyspermii dochází méně často v podmínkách in vivo než in vitro (Canovas et al., 2009). U většiny savců je polyspermickému oplození předcházeno redukcí počtu spermií v pohlavních orgánech samice (viz bod Spermie v reprodukčním traktu samice) v kombinaci s polyspermickým blokem (Ducibella, 1996). Uvádí se, že dokončení ZP hardeningu v podmínkách in vitro není dostatečně rychlé, aby se zabránilo vnikání přebytku spermií do oocytu nebo že dochází k opoždění kortikální reakce (Coy et Aviles, 2010). 39
40 Přesná regulace kortikální reakce je velmi důležitá, protože předčasná CR vede k neschopnosti spermií penetrovat do oocytu, zatímco opožděná CR končí polyspermickým oplozením. V obou případech se jedná o selhání procesu oplození (Tsai et al., 2011). Nicméně, po 6 hodinách po IVF nebyly pozorovány žádné rozdíly v rychlosti CR mezi oocyty zrajícími in vivo a in vitro, ale u in vivo zrajících oocytů byly CG více agregovány v některých oblastech (Wang et al., 1998). Podle Abeydeera (2002) je možné, že ke zpoždění CG exocytózy dochází v okamžiku počátečního průniku spermií do oocytu, což odpovídá době 2 3 hodiny po IVF. A naopak, když CG exocytóza probíhá příliš rychle, obsah CG nemusí být řádně rozptýlen a to může vznik ZP bloku oddálit. Podle Sun et Nagai (2003) se však na polyspermii s větší pravděpodobností podílí opoždění ZP reakce a/nebo souběžná penetrace spermií, než opožděná nebo neúplná CG exocytóza. Polyspermie in vitro může dosáhnout až 65 % a i in vivo je ve srovnání s jinými druhy velmi vysoká, dosahuje % (Sun et Nagai, 2003). Podle Xia et al. (2001) může být polyspermie u prasete fyziologický jev, jelikož po vložení spermie do cytoplazmy rýhujícího se embrya nedošlo k její dekondenzaci a cytoplazma oocytu má schopnost tuto spermii odstranit. Pokud by nedošlo k narušení embryonálního genomu, embryo by mohlo pokračovat ve vývoji. Polyspermii v podmínkách in vitro je možné předcházet snížením počtu spermií použitých na oocyt při respektování individuality kance. Kryokonzervace kančí spermie poškozuje, pak je třeba počet spermií navýšit. Zkušenosti jsou však takové, že úspěšná IVF je doprovázena i vysokou mírou polyspermie (Nagai, 1996). Snížením počtu spermií dochází také ke snížení penetrace, ale problém polyspermie není vyřešen (Coy et Aviles, 2010). Řada starších studií hovoří pozitivním vlivu vejcovodu na regulaci polyspermie (Wang et al., 1998; Sun et Nagai, 2003; Killian, 2004). Novější studie hovoří o tzv. předfertilizačním ZP hardeningu, o ZP modifikaci ve vejcovodu, ještě před interakcí spermie s oocytem (Coy et al., 2008a; Coy et al., 2008b; Canovas et al., 2009). Jeho nedostatky u oocytů zrajících v podmínkách in vitro by mohly být jedním z důvodů pro extrémně vysoký výskyt polyspermie při IVF prasečích oocytů (Coy et al., 2008a), stejně jako nevhodné kultivační podmínky (Coy et al., 1999), nedostatečné cytoplazmatické zrání (van den Hurk et Zhao, 2005) nebo neúplná sekrece ZP2 proteinu (Töpfer-Petersen et al., 2008). 40
41 Vejcovod v reakci na ovariální hormony syntetizuje různé proteiny a vytváří tak vhodné mikroprostředí, které je schopno podporovat nastávající fertilizační události a následný vývoj embrya (Abeydeera, 2002). Oocyty zrající v podmínkách in vivo (odebrané 2. den říje z vejcovodů) mají prokazatelně větší a širší ZP, větší perivitelinní prostor a jejich ZP jsou odolné vůči štěpení pronázou (>2 hodiny vs. 2,1 min in vitro), průměr oocytů se nezměnil; viz Obr. 10 (Wang et al., 1998). Obr. 10 Mikrofotografie (a) prasečího oocytu získaného z vejcovodu 2. den říje a (b) oocyt zrající v podmínkách in vitro (převzato z Wang et al., 1998). Oocyt zrající v podmínkách in vivo má větší a širší ZP a větší perivitelinní prostor, velikost oocytu se nezměnila. Uvedené měřítko je 26 μm. Většina proteinů přítomných ve vejcovodové tekutině se nachází i v jiných tkáních, ale nachází se tam také skupina ovidukt-specifických glykoproteinů (OSG), tzv. oviduktinů. Jejich sekrece je maximální v předovulačním období v závislosti na estrogenu. Když byly spermie inkubovány v tekutině získané z isthmus a oocyty v ampulární tekutině, počet spermií navázaných na oocyt byl výrazně nižší (Killian, 2004). Stejně tak expozice oocytů oviduktální tekutině zvyšuje úroveň monospermie při IVF a oocyty jsou odolné vůči štěpení pronázou. Tato odolnost ale zanikla po inkubaci oocytu v médiu s nízkým obsahem heparinu (Coy et al., 2008b). Předfertilizační ZP hardening je tak pravděpodobně zprostředkován OVGP1 (oviductal glycoprotein 1), specifickými glykoproteiny vylučovanými epitelem vejdovodu v době ovulace, a S-GAG (sulphated glycosaminoglycans), heparinu podobnými glykosaminoglykany přítomnými ve vejcovodové tekutině (Coy et Aviles, 2010). Odolnost vůči proteolýze je tedy získána před oplozením, ve vejcovodu. Byl navržen následující model: specifické oviduktální proteiny se naváží na ZP a blokují tak polyspermii. Během migrace oocytu ve vejdovodu jsou postupně 41
42 odstraněny nebo dochází k jejich začleňování přes perivitelnní prostor do cytoplazmy oocytu (Coy et al., 2008b). Oviduktiny, navázané na ZP, by mohly působit jako ochranná vrstva na základě jejich typu hustě glykosylované mucinózní domény (Sinowatz et al., 2001b). Uvedený model by mohl odpovídat výsledkům Michelmann et al. (2007). Tito autoři zjistili, že u embryí vyvíjejících se in vitro již nedochází k navazování dalších spermií na ZP, zatímco u embryí in vivo, bez ohledu na přítomnost polyspermického bloku, dochází s pokračujícím vývojem embrya k navázání dalších spermií na ZP. Tyto spermie nebyly jen volně přiloženy, ale některé se nacházely i hluboko v ZP a viditelné byly pouze bičíky. Zároveň uvedený model vysvětluje výsledky studie Lay et al. (2013), kde inhibice N-glykosylace během IVM neovlivnila ZP hardening. Předchozí tvrzení mohou být také v souladu s teorií o důležitosti postupné a pomalé CG exocytózy, jak byla navrhnuta Romar et al. (2012), jelikož CR byla ovlivněna individualitou kance a byla rychlejší u polyspermických oocytů než u monospermických a u oocytů zrajících in vitro než u oocytů zrajících in vivo. Pomalejší CG tedy souvisí s nižší mírou polyspermie a prasečí ZP vyžaduje delší čas, aby dokončila ZP úpravy. 42
43 4 MATERIÁL A METODIKA Metodické přístupy byly zvoleny podle ověřených postupů Laboratoře reprodukčních biotechnologií, Oddělení genetiky a reprodukce, Výzkumného ústavu veterinárního lékařství, v.v.i. (VÚVel) v Brně. Oocyty byly shromažďovány v průběhu roku a před vlastními experimenty byly uchovávány při teplotě 80 C. Jednotlivé experimenty byly provedeny v průběhu roku Dárkyně oocytů K získávání oocytů byly použity vaječníky pohlavně dospělých prasniček hybridní kombinace landrase české bílé ušlechtilé (věk 8,5 11 měsíců, váha kg), poražených na lokálních jatkách. Vaječníky všech dárkyň byly ohodnoceny a vaječníky bez morfologických anomálií byly během 2 hodin po porážce převezeny do laboratoře za konstantní teploty 39 C. Na základě morfologického hodnocení stavu ovárií (tvaru a velikosti antrálních folikulů a žlutého tělíska) byla získaná ovária rozdělena do čtyř fází folikulogeneze: časná (1. 5.den), střední ( den) a pozdní ( den) luteální fáze a časná ( den) folikulární fáze. 4.2 Získávání oocytů Oocyty z antrálních folikulů byly získávány dvěma způsoby: aspirací antrálních folikulů o velikosti 5 9 mm a totální disekcí ovariální kůry (folikuly o velikosti 2 4 mm). Oocyty z folikulů > 10 mm nebyly do studie zařazeny z důvodu dominantní fáze vývoje folikulů. Oocyty izolované z folikulů < 2 mm nebyly zařazeny do této studie, protože nejsou meioticky kompetentní. Pro experimenty bylo použito 6 subpopulací oocytů získaných z antrálních folikulů: 1. Časná luteální fáze (1. 5. den), velikost folikulů S (2 4 mm) subpopulace oocytů označovaná jako S Střední luteální fáze ( den), velikost folikulů S (2 4 mm) subpopulace oocytů označovaná jako S Pozdní luteální fáze ( den), velikost folikulů S (2 4 mm) subpopulace oocytů označovaná jako S
44 4. Pozdní luteální fáze ( den), velikost folikulů M (5 9 mm) subpopulace oocytů označovaná jako M Časná folikulární fáze ( den), velikost folikulů S (2 4 mm) subpopulace oocytů označovaná jako S Časná folikulární fáze ( den), velikost folikulů M (5 9 mm) subpopulace oocytů označovaná jako M Zrání oocytů Pro meiotické zrání byly použity pouze oocyty, které odpovídaly selekčních kritériím dle Hulínská et al. (2011). Oocyty byly kultivovány v 4 jamkové kultivační destičce (Nunc, Intermed, Denmark), po oocytech na jamku, při 39 C s 5 % CO 2 v atmosféře. V každé jamce bylo 500 µl zracího média. Bylo použito zrací médium TCM-199 doplněné 0,20 mm pyruvátu sodného, 0,57 mm cysteaminu, 50 IU ml 1 penicillinu, 50 µg ml 1 streptomycinu (Sigma Chemicals Co., Prague, Czech Republic), 10 % BFS (bovinní fetální sérum; Sigma) a gonádotropiny (P.G IU ml 1 ; Intervet, Holland). Izolované oocyty zrály 44 hodin v in vitro prostředí. Po této době byly pomocí vortexu a hyázy odstraněny kumulární buňky jak ze zralých, tak nezralých oocytů. 4.4 Imunohistochemická analýza Nezralé oocyty, pocházející z folikulů o velikosti S a z folikulů o velikosti M, bez ohledu na fázi folikulogeneze, byly fixovány v 3,7% paraformaldehydu v PBS (fosfátový pufr; Sigma) po dobu 1 hodiny při pokojové teplotě. Následovalo promytí v PBS obsahující 0,4 % BSA (bovinní sérový albumin; Sigma) po dobu 3krát 5 minut. Pro zvýšení prostupnosti membrán byla provedena permeabilizace oocytů v 0,1% Tritonu X-100 (Sigma) po dobu 30 minut. Po permeabilizaci byly oocyty promyty v již uvedeném promývacím médiu (0,4% BSA v PBS) po dobu 3krát 5 minut. K zablokování nespecifických vazeb byly oocyty inkubovány v blokovacím médiu obsahujícím 3% BSA v PBS s obsahem 0,1 % Tweenu a 3 % rabbit séra (Sigma) po dobu 30 minut. Následovalo promytí v promývacím médiu 3krát 5 minut. Oocyty byly inkubovány s primární protilátkou ZP3 proteinu (ZP3 N-20; Santa Cruz, CA, USA) po dobu 12 hodin ve 4 C. Koncentrace primární protilátky v blokovacím médiu byla v poměru 1 : 100. Část oocytů byla použita jako negativní 44
45 kontrola, tj. oocyty nebyly inkubovány s primární protilátkou, ale zůstaly v blokovacím médiu. Po 12 hodinách bylo provedeno promytí v promývacím médiu po dobu 5krát 5 minut. Po promytí byly oocyty inkubovány se sekundární protilátkou Rabbit Anti-Goat HRP (Jackson ImmunoResearch Laboratories, Inc., West Grove, PA, USA) asociovanou s florescenční sondou DyLight488 po dobu 1 hodiny za pokojové teploty a za tmy, aby nedošlo k vysvícení sondy. Koncentrace sekundární protilátky byla 1 : 200. Pro orientaci stavu oocytů bylo vyžito značení cytoplazmy a DNA pomocí Sytox Orange (Invitrogen, Carlsbad, CA, USA). Oocyty byly zamontovány na podložní sklíčko do média Vectashield (Vector Laboratories, Burlingame, CA, USA) a tyto preparáty byly pozorovány laserovým skenovacím konfokálním mikroskopem (Leica TCS SP2 AOBS; Leica, Heidelberg, Germany). Oocyty byly naskenovány v ekvatoriální optické rovině a mikrofotografie byly uloženy a zpracovány za pomocí softwaru NIS-Elements ar 3.0 (Laboratory Imaging, Prague, Czech Republic). 4.5 Western blot Ke vzorku 25 oocytů, z každé subpopulace oocytů před zráním (GV) a po 44 hodinách zrání (MII) in vitro, bylo přidáno 5 μl lyzačního pufru a 5 μl 10% SDS (dodecylsulfát sodný; Serva, Heidelberg, Germany). Vzorky byly zcentrifugovány. Byla provedena sonikace oocytů sonikační jehlou a ke každému vzorku bylo přidáno 10 μl nanášecího pufru (0,5 M tris-hcl, 10% SDS, glycerol, bromfenolová modř, dh 2 O, 2-mercaptoethanol; Serva). Poté vzorky prošly 2 minuty varem. Pro elektroforézu byl používán polyakrylamidový gel, tvořený 10% dělícím gelem a 5% zaostřovacím gelem, vždy čerstvě připravený v naší laboratoři (chemikálie Serva). Byla sestrojena aparatura (Mini-Protean Tetra Systém; Bio-Rad, Hercules, CA, USA) a namíchán elektrodový pufr (0,5 M tris-hcl, glycin, 10% SDS a dh 2 O). Do každé jamky gelu bylo naloadováno 20 μl vzorku a použitý marker byl Dual Xtra (Bio-Rad). Jako kontrola sloužil vzorek ovariální tkáně prasete. Po připojení ke zdroji bylo nastaveno 60 V na 20 minut a poté 90 V. Elektroforéza byla zastavena po dostatečném roztáhnutí bandů požadované molekulové hmotnosti. Po gelové elektroforéze byly gely podle potřeby zastřiženy a přeneseny na 10 minut do transferového pufru (tris-hcl, glycin, methanol a dh 2 O). Zároveň byla provedena aktivace PVDF membrány (polyvinyl fluoridová membrána; GE Healthcare, Little 45
46 Chalfont, UK) 10 sekund v methanolu, 5 minut v dh 2 O a 10 minut v transferovém pufru. Byla provedena i ekvilibrace soupravy. Po přípravě na blotování mohl být sestaven sendvič pro westernový přenos (podpůrná vložka, filtrační papír, gel, PVDF membrána, filtrační papír a podpůrná vložka) a bylo provedeno blotování semidry systémem (Mini-Protean Tetra Systém; Bio-Rad) při 415 ma a 100 V, po dobu 1 hodiny. Poté byla membrána 1 hodinu blokována v 5% sušeném mléce rozpuštěném v promývacím roztoku (100 mm NaCl, 20 mm tris-hcl, 0,075% Tween). Po zablokování PVDF membrány byla do mléka přidána primární protilátka ZP3 N-20 (Santa Cruz), v koncentraci 1 : Inkubace trvala 12 hodin při 4 C. Poté byla membrána promyta promývacím médiem, stejným jako po blokování, po dobu 3krát 5 minut a 2krát 10 minut. Byla přidána sekundární protilátka Rabbit anti-goat HRP (Santa Cruz) v koncentraci 1 : 2000 na 1 hodinu. Po 1 hodině bylo provedeno promývání po dobu 3krát 5 minut a 2krát 10 minut. ZP3 protein byl vizualizován pomocí ECL soupravy (Enhanced Chemiluminescence; Santa Cruz) v temné komoře. Výsledky byly zpracovány softwarem NIS-Elements ar 3.0 (Laboratory Imaging). Metoda Western blot byla provedena ve 3 opakováních. 4.6 Dvojrozměrná (2D) gelová elektroforéza Ke vzorku 100 oocytů v lyzačním pufru, pocházejících z folikulů o velikosti S a z folikulů o velikosti M, bez ohledu na fázi folikulogeneze, byl přidán Chaps pufr (urea, Chaps, amfolyty; Bio-Rad) a vzorky byly stočeny při G za teploty 14 C. Přes kolonku, umístěnou ve zkumavce, proteklo vše < 30 kda a došlo k zahuštění vzorku. Koncentrovaný vzorek byl naředěn 4krát koncentrovaným roztokem DTT (dithiothreitol; Serva) a byl nanesen na 2D strip (Bio-Rad). Přes noc proběhla izoelektrická fokusace (IEF) na fokusátoru (Protean IEF Cell; Bio-Rad) a proteiny se rozvrstvily podle jejich izoelektrického bodu. Po izoelektrické fokusaci byla provedena gelová elektroforéza (Mini-Protean Tetra Systém; Bio-Rad). Strip byl přenesen na 10% polyakrylamidový gel (5% zaostřovací gel) a byl zalit 1% agarózou, rozpuštěnou v transferovém pufru, o teplotě cca 50 C. Strip byl opatrně domáčknut, aby byl odstraněn všechen přebytečný vzduch. Byl nanesen marker High Range (Bio-Rad). Elektroforéza a další postup, včetně vizualizace ZP3 proteinu a zpracování výsledků, je obdobný jako v bodu 4.3 Western blot. 46
47 4.7 Statistická analýza Výsledky byly statisticky analyzovány pomocí T-testu pro nezávislé výběry, programem STATISTICA Cz, verze 10 (StatSoft, Inc., Prague, Czech Republic). Výsledná data jsou uvedena jako průměrná intenzita ZP3 proteinu ± směrodatná odchylka. Statisticky významné rozdíly se lišily na hladině P < 0,05. 47
48 5 VÝSLEDKY 5.1 Vizualizace ZP3 proteinu pomocí specifické protilátky Imunohistochemickou analýzou byla detekována lokalizace ZP3 proteinu v nezralých prasečích oocytech. V obou případech, jak u oocytů pocházejících z folikulů o velikosti S, tak u oocytů pocházejících z folikulů o velikosti M, se ZP3 protein nacházel v extracelulární matrix zony pellucidy, bez známek výskytu tohoto proteinu v cytoplazmě (viz Obr. 11). Nebyl zjištěn statisticky průkazný rozdíl v expresi ZP3 proteinu u oocytů s nižší vývojovou kompetencí (velikost folikulů S), ve srovnání s oocyty s vyšší vývojovou kompetencí (velikost folikulů M). Exprese ZP3 proteinu byla hodnocena průměrnou intenzitou tohoto proteinu (viz Tab. 1 a Obr. 12). Tab. 1 Detekce ZP3 proteinu u nezralých prasečích oocytů. Hladina ZP3 proteinu byla hodnocena u oocytů pocházejících z různě velkých antrálních folikulů a stejného stupně meiotického zrání (GV). Statisticky významné rozdíly v expresi ZP3 proteinu jsou označeny odlišnými indexy (P < 0,05). Stupeň meiotického zrání oocytů Velikost folikulů Počet měření Průměrná intenzita ZP3 proteinu ± sm. odchylka GV (0 hod.) S (2 4 mm) 5 41,25 ± 10,98 a GV (0 hod.) M (5 9 mm) 5 46,56 ± 12,72 a A B Obr. 11 Vizualizace ZP3 proteinu nezralých prasečích oocytů. ZP3 protein byl vizualizován pomocí sekundární protilátky Rabbit Anti-Goat HRP asociované s florescenční sondou DyLight488. Byly hodnoceny nezralé prasečí oocyty s rozdílnou vývojovou kompetencí: (A) oocyt pocházející z folikulu o velikosti S (2 4 mm), (B) oocyt pocházející z folikulu o velikosti M (5 9 mm). Uvedené měřítko je 30 μm. 48
49 Průměrná intenzita a S a M Obr. 12 Hodnocení exprese ZP3 proteinu u nezralých prasečích oocytů s různou vývojovou kompetencí. Rozdíl v průměrné intenzitě ZP3 proteinu u nezralých oocytů, získaných z folikulů o velikosti S a z folikulů o velikosti M, není statisticky průkazný (P < 0,05). 5.2 Modifikace ZP3 proteinu během folikulogeneze Pomocí metody Western blot byly detekovány modifikace ZP3 proteinu u prasečích oocytů, pocházejících z různě velkých antrálních folikulů. Oocyty byly rozděleny do 6 subpopulací podle fáze folikulogeneze a velikosti folikulů (viz Obr. 13). Den 1 14 představuje luteální fázi estrálního cyklu prasniček a den folikulární fázi cyklu. Band subpopulace oocytů S 1 5 se jevil vždy slabší. U této subpopulace se také nevyskytoval band v oblasti > 50 kda, jak před zráním oocytů, tak i po zrání in vitro. U nezralých oocytů se band v oblasti > 50 kda objevoval postupně, s přibývajícími dny estrálního cyklu prasniček a s rostoucí velikostí folikulů. Bandy oocytů po zrání se, ve srovnání s bandy oocytů před zráním, zdají být kratší. A 75 kda S 1 5 S 6 10 S S M M kda B 75 kda S 1 5 S 6 10 S S M M kda Obr. 13 Modifikace ZP3 proteinu prasečích oocytů během folikulogeneze, detekované metodou Western blot. Oocyty byly rozděleny do 6 subpopulací oocytů: (A) subpopulace oocytů před zráním a (B) subpopulace oocytů po 44 hodinách zrání in vitro. ZP3 protein byl detekován pomocí primární protilátky ZP3 N-20 a sekundární protilátky Rabbit anti-goat HRP. 49
50 Průměrná intenzita Průměrná intenzita Nebyl zjištěn žádný statisticky průkazný rozdíl v expresi ZP3 proteinu u nezralých oocytů (GV) pocházejících z folikulů o velikosti S, ve srovnání s oocyty pocházejícími z folikulů o velikosti M. Stejně tak u zralých oocytů (MII) nebyl zjištěn žádný statisticky průkazný rozdíl mezi oocyty pocházejícími z folikulů o velikosti S, ve srovnání s folikuly velikosti M. Exprese ZP3 proteinu byla hodnocena průměrnou intenzitou tohoto proteinu (viz Tab. 2 a Obr. 14). Jednotlivé subpopulace oocytů pocházející z různě velkých antrálních folikulů byly hodnoceny jako celky, protože průměrná velikost folikulů se neměnila a vývojová kompetence oocytů byla hodnocena velikostí folikulů. Tab. 2 Vliv stupně meiotického zrání a vývojové kompetence prasečích oocytů na expresi ZP3 proteinu. Hladina ZP3 proteinu byla hodnocena u oocytů pocházejících z různě velkých antrálních folikulů a různého stupně meiotického zrání. Statisticky významné rozdíly v rámci stejného stupně meiotického zrání jsou označeny odlišnými indexy (P < 0,05). Stupeň meiotického zrání oocytů Velikost folikulů Počet měření Průměrná intenzita ZP3 proteinu ± sm. odchylka GV (0 hod.) S (2 4 mm) 12 31,84 ± 6,63 a GV (0 hod.) M (5 9 mm) 6 30,66 ± 12,29 a MII (44 hod.) S (2 4 mm) 8 24,41 ± 5,82 a MII (44 hod.) M (5 9 mm) 4 23,24 ± 6,79 a A a a B a a 0 S M 0 S M Obr. 14 Hodnocení přítomnosti ZP3 proteinu u prasečích oocytů s ohledem na stupeň meiotického zrání a vývojovou kompetenci oocytů. (A) Průměrná intenzita ZP3 proteinu u nezralých prasečích oocytů, pocházejících z folikulů o velikosti S a z folikulů o velikosti M. (B) Průměrná intenzita ZP3 proteinu zralých oocytů, pocházejících z folikulů o velikosti S a z folikulů o velikosti M. Statisticky významné rozdíly v přítomnosti ZP3 proteinu jsou označeny odlišnými indexy (P < 0,05). 50
51 5.3 Stanovení izoelektrického bodu ZP3 proteinu Při 2D gelové elektroforéze byl ZP3 protein nezralých prasečích oocytů nejdříve rozdělen podle jeho izoelektrického bodu (pi) izoelektrickou fokusací a následovala separace v druhém rozměru gelovou elektroforézou. U oocytů s nižší vývojovou kompetencí (pocházejících z folikulů o velikosti S) se ZP3 protein nacházel v kyselé oblasti gelu. U oocytů s vyšší vývojovou kompetencí (pocházejících z folikulů o velikosti M) se ZP3 protein nacházel v kyselé oblasti gelu, tak i v zásadité oblasti (viz Obr. 15). A B kda 97 kda 48 kda 48 kda Obr. 15 Vizualizace ZP3 proteinu nezralých prasečích oocytů po dvojrozměrné (2D) gelové elektroforéze. Byly použity oocyty s rozdílnou vývojovou kompetencí: (A) oocyty pocházející z folikulů o velikosti S a (B) oocyty pocházející z folikulů o velikosti M. K detekci proteinu byla využita primární protilátka ZP3 N-20 a sekundární protilátka Rabbit anti-goat HRP. Z 2D snímku je patrné, že oocyty pocházející z folikulů o velikosti M mají výrazně větší rozmezí hodnot pi ZP3 proteinu a protein obsahuje i bandy > 48 kda, které se u oocytů pocházejících z folikulů o velikosti S nevyskytují. Po změření průměrné intenzity ZP3 proteinu v oblasti hodnot pi 5,5 8,0 byl zjištěn statisticky průkazný rozdíl v acidifikaci tohoto proteinu u oocytů s nižší vývojovou kompetencí, ve srovnání s oocyty s vyšší vývojovou kompetencí, viz Tab. 3 a Obr
44 somatických chromozomů pohlavní hormony (X,Y) 46 chromozomů
 Buněčný cyklus MUDr.Kateřina Kapounková Inovace studijního oboru Regenerace a výţiva ve sportu (CZ.107/2.2.00/15.0209) 1 DNA,geny genom = soubor všech genů a všechna DNA buňky; kompletní genetický materiál
Buněčný cyklus MUDr.Kateřina Kapounková Inovace studijního oboru Regenerace a výţiva ve sportu (CZ.107/2.2.00/15.0209) 1 DNA,geny genom = soubor všech genů a všechna DNA buňky; kompletní genetický materiál
10. oogeneze a spermiogeneze meióza, vznik spermií a vajíček ovulační a menstruační cyklus antikoncepční metody, oplození
 10. oogeneze a spermiogeneze meióza, vznik spermií a vajíček ovulační a menstruační cyklus antikoncepční metody, oplození MEIÓZA meióza (redukční dělení/ meiotické dělení), je buněčné dělení, při kterém
10. oogeneze a spermiogeneze meióza, vznik spermií a vajíček ovulační a menstruační cyklus antikoncepční metody, oplození MEIÓZA meióza (redukční dělení/ meiotické dělení), je buněčné dělení, při kterém
Ženský pohlavní systém
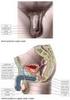 Ženský pohlavní systém 419 Ženský pohlavní systém Oogonia primordiální zárodečná buňka z epiblastu - ve stěně žloutkového váčku migrace do základu gonád mitotické dělení pod vlivem medulárního rete ovarii
Ženský pohlavní systém 419 Ženský pohlavní systém Oogonia primordiální zárodečná buňka z epiblastu - ve stěně žloutkového váčku migrace do základu gonád mitotické dělení pod vlivem medulárního rete ovarii
8 cyklinů (A, B, C, D, E, F, G a H) - v jednotlivých fázích buněčného cyklu jsou přítomny určité typy cyklinů
 Buněč ěčné dělení BUNĚČ ĚČNÝ CYKLUS ŘÍZENÍ BUNĚČ ĚČNÉHO CYKLU cykliny a na cyklinech závislé proteinkinázy (Cyclin-Dependent Protein Kinases; Cdk-proteinkinázy) - proteiny, které jsou součástí řídícího
Buněč ěčné dělení BUNĚČ ĚČNÝ CYKLUS ŘÍZENÍ BUNĚČ ĚČNÉHO CYKLU cykliny a na cyklinech závislé proteinkinázy (Cyclin-Dependent Protein Kinases; Cdk-proteinkinázy) - proteiny, které jsou součástí řídícího
Buněčné dělení ŘÍZENÍ BUNĚČNÉHO CYKLU
 BUNĚČNÝ CYKLUS Buněčné dělení Cykliny a na cyklinech závislé proteinkinázy (Cyclin- Dependent Protein Kinases; Cdk-proteinkinázy) - proteiny, které jsou součástí řídícího systému buněčného cyklu 8 cyklinů
BUNĚČNÝ CYKLUS Buněčné dělení Cykliny a na cyklinech závislé proteinkinázy (Cyclin- Dependent Protein Kinases; Cdk-proteinkinázy) - proteiny, které jsou součástí řídícího systému buněčného cyklu 8 cyklinů
Buněčný cyklus. Replikace DNA a dělení buňky
 Buněčný cyklus Replikace DNA a dělení buňky 2 Regulace buněčného dělení buněčný cyklus: buněčné dělení buněčný růst kontrola kvality potomstva (dceřinných buněk) bránípřenosu nekompletně zreplikovaných
Buněčný cyklus Replikace DNA a dělení buňky 2 Regulace buněčného dělení buněčný cyklus: buněčné dělení buněčný růst kontrola kvality potomstva (dceřinných buněk) bránípřenosu nekompletně zreplikovaných
BUŇEČNÝ CYKLUS A JEHO KONTROLA
 BUŇEČNÝ CYKLUS A JEHO KONTROLA MITOSA - fáze: Profáze - kondensace chromosomů - 30 nm chromatine fibres vázané na matrix Rozpad Metafáze - párové ( sesterské ) chromatidy - vázané centromerou, seřazené
BUŇEČNÝ CYKLUS A JEHO KONTROLA MITOSA - fáze: Profáze - kondensace chromosomů - 30 nm chromatine fibres vázané na matrix Rozpad Metafáze - párové ( sesterské ) chromatidy - vázané centromerou, seřazené
Gametogenese a fertilizace. Vývoj 142
 Gametogenese a fertilizace Vývoj 142 Gamety pohlavní buňky Gametogenese diferenciace vysoce specializovaných pohlavních buněk schopných po fertilizaci vytvořit nového jedince Vajíčko (ovum) Spermie 1.
Gametogenese a fertilizace Vývoj 142 Gamety pohlavní buňky Gametogenese diferenciace vysoce specializovaných pohlavních buněk schopných po fertilizaci vytvořit nového jedince Vajíčko (ovum) Spermie 1.
MENSTRUAČNÍ A OVULAČNÍ CYKLUS. Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje
 MENSTRUAČNÍ A OVULAČNÍ CYKLUS Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Říjen 2010 Mgr. Radka Benešová Ženské pohlavní ústrojí Vznik a cesta neoplozeného
MENSTRUAČNÍ A OVULAČNÍ CYKLUS Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Říjen 2010 Mgr. Radka Benešová Ženské pohlavní ústrojí Vznik a cesta neoplozeného
Variace Pohlavní soustava ženy
 Variace 1 Pohlavní soustava ženy 21.7.2014 16:03:50 Powered by EduBase BIOLOGIE ČLOVĚKA POHLAVNÍ SOUSTAVA POHLAVNÍ SOUSTAVA ŽENY Funkce pohlavního systému ženy 1. Zrání vajíček a jejich uvolňování z kůry
Variace 1 Pohlavní soustava ženy 21.7.2014 16:03:50 Powered by EduBase BIOLOGIE ČLOVĚKA POHLAVNÍ SOUSTAVA POHLAVNÍ SOUSTAVA ŽENY Funkce pohlavního systému ženy 1. Zrání vajíček a jejich uvolňování z kůry
SOMATOLOGIE Vnitřní systémy
 SOMATOLOGIE Vnitřní systémy VY-32-INOVACE-56 AUTOR: Mgr. Ludmila Kainarová POHLAVNÍ SYSTÉM ŽENY FUNKCE 1. tvorba pohlavních buněk vajíček 2. tvorba pohlavních hormonů (estrogen,progesteron) 3. umožnění
SOMATOLOGIE Vnitřní systémy VY-32-INOVACE-56 AUTOR: Mgr. Ludmila Kainarová POHLAVNÍ SYSTÉM ŽENY FUNKCE 1. tvorba pohlavních buněk vajíček 2. tvorba pohlavních hormonů (estrogen,progesteron) 3. umožnění
Základy buněčné biologie
 Maturitní otázka č. 8 Základy buněčné biologie vypracovalo přírodozpytné sympózium LP, AM & DK na konferenci v Praze, 1. Máje 2014 Buňka (cellula) je nejmenší známý útvar, který je schopný všech životních
Maturitní otázka č. 8 Základy buněčné biologie vypracovalo přírodozpytné sympózium LP, AM & DK na konferenci v Praze, 1. Máje 2014 Buňka (cellula) je nejmenší známý útvar, který je schopný všech životních
Buňky, tkáně, orgány, soustavy
 Lidská buňka buněčné organely a struktury: Jádro Endoplazmatické retikulum Goldiho aparát Mitochondrie Lysozomy Centrioly Cytoskelet Cytoplazma Cytoplazmatická membrána Buněčné jádro Jadérko Karyoplazma
Lidská buňka buněčné organely a struktury: Jádro Endoplazmatické retikulum Goldiho aparát Mitochondrie Lysozomy Centrioly Cytoskelet Cytoplazma Cytoplazmatická membrána Buněčné jádro Jadérko Karyoplazma
Inovace studia molekulární. a buněčné biologie
 Inovace studia molekulární I n v e s t i c e d o r o z v o j e v z d ě l á v á n í a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Tento projekt je spolufinancován Evropským sociálním fondem a státním
Inovace studia molekulární I n v e s t i c e d o r o z v o j e v z d ě l á v á n í a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Tento projekt je spolufinancován Evropským sociálním fondem a státním
Menstruační cyklus. den fáze změny
 Menstruační cyklus Menstruační cyklus Zahrnuje v sobě poměrně složitý děj při kterém dochází ke změnám na vaječníku, děloze (zvláště sliznici děložní), vejcovodech, pochvě. V jeho průběhu dochází ke změnám
Menstruační cyklus Menstruační cyklus Zahrnuje v sobě poměrně složitý děj při kterém dochází ke změnám na vaječníku, děloze (zvláště sliznici děložní), vejcovodech, pochvě. V jeho průběhu dochází ke změnám
INTRACELULÁRNÍ SIGNALIZACE II
 INTRACELULÁRNÍ SIGNALIZACE II 1 VÝZNAM INTRACELULÁRNÍ SIGNALIZACE V MEDICÍNĚ Příklad: Intracelulární signalizace: aktivace Ras proteinu (aktivace receptorové kinázy aktivace Ras aktivace kinázové kaskády
INTRACELULÁRNÍ SIGNALIZACE II 1 VÝZNAM INTRACELULÁRNÍ SIGNALIZACE V MEDICÍNĚ Příklad: Intracelulární signalizace: aktivace Ras proteinu (aktivace receptorové kinázy aktivace Ras aktivace kinázové kaskády
MEIÓZA. 1. Které fáze z meiotické profáze I jsou znázorněny na obrázcích?
 Cvičení 8: ROZMNOŽOVÁNÍ A VÝVOJ Jméno: Skupina: MEIÓZA Trvalý preparát: obarvené podélné řezy varlat brouka smrtníka obecného (Blaps mortisaga) Prohlédněte si několik řezů varlete a hledejte v semenotvorných
Cvičení 8: ROZMNOŽOVÁNÍ A VÝVOJ Jméno: Skupina: MEIÓZA Trvalý preparát: obarvené podélné řezy varlat brouka smrtníka obecného (Blaps mortisaga) Prohlédněte si několik řezů varlete a hledejte v semenotvorných
ŽENSKÝ REPRODUKČNÍ SYSTÉM
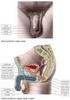 MUDr. Josef Jonáš ŽENSKÝ REPRODUKČNÍ SYSTÉM a jeho detoxikace 1 Vaječník - základní orgán ženské reprodukce Zdroj: P. Abrams, Lidské tělo 2 Hned při narození je ve vaječníku založeno mnoho folikulů, z
MUDr. Josef Jonáš ŽENSKÝ REPRODUKČNÍ SYSTÉM a jeho detoxikace 1 Vaječník - základní orgán ženské reprodukce Zdroj: P. Abrams, Lidské tělo 2 Hned při narození je ve vaječníku založeno mnoho folikulů, z
MITÓZA V BUŇKÁCH KOŘÍNKU CIBULE
 Cvičení 6: BUNĚČNÝ CYKLUS, MITÓZA Jméno: Skupina: MITÓZA V BUŇKÁCH KOŘÍNKU CIBULE Trvalý preparát: kořínek cibule obarvený v acetorceinu V buňkách kořínku cibule jsou viditelné různé mitotické figury.
Cvičení 6: BUNĚČNÝ CYKLUS, MITÓZA Jméno: Skupina: MITÓZA V BUŇKÁCH KOŘÍNKU CIBULE Trvalý preparát: kořínek cibule obarvený v acetorceinu V buňkách kořínku cibule jsou viditelné různé mitotické figury.
Mechanismy hormonální regulace metabolismu. Vladimíra Kvasnicová
 Mechanismy hormonální regulace metabolismu Vladimíra Kvasnicová Osnova semináře 1. Obecný mechanismus působení hormonů (opakování) 2. Příklady mechanismů účinku vybraných hormonů na energetický metabolismus
Mechanismy hormonální regulace metabolismu Vladimíra Kvasnicová Osnova semináře 1. Obecný mechanismus působení hormonů (opakování) 2. Příklady mechanismů účinku vybraných hormonů na energetický metabolismus
BUŇKA ZÁKLADNÍ JEDNOTKA ORGANISMŮ
 BUŇKA ZÁKLADNÍ JEDNOTKA ORGANISMŮ SPOLEČNÉ ZNAKY ŽIVÉHO - schopnost získávat energii z živin pro své životní potřeby - síla aktivně odpovídat na změny prostředí - možnost růstu, diferenciace a reprodukce
BUŇKA ZÁKLADNÍ JEDNOTKA ORGANISMŮ SPOLEČNÉ ZNAKY ŽIVÉHO - schopnost získávat energii z živin pro své životní potřeby - síla aktivně odpovídat na změny prostředí - možnost růstu, diferenciace a reprodukce
Stavba dřeva. Základy cytologie. přednáška
 Základy cytologie přednáška Buňka definice, charakteristika strana 2 2 Buňky základní strukturální a funkční jednotky živých organismů Základní charakteristiky buněk rozmanitost (diverzita) - např. rostlinná
Základy cytologie přednáška Buňka definice, charakteristika strana 2 2 Buňky základní strukturální a funkční jednotky živých organismů Základní charakteristiky buněk rozmanitost (diverzita) - např. rostlinná
- význam: ochranná funkce, dodává buňce tvar. jádro = karyon, je vyplněné karyoplazmou ( polotekutá tekutina )
 Otázka: Buňka a dělení buněk Předmět: Biologie Přidal(a): Štěpán Buňka - cytologie = nauka o buňce - rostlinná a živočišná buňka jsou eukaryotické buňky Stavba rostlinné (eukaryotické) buňky: buněčná stěna
Otázka: Buňka a dělení buněk Předmět: Biologie Přidal(a): Štěpán Buňka - cytologie = nauka o buňce - rostlinná a živočišná buňka jsou eukaryotické buňky Stavba rostlinné (eukaryotické) buňky: buněčná stěna
Bunka a bunecné interakce v patogeneze tkánového poškození
 Bunka a bunecné interakce v patogeneze tkánového poškození bunka - stejná genetická výbava - funkce (proliferace, produkce látek atd.) závisí na diferenciaci diferenciace tkán - specializovaná produkce
Bunka a bunecné interakce v patogeneze tkánového poškození bunka - stejná genetická výbava - funkce (proliferace, produkce látek atd.) závisí na diferenciaci diferenciace tkán - specializovaná produkce
Struktura a funkce biomakromolekul
 Struktura a funkce biomakromolekul KBC/BPOL 10. Struktury signálních komplexů Ivo Frébort Typy hormonů Steroidní hormony deriváty cholesterolu, regulují metabolismus, osmotickou rovnováhu, sexuální funkce
Struktura a funkce biomakromolekul KBC/BPOL 10. Struktury signálních komplexů Ivo Frébort Typy hormonů Steroidní hormony deriváty cholesterolu, regulují metabolismus, osmotickou rovnováhu, sexuální funkce
Bílkoviny a rostlinná buňka
 Bílkoviny a rostlinná buňka Bílkoviny Rostliny --- kontinuální diferenciace vytváření orgánů: - mitotická dělení -zvětšování buněk a tvorba buněčné stěny syntéza bílkovin --- fotosyntéza syntéza bílkovin
Bílkoviny a rostlinná buňka Bílkoviny Rostliny --- kontinuální diferenciace vytváření orgánů: - mitotická dělení -zvětšování buněk a tvorba buněčné stěny syntéza bílkovin --- fotosyntéza syntéza bílkovin
Pohlavní rozmnožování. Gametogeneze u rostlin a živočichů.
 "Učení nás bude více bavit aneb moderní výuka oboru lesnictví prostřednictvím ICT ". Pohlavní rozmnožování Gametogeneze u rostlin a živočichů. 2/65 Pohlavní rozmnožování obecně zajišťuje variabilitu druhu
"Učení nás bude více bavit aneb moderní výuka oboru lesnictví prostřednictvím ICT ". Pohlavní rozmnožování Gametogeneze u rostlin a živočichů. 2/65 Pohlavní rozmnožování obecně zajišťuje variabilitu druhu
PROCES OPLOZENÍ. - oplození vajíčka musí předcházet kapacitace spermií a akrozomální reakce ( dochází k uvolnění
 PROCES OPLOZENÍ - oplození vajíčka musí předcházet kapacitace spermií a akrozomální reakce ( dochází k uvolnění enzymů z akrozomu) - takto připravená spermie nasedá na povrch vajíčka váže se primární vazbou
PROCES OPLOZENÍ - oplození vajíčka musí předcházet kapacitace spermií a akrozomální reakce ( dochází k uvolnění enzymů z akrozomu) - takto připravená spermie nasedá na povrch vajíčka váže se primární vazbou
Endocytóza o regulovaný transport látek v buňce
 . Endocytóza o regulovaný transport látek v buňce Exocytóza BUNĚČNÝ CYKLUS OMNIS CELLULA ET CELLULA - buňka vzniká jen z buňky Sled akcí, ve kterých buňka zdvojí svůj obsah a pak se rozdělí systém regulace
. Endocytóza o regulovaný transport látek v buňce Exocytóza BUNĚČNÝ CYKLUS OMNIS CELLULA ET CELLULA - buňka vzniká jen z buňky Sled akcí, ve kterých buňka zdvojí svůj obsah a pak se rozdělí systém regulace
I. vývoj pohlavních buněkspermatogenese
 I. vývoj pohlavních buněkspermatogenese a oogenese určeno výhradně pro přípravu p pravu studentů 1.léka kařské fakulty Rešerše: Hamilton-Boyd-Mossman, Langman, Larsen, Lüllmann-Rauch, Moore-Persaud, edu,
I. vývoj pohlavních buněkspermatogenese a oogenese určeno výhradně pro přípravu p pravu studentů 1.léka kařské fakulty Rešerše: Hamilton-Boyd-Mossman, Langman, Larsen, Lüllmann-Rauch, Moore-Persaud, edu,
Karyokineze. Amitóza. Mitóza. Meióza. Dělení jádra. Předchází dělení buňky Dochází k rozdělení genetické informace u mateřské buňky.
 Karyokineze Dělení jádra Předchází dělení buňky Dochází k rozdělení genetické informace u mateřské buňky Druhy karyokineze Amitóza Mitóza Meióza Amitóza Přímé dělení jádra Genetická informace je rozdělena
Karyokineze Dělení jádra Předchází dělení buňky Dochází k rozdělení genetické informace u mateřské buňky Druhy karyokineze Amitóza Mitóza Meióza Amitóza Přímé dělení jádra Genetická informace je rozdělena
Vliv oxidu dusnatého na meiotickou kompetenci prasečích oocytů
 ČESKÁ ZEMĚDĚLSKÁ UNIVERZITA V PRAZE Fakulta agrobiologie, potravinových a přírodních zdrojů Katedra veterinárních disciplín Vliv oxidu dusnatého na meiotickou kompetenci prasečích oocytů DISERTAČNÍ PRÁCE
ČESKÁ ZEMĚDĚLSKÁ UNIVERZITA V PRAZE Fakulta agrobiologie, potravinových a přírodních zdrojů Katedra veterinárních disciplín Vliv oxidu dusnatého na meiotickou kompetenci prasečích oocytů DISERTAČNÍ PRÁCE
Nejmenší jednotka živého organismu schopná samostatné existence. Výměnu látek Růst Pohyb Rozmnožování Dědičnost
 BUŇKA Nejmenší jednotka živého organismu schopná samostatné existence Buňka je schopna uskutečňovat základní funkce organismu: obrázky použity z Nečas: BIOLOGIE LIDSKÉ TĚLO Alberts: ZÁKLADY BUNĚČNÉ BIOLOGIE
BUŇKA Nejmenší jednotka živého organismu schopná samostatné existence Buňka je schopna uskutečňovat základní funkce organismu: obrázky použity z Nečas: BIOLOGIE LIDSKÉ TĚLO Alberts: ZÁKLADY BUNĚČNÉ BIOLOGIE
Prokaryota x Eukaryota. Vibrio cholerae
 Živočišná buňka Prokaryota x Eukaryota Vibrio cholerae Dělení živočišných buněk: buňky jednobuněčných organismů (volně žijící samostatné jednotky) buňky mnohobuněčných větší morfologické i funkční celky
Živočišná buňka Prokaryota x Eukaryota Vibrio cholerae Dělení živočišných buněk: buňky jednobuněčných organismů (volně žijící samostatné jednotky) buňky mnohobuněčných větší morfologické i funkční celky
Exprese genetického kódu Centrální dogma molekulární biologie DNA RNA proteinu transkripce DNA mrna translace proteosyntéza
 Exprese genetického kódu Centrální dogma molekulární biologie - genetická informace v DNA -> RNA -> primárního řetězce proteinu 1) transkripce - přepis z DNA do mrna 2) translace - přeložení z kódu nukleových
Exprese genetického kódu Centrální dogma molekulární biologie - genetická informace v DNA -> RNA -> primárního řetězce proteinu 1) transkripce - přepis z DNA do mrna 2) translace - přeložení z kódu nukleových
Mitóza, meióza a buněčný cyklus. Milan Dundr
 Mitóza, meióza a buněčný cyklus Milan Dundr Rozmnožování eukaryotických buněk Mitóza (mitosis) Mitóza dělení (nepřímé) tělních (somatických) buněk 1 jádro s2n (diploidním počtem) chromozómů (dvouchromatidových)
Mitóza, meióza a buněčný cyklus Milan Dundr Rozmnožování eukaryotických buněk Mitóza (mitosis) Mitóza dělení (nepřímé) tělních (somatických) buněk 1 jádro s2n (diploidním počtem) chromozómů (dvouchromatidových)
Digitální učební materiál
 Digitální učební materiál Projekt CZ.1.07/1.5.00/34.0415 Inovujeme, inovujeme Šablona III/2 Inovace a zkvalitnění výuky prostřednictvím ICT (DUM) Tematická Vylučovací soustava Společná pro celou sadu oblast
Digitální učební materiál Projekt CZ.1.07/1.5.00/34.0415 Inovujeme, inovujeme Šablona III/2 Inovace a zkvalitnění výuky prostřednictvím ICT (DUM) Tematická Vylučovací soustava Společná pro celou sadu oblast
Co nás učí nádory? Prof. RNDr. Jana Šmardová, CSc. Ústav patologie FN Brno Přírodovědecká a Lékařská fakulta MU Brno
 Co nás učí nádory? Prof. RNDr. Jana Šmardová, CSc. Ústav patologie FN Brno Přírodovědecká a Lékařská fakulta MU Brno Brno, 17.5.2011 Izidor (Easy Door) Osnova přednášky 1. Proč nás rakovina tolik zajímá?
Co nás učí nádory? Prof. RNDr. Jana Šmardová, CSc. Ústav patologie FN Brno Přírodovědecká a Lékařská fakulta MU Brno Brno, 17.5.2011 Izidor (Easy Door) Osnova přednášky 1. Proč nás rakovina tolik zajímá?
VÝVOJ POHLAVNÍCH BUNĚK OOGENESE A SPERMATOGENESE OPLOZENÍ, RÝHOVÁNÍ, VÝVOJ BLASTOCYSTY
 VÝVOJ POHLAVNÍCH BUNĚK OOGENESE A SPERMATOGENESE OPLOZENÍ, RÝHOVÁNÍ, VÝVOJ BLASTOCYSTY ÚHIEM 1. LF UK v PRAZE Předmět: B02241 Obecná histologie a obecná embryologie Akademický rok 2013 2014 POUZE PRO OSOBNÍ
VÝVOJ POHLAVNÍCH BUNĚK OOGENESE A SPERMATOGENESE OPLOZENÍ, RÝHOVÁNÍ, VÝVOJ BLASTOCYSTY ÚHIEM 1. LF UK v PRAZE Předmět: B02241 Obecná histologie a obecná embryologie Akademický rok 2013 2014 POUZE PRO OSOBNÍ
Inovace a zkvalitnění výuky prostřednictvím ICT Soustavy člověka
 Střední průmyslová škola a Vyšší odborná škola technická Brno, Sokolská 1 Šablona: Název: Téma: Autor: Číslo: Anotace: Inovace a zkvalitnění výuky prostřednictvím ICT Soustavy člověka Oplození Mgr, Klepáčková
Střední průmyslová škola a Vyšší odborná škola technická Brno, Sokolská 1 Šablona: Název: Téma: Autor: Číslo: Anotace: Inovace a zkvalitnění výuky prostřednictvím ICT Soustavy člověka Oplození Mgr, Klepáčková
David Rumpík1, Stanislav Los Chovanec1, Taťána Rumpíková1 Jaroslav Loucký2, Radek Kučera3
 David Rumpík1, Stanislav Los Chovanec1, Taťána Rumpíková1 Jaroslav Loucký2, Radek Kučera3 Klinika reprodukční medicíny a gynekologie Zlín 1 Imalab s.r.o. Zlín 2 Beckman Coulter ČR, a Imunoanalytická laboratoř,
David Rumpík1, Stanislav Los Chovanec1, Taťána Rumpíková1 Jaroslav Loucký2, Radek Kučera3 Klinika reprodukční medicíny a gynekologie Zlín 1 Imalab s.r.o. Zlín 2 Beckman Coulter ČR, a Imunoanalytická laboratoř,
A. chromozómy jsou rozděleny na 2 chromatidy spojené jen v místě centromery. B. vlákna dělícího vřeténka jsou připojena k chromozómům
 Karlova univerzita, Lékařská fakulta Hradec Králové Obor: všeobecné lékařství - test z biologie Vyberte tu z nabídnutých odpovědí (1-5), která je nejúplnější. Otázka Odpověď 1. Mezi organely membránového
Karlova univerzita, Lékařská fakulta Hradec Králové Obor: všeobecné lékařství - test z biologie Vyberte tu z nabídnutých odpovědí (1-5), která je nejúplnější. Otázka Odpověď 1. Mezi organely membránového
VÝZNAM REGULACE APOPTÓZY V MEDICÍNĚ
 REGULACE APOPTÓZY 1 VÝZNAM REGULACE APOPTÓZY V MEDICÍNĚ Příklad: Regulace apoptózy: protein p53 je klíčová molekula regulace buněčného cyklu a regulace apoptózy Onemocnění: více než polovina (70-75%) nádorů
REGULACE APOPTÓZY 1 VÝZNAM REGULACE APOPTÓZY V MEDICÍNĚ Příklad: Regulace apoptózy: protein p53 je klíčová molekula regulace buněčného cyklu a regulace apoptózy Onemocnění: více než polovina (70-75%) nádorů
http://www.accessexcellence.org/ab/gg/chromosome.html
 3. cvičení Buněčný cyklus Mitóza Modifikace mitózy 1 DNA, chromosom genetická informace organismu chromosom = strukturní podoba DNA během dělení (mitózy) řetězec DNA (chromonema) histony další enzymatické
3. cvičení Buněčný cyklus Mitóza Modifikace mitózy 1 DNA, chromosom genetická informace organismu chromosom = strukturní podoba DNA během dělení (mitózy) řetězec DNA (chromonema) histony další enzymatické
MVDr. Radka Slezáková Doc. MVDr. Eva Bártová, Ph.D. Poděkování: Interní vzdělávací agentura IVA VFU Brno, č. projektu: 2015FVHE/2150/35
 MVDr. Radka Slezáková Doc. MVDr. Eva Bártová, Ph.D. Poděkování: Interní vzdělávací agentura IVA VFU Brno, č. projektu: 2015FVHE/2150/35 Fáze pohlavního cyklu PROESTRUS ESTRUS METESTRUS (DIESTRUS) ANESTRUS
MVDr. Radka Slezáková Doc. MVDr. Eva Bártová, Ph.D. Poděkování: Interní vzdělávací agentura IVA VFU Brno, č. projektu: 2015FVHE/2150/35 Fáze pohlavního cyklu PROESTRUS ESTRUS METESTRUS (DIESTRUS) ANESTRUS
- vytvoření speciálních buněk (gamety), vznikají meiózou (redukční dělení) v pohlavních orgánech
 Otázka: Pohlavní rozmnožování Předmět: Biologie Přidal(a): Pípi - většina živočichů - vytvoření speciálních buněk (gamety), vznikají meiózou (redukční dělení) v pohlavních orgánech 1) Prvoci k obohacení
Otázka: Pohlavní rozmnožování Předmět: Biologie Přidal(a): Pípi - většina živočichů - vytvoření speciálních buněk (gamety), vznikají meiózou (redukční dělení) v pohlavních orgánech 1) Prvoci k obohacení
Regulace metabolizmu lipidů
 Regulace metabolizmu lipidů Principy regulace A) krátkodobé (odpověď s - min): Dostupnost substrátu Alosterické interakce Kovalentní modifikace (fosforylace/defosforylace) B) Dlouhodobé (odpověď hod -
Regulace metabolizmu lipidů Principy regulace A) krátkodobé (odpověď s - min): Dostupnost substrátu Alosterické interakce Kovalentní modifikace (fosforylace/defosforylace) B) Dlouhodobé (odpověď hod -
Variace Vývoj dítěte
 Variace 1 Vývoj dítěte 21.7.2014 16:25:04 Powered by EduBase BIOLOGIE ČLOVĚKA VÝVOJ DÍTĚTE OPLOZENÍ A VÝVOJ PLACENTY Oplození K oplození dochází ve vejcovodu. Pohyb spermií: 3-6 mm za minutu. Životnost
Variace 1 Vývoj dítěte 21.7.2014 16:25:04 Powered by EduBase BIOLOGIE ČLOVĚKA VÝVOJ DÍTĚTE OPLOZENÍ A VÝVOJ PLACENTY Oplození K oplození dochází ve vejcovodu. Pohyb spermií: 3-6 mm za minutu. Životnost
Degenerace genetického kódu
 AJ: degeneracy x degeneration CJ: degenerace x degenerace Degenerace genetického kódu Genetický kód je degenerovaný, resp. redundantní, což znamená, že dva či více kodonů může kódovat jednu a tutéž aminokyselinu.
AJ: degeneracy x degeneration CJ: degenerace x degenerace Degenerace genetického kódu Genetický kód je degenerovaný, resp. redundantní, což znamená, že dva či více kodonů může kódovat jednu a tutéž aminokyselinu.
Rozmnožování buněk Vertikální přenos GI. KBI / GENE Mgr. Zbyněk Houdek
 Rozmnožování buněk Vertikální přenos GI KBI / GENE Mgr. Zbyněk Houdek Buněčný cyklus Buňky vznikají z bb. a jedinou možnou cestou, jak vytvořit více bb. je jejich dělením. Vertikální přenos GI: B. (mateřská)
Rozmnožování buněk Vertikální přenos GI KBI / GENE Mgr. Zbyněk Houdek Buněčný cyklus Buňky vznikají z bb. a jedinou možnou cestou, jak vytvořit více bb. je jejich dělením. Vertikální přenos GI: B. (mateřská)
BUNĚČNÝ CYKLUS. OMNIS CELLULA ET CELLULA - buňka vzniká jen z buňky. Sled akcí, ve kterých buňka zdvojí svůj obsah a pak se rozdělí
 (1 BUNĚČNÝ CYKLUS BUNĚČNÝ CYKLUS OMNIS CELLULA ET CELLULA - buňka vzniká jen z buňky Sled akcí, ve kterých buňka zdvojí svůj obsah a pak se rozdělí systém regulace kontrolní body molekulární brzdy Jednobuněčné
(1 BUNĚČNÝ CYKLUS BUNĚČNÝ CYKLUS OMNIS CELLULA ET CELLULA - buňka vzniká jen z buňky Sled akcí, ve kterých buňka zdvojí svůj obsah a pak se rozdělí systém regulace kontrolní body molekulární brzdy Jednobuněčné
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115
 Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: CZ.1.07/1.5.00/34.0410 Číslo šablony: V/2 - inovace směřující k rozvoji odborných kompetencí Název materiálu: Buněčný cyklus
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: CZ.1.07/1.5.00/34.0410 Číslo šablony: V/2 - inovace směřující k rozvoji odborných kompetencí Název materiálu: Buněčný cyklus
Pohlavní soustava klisny
 Pohlavní soustava klisny Pohlavní soustava klisny - zadní část dutiny břišní + dutina pánevní - vaječníky + vejcovody + děloha + pochva + vulva 1 Vaječník (ovarium) = samičí pohlavní žláza - produkce pohlavních
Pohlavní soustava klisny Pohlavní soustava klisny - zadní část dutiny břišní + dutina pánevní - vaječníky + vejcovody + děloha + pochva + vulva 1 Vaječník (ovarium) = samičí pohlavní žláza - produkce pohlavních
Syllabus pro dosažení kvalifikace klinického embryologa
 Syllabus pro dosažení kvalifikace klinického embryologa Blok 1. Základní pojmy: buněčná biologie, molekulární biologie a genetika 1.1 Buňka Vnitřní organizace Řízení buněčného cyklu, kontrolní body Mitóza
Syllabus pro dosažení kvalifikace klinického embryologa Blok 1. Základní pojmy: buněčná biologie, molekulární biologie a genetika 1.1 Buňka Vnitřní organizace Řízení buněčného cyklu, kontrolní body Mitóza
DUM č. 1 v sadě. 37. Bi-2 Cytologie, molekulární biologie a genetika
 projekt GML Brno Docens DUM č. 1 v sadě 37. Bi-2 Cytologie, molekulární biologie a genetika Autor: Martin Krejčí Datum: 02.06.2014 Ročník: 6AF, 6BF Anotace DUMu: Charakteristika buněčného cyklu eukaryot
projekt GML Brno Docens DUM č. 1 v sadě 37. Bi-2 Cytologie, molekulární biologie a genetika Autor: Martin Krejčí Datum: 02.06.2014 Ročník: 6AF, 6BF Anotace DUMu: Charakteristika buněčného cyklu eukaryot
FYZIOLOGIE ROSTLIN. Přednášející: Doc. Ing. Václav Hejnák, Ph.D. Tel.: 224382514 E-mail: hejnak @af.czu.cz
 FYZIOLOGIE ROSTLIN Přednášející: Doc. Ing. Václav Hejnák, Ph.D. Tel.: 224382514 E-mail: hejnak @af.czu.cz Studijní literatura: Hejnák,V., Zámečníková,B., Zámečník, J., Hnilička, F.: Fyziologie rostlin.
FYZIOLOGIE ROSTLIN Přednášející: Doc. Ing. Václav Hejnák, Ph.D. Tel.: 224382514 E-mail: hejnak @af.czu.cz Studijní literatura: Hejnák,V., Zámečníková,B., Zámečník, J., Hnilička, F.: Fyziologie rostlin.
BUNĚČ ORGANISMŮ KLÍČOVÁ SLOVA:
 BUNĚČ ĚČNÁ STAVBA ŽIVÝCH ORGANISMŮ KLÍČOVÁ SLOVA: Prokaryota, eukaryota, viry, bakterie, živočišná buňka, rostlinná buňka, organely buněčné jádro, cytoplazma, plazmatická membrána, buněčná stěna, ribozom,
BUNĚČ ĚČNÁ STAVBA ŽIVÝCH ORGANISMŮ KLÍČOVÁ SLOVA: Prokaryota, eukaryota, viry, bakterie, živočišná buňka, rostlinná buňka, organely buněčné jádro, cytoplazma, plazmatická membrána, buněčná stěna, ribozom,
Číslo a název projektu Číslo a název šablony
 Číslo a název projektu Číslo a název šablony DUM číslo a název CZ.1.07/1.5.00/34.0378 Zefektivnění výuky prostřednictvím ICT technologií III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT SSOS_ZE_1.05
Číslo a název projektu Číslo a název šablony DUM číslo a název CZ.1.07/1.5.00/34.0378 Zefektivnění výuky prostřednictvím ICT technologií III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT SSOS_ZE_1.05
Buňka. Buňka (cellula) základní stavební a funkční jednotka organismů, schopná samostatné existence. Cytologie nauka o buňkách
 Buňka Historie 1655 - Robert Hooke (1635 1703) - použil jednoduchý mikroskop k popisu pórů v řezu korku. Nazval je, podle podoby k buňkám včelích plástů, buňky. 18. - 19. St. - vznik buněčné biologie jako
Buňka Historie 1655 - Robert Hooke (1635 1703) - použil jednoduchý mikroskop k popisu pórů v řezu korku. Nazval je, podle podoby k buňkám včelích plástů, buňky. 18. - 19. St. - vznik buněčné biologie jako
CZ.1.07/1.5.00/34.0378 Zefektivnění výuky prostřednictvím ICT technologií III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT SSOS_ZD_2.
 Číslo a název projektu Číslo a název šablony DUM číslo a název Název školy CZ.1.07/1.5.00/34.0378 Zefektivnění výuky prostřednictvím ICT technologií III/2 - Inovace a zkvalitnění výuky prostřednictvím
Číslo a název projektu Číslo a název šablony DUM číslo a název Název školy CZ.1.07/1.5.00/34.0378 Zefektivnění výuky prostřednictvím ICT technologií III/2 - Inovace a zkvalitnění výuky prostřednictvím
Praktické cvičení č. 7. Reprodukční soustava muže a ženy
 Praktické cvičení č. 7 Reprodukční soustava muže a ženy Literatura: DYLEVSKÝ, I.: Anatomie a fyziologie člověka: učebnice pro zdravotnické školy. Olomouc: Epava, 1998. ISBN: 80-901667-0-9. KOPECKÝ, M.:
Praktické cvičení č. 7 Reprodukční soustava muže a ženy Literatura: DYLEVSKÝ, I.: Anatomie a fyziologie člověka: učebnice pro zdravotnické školy. Olomouc: Epava, 1998. ISBN: 80-901667-0-9. KOPECKÝ, M.:
PŘENOS SIGNÁLU DO BUŇKY, MEMBRÁNOVÉ RECEPTORY
 PŘENOS SIGNÁLU DO BUŇKY, MEMBRÁNOVÉ RECEPTORY 1 VÝZNAM MEMBRÁNOVÝCH RECEPTORŮ V MEDICÍNĚ Příklad: Membránové receptory: adrenergní receptory (receptory pro adrenalin a noradrenalin) Funkce: zprostředkování
PŘENOS SIGNÁLU DO BUŇKY, MEMBRÁNOVÉ RECEPTORY 1 VÝZNAM MEMBRÁNOVÝCH RECEPTORŮ V MEDICÍNĚ Příklad: Membránové receptory: adrenergní receptory (receptory pro adrenalin a noradrenalin) Funkce: zprostředkování
PREZENTACE ANTIGENU A REGULACE NA ÚROVNI Th (A DALŠÍCH) LYMFOCYTŮ PREZENTACE ANTIGENU
 PREZENTACE ANTIGENU A REGULACE NA ÚROVNI Th (A DALŠÍCH) LYMFOCYTŮ PREZENTACE ANTIGENU Podstata prezentace antigenu (MHC restrikce) byla objevena v roce 1974 V současnosti je zřejmé, že to je jeden z klíčových
PREZENTACE ANTIGENU A REGULACE NA ÚROVNI Th (A DALŠÍCH) LYMFOCYTŮ PREZENTACE ANTIGENU Podstata prezentace antigenu (MHC restrikce) byla objevena v roce 1974 V současnosti je zřejmé, že to je jeden z klíčových
Gametogeneze, mitóza a meióza. Prof. MUDr. Pavel Trávník, DrSc.
 Gametogeneze, mitóza a meióza Prof. MUDr. Pavel Trávník, DrSc. Buněčný cyklus generační doba - trvání cyklu interfáze - období mezi dvěma následnými mitózami vlastní buněčné dělení - mitóza regulace buněčného
Gametogeneze, mitóza a meióza Prof. MUDr. Pavel Trávník, DrSc. Buněčný cyklus generační doba - trvání cyklu interfáze - období mezi dvěma následnými mitózami vlastní buněčné dělení - mitóza regulace buněčného
Apoptóza Onkogeny. Srbová Martina
 Apoptóza Onkogeny Srbová Martina Buněčný cyklus Regulace buněčného cyklu 1. Cyklin-dependentní kináza (Cdk) cyclin Regulace buněčného cyklu 2. Retinoblastomový protein (prb) E2F Regulace buněčného cyklu
Apoptóza Onkogeny Srbová Martina Buněčný cyklus Regulace buněčného cyklu 1. Cyklin-dependentní kináza (Cdk) cyclin Regulace buněčného cyklu 2. Retinoblastomový protein (prb) E2F Regulace buněčného cyklu
Funkce pohlavního systému ženy ovaria oocyty ova folikul Graafův folikul
 Funkce pohlavního systému ženy - zrání vajíček - produkce pohlavních hormonů - realizace pohlavního spojení = koitus - vytvoření vhodného prostředí pro vývoj plodu a jeho porod Vaječníky ovaria - párové
Funkce pohlavního systému ženy - zrání vajíček - produkce pohlavních hormonů - realizace pohlavního spojení = koitus - vytvoření vhodného prostředí pro vývoj plodu a jeho porod Vaječníky ovaria - párové
Buňka. Autor: Mgr. Jitka Mašková Datum: Gymnázium, Třeboň, Na Sadech 308
 Buňka Autor: Mgr. Jitka Mašková Datum: 27. 10. 2012 Gymnázium, Třeboň, Na Sadech 308 Číslo projektu Číslo materiálu CZ.1.07/1.5.00/34.0702 VY_32_INOVACE_BIO.prima.02_buňka Škola Gymnázium, Třeboň, Na Sadech
Buňka Autor: Mgr. Jitka Mašková Datum: 27. 10. 2012 Gymnázium, Třeboň, Na Sadech 308 Číslo projektu Číslo materiálu CZ.1.07/1.5.00/34.0702 VY_32_INOVACE_BIO.prima.02_buňka Škola Gymnázium, Třeboň, Na Sadech
STIMULAČNÍ PROTOKOLY A CO DÁL?! MUDr. Marcel Štelcl, Ph.D. ReproGenesis Brno
 STIMULAČNÍ PROTOKOLY A CO DÁL?! MUDr. Marcel Štelcl, Ph.D. ReproGenesis Brno STARÁ DOBRÁ KLASIKA Agonistický protokol, antagonistický protokol, flair up protokol. Různé studie, různé závěry ve smyslu toho,
STIMULAČNÍ PROTOKOLY A CO DÁL?! MUDr. Marcel Štelcl, Ph.D. ReproGenesis Brno STARÁ DOBRÁ KLASIKA Agonistický protokol, antagonistický protokol, flair up protokol. Různé studie, různé závěry ve smyslu toho,
- pro učitele - na procvičení a upevnění probírané látky - prezentace
 Číslo projektu Název školy Autor Tematická oblast CZ.1.07/1.5.00/34.0743 Moravské gymnázium Brno s.r.o. RNDr. Monika Jörková Biologie 10 obecná biologie Organely eukaryotní buňky Ročník 1. Datum tvorby
Číslo projektu Název školy Autor Tematická oblast CZ.1.07/1.5.00/34.0743 Moravské gymnázium Brno s.r.o. RNDr. Monika Jörková Biologie 10 obecná biologie Organely eukaryotní buňky Ročník 1. Datum tvorby
Pohlavní soustava muže a ženy, sekundární pohlavní znaky, pohlavní hormony, menstruační cyklus.
 Otázka: Pohlavní soustava člověka Předmět: Biologie Přidal(a): Don Pohlavní soustava člověka. Pohlavní soustava muže a ženy, sekundární pohlavní znaky, pohlavní hormony, menstruační cyklus. Pohlavní soustava
Otázka: Pohlavní soustava člověka Předmět: Biologie Přidal(a): Don Pohlavní soustava člověka. Pohlavní soustava muže a ženy, sekundární pohlavní znaky, pohlavní hormony, menstruační cyklus. Pohlavní soustava
ve srovnání s eukaryoty (životnost v řádu hodin) u prokaryot kratší (životnost v řádu minut) na životnost / stabilitu molekuly mají vliv
 Urbanová Anna ve srovnání s eukaryoty (životnost v řádu hodin) u prokaryot kratší (životnost v řádu minut) na životnost / stabilitu molekuly mají vliv strukturní rysy mrna proces degradace každá mrna v
Urbanová Anna ve srovnání s eukaryoty (životnost v řádu hodin) u prokaryot kratší (životnost v řádu minut) na životnost / stabilitu molekuly mají vliv strukturní rysy mrna proces degradace každá mrna v
- spermie vznikají spermatogenezí ze spermatocytů - redukčním dělením
 Otázka: Rozmnožovací soustava Předmět: Biologie Přidal(a): Petra - zajišťuje vznik nového jedince - přenos genetické informace - tvořena pohlavními žlázami a pohlavními vývojovými cestami Mužská pohlavní
Otázka: Rozmnožovací soustava Předmět: Biologie Přidal(a): Petra - zajišťuje vznik nového jedince - přenos genetické informace - tvořena pohlavními žlázami a pohlavními vývojovými cestami Mužská pohlavní
Buněčný cyklus a molekulární mechanismy onkogeneze
 Buněčný cyklus a molekulární mechanismy onkogeneze Imunofluorescence DAPI Přehled regulace buněčného cyklu Základní terminologie: Cycliny evolučně konzervované proteiny s homologními oblastmi; jejich
Buněčný cyklus a molekulární mechanismy onkogeneze Imunofluorescence DAPI Přehled regulace buněčného cyklu Základní terminologie: Cycliny evolučně konzervované proteiny s homologními oblastmi; jejich
Univerzita Karlova v Praze - 1. lékařská fakulta. Buňka. Ústav pro histologii a embryologii
 Univerzita Karlova v Praze - 1. lékařská fakulta Buňka. Stavba a funkce buněčné membrány. Transmembránový transport. Membránové organely, buněčné kompartmenty. Ústav pro histologii a embryologii Doc. MUDr.
Univerzita Karlova v Praze - 1. lékařská fakulta Buňka. Stavba a funkce buněčné membrány. Transmembránový transport. Membránové organely, buněčné kompartmenty. Ústav pro histologii a embryologii Doc. MUDr.
INSEMINACE PRASAT. II. Inseminace prasnic. Multimediální učební pomůcka pro výuku Reprodukce hospodářských zvířat II
 INSEMINACE PRASAT II. Inseminace prasnic Multimediální učební pomůcka pro výuku Reprodukce hospodářských zvířat II Řešitel: prof. Ing. František Louda, DrSc. Ing. Alena Ježková, CSc. Doc. Ing. Luděk Stádník,
INSEMINACE PRASAT II. Inseminace prasnic Multimediální učební pomůcka pro výuku Reprodukce hospodářských zvířat II Řešitel: prof. Ing. František Louda, DrSc. Ing. Alena Ježková, CSc. Doc. Ing. Luděk Stádník,
NEPLODNOST A ASISITOVANÁ REPRODUKCE
 NEPLODNOST A ASISITOVANÁ REPRODUKCE Problém dnešní doby http://www.ulekare.cz/clanek/ve-zkumavce-se-da-vypestovat-vajicko-i-spermie-13323 http://www.babyfrance.com/grossesse/fecondation.html Co tě napadne,
NEPLODNOST A ASISITOVANÁ REPRODUKCE Problém dnešní doby http://www.ulekare.cz/clanek/ve-zkumavce-se-da-vypestovat-vajicko-i-spermie-13323 http://www.babyfrance.com/grossesse/fecondation.html Co tě napadne,
Současná formulace: Buňka je minimální jednotka, která vykazuje všechny znaky živých soustav
 Buněčná teorie: Počátky formování: 1840 a dále, Jan E. Purkyně myšlenka o analogie rostlinného a živočišného těla (buňky zrníčka) Schwann T. Virchow R. nové buňky vznikají pouze dělením buněk již existujících
Buněčná teorie: Počátky formování: 1840 a dále, Jan E. Purkyně myšlenka o analogie rostlinného a živočišného těla (buňky zrníčka) Schwann T. Virchow R. nové buňky vznikají pouze dělením buněk již existujících
LÁTKOVÉ ŘÍZENÍ ORGANISMU
 LÁTKOVÉ ŘÍZENÍ ORGANISMU PhDr. Jitka Jirsáková, Ph.D. LÁTKOVÉ ŘÍZENÍ ORGANISMU je uskutečňováno prostřednictvím: hormonů neurohormonů tkáňových hormonů endokrinní žlázy vylučují látky do krevního oběhu
LÁTKOVÉ ŘÍZENÍ ORGANISMU PhDr. Jitka Jirsáková, Ph.D. LÁTKOVÉ ŘÍZENÍ ORGANISMU je uskutečňováno prostřednictvím: hormonů neurohormonů tkáňových hormonů endokrinní žlázy vylučují látky do krevního oběhu
Přednáška 3 Biologie reprodukce & Embryologie
 Přednáška 3 Biologie reprodukce & Embryologie Gamety Meióza Struktura a vývoj Rozdíly mezi vývojem vajíčka a spermie Regulace gametogeneze Ovariální a menstruační cyklus vzájemný vztah Transport gamet,
Přednáška 3 Biologie reprodukce & Embryologie Gamety Meióza Struktura a vývoj Rozdíly mezi vývojem vajíčka a spermie Regulace gametogeneze Ovariální a menstruační cyklus vzájemný vztah Transport gamet,
AMH preanalytické podmínky
 AMH preanalytické podmínky Testování stability podle ISBER protokolu R. Kučera, O. Topolčan, M. Karlíková Oddělení imunochemické diagnostiky, Fakultní nemocnice Plzeň O čem to dnes bude? AMH základní informace
AMH preanalytické podmínky Testování stability podle ISBER protokolu R. Kučera, O. Topolčan, M. Karlíková Oddělení imunochemické diagnostiky, Fakultní nemocnice Plzeň O čem to dnes bude? AMH základní informace
Regulace metabolických drah na úrovni buňky
 Regulace metabolických drah na úrovni buňky EB Obsah přednášky Obecné principy regulace metabolických drah na úrovni buňky regulace zajištěná kompartmentací metabolických dějů změna absolutní koncentrace
Regulace metabolických drah na úrovni buňky EB Obsah přednášky Obecné principy regulace metabolických drah na úrovni buňky regulace zajištěná kompartmentací metabolických dějů změna absolutní koncentrace
"Učení nás bude více bavit aneb moderní výuka oboru lesnictví prostřednictvím ICT ". Základy genetiky, základní pojmy
 "Učení nás bude více bavit aneb moderní výuka oboru lesnictví prostřednictvím ICT ". Základy genetiky, základní pojmy 1/75 Genetika = věda o dědičnosti Studuje biologickou informaci. Organizmy uchovávají,
"Učení nás bude více bavit aneb moderní výuka oboru lesnictví prostřednictvím ICT ". Základy genetiky, základní pojmy 1/75 Genetika = věda o dědičnosti Studuje biologickou informaci. Organizmy uchovávají,
Vliv folikulogeneze na efektivitu in vitro fertilizace prasečích oocytů
 Mendelova univerzita v Brně Agronomická fakulta Ústav chovu a šlechtění zvířat Vliv folikulogeneze na efektivitu in vitro fertilizace prasečích oocytů Disertační práce Vedoucí práce: prof. Ing. Ladislav
Mendelova univerzita v Brně Agronomická fakulta Ústav chovu a šlechtění zvířat Vliv folikulogeneze na efektivitu in vitro fertilizace prasečích oocytů Disertační práce Vedoucí práce: prof. Ing. Ladislav
Střední průmyslová škola a Vyšší odborná škola technická Brno, Sokolská 1
 Střední průmyslová škola a Vyšší odborná škola technická Brno, Sokolská 1 Šablona: Název: Téma: Autor: Číslo: Anotace: Inovace a zkvalitnění výuky prostřednictvím ICT Soustavy člověka Orgány pohlavní soustavy
Střední průmyslová škola a Vyšší odborná škola technická Brno, Sokolská 1 Šablona: Název: Téma: Autor: Číslo: Anotace: Inovace a zkvalitnění výuky prostřednictvím ICT Soustavy člověka Orgány pohlavní soustavy
2. Z následujících tvrzení, týkajících se prokaryotické buňky, vyberte správné:
 Výběrové otázky: 1. Součástí všech prokaryotických buněk je: a) DNA, plazmidy b) plazmidy, mitochondrie c) plazmidy, ribozomy d) mitochondrie, endoplazmatické retikulum 2. Z následujících tvrzení, týkajících
Výběrové otázky: 1. Součástí všech prokaryotických buněk je: a) DNA, plazmidy b) plazmidy, mitochondrie c) plazmidy, ribozomy d) mitochondrie, endoplazmatické retikulum 2. Z následujících tvrzení, týkajících
MEMBRÁNOVÉ STRUKTURY EUKARYONTNÍCH BUNĚK
 MEMBRÁNOVÉ STRUKTURY EUKARYONTNÍCH BUNĚK PLASMATICKÁ MEMBRÁNA EUKARYOTICKÝCH BUNĚK Všechny buňky (prokaryotické a eukaryotické) jsou ohraničeny membránami zajišťujícími integritu a funkci buněk Ochrana
MEMBRÁNOVÉ STRUKTURY EUKARYONTNÍCH BUNĚK PLASMATICKÁ MEMBRÁNA EUKARYOTICKÝCH BUNĚK Všechny buňky (prokaryotické a eukaryotické) jsou ohraničeny membránami zajišťujícími integritu a funkci buněk Ochrana
Eukaryotická buňka. Stavba. - hlavní rozdíly:
 Eukaryotická buňka - hlavní rozdíly: rostlinná buňka živočišná buňka buňka hub buněčná stěna ano (celulóza) ne ano (chitin) vakuoly ano ne (prvoci ano) ano lysozomy ne ano ne zásobní látka škrob glykogen
Eukaryotická buňka - hlavní rozdíly: rostlinná buňka živočišná buňka buňka hub buněčná stěna ano (celulóza) ne ano (chitin) vakuoly ano ne (prvoci ano) ano lysozomy ne ano ne zásobní látka škrob glykogen
ZÁKLADY FUNKČNÍ ANATOMIE
 OBSAH Úvod do studia 11 1 Základní jednotky živé hmoty 13 1.1 Lékařské vědy 13 1.2 Buňka - buněčné organely 18 1.2.1 Biomembrány 20 1.2.2 Vláknité a hrudkovité struktury 21 1.2.3 Buněčná membrána 22 1.2.4
OBSAH Úvod do studia 11 1 Základní jednotky živé hmoty 13 1.1 Lékařské vědy 13 1.2 Buňka - buněčné organely 18 1.2.1 Biomembrány 20 1.2.2 Vláknité a hrudkovité struktury 21 1.2.3 Buněčná membrána 22 1.2.4
Termíny z časného vývoje zárodku:
 Embryologie Termíny z časného vývoje zárodku: Ovulace 14.den menstruačního cyklu Oplodnění fertilizace vznik zygoty a dokončení 2. zracího dělení Rýhování mitotické dělení buněk (blastomer) a vznik moruly
Embryologie Termíny z časného vývoje zárodku: Ovulace 14.den menstruačního cyklu Oplodnění fertilizace vznik zygoty a dokončení 2. zracího dělení Rýhování mitotické dělení buněk (blastomer) a vznik moruly
Obecný metabolismus.
 mezioborová integrace výuky zaměřená na rostlinnou biochemii a fytopatologii CZ.1.07/2.2.00/28.0171 Obecný metabolismus. Regulace glykolýzy a glukoneogeneze (5). Prof. RNDr. Pavel Peč, CSc. Katedra biochemie,
mezioborová integrace výuky zaměřená na rostlinnou biochemii a fytopatologii CZ.1.07/2.2.00/28.0171 Obecný metabolismus. Regulace glykolýzy a glukoneogeneze (5). Prof. RNDr. Pavel Peč, CSc. Katedra biochemie,
1. Napište strukturní vzorce aminokyselin D a Y a vzorce adenosinu a thyminu
 Test pro přijímací řízení magisterské studium Biochemie 2019 1. Napište strukturní vzorce aminokyselin D a Y a vzorce adenosinu a thyminu U dalších otázek zakroužkujte správné tvrzení (pouze jedna správná
Test pro přijímací řízení magisterské studium Biochemie 2019 1. Napište strukturní vzorce aminokyselin D a Y a vzorce adenosinu a thyminu U dalších otázek zakroužkujte správné tvrzení (pouze jedna správná
VÝZNAM FUNKCE PROTEINŮ V MEDICÍNĚ
 FUNKCE PROTEINŮ 1 VÝZNAM FUNKCE PROTEINŮ V MEDICÍNĚ Příklad: protein: dystrofin onemocnění: Duchenneova svalová dystrofie 2 3 4 FUNKCE PROTEINŮ: 1. Vztah struktury a funkce proteinů 2. Rodiny proteinů
FUNKCE PROTEINŮ 1 VÝZNAM FUNKCE PROTEINŮ V MEDICÍNĚ Příklad: protein: dystrofin onemocnění: Duchenneova svalová dystrofie 2 3 4 FUNKCE PROTEINŮ: 1. Vztah struktury a funkce proteinů 2. Rodiny proteinů
Digitální učební materiál
 Digitální učební materiál Projekt CZ.1.07/1.5.00/34.0415 Inovujeme, inovujeme Šablona III/2 Inovace a zkvalitnění výuky prostřednictvím ICT (DUM) Tematická Vylučovací soustava Společná pro celou sadu oblast
Digitální učební materiál Projekt CZ.1.07/1.5.00/34.0415 Inovujeme, inovujeme Šablona III/2 Inovace a zkvalitnění výuky prostřednictvím ICT (DUM) Tematická Vylučovací soustava Společná pro celou sadu oblast
POHLAVNÍ SOUSTAVA. PhDr. Jitka Jirsáková,Ph.D. jitkajirsakova@seznam.cz
 POHLAVNÍ SOUSTAVA PhDr. Jitka Jirsáková,Ph.D. jitkajirsakova@seznam.cz Pohlavní soustava zajišťuje vznik nového života zabezpečuje existenci biologického druhu zajišťuje přenos genetických informací dělíme
POHLAVNÍ SOUSTAVA PhDr. Jitka Jirsáková,Ph.D. jitkajirsakova@seznam.cz Pohlavní soustava zajišťuje vznik nového života zabezpečuje existenci biologického druhu zajišťuje přenos genetických informací dělíme
(Vývojová biologie) Embryologie. Jiří Pacherník
 (Vývojová biologie) Embryologie Jiří Pacherník jipa@sci.muni.cz Podpořeno projektem FRVŠ 524/2011 buňka -> tkáně -> orgány -> organismus / jedinec Základní procesy na buněčné úrovni dělení buněk proliferace
(Vývojová biologie) Embryologie Jiří Pacherník jipa@sci.muni.cz Podpořeno projektem FRVŠ 524/2011 buňka -> tkáně -> orgány -> organismus / jedinec Základní procesy na buněčné úrovni dělení buněk proliferace
PLODNOST. Ivana Gardiánová. Katedra genetiky a šlechtní
 PLODNOST Ivana Gardiánová Katedra genetiky a šlechtní Plodnost - komplexní vlastnost, která je výsledkem schopností samc a samic poskytovat zdravé potomstvo v optimálním potu za uritý as. Nejdležitjší
PLODNOST Ivana Gardiánová Katedra genetiky a šlechtní Plodnost - komplexní vlastnost, která je výsledkem schopností samc a samic poskytovat zdravé potomstvo v optimálním potu za uritý as. Nejdležitjší
Struktura a funkce biomakromolekul
 Struktura a funkce biomakromolekul KBC/BPOL 3. Enzymy a proteinové motory Ivo Frébort Enzymová katalýza Mechanismy enzymové katalýzy o Ztráta entropie při tvorbě komplexu ES odestabilizace komplexu ES
Struktura a funkce biomakromolekul KBC/BPOL 3. Enzymy a proteinové motory Ivo Frébort Enzymová katalýza Mechanismy enzymové katalýzy o Ztráta entropie při tvorbě komplexu ES odestabilizace komplexu ES
VY_32_INOVACE_11.16 1/5 3.2.11.16 Nitroděložní vývin člověka
 1/5 3.2.11.16 Cíl popsat oplození - znát funkci spermie a vajíčka - chápat vývin plodu - porovnat rozdíl vývinu plodu u ptáků, králíka a člověka - uvést etapy, délku a průběh v matčině těle - charakterizovat
1/5 3.2.11.16 Cíl popsat oplození - znát funkci spermie a vajíčka - chápat vývin plodu - porovnat rozdíl vývinu plodu u ptáků, králíka a člověka - uvést etapy, délku a průběh v matčině těle - charakterizovat
DUM č. 11 v sadě. 37. Bi-2 Cytologie, molekulární biologie a genetika
 projekt GML Brno Docens DUM č. 11 v sadě 37. Bi-2 Cytologie, molekulární biologie a genetika Autor: Martin Krejčí Datum: 30.06.2014 Ročník: 6AF, 6BF Anotace DUMu: Princip genové exprese, intenzita překladu
projekt GML Brno Docens DUM č. 11 v sadě 37. Bi-2 Cytologie, molekulární biologie a genetika Autor: Martin Krejčí Datum: 30.06.2014 Ročník: 6AF, 6BF Anotace DUMu: Princip genové exprese, intenzita překladu
