VÝROBA SODY ZÁKLADY CHEMICKÝCH TECHNOLOGIÍ. ší šířen. Základy chemických technologií 1
|
|
|
- Anežka Křížová
- před 9 lety
- Počet zobrazení:
Transkript
1 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá VÝROBA SODY ZÁKLADY CHEMICKÝCH TECHNOLOGIÍ Základy chemických techlogií 1
2 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Výroba sody Leblancův proces (začátek chemického průmyslu) Solvayův proces (nahradil Leblancův proces) Zpracování trony (Na 2 CO 3.NaHCO 3.2H 2 O Základy chemických techlogií 2
3 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Vlaststi sody bílý prášek, v bezvodém stavu taje při 852 o C rozklad nastává již od 300 o C rozštění je exotermní pod 32 o C krystaluje dekahydrát, v rozmezí teplot o C vzniká heptahydrát, nad 35 o C vzniká mohydrát mohydrát má inverzní rozpustst Základy chemických techlogií 3
4 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Leblancův proces 2 NaCl + H 2 SO 4 = Na 2 SO HCl Na 2 SO C = Na 2 S + 4 CO Na 2 S + CaCO 3 = Na 2 CO 3 + CaS MnO HCl = MnCl 2 + Cl H 2 O 4 HCl + O 2 = 2 Cl H 2 O (katalyzátor CaCl 2 na SiO 2 ) Ca(OH) 2 + Na 2 CO 3 = CaCO NaOH Základy chemických techlogií 4
5 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Solvayův v proces NH 3 + H 2 O + CO 2 = NH 4 HCO 3 NH 4 HCO 3 + NaCl = NaHCO 3 + NH 4 Cl 2 NaHCO 3 = Na 2 CO 3 + CO 2 + H 2 O Pozor na nežádoucí reakci!!! NH 4 Cl + NaHCO 3 = NaCl + NH 3 + CO 2 + H 2 O NH 4 Cl + Ca(OH) 2 = CaCl NH H 2 O Základy chemických techlogií 5
6 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Solvayův v proces (pokrač.) Suroviny pro výrobu sody Odpady při výrobě sody Ostatní výrobky:hydroxid sodný (kaustifikací), hydrogenuhličitan sodný, chlorid amonný, chlorid sodný, chlorid vápenatý Princip výroby: podvojná výměna kationtů a aniontů solí za vzniku málo rozpustné soli Základy chemických techlogií 6
7 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Solvayův v proces (pokrač.) vlastní proces lze rozdělit na tyto hlavní fáze: příprava a čištění solanky amoniakalizace solanky karbonatace zpracování surového NaHCO 3 regenerace amoniaku pál vápence Základy chemických techlogií 7
8 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá AMONIAK ZÁKLADY CHEMICKÝCH TECHNOLOGIÍ Základy chemických techlogií 8
9 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Amoniak výchozí surovina pro všechny ostatní dusíkaté sloučeniny (kromě dusíkatého vápna) cca 80% vyrobeného amoniaku se spotřebuje na výrobu hjiv Základy chemických techlogií 9
10 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Přírodní zdroje vázaného dusíku ve srovnání s dnešní spotřebou jsou velmi malé kamenné uhlí dusičnan sodný Základy chemických techlogií 10
11 Získávání dusíkatých látek ze Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá vzdušného dusíku dusíkaté váp příprava kyseliny dusičné ze vzdušného dusíku příprava amoniaku kyanamidovým postupem syntéza amoniaku z prvků Základy chemických techlogií 11
12 Výroba amoniaku ze syntézního Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá plynu N 2 + 3H 2 = 2NH 3 EXOTERMNÍ žití katalyzátoru vysoké tlaky vysoké teploty (z důvodu katalyzátoru) speciální požadavky na konstrukční y Základy chemických techlogií 12
13 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Výrobní linka příprava surového syntézního plynu přetvář (reformování) plynných paliv zplyňování kapalných nebo pevných paliv odstraňování zbytků oxidu uhelnatého vlastní syntéza amoniaku odděl amoniaku ze syntézní směsi konverze oxidu uhelnatého vodní parou Základy chemických techlogií 13
14 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Výrobní linka - ňky Čištění plynu od arganických sloučenin síry. V závislosti na volbě suroviny a způsobu jejího zpracování se zařazuje do čela výrobní linky (např. parní reformování methanu) a nebo až po zplynění výchozích surovin (např. parciální oxidace mazutu). Základy chemických techlogií 14
15 Čištění plynu od sloučenin Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá síry sloučeniny síry jsou silnými katalytickými jedy odstraňování sloučenin síry z plynné fáze síra je přítomna převážně sulfan, v men míře je ve formě organických sloučenin karbonylsulfid, sirouhlík, thiofen nebo thioetery obsah organické síry většiu do 1 g/m 3 Základy chemických techlogií 15
16 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Dvoustupňové odsiřování první stupeň odstranění sulfanu druhý stupeň odstranění organických sloučenin síry Základy chemických techlogií 16
17 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Odstraňování sulfanu absorpční roztoky s probíhající u reakcí bez chemické reakce (fyzikální děj) tuhé adsorbenty Základy chemických techlogií 17
18 Absorpce probíhající Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá u reakcí ve vodném prostředí dochází k disociaci sulfanu a aby rozpustst byla co největ, je třeba vázat vodíkové ionty, čehož se dosáhne roztoky solí silných zásad a slabých kyselin, nebo roztoky zásad organických i arganických zachycování sulfanu se provádí v patrových kolonách nebo kolonách s výplní za rmální nebo snížené teploty, tlak se žívá většiu zvýšený Základy chemických techlogií 18
19 Absorpce probíhající Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá u reakcí (pokrač.) regenerace absorpčních roztoků se děje snížm tlaků a zahřátím až na bod varu, získává se plyn o obsahu cca 80% sulfanu karbonátový způsob (roztok uhličitanu draselného) alkacidový způsob alkacid M (draselná sůl N-metyl,1-amipropiové kyseliny) alkacid DIK (draselná sůl kyseliny dimetyl nebo dietylamioctové) způsob využívající organické zásady moetalamin (MEA) dietalamin (DEA) Základy chemických techlogií 19
20 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Fyzikální absorpce N-metylpyrolidon (způsob PURISOL) metal (způsob RECTISOL) Základy chemických techlogií 20
21 Odstraňování organických Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá sloučenin síry katalytická hydrogenace (Co-Mo, endotermní, C) katalytická hydrolýza (Al 2 O 3, exotermní, C) adsorpce na aktivní uhlí Základy chemických techlogií 21
22 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Příprava syntézního plynu stechiometrický poměr chemické metody přípravy z plynných paliv (zemní plyn) z kapalných paliv (ropa, benzin, mazut) z tuhých paliv (uhlí, koks) Základy chemických techlogií 22
23 Syntézní plyn z plynných a Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá kapalných uhlovodíků parciální oxidace vodní parou (tzv.parní reforming) parciální oxidace kyslíkem Základy chemických techlogií 23
24 Syntézní plyn z plynných a Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá kapalných uhlovodíků (pokrač.) Oba procesy probíhají se zvětšm počtů molů. Je proto výhodněj stlačovat již směs plynů vstupujících do reakce a ne až reakční produkty. Ušetří se tím na energie při následující kompresi plynu. Základy chemických techlogií 24
25 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Parní reforming endotermický proces vhodný pro uhlovodíky do bodu varu 220 C žívá se přebytek vodní páry proces se katalyzuje (Ni na alumině) pro methan CH 4 + H 2 O = CO + 3H 2 ENDOTERMNÍ CO + H 2 O = H 2 + CO 2 (vedlej reakce) Základy chemických techlogií 25
26 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Parní reforming (pokrač.) u vyšch uhlovodíků se předpokládá, že v první fázi dochází ke štěp na methan nežádoucím jevem je vznik uhlíku v důsledku tepelného štěp uhlovodíků nebo Boudouardovy reakce Základy chemických techlogií 26
27 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Parciální oxidace kyslíkem exotermní proces vhodný i pro uhlovodíky o vyšm bodu varu než 220 C proces může být katalyzován oxidace methanu probíhá podle reakce CH 4 + 0,5 O 2 = CO + 2H 2 EXOTERMNÍ CH 4 + 2O 2 = CO 2 + 2H 2 O (vedlej reakce) obě reakce jsou i za vysokých teplot jedsměrné Základy chemických techlogií 27
28 Parciální oxidace kyslíkem Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá (pokrač.) proces se vede s přebytkem kyslíku teplota procesu se reguluje přídavkem vodní páry žití katalyzátoru omezuje vznik sazí a umožňuje pracovat při nižch teplotách C oproti režimu bez katalyzátoru ( C) Kombivaný proces parního reformingu následovaný parciální oxidací kyslíkem nebo vzduchem. Základy chemických techlogií 28
29 Tepelně oxidační štěp Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá (pyrolýza) metanu na acetylén endotermní proces teplo se získává parciální oxidací části methanu vodík vzniká při reakci 2CH 4 = C 2 H 2 + 3H 2 Základy chemických techlogií 29
30 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Zplyňování tuhých paliv zplyňování je proces při kterém se působí plyny, které obsahují kyslík, na tuhá paliva, přičemž vznikají hořlavé plyny, může být žit vzduch, kyslík, vodní pára i oxid uhličitý podle slož oxidačního plynu mění se i slož vznikajících hořlavých plynů chudý plyn zplyňování se provádí vzduchem smíšený (generátorový plyn) zplyňování se provádí vzduchem za přídavku vodní páry vodní plyn zplyňování se provádí vodní parou Základy chemických techlogií 30
31 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Zplyňování tuhých paliv (pokrač.) při zplyňování koksu (uhlí) se vzduchem nebo kyslíkem probíhají reakce 1. C + O 2 = CO C + O 2 = 2CO 3. C + CO 2 = 2CO ENDOTERMNÍ 4. 2CO + O 2 = 2CO 2 při zplyňování koksu(uhlí) vodní parou probíhá reakce C + H 2 O = CO + H 2 ENDOTERMNÍ Teplo pro tuto reakci se získává spalováním části paliva Základy chemických techlogií 31
32 Výroba dusíko-vodíkové směsi Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá dělm zpracování koksárenského plynu zpracování odplynů při výrobě amoniaku Základy chemických techlogií 32
33 Zpracování surového syntézního Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá plynu konverze oxidu uhelnatého vodní parou odstraňování oxidu uhličitého odstraňování zbytků oxidu uhelnatého Základy chemických techlogií 33
34 Konverze oxidu uhelnatého Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá vodní parou exotermní proces chemická reakce bez katalyzátoru neprobíhá CO + H 2 O = CO 2 + H 2 EXOTERMNÍ přebytek vodní páry a co nejniž teplota středoteplotní katalyzátor C (oxid železitý promotovaný oxidem chromitým) Základy chemických techlogií 34
35 Konverze oxidu uhelnatého Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá vodní parou (pokrač.) nízkoteplotní katalyzátor C (oxid měďnatý a oxid zinečnatý promotovaný oxidem chromitým nebo oxidem železitým a oxidem hlinitým) rychlost procesu je silně ovlivňována vniřní difuzí reaktor je rozdělen na dva stupně mezi nimiž se provádí ochlazování reakční směsi vstřikem kondenzátu Základy chemických techlogií 35
36 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Odstraňování oxidu uhličitého absorpce spojená s u reakcí fyzikální absorpce ostatní způsoby Základy chemických techlogií 36
37 Absorpce spojená s Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá u reakcí vodní vypírka karbonátový způsob ethalamivý způsob (MEA, DEA, TEA) alkacidový postup Základy chemických techlogií 37
38 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Fyzikální absorpce způsob PURISOL (N-methylpyrolidon) způsob RESTISOL (methal) v praxi se žívá dvoustupňová vypírka (např.kombinace karbonátového a ethalamivého postupu) Základy chemických techlogií 38
39 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Ostatní způsoby adsorpční, případně membrávý postup Základy chemických techlogií 39
40 Odstraňování oxidu Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá uhelnatého pomocí kapalného dusíku hydrogenace CO na methan CO + 3H 2 = CH 4 + H 2 O EXOTERMNÍ katalyzátor Ni při 300 C nebo Cr-Ni při C Základy chemických techlogií 40
41 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Syntéza amoniaku komprese plynu minimální práce pístové kompresory turbokompresory Základy chemických techlogií 41
42 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Výroba vysokotlakých těles vykováním z ingotu navivání profilového pásku v několika vrstvách na tenkostěnu jádrovou trubku navlékání skruží na tenkostěnu jádrovou trubku Základy chemických techlogií 42
43 Stupeň přeměny syntézní Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá směsi vliv teploty vliv tlaku katalytický proces probíhající v oblasti vnitřní difúze měrný výkon katalyzátoru (30-50 t NH 3 vyrobených na 1m 3 katalyzátoru za 1 hodinu pro zrna 8 mm) žívání drobzrných katalyzátorů cca 2-3 mm tok plynu přes katalyzátor (axiální zaměněn za štěpný nebo příčný nebo radiální) Základy chemických techlogií 43
44 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Katalyzátor a katalytické jedy syntéza i rozklad probíhá na katalyzátoru katalyzátor na bázi železa (gama Fe) příprava katalyzátoru vychází z redukce vypražených a přetavených oxidů železa, pro redukci je nejvhodněj Fe 3 O 4 tepelná stabilita se dociluje přídavkem těžko redukovatelných oxidů katalyzátor je pyroforický (na vzduchu samozápalný) vratná otrava (kyslík, voda, oxid uhelnatý a uhličitý) nevratná otrava (sloučeniny síry, selenu, arzénu a fosforu) Základy chemických techlogií 44
45 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Syntézní okruh z termodynamiky plyne vysoký tlak, nízké teploty nejniž teplota odpovídá pracovní teplotě katalyzátoru (cca C), z toho plyne nízká konverze výchozí suroviny (cca 25-35%) nutst oddělit vzniklý amoniak a zbylou reakční směs vrátit zpět do procesu Základy chemických techlogií 45
46 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Syntézní okruh (pokrač.) děl syntézních okruhů podle tlaku nízkotlaký (10-20 MPa) středotlaký (25-35 MPa) vysokotlaký ( MPa) s rostoucí objemovou rychlostí reakční směsi lze docílit vět produkce, přesto že stupeň konverze klesá odvod inertních látek z cirkulačního okruhu (obsahuje argon, methan), tzv. odfuky Základy chemických techlogií 46
47 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Syntézní okruh - sestava syntézní reaktor chladič reakční směsi podchlazovač reakční směsi odlučovač reakční směsi filtr oběhové čerpadlo Základy chemických techlogií 47
48 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Syntézní reaktor skládá se z vysokotlakého tělesa a vestavby požadavky na kvalitu konstrukčních ů vodíková koroze (vodík + železo poskytuje hydrid a ten reaguje s uhlíkem v železu za vzniku methanu) vestavba tlakového tělesa je z měkké a uhlíkem chudé oceli, tělesa jsou dvouvrstvá vestavba zahrnuje výměník tepla (trubkový) k ohřevu plynu koš s katalyzátorem amoniakové syntézní reaktory se dělí na reaktory s vnitřní výměu tepla reaktory s vněj výměu tepla Základy chemických techlogií 48
49 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Chladiče a podchlazovače systém trubka v trubce chladiče (vodní, vzduchové) podchlazovače (kapalný amoniak) Základy chemických techlogií 49
50 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Odlučovače ležatý (vertikální zarážky) vertikální (trubka v trubce) Základy chemických techlogií 50
51 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Uskladnění amoniaku tři způsoby uskladnění teplé ( do 40 C, odpovídající tlak 1,55 MPa) středoteplotní (-5 až +5 C) t NH 3 nízkoteplotní (-33 C atmosférický tlak) t NH 3 Základy chemických techlogií 51
52 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Přeprava amoniaku železniční a automobilové cisterny Základy chemických techlogií 52
53 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Bezpečst práce amoniak dusík vodík oxid uhelnatý sulfan oxid uhličitý Základy chemických techlogií 53
54 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá VÝROBA KYSELINY DUSIČNÉ ZÁKLADY CHEMICKÝCH TECHNOLOGIÍ Základy chemických techlogií 54
55 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Vlaststi HNO 3 bezbarvá, na vzduchu dýmající kapalina dusivý zápach na vzduchu se rozkládá 4HNO 3 = 4NO 2 + H 2 O + O 2 NO 2 se rozští v HNO 3 a hnědě ji zabarvuje ve vodě se HNO 3 rozští ve všech poměrech za vývoje tepla Základy chemických techlogií 55
56 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Vlaststi HNO 3 (pokrač.) s vodou tvoří dva hydráty HNO 3. 3H 2 O a HNO 3. H 2 O nejniž bod tuhnutí -66,3 C má směs o slož cca 90% hm HNO 3 nejvyš bod varu 121,9 C příslu azeotropní směsi o slož 68,4% hm HNO 3 (hým zahříváním nelze získat kyselinu o vyš koncentraci) Základy chemických techlogií 56
57 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Vlaststi oxidu dusnatého bezbarvý plyn kritická teplota je -92,9 C, kritický tlak je 6,52 MPa za rmálního tlaku se zkapalňuje při - 151,4 C rozští se v HNO 3 a to tím více čím je koncentrovaněj rozpuštěný redukuje HNO 3 za vzniku NO 2 Základy chemických techlogií 57
58 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Vlaststi oxidu dusitého existuje při vyšch tlacích a nízké teplotě v ekvimolární směsi NO a NO 2 přechází při 25 C a 0,1 MPa ze 10,5% hm na N 2 O 3 při +3,5 C zkapalňuje za vzniku modře zbarvené kapaliny Základy chemických techlogií 58
59 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Vlaststi oxidu dusičitého rudohnědý plyn se snižující se teplotou zbarv slábne, se zvyšující se zesiluje (souvisí se vznikem polymeru 2NO 2 =N 2 O 4, který je bezbarvý) při ochlaz na 21,5 C N 2 O 4 kapalní při -10,8 C přechází v bezbarvé krystaly Základy chemických techlogií 59
60 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Vlaststi oxidu dusičného za rmálních podmínek ho nelze připravit oxidací oxidu dusnatého vzniká oxidací plynných nebo kapalných oxidů dusíku ozonem N 2 O 4 + O 3 = N 2 O 5 + O 2 vzniká též oxidací N 2 O 4 kyslíkem při tlaku 200 MPa s vodou lehce tvoří HNO 3 o vysoké koncentraci Základy chemických techlogií 60
61 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Použití kyseliny dusičné výroba dusíkatých hjiv výroba kombivaných hjiv výroba výbušnin výroba syntetických barviv Základy chemických techlogií 61
62 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Historie výrobních postupů rozklad dusičnanu sodného kyseliu sírovou při 200 C NaNO 3 + H 2 SO 4 = NaHSO 4 + HNO 3 zaříz retorta + chladič produktem je kyselina o koncentraci 96-98% (při žití H 2 SO 4 a čistého NaNO 3 ) Základy chemických techlogií 62
63 Historie výrobních postupů Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá (pokrač.) oxidace vzdušného dusíku kyslíkem v elektrickém oblouku N 2 + O 2 = NO Základy chemických techlogií 63
64 Historie výrobních postupů Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá (pokrač.) katalytická oxidace amoniaku plativý katalyzátor velmi krátká doba styku (0,001 s), jinak dochází k rozlož vzniklého oxidu dusnatého Základy chemických techlogií 64
65 Výroba podazeotropické Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá kyseliny dusičné sumární rovnice NH 3 + 2O 2 = HNO 3 + H 2 O vlastní výroba probíhá ve dvou fázích 1. spalování amoniaku za přítomsti katalyzátoru NH 3 + 5O 2 = 4NO + 6H 2 O 2. oxidace oxidu dusnatého na oxid dusičitý a jeho absorpce ve vodě 2NO + O 2 = NO 2 3NO 2 + H 2 O = 2HNO 3 + NO proces oxidace NO a absorpce NO 2 se několikrát opakuje (vyš stupeň přeměny NO na HNO 3 Základy chemických techlogií 65
66 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Katalytická oxidace amoniaku při oxidaci amoniaku vzniká vedle NO také N 2 O a N 2 4NH 3 + 5O 2 = 4NO + 6H 2 O 4NH 3 + 4O 2 = 2N 2 O + 6H 2 O 4NH 3 + 3O 2 = 2N 2 + 6H 2 O průběh ovlivňuje katalyzátor a podmínky ved procesu Základy chemických techlogií 66
67 Katalytická oxidace amoniaku Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá (pokrač.) všechny reakce jsou exotermní a prakticky nevratné při dosaž rovváhy by konečným produktem byl dusík a vodní pára, což n žádoucí úlohou katalyzátoru je usměrňování reakce na oxid dusnatý ostatním reakcím nesmí být dopřá dost času k jejich průběhu (zplodiny reakce je třeba odvést z reakčního prostoru) kromě výše uvedených tří reakcí se při spalování amoniaku uplatňují i nežádoucí pochody: Základy chemických techlogií 67
68 Katalytická oxidace amoniaku Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá (pokrač.) 2NH 3 = N 2 + 3H 2 2NO = N 2 + O 2 4NH 3 + 6NO = 5N 2 + 6H 2 O cílem spalování amoniaku je podpořit jen reakci se vznikem NO a potlačit průběh ostatních rozhodující je doba styku plynu s katalyzátorem, jeho slož a reakční podmínky (teplota, tlak, slož výchozí plynné směsí) Základy chemických techlogií 68
69 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Katalyzátor plativé sítě (slitina s rhodiem nebo i paladiem Pt + 4%Pd + 3,5%Rh nebo Pt + 7,5%Rh pro tlakové spalování) síla drátu 0,05 0,09 mm zpracovaná háčkováním spalování za rmálního tlaku: 3 až 4 síta, stupeň přeměny NH 3 na NO je 95-98% spalování za vyšho tlaku: 10 až 30 sít (s rostoucím tlakem se žívá více sít, protože klesá stupeň přeměny, dosahovaný stupeň přeměny je 95% Základy chemických techlogií 69
70 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Katalyzátor (pokrač.) katalyzátor v průběhu výroby křehne, zpočátku hladký a lesklý přechází na houbovitý a lesklý, vytváří se silně rozvitý povrch, který katalytickou aktivitu zvětšuje ztráty Pt v důsledku ztráty soudružsti (úlet), při rmálním tlaku 0,05-0,07g/t HNO 3, při vyšch tlacích ztráty rostou Základy chemických techlogií 70
71 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Sníž ztrát Pt katalyzátoru zachycování Pt z nitrózních plynů páleným vápnem zachycování Pt na Pd-Au sítech filtrace nitrózních plynů případně i kyseliny např. skelu vatou Základy chemických techlogií 71
72 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Mechanizmus oxidace NH 3 aktivovaná adsorpce kyslíku vzniká peroxidický adsorpční komplex katalyzátor kyslík aktivovaná adsorpce amoniaku vzniká vý komplex katalyzátor kyslík amoniak přeskup elektrových vazeb atomy vodíku a dusíku se spojují s kyslíkem za vzniku vody a oxidu dusnatého Základy chemických techlogií 72
73 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Katalytické jedy fosforovodík, sulfan, křemíkovodík acetylén, pyridin mazací oleje a tuky prachové částice (ze vzduchu) Základy chemických techlogií 73
74 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Čištění katalyzátoru proprání destilovau vodou proprání 10 15% hm kyseliu chlorovodíkovou při teplotě C po dobu 1 až 2 hodiny opláchnutí destilovau vodou přežíhání vodíkovým plamenem oprava poškozených míst vystřihnutí, přivař záplaty kyslíko-vodíkovým plamenem Základy chemických techlogií 74
75 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Techlogické podmínky teplota katalyzátoru při spalování amoniaku vzduchem je C poměr O 2 :NH 3 je 1,6-2,0, což odpovídá koncentraci NH 3 ve vzducho-amoniakové směsi 9,5-11,6 % obj. Základy chemických techlogií 75
76 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Techlogické podmínky (pokrač.) kyslík je potřebný nejen na spalování amoniaku, ale i na oxidaci oxidu dusnatého na oxid dusičitý bilančně vychází, že na 1 mol amoniaku je třeba 2 moly kyslíku. Mžství kyslíku se volí tak, aby po oxidaci NO na HNO 3 zůstalo v koncovém plynu 2,5 až 5 % obj. O 2. Vstupní poměr O 2 :NH 3 je určován spalováním amoniaku a potřebný přebytek vzduchu na oxidaci NO na NO 2 se dosahuje přidáváním vzduchu do oxidačně absorpčních věží zvýšený tlak při výrobě HNO 3 urychluje oxidaci oxidu dusnatého na oxid dusičitý Základy chemických techlogií 76
77 Průmyslové uspořádání Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá procesu spalování rmální tlak středotlaké do cca 0,5 MPa vysokotlaké cca 0,7 MPa a více zdrojem kyslíku je většiu vzduch / čištění několikanásobu filtrací směšovač amoniaku se vzduchem reaktor na spalování amoniaku, rozehřátí katalyzátoru vodíkovým plamenem, parní kotel chladič nitrózních plynů oxidace oxidu dusnatého Základy chemických techlogií 77
78 Průmyslové uspořádání Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá procesu (pokrač.) chladič nitrózních plynů 2NO + O 2 = 2NO 2 2NO 2 = N 2 O 4 NO + NO 2 = N 2 O 3 všechny reakce jsou exotermické, spojené se zmenšm objemu. Sníž teploty a zvýš tlaku posunuje rovváhu všech pochodů doprava (oxidace oxidu dusnatého patří k jedné z mála reakcí, jejichž reakční rychlost se zvyšující se teplotou klesá) Základy chemických techlogií 78
79 Průmyslové uspořádání Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá procesu (pokrač.) komplexní mechanismus reakce 2NO = O 2 = 2NO 2 N 2 O 2 + O 2 = 2NO 2 Základy chemických techlogií 79
80 Průmyslové uspořádání Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá procesu (pokrač.) dimerizace oxidu dusičitého 2NO 2 = N 2 O 4 oxidací NO vznikají rudohnědé dýmy NO 2 při sníž teploty zabarv slábne v důsledku probíhající polymerizaci NO 2 Základy chemických techlogií 80
81 Průmyslové uspořádání Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá procesu (pokrač.) absorpce oxidů dusíku ve zředění HNO 3 2NO 2 + H 2 O = HNO 3 + HNO 2 N 2 O 4 + H 2 O = HNO 3 + HNO 2 N 2 O 3 + H 2 O = HNO 2 kyselina dusitá je stálá jen při velmi zředěných roztocích a při teplotách pod 0 C za pracovních podmínek se rozkládá dle rovnice 3HNO 2 = HNO 3 + 2NO + H 2 O Základy chemických techlogií 81
82 Průmyslové uspořádání Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá procesu (pokrač.) všechny pochody až na rozklad kyseliny dusité jsou exotermní. Oxidace NO na NO 2 probíhá podstatně rychleji v kyselině dusičné obsahující rozpuštěný kyslík než v plynné fázi. denitrace kyseliny dusičné odstranění oxidů dusíku a tím i rudohnědého zabarv kyseliny profukováním vzduchu (bělící kolona) Základy chemických techlogií 82
83 Průmyslové uspořádání Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá procesu (pokrač.) odstraňování oxidů dusíku z koncových plynů 1. absorpce oxidů dusíku v roztocích louhu 2NO 2 + Na 2 CO 3 = NaNO 3 + NaNO 2 + CO 2 slož v sušině: 10 30% dusičnanů a 90-70% dusitanu 3NaNO 2 + 2HNO 3 = 3NaNO 3 + H 2 O + 2NO na dusitany se roztok zpracovává zahuštěním a krystalizací dusitanů Základy chemických techlogií 83
84 Průmyslové uspořádání Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá procesu (pokrač.) 2. katalytická redukce oxidů dusíku totální redukce vodíkem (středoteplotní 500 C) 2NO + H 2 = N 2 + 2H 2 O oxidem uhelnatým (středoteplotní 500 C) 2NO + 2CO = N 2 + 2O 2 metanem (vysokoteplotní 800 C) 2NO + CH 4 = 2N 2 + CO 2 + H 2 0 katalyzátor se žívá paladium na aktivní alumině, nebo chromniklové pásky (80% Ni + 20% Cr) Základy chemických techlogií 84
85 Průmyslové uspořádání Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá procesu (pokrač.) selektivní redukce (vhodné pro plyny s vysokým obsahem kyslíku, neboť ten se reakce s amoniakem redukčním činidlem nezúčastní) 6 NO + 4 NH 3 = 5 N 2 + 6H 2 0 6NO 2 + 8NH 3 = 7N 2 + 6H 2 0 stechiometrické mžství složek teplota C katalyzátor: paladium na aktivní alumině oxid vanadičný na aktivní alumině Základy chemických techlogií 85
86 Základní schémata výrobních Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá postupů 1. kombivané spalování amoniaku a absorpce nitrózních plynů se provádí za různých tlaků 2. rovtlaké spalování i absorpce probíhají při stejném tlaku středotlaké 0,4-0,5 MPa vysokotlaké 0,7-0,9 MPa Základy chemických techlogií 86
87 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá KYSELINA SÍROVÁ ZÁKLADY CHEMICKÝCH TECHNOLOGIÍ Základy chemických techlogií 87
88 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Vlaststi Vyrábí se v koncentraci % hm. Velmi reaktivní olejovitá kapalina Ochotně se spojuje s vodou, a to i chem. vázau, za silného vývoje tepla Chem. čistá a p.a. se skladuje ve skleněných nádobách Technická konc. kyselina se skladuje a dopravuje v ocelových nádobách (ocel je chráněna před korozí vrstvičkou FeSO 4, který je v konc. kyselině nerozpustný Základy chemických techlogií 88
89 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Vlaststi (pokrač.) hustota při 20 C je 1,830 g/cm3 (v oblasti % prochází hodta hustoty maximem = jedna hodta hustoty odpovídá dvěma koncentracím) bod tání 10,45 C bod varu 296,2 C azeotropická směs 98,5 % hm. H 2 SO 4 má bod varu 336,6 C Základy chemických techlogií 89
90 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Vlaststi (pokrač.) Zředěná H 2 SO 4 (pod 75 % hm.) se skladuje a přepravuje v nádobách vyložených olovem, pryží nebo plastickými hmotami (FeSO 4 se již rozští a koroze pokračuje) Dýmavá kys. sírová je kyselina s rozpuštěným SO 3 technicky se žívá 15 %ní a 60%ní oleum (mají nízké body tání, takže tak snad nezamrzají během dopravy a skladování (ostatní snad tuhu) Základy chemických techlogií 90
91 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Použití H 2 SO 4 Výroba hjiv (superfosfát, síran amonný) Výroba kyseliny trihydrogenfosforečné extrakčním způsobem Výroba titavé běloby Moř plechů Výroba viskózových vláken Výroba kaprolaktamu Louž uravých rud Náplň akumulátorů Sulfonace a nitrace organických látek Základy chemických techlogií 91
92 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Historie výroby pál vitriolového kamence (Fe 2 O 3.3SO 3 ), vznikající SO 3 se absorboval v kyselině sírové, kde reakcí s vodou vznikala kyselina sírová resp. oleum nitrózní způsob oxidace SO 2 na SO 3 v přítomsti oxidů dusíku v olověných komorách (produktem je H 2 SO % hm. Základy chemických techlogií 92
93 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Historie výroby (pokrač.) Kontaktní pochod oxidace SO 2 na povrchu pevného katalyzátoru (produktem je konc. H 2 SO % hm. nebo oleum Oxid siřičitý se získává spalováním sirných surovin (síry, pyritu, sulfanu) nebo redukčním štěpm sulfátů (sádrovce, anhydritu... ) Základy chemických techlogií 93
94 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Oxid siřičitý Bezbarvý plyn, ostře páchucí Lidský organismus je proti němu odolněj než rostlinná vegetace Pro mikroorganismy je prudkým jedem SO 2 je částečně asociován, takže jeho molární objem za rmálních podmínek (0 C, 0,1013 MPa) je 21,89 l; kritická teplota je 157,25 C, kritický tlak 7,88 MPa, z toho vyplývá, že je lehce zkapalnitelný Rozpustst ve vodě je několikanásobně vět než v kyselině sírové Základy chemických techlogií 94
95 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Oxid sírový Bezbarvá olejovitá kapalina s bodem varu 44,7 C, tuhnutím přechází v ledovitou nebo asbestovitou látku Jako plyn je nedýchatelný, ve styku s vodou tvoří bílé dýmy mlhu, což jsou velmi jemné kapičky kyseliny sírové Kromě momerní formy může existovat ve třech modifikacích, které jsou různými polymery Jako momer je přítomen v plynné i kapalné fázi V kapalné fázi i kruhové trimery Základy chemických techlogií 95
96 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Oxid sírový (pokrač.) Pod 27 C tuhne a vznikají dvě stabilní formy Tuhý oxid sírový nelze převést za rmálního tlaku zpět do kapalného stavu dochází k sublimaci dříve, než by roztál Základy chemických techlogií 96
97 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Výroba H 2 SO 4 Kontaktní způsob výroby S + O 2 = SO 2 SO 2 + 1/2O 2 = SO 3 SO 3 + H 2 O (konc. H 2 SO 4 ) H 2 SO 4 Jedná se o jedduché exotermní chemické reakce, s velmi odlišnými reakčními podmínkami a velmi růzu náročstí jejich realizace Základy chemických techlogií 97
98 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Oxidace síry na SO 2 Elementární síra se přepravuje v železničních cisternách, veškerá manipulace a skladování se provádí s kapalu sírou Filtrace přes keramické filtry Nástřik hořákem do pece (jemné kapičky) Spalování suchým vzduchem při cca 800 C Velké reakční teplo produkce páry (cca 1 t páry 4 MPa na 1 t H 2 SO 4 Základy chemických techlogií 98
99 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Oxidace síry na SO 2 (pokrač.) Spalování síry se provádí dvojnásobným přebytkem vzduchu oproti teoretické spotřebě Plyn na výstupu z pece má koncentraci 10 % SO 2, 11 % O 2 (zbytek je N 2 ) a teplotu C Při styku horkého siřičitého plynu s vyzdívkou, izolací a konstrukčními prvky dochází ke vzniku malého mžství SO 3 Základy chemických techlogií 99
100 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Oxidace SO 2 na SO 3 K její realizaci je zapotřebí katalyzátor (vanadový) Z termodynamického rozboru plyne, že se jedná o exotermní rovvážu reakci, proveditelu se stupněm přeměny téměř 100 % při teplotě niž než 350 C ( se stoupající teplotou stupeň přeměny SO 2 rychle klesá) Základy chemických techlogií 100
101 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Oxidace SO 2 na SO 3 (pokrač.) Z hlediska kinetického je tedy nutný katalyzátor, pracující při této teplotě (v současné době známe jen katalyzátory pracující v teplotní oblasti C) N tedy možné dosáhut vyš stupeň přeměny než %, což znamená, že 1 2 % z celkového mžství SO 2 nelze využít pro výrobu H 2 SO 4 Vývoj vých katalyzátorů má velký význam Základy chemických techlogií 101
102 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Vanadové katalyzátory Katalytická reakce probíhá v kapalné fázi (výrazná odlišst od většiny ostatních pevných katalyzátorů) Aktivní složka je během reakce ( C) tvořena taveniu polysíranů alkalických kovů, ve kterých jsou rozpuštěny oxidy vanadu (slož odpovídá směsi sloučenin K 2 O.V 2 O 5.nSO 3, kde n nabývá hodt 2 6 podle teploty a koncentrace SO 2 Základy chemických techlogií 102
103 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Vanadové katalyzátory (pokrač.) Aktivní složka je nanesena na porézní sič, kterým je SiO 2 Slož katalyzátoru je % hm. aktivní složky a zbytek je sič, který má cca 50 % porozitu a specifický povrch 1,5 10 m 2 /g Tvar katalyzátoru válečky, duté válečky, kuličky atd. o rozměru 4 10 mm Životst katalyzátoru je 3 10 let Základy chemických techlogií 103
104 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Vanadové katalyzátory (pokrač.) Příčiny detivace Přehřátí nad 600 C (sič reaguje s aktivní složkou) Poškoz vodou nebo vodní parou (při odstavování se katalyzátor profoukává horkým suchým vzduchem, aby došlo k desorpci SO 3 a při ochlaz nemohla vznikut H 2 SO 4, která by katalyzátor poškodila Základy chemických techlogií 104
105 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Vanadové katalyzátory (pokrač.) Zapráš dochází k ucpání pórů prachem (nutná účinná filtrace vzduchu i síry Střídání techlogických režimů (časté odstavování a najíždění) Základy chemických techlogií 105
106 Konstrukce kontaktních Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá reaktorů pro oxidaci SO 2 na SO 3 : Čtyř až pětietážové adiabatické reakctory o průměru 10 až 12 m Chlaz se provádí mezi etážemi buď výměníky tepla nebo přídavkem chladného vzduchu Základy chemických techlogií 106
107 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Absorpce SO 3 Poslední stupeň výroby rovváha této exotermní reakce je posunuta ve prospěch H 2 SO 4 (100 % absorpce): SO 3 +H 2 O (konc. H 2 SO 4 ) = H 2 SO 4 Při žití H 2 O nebo zředěné H 2 SO 4 vzniká velmi stabilní mlha (aerosol) kyseliny sírové (SO 3 reaguje s vodou v plynné fázi), příčiu je vysoká tenze vodní páry Základy chemických techlogií 107
108 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Absorpce SO 3 (pokrač.) Používá se H 2 SO 4 o koncentraci 98,3 % hm., která má nejniž (prakticky nulovou) tenzi vodní páry Stejná koncentrace kyseliny se žívá pro suš vzduchu pro spalování síry Suš vzduchu a absorpce SO 3 tvoří ve výrobě jeden techlogický celek Základy chemických techlogií 108
109 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Absorpce SO 3 (pokrač.) Absorbér ocelová věž s kyselivzdoru vyzdívkou, vyplněná Raschigovými kroužky Absorbéry jsou většiu dva, první produkuje %ní oleum a druhý koncentrovau kyselinu Plyny po absorpci procházejí přes odlučovače kapek a mlhy (demistery) do komína Základy chemických techlogií 109
110 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Extrakce zbytkového SO 2 Obsah SO 3 v koncových plynech je zanedbatelný Obsah SO 2 v plynu u 1 t H 2 SO 4 je cca kg, což odpovídá ztrátě cca kg H 2 SO 4 Základy chemických techlogií 110
111 Extrakce zbytkového SO 2 Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá (pokrač.) Sníž obsahu SO 2 - optimalizovaná varianta dvojí oxidace s vložeu absorpcí po dosaž stupně přeměny SO 2 na SO 3 cca % se reakční směs odvede z reaktoru, ochladí, absorbuje se vzniklý SO 3 asi z 95 %, zbylý plyn se ohřeje a vede zpět do reaktoru na poslední vrstvu katalyzátoru ztráty se sníží na 1 5 kg H 2 SO 4 ; za vyš investiční náklady se získá více H 2 SO 4 a významný ekologický efekt Základy chemických techlogií 111
112 Extrakce zbytkového SO 2 Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá (pokrač.) Použití uzavřeného cyklu n prozatím zvládnuto (konstrukční y, techlogický režim) Základy chemických techlogií 112
113 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá TECHNOLOGIE A APLIKACE PRŮMYSLOVÝCH HNOJIV ZÁKLADY CHEMICKÝCH TECHNOLOGIÍ Základy chemických techlogií 113
114 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Úvod FAO (Food and Agriculture Organisation) výživa lidstva produkce potravin výroba průmyslových hjiv Koloběh živin v přírodě Základy chemických techlogií 114
115 Vývoj obyvatelstva a rozlohy Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá zemědělské půdy v ČR i ve světě celkový růst počtu obyvatelstva zmenšování ploch zemědělské půdy růst civilizačního stupně Surovivé zdroje pro výroby průmyslových hjiv. Základy chemických techlogií 115
116 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Podmínky rostlinné výroby rostliny jsou specifickým útvarem živé hmoty (z prostředí ve kterém žijí odebírají různé látky, kterými se živí) agrochemie se zabývá naukou o výživě rostlin hjiva jsou cílené látky, které přidávané do živého prostředí rostlin mohou zlepšovat jejich výživu a tedy i mžství a kvalitu úrody (cílem je zvýšit produktivitu lidské práce) Základy chemických techlogií 116
117 Podmínky rostlinné výroby Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá (pokrač.) hj je úkon, při kterém přidáváme hjiva do životního prostředí rostlin, mající za cíl udrž rovváhy v oběhu rostlinných živin fotosyntéza probíhá tam, kde je přítomna vlhkost, oxid uhličitý, světelná i tepelná energie a biologický schopný organizovat průběh fotosyntézy živiny, potřebné pro růst rostlin, jsou většiu přijímany kořeny ze živného roztoku půdy Základy chemických techlogií 117
118 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Biogenní (živné) prvky pro fotosyntézu C, H, O základní prvky (makroživiny) N, P, K, Mg ostatní živiny Ca, Mg, S, Fe, Na, Si.. stopové prvky (mikroživiny) B, Mn, Zn, Cu, Mo, J Základy chemických techlogií 118
119 Ověř potřeby jedtlivých Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá živin chemická analýza hydroponie Základy chemických techlogií 119
120 Způsoby pěstování Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá zemědělských plodin nejniž extenzivní vyš organizovaný návrat živin do půdy nejvyš intenzivní způsob Základy chemických techlogií 120
121 Hranice spotřeby Tento Tento se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá průmyslových hjiv zásoby surovin biologický limit dávek znečišťování prostředí Základy chemických techlogií 121
122 se se souhlasem souhlasem autora autora školy koly -techlogic techlogické v Jeho Jeho žit bez bez souhlasu souhlasu autora autora je je ázá Spotřeba průmyslových hjiv vývoj poznatků o minerální výživě rostlin byl impulzem rozvoje spotřeby iniciátorem bylo zemědělství nejprve se využívaly suroviny obsahující biogenní prvky (chilský ledek, přírodní fosfáty a draselné soli a dále pak průmyslové odpady (Thomasova moučka a síran amonný) Základy chemických techlogií 122
5. Nekovy sı ra. 1) Obecná charakteristika nekovů. 2) Síra a její vlastnosti
 5. Nekovy sı ra 1) Obecná charakteristika nekovů 2) Síra a její vlastnosti 1) Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu. Jsou to prvky uspořádané
5. Nekovy sı ra 1) Obecná charakteristika nekovů 2) Síra a její vlastnosti 1) Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu. Jsou to prvky uspořádané
Ústřední komise Chemické olympiády. 55. ročník 2018/2019 OKRESNÍ KOLO. Kategorie D. Teoretická část Řešení
 Ústřední komise Chemické olympiády 55. ročník 2018/2019 OKRESNÍ KOLO Kategorie D Teoretická část Řešení Úloha 1 Bezpečnostní předpisy MarsCity II 16 bodů 1) Vybrané činnosti: a) Zvracení na mramorovou
Ústřední komise Chemické olympiády 55. ročník 2018/2019 OKRESNÍ KOLO Kategorie D Teoretická část Řešení Úloha 1 Bezpečnostní předpisy MarsCity II 16 bodů 1) Vybrané činnosti: a) Zvracení na mramorovou
Průmysl dusíku. amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin. NaClO NaOH CO(NH 2 ) 2.
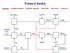 Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np:
 PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
H H C C C C C C H CH 3 H C C H H H H H H
 Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Kyselina dusičná. jedna z nejdůležitějších chemikálií
 Kyselina dusičná jedna z nejdůležitějších chemikálií Výroba: minulost - surovinou pro průmyslovou výrobu dusičnan sodný (ledek sodný, guano) současnost - katalytické spalování amoniaku (první výrobní jednotka
Kyselina dusičná jedna z nejdůležitějších chemikálií Výroba: minulost - surovinou pro průmyslovou výrobu dusičnan sodný (ledek sodný, guano) současnost - katalytické spalování amoniaku (první výrobní jednotka
Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0
 Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ)
 KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ) Úloha 1 Ic), IIa), IIId), IVb) za každé správné přiřazení po 1 bodu; celkem Úloha 2 8 bodů 1. Sodík reaguje s vodou za vzniku hydroxidu sodného a dalšího produktu.
KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ) Úloha 1 Ic), IIa), IIId), IVb) za každé správné přiřazení po 1 bodu; celkem Úloha 2 8 bodů 1. Sodík reaguje s vodou za vzniku hydroxidu sodného a dalšího produktu.
Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška Rafinace pohonných hmot, zpracování sulfanu, výroba vodíku
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška Rafinace pohonných hmot, zpracování sulfanu, výroba vodíku
POKYNY FAKTORY OVLIVŇUJÍCÍ RYCHLOST REAKCÍ
 POKYNY Prostuduj si teoretický úvod a následně vypracuj postupně všechny zadané úkoly zkontroluj si správné řešení úkolů podle řešení FAKTORY OVLIVŇUJÍCÍ RYCHLOST REAKCÍ 1) Vliv koncentrace reaktantů čím
POKYNY Prostuduj si teoretický úvod a následně vypracuj postupně všechny zadané úkoly zkontroluj si správné řešení úkolů podle řešení FAKTORY OVLIVŇUJÍCÍ RYCHLOST REAKCÍ 1) Vliv koncentrace reaktantů čím
Omezování plynných emisí. Ochrana ovzduší ZS 2012/2013
 Omezování plynných emisí Ochrana ovzduší ZS 2012/2013 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Omezování plynných emisí Ochrana ovzduší ZS 2012/2013 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
DUM č. 2 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 2 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 2 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
Inovace bakalářského studijního oboru Aplikovaná chemie CZ.1.07/2.2.00/ Výpočty z chemických vzorců
 Výpočty z chemických vzorců 1. Hmotnost kyslíku je 80 g. Vypočítejte : a) počet atomů kyslíku ( 3,011 10 atomů) b) počet molů kyslíku (2,5 mol) c) počet molekul kyslíku (1,505 10 24 molekul) d) objem (dm
Výpočty z chemických vzorců 1. Hmotnost kyslíku je 80 g. Vypočítejte : a) počet atomů kyslíku ( 3,011 10 atomů) b) počet molů kyslíku (2,5 mol) c) počet molekul kyslíku (1,505 10 24 molekul) d) objem (dm
Obsah Chemická reakce... 2 PL:
 Obsah Chemická reakce... 2 PL: Vyčíslení chemické rovnice - řešení... 3 Tepelný průběh chemické reakce... 4 Rychlost chemických reakcí... 4 Rozdělení chemických reakcí... 4 1 Chemická reakce děj, při němž
Obsah Chemická reakce... 2 PL: Vyčíslení chemické rovnice - řešení... 3 Tepelný průběh chemické reakce... 4 Rychlost chemických reakcí... 4 Rozdělení chemických reakcí... 4 1 Chemická reakce děj, při němž
Omezování plynných emisí. Ochrana ovzduší ZS 2010/2011
 Omezování plynných emisí Ochrana ovzduší ZS 2010/2011 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Omezování plynných emisí Ochrana ovzduší ZS 2010/2011 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Zplyňování biomasy. Sesuvný generátor. Autotermní zplyňování Autotermní a alotermní zplyňování
 Zplyňování = termochemická přeměna uhlíkatého materiálu v pevném či kapalném skupenství na výhřevný energetický plyn pomocí zplyňovacích médií a tepla. Produktem je plyn obsahující výhřevné složky (H 2,
Zplyňování = termochemická přeměna uhlíkatého materiálu v pevném či kapalném skupenství na výhřevný energetický plyn pomocí zplyňovacích médií a tepla. Produktem je plyn obsahující výhřevné složky (H 2,
CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK
 CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK Význam stechiometrických koeficientů 2 H 2 (g) + O 2 (g) 2 H 2 O(l) Počet reagujících částic 2 molekuly vodíku reagují s 1 molekulou kyslíku za vzniku
CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK Význam stechiometrických koeficientů 2 H 2 (g) + O 2 (g) 2 H 2 O(l) Počet reagujících částic 2 molekuly vodíku reagují s 1 molekulou kyslíku za vzniku
Ústřední komise Chemické olympiády. 42. ročník. KRAJSKÉ KOLO Kategorie D. SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut
 Ústřední komise Chemické olympiády 42. ročník 2005 2006 KRAJSKÉ KOLO Kategorie D SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut Institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy
Ústřední komise Chemické olympiády 42. ročník 2005 2006 KRAJSKÉ KOLO Kategorie D SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut Institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy
Bilan a ce c zák á l k ad a ní pojm j y m aplikace zákonů o zachování čehokoli 10.10.2008 3
 Výpočtový seminář z Procesního inženýrství podzim 2008 Bilance Materiálové a látkové 10.10.2008 1 Tématické okruhy bilance - základní pojmy bilanční schéma způsoby vyjadřování koncentrací a přepočtové
Výpočtový seminář z Procesního inženýrství podzim 2008 Bilance Materiálové a látkové 10.10.2008 1 Tématické okruhy bilance - základní pojmy bilanční schéma způsoby vyjadřování koncentrací a přepočtové
CHEMICKÉ VÝPOČTY HMOTNOST REAKTANTŮ A PRODUKTŮ PŘI CHEMICKÉ REAKCI PROJEKT EU PENÍZE ŠKOLÁM OPERAČNÍ PROGRAM VZDĚLÁVÁNÍ PRO KONKURENCESCHOPNOST
 CHEMICKÉ VÝPOČTY HMOTNOST REAKTANTŮ A PRODUKTŮ PŘI CHEMICKÉ REAKCI PROJEKT EU PENÍZE ŠKOLÁM OPERAČNÍ PROGRAM VZDĚLÁVÁNÍ PRO KONKURENCESCHOPNOST VÝPOČET HMOTNOSTI REAKTANTŮ A PRODUKTŮ PŘI CHEMICKÉ REAKCI
CHEMICKÉ VÝPOČTY HMOTNOST REAKTANTŮ A PRODUKTŮ PŘI CHEMICKÉ REAKCI PROJEKT EU PENÍZE ŠKOLÁM OPERAČNÍ PROGRAM VZDĚLÁVÁNÍ PRO KONKURENCESCHOPNOST VÝPOČET HMOTNOSTI REAKTANTŮ A PRODUKTŮ PŘI CHEMICKÉ REAKCI
Příklady úspěšných projektů čistší produkce (Cleaner Production) Výroba: kyseliny sírové mikrokorundu
 Příklady úspěšných projektů čistší produkce (Cleaner Production) Výroba: kyseliny sírové mikrokorundu Ing. Miroslav Richter, PhD., EUR ING Fakulta životního prostředí Univerzity J.E.Purkyně v Ústí n.l.
Příklady úspěšných projektů čistší produkce (Cleaner Production) Výroba: kyseliny sírové mikrokorundu Ing. Miroslav Richter, PhD., EUR ING Fakulta životního prostředí Univerzity J.E.Purkyně v Ústí n.l.
ZÁKLADNÍ CHEMICKÉ VÝPOČTY
 ZÁKLADNÍ CHEMICKÉ VÝPOČTY Látkové množství - vyjadřování množství: jablka pivo chleba uhlí - (téměř každá míra má svojí jednotku) v chemii existuje univerzální veličina pro vyjádření množství látky LÁTKOVÉ
ZÁKLADNÍ CHEMICKÉ VÝPOČTY Látkové množství - vyjadřování množství: jablka pivo chleba uhlí - (téměř každá míra má svojí jednotku) v chemii existuje univerzální veličina pro vyjádření množství látky LÁTKOVÉ
Registrační číslo projektu: CZ.1.07/1.4.00/21.2939. Název projektu: Investice do vzdělání - příslib do budoucnosti
 Registrační číslo projektu: CZ.1.07/1.4.00/21.2939 Název projektu: Investice do vzdělání - příslib do budoucnosti Číslo přílohy: VY_číslo šablony_inovace_číslo přílohy Autor Datum vytvoření vzdělávacího
Registrační číslo projektu: CZ.1.07/1.4.00/21.2939 Název projektu: Investice do vzdělání - příslib do budoucnosti Číslo přílohy: VY_číslo šablony_inovace_číslo přílohy Autor Datum vytvoření vzdělávacího
Kyselina fosforečná Suroviny: Výroba: termický způsob extrakční způsob
 Kyselina fosforečná bezbarvá krystalická sloučenina snadno rozpustná ve vodě komerčně dodávané koncentrace 75% H 3 PO 4 s 54,3% P 2 O 5 80% H 3 PO 4 s 58.0% P 2 O 5 85% H 3 PO 4 s 61.6% P 2 O 5 po kyselině
Kyselina fosforečná bezbarvá krystalická sloučenina snadno rozpustná ve vodě komerčně dodávané koncentrace 75% H 3 PO 4 s 54,3% P 2 O 5 80% H 3 PO 4 s 58.0% P 2 O 5 85% H 3 PO 4 s 61.6% P 2 O 5 po kyselině
Paliva. nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování
 Paliva Paliva nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování Dělení paliv podle skupenství pevná uhlí, dřevo kapalná benzín,
Paliva Paliva nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování Dělení paliv podle skupenství pevná uhlí, dřevo kapalná benzín,
Dusík a fosfor. Dusík
 5.9.010 Dusík a fosfor Dusík lyn Bezbarvý, bez chuti a zápachu Vyskytuje se v dvouatomových molekulách N Molekuly dusíku extremně stabilní říprava: reakce dusitanů s amonnými ionty NH N N ( ( ( ( Výroba:
5.9.010 Dusík a fosfor Dusík lyn Bezbarvý, bez chuti a zápachu Vyskytuje se v dvouatomových molekulách N Molekuly dusíku extremně stabilní říprava: reakce dusitanů s amonnými ionty NH N N ( ( ( ( Výroba:
Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH. atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na +
 OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
Prvky V.A a VI.A skupiny
 Prvky V.A a VI.A skupiny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Duben 2010 Mgr. Alena Jirčáková Prvky V.A skupiny - vlastnosti - Prvky s pěti
Prvky V.A a VI.A skupiny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Duben 2010 Mgr. Alena Jirčáková Prvky V.A skupiny - vlastnosti - Prvky s pěti
Pozn.: Pokud není řečeno jinak jsou pod pojmem procenta míněna vždy procenta hmotnostní.
 Sebrané úlohy ze základních chemických výpočtů Tento soubor byl sestaven pro potřeby studentů prvního ročníku chemie a příbuzných předmětů a nebyl nikterak revidován. Prosím omluvte případné chyby, překlepy
Sebrané úlohy ze základních chemických výpočtů Tento soubor byl sestaven pro potřeby studentů prvního ročníku chemie a příbuzných předmětů a nebyl nikterak revidován. Prosím omluvte případné chyby, překlepy
Amoniak. 1913 průmyslová výroba syntetického amoniaku
 Amoniak 1913 průmyslová výroba syntetického amoniaku využití 20 % výroba dusíkatých hnojiv 80 % nejrůznější odvětví průmyslu (plasty, vlákna, výbušiny, hydrazin, aminy, amidy, nitrily a další organické
Amoniak 1913 průmyslová výroba syntetického amoniaku využití 20 % výroba dusíkatých hnojiv 80 % nejrůznější odvětví průmyslu (plasty, vlákna, výbušiny, hydrazin, aminy, amidy, nitrily a další organické
 Typy chemických reakcí prezentace VY_52_INOVACE_213 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 8, 9 Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
Typy chemických reakcí prezentace VY_52_INOVACE_213 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 8, 9 Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
1.1 Suroviny síry Průmyslově využitelné suroviny pro zisk síry nebo jejích sloučenin nebo dalších složek obsažených v příslušných minerálech výskyt:
 1. Chemie a technologie sloučenin síry 1.1 Suroviny síry Průmyslově využitelné suroviny pro zisk síry nebo jejích sloučenin nebo dalších složek obsažených v příslušných minerálech výskyt: Elementární síra:
1. Chemie a technologie sloučenin síry 1.1 Suroviny síry Průmyslově využitelné suroviny pro zisk síry nebo jejích sloučenin nebo dalších složek obsažených v příslušných minerálech výskyt: Elementární síra:
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Oxidace a redukce jsou chemické reakce spojené s výměnou elektronů. Při oxidaci látka elektrony uvolňuje a její oxidační číslo se zvyšuje.
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Oxidace a redukce jsou chemické reakce spojené s výměnou elektronů. Při oxidaci látka elektrony uvolňuje a její oxidační číslo se zvyšuje.
NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE. Ing. Stanislav HONUS
 NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE Ing. Stanislav HONUS ORGANICKÝ MATERIÁL Spalování Chemické přeměny Chem. přeměny ve vodním prostředí Pyrolýza Zplyňování Chemické Biologické Teplo
NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE Ing. Stanislav HONUS ORGANICKÝ MATERIÁL Spalování Chemické přeměny Chem. přeměny ve vodním prostředí Pyrolýza Zplyňování Chemické Biologické Teplo
Složení soustav (roztoky, koncentrace látkového množství)
 VZOROVÉ PŘÍKLADY Z CHEMIE A DOPORUČENÁ LITERATURA pro přípravu k přijímací zkoušce studijnímu oboru Nanotechnologie na VŠB TU Ostrava Doporučená literatura z chemie: Prakticky jakákoliv celostátní učebnice
VZOROVÉ PŘÍKLADY Z CHEMIE A DOPORUČENÁ LITERATURA pro přípravu k přijímací zkoušce studijnímu oboru Nanotechnologie na VŠB TU Ostrava Doporučená literatura z chemie: Prakticky jakákoliv celostátní učebnice
7) Uveď příklad chemické reakce, při níž se sloučí dva prvky za vzniku sloučeniny. (3) hoření vodíku s kyslíkem a vzniká voda
 Chemické reakce a děje Chemické reakce 1) Jak se chemické reakce odlišují od fyzikálních dějů? (2) změna vlastností látek, změna vazeb mezi atomy 2) Co označujeme v chemických reakcích jako reaktanty a
Chemické reakce a děje Chemické reakce 1) Jak se chemické reakce odlišují od fyzikálních dějů? (2) změna vlastností látek, změna vazeb mezi atomy 2) Co označujeme v chemických reakcích jako reaktanty a
Chemické veličiny, vztahy mezi nimi a chemické výpočty
 SBÍRKA ŘEŠENÝCH PŘÍKLADŮ PRO PROJEKT PŘÍRODNÍ VĚDY AKTIVNĚ A INTERAKTIVNĚ CZ.1.07/1.1.24/01.0040 Chemické veličiny, vztahy mezi nimi a chemické výpočty Mgr. Jana Žůrková, 2013, 20 stran Obsah 1. Veličiny
SBÍRKA ŘEŠENÝCH PŘÍKLADŮ PRO PROJEKT PŘÍRODNÍ VĚDY AKTIVNĚ A INTERAKTIVNĚ CZ.1.07/1.1.24/01.0040 Chemické veličiny, vztahy mezi nimi a chemické výpočty Mgr. Jana Žůrková, 2013, 20 stran Obsah 1. Veličiny
SOLI. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: 12. 4. 2013. Ročník: osmý
 SOLI Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 12. 4. 2013 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Anorganické sloučeniny 1 Anotace: Žáci se seznámí s vlastnostmi solí,
SOLI Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 12. 4. 2013 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Anorganické sloučeniny 1 Anotace: Žáci se seznámí s vlastnostmi solí,
ŘEŠENÍ KONTROLNÍHO TESTU ŠKOLNÍHO KOLA
 Ústřední komise Chemické olympiády 48. ročník 2011/2012 ŠKOLNÍ KOLO kategorie C ŘEŠENÍ KONTROLNÍHO TESTU ŠKOLNÍHO KOLA KONTROLNÍ TEST ŠKOLNÍHO KOLA (60 BODŮ) Úloha 1 Neznámý nerost 21 bodů 1. Barva plamene:
Ústřední komise Chemické olympiády 48. ročník 2011/2012 ŠKOLNÍ KOLO kategorie C ŘEŠENÍ KONTROLNÍHO TESTU ŠKOLNÍHO KOLA KONTROLNÍ TEST ŠKOLNÍHO KOLA (60 BODŮ) Úloha 1 Neznámý nerost 21 bodů 1. Barva plamene:
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace
 Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
3. Soda a potaš Ing. Miroslav Richter, Ph.D., EUR ING
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE 3. Soda a potaš Ing. Miroslav Richter, Ph.D., EUR ING Výroby sody a potaše Suroviny, Přehled výrobních technologií
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE 3. Soda a potaš Ing. Miroslav Richter, Ph.D., EUR ING Výroby sody a potaše Suroviny, Přehled výrobních technologií
CHO cvičení, FSv, ČVUT v Praze
 2. Chemické rovnice Chemická rovnice je schématický zápis chemického děje (reakce), který nás informuje o reaktantech (výchozích látkách), produktech, dále o stechiometrii reakce tzn. o vzájemném poměru
2. Chemické rovnice Chemická rovnice je schématický zápis chemického děje (reakce), který nás informuje o reaktantech (výchozích látkách), produktech, dále o stechiometrii reakce tzn. o vzájemném poměru
Technické plyny. kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny)
 Technické plyny kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny) Kapalný vzduch složení vzduchu Před zkapalněním odstranění nežádoucích složek, např. vodní pára, CO 2, prach Zkapalňování
Technické plyny kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny) Kapalný vzduch složení vzduchu Před zkapalněním odstranění nežádoucích složek, např. vodní pára, CO 2, prach Zkapalňování
ZŠ ÚnO, Bratří Čapků 1332
 Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 2 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 2 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ)
 TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ) 3. část ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Zpracoval: Tým autorů EVECO Brno, s.r.o. ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Množství SO 2, HCl,
TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ) 3. část ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Zpracoval: Tým autorů EVECO Brno, s.r.o. ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Množství SO 2, HCl,
6.Úprava a čistění vod pro průmyslové a speciální účely
 6.Úprava a čistění vod pro průmyslové a speciální účely Ivan Holoubek Zdeněk Horsák RECETOX, Masaryk University, Brno, CR holoubek@recetox.muni.cz; http://recetox.muni.cz Inovace tohoto předmětu je spolufinancována
6.Úprava a čistění vod pro průmyslové a speciální účely Ivan Holoubek Zdeněk Horsák RECETOX, Masaryk University, Brno, CR holoubek@recetox.muni.cz; http://recetox.muni.cz Inovace tohoto předmětu je spolufinancována
Učební osnovy Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemický kroužek ročník 6.-9.
 Učební osnovy Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemický kroužek ročník 6.-9. Školní rok 0/03, 03/04 Kapitola Téma (Učivo) Znalosti a dovednosti (výstup) Počet hodin pro kapitolu Úvod
Učební osnovy Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemický kroužek ročník 6.-9. Školní rok 0/03, 03/04 Kapitola Téma (Učivo) Znalosti a dovednosti (výstup) Počet hodin pro kapitolu Úvod
VY_32_INOVACE_30_HBEN11
 Sloučeniny síry Temacká oblast : Chemie anorganická chemie Datum vytvoření: 15. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Sloučeniny síry sulfan, oxidy a
Sloučeniny síry Temacká oblast : Chemie anorganická chemie Datum vytvoření: 15. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Sloučeniny síry sulfan, oxidy a
Chemie. Mgr. Petra Drápelová Mgr. Jaroslava Vrbková. Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou
 Chemie Mgr. Petra Drápelová Mgr. Jaroslava Vrbková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH ROVNIC VY_32_INOVACE_03_3_18_CH Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH
Chemie Mgr. Petra Drápelová Mgr. Jaroslava Vrbková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH ROVNIC VY_32_INOVACE_03_3_18_CH Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH
DUM č. 4 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 4 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 4 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
Kolik energie by se uvolnilo, kdyby spalování ethanolu probíhalo při teplotě o 20 vyšší? Je tato energie menší nebo větší než při teplotě 37 C?
 TERMOCHEMIE Reakční entalpie při izotermním průběhu reakce, rozsah reakce 1 Kolik tepla se uvolní (nebo spotřebuje) při výrobě 2,2 kg acetaldehydu C 2 H 5 OH(g) = CH 3 CHO(g) + H 2 (g) (a) při teplotě
TERMOCHEMIE Reakční entalpie při izotermním průběhu reakce, rozsah reakce 1 Kolik tepla se uvolní (nebo spotřebuje) při výrobě 2,2 kg acetaldehydu C 2 H 5 OH(g) = CH 3 CHO(g) + H 2 (g) (a) při teplotě
Prvky 14. Skupiny (Tetrely)
 Prvky 14. Skupiny (Tetrely) 19.1.2011 p 2 prvky C nekov Si, Ge polokov Sn, Pb kov ns 2 np 2 Na vytvoření kovalentních vazeb ve sloučeninách poskytují 2, nebo 4 elektrony Všechny prvky jsou pevné látky
Prvky 14. Skupiny (Tetrely) 19.1.2011 p 2 prvky C nekov Si, Ge polokov Sn, Pb kov ns 2 np 2 Na vytvoření kovalentních vazeb ve sloučeninách poskytují 2, nebo 4 elektrony Všechny prvky jsou pevné látky
Anorganické sloučeniny opakování Smart Board
 Anorganické sloučeniny opakování Smart Board VY_52_INOVACE_210 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 8.,9. Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
Anorganické sloučeniny opakování Smart Board VY_52_INOVACE_210 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 8.,9. Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
Chemické výpočty 11. Stechiometrické výpočty (včetně reakcí s ideálními plyny); reakce s přebytkem výchozí látky
 Chemické výpočty 11 Stechiometrické výpočty (včetně reakcí s ideálními plyny); reakce s přebytkem výchozí látky Ing. Martin Pižl Skupina koordinační chemie místnost A213 E-mail: martin.pizl@vscht.cz Web:
Chemické výpočty 11 Stechiometrické výpočty (včetně reakcí s ideálními plyny); reakce s přebytkem výchozí látky Ing. Martin Pižl Skupina koordinační chemie místnost A213 E-mail: martin.pizl@vscht.cz Web:
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ
 SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
zadání příkladů 10. výsledky příkladů 7. 3,543 litru kyslíku
 zadání Jaký bude objem vodíku při tlaku 105 kpa a teplotě 15 stupňů Celsia, který vznikne reakcí 8 gramů zinku s nadbytkem kyseliny trihydrogenfosforečné? Jaký bude objem vodíku při tlaku 97 kpa a teplotě
zadání Jaký bude objem vodíku při tlaku 105 kpa a teplotě 15 stupňů Celsia, který vznikne reakcí 8 gramů zinku s nadbytkem kyseliny trihydrogenfosforečné? Jaký bude objem vodíku při tlaku 97 kpa a teplotě
Ch - Hydroxidy VARIACE
 Ch - Hydroxidy Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl kompletně vytvořen,
Ch - Hydroxidy Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl kompletně vytvořen,
NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV:VY_32_INOVACE_102_Soli AUTOR: Igor Dubovan ROČNÍK, DATUM: 9., 15. 9.
 NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV:VY_32_INOVACE_102_Soli AUTOR: Igor Dubovan ROČNÍK, DATUM: 9., 15. 9. 2011 VZDĚL. OBOR, TÉMA: Chemie, Soli ČÍSLO PROJEKTU: OPVK
NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV:VY_32_INOVACE_102_Soli AUTOR: Igor Dubovan ROČNÍK, DATUM: 9., 15. 9. 2011 VZDĚL. OBOR, TÉMA: Chemie, Soli ČÍSLO PROJEKTU: OPVK
kyslík ve vodě CO 2 (vápenato-)uhličitanová rovnováha alkalita
 kyslík ve vodě CO 2 ph (vápenato-)uhličitanová rovnováha alkalita elementární plyny s vodou nereagují, ale rozpouštějí se fyzikálně (N 2, O 2, ) plynné anorganické sloučeniny (CO 2, H 2 S, NH 3 ) s vodou
kyslík ve vodě CO 2 ph (vápenato-)uhličitanová rovnováha alkalita elementární plyny s vodou nereagují, ale rozpouštějí se fyzikálně (N 2, O 2, ) plynné anorganické sloučeniny (CO 2, H 2 S, NH 3 ) s vodou
Chemické procesy v ochraně životního prostředí
 Chemické procesy v ochraně životního prostředí 1. Vliv výroby energie na životní prostředí 2. Zpracování výfukových plynů ze spalovacích motorů 3. Zachycování oxidů síry ve spalinách 4. Výroba paliv pro
Chemické procesy v ochraně životního prostředí 1. Vliv výroby energie na životní prostředí 2. Zpracování výfukových plynů ze spalovacích motorů 3. Zachycování oxidů síry ve spalinách 4. Výroba paliv pro
Ropa Kondenzované uhlovodíky
 Nejdůležitější surovina pro výrobu organických sloučenin Nejvýznamnější surovina světové ekonomiky Výroba energie Chemické zpracování - 15 % Cena a zásoby ropy (70-100 let) Ropné krize Nutnost hledání
Nejdůležitější surovina pro výrobu organických sloučenin Nejvýznamnější surovina světové ekonomiky Výroba energie Chemické zpracování - 15 % Cena a zásoby ropy (70-100 let) Ropné krize Nutnost hledání
kyslík ve vodě CO 2 (vápenato-)uhličitanová rovnováha alkalita
 kyslík ve vodě CO 2 ph (vápenato-)uhličitanová rovnováha alkalita elementární plyny s vodou nereagují, ale rozpouštějí se fyzikálně (N 2, O 2, ) plynné anorganické sloučeniny (CO 2, H 2 S, NH 3 ) s vodou
kyslík ve vodě CO 2 ph (vápenato-)uhličitanová rovnováha alkalita elementární plyny s vodou nereagují, ale rozpouštějí se fyzikálně (N 2, O 2, ) plynné anorganické sloučeniny (CO 2, H 2 S, NH 3 ) s vodou
Modul 02 - Přírodovědné předměty
 Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 - Přírodovědné předměty Hana Gajdušková 12.skupina
Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 - Přírodovědné předměty Hana Gajdušková 12.skupina
ZŠ ÚnO, Bratří Čapků 1332
 Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
1 mol (ideálního) plynu, zaujímá za normálních podmínek objem 22,4 litru. , Cl 2 , O 2
 10.výpočty z rovnic praktické provádění výpočtů z rovnic K výpočtu chemických rovnic je důležité si shrnout tyto poznatky: Potřebujem znát vyjadřování koncentrací, objemový zlomek, molární zlomek, molární
10.výpočty z rovnic praktické provádění výpočtů z rovnic K výpočtu chemických rovnic je důležité si shrnout tyto poznatky: Potřebujem znát vyjadřování koncentrací, objemový zlomek, molární zlomek, molární
III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
HOŘČÍK KOVY ALKALICKÝCH ZEMIN. Pozn. Elektronová konfigurace valenční vrstvy ns 2
 HOŘČÍK KOVY ALKALICKÝCH ZEMIN Pozn. Elektronová konfigurace valenční vrstvy ns 2 Hořčík Vlastnosti: - stříbrolesklý, měkký, kujný kov s nízkou hustotou (1,74 g.cm -3 ) - diagonální podobnost s lithiem
HOŘČÍK KOVY ALKALICKÝCH ZEMIN Pozn. Elektronová konfigurace valenční vrstvy ns 2 Hořčík Vlastnosti: - stříbrolesklý, měkký, kujný kov s nízkou hustotou (1,74 g.cm -3 ) - diagonální podobnost s lithiem
Název školy: Číslo a název sady: klíčové aktivity: Jméno a příjmení autora: Mgr. Alexandra Šlegrová
 Název školy: Číslo a název projektu: Číslo a název šablony klíčové aktivity: Označení materiálu: Typ materiálu: Předmět, ročník, obor: Číslo a název sady: Téma: Jméno a příjmení autora: STŘEDNÍ ODBORNÁ
Název školy: Číslo a název projektu: Číslo a název šablony klíčové aktivity: Označení materiálu: Typ materiálu: Předmět, ročník, obor: Číslo a název sady: Téma: Jméno a příjmení autora: STŘEDNÍ ODBORNÁ
Úlohy: 1) Vypočítejte tepelné zabarvení dané reakce z následujících dat: C 2 H 4(g) + H 2(g) C 2 H 6(g)
 Úlohy: 1) Vypočítejte tepelné zabarvení dané reakce z následujících dat: C 2 H 4(g) + H 2(g) C 2 H 6(g) C 2 H 4(g) + 3O 2(g ) 2CO 2(g) +2H 2 O (l) H 0 298,15 = -1410,9kJ.mol -1 2C 2 H 6(g) + 7O 2(g) 4CO
Úlohy: 1) Vypočítejte tepelné zabarvení dané reakce z následujících dat: C 2 H 4(g) + H 2(g) C 2 H 6(g) C 2 H 4(g) + 3O 2(g ) 2CO 2(g) +2H 2 O (l) H 0 298,15 = -1410,9kJ.mol -1 2C 2 H 6(g) + 7O 2(g) 4CO
DUM VY_52_INOVACE_12CH19
 Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH19 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH19 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
Tematický blok 2 Zdroje znečišťování ovzduší Chemický průmysl Ing. Miroslav Richter, Ph.D., EUR ING miroslav.richter@ujep.cz
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Tematický blok 2 Zdroje znečišťování ovzduší Chemický průmysl Ing. Miroslav Richter, Ph.D., EUR ING miroslav.richter@ujep.cz
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Tematický blok 2 Zdroje znečišťování ovzduší Chemický průmysl Ing. Miroslav Richter, Ph.D., EUR ING miroslav.richter@ujep.cz
Technologie pro úpravu bazénové vody
 Technologie pro úpravu GHC Invest, s.r.o. Korunovační 6 170 00 Praha 7 info@ghcinvest.cz Příměsi významné pro úpravu Anorganické látky přírodního původu - kationty kovů (Cu +/2+, Fe 2+/3+, Mn 2+, Ca 2+,
Technologie pro úpravu GHC Invest, s.r.o. Korunovační 6 170 00 Praha 7 info@ghcinvest.cz Příměsi významné pro úpravu Anorganické látky přírodního původu - kationty kovů (Cu +/2+, Fe 2+/3+, Mn 2+, Ca 2+,
Bezpečnostní inženýrství - Chemické procesy -
 Bezpečnostní inženýrství - Chemické procesy - M. Jahoda Nebezpečí a prevence chemických procesů 2 Chemické reakce Tepelné efekty exotermní procesy (teplo se uvolňuje => nutnost chlazení) endotermní procesy
Bezpečnostní inženýrství - Chemické procesy - M. Jahoda Nebezpečí a prevence chemických procesů 2 Chemické reakce Tepelné efekty exotermní procesy (teplo se uvolňuje => nutnost chlazení) endotermní procesy
KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení. Ing. Miroslav Richter, PhD.
 KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení Ing. Miroslav Richter, PhD., EUR ING 2014 Materiálové bilance 3.5.1 Do tkaninového filtru vstupuje 10000
KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení Ing. Miroslav Richter, PhD., EUR ING 2014 Materiálové bilance 3.5.1 Do tkaninového filtru vstupuje 10000
Soli kyslíkatých kyselin
 Soli kyslíkatých kyselin Temacká oblast : Chemie anorganická chemie Datum vytvoření: 19. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Soli důležitých anorganických
Soli kyslíkatých kyselin Temacká oblast : Chemie anorganická chemie Datum vytvoření: 19. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Soli důležitých anorganických
Vodík jako alternativní ekologické palivo. palivové články a vodíkové hospodářství
 Vodík jako alternativní ekologické palivo palivové články a vodíkové hospodářství Charakteristika vodíku vodík je nejrozšířenějším prvkem ve vesmíru na Zemi je třetím nejrozšířenějším prvkem po kyslíku
Vodík jako alternativní ekologické palivo palivové články a vodíkové hospodářství Charakteristika vodíku vodík je nejrozšířenějším prvkem ve vesmíru na Zemi je třetím nejrozšířenějším prvkem po kyslíku
Předmět: CHEMIE Ročník: 8. ŠVP Základní škola Brno, Hroznová 1. Výstupy předmětu
 Chemie ukázka chemického skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce práce s dostupnými a běžně používanými látkami (směsmi). Na základě piktogramů žák posoudí nebezpečnost
Chemie ukázka chemického skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce práce s dostupnými a běžně používanými látkami (směsmi). Na základě piktogramů žák posoudí nebezpečnost
O X I D Y. Ing. Lubor Hajduch ZŠ Újezd Kyjov
 O X I D Y Ing. Lubor Hajduch ZŠ Újezd Kyjov CO TO JSOU OXIDY? Oxidy (starší název kysličníky) jsou dvouprvkové sloučeniny kyslíku a dalšího prvku, kromě vodíku. Mezi oxidy patří mnoho nerostů, průmyslových
O X I D Y Ing. Lubor Hajduch ZŠ Újezd Kyjov CO TO JSOU OXIDY? Oxidy (starší název kysličníky) jsou dvouprvkové sloučeniny kyslíku a dalšího prvku, kromě vodíku. Mezi oxidy patří mnoho nerostů, průmyslových
atomová hmotnost S + O 2 -> SO 2 Fe + S -> FeS
 PRVKY ŠESTÉ SKUPINY - CHALKOGENY Mezi chalkogeny (nepřechodné prvky 6.skupiny) zařazujeme kyslík, síru, selen, tellur a radioaktivní polonium. Společnou vlastností těchto prvků je šest valenčních elektronů
PRVKY ŠESTÉ SKUPINY - CHALKOGENY Mezi chalkogeny (nepřechodné prvky 6.skupiny) zařazujeme kyslík, síru, selen, tellur a radioaktivní polonium. Společnou vlastností těchto prvků je šest valenčních elektronů
Na Zemi tvoří vodík asi 15 % atomů všech prvků. Chemické slučování je děj, při kterém z látek jednodušších vznikají látky složitější.
 Nejjednodušší prvek. Na Zemi tvoří vodík asi 15 % atomů všech prvků. Chemické slučování je děj, při kterém z látek jednodušších vznikají látky složitější. Vodík tvoří dvouatomové molekuly, je lehčí než
Nejjednodušší prvek. Na Zemi tvoří vodík asi 15 % atomů všech prvků. Chemické slučování je děj, při kterém z látek jednodušších vznikají látky složitější. Vodík tvoří dvouatomové molekuly, je lehčí než
TECHNOLOGIE OCHRANY OVZDUŠÍ
 TECHNOLOGIE OCHRANY OVZDUŠÍ Přednáška č. 5 Přednášející: Ing. Marek Staf, Ph.D. tel. 0 444 458; e-mail marek.staf@vscht.cz budova A, ústav 16, č. dveří 16 Snímek 1. Osnova přednášky Suchá vápencová metoda
TECHNOLOGIE OCHRANY OVZDUŠÍ Přednáška č. 5 Přednášející: Ing. Marek Staf, Ph.D. tel. 0 444 458; e-mail marek.staf@vscht.cz budova A, ústav 16, č. dveří 16 Snímek 1. Osnova přednášky Suchá vápencová metoda
EU peníze středním školám digitální učební materiál
 EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
Vzdělávací obsah vyučovacího předmětu
 Vzdělávací obsah vyučovacího předmětu Chemie 9. ročník Zpracovala: Mgr. Michaela Krůtová ANORGANICKÉ SLOUČENINY KYSELINY porovná vlastnosti a použití vybraných prakticky významných kyselin orientuje se
Vzdělávací obsah vyučovacího předmětu Chemie 9. ročník Zpracovala: Mgr. Michaela Krůtová ANORGANICKÉ SLOUČENINY KYSELINY porovná vlastnosti a použití vybraných prakticky významných kyselin orientuje se
Směšovací poměr a emise
 Směšovací poměr a emise Hmotnostní poměr mezi palivem a okysličovadlem - u motorů provozovaných v atmosféře, je okysličovadlem okolní vzduch Složení vzduchu: (objemové podíly) - 78% dusík N 2-21% kyslík
Směšovací poměr a emise Hmotnostní poměr mezi palivem a okysličovadlem - u motorů provozovaných v atmosféře, je okysličovadlem okolní vzduch Složení vzduchu: (objemové podíly) - 78% dusík N 2-21% kyslík
Denitrifikace. Ochrana ovzduší ZS 2012/2013
 Denitrifikace Ochrana ovzduší ZS 2012/2013 1 Úvod Pojem oxidy dusíku NO NO 2 Další formy NO x Vznik NO x 2 Vlastnosti NO Oxid dusnatý Vlastnosti M mol,no = 30,01 kg/kmol V mol,no,n = 22,41 m 3 /kmol ρ
Denitrifikace Ochrana ovzduší ZS 2012/2013 1 Úvod Pojem oxidy dusíku NO NO 2 Další formy NO x Vznik NO x 2 Vlastnosti NO Oxid dusnatý Vlastnosti M mol,no = 30,01 kg/kmol V mol,no,n = 22,41 m 3 /kmol ρ
Střední průmyslová škola strojnická Vsetín Číslo projektu. Druh učebního materiálu prezentace Pravidla pro tvorbu vzorců a názvů kyselin a solí
 Název školy Střední průmyslová škola strojnická Vsetín Číslo projektu CZ.1.07/1.5.00/34.0483 Autor RNDr. Miroslava Pospíšilíková Název šablony III/2 Název DUMu 10.3 Názvosloví kyselin a solí Tematická
Název školy Střední průmyslová škola strojnická Vsetín Číslo projektu CZ.1.07/1.5.00/34.0483 Autor RNDr. Miroslava Pospíšilíková Název šablony III/2 Název DUMu 10.3 Názvosloví kyselin a solí Tematická
Chemické děje a rovnice procvičování Smart Board
 Chemické děje a rovnice procvičování Smart Board VY_52_INOVACE_216 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 9. Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
Chemické děje a rovnice procvičování Smart Board VY_52_INOVACE_216 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 9. Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
Dusík a jeho sloučeniny
 Dusík a jeho sloučeniny Mgr. Jana Pertlová Copyright istudium, 2008, http://www.istudium.cz Žádná část této publikace nesmí být publikována a šířena žádným způsobem a v žádné podobě bez výslovného svolení
Dusík a jeho sloučeniny Mgr. Jana Pertlová Copyright istudium, 2008, http://www.istudium.cz Žádná část této publikace nesmí být publikována a šířena žádným způsobem a v žádné podobě bez výslovného svolení
16.5.2010 Halogeny 1
 16.5.010 Halogeny 1 16.5.010 Halogeny Prvky VII.A skupiny: F, Cl, Br, I,(At) Obecnávalenčníkonfigurace:ns np 5 Pro plné zaplnění valenční vrstvy potřebují 1 e - - nejčastější sloučeniny s oxidačním číslem
16.5.010 Halogeny 1 16.5.010 Halogeny Prvky VII.A skupiny: F, Cl, Br, I,(At) Obecnávalenčníkonfigurace:ns np 5 Pro plné zaplnění valenční vrstvy potřebují 1 e - - nejčastější sloučeniny s oxidačním číslem
SOLI A JEJICH VYUŽITÍ. Soli bezkyslíkatých kyselin Soli kyslíkatých kyselin Hydrogensoli Hydráty solí
 SOLI A JEJICH VYUŽITÍ Soli bezkyslíkatých kyselin Soli kyslíkatých kyselin Hydrogensoli Hydráty solí POUŽITÍ SOLÍ Zemědělství dusičnany, draselné soli, fosforečnany. Stavebnictví, sochařství vápenaté soli.
SOLI A JEJICH VYUŽITÍ Soli bezkyslíkatých kyselin Soli kyslíkatých kyselin Hydrogensoli Hydráty solí POUŽITÍ SOLÍ Zemědělství dusičnany, draselné soli, fosforečnany. Stavebnictví, sochařství vápenaté soli.
ÚPRAVA VODY V ENERGETICE. Ing. Jiří Tomčala
 ÚPRAVA VODY V ENERGETICE Ing. Jiří Tomčala Úvod Voda je v elektrárnách po palivu nejdůležitější surovinou Její množství v provozních systémech elektráren je mnohonásobně větší než množství spotřebovaného
ÚPRAVA VODY V ENERGETICE Ing. Jiří Tomčala Úvod Voda je v elektrárnách po palivu nejdůležitější surovinou Její množství v provozních systémech elektráren je mnohonásobně větší než množství spotřebovaného
J. Kubíček FSI Brno 2018
 J. Kubíček FSI Brno 2018 Fosfátování je povrchová úprava, kdy se na povrch povlakovaného kovu vylučují nerozpustné fosforečnany. Povlak vzniká reakcí iontů z pracovní lázně s ionty rozpuštěnými z povrchu
J. Kubíček FSI Brno 2018 Fosfátování je povrchová úprava, kdy se na povrch povlakovaného kovu vylučují nerozpustné fosforečnany. Povlak vzniká reakcí iontů z pracovní lázně s ionty rozpuštěnými z povrchu
Gymnázium Jiřího Ortena, Kutná Hora. Pojmy Metody a formy Poznámky
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie 2. ročník a sexta 2 hodiny týdně Školní tabule, interaktivní tabule, tyčinkové a kalotové modely molekul, zpětný
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie 2. ročník a sexta 2 hodiny týdně Školní tabule, interaktivní tabule, tyčinkové a kalotové modely molekul, zpětný
Modul 02 - Přírodovědné předměty
 Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 - Přírodovědné předměty Hana Gajdušková Výskyt
Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 - Přírodovědné předměty Hana Gajdušková Výskyt
ZŠ ÚnO, Bratří Čapků 1332
 Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 1 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 1 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Chemie a technologie sloučenin dusíku. 1.0. Výskyt dusíku a jeho sloučenin
 Chemie a technologie sloučenin dusíku 1.0. Výskyt dusíku a jeho sloučenin V atmosféře je 79 % obj. dusíku. Zároveň se v atmosféře vyskytují stopová množství oxidů dusíku souhrnně označovaných jako NO x
Chemie a technologie sloučenin dusíku 1.0. Výskyt dusíku a jeho sloučenin V atmosféře je 79 % obj. dusíku. Zároveň se v atmosféře vyskytují stopová množství oxidů dusíku souhrnně označovaných jako NO x
Výfukové plyny pístových spalovacích motorů
 Výfukové plyny pístových spalovacích motorů Hlavními složkami výfukových plynů při spalování směsi uhlovodíkových paliv a vzduchu jsou dusík, oxid uhličitý, vodní pára a zbytkový kyslík. Jejich obvyklá
Výfukové plyny pístových spalovacích motorů Hlavními složkami výfukových plynů při spalování směsi uhlovodíkových paliv a vzduchu jsou dusík, oxid uhličitý, vodní pára a zbytkový kyslík. Jejich obvyklá
Masarykova střední škola zemědělská a Vyšší odborná škola, Opava, příspěvková organizace
 Číslo projektu Číslo materiálu Název školy Autor Průřezové téma Tematický celek CZ.1.07/1.5.00/34.0565 VY_32_INOVACE_347_Chemické reakce a rovnice Masarykova střední škola zemědělská a Vyšší odborná škola,
Číslo projektu Číslo materiálu Název školy Autor Průřezové téma Tematický celek CZ.1.07/1.5.00/34.0565 VY_32_INOVACE_347_Chemické reakce a rovnice Masarykova střední škola zemědělská a Vyšší odborná škola,
Chemie 8.ročník. Rozpracované očekávané výstupy žáka Učivo Přesuny, OV a PT. Pozorování, pokus a bezpečnost práce předmět chemie,význam
 Chemie 8.ročník Zařadí chemii mezi přírodní vědy. Pozorování, pokus a bezpečnost práce předmět chemie,význam Popisuje vlastnosti látek na základě pozorování, měření a pokusů. těleso,látka (vlastnosti látek)
Chemie 8.ročník Zařadí chemii mezi přírodní vědy. Pozorování, pokus a bezpečnost práce předmět chemie,význam Popisuje vlastnosti látek na základě pozorování, měření a pokusů. těleso,látka (vlastnosti látek)
