Podzimní semestr 2013/2014
|
|
|
- Jaroslav Janda
- před 6 lety
- Počet zobrazení:
Transkript
1 Lékařská chemie Podzimní semestr 2013/2014 Přednášky: Seminář: 2 hod týdně - zkouška 2 hod týdně - zápočet Praktická cvičení: 2 hodiny 1x za 14 dní - zápočet 1
2 Doporučená literatura: Táborská E., Sláma J. a kolektiv: Lékařská chemie I (Obecná a anorganická chemie), 2005, 2010, 2012 Dostál J. a kolektiv: Lékařská chemie II (Bioorganická chemie) 2005, 2009, 2012 Podklady přednášek:is MUNI VSLC011p Lékařská chemie-přednáška (podzim 2012) studijní materiály 2
3 Disperzní soustavy a jejich vlastnosti Biochemický ústav LF MU (E.T.)
4 Pojmy, jejichž znalost ze střední školy je nezbytná pro porozumění přednášené látce : koncentrace roztoků elektrolyty, jejich chování, typy elektrolytů 4
5 Roztoky jsou hlavní složkou organismů Lidské tělo celková tělesná voda pevné látky CTV 60 % 40 % extracelulární tekutina intracelulární tekutina ECT 20 % ICT 40 % intravaskulární (plazma) intersticiální IVT 5 % IST 15 % 5
6 Podíl tělesné vody na celkové hmotnosti % 72 % 65 % 62 % 51 % 54 % 46 % 6 Novorozenci Děti 0,5 r Děti 1 r Muži Ženy Muži > 60 let Ženy > 60 let
7 Disperzní soustavy Dispergované částice Disperzní prostředí Roztoky patří mezi disperzní soustavy 7
8 Typy disperzních soustav Disperzní prostředí Disperg. částice Název soustavy Tuhé Tuhé Kapalné Plynné Slitiny, sklo Tuhé emulse (máslo) Houby, frity Kapalné Tuhé Kapalné Plynné Suspenze, roztoky Emulze, roztoky Pěny, roztoky plynů Plynné Tuhé Kapalné Plynné Kouře, aerosoly Mlha, aerosoly Směsi plynů 8
9 Kapalné disperzní soustavy velikost disp.částic < 1 nm analytické soustavy, pravé roztoky nm koloidní soustavy > 500 nm hrubé disperze Rozdíly: viditelnost dispergovaných částic, sedimentace, difuze, optické vlastnosti ad. Terminologie: Solut rozpouštěná látka Solvent - rozpouštědlo 9
10 Vlastnosti kapalných disperzních soustav Charakteristika Pravý roztok Koloidní disperze Hrubá disperze Velikost částic < 1nm nm >500 nm Viditelnost částic Ne Elektr.mikroskop Opt.mikroskop Sedimentace Ne Při ultracentrifugaci Ano Difuze Rychlá Pomalá Nemá význam Kolig. vlastnosti Významné Málo významné Nevýznamné Transparentnost Ano Ne (opalescence) Ne (zákal) Příklady Roztoky Roztok škrobu, Emulze (mléko), rozpustných krevní sérum, suspenze (krev) nízkomolekulárních roztok mýdla látek 10
11 Pravé roztoky vznikají samovolným rozpouštěním jedné látky v druhé schopnost látek rozpouštět se v daném rozpouštědle - rozpustnost g/l rozpustnost závisí na chemické povaze rozpouštěné látky a rozpouštědla, na teplotě a u plynů též na tlaku při rozpouštění se uplatňují nevazebné interakce Similia Similibus Solvuntur nejčastějším rozpouštědlem je voda je polární polární rozpouštědla jsou také methanol, ethanol organická rozpouštědla: např. hexan, benzen, diethylether, tetrachlormethan - jsou nepolární 11
12 Koncentrace roztoků viz znalosti ze střední školy, opakování: seminář z Lékařské chemie č.1 a Praktické cvičení č.1 12
13 Molarita x Molalita n c = V Molární koncentrace (molarita) - V rozt mol/l V rozt = objem roztoku n = počet molů (látkové množství) 13
14 Molální koncentrace (molalita) -c m n c = m mol/kg m m rozp m rozp = hmotnost rozpouštědla Hodnota molality nezávisí na teplotě a udává konstantní poměr mezi počtem molekul solutu a rozpouštědla (popisuje reálné vlastnosti roztoku) 14
15 Proč tedy více používáme molaritu? Protože zjištění molarity je snadnější: zjišťujeme navážku (přepočtenou na počet molů) v objemu roztoku (objem roztoku snadno změříme) U zředěných vodných roztoků, kdy hustota roztoku se blíží 1 kg.dm -3, je rozdíl mezi molalitou a molaritou zanedbatelný. 15
16 Jak připravíme roztok NaOH o koncentraci (M r /NaOH/=40)? c = 1 mol/l c m = 1 mol/kg 16
17 opakování Chování nízkomolekulárních látek při rozpouštění v polárním rozpouštědle (voda) rozpouštějí se rozpouštějí se a štěpí se na ionty neelektrolyty štěpí se částečně slabé elektrolyty štěpí se úplně silné elektrolyty 17
18 Koligativní vlastnosti roztoků vlastnosti závislé pouze na koncentraci (počtu) částic solutu, nikoliv na jeho kvalitě (nejsou závislé na velikosti molekul, jejich tvaru nebo náboji) Koligativní vlastnosti: snížení tlaku par rozpouštědla nad roztokem (kryoskopie, ebulioskopie, viz biofyzika) osmotický tlak 18
19 Osmotický tlak roztoku osmóza Π Polopropustná membrána - propouští jen molekuly rozpouštědla 19
20 měření (osmometry) výpočet Zjištění osmotického tlaku Osmometry měření osmotického tlaku Principy měření: snížení bodu tuhnutí (citlivé teploměry s rozlišitelností 0,001 o C)* zvýšení teploty varu (snížení rosného bodu)* membránové (přímé) * Zjišťuje se molalita, převádí se na hodnotu osmotického tlaku Viz též: Dastych M.: Instrumentální technika, Brno
21 Výpočet osmotického tlaku (přibližný výpočet, známe-li látkovou koncentraci roztoku) Π = i. c. R.T. (kpa) c - koncentrace mol.l -1 R - universální plynová konstanta 8,314 J.mol -1.K -1 T - teplota (K) 21
22 Jaký význam má i Osmotický tlak závisí na počtu částic Neelektrolyty i = 1 Silné elektrolyty: n=2,3,. Slabé elektrolyty i = 1 + αc(n 1) i - koeficient, udávající počet částic vzniklých disociací elektrolytů α stupeň disociace N- počet iontů vzniklých disociací jedné molekuly 22
23 Hodnoty i pro neelektrolyty Glukosa, ethanol, urea,. i=1 Hodnoty i pro silné elektrolyty NaCl Na + + Cl - i = 2 Na 2 SO 4 2 Na + + SO 4 2- i = 3 MgCl 2 Mg Cl - i = 3 Na 3 PO 4 3 Na + + PO 3-4 i = 4 23
24 Koncentrace osmoticky aktivních částic Π = i. c. R.T. (kpa) Osmolalita (osmolální koncentrace) Osmolarita (osmolární koncentrace) i. c.mol/kg rozpouštědla i.c..mol/l zjistí se měřením (kryoskopicky, ebulioskopicky) vypočítá se z hodnot molárních koncentrací Vždy vyšší než odpovídá reálným vlastnostem roztoku 24
25 Příklad 1: Jaký osmotický tlak vykazuje fyziologický roztok chloridu sodného? (T = 298 K ) c(nacl) = 0,154 mol.l -1 NaCl Na + + Cl - silný elektrolyt i = 2 Osmolarita : i.c = 2 x 0,154 = 0,308 mol/l Osmotický tlak π = 2. 0,154. 8, = 762,7 kpa!!!dosazujeme li koncentraci v mol/l a teplotu v kelvinech, výsledek je vyčíslen v kpa!!! 25
26 Příklad 2: Jaký osmotický tlak vykazuje roztok glukosy o koncentraci 0,154 mol/l? (T = 25 0 C ) glukosa je neelektrolyt i = 1 osmolarita odpovídá molární koncentraci π = 1. 0,154. 8, = 381,4 kpa Roztok glukosy má poloviční osmotický tlak než roztok NaCl o stejné koncentraci. 26
27 Shrnutí sloučenina Glukóza NaCl (neelektrolyt) (elektrolyt) Koncentrace 0,1 0,1 (mol/l) Hodnota i i=1 i=2 Osmolarita i.c = 1. 0,1=0,1 i. c = 2. 0,1 =0,2 (mol/l) Osmotický tlak 247,6 495,2 27 NaCl se stejnou koncentrací má dvojnásobnou hodnotu osmotického tlaku
28 Osmotický tlak v roztoku obsahujícím více látek Π = R.T Σ i. c Σ i. c -suma koncentrací všech osmoticky aktivních částic 28
29 Osmotický tlak v živých organismech Osmóza je významná pro řízení rozložení vody v organismech. 29
30 Osmotický tlak krevní plazmy - přísná regulace (Π 795 kpa) (aldosteron, vasopresin, ANP) Osmolalita krevní plazmy mmol.kg -1 Závisí především na koncentraci Na + a hlavních neelektrolytů. Je regulována příjmem vody na základě pocitu žízně a výdejem vody v ledvinách regulovaným hormonem adiuretinem Nízká osmolalita (až 230 mmol/kg): nedostatek sodíku nebo příliš mnoho vody Vysoká osmolalita (až 400 mmol/kg): hypernatremie, hyperglykemie, uremie, přítomnost cizích molekul. Hyperosmolalita může způsobit koma (hyperosmolární koma) 30
31 Žízeň Pocit žízně vzniká při osmolalitě plazmy kolem 290 mmol/kg. Zvýšená osmolalita je zaregistrována osmoreceptory v hypothalamu, které vyvolají pocit žízně ADH adiuretin (antidiuretický hormon) ADH je uvolňován z neurohypofýzy při zvýšení osmolality plazmy Působí v ledvinách a zvyšuje resorpci vody ADH 31 resorpce
32 Osmolalita a tonicita Osmolalita je vlastnost určitého roztoku a je nezávislá na membráně. Tonicita (efektivní osmolalita) je vlastnost roztoku ve vztahu k membráně. Roztoky se stejnou osmolalitou oddělené membránou mají stejný osmotický tlak (jsou izotonické) pokud osmoticky účinné látky membránou neprocházejí (membrána se chová jako semipermeabilní). Biologické membrány však nejsou ideálně semipermeabilní, některé látky mohou membránou procházet 32
33 Tonicita (efektivní osmolalita) Vztahuje se pouze ke koncentraci látek, které nemohou volně přecházet přes buněčnou membránu (především iontů) a jsou distribuovány pouze v některém z prostorů Neodpovídá osmolalitě měřené v dané tekutině Typickou látkou snadno difundující přes membrány je močovina Plazma IST ICT urea glc Na + proteiny Močovina se tedy nepodílí na efektivní osmolalitě 33
34 Co se stane, když se zvýší hladina močoviny v plazmě? Co se stane, když se zvýší koncentrace glukosy v plazmě? 34
35 Vzájemný vztah dvou roztoků (ve vztahu k plně semipermeabilní membráně*) Roztoky izotonické = mají stejný osmotický tlak Hypotonický roztok má nižší osmotický tlak ve srovnání s jiným roztokem Hypertonický roztok má vyšší osmotický tlak V lékařství se pod pojmem izotonický rozumí roztok, který má stejný osmotický tlak jako plazma. Mezi roztoky s rozdílnými osmotickými tlaky oddělenými semipermeabilní membránou dochází k přesunům vody *Dle konvence se obvykle předpokládá, že membrána je semipermeabilní 35
36 Erytrocyty a isotonické roztoky Krevní plazma a cytosol erytrocytů (i všech dalších buněk) jsou izotonické Roztoky pro i.v. injekce musí být izotonické s krevní plazmou. Roztoky izotonické s krevní plazmou: 155 mmol/l NaCl ( fyziologický roztok, 0,9% roztok) 310 mmol/l glukosa (cca 5% roztok G5) 36
37 Erytrocyt v roztocích NaCl o různé koncentraci Isotonický roztok Osmotická rezistence erytrocytů=odolnost erytrocytů vůči hypotonickým roztokům - stanovuje se v hematologii, součást vyšetření hemolytických anemií 37
38 Př.:Hypernatrémie (zvýšená hladina Na + v plazmě) Hypernatrémie S osm = ECT osm > ICT osm Na + Na + Na+ Na + Na + Na + Na + Na + Na + Na + Na + Na + Na + Na+ Na + Na + 2 H 2O Buňka CNS při kontaktu s hyperosmolální ECT má tendenci ztrácet vodu, smršťovat se. Plazma ECT ICT Přesuny vody mezi extracelulární tekutinou a buňkou vyvolávají poruchy buněk (zejména CNS) 38
39 Zjištění osmolality krevní plazmy Osmolalita plazmy (mmol.kg -1 ) - výpočet 2 [Na + ] + [glukosa] + [močovina] 1,86 [Na + ] + [glukosa] + [močovina] + 9 Osmolalita plazmy (mmol.kg -1 ) -měření osmometry rozdíl mezi naměřenou a vypočtenou hodnotou (osmolární gap) může být vyvolán přítomností dalšího neelektrolytu ve vysoké koncentraci (ethanol, aceton, ethylenglykol...) Ethanol zvyšuje osmolalitu plazmy přibližně o 23 mmol/kg na každé promile 39
40 Bílkoviny v krevní plazmě koloidně osmotický tlak = onkotický tlak ( 0,5% z celkového tlaku plazmy, cca 2 mmo/l) podílí se hlavně albumin při poklesu koncentrace bílkovin v krvi dochází k přesunům vody z plazmy do intersticia (edémy) 40
41 Význam onkotického tlaku Kapilární stěna je propustná pro malé molekuly vody, ale není propustná pro proteiny. Hydrostatický tlak krve v kapilárách vytlačuje vodu s živinami do periferních tkání Onkotický tlak v kapilárách (bílkoviny) umožňuje nasávání vody zpět. Při poklesu koncentrace bílkovin v krvi dochází k přesunům vody z plazmy do intersticia (edémy) Buňky cévního endotelu Krevní kapilára 41
42 Osmotický gradient Osmotický tlak je velmi významný pro pohyby vody v organismu. Voda vždy samovolně přechází do prostoru s vyšší osmolalitou Např. sodné ionty jsou transportovány z lumen tenkého střeva přes epiteliální buňky do krve. Tím se zvyšuje osmotický tlak nejprve v epitelových buňkách a po té v plazmě. To vyvolává osmotický gradient, který táhne vodu ve stejném směru. 42
43 Polyurie při diabetes mellitus Při vysoké hladině glukosy v krvi se glukosa v ledvinách nestačí resorbovat. Její koncentrace v moči vzrůstá, současně osmoticky poutá vodu nastává polyurie. Terapie mannitolem Působí jako osmotické diuretikum (po intravenózním podání se filtruje v ledvinách, nevstřebává se a osmoticky poutá vodu) terapie při edému mozku, snížování nitroočního tlaku, podpora eliminace toxických látek Pohyb vody Roztok Mannitolum (g) Aqua pro Teoretická osmolarita % injectione ad (ml) mmol/l
44 Struktura chrupavky Vysoký obsah glykosaminoglykanů (obsahují početné skupiny uronových kyselin, kys. sírové), vysoký obsah iontů Na +, Mg 2+, Ca 2+ Ionty vážou velké množství extracelulární vody vysoký osmotický tlak Při zatížení částečné vytlačení vody z chrupavky (tlak z vnějšku) Uvolnění zátěže návrat vody (osmóza) Na + Mg
45 Změna chrupavky po zátěži zátěž 45
46 Tekuté koloidně disperzní soustavy Hydrofobní koloidy Hydrofilní koloidy Koloidní roztoky síry, zlata, platiny... Micelární koloidy Molekulární koloidy Roztoky mýdla, saponátu Roztoky bílkovin, polysacharidů, synt.polymerů (sérum, hlen, lymfa) 46
47 Terminologie Lyofilní částice = částice schopné obklopovat se rozpouštědlem Je-li rozpouštědlem voda Hydrofilní částice Lyofobní částice = částice odpuzující rozpouštědlo, nemající afinitu k rozpouštědlu Je-li rozpouštědlem voda Hydrofobní částice 47
48 Vlastnosti roztoků hydrofilních koloidních částic Velikost částic nm Viditelné v elektronovém mikroskopu Nesedimentují Difuze pomalá Roztoky opaleskují Koligativní vlastnosti slabé 48
49 Roztoky hydrofilních makromolekul Proč jsou některé bílkoviny rozpustné ve vodě? (např. bílkoviny krevní plazmy) Proč se škrob částečně rozpouští ve vodě? Proč jsou ve vodě rozpustné nukleové kyseliny? 49
50 Rozpouštění hydrofilních makromolekul (např. bílkovin) Cl Na + Cl bílkovina Ve vodě se rozpouští jen ty makromolekuly, které mají dostatek polárních skupin ve své struktuře (srovnej rozpustnost fibroinu a albuminu) Cl Molekuly vody Na + interakce polárních částí s rozpouštědlem (vodou) umožňuje rozpouštění nepolární (hydrofobní úseky) jsou skryty uvnitř Nabité skupiny v makromolekule 50
51 Při interakci polárního rozpouštědla a makromolekuly se uplatňují nevazebné interakce dipól-ion H O H ion-ion Cl - δ - H N H + O - H H + H N H H O Na + O- C O ion-ion H dipól-ion δ + C O O-H O H H vodíkové můstky 51
52 Cl bílkovina anion soli, např. Cl - kation soli, např. Na + Vliv iontů soli na rozpouštění makromolekuly Ve vodě mohou být obsaženy i soli ovlivňují rozpustnost interakcí s polárními skupinami makromolekuly Makromolekula se obaluje molekulami rozpouštědla a přítomnými ionty soli - vzniká elektrická dvojvrstva 52
53 Nízká koncentrace soli - vsolování (rozpustnost je usnadněna) animace Cl - Na NH OOC Interakce mezi ionty soli a ionty makromolekuly podporuje rozpouštění 53
54 Vysoká koncentrace soli - vysolování (rozpustnost je snížena) Na Na Na + Nabité a polární skupiny makromolekuly interagují mezi sebou Interakce mezi ionty soli a vodou snižuje solvataci makromolekuly a destabilizuje roztok 54
55 Vliv koncentrace soli vsolování a vysolování Vsolování rozpustnost Vysolování 55 Koncentrace soli
56 Vysolování bílkovin = srážení bílkovin koncentrovanými roztoky solí Jedna ze separačních metod Proteiny se liší aminokyselinovým složením a proto různé proteiny se sráží při různé koncentraci soli Používá se např. síran amonný, síran sodný Srážení bílkovin lze provádět i přídavkem ethanolu, acetonu a jiných org. rozpouštědel působí rovněž dehydratačně 56
57 Stabilita koloidních roztoků makromolekul Shrnutí: je podmíněna nábojem a hydratačním obalem vliv koncentrace a náboje soli (iontová síla) ovlivnění náboje i hydratace vliv ph ovlivnění náboje (disociace postranních řetězců) vliv snadno hydratujících se látek (org. rozp.) ovlivnění hydratace (odnímání vody) koncentrace koloidu - koncentrovanější roztoky jsou méně stabilní 57
58 Micelární koloidní roztoky Proč je roztok mýdla zakalený a odstraňuje špínu? Jak fungují saponáty? Jak funguje bublifuk? 58
59 Micelární koloidní roztoky roztoky nízkomolekulárních látek s difilním (polárně-nepolárním) charakterem Polární část molekuly Hydrofobní část molekuly Tyto látky mají schopnost měnit povrchové napětí kapalin nazývají se proto také povrchově aktivní látky neboli tenzidy 59
60 Bez náboje- neiontový tenzid Záporný náboj - aniontový tenzid mýdla, saponáty Kladný náboj - kationtový tenzid kvartérní amoniové soli s jedním dlouhým uhlíkatým řetězcem Typy tenzidů (dle charakteru polární části molekuly) Kladný i záporný náboj - amfoterní tenzid fosfatidylcholin fosfatidylserin polyethylenglykol Triton 60
61 Chování tenzidů v roztoku Při nízké koncentraci se adsorbují na povrchu polární kapaliny (rozhraní fází) Snižují povrchové napětí Jak se bude chovat tenzid v nepolární kapalině? 61
62 Při větší koncentraci - tvorba micel Micelární koloidní roztok 62
63 Aniontové tenzidy Mýdlo je typickým aniontovým tenzidem. Vyrábí se alkalickou hydrolýzou tuků (zmýdelnění). nepolární řetězec natrium-stearát (sodium stearate) O C O Na polární konec Mýdlo není ester, je to sůl vyšší mastné kyseliny 63
64 Mýdlo se vyrábí z podřadných tuků tallow (směs TAG) NaOH sodium tallowate (směs Na-solí MK obsažených v loji) Anglicko-český minislovníček sodium = sodík (Na), sodný (Na + ) tallow = hovězí lůj lard = vepřové sádlo coco = coconut = kokos, kokosový tuk palm = palma; kernel = jádro (ořechů aj.) palm kernel = palmový jádrový tuk 64
65 Co je v mýdle? Tenzidy sodium tallowate sodium palm kernelate sodium lardate sodium cocoate a podobné Pomocné látky NaCl (zahušťovadlo) TiO 2 (inertní plnidlo) glycerol (zvlhčovadlo) olej, parafin (změkčovadlo) EDTA (váže Ca 2+, okyseluje) parfémy, barviva (CI) a další 65
66 Jak působí mýdlo? Micely mýdla mají hydrofilní povrch, který je v kontaktu s vodou a uvnitř mají hydrofobní řetězec, který má afinitu k mastné nečistotě. Mastná nečistota se zabudovává do micel a tím se rozpouští = solubilizační efekt tenzidu 66
67 Další aniontové tenzidy O alkyl-sulfát sodný O S O O Na O alkansulfonát sodný O S O Na Jsou součástí saponátů 67
68 Příklady použití aniontových tenzidů Tenzid Dodecylbenzensulfonát Triethanolaminbenzensulfonát Laurylsulfát sodný Laurylsulfát lithný Laurylethersulfát sodný Diethanolamin cetylfosfát Aplikace Prostředky na mytí nádobí Autošampóny Šampony, zubní pasty Pěny na koberce Pěna do koupele Kosmetické emulgátory 68
69 Kationtové tenzidy Tetraalkylamonné soli s jedním nebo dvěma výrazně dlouhými alkyly X - R2 R 1 + N R3 R 1 N + Cl - R 2 Užití: antiseptika, dezinfekční prostředky (Septonex, Ajatin) Součást aviváží 69
70 Jak působí vlasový kondicionér? Zvlhčené bílkoviny vlasu (keratin) mají na svém povrchu záporný náboj Tenzid se naváže na povrch vlasu svým kladným nábojem Hydrofobní část tenzidu vytvoří povrchový obal vlasu Vlas se stává na povrchu hydrofobní mizí vliv statické elektřiny, vlas je hebký, měkký vlas kationtový tenzid 70
71 Antibakteriální účinek kationtových tenzidů Bílkoviny buněčné membrány mají obvykle záporný náboj. Kationtový tenzid se váže na tyto bílkoviny a narušuje jejich funkci. Různé tenzidy působí na různé typy bakterií, v závislosti na skupinách navázaných na kvartérní dusík. Obecně však současně dochází i k poškození jiných biologických systémů (kůže, ) 71
72 Příklady použití kationtových tenzidů Tenzid Distearyldimethyl amonium chlorid Lauryltrimethylamonium chlorid Cetyltrimethylamonium chlorid Alkyltrimethylamonium methosulfát Dodecyldimethylamonium chlorid Aplikace Průmyslové změkčovadlo Šampony Antibakteriální účinek Vlasový kondicionér Fungicid 72
73 Přirozené tenzidy Fosfolipidy O C O CH2 Fosfatidylcholin C O O CH O CH2 O P O CH3 O CH2CH2 N CH3 CH 3 Fosfolipidové dvojvrstvy 73
74 Liposomy Uměle připravené uzavřené váčky tvořené lipidovou dvojvrstvou a izolovaným vnitřním kompartmentem obsahujícím vodný roztok. Vznikají např. působením ultrazvuku na vodnou suspensi vhodných polárních lipidů Transport léčiv nebo nukleových kyselin. Do buněk pronikají endocytosou. Obrázek převzatý z: 74
75 Obecná struktura lipoproteinu Apoproteiny Fosfolipidy Triacylglyceroly Apoproteiny Estery cholesterolu Cholesterol neesterifikovaný jádro obal 75
76 Přirozené tenzidy Žlučové kyseliny OH HO OH COO - Kyselina cholová Trávení lipidů v tenkém střevě 76
77 Proč má žlučová kyselina charakter tenzidu? Prostorové uspořádaní nepolární tetracyklický skelet polární skupiny ( OH a COO ) 77
78 Účinek tenzidů solubilizační emulgační <500 nm >500 nm Do nitra micely se zabuduje omezené množství nepolární fáze roztok zůstává koloidní (částice do 500 nm) Stabilizace kapének v emulzi roztok má charakter hrubé disperze 78
79 Hrubé disperze Suspenze nerozpustné částice v kapalném prostředí (krev, lékové formy... Emulze dvě nemísitelné kapaliny Ochranné koloidy - stabilizují suspenze o/v v/o olej ve vodě voda v oleji Emulgátory - stabilizují emulze 79
80 Příklady emulzí Emulze/Typ Polární fáze Nepolární fáze Emulgátor Mléko o/v voda (90 %) mléčný tuk (3 %) kasein, fosfolipidy Máslo v/o voda (20 %) mléčný tuk (80 %) kasein, fosfolipidy Margariny v/o voda (~20 %) rostl. olej (~80%) diacylglyceroly Krémy o/v voda tekutý parafin cetylalkohol aj. Masti v/o voda parafin lanolin aj. 80
81 Pasty Koncentrované formy suspenze (>25% suspendované tuhé látky) Polotuhá konzistence Použití: zubní pasty, místně aplikované lékové formy 81
Micelární koloidní roztoky. Proč je roztok mýdla zakalený a odstraňuje špínu? Jak fungují saponáty? Jak funguje bublifuk?
 Micelární koloidní roztoky Proč je roztok mýdla zakalený a odstraňuje špínu? Jak fungují saponáty? Jak funguje bublifuk? 1 Micelární koloidní roztoky roztoky nízkomolekulárních látek s difilním (polárně-nepolárním)
Micelární koloidní roztoky Proč je roztok mýdla zakalený a odstraňuje špínu? Jak fungují saponáty? Jak funguje bublifuk? 1 Micelární koloidní roztoky roztoky nízkomolekulárních látek s difilním (polárně-nepolárním)
školy, viz též praktická cvičení) Tlumivé roztoky (pufry)
 Roztoky elektrolytů Acidobazické reakce II Biochemický ústav LF MU (E.T.) 2008 1 OBSAH PŘEDNÁŠKY 1.část: Hydrolýza solí (opak. ze střední školy, viz též praktická cvičení) Tlumivé roztoky (pufry) 2 Hydrolýza
Roztoky elektrolytů Acidobazické reakce II Biochemický ústav LF MU (E.T.) 2008 1 OBSAH PŘEDNÁŠKY 1.část: Hydrolýza solí (opak. ze střední školy, viz též praktická cvičení) Tlumivé roztoky (pufry) 2 Hydrolýza
Rozpustnost Rozpustnost neelektrolytů
 Rozpustnost Podobné se rozpouští v podobném látky jejichž molekuly na sebe působí podobnými mezimolekulárními silami budou pravděpodobně navzájem rozpustné. Př.: nepolární látky jsou rozpustné v nepolárních
Rozpustnost Podobné se rozpouští v podobném látky jejichž molekuly na sebe působí podobnými mezimolekulárními silami budou pravděpodobně navzájem rozpustné. Př.: nepolární látky jsou rozpustné v nepolárních
2 Roztoky elektrolytů. Osmotický tlak
 Roztoky elektrolytů. Osmotický tlak 1. Doplněním uvedených schémat vyjádřete rozdílné chování různých typů látek po jejich rozpuštění ve vodě. Použijte symboly AB(aq), A + (aq), B - (aq). [s pevná fáze,
Roztoky elektrolytů. Osmotický tlak 1. Doplněním uvedených schémat vyjádřete rozdílné chování různých typů látek po jejich rozpuštění ve vodě. Použijte symboly AB(aq), A + (aq), B - (aq). [s pevná fáze,
Roztoky - druhy roztoků
 Roztoky - druhy roztoků Roztok = homogenní směs molekul, které mohou být v pevném (s), kapalném (l) nebo plynném (g) stavu Složka 1 Složka 2 Stav směsi Příklad G G G Vzduch G L L Sodová voda (CO 2 ) G
Roztoky - druhy roztoků Roztok = homogenní směs molekul, které mohou být v pevném (s), kapalném (l) nebo plynném (g) stavu Složka 1 Složka 2 Stav směsi Příklad G G G Vzduch G L L Sodová voda (CO 2 ) G
Roztok. Homogenní směs molekul, které mohou být v pevném, kapalném nebo plynném stavu. Pravé roztoky
 Roztok Homogenní směs molekul, které mohou být v pevném, kapalném nebo plynném stavu Pravé roztoky Micelární a koloidní roztoky (suspenze): částice velké 1 nm 10 µm Tyndallův jev rozptyl světla 1 Druhy
Roztok Homogenní směs molekul, které mohou být v pevném, kapalném nebo plynném stavu Pravé roztoky Micelární a koloidní roztoky (suspenze): částice velké 1 nm 10 µm Tyndallův jev rozptyl světla 1 Druhy
Směsi, roztoky. Disperzní soustavy, roztoky, koncentrace
 Směsi, roztoky Disperzní soustavy, roztoky, koncentrace 1 Směsi Směs je soustava, která obsahuje dvě nebo více chemických látek. Mezi složkami směsi nedochází k chemickým reakcím. Fyzikální vlastnosti
Směsi, roztoky Disperzní soustavy, roztoky, koncentrace 1 Směsi Směs je soustava, která obsahuje dvě nebo více chemických látek. Mezi složkami směsi nedochází k chemickým reakcím. Fyzikální vlastnosti
Roztok. Homogenní směs molekul, které mohou být v pevném, kapalném nebo plynném stavu. Pravé roztoky
 Roztok Homogenní směs molekul, které mohou být v pevném, kapalném nebo plynném stavu Pravé roztoky Micelární a koloidní roztoky (suspenze): částice velké 1 nm 10 µm Tyndallův jev 1 Druhy roztoků Složka
Roztok Homogenní směs molekul, které mohou být v pevném, kapalném nebo plynném stavu Pravé roztoky Micelární a koloidní roztoky (suspenze): částice velké 1 nm 10 µm Tyndallův jev 1 Druhy roztoků Složka
Roztok. Homogenní směs molekul, které mohou být v pevném, kapalném nebo plynném stavu
 Roztok Homogenní směs molekul, které mohou být v pevném, kapalném nebo plynném stavu Pravé roztoky Micelární a koloidní roztoky (suspenze): částice 1 nm 10 μm Micela Tyndallův jev rozptyl světla 1 Druhy
Roztok Homogenní směs molekul, které mohou být v pevném, kapalném nebo plynném stavu Pravé roztoky Micelární a koloidní roztoky (suspenze): částice 1 nm 10 μm Micela Tyndallův jev rozptyl světla 1 Druhy
Jana Fauknerová Matějčková
 Jana Fauknerová Matějčková vyjadřování koncentrace molarita procentuální koncentrace osmolarita, osmotický tlak ředění roztoků převody jednotek předpona označení řád giga- G 10 9 mega- M 10 6 kilo- k 10
Jana Fauknerová Matějčková vyjadřování koncentrace molarita procentuální koncentrace osmolarita, osmotický tlak ředění roztoků převody jednotek předpona označení řád giga- G 10 9 mega- M 10 6 kilo- k 10
Chemické výpočty I. Vladimíra Kvasnicová
 Chemické výpočty I Vladimíra Kvasnicová 1) Vyjadřování koncentrace molarita procentuální koncentrace převod jednotek 2) Osmotický tlak, osmolarita Základní pojmy koncentrace = množství rozpuštěné látky
Chemické výpočty I Vladimíra Kvasnicová 1) Vyjadřování koncentrace molarita procentuální koncentrace převod jednotek 2) Osmotický tlak, osmolarita Základní pojmy koncentrace = množství rozpuštěné látky
Prezentace navazuje na základní znalosti z biochemie (lipidy, proteiny, sacharidy) Dynamický fluidní model membrány 2008/11
 RNDr. Ivana Fellnerová, Ph.D. Katedra zoologie PřF UP Olomouc Prezentace navazuje na základní znalosti z biochemie (lipidy, proteiny, sacharidy) Rozšiřuje přednášky: Stavba cytoplazmatické membrány Membránový
RNDr. Ivana Fellnerová, Ph.D. Katedra zoologie PřF UP Olomouc Prezentace navazuje na základní znalosti z biochemie (lipidy, proteiny, sacharidy) Rozšiřuje přednášky: Stavba cytoplazmatické membrány Membránový
OSMOMETRIE. Jana Gottwaldová FN Brno
 OSMOMETRIE Jana Gottwaldová FN Brno OSMOMETRIE Princip analytická metoda k měření koncentrace částic v roztoku. využívá změn, které způsobí částice rozpuštěné v rozpouštědle tzv. koligativních vlastností
OSMOMETRIE Jana Gottwaldová FN Brno OSMOMETRIE Princip analytická metoda k měření koncentrace částic v roztoku. využívá změn, které způsobí částice rozpuštěné v rozpouštědle tzv. koligativních vlastností
Disperzní soustavy. Pravé roztoky (analytické disperze) Látková koncentrace (molarita) Molalita. Rozdělení disperzních soustav
 Rozdělení disperzních soustav Disperzní soustavy částice jedné nebo více látek rovnoěrně rozptýlené (dispergované) ve forě alých částeček v dispergující fázi podle počtu fází podle skupenského stavu jednofázové
Rozdělení disperzních soustav Disperzní soustavy částice jedné nebo více látek rovnoěrně rozptýlené (dispergované) ve forě alých částeček v dispergující fázi podle počtu fází podle skupenského stavu jednofázové
Ilya Prigogine * 1917
 Přednášky z lékařské biofyziky pro obor: Nutriční terapeut Ilya Prigogine * 1917 Aplikace termodynamiky Příklady termodynamického přístupu k řešení problémů: Rovnovážná termodynamika: Osmóza a osmotický
Přednášky z lékařské biofyziky pro obor: Nutriční terapeut Ilya Prigogine * 1917 Aplikace termodynamiky Příklady termodynamického přístupu k řešení problémů: Rovnovážná termodynamika: Osmóza a osmotický
Třídění látek. Chemie 1.KŠPA
 Třídění látek Chemie 1.KŠPA Systém (soustava) Vymezím si kus prostoru, látky v něm obsažené nazýváme systém soustava okolí svět Stěny soustavy Soustava může být: Izolovaná = stěny nedovolí výměnu částic
Třídění látek Chemie 1.KŠPA Systém (soustava) Vymezím si kus prostoru, látky v něm obsažené nazýváme systém soustava okolí svět Stěny soustavy Soustava může být: Izolovaná = stěny nedovolí výměnu částic
(III.) Sedimentace červených krvinek. červených krvinek. (IV.) Stanovení osmotické rezistence. Fyziologie I - cvičení
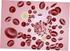 (III.) Sedimentace červených krvinek (IV.) Stanovení osmotické rezistence červených krvinek Fyziologie I cvičení Fyziologický ústav LF MU, 2015 Michal Hendrych, Tibor Stračina Sedimentace erytrocytů fyzikální
(III.) Sedimentace červených krvinek (IV.) Stanovení osmotické rezistence červených krvinek Fyziologie I cvičení Fyziologický ústav LF MU, 2015 Michal Hendrych, Tibor Stračina Sedimentace erytrocytů fyzikální
RNDr. Ivana Fellnerová, Ph.D. Katedra zoologie PřF UP Olomouc 2008/11. *Ivana FELLNEROVÁ, PřF UP Olomouc*
 RNDr. Ivana Fellnerová, Ph.D. Katedra zoologie PřF UP Olomouc 2008/11 Prezentace navazuje na základní znalosti z biochemie (lipidy, proteiny, sacharidy) Rozšiřuje přednášky: Stavba cytoplazmatické membrány
RNDr. Ivana Fellnerová, Ph.D. Katedra zoologie PřF UP Olomouc 2008/11 Prezentace navazuje na základní znalosti z biochemie (lipidy, proteiny, sacharidy) Rozšiřuje přednášky: Stavba cytoplazmatické membrány
FUNKČNÍ ANATOMIE. Mikrocirkulace označuje oběh krve v nejmenších cévách lidského těla arteriolách, kapilárách a venulách.
 MIKROCIR ROCIRKULACE FUNKČNÍ ANATOMIE Mikrocirkulace označuje oběh krve v nejmenších cévách lidského těla arteriolách, kapilárách a venulách. (20-50 µm) (>50 µm) (4-9 µm) Hlavní funkcí mikrocirkulace je
MIKROCIR ROCIRKULACE FUNKČNÍ ANATOMIE Mikrocirkulace označuje oběh krve v nejmenších cévách lidského těla arteriolách, kapilárách a venulách. (20-50 µm) (>50 µm) (4-9 µm) Hlavní funkcí mikrocirkulace je
Chemické výpočty I (koncentrace, ředění)
 Chemické výpočty I (koncentrace, ředění) Pavla Balínová Předpony vyjadřující řád jednotek giga- G 10 9 mega- M 10 6 kilo- k 10 3 deci- d 10-1 centi- c 10-2 mili- m 10-3 mikro- μ 10-6 nano- n 10-9 piko-
Chemické výpočty I (koncentrace, ředění) Pavla Balínová Předpony vyjadřující řád jednotek giga- G 10 9 mega- M 10 6 kilo- k 10 3 deci- d 10-1 centi- c 10-2 mili- m 10-3 mikro- μ 10-6 nano- n 10-9 piko-
Acidobazické děje - maturitní otázka z chemie
 Otázka: Acidobazické děje Předmět: Chemie Přidal(a): Žaneta Teorie kyselin a zásad: Arrhemiova teorie (1887) Kyseliny jsou látky, které odštěpují ve vodném roztoku proton vodíku H+ HA -> H+ + A- Zásady
Otázka: Acidobazické děje Předmět: Chemie Přidal(a): Žaneta Teorie kyselin a zásad: Arrhemiova teorie (1887) Kyseliny jsou látky, které odštěpují ve vodném roztoku proton vodíku H+ HA -> H+ + A- Zásady
Biofyzikální chemie interakce bílkovin s ligandy, koloidy v biochemii, rovnováha na membránách. Zita Purkrtová říjen - prosinec 2015
 Biofyzikální chemie interakce bílkovin s ligandy, koloidy v biochemii, rovnováha na membránách Zita Purkrtová říjen - prosinec 2015 energie [kj/mol] energie [kj/mol] Kodíček, M.; Karpenko, V.: Biofysikální
Biofyzikální chemie interakce bílkovin s ligandy, koloidy v biochemii, rovnováha na membránách Zita Purkrtová říjen - prosinec 2015 energie [kj/mol] energie [kj/mol] Kodíček, M.; Karpenko, V.: Biofysikální
1 Základní chemické výpočty. Koncentrace roztoků
 1 Základní chemické výpočty. Koncentrace roztoků Množství látky (Doplňte tabulku) Veličina Symbol Jednotka SI Jednotky v biochemii Veličina se zjišťuje Počet částic N. výpočtem Látkové množství n... Hmotnost
1 Základní chemické výpočty. Koncentrace roztoků Množství látky (Doplňte tabulku) Veličina Symbol Jednotka SI Jednotky v biochemii Veličina se zjišťuje Počet částic N. výpočtem Látkové množství n... Hmotnost
Biofyzikální chemie interakce bílkovin s ligandy, koloidy v biochemii, rovnováha na membránách. Zita Purkrtová březen duben 2012
 Biofyzikální chemie interakce bílkovin s ligandy, koloidy v biochemii, rovnováha na membránách Zita Purkrtová březen duben 2012 Interakce bílkovin s ligandy vratné interakce množství ligandu vázaného na
Biofyzikální chemie interakce bílkovin s ligandy, koloidy v biochemii, rovnováha na membránách Zita Purkrtová březen duben 2012 Interakce bílkovin s ligandy vratné interakce množství ligandu vázaného na
Chemie životního prostředí III Hydrosféra (03) Sedimenty
 Centre of Excellence Chemie životního prostředí III Hydrosféra (03) Sedimenty Ivan Holoubek RECETOX, Masaryk University, Brno, CR holoubek@recetox. recetox.muni.cz; http://recetox.muni muni.cz Koloidní
Centre of Excellence Chemie životního prostředí III Hydrosféra (03) Sedimenty Ivan Holoubek RECETOX, Masaryk University, Brno, CR holoubek@recetox. recetox.muni.cz; http://recetox.muni muni.cz Koloidní
OSMOMETRIE. Jana Gottwaldová FN Brno
 OSMOMETRIE Jana Gottwaldová FN Brno Osnova princip osmometrie koligativní vlastnosti látek, osmotický tlak osmolární koncentrace: osmolalita x osmolarita měření osmotického tlaku: kryoskopie, průběh měření
OSMOMETRIE Jana Gottwaldová FN Brno Osnova princip osmometrie koligativní vlastnosti látek, osmotický tlak osmolární koncentrace: osmolalita x osmolarita měření osmotického tlaku: kryoskopie, průběh měření
Anorganické látky v buňkách - seminář. Petr Tůma některé slidy převzaty od V. Kvasnicové
 Anorganické látky v buňkách - seminář Petr Tůma některé slidy převzaty od V. Kvasnicové Zastoupení prvků v přírodě anorganická hmota kyslík (O) 50% křemík (Si) 25% hliník (Al) 7% železo (Fe) 5% vápník
Anorganické látky v buňkách - seminář Petr Tůma některé slidy převzaty od V. Kvasnicové Zastoupení prvků v přírodě anorganická hmota kyslík (O) 50% křemík (Si) 25% hliník (Al) 7% železo (Fe) 5% vápník
Vnitřní rozdělení tělních tekutin
 Vnitřní prostředí Spolu s krevním oběhem, plícemi, ledvinami zajišťuje tkáním přísun kyslíku, živin a odsun katabolitů regulace osmolality,, iontového složení, acidobazické rovnováhy a teploty normální
Vnitřní prostředí Spolu s krevním oběhem, plícemi, ledvinami zajišťuje tkáním přísun kyslíku, živin a odsun katabolitů regulace osmolality,, iontového složení, acidobazické rovnováhy a teploty normální
Disperzní soustavy a jejich vlastnosti
 Disperzní soustavy a jejich vlastnosti Disperzní soustavy Dispergované ástice Disperzní prost edí Typy disperzních soustav Disperzní prost edí Tuhé Disperg. ástice Tuhé Kapalné Plynné Název soustavy Slitiny,
Disperzní soustavy a jejich vlastnosti Disperzní soustavy Dispergované ástice Disperzní prost edí Typy disperzních soustav Disperzní prost edí Tuhé Disperg. ástice Tuhé Kapalné Plynné Název soustavy Slitiny,
Vnitřní prostředí organismu. Procento vody v organismu
 Vnitřní prostředí organismu Procento vody v organismu 2 Vnitřní prostředí organismu Obsah vody v různých tkáních % VODY KREV 83% SVALY 76% KŮŽE 72% KOSTI 22% TUKY 10% ZUBNÍ SKLOVINA 2% 3 Vnitřní prostředí
Vnitřní prostředí organismu Procento vody v organismu 2 Vnitřní prostředí organismu Obsah vody v různých tkáních % VODY KREV 83% SVALY 76% KŮŽE 72% KOSTI 22% TUKY 10% ZUBNÍ SKLOVINA 2% 3 Vnitřní prostředí
Osmometrie. Doc. MUDr. Petr Schneiderka CSc. Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky
 Osmometrie Doc. MUDr. Petr Schneiderka CSc. Tvorba a ověření e-learningového prostředí pro integraci výuky preklinických a klinických předmětů na LF UP a FZV UP Reg. č.: CZ.1.07/2.2.00/15.0313 Úvod Udržování
Osmometrie Doc. MUDr. Petr Schneiderka CSc. Tvorba a ověření e-learningového prostředí pro integraci výuky preklinických a klinických předmětů na LF UP a FZV UP Reg. č.: CZ.1.07/2.2.00/15.0313 Úvod Udržování
LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 2. PLASMATICKÁ MEMBRÁNA
 LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 2. PLASMATICKÁ MEMBRÁNA TEORETICKÝ ÚVOD: Cytoplasmatická membrána je lipidová dvouvrstva o tloušťce asi 5 nm oddělující buňku od okolního prostředí. Nejvíce jsou v
LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 2. PLASMATICKÁ MEMBRÁNA TEORETICKÝ ÚVOD: Cytoplasmatická membrána je lipidová dvouvrstva o tloušťce asi 5 nm oddělující buňku od okolního prostředí. Nejvíce jsou v
BIOLOGICKÁ MEMBRÁNA Prokaryontní Eukaryontní KOMPARTMENTŮ
 BIOMEMRÁNA BIOLOGICKÁ MEMBRÁNA - všechny buňky na povrchu plazmatickou membránu - Prokaryontní buňky (viry, bakterie, sinice) - Eukaryontní buňky vnitřní členění do soustavy membrán KOMPARTMENTŮ - za
BIOMEMRÁNA BIOLOGICKÁ MEMBRÁNA - všechny buňky na povrchu plazmatickou membránu - Prokaryontní buňky (viry, bakterie, sinice) - Eukaryontní buňky vnitřní členění do soustavy membrán KOMPARTMENTŮ - za
5. Lipidy a biomembrány
 5. Lipidy a biomembrány Obtížnost A Co je chybného na často slýchaném konstatování: Biologická membrána je tvořena dvojvrstvou fosfolipidů.? Jmenujte alespoň tři skupiny látek, které se podílejí na výstavbě
5. Lipidy a biomembrány Obtížnost A Co je chybného na často slýchaném konstatování: Biologická membrána je tvořena dvojvrstvou fosfolipidů.? Jmenujte alespoň tři skupiny látek, které se podílejí na výstavbě
7. Tenzidy. Kationaktivní Neinogenní. Anionaktivní. Asymetrická molekula. odstranění nečistot Rozdělení podle iontového charakteru
 7. Tenzidy Tenzidy látky snižující povrchové napětí rozpouštědel usnadnění rozpouštění a odstranění nečistot Rozdělení podle iontového charakteru Anionaktivní Kationaktivní Neinogenní Detergenty čistící
7. Tenzidy Tenzidy látky snižující povrchové napětí rozpouštědel usnadnění rozpouštění a odstranění nečistot Rozdělení podle iontového charakteru Anionaktivní Kationaktivní Neinogenní Detergenty čistící
Roztoky - elektrolyty
 Roztoky - elektrolyty Roztoky - vodné roztoky prakticky vždy vedou elektrický proud Elektrolyty látky, které se štěpí disociují na elektricky nabité částice ionty Původně se předpokládalo, že k disociaci
Roztoky - elektrolyty Roztoky - vodné roztoky prakticky vždy vedou elektrický proud Elektrolyty látky, které se štěpí disociují na elektricky nabité částice ionty Původně se předpokládalo, že k disociaci
Chemické speciality. Chemické speciality přednáška I
 Chemické speciality 1. Povrchově aktivní látky 2. Organická barviva a pigmenty 3. Biologicky aktivní látky: léčiva, regulátory růstu rostlin, pesticidy 4. Vonné a chuťové látky 5. Přísady pro polymery
Chemické speciality 1. Povrchově aktivní látky 2. Organická barviva a pigmenty 3. Biologicky aktivní látky: léčiva, regulátory růstu rostlin, pesticidy 4. Vonné a chuťové látky 5. Přísady pro polymery
PŘEVODY JEDNOTEK. jednotky " 1. základní
 PŘEVODY JEDNOTEK jednotky 1. základní Fyzikální veličina Jednotka Značka Délka l metr m Hmotnost m kilogram kg Čas t sekunda s Termodynamická teplota T kelvin K Látkové množství n mol mol Elektrický proud
PŘEVODY JEDNOTEK jednotky 1. základní Fyzikální veličina Jednotka Značka Délka l metr m Hmotnost m kilogram kg Čas t sekunda s Termodynamická teplota T kelvin K Látkové množství n mol mol Elektrický proud
TUKY. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: 15. 3. 2013. Ročník: devátý
 TUKY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 15. 3. 2013 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci se seznámí s lipidy. V rámci tohoto
TUKY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 15. 3. 2013 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci se seznámí s lipidy. V rámci tohoto
Úvod do biochemie. Vypracoval: RNDr. Milan Zimpl, Ph.D.
 Úvod do biochemie Vypracoval: RNDr. Milan Zimpl, Ph.D. TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Co je to biochemie? Biochemie je chemií živých soustav.
Úvod do biochemie Vypracoval: RNDr. Milan Zimpl, Ph.D. TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Co je to biochemie? Biochemie je chemií živých soustav.
Produkce kyselin v metabolismu Těkavé: 15,000 mmol/den kyseliny uhličité, vyloučena plícemi jako CO 2 Netěkavé kyseliny (1 mmol/kg/den) jsou vyloučeny
 Vnitřní prostředí a acidobazická rovnováha 13.12.2004 Vnitřní prostředí Sestává z posuzování složení extracelulární tekutiny z hlediska izohydrie (= optimální koncentrace ph) izoionie (= optimální koncentrace
Vnitřní prostředí a acidobazická rovnováha 13.12.2004 Vnitřní prostředí Sestává z posuzování složení extracelulární tekutiny z hlediska izohydrie (= optimální koncentrace ph) izoionie (= optimální koncentrace
Funkční anatomie ledvin Clearance
 Funkční anatomie ledvin Clearance doc. MUDr. Markéta Bébarová, Ph.D. Fyziologický ústav Lékařská fakulta Masarykovy univerzity Tato prezentace obsahuje pouze stručný výtah nejdůležitějších pojmů a faktů.
Funkční anatomie ledvin Clearance doc. MUDr. Markéta Bébarová, Ph.D. Fyziologický ústav Lékařská fakulta Masarykovy univerzity Tato prezentace obsahuje pouze stručný výtah nejdůležitějších pojmů a faktů.
Sorpční charakteristiky půdy stanovení KVK podle Bowera, stanovení hydrolytické acidity, výpočet S,V
 Sorpční charakteristiky půdy stanovení KVK podle Bowera, stanovení hydrolytické acidity, výpočet S,V Sorpční vlastnosti půdy sorpce půdy schopnost půdy zadržovat ve svém sorpčním komplexu prvky a živiny,
Sorpční charakteristiky půdy stanovení KVK podle Bowera, stanovení hydrolytické acidity, výpočet S,V Sorpční vlastnosti půdy sorpce půdy schopnost půdy zadržovat ve svém sorpčním komplexu prvky a živiny,
Změny osmolality vnitřního prostředí vyšetřovací metody a interpretace
 Změny osmolality vnitřního prostředí vyšetřovací metody a interpretace Voda a elektrolyty jsou hlavními složkami vnitřního prostředí. Tělesná voda celková tělesná voda CTV je 50 70 % celkové tělesné hmotnosti
Změny osmolality vnitřního prostředí vyšetřovací metody a interpretace Voda a elektrolyty jsou hlavními složkami vnitřního prostředí. Tělesná voda celková tělesná voda CTV je 50 70 % celkové tělesné hmotnosti
Přednášky z lékařské biofyziky Masarykova univerzita v Brně - Biofyzikální ústav Lékařské fakulty. Ilya Prigogine Termodynamika a život
 Přednášky z lékařské biofyziky Masarykova univerzita v Brně - Biofyzikální ústav Lékařské fakulty Ilya Prigogine 1917-2003 Termodynamika a život Obsah přednášky Základní pojmy nerovnovážné termodynamiky
Přednášky z lékařské biofyziky Masarykova univerzita v Brně - Biofyzikální ústav Lékařské fakulty Ilya Prigogine 1917-2003 Termodynamika a život Obsah přednášky Základní pojmy nerovnovážné termodynamiky
Typy molekul, látek a jejich vazeb v organismech
 Typy molekul, látek a jejich vazeb v organismech Typy molekul, látek a jejich vazeb v organismech Organismy se skládají z molekul rozličných látek Jednotlivé látky si organismus vytváří sám z jiných látek,
Typy molekul, látek a jejich vazeb v organismech Typy molekul, látek a jejich vazeb v organismech Organismy se skládají z molekul rozličných látek Jednotlivé látky si organismus vytváří sám z jiných látek,
Některé základní pojmy
 Klasifikace látek Některé základní pojmy látka látka čistá chemické individuum fáze směs prvek sloučenina homogenní směs heterogenní směs plynná směs kapalný roztok tuhý roztok Homogenní a heterogenní
Klasifikace látek Některé základní pojmy látka látka čistá chemické individuum fáze směs prvek sloučenina homogenní směs heterogenní směs plynná směs kapalný roztok tuhý roztok Homogenní a heterogenní
Rozpustnost s. Rozpouštění = opakem krystalizace Veličina udávající hmotnost rozpuštěné látky v daném objemu popř. v hmotnosti nasyceného roztoku.
 Rozpustnost 1 Rozpustnost s Rozpouštění = opakem krystalizace Veličina udávající hmotnost rozpuštěné látky v daném objemu popř. v hmotnosti nasyceného roztoku. NASYCENÝ = při určité t a p se již více látky
Rozpustnost 1 Rozpustnost s Rozpouštění = opakem krystalizace Veličina udávající hmotnost rozpuštěné látky v daném objemu popř. v hmotnosti nasyceného roztoku. NASYCENÝ = při určité t a p se již více látky
Osmometrie. Specializační vzdělávání Katedra laboratorních metod LF MU Mgr. Jana Gottwaldová
 Osmometrie Specializační vzdělávání Katedra laboratorních metod LF MU Mgr. Jana Gottwaldová 14.2.-18.2. 2011 Osmometrie Analytická metoda k měření koncentrace částic v roztoku; využívá změn, které působí
Osmometrie Specializační vzdělávání Katedra laboratorních metod LF MU Mgr. Jana Gottwaldová 14.2.-18.2. 2011 Osmometrie Analytická metoda k měření koncentrace částic v roztoku; využívá změn, které působí
12. Elektrochemie základní pojmy
 Důležité veličiny Elektroda, článek Potenciometrie Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti Důležité veličiny proud I (ampér - A) náboj Q (coulomb - C) Q t 0 I dt napětí, potenciál
Důležité veličiny Elektroda, článek Potenciometrie Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti Důležité veličiny proud I (ampér - A) náboj Q (coulomb - C) Q t 0 I dt napětí, potenciál
ROSTLINNÁ FYZIOLOGIE OSMOTICKÉ JEVY
 Gymnázium a Střední odborná škola pedagogická, Čáslav, Masarykova 248 M o d e r n í b i o l o g i e reg. č.: CZ.1.07/1.1.32/02.0048 TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM
Gymnázium a Střední odborná škola pedagogická, Čáslav, Masarykova 248 M o d e r n í b i o l o g i e reg. č.: CZ.1.07/1.1.32/02.0048 TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM
Chemické složení buňky
 Chemické složení buňky Chemie života: založena především na sloučeninách uhlíku téměř výlučně chemické reakce probíhají v roztoku nesmírně složitá ovládána a řízena obrovskými polymerními molekulami -chemickými
Chemické složení buňky Chemie života: založena především na sloučeninách uhlíku téměř výlučně chemické reakce probíhají v roztoku nesmírně složitá ovládána a řízena obrovskými polymerními molekulami -chemickými
BIOLOGICKÉ ÚVOD ZÁKLADY MOLEKULÁRN RNÍ BIOLOGIE
 BIOLOGICKÉ VĚDY ÚVOD ZÁKLADY MOLEKULÁRN RNÍ BIOLOGIE DOPORUČEN ENÁ LITERATURA Jan Šmarda BIOLOGIE PRO PSYCOLOGY A PEDAGOGY Jan Šmarda ZÁKLADY BIOLOGIE A ANATOMIE PRO STUDUJÍCÍ PSYCOLOGIE Zdeněk Wilhelm
BIOLOGICKÉ VĚDY ÚVOD ZÁKLADY MOLEKULÁRN RNÍ BIOLOGIE DOPORUČEN ENÁ LITERATURA Jan Šmarda BIOLOGIE PRO PSYCOLOGY A PEDAGOGY Jan Šmarda ZÁKLADY BIOLOGIE A ANATOMIE PRO STUDUJÍCÍ PSYCOLOGIE Zdeněk Wilhelm
ZÁKLADNÍ CHEMICKÉ POJMY A ZÁKONY
 ZÁKLADNÍ CHEMICKÉ POJMY A ZÁKONY Klíčová slova: relativní atomová hmotnost (A r ), relativní molekulová hmotnost (M r ), Avogadrova konstanta (N A ), látkové množství (n, mol), molární hmotnost (M, g/mol),
ZÁKLADNÍ CHEMICKÉ POJMY A ZÁKONY Klíčová slova: relativní atomová hmotnost (A r ), relativní molekulová hmotnost (M r ), Avogadrova konstanta (N A ), látkové množství (n, mol), molární hmotnost (M, g/mol),
Jana Fauknerová Matějčková
 Jana Fauknerová Matějčková převody jednotek výpočet ph ph vodných roztoků ph silných kyselin a zásad ph slabých kyselin a zásad, disociační konstanta, pk ph pufrů koncentace 1000mg př. g/dl mg/l = = *10000
Jana Fauknerová Matějčková převody jednotek výpočet ph ph vodných roztoků ph silných kyselin a zásad ph slabých kyselin a zásad, disociační konstanta, pk ph pufrů koncentace 1000mg př. g/dl mg/l = = *10000
Opakování
 Slabé vazebné interakce Opakování Co je to atom? Opakování Opakování Co je to atom? Atom je nejmenší částice hmoty, chemicky dále nedělitelná. Skládá se z atomového jádra obsahujícího protony a neutrony
Slabé vazebné interakce Opakování Co je to atom? Opakování Opakování Co je to atom? Atom je nejmenší částice hmoty, chemicky dále nedělitelná. Skládá se z atomového jádra obsahujícího protony a neutrony
CHEMICKÉ VÝPOČTY I. ČÁST LÁTKOVÉ MNOŽSTVÍ. HMOTNOSTI ATOMŮ A MOLEKUL.
 CHEMICKÉ VÝPOČTY I. ČÁST LÁTKOVÉ MNOŽSTVÍ. HMOTNOSTI ATOMŮ A MOLEKUL. Látkové množství Značka: n Jednotka: mol Definice: Jeden mol je množina, která má stejný počet prvků, jako je atomů ve 12 g nuklidu
CHEMICKÉ VÝPOČTY I. ČÁST LÁTKOVÉ MNOŽSTVÍ. HMOTNOSTI ATOMŮ A MOLEKUL. Látkové množství Značka: n Jednotka: mol Definice: Jeden mol je množina, která má stejný počet prvků, jako je atomů ve 12 g nuklidu
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ
 SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
Základní stavební kameny buňky Kurz 1 Struktura -7
 Základní stavební kameny buňky Kurz 1 Struktura -7 vladimira.kvasnicova@lf3.cuni.cz Oddělení biochemie - 4. patro pracovna 411 Doporučená literatura kapitoly z biochemie http://neoluxor.cz (10% sleva přes
Základní stavební kameny buňky Kurz 1 Struktura -7 vladimira.kvasnicova@lf3.cuni.cz Oddělení biochemie - 4. patro pracovna 411 Doporučená literatura kapitoly z biochemie http://neoluxor.cz (10% sleva přes
Homeostáza vody a iontů
 Homeostáza vody a iontů 1 Homeostasa Je stálost vnitřního prostředí Tělesna teplota distribuce vody ph Koncentrace iontů, glukosy, Základní regulační mechanismus je zpětná vazba 2 3 Voda v lidském těle
Homeostáza vody a iontů 1 Homeostasa Je stálost vnitřního prostředí Tělesna teplota distribuce vody ph Koncentrace iontů, glukosy, Základní regulační mechanismus je zpětná vazba 2 3 Voda v lidském těle
Základní chemické výpočty I
 Základní chemické výpočty I Tomáš Kučera tomas.kucera@lfmotol.cuni.cz Ústav lékařské chemie a klinické biochemie 2. lékařská fakulta, Univerzita Karlova v Praze a Fakultní nemocnice v Motole 2017 Relativní
Základní chemické výpočty I Tomáš Kučera tomas.kucera@lfmotol.cuni.cz Ústav lékařské chemie a klinické biochemie 2. lékařská fakulta, Univerzita Karlova v Praze a Fakultní nemocnice v Motole 2017 Relativní
Chemické výpočty II. Vladimíra Kvasnicová
 Chemické výpočty II Vladimíra Kvasnicová Převod jednotek pmol/l nmol/l µmol/l mmol/l mol/l 10-12 10-9 10-6 10-3 mol/l µg mg g 10-6 10-3 g µl ml dl L 10-6 10-3 10-1 L Cvičení 12) cholesterol (MW=386,7g/mol):
Chemické výpočty II Vladimíra Kvasnicová Převod jednotek pmol/l nmol/l µmol/l mmol/l mol/l 10-12 10-9 10-6 10-3 mol/l µg mg g 10-6 10-3 g µl ml dl L 10-6 10-3 10-1 L Cvičení 12) cholesterol (MW=386,7g/mol):
Plasma a většina extracelulární
 Acidobazická rovnováha Tato prezentace je přístupná online Fyziologické ph Plasma a většina extracelulární tekutiny ph = 7,40 ± 0,02 Význam stálého ph Na ph závisí vlastnosti bílkovin aktivita enzymů struktura
Acidobazická rovnováha Tato prezentace je přístupná online Fyziologické ph Plasma a většina extracelulární tekutiny ph = 7,40 ± 0,02 Význam stálého ph Na ph závisí vlastnosti bílkovin aktivita enzymů struktura
Netkané textilie. Materiály 2
 Materiály 2 1 Pojiva pro výrobu netkaných textilií Pojivo je jednou ze dvou základních složek pojených textilií. Forma pojiva a jeho vlastnosti předurčují technologii a podmínky procesu pojení způsob rozmístění
Materiály 2 1 Pojiva pro výrobu netkaných textilií Pojivo je jednou ze dvou základních složek pojených textilií. Forma pojiva a jeho vlastnosti předurčují technologii a podmínky procesu pojení způsob rozmístění
Bílkoviny. Bílkoviny. Bílkoviny Jsou
 Bílkoviny Bílkoviny Úkol: Vyberte zdroje bílkovin: Citróny Tvrdý sýr Tvaroh Jablka Hovězí maso Luštěniny Med Obilí Vepřové sádlo Hroznové víno Bramborové hlízy Řepa cukrovka Bílkoviny Základními stavebními
Bílkoviny Bílkoviny Úkol: Vyberte zdroje bílkovin: Citróny Tvrdý sýr Tvaroh Jablka Hovězí maso Luštěniny Med Obilí Vepřové sádlo Hroznové víno Bramborové hlízy Řepa cukrovka Bílkoviny Základními stavebními
Lékařská chemie přednáška č. 3
 Lékařská chemie přednáška č. 3 vnitřní prostředí organismu transport látek v membráně Václav Babuška Vaclav.Babuska@lfp.cuni.cz Vnitřní prostředí organismu Procento vody v organismu 2 Vnitřní prostředí
Lékařská chemie přednáška č. 3 vnitřní prostředí organismu transport látek v membráně Václav Babuška Vaclav.Babuska@lfp.cuni.cz Vnitřní prostředí organismu Procento vody v organismu 2 Vnitřní prostředí
neionogenní aniontové kationtové amfoterní
 Koloidně disperzní částice - micely - vznikají vratnou asociací z pravých roztoků některých nízkomolekulárních látek. Na rozdíl od lyofobních micel nepotřebují umělou stabilizaci, jejich velikost, koncentrace
Koloidně disperzní částice - micely - vznikají vratnou asociací z pravých roztoků některých nízkomolekulárních látek. Na rozdíl od lyofobních micel nepotřebují umělou stabilizaci, jejich velikost, koncentrace
Chemie 2018 CAUS strana 1 (celkem 5)
 Chemie 2018 CAUS strana 1 (celkem 5) 1. Vápník má atomové číslo 20, hmotnostní 40. Kolik elektronů obsahuje kationt Ca 2+? a) 18 b) 20 c) 40 d) 60 2. Kolik elektronů ve valenční sféře má atom Al? a) 1
Chemie 2018 CAUS strana 1 (celkem 5) 1. Vápník má atomové číslo 20, hmotnostní 40. Kolik elektronů obsahuje kationt Ca 2+? a) 18 b) 20 c) 40 d) 60 2. Kolik elektronů ve valenční sféře má atom Al? a) 1
11. Koloidní roztoky makromolekul
 11. Koloidní roztoky makromolekul Vysokomolekulární látky se ve vhodném rozpouštědle mohou samovolně rozpouštět za vzniku termodynamicky stálých pravých roztoků, jejichž částice koloidních rozměrů jsou
11. Koloidní roztoky makromolekul Vysokomolekulární látky se ve vhodném rozpouštědle mohou samovolně rozpouštět za vzniku termodynamicky stálých pravých roztoků, jejichž částice koloidních rozměrů jsou
Elektrolyty Na+ K+ Ca++ Mg++ Chloridy Fosfáty Sulfáty Organické kyseliny Proteiny Kationty: Kationty celkově: Anionty Bikarbonáty Anionty celkově: Pla
 Obecná patofyziologie metabolismu vody a elektrolytů. Poruchy intravaskulárního objemu a tonicity 7. 4. 004 4. 4. 004 Tělesné kompartmenty tekutin Voda je v organismu kompartmentalizovaná do několika oddílů.
Obecná patofyziologie metabolismu vody a elektrolytů. Poruchy intravaskulárního objemu a tonicity 7. 4. 004 4. 4. 004 Tělesné kompartmenty tekutin Voda je v organismu kompartmentalizovaná do několika oddílů.
ÚPRAVA VODY V ENERGETICE. Ing. Jiří Tomčala
 ÚPRAVA VODY V ENERGETICE Ing. Jiří Tomčala Úvod Voda je v elektrárnách po palivu nejdůležitější surovinou Její množství v provozních systémech elektráren je mnohonásobně větší než množství spotřebovaného
ÚPRAVA VODY V ENERGETICE Ing. Jiří Tomčala Úvod Voda je v elektrárnách po palivu nejdůležitější surovinou Její množství v provozních systémech elektráren je mnohonásobně větší než množství spotřebovaného
Krevní plazma organické a anorganické součásti, význam minerálů a bílkovin krevní plazmy. Somatologie Mgr. Naděžda Procházková
 Krevní plazma organické a anorganické součásti, význam minerálů a bílkovin krevní plazmy. Somatologie Mgr. Naděžda Procházková Krevní plazma definice: Tekutá složka krve Nažloutlá, vazká tekutina Složení
Krevní plazma organické a anorganické součásti, význam minerálů a bílkovin krevní plazmy. Somatologie Mgr. Naděžda Procházková Krevní plazma definice: Tekutá složka krve Nažloutlá, vazká tekutina Složení
Oligobiogenní prvky bývají běžnou součástí organismů, ale v těle jich již podstatně méně (do 1%) než prvků makrobiogenních.
 1 (3) CHEMICKÉ SLOŢENÍ ORGANISMŮ Prvky Stejné prvky a sloučeniny se opakují ve všech formách života, protože mají shodné principy stavby těla i metabolismu. Např. chemické děje při dýchání jsou stejné
1 (3) CHEMICKÉ SLOŢENÍ ORGANISMŮ Prvky Stejné prvky a sloučeniny se opakují ve všech formách života, protože mají shodné principy stavby těla i metabolismu. Např. chemické děje při dýchání jsou stejné
Lipidy a biologické membrány
 Lipidy a biologické membrány Rozdělení a struktura lipidů Biologické membrány - lipidové složení Membránové proteiny Transport látek přes membrány Přenos informace přes membrány Lipidy Nesourodá skupina
Lipidy a biologické membrány Rozdělení a struktura lipidů Biologické membrány - lipidové složení Membránové proteiny Transport látek přes membrány Přenos informace přes membrány Lipidy Nesourodá skupina
Farmakokinetika I. Letní semestr 2015 MVDr. PharmDr. R. Zavadilová, CSc.
 Farmakokinetika I Letní semestr 2015 MVDr. PharmDr. R. Zavadilová, CSc. Farmakokinetika zabývá se procesy, které modifikují změny koncentrace léčiva v organismu ve vazbě na čas v němž probíhají změnami
Farmakokinetika I Letní semestr 2015 MVDr. PharmDr. R. Zavadilová, CSc. Farmakokinetika zabývá se procesy, které modifikují změny koncentrace léčiva v organismu ve vazbě na čas v němž probíhají změnami
Poruchy vnitřního prostředí
 Poruchy vnitřního prostředí Poruchy objemu, osmolarity a tonicity Etiopatogeneze jednotlivých poruch Homeostáza vnitřní prostředí (nitrobuněčné a v okolí buněk) není totožné se zevním prostředím vnitřní
Poruchy vnitřního prostředí Poruchy objemu, osmolarity a tonicity Etiopatogeneze jednotlivých poruch Homeostáza vnitřní prostředí (nitrobuněčné a v okolí buněk) není totožné se zevním prostředím vnitřní
Monitoring vnitřního prostředí pacienta
 Monitoring vnitřního prostředí pacienta MVDr. Leona Raušerová -Lexmaulová, Ph.D. Klinika chorob psů a koček VFU Brno Vnitřní prostředí Voda Ionty Bílkoviny Cukry Tuky Důležité faktory Obsah vody Obsah
Monitoring vnitřního prostředí pacienta MVDr. Leona Raušerová -Lexmaulová, Ph.D. Klinika chorob psů a koček VFU Brno Vnitřní prostředí Voda Ionty Bílkoviny Cukry Tuky Důležité faktory Obsah vody Obsah
Vyjadřuje poměr hmotnosti rozpuštěné látky k hmotnosti celého roztoku.
 Koncentrace roztoků Hmotnostní zlomek w Vyjadřuje poměr hmotnosti rozpuštěné látky k hmotnosti celého roztoku. w= m A m s m s...hmotnost celého roztoku, m A... hmotnost rozpuštěné látky Hmotnost roztoku
Koncentrace roztoků Hmotnostní zlomek w Vyjadřuje poměr hmotnosti rozpuštěné látky k hmotnosti celého roztoku. w= m A m s m s...hmotnost celého roztoku, m A... hmotnost rozpuštěné látky Hmotnost roztoku
Skupenské stavy látek. Mezimolekulární síly
 Skupenské stavy látek Mezimolekulární síly 1 Interakce iont-dipól Např. hydratační (solvatační) interakce mezi Na + (iont) a molekulou vody (dipól). Jde o nejsilnější mezimolekulární (nevazebnou) interakci.
Skupenské stavy látek Mezimolekulární síly 1 Interakce iont-dipól Např. hydratační (solvatační) interakce mezi Na + (iont) a molekulou vody (dipól). Jde o nejsilnější mezimolekulární (nevazebnou) interakci.
Hospodaření s vodou a minerály, ledviny, moč. Helena Brodská
 ZÁKLADY OBECNÉ A KLINICKÉ BIOCHEMIE 2004 Hospodaření s vodou a minerály, ledviny, moč Helena Brodská kapitola ve skriptech - 3.7 Tělesná voda-rozložení Celková tělesná voda /CTV/ 55-60% hmotnosti organismu.
ZÁKLADY OBECNÉ A KLINICKÉ BIOCHEMIE 2004 Hospodaření s vodou a minerály, ledviny, moč Helena Brodská kapitola ve skriptech - 3.7 Tělesná voda-rozložení Celková tělesná voda /CTV/ 55-60% hmotnosti organismu.
Tělesné kompartmenty tekutin. Tělesné kompartmenty tekutin. Obecná patofyziologie hospodaření s vodou a elektrolyty.
 Obecná patofyziologie hospodaření s vodou a elektrolyty. 2. 4. 2008 Tělesné kompartmenty tekutin Voda je v organismu kompartmentalizovaná do několika oddílů. Intracelulární tekutina (ICF) zahrnuje 2/3
Obecná patofyziologie hospodaření s vodou a elektrolyty. 2. 4. 2008 Tělesné kompartmenty tekutin Voda je v organismu kompartmentalizovaná do několika oddílů. Intracelulární tekutina (ICF) zahrnuje 2/3
Pro zředěné roztoky za konstantní teploty T je osmotický tlak úměrný molární koncentraci
 TRANSPORTNÍ MECHANISMY Transport látek z vnějšího prostředí do buňky a naopak se může uskutečňovat dvěma cestami - aktivním a pasivním transportem. Pasivním transportem rozumíme přenos látek ve směru energetického
TRANSPORTNÍ MECHANISMY Transport látek z vnějšího prostředí do buňky a naopak se může uskutečňovat dvěma cestami - aktivním a pasivním transportem. Pasivním transportem rozumíme přenos látek ve směru energetického
 Jiøí Vlèek ZÁKLADY STØEDOŠKOLSKÉ CHEMIE obecná chemie anorganická chemie organická chemie Obsah 1. Obecná chemie... 1 2. Anorganická chemie... 29 3. Organická chemie... 48 4. Laboratorní cvièení... 69
Jiøí Vlèek ZÁKLADY STØEDOŠKOLSKÉ CHEMIE obecná chemie anorganická chemie organická chemie Obsah 1. Obecná chemie... 1 2. Anorganická chemie... 29 3. Organická chemie... 48 4. Laboratorní cvièení... 69
2.3 CHEMICKÁ VAZBA. Molekula bílého fosforu P 4 a kyseliny sírové H 2 SO 4. Předpona piko p je dílčí jednotkou a udává velikost m.
 2.3 CHEMICKÁ VAZBA Spojováním dvou a více atomů vznikají molekuly. Jestliže dochází ke spojování výhradně atomů téhož chemického prvku, pak se jedná o molekuly daného prvku (vodíku H 2, dusíku N 2, ozonu
2.3 CHEMICKÁ VAZBA Spojováním dvou a více atomů vznikají molekuly. Jestliže dochází ke spojování výhradně atomů téhož chemického prvku, pak se jedná o molekuly daného prvku (vodíku H 2, dusíku N 2, ozonu
V organismu se bílkoviny nedají nahradit žádnými jinými sloučeninami, jen jako zdroj energie je mohou nahradit sacharidy a lipidy.
 BÍLKOVINY Bílkoviny jsou biomakromolekulární látky, které se skládají z velkého počtu aminokyselinových zbytků. Vytvářejí látkový základ života všech organismů. V tkáních vyšších organismů a člověka je
BÍLKOVINY Bílkoviny jsou biomakromolekulární látky, které se skládají z velkého počtu aminokyselinových zbytků. Vytvářejí látkový základ života všech organismů. V tkáních vyšších organismů a člověka je
Exkrece = Exkrety Exkrementy
 Vylučovací soustava Vylučovací soustava Exkrece = vylučování vylučování odpadních produktů tkáňového metabolismu z těla ven Exkrety tekuté odpadní látky x Exkrementy tuhé odpadní látky Hlavní exkrety:
Vylučovací soustava Vylučovací soustava Exkrece = vylučování vylučování odpadních produktů tkáňového metabolismu z těla ven Exkrety tekuté odpadní látky x Exkrementy tuhé odpadní látky Hlavní exkrety:
Lékařská chemie -přednáška č. 8
 Lékařská chemie -přednáška č. 8 Lipidy, izoprenoidya steroidy Václav Babuška Vaclav.Babuska@lfp.cuni.cz Lipidy heterogenní skupina látek špatně rozpustné ve vodě, dobře rozpustné v organických rozpouštědlech
Lékařská chemie -přednáška č. 8 Lipidy, izoprenoidya steroidy Václav Babuška Vaclav.Babuska@lfp.cuni.cz Lipidy heterogenní skupina látek špatně rozpustné ve vodě, dobře rozpustné v organických rozpouštědlech
VÝPO C TY. Tomáš Kuc era & Karel Kotaška
 ZÁKLADNÍ CHEMICKÉ VÝPO C TY I Tomáš Kuc era & Karel Kotaška tomas.kucera@lfmotol.cuni.cz Ústav lékar ské chemie a klinické biochemie 2. lékar ská fakulta, Univerzita Karlova v Praze a Fakultní nemocnice
ZÁKLADNÍ CHEMICKÉ VÝPO C TY I Tomáš Kuc era & Karel Kotaška tomas.kucera@lfmotol.cuni.cz Ústav lékar ské chemie a klinické biochemie 2. lékar ská fakulta, Univerzita Karlova v Praze a Fakultní nemocnice
Mol. fyz. a termodynamika
 Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
ZÁSADY SPRÁVNÉ LABORATORNÍ PRAXE VYBRANÁ USTANOVENÍ PRAKTICKÉ APLIKACE
 ZÁSADY SPRÁVNÉ LABORATORNÍ PRAXE VYBRANÁ USTANOVENÍ PRAKTICKÉ APLIKACE Zabezpečování jakosti v laboratorní praxi je významnou součástí práce každé laboratoře. Problematiku jakosti řeší řada předpisů, z
ZÁSADY SPRÁVNÉ LABORATORNÍ PRAXE VYBRANÁ USTANOVENÍ PRAKTICKÉ APLIKACE Zabezpečování jakosti v laboratorní praxi je významnou součástí práce každé laboratoře. Problematiku jakosti řeší řada předpisů, z
Voda polární rozpouštědlo
 VY_32_INVACE_30_BEN05.notebook Voda polární rozpouštědlo Temacká oblast : Chemie anorganická chemie Datum vytvoření: 2. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný
VY_32_INVACE_30_BEN05.notebook Voda polární rozpouštědlo Temacká oblast : Chemie anorganická chemie Datum vytvoření: 2. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný
[K kg mol 1 ] T v = K E m 2. T t = K K m 2. 1 p1. 2 v1 M1 H. 2 t1 M1 H 3/ 2 2
![[K kg mol 1 ] T v = K E m 2. T t = K K m 2. 1 p1. 2 v1 M1 H. 2 t1 M1 H 3/ 2 2 [K kg mol 1 ] T v = K E m 2. T t = K K m 2. 1 p1. 2 v1 M1 H. 2 t1 M1 H 3/ 2 2](/thumbs/48/24610687.jpg) 13. KOLIGATIVNÍ VLASTNOSTI 01 Snížení tlaku páry nad roztokem... 0 Snížení tlaku páry nad roztokem, výpočet molární hmotnoti... 03 Snížení tlaku páry nad roztokem, výpočet molární hmotnoti rozpouštědla...
13. KOLIGATIVNÍ VLASTNOSTI 01 Snížení tlaku páry nad roztokem... 0 Snížení tlaku páry nad roztokem, výpočet molární hmotnoti... 03 Snížení tlaku páry nad roztokem, výpočet molární hmotnoti rozpouštědla...
LIPIDY Michaela Jurčáková & Radek Durna
 LIPIDY Michaela Jurčáková & Radek Durna Fyziologie živočichů cvičení, katedra biologie, PedF MU 1 LIPIDY Přírodní organické látky rostlinného, živočišného i mikrobiálního původu nerozpustné ve vodě, ale
LIPIDY Michaela Jurčáková & Radek Durna Fyziologie živočichů cvičení, katedra biologie, PedF MU 1 LIPIDY Přírodní organické látky rostlinného, živočišného i mikrobiálního původu nerozpustné ve vodě, ale
1 Základní chemické výpočty. Koncentrace roztoků
 1 Záklní chemické výpočty. Koncentrace roztoků Množství látky (Doplňte tabulku) Veličina Symbol Jednotka SI Jednotky v biochemii Veličina se zjišťuje Počet částic N výpočtem Látkové množství n.. Hmotnost
1 Záklní chemické výpočty. Koncentrace roztoků Množství látky (Doplňte tabulku) Veličina Symbol Jednotka SI Jednotky v biochemii Veličina se zjišťuje Počet částic N výpočtem Látkové množství n.. Hmotnost
Sešit pro laboratorní práci z chemie
 Sešit pro laboratorní práci z chemie téma: Příprava roztoků a měření ph autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační
Sešit pro laboratorní práci z chemie téma: Příprava roztoků a měření ph autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační
Lipidy charakteristika, zdroje, výroba a vlastnosti
 Lipidy charakteristika, zdroje, výroba a vlastnosti Tematická oblast Datum vytvoření Ročník Stručný obsah Způsob využití Autor Kód Chemie přírodních látek lipidy 2.7.2012 3. ročník čtyřletého G Charakteristika,
Lipidy charakteristika, zdroje, výroba a vlastnosti Tematická oblast Datum vytvoření Ročník Stručný obsah Způsob využití Autor Kód Chemie přírodních látek lipidy 2.7.2012 3. ročník čtyřletého G Charakteristika,
3 Acidobazické reakce
 3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
