REAKTORY V ORGANICKÉ TECHNOLOGII
|
|
|
- Ondřej Esterka
- před 8 lety
- Počet zobrazení:
Transkript
1 REAKTORY V ORGANICKÉ TECHNOLOGII Literatura 1 Weissermel K., Arpe H. J.: Průmyslová organická chemie,1984 SNTL, Praha. 2 Hrdina R.: Organická technologie, nebo 3 Hrušovský M., Růžička V., Zbirožský M., Poskočil J.: Organická technológia a petrochémia, SVŠT Bratislava, Majer, Mýl, Kuchler, Poskočil: Základy organické technologie I, II, skripta, Pardubice, Uhlíř, Socha: Agrochemie, skripta Pardubice Černý O.: Průmyslová organická syntéza, 1978 SNTL, Praha. 7 Černý: Průmyslová organická syntéza, skripta Pardubice, Horák: Technická heterogenní katalýza, skripta Praha, Kizlink: Technologie chemických látek I, II, skripta Brno Ullmanns Encyklopadie der technischen Chemie, Verlag Chemie, Weinheim 1973.
2 Obsah Úvod 3 1 Konstrukční materiály 3 2 Základní charakteristiky chemické reakce 4 3 Základní typy reaktorů Látková bilance vsádkového reaktoru Látková bilance trubkového průtočného reaktoru Látková bilance ideálně míchaného průtočného reaktoru Teplotní režimy reaktorů Výkon reaktorů Příklady Konstrukce průtočných reaktorů 17 4 Reaktory pro exotermní reakce v plynné fázi Vysokotlaká radikálová polymerace ethylenu Termická chlorace methanu 21 5 Reaktory pro endotermní reakce v plynné fázi Termické štěpení uhlovodíků 22 6 Reaktory pro reakce v heterogenních fázích kapalina-kapalina Diskontinuální nitrace benzenu Kontinuální nitrace benzenu 27 7 Reaktory pro reakce v heterogenních fázích kapalina-plyn Diskontinuální chlorace toluenu Parciální oxidace cyklohexanu na cyklohexanon Parciální oxidace n-butanu na kyselinu octovou Výroba adiponitrilu z kyseliny adipové Výroba acetanhydridu z ketenu a kyseliny octové Výroba dodecylbenzensulfonové kyseliny z dodecylbenzenu 33 8 Reaktory pro reakce v heterogenních fázích tuhá látka-plyn 34 9 Reaktory pro reakce v heterogenních fázích tuhá látka-tuhá látka Výroba kyseliny sulfanilové Výroba ftalocyaninu suchou cestou z ftalodinitrilu 34 1 Reaktory pro reakce plynné fáze na pevných katalyzátorech Oxidace sirovodíku Katalytická hydrogenace fenolu na cyklohexanon Katalytická dehydrogenace cyklohexanolu na cyklohexanon Amoxidace propylenu na akrylonitril Parciální oxidace o-xylenu na ftalanhydrid 4 11 Reaktory pro reakce v heterogenních fázích tuhá látka-kapalina-plyn Hydrogenace benzenu na cyklohexan v kapalné fázi Nízkotlaká polymerace ethenu 42
3 1. Úvod Obecně pojato, reaktor je zařízení, ve kterém se uskutečňuje chemická reakce. V celém procesu výroby tvoří ústřední část, kde ovšem neméně důležitou roli hrají dopravníky surovin (čerpadla, kompresory, monžíky, šneky, dopravníkové pásy, apod.) a zařízení pro separaci produktů z reakčních směsí (krystalizátory, destilační kolony, filtry, usazováky, apod.). 1. Konstrukční materiály Materiál pro stavbu chemického reaktoru je vybírán podle následujících hledisek: - pevnost - korozivní účinky reakční směsi - vliv použitého materiálu na látky v reakční směsi. Druhy konstrukčních materiálů, kde výčet není samozřejmě úplný, udává následující tabulka 1. Tabulka 1 Druhy konstrukčních materiálů Kovové Anorganické Organické Ocele (nelegované, legované) Cihly (šamotové, kyselinovzdorné) Polyethylen Litina Grafit Polypropylen Titan Azbest PVC Nikl Skla (obyčejná, křemenná) Teflon Mědˇ Smalty Pryž Olovo Dřevo Hliník U vsádkových reaktorů, kde nepotřebujeme ohřev na vysokou teplotu (do ca 1 C), se často používají pogumované reaktory. Smaltované reakční nádoby jsou asi nejpoužívanější v malotonážní chemii, kde je potřeba vědět, že opět platí jistá hranice reakční teploty a ph (nesmí nastat kombinace vysoké teploty a vysokého ph). Smalty mají také omezení v tom smyslu, že při zahřívání reakční směsi či jejím chlazení nesmí dojít k tzv. teplotnímu šoku. To znamená, že rychlost teplotní změny reakční směsi by obvykle měla být 5 C/min. Sklo jako konstrukční materiál se spíše používá pro malé výroby laboratorního či poloprovozního charakteru. Z hlediska koroze či vlivu na chemické látky se jedná o materiál vynikající, chemicky odolný. Nelze jej ale použít v oblasti fluorové chemie a pro substance s obsahem alkalických louhů. Nevýhodou je také jeho křehkost. Sklo je jediným materiálem vhodným pro konstrukci fotochemických reaktorů. Je zde nutno mít na paměti, že obyčejné sklo nepropouští ultrafialové (UV) záření, kdežto křemenné sklo ano. Nejlepším optickým materiálem je syntetický safír (Al2O3), který má oblast takřka 1 % propustnosti (až na několik procent reflexe) od 15 do 6 nm (viditelné záření světlo se nachází v oblasti nm). Navíc je to materiál chemicky velmi odolný.
4 Pro běžné účely je ale drahý. Následující tabulka 2 ukazuje optické vlastnosti některých materiálů. Tabulka 2 Optická propustnost některých materiálů Hraniční vlnová délka v nm pro Materiál Tloušťka (mm) transmitanci 5% 1% sklo pyrexové sklo (v ČR Simax) uviolové sklo a) křemen polymethylmethakrylát LiF CaF voda a) směs SiO2 (ca 65%) a oxidů Ia, IIa 2. Základní charakteristiky chemické reakce Při popisu chemických reakcí se kromě pojmu rovnovážné koncentrace (molální, molární) setkáme s pojmy jako konverze, výtěžek, selektivita, rychlost, molekularita, řád reakce, rozsah reakce či residenční čas. V případě reakce dle schéma (r1) je konverze X, výtěžek B a selektivita SB dána v rov. 1, 2 a 3. k (r1) A B B X a a A A a (1) A B B B a (2) S B A B B A (3) Pozn. Symboly v hranatých závorkách mají konvenčně význam aktuálních koncentrací (molálních [mol/kg] nebo molárních [mol/l]). Rychlost r irreversibilní monomolekulární reakce A k B je, dle Guldberg Waageova zákona o působení aktivní hmoty, přímo úměrná aktuální koncentraci výchozí látky [A].
5 A d dt B d dt r ka Mezi koncentracemi [A] a [B] platí, že a A B. Celkové časové změny koncentrací rovnovážné monomolekulární reakce: A k 1 k -1 B jsou dány výrazy: da k A k dt B d dt k 1 1 A k 1 1 B B Mezi koncentracemi [A] a [B] platí, že a A B. (4) (5) (6) Rychlostní rovnice následné reakce: k 1 k 2 A B C jsou dány výrazy: da k1a dt B d dt C d dt k k A 1 2 B k 2 B Mezi koncentracemi [A], [B] a [C] platí, že a A B C. (7) (8) (9) Rychlostní rovnice bočné (paralelní) reakce: B A k 1 k 2 C jsou dány výrazy: d A k1 k2 A dt (1) B d dt C d dt k 1 k 2 A A (11) (12)
6 Mezi koncentracemi [A], [B] a [C] platí, že a A B C. Rychlostní rovnice bimolekulární reakce: k A + B C je dána výrazem: da db dc r ka B dt dt dt Mezi koncentracemi [A], [B] a [C] platí, že a A b B C. b Pozn. Integrální tvar modelu je nutno řešit zvlášť pro a a zvlášť pro a b. b a a V prvním případě je A a ve druhém případě je A. b b a kt akt 1 e 1 a (13)
7 3. Základní typy reaktorů Z hlediska konstrukce lze rozlišit dva typy reaktorů: vsádkový (tzv. integrální) a průtočný (tzv. diferenciální). Ve vsádkovém reaktoru je reakční rychlost stejná v celém jeho objemu a je funkcí času, v průtočném reaktoru je reakční rychlost závislá na prostorové souřadnici ale s časem se v daném místě nemění. Doba, po kterou reakční směs setrvá v reaktoru se nazývá residenční čas. V případě integrálního reaktoru je residenční čas dán celkovou dobou reakce. V případě průtočného reaktoru je průtok F = S.u součinem průřezu (S) a rychlosti toku (u). Rychlost toku je dána podílem u = l/t délky reaktoru (l) a residenčního času (t). Residenční čas t je pak dán poměrem t = V/F objemu reaktoru (V) a průtoku F (t = l/u = S.l/F = V/F). 3.1 Látková bilance vsádkového reaktoru Vsádkový reaktor (Obr. 1) je obvykle tvořen válcovou nádobou s víkem, opatřenou vstupním otvorem, přívodem reagentů, míchadlem, teplosměnnou vestavbou (hadem nebo duplikátorem) a spodní výpustí. Teplosměnné zařízení je napojeno dle potřeby na přívod chladicího/ohřevného média. V případě ohřevu je reaktor také vybaven kondenzátorem se zpětným tokem. chlazení/ohřev V výpusť reakční směsi Obr. 1 Schéma vsádkového reaktoru Látkovou bilanci reaktantu lze obecně vyjádřit ve tvaru: Množství látky přiváděné + Množství látky vznikající = Množství látky akumulované + Množství látky odváděné (14) Vsádkový reaktor je z hlediska látkové bilance uzavřený systém a množství přiváděné a odváděné látky je zde rovno nule. Pro reakce v homogenní kapalné fázi lze tedy jeho látkovou bilanci vyjádřit formou diferenciální rovnice 15, kde c značí aktuální koncentraci (molální nebo molární) dané látky v čase t a r je reakční rychlost. dc (15) r dt
8 Hodnota znaménka před akumulačním členem na pravé straně rovnice 15 závisí na tom, zda uvažujeme aktuální koncentraci produktu (+) či výchozí látky (-). Tato diferenciální rovnice se řeší separací proměnných a integrací: dc (16) t r c Pro příklad bimolekulární reakce vyjádřené schématem: k A + B P platí kinetická rovnice: dp k A B dt (r2) (17) Aktuální koncentrace produktu v reakční směsi je: a X (18) P Vztah mezi přírůstkem konverze a reakční rychlostí je dán derivací rov. 1 podle času: dx da dp (19) a r dt dt dt V případě, že vstupní koncentrace a = b obou reakčních složek jsou stejné (X značí konverzi látky A v rozsahu od do 1): A B a 1 X (2) lze kinetickou rovnici 17 přepsat (dosazením rov. 19 a 2 do rov. 17) ve tvaru: dx ka 1 X 2 dt Integrací v mezích X, X a t, t získáme vztah: ka t X (21) (22) který je rovnicí přímky (na abscise je čas t násobený počáteční koncentrací, na ordinátě je 1/(1 - X), směrnice přímky je rychlostní konstanta k). Závislost konverze na čase je: kat X ka t 1 (23) kde platí, že v čase t = je X = a v čase t je X = 1.
9 2.2 Látková bilance trubkového reaktoru s ideálním pístovým tokem Trubkový reaktor je tvořen trubkou s objemem V, kterou protéká reakční směs s konstantním průtokem F. Látková bilance provedená pro element objemu dv (Obr. 2) s použitím rov. 14 je dána vztahem v rov. 24. koncentrace c průtok F koncentrace c+dc element objemu dv Obr. 2 Objemový element dv v průtočném trubkovém reaktoru Fc rdv dn dt ak. F c dc (24) V ustáleném stavu je akumulační člen na pravé straně rov. 24 roven nule. Po úpravě dostaneme vztah: V dc (25) F r c Poměr objemu reaktoru V a rychlosti nástřiku F udává čas potřebný k tomu, aby tekutina vstupující do reaktoru dosáhla jeho konce, a proto se nazývá prostorový (residenční) čas. Nedochází-li během reakce ke změně hustoty (reakce v kapalné fázi či reakce v plynné fázi beze změny počtu molů za konstantní teploty), pak je prostorový čas totožný s časem reálným. V analogii s předchozím příkladem vyhodnocení látkové bilance vsádkovéh reaktoru pro reakci A + B k P je látková bilance průtočného reaktoru ve stejném tvaru rovnice 23, jen namísto času t se dosadí prostorový čas.
10 3.3 Látková bilance průtočného míchaného reaktoru Jedná se zde o míchanou nádobu (Obr. 3), do které konstantní rychlostí natéká výchozí reakční směs (např. o složení a + b pro případ r2). Reaktor pracuje v ustáleném stavu, což znamená, že stejnou rychlostí (F) reakční směs (o složení a, b) do reaktoru natéká a stejnou rychlostí (F) vytéká z reaktoru dostatečně dimenzovaným přepadem (statická soustava). Složení vytékající reakční směsi je (např. A + B + P) konstantní v čase. přívod reakční směsi (A + B ) F chlazení/ohřev V odvod reakční směsi ([A] + [B] + [P]) Obr. 3 Schéma průtočného ideálně míchaného reaktoru s reakcí A + B k P Pro látkovou bilanci platí stejný vztah (rov. 25) jako v případě trubkového reaktoru. Prostorový čas pro tento reaktor je pak opět = V/F. Protože složení vystupující reakční směsi je pořád stejné, znamená to, že celková rychlost reakce r v reaktoru je stále stejná, konstantní. Pro případ a = b je, s použitím konverse X, řešením látkové bilance rovnice ka (26) X a
11 3.4 Tepelné režimy reaktorů Izotermní režim Izotermní režim reakce znamená, že v reaktoru během reakce je udržována konstantní teplota. To se u vsádkových a průtočných míchaných reaktorů technicky zabezpečuje ohřevem nebo chlazením pláště (tzv. duplikátor, Obr. 4), vestavěnými hady, nebo přečerpáváním reakční směsi přes výměník tepla. U trubkových reaktorů se výměna tepla technicky zabezpečuje opět dvojitým pláštěm (souproudý či protiproudý princip) nebo uložením trubek do ohřevného prostoru (pece). Q 1, T 1 H r r Q 2, T 2 Obr. 4 Vsádkový reaktor s duplikátorem Pokud ve vsádkovém reaktoru probíhá exotermní reakce, pak vybavené teplo za jednotku času je rovno -HrrV, kde Hr je molární reakční teplo ([J/mol], kladné pro endotermní reakci a záporné pro exotermní), r je reakční rychlost a V je objem reakční směsi. Záporné znaménko u vybaveného tepla je nutné pro to, aby při exotermní reakci bylo teplo kladné (teplota stoupá) a při endotermní reakci záporné (teplota klesá). Akumulované teplo (dq/dt)ak je pak rovno součinu hmotnosti reakční směsi (m), střední tepelné kapacity c p a gradientu teploty dt/dt. Obecně je tepelná bilance reaktoru, v analogii s rov. 14, vyjádřena vztahem v rov. 27. Q H 1 r dq rv dt ak. Q 2 V případě isotermického vedení reakce je akumulační člen na pravé straně rovnice 27 roven nule (protože dt/dt = ) a reakční teplo -HrrV, které se během reakce v reaktoru vyvine či spotřebuje, se musí vyměnit na povrchu výměnného zařízení ( dq dq dq Q Q 2 Q1 H rrv, [J/s)]). Úpravou rovnice 27 vyjde dt dt 2 dt 1 bilance reakčního tepla Q ve vztahu ke konverzi X: a XV Q H r (27) Neizotermní režim Neizotermní průběh znamená, že během reakce dochází ke změně teploty. Energetická bilance pak zní: H r dq rv dt ak. Q (28)
12 kde levá strana rovnice označuje teplo uvolněné či spotřebované reakcí, prvý člen na pravé straně rovnice označuje teplo akumulované v reakční směsi a Q [J/s)] označuje teplo vyměněné s okolím. Uvažujeme-li reakci A+B P (r2) s konverzí X a střední tepelnou kapacitou reakční směsi c [J/(kg.K)], pak rovnice 28 (po vynásobení diferenciálem času a integraci) p přejde na tvar: H a XV mc T Q (29) r p Výše uvedená rovnice 29 je rovnicí přímky pro závislost teploty na konverzi (rov. 3, Obr. 5). H rav Q (3) T X T mc mc p p T exotermní reakce T konverze X endotermní reakce Obr. 5 Závislost teploty v reaktoru na konverzi pro neizotermní proces Adiabatický režim Adiabaticky pracující reaktor je tepelně izolován, takže během reakce nedochází k výměně tepla s okolím. Aby nedošlo k přehřátí/podchlazení a kolizi musí se teplo vyvinuté/spotřebované reakcí spotřebovat na ohřev/chlazení reakční směsi. Tepelná bilance je v rovnicích Rovnice 33 je opět rovnicí přímky. H r rv dq dt ak. (31) H a XV mc T (32) r p T H rav mc p X T (33) Pozn. Střední specifické teplo c p reakční směsi je dáno použitým reakčním prostředím; u reakce v roztoku je to tepelná kapacita rozpouštědla.
13 3.5 Výkon reaktorů V této části textu porovnáme výkony jednotlivých reaktorů pro modelové reakce, kde ale získané závěry jsou platné i pro systémy složitější. V tabulce 3 jsou vypočteny pracovní objemy základních typů reaktorů v závislosti na konversi. Tabulka 3 Potřebný pracovní objem reaktoru (pro modelovou reakci A B s parametry: k = 1 hod -1, a = 1 mol.l -1 ) pro požadovaný výkon 1 mol látky B za 1 hodinu a) Konverze pracovní objem v litrech vsádkový trubkový průtokový míchaný,2 1,12 1,12 1,25,6 1,52 1,52 2,5,9 2,56 2,56 1,99 4,66 4,66 1, a) O. Černý: Průmyslová organická syntéza, SNTL, Praha Z výše uvedené tabulky vyplývá několik základních závěrů: pracovní objem, potřebný pro docílení téhož výkonu při téže konverzi, je stejný u ideálního vsádkového a trubkového reaktoru pracovní objem, potřebný pro docílení téhož výkonu při téže konverzi, je u ideálního průtokového míchaného reaktoru vždy větší než u reaktoru vsádkového resp. trubkového pracovní objem, potřebný pro docílení vysokých konverzí, u ideálního průtokového míchaného reaktoru neúměrně roste a totální konverzi nelze dosáhnout. Závislost selektivity reakce na použitém typu reaktoru pro konsekutivní reakci ukazuje tabulka 4. Tabulka 4 Závislost selektivity SB na konverzi pro reakci A B C se vstupní koncentrací a = 1 mol.l -1, žádaný produkt je B Konverze Vsádkový Trubkový Průtočný míchaný B (mol.l -1 ) SB B (mol.l -1 ) SB B (mol.l -1 ) SB,1,9,9,9,9,9,9,2,16,8,16,8,16,8,4,24,6,24,6,24,6,6,24,4,24,4,24,4,8,16,2,16,2,16,2 Opět platí následující závěry: selektivita v každém případě klesá se stoupající konverzí a nezávisí na typu reaktoru Z předcházejícího textu vyplývá, že průtočný míchaný reaktor je ze všech nejméně výhodný. Jeho nevýhody lze ovšem částečně odstranit použitím kaskády průtočných míchaných reaktorů, kde v každém i-tém reaktoru probíhá reakce konstantní
14 rychlostí ri. Materiálová bilance jednoho reaktoru v kaskádě (index i) ve stacionárním (ustáleném) stavu je: d P 1 Pi d 1 P P P P i i1 r P i ri r P i r i1 i Při vysokých rychlostech průtoku F a malých objemech Vi v kaskádě konverguje rezidenční čas k nule ( d ) a koncentrační diference P i k diferenciálu d P. Kaskáda složená z nekonečného počtu takovýchto stejně velkých reaktorů pak imituje trubkový reaktor s parametrem F : 1 P r i d r P P a je stejně výkonná a rovněž se dosahuje stejné selektivity v daném reakčním systému. V praktickém provedení se obvykle používá kaskáda tří průtočných míchaných reaktorů. Oproti trubkovému reaktoru má kaskáda i několik výhod. V každém reaktoru je reakční směs dobře promíchávána (promíchávání v příčném směru je u trubkového reaktoru často problém). Předností kaskádového uspořádání je také možnost měnit v každém reaktoru speciálně reakční podmínky, například teplotu, tlak, přidávat jedno nebo více reakčních činidel. i 1 V i (34) (35)
15 3.6 Příklady 1. Pro model A B proběhne reakce ze 4% za 2 min. Určete rychlostní konstantu. kt 1 A A a e k ln, pro konverzi X =,4 je A a1 X, 6a t a 1, 6a 1 k ln, 26 2 a min 2. Reakce A+B prod. za stejných koncentrací A = B = 1-2 M proběhne ze 4% za 2 min. a) Určete rychlostní konstantu. b) Určete za jak dlouho proběhne reakce do 4%, jestliže výchozí koncentrace obou látek je 1-1 M. a l a) A k 1 1 3, 33 a kt t 1 A a 2 a, mol.min b) t min k A a 1 a, Pro reakci A+B prod. (v příkladu 2) probíhající v trubkovém průtočném reaktoru určete jeho délku pro 4% konverze, průtok 1 l/min, průřez trubky 1 cm 2 a A = B = 1-2 M. V F sl F F l s 1 pro = 2 min je l = 2 m Pro bimolekulární reakci A + B Prod, kde výchozí koncentrace složek jsou a = b = 2 mol.dm -3 ; rychlostní konstanta k =,1 dm 3 mol -1 s -1 a Hr = -15 kj.mol -1 (exotermní reakce), vypočtěte (a) potřebný reakční čas pro dosažení konverze X =,8. Vypočtěte (b) na jakou teplotu stoupne reakční směs za předpokladu, že reakčním rozpouštědlem je voda (měrná tepelná kapacita je cp = 4 18 J.Kg -1.K -1 ) celkového objemu 1 litr (1 kg) a výchozí teplota vody je 2 o C. Tepelné kapacity A, B a Prod vzhledem k tomu, že jsou to organické sloučeniny, zanedbejte. Reaktor je izolovaný. Změnu rychlosti se změnou teploty zanedbáme. X,8 (a) t 2s ka 1 X,1 2,2 (b) Pro exotermní reakci je Hr <, aby bylo akumulované teplo kladné, musí být dq H rav tepelná bilance H rrv, tj. po úpravě T X T a dosazení je dt ak. mc p T,8 2 77C 1 4,18 5. Pro reakci A + B Prod probíhající za pseudo-monomolekulárních podmínek (a b), kde výchozí koncentrace složek jsou a =,1 mol.dm -3 ; b = 3 mol.dm -3 ;
16 rychlostní konstanta k =,1 dm 3 mol -1 s -1 a Hr = -1 kj.mol -1 (exotermní reakce), vypočtěte (a) potřebný reakční čas pro dosažení konverze X =,7. Vypočtěte (b) na jakou teplotu stoupne reakční směs za předpokladu, že reakčním rozpouštědlem je voda (měrná tepelná kapacita je cp = 4 18 J.Kg -1.K -1 ) celkového objemu 1 litr (1 kg) a výchozí teplota vody je 25 o C. Tepelné kapacity A, B a Prod vzhledem k tomu, že jsou to organické sloučeniny, zanedbejte. Reaktor je izolovaný. Změnu rychlosti se změnou teploty zanedbáme. da (a) Monomolekulární podmínky znamenají, že r ka B kab k p A, kde dt pozorovaná rychlostní konstanta je kp = kb =,1 3. Kinetická rovnice je: A a e k t 1 1 p t ln1 X ln1,7 s k,1 3 4 p V porovnáním s obecným modelem kde je t k 1 b ln a b a b X 1 X, vyjde po dosazení čas reakce t 1 3,1,7 ln 4,,1 2,9 31,7 1s (b) Pro exotermní reakci je Hr <. Aby bylo akumulované teplo kladné, musí být teplo dq H rav vybavené reakcí H rrv, tj. po úpravě je T X T a po dt ak. mc p 1,1 1 dosazení je T, , 7C 1 4,18 6. Pro obecnou bimolekulární reakci A + B Prod, kde výchozí koncentrace složek jsou a = 1 mol.dm -3 ; b = 2 mol.dm -3 ; rychlostní konstanta k =,2 dm 3 mol -1 s -1 a Hr = -2 kj.mol -1 vypočtěte (a) potřebný reakční čas pro dosažení konverze X =,9. Vypočtěte dále, na jakou teplotu stoupne reakční směs za předpokladu, že reakčním rozpouštědlem je voda (měrná tepelná kapacita je cp = 4 18 J.Kg -1.K -1 ) celkového objemu 1 litr (1 kg) a výchozí teplota vody je 22 o C. Tepelné kapacity A, B a Prod vzhledem k tomu, že jsou to organické sloučeniny, zanedbejte. Reaktor je izolovaný. Změnu rychlosti se změnou teploty zanedbáme. 1 b a X (a) t ln k b a b 1 X, po dosazení je čas reakce t 1 2 1,9 ln 8,,2 1 21,9 5s (b) Pro exotermní reakci je Hr <. Aby bylo akumulované teplo kladné, musí být teplo dq H rav vybavené reakcí H rrv, tj. po úpravě je T X T a po dt ak. mc p 211 dosazení je T, C 1 4,18
17 3.7 Konstrukce průtočných reaktorů Kontinuální způsob výroby ve fázích kapalina - plyn používá velmi často kolonový reaktor. Existuje celá řada kolonových reaktorů (jejich konstrukce je velmi podobná destilačním kolonám) např.: bublinový, patrový, náplňový, zkrápěný, tryskový. G 2 L 1 L 1 L 1 L 2 G 2 L 2 G 2 L 2 G 1 G 1 G 1 L 1 G 2 G2 L 2 G 1 L 2 G 1 L 1 Obr. 6 Typy kolonových reaktorů
18 Protiproudý kolonový reaktor se používá například pro absorpci NO2 do vody při výrobě kyseliny dusičné. Zvláštní typ reaktoru představuje Venturiho trubice. Tento typ reaktoru se používá například pro výrobu HCl anebo pyrolýzu methanu. Zařízení lze též použít k odčerpávání (agresivních) plynných reakčních zplodin (např. Cl2, SO2, HCl, apod.). Všeobecně platí, že pro poměr fází (objemově) je g/l = 1 1. (L nebo G) (G) Obr. 7 Venturiho trubice
19 Jiným typem reaktorů jsou reaktory s pevným ložem. Do této kapitoly patří především reaktory etážové a trubkové. Schéma etážových reaktorů pro reakce v plynné fázi je na následujícím obrázku. Pro výměnu tepla mezi patry je zde použito buďto vnitřního nebo vnějšího výměníku. Obr. 8 Etážové reaktory s pevným ložem katalyzátoru. (I) Výměník tepla je zabudován uvnitř reaktoru mezi patry. (II) Výměník tepla je externí. Jednoduchá konstrukce reaktoru umožňuje naplnit reaktor velkým množstvím katalyzátoru. Reaktor je vhodný pro reakce za vysokého tlaku, z čehož plyne vysoké využití jeho objemu. Nevýhodou je naopak to, že se nedá příliš řídit teplota reakce, protože poměr plochy stěn reaktoru k jeho objemu je malý a tepelná vodivost katalyzátoru naneseného na nosiči je obvykle také malá. Plyne z toho, že reaktor pracuje v podstatě adiabaticky. Etážové reaktory se používají hlavně pro reakce v plynné fázi. Při reakcích v kapalných fázích (např. hydrogenace), kde reaguje plyn s kapalinou (na povrchu katalyzátoru), pracují buď v režimu "zahlcení", tj., že pracovní objem je plně naplněn kapalinou a plyn probublává, nebo v režimu "zkrápěného reaktoru", kdy kapalina stéká dolů katalytickým ložem a vytváří na povrchu částic katalyzátoru film, kolem kterého proudí plyn. Některé etážové reaktory jsou vybaveny mezi jednotlivými patry výměníky tepla, někdy také nástřikem suroviny (jedné z reakčních komponent). Katalyzátor (je obvykle nanesen na nosiči jako je aktivní uhlí, Al2O3 nebo SiO2) je pevně umístěn v reaktoru (na roštu) a reakční složky přes něj přechází. Pro reakce vyžadující intenzívní výměnu tepla se používají reaktory trubkové. Jedná se o reaktory drahé, kde i plnění trubek katalyzátorem je obtížné, protože každá trubka musí mít stejný hydraulický odpor.
20 4. Reaktory pro exotermní reakce v plynné fázi 4.1 Vysokotlaká radikálová polymerace ethylenu CH 2 CH 2 iniciátor kbar CH 2 CH o C Pozn. 1 at = 1,197 bar n H r = - 4 kj/kg Na jeden kg produktu se uvolní asi 4 kj, to znamená, že reakce je silně exotermní. Během reakce nesmí teplota přestoupit určitou mez. Proto je reaktor konstruován tak, že v první části se zahřívá na potřebnou počáteční (iniciační) teplotu a během reakce se pak vznikající teplo odvádí. Reakce se uskutečňuje v trubkovém reaktoru. Trubky jsou vyrobeny z legované ocele, vnitřního průměru okolo 5 cm a dlouhé 1-2 m. Iniciátorem jsou sloučeniny produkující tepelným rozkladem radikály, např. peroxidy či azosloučeniny. přívod iniciátoru M topné médium (termofor) M přívod ethylenu odvod reakční směsi Obr. 9 Trubkový reaktor pro vysokotlakou polymeraci ethenu chlazení
21 4.2 Termická chlorace methanu Termická chlorace se uskutečňuje při 2-7 C a tlaku vyšším než 1 bar. Z kinetického hlediska a z hlediska reakčního mechanismu se jedná o radikálovou řetězovou reakci: Cl o C 2Cl iniciace H r = 243 kj/mol Cl + CH 4 HCl + CH 3 CH 3 + Cl 2 CH 3 Cl + Cl CH 3 + Cl CH 3 Cl 2Cl Cl 2 propagace terminace H r = - 17 kj/mol H r = kj/mol 2CH 3 C 2 H 6 Výchozí reakční směs musí v reaktoru nejprve dosáhnout potřebnou teplotu, aby se dosáhlo disociace molekuly chlóru (disociační energie je HD = 243 kj/mol). Potom reakční směs nesmí překročit limitní teplotu, jinak by nastal nekontrolovatelný výbuch. Radikálové reakce jsou neselektivní a v tomto případě vzniká směs různě chlorovaných produktů dle schématu: CH 4 Cl 2, - HCl Cl 2, - HCl CH 3 Cl CH 2 Cl 2 Cl 2, - HCl CHCl 3 Cl 2, - HCl CCl 4 H r = kj/mol Při výrobě chloridu uhličitého se pracuje v trubkovém reaktoru, kdy prudkému průběhu reakce se zamezuje zřeďováním výchozích komponent produktem reakce. chlazení Cl 2 odvod reakční směsi CH 4 zpětný tokccl 4 Obr. 1 Trubkový reaktor pro výrobu chloridu uhličitého
22 Při chloracích do nižšího stupně (výroba CH3Cl, CH2Cl2) je základem pec, reaktor průměru 1-3 m, výšky 4-8 m, který pracuje v podstatě adiabaticky. Promíchávání reakční směsi zajišťují vestavěné přepážky. odvod reakční směsi porézní přepážka přívod CH 4 přívod Cl 2 Obr. 11 Adiabatický reaktor pro parciální chloraci methanu 5. Reaktory pro endotermní reakce v plynné fázi 5.1 Termické štěpení uhlovodíků Jedná se o jeden z nejdůležitějších příkladů výrob dvou základních produktů: výrobu ethylenu a acetylenu, kde stechiometrické rovnice jsou: 1 o C 3 CH 2 CH 2 + H 2 C 6 H 14 CH CH H r = 18 kj/mol 14 o C H 2 H r = 282 kj/mol Pracovní teplota pro dehydrogenaci a štěpení C-C vazeb je okolo 1 C. Výroba ethylenu z lehkého benzínu se uskutečňuje v trubkové peci, jejímž základem jsou trubky z Cr/Ni ocele, délky 5-2 m, vnitřního průměru 1 cm, umístěné v peci vyhřívané např. topným plynem.
23 přehřátá pára odvod reakční směsi vstup suroviny (lehký benzín) předehřívací zóna zóna nepřímého ohřevu přívod předehřátého vzduchu přívod topného plynu do hořáku Obr. 12 Pyrolýzní pec pro výrobu ethylenu Typické složení produktu pyrolýzy pro základní typy surovin je uvedeno v následující tabulce ( (Pozn.: Jelikož se pyrolýzou vznikající ethan vrací v rámci ethylenové jednotky vždy jako surovina na začátek do pyrolýzy, uvádějí se obvykle výtěžky ethylenu se zahrnutím té části ethylenu vzniklé pyrolýzou ethanu). Tabulka 5. Typické výtěžky hlavních produktů při pyrolýze vybraných surovin s recyklem etanu (% hmot.) *Výtěžky jsou silně závislé na složení LPG Surovina a její destilační rozmezí produkt ethan LPG* Primární benzín 3-17 C Plynový olej Ethylene Propylene C4 frakce Benzen Vakuový destilát z hydrokrakování C
24 Kapalné suroviny obsahují vždy aromatické uhlovodíky, ty se termicky dealkylují a v případě delších postranních řetězců poskytují rovněž (v malém výtěžku) ethylen. Jejich hlavní význam je však v tom, že pyrolýzní produkt obohacují o základní monoaromáty benzen, toluen a xyleny. Pyrolýzní produkt je tak často zdrojem pro výrobu čistých petrochemických aromátů zejména benzenu. Výsledkem pyrolýzy, neboli primárním produktem pyrolýzního reaktoru je soustava velkého počtu především nenasycených a aromatických uhlovodíků. Pro představu je tento tzv. výtěžkový vektor uveden v další tabulce. Tabulka 6. Obsah hlavních složek v primárním produktu pyrolýzy ethylenové jednotky v Unipetrolu RPA v Litvínově produkt Výtěžek % produkt Výtěžek % produkt Výtěžek % Vodík.57 Propin.68 C6-C Methan n-butan.68 Benzen 6.71 Ethan 4.7 Iso-butan.11 Toluen 4.4 Ethylen buten 1.24 Xyleny 1.56 Acetylen.63 2-buten 1.21 Ethylbenzen.16 Propan.75 Iso-buten 1.92 Styren 1 propylen ,3-butadien 5.89 C9-C Olej 2.5
25 Výroba acetylenu pyrolýzou je mnohem náročnější na množství potřebného tepla, které je nutné během reakce dodat. Zde by už nepřímý ohřev reakční směsi nestačil, a proto se provádí tzv. přímý ohřev, a to částečným spalováním výchozího lehkého benzínu, kdy vzniklé teplo štěpí nespálený uhlovodík na acetylen. Základem je hořák přibližně 1 m vysoký, kde se spalováním v pracovním prostoru docílí potřebné teploty 14 C. Protože se pracuje v oblasti výbušnosti reakční směsi, musí být rychlost plynu (2-3 m/s) vstupujícího do hořáku větší než rychlost šíření plamene. přívod kyslíku FE FE přívod suroviny (lehký benzín nebo methan) difuzor chlazení reakční směsi hořák 14 o C odvod reakční směsi Obr. 13 Reaktor pro výrobu acetylenu pyrolýzou methanu
26 6. Reaktory pro reakce v heterogenních fázích kapalina-kapalina Rychlost reakcí v heterogenních fázích je přímo úměrná stykové ploše obou fází (plocha pro výměnu hmoty). Z toho pramení nutnost velmi intenzivního míchání, aby v tomto případě emulze byla co nejjemnější. 6.1 Diskontinuální nitrace benzenu nitrační směs - H 2 O NO 2 H r = -117 kj/mol Jedná se o heterogenní soustavu, kde benzen (nitrobenzen) je organickou fází a nitrační směs (směs H2SO4/HNO3/H2O) je vodnou fází. Obě fáze jsou navzájem nemísitelné, takže rychlost nitrace je úměrná stykové ploše obou fází. Diskontinuální způsob nitrace se provádí v litinovém duplikátoru, opatřeném vrtulovým míchadlem. Do reaktoru se předloží benzen a pomalu se připouští nitrační směs (3 % HNO3, 6 % H2SO4, 1 % H2O). Reakční směs je chlazená průtokem vody v plášti na potřebnou teplotu. přívod nitrační směsi chlazení benzen spodní výpusť (dekantace, rafinace) Obr. 14 Reaktor pro diskontinuální nitraci benzenu.
27 6.2 Kontinuální nitrace benzenu Proces se může provádět v sérii tří průtokových míchaných reaktorů. Výhodou tohoto způsobu je, že se v daném okamžiku zpracovává malé množství reakční směsi (ekonomické a bezpečnostní hledisko), navíc v každém z reaktorů lze nastavit optimální podmínky reakce (postupně zvyšovat reakční teplotu a koncentraci nitrační směsi). benzen nitrační směs 3 C nitrační směs 5 C nitrační směs 6 C chladící médium Obr. 15 Kaskáda míchaných reaktorů pro kontinuální nitraci benzenu
28 7. Reaktory pro reakce v heterogenních fázích kapalina-plyn 7.1 Diskontinuální chlorace toluenu CH 3 CH 3 Cl 2, Fe/ FeCl 3 - HCl, 2 o C Opět je potřeba, aby styk fází byl co největší. Silně exotermní reakce se provádí tak, že do duplikátorového reaktoru opatřeného silným kotvovým míchadlem se předloží toluen a směs prachového železa a chloridu železitého. Za míchání se přivádí chlor a to takovou rychlostí, aby se reakční směs stačila uchladit na maximální teplotu 2 C. Přívod plynu je tvořen trubkou zakončenou fritou pro jemnou dispergaci plynu. Plyn se zavádí pod míchadlo. Na toto potrubí je také zapojen dusík na odstranění ( propláchnutí ) zbytků chloru po skončení reakce (z hlediska fází tento příklad není úplně čistý, protože se jedná o systém l + g + s). Cl přívod Cl 2 odtah HCl (alkalická absorbce) přívod N 2 chlazení spodní výpusť (rafinace r. směsi) Obr. 16 Reaktor pro diskontinuální chloraci toluenu
29 7.2 Parciální oxidace cyklohexanu na cyklohexanon, naftenátco 2+ O 2, 155 o C, 9 bar - H 2 O O Jedná se o exotermní radikálovou řetězovou oxidaci, která se uskutečňuje kontinuálně v kaskádě tří průtokových míchaných reaktorů. Vznikající teplo se odvádí varem reakční směsi (vazba mezi tlakem a teplotou varu), maximální selektivity se dosahuje při teplotě 155 C a tlaku 8-9 bar. Existence následných reakcí si žádá, aby konverze C6H6 nebyla úplná. separátor odplyn voda C6H6 vzduch zpracování Obr. 17 Kaskáda míchaných reaktorů pro oxidaci cyklohexanu
30 7.3 Parciální oxidace n-butanu na kyselinu octovou C 4 H 1, octan Co 2+ O 2, 17 o C, 5.4 MPa - H 2 O CH 3 COOH H r = -127 kj/mol Radikálová řetězová oxidační reakce je silně exotermní. Kapalná fáze je tvořena vyrobenou kyselinou octovou. Jako každá radikálová oxidace je tento proces neselektivní a vedlejšími reakcemi vznikají také aceton, methylethylketon a methyl- a ethylacetát. Jako reaktor je používán zvláštní typ kolony se zpětným promícháváním, kdy ve vnitřku kolony je vestavěna trubka, usnadňující lepší vedení teplotního režimu. V závislosti na vypracovaném technologickém postupu může být proces katalyzovaný octanem kobaltnatým, nebo bez katalýzy za vyššího tlaku (cca 8 MPa). Vzhledem k neselektivitě oxidace musí být konverze butanu pod 1 %. odvod plynných zplodin (dusík, atd.) roztok butanu v kys. octové chlazení kapalná reakční směs (rektifikace) M vzduch nebo kyslík Obr. 18 Kolonový probublávaný reaktor pro oxidaci butanu na kyselinu octovou
31 7.4 Výroba adiponitrilu z kyseliny adipové Proces se realizuje ve dvou fázích. Nejprve se do taveniny kyseliny adipové uvádí amoniak za vzniku amonné sole, produkt se pak čerpá do trubkového reaktoru, kde probíhá dehydratace. HOOC(CH 2 ) 4 COOH NH 3 3 o C H 4 NOOC(CH 2 ) 4 COONH 4 kat. H 3 PO 4 - H, 3 o 2 O C NC(CH 2 ) 4 CN H r = 21 kj/mol Kyselina fosforečná zde působí jako dehydratační katalyzátor. Vzhledem k řadě možných vedlejších reakcí se selektivita zvyšuje přebytkem amoniaku (objemový poměr g/l = 35). Zvýšení selektivity se docílí také malým prostorovým časem, to ovšem znamená dodat v krátkém čase dostatek tepla, protože reakce je endotermní s Hr = 21 kj.mol -1. přívod taveniny kys. adipové NH 3 odvod reakční směsi ke zpracování termofor adipát amonný H 3 PO 4 Obr. 19 Trubkový reaktor pro výrobu adiponitrilu
32 7.5 Výroba acetanhydridu z ketenu a kyseliny octové CH 3 COOH triethylfosfát CH 2 CO - H 2 O, 7 o C H r = 21 kj/mol CH 2 CH 3 COOH CO 13-2 mbar, 5 o C (CH 3 CO) 2 O H r = -85 kj/mol Proces probíhá ve dvou stupních. Nejprve se pyrolyzuje kys. octová na keten (7 C) za katalýzy triethylfosfátem za sníženého tlaku, pak se mísí keten s kyselinou octovou (5 C) a vzniká produkt. Reakce je slabě exotermní (Hr = -85 kj.mol -1 ). Jako reaktor se používá odstředivé lopatkové čerpadlo, které nasává kapalnou kyselinu octovou spolu s plynným ketenem a dokonale je směšuje ve své rotační části. Mírného podtlaku odstředivého čerpadla se používá proto, že keten při tlaku vyšším než,2 bar polymeruje a nelze proto použít např. kompresor pro natlačení ketenu do jiného typu reaktoru. CH 3 COOH odplyn CH 3 COOH CH 2 CO vzduch přívod topného plynu do hořáku produkt k rafinaci Obr. 2 Odstředivý reaktor pro výrobu acetanhydridu z ketenu
33 7.6 Výroba dodecylbenzensulfonové kyseliny z dodecylbenzenu C 12 H 25 C 12 H 25 SO 3 HO 3 S H r = -17 kj/mol Proces je příkladem pro použití filmového reaktoru. Reakce je exotermní (Hr = - 17 kj.mol -1 ) a probíhá velmi rychle, produkt je velmi viskózní a hrozí nebezpečí dalších následných reakcí, kde nečistoty hnědě zabarvují produkt. Aby byl proces dostatečně selektivní je třeba dodržet několik základních požadavků: - nutno naředit SO3 vzduchem na obsah 5-1 % - zajistit dobrý odvod tepla - krátký prostorový čas - co nejmenší zpětné promíchávání. Z výše uvedených důvodů se proto používá filmový reaktor. Kapalná fáze stéká v tenkém filmu po vnitřní stěně reaktoru (duplikovaný válec) a plyn protiproudně stoupá válcem. V podstatě zde neexistuje zpětné promíchávání. Teplotu filmu lze s velkou přesností udržovat na požadované hodnotě. dodecylbenzen chlazení SO 3 vzduch SO 3 k recyklaci reakční směs ke zpracování Obr. 21 Filmový reaktor pro sulfonaci dodecylbenzenu
34 8. Reaktory pro reakce v heterogenních fázích tuhá fáze-plyn Tyto reaktory používá hlavně anorganický průmysl, kde lze nalézt následující příklady: vysoké pece - výroba železa etážové reaktory a fluidní reaktory - pražení pyritu V organických výrobách lze uvést příklad Winklerova generátoru na výrobu vodního plynu. 9. Reaktory pro reakce v heterogenních fázích tuhá fáze-tuhá fáze Pro reakce v tuhých fázích lze v podstatě použít všechny typy sušáren a pecí, kontinuální i diskontinuální. V anorganickém průmyslu se např. pro výrobu cementu používá kontinuální reaktor - rotační pec. 9.1 Výroba kyseliny sulfanilové V organické technologii je příkladem reakce v tuhé fázi výroba kyseliny sulfanilové tak zvaným pečením. NH NH 3 HSO4 H 2 SO 4 - H, 19 o 2 O C NHSO 3 H NH 2 HO 3 S Anilin a kyselina sírová se smísí v ekvimolárním poměru v malaxeru a vzniklý sulfát (jeho vznik je silně exotermní) se umístí na železné plechy (maximální výška vrstvy cca 2 cm) v sušárně a vyhřejí na teplotu 19-2 C. Sušárna se evakuuje tak, aby se zlepšilo odstraňování reakční vody. Proces pečení je u konce, když je produkt rozpustný ve zředěném louhu. vacuum anilin H 2 SO 4 M sušárna chlazení expedice Obr. 22 Diskontinuální výroba kys. sulfanilové Kontinuální velkovýroba kyseliny sulfanilové se provádí tak, že se plechy se sulfátem anilinu umístí na vozíky, které projíždí tunelovou pecí, kde proudí přehřátý vzduch.
35 Pro produkci většího množství vsádkovým způsobem se používá také rotační sulfonátor ( pecivál ). Jeho výhodou je, že odpadá mísení surovin v malaxeru a následná manipulace se sušicími plechy. horký vzduch Obr. 23 Diskontinuální reaktor pro výrobu kyseliny sulfanilové Kontinuální způsob výroby kyseliny sulfanilové využívá dvou rotačních reaktorů (pecí), kde první reaktor slouží k výrobě sulfátu a druhý pak k vlastnímu pečení (velmi podobné pece se využívají k výrobě cementu). 9.2 Výroba ftalocyaninu suchou cestou z ftalodinitrilu Ftalocyanin mědi je velmi kvalitním modrým organickým pigmentem, který se například používá pro výrobu vypalovacích autolaků. CN CN Cu 2 Cl 2, Na 2 SO 4 - CuCl 2, 3 o C N N N N Cu N N N N Dobře rozemletá směs ftalodinitrilu, chloridu měďného a bezvodého síranu sodného se zahřívá na 14 C (ftalodinitril má teplotu tání 141 C). Vlastní reakce je exotermní a teplota samovolně stoupne na 26-3 C. Reakce je ukončena během 3-5 minut. Krátká reakční doba umožňuje kontinuální způsob výroby; ten se například uskutečňuje ve válcovém reaktoru:
36 mísič zachycení prchavých podílů zásobník směsi produkt Obr. 24 Mísič na kontinuální výrobu ftalocyaninu
37 1. Reaktory pro reakce plynné fáze na pevných katalyzátorech 1.1 Oxidace sirovodíku Procesu se využívá při likvidaci exhalací ze zpracování ropy. Oxidace probíhá na aktivním uhlí vzduchem. 2H2S + O2 S + 2H2O temperování na vstupní teplotu vrstva katalyzátoru rošt temperování na výstupní teplotu Obr. 25 Etážový reaktor pro katalytickou oxidaci sirovodíku Sulfan izolovaný z rafinérských plynů se většinou přeměňuje parciální katalytickou oxidací na síru. Tato reakce je silně exotermní a při zpracování plynů obsahujících větší koncentrace sulfanu byly potíže s odvodem tepla. Proto byly vyvinuty procesy, při nichž je sulfan na síru přeměňován ve dvou stupních (dvoustupňový Clausův proces).
38 Také tyto reakce jsou exotermní, ale ve dvoustupňových procesech lze tepelný režim snadněji kontrolovat. Kyselý plyn obsahující oxid uhličitý, sulfan a malé množství uhlovodíků je veden do pece, ve které je sulfan spalován jednou třetinou stechiometricky potřebného množství vzduchu při cca 12 C. Uvolněné teplo se využívá k výrobě vysokotlaké páry. Ochlazené reakční zplodiny obsahující síru ve formě SO2, H2S a elementární síry se ihned, případně po odloučení elementární síry, vedou do dvou za sebou zapojených katalytických konvertorů, kde při teplotě cca 25 C reaguje SO2 s H2S na elementární síru. Konvertory jsou naplněny katalyzátorem, kterým je např. oxid hlinitý s chrómem. V prvním stupni se dosahuje cca 85% a ve druhém stupni až 95 % konverze na elementární síru. Za každým konvertorem je zařazen kondenzátor, který slouží k oddělení kapalné síry. Část horkých plynů je odváděna neochlazená z pece a je použita ke zvýšení teploty hlavní části reakčních plynů před jejich vstupem do jednotlivých konvertorů. Teplota na výstupu z konvertorů musí být udržována nad rosným bodem síry (22-25 C) a teplota na výstupu z kondenzátorů nad cca 135 C, aby byla síra v kapalném stavu a nedocházelo k jejímu tuhnutí. Některé procesy mají tři konvertory. Schéma výroby síry Clausovým procesem (1 -spalovací komora, 2 -kotel na odpadní teplo, 3 -reaktor, 4 -kondenzátor, 5 -kompresor)
39 1.2 Katalytická hydrogenace fenolu na cyklohexanon OH Pd-kontakt O + 2 H 2 Páry fenolu jsou spolu s vodíkem vedeny přes kontaktní lože při teplotě C a při tlaku asi 1 bar. Jako katalyzátor se používá paladium nanesené v koncentraci,2-,5 % na nosiči zeolitického typu (molekulové síto). Výtěžek hydrogenace je přes 95 % při takřka totální konverzi výchozího fenolu. 1.3 Katalytická dehydrogenace cyklohexanolu na cyklohexanon Příkladem výroby používající trubkového reaktoru s pevným ložem katalyzátoru je katalytická dehydrogenace cyklohexanolu na cyklohexanon. OH O + H 2 Hr = 65 kj.mol -1 Čistý cyklohexanol se při atmosférickém tlaku vede do vyhřáté trubkové pece (4-45 C), kde se dehydrogenuje. Jako katalyzátor se používá Raney-Cu nebo Raney- Co, vyrobená ze slitiny příslušného kovu s hliníkem metodou loužení NaOH. Kromě toho se také používá jako dehydogenační katalyzátor směsi Cu/Cr2O Amoxidace propylenu na akrylonitril Příkladem použití reaktoru s pohyblivým ložem katalyzátoru je výroba akrylonitrilu amoxidací propylenu: NH 3, O 2, kat. Bi 2 O 3 / MoO 3 CH 2 CH CH 3 -H 2 O CH 2 CH CN H r = -5 kj/mol
40 Reakce je silně exotermní (Hr = -5 kj/mol). Používá se fluidní reaktor s částicemi katalyzátoru (oxidy kovů Bi2O3/MoO3 nebo UO2/Sb2O3) ve vznosu v proudu plynu nad roštem. Reakční směs musí být intenzivně chlazena. Obvykle je to vyřešeno cirkulací chladící směsi přes lože reaktoru a externí výměník tepla. Reaktor má zabudovaný cyklon pro záchyt katalyzátoru. Obr. 26 Fluidní reaktor pro katalytickou amoxidaci propylenu 1.5 Parciální oxidace o-xylenu na ftalanhydrid CH 3 CH O 2 35oC O C C O O + 3 H 2 O Pracuje se ve fluidním reaktoru s prostorovým časem 1-2 sekund. Jako výchozí látka může být použit také naftalen. Oxidačním činidlem je vzduch a katalyzátorem je V2O5 nanesený na silikagelu. Velikost částic katalyzátoru je okolo 3 m. Reakce je velmi silně exotermní (Hr = -11 kj/mol). Reakčního tepla se proto využívá podobně jako v předcházejícím případě k výrobě páry ve výměníku tepla.
41 11. Reaktory pro reakce v heterogenních fázích tuhá látka-kapalina-plyn Klasickými výrobami jsou hydrogenace vodíkem na kovových katalyzátorech, tuhou fázi představuje katalyzátor a hydrogenovaný substrát (nebo jeho roztok ve vhodném rozpouštědle) tvoří kapalnou fázi. Například hydrogenace tuků se uskutečňuje ve vsádkovém reaktoru opatřeném přívodem vodíku. Pro hydrogenace za tlaku se používají tzv. autoklávy: to jsou vsádkové reaktory (míchaný), pracující s tlakem až 2 bar Hydrogenace benzenu na cyklohexan v kapalné fázi H 2, kat. Ra-Ni 21 o C, 5 bar H r = -21 kj/mol Reakce je exotermní (Hr = -21 kj/mol). Jako katalyzátor se používá Raney-Ni. Teplota reakce nesmí přestoupit 23 C, aby neprobíhala následná isomerační reakce na methylcyklopentan (silně snižuje selektivitu procesu, navíc velmi podobná teplota varu značně ztěžuje izolaci produktu). Proto se používá kontinuální reaktor s dvojí regulací teploty. Kvůli selektivitě činí konverze benzenu 95%, zbývajících 5% se dohydrogenuje v druhém reaktoru v plynné fázi na pevném loži. H2 produkt (X = 95 %) benzen Ra-Ni vodík suspenze Ra-niklu se přečerpává Obr. 27 Autokláv pro diskontinuální hydrogenaci
42 11.2 Nízkotlaká polymerace ethenu Dalším zajímavým příkladem kontinuální výroby ve fázích s+l+g je nízkotlaká polymerace ethylenu. Provádí se v rozpouštědle za heterogenní katalýzy Zieglerovými katalyzátory Al(alkyl)3 v cirkulačním reaktoru. Reakční teplota je cca 6 C a tlak od 1 do 3 bar. Obr. 28 Cirkulační reaktor pro nízkotlakou polymeraci ethenu (ULLMANNS ENCYCLOPADIE DER TECHNISCHEN CHEMIE, 3, Verlag Chemie, Weinheim, 1973.).
Obsah Úvod 3 1 Konstrukční materiály 3 2 Základní charakteristiky chemické reakce 4 3 Základní typy reaktorů 7 3.1 Látková bilance vsádkového
 REAKTORY V ORGANICKÉ TECHNOLOGII Literatura: 1 Weissermel K., Arpe H. J.: Průmyslová organická chemie,1984 SNTL, Praha. 2 Hrdina R.: Organická technologie, www.upce.cz/fcht/uocht/informace.html, nebo http://www.upce.cz/fcht/uocht/spektrum.html
REAKTORY V ORGANICKÉ TECHNOLOGII Literatura: 1 Weissermel K., Arpe H. J.: Průmyslová organická chemie,1984 SNTL, Praha. 2 Hrdina R.: Organická technologie, www.upce.cz/fcht/uocht/informace.html, nebo http://www.upce.cz/fcht/uocht/spektrum.html
Vícefázové reaktory. Probublávaný reaktor plyn kapalina katalyzátor. Zuzana Tomešová
 Vícefázové reaktory Probublávaný reaktor plyn kapalina katalyzátor Zuzana Tomešová 2008 Probublávaný reaktor plyn - kapalina - katalyzátor Hydrogenace méně těkavých látek za vyššího tlaku Kolony naplněné
Vícefázové reaktory Probublávaný reaktor plyn kapalina katalyzátor Zuzana Tomešová 2008 Probublávaný reaktor plyn - kapalina - katalyzátor Hydrogenace méně těkavých látek za vyššího tlaku Kolony naplněné
Kolik energie by se uvolnilo, kdyby spalování ethanolu probíhalo při teplotě o 20 vyšší? Je tato energie menší nebo větší než při teplotě 37 C?
 TERMOCHEMIE Reakční entalpie při izotermním průběhu reakce, rozsah reakce 1 Kolik tepla se uvolní (nebo spotřebuje) při výrobě 2,2 kg acetaldehydu C 2 H 5 OH(g) = CH 3 CHO(g) + H 2 (g) (a) při teplotě
TERMOCHEMIE Reakční entalpie při izotermním průběhu reakce, rozsah reakce 1 Kolik tepla se uvolní (nebo spotřebuje) při výrobě 2,2 kg acetaldehydu C 2 H 5 OH(g) = CH 3 CHO(g) + H 2 (g) (a) při teplotě
Ropa Kondenzované uhlovodíky
 Nejdůležitější surovina pro výrobu organických sloučenin Nejvýznamnější surovina světové ekonomiky Výroba energie Chemické zpracování - 15 % Cena a zásoby ropy (70-100 let) Ropné krize Nutnost hledání
Nejdůležitější surovina pro výrobu organických sloučenin Nejvýznamnější surovina světové ekonomiky Výroba energie Chemické zpracování - 15 % Cena a zásoby ropy (70-100 let) Ropné krize Nutnost hledání
10. Chemické reaktory
 10. Chemické reaktory V každé chemické technologii je základní/nejvýznamnější zařízení pro provedení chemické reakce chemický reaktor. Celý technologický proces se skládá v podstatě ze tří typů zařízení:
10. Chemické reaktory V každé chemické technologii je základní/nejvýznamnější zařízení pro provedení chemické reakce chemický reaktor. Celý technologický proces se skládá v podstatě ze tří typů zařízení:
H H C C C C C C H CH 3 H C C H H H H H H
 Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Reaktory pro systém plyn kapalina
 FCHT Reaktory pro systém plyn kapalina Lubomír Krabáč 1 Probublávané reaktory: příklady procesů oxidace organických látek kyslíkem, resp. vzduchem chlorace hydrogenace org. látek s homogenním katal. vyšších
FCHT Reaktory pro systém plyn kapalina Lubomír Krabáč 1 Probublávané reaktory: příklady procesů oxidace organických látek kyslíkem, resp. vzduchem chlorace hydrogenace org. látek s homogenním katal. vyšších
Reaktory pro systém plyn-kapalina
 Reaktory pro systém plyn-kapalina Vypracoval : Jan Horáček FCHT, ústav 111 Prováděné reakce Rychlé : všechen absorbovaný plyn zreaguje již na fázovém rozhraní (př. : absorpce kyselých plynů : CO 2, H 2
Reaktory pro systém plyn-kapalina Vypracoval : Jan Horáček FCHT, ústav 111 Prováděné reakce Rychlé : všechen absorbovaný plyn zreaguje již na fázovém rozhraní (př. : absorpce kyselých plynů : CO 2, H 2
Třífázové trubkové reaktory se zkrápěným ložem katalyzátoru. Předmět: Vícefázové reaktory Jméno: Veronika Sedláková
 Třífázové trubkové reaktory se zkrápěným ložem katalyzátoru Předmět: Vícefázové reaktory Jméno: Veronika Sedláková 3-fázové reakce Autoklávy (diskontinuální) Trubkové reaktory (kontinuální) Probublávané
Třífázové trubkové reaktory se zkrápěným ložem katalyzátoru Předmět: Vícefázové reaktory Jméno: Veronika Sedláková 3-fázové reakce Autoklávy (diskontinuální) Trubkové reaktory (kontinuální) Probublávané
TVORBA UHLÍKATÝCH PRODUKTŮ PŘI I PYROLÝZE UHLOVODÍKŮ
 TVORBA UHLÍKATÝCH PRODUKTŮ PŘI I PYROLÝZE UHLOVODÍKŮ Martin Hrádel 5. ročník Školitel: Doc. Ing. Zdeněk Bělohlav, CSc. Obsah Úvod Mechanismus vzniku a vlastnosti uhlíkatých produktů Provozního sledování
TVORBA UHLÍKATÝCH PRODUKTŮ PŘI I PYROLÝZE UHLOVODÍKŮ Martin Hrádel 5. ročník Školitel: Doc. Ing. Zdeněk Bělohlav, CSc. Obsah Úvod Mechanismus vzniku a vlastnosti uhlíkatých produktů Provozního sledování
Třífázové trubkové reaktory se zkrápěným ložem katalyzátoru. Roman Snop
 Třífázové trubkové reaktory se zkrápěným ložem katalyzátoru Roman Snop Charakteristika Zkrápěné reaktory jsou nejvhodněji aplikovatelné na provoz heterogenně katalyzovaných reakcí. Nacházejí uplatnění
Třífázové trubkové reaktory se zkrápěným ložem katalyzátoru Roman Snop Charakteristika Zkrápěné reaktory jsou nejvhodněji aplikovatelné na provoz heterogenně katalyzovaných reakcí. Nacházejí uplatnění
Bilan a ce c zák á l k ad a ní pojm j y m aplikace zákonů o zachování čehokoli 10.10.2008 3
 Výpočtový seminář z Procesního inženýrství podzim 2008 Bilance Materiálové a látkové 10.10.2008 1 Tématické okruhy bilance - základní pojmy bilanční schéma způsoby vyjadřování koncentrací a přepočtové
Výpočtový seminář z Procesního inženýrství podzim 2008 Bilance Materiálové a látkové 10.10.2008 1 Tématické okruhy bilance - základní pojmy bilanční schéma způsoby vyjadřování koncentrací a přepočtové
Autokláv reaktor pro promíchávané vícefázové reakce
 Vysoká škola chemicko technologická v Praze Ústav organické technologie (111) Autokláv reaktor pro promíchávané vícefázové reakce Vypracoval : Bc. Tomáš Sommer Předmět: Vícefázové reaktory (prof. Ing.
Vysoká škola chemicko technologická v Praze Ústav organické technologie (111) Autokláv reaktor pro promíchávané vícefázové reakce Vypracoval : Bc. Tomáš Sommer Předmět: Vícefázové reaktory (prof. Ing.
Bezpečnostní inženýrství - Chemické procesy -
 Bezpečnostní inženýrství - Chemické procesy - M. Jahoda Nebezpečí a prevence chemických procesů 2 Chemické reakce Tepelné efekty exotermní procesy (teplo se uvolňuje => nutnost chlazení) endotermní procesy
Bezpečnostní inženýrství - Chemické procesy - M. Jahoda Nebezpečí a prevence chemických procesů 2 Chemické reakce Tepelné efekty exotermní procesy (teplo se uvolňuje => nutnost chlazení) endotermní procesy
Bezpečnost chemických výrob N111001
 Bezpečnost chemických výrob N111001 Petr Zámostný místnost: A-72a tel.: 4222 e-mail: petr.zamostny@vscht.cz Specifická rizika chemických reakcí Reaktivita látek Laboratorní měření reaktivity Reaktory s
Bezpečnost chemických výrob N111001 Petr Zámostný místnost: A-72a tel.: 4222 e-mail: petr.zamostny@vscht.cz Specifická rizika chemických reakcí Reaktivita látek Laboratorní měření reaktivity Reaktory s
Zplyňování biomasy. Sesuvný generátor. Autotermní zplyňování Autotermní a alotermní zplyňování
 Zplyňování = termochemická přeměna uhlíkatého materiálu v pevném či kapalném skupenství na výhřevný energetický plyn pomocí zplyňovacích médií a tepla. Produktem je plyn obsahující výhřevné složky (H 2,
Zplyňování = termochemická přeměna uhlíkatého materiálu v pevném či kapalném skupenství na výhřevný energetický plyn pomocí zplyňovacích médií a tepla. Produktem je plyn obsahující výhřevné složky (H 2,
Omezování plynných emisí. Ochrana ovzduší ZS 2012/2013
 Omezování plynných emisí Ochrana ovzduší ZS 2012/2013 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Omezování plynných emisí Ochrana ovzduší ZS 2012/2013 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Výzkum vlivu přenosových jevů na chování reaktoru se zkrápěným ložem katalyzátoru. Petr Svačina
 Výzkum vlivu přenosových jevů na chování reaktoru se zkrápěným ložem katalyzátoru Petr Svačina I. Vliv difuze vodíku tekoucím filmem kapaliny na průběh katalytické hydrogenace ve zkrápěných reaktorech
Výzkum vlivu přenosových jevů na chování reaktoru se zkrápěným ložem katalyzátoru Petr Svačina I. Vliv difuze vodíku tekoucím filmem kapaliny na průběh katalytické hydrogenace ve zkrápěných reaktorech
zpracování těžkých frakcí na motorová paliva (mazut i vakuový zbytek)
 Ropa štěpné procesy zpracování těžkých frakcí na motorová paliva (mazut i vakuový zbytek) typy štěpných procesů: - termické krakování - katalytické krakování - hydrogenační krakování (hydrokrakování) podmínky
Ropa štěpné procesy zpracování těžkých frakcí na motorová paliva (mazut i vakuový zbytek) typy štěpných procesů: - termické krakování - katalytické krakování - hydrogenační krakování (hydrokrakování) podmínky
9. Chemické reakce Kinetika
 Základní pojmy Kinetické rovnice pro celistvé řády Katalýza Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti reakční mechanismus elementární reakce a molekularita reakce reakční rychlost
Základní pojmy Kinetické rovnice pro celistvé řády Katalýza Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti reakční mechanismus elementární reakce a molekularita reakce reakční rychlost
Zadání příkladů řešených na výpočetních cvičeních z Fyzikální chemie I, obor CHTP. Termodynamika. Příklad 10
 Zadání příkladů řešených na výpočetních cvičeních z Fyzikální chemie I, obor CHTP Termodynamika Příklad 1 Stláčením ideálního plynu na 2/3 původního objemu vzrostl při stálé teplotě jeho tlak na 15 kpa.
Zadání příkladů řešených na výpočetních cvičeních z Fyzikální chemie I, obor CHTP Termodynamika Příklad 1 Stláčením ideálního plynu na 2/3 původního objemu vzrostl při stálé teplotě jeho tlak na 15 kpa.
Bezpečnost chemických výrob N Petr Zámostný místnost: A-72a tel.:
 Bezpečnost chemických výrob N111001 Petr Zámostný místnost: A-72a tel.: 4222 e-mail: petr.zamostny@vscht.cz Specifická rizika chemických reakcí Reaktivita látek Laboratorní měření reaktivity Reaktory s
Bezpečnost chemických výrob N111001 Petr Zámostný místnost: A-72a tel.: 4222 e-mail: petr.zamostny@vscht.cz Specifická rizika chemických reakcí Reaktivita látek Laboratorní měření reaktivity Reaktory s
kde k c(no 2) = 2, m 6 mol 2 s 1. Jaká je hodnota rychlostní konstanty v rychlostní rovnici ? V [k = 1, m 6 mol 2 s 1 ]
![kde k c(no 2) = 2, m 6 mol 2 s 1. Jaká je hodnota rychlostní konstanty v rychlostní rovnici ? V [k = 1, m 6 mol 2 s 1 ] kde k c(no 2) = 2, m 6 mol 2 s 1. Jaká je hodnota rychlostní konstanty v rychlostní rovnici ? V [k = 1, m 6 mol 2 s 1 ]](/thumbs/98/135866737.jpg) KINETIKA JEDNODUCHÝCH REAKCÍ Různé vyjádření reakční rychlosti a rychlostní konstanty 1 Rychlost reakce, rychlosti přírůstku a úbytku jednotlivých složek Rozklad kyseliny dusité je popsán stechiometrickou
KINETIKA JEDNODUCHÝCH REAKCÍ Různé vyjádření reakční rychlosti a rychlostní konstanty 1 Rychlost reakce, rychlosti přírůstku a úbytku jednotlivých složek Rozklad kyseliny dusité je popsán stechiometrickou
Alkany a cykloalkany
 Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Září 2010 Mgr. Alena Jirčáková Charakteristika alkanů: Malá reaktivita, odolné chemickým činidlům Nasycené
Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Září 2010 Mgr. Alena Jirčáková Charakteristika alkanů: Malá reaktivita, odolné chemickým činidlům Nasycené
Omezování plynných emisí. Ochrana ovzduší ZS 2010/2011
 Omezování plynných emisí Ochrana ovzduší ZS 2010/2011 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Omezování plynných emisí Ochrana ovzduší ZS 2010/2011 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Termochemie. Katedra materiálového inženýrství a chemie A Ing. Martin Keppert Ph.D.
 Termochemie Ing. Martin Keppert Ph.D. Katedra materiálového inženýrství a chemie keppert@fsv.cvut.cz A 329 http://tpm.fsv.cvut.cz/ Termochemie: tepelné jevy při chemických reakcích Chemická reakce: CH
Termochemie Ing. Martin Keppert Ph.D. Katedra materiálového inženýrství a chemie keppert@fsv.cvut.cz A 329 http://tpm.fsv.cvut.cz/ Termochemie: tepelné jevy při chemických reakcích Chemická reakce: CH
ÚPRAVA VODY V ENERGETICE. Ing. Jiří Tomčala
 ÚPRAVA VODY V ENERGETICE Ing. Jiří Tomčala Úvod Voda je v elektrárnách po palivu nejdůležitější surovinou Její množství v provozních systémech elektráren je mnohonásobně větší než množství spotřebovaného
ÚPRAVA VODY V ENERGETICE Ing. Jiří Tomčala Úvod Voda je v elektrárnách po palivu nejdůležitější surovinou Její množství v provozních systémech elektráren je mnohonásobně větší než množství spotřebovaného
Inovace bakalářského studijního oboru Aplikovaná chemie CZ.1.07/2.2.00/ Výpočty z chemických vzorců
 Výpočty z chemických vzorců 1. Hmotnost kyslíku je 80 g. Vypočítejte : a) počet atomů kyslíku ( 3,011 10 atomů) b) počet molů kyslíku (2,5 mol) c) počet molekul kyslíku (1,505 10 24 molekul) d) objem (dm
Výpočty z chemických vzorců 1. Hmotnost kyslíku je 80 g. Vypočítejte : a) počet atomů kyslíku ( 3,011 10 atomů) b) počet molů kyslíku (2,5 mol) c) počet molekul kyslíku (1,505 10 24 molekul) d) objem (dm
NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE. Ing. Stanislav HONUS
 NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE Ing. Stanislav HONUS ORGANICKÝ MATERIÁL Spalování Chemické přeměny Chem. přeměny ve vodním prostředí Pyrolýza Zplyňování Chemické Biologické Teplo
NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE Ing. Stanislav HONUS ORGANICKÝ MATERIÁL Spalování Chemické přeměny Chem. přeměny ve vodním prostředí Pyrolýza Zplyňování Chemické Biologické Teplo
Průmysl dusíku. amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin. NaClO NaOH CO(NH 2 ) 2.
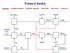 Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
5. CHEMICKÉ REAKTORY
 5. CHEMICÉ REAORY 5.1 IZOERMNÍ REAORY... 5.1.1 Diskontinuální reaktory... 5.1. Průtočné reaktory... 5.1..1 Průtočné reaktory s pístovým tokem... 5.1.. Průtočné reaktory s dokonale promíchávaným obsahem...4
5. CHEMICÉ REAORY 5.1 IZOERMNÍ REAORY... 5.1.1 Diskontinuální reaktory... 5.1. Průtočné reaktory... 5.1..1 Průtočné reaktory s pístovým tokem... 5.1.. Průtočné reaktory s dokonale promíchávaným obsahem...4
Úlohy: 1) Vypočítejte tepelné zabarvení dané reakce z následujících dat: C 2 H 4(g) + H 2(g) C 2 H 6(g)
 Úlohy: 1) Vypočítejte tepelné zabarvení dané reakce z následujících dat: C 2 H 4(g) + H 2(g) C 2 H 6(g) C 2 H 4(g) + 3O 2(g ) 2CO 2(g) +2H 2 O (l) H 0 298,15 = -1410,9kJ.mol -1 2C 2 H 6(g) + 7O 2(g) 4CO
Úlohy: 1) Vypočítejte tepelné zabarvení dané reakce z následujících dat: C 2 H 4(g) + H 2(g) C 2 H 6(g) C 2 H 4(g) + 3O 2(g ) 2CO 2(g) +2H 2 O (l) H 0 298,15 = -1410,9kJ.mol -1 2C 2 H 6(g) + 7O 2(g) 4CO
Fosfor a sloučeniny fosforu. Suroviny. Sloučeniny. kalcinace pro oddělení organických. Kyselina trihydrogenfosforečná H3PO4
 Fosfor a sloučeniny fosforu Sloučeniny Fosfor bílý Kyselina trihydrogenfosforečná H3PO4 Suroviny Apatit Ca5 (PO4)3(F, OH, Cl) fluoroapatity úpravy mletí promývání sítování magnetické oddělování oxidů železa
Fosfor a sloučeniny fosforu Sloučeniny Fosfor bílý Kyselina trihydrogenfosforečná H3PO4 Suroviny Apatit Ca5 (PO4)3(F, OH, Cl) fluoroapatity úpravy mletí promývání sítování magnetické oddělování oxidů železa
Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška Rafinace pohonných hmot, zpracování sulfanu, výroba vodíku
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška Rafinace pohonných hmot, zpracování sulfanu, výroba vodíku
Složení soustav (roztoky, koncentrace látkového množství)
 VZOROVÉ PŘÍKLADY Z CHEMIE A DOPORUČENÁ LITERATURA pro přípravu k přijímací zkoušce studijnímu oboru Nanotechnologie na VŠB TU Ostrava Doporučená literatura z chemie: Prakticky jakákoliv celostátní učebnice
VZOROVÉ PŘÍKLADY Z CHEMIE A DOPORUČENÁ LITERATURA pro přípravu k přijímací zkoušce studijnímu oboru Nanotechnologie na VŠB TU Ostrava Doporučená literatura z chemie: Prakticky jakákoliv celostátní učebnice
KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení. Ing. Miroslav Richter, PhD.
 KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení Ing. Miroslav Richter, PhD., EUR ING 2014 Materiálové bilance 3.5.1 Do tkaninového filtru vstupuje 10000
KTEV Fakulty životního prostředí UJEP v Ústí n.l. Průmyslové technologie 3 příklady pro cvičení Ing. Miroslav Richter, PhD., EUR ING 2014 Materiálové bilance 3.5.1 Do tkaninového filtru vstupuje 10000
Chemie. Mgr. Petra Drápelová Mgr. Jaroslava Vrbková. Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou
 Chemie Mgr. Petra Drápelová Mgr. Jaroslava Vrbková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH ROVNIC VY_32_INOVACE_03_3_18_CH Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH
Chemie Mgr. Petra Drápelová Mgr. Jaroslava Vrbková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH ROVNIC VY_32_INOVACE_03_3_18_CH Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH
Chemická kinetika. Chemické změny probíhající na úrovni atomárně molekulové nazýváme reakční mechanismus.
 Chemická kinetika Chemická reakce: děj mezi jednotlivými atomy a molekulami, při kterých zanikají některé vazby v molekulách výchozích látek a jsou nahrazovány vazbami v molekulách nově vznikajících látek.
Chemická kinetika Chemická reakce: děj mezi jednotlivými atomy a molekulami, při kterých zanikají některé vazby v molekulách výchozích látek a jsou nahrazovány vazbami v molekulách nově vznikajících látek.
2. KINETICKÁ ANALÝZA HOMOGENNÍCH REAKCÍ
 2. KINETICKÁ ANALÝZA HOMOGENNÍCH REAKCÍ Úloha 2-1 Řád reakce a rychlostní konstanta integrální metodou stupeň přeměny... 2 Úloha 2-2 Řád reakce a rychlostní konstanta integrální metodou... 2 Úloha 2-3
2. KINETICKÁ ANALÝZA HOMOGENNÍCH REAKCÍ Úloha 2-1 Řád reakce a rychlostní konstanta integrální metodou stupeň přeměny... 2 Úloha 2-2 Řád reakce a rychlostní konstanta integrální metodou... 2 Úloha 2-3
= 2,5R 1,5R =1,667 T 2 =T 1. W =c vm W = ,5R =400,23K. V 1 =p 2. p 1 V 2. =p 2 R T. p 2 p 1 1 T 1 =p 2 1 T 2. =p 1 T 1,667 = ,23
 15-17 Jeden mol argonu, o kterém budeme předpokládat, že se chová jako ideální plyn, byl adiabaticky vratně stlačen z tlaku 100 kpa na tlak p 2. Počáteční teplota byla = 300 K. Kompresní práce činila W
15-17 Jeden mol argonu, o kterém budeme předpokládat, že se chová jako ideální plyn, byl adiabaticky vratně stlačen z tlaku 100 kpa na tlak p 2. Počáteční teplota byla = 300 K. Kompresní práce činila W
Fentonova oxidace ve zkrápěném reaktoru za kontinuálního a periodického nástřiku
 Fentonova oxidace ve zkrápěném reaktoru za kontinuálního a periodického nástřiku Autor: Uhlíř David Ročník: 5. Školitel: doc.ing. Vratislav Tukač, CSc. Ústav organické technologie 2005 Úvod Odpadní vody
Fentonova oxidace ve zkrápěném reaktoru za kontinuálního a periodického nástřiku Autor: Uhlíř David Ročník: 5. Školitel: doc.ing. Vratislav Tukač, CSc. Ústav organické technologie 2005 Úvod Odpadní vody
Třídění látek. Chemie 1.KŠPA
 Třídění látek Chemie 1.KŠPA Systém (soustava) Vymezím si kus prostoru, látky v něm obsažené nazýváme systém soustava okolí svět Stěny soustavy Soustava může být: Izolovaná = stěny nedovolí výměnu částic
Třídění látek Chemie 1.KŠPA Systém (soustava) Vymezím si kus prostoru, látky v něm obsažené nazýváme systém soustava okolí svět Stěny soustavy Soustava může být: Izolovaná = stěny nedovolí výměnu částic
Bezpečnost chemických výrob N111001
 Bezpečnost chemických výrob N111 Petr Zámostný místnost: A-72a tel.: 4222 e-mail: petr.zamostny@vscht.cz Rizika spojená s hořlavými látkami Povaha procesů hoření a výbuchu Požární charakteristiky látek
Bezpečnost chemických výrob N111 Petr Zámostný místnost: A-72a tel.: 4222 e-mail: petr.zamostny@vscht.cz Rizika spojená s hořlavými látkami Povaha procesů hoření a výbuchu Požární charakteristiky látek
Kyselina dusičná. jedna z nejdůležitějších chemikálií
 Kyselina dusičná jedna z nejdůležitějších chemikálií Výroba: minulost - surovinou pro průmyslovou výrobu dusičnan sodný (ledek sodný, guano) současnost - katalytické spalování amoniaku (první výrobní jednotka
Kyselina dusičná jedna z nejdůležitějších chemikálií Výroba: minulost - surovinou pro průmyslovou výrobu dusičnan sodný (ledek sodný, guano) současnost - katalytické spalování amoniaku (první výrobní jednotka
ZÁKLADNÍ CHEMICKÉ VÝPOČTY
 ZÁKLADNÍ CHEMICKÉ VÝPOČTY Látkové množství - vyjadřování množství: jablka pivo chleba uhlí - (téměř každá míra má svojí jednotku) v chemii existuje univerzální veličina pro vyjádření množství látky LÁTKOVÉ
ZÁKLADNÍ CHEMICKÉ VÝPOČTY Látkové množství - vyjadřování množství: jablka pivo chleba uhlí - (téměř každá míra má svojí jednotku) v chemii existuje univerzální veličina pro vyjádření množství látky LÁTKOVÉ
1. PROCES A PODMÍNKY HOŘENÍ, HOŘLAVÉ LÁTKY
 1. PROCES A PODMÍNKY HOŘENÍ, HOŘLAVÉ LÁTKY V této kapitole se dozvíte: Jak lze definovat hoření? Jak lze vysvětlit proces hoření? Jaké jsou základní podmínky pro hoření? Co jsou hořlavé látky (hořlaviny)
1. PROCES A PODMÍNKY HOŘENÍ, HOŘLAVÉ LÁTKY V této kapitole se dozvíte: Jak lze definovat hoření? Jak lze vysvětlit proces hoření? Jaké jsou základní podmínky pro hoření? Co jsou hořlavé látky (hořlaviny)
1. Termochemie - příklady 1. ročník
 1. Termochemie - příklady 1. ročník 1.1. Urči reakční teplo reakce: C (g) + 1/2 O 2 (g) -> CO (g), ΔH 1 =?, známe-li C (g) + O 2 (g) -> CO 2 (g) ΔH 2 = -393,7 kj/mol CO (g) + 1/2 O 2 -> CO 2 (g) ΔH 3 =
1. Termochemie - příklady 1. ročník 1.1. Urči reakční teplo reakce: C (g) + 1/2 O 2 (g) -> CO (g), ΔH 1 =?, známe-li C (g) + O 2 (g) -> CO 2 (g) ΔH 2 = -393,7 kj/mol CO (g) + 1/2 O 2 -> CO 2 (g) ΔH 3 =
TERMICKÉ PROCESY PŘI VYUŽITÍ ALTERNATIVNÍCH SUROVIN. Most, 13.6.2013 Autor: Doc. Ing. J.LEDERER, CSc.
 TERMICKÉ PROCESY PŘI VYUŽITÍ ALTERNATIVNÍCH SUROVIN Most, 13.6.2013 Autor: Doc. Ing. J.LEDERER, CSc. OBSAH PRINCIPY POUŽÍVANÝCH TERMOCHEMICKÝCH PROCESŮ VELKOKAPACITNÍ REALIZACE TERMOCHEMICKÝCH PROCESŮ
TERMICKÉ PROCESY PŘI VYUŽITÍ ALTERNATIVNÍCH SUROVIN Most, 13.6.2013 Autor: Doc. Ing. J.LEDERER, CSc. OBSAH PRINCIPY POUŽÍVANÝCH TERMOCHEMICKÝCH PROCESŮ VELKOKAPACITNÍ REALIZACE TERMOCHEMICKÝCH PROCESŮ
Energie v chemických reakcích
 Energie v chemických reakcích Energetická bilance reakce CH 4 + Cl 2 = CH 3 Cl + HCl rozštěpení vazeb vznik nových vazeb V chemických reakcích dochází ke změně vazeb mezi atomy. Vazebná energie uvolnění
Energie v chemických reakcích Energetická bilance reakce CH 4 + Cl 2 = CH 3 Cl + HCl rozštěpení vazeb vznik nových vazeb V chemických reakcích dochází ke změně vazeb mezi atomy. Vazebná energie uvolnění
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: Číslo DUMu: VY_32_INOVACE_10_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné
 Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 12.02.2013 Číslo DUMu: VY_32_INOVACE_10_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Obecná
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 12.02.2013 Číslo DUMu: VY_32_INOVACE_10_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Obecná
Model dokonalého spalování pevných a kapalných paliv Teoretické základy spalování. Teoretické základy spalování
 Spalování je fyzikálně chemický pochod, při kterém probíhá organizovaná příprava hořlavé směsi paliva s okysličovadlem a jejich slučování (hoření) za intenzivního uvolňování tepla, což způsobuje prudké
Spalování je fyzikálně chemický pochod, při kterém probíhá organizovaná příprava hořlavé směsi paliva s okysličovadlem a jejich slučování (hoření) za intenzivního uvolňování tepla, což způsobuje prudké
Amoniak. 1913 průmyslová výroba syntetického amoniaku
 Amoniak 1913 průmyslová výroba syntetického amoniaku využití 20 % výroba dusíkatých hnojiv 80 % nejrůznější odvětví průmyslu (plasty, vlákna, výbušiny, hydrazin, aminy, amidy, nitrily a další organické
Amoniak 1913 průmyslová výroba syntetického amoniaku využití 20 % výroba dusíkatých hnojiv 80 % nejrůznější odvětví průmyslu (plasty, vlákna, výbušiny, hydrazin, aminy, amidy, nitrily a další organické
Denitrifikace. Ochrana ovzduší ZS 2012/2013
 Denitrifikace Ochrana ovzduší ZS 2012/2013 1 Úvod Pojem oxidy dusíku NO NO 2 Další formy NO x Vznik NO x 2 Vlastnosti NO Oxid dusnatý Vlastnosti M mol,no = 30,01 kg/kmol V mol,no,n = 22,41 m 3 /kmol ρ
Denitrifikace Ochrana ovzduší ZS 2012/2013 1 Úvod Pojem oxidy dusíku NO NO 2 Další formy NO x Vznik NO x 2 Vlastnosti NO Oxid dusnatý Vlastnosti M mol,no = 30,01 kg/kmol V mol,no,n = 22,41 m 3 /kmol ρ
CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N VÝROBA MTBE
 CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N409059 VÝROBA MTBE Fyzikální a chemické vlastnosti Suroviny Reakce Technologie Dvoustupňová výroba Jednostupňová výroba Charakteristiky technologií Zdroje
CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N409059 VÝROBA MTBE Fyzikální a chemické vlastnosti Suroviny Reakce Technologie Dvoustupňová výroba Jednostupňová výroba Charakteristiky technologií Zdroje
CHEMICKÉ VÝPOČTY I. ČÁST LÁTKOVÉ MNOŽSTVÍ. HMOTNOSTI ATOMŮ A MOLEKUL.
 CHEMICKÉ VÝPOČTY I. ČÁST LÁTKOVÉ MNOŽSTVÍ. HMOTNOSTI ATOMŮ A MOLEKUL. Látkové množství Značka: n Jednotka: mol Definice: Jeden mol je množina, která má stejný počet prvků, jako je atomů ve 12 g nuklidu
CHEMICKÉ VÝPOČTY I. ČÁST LÁTKOVÉ MNOŽSTVÍ. HMOTNOSTI ATOMŮ A MOLEKUL. Látkové množství Značka: n Jednotka: mol Definice: Jeden mol je množina, která má stejný počet prvků, jako je atomů ve 12 g nuklidu
Škola: Gymnázium, Brno, Slovanské náměstí 7 III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 VY_32_INOVACE_C.3.01 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT
VY_32_INOVACE_C.3.01 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT
5. PRŮTOČNÉ HOMOGENNÍ REAKTORY
 5. PRŮTOČNÉ HOMOGENNÍ REAKTORY Úloha 5-1 Diskontinuální a průtočný reaktor s pístovým tokem... 2 Úloha 5-2 Protisměrné reakce oboustranně prvého řádu, výpočet přeměny... 2 Úloha 5-3 Protisměrné reakce
5. PRŮTOČNÉ HOMOGENNÍ REAKTORY Úloha 5-1 Diskontinuální a průtočný reaktor s pístovým tokem... 2 Úloha 5-2 Protisměrné reakce oboustranně prvého řádu, výpočet přeměny... 2 Úloha 5-3 Protisměrné reakce
Paliva. nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování
 Paliva Paliva nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování Dělení paliv podle skupenství pevná uhlí, dřevo kapalná benzín,
Paliva Paliva nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování Dělení paliv podle skupenství pevná uhlí, dřevo kapalná benzín,
Úloha 1-39 Teplotní závislost rychlostní konstanty, reakce druhého řádu... 11
 1. ZÁKLADNÍ POJMY Úloha 1-1 Různé vyjádření reakční rychlosti rychlosti přírůstku a úbytku jednotlivých složek... 2 Úloha 1-2 Různé vyjádření reakční rychlosti změna celkového látkového množství... 2 Úloha
1. ZÁKLADNÍ POJMY Úloha 1-1 Různé vyjádření reakční rychlosti rychlosti přírůstku a úbytku jednotlivých složek... 2 Úloha 1-2 Různé vyjádření reakční rychlosti změna celkového látkového množství... 2 Úloha
N A = 6,023 10 23 mol -1
 Pro vyjadřování množství látky se v chemii zavádí veličina látkové množství. Značí se n, jednotkou je 1 mol. Látkové množství je jednou ze základních veličin soustavy SI. Jeden mol je takové množství látky,
Pro vyjadřování množství látky se v chemii zavádí veličina látkové množství. Značí se n, jednotkou je 1 mol. Látkové množství je jednou ze základních veličin soustavy SI. Jeden mol je takové množství látky,
Základy procesního inženýrství Program výpočtových cvičení
 Základy procesního inženýrství Program výpočtových cvičení zimní semestr 2007/2008 vyučující: L. Obalová, M. Večeř, K. Pacultová Literatura: 1) Holeček, O. Chemicko inženýrské tabulky, 2. vydání VŠCHT,
Základy procesního inženýrství Program výpočtových cvičení zimní semestr 2007/2008 vyučující: L. Obalová, M. Večeř, K. Pacultová Literatura: 1) Holeček, O. Chemicko inženýrské tabulky, 2. vydání VŠCHT,
2.4 Stavové chování směsí plynů Ideální směs Ideální směs reálných plynů Stavové rovnice pro plynné směsi
 1. ZÁKLADNÍ POJMY 1.1 Systém a okolí 1.2 Vlastnosti systému 1.3 Vybrané základní veličiny 1.3.1 Množství 1.3.2 Délka 1.3.2 Délka 1.4 Vybrané odvozené veličiny 1.4.1 Objem 1.4.2 Hustota 1.4.3 Tlak 1.4.4
1. ZÁKLADNÍ POJMY 1.1 Systém a okolí 1.2 Vlastnosti systému 1.3 Vybrané základní veličiny 1.3.1 Množství 1.3.2 Délka 1.3.2 Délka 1.4 Vybrané odvozené veličiny 1.4.1 Objem 1.4.2 Hustota 1.4.3 Tlak 1.4.4
Základy chemických technologií
 4. Přednáška Mísení a míchání MÍCHÁNÍ patří mezi nejvíc používané operace v chemickém průmyslu ( resp. příbuzných oborech, potravinářský, výroba kosmetiky, farmaceutických přípravků, ) hlavní cíle: odstranění
4. Přednáška Mísení a míchání MÍCHÁNÍ patří mezi nejvíc používané operace v chemickém průmyslu ( resp. příbuzných oborech, potravinářský, výroba kosmetiky, farmaceutických přípravků, ) hlavní cíle: odstranění
CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK
 CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK Význam stechiometrických koeficientů 2 H 2 (g) + O 2 (g) 2 H 2 O(l) Počet reagujících částic 2 molekuly vodíku reagují s 1 molekulou kyslíku za vzniku
CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK Význam stechiometrických koeficientů 2 H 2 (g) + O 2 (g) 2 H 2 O(l) Počet reagujících částic 2 molekuly vodíku reagují s 1 molekulou kyslíku za vzniku
Směsi a čisté látky, metody dělení
 Směsi a čisté látky, metody dělení LÁTKY Chemicky čisté látky Sloučeniny Chemické prvky Homogenní Roztoky pevné kapalné plynné Směsi Heterogenní Suspenze Emulze Pěna Aerosol Chemicky čisté látky: prvky
Směsi a čisté látky, metody dělení LÁTKY Chemicky čisté látky Sloučeniny Chemické prvky Homogenní Roztoky pevné kapalné plynné Směsi Heterogenní Suspenze Emulze Pěna Aerosol Chemicky čisté látky: prvky
Acidobazické děje - maturitní otázka z chemie
 Otázka: Acidobazické děje Předmět: Chemie Přidal(a): Žaneta Teorie kyselin a zásad: Arrhemiova teorie (1887) Kyseliny jsou látky, které odštěpují ve vodném roztoku proton vodíku H+ HA -> H+ + A- Zásady
Otázka: Acidobazické děje Předmět: Chemie Přidal(a): Žaneta Teorie kyselin a zásad: Arrhemiova teorie (1887) Kyseliny jsou látky, které odštěpují ve vodném roztoku proton vodíku H+ HA -> H+ + A- Zásady
TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ)
 TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ) 3. část ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Zpracoval: Tým autorů EVECO Brno, s.r.o. ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Množství SO 2, HCl,
TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ) 3. část ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Zpracoval: Tým autorů EVECO Brno, s.r.o. ODSTRANĚNÍ SO 2 A HCl ZE SPALIN Množství SO 2, HCl,
Výměna tepla může probíhat vedením (kondukcí), prouděním (konvekcí) nebo sáláním (zářením).
 10. VÝMĚNÍKY TEPLA Výměníky tepla jsou zařízení, ve kterých se jeden proud ohřívá a druhý ochlazuje sdílením tepla. Nezáleží přitom na konečném cíli operace, tj. zda chceme proud ochladit nebo ohřát, ani
10. VÝMĚNÍKY TEPLA Výměníky tepla jsou zařízení, ve kterých se jeden proud ohřívá a druhý ochlazuje sdílením tepla. Nezáleží přitom na konečném cíli operace, tj. zda chceme proud ochladit nebo ohřát, ani
Aplikované chemické procesy. Heterogenní nekatalyzované reakce
 plikované hemiké proesy Heterogenní nekatalyzované reake Heterogenní nekatalytiké reake plyn nebo kapalina dostávají do styku s tuhou látkou a reagují s ní, přičemž se tato látka mění v produkt. a ( tekutina
plikované hemiké proesy Heterogenní nekatalyzované reake Heterogenní nekatalytiké reake plyn nebo kapalina dostávají do styku s tuhou látkou a reagují s ní, přičemž se tato látka mění v produkt. a ( tekutina
Rozdělení uhlovodíků
 Rozdělení uhlovodíků 1/8 Alkany a cykloalkany Obecné vzorce: alkany C n H 2n+2, cykloalkany C n H 2n, kde n je přirozené číslo Homologický přírustek: - CH 2 - Alkany přímé ( n - alkany) rozvětvené Primární,
Rozdělení uhlovodíků 1/8 Alkany a cykloalkany Obecné vzorce: alkany C n H 2n+2, cykloalkany C n H 2n, kde n je přirozené číslo Homologický přírustek: - CH 2 - Alkany přímé ( n - alkany) rozvětvené Primární,
Technické plyny. kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny)
 Technické plyny kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny) Kapalný vzduch složení vzduchu Před zkapalněním odstranění nežádoucích složek, např. vodní pára, CO 2, prach Zkapalňování
Technické plyny kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny) Kapalný vzduch složení vzduchu Před zkapalněním odstranění nežádoucích složek, např. vodní pára, CO 2, prach Zkapalňování
Termochemie. Verze VG
 Termochemie Verze VG Termochemie Termochemie je oblast termodynamiky zabývající se studiem tepelného zabarvení chemických reakcí. Reakce, při kterých se teplo uvolňuje = exotermní. Reakce, při kterých
Termochemie Verze VG Termochemie Termochemie je oblast termodynamiky zabývající se studiem tepelného zabarvení chemických reakcí. Reakce, při kterých se teplo uvolňuje = exotermní. Reakce, při kterých
Gymnázium Vysoké Mýto nám. Vaňorného 163, Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto H 3 C Vymezení arenů V aromatickém cyklu dochází k průniku orbitalů kolmých k rovině cyklu. Vzniká tzv. delokalizovaná vazba π. Stabilita benzenu
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto H 3 C Vymezení arenů V aromatickém cyklu dochází k průniku orbitalů kolmých k rovině cyklu. Vzniká tzv. delokalizovaná vazba π. Stabilita benzenu
Zpracování ropy doc. Ing. Josef Blažek, CSc.
 ODBONÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PO VÝKON STÁTNÍ SPÁVY OCHANY OVZDUŠÍ V ČESKÉ EPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 2. přednáška Složení ropy, základní schémata zpracování ropy, odsolování a
ODBONÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PO VÝKON STÁTNÍ SPÁVY OCHANY OVZDUŠÍ V ČESKÉ EPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 2. přednáška Složení ropy, základní schémata zpracování ropy, odsolování a
Inovace profesní přípravy budoucích učitelů chemie
 Inovace profesní přípravy budoucích učitelů chemie I n v e s t i c e d o r o z v o j e v z d ě l á v á n í CZ.1.07/2.2.00/15.0324 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem
Inovace profesní přípravy budoucích učitelů chemie I n v e s t i c e d o r o z v o j e v z d ě l á v á n í CZ.1.07/2.2.00/15.0324 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem
Obsah Chemická reakce... 2 PL:
 Obsah Chemická reakce... 2 PL: Vyčíslení chemické rovnice - řešení... 3 Tepelný průběh chemické reakce... 4 Rychlost chemických reakcí... 4 Rozdělení chemických reakcí... 4 1 Chemická reakce děj, při němž
Obsah Chemická reakce... 2 PL: Vyčíslení chemické rovnice - řešení... 3 Tepelný průběh chemické reakce... 4 Rychlost chemických reakcí... 4 Rozdělení chemických reakcí... 4 1 Chemická reakce děj, při němž
rtuť při 0 o C = 470 mn m 1 15,45 17,90 19,80 21,28
 zkapalněné plyny - velmi nízké; např. helium 0354 mn m při teplotě 270 C vodík 2 mn m při teplotě 253 C roztavené kovy - velmi vysoké; např. měď při teplotě tání = 00 mn m organické látky při teplotě 25
zkapalněné plyny - velmi nízké; např. helium 0354 mn m při teplotě 270 C vodík 2 mn m při teplotě 253 C roztavené kovy - velmi vysoké; např. měď při teplotě tání = 00 mn m organické látky při teplotě 25
Destilace
 Výpočtový ý seminář z Procesního inženýrství podzim 2007 Destilace 18.9.2008 1 Tématické okruhy destilace - základní pojmy rovnováha kapalina - pára jednostupňová destilace rektifikace 18.9.2008 2 Destilace
Výpočtový ý seminář z Procesního inženýrství podzim 2007 Destilace 18.9.2008 1 Tématické okruhy destilace - základní pojmy rovnováha kapalina - pára jednostupňová destilace rektifikace 18.9.2008 2 Destilace
[ ] d[ Y] rychlost REAKČNÍ KINETIKA X Y
![[ ] d[ Y] rychlost REAKČNÍ KINETIKA X Y [ ] d[ Y] rychlost REAKČNÍ KINETIKA X Y](/thumbs/78/77051926.jpg) REAKČNÍ KINETIKA Faktory ovlivňující rychlost chemických reakcí Chemická povaha reaktantů - reaktivita Fyzikální stav reaktantů homogenní vs. heterogenní reakce Teplota 10 C zvýšení rychlosti 2x 3x zýšení
REAKČNÍ KINETIKA Faktory ovlivňující rychlost chemických reakcí Chemická povaha reaktantů - reaktivita Fyzikální stav reaktantů homogenní vs. heterogenní reakce Teplota 10 C zvýšení rychlosti 2x 3x zýšení
Reakční kinetika. Nauka zabývající se rychlostí chemických reakcí a ovlivněním rychlosti těchto reakcí
 Nauka zabývající se rychlostí chemických reakcí a ovlivněním rychlosti těchto reakcí Vymezení pojmů : chemická reakce je děj, při kterém zanikají výchozí látky a vznikají látky nové reakční mechanismus
Nauka zabývající se rychlostí chemických reakcí a ovlivněním rychlosti těchto reakcí Vymezení pojmů : chemická reakce je děj, při kterém zanikají výchozí látky a vznikají látky nové reakční mechanismus
Chemické veličiny, vztahy mezi nimi a chemické výpočty
 SBÍRKA ŘEŠENÝCH PŘÍKLADŮ PRO PROJEKT PŘÍRODNÍ VĚDY AKTIVNĚ A INTERAKTIVNĚ CZ.1.07/1.1.24/01.0040 Chemické veličiny, vztahy mezi nimi a chemické výpočty Mgr. Jana Žůrková, 2013, 20 stran Obsah 1. Veličiny
SBÍRKA ŘEŠENÝCH PŘÍKLADŮ PRO PROJEKT PŘÍRODNÍ VĚDY AKTIVNĚ A INTERAKTIVNĚ CZ.1.07/1.1.24/01.0040 Chemické veličiny, vztahy mezi nimi a chemické výpočty Mgr. Jana Žůrková, 2013, 20 stran Obsah 1. Veličiny
V. Soustavy s chemickou reakcí
 V. Soustavy s chemickou reakcí 1 5. Soustavy s chemickou reakcí 5.1 Základní pojmy 5.2 Rozdělení reakcí 5.3 Reakční kinetika 5.3.1 Podmínky pro zreagování dvou molekul 5.3.2 Mechanismy reakce 5.3.3 Rychlost
V. Soustavy s chemickou reakcí 1 5. Soustavy s chemickou reakcí 5.1 Základní pojmy 5.2 Rozdělení reakcí 5.3 Reakční kinetika 5.3.1 Podmínky pro zreagování dvou molekul 5.3.2 Mechanismy reakce 5.3.3 Rychlost
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 CHEMICKY ČISTÉ LÁTKY A SMĚSI Látka = forma hmoty, která se skládá z velkého množství základních částic: atomů, iontů a... 1. Přiřaďte látky: glukóza, sůl, vodík a helium k níže zobrazeným typům částic.
CHEMICKY ČISTÉ LÁTKY A SMĚSI Látka = forma hmoty, která se skládá z velkého množství základních částic: atomů, iontů a... 1. Přiřaďte látky: glukóza, sůl, vodík a helium k níže zobrazeným typům částic.
Průvodka. CZ.1.07/1.5.00/ Zkvalitnění výuky prostřednictvím ICT. III/2 Inovace a zkvalitnění výuky prostřednictvím ICT
 Průvodka Číslo projektu Název projektu Číslo a název šablony klíčové aktivity CZ.1.07/1.5.00/34.0802 Zkvalitnění výuky prostřednictvím ICT III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Příjemce
Průvodka Číslo projektu Název projektu Číslo a název šablony klíčové aktivity CZ.1.07/1.5.00/34.0802 Zkvalitnění výuky prostřednictvím ICT III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Příjemce
Úloha 3-15 Protisměrné reakce, relaxační kinetika... 5. Úloha 3-18 Protisměrné reakce, relaxační kinetika... 6
 3. SIMULTÁNNÍ REAKCE Úloha 3-1 Protisměrné reakce oboustranně prvého řádu, výpočet přeměny... 2 Úloha 3-2 Protisměrné reakce oboustranně prvého řádu, výpočet času... 2 Úloha 3-3 Protisměrné reakce oboustranně
3. SIMULTÁNNÍ REAKCE Úloha 3-1 Protisměrné reakce oboustranně prvého řádu, výpočet přeměny... 2 Úloha 3-2 Protisměrné reakce oboustranně prvého řádu, výpočet času... 2 Úloha 3-3 Protisměrné reakce oboustranně
Vícefázové reaktory. MÍCHÁNÍ ve vsádkových reaktorech
 Vícefázové reaktory MÍCHÁNÍ ve vsádkových reaktorech Úvod vsádkový reaktor s mícháním nejběžnější typ zařízení velké rozmezí velikostí aparátů malotonážní desítky litrů (léčiva, chemické speciality, )
Vícefázové reaktory MÍCHÁNÍ ve vsádkových reaktorech Úvod vsádkový reaktor s mícháním nejběžnější typ zařízení velké rozmezí velikostí aparátů malotonážní desítky litrů (léčiva, chemické speciality, )
Zpracování ropy doc. Ing. Josef Blažek, CSc. 6. přednáška
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 6. přednáška Vlastnosti a výroba minerálních olejů ZÁKLADOVÉ OLEJE Oleje:
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 6. přednáška Vlastnosti a výroba minerálních olejů ZÁKLADOVÉ OLEJE Oleje:
Zpracování ropy doc. Ing. Josef Blažek, CSc. 3. přednáška
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 3. přednáška Termické a katalytické krakování a hydrokrakování těžkých
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 3. přednáška Termické a katalytické krakování a hydrokrakování těžkých
Příklady úspěšných projektů čistší produkce (Cleaner Production) Výroba: kyseliny sírové mikrokorundu
 Příklady úspěšných projektů čistší produkce (Cleaner Production) Výroba: kyseliny sírové mikrokorundu Ing. Miroslav Richter, PhD., EUR ING Fakulta životního prostředí Univerzity J.E.Purkyně v Ústí n.l.
Příklady úspěšných projektů čistší produkce (Cleaner Production) Výroba: kyseliny sírové mikrokorundu Ing. Miroslav Richter, PhD., EUR ING Fakulta životního prostředí Univerzity J.E.Purkyně v Ústí n.l.
TEPELNÉ JEVY. Mgr. Jan Ptáčník - GJVJ - Fyzika - Tercie
 TEPELNÉ JEVY Mgr. Jan Ptáčník - GJVJ - Fyzika - Tercie Vnitřní energie tělesa Každé těleso se skládá z látek. Látky se skládají z částic. neustálý neuspořádaný pohyb kinetická energie vzájemné působení
TEPELNÉ JEVY Mgr. Jan Ptáčník - GJVJ - Fyzika - Tercie Vnitřní energie tělesa Každé těleso se skládá z látek. Látky se skládají z částic. neustálý neuspořádaný pohyb kinetická energie vzájemné působení
1/6. 2. Stavová rovnice, plynová konstanta, Avogadrův zákon, kilomol plynu
 1/6 2. Stavová rovnice, plynová konstanta, Avogadrův zákon, kilomol plynu Příklad: 2.1, 2.2, 2.3, 2.4, 2.5, 2.6, 2.7, 2.8, 2.9, 2.10, 2.11, 2.12, 2.13, 2.14, 2.15, 2.16, 2.17, 2.18, 2.19, 2.20, 2.21, 2.22,
1/6 2. Stavová rovnice, plynová konstanta, Avogadrův zákon, kilomol plynu Příklad: 2.1, 2.2, 2.3, 2.4, 2.5, 2.6, 2.7, 2.8, 2.9, 2.10, 2.11, 2.12, 2.13, 2.14, 2.15, 2.16, 2.17, 2.18, 2.19, 2.20, 2.21, 2.22,
Vyšší odborná škola, Obchodní akademie a Střední odborná škola EKONOM, o. p. s. Litoměřice, Palackého 730/1
 DUM Základy přírodních věd DUM III/2-T3-2-20 Téma: Test obecná chemie Střední škola Rok: 2012 2013 Varianta: A Test obecná chemie Zpracoval: Mgr. Pavel Hrubý Mgr. Josef Kormaník TEST Otázka 1 OsO 4 je
DUM Základy přírodních věd DUM III/2-T3-2-20 Téma: Test obecná chemie Střední škola Rok: 2012 2013 Varianta: A Test obecná chemie Zpracoval: Mgr. Pavel Hrubý Mgr. Josef Kormaník TEST Otázka 1 OsO 4 je
VY_32_INOVACE_30_HBEN11
 Sloučeniny síry Temacká oblast : Chemie anorganická chemie Datum vytvoření: 15. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Sloučeniny síry sulfan, oxidy a
Sloučeniny síry Temacká oblast : Chemie anorganická chemie Datum vytvoření: 15. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Sloučeniny síry sulfan, oxidy a
Kyselina fosforečná Suroviny: Výroba: termický způsob extrakční způsob
 Kyselina fosforečná bezbarvá krystalická sloučenina snadno rozpustná ve vodě komerčně dodávané koncentrace 75% H 3 PO 4 s 54,3% P 2 O 5 80% H 3 PO 4 s 58.0% P 2 O 5 85% H 3 PO 4 s 61.6% P 2 O 5 po kyselině
Kyselina fosforečná bezbarvá krystalická sloučenina snadno rozpustná ve vodě komerčně dodávané koncentrace 75% H 3 PO 4 s 54,3% P 2 O 5 80% H 3 PO 4 s 58.0% P 2 O 5 85% H 3 PO 4 s 61.6% P 2 O 5 po kyselině
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ
 SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
DOUČOVÁNÍ KVINTA CHEMIE
 1. ÚVOD DO STUDIA CHEMIE 1) Co studuje chemie? 2) Rozděl chemii na tři důležité obory. DOUČOVÁNÍ KVINTA CHEMIE 2. NÁZVOSLOVÍ ANORGANICKÝCH SLOUČENIN 1) Pojmenuj: BaO, N 2 0, P 4 O 10, H 2 SO 4, HMnO 4,
1. ÚVOD DO STUDIA CHEMIE 1) Co studuje chemie? 2) Rozděl chemii na tři důležité obory. DOUČOVÁNÍ KVINTA CHEMIE 2. NÁZVOSLOVÍ ANORGANICKÝCH SLOUČENIN 1) Pojmenuj: BaO, N 2 0, P 4 O 10, H 2 SO 4, HMnO 4,
J.Kubíček 2018 FSI Brno
 J.Kubíček 2018 FSI Brno Chemicko-tepelným zpracováním označujeme způsoby difúzního sycení povrchu různými prvky. Nasycujícími (resp. legujícími) prvky mohou být kovy i nekovy. Cílem chemickotepelného zpracování
J.Kubíček 2018 FSI Brno Chemicko-tepelným zpracováním označujeme způsoby difúzního sycení povrchu různými prvky. Nasycujícími (resp. legujícími) prvky mohou být kovy i nekovy. Cílem chemickotepelného zpracování
pevná látka tekutina (kapalina, plyn) (skripta str )
 Reakce v heterogenních soustavách pevná látka tekutina (kapalina, plyn) (skripta str. 90-03) Rozpouštění pevných látek s chemickou reakcí (např. Mg 3(s) + HN 3(l) ) CVD - Chemical Vapor Deposition (SiH
Reakce v heterogenních soustavách pevná látka tekutina (kapalina, plyn) (skripta str. 90-03) Rozpouštění pevných látek s chemickou reakcí (např. Mg 3(s) + HN 3(l) ) CVD - Chemical Vapor Deposition (SiH
Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH. atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na +
 OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
