Příloha č. 3 k rozhodnutí o povolení souběžného dovozu sp. zn.:sukls146105/2011
|
|
|
- Bohumila Konečná
- před 6 lety
- Počet zobrazení:
Transkript
1 Příloha č. 3 k rozhodnutí o povolení souběžného dovozu sp. zn.:sukls146105/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FROMILID 500, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fromilid 500: clarithromycinum 500 mg v 1 potahované tabletě Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Fromilid 500: Potahované tablety Popis přípravku: žluté, oválné, bikonvexní, potahované tablety 4. KLINICKÉ ÚDAJE 4.1. Terapeutické indikace Infekce horních cest dýchacích (tonzilofaryngitida, otitis media, akutní sinusitida), infekce dolních cest dýchacích (akutní bakteriální bronchitida, akutní exacerbace chronické bronchitidy, pneumonie získaná z prostředí a atypická pneumonie), infekce kůže a měkkých tkání, infekce vyvolané mykobakteriemi (M. avium complex, M. kansasii, M. marinum, M. leprae) a prevence rozšíření těchto infekcí u pacientů s AIDS, eradikace H. pylori u pacientů s vředovou chorobou žaludku a duodena (vždy v kombinaci s jinými léky) Dávkování a způsob podání Dospělí a děti starší než 12 let: K léčbě sinusitidy, jiných závažných infekcí a v případech, kdy infekčním patogenem je Haemophilus influenzae se podává 500 mg každých 12 h. K eradikaci H. pylori se podává 500 mg dvakrát denně, po dobu 7 dnů spolu s jinými léky. Děti mladší 12 let obvykle užívají jinou lékovou formu. Doba trvání léčby je obvykle 7 až 14 dnů. K léčbě a prevenci rozšíření infekce bakteriemi Mycobacterium avium complex se podává 500 mg každých 12 h. Dávkování je možno zvýšit, léčba je dlouhodobá. Maximální denní dávka je 2 g klarithromycinu. Maximální dávka pro děti je 1 g. Způsob použití: Fromilid 500: Tablety se polykají celé a zapíjejí se tekutinou. Neměly by se lámat. U nemocných s mírnou a střední poruchou jaterních funkcí a současně při normální funkci ledvin není nutná úprava dávky. U nemocných s poruchou renálních funkcí, pokud je clearance kreatininu nižší než 0,5 ml/s (30 ml/min) nebo hladiny kreatininu v krevním séru vyšší než 290 µmol/l (3,3 mg/100 ml) se doporučuje snížit dávku na polovinu nebo zdvojnásobit interval mezi dávkami. 1/9
2 4.3. Kontraindikace Přípravek nesmí užívat pacienti, kteří jsou přecitlivělí na klarithromycin, jiná makrolidová antibiotika nebo na ostatní složky přípravku. Dále se nesmí podávat nemocným s těžkou poruchou jater. Současné užívání klarithromycinu a terfenadinu, cisapridu, pimozidu nebo astemizolu je kontraindikováno (viz Interakce) Zvláštní upozornění a opatření pro použití Mezi makrolidovými antibiotiky existuje zkřížená rezistence. U nemocných s mírnou poruchou jaterních funkcí není potřeba úprava dávkování, pokud jsou renální funkce normální. U pacientů se závažnou poruchou renálních funkcí je třeba dávky snížit (viz Dávkování a způsob podávání). Klarithromycin by se neměl podávat nemocným s porfyrií. Není dostatek zkušeností s podáváním klarithromycinu u dětí mladších 6 měsíců. Léčba antibiotiky mění normální střevní flóru, a proto může dojít k superinfekci rezistentními mikroorganismy. V případě závažného přetrvávajícího průjmu, který může být projevem pseudomembranózní kolitidy, je třeba ihned přerušit léčbu a provést příslušná opatření Interakce s jinými léčivými přípravky a jiné formy interakce Klarithromycin je metabolizován v játrech, kde může způsobit inhibici aktivity enzymového komplexu cytochromu P-450. Sérové hladiny léků metabolizovaných prostřednictvím tohoto systému mohou být během současného podávání s klarithromycinem zvýšené a tudíž se mohou projevit nežádoucí účinky těchto léků. Současné užívání klarithromycinu a terfenadinu, cisapridu, pimozidu nebo astemizolu může vést k prodlouženému intervalu QT, ventrikulární tachykardii, ventrikulární fibrilaci a k "torsades de pointes". Při současném užívání klarithromycinu a teofylinu, karbamazepinu, digoxinu, lovastatinu, simvastatinu, triazolamu, midazolamu, fenytoinu, valproátu, cyklosporinu, takrolimu a námelových alkaloidů se doporučuje sledování sérových koncentrací, neboť může dojít k jejich zvýšení. U nemocných, kteří užívají klarithromycin současně s warfarinem nebo jinými perorálními antikoagulančními léky, je třeba opakovaně provést kontrolu protrombinového času. Současné podávání klarithromycinu a zidovudinu snižuje absorpci zidovudinu. Současné podávání klarithromycinu a ritonaviru vede k významnému zvýšení (až o 77%) plochy pod křivkou sérových koncentrací klarithromycinu, zatímco plochy pod křivkou jeho metabolitu, 14-hydroxyklarithromycinu, se významně snižují (až o 100%). Pokud je renální funkce normální, není nutná úprava dávky. U mírné renální nedostatečnosti, kdy je clearance kreatininu nižší než 60 ml/min (1,0 ml/s), se doporučuje snížit dávkování na polovinu; pokud je clearance kreatininu nižší než 30 ml/min (0,5 ml/s), podává se 1/4 dávky klarithromycinu Těhotenství a kojení Bezpečnost klarithromycinu během těhotenství a kojení nebyla stanovena. Klarithromycin lze podávat těhotným ženám pouze ve výjimečných případech, po pečlivém zvážení prospěchu léčby pro matku oproti potenciálnímu riziku pro plod. Kojení je třeba v průběhu léčby přerušit Účinky na schopnost řídit a obsluhovat stroje Přípravek neovlivňuje psychomotorické schopnosti pacientů Nežádoucí účinky Nežádoucí účinky, které se mohou vyskytnout během léčby klarithromycinem, jsou tříděny do následujících skupin dle četnosti: 2/9
3 velmi časté ( 1/10); časté ( 1/100 až < 1/10); méně časté ( 1/1 000 až < 1/100); vzácné ( 1/ až < 1/1 000); velmi vzácné (< 1/10 000), není známo (z dostupných údajů nelze určit). Frekvence uvedených nežádoucích účinků podle tříd orgánových systémů: Gastrointestinální poruchy: časté: nauzea, bolesti břicha, zvracení, průjem (v případě dlouhotrvajícího závažného průjmu je nutné vyloučit pseudomembranózní kolitidu, která se může u některých pacientů vyskytnout), poruchy chuti méně časté: stomatitida, glositida Poruchy nervového systému: časté: bolesti hlavy velmi vzácné, není známo (z dostupných údajů nelze určit): závratě, insomnie, zmatenost, pocity strachu, noční můry Poruchy kůže a podkožní tkáně: časté: vyrážka velmi vzácné, není známo (z dostupných údajů nelze určit): Stevens-Johnsonův syndrom Vícenásobná vyšetření: méně časté: zvýšená aktivita jaterních enzymů Poruchy jater a žlučových cest: velmi vzácné, není známo (z dostupných údajů nelze určit): cholestatická žloutenka 4.9. Předávkování Při předávkování se obvykle objeví zvracení a bolesti břicha, bolesti hlavy a zmatenost. Po požití velkého množství léčivého přípravku je nutné provést výplach žaludku. Léčba je symptomatická. 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1. Farmakodynamické vlastnosti Farmakoterapeutická skupina: Antibiotikum, ATC kód: J01FA Mechanismus účinku Klarithromycin je makrolidové antibiotikum. Makrolidy se váží reverzibilně na vazebné místo P ribozomální podjednotky 50S a inhibují syntézu proteinů závislou na ribonukleové kyselině (RNA). Zabraňují transpeptidaci (prodloužení proteinového řetězce) a/nebo translokaci (přenos aminokyselin z transportní RNA na messengerovou RNA). Dochází tak k inhibici syntézy důležitých peptidů a k porušení normálních buněčných funkcí. Vzhledem k odlišné struktuře ribosomů nedochází k vazbě na ribosomy eukaryotických buněk, což je pravděpodobně příčinou velmi nízké toxicity makrolidů pro člověka. Chloramfenikol a linkosamidy soutěží u některých bakterií s makrolidy o vazbu na vazebné místo P, což má za následek antagonistické působení. 3/9
4 Primární účinek makrolidů je bakteriostatický, závisí však na koncentraci antibiotika, počtu přítomných bakterií a stadiu životního cyklu bakterií v okamžiku podání antibiotika. Podobně jako ostatní makrolidová antibiotika může klarithromycin působit též baktericidně. Klarithromycin má baktericidní účinek na S. pyogenes, S. pneumoniae a M. catarrhalis. Podle současných výzkumů účinnosti erythromycinu je nejlepším ukazatelem pro prognózu účinnosti makrolidů po který jsou koncentrace antibiotika nad hodnotou MIC Antibakteriální účinek Klarithromycin působí bakteriostaticky a baktericidně na četné klinicky významné grampozitivní a gramnegativní bakterie, jako jsou aerobní, anaerobní nebo fakultativně anaerobní bakterie, další typy bakterií (mykoplasmata, ureaplasmata, chlamydie, legionelly) a atypické mykobakterie. Citlivost in vitro se liší v různých oblastech. Existují rovněž rozdíly vztahující se k laboratorním metodám. Tabulka 1 Bakterie citlivé na klarithromycin Aerobní, Aerobní, Anaerobní bakterie grampozitivní bakterie gramnegativní bakterie Bacillus spp. Bordetella pertussis Grampozitivní bakterie Corynebacterium spp. Campylobacter jejuni Eubacterium spp. Listeria monocytogenes H. influenzae Clostridium perfringens S. aureus citlivý na methicilin Helicobacter pylori Peptococcus spp. Streptococcus agalactiae Legionella pneumophila Peptostreptococcus spp. Streptococcus pneumoniae Moraxella catarrhalis Propionibacterium acnes Streptococcus pyogenes Neisseria gonorrhoeae Gramnegativní bakterie Streptococcus viridans Neisseria meningitidis Bacterioides spp. Pasteurella multocida Bacterioides fragilis Prevotella melaninogenica Ostatní mikroorganismy Chlamydia pneumoniae Chlamydia trachomatis Mycoplasma pneumoniae Ureaplasma urealyticum Borrelia burgdorferi Toxoplasma gondii Mycobacterium avium complex Mycobacterium fortuitum Mycobacterium chelonae Mycobacterium kansasii Mycobacterium xenopi Mycobacterium leprae Kmeny Staphylococcus aureus a S. epidermidis, které jsou citlivé na penicilin a erythromycin, jsou též citlivé na klarithromycin. Pokud jsou rezistentní na erythromycin, jsou rovněž rezistentní na klarithromycin. Klarithromycin je účinný proti streptokokům skupiny A, B, C, G a S. bovis. Kmeny S. pneumoniae jsou citlivé na klarithromycin, pokud nejsou rezistentní na erythromycin. Enterokoky jsou obvykle na klarithromycin rezistentní. Klarithromycin je obvykle nejúčinnějším makrolidovým antibiotikem proti Bacillus sp. (MIC 90 je 0,12 µg/ml). Klarithromycin je účinný nebo středně účinný proti Campylobacter spp. a účinnější než erythromycin proti Helicobacter pylori. U gramnegativních bakterií je klarithromycin účinný zejména proti Bordetella pertussis, Legionella pneumophila a Moraxella catarrhalis. Ve srovnání s erythromycinem 4/9
5 je klarithromycin účinnější proti H. influenzae, což platí zejména pro jeho metabolit 14-hydroxyklarithromycin, který je zhruba dvakrát účinnější proti této bakterii než samotný klarithromycin. Klarithromycin není účinný proti Enterobacteriaceae sp.a Pseudomonas sp. ani proti kmenům S. aureus rezistentním na methicilin. Je účinný proti grampozitivním anaerobům, jako jsou Clostridia spp., Eubacterium spp., Peptococcus spp. a Propionibacterium spp. Je též účinný proti Bacteroides spp. Klarithromycin je nejúčinnějším makrolidovým antibiotikem proti Chlamydia trachomatis a C. pneumoniae. Je rovněž účinný proti Mycoplasma pneumoniae a Ureaplasma urealyticum. Mycoplasma hominis je na klarithromycin rezistentní. Klarithromycin je účinný proti řadě mykobakterií s výjimkou Mycobacterium tuberculosis. Je nejúčinnější ze všech makrolidových antibiotik proti Mycobacterium avium complex (MAC), Mycobacterium fortuitum a Mycobacterium chelonae. Je též účinný proti Mycobacterium kansasii, Mycobacterium xenopi a Mycobacterium leprae. U treponem je účinný proti Borrelia burgdorferi; účinnost proti Treponema pallidum není známa. Je též účinný proti Toxoplasma gondii. Klarithromycin a jeho metabolit 14-hydroxyklarithromycinem mají synergický účinek na H. influenzae, M. catarrhalis, Legionella spp. a na některé streptokoky a stafylokoky. Tabulka 2 Účinnost klarithromycinu in vitro (MIC v µg/ml) Mikroorganismus Klarithromycin MIC90 (µg/ml) S. aureus citlivý na methicilin 0,125 S. pyogenes 0,015 S. pneumoniae 0,015 S. agalactiae 0,06 Skupina S. viridans 0,03 Corynebacterium spp. 4 Listeria monocytogenes 0,25 M. catarrhalis 0,25 N. gonorrhoeae 0,5 C. jejuni 2 L. pneumophila 0,25 H. influenzae 8 B. pertussis 0,03 Bacteroides fragilis 2 Cl. perfrigens 0,5 Propionibacterium acnes 0,03 C. trachomatis 0,125 C. pneumoniae 0,015-0,03 M. pneumoniae 0,03-0,5 Ureaplasma urealyticum 0,025-1,0 H. pylori 0,03 Mycobacterium avium (při AIDS) 16 Mycobacterium avium (nikoliv při AIDS) 8-16 Mycobacterium fortuitum 4 Mycobacterium kansasii 1 Mycobacterium xenopi 0,25-0,5 Mycobacterium chelonae 0,25 Mycobacterium abscessus 1 5/9
6 Pro stanovení citlivosti bakterií na klarithromycin se používá standardizovaný postup založený na zřeďovací metodě. Mikroorganismus je citlivý na klarithromycin, pokud je jeho MIC 2 µg/ml; středně citlivý, pokud je MIC 4 µg/ml; a rezistentní, pokud je MIC 8 µg/ml. H. influenzae je citlivý, pokud je MIC 8 µg/ml. Kontrolním mikroorganismem v tomto standardizovaném postupu je S. aureus, jehož hodnota MIC se pohybuje v rozmezí od 0,12 µg/ml do 0,5 µg/ml. Existuje několik způsobů testování citlivosti mykobakterií a H. pylori, které nejsou standardizované. Účinek klarithromycinu na střevní mikroflóru Účinek klarithromycinu na střevní mikroflóru byl zkoumán u zdravých dobrovolníků, kteří užívali 250 mg klarithromycinu dvakrát denně po dobu 7 dnů. V průběhu této studie nebyly zaznamenány žádné významné změny v počtu stafylokoků, mikrokoků, enterokoků, aerobních difteroidů, anaerobních koků, eubakterií, klostridií a mikroorganismů rodu Veillonella. Růst streptokokových kolonií, gramnegativních střevních bakterií, laktobacilů, bifidobakterií a Bacteriodes spp. byl inhibován středně. U dvou dobrovolníků došlo k pomnožení Candida albicans Rezistence na makrolidová antibiotika Rezistence pneumokoků na makrolidová antibiotika v Evropě roste, pohybuje se v rozmezí 2,7 % až 40,6 % pro rok Na Slovensku byla v roce ,6 %. Rezistence S. pyogenes je většinou nižší než 5 %. Na Slovensku byla v roce 1998 okolo 5,8 %. Ve stejném roce byla rezistence S. aureus na erythromycin 6,9 %. Rezistence H. influenzae na azitromycin a tím pravděpodobně také na klarithromycin je na Slovensku do 3,6 %. Rezistence M. catarrhalis a C. dyphteriae je vzácná. Velice vzácně se objevuje rezistence u mykoplasmat a Chlamydia pneumoniae. Mezi erythromycinem a klarithromycinem existuje vysoký stupeň zkřížené rezistence, což znamená, že bakterie rezistentní in vitro na erythromycin je pravděpodobně rezistentní na klarithromycin (pokud se neprovede antibiogram). Primární rezistence gramnegativních bakterií, jako jsou enterobakterie, Pseudomonas spp. a Acinetobacter spp., je pravděpodobně založena na relativní nepropustnosti vnější buněčné membrány pro antibiotika. Mechanismy získané rezistence bakterií na makrolidová antibiotika jsou následující: - zvýšené vylučování antibiotika z bakteriální buňky (S. epidermidis), - inaktivace enzymů -esterázy, fosfotransferázy (E. coli, P. aeruginosa), - změny v cílovém místě, na které se makrolidové antibiotikum váže (nejčastěji se vyskytující mechanismus) Rezistence může být konstituční a indukovaná. Konstituční rezistence znamená zkříženou rezistenci na všechna makrolidová antibiotika včetně linkosamidů a streptograminu typu B (MLS B ). Při indukované rezistenci jsou bakteriální kmeny rezistentní pouze na makrolidová antibiotika se 14-členným laktonovým kruhem (erythromycin, roxitromycin, klarithromycin) a s 15-členným kruhem (azitromycin), avšak nejsou rezistentní na 16-členná makrolidová antibiotika (spiramycin, josamycin, midekamycin, miokamycin), linkosamidy a stroptogramin B. Rezistence na MLS B se vyskytuje u následujících bakterií: S. aureus, S. pyogenes, S. pneumoniae, Enterococcus faecalis, Clostridium spp. a Bacteroides spp. Mechanismus rezistence založený na zvýšeném odstraňování antibiotika byl zjištěn u S. epidermidis a nedávno u četných streptokoků s fenotypem M. Ty jsou rezistentní na 14-členná a 15-členná makrolidová antibiotika, avšak nikoliv na 16-členná, linkosamidy a streptogramin B. Rezistence se rozvíjí díky genům (mef A a mef E), které kódují výskyt tohoto fenotypu bakterií. Tyto geny se často nacházejí u S. pyogenes, S. agalactiae a S. pneumoniae. Některé bakterie jsou rezistentní díky několika mechanismům. 6/9
7 5.2. Farmakokinetické vlastnosti Absorpce Klarithromycin je v prostředí žaludeční kyseliny stabilní. Biologická dostupnost je zhruba 55 % perorálně podané dávky. Současný příjem potravy může zpomalovat absorpci, avšak neovlivňuje podstatně biologickou dostupnost klarithromycinu. Zhruba 20% klarithromycinu se rychle metabolizuje na 14-hydroxyklarithromycin, který má podobný biologický účinek jako klarithromycin. U zdravých dobrovolníků byly sérové koncentrace úměrné velikosti perorálních dávek. Maximálních koncentrací v krevním séru je dosaženo za dobu kratší než 3 h. Po jednotlivé perorální dávce 250 mg klarithromycinu jsou průměrné koncentrace od 0,62 µg/ml do 0,84 µg/ml; po jednotlivé dávce 500 mg klarithromycinu jsou koncentrace od 1,77 µg/ml do 1,89 µg/ml. Odpovídající koncentrace 14- hydroxymetabolitu jsou od 0,4 µg/ml do 0,7 µg/ml po dávce 250 mg a od 0,67 µg/ml do 0,8 µg/ml po dávce 500 mg. Hodnoty plochy pod křivkou sérové koncentrace v závislosti na čase (AUC x čas) jsou 4 µg/ml x h po dávce 250 mg a 11 µg/ml x h po dávce 500 mg. Po opakovaných dávkách 250 mg klarithromycinu dvakrát denně je rovnovážných koncentrací klarithromycinu dosaženo po páté dávce při maximální koncentraci 1 µg/ml klarithromycinu a 0,6 µg/ml 14-hydroxyklarithromycinu Distribuce Makrolidová antibiotika jsou málo ionizována a jsou rozpustná v tucích, což umožňuje dobrý průnik do tělesných tekutin a tkání. Koncentrace klarithromycinu v tkáních dosahují zhruba desetinásobků koncentrací v krevním séru. Vysoké koncentrace lze nalézt v plících (8,8 mg/kg), tonsilách (1,6 mg/kg), nosní sliznici, kůži, slinách, alveolárních buňkách, sputu a ve středním uchu. Distribuční objem klarithromycinu u zdravých dobrovolníků po jedné dávce 250 mg a/nebo 500 mg je 226 až 266 l neboli 2,5 l/kg. Distribuční objem 14-hydro-xyklarithromycinu je 304 až 309 l. Vazba klarithromycinu na sérové bílkoviny je nízká a reverzibilní Metabolismus a vylučování Klarithromycin je metabolizován v játrech. Bylo nalezeno nejméně 7 metabolitů. Nejdůležitějším je 14-hydroxyklarithromycin. Klarithromycin se vylučuje močí ve formě metabolitů nebo v nezměněné formě a menším podílem stolicí (4%). Zhruba 20% dávky 250 mg a 30% dávky 500 mg se vylučuje v nezměněné formě močí. 10 až 15% dávky se vylučuje močí ve formě 14-hydroxyklarithromycinu. Poločas klarithromycinu při dávce 250 mg za 12 h je 3 až 4 hodiny; při dávce 500 mg za 12 h je 5 až 7 hodin Vliv věku na farmakokinetické vlastnosti přípravku Děti a kojenci: Podle výsledků provedených studií jsou farmakokinetické vlastnosti klarithromycinu podaného v dávce 7,5 mg/kg tělesné hmotnosti dvakrát denně podobné jako u dospělých. Starší pacienti: Výsledky studií prokázaly, že u starších osob není nutno upravovat dávku vyjma nemocných se závažnou poruchou renálních funkcí. Vliv onemocnění na farmakokinetiku přípravku: Po podání 200 mg klarithromycinu vzrůstá maximální koncentrace a plocha pod křivkou a klesá vylučování klarithromycinu u pacientů se závažným poškozením ledvin ve srovnání se zdravými dobrovolníky. Celkové vylučování klarithromycinu u pacientů se závažným poškozením renálních funkcí ve srovnání se zdravými dospělými pokleslo z 26,5% na 3,3%. Tyto výsledky ukazují, že je třeba snížit dávku nebo prodloužit časový interval mezi dávkami u pacientů se závažným poškozením ledvin. Rovnovážná koncentrace klarithromycinu u pacientů s poškozením jater se neliší od koncentrací u zdravých jedinců, zatímco koncentrace 14-hydroxyklarithromycinu jsou nižší. 7/9
8 5.3. Předklinické údaje vztahující se k bezpečnosti Studie akutní toxicity prokázaly nízkou toxicitu klarithromycinu u laboratorních zvířat. Hodnoty LD 50 po perorálním podání byly 1,5 až >5 g/kg a po parenterálním podání 0,7 až >5,0 g/kg. Po opakovaném podání velmi vysokých dávek klarithromycinu nebyly zjištěny hepatotoxické a nefrotoxické účinky a škodlivé účinky na gastrointestinální ústrojí. Ačkoliv byla zjištěna určitá souvislost mezi působením klarithromycinu a embryofetálním vývojem, nebyly pozorovány žádné teratogenní účinky. Několik testů in vitro a in vivo ukázalo, že nemá mutagenní působení. V literatuře nejsou žádné studie týkající se kancerogenity. Určité lékové formy vyvolávají lokální podráždění. Klarithromycin neindukuje specifické antigeny. 6. FARMACEUTICKÉ ÚDAJE 6.1. Seznam pomocných látek Fromilid 500: mikrokrystalická celulosa, hydroxypropymethylcelulosa, propylenglykol, kukuřičný škrob, koloidní bezvodý oxid křemičitý, předbobtnalý škrob, draselná sůl polakrilinu, mastek, magnesium-stearát, chinolinová žluť, oxid titaničitý 6.2. Inkompatibility Neuplatňuje se Doba použitelnosti 5 let 6.4. Zvláštní opatření pro uchovávání Fromilid 500: Uchovávejte při teplotě do 25 C. v původním obalu, aby byl přípravek chráněn před vlhkostí Druh obalu a velikost balení Fromilid 500: Al/ PVC/PVDC blistr, krabička. Velikost balení: 14 potahovaných tablet po 500 mg 6.6. Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním Perorální podání Všechen nepoužitý přípravek nebo odpad musí být likvidován v souladu s místními požadavky. 7. DRŽITEL ROZHODNUTÍ O REGISTRACI KRKA, d.d., Novo mesto, Šmarješka cesta 6, 8501 Novo mesto, Slovinsko SOUBĚŽNÝ DOVOZCE Chemark s.r.o., Praha 9, Česká republika 8/9
9 8. REGISTRAČNÍ ČÍSLO 15/422/99-C/PI/001/12 9. DATUM PRVNÍ REGISTRACE/ PRODLOUŽENÍ REGISTRACE DATUM REVIZE TEXTU: /9
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 ke sdělení sp. zn. sukls196612/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FROMILID 250, potahované tablety FROMILID 500, potahované tablety FROMILID 125 mg/5 ml, granule pro přípravu
Příloha č. 2 ke sdělení sp. zn. sukls196612/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FROMILID 250, potahované tablety FROMILID 500, potahované tablety FROMILID 125 mg/5 ml, granule pro přípravu
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Claritromycinum 250 mg nebo 500 mg v jedné potahované tabletě.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU KLABAX 250 mg KLABAX 500 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Claritromycinum 250 mg nebo 500 mg v jedné potahované tabletě. 3. LÉKOVÁ FORMA Přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU KLABAX 250 mg KLABAX 500 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Claritromycinum 250 mg nebo 500 mg v jedné potahované tabletě. 3. LÉKOVÁ FORMA Přípravek
Indikace přípravku Zetamac v ordinaci praktického lékaře
 Indikace přípravku Zetamac v ordinaci praktického lékaře MUDr. Igor Karen 13.10. 2009 Zetamac léková forma azithromycinum 2g granule s prodlouženým uvolňováním pro přípravu perorální suspenze s příchutí
Indikace přípravku Zetamac v ordinaci praktického lékaře MUDr. Igor Karen 13.10. 2009 Zetamac léková forma azithromycinum 2g granule s prodlouženým uvolňováním pro přípravu perorální suspenze s příchutí
Azyter 15 mg/g, oční kapky, roztok, jednodávkový obal
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls143390/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azyter 15 mg/g, oční kapky, roztok, jednodávkový
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls143390/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azyter 15 mg/g, oční kapky, roztok, jednodávkový
Při výběru antibiotika je nutné brát v úvahu oficiální doporučení o vhodném použití antibakteriálních látek.
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls157421/2011 a sukls157423/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU: Rovamycine 3 M.I.U. Rovamycine 1,5 M.I.U. potahované tablety 2. KVALITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls157421/2011 a sukls157423/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU: Rovamycine 3 M.I.U. Rovamycine 1,5 M.I.U. potahované tablety 2. KVALITATIVNÍ
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Klacid I.V. Příbalová informace
 Klacid I.V. Příbalová informace Informace pro použití, čtěte pozorně! KLACID I.V. (Clarithromycinum) Prášek pro přípravu infuzního roztoku Držitel rozhodnutí o registraci: Abbott Laboratories s.r.o., Praha,
Klacid I.V. Příbalová informace Informace pro použití, čtěte pozorně! KLACID I.V. (Clarithromycinum) Prášek pro přípravu infuzního roztoku Držitel rozhodnutí o registraci: Abbott Laboratories s.r.o., Praha,
sp.zn.: sukls7967/2011
 sp.zn.: sukls7967/2011 Souhrn údajů o přípravku. 1. NÁZEV PŘÍPRAVKU sáčky 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ Jedna tobolka obsahuje léčivou látku: Lysatum bacteriale OM 85 cryodesicatum, odpovídá
sp.zn.: sukls7967/2011 Souhrn údajů o přípravku. 1. NÁZEV PŘÍPRAVKU sáčky 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ Jedna tobolka obsahuje léčivou látku: Lysatum bacteriale OM 85 cryodesicatum, odpovídá
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls66153/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bactroban Nasal 20 mg/g nosní mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mupirocinum calcicum 0,0645 g (což odpovídá mupirocinum 0,06
sp.zn.sukls66153/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bactroban Nasal 20 mg/g nosní mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mupirocinum calcicum 0,0645 g (což odpovídá mupirocinum 0,06
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls52820/2014 a sukls52795/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FROMILID 250, potahované tablety FROMILID 500, potahované tablety FROMILID 125 mg/5 ml, granule pro perorální suspenzi
sp.zn.sukls52820/2014 a sukls52795/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FROMILID 250, potahované tablety FROMILID 500, potahované tablety FROMILID 125 mg/5 ml, granule pro perorální suspenzi
sp.zn.: sukls47964/2012
 sp.zn.: sukls47964/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FROMILID 250, potahované tablety FROMILID 500, potahované tablety FROMILID 125 mg/5 ml, granule pro perorální suspenzi 2. KVALITATIVNÍ
sp.zn.: sukls47964/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FROMILID 250, potahované tablety FROMILID 500, potahované tablety FROMILID 125 mg/5 ml, granule pro perorální suspenzi 2. KVALITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn. sukls125068-70/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Xorimax 125 mg potahované tablety Xorimax 250 mg potahované tablety Xorimax 500
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn. sukls125068-70/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Xorimax 125 mg potahované tablety Xorimax 250 mg potahované tablety Xorimax 500
sp.zn. sukls172661/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls172661/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FROMILID 250 mg potahované tablety FROMILID 500 mg potahované tablety FROMILID 125 mg/5 ml granule pro perorální suspenzi 2. KVALITATIVNÍ
sp.zn. sukls172661/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FROMILID 250 mg potahované tablety FROMILID 500 mg potahované tablety FROMILID 125 mg/5 ml granule pro perorální suspenzi 2. KVALITATIVNÍ
KLACID 250, 500 mg. Abbott S.p.A., Campoverde di Aprilia, Latina, Itálie. Abbott Laboratories Ltd., Queenborough, Kent, Velká Británie
 KLACID 250, 500 mg Příbalová informace Informace pro použití, čtěte pozorně! (Clarithromycinum) Potahované tablety Držitel rozhodnutí o registraci Abbott S.p.A., Campoverde di Aprilia, Latina, Itálie Abbott
KLACID 250, 500 mg Příbalová informace Informace pro použití, čtěte pozorně! (Clarithromycinum) Potahované tablety Držitel rozhodnutí o registraci Abbott S.p.A., Campoverde di Aprilia, Latina, Itálie Abbott
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
SOUHRN ÚDAJŮ OPŘÍPRAVKU
 SOUHRN ÚDAJŮ OPŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU U N A S Y N 2. KVALITATITNÍ A KVANTITATIVNÍ SLOŽENÍ léčivá látka: Sultamicillinum 375,0 mg v jedné potahované tabletě. Sultamicilin je prolék, ze kterého po požití
SOUHRN ÚDAJŮ OPŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU U N A S Y N 2. KVALITATITNÍ A KVANTITATIVNÍ SLOŽENÍ léčivá látka: Sultamicillinum 375,0 mg v jedné potahované tabletě. Sultamicilin je prolék, ze kterého po požití
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-AZITHROMYCIN 500 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje azithromycinum dihydricum odpovídající azithromycinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-AZITHROMYCIN 500 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje azithromycinum dihydricum odpovídající azithromycinum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls179223/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NEO-ANGIN BEZ CUKRU 1,2 mg/0,6 mg/5,72 mg Pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje: alcohol dichlorbenzylicus
sp. zn. sukls179223/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NEO-ANGIN BEZ CUKRU 1,2 mg/0,6 mg/5,72 mg Pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje: alcohol dichlorbenzylicus
Pomocné látky se známým účinkem: prostý sirup 67%, usušená tekutá glukosa.
 sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
RESPIRAČNÍ INFEKCE. Milan Kolář
 RESPIRAČNÍ INFEKCE Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci Nejčastějšími bakteriálními původci infekcí horních a dolních cest dýchacích v komunitním prostředí jsou kmeny: Streptococcus
RESPIRAČNÍ INFEKCE Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci Nejčastějšími bakteriálními původci infekcí horních a dolních cest dýchacích v komunitním prostředí jsou kmeny: Streptococcus
AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok
 www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1.NÁZEV PŘÍPRAVKU: AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok 2.KVALITATIVNÍ A KVANTITATIVNÍ
www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1.NÁZEV PŘÍPRAVKU: AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok 2.KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU RILEXINE 300 tbl. ad us.vet. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Cefalexinum (ut monohydricum): V jedné 800 mg tabletě
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU RILEXINE 300 tbl. ad us.vet. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Cefalexinum (ut monohydricum): V jedné 800 mg tabletě
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls15507/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ENTIZOL vaginální tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Metronidazolum 500 mg v 1 vaginální tabletě. 3. LÉKOVÁ FORMA Vaginální
sp.zn.: sukls15507/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ENTIZOL vaginální tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Metronidazolum 500 mg v 1 vaginální tabletě. 3. LÉKOVÁ FORMA Vaginální
Příloha č. 2 k rozhodnutí o prodloužení registrace sp. zn. sukls127662/2011 a příloha k sp. zn. sukls119151/2010, sukls136265/2012
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp. zn. sukls127662/2011 a příloha k sp. zn. sukls119151/2010, sukls136265/2012 1. NÁZEV PŘÍPRAVKU APO-AZITHROMYCIN 500 mg potahované tablety SOUHRN ÚDAJŮ
Příloha č. 2 k rozhodnutí o prodloužení registrace sp. zn. sukls127662/2011 a příloha k sp. zn. sukls119151/2010, sukls136265/2012 1. NÁZEV PŘÍPRAVKU APO-AZITHROMYCIN 500 mg potahované tablety SOUHRN ÚDAJŮ
KLACID 250 KLACID 500 Potahované tablety (Clarithromycinum)
 sp.zn.sukls58557/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE KLACID 250 KLACID 500 Potahované tablety (Clarithromycinum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn.sukls58557/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE KLACID 250 KLACID 500 Potahované tablety (Clarithromycinum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DURACEF 250 mg DURACEF 500 mg Tvrdé tobolky. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: cefadroxilum monohydricum, v množství odpovídajícím cefadroxilum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DURACEF 250 mg DURACEF 500 mg Tvrdé tobolky. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: cefadroxilum monohydricum, v množství odpovídajícím cefadroxilum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DALACIN T KOŽNÍ EMULZE 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Clindamycini dihydrogenophosphas je ve vodě rozpustný ester polo-syntetického antibiotika vytvářeného
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DALACIN T KOŽNÍ EMULZE 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Clindamycini dihydrogenophosphas je ve vodě rozpustný ester polo-syntetického antibiotika vytvářeného
Hypersenzitivita na léčivou látku ofloxacin nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1 nebo na kterýkoli z dalších chinolonů.
 sp.zn.sukls193220/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Floxal 3 mg/g oční mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram masti obsahuje ofloxacinum 3,0 mg Jeden cm proužku masti obsahuje
sp.zn.sukls193220/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Floxal 3 mg/g oční mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram masti obsahuje ofloxacinum 3,0 mg Jeden cm proužku masti obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.: sukls59472/2009, sukls59473/2009, sukls59474/2009 a příloha k sp.zn.: sukls233284/2010, sukls233285/2010, sukls233286/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.: sukls59472/2009, sukls59473/2009, sukls59474/2009 a příloha k sp.zn.: sukls233284/2010, sukls233285/2010, sukls233286/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
Příloha III. Souhrn údajů o přípravku, označení na obalu a příbalová informace. Poznámka:
 Příloha III Souhrn údajů o přípravku, označení na obalu a příbalová informace Poznámka: Tento Souhrn údajů o přípravku, označení na obalu a příbalová informace jsou výsledkem procedury přezkoumání, ke
Příloha III Souhrn údajů o přípravku, označení na obalu a příbalová informace Poznámka: Tento Souhrn údajů o přípravku, označení na obalu a příbalová informace jsou výsledkem procedury přezkoumání, ke
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls125780/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MACMIROR 200 mg Obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje nifuratelum 200 mg. Pomocné látky
sp.zn.sukls125780/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MACMIROR 200 mg Obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje nifuratelum 200 mg. Pomocné látky
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 400 mg + 40 mg. čípky PROCTO-GLYVENOL. 50 mg/g + 20 mg/g. rektální krém
 sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Rovamycine 1,5 M.I.U: Jedna potahovaná tableta obsahuje spiramycinum 1,50 mil. m.j. (dále jen M.I.U.)
 sp.zn.sukls149263/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rovamycine 1,5 M.I.U. Rovamycine 3 M.I.U. potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ: Rovamycine 1,5 M.I.U: Jedna potahovaná
sp.zn.sukls149263/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rovamycine 1,5 M.I.U. Rovamycine 3 M.I.U. potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ: Rovamycine 1,5 M.I.U: Jedna potahovaná
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6046/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucosolvan long effect Tvrdé tobolky s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6046/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucosolvan long effect Tvrdé tobolky s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
3 LÉKOVÁ FORMA Tableta s prodlouženým uvolňováním. Růžové, kulaté bikonvexní tablety s vyraženým '35' na jedné straně, na druhé straně hladké.
 Příloha č. 3 k rozhodnutí o registraci sp.zn.sukls200469/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV LÉČIVÉHO PŘÍPRAVKU Portora 35 mg tablety s prodlouženým uvolňováním 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o registraci sp.zn.sukls200469/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV LÉČIVÉHO PŘÍPRAVKU Portora 35 mg tablety s prodlouženým uvolňováním 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety 2. KVALITATIVNÍ
CEFZIL 500 mg - cefprozilum monohydricum 523,14 mg odpovídá cefprozilum 500 mg v l potahované tabletě.
 sp.zn.sukls211445/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CEFZIL 250 mg, potahované tablety CEFZIL 500 mg, potahované tablety CEFZIL O.S. 250 mg, prášek pro perorální suspenzi 2. KVALITATIVNÍ
sp.zn.sukls211445/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CEFZIL 250 mg, potahované tablety CEFZIL 500 mg, potahované tablety CEFZIL O.S. 250 mg, prášek pro perorální suspenzi 2. KVALITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls36308-09/2007 1. NÁZEV PŘÍPRAVKU Cefuroxim-ratiopharm 250 mg Cefuroxim-ratiopharm 500 mg potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls36308-09/2007 1. NÁZEV PŘÍPRAVKU Cefuroxim-ratiopharm 250 mg Cefuroxim-ratiopharm 500 mg potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A
Souhrn údajů o přípravku Klacid SR ABBOTT
 1. NÁZEV PŘÍPRAVKU KLACID SR Tablety s řízeným uvolňováním. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Clarithromycinum 500 mg v jedné tabletě s řízeným uvolňováním Pomocné látky: monohydrát laktosy Úplný
1. NÁZEV PŘÍPRAVKU KLACID SR Tablety s řízeným uvolňováním. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Clarithromycinum 500 mg v jedné tabletě s řízeným uvolňováním Pomocné látky: monohydrát laktosy Úplný
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Rovamycine 1,5 M.I.U: Jedna potahovaná tableta obsahuje spiramycinum 1,50 mil. m.j. (dále jen M.I.U.)
 sp.zn. sukls243841/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rovamycine 1,5 M.I.U. Rovamycine 3 M.I.U. potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ: Rovamycine 1,5 M.I.U: Jedna potahovaná
sp.zn. sukls243841/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rovamycine 1,5 M.I.U. Rovamycine 3 M.I.U. potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ: Rovamycine 1,5 M.I.U: Jedna potahovaná
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Mupirocinum calcicum 0,0645 g (což odpovídá 0,06 g mupirocinu) ve 3 g masti.
 sp.zn.sukls210114/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bactroban Nasal 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mupirocinum calcicum 0,0645 g (což odpovídá 0,06 g mupirocinu) ve 3 g masti. 3.
sp.zn.sukls210114/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bactroban Nasal 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mupirocinum calcicum 0,0645 g (což odpovídá 0,06 g mupirocinu) ve 3 g masti. 3.
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls38160/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXYBENE 100 mg TABLETY DOXYBENE 200 mg TABLETY 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Doxycyclinum
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls38160/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXYBENE 100 mg TABLETY DOXYBENE 200 mg TABLETY 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Doxycyclinum
Pomocná látka se známým účinkem: Jedna tableta obsahuje 75 mg monohydrátu laktosy. Úplný seznam pomocných látek viz bod 6.1.
 sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SANDOMIGRAN 0,5 mg obalené tablety 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SANDOMIGRAN 0,5 mg obalené tablety 2. KVALITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
Souhrn údajů o přípravku
 Příloha č. 1 ke sdělení sp. zn. sukls119756/2011 1. NÁZEV PŘÍPRAVKU AZIBIOT 500 mg potahované tablety Souhrn údajů o přípravku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Potahované tablety: Azithromycinum
Příloha č. 1 ke sdělení sp. zn. sukls119756/2011 1. NÁZEV PŘÍPRAVKU AZIBIOT 500 mg potahované tablety Souhrn údajů o přípravku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Potahované tablety: Azithromycinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp. zn. sukls201848/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ofloxacin-POS 3 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku očních kapek obsahuje ofloxacinum 3 mg.
Sp. zn. sukls201848/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ofloxacin-POS 3 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku očních kapek obsahuje ofloxacinum 3 mg.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls82246/2009 1. NÁZEV PŘÍPRAVKU Azitromycin Mylan 500 mg potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls82246/2009 1. NÁZEV PŘÍPRAVKU Azitromycin Mylan 500 mg potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
Přípravek Neo-angin třešeň je určen pro dospělé, dospívající a děti od 6 let.
 sp.zn. sukls21393/2010 a sp,zn. sukls6362/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NEO-ANGIN TŘEŠEŇ 1,2 mg/0,6 mg/ 5,9 mg pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje
sp.zn. sukls21393/2010 a sp,zn. sukls6362/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NEO-ANGIN TŘEŠEŇ 1,2 mg/0,6 mg/ 5,9 mg pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU RILEXINE 600 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Cefalexinum (ut C. monohydricum) 600 mg v 1 tabletě. Úplný
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU RILEXINE 600 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Cefalexinum (ut C. monohydricum) 600 mg v 1 tabletě. Úplný
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU ZUPREVO 40 mg/ml injekční roztok pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivá látka: Tildipirosinum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU ZUPREVO 40 mg/ml injekční roztok pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivá látka: Tildipirosinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DALACIN T 10 mg/ml kožní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Clindamycini phosphas je ve vodě rozpustný ester polosyntetického antibiotika vytvářeného
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DALACIN T 10 mg/ml kožní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Clindamycini phosphas je ve vodě rozpustný ester polosyntetického antibiotika vytvářeného
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
sp. zn. sukls145243/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU XIFLODROP 5 mg/ml Oční kapky, roztok
 sp. zn. sukls145243/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU XIFLODROP 5 mg/ml Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje moxifloxacini hydrochloridum 5,45
sp. zn. sukls145243/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU XIFLODROP 5 mg/ml Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje moxifloxacini hydrochloridum 5,45
sp.zn.sukls188553/2014
 sp.zn.sukls188553/2014 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU tablety s prodlouženým uvolňováním. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním obsahuje pentoxifyllinum
sp.zn.sukls188553/2014 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU tablety s prodlouženým uvolňováním. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním obsahuje pentoxifyllinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls190080/2010
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls190080/2010 1. NÁZEV PŘÍPRAVKU DALACIN T KOŽNÍ ROZTOK SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Clindamycini dihydrogenophosphas
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls190080/2010 1. NÁZEV PŘÍPRAVKU DALACIN T KOŽNÍ ROZTOK SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Clindamycini dihydrogenophosphas
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
Granule pro perorální roztok. Bílé až téměř bílé granule v jednodávkovém sáčku.
 Sp.zn.sukls70977/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Fosfomycin LadeePharma 3 g Granule pro perorální roztok 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fosfomycinum trometamoli. Jeden jednodávkový
Sp.zn.sukls70977/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Fosfomycin LadeePharma 3 g Granule pro perorální roztok 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fosfomycinum trometamoli. Jeden jednodávkový
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls153624/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Septomixine 286 mg/g + 190 000 IU/g dentální pasta 2. KVANTITATIVNÍ A KVALITATIVNÍ SLOŽENÍ 1 g pasty obsahuje hydrocortisoni acetas 286
sp.zn.sukls153624/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Septomixine 286 mg/g + 190 000 IU/g dentální pasta 2. KVANTITATIVNÍ A KVALITATIVNÍ SLOŽENÍ 1 g pasty obsahuje hydrocortisoni acetas 286
sp.zn.: sukls219632/2013, sukls219655/2013 a sp.zn.: sukls184216/2014, sukls184239/2014
 sp.zn.: sukls219632/2013, sukls219655/2013 a sp.zn.: sukls184216/2014, sukls184239/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU, 7 mg, tvrdé tobolky, 3,5 mg, tvrdé tobolky 3,5 mg, perorální prášek
sp.zn.: sukls219632/2013, sukls219655/2013 a sp.zn.: sukls184216/2014, sukls184239/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU, 7 mg, tvrdé tobolky, 3,5 mg, tvrdé tobolky 3,5 mg, perorální prášek
SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ. Trimetazidini dihydrochloridum 35 mg v jedné tabletě s řízeným uvolňováním.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Angizidine 35 mg, tablety s řízeným uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Trimetazidini dihydrochloridum 35 mg v jedné tabletě s řízeným uvolňováním.
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Angizidine 35 mg, tablety s řízeným uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Trimetazidini dihydrochloridum 35 mg v jedné tabletě s řízeným uvolňováním.
Florfeni-kel 300mg/ml inj. 100ml
 Florfeni-kel 300mg/ml inj. 100ml Popis zboží: FLORFENIKEL 300 mg/ml injekční roztok pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každý mililitr obsahuje Léčivá látka: Florfenicolum 300 mg Úplný
Florfeni-kel 300mg/ml inj. 100ml Popis zboží: FLORFENIKEL 300 mg/ml injekční roztok pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každý mililitr obsahuje Léčivá látka: Florfenicolum 300 mg Úplný
SOUHRN ÚDAJÚ O PŘÍPRAVKU
 SOUHRN ÚDAJÚ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BACTROBAN 20 mg/g mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram masti obsahuje mupirocinum 20 mg (2 % w/w). Úplný seznam pomocných látek viz bod 6.1.
SOUHRN ÚDAJÚ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BACTROBAN 20 mg/g mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram masti obsahuje mupirocinum 20 mg (2 % w/w). Úplný seznam pomocných látek viz bod 6.1.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
Souhrn údajů o přípravku
 Příloha č. 3 ke sdělení sp.zn. sukls104280/2011 1. NÁZEV PŘÍPRAVKU BACTROBAN Mast Souhrn údajů o přípravku 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Mupirocinum 0,3 g v 15 g masti. Úplný seznam pomocných
Příloha č. 3 ke sdělení sp.zn. sukls104280/2011 1. NÁZEV PŘÍPRAVKU BACTROBAN Mast Souhrn údajů o přípravku 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Mupirocinum 0,3 g v 15 g masti. Úplný seznam pomocných
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 1. NÁZEV PŘÍPRAVKU Nitresan 10 mg Nitresan 20 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 1. NÁZEV PŘÍPRAVKU Nitresan 10 mg Nitresan 20 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 1 mg žvýkací tablety pro psy Metacam 2,5 mg žvýkací tablety pro psy
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 1 mg žvýkací tablety pro psy Metacam 2,5 mg žvýkací tablety pro psy 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 1 mg žvýkací tablety pro psy Metacam 2,5 mg žvýkací tablety pro psy 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Shotapen injekční suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1ml obsahuje: Léčivé látky: Benzylpenicillinum (ut benzathinum)...
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Shotapen injekční suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1ml obsahuje: Léčivé látky: Benzylpenicillinum (ut benzathinum)...
sp.zn.: sukls49677/2013
 sp.zn.: sukls49677/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BIOPAROX nosní/orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fusafunginum 500 mg ve 100 ml. Jedna odměřená dávka obsahuje
sp.zn.: sukls49677/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BIOPAROX nosní/orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fusafunginum 500 mg ve 100 ml. Jedna odměřená dávka obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
 Sp.zn.sukls137614/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
Sp.zn.sukls137614/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU RILEXINE 75 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Cefalexinum (ut monohydricum) V jedné 200 mg tabletě... 75
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU RILEXINE 75 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Cefalexinum (ut monohydricum) V jedné 200 mg tabletě... 75
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 1. NÁZEV PŘÍPRAVKU LANBICA 50 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 1. NÁZEV PŘÍPRAVKU LANBICA 50 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tableta obsahuje 10 mg loratadinum. Jedna 10 mg tableta loratadinu obsahuje 71,3 mg monohydrátu laktosy.
 sp.zn. sukls138016/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 10 mg loratadinum. Jedna 10 mg tableta loratadinu obsahuje
sp.zn. sukls138016/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 10 mg loratadinum. Jedna 10 mg tableta loratadinu obsahuje
Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg.
 Sp.zn.sukls97430/2013 1.NÁZEV LÉČIVÉHO PŘÍPRAVKU Tannex 2 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg. Pomocná látka se známým účinkem:
Sp.zn.sukls97430/2013 1.NÁZEV LÉČIVÉHO PŘÍPRAVKU Tannex 2 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg. Pomocná látka se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls63588/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se známým účinkem:
sp.zn.sukls63588/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se známým účinkem:
Příloha č. 1 k rozhodnutí o změně v povolení souběžného dovozu sp. zn.: sukls13759/2013, sukls13760/2013
 Příloha č. 1 k rozhodnutí o změně v povolení souběžného dovozu sp. zn.: sukls13759/2013, sukls13760/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FROMILID 250 FROMILID 500 potahované tablety (clarithromycinum)
Příloha č. 1 k rozhodnutí o změně v povolení souběžného dovozu sp. zn.: sukls13759/2013, sukls13760/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FROMILID 250 FROMILID 500 potahované tablety (clarithromycinum)
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007 1. NÁZEV PŘÍPRAVKU UNIPRES 10 UNIPRES 20 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007 1. NÁZEV PŘÍPRAVKU UNIPRES 10 UNIPRES 20 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU. K symptomatické krátkodobé léčbě akutního průjmu u dospělých a dospívajících starších 12 let.
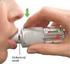 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls188317/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRVKU Lopacut 2 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls188317/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRVKU Lopacut 2 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Clarithromycin Aurobindo 250 mg potahované tablety Clarithromycin Aurobindo 500 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Clarithromycin Aurobindo 250 mg potahované tablety Clarithromycin Aurobindo 500 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tobolka obsahuje azithromycinum 250 mg ve formě azithromycinum dihydricum.
 sp. zn. sukls114667/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SUMAMED tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje azithromycinum 250 mg ve formě azithromycinum dihydricum.
sp. zn. sukls114667/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SUMAMED tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje azithromycinum 250 mg ve formě azithromycinum dihydricum.
Jedna obalená tableta obsahuje Valerianae extractum siccum (3-6:1), extrahováno ethanolem 70% (V/V) 445 mg.
 Sp.zn.sukls16435/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU PERSEN mono obalená tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje Valerianae extractum siccum (3-6:1),
Sp.zn.sukls16435/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU PERSEN mono obalená tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje Valerianae extractum siccum (3-6:1),
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LEVOPRONT sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: levodropropizinum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LEVOPRONT sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: levodropropizinum
Tableta s prodlouženým uvolňováním. Popis přípravku : bílé, kulaté, nepotahované tablety se zkosenými hranami.
 Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls37077/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls37077/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls13074/2011 a sukls13103/2011
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls13074/2011 a sukls13103/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU AZITROX 250 AZITROX 500 potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls13074/2011 a sukls13103/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU AZITROX 250 AZITROX 500 potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls235834/2012, sukls140698/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Triprim 200 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje trimethoprimum 200 mg. Úplný
sp.zn.: sukls235834/2012, sukls140698/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Triprim 200 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje trimethoprimum 200 mg. Úplný
Tento přípravek se používá jednou za 24 hodin, maximálně během 3 5 dnů. Nesmí se používat dlouhodobě.
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls156150/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Dettol 0,2 % antiseptický sprej 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: benzalconii
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls156150/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Dettol 0,2 % antiseptický sprej 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: benzalconii
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls2006/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL Rapide potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls2006/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL Rapide potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls13074/2011 a sukls13103/2011
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls13074/2011 a sukls13103/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE AZITROX 250 AZITROX 500 potahované tablety azithromycinum Přečtěte si
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls13074/2011 a sukls13103/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE AZITROX 250 AZITROX 500 potahované tablety azithromycinum Přečtěte si
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.2 k rozhodnutí o změně registrace sp.zn. sukls 145753/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Betaserc 16 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 16 mg
Příloha č.2 k rozhodnutí o změně registrace sp.zn. sukls 145753/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Betaserc 16 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 16 mg
Implementace laboratorní medicíny do systému vzdělávání na Univerzitě Palackého v Olomouci. reg. č.: CZ.1.07/2.2.00/
 Implementace laboratorní medicíny do systému vzdělávání na Univerzitě Palackého v Olomouci reg. č.: CZ.1.07/2.2.00/28.0088 PROBLEMATIKA INFEKCÍ HORNÍCH CEST DÝCHACÍCH DIAGNOSTIKA A LÉČBA TONSILITID, SINUSITID
Implementace laboratorní medicíny do systému vzdělávání na Univerzitě Palackého v Olomouci reg. č.: CZ.1.07/2.2.00/28.0088 PROBLEMATIKA INFEKCÍ HORNÍCH CEST DÝCHACÍCH DIAGNOSTIKA A LÉČBA TONSILITID, SINUSITID
