UNIVERZITA PALACKÉHO V OLOMOUCI LÉKAŘSKÁ FAKULTA Ústav mikrobiologie. Doktorská disertační práce
|
|
|
- Radim Kučera
- před 4 lety
- Počet zobrazení:
Transkript
1 UNIVERZITA PALACKÉHO V OLOMOUCI LÉKAŘSKÁ FAKULTA Ústav mikrobiologie MOŽNOSTI TESTOVÁNÍ ANTIMIKROBNÍ AKTIVITY STÁVAJÍCÍCH A NOVĚ VYVÍJENÝCH LÁTEK Doktorská disertační práce Olomouc 2017 Mgr. Renata Večeřová 1
2 Poděkování Děkuji svému školiteli prof. MUDr. Milanu Kolářovi, Ph.D za odborné vedení v průběhu celého doktorského studia a za cenné rady, připomínky a náměty při zpracování disertační práce. Poděkování patří také doc. RNDr. Aleši Panáčkovi, Ph.D z Katedry fyzikální chemie Přírodovědecké fakulty Univerzity Palackého v Olomouci a Ing. Dominiku Rejmanovi Ph.D. z Ústavu organické chemie a biochemie AV ČR za výbornou spolupráci a přípravu látek pro testování antimikrobní aktivity. V neposlední řadě děkuji své rodině za podporu, zázemí a trpělivost. 2
3 Čestné prohlášení Čestně prohlašuji, že jsem disertační práci s názvem Možnosti testování antimikrobní aktivity stávajících a nově vyvíjených látek vypracovala samostatně. Použitou literaturu a všechny podklady uvádím v přiloženém seznamu literatury. V Olomouci dne 18. dubna Mgr. Renata Večeřová 3
4 OBSAH 1. ÚVOD PROBLEMATIKA BAKTERIÁLNÍ REZISTENCE K ANTIMIKROBNÍM PŘÍPRAVKŮM Rezistence bakterií k antibiotikům a její vývoj Klinický dopad bakteriální rezistence na antibiotickou léčbu Možnosti řešení problému bakteriální rezistence VÝVOJ NOVÝCH LÁTEK S ANTIMIKROBNÍ ÚČINNOSTÍ Vývoj nových antibiotik Nanočástice stříbra Stříbro a historie jeho použití v medicíně Koloidní stříbro Lipofosfonoxiny CÍL PRÁCE STANOVENÍ ANTIMIKROBNÍ AKTIVITY NANOČÁSTIC STŘÍBRA Stanovení antimikrobní účinnosti nanočástic stříbra a jejich kombinace s antibiotiky Stanovení antimikrobní účinnosti nanokompozitů a povrchů s nanočásticemi stříbra Indukce bakteriální rezistence k nanočásticím stříbra STANOVENÍ ANTIMIKROBNÍ AKTIVITY LIPOFOSFONOXINŮ Stanovení antimikrobní účinnosti lipofosfonoxinů Stanovení antimikrobní účinnosti kostních cementů s navázanými lipofosfonoxiny Indukce bakteriální rezistence k lipofosfonoxinům MATERIÁL A METODY STANOVENÍ ANTIMIKROBNÍ AKTIVITY NANOČÁSTIC STŘÍBRA Stanovení antimikrobní účinnosti nanočástic stříbra a jejich kombinace s antibiotiky Stanovení antibakteriální účinnosti Stanovení antifungální účinnosti Stanovení účinku kombinace nanočástic stříbra a antibiotik Účinek kombinace AgNPs a antibiotik na citlivé bakterie Účinek kombinace AgNPs a antibiotik na rezistentní bakterie Fenotypová detekce produkce ESBL na modifikovaných agarech s AgNPs Stanovení antimikrobní účinnosti nanokompozitů a povrchů s nanočásticemi stříbra Stanovení účinku nanokompozitů s nanočásticemi stříbra Nanokompozit Ag/PDDA-křemelina Stanovení MIC Ag/PDDA-CBL Kvalitativní stanovení rychlosti baktericidního účinku
5 Kvantitativní stanovení rychlosti baktericidního účinku Stanovení aktivity metylcelulózového hydrogelu s nanočásticemi stříbra Stanovení antibakteriálního účinku povrchů s nanočásticemi stříbra Testování antibakteriální aktivity povrchu plastů Testování antibakteriální aktivity textilií Indukce bakteriální rezistence k nanočásticím stříbra STANOVENÍ ANTIMIKROBNÍ AKTIVITY LIPOFOSFONOXINŮ Stanovení antibakteriální účinnosti Semikvantitativní hodnocení baktericidního účinku v čase Stanovení účinku kostních cementů s lipofosfonoxiny Indukce bakteriální rezistence k lipofosfonoxinům VÝSLEDKY ANTIMIKROBNÍ AKTIVITA NANOČÁSTIC STŘÍBRA Stanovení antimikrobní účinnosti nanočástic stříbra a jejich kombinace s antibiotiky Antibakteriální aktivita nanočástic stříbra Antifungální aktivita nanočástic stříbra Účinek nanočástic stříbra a jejich kombinace s antibiotiky Účinek kombinace AgNPs a antibiotik na citlivé bakterie Účinek kombinace AgNPs a antibiotik na rezistentní bakterie Inhibice produkce ESBL na modifikovaném agaru s AgNPs Antimikrobní účinnost nanokompozitů a povrchů s nanočásticemi stříbra Nanokompozity s nanočásticemi stříbra Účinek nanokompozitu Ag/PDDA-křemelina Stanovení MIC nanokompozitu Kvalitativní stanovení baktericidního účinku Kvantitativní stanovení baktericidního účinku Účinek metylcelulózového hydrogelu s nanočásticemi stříbra Aktivita povrchů s nanočásticemi stříbra Antibakteriální aktivita povrchu plastů Antibakteriální aktivita textilií Indukce bakteriální rezistence k nanočásticím stříbra ANTIMIKROBNÍ AKTIVITA LIPOFOSFONOXINŮ Stanovení antibakteriální účinnosti Stanovení MIC a MBC lipofosfonoxinů Semikvantitativní hodnocení baktericidního účinku Antimikrobní účinnost kostních cementů s navázanými lipofosfonoxiny Indukce rezistence k lipofosfonoxinům
6 5. DISKUZE STŘÍBRO A JEHO ANTIMIKROBNÍ AKTIVITA Zhodnocení antimikrobní účinnosti nanočástic stříbra a jejich kombinace s antibiotiky Možnosti nanokompozitů a povrchů s nanočásticemi stříbra Problematika bakteriální rezistence k nanočásticím stříbra ANTIMIKROBNÍ ÚČINNOST LIPOFOSFONOXINŮ Zhodnocení účinku lipofosfonoxinů na bakterie Možnosti kostních cementů s navázanými lipofosfonoxiny Potenciální vývoj bakteriální rezistence k lipofosfonoxinům ZÁVĚR SOUHRN SUMMARY SEZNAM ZKRATEK SEZNAMY TABULEK, SCHÉMAT, GRAFŮ A OBRÁZKŮ SEZNAM TABULEK SEZNAM SCHÉMAT SEZNAM GRAFŮ SEZNAM OBRÁZKŮ LITERATURA SEZNAM PUBLIKACÍ SOUVISEJÍCÍCH S TÉMATEM DISERTAČNÍ PRÁCE PUBLIKACE V ČASOPISECH S IMPAKT FAKTOREM PUBLIKACE V RECENZOVANÝCH ČASOPISECH SEZNAM PŘEDNÁŠEK A POSTERŮ SOUVISEJÍCÍCH S TÉMATEM DISERTAČNÍ PRÁCE
7 1. ÚVOD 1.1 PROBLEMATIKA BAKTERIÁLNÍ REZISTENCE K ANTIMIKROBNÍM PŘÍPRAVKŮM Rezistence bakterií k antibiotikům a její vývoj Bakteriální rezistence je schopnost bakterií odolat působení antimikrobní látky. Bakteriální rezistence se dělí na dva základní typy, přirozenou (primární) a získanou (sekundární). Bakterie jsou vůči některým antibiotikům primárně rezistentní, protože nemají cílovou strukturu příslušného antibiotika. Příkladem mohou být mykoplasmata přirozeně rezistentní ke všem beta-laktamovým antibiotikům, enterobakterie rezistentní k penicilinu, enterokoky k cefalosporinům nebo kmeny Proteus sp. ke kolistinu. Získaná (sekundární) rezistence vzniká následkem evoluce bakteriálního genomu a selekčního tlaku prostředí. Původně citlivý kmen se stává k definované antibakteriální látce rezistentní. Mechanismy získané rezistence lze rozdělit do několika skupin: změna cílové struktury, zábrana nebo zhoršený průnik antibiotika do buňky, aktivní eflux antibiotika z buňky nebo inaktivace antibiotika enzymem. Ke změnám genomu dochází mutací (chromozomální rezistence) nebo převzetím extrachromozomální DNA od bakterií rezistentních na dané antibiotikum (extrachromozomální rezistence) [83]. Vlivem selekčního tlaku antibiotik rezistentní kmeny přežívají a rychle se rozšiřují. Například ve Fakultní nemocnici Olomouc byla popsána souvislost mezi zvýšenou aplikací cefalosporinů III. generace a nárůstem četnosti ESBL produkujících kmenů Klebsiella pneumoniae rezistentních k širokospektrým penicilinům a cefalosporinům [75]. Objevují se ale i studie, které přímou souvislost mezi spotřebou antibiotik a rostoucí rezistencí bakterií popírají. Například práce Htoutou Sedlákové a kol. uvádí, že během11-letého sledování nedošlo ke snížení výskytu kmenů rezistentních k cefalosporinům a fluorochinolonům, i když jejich spotřeba klesala [26]. Je tedy nutné počítat s možností, že geny kódující rezistenci se mohou rekombinačními procesy horizontálně dále šířit bez ohledu na spotřebu antibiotik. Nicméně vysoká spotřeba antibiotik v humánní i veterinární oblasti vytváří nadále ideální podmínky pro vznik a šíření bakteriální rezistence Klinický dopad bakteriální rezistence na antibiotickou léčbu Vzrůstající rezistence bakterií ke stávajícím antibakteriálním přípravkům představuje závažný problém ve zdravotnictví a infekce způsobené multirezistentními bakteriemi zvyšují nemocnost a úmrtnost pacientů z důvodu selhání antibiotické léčby. Narůstající invazivita léčebných a diagnostických postupů v současné medicíně má za následek stoupající počet komplikujících bakteriálních infekcí, především u pacientů hospitalizovaných na jednotkách intenzívní péče [34, 58]. Při léčbě infekcí způsobených multirezistentními gramnegativními patogeny, jako jsou komplikované intraabdominální infekce nebo ventilátorové pneumonie a sepse, dochází k situacím, kdy k eradikaci 7
8 vyvolávajícího bakteriálního patogena nemáme již žádné účinné antibiotikum nebo je výběr adekvátní antibiotické léčby je velmi limitovaný [67] Možnosti řešení problému bakteriální rezistence Při řešení problému vzrůstající rezistence bakteriálních patogenů k antibiotikům, je nutné využít všech stávajících možností. To znamená podávat antibiotika cíleně na základě mikrobiologického vyšetření a antibiogramu, optimalizovat dávkování a využívat působení kombinací antibiotik. Pokud není možná časová prodleva až do výsledku laboratorního vyšetření, zohlednit v iniciální antibiotické léčbě lokální situaci ve frekvenci bakteriálních patogenů a jejich rezistenci k antibiotikům. Z tohoto důvodu je tedy nezbytně nutné monitorovat výskyt rezistentních bakteriálních kmenů, resp. realizovat surveillance bakteriální rezistence v jejím plném rozsahu. Pro zabránění přenosu rezistentních bakterií je potřeba dodržovat příslušné hygienické a epidemiologické režimy. Velmi potřebná je informovanost odborné i laické veřejnosti. V neposlední řadě je nutné pokračovat ve studiu vlastností již známých látek s antimikrobním účinkem, vyvíjet a hledat látky nové [32, 33, 34]. 1.2 VÝVOJ NOVÝCH LÁTEK S ANTIMIKROBNÍ ÚČINNOSTÍ Vývoj nových antibiotik Nové antibakteriální látky se na trh dostávají velmi pomalu. Jejich výzkum je finančně náročný a ve srovnání s jinými skupinami léčiv nerentabilní. Většina používaných antibiotik je známa ze let minulého století, v následujících letech se vývoj nových antibakteriálních látek výrazně zpomalil. Za posledních 15 let bylo registrováno 30 nových molekul antibiotik, z nichž většina má chemickou strukturu odvozenou od již známého antibiotika. Z hlediska vývoje rezistence je však důležité zaměřit se také na vývoj originálních molekul s novým mechanismem účinku. Ani to ovšem není zárukou jejich dlouhodobé účinnosti. Je jen otázkou času, kdy si bakterie vyvinou rezistenci i proti novým látkám [67] Nanočástice stříbra STŘÍBRO A HISTORIE JEHO POUŽITÍ V MEDICÍNĚ Stříbro, latinsky Argentum, chemická značka Ag, je ušlechtilý kov bílé barvy, používaný člověkem pro své antimikrobní účinky již od starověku. Stříbrné nádoby se používaly k uchovávání potravin, do mléka a tekutin se vkládaly stříbrné mince pro prodloužení trvanlivosti. V 15. století se na stolech šlechty dokonce objevovaly slánky s mletým stříbrem, které se přidávalo do jídla [2]. Od konce 19. století se používala metoda tzv. kredeizace, tj. profylaktické opatření k zabránění hnisavé gonokokové konjunktivitidy novorozenců pomocí 1% roztoku AgNO 3. Počátkem 20. století se stříbro 8
9 užívalo jako lék na různé druhy infekcí a chorob, ale také lokálně na ošetření popálenin a léčení plísňových nákaz. S příchodem antibiotické éry používání stříbra v medicíně ustupovalo a stříbro se používalo pouze pro dezinfekci pitné vody nebo pro povrchové lokální ošetření ran přípravky s obsahem sulfodiazinu stříbrného [2, 44]. Dnešní doba přináší renesanci používání stříbra pro medicínské i průmyslové aplikace. Příkladem jsou lokální přípravky s obsahem stříbra k ošetření ran (náplasti, obvazový materiál), kosmetické přípravky, hygienické potřeby, roušky, textil a obuv, matrace nebo nátěrové hmoty. Biologickým vlastnostem stříbra je věnována velká pozornost [5, 7]. Intenzivně studované jsou zejména antimikrobní vlastnosti a toxicita koloidního stříbra. Prokázaný antimikrobní efekt koloidního stříbra je však ve svém uplatnění omezován nežádoucími vedlejšími účinky. Při lokální aplikaci byly popsány reakce z přecitlivělosti. Dlouhodobé celkové i lokální užívání může vést k ukládání stříbra a jeho solí do tkání. Výsledkem je nevratné šedomodré zabarvení, tzv. argyrie. Tyto nežádoucí účinky byly důvodem zákazu vnitřního užívání koloidního stříbra v rámci EU s platností od [2, 5, 15, 44] KOLOIDNÍ STŘÍBRO Koloid je označení pro disperzní soustavu, ve které jsou rozptýlené částice o velikostí nm. Koloidní částice v tomto rozmezí udělují danému systému unikátní vlastnosti, které se nevyskytují u částic jiných rozměrů. Tyto vlastnosti souvisí s malým rozměrem částic a velkou plochou jejich povrchu, charakterem fázového rozhraní a jeho interakcí s okolním prostředím [15]. Koloidní stříbro je vyráběno ve formě vodní disperze. Obvykle se jedná o nanočástice stříbra o velikosti nm. Nejužívanějšími metodami přípravy jsou chemické redukční metody, které jsou levné, rychlé a umožňují ovlivnění konečných vlastností nanočástic stříbra jako je jejich velikost, tvar a povrchový náboj [52, 53]. Nanočástice stříbra lze vyrobit také elektrochemickým procesem za použití stříbrných elektrod nebo syntetizovat pomocí různých mikroorganizmů, například enterobakterií, stafylokoků nebo vláknitých hub, které jsou zdrojem redukčních enzymů. Nevýhodou biologické výroby nanočástic je omezená možnost ovlivnění jejich vlastností [40, 63] Lipofosfonoxiny Lipofosfonoxiny (LPPOs) jsou nedávno objevené látky, u kterých byla zjištěna antibakteriální aktivita proti grampozitivním bakteriím, na které působí baktericidně destrukcí cytoplasmatické membrány [60]. Jsou to uměle vytvořené modulární látky vycházející ze struktury fosfonoxinů, skládají se ze čtyř strukturních modulů: nukleosid, iminocukr, hydrofobní lipofilní alkylový řetězec a spojovací fosfanát, který spojuje jednotlivé moduly. Obecná struktura LPPOs je zobrazena ve 9
10 schématu 1 [61, 71]. Výzkum lipofosfonoxinů nadále probíhá a snahou je vytvořit nové látky, které by působily na široké spektrum mikroorganismů, včetně multirezistentních gramnegativních bakterií. Schéma 1: Modulární struktura lipofosfonoxinů 2. CÍL PRÁCE Cíle předložené disertační práce jsou definovány následujícími body: 2.1 STANOVENÍ ANTIMIKROBNÍ AKTIVITY NANOČÁSTIC STŘÍBRA Stanovení antimikrobní účinnosti nanočástic stříbra a jejich kombinace s antibiotiky Stanovení antimikrobní účinnosti nanokompozitů a povrchů s nanočásticemi stříbra Indukce bakteriální rezistence k nanočásticím stříbra 2.2 STANOVENÍ ANTIMIKROBNÍ AKTIVITY LIPOFOSFONOXINŮ Stanovení antimikrobní účinnosti lipofosfonoxinů Stanovení antimikrobní účinnosti kostních cementů s navázanými lipofosfonoxiny Indukce bakteriální rezistence k lipofosfonoxinům 10
11 3. MATERIÁL A METODY 3.1 STANOVENÍ ANTIMIKROBNÍ AKTIVITY NANOČÁSTIC STŘÍBRA Nanočástice stříbra (AgNPs) a všechny koloidní systémy byly připraveny na Katedře fyzikální chemie Přírodovědecké fakulty Univerzity Palackého v Olomouci modifikovaným Tollensovým procesem za použití kationového komplexu [Ag(NH 3 ) 2 ] +, který byl v alkalickém prostředí (ph = 11.5) redukován D-maltózou (Schéma 2). Počáteční koncentrace AgNO 3 byla mol/l, NH mol/l, NaOH a maltózy mol/l. Reakce probíhala při laboratorní teplotě za stálého míchání po dobu 5 minut. Koncentrace připravených nanočástic stříbra byla 108 mg/l. Schéma 2: Modifikovaný Tollensův proces NaOH, redukující látka Ag + + 2NH 3 [Ag(NH 3 ) 2 ] + Ag Stanovení antimikrobní účinnosti nanočástic stříbra a jejich kombinace s antibiotiky Pro stanovení antimikrobní aktivity nanočástic stříbra bylo provedeno testování s aerobními, fakultativně anaerobními a anaerobními bakteriemi, přičemž byly použity citlivé i rezistentní bakteriální kmeny. Dále byla sledována účinnost na kvasinky a posouzena možná synergická aktivita nanočástic stříbra s antibiotiky STANOVENÍ ANTIBAKTERIÁLNÍ ÚČINNOSTI Antibakteriální účinnost byla testována pomocí standardní diluční mikrometody určením minimální inhibiční koncentrace (MIC) látky potřebné k inhibici růstu bakterie a minimální baktericidní koncentrace (MBC) látky potřebné k usmrcení bakterií. Testování bylo prováděno v mikrotitrační destičce, vzorky byly ředěny geometrickou řadou v Mueller-Hinton (MH) bujónu na koncentrace 54 0,084 mg/l. Pro srovnání antimikrobního účinku bylo testováno také iontové stříbro ve formě AgNO 3. Do destiček bylo očkováno standardní množství testovaného mikroba, hustota inokula odpovídala 10 6 CFU/ml. Po 24 hod inkubace při 35 C byla odečtena MIC jako nejnižší koncentrace testované látky, která inhibovala viditelný růst mikroorganismu. Jamky bez viditelného růstu byly inokulovány na krevní agar pro stanovení MBC [12, 14, 76]. Testované bakterie zahrnovaly sbírkové kmeny: Enterococcus faecalis CCM 4224, Staphylococcus aureus CCM 3953, Escherichia coli CCM 3954, Pseudomonas aeruginosa CCM 3955 a kmeny ze sbírky Ústavu mikrobiologie Lékařské fakulty Univerzity Palackého v Olomouci 11
12 Pseudomonas aeruginosa, Staphylococcus epidermidis, Staphylococcus aureus MRSA, Enterococcus faecium VRE a ESBL-pozitivní kmen Klebsiella pneumoniae. Pro přípravu kultivačního MH bujónu byl použitý Beef extrakt dessicated (Difco), Casein acid hydrolysate technical (HIMEDIA), ph 7,2 bylo upraveno pomocí 20% NaHCO 3. Antibakteriální účinnost AgNPs o velikosti 28 nm u anaerobních bakterií byla testována pomocí diluční mikrometody určením MIC. Testování bylo provedeno v mikrotitrační destičce, vzorky byly ředěny geometrickou řadou ve VL bujónu. Pro přípravu kultivačního VL bujónu byly použity Brain Heart Infusion (HIMEDIA), Yeast autolysate (HIMEDIA), Ferrum (LEK) a Kanavit (BIOTIKA). Do destiček bylo očkováno standardní množství testovaného mikroba, hustota inokula odpovídala 10 6 CFU/ml. Po 72 hodinách inkubace v anaerobní atmosféře (Systém pro anaerobní kultivaci LAS, Trios) při 35 C byla odečtena MIC jako nejnižší koncentrace testované látky, která inhibovala viditelný růst testovaných mikroorganismů. Pro testování byly použity anaerobní bakterie z České sbírky mikroorganismů v Brně: Bacteroides fragilis CCM 4712, Bacteroides thetaiotaomicron CCM 4713, Eggerthella lenta CCM 4714, Propionibacterium acnes CCM 3343, Clostridium perfringens CCM 4991 a Clostridium difficile CCM Kmen Fusobacterium varium pocházel ze sbírky bakterií Ústavu mikrobiologie Lékařské fakulty Univerzity Palackého v Olomouci [81] STANOVENÍ ANTIFUNGÁLNÍ ÚČINNOSTI Antifungální účinky byly stanoveny podobně jako antibakteriální účinky, tedy stanovením MIC pomocí diluční mikrometody a určením minimální fungicidní aktivity (MFC) po přeočkování na Sabouraudův agar a následné kultivaci. Pro testování byly zvoleny nanočástice stříbra o velikosti 25 nm připravené redukcí maltosou a stabilizované povrchově aktivními látkami (sodium dodecylsulfát, Tween 80, Brij, PVP 360). Antifungální aktivita nanočástic stříbra byla testována u čtyř kmenů kvasinek ze sbírky Ústavu mikrobiologie Lékařské fakulty Univerzity Palackého v Olomouci. Jednalo se o 2 kmeny Candida albicans, Candida parapsilosis a Candida tropicalis [51] STANOVENÍ ÚČINKU KOMBINACE NANOČÁSTIC STŘÍBRA A ANTIBIOTIK Účinek kombinací vybraných antibiotik s různým mechanismem účinku a nanočástic stříbra byl hodnocen u citlivých i rezistentních bakterií pomocí diluční mikrometody ÚČINEK KOMBINACE AGNPS A ANTIBIOTIK NA CITLIVÉ BAKTERIE Synergická aktivita byla hodnocena při subinhibičních koncentracích, tedy při koncentracích pod hodnotami MIC samotných antibiotik i nanočástic stříbra. V testech byly použity referenční bakterie Escherichia coli CCM 4225, Pseudomonas aeruginosa CCM 3955 a Staphylococcus aureus CCM 4223 citlivé k testovaným antibiotikům. Sestava testovaných antibiotik se lišila podle druhu 12
13 bakterie. Pro Escherichia coli byla zvolena antibiotika ampicilin, ampicilin/sulbactam, cefazolin, cefuroxim, cefoxitin, gentamicin, sulfamethoxazol/trimethoprim, kolistin, kyselina oxolinová, ofloxacin, tetracyklin a aztreonam. U Pseudomonas aeruginosa byla testována antibiotika piperacilin, piperacilin/tazobactam, aztreonam, meropenem, ceftazidim, cefoperazon, cefepim, gentamicin, amikacin, kolistin, ofloxacin a ciprofloxacin. Pro Staphylococcus aureus byla vybrána antibiotika benzylpenicilin, oxacilin, ampicilin/sulbactam, chloramfenikol, sulfamethoxazol/trimethoprim, tetracyklin, erytromycin, klindamycin, ciprofloxacin, gentamicin, teikoplanin a vankomycin ÚČINEK KOMBINACE AGNPS A ANTIBIOTIK NA REZISTENTNÍ BAKTERIE Synergický, indiferentní nebo aditivní účinek každé jednotlivé kombinace antibiotika a nanočástic stříbra byl stanoven pomocí koeficientu FIC (frakční inhibiční koncentrace). Postup výpočtu znázorňuje schéma 3. Hodnota FIC 0,5 byla vyhodnocena jako synergie; FIC 0,5-1 byla hodnocena jako aditivní efekt, FIC 1-2 indiferentní účinek a hodnota FIC 2 byla hodnocena jako antagonismus [14, 29]. V testech byly použity multirezistentní bakterie ze sbírky bakterií Ústavu mikrobiologie Lékařské fakulty Univerzity Palackého v Olomouci: Klebsiella pneumoniae produkující ESBL (blatem, blashv, blactx-m), Escherichia coli produkující ESBL (blashv-12), Escherichia coli produkující AmpC (blacmy-2) a Klebsiella pneumoniae produkující karbapenemázu (blakpc). U všech kmenů byla v kombinaci s AgNPs testována následující antibiotika: cefotaxim, ceftazidim, meropenem, ciprofloxacin a gentamicin. Schéma 3:Výpočet hodnoty FIC FIC = MIC AgNPs v kombinaci MIC AgNPs + MIC ATB v kombinaci MIC ATB FENOTYPOVÁ DETEKCE PRODUKCE ESBL NA MODIFIKOVANÝCH AGARECH S AGNPS Stanovení produkce širokospektrých beta-laktamáz ESBL metodou DDST (double disk synergy test) je založeno na detekci deformace inhibičních zón, které vytváří testovaný kmen na Mueller-Hinton agaru mezi disky s cefalosporiny a aztreonamem a diskem s obsahem amoxicilinu s kyselinou klavulanovou. Vzdálenost disků byla v rozmezí mm od středů. Současně byla hodnocena velikost inhibiční zóny kolem disků ceftazidimu a ceftazidimu s kyselinou klavulanovou. Inokulované plotny s rozmístěnými antibiotickými disky byly inkubovány při 35 C po dobu 24 hod. DDST testy byly provedeny u ESBL-pozitivních kmenů Escherichia coli a Klebsiella pneumoniae. Test byl proveden na standardním MH agaru a na MH agaru obsahujícím AgNPs v subinhibiční koncentraci 5 mg/l. Modifikovaný agar byl připraven tak, že do ještě tekutého MH agaru byla po 13
14 sterilizaci přidána, při teplotě 50 C, suspenze AgNPs. Agar byl rozplněn do Petriho misek, aby bylo dosaženo výšky agaru 4 mm. Doporučené kombinace a rozložení antibiotických disků ukazuje schéma 4 [13]. Schéma 4: Schéma provedení DDST Stanovení antimikrobní účinnosti nanokompozitů a povrchů s nanočásticemi stříbra Antibakteriální aktivita nanočástic stříbra byla hodnocena také v konkrétních aplikacích při vazbě AgNPs na křemelinu, metylcelulózu, povrchy plastů a textilií STANOVENÍ ÚČINKU NANOKOMPOZITŮ S NANOČÁSTICEMI STŘÍBRA Termínem nanokompozity jsou označovány materiály složené ze dvou nebo více složek, z nichž alespoň jedna se v materiálu vyskytuje ve formě částic o velikosti do 100 nm. Vzorky nanokompozitů s AgNPs byly připraveny na Přírodovědecké fakultě Univerzity Palackého v Olomouci NANOKOMPOZIT AG/PDDA-KŘEMELINA Křemelina je běžně používána k filtracím v potravinářském průmyslu. Jedná se o lehký práškový materiál s velkým množstvím pórů o velikosti µm, které zachytí hrubé nečistoty a kvasinky, ale propustí bakterie. Testovaný nanokompozit Ag/PDDA-CBL3 byl připraven navázáním AgNPs na křemelinu CBL3 (Obrázek 1). Koncentrace stříbra byla 46,6 mg AgNPs na 1 g kompozitu. Stříbrné nanočástice byly velmi silně poutány na povrch křemeliny, koncentrace uvolňovaného stříbra z nanokompozitů byla ve vodném prostředí velmi nízká [49]. 14
15 Obrázek 1: TEM snímek nanokompozitu Ag/PDDA-CBL Stanovení MIC Ag/PDDA-CBL3 Diluční mikrometodou byla určena MIC nanokompozitů. Pro testování byly použity bakteriální kmeny Enterococcus faecalis CCM 4224, Staphylococcus aureus CCM 3953, Escherichia coli CCM 3954, Pseudomonas aeruginosa CCM 3955 a multirezistentní kmeny ze sbírky Ústavu mikrobiologie Lékařské fakulty Univerzity Palackého v Olomouci, konkrétně ciprofloxacin-rezistentní kmen Pseudomonas aeruginosa, ESBL-pozitivní kmen Klebsiella pneumoniae, oxacilin-rezistentní kmen Staphylococcus epidermidis, Staphylococcus aureus MRSA a Enterococcus faecium VRE Kvalitativní stanovení rychlosti baktericidního účinku Kvalitativní stanovení rychlosti baktericidního účinku bylo testováno u nanokompozitů s koncentracemi Ag 120 a 60 mg/l u bakterií Escherichia coli CCM 3954 a Enterococcus faecalis CCM Z čerstvě narostlé bakteriální kultury byla připravena buněčná suspenze v destilované vodě o koncentraci cca 3x10 8 CFU/ml. K 5 ml vzorku bylo přidáno 50 μl připravené bakteriální suspenze a vzorky s bakteriemi byly inkubovány ve vodní třepací lázni při 24 C. V časech 0, 15, 30, 45 a 60 min byly vzorky vyočkovány na krevní agar a po 24 hodinové inkubaci při 35 C vyhodnoceny. Rozmístění vyočkovaných vzorků na krevním agaru je znázorněno ve schématu 5. Schéma 5: Kvalitativní stanovení baktericidního účinku 1 Enterococcus faecalis 120 mg/l Ag 2 Enterococcus faecalis 60 mg/l 3 Enterococcus faecalis CBL-3 bez Ag 4 Enterococcus faecalis - kontrola růstu 5 Escherichia coli 120 mg/l Ag 6 Escherichia coli 60 mg/l Ag 7 Escherichia coli CBL-3 bez Ag 8 Escherichia coli - kontrola růstu
16 Kvantitativní stanovení rychlosti baktericidního účinku Pro kvantitativní stanovení rychlosti baktericidního účinku (kill time assay) byl testován nanokompozit Ag/PDDA-CBL-3 s kmeny Escherichia coli CCM 3954 a Enterococcus faecalis CCM V disperzích nanokompozitu odpovídajícím koncentraci stříbra 40; 20; 10; 5; a 2,5 mg/l byla připravena bakteriální suspenze o počáteční koncentraci 10 6 CFU/ml. Všechny vzorky byly inkubovány za stálého míchání při teplotě 24 C po dobu 360 min. V časových intervalech 0, 15, 30, 45, 60, 120, 180 a 360 min bylo vyočkováno 100 µl vzorků, ředěno fyziologickým roztokem a očkováno na krevní agar. Po 24 hodinách inkubace při 35 C byly spočítány narostlé kolonie a přepočítané na počet CFU/ml [29, 49] STANOVENÍ AKTIVITY METYLCELULÓZOVÉHO HYDROGELU S NANOČÁSTICEMI STŘÍBRA Metylcelulózový hydrogel s nanočásticemi stříbra byl syntetizován pro možnou lokální aplikaci na rány a popáleniny. V hydrogelu byly navázány nanočástice stříbra o velikosti 10 nm ve vysoké koncentraci 5 g/l. Pro přípravu AgNPs o velikosti 10 nm bylo použité redukční činidlo NaBH 4 a pro stabilizaci vzniklých AgNPs byl použitý polyakrylát sodný. Takto připravené AgNPs byly vloženy do metylcelulózové suspenze a za zvýšené teploty byl vytvořen hydrogel. Antimikrobní účinnost AgNPs o velikosti 10 nm, NaBH 4 a polyakrylátu sodného byla ověřena stanovením MIC diluční mikrometodou. Antimikrobní účinnost hydrogelu s navázanými AgNPs byla testována difúzní agarovou metodou. 100 µl hydrogelu s různými koncentracemi stříbra bylo přidáno do jamek v MH agaru, který byl inokulován bakteriální nebo kvasinkovou suspenzí o hustotě 10 6 CFU/ml. Schéma 6 popisuje rozložení testovaných vzorků na agaru. Sestava testovaných bakterií a kvasinek zahrnovala sbírkové bakterie Enterococcus faecalis CCM 4224, Staphylococcus aureus CCM 3953, Escherichia coli CCM 3954, Pseudomonas aeruginosa CCM 3955, rezistentní kmeny ze sbírky Ústavu mikrobiologie Lékařské fakulty Univerzity Palackého v Olomouci Pseudomonas aeruginosa ciprofloxacin-rezistentní kmen, ESBL-pozitivní kmen Klebsiella pneumoniae, Staphylococcus epidermidis oxacilin-rezistentní kmen, Staphylococcus aureus MRSA, Enterococcus faecium VRE a kvasinky Candida albicans (2 kmeny), Candida parapsilosis a Candida tropicalis. Aktivita byla hodnocena na základě inhibičních zón kolem jamek s testovanými látkami na agaru s inokulovanou testovanou bakterií nebo kvasinkou [50]. 16
17 Schéma 6: Testování metylcelulózového hydrogelu s AgNPs STANOVENÍ ANTIBAKTERIÁLNÍHO ÚČINKU POVRCHŮ S NANOČÁSTICEMI STŘÍBRA Nanočásticemi stříbra upravené povrchy textilií a plastů byly připraveny na Přírodovědecké fakultě Univerzity Palackého v Olomouci. Antibakteriální aktivita modifikovaných materiálů byla hodnocena u 2 bakteriálních kmenů, a to Escherichia coli CCM a Staphylococcus aureus CCM TESTOVÁNÍ ANTIBAKTERIÁLNÍ AKTIVITY POVRCHU PLASTŮ Vzorky plastových folií byly připraveny v rámci projektu: Využití nanomateriálů a přírodních extraktů jako funkčních látek ve vývoji aktivních obalových materiálů s bariérovým, antimikrobiálním, protektivním a kyslík pohlcujícím efektem (TAČR , Technologická agentura České republiky). Cílem bylo připravit fólie s antimikrobním účinkem pro suchou desinfekci a optimalizovat výrobu aktivních obalových fólií obsahujících také aktivní stříbro. Prášková disperze AgNPs byla nanesena na plastovou folii LDPE typu AC 100 LD v koncentracích 0,2; 0,1; 0,05 a 0,025 g AgNPs na 1 kg polymeru (Obrázek 2). Obrázek 2:Folie LDPE s obsahem 0,2; 0,1; 0,05 a 0,025 g AgNPs na 1 kg polymeru 17
18 Vzorky folií byly zpracovány modifikovanou metodou vycházející z ISO 22196:2011 Plastics Measurment of antibacterial activity on plastics surfaces [21, 28]. Plastový vzorek o velikosti 5 x 5 cm byl opláchnutý 70% etanolem. Po oschnutí bylo na povrch vzorku umístěného ve sterilní Petriho misce inokulováno 0,4 ml bakteriální suspenze Staphylococcus aureus CCM 3953 nebo Escherichia coli CCM 3954, hustota inokula odpovídala 10 5 CFU/ml v MH bujónu ředěném 1/500 destilovanou vodou. Přes inokulum byla přiložena polyetylenová folie LDPE o velikosti 40 x 40 x 0,65 mm. Vzorky byly inkubovány 24 hodin při 35 C ve vlhké komoře. Po inkubaci byly vzorky důkladně opláchnuty 10 ml fyziologického roztoku. Oplachovací roztok byl ředěn geometrickou řadou fyziologickým roztokem. Z každého ředění bylo vyočkováno 0,1 ml na MH agar a rozetřeno inokulační hokejkou. Po inkubaci 24 hodin při 35 C byly odečteny počty CFU a přepočítány na CFU/cm 2. Antibakteriální aktivita (R) byla vypočtena podle ISO (Schéma 7). Schéma 7: Výpočet antibakteriální aktivity (R) podle ISO R = log CFU na cm 2 neošetřené kontrolní fólie log CFU na cm 2 fólie s AgNPs TESTOVÁNÍ ANTIBAKTERIÁLNÍ AKTIVITY TEXTILIÍ Nosné tkaniny bavlnu (BAV), polyester (PES), polyamid (PA), bavlnu/polyester 1:1 (BAV/PES) dodala firma INOTEX s.r.o. Pro impregnaci textilií nanočásticemi stříbra byly použity různé metody přípravy, ponoření tkaniny do disperze před redukcí (in situ), po proběhlé redukci (ex situ) za použití různých redukčních činidel a impregnace tkaniny během sonochemické reakce. Při všech postupech došlo ke změnám fyzikálních vlastností tkanin a viditelné změně barvy na žlutohnědou v závislosti na koncentraci AgNPs. Navázané stříbrné nanočástice měly různou velikost a lišila se také koncentrace navázaných AgNPs. Cílem testování bylo porovnat jednotlivé typy přípravy textilií z pohledu účinnosti, náročnosti přípravy a vhodnosti pro další použití pro průmyslovou výrobu. Při impregnaci tkanin disperzí AgNPs připravenou redukcí komplexu [Ag(NH 3 ) 2 ] + maltozou za využití sonochemické metody byla velikost navázaných AgNPs nm, koncentrace navázaného stříbra se pohybovala v rozmezí µg/g tkaniny, obojí v závislosti na typu nosné textilie (Obrázek 3). 18
19 Obrázek 3: Tkaniny BAV, PES, BAV/PES, PA impregnované sonochemickou metodou Při impregnaci tkanin disperzí AgNPs připravenou redukcí [Ag(NH 3 ) 2 ] + maltózou metodou in situ byla tkanina vložena do reakčního roztoku před přidáním redukčního činidla, impregnace probíhala po dobu 5 minut. Velikost navázaných AgNPs byla nm, koncentrace navázaného stříbra se pohybovala v rozmezí µg/g tkaniny. Při použití metody ex situ byla tkanina vložena do hotové disperze AgNPs na dobu 23 hodin. Velikost navázaných AgNPs byla nm, koncentrace navázaného stříbra se pohybovala v rozmezí µg/g tkaniny. Při impregnaci tkanin metodou ex situ disperzí AgNPs, v konečné koncentraci stříbra 5 g/l nebo 0,1 g/l disperze, připravenou redukcí [Ag(NH 3 ) 2 ] + pomocí NaBH 4 za přítomnosti stabilizátoru NaPA 15000, byla velikost AgNPs nm, resp nm, koncentrace navázaného stříbra se pohybovala v rozmezí µg/g tkaniny, resp µg/g tkaniny. Vysoká koncentrace navázaného AgNPs při použití koncentrovanější disperze byla viditelná pouhým okem, textilie byly výrazně zbarveny žlutohnědě, impregnace nebyla homogenní (Obrázek 4). Při použití disperze o koncentraci stříbra 0,1 g/l byla koncentrace navázaného stříbra výrazně nižší (Obrázek 5). Obrázek 4: Tkaniny BAV, PES, PAV/PES, PA impregnované metodou ex situ disperzí AgNPs o koncentraci 5g/l 19
20 Obrázek 5: Tkaniny BAV, PES, PAV/PES, PA impregnované metodou ex situ disperzí AgNPs o koncentraci 0,1 g/l Pro vyhodnocení antibakteriální aktivity byly vzorky zpracovány upravenou metodou vycházející z JIS1902/ISO Textiles - Determination of antibacterial activity of antibacterial finished products [21, 27]. Textilní vzorek o hmotnosti 0,4 g byl sterilizován autoklávováním při 120 C po dobu 15 minut. Na vzorek uložený ve sterilní plastové zkumavce bylo inokulováno 0,2 ml bakteriální suspenze Staphylococcus aureus CCM 3953 nebo Escherichia coli CCM Hustota inokula byla 10 5 CFU/ml v MH bujónu ředěném 1/20 destilovanou vodou. Vzorky byly inkubovány po dobu 24 hodin při 35 C. Po inkubaci byly vzorky důkladně vypláchnuty do 20 ml fyziologického roztoku. Vyplachovací roztok byl ředěn geometrickou řadou fyziologickým roztokem. Z každého ředění bylo vyočkováno 0,1 ml na MH agar a rozetřeno inokulační hokejkou. Po inkubaci 24 hodin při 35 C byly odečteny počty CFU a přepočítány na CFU/vzorek. Antibakteriální aktivita (R) tkaniny byla vypočtena srovnáním logaritmů počtu CFU na neošetřeném a ošetřeném vzorku. Výpočet vychází z normy ISO (Schéma 8). Schéma 8: Výpočet antibakteriální aktivity R podle ISO R = log CFU na kontrolním vzorku log CFU na vzorku s AgNPs Indukce bakteriální rezistence k nanočásticím stříbra Bakterie byly vystaveny dlouhodobému a opakovanému účinku stříbra při subinhibičních koncentracích s cílem prokázat či vyvrátit možnost indukce bakteriální rezistence. K testování indukce rezistence, resp. zvýšení hodnot MIC, byly použity kmeny Staphylococcus aureus CCM 3953, Escherichia coli CCM 3954 a Pseudomonas aeruginosa CCM 3955 z České sbírky mikroorganismů v Brně, dále pak kmeny Staphylococcus aureus 008 a Escherichia coli 013 ze sbírky Ústavu mikrobiologie Lékařské fakulty Univerzity Palackého v Olomouci. 20
21 Indukce rezistence byla provedena v mikrotitrační destičce opakovanou expozicí výše uvedených bakteriálních kmenů subinhibičním koncentracím nanočástic stříbra a AgNO 3. Testované vzorky byly exponenciálně naředěny v kultivačním MH bujónu a inokulovány bakteriální suspenzí. Konečná koncentrace inokula v jamce byla 10 6 CFU/ml. Destičky byly inkubovány při 35 C po dobu 24 hodin. Po inkubaci bylo 10 µl bakteriální suspenze z jamky s nejvyšší subinhibiční koncentrací testované látky vyočkováno na krevní agar a inkubováno 24 hodin při 35 C. Získané bakterie byly použity pro další cyklus. Popsaný postup představuje 1 cyklus indukce rezistence a celkem bylo provedeno 20 cyklů. Při 10. cyklu a posledním 20. cyklu indukce rezistence byla stanovena MIC původního kmene a srovnána s MIC kmene vystaveného opakovanému působení AgNPs a AgNO STANOVENÍ ANTIMIKROBNÍ AKTIVITY LIPOFOSFONOXINŮ Všechny testované lipofosfonoxiny (LPPOs) byly připravené v Ústavu organické chemie a biochemie AV ČR v.v.i. Testované látky vycházely ze základní struktury fosfonoxinů (Schéma 1). Chemické vzorce látek DR5026 a DR5047 patřících do I. generace LPPOs jsou znázorněny ve schématu 9. Schéma 9: Struktura lipofosfonoxinu DR5047a DR Stanovení antibakteriální účinnosti Minimální inhibiční koncentrace testovaných LPPOs byly stanoveny standardní diluční mikrometodou. Hodnota minimální baktericidní koncentrace byla určena vyočkováním jamek se zábranou růstu na krevní agar [14, 76]. Stanovení MIC bylo provedeno u několika desítek nově syntetizovaných látek. Testované bakterie zahrnovaly sbírkové kmeny Enterococcus faecalis CCM 4224, Staphylococcus aureus CCM 3953, Escherichia coli CCM 3954, Pseudomonas aeruginosa CCM 3955 a kmeny ze sbírky Ústavu mikrobiologie Lékařské fakulty Univerzity Palackého v Olomouci Staphylococcus epidermidis, Staphylococcus haemolyticus, Bacillus subtilis, Streptococcus agalactiae, Staphylococcus aureus MRSA, Enterococcus faecium VRE a k chinolonům rezistentní kmeny Escherichia coli a Pseudomonas aeruginosa. 21
22 3.2.2 Semikvantitativní hodnocení baktericidního účinku v čase Pro stanovení rychlosti baktericidního účinku byly vybrány vzorky lipofosfonoxinů II. generace DR6155 a DR6180 v koncentracích odpovídající MBC a jejím násobkům, tedy 6,25; 12,5 a 25 µg/ml. Vzorky testovaných látek byly naředěny do 5 ml BHI media a inokulovány bakteriálním kmenem Staphylococcus aureus CCM 4223 a Escherichia coli CCM Počáteční koncentrace inokula byla 10 6 CF/ml. Zkumavky byly inkubovány 24 hodin při 35 C. Během inkubace bylo v časových intervalech 0, 15, 30 a 45 minut a 1, 2, 3, 4, 5, 6 a 24 hodin vyočkováno 10 µl vzorku na krevní agar a po 24 hodinách inkubaci při 35 C semikvantitativně odečten počet kolonií (CFU). Ze získaných dat byla sestavena kill-time křivka pro každý bakteriální kmen Stanovení účinku kostních cementů s lipofosfonoxiny Pro vyhodnocení vlivu lipofosfonoxinu na bakteriální kolonizaci kostního cementu byly sledovány počet a aktivita bakterií adherovaných na cementových kuličkách. Za sterilních podmínek byl připraven kostní cement (Hi-Fatigue Bone Cement 2x 40, aap Biomaterials GmbH, Germany) s testovaným lipofosfonoxinem. 300 mg DR5026 bylo smícháno s 5 g kostního cementu a polymerizováno přidáním 2,5 ml polymerizačního media. Z připraveného cementu byly vytvarovány kuličky o průměru cca 5 mm. Jako kontrola byl použit cement, který byl připraven ze stejné výrobní šarže, avšak bez přidané antimikrobní látky. Vzorky kostních cementů byly umístěny do 12-jamkových panelů a zality 3 ml kultivačního media (Brain heart infusion s 0,5 % glukózy) s bakteriální suspenzí Staphylococcus epidermidis CCM Počáteční hustota bakteriálního inokula odpovídala 10 6 CFU/ml. Následovala statická inkubace po dobu 3, 24 a 48 hodin, poté byly vzorky z jamek vyjmuty, třikrát opláchnuty sterilním fyziologickým roztokem a umístěny do 2 ml kultivačního media ve zkumavce. Pro uvolnění adherovaných buněk byla použita sonikace a důkladné roztřepání. Do jamek sterilní mikrotitrační destičky bylo následně přeneseno 100 µl sonikovaného kultivačního media a destička byla umístěna do spektrofotometru se zabudovaným inkubátorem. Statická inkubace probíhala 24 hodin při 35 C, v intervalu 1 hodiny byla po dvouminutovém roztřepání měřena absorbance při 630 nm. Ze získaných hodnot byla sestavena růstová křivka [3]. Zároveň bylo sonikované medium ředěno geometrickou řadou fyziologickým roztokem. Z každého ředění bylo přeneseno100 µl na MH agar (Trios) a rozetřeno inokulační hokejkou. Po 24 hodinách inkubace při 35 C byly spočítány narostlé kolonie a přepočítány na počet CFU adherovaných na vzorek. Christensenovou metodou byla potvrzena schopnost tvorby biofilmu kmenem Staphylococcus epidermidis CCM 7221 (Česká sbírka mikroorganismů, Brno; pozitivní kontrola pro detekci tvorby biofilmu a ica operonu) v kultivačním mediu Brain heart infusion (HIMEDIA) s 0,5 % glukózy. Do jamek mikrotitrační destičky typu P bylo napipetováno 200 μl bakteriální suspenze, po 24 hodinové statické inkubaci při 35 C byla destička šetrně promyta vodou a tím odstraněny volné bakteriální 22
23 buňky, adherované bakterie byly na povrch jamky fixovány 200 μl 99% metanolu po dobu 15 min. Po odsátí metanolu byl bakteriální biofilm barven 1% krystalovou violetí po dobu 10 min. Po důkladném promytí a odsátí volného barviva bylo barvivo navázáné na biofilm rozpuštěno v 33% kyselině octové a změřena optická denzita při vlnové délce 570 nm [11, 62, 68] Indukce bakteriální rezistence k lipofosfonoxinům K testování indukce rezistence, resp. zvýšení hodnot MIC, byly použity kmeny Staphylococcus aureus CCM 4223, Enterococcus faecalis CCM 4224, Pseudomonas aeruginosa CCM 3955 (Česká sbírka mikroorganismů, Brno) a Streptococcus agalactiae AV2006 (sbírka Ústavu mikrobiologie Lékařské fakulty Univerzity Palackého v Olomouci). Indukce rezistence byla provedena v mikrotitrační destičce opakovanou expozicí výše uvedených bakteriálních kmenů subinhibičním koncentracím testovaných látek DR5026, DR5047, DR5557, DR6088, DR6155 a DR6180, které byly v kultivačním mediu (Brain heart infusion, HIMEDIA) exponenciálně naředěny na koncentrace 1,6 200 mg/l. Připravené destičky byly skladovány při -20 C. Do rozmražené mikrotitrační desky byl inokulován příslušný bakteriální kmen. Konečná koncentrace inokula v jamce byla 10 6 CFU/ml. Destičky byly inkubovány při 35 C po dobu 24 hodin. Po inkubaci bylo 10 µl bakteriální suspenze z jamky s nejvyšší subinhibiční koncentrací testované látky vyočkováno na krevní agar a inkubováno 24 hodin při 35 C. Získané bakterie byly použity pro další cyklus. Popsaný postup představuje 1 cyklus indukce rezistence a celkem bylo provedeno 14 cyklů. Po posledním cyklu byla stanovena MIC původního kmene a srovnána s MIC po indukci. Jako kontrolní látka pro indukci vzniku rezistence byl použit ciprofloxacin, ke kterému vzniká rezistence velmi rychle [31]. Ciprofloxacin byl testován za stejných podmínek v koncentracích 0,06 8 mg/l. 23
24 4. VÝSLEDKY 4.1 ANTIMIKROBNÍ AKTIVITA NANOČÁSTIC STŘÍBRA Stanovení antimikrobní účinnosti nanočástic stříbra a jejich kombinace s antibiotiky V následující kapitole jsou uvedeny výsledky získané při testování aktivity nanočástic stříbra na aerobní, fakultativně anaerobní a anaerobní bakterie, dále pak na kvasinky a současně jsou popsány možnosti synergického účinku s antibakteriálnímí látkami ANTIBAKTERIÁLNÍ AKTIVITA NANOČÁSTIC STŘÍBRA Stanovením MIC nanočástic stříbra diluční mikrometodou byla potvrzena jejich antibakteriální aktivita. Účinnost AgNPs byla závislá na jejich velikosti. Nejnižší hodnoty MIC měly nanočástice stříbra o velikosti 25 nm redukované maltosou, které se v některých případech dostaly až na hodnoty MIC iontového stříbra, tedy AgNO 3. Částice redukované galaktózou o velikosti 50 nm už dosahovaly MIC 27 - >54 mg/l. Hodnoty MIC se rovnaly hodnotám MBC. MIC AgNO 3 se pohybovaly v rozmezí 0,84 6,75 mg/l. Výsledky MIC AgNPs o různých velikostech jsou uvedeny v tabulce 1 [53]. Tabulka 1: Minimální inhibiční koncentrace AgNPs o různé velikosti (nm) a AgNO 3 MIC AgNPs (mg/l) 50 nm 40 nm 35 nm 25nm AgNO 3 Enterococcus faecalis CCM 4224 >54 >54 54,0 13,5 6,75 Staphylococcus aureus CCM ,0 6,75 6,75 6,75 6,75 Escherichia coli CCM 3954 >54 27,0 27,0 3,38 1,69 Pseudomonas aeruginosa CCM 3955 >54 27,0 13,5 6,75 0,84 Pseudomonas aeruginosa ciprofloxacin-rezistentní kmen Staphylococcus epidermidis oxacilin-citlivý kmen Staphylococcus epidermidis oxacilin-rezistentní kmen 27,0 13,5 6,75 1,69 0,84 6,75 13,5 6,75 1,69 0,84 54,0 6,75 6,75 1,69 1,69 Staphylococcus aureus MRSA 54,0 27,0 27,0 6,75 6,75 Enterococcus faecium VRE >54 >54 54,0 13,5 3,38 Klebsiella pneumoniae producent ESBL > ,0 6,75 3,38 24
25 Ag+ AgNPs AgNPs +0,01 % kaseinu AgNPs +0,1 % kaseinu AgNPs +1 % kaseinu AgNPs +0,1 % želatiny AgNPs +1 % PAA Tabulka 2 uvádí výsledky aktivity stříbra na testované kmeny anaerobních bakterií. Vysoké hodnoty MIC v intervalu od 13 do 34 mg/l prokázaly, že antibakteriální aktivita nestabilizovaných nanočástic stříbra vůči anaerobním bakteriím je nízká. MIC iontového stříbra dosahovaly u testovaných anaerobních bakterií hodnot v rozmezí 6 25 mg/l. Nejvyšší aktivity dosáhly částice stříbra stabilizované 1 % kaseinu, hodnoty MIC se pohybovaly se v intervalu od 1 do 13 mg/l. Aktivita takto stabilizovaných nanočástic byla dokonce vyšší než aktivita iontového stříbra. Částice stříbra stabilizované nižší koncentrací kaseinu a také částice stabilizované želatinou a polyakrylátem nevykazovaly významně nižší hodnoty MIC oproti nestabilizovaným částicím [81]. Tabulka 2: Minimální inhibiční koncentrace AgNPs (mg/l) u anaerobních bakterií MIC (mg/l) Bacteroides fragilis CCM ,72 22,78 30,38 40,50 6,75 >108 18,00 Bacteroides thetaiotaomicron CCM ,72 17,09 13,50 33,75 1,69 >108 23,63 Eggerthella lenta CCM ,02 30,52 40,50 33,75 0, ,33 Propionibacterium acnes CCM ,99 13,50 8,10 7,43 1, ,02 Clostridium perfringens CCM ,31 22,54 21,38 5,07 5,07 > Clostridium difficile CCM ,85 33,75 31,50 27,00 12,5 > Fusobacterium varium 15,19 24,75 21,94 27,00 6,75 > AgNPs nanočástice stříbra; PAA kyselina polyakrylová ANTIFUNGÁLNÍ AKTIVITA NANOČÁSTIC STŘÍBRA Výsledky MIC u jednotlivých kvasinek jsou uvedeny v tabulce 3. MIC dosahovaly hodnot 0,1 1,69 mg/l. Hodnota MIC nestabilizovaných nanočástic stříbra se rovnala hodnotě MIC iontového stříbra. Při stabilizaci AgNPs pomocí SDS bylo dosaženo ještě nižších hodnot MIC, v případě Candida albicans I se MIC rovnala 0,05 mg/l. Hodnota minimální fungicidní koncentrace (MFC) byla 2-4x vyšší než hodnota minimální inhibiční koncentrace [51]. 25
26 Tabulka 3: Minimální inhibiční koncentrace AgNPs u kvasinek AgNO 3 AgNPs AgNPs + SDS MIC (mg/l) AgNPs + Tween 80 AgNPs + Brij AgNPs + PVP 360 Candida albicans I 0,42 0,42 0,05 0,10 0,10 0,10 Candida albicans II 0,42 0,21 0,10 0,21 0,21 0,21 Candida parapsilosis 1,69 1,69 0,84 0,84 0,84 0,84 Candida tropicalis 0,84 0,84 0,42 0,42 0,42 0,42 SDS sodium dodecylsulfát, Brij - Polyethylene glycol hexadecyl ether, PVP polyvinylpyrrolidon ÚČINEK NANOČÁSTIC STŘÍBRA A JEJICH KOMBINACE S ANTIBIOTIKY ÚČINEK KOMBINACE AGNPS A ANTIBIOTIK NA CITLIVÉ BAKTERIE Bez ohledu na mechanismus účinku nebo chemickou strukturu antibiotika byl potvrzen nespecifický synergický efekt mezi nanočásticemi stříbra a všemi testovanými antibiotiky. Nanočástice stříbra v subinhibiční koncentraci v kombinaci s jednotlivými antibiotiky snižovaly hodnotu MIC antibiotik, resp. zesilovaly jejich účinnost. Například MIC ampicilinu pro Escherichia coli CCM 4225 byla 64 mg/l, MIC nanočástic stříbra 7,5 mg/l. Přidání nanočástic stříbra v koncentraci 2,5 mg/l snížilo MIC ampicilinu na 0,03 mg/l. Hodnoty MIC kombinací antibiotik a AgNPs jsou uvedeny v tabulkách 4 6 [54] ÚČINEK KOMBINACE AGNPS A ANTIBIOTIK NA REZISTENTNÍ BAKTERIE Pomocí frakční inhibiční koncentrace (FIC) byl podrobněji vyhodnocen účinek kombinací antibiotik a AgNPs u rezistentních bakterií. Výsledky jsou shrnuty v tabulkách Např. u ESBLpozitivního kmene Escherichia coli byla MIC samotného cefotaximu 4 mg/l, MIC AgNPs 0,8 mg/l. Přidáním AgNPs v koncentraci 0,4 mg/l došlo ke snížení MIC cefotaximu na 0,03 mg/l, hodnota FIC byla stanovena na 0,508, což vyjadřuje aditivní efekt uvedené kombinace. Při přidání 0,2 mg/l AgNPs k cefotaximu se jeho MIC dostala na hodnotu 0,125 mg/l, FIC byla vypočtena 0,281, což odpovídá synergickému působení uvedené kombinace [55]. Obecně lze říci, že nanočástice stříbra zesilovaly účinky antibiotik ve všech testovaných koncentracích, a to i při nejnižší koncentraci odpovídající koncentraci MIC AgNPs/16. Nejsilnější efekt na antibakteriální aktivitu byl pozorován při koncentracích AgNPs odpovídajících MIC AgNPs/2 a MIC AgNPs/4, kdy došlo až k 100násobnému snížení MIC příslušného antibiotika. Zvýšené antibakteriální účinky antibiotik v kombinaci s koncentracemi nanočástic odpovídající MIC AgNPs/8 a MIC AgNPs/16 byly stále patrné, i když ne tak výrazně. 26
27 Tabulka 4: Escherichia coli CCM MIC antibiotik (mg/l) v přítomnosti subinhibičních koncentrací AgNPs (MIC AgNPs byla 7,5 mg/l) AMP AMS CZL CRX CXT GEN COT COL OXO OFL TET AZT ATB ,5 4 0,5 0,5 0,03 4 0,03 ATB+5 mg/l AgNPs 0,001 0,001 0,001 0,001 0,001 0,0005 0,002 0,0005 0,001 0,0002 0,0005 0,002 ATB + 2,5 mg/l AgNPs 0,03 0,03 0,002 0,001 0,001 0, ,001 0,5 0, ,008 ATB + 1,25 mg/l AgNPs ,06 2 0,125 0,5 0, ,03 ATB + 0,6 mg/l AgNPs ,03 2 0,125 0,5 0, ,03 AMP ampicilin, AMS ampicilin/sulbactam, CZL cefazolin, CRX cefuroxim, CXT cefoxitin, GEN gentamicin, COT sulfamethoxazol/trimethoprim, COL kolistin, OXO kyselina oxolinová, OFL ofloxacin, TET tetracyklin, AZT aztreonam Tabulka 5: Pseudomonas aeruginosa CCM MIC antibiotik (mg/l) v přítomnosti subinhibičních koncentrací AgNPs (MIC AgNPs byla 7,5 mg/l) PIP PPT AZT MER CTZ CPR CPM GEN AMI COL OFL CIP ATB ,25 1 0,5 1 0,125 ATB+5 mg/l AgNPs 0,0078 0,0039 0, ,0019 0, , , , , , , ,00024 ATB + 2,5 mg/l AgNPs 0,015 0,0039 0, ,0019 0, , , , , , , ,00024 ATB + 1,25 mg/l AgNPs , ,015 0,25 0,06 1 0,03 ATB + 0,6 mg/l AgNPs ,03 0,25 0, ,03 PIP piperacilin, PPT piperacilin/tazobactam, AZT aztreonam, MER meropenem, CTZ ceftazidim, CPR cefoperazon, CPM cefepim, GEN gentamicin, AMI amikacin, COL kolistin, OFL ofloxacin, CIP ciprofloxacin 27
28 Tabulka 6: Staphylococcus aureus CCM MIC antibiotik (mg/l) v přítomnosti subinhibičních koncentrací AgNPs (MIC AgNPs byla 5 mg/l) PEN OXA AMS CMP TET COT ERY CLI CIP GEN TEI VAN ATB 0,125 0,25 0,5 4 0,25 1 0,125 0,125 0,25 0,25 0,25 1 ATB + 2,5 mg/l AgNPs 0, , , , , ,0019 0, , , , , ,00048 ATB + 1,25 mg/l AgNPs 0,015 0,03 0,06 2 0,015 0,0078 0,06 0,015 0,015 0,06 0,015 0,00097 ATB + 0,6 mg/l AgNPs 0,015 0,25 0, ,015 0,03 0,06 0,015 0,03 0,25 0,03 0,03 PEN benzylpenicilin, OXA oxacilin, AMS ampicilin/sulbactam, CMP chloramfenikol, TET tetracyklin, COT sulfamethoxazol/trimethoprim, ERY erytromycin, CLI klindamycin, CIP ciprofloxacin, GEN gentamicin, TEI teikoplanin, VAN - vankomycin 28
29 Tabulka 7: Účinek kombinací AgNPs a antibiotik na kmen Escherichia coli produkující ESBL MIC AgNPs = 0,8 mg/l CTX CTZ MER CIP GEN MIC FIC efekt MIC FIC efekt MIC FIC efekt MIC FIC efekt MIC FIC efekt ATB + AgNPs 0,0 mg/l ,06 >32 0,5 ATB + AgNPs 0,4 mg/l 0,03 0,508 A 0,125 0,508 A 0,06 1,5 I 0,125 0,504 A 0,125 0,75 A ATB + AgNPs 0,2 mg/l 0,125 0,281 S 0,125 0,258 S 0,06 1,25 I 0,125 0,254 S 0,125 0,5 S ATB + AgNPs 0,1 mg/l 1 0,375 S 2 0,25 S 0,06 1,125 I 0,5 0,140 S 0,125 0,375 S ATB + AgNPs 0,05 mg/l 1 0,312 S 16 1,063 I 0,06 1,063 I 2 0,125 S 0,125 0,313 S Tabulka 8: Účinek kombinací AgNPs a antibiotik na kmen Escherichia coli produkující AmpC MIC AgNPs = 3,4 mg/l CTX CTZ MER CIP GEN MIC FIC efekt MIC FIC efekt MIC FIC efekt MIC FIC efekt MIC FIC efekt ATB + AgNPs 0,0 mg/l , ,5 ATB + AgNPs 1,7 mg/l 0,03 0,504 A 0,125 0,504 A 0,06 0,502 I 0,125 0,504 A 0,125 0,525 A ATB + AgNPs 0,8 mg/l 0,03 0,254 S 0,125 0,254 S 0,06 0,251 I 0,125 0,254 S 0,125 0,275 S ATB + AgNPs 0,4 mg/l 1 0,25 S 2 0,188 S 0,06 0,25 I 8 0,375 S 0,125 0,15 S ATB + AgNPs 0,2 mg/l 1 0,188 S 8 0,313 S 0,06 1,063 I 16 0,562 A 0,125 0,087 S A aditivní efekt, S synergie, I indiference CTX cefotaxim, CTZ ceftazidim, MER meropenem, CIP ciprofloxacin, GEN gentamicin 29
30 Tabulka 9: Účinek kombinací AgNPs a antibiotik na kmen Klebsiella pneumoniae produkující KPC MIC AgNPs = 3,4 mg/l CTX CTZ MER CIP GEN MIC FIC efekt MIC FIC efekt MIC FIC efekt MIC FIC efekt MIC FIC efekt ATB + AgNPs 0,0 mg/l >16 >64 >32 >32 1 ATB + AgNPs 1,7 mg/l 0,03 0,502 A 0,125 0,502 A 0,06 0,502 A 0,125 0,504 A 0,125 0,625 A ATB + AgNPs 0,8 mg/l 2 0,375 S 0,125 0,252 S 0,06 0,252 S 0,5 0,267 S 0,125 0,375 S ATB + AgNPs 0,4 mg/l >16 1,125 I 2 0,156 S 4 0,25 S 8 0,375 S 0,125 0,25 S ATB + AgNPs 0,2 mg/l >16 1,063 I >64 1,063 I >32 1,063 I 16 0,563 A 1 1,063 I Tabulka 10: Účinek kombinací AgNPs a antibiotik na kmen Klebsiella pneumoniae produkující ESBL MIC AgNPs = 6,8 mg/l CTX CTZ MER CIP GEN MIC FIC efekt MIC FIC efekt MIC FIC efekt MIC FIC efekt MIC FIC efekt ATB + AgNPs 0,0 mg/l > ,06 0,25 >32 ATB + AgNPs 3,4 mg/l 0,03 0,501 A 0,125 0,504 A 0,06 1,5 A 0,125 1 A 0,125 0,504 I ATB + AgNPs 1,7 mg/l 0,03 0,251 S 0,125 0,254 S 0,06 1,25 A 0,125 0,75 A 1 0,281 S ATB + AgNPs 0,8 mg/l 0,03 0,126 S 0,125 0,129 S 0,06 1,125 I 0,25 1,125 I 2 0,187 S ATB + AgNPs 0,4 mg/l 1 0,094 S 2 0,125 S 0,06 1,063 I 0,25 1,063 I 16 0,563 I A aditivní efekt, S synergie, I indiference CTX cefotaxim, CTZ ceftazidim, MER meropenem, CIP ciprofloxacin, GEN - gentamicin 30
31 INHIBICE PRODUKCE ESBL NA MODIFIKOVANÉM AGARU S AGNPS Synergický účinek AgNPs a antibiotik byl potvrzen také při použití fenotypových testů pro průkaz ESBL. Použitím DDST byla potvrzena produkce ESBL u obou testovaných kmenů, tedy Escherichia coli a Klebsiella pneumoniae. Na MH agaru bez AgNPs došlo k deformaci inhibičních zón kolem antibiotik a ke zvětšení zóny ceftazidimu s kyselinou klavulanovou oproti inhibiční zóně samotného ceftazidimu (Obrázek 6a, 7a). Na MH agaru s 5 mg/l AgNPs se vytvořily velké inhibiční zóny kolem antibiotických disků, oba kmeny se jevily jako citlivé k testovaným antibiotikům a fenotypový průkaz ESBL byl vyhodnocen jako negativní (Obrázek 6b, 7b) [55]. Obrázek 6: Escherichia coli producent ESBL, fenotypový průkaz ESBL pomocí modifikovaného DDST testu, MH agar (a) a MH agar s AgNPs (b) Obrázek 7: Klebsiella pneumoniae producent ESBL, fenotypový průkaz ESBL pomocí modifikovaného DDST testu, MH agar (a) a MH agar s AgNPs (b) 31
32 4.1.2 Antimikrobní účinnost nanokompozitů a povrchů s nanočásticemi stříbra Kapitola shrnuje výsledky antimikrobní aktivity nanočástic stříbra v konkrétních aplikacích, a to při navázání nanočástic stříbra na nosiče křemelinu, metylcelulózu povrchy plastů a textilií NANOKOMPOZITY S NANOČÁSTICEMI STŘÍBRA ÚČINEK NANOKOMPOZITU AG/PDDA-KŘEMELINA Stanovení MIC nanokompozitu Připravený nanokompozit Ag/PDDA-křemelina vykazoval inhibiční aktivitu už při koncentraci stříbra 4,5 mg/l. Výsledky stanovení MIC testovaného nanokompozitu, resp. hodnoty MIC vztažené na množství nanočástic stříbra, u jednotlivých bakteriálních kmenů a kvasinek jsou uvedeny v tabulce 11. Tabulka 11: Minimální inhibiční koncentrace nanokompozitu Ag/PDDA-CBL-3 MIC Ag/PDDA- CBL-3 (mg/l) MIC navázaného Ag (mg/l) Enterococcus faecalis CCM ,55 Staphylococcus aureus CCM ,1 Escherichia coli CCM ,55 Pseudomonas aeruginosa CCM ,2 Pseudomonas aeruginosa 200 9,1 Staphylococcus epidermidis ,1 Staphylococcus epidermidis ,1 Staphylococcus aureus MRSA 100 4,55 Enterococcus faecium VRE 200 9,1 Klebsiella pneumoniae producent ESBL 200 9,1 Candida albicans I 200 9,1 Candida tropicalis 200 9,1 Candida parapsilosis , Kvalitativní stanovení baktericidního účinku Při kvalitativním hodnocení baktericidního účinku koncentrace stříbra u Escherichia coli, usmrtila koncentrace 120 mg/l ihned všechny buňky, k dosažení stejného výsledku u koncentrace 60 mg/l bylo potřeba 15 minut. V případě bakterie Enterococcus faecalis došlo k usmrcení všech 32
33 bakterií do 15 minut při použití koncentrace stříbra 120 mg/l, do 45 minut byly usmrceny všechny bakterie i ve vzorku s koncentrací stříbra 60 mg/l (Obrázek 8). Obrázek 8: Kvalitativní stanovení baktericidního účinku nanokompozitů 0 minut 15 minut minut 45 minut 1 4: Enterococcus faecalis: mg/l Ag, 2-60 mg/l, 3 - kompozit bez Ag, 4 - kontrola růstu 5 8: Escherichia coli: mg/l Ag, 6-60 mg/l Ag, 7 - kompozit bez Ag, 8 - kontrola růstu Kvantitativní stanovení baktericidního účinku Metodou kill-time assay byl potvrzen rychlý baktericidní účinek nanokompozitu. Při koncentraci stříbra 40 mg/l byly testované bakterie Escherichia coli usmrceny do 30 minut, resp. do 180 minut u Enterococcus faecalis. Výsledek počtu bakterií (CFU/ml) v čase je uvedený v grafech 1 a 2. Je zřejmé, že rychlost baktericidního účinku závisí na koncentraci stříbra. Rychlejší baktericidní účinek i při nižších koncentracích stříbra byl zaznamenán u Escherichia coli [49]. 33
34 log CFU/ml log CFU/ml Graf 1: Rychlost baktericidního účinku Ag/PDDA-křemeliny u Escherichia coli Escherichia coli čas (min) 40 mg/l AgNPs 20 mg/l AgNPs 10 mg/l AgNPs 5 mg/l AgNPs 2,5 mg/l AgNPs 0 mg/l AgNPs Graf 2:Rychlost baktericidního účinku Ag/PDDA-křemeliny u Enterococcus faecalis Enterococcus faecalis čas (min) 40 mg/l AgNPs 20 mg/l AgNPs 10 mg/l AgNPs 5 mg/l AgNPs 2,5 mg/l AgNPs 0 mg/l AgNPs ÚČINEK METYLCELULÓZOVÉHO HYDROGELU S NANOČÁSTICEMI STŘÍBRA Antimikrobní účinnost disperze AgNPs, NaBH 4 a polyakrylátu sodného je uvedena v tabulce 12. Z výsledku je zřejmé, že aktivitu v kompozitu zajišťují pouze stříbrné nanočástice. Borohydrát sodný ani polyakrylát sodný nemají na testované kmeny bakterií a kvasinek inhibiční vliv. 34
35 Tabulka 12: Minimální inhibiční koncentrace AgNPs o velikosti 10 nm, NaBH 4 a polyakrylátu sodného MIC (mg/l) AgNPs NaBH 4 NaPA Escherichia coli CCM , Klebsiella pneumoniae 2486 producent ESBL 3, Pseudomonas aeruginosa CCM , Pseudomonas aeruginosa 532 0, Staphylococcus aureus CCM , Staphylococcus aureus 4591 MRSA 1, Staphylococcus epidermidis 879 0, Staphylococcus epidermidis 901 0, Candida albicans I 0, Candida albicans II 0, Candida tropicalis 0, Candida parapsilosis 0, NaBH 4 - borohydrát sodný, NaPA polyakrylát sodný Při použití difuzní metody byly srovnávány průměry inhibičních zón. Velikosti inhibičních zón se lišily v závislosti na testovaném mikroorganismu a koncentraci AgNPs v hydrogelu. Průměr inhibičních zón se zvětšoval se vzrůstající koncentrací AgNPs. Antimikrobní účinek metylcelulózového hydrogelu se stříbrem byl větší proti kvasinkám, což odpovídalo i hodnotám MIC samotných AgNPs. Antibakteriální aktivita hydrogelu proti jednotlivým testovaným bakteriím byla srovnatelná, pouze u testovaných kmenů enterobakterií (Escherichia coli a ESBL-pozitivní kmen Klebsiella pneumoniae) neměla nejnižší použitá koncentrace AgNPs 25 mg/l účinek. (Obrázek 9) Metylcelulóza s obsahem AgNPs mg/l se tedy ukázala jako účinná proti testovaným bakteriím a kvasinkám [50]. 35
36 Obrázek 9: Antimikrobní aktivita metylcelulózového hydrogelu s AgNPs a b c d e f g h i j k l (a) Escherichia coli CCM 3954, (b) Staphylococcus aureus CCM 3953, (c) Staphylococcus epidermidis, (d) Staphylococcus aureus MRSA 4591, (e) Klebsiella pneumoniae producent ESBL 2486, (f) Pseudomonas aeruginosa CCM 3955, (g) Pseudomonas aeruginosa 532, (h) Staphylococcus epidermidis 901, (i) Candida albicans I, (j) Candida albicans II, (k) Candida tropicalis, (l) Candida parapsilosis AKTIVITA POVRCHŮ S NANOČÁSTICEMI STŘÍBRA ANTIBAKTERIÁLNÍ AKTIVITA POVRCHU PLASTŮ Antibakteriální aktivita testovaných plastových folií s různými koncentracemi AgNPs vypočtená dle ISO byla vysoká u obou testovaných bakterií, tedy Escherichia coli a Staphylococcus aureus. Výsledky jsou shrnuty v tabulce 13. Fólie s různými koncentracemi AgNPs vykazovaly stejně vysoké antimikrobní účinky i přes nehomogenitu nanesené disperze. Při antibakteriální aktivitě R = 3 dochází během 24 hodin ke snížení počtu CFU/cm 2 o 3 řády. 36
37 Tabulka 13:Antibakteriální aktivita (R) folií s obsahem AgNPs CFU/cm 2 Escherichia coli Staphylococcus aureus Log CFU/cm 2 R CFU/cm 2 Log CFU/cm 2 0 g AgNPs/kg , ,51 R 0,2 g AgNPs/kg , ,51 0,1 g AgNPs/kg 37,5 1,57 2, ,51 0,05 g AgNPs/kg , ,51 0,025 g AgNPs/kg , ,51 Po optimalizaci postupu nanášení disperzí AgNPs a sériích dalších testů antibakteriální aktivity byl pro poloprovozní zkoušky vybrán vzorek polyetylenu LDPE s obsahem 0,025 g AgNPs na 1 kg polymeru. Po optimalizaci procesu výroby měl výsledný polymer antibakteriální aktivitu u Escherichia coli 1,11 (R = 1,11), v případě Staphylococcus aureus 2,12 (R = 2,12) ANTIBAKTERIÁLNÍ AKTIVITA TEXTILIÍ Při impregnaci tkanin disperzí AgNPs s redukcí [Ag(NH 3 ) 2 ] + maltozou za využití sonochemické metody byly výsledky antibakteriální aktivity vysoké s výjimkou polyesteru, kde se hodnota R pohybovala v nulových hodnotách. Výsledky jsou shrnuty v tabulce 14. Tabulka 14: Antibakteriální aktivita (R) při impregnaci tkanin sonochemickou metodou CFU/cm 2 Escherichia coli Log CFU/vzorek Staphylococcus aureus R CFU/cm 2 Log CFU/vzorek BAV , ,34 R BAV + AgNPs 20 1,30 4, ,48 1,86 PES , ,19 PES + AgNPs ,80 0, ,43-0,24 BAV/PES , ,32 BAV/PES + AgNPs ,30 2, ,26 2,06 PA , ,27 PA + AgNPs 20 1,30 4, ,30 4,96 BAV bavlna, PES polyester, PA - polyamid 37
38 Impregnace tkanin disperzí AgNPs připravenou redukcí [Ag(NH 3 ) 2 ] + maltózou metodou in situ, stejně jako impregnace tkanin metodou ex situ se z hlediska antibakteriální aktivity neosvědčila. Připravené textilie nevykazovaly antibakteriální aktivitu proti testovaným bakteriím. Hodnoty R se pohybovaly u všech druhů textilií v rozmezí 0 0,63 bez rozdílu v použité metodě impregnace. Impregnace tkanin metodou ex situ disperzí AgNPs připravenou redukcí [Ag(NH 3 ) 2 ]+ pomocí NaBH 4 za přítomnosti stabilizátoru NaPA bylo dosaženo vysokých hodnot antibakteriální aktivity. Při použití koncentrovanější disperze byla antibakteriální aktivita u všech textilií vysoká, pro Escherichia coli dosahovala antibakteriální aktivita hodnot 4,57 4,92, u stafylokoka byla nižší, a to v rozmezí 2,41 5,04 (Tabulka 15). Tabulka 15: Antibakteriální aktivita (R) při impregnace tkanin metodou ex situ disperzí AgNPs o koncentraci 5 g/l CFU/cm 2 Escherichia coli Log CFU/vzorek Staphylococcus aureus R CFU/cm 2 Log CFU/vzorek BAV , ,34 R BAV + AgNPs 20 1,36 4, ,30 5,04 PES , ,19 PES + AgNPs 20 1,30 4, ,78 2,41 BAV/PES , ,20 BAV/PES + AgNPs 20 1,30 4, ,30 2,9 PA , ,34 PA + AgNPs 20 1,30 4, ,30 3,04 BAV bavlna, PES polyester, PA - polyamid Při použití disperze s koncentrací AgNPs 0,1 g/l byla zjištěná antibakteriální aktivita opět vysoká. U kmene Escherichia coli byly hodnoty R u všech druhů textilií vyšší než 4 a aktivita textilií byla srovnatelná s textiliemi impregnovanými koncentrovanější disperzí. U Staphylococcus aureus měl pouze polyamid nižší antibakteriální aktivitu (R = 1,04). Výsledky jsou shrnuty v tabulce
39 Tabulka 16: Antibakteriální aktivita (R) impregnovaných tkanin metodou ex situ disperzí AgNPs o koncentraci 0,1g/l CFU/cm 2 Escherichia coli Log CFU/vzorek Staphyloccus aureus R CFU/cm 2 Log CFU/vzorek BAV , ,14 R BAV + AgNPs 200 2,30 4, ,30 3,84 PES , ,12 PES + AgNPs 20 1,30 4, ,30 4,82 BAV/PES , ,20 BAV/PES + AgNPs 20 1,30 4, ,30 2,9 PA , ,34 PA + AgNPs 20 1,30 4, ,30 1,04 BAV bavlna, PES polyester, PA - polyamid Indukce bakteriální rezistence k nanočásticím stříbra Testované kmeny bakterií (Escherichia coli CCM 3954, Staphylococcus aureus CCM 3953, Pseudomonas aeruginosa CCM 3955, Staphylococcus aureus 008, Escherichia coli 013) byly k AgNPs citlivé, MIC se pohybovaly v rozmezí 1,69 13,5 mg/l v závislosti na bakteriálním druhu. Rostoucí odolnost jednotlivých bakterií vystavených opakované kultivaci v subinhibičních koncentracích nanočástic stříbra je doložena v tabulce 17. Tabulka shrnuje hodnoty MIC AgNPs u jednotlivých kmenů po každém kroku indukce rezistence a MIC kontrolních kmenů nevystavených působení AgNPs v testech provedených paralelně s 10. a 20. cyklem indukce. Z hodnot MIC je zřejmé, že si bakterie postupně vytváří odolnost k AgNPs. Jako první se stala odolnou bakterie Escherichia coli CCM Významně vyšší hodnota MIC 13,5 mg/l oproti původní 3,38 mg/l byla zaznamenána už po 6 cyklu indukce rezistence, po osmém cyklu se hodnota MIC zvýšila až na >54 mg/l. Staphylococcus aureus CCM 3953 se stal rezistentním po 12. cyklu indukce rezistence, kdy se MIC zvedla na hodnotu 54 mg/l oproti původním 13,5 mg/l. Ke změně MIC u Pseudomonas aeruginosa CCM 3955 došlo také po 12. cyklu indukce, MIC se zvedla z původní hodnoty 1,69 mg/l na >54 mg/l. 39
40 Tabulka 17: Minimální inhibiční koncentrace AgNPs testovaných bakterií po jednotlivých krocích indukce rezistence Escherichia coli CCM 3954 Staphylococcus aureus CCM 3953 Pseudomonas aeruginosa CCM 3955 Staphylococcus aureus 008 AgNPs MIC (mg/l) 1* * * 3,38 6,75 3,38 6,75 6,75 13,5 13,5 >54 >54 >54 3,38 >54 >54 >54 >54 >54 >54 >54 >54 >54 >54 6,75 13,5 13,5 6,75 13,5 6,75 13,5 6,75 6,75 13,5 13,5 13,5 13, , ,5 1,69 3,38 0,89 1,69 3,38 3,38 1,69 1,69 3,38 6,75 1,69 3,38 >54 >54 >54 >54 >54 >54 >54 >54 >54 3,38 3,38 6,75 1,69 3,38 1,69 1,69 1,69 1,69 3,38 6,75 1,69 3,38 6,75 13,5 6,75 13,5 13,5 27 >54 >54 >54 3,38 Escherichia coli , ,5 13,5 13,5 13,5 13,5 13,5 13, >54 >54 > *, 20* srovnání MIC původního kmene, zpracováno současně s kmenem z 10. nebo 20. kroku indukce rezistence 40
41 Po kultivaci rezistentních kmenů v MH bujónu s 54 mg/l AgNPs docházelo v mikrotitrační destičce ke změně barvy a vzniku sraženiny. V případě Escherichia coli CCM 3954 ilustruje uvedenou skutečnost obrázek 10. Obrázek 10: Růst citlivé a rezistentní Escherichia coli v MH bujonu s AgNPs A B Mikrotitrační destička po kultivaci citlivého (A) a rezistentního kmene (B) Escherichia coli v přítomnosti AgNPs naředěných v koncentrační řadě 54 0,84 mg/l. Horní řada obsahuje pouze disperzi AgNPs o koncentraci 108 mg/l. Rezistentní kmeny, získané opakovanou kultivací v tekutém MH mediu se subinhibičními koncentracemi AgNPs, byly naočkovány na MH agary s obsahem AgNPs v koncentraci 20 mg/l a 40 mg/l. Modifikované MH agary změnily barvu do žlutohněda v závislosti na přidané koncentraci AgNPs (Obrázek 11A, 11B, 11C). Při kultivaci bakterií na MH agaru s obsahem 20 a 40 mg/l AgNPs se potvrdila inhibice růstu citlivých kmenů, zatímco růst rezistentních kmenů nebyl inhibován. Růst rezistentní a citlivé Escherichia coli CCM 3954 na agarech s AgNPs ukazuje obrázek 11. Při růstu rezistentních kmenů na agaru s 40 mg/l AgNPs docházelo v okolí růstu bakterií k černému zbarvení agarové půdy (Obrázek 12). Obrázek 11: Růst citlivé a rezistentní Escherichia coli na MH agaru s AgNPs A B C 41
42 D E F G H I MH agar bez AgNPs (A), MH s obsahem AgNPs o koncentraci 20 mg/l (B), MH s obsahem AgNPs o koncentraci 40 mg/l(c), růst AgNPs citlivé Escherichia coli na MH bez obsahu AgNPs (D), inhibice růstu citlivé Escherichia coli na MH agaru s obsahem 20 mg/l (E) a 40 mg/l (F), růst AgNPs rezistentní Escherichia coli na MH agaru bez obsahu AgNPs (G) a s obsahem AgNPs o koncentraci 20 mg/l (H) a 40 mg/l (I). Obrázek 12: Růst AgNPs rezistentní Escherichia coli na MH agaru s obsahem 40 mg/l AgNPs Stejným postupem, tedy opakovanou kultivací v subinhibičních koncentracích AgNO 3, byla provedena indukce rezistence k iontové formě stříbra. Ani po 20 cyklech kultivace bakterií v subinhibičních koncentracích AgNO 3 nedošlo k zvýšení MIC. Hodnoty MIC AgNO 3 na začátku, po 10. a 20. cyklu indukce jsou uvedeny v tabulce 18. Opakovanou kultivací bakterií v subinhibičních koncentracích AgNO 3 nedošlo ke vzniku rezistence bakterií k AgNO 3. 42
DOTAZY A ODPOVĚDI Veřejná zakázka: Dodávka hotových médií pro růst mikroorganismů Evid. č. přidělené v IS VZ US:
 DOTAZY A ODPOVĚDI Veřejná zakázka: Dodávka hotových médií pro růst mikroorganismů Evid. č. přidělené v IS VZ US: 60011839 Znění dotazů zájemce TRIOS spol. s r.o. ze dne 14.11. Ad. dotaz č. 1 G-minus I.
DOTAZY A ODPOVĚDI Veřejná zakázka: Dodávka hotových médií pro růst mikroorganismů Evid. č. přidělené v IS VZ US: 60011839 Znění dotazů zájemce TRIOS spol. s r.o. ze dne 14.11. Ad. dotaz č. 1 G-minus I.
Funkční vzorek 5454/2017. Set ke stanovení minimálních inhibičních koncentrací antimikrobiálních. látek u Pseudomonas spp.
 Funkční vzorek 5454/2017 Set ke stanovení minimálních inhibičních koncentrací antimikrobiálních látek u Pseudomonas spp. Autoři: MVDr. Kateřina Nedbalcová, Ph.D., Výzkumný ústav veterinárního lékařství,
Funkční vzorek 5454/2017 Set ke stanovení minimálních inhibičních koncentrací antimikrobiálních látek u Pseudomonas spp. Autoři: MVDr. Kateřina Nedbalcová, Ph.D., Výzkumný ústav veterinárního lékařství,
Citlivost a rezistence mikroorganismů na antimikrobiální léčiva
 Citlivost a rezistence mikroorganismů na antimikrobiální léčiva Sylva Janovská Univerzita Pardubice Fakulta chemicko-technologická Katedra biologických a biochemických věd Centralizovaný rozvojový projekt
Citlivost a rezistence mikroorganismů na antimikrobiální léčiva Sylva Janovská Univerzita Pardubice Fakulta chemicko-technologická Katedra biologických a biochemických věd Centralizovaný rozvojový projekt
INTERPRETACE VÝSLEDKŮ CITLIVOSTI NA ANTIBIOTIKA. Milan Kolář Ústav mikrobiologie Fakultní nemocnice a LF UP v Olomouci
 INTERPRETACE VÝSLEDKŮ CITLIVOSTI NA ANTIBIOTIKA Milan Kolář Ústav mikrobiologie Fakultní nemocnice a LF UP v Olomouci Současná medicína je charakteristická svým multidisciplinárním přístupem k řešení mnoha
INTERPRETACE VÝSLEDKŮ CITLIVOSTI NA ANTIBIOTIKA Milan Kolář Ústav mikrobiologie Fakultní nemocnice a LF UP v Olomouci Současná medicína je charakteristická svým multidisciplinárním přístupem k řešení mnoha
European Committee on Antimicrobial Susceptibility Testing
 European Committee on Antimicrobial Susceptibility Testing Breakpointy průměrů zón pro rychlé vyšetření antimikrobní citlivosti přímo z hemokultivačních lahviček (RAST) Verze 1.0, platná od 28-11-2018
European Committee on Antimicrobial Susceptibility Testing Breakpointy průměrů zón pro rychlé vyšetření antimikrobní citlivosti přímo z hemokultivačních lahviček (RAST) Verze 1.0, platná od 28-11-2018
Stav rezistence bakteriálních patogenů v Karlovarském kraji.
 Stav rezistence bakteriálních patogenů v Karlovarském kraji. Vážení kolegové, předkládáme vám k prostudování statistiku rezistencí hlavních bakteriálních patogenů. Kmeny jsme otestovali standardní diskovou
Stav rezistence bakteriálních patogenů v Karlovarském kraji. Vážení kolegové, předkládáme vám k prostudování statistiku rezistencí hlavních bakteriálních patogenů. Kmeny jsme otestovali standardní diskovou
TIGECYKLIN. Milan Kolář, Miroslava Htoutou Sedláková Ústav mikrobiologie, FNOL a LF UP
 TIGECYKLIN Milan Kolář, Miroslava Htoutou Sedláková Ústav mikrobiologie, FNOL a LF UP Odolnost bakterií k účinku antibiotické léčby patří k nejdůležitějším problémům současné medicíny Počet bakteriálních
TIGECYKLIN Milan Kolář, Miroslava Htoutou Sedláková Ústav mikrobiologie, FNOL a LF UP Odolnost bakterií k účinku antibiotické léčby patří k nejdůležitějším problémům současné medicíny Počet bakteriálních
ROZDĚLENÍ ANTIMIKROBIÁLNÍCH LÁTEK, VYŠETŘOVÁNÍ CITLIVOSTI. M.Hanslianová Antibiotické středisko OKM FN Brno
 ROZDĚLENÍ ANTIMIKROBIÁLNÍCH LÁTEK, VYŠETŘOVÁNÍ CITLIVOSTI M.Hanslianová Antibiotické středisko OKM FN Brno Antimikrobiální látky I. Antibiotika= léčiva používaná k profylaxi a terapii infekčních onemocnění
ROZDĚLENÍ ANTIMIKROBIÁLNÍCH LÁTEK, VYŠETŘOVÁNÍ CITLIVOSTI M.Hanslianová Antibiotické středisko OKM FN Brno Antimikrobiální látky I. Antibiotika= léčiva používaná k profylaxi a terapii infekčních onemocnění
Stav rezistence bakteriálních patogenů v Karlovarském kraji za rok 2009
 Stav rezistence bakteriálních patogenů v Karlovarském kraji za rok 9 Vážení kolegové, předkládáme vám k prostudování statistiku rezistencí hlavních bakteriálních patogenů. Kmeny jsme otestovali standardní
Stav rezistence bakteriálních patogenů v Karlovarském kraji za rok 9 Vážení kolegové, předkládáme vám k prostudování statistiku rezistencí hlavních bakteriálních patogenů. Kmeny jsme otestovali standardní
Funkční vzorek 5452/2017. Set ke stanovení minimálních inhibičních koncentrací antimikrobiálních. látek u gramnegativních bakterií II.
 Funkční vzorek 5452/2017 Set ke stanovení minimálních inhibičních koncentrací antimikrobiálních látek u gramnegativních bakterií II. řada Autoři: MVDr. Kateřina Nedbalcová, Ph.D., Výzkumný ústav veterinárního
Funkční vzorek 5452/2017 Set ke stanovení minimálních inhibičních koncentrací antimikrobiálních látek u gramnegativních bakterií II. řada Autoři: MVDr. Kateřina Nedbalcová, Ph.D., Výzkumný ústav veterinárního
European Committee on Antimicrobial Susceptibility Testing
 European Committee on Antimicrobial Susceptibility Testing Breakpointy průměrů zón pro rychlé vyšetření antimikrobní citlivosti přímo z hemokultivačních lahviček (RAST) Verze 1.1, platná od 2.5.2019 Tento
European Committee on Antimicrobial Susceptibility Testing Breakpointy průměrů zón pro rychlé vyšetření antimikrobní citlivosti přímo z hemokultivačních lahviček (RAST) Verze 1.1, platná od 2.5.2019 Tento
kontaminovaných operačních výkonů, ale i u čistých operací, při kterých dochází k aplikaci
 ANTIMIKROBNÍ PROFYLAXE Antibiotická profylaxe je aplikace vybraných antibakteriálních léčiv s cílem snížit výskyt infekcí v místě operačního výkonu. Použití profylaxe je indikováno nejen u kontaminovaných
ANTIMIKROBNÍ PROFYLAXE Antibiotická profylaxe je aplikace vybraných antibakteriálních léčiv s cílem snížit výskyt infekcí v místě operačního výkonu. Použití profylaxe je indikováno nejen u kontaminovaných
European Committee on Antimicrobial Susceptibility Testing
 European Committee on Antimicrobial Susceptibility Testing Rutinní a rozšířená kontrola kvality doporučená EUCAST Verze.0, platná od 9.. 0 Tento dokument se doporučuje citovat takto: "The European Committee
European Committee on Antimicrobial Susceptibility Testing Rutinní a rozšířená kontrola kvality doporučená EUCAST Verze.0, platná od 9.. 0 Tento dokument se doporučuje citovat takto: "The European Committee
Stav rezistence bakteriálních patogenů v Karlovarském kraji.
 Stav rezistence bakteriálních patogenů v Karlovarském kraji. Vážení kolegové, předkládáme vám k prostudování statistiku rezistencí hlavních bakteriálních patogenů. Kmeny jsme otestovali standardní diskovou
Stav rezistence bakteriálních patogenů v Karlovarském kraji. Vážení kolegové, předkládáme vám k prostudování statistiku rezistencí hlavních bakteriálních patogenů. Kmeny jsme otestovali standardní diskovou
Využití antibakteriálních testů v textilním průmyslu Mgr. Irena Šlamborová, Ph.D.
 Využití antibakteriálních testů v textilním průmyslu Mgr. Irena Šlamborová, Ph.D. Fakulta Přírodovědně-humanitní a pedagogická, katedra chemie OBSAH: 1. Stavba a fyziologie bakterií. 2. Kultivace bakterií,
Využití antibakteriálních testů v textilním průmyslu Mgr. Irena Šlamborová, Ph.D. Fakulta Přírodovědně-humanitní a pedagogická, katedra chemie OBSAH: 1. Stavba a fyziologie bakterií. 2. Kultivace bakterií,
RESPIRAČNÍ INFEKCE. Milan Kolář
 RESPIRAČNÍ INFEKCE Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci Nejčastějšími bakteriálními původci infekcí horních a dolních cest dýchacích v komunitním prostředí jsou kmeny: Streptococcus
RESPIRAČNÍ INFEKCE Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci Nejčastějšími bakteriálními původci infekcí horních a dolních cest dýchacích v komunitním prostředí jsou kmeny: Streptococcus
Co musí intenzivista vědět o antibiotické rezistenci?
 Co musí intenzivista vědět o antibiotické rezistenci? V. Adámková Klinická mikrobiologie a ATB centrum Ústav lékařské biochemie a laboratorní diagnostiky 1. LF a VFN Praha Rezistenci máme v rukou Klasifikace
Co musí intenzivista vědět o antibiotické rezistenci? V. Adámková Klinická mikrobiologie a ATB centrum Ústav lékařské biochemie a laboratorní diagnostiky 1. LF a VFN Praha Rezistenci máme v rukou Klasifikace
ANTIBIOTICKÉ LÉČBY V INTENZIVNÍ MEDICÍNĚ
 PRINCIPY ANTIBIOTICKÉ LÉČBY V INTENZIVNÍ MEDICÍNĚ Milan Kolář Ústav mikrobiologie Fakultní nemocnice Olomouc Lékařská fakulta Univerzity Palackého v Olomouci Bakteriální infekce byly, jsou a s velkou pravděpodobností
PRINCIPY ANTIBIOTICKÉ LÉČBY V INTENZIVNÍ MEDICÍNĚ Milan Kolář Ústav mikrobiologie Fakultní nemocnice Olomouc Lékařská fakulta Univerzity Palackého v Olomouci Bakteriální infekce byly, jsou a s velkou pravděpodobností
ZLLM0421c Lékařská orální mikrobiologie I, praktická cvičení. Protokol k tématu J05
 Téma J05: Stanovení citlivosti bakterií na antimikrobiální látky, průkaz faktorů rezistence K nastudování: z učebnic a internetu: hesla například Difusní diskový test ; E-test ; diluční mikrometoda ; minimální
Téma J05: Stanovení citlivosti bakterií na antimikrobiální látky, průkaz faktorů rezistence K nastudování: z učebnic a internetu: hesla například Difusní diskový test ; E-test ; diluční mikrometoda ; minimální
M. Laichmanová NOVINKY V NABÍDCE KONTROLNÍCH KMENŮ ČESKÉ SBÍRKY MIKROORGANISMŮ
 M. Laichmanová NOVINKY V NABÍDCE KONTROLNÍCH KMENŮ ČESKÉ SBÍRKY MIKROORGANISMŮ držitel certifikátu Kompletní nabídku referenčních mikroorganizmů tvoří 157 kontrolních kmenů bakterií vláknitých hub kvasinek
M. Laichmanová NOVINKY V NABÍDCE KONTROLNÍCH KMENŮ ČESKÉ SBÍRKY MIKROORGANISMŮ držitel certifikátu Kompletní nabídku referenčních mikroorganizmů tvoří 157 kontrolních kmenů bakterií vláknitých hub kvasinek
CVIČENÍ I. STANOVENÍ FENOTYPU REZISTENCE K VYBRANÝM ANTIBIOTIKŮM
 CVIČENÍ I. STANOVENÍ FENOTYPU REZISTENCE K VYBRANÝM ANTIBIOTIKŮM Stanovení citlivosti bakteriálního kmene k antibiotikům umožňuje výběr účinné terapie pro léčbu bakteriálních infekcí, což vede k zrychlení
CVIČENÍ I. STANOVENÍ FENOTYPU REZISTENCE K VYBRANÝM ANTIBIOTIKŮM Stanovení citlivosti bakteriálního kmene k antibiotikům umožňuje výběr účinné terapie pro léčbu bakteriálních infekcí, což vede k zrychlení
NEBEZPEČÍ IMPORTU MULTIREZISTENTNÍCH (MDR) BAKTERIÍ. Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci
 NEBEZPEČÍ IMPORTU MULTIREZISTENTNÍCH (MDR) BAKTERIÍ Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci Ženu v USA zabila bakterie, na kterou nefungovala žádná dostupná antibiotika. Americké CDC uvedlo,
NEBEZPEČÍ IMPORTU MULTIREZISTENTNÍCH (MDR) BAKTERIÍ Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci Ženu v USA zabila bakterie, na kterou nefungovala žádná dostupná antibiotika. Americké CDC uvedlo,
M KR K O R BI B OLO L GA
 SEPSE Z POHLEDU MIKROBIOLOGA Milan Kolář Ústav mikrobiologie LF UP a FNOL Sepse patří k nejzávažnějším infekčním onemocněním a nadále představuje velký terapeutický problém. Sepsi lze definovat jako systémovou
SEPSE Z POHLEDU MIKROBIOLOGA Milan Kolář Ústav mikrobiologie LF UP a FNOL Sepse patří k nejzávažnějším infekčním onemocněním a nadále představuje velký terapeutický problém. Sepsi lze definovat jako systémovou
NEBEZPEČÍ IMPORTU MULTIREZISTENTNÍCH (MDR) BAKTERIÍ. Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci
 NEBEZPEČÍ IMPORTU MULTIREZISTENTNÍCH (MDR) BAKTERIÍ Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci Ženu v USA zabila bakterie, na kterou nefungovala žádná dostupná antibiotika. Americké CDC uvedlo,
NEBEZPEČÍ IMPORTU MULTIREZISTENTNÍCH (MDR) BAKTERIÍ Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci Ženu v USA zabila bakterie, na kterou nefungovala žádná dostupná antibiotika. Americké CDC uvedlo,
ANTIBIOTICKÁ LÉČBA OFF-LABEL Z POHLEDU MIKROBIOLOGA. Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci
 ANTIBIOTICKÁ LÉČBA OFF-LABEL Z POHLEDU MIKROBIOLOGA Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci Septický pacient s nozokomiální pneumonií Endosekret: KLPN + ESCO Terapie: PPT + GEN INTERPRETACE?
ANTIBIOTICKÁ LÉČBA OFF-LABEL Z POHLEDU MIKROBIOLOGA Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci Septický pacient s nozokomiální pneumonií Endosekret: KLPN + ESCO Terapie: PPT + GEN INTERPRETACE?
Funkční vzorek 5456/2017. Set ke stanovení minimálních inhibičních koncentrací antimikrobiálních. látek u Enterococcus spp.
 Funkční vzorek 5456/2017 Set ke stanovení minimálních inhibičních koncentrací antimikrobiálních látek u Enterococcus spp. Autoři: MVDr. Kateřina Nedbalcová, Ph.D., Výzkumný ústav veterinárního lékařství,
Funkční vzorek 5456/2017 Set ke stanovení minimálních inhibičních koncentrací antimikrobiálních látek u Enterococcus spp. Autoři: MVDr. Kateřina Nedbalcová, Ph.D., Výzkumný ústav veterinárního lékařství,
European Committee on Antimicrobial Susceptibility Testing
 European Committee on Antimicrobial Susceptibility Testing Rutinní a rozšířená kontrola kvality doporučená EUCAST Verze 7, platná od 0. 0. 07 Tento dokument se doporučuje citovat takto: "The European Committee
European Committee on Antimicrobial Susceptibility Testing Rutinní a rozšířená kontrola kvality doporučená EUCAST Verze 7, platná od 0. 0. 07 Tento dokument se doporučuje citovat takto: "The European Committee
Ověřená technologie 4782/2017
 Ověřená technologie 4782/2017 Výroba setu ke stanovení minimálních inhibičních koncentrací antimikrobiálních látek u Enterococcus spp. Autoři: MVDr. Kateřina Nedbalcová, Ph.D., Výzkumný ústav veterinárního
Ověřená technologie 4782/2017 Výroba setu ke stanovení minimálních inhibičních koncentrací antimikrobiálních látek u Enterococcus spp. Autoři: MVDr. Kateřina Nedbalcová, Ph.D., Výzkumný ústav veterinárního
Stanovení citlivosti k antibiotikům. Stanovení koncentrace antibiotik.
 Stanovení citlivosti k antibiotikům. Stanovení koncentrace antibiotik. Antimikrobiální látky Látky působící celkově: Antiparazitární látky proti parazitům Antimykotika proti kvasinkám a vláknitým houbám
Stanovení citlivosti k antibiotikům. Stanovení koncentrace antibiotik. Antimikrobiální látky Látky působící celkově: Antiparazitární látky proti parazitům Antimykotika proti kvasinkám a vláknitým houbám
Využití molekulárně-biologických postupů a multimarkerových strategií v intenzívní péči. Marek Protuš
 Využití molekulárně-biologických postupů a multimarkerových strategií v intenzívní péči Marek Protuš Sepsis - 3 Sepse je definovaná jako život ohrožující orgánová dysfunkce způsobená dysregulovanou odpovědí
Využití molekulárně-biologických postupů a multimarkerových strategií v intenzívní péči Marek Protuš Sepsis - 3 Sepse je definovaná jako život ohrožující orgánová dysfunkce způsobená dysregulovanou odpovědí
Využití molekulárně-biologických postupů a multimarkerových strategií v intenzívní péči. Marek Protuš
 Využití molekulárně-biologických postupů a multimarkerových strategií v intenzívní péči Marek Protuš Sepsis - 3 Sepse je definovaná jako život ohrožující orgánová dysfunkce způsobená dysregulovanou odpovědí
Využití molekulárně-biologických postupů a multimarkerových strategií v intenzívní péči Marek Protuš Sepsis - 3 Sepse je definovaná jako život ohrožující orgánová dysfunkce způsobená dysregulovanou odpovědí
NOVINKY V NABÍDCE KONTROLNÍCH KMENŮ ČESKÉ SBÍRKY MIKROORGANISMŮ
 M. Laichmanová a S. Karpíšková Česká sbírka mikroorganismů, Ústav experimentální biologie, Přírodovědecká fakulta, Masarykova univerzita, Tvrdého 14, 602 00 Brno NOVINKY V NABÍDCE KONTROLNÍCH KMENŮ ČESKÉ
M. Laichmanová a S. Karpíšková Česká sbírka mikroorganismů, Ústav experimentální biologie, Přírodovědecká fakulta, Masarykova univerzita, Tvrdého 14, 602 00 Brno NOVINKY V NABÍDCE KONTROLNÍCH KMENŮ ČESKÉ
NA ANTIBIOTIKA NA ČOV
 Vodárenská biologie 2018, 6. 2. 2018 DETEKCE GENŮ REZISTENCE NA ANTIBIOTIKA NA ČOV TESTOVÁNÍ METODIKY Dana Vejmelková Kristýna Časarová Eva Proksová Jana Říhová Ambrožová PROBLEMATIKA REZISTENCE NA ANTIBIOTIKA
Vodárenská biologie 2018, 6. 2. 2018 DETEKCE GENŮ REZISTENCE NA ANTIBIOTIKA NA ČOV TESTOVÁNÍ METODIKY Dana Vejmelková Kristýna Časarová Eva Proksová Jana Říhová Ambrožová PROBLEMATIKA REZISTENCE NA ANTIBIOTIKA
Výskyt multirezistentních bakteriálních kmenů produkujících betalaktamázy
 Výskyt multirezistentních bakteriálních kmenů produkujících betalaktamázy Jaromíra Kratochvílová, Veronika Janásová 19. mezinárodní konference nemocniční epidemiologie a hygiena Mikulov 17. 18. dubna 2012
Výskyt multirezistentních bakteriálních kmenů produkujících betalaktamázy Jaromíra Kratochvílová, Veronika Janásová 19. mezinárodní konference nemocniční epidemiologie a hygiena Mikulov 17. 18. dubna 2012
STATISTIKA ANTIBIOTIK ZA ROK 2009
 Přehled kvalitativní citlivosti na antibiotika STATISTIKA ANTIBIOTIK ZA ROK 2009 Klinické materiály: MOČ KRK NOS UCHO POCHVA STĚRY (kožní a hnisavá ložiska) SPUTUM Zpracoval kolektiv mikrobiologické laboratoře
Přehled kvalitativní citlivosti na antibiotika STATISTIKA ANTIBIOTIK ZA ROK 2009 Klinické materiály: MOČ KRK NOS UCHO POCHVA STĚRY (kožní a hnisavá ložiska) SPUTUM Zpracoval kolektiv mikrobiologické laboratoře
Eva Krejčí. Antibiotické středisko, Zdravotní ústav se sídlem v Ostravě Lékařská fakulta Ostravské univerzity
 Eva Krejčí Antibiotické středisko, Zdravotní ústav se sídlem v Ostravě Lékařská fakulta Ostravské univerzity Jeden z problémů v pediatrické péči, jenž budou řešit naši nástupci, bude narůstající rezistence
Eva Krejčí Antibiotické středisko, Zdravotní ústav se sídlem v Ostravě Lékařská fakulta Ostravské univerzity Jeden z problémů v pediatrické péči, jenž budou řešit naši nástupci, bude narůstající rezistence
Možnosti beta-laktamových antibiotik v léčbě nozokomiálních pneumonií
 Možnosti beta-laktamových antibiotik v léčbě nozokomiálních pneumonií Htoutou Sedláková Miroslava, Kolář Milan, Uvízl Radovan Ústav mikrobiologie, LF UP v Olomouci Klinika anesteziologie, resuscitace a
Možnosti beta-laktamových antibiotik v léčbě nozokomiálních pneumonií Htoutou Sedláková Miroslava, Kolář Milan, Uvízl Radovan Ústav mikrobiologie, LF UP v Olomouci Klinika anesteziologie, resuscitace a
LABORATORNÍ STUDIE ANTIMIKROBNÍ AKTIVITY CHLOROVÝCH PŘÍPRAVKŮ NA BÁZI DICHLORIZOKYANURANU SODNÉHO
 LABORATORNÍ STUDIE ANTIMIKROBNÍ AKTIVITY CHLOROVÝCH PŘÍPRAVKŮ NA BÁZI DICHLORIZOKYANURANU SODNÉHO Doc. Ing. Marie Hartmanová, CSc. Vojenská lékařská akademie JEP, Hradec Králové, Česká republika Mezi klasické,
LABORATORNÍ STUDIE ANTIMIKROBNÍ AKTIVITY CHLOROVÝCH PŘÍPRAVKŮ NA BÁZI DICHLORIZOKYANURANU SODNÉHO Doc. Ing. Marie Hartmanová, CSc. Vojenská lékařská akademie JEP, Hradec Králové, Česká republika Mezi klasické,
European Committee on Antimicrobial Susceptibility Testing
 European Committee on Antimicrobial Susceptibility Testing Rutinní a rozšířená kontrola kvality doporučená EUCAST Verze 8, platná od 0. 0. 08 Tento dokument se doporučuje citovat takto: "The European Committee
European Committee on Antimicrobial Susceptibility Testing Rutinní a rozšířená kontrola kvality doporučená EUCAST Verze 8, platná od 0. 0. 08 Tento dokument se doporučuje citovat takto: "The European Committee
tvoří tvoř biofilm biofilm tvoří biof tvoř ilm tvoří biof tvoř ilm tvoří biofilm tvoř
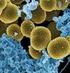 Tvorba biofilmu u mikrobů izolovaných z klinického materiálu MUDr. Černohorská Lenka, Ph.D. Kdo tvoří biofilm (bakterie, viry, kvasinky, 1druh, více druhů, multibakteriální komunity) Kde se tvoří biofilm
Tvorba biofilmu u mikrobů izolovaných z klinického materiálu MUDr. Černohorská Lenka, Ph.D. Kdo tvoří biofilm (bakterie, viry, kvasinky, 1druh, více druhů, multibakteriální komunity) Kde se tvoří biofilm
European Committee on Antimicrobial Susceptibility Testing
 European Committee on Antimicrobial Susceptibility Testing Rutinní a rozšířená kontrola kvality doporučená EUCAST Verze 9.0, platná od 0. 0. 09 Tento dokument se doporučuje citovat takto: "The European
European Committee on Antimicrobial Susceptibility Testing Rutinní a rozšířená kontrola kvality doporučená EUCAST Verze 9.0, platná od 0. 0. 09 Tento dokument se doporučuje citovat takto: "The European
DIAGNOSTIKA INFEKČNÍCH CHOROB KULTIVACE V LABORATORNÍCH PODMÍNKÁCH
 STŘEDNÍ ZDRAVOTNICKÁ ŠKOLA A VYŠŠÍ ODBORNÁ ŠKOLA ZDRAVOTNICKÁ ŽĎÁR NAD SÁZAVOU DIAGNOSTIKA INFEKČNÍCH CHOROB KULTIVACE V LABORATORNÍCH PODMÍNKÁCH MGR. IVA COUFALOVÁ DIAGNOSTIKA INFEKČNÍCH CHOROB KULTIVACE
STŘEDNÍ ZDRAVOTNICKÁ ŠKOLA A VYŠŠÍ ODBORNÁ ŠKOLA ZDRAVOTNICKÁ ŽĎÁR NAD SÁZAVOU DIAGNOSTIKA INFEKČNÍCH CHOROB KULTIVACE V LABORATORNÍCH PODMÍNKÁCH MGR. IVA COUFALOVÁ DIAGNOSTIKA INFEKČNÍCH CHOROB KULTIVACE
BETA-LAKTAMOVÁ ANTIBIOTIKA V INTENZIVNÍ PÉČI Z POHLEDU MIKROBIOLOGA
 BETA-LAKTAMOVÁ ANTIBIOTIKA V INTENZIVNÍ PÉČI Z POHLEDU MIKROBIOLOGA Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci BETA-LAKTAMOVÁ ANTIBIOTIKA Peniciliny Cefalosporiny Monobaktamy Karbapenemy BETA-LAKTAMOVÁ
BETA-LAKTAMOVÁ ANTIBIOTIKA V INTENZIVNÍ PÉČI Z POHLEDU MIKROBIOLOGA Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci BETA-LAKTAMOVÁ ANTIBIOTIKA Peniciliny Cefalosporiny Monobaktamy Karbapenemy BETA-LAKTAMOVÁ
Speciální hybridní vrstvy připravené metodou sol-gel a jejich biomedicínské aplikace
 Speciální hybridní vrstvy připravené metodou sol-gel a jejich biomedicínské aplikace Petr Exnar, Irena Lovětinská-Šlamborová Katedra chemie a Ústav zdravotnických studií, Technická univerzita v Liberci
Speciální hybridní vrstvy připravené metodou sol-gel a jejich biomedicínské aplikace Petr Exnar, Irena Lovětinská-Šlamborová Katedra chemie a Ústav zdravotnických studií, Technická univerzita v Liberci
VÝVOJ REZISTENCE BAKTERIÁLNÍCH PATOGENŮ
 LABORATORNÍ LISTY Listopad č.29/2016 2016 Vážené kolegyně a kolegové, v tomto čísle našich Laboratorních listů Vám předkládáme statistiku rezistencí hlavních bakteriálních patogenů. Kmeny jsme testovali
LABORATORNÍ LISTY Listopad č.29/2016 2016 Vážené kolegyně a kolegové, v tomto čísle našich Laboratorních listů Vám předkládáme statistiku rezistencí hlavních bakteriálních patogenů. Kmeny jsme testovali
NÁRODNÍ PROGRAM SLEDOVÁNÍ REZISTENCÍ K ANTIMIKROBIKŮM U VETERINÁRNĚ VÝZNAMNÝCH PATOGENŮ
 RL antibiotické centrum pro veterinární klinickou praxi NÁRODNÍ PROGRAM SLEDOVÁNÍ REZISTENCÍ K ANTIMIKROBIKŮM U VETERINÁRNĚ VÝZNAMNÝCH PATOGENŮ za rok 2017 část II. Obsah 1. Úvod... 2 2. Staphylococcus
RL antibiotické centrum pro veterinární klinickou praxi NÁRODNÍ PROGRAM SLEDOVÁNÍ REZISTENCÍ K ANTIMIKROBIKŮM U VETERINÁRNĚ VÝZNAMNÝCH PATOGENŮ za rok 2017 část II. Obsah 1. Úvod... 2 2. Staphylococcus
ROZDĚLENÍ ANTIMIKROBIÁLNÍCH LÁTEK, VYŠETŘOVÁNÍ CITLIVOSTI. M.Hanslianová Antibiotické středisko OKM FN Brno
 ROZDĚLENÍ ANTIMIKROBIÁLNÍCH LÁTEK, VYŠETŘOVÁNÍ CITLIVOSTI M.Hanslianová Antibiotické středisko OKM FN Brno Antimikrobiální látky I. Antibiotika II. III. IV. Antimykotika Antiparazitika Antivirotika Antibiotika
ROZDĚLENÍ ANTIMIKROBIÁLNÍCH LÁTEK, VYŠETŘOVÁNÍ CITLIVOSTI M.Hanslianová Antibiotické středisko OKM FN Brno Antimikrobiální látky I. Antibiotika II. III. IV. Antimykotika Antiparazitika Antivirotika Antibiotika
NÁVRH A PŘÍPRAVA PEPTIDŮ A LIPOPEPTIDŮ S ANTIMIKROBIÁLNÍM ÚČINKEM A STUDIUM JEJICH BIOLOGICKÝCH VLASTNOSTÍ
 NÁVRH A PŘÍPRAVA PEPTIDŮ A LIPOPEPTIDŮ S ANTIMIKROBIÁLNÍM ÚČINKEM A STUDIUM JEJICH BIOLOGICKÝCH VLASTNOSTÍ A. Macůrková R. Ježek P. Lovecká V. Spiwok P. Ulbrich T. Macek Antimikrobiální peptidy přírodní
NÁVRH A PŘÍPRAVA PEPTIDŮ A LIPOPEPTIDŮ S ANTIMIKROBIÁLNÍM ÚČINKEM A STUDIUM JEJICH BIOLOGICKÝCH VLASTNOSTÍ A. Macůrková R. Ježek P. Lovecká V. Spiwok P. Ulbrich T. Macek Antimikrobiální peptidy přírodní
VÝVOJ REZISTENCE BAKTERIÁLNÍCH PATOGENŮ
 LABORATORNÍ LISTY Srpen č.27/2015 2015 Vážené kolegyně a kolegové, v tomto čísle našich Laboratorních listů Vám předkládáme statistiku rezistencí hlavních bakteriálních patogenů. Kmeny jsme testovali standardní
LABORATORNÍ LISTY Srpen č.27/2015 2015 Vážené kolegyně a kolegové, v tomto čísle našich Laboratorních listů Vám předkládáme statistiku rezistencí hlavních bakteriálních patogenů. Kmeny jsme testovali standardní
Streptokoky - průkaz fenotypu rezistence k antibiotikům ze skupiny makrolidů, linkosamidů a streptograminub
 Streptokoky - průkaz fenotypu rezistence k antibiotikům ze skupiny makrolidů, linkosamidů a streptograminub Revize 27. 1. 2014 A. Klinické vzorky pro vyšetření citlivosti Citlivost k antibiotikům (včetně
Streptokoky - průkaz fenotypu rezistence k antibiotikům ze skupiny makrolidů, linkosamidů a streptograminub Revize 27. 1. 2014 A. Klinické vzorky pro vyšetření citlivosti Citlivost k antibiotikům (včetně
European Committee on Antimicrobial Susceptibility Testing
 European Committee on Antimicrobial Susceptibility Testing Rutinní a rozšířená kontrola kvality doporučená EUCAST Verze 6., platná od 0. 03. 06 Tento dokument se doporučuje citovat takto: "The European
European Committee on Antimicrobial Susceptibility Testing Rutinní a rozšířená kontrola kvality doporučená EUCAST Verze 6., platná od 0. 03. 06 Tento dokument se doporučuje citovat takto: "The European
POTŘEBUJEME NOVÁ ANTIBIOTIKA V INTENZIVNÍ PÉČI? Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci
 POTŘEBUJEME NOVÁ ANTIBIOTIKA V INTENZIVNÍ PÉČI? Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci POTŘEBUJEME NOVÁ ANTIBIOTIKA V INTENZIVNÍ PÉČI? ANO POTŘEBUJEME, ALE NENÍ TO JEDINÉ ŘEŠENÍ PROBLÉMU
POTŘEBUJEME NOVÁ ANTIBIOTIKA V INTENZIVNÍ PÉČI? Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci POTŘEBUJEME NOVÁ ANTIBIOTIKA V INTENZIVNÍ PÉČI? ANO POTŘEBUJEME, ALE NENÍ TO JEDINÉ ŘEŠENÍ PROBLÉMU
CITLIVOST A REZISTENCE MIKROORGANISMŮ K ANTIBIOTIKŮM
 CITLIVOST A REZISTENCE MIKROORGANISMŮ K ANTIBIOTIKŮM Mgr. Sylva Janovská, Ph.D. Mgr. Eva Slehová Univerzita Pardubice Fakulta chemicko-technologická Katedra biologických a biochemických věd Centralizovaný
CITLIVOST A REZISTENCE MIKROORGANISMŮ K ANTIBIOTIKŮM Mgr. Sylva Janovská, Ph.D. Mgr. Eva Slehová Univerzita Pardubice Fakulta chemicko-technologická Katedra biologických a biochemických věd Centralizovaný
Jak léčím infekce vyvolané multi- rezistentními bakteriemi
 Jak léčím infekce vyvolané multi- rezistentními bakteriemi Praha, 13.6.2013 Jiří Beneš Klinika infekčních nemocí 3. LF UK Nemocnice Na Bulovce, Praha Multirezistentní (nozokomiální) bakterie Gram-pozitivní
Jak léčím infekce vyvolané multi- rezistentními bakteriemi Praha, 13.6.2013 Jiří Beneš Klinika infekčních nemocí 3. LF UK Nemocnice Na Bulovce, Praha Multirezistentní (nozokomiální) bakterie Gram-pozitivní
LABORATORNÍ LISTY Vážené kolegyně a kolegové,
 LABORATORNÍ LISTY Červen Vážené kolegyně a kolegové, VÝVOJ REZISTENCE BAKTERIÁLNÍCH PATOGENŮ Horní cesty dýchací Streptococcus pyogenes č. 19/2018 2018 v tomto čísle našich laboratorních listů Vám předkládáme
LABORATORNÍ LISTY Červen Vážené kolegyně a kolegové, VÝVOJ REZISTENCE BAKTERIÁLNÍCH PATOGENŮ Horní cesty dýchací Streptococcus pyogenes č. 19/2018 2018 v tomto čísle našich laboratorních listů Vám předkládáme
POH O L H E L D E U D U M
 SEPSE Z POHLEDU MIKROBIOLOGA Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci K významným problémům současné medicíny patří bezesporu septické stavy z důvodu vysoké morbidity, mortality a současně
SEPSE Z POHLEDU MIKROBIOLOGA Milan Kolář Ústav mikrobiologie FNOL a LF UP v Olomouci K významným problémům současné medicíny patří bezesporu septické stavy z důvodu vysoké morbidity, mortality a současně
Návod k odečítání. Disková difuzní metoda EUCAST pro vyšetřování antibiotické citlivosti. Verze 3.0 Duben 2013
 Návod k odečítání Disková difuzní metoda EUCAST pro vyšetřování antibiotické citlivosti Verze 3.0 Duben 2013 2 Modifikace obrázkového návodu k odečítání EUCAST Verze Verze 3.0 Duben 2013 Verze 2.0 Květen
Návod k odečítání Disková difuzní metoda EUCAST pro vyšetřování antibiotické citlivosti Verze 3.0 Duben 2013 2 Modifikace obrázkového návodu k odečítání EUCAST Verze Verze 3.0 Duben 2013 Verze 2.0 Květen
Stanovení citlivosti bakterií k ATB, stanovení koncentrace ATB
 Stanovení citlivosti bakterií k ATB, stanovení koncentrace ATB Cíl: Stanovit citlivost MO k ATB Porovnat citlivost různých MO k různým ATB Stanovit min. inhibiční koncentraci dilučním testem Mikroorganizmy
Stanovení citlivosti bakterií k ATB, stanovení koncentrace ATB Cíl: Stanovit citlivost MO k ATB Porovnat citlivost různých MO k různým ATB Stanovit min. inhibiční koncentraci dilučním testem Mikroorganizmy
Návod k odečítání Disková difuzní metoda EUCAST pro vyšetřování antibiotické citlivosti
 Návod k odečítání Disková difuzní metoda EUCAST pro vyšetřování antibiotické citlivosti Verze 5.0 Leden 2017 Změny proti předchozí verzi (v 4.0) Obrázek Změna 3 17 Objasnění týkající se odečítání zón a
Návod k odečítání Disková difuzní metoda EUCAST pro vyšetřování antibiotické citlivosti Verze 5.0 Leden 2017 Změny proti předchozí verzi (v 4.0) Obrázek Změna 3 17 Objasnění týkající se odečítání zón a
Stav rezistence bakteriálních patogenů v Karlovarském kraji.
 Stav rezistence bakteriálních patogenů v Karlovarském kraji. Vážní kolegové, předkládáme Vám k prostudování statistiku rezistencí hlavních bakteriálních patogenů. Kmeny jsme otestovaly standardní diskovou
Stav rezistence bakteriálních patogenů v Karlovarském kraji. Vážní kolegové, předkládáme Vám k prostudování statistiku rezistencí hlavních bakteriálních patogenů. Kmeny jsme otestovaly standardní diskovou
VANOQUAT. Mycí a dezinfekční přípravek pro potravinářství. Mikrobiologická dokumentace přípravku
 VANOQUAT Mycí a dezinfekční přípravek pro potravinářství Mikrobiologická dokumentace přípravku 1 Obsah strana ÚVOD 3 1 NÁRODNÍ REGISTRACE 4 2 BAKTERIOSTATICKÁ ÚČINNOST 5 3 BAKTERCIDNÍ ÚČINNOST 6-8 4 FUNGISTATICKÁ
VANOQUAT Mycí a dezinfekční přípravek pro potravinářství Mikrobiologická dokumentace přípravku 1 Obsah strana ÚVOD 3 1 NÁRODNÍ REGISTRACE 4 2 BAKTERIOSTATICKÁ ÚČINNOST 5 3 BAKTERCIDNÍ ÚČINNOST 6-8 4 FUNGISTATICKÁ
Protokol o zkoušce č. 1652
 Výtisk č.: 1 Vydání č.: 2 Protokol o zkoušce č. 1652 Evidenční číslo vzorku: 1652 List č.: 1 Název vzorku: Cleamen dezi PPM Počet listů: 7 Zákazník: Cormen, s.r.o., Nádražní 993, 593 01 Bystřice nad Perštejnem
Výtisk č.: 1 Vydání č.: 2 Protokol o zkoušce č. 1652 Evidenční číslo vzorku: 1652 List č.: 1 Název vzorku: Cleamen dezi PPM Počet listů: 7 Zákazník: Cormen, s.r.o., Nádražní 993, 593 01 Bystřice nad Perštejnem
Ověřená technologie 4797/2017
 Ověřená technologie 4797/2017 Výroba setu ke stanovení minimálních inhibičních koncentrací antimikrobiálních látek u bakteriálních anaerobních patogenů hospodářských zvířat Autoři: MVDr. Kateřina Nedbalcová,
Ověřená technologie 4797/2017 Výroba setu ke stanovení minimálních inhibičních koncentrací antimikrobiálních látek u bakteriálních anaerobních patogenů hospodářských zvířat Autoři: MVDr. Kateřina Nedbalcová,
Funkční vzorek 5474/2017
 Funkční vzorek 5474/2017 Set ke stanovení minimálních inhibičních koncentrací antimikrobiálních látek u bakteriálních anaerobních patogenů hospodářských zvířat MVDr. Kateřina Nedbalcová, Ph.D. 1 MVDr.
Funkční vzorek 5474/2017 Set ke stanovení minimálních inhibičních koncentrací antimikrobiálních látek u bakteriálních anaerobních patogenů hospodářských zvířat MVDr. Kateřina Nedbalcová, Ph.D. 1 MVDr.
Urbánek K, Kolá M, ekanová L. Pharmacy World and Science. 2005, 27:
 RESPIRA NÍ INFEKCE Milan Kolá Ústav mikrobiologie FNOL a LF UP v Olomouci Nej ast j ími bakteriálními p vodci infekcí horních a dolních cest dýchacích v komunitním prost edí jsou kmeny: Streptococcus pyogenes
RESPIRA NÍ INFEKCE Milan Kolá Ústav mikrobiologie FNOL a LF UP v Olomouci Nej ast j ími bakteriálními p vodci infekcí horních a dolních cest dýchacích v komunitním prost edí jsou kmeny: Streptococcus pyogenes
PVC Závěsné fólie do vrat a průchodů
 1/10 PVC závěsné fólie jsou používány ve venkovních i vnitřních prostorech jako zábrana proti prachu, kouři, hmyzu, ptactvu atd. Používají se také jako protihluková bariéra mezi hlučnými výrobními prostory
1/10 PVC závěsné fólie jsou používány ve venkovních i vnitřních prostorech jako zábrana proti prachu, kouři, hmyzu, ptactvu atd. Používají se také jako protihluková bariéra mezi hlučnými výrobními prostory
Funkční vzorek 4595/2018. Set ke stanovení minimálních inhibičních koncentrací antimikrobiálních. látek u Streptococcus suis
 Funkční vzorek 4595/2018 Set ke stanovení minimálních inhibičních koncentrací antimikrobiálních látek u Streptococcus suis Autoři: MVDr. Kateřina Nedbalcová, Ph.D., Výzkumný ústav veterinárního lékařství,
Funkční vzorek 4595/2018 Set ke stanovení minimálních inhibičních koncentrací antimikrobiálních látek u Streptococcus suis Autoři: MVDr. Kateřina Nedbalcová, Ph.D., Výzkumný ústav veterinárního lékařství,
Viviana Fuchsová, Kamila Zdeňková, Martina Boháčová, Kateřina Demnerová
 Viviana Fuchsová, Kamila Zdeňková, Martina Boháčová, Kateřina Demnerová penicilin Antibiotika = antimikrobiální látky různé struktury a původu látky přírodního původu - sekundární metabolity mikromycet
Viviana Fuchsová, Kamila Zdeňková, Martina Boháčová, Kateřina Demnerová penicilin Antibiotika = antimikrobiální látky různé struktury a původu látky přírodního původu - sekundární metabolity mikromycet
SeptiFast. rychlá detekce sepse. Olga Bálková Roche s.r.o., Diagnostics Division
 SeptiFast rychlá detekce sepse Olga Bálková Roche s.r.o., Diagnostics Division Požadavky kliniků Rychlá detekce a identifikace patogenů způsobujících sepsi Rychlé výsledky Výsledky do několika hodin Jednoznačné
SeptiFast rychlá detekce sepse Olga Bálková Roche s.r.o., Diagnostics Division Požadavky kliniků Rychlá detekce a identifikace patogenů způsobujících sepsi Rychlé výsledky Výsledky do několika hodin Jednoznačné
Zkušenosti s diagnostikou sepse pomocí testu SeptiFast Test M GRADE. Zdeňka Doubková Klinická mikrobiologie a ATB centrum VFN Praha
 Zkušenosti s diagnostikou sepse pomocí testu SeptiFast Test M GRADE Zdeňka Doubková Klinická mikrobiologie a ATB centrum VFN Praha Definice: Sepse je definována jako syndrom systémové zánětlivé odpovědi
Zkušenosti s diagnostikou sepse pomocí testu SeptiFast Test M GRADE Zdeňka Doubková Klinická mikrobiologie a ATB centrum VFN Praha Definice: Sepse je definována jako syndrom systémové zánětlivé odpovědi
Evropský antibiotický den aktivita Evropského centra pro kontrolu a prevenci infekčních onemocnění (ECDC)
 Evropský antibiotický den aktivita Evropského centra pro kontrolu a prevenci infekčních onemocnění (ECDC) doc. MUDr. Helena Žemličková, PhD. Národní referenční laboratoř pro antibiotika Státní zdravotní
Evropský antibiotický den aktivita Evropského centra pro kontrolu a prevenci infekčních onemocnění (ECDC) doc. MUDr. Helena Žemličková, PhD. Národní referenční laboratoř pro antibiotika Státní zdravotní
Kultivační metody stanovení mikroorganismů
 Kultivační metody stanovení mikroorganismů Základní rozdělení půd Syntetická, definovaná media, jednoduché sloučeniny, známé sloţení Komplexní media, vycházejí z ţivočišných nebo rostlinných tkání a pletiv,
Kultivační metody stanovení mikroorganismů Základní rozdělení půd Syntetická, definovaná media, jednoduché sloučeniny, známé sloţení Komplexní media, vycházejí z ţivočišných nebo rostlinných tkání a pletiv,
PT#M/5-4/2018 (č.1045v) Bakteriologická diagnostika
 Státní zdravotní ústav Expertní skupina pro zkoušení způsobilosti Poskytovatel zkoušení způsobilosti akreditovaný ČIA podle ČSN EN ISO/IEC 17043, reg. č. 7001 Šrobárova 48, 100 42 Praha 10 Vinohrady Zkoušení
Státní zdravotní ústav Expertní skupina pro zkoušení způsobilosti Poskytovatel zkoušení způsobilosti akreditovaný ČIA podle ČSN EN ISO/IEC 17043, reg. č. 7001 Šrobárova 48, 100 42 Praha 10 Vinohrady Zkoušení
MIKROBIOLOGIE. Grampozitivní kokovitá bakterie STAPHYLOCOCCUS AUREUS bakteriální kmen dle ATCC 1260 (CCM 888).
 MIKROBIOLOGIE Veškeré testy jsou prováděny s těmito bakteriálními kmeny: Gramnegativní tyčinkovitá bakterie ESCHERICHIA COLI bakteriální kmen dle ATCC 9637 (CCM 2024). Grampozitivní kokovitá bakterie STAPHYLOCOCCUS
MIKROBIOLOGIE Veškeré testy jsou prováděny s těmito bakteriálními kmeny: Gramnegativní tyčinkovitá bakterie ESCHERICHIA COLI bakteriální kmen dle ATCC 9637 (CCM 2024). Grampozitivní kokovitá bakterie STAPHYLOCOCCUS
Ověřená technologie 4903/2018
 Ověřená technologie 4903/2018 Výroba setu ke stanovení minimálních inhibičních koncentrací antimikrobiálních látek u Streptococcus suis Autoři: MVDr. Kateřina Nedbalcová, Ph.D., Výzkumný ústav veterinárního
Ověřená technologie 4903/2018 Výroba setu ke stanovení minimálních inhibičních koncentrací antimikrobiálních látek u Streptococcus suis Autoři: MVDr. Kateřina Nedbalcová, Ph.D., Výzkumný ústav veterinárního
Cellistypt Vstřebatelný hemostatický prostředek na bázi oxidované celulózy
 Cellistypt Vstřebatelný hemostatický prostředek na bázi oxidované celulózy Biochirurgie Cellistypt Vstřebatelný hemostatický prostředek na bázi oxidované celulózy Cellistypt je vstřebatelný hemostatický
Cellistypt Vstřebatelný hemostatický prostředek na bázi oxidované celulózy Biochirurgie Cellistypt Vstřebatelný hemostatický prostředek na bázi oxidované celulózy Cellistypt je vstřebatelný hemostatický
Moderní metody stanovení mikroorganismů
 Moderní metody stanovení mikroorganismů Mgr. Martin Polách NOACK ČR, spol. s r.o. Legislativní požadavky EU na mikrobiologické parametry potravin Závazným předpisem je nařízení 1441 / 2007 / ES, pozměňující
Moderní metody stanovení mikroorganismů Mgr. Martin Polách NOACK ČR, spol. s r.o. Legislativní požadavky EU na mikrobiologické parametry potravin Závazným předpisem je nařízení 1441 / 2007 / ES, pozměňující
Implementace laboratorní medicíny do systému vzdělávání na Univerzitě Palackého v Olomouci. reg. č.: CZ.1.07/2.2.00/
 Implementace laboratorní medicíny do systému vzdělávání na Univerzitě Palackého v Olomouci reg. č.: CZ.1.07/2.2.00/28.0088 PROBLEMATIKA INFEKCÍ HORNÍCH CEST DÝCHACÍCH DIAGNOSTIKA A LÉČBA TONSILITID, SINUSITID
Implementace laboratorní medicíny do systému vzdělávání na Univerzitě Palackého v Olomouci reg. č.: CZ.1.07/2.2.00/28.0088 PROBLEMATIKA INFEKCÍ HORNÍCH CEST DÝCHACÍCH DIAGNOSTIKA A LÉČBA TONSILITID, SINUSITID
PREGRADUÁLNÍ VZDĚLÁVÁNÍ V LÉKAŘSKÉ MIKROBIOLOGII
 PREGRADUÁLNÍ VZDĚLÁVÁNÍ V LÉKAŘSKÉ MIKROBIOLOGII Milan Kolář Lékařská fakulta UP v Olomouci ZÁVĚRY Z PŘEDCHÁZEJÍCÍCH SETKÁNÍ Výuka lékařské mikrobiologie patří k nezbytným předpokladům pro výuku klinických
PREGRADUÁLNÍ VZDĚLÁVÁNÍ V LÉKAŘSKÉ MIKROBIOLOGII Milan Kolář Lékařská fakulta UP v Olomouci ZÁVĚRY Z PŘEDCHÁZEJÍCÍCH SETKÁNÍ Výuka lékařské mikrobiologie patří k nezbytným předpokladům pro výuku klinických
Průkaz beta-laktamáz širokého spektra (ESBL) a typu AmpC u enterobakterií
 Průkaz beta-laktamáz širokého spektra (ESBL) a typu AmpC u enterobakterií A. Definice - Širokospektré b-laktamázy - ESBL (extended-spectrum b-lactamases) jsou enzymy produkované některými mikroby, které
Průkaz beta-laktamáz širokého spektra (ESBL) a typu AmpC u enterobakterií A. Definice - Širokospektré b-laktamázy - ESBL (extended-spectrum b-lactamases) jsou enzymy produkované některými mikroby, které
Racionální terapie komplikovaných infekcí z pohledu mikrobiologa. V. Adámková KM ATB ÚKBLD VFN
 Racionální terapie komplikovaných infekcí z pohledu mikrobiologa V. Adámková KM ATB ÚKBLD VFN Klasifikace léčby antibiotiky Empirická terapie (pathogen non-specific therapy) - odhadem, bez mikrobiologického
Racionální terapie komplikovaných infekcí z pohledu mikrobiologa V. Adámková KM ATB ÚKBLD VFN Klasifikace léčby antibiotiky Empirická terapie (pathogen non-specific therapy) - odhadem, bez mikrobiologického
NÁRODNÍ PROGRAM SLEDOVÁNÍ REZISTENCÍ K ANTIMIKROBIKŮM U VETERINÁRNĚ VÝZNAMNÝCH PATOGENŮ. část I. za rok 2017
 RL antibiotické centrum pro veterinární klinickou praxi NÁRODNÍ PROGRAM SLEDOVÁNÍ REZISTENCÍ K ANTIMIKROBIKŮM U VETERINÁRNĚ VÝZNAMNÝCH PATOGENŮ za rok 2017 část I. Obsah 1. Úvod... 2 2. Cíle programu...
RL antibiotické centrum pro veterinární klinickou praxi NÁRODNÍ PROGRAM SLEDOVÁNÍ REZISTENCÍ K ANTIMIKROBIKŮM U VETERINÁRNĚ VÝZNAMNÝCH PATOGENŮ za rok 2017 část I. Obsah 1. Úvod... 2 2. Cíle programu...
Rezistence patogenů vůči antimikrobialním látkám. Martin Hruška Jan Dlouhý
 Rezistence patogenů vůči antimikrobialním látkám Martin Hruška Jan Dlouhý Pojmy Patogen (patogenní agens, choroboplodný zárodek nebo původce nemoci) je biologický faktor (organismus), který může zapřičinit
Rezistence patogenů vůči antimikrobialním látkám Martin Hruška Jan Dlouhý Pojmy Patogen (patogenní agens, choroboplodný zárodek nebo původce nemoci) je biologický faktor (organismus), který může zapřičinit
Odbor ochrany zdraví a pohody zvířat. Národní program sledování rezistencí k antimikrobikům u veterinárně významných patogenů
 Odbor ochrany zdraví a pohody zvířat Národní program sledování rezistencí k antimikrobikům u veterinárně významných patogenů Informační bulletin č. 4/17 Obsah 1. Úvod... 2 2. Cíle programu... 3 3. Metodika
Odbor ochrany zdraví a pohody zvířat Národní program sledování rezistencí k antimikrobikům u veterinárně významných patogenů Informační bulletin č. 4/17 Obsah 1. Úvod... 2 2. Cíle programu... 3 3. Metodika
Multirezistentních gramnegativní tyčky: základy epidemiologie antibiotické rezistence
 B I O M E D I C AL Multirezistentních gramnegativní tyčky: základy epidemiologie antibiotické rezistence Jaroslav Hrabák CHARLES UNIVERSITY IN PRAGUE Obsah prezentace Jaké multirezistentní gramnegativní
B I O M E D I C AL Multirezistentních gramnegativní tyčky: základy epidemiologie antibiotické rezistence Jaroslav Hrabák CHARLES UNIVERSITY IN PRAGUE Obsah prezentace Jaké multirezistentní gramnegativní
Expertní pravidla EUCAST verze 3.0
 Expertní pravidla EUCAST verze 3.0 Přirozená rezistence a výjimečné fenotypy Expertní pravidla EUCAST verze 2.0 byla zveřejněna 29 října 20(http://www.eucast.org/expert_rules). V průběhu minulého roku
Expertní pravidla EUCAST verze 3.0 Přirozená rezistence a výjimečné fenotypy Expertní pravidla EUCAST verze 2.0 byla zveřejněna 29 října 20(http://www.eucast.org/expert_rules). V průběhu minulého roku
LABORATOŘE EUROMEDIC s.r.o. Oddělení klinické mikrobiologie a autovakcín
 Přehledy nejčastějších původců komunitních infekcí a jejich rezistence k antimikrobiálním látkám dle materiálů vyšetřených v mikrobiologické laboratoři v roce 2012. MUDr. Alžbeta Ouertani Říjen 2013 Respirační
Přehledy nejčastějších původců komunitních infekcí a jejich rezistence k antimikrobiálním látkám dle materiálů vyšetřených v mikrobiologické laboratoři v roce 2012. MUDr. Alžbeta Ouertani Říjen 2013 Respirační
Neodolatelný SELECTAN ORAL SELECTAN ORAL. 23 mg/ml koncentrát k použití v pitné vodě. Vysoký příjem, nejlepší léčba.
 SELECTAN ORAL 23 mg/ml koncentrát k použití v pitné vodě Neodolatelný Vysoký příjem, nejlepší léčba. SELECTAN ORAL představuje léčivý roztok v pitné vodě řešící opakující se infekce u prasat. : nová molekula
SELECTAN ORAL 23 mg/ml koncentrát k použití v pitné vodě Neodolatelný Vysoký příjem, nejlepší léčba. SELECTAN ORAL představuje léčivý roztok v pitné vodě řešící opakující se infekce u prasat. : nová molekula
OVĚŘENÁ TECHNOLOGIE. Výroba setu ke stanovení MIC antimikrobiálních látek u bakteriálních patogenů psů a koček
 OVĚŘENÁ TECHNOLOGIE Výroba setu ke stanovení MIC antimikrobiálních látek u bakteriálních patogenů psů a koček MVDr. Kateřina Nedbalcová, Ph.D. MVDr. Monika Zouharová, Ph.D. Mgr. Lucie Pokludová, Ph.D.
OVĚŘENÁ TECHNOLOGIE Výroba setu ke stanovení MIC antimikrobiálních látek u bakteriálních patogenů psů a koček MVDr. Kateřina Nedbalcová, Ph.D. MVDr. Monika Zouharová, Ph.D. Mgr. Lucie Pokludová, Ph.D.
Antibiotická profylaxe v gynekologické operativě
 Antibiotická profylaxe v gynekologické operativě J. MAŠATA Gynekologicko porodnická klinika VFN a 1. LF UK, Praha Definice infekce Kolonizace (colonisation) běžná přítomnost bakterie Kontaminace (contamination)
Antibiotická profylaxe v gynekologické operativě J. MAŠATA Gynekologicko porodnická klinika VFN a 1. LF UK, Praha Definice infekce Kolonizace (colonisation) běžná přítomnost bakterie Kontaminace (contamination)
ANTIBIOTIKA. Mgr. Marie Vilánková. Joalis s.r.o. Všechna práva vyhrazena
 ANTIBIOTIKA Mgr. Marie Vilánková 1 Antibiotika - látky působící na mikroorganismy Antibiotika = původně získávána biologickou cestou (produkována plísněmi nebo bakteriemi) Chemoterapeutika = chemický původ,
ANTIBIOTIKA Mgr. Marie Vilánková 1 Antibiotika - látky působící na mikroorganismy Antibiotika = původně získávána biologickou cestou (produkována plísněmi nebo bakteriemi) Chemoterapeutika = chemický původ,
MTI Cvičení č. 2 Pasážování buněk / Jana Horáková
 MTI Cvičení č. 2 Pasážování buněk 15.11./16.11.2016 Jana Horáková Doporučená literatura M. Vejražka: Buněčné kultury http://bioprojekty.lf1.cuni.cz/3381/sylabyprednasek/textova-verze-prednasek/bunecnekultury-vejrazka.pdf
MTI Cvičení č. 2 Pasážování buněk 15.11./16.11.2016 Jana Horáková Doporučená literatura M. Vejražka: Buněčné kultury http://bioprojekty.lf1.cuni.cz/3381/sylabyprednasek/textova-verze-prednasek/bunecnekultury-vejrazka.pdf
OVĚŘENÁ TECHNOLOGIE. Výroba setu ke stanovení MIC antimikrobiálních látek u bakteriálních původců mastitid
 OVĚŘENÁ TECHNOLOGIE Výroba setu ke stanovení MIC antimikrobiálních látek u bakteriálních původců mastitid MVDr. Kateřina Nedbalcová, Ph.D. MVDr. Monika Zouharová, Ph.D. Mgr. Lucie Pokludová, Ph.D. MVDr.
OVĚŘENÁ TECHNOLOGIE Výroba setu ke stanovení MIC antimikrobiálních látek u bakteriálních původců mastitid MVDr. Kateřina Nedbalcová, Ph.D. MVDr. Monika Zouharová, Ph.D. Mgr. Lucie Pokludová, Ph.D. MVDr.
ODSTRAŇOVÁNÍ KYANIDŮ Z MODELOVÝCH VOD
 ODSTRAŇOVÁNÍ KYANIDŮ Z MODELOVÝCH VOD Jana Muselíková 1, Jiří Palarčík 1, Eva Slehová 1, Zuzana Blažková 1, Vojtěch Trousil 1, Sylva Janovská 2 1 Ústav environmentálního a chemického inženýrství, Fakulta
ODSTRAŇOVÁNÍ KYANIDŮ Z MODELOVÝCH VOD Jana Muselíková 1, Jiří Palarčík 1, Eva Slehová 1, Zuzana Blažková 1, Vojtěch Trousil 1, Sylva Janovská 2 1 Ústav environmentálního a chemického inženýrství, Fakulta
RIZIKA PŘI PŘÍPRAVĚ PARENTERÁLNÍ VÝŽIVY
 Všeobecná fakultní nemocnice v Praze PharmDr. Michal Janů, Ph.D. RIZIKA PŘI PŘÍPRAVĚ PARENTERÁLNÍ VÝŽIVY Rizika při přípravě parenterální výživy ZÁKON Č. 378/2007 SB. ZÁKON O LÉČIVECH A O ZMĚNÁCH NĚKTERÝCH
Všeobecná fakultní nemocnice v Praze PharmDr. Michal Janů, Ph.D. RIZIKA PŘI PŘÍPRAVĚ PARENTERÁLNÍ VÝŽIVY Rizika při přípravě parenterální výživy ZÁKON Č. 378/2007 SB. ZÁKON O LÉČIVECH A O ZMĚNÁCH NĚKTERÝCH
KARLOVA UNIVERZITA V PRAZE FARMACEUTICKÁ FAKULTA HRADEC KRÁLOVÉ
 KARLOVA UNIVERZITA V PRAZE FARMACEUTICKÁ FAKULTA HRADEC KRÁLOVÉ KATEDRA BIOLOGICKÝCH A LÉKAŘSKÝCH VĚD MOŽNOSTI STANOVENÍ ŠIROKOSPEKTRÝCH BETA- LAKTAMÁZ A JEJICH VÝZNAM PRO KLINICKOU MIKROBIOLOGII BAKALÁŘSKÁ
KARLOVA UNIVERZITA V PRAZE FARMACEUTICKÁ FAKULTA HRADEC KRÁLOVÉ KATEDRA BIOLOGICKÝCH A LÉKAŘSKÝCH VĚD MOŽNOSTI STANOVENÍ ŠIROKOSPEKTRÝCH BETA- LAKTAMÁZ A JEJICH VÝZNAM PRO KLINICKOU MIKROBIOLOGII BAKALÁŘSKÁ
Dana Baudišová. Novinky v mikrobiologii vody 2016
 Dana Baudišová Novinky v mikrobiologii vody 2016 Nová Směrnice EU o pitné vodě Vyšla na podzim 2015, do 2 let nutná implementace v České republice (tzn. bude nová vyhláška ) Hlavní změny (pro mikrobiology):
Dana Baudišová Novinky v mikrobiologii vody 2016 Nová Směrnice EU o pitné vodě Vyšla na podzim 2015, do 2 let nutná implementace v České republice (tzn. bude nová vyhláška ) Hlavní změny (pro mikrobiology):
Státní veterinární ústav Praha. Odd. bakteriologie. Černý Tomáš
 Trendy vývoje antimikrobiální rezistence vybraných zoonotických bakterií v České republice v letech 2008-2015 a jejich srovnání s daty publikovanými EFSA Státní veterinární ústav Praha Odd. bakteriologie
Trendy vývoje antimikrobiální rezistence vybraných zoonotických bakterií v České republice v letech 2008-2015 a jejich srovnání s daty publikovanými EFSA Státní veterinární ústav Praha Odd. bakteriologie
let na trhu JEDINÝ ČESKÝ VÝROBCE MYČEK PODLOŽNÍCH MÍS
 1996 2017 21 let na trhu JEDINÝ ČESKÝ VÝROBCE MYČEK PODLOŽNÍCH MÍS Ing. Martin Mikeš Ředitel společnosti reditel@csoostrava.cz +420 596 780 538 Problematika přenosu plošných infekcí v zařízeních s vysokou
1996 2017 21 let na trhu JEDINÝ ČESKÝ VÝROBCE MYČEK PODLOŽNÍCH MÍS Ing. Martin Mikeš Ředitel společnosti reditel@csoostrava.cz +420 596 780 538 Problematika přenosu plošných infekcí v zařízeních s vysokou
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp. zn. sukls201848/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ofloxacin-POS 3 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku očních kapek obsahuje ofloxacinum 3 mg.
Sp. zn. sukls201848/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ofloxacin-POS 3 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku očních kapek obsahuje ofloxacinum 3 mg.
