Sborník dlouhodobých stáží projektu OrganoNET
|
|
|
- Libuše Matějková
- před 6 lety
- Počet zobrazení:
Transkript
1 Sborník dlouhodobých stáží projektu OrganoNET Tento sborník shrnuje průběh 8 témat dlouhodobých stáží realizovaných v rámci projektu OrganoNET. Stáže byly realizovány v letech Sborník obsahuje 8 samostatných metodických brožurek. Tento sborník vznikl v rámci projektu OrganoNET Partnerství pro vzdělávání a výzkum v oblasti zobrazování tkání a orgánů, reg. číslo CZ.1.07/2.4.00/ Na jeho vzniku se podílely tyto partnerské organizace: Masarykova univerzita Lékařská fakulta Ústav histologie a embryologie Kamenice Brno Fakultní nemocnice u sv. Anny v Brně Pekařská Brno Biofyzikální ústav AV ČR, v.v.i. Královopolská Brno
2 Obsah sborníku: Separace definovaných populací normálních a nádorových kmenových buněk za účelem jejich detailní mikroskopické analýzy In vivo vizualizace růstu a invazivity nádorových buněk pomocí bioluminiscence a fluorescence Separace buněčných populací získaných diferenciací lidských embryonálních kmenových buněk za účelem jejich detailní mikroskopické analýzy Izolace, in vitro kultivace a zobrazování kmenových buněk In vitro diferenciace a zobrazování kmenových buněk Komplexní charakterizace buněk výstelky cév a jejich prekurzorů derivovaných z kmenových buněk v mikrofluidních podmínkáchin vitro Vývoj metodiky analýzy kmenových buněk pomocí konfokální mikroskopie s návazností na komplexní charakterizaci pomocí elektronové mikroskopie a live cell zobrazování In vivo vizualizace růstu a invazivity nádorových buněk pomocí vysokofrekvenčního ultrazvuku (EN)
3 Projekt: OrganoNET partnerství pro vzdělávání a výzkum v oblasti zobrazování tkání a orgánů Registrační číslo: CZ.1.07/2.4.00/ Operační program: Vzdělávání pro konkurenceschopnost Separace definovaných populací normálních a nádorových kmenových buněk za účelem jejich detailní mikroskopické analýzy Metodický sborník Autoři: Zuzana Pernicová, Šárka Šimečková, Stanislav Lerch, Karel Souček
4 Obsah 1. Úvod Průtoková cytometrie Fluorescenční mikroskopie Praktická část Analýza buněčného cyklu Víceparametrová analýza Imunofenotypová analýza epiteliálních kmenových buněk prostaty a jejich následná separace Stanovení vnitrobuněčné lokalizace vybraných proteinů Stanovení životnosti buněk pomocí Cell Viability Kitu Reference
5 1. Úvod Nádorové kmenové buňky (NKB) představují populaci buněk v nádoru, která se svými vlastnostmi podobá buňkám kmenovým a je zodpovědná za udržování nádorové tkáně (Reya et al., 2001). Kromě asymetrického dělení a schopnosti sebeobnovy je pro ně charakteristická především rezistence vůči radioterapii a celé řadě chemoterapeutik. Proto je identifikace a hlubší charakterizace této subpopulace předmětem intenzivního výzkumu posledních let. Vznik NKB byl prokázán několika způsoby a je stále oblastí studia (Yu et al., 2012). Jedním z potvrzených způsobů vzniku nádorových kmenových buněk je také aktivace procesu epiteliálně-mesenchymálního přechodu v nádorových buňkách (Kong et al., 2010). Tento fyziologický proces vede ke změně fenotypu epiteliálních buněk v buňky s fenotypem mesenchymálním. To přispívá ke schopnosti buněk více migrovat a invadovat do okolních tkání, což je charakteristické pro pokročilá stádia celé řady nádorových onemocnění. Průtoková cytometrie je metoda, která umožňuje charakterizovat každou jednotlivou analyzovanou částici pomocí detekce spektra parametrů. Pro identifikaci nádorových kmenových buněk je úspěšně používána imunofenotypová analýza pomocí kombinace řady fluorescenčně značených protilátek. Každá buňka ve vzorku pak může být charakterizována detekcí řady znaků jak povrchových, tak vnitrobuněčných. Pro izolaci i velmi malých populací, jako je i populace NKB, je v průtokové cytometrii úspěšně využíváno kombinace imunofenotypové analýzy s následnou vysokorychlostní separací detekované populace NKB. Takto izolované buněčné populace mohou být dále kultivovány nebo použity pro další experimenty. Příkladem je jejich další charakterizace s využitím mikroskopických technik. Pomocí fluorescenční mikroskopie lze analyzovat nejen viabilitu a metabolickou aktivitu těchto buněk, ale také expresi vybraných proteinů i jejich vnitrobuněčnou lokalizaci. Lokalizace uvnitř buňky je u řady proteinů klíčová pro jejich aktivitu. Vzhledem k velkému množství aplikací, které jsou v současné době pro průtokovou cytometrii i fluorescenční mikroskopii zavedeny, nachází tyto metody široké uplatnění nejen v oblasti základního výzkumu, ale také např. v oblasti diagnostiky některých onemocnění. 1.1 Průtoková cytometrie Základním principem průtokové cytometrie je měření vlastností každé jednotlivé buňky v proudu nosné kapaliny. Buňky protékají jednotlivě napříč osvětlenou částí, kde rozptylují světlo a emitují fluorescenci, která je detekována, filtrována a převedena na digitální hodnoty uložené do počítače. Průtokový cytometr analyzuje buňky ve světelném paprsku pomocí hydrodynamického zaostření. Základními komponentami průtokového cytometru jsou: - fluidika (nasátí a průtok vzorku přístrojem) - optika (zdroj excitace, systém pro detekci emise a odraženého světla; lasery, detektory, diachronická zrcátka) - elektronika (analogově digitální konverze - převod optického signálu na elektronický) - analýza dat (kvantifikace signálu, analýza jednotlivých částic a různých subpopulací). 3
6 Mezi parametry, které je možné pomocí průtokové cytometrie analyzovat, patří počítání částic v suspenzi, rozlišení živých a mrtvých částic, kvantifikace intenzity fluorescence a také rozptylu světla. Na základě měření těchto parametrů je možné také vybrané částice separovat průtokový sorting (FACS Fluorescence Activated Cell Sorting). Principem detekce v průtokové cytometrii je analýza rozptylu světla (forward scatter a side scatter velikost buněk a granularita) a detekce specifické fluorescence. Fluorescence je emitována fluorochromy, značkami které po ozáření světlem určité vlnové délky emitují světlo jiné vlnové délky. Tyto fluorochromy mohou přímo interagovat s některou buněčnou komponentou (např. propidium jodid interagující s DNA) a nebo jsou tyto fluorochromy konjugovány s protilátkami rozeznávajícími specifické proteiny. ( /resources/education/tutorials/4intro_flow/player.html, Pomocí pokročilých metod multiparametrické průtokové cytometrie je dnes možné měřit až 20 parametrů současně (18 fluorescenčních značek, velikost buněk a jejich granularita), moderní metody, tzv. mass cytometry, tedy cytometrie ve spojení s hmotnostní spektrometrií umožňují již měřit až 45 parametrů bez fluorescenčních značek (shrnuto v (Bendall et al., 2012)). Měření tak velkého množství parametrů vyžaduje samozřejmě splnění řady technických požadavků, jako je výběr vhodných fluorochromů (minimální překryv excitačních a emisních spekter jednotlivých použitých fluorescenčních konjugátů), používání optimální koncentrace protilátek (maximální fluorescence při minimálním pozadí), používání správných kontrol (isotopové kontroly), eliminace mrtvých buněk z analýzy (pokud není analyzována buněčná smrt), a také správné nastavení kompenzací (minimalizace přesvitu dvou fluorochromů v důsledku překryvu emisních spekter) (Duggan R., 2012). V neposlední řadě klade víceparametrická analýza také vysoké nároky na následnou analýzu dat. 1.2 Fluorescenční mikroskopie Princip fluorescenční mikroskopie je obdobný jako princip průtokové cytometrie, tj. detekce proteinů nebo vnitrobuněčných struktur, na základě detekce emise fluorochromů; ty jsou excitovány světlem určité vlnové délky a následně je detekováno emitované světlo jiné vlnové délky. Kromě fluorescence je pomocí fluorescenčního mikroskopu také možné sledovat preparáty v procházejícím světle, bez jakékoliv fluorescenční značky, zato je možné pomocí různých barvení a technik vizualizovat různé struktury v buňkách a tkáních. Důležitými komponentami fluorescenčního mikroskopu jsou: - velmi silný zdroj světla (sloužící pro excitaci) - optická část (excitační filtry, soustava dichroických zrcadel, objektivy, bariérové filtry, kondenzor, detektory, okuláry) - software pro zaznamenávání a analýzu obrazu. Stejně tak jako průtoková cytometrie, je i fluorescenční mikroskopie rychle se rozvíjející metodikou, která má v současné době celou řadu aplikací v oblasti výzkumu. Mezi její základní aplikace patří například detekce vnitrobuněčných proteinů, stanovení jejich lokalizace, případně interakce s jinými proteiny, a díky vysoké rozlišovací schopnosti i sledování a studium vnitrobuněčných struktur ( fluorescenceintro.html, microscopy). 4
7 2. Praktická část 2.1 Analýza buněčného cyklu Průtoková cytometrie je vhodnou metodou pro stanovení buněčného cyklu, neboť poměrně jednoduchým způsobem je DNA každé buňky obarvena fluorescenční značkou specifickou pro DNA. Tyto značky emitují fluorescenční signál, který je přímo úměrný množství DNA. Některé tyto značky vyžadují permeabilizaci buněčné membrány (propidium iodid), jiné mohou být použity pro značení živých buněk (Hoechst 33342). Pomocí tohoto značení lze tedy rozlišit tři základní fáze buněčného cyklu - G0/G1 (jeden set párových chromozomů na buňku), S (probíhá syntéza DNA, proto obsah DNA je variabilní), a G2/M fáze (dva sety párových chromozomů na buňku, těsně před dělením buňky). Obecný protokol pro přípravu buněk pro analýzu buněčného cyklu: 1. sběr buněk - adherentní buňky uvolnit od kultivačního povrchu pomocí působení roztoků EDTA/PBS a trypsin/edta - centrifugace 200g 5 minut - oplach nadbytkem PBS 2. fixace buněk - stočit 200g 5 minut, odsát supernatant - pelet rozsuspendovat ve 2 ml PBS - stočit 200g 5 minut, odsát supernatant - pelet dobře rozsuspendovat ve 200 l PBS - přidat 3,5 ml 70% EtOH, dobře promíchat několikanásobným převrácením zavřené zkumavky - fixace v EtOH minimálně 30 min 4 o C, může zůstat i několik dní ve 4 o C 3. barvení pomocí Vindelova roztoku - buňky fixované v EtOH stočit 200g 5 min, odsát supernatant - pelet rozsuspendovat ve 3 ml PBS - stočit 200g 5 minut, odsát supernatant - pelet rozsuspendovat ve 300 l Vindelova roztoku (Propidium jodid (20 g/ml), RNasa A (DNase free, 5 U/ml, Sigma-Aldrich Corp.), 1 M Tris (ph 8,0), 0,1% Triton X-100, destilovaná voda) (podle (Robinson, 1993) - barvit 30 min 37 o C 4. měření na průtokovém cytometru - měření na průtokovém cytometru BD FACSCalibur nebo BD FACSVerse 5. analýza naměřených dat - program Mod Fit nebo FlowJo (software umožňující speciální analýzu buněčného cyklu modelování distribuce jednotlivých fází cyklu) 5
8 Obr. 1 Ukázka výsledků měření buněčného cyklu vybraných buněčných linií po ovlivnění specifickým inhibitorem neddylace MLN-4924 po dobu 24 hodin. Výsledky: Pomocí popsaného protokolu byl stanoven vliv chemické látky MLN 4924 na průběh buněčného cyklu u myší prostatické nádorové linie ce2 a lidské linie nádoru tlustého střeva HCT 116. Analýza histogramu prokázala modulaci cyklu u obou buněčných linií po působení této chemické látky ve smyslu zvýšení procentuálního zastoupení buněk v S a G2/M fázi buněčného cyklu. Přibývá také buněk s obsahem DNA, který je větší než odpovídá obsahu DNA u buněk v G2/M fázi buněčného cyklu. 6
9 2.2 Víceparametrová analýza Jednou z nesporných výhod průtokové cytometrie je možnost současné detekce více parametrů u každé jednotlivé analyzované buňky. Příkladem je nově zavedená mnohobarevná metoda pro současnou detekci povrchových znaků, poškození DNA, apoptózy, syntézy DNA a buněčného cyklu. Detekované parametry: povrchové znaky CD133, CD44 znaky kmenových a nádorových kmenových buněk poškození DNA p-h2ax apoptóza (M30 CytoDEATH V časných stádiích apoptózy je štěpen cytokeratinu 18. M30 CytoDEATH rozeznává specifické místo cytokeratinu 18 štěpené kaspázami, které není detekovatelné v neštěpeném cytokertinu 18 v živých buňkách) syntéza DNA (komerční kit Click-iT EdU Flow Cytometry Assays Kits - EdU (5- ethynyl-2 -deoxyuridine) je flourescenčně značený nukleosidový analog thymidinu, který se inkorporuje do DNA během aktivní syntézy DNA) buněčný cyklus (komerční kit FxCycle Stains for Fixed Cell Cycle Analysis detekce buněčného cyklu pomocí fluorescenční značky interagující s DNA ve fixovaných a permeabilizovaných buňkách) Postup (s využitím doporučených postupů u jednotlivých komerčně dodávaných kitů): 1. sběr buněk - buňky v buněčné suspenzi, po oplachu PBS, buněk na 100 l barvícího roztoku 2. barvení povrchových znaků - inkubace buněk min ve 4 C v roztoku PBS s 1% BSA a 0,1% NaN3 s primárními protilátkami proti povrchovým znakům CD133-biotin a CD44 APC/Cy-7 v příslušném ředění - oplach v PBS - inkubace se sekundárním konjugátem streptavidin PerCP/eFluor 710 ředěném v roztoku PBS s 1% BSA a 0,1% NaN3 inkubace 20 min 4 o C - oplach PBS 3. barvení pro odlišení živých a mrtvých buněk - značení pomocí LIVE/DEAD Fixable Dead Cell Stain Kit - příslušná fluorescenční barva (Yellow/FarRed/Blue) byla vybrána na základě konfigurace celého pokusu - inkubace min ve 4 C v PBS - oplach PBS 5. fixace - fixace buněk ve 4% PFA po dobu 15 min ve tmě při pokojové teplotě - oplach v PBS s 1% BSA a 0,1% NaN3 7
10 6. permeabilizace - permeabilizace buněk v 1x Click-iT Saponin v 1% BSA po dobu 15 min při pokojové teplotě - oplach v 1x Click-iT Saponin v 1% BSA 7. Click-iT reakce analýza syntézy DNA - přidání reakční směsi, která je součástí kitu - inkubace 30 min ve tmě při pokojové teplotě - oplach v 1x Click-iT Saponin v 1% BSA 8. Značení intracelulárních znaků M30 a ph2ax - inkubace buněk s protilátkami detekujícími M30 a ph2ax v příslušné koncentraci ředěných v 1X Click-iT Saponin v 1% BSA přes noc ve 4 C - oplach 1x Click-iT Saponin v 1% BSA 9. Značení DNA analýza buněčného cyklu - inkubace buněk v roztoku 1x Click-iT Saponin FxCycle s RNasou A (100 μg/ml) - inkubace 30 min ve tmě při pokojové teplotě 10. Analýza buněk na BD FACSAria II Sorp - pro analýzu byly brány živé buňky po odstranění doublets (slepené dvě a více buněk) pozitivní na CD44 lišící se v míře exprese CD133 low a high buňky 11. Analýza výsledků - výsledky byly vyhodnoceny pomocí programu FlowJo (Tree Star) Obr. 2 Ukázka výsledků víceparametrové analýzy pomocí průtokové cytometrie A) Analýza buněčného cyklu (FxCycle Far Red) a syntézy DNA (Click-IT EdU Pacific Blue) u subpopulací exprimujících CD44 a lišících se mírou exprese CD133. 8
11 B) Analýza poškození DNA (ph2ax-pe) C) Detekce apoptózy (M30 FITC) Výsledky: Pro experiment byla využita buněčná linie HCT-116 ovlivněná buď kontrolním rozpouštědlem DMSO (kontrola) nebo chemikálií MLN4924. Tato linie exprimuje povrchové znaky CD44 a CD133, charakteristické pro nádorové kmenové buňky, a působení MLN 4924 u ní vyvolává deregulaci buněčného cyklu, poškození DNA a částečně i buněčnou smrt (apoptózu). 9
12 2.3 Imunofenotypová analýza epiteliálních kmenových buněk prostaty a jejich následná separace Existuje celá řada postupů v průtokové cytometrii, které lze využít k identifikaci subpopulace kmenových nebo nádorových kmenových buněk detekce povrchových znaků, detekce tzv. side population, stanovení aktivity enzymu aldehyd dehydrogenázy nebo jejich kombinace (shrnuto v (Greve et al., 2012). Pro identifikaci kmenových a nádorových kmenových buněk prostaty byla popsána řada povrchových znaků například podle publikace Goldstein a kol. (Goldstein et al., 2008) byly kmenové buňky myší prostaty identifikovány na základě fenotypu Lin - /Sca1 + /CD49f + /Trop-2 +. Obecný protokol pro imunofenotypovou analýzu kmenových buněk z myší prostaty s následným sortingem a kontrolou čistoty sortingu (na základě publikace (Lukacs et al., 2010). 1. Izolace a disociace prostaty - ze zdravých samců myši kmene C57BL/6 byla izolována prostata - disociace tkáně proběhla na základě již dříve optimalizovaného protokolu s využitím komerčně dodávaného kitu Papain dissociation system (Worthington) (využití enzymu papain, pomocí kterého je disociace tkáně jemnější a nedochází tak k destrukci většiny povrchových epitopů, jako je tomu například u použití trypsinu pro disociaci tkáně) postup podle návodu dodaného výrobcem komerčního kitu 2. Značení vybraných povrchových znaků pomocí kombinace primárních protilátek - inkubace buněk min ve 4 C v roztoku PBS s 1% BSA a 0,1% NaN3 s primárními protilátkami proti povrchovým znakům CD45 FITC, CD31 FITC a Ter- 119 FITC (souhrnně označené jako Lin), Sca-1 Pacific Blue, CD49f PerCP/eFluor710, Trop-2-biotin - oplach v PBS s 1% BSA - inkubace se sekundárním konjugátem streptavidin PE-Cy7 ředěném v roztoku PBS s 1% BSA inkubace 20 min 4 o C - oplach PBS 3. barvení pro odlišení živých a mrtvých buněk - značení pomocí LIVE/DEAD Yellow Fixable Dead Cell Stain Kit (fluorescenční značka, která reaguje s živými buňkami bez porušené membrány pouze na jejich povrchu, tudíž fluorescenční signál je slabý; buňky s permeabilizovanou membránou reagují s fluorescenční značkou slabě na svém povrchu, ale mnohem více také uvnitř buňky, fluorescenční signál permeabilizovaných a tedy mrtvých buněk, je proto mnohem větší) - inkubace min ve 4 C v PBS - oplach PBS 4. analýza a separace - analýza vzorků a sorting subpopulací Lin - /Sca1 - /CD49f - a Lin - / Sca1 + /CD49f + /Trop-2 + na přístroji BD FACS Aria Sorp II 10
13 5. analýza čistoty separace - po separaci vybraných subpopulací bylo z každého separovaného vzorku odebrán kontrolní vzorek a znovu proměřen při stejném nastavení, jako při vlastní separaci, na přístroji BD FACS Aria Sorp II 6. analýza dat - analýza dat pomocí softwaru DIVA a FlowJo Obr. 3 Imunofenotypová analýza myších kmenových buněk prostaty a) izotypová kontrola b) specifické značení 11
14 Obr. 4 Kontrola čistoty sortingu subpopulací Lin - /Sca1 - /CD49f - a Lin - /Sca1 + /CD49f + /Trop-2 + Výsledky: Pomocí mnohobarevné imunofenotypové analýzy byla v myší prostatě identifikována subpopulace buněk s fenotypem Lin - /Sca1 + /CD49f + /Trop-2 +. Tato subpopulace byla izolována pomocí buněčného sorteru. Čistota izolace byla následně ověřena dalším měřením, které prokázalo, že parametry při sortingu byly nastaveny správně a byly získány dostatečně čisté subpopulace s fenotypem Lin - /Sca1 + /CD49f + /Trop-2 + a Lin - /Sca1 - /CD49f -. 12
15 2.4 Stanovení vnitrobuněčné lokalizace vybraných proteinů Pro stanovení funkčnosti proteinů je kromě jejich exprese důležitá i analýza jejich vnitrobuněčné lokalizace. Standardní metoda pro tuto analýzu je fluorescenční mikroskopie, kdy je vybraný protein detekován pomocí fluorescenčně značené specifické protilátky. Současně lze vizualizovat i buněčné jádra pomocí fluorescenčních značek interagujících s DNA. Obecný protokol pro imunofluorescenční značení: 1. příprava skla - použití kultivačního skla Lab-TeK (BD Falcon) s 8 jamkami - před vysetím buněk byl povrch kultivačního skla potažen 0,02% želatinou (inkubace 15 min, 37 o C, suchý termostat) - oplach PBS - vysetí buněčné suspenze v hustotě buněk na cm 2 kultivační plochy 2. fixace a permeabilizace - v den sběru bylo odstraněno kultivační médium a buňky byly fixovány vyzkoušeny dva postupy fixace: a) fixace 100% methanolem (-20 o C) fixace 5 minut v -20 o C - po uplynutí 5 minut methanol odstraněn a skla uložena v -80 o C pro další použití b) fixace 4% paraformaldehydem (PFA) v PBS v 4% PFA byla skla uložena do 4 o C ve vlhké komůrce - permeabilizace před vlastní permeabilizací byla skla opláchnuta PBS - vlastní permeabilizace roztok 0,1% Triton-X min při pokojové teplotě za mírného třepání 3. blokování - inkubace se sérem pro blokaci nespecifických vazebných míst - 5% oslí sérum v 1xPBS nebo 1% hovězí sérový albumin v 1x PBS - inkubace 1 hodinu při pokojové teplotě na třepačce 4. značení primárními protilátkami - po inkubaci se sérem byla skla opláchnuta PBS a inkubována se specifickou primární protilátkou v příslušném ředění - 1 hodina při pokojové teplotě za mírného třepání - oplach PBS 5. značení sekundárními protilátkami - inkubace s příslušnou sekundární protilátkou - 1 hodina při pokojové teplotě ve tmě za mírného třepání - oplach PBS 6. značení jader - vizualizace jader DAPI (0,1 g/ml v 1x PBS) - 5 minut při pokojové teplotě ve tmě za mírného třepání 7. závěrečná úprava mikroskopického skla a analýza - překrytí preparátu MOWIOL 4-88/DABCO a zakrytí krycím sklem 13
16 8. snímání - konfokální mikroskop LSM Leica SP5 (Leica Microsystems GmbH) s pomocí programu Leica Application Suite Advanced Fluorescence (Leica) - invertní fluorescenční mikroskop Olympus IX70 (Olympus) s Fluoview II CCD kamerou 9. analýza a úprava obrázků - program Image J Příklady výsledků získaných s využitím zavedeného obecného protokolu pro imunofluorescenční značení Obr.5 Analýza intracelulární lokalizace proteinu Slug u buněčné linie BPH-1 Obr.6 Analýza intracelulární proteinu Twist u buněčné linie BPH-1 Výsledky: Imunofluorescenční detekce proteinů Slug a Twist byla provedena u linie BPH-1 odvozené z benigní hyperplazie prostaty. Výsledky naznačují jadernou lokalizaci proteinu Slug, avšak interpretace je vzhledem k vysokému nespecifickému pozadí sekundární protilátky nejednoznačná. Pro detekci proteinu Twist byla buněčná linie transfekována vektorem, jehož exprese v buňkách způsobila zvýšenou expresi proteinu Twist. Následně byl protein Twist jednoznačně detekován v jádře těchto buněk. 14
17 2.5 Stanovení životnosti buněk pomocí Cell Viability Kitu Také pomocí fluorescenční mikroskopie je možné detekovat více parametrů současně. Jako příklad je uveden experiment s využitím komerčního kitu Cell Viability Imaging Kit. Ten umožňuje rychlé rozlišení živých a mrtvých buněk na základě detekce fluorescence tří fluorescenčních značek: Hoechst je značka, která se váže na DNA a může být použita pro značení jader živých i mrtvých buněk Propidium jodid je fluorescenční značka vážící se na DNA, která může prostupovat membránou pouze mrtvých buněk, živé buňky s intaktní membránou se propidium jodidem neznačí Calcein-AM je molekula, která sama o sobě není fluorescenční, ale v živých buňkách reaguje s esterázami, a z Calcein-AM vzniká fluorescenční calcein; calcein značí pouze živé enzymaticky aktivní buňky. Obecný postup na základě protokolu poskytnutého výrobcem: 1. výsev buněk - buněčné linie byly vysety, kultivovány a ovlivněny podle požadavků daného experimentu 2. příprava barvícího roztoku: - do zkumavky Viable Dye bylo přidáno 25 l DMSO, následovala centrifugace - před použitím byla zkumavka temperována na pokojovou teplotu 3. obsah zkumavka Nuclei Dye byl zředěn v 5 ml 1x PBS, promícháno 4. přidat 25 l Dead Dye do směsi z kroku 3 5. přidat 3 l Viable Dye do směsi z kroku 4 6. přidat 50 l směsi značek získané v kroku 5 na každý vzorek 7. inkubace 30 min 37oC 8. analýza pomocí fluorescenčního mikroskopu Obr. 7 Mikroskopická analýza živých a mrtvých buněk pomocí Cell Viability Imaging Kit 15
18 Výsledky: Pro experiment byla využita buněčná linie ce2 (myší linie odvozená z nádorových buněk prostaty, která exprimuje některé povrchové znaky nádorových kmenových buněk) ovlivněná buď kontrolním rozpouštědlem DMSO (kontrola) nebo chemikálií MLN4924. Výsledky potvrzují, že tato chemikálie indukuje u linie ce2 buněčnou smrt (zvýšené zastoupení buněk pozitivních pro propidium jodid). 16
19 3. Reference A) Odborné publikace: Bendall, S.C., Nolan, G.P., Roederer, M., Chattopadhyay, P.K., A deep profiler's guide to cytometry. Trends Immunol 33, Goldstein, A.S., Lawson, D.A., Cheng, D., Sun, W., Garraway, I.P., Witte, O.N., Trop2 identifies a subpopulation of murine and human prostate basal cells with stem cell characteristics. Proc Natl Acad Sci U S A 105, Greve, B., Kelsch, R., Spaniol, K., Eich, H.T., Gotte, M., Flow cytometry in cancer stem cell analysis and separation. Cytometry A 81, Kong, D., Banerjee, S., Ahmad, A., Li, Y., Wang, Z., Sethi, S., Sarkar, F.H., Epithelial to mesenchymal transition is mechanistically linked with stem cell signatures in prostate cancer cells. PLoS One 5, e Lukacs, R.U., Goldstein, A.S., Lawson, D.A., Cheng, D., Witte, O.N., Isolation, cultivation and characterization of adult murine prostate stem cells. Nat Protoc 5, Reya, T., Morrison, S.J., Clarke, M.F., Weissman, I.L., Stem cells, cancer, and cancer stem cells. Nature 414, Robinson, J.P., Handbook of Flow Cytometry Methods. Wiley-Liss. Yu, C., Yao, Z., Jiang, Y., Keller, E.T., Prostate cancer stem cell biology. Minerva Urol Nefrol 64, B) Použité dostupné internetové zdroje: /resources/education/tutorials/4intro_flow/player.html, a související odkazy a související odkazy Duggan R., Do s and Don ts of Flow Cytometry. Lab Times , page 50, dostupné z internetového odkazu lt_2012_06_50_51.pdf - dostupné přednášky prof. P.J.Robinsona, prof. C.C. Stewarta, prof. S.J. Stewarta C) Reference použitých komerčních kitů: M30 CytoDEATH Click-iT EdU Flow Cytometry Assays Kits 17
20 FxCycle Stains for Fixed Cell Cycle Analysis Services/Applications/ Cell-Analysis/Flow-Cytometry/Cell-Health-and-Viability-Assays-for-Flow- Cytometry/Cell-Cycle-Assays-for-Flow-Cytometry/FxCycle-Stains-for-Fixed-Cell- Cycle-Analysis.html Papain dissociation system LIVE/DEAD Yellow Fixable Dead Cell Stain Kit Cell Viability Imaging Kit D) Reference prezentovaných výsledků: Výsledky experimentů prezentovaných v tomto metodickém sborníku jsou součástí diplomových prací studentů, kteří se účastnili dlouhodobé stáže Separace definovaných populací normálních a nádorových kmenových buněk za účelem jejich detailní mikroskopické analýzy v rámci projektu OrganoNET. Obě diplomové práce jsou volně dostupné na internetových stránkách výsledky z kapitoly 2.1, 2.2 a 2.5 jsou součástí diplomové práce Mgr. Šárky Šimečkové (Možnosti modulace biologických vlastností nádorových kmenových buněk prostaty pomocí farmakologické inhibice aktivity Skp2-SCF komplexu, Masarykova univerzita, 2013), výsledky z kapitoly 2.4 jsou součástí diplomové práce Mgr. Stanislava Lecha (Regulace exprese a stability transkripčních faktorů SNAI2/Slug a Twist u transformovaných epiteliálních buněk prostaty, Masarykova univerzita, 2013). výsledky prezentované v kapitole 2.3 jsou dosud nikde nepublikované výsledky. 18
21 Projekt: OrganoNET partnerství pro vzdělávání a výzkum v oblasti zobrazování tkání a orgánů Registrační číslo: CZ.1.07/2.4.00/ Operační program: Vzdělávání pro konkurenceschopnost In vivo vizualizace růstu a invazivity nádorových buněk pomocí bioluminiscence a fluorescence Metodický sborník Autoři: Lenka Švihálková Šindlerová, Karel Souček, František Dráfi, Anna Černá
22 Obsah 1. Úvod Optické metody Fluorescence Biolumniscence.4 2. Praktická část Indukce zánětu ucha u myši Příprava sodné soli luminolu Indukce zánětu Detekce ROS produkovaných v místě zánětu Indukce lokálního zánětu tlapy u myši Indukce tumoru a následná vizualizace jeho růstu pomocí bioluminiscence Příprava buněk pro injikaci Příprava myši na injikaci Vizualizace tumoru ve vybraných časových intervalech Indukce tumoru a následná vizualizace jeho růstu pomocí fluorescence Příprava buněk pro injikaci Příprava myši na injikaci Vizualizace tumoru ve vybraných časových intervalech Seznam zkratek Reference..12 2
23 1. Úvod Zobrazování in vivo, tedy v živém organismu, umožňuje sledovat procesy či orgány zájmu bez nutnosti usmrcení experimentálního zvířete a především dlouhodobě. Pro in vivo zobrazování malých zvířat jsou rutinně používány metody nukleární (pozitronová emisní tomografie, jednofotonová emisní výpočetní tomografie), optické (fluorescence, bioluminiscence), ultrazvukové, magnetická rezonance a počítačová tomografie. Většina těchto zobrazovacích metod je běžně využívaná v humánní klinické diagnostice s výjimkou metod optických Optické metody Optické metody jsou limitovány absorpcí a rozptylem emitovaného světla tkáněmi, jsou tedy omezeny hloubkou, v níž se nachází sledovaný orgán. V případě experimentálních zvířat jsou používány metody využívající zobrazování fluorescenční (FLI) a bioluminiscenční (BLI). Obě tyto metody využívají pro zachytávání fotonů kameru se zařízením s vázanými náboji (charge-coupled device; CCD) (1). Mezi základní limitace optických metod patří rozptyl a absorpce emitovaného světla tkání (2). Světlo je v organismu absorbováno endogenními molekulami, především hemoglobinem ( nm) a vodou ( 900 nm). Limitujícím faktorem je tedy tloušťka tkáně, kterou musí emitované (u fluorescence i excitující) světlo projít Fluorescence Fluorescence je emise světla látkou, která absorbovala světlo nebo jiné elektromagnetické záření. Elektron, který absorbuje energii, je excitován na vyšší energetickou hladinu, z níž se uvolněním fluorescenčního záření vrací zpět do základního stavu. V případě FLI je do živého organismu injikována fluorescenční próba, která je externím zdrojem světla excitována. Ta pak v důsledku návratu excitovaných elektronů do původního stavu emituje fluorescenční záření, které je zachytáváno CCD kamerou s příslušným emisním filtrem (Obr. 1). Jedním z limitujících faktorů této metody je autofluorescence organismu (např. hemoglobin) (1). Tento problém v současné době pomáhají řešit próby emitující ve vlnových délkách blízkých infračervenému záření a zdokonalování zobrazování a jeho 3
24 softwarového zpracování, které umožňuje oddělení spekter exogenních prób od endogenní autofluorescence (3) Bioluminiscence Bioluminiscence je produkce a emise světla živými organismy vyskytující se u mnoha mořských živočichů, některých hub i suchozemských bezobratlých. Jedná se o chemickou reakci, při které za katalytického působení enzymu luciferáza dochází k oxidaci luciferinu a následné emisi světla. BLI proto nevyžaduje externí zdroj světla (Obr. 1). Většina luciferáz emituje v oblasti modré a zelené, čímž jsou omezeny možnosti jejich využití pro zobrazování hlubších tkání. Nejčastěji jsou pro in vivo zobrazování používány luciferázy z organismů Photinus pyralis, Renilla, Pyrophorus plagiophthalamus a Gaussia (4-6). Obr. 1: Princip detekce fluorescence a bioluminiscence. A/ Při fluorescenčním zobrazení je světlem z externího zdroje excitován fluorofor (barvivo nebo reportérový gen). Emitované 4
25 světlo je zachycováno CCD kamerou. B/ Při bioluminiscenčním zobrazováním je nejčastěji využíván systém luciferáza/d-luciferin nebo Renilla luciferáza/coelenterazin. Světlo vzniká de novo chemickou reakcí příslušného substrátu s enzymem a je opět zachytáváno CCD kamerou (1). 2. Praktická část 2.1. Indukce zánětu ucha u myši Příprava sodné soli luminolu: - 10 mg luminolu rozpustit ve 115 μl 0,5 M NaOH, řádně zvortexovat (minimální množství luminolu zůstává nerozpuštěné) - roztok přenést do sterilní zkumavky ve sterilním boxu, objem doplnit do 1 ml sterilním PBS - nerozpuštěný zbytek nechat usadit na dno, odsát čirý roztok a rozdělit na alikvóty podle potřeby (ph roztoku by mělo být 8,4-8,6) - alikvóty zamrazit na -20 C Poznámka: luminol je citlivý na světlo, proto je třeba délku přípravy zkrátit na minimum a vyvarovat se kontaktu přímého světla včetně denního s finálním roztokem (chránit např. Al folií) Indukce zánětu: - anestezie myši (inhalačně v anestetické jednotce přístroje IVIS Lumina XR) - na levé ucho nanést 20 μl roztoku PMA (200 μg/ml v DMSO/aceton 1:19) na vnější stranu boltce a 20 μl PMA na vnitřní stranu boltce - na pravé (kontrolní) ucho nanést po 20 μl směsi DMSO/acetonu (1:19) na každou stranu - ukončení anestezie, myš vrácena zpět do chovného zařízení Detekce ROS produkovaných v místě zánětu: - 24 a 48 hod. po indukci zánětu anestezie (inhalačně v anestetické jednotce přístroje IVIS Lumina XR) - intraperitoneálně injikace roztoku sodné soli luminolu v koncentraci 5 mg v 500 μl PBS 5
26 - oči ošetřit očním gelem jako ochranou před poškozením v důsledku vysušení, myš umístit do přístroje - 15 min po injikaci začít pořizování snímků (na začátek se osvědčilo nastavení F/stop 1 (maximální otevření clony), binning large (vysoká citlivost, nízké rozlišení), FOV A nebo B (5 nebo 7,5 cm) v případě jedné myši, expoziční čas 5 min Obr. 2: Indukce lokálního zánětu ucha, detekováno po 24 a 48 hod. Signál luminiscence je vizualizován pomocí nepravých barev v závislosti na intenzitě dle barevné škály (foton/sec/cm 2 /sr). 6
27 2.2. Indukce lokálního zánětu tlapy u myši - anestezie myši - injikace roztoku sodné soli luminolu (5 mg/500 μl PBS) intraperitoneálně - injikace roztoku histaminu (100 μg/50 μl v H2O pro injekce) do spodní plosky levé zadní končetiny - injikace 50 μl H2O pro injekce do spodní plosky pravé zadní končetiny (kontrolní) - oči ošetřit očním gelem jako ochranou před poškozením v důsledku vysušení - po vytvoření viditelného otoku umístit myši do přístroje IVIS Lumina XR - začít pořizovat snímky s délkou expozice 5 min, F/stop 1, binning 8 a FOV 12,5 cm Obr. 3: Indukce lokálního zánětu tlapy. Signál luminiscence je vizualizován pomocí nepravých barev v závislosti na intenzitě dle barevné škály (foton/sec/cm 2 /sr). 7
28 2.3. Indukce tumoru a následná vizualizace jeho růstu pomocí bioluminescence Příprava buněk pro injikaci - buňky B16 F10 luc (myší melanom se stabilně transfekovanou luciferázou - pgl4.50(luc2/cmv/hygro) vektor, Promega) napěstovat na misce - stáhnout, spočítat a zředit čistým médiem bez séra, antibiotik atd. na koncentraci 10 6 buněk/100 μl (pracovat v chladu PBS 4 C, buněčná suspenze na led) ul suspenze smíchat se 100 μl HC Matrigelu (pracovat na ledu s předchlazeným materiálem) - směs subkutánně injikovat Příprava myši na injikaci - anestezie myši - oholit srst v oblasti injikace Vizualizace tumoru ve vybraných časových intervalech - anestezie myši - injikace luciferinu, doporučené množství 150 mg/kg, provést i.p. 200 µl (15 mg/ml roztoku v PBS, Perkin Elmer) - umístění myši do přístroje IVIS Lumina XR - snímání bioluminiscence (výchozí nastavení je pouze orientační a musí být optimalizováno, Em Filter=Open, Ex Filter=Block, Bin:(HR)2, FOV:10, f1, 300s) 8
29 Obr. 4: Vizualizace tumoru pomocí bioluminiscence. Signál luminiscence je vizualizován pomocí nepravých barev v závislosti na intenzitě dle barevné škály (foton/sec/cm 2 /sr). Kvantifikace signálu probíhá pomocí tzv. ROI (region of interest) Indukce tumoru a následná vizualizace jeho růstu pomocí fluorescenece Příprava buněk pro injikaci - buňky B16F10 GFP (stabilně transfekovány vektorem pcdna3 GFP, Life Technologies) napěstovat na misce - stáhnout, spočítat a zředit čistým médiem bez séra, antibiotik atd. na koncentraci 10 6 buněk/100 µl (pracovat v chladu PBS 4 C, buněčná suspenze na led) µl suspenze smíchat se 100 ul HC Matrigelu - směs subkutánně injikovat Příprava myši na injikaci - anestezie myši - oholit srst v oblasti injikace 9
30 Vizualizace tumoru ve vybraných časových intervalech - výchozí nastavení přístroje je pouze orientační a musí být optimalizováno, Em Filter=430, 465, Ex Filter=GFP, Bin:(HR)2, FOV:10, f1, 300s) - pro odfiltrování pozadí je vhodné použít tzv. spectral unmixing, při němž dojde k nasnímání obrazu při různém nastavení (spektru) a následně dojde pomocí softwarového nástroje k oddělení specifického a nespecifického signálu (viz. Perkin Elmer, Technical Note, Spectral Unmixing, Obr. 5: Vizualizace nádorových buněk a dalších parametrů pomocí fluorescence. Samice kmene C57Bl/6 byly s.c. injikovány buňkami B16 F10 GFP. Dva týdny po injikaci nádorových buněk a 24 hodin před vlastní vizualizací byla provedena i.p. injikace značky pro zobrazení vaskulatury nádoru IntegriSense 680 (2 nmol ve 100 µl/myš, Perkin Elmer). Obraz byl snímán v režimu pro tzv. spectral unmixing (vpravo) v kombinaci s rentgenovým zobrazením (vlevo). Zeleně je vizualizováno pozadí, modře signál pro GFP a červeně IntegriSense. 10
31 3. Seznam zkratek FLI Fluorescence imaging Fluorescenční zobrazování in vivo BLI Bioluminescence imaging Bioluminicenční zobrazování in vivo CCD Charge-coupled device Zařízením s vázanými náboji PBS Phosphate buffered saline Fosfátový pufr DMSO Dimethyl sulfoxide Dimethylsulfoxid PMA phorbol 12-myristate 13-acetate Forbol-12-myristát-13-acetát FOV Field of view Zorné pole ROI Region of interest Oblast zájmu 11
32 4. Reference 1. Gheysens O. and Mottaghy F.M. (2009) Method of bioluminescence imaging for molecular imaging of physiological and pathological processes, Methods 48; Rice B.W., Cable M.D. and Nelson M.B., (2001) In vivo imaging of light-emitting probes, J. Biomed. Opt. 6; Mansfield J.R. et al. (2005) Autofluorescence removal, multiplexing, and automated analysis methods for in-vivo fluoresccence imaging, J. Biomed. Opt. 10; Contag CH. and Bachmann M.H. (2002) Advances in in vivo bioluminescence imaging of gene expression, Annu Rev Biomed Eng. 4; Zhao H. et al. (2005) Emission spectra of bioluminescent reporters and interaction with mammalian tissue determine the sensitivity of detection in vivo, J. Biomed. Opt., 10; Tannous B.A. et al. (2005) Codon-optimized Gaussia luciferase cdna for mammalian geneexpressionincultureandin vivo, Mol. Ther.11;
33 Projekt: OrganoNET partnerství pro vzdělávání a výzkum v oblasti zobrazování tkání a orgánů Registrační číslo: CZ.1.07/2.4.00/ Operační program: Vzdělávání pro konkurenceschopnost Separace buněčných populací získaných diferenciací lidských embryonálních kmenových buněk za účelem jejich detailní mikroskopické analýzy Metodický sborník Autoři: Jiřina Procházková, Jan Křivánek
34 Obsah 1. Teoretický úvod Embryonální kmenové buňky Neurální lišta Metody diferenciace hes buněk do NC buněk Praktická část Diferenciace NC buněk z hes buněk metodou dvojí inhibice SMAD signalizace Sortrování živých buněk rostoucích v adherentních podmínkách na základě exprese povrchového receptoru CD271 metodou FACS Imunocytochemická charakterizace získaných buněk Literatura
35 1. Teoretický úvod 1.1 Embryonální kmenové buňky Embryonální kmenové buňky jsou pluripotentní buňky, mající při zachování specifických podmínek během in vitro kultivace schopnost neomezené sebeobnovy a možnosti diferenciace do buněčných typů majících původ ve všech třech zárodečných listech (ektodermu, mezodermu i entodermu). Takové buňky byly poprvé získány izolací embryoblastu z myšího embrya ve stádiu blastocysty v roce 1981 (Evans et Kaufman, 1981). Lidské embryonální kmenové buňky (hes buňky) byly izolovány o více jak 15 let později (Thomson et al., 1998). Morfologicky jsou hes buňky charakteristické velkým jádrem v poměru k velikosti buňky a tím, že při standardním způsobu kultivace s myšími embryonálními fibroblasty, tvoří okrouhlé kolonie s jasnými okraji (obr. 1). Z molekulárního pohledu je pro hes buňky charakteristická přítomnost povrchových molekul SSEA-3 (stage-specific embryonic antigen 3), SSEA-4 (stage-specific embryonic antigen 4), TRA-1-60 (tumor-rejection antigen 1-60), TRA-1-81 (tumor-rejection antigen 1-81), dále alkalické fosfatázy a transkripčních faktorů Oct-4 (Octamer binding homeodomain transcription factor 4), Sox-2 (Sex region Y - box 2) a Nanog (Ulloa-Montoya et al., 2005; Boyer et al., 2006). Obrázek 1: Kolonie hes buněk kultivovaná na myších embryonálních fibroblastech. 3
36 1.2 Neurální lišta Buňky neurální lišty (NC buňky) jsou transientní buněčnou populací, která se diferencuje během rané embryogeneze při invaginaci neurální ploténky. Po splynutí protilehlých neurálních valů, z tohoto místa spojení do okolního mesenchymu migrují buňky (dochází k epiteliálně-mezenchymální tranzici), které nazýváme NC buňkami. Tyto buňky disponují vysokou migrační schopností, migrují v rámci celého embrya a diferencují se v řadu buněčných typů, jako jsou melanocyty, Schwannovy buňky, odontoblasty, buňky pojivových tkání, ale i v mnoho dalších. Z tohoto pohledu mohou být zajímavým cílem pro jejich možné využití jako mezikroku při aplikaci buněčných terapií. Na obr. 2 je znázorněno místo vzniku a směru migrace buněk neurální lišty v embryu. Pro buňky neurální lišty je charakteristická exprese určitých proteinů. Mezi tyto proteiny patří CD271, CD57, Sox9, Sox10 a jiné. Přítomnost neurální lišty je jedinečným znakem obratlovců. Její akvizice u obratlovců je chápána jako zásadní evoluční krok, který je odlišuje od vývojově nižší skupiny protochordat, náležící taktéž do kmenu chordat. Umožnila jim aktivnější pohyb, větší vývoj mozku, což následně způsobilo, že obratlovci osídlili téměř všechna ekologická místa planety. Neurální lišta je též někdy nazývána čtvrtým zárodečným listem (shrnuto v Douarin et Dupin 2012). Obrázek 2: Neurální lišta a směry migrace buněk. Převzato z: pg 4
37 1.3 Metody diferenciace hes buněk do NC buněk V současné době existuje několik metod diferenciace hes do NC buněk lišících se délkou procesu diferenciace, množstvím získaných NC buněk a definovaností kultivačních podmínek. Nejstarší metodou je metoda společně kultivace hes buněk se stromálními buňkami. Jedná se však o metodu poměrně dlouhou (3 týdny společné kultivace), s malým výtěžkem NC buněk a zejména se jedná o kultivaci v nedefinovaných podmínkách. Pro zvýšení výtěžku byla tato metoda později kombinována s tvorbou neurosfér, přídavkem růstových faktorů a následným vznikem neurálních rozet. Později byly vyvinuty odlišné způsoby získávání NC buněk v definovaných podmínkách tj. bez nutnosti společné kultivace s jinými buňkami (obr. 3). Tyto postupy přinesly vyšší výtěžky získaných NC buněk a zároveň kratší čas diferenciace (Cimadamore et al., 2011; Curchoe et al., 2010; Lee et al., 2010; shrnuto v Milet, C. et Monsoro-Burq, 2012). Všechny metody diferenciace mohou být doplněny o využití metody FACS (Fluorescence-Activated Cell Sorting). Specifickým značením NC buněk a následného využití průtokové cytometrie můžeme buňky takzvaně sortrovat a získat tak purifikovanou populaci diferencovaných buněk. Obrázek 3: Metody diferenciace NC buněk z hes buněk (upraveno podle Milet, C. et Monsoro- Burq, 2012). 5
38 2. Praktická část 2.1 Diferenciace NC buněk z hes buněk metodou dvojí inhibice SMAD signalizace K získání NC buněk bylo v tomto protokolu využito metody dvojité inhibice SMAD signalizace pomocí molekul NOGGIN a SB Postup Příprava hes buněk Kultivace hes buněk na myších embryonálních fibroblastech (MEF) s přítomností HES média Enzymatické nebo mechanické sklizení kolonií hes buněk do média Centrifugace (5 min, 150 g) Resuspendování v čerstvém médiu a inkubace na želatině (30 min, 37 C) selektivní přichycení fibroblastů k želatině Odebrání a centrifugace (5 min, 150 g) nepřichycených buněk v médiu získání hes buněk, částečně zbavených fibroblastů Přenesení a kultivace hes buněk na extracelulární matrix Matrigel TM, kultivace s MEF kondiciovaným médiem obohaceným o L-glutamin a FGF2 Složení HES média: DMEM/F12 (Life technologies), 15% knockout serum replacement - KSR (Life Technologies), 1% L-glutamine (PAA), 1% MEM non-essential amino acids (PAA), 0,5% penicillin/streptomycin (PAA), 100µM β mercaptoethanol (Roth) and 4 ng/ml FGF2 (PeproTech) Diferenciace Po několika pasážích (adaptace buněk na nové podmínky, vyředění zbylých fibroblastů) nasazení hes buněk na novou kultivační misku s Matrigel TM a po dosažení 60% konfluence započetí diferenciace (den 0) Iniciace diferenciace faktory NOGGIN (10 μm) a SB (500 ng/ml) v KSR médiu, přidávanými pokaždé s novým médiem dle schématu znázorněném v obr. 4 6
39 KSR (Knockout Serum Replacement) médim, ode dne 5 postupně měněno za MEC3 (MEdium for neural Crest cells, verze 3) médium Po ukončení diferenciace byly živé buňky sortrovány dle přítomnosti CD271 metodou FACS. Složení KSR média: Knockout DMEM (Life Technologies), 15% KSR (Life Technologies), 1% L-glutamine (PAA), 1% neesensiální aminokyseliny (PAA), 1% Penicilin/Streptomycin (PAA), 20μM β-mercaptoethanol (Roth) Složení MEC3 média: Neurobasal (Life Technologies), 1% L-glutamine (PAA), 1% neesensiální aminokyseliny (PAA), 1% Penicilin/Streptomycin (PAA), 20μM β- Mercaptoethanol (Roth), 2% B27 supplement (Life Technologies), 1% N2 supplement (Life Technologies), 20 ng/ml FGF2 (Peprotech) a 20 ng/ml EGF (Peprotech) Obrázek 4: Schéma užitého diferenciačního protokolu hes buněk do NC buněk. 2.2 Sortrování živých buněk rostoucích v adherentních podmínkách na základě exprese povrchového receptoru CD271 metodou FACS Příprava vzorku Odsátí kultivačního média 1 x oplach PBS Enzymatické uvolnění buněk od podkladu pomocí Accutase TM (2 min, 37 C) Přenesení uvolněných buněk do centrifugační zkumavky s kultivačním médiem (inaktivace Accutase TM ), centrifugace (5 min, 150 g) Odsátí supernatantu, resuspendování peletu v 1 ml PBS s 1% BSA Spočítání buněk použitím Bürkerovy komůrky nebo automatického zařízení pro počítání buněk Naředění suspenze do finální koncentrace 1 x 10 7 buněk na 1 ml PBS s 1% BSA 7
40 Barvení specifickými protilátkami Inkubace s FITC konjugovanou CD271 protilátkou, případně s myším FITC konjugovaným imunoglobulinem třídy G s neznámou afinitou ke konkrétnímu antigenu slouží jako izotypová kontrola (30 min, ve tmě při 4 C) 1 x promytí v PBS s 1% BSA, centrifugace (5 min, 150 g) 1 x promytí v PBS, centrifugace (5 min, 150 g) Resuspendování peletu v 1 ml LIVE/DEAD Fixable Dead Cell Stain kit naředěném v PBS v poměru 1:1000. Pozn. Použít PBS bez BSA, kit není s BSA kompatibilní. Dochází k vazbě na aminové skupiny v cytoplasmatické membráně. U permeabilizovaných (mrtvých) buněk je intenzita signálu znásobena o vazby uvnitř buňky. Jedná se o netoxický způsob detekce viability, buňky lze proto následně dál kultivovat. 1 x promytí v PBS, centrifugace (5 min, 150 g) Resuspendování v PBS s 1% BSA Analýza a sorting Před samotným sortrováním bylo použito několik nástrojů nastavené přístroje k tomu, aby byly sortrovány pouze jednodlivé buňky exkluzí dubletů, případně shluků buněk (FSC-A/FSC-H), živé buňky (LIVE/DEATH) a buňky odpovídající standardnímu rozložení populace v grafu porovnávající velikost a granularitu buněk (FSC/SSC) viz obr. 5, A,B. Podle rozvržení exprese CD271 v této populaci buněk a intenzity fluorescence izotypové kontroly byly buňky sortrovány do 2 skupin, skupiny která CD271 protein neexprimuje, případně ho exprimuje v nízkém množství a skupiny buněk, která tento protein exprimuje ve vyšším množství. Samotné sortrování (grafy v obr. 5, C), bylo provedeno s buňkami, na jejichž vyčlenění byly použity nástroje popsané výše. Poslední dva obrázky představují post sortingovou kontrolu, která byla provedena z buněk po sortingu, abychom se přesvědčily o jeho úspěšnosti. 8
41 Izotypová kontrola FSC/SSC FSC-A/FSC-H LIVE/DEATH mouse IgG FITC A) Barvení specifickou protilátkou proti proteinu CD271 FSC/SSC FSC-A/FSC-H LIVE/DEATH CD271 FITC B) Sortrování a post-sortingová kontrola Izotypová kontrola CD271 Post-sortingová kontrola CD271 málo exprimující Post-sortingová kontrola CD271 hodně exprimující Obrázek 5: Sorting diferencovaných buněk. 9
42 2.3 Imunocytochemická charakterizace získaných buněk Diferencované buňky neurální lišty byly podrobeny imunocytochemické, fluorescenčněmikroskopické analýze za účelem zjištění exprese proteinů charakteristických pro expresi u NP buněk. Postup: Kultivace buněk na podložních sklíčcích, jejichž povrch je předem ošetřený pokrytím poly L ornithinem a fibronectinem (podmínky vhodné pro růst NC buněk) 1 x oplach PBS Fixace ve 4% paraformaldehydu (v PBS) po dobu 15 minut při pokojové teplotě V následujících bodech je potřeba postupovat velmi šetrně aby nedošlo k odlepení buněk od podkladu a jejich odmytí. 1 x oplach v PBS s 0,1% TWEEN20 V případě, že se jedná o intracelulární molekulu nebo o protilátku s afinitou k intracelulární doméně transmembránového receptoru provedeme permeabilizaci v 0,5% Triton-X v PBS po dobu 5 minut při pokojové teplotě. 1 x oplach v PBS s 0,1% TWEEN20 Blokace v 1% BSA v PBS s 0,1% TWEEN20 Inkubace s primárními protilátkami, případně s protilátkami přímo konjugovanými s daným fluorochromem, přes noc při 4 C případně 1 hodinu při pokojové teplotě. Protilátky jsou rozředěné dle dané protilátky v poměru 1:50 1:500 v 1% BSA v PBS s 0,1% TWEEN20. 2 x oplach v PBS s 0,1% TWEEN20 Inkubace s danými sekundárními protilátkami (vybrané dle požadovaného fluorochromu a původu primární protilátky) 1 hodinu při pokojové teplotě. Protilátky jsou rozředěné 1:200 v 1% BSA v PBS s 0,1% TWEEN20. Podbarvení buněčných jader DAPI (4',6-diamidin-2-fenylindol) 1:1000 v 1% BSA v PBS s 0,1% TWEEN20 po dobu 5 minut při pokojové teplotě 2 x oplach PBS s 0,1% TWEEN20 Použití Vectashield případně Mowiol pro zafixování krycího skla na podložní sklo a zabránění ztráty fluorescenčního signálu Fluorescenční mikroskopie (mikroskop DM5000B Leica) Zpracování obrázků v programu ImageJ V obr. 6 jsou fotografie NC buněk získané podle postupu v tomto protokolu. 10
43 A) B) C) D) Obrázek 6: Exprese proteinů charakteristických pro buňky neurální lišty. A, B: jaderně lokalizované transkripční faktory Sox9 a Sox10 (kolokalizace s DAPI), C: povrchová exprese receptoru CD271, D: exprese CD57 v místě golgiho aparátu. 11
44 3. Literatura Boyer, L. A., Mathur, D. and Jaenisch, R Molecular control of pluripotency. Curr. Opin. Genet. Dev. 16 (5): Cimadamore, F., Fishwick, K., Giusto, E., Gnedeva, K., Cattarossi, G., Miller, A., Pluchino, S., Brill, L.M., Bronner-Fraser, M. and Terskikh, A.V Human ESC-derived neural crest model reveals a key role for SOX2 in sensory neurogenesis. Cell Stem Cell 8: Curchoe, C.L., Maurer, J., McKeown, S.J., Cattarossi, G., Cimadamore, F., Nilbratt, M., Snyder, E.Y., Bronner-Fraser, M., Terskikh, A.V Early acquisition of neural crest competence during hescs neuralization. PLoS One 5: e Le Douarin, N. M. and Dupin, E The neural crest in vertebrate evolution. Curr Opin Genet Dev. 22 (4): Evans, M. J. and Kaufman, M. H Establishment in culture of pluripotential cells from mouse embryos. Nature. 292 (5819): Lee, G., Chambers, S. M, Tomishima, M. J. and Studer L Derivation of neural crest cells from human pluripotent stem cells. Nat Protoc. 5 (4): Milet, C., Monsoro-Burq, A. H Embryonic stem cell strategies to explore neural crest development in human embryos. Dev Biol. 366(1): Thomson, J. A., Itskovitz-Eldor, J., Shapiro, S. S., Waknitz, M. A., Swiergiel, J. J., Marshall V.S. and Jones JM Embryonic stem cell lines derived from human blastocysts. Science. 282 (5391): Ulloa-Montoya, F., Verfaillie, C. M. and Hu, W. S Culture systems for pluripotent stem cells. J. Biosci. Bioeng. 100 (1):
45 Projekt: OrganoNET partnerství pro vzdělávání a výzkum v oblasti zobrazování tkání a orgánů Registrační číslo: CZ.1.07/2.4.00/ Operační program: Vzdělávání pro konkurenceschopnost Izolace, in vitro kultivace a zobrazování kmenových buněk Metodický sborník Autoři: Klára Koudelková, Lukáš Kučera, Libor Streit
46 Obsah 1. Úvod Fluorescenční mikroskopie Praktická část Odběr a transport tukové tkáně Zpracování tukové tkáně před izolací ASCs Izolace ASCs z tukové tkáně Kolagenázová digesce Neutralizace kolagenázy Izolace vaskulární stromální frakce Lýza erytrocytů Nasazení na misky, kultivace Indukce diferenciace kultivovaných ASCs Zobrazení ASCs Stanovení počtu buněk vaskulární stromální frakce Stanovení počtu adherovaných buněk, růstová křivka Charakteristika povrchových CD markerů pomocí fluorescenční mikroskopie Barvení na adipogenní a osteogenní buněčné linie Reference
47 1. Úvod Mezenchymální kmenové buňky (MSC) jsou multipotentní kmenové buňky, které se nacházejí v různém kvantitativním zastoupení na více místech lidského těla včetně kostní dřeně a tukové tkáně. Ukazuje se, že relativní zastoupení MSC je nejvyšší právě v tukové tkáni, která je navíc snadno dostupná prostřednictvím jednoduchého chirurgického zákroku - liposukce. MSC jsou definovány Mezinárodní komisí pro buněčnou terapii jako buňky adherentní k plastu s fenotypem CD105+, CD73+, CD90+, CD45-, CD34-, CD14-, HLA-DR- a jsou schopny se in vitro diferencovat nejméně do tří odlišných buněčných linií: na osteoblasty, adipocyty a chondrocyty (1, 2). Díky schopnosti multipotence MSC, jejich poměrně snadné izolaci a kultivaci a díky jejich vysoké schopnosti expanze ex vivo jsou tyto buňky atraktivním nástrojem pro buněčnou terapii a tkáňové inženýrství. V současné době jsou k dispozici laboratorní techniky izolace a kultivace MSC především z kostní dřeně a lipoaspirátu tukové tkáně. Rozvoj buněčného inženýrství v posledních letech dovoluje reálně uvažovat o konkrétních klinických aplikacích MSC. V současné době probíhají preklinické a klinické studie, které využívají léčebné vlastnosti MSC u řady onemocnění, která lze jen velmi těžko ovlivnit jiným způsobem. Patří mezi ně reakce štěpu proti hostiteli (3), léčba autoimunitních onemocnění (4), obnova cévního řečiště u ischemické choroby srdeční a ischemické choroby dolních končetin (5), hojení kostí a šlach (6, 7), léčba popálenin (8), léčba pseudoartrózy (9-11), obnova chrupavky (12). Vůbec nejčastěji se v klinické praxi používá efektu kmenových buněk z tukové tkáně (adiposed-derived stem cells ASCs) v plastické rekonstrukční chirurgii při přenosu autologní tukové tkáně technikou nazývanou fat grafting (nebo také lipofilling či lipomodelace). Technika se používá pro zvětšení objemu příjmového místa a pro svoje regenerační účinky. Regenerační účinky přenesené tukové tkáně jsou přisuzovány kmenovým buňkám tukové tkáně (ASCs). Tyto regenerační účinky byly poprvé potvrzeny při přenosu tukové tkáně do fibrózně změněné kůže po radioterapii (8, 13). Přenášená tuková tkáň může být obohacována o izolované ASCs, anebo jen jinak mechanicky zpracována. Izolace ASCs se pak využívá k porovnávání těchto technik zpracování tukové 3
48 tkáně pro fat grafting. Cílem tohoto metodického sborníku je prezentovat standardizovaný protokol izolace a in vitro kultivace a zobrazování ASCs Fluorescenční mikroskopie Fluorescenční mikroskop je světelný mikroskop umožňující detekci a pozorování fluoreskujících látek (fluoroforu) ve vzorku. Fluorescence vzniká ozářením vzorku zářením o patřičné vlnové délce, což vede k vybuzení molekul fluorescenční látky a následnému návratu na původní energetickou hladinu za současného vyzáření fotonů světla o jiné vlnové délce, detektorem je tak snímán světelný signál vzniklý ve vzorku samotném. O autofluorescenci hovoříme v případě, kdy využíváme schopnosti DNA fluoreskovat bez obarvení fluoroforem. Častěji se tkáně barví více či méně specifickými látkami, fluorochromy. Příkladem takového barviva je DAPI. Připojení fluoresceinu na protilátky nám umožňuje barvit tkáně specificky a velmi přesně charakterizovat buňky podle přítomnosti/nepřítomnosti buněčných makromolekul, nejčastěji bílkovin, hovoříme o imunofluorescenci. Pomocí imunofluorescence lze somatické buňky charakterizovat na základě exprese povrchových CD markerů (Cluster of Differentiation cell markers). Lze tak určit fenotyp buněk vaskulární stromální frakce po izolaci z tukové tkáně. 4
49 2. Praktická část 2.1. Odběr a transport tukové tkáně Odběr tukové tkáně pro izolaci ASCs se provádí liposukcí z míst relativního nadbytku tukové tkáně (břicho, boky, hýždě, stehna) v celkové, anebo i lokální anestézii po infiltraci odběrových míst tumescenčním roztokem. Používáme ruční liposukci, tak aby se zabránilo poškození tukové tkáně nadměrným podtlakem, ke kterému může docházet při strojovém odběru. K odběru používáme tenké odběrové kanyly průměru 3,5 mm délky 17cm (model PLA187, Pouret Medical, France). Odebraný tuk (lipoaspirát) se do laboratoře transportuje při teplotě 37 C ve sterilních zkumavkách. Interval mezi odběrem tukové tkáně a zahájením procesu izolace (doba ischémie) by neměl přesahovat 4 hodiny Zpracování tukové tkáně před izolací ASCs Před zahájením izolace ASCs je vhodné lipoaspirát zpracovat tak, aby se odstranily složky tumescenčního roztoku. Je možné použít sedimentaci, centrifugaci či filtraci přes membránu. Ekonomicky nejvýhodnější je použití centrifugace 1,2G na 3 min a vlastní izolaci ASCs provádět pouze z tukové vrstvy centrifugované tukové tkáně (obr. 1). Množství tumescenčního roztoku v lipoaspirátu může být rozdílné, proto při vynechání tohoto kroku můžou vznikat nepřesnosti v koncentracích kolagenázy na jednotku tukové tkáně. Při odběru 200 ml tukové tkáně se obvykle aplikuje 500 ml tumescenčního roztoku. Po centrifugaci následují kroky izolace kmenových buněk. 5
50 Tuková vrstva obr. 1.Zkumavka s centrifugovanou tukovou tkání. Označena je tuková vrstva, která je určena k dalšímu zpracování 2.3. Izolace ASCs z tukové tkáně Kolagenázová digesce - do zkumavky s tukovou tkání přidat roztok 1% kolagenázy (Col IV, ředěna v DMEM F12) v objemu odpovídající 1/10 objemu tukové tkáně. - promíchat/zvířit - zkumavku ponechat ležet v inkubátoru ve vodorovné poloze při teplotě 37 C na 30 min Neutralizace kolagenázy - objem vzorku zdvojnásoben pomocí 10% FBS v DMEM-F12. - zvířit, nechat působit v inkubátoru při teplotě 37 C na 25 min Izolace vaskulární stromální frakce z tukové tkáně - centrifugací 600g/10min se oddělují 4 viditelné frakce vrstvy. 6
51 - pomocí 25 ml pipety odsáta vrstva oleje, vrstva tuku a vrstva vody, ponechána pouze dolní vrstva pellet. - pelet přenesen do čistých 15ml zkumavek - proplach: přidáno 10 ml PBS, zvířit - centrifugace 600g/2min - odsán supernatant - opakování proplachu: přidáno 10 ml PBS, zvířit - centrifugace 600g/2min - odsán supernatant - ponechaná frakce se označuje jako vaskulární stromální frakce Lýza erytrocytů - 10x pufr pro lýzu erytrocytů (EL) [155 mm NH4Cl, 10 mm KHCO3, 0,1 mm EDTA] rozředěn na 1x v MQ vodě - do vzorku přidáno 5 ml 1x EL pufru - lyzace v inkubátoru při 37 C na 10 min - centrifugace 200g/4min (obr. 2) - odsání supernatantu - doplněno MSC kultivačním médium (DMEM Glutamax, 10% FBS, 0,5% Penstrep) do 5 ml u všech vzorků SVF 7
52 Obr. 2. Vzorek ve zkumavce po lýze erytrocytů. Na spodině po centrifugami 200g/4min separovaná vaskulární stromální frakce (SVF) 2.4. Nasazení na misky, kultivace - stanovení počtu buněk vaskulární stromální frakce spočítání na Bürkerově komůrce (10 μl vzorku) - na kultivační misku vhodné pipetovat vždy stejný počet buněk doporučený počet buněk na 24 jamku je bb - kultivace při 37 C při 5% CO2 - výměna MSC kultivačního média po 3 dnech 2.5. Indukce diferenciace kultivovaných ASCs - po dosažení konfluence buněk 70-80% kultivační misky byla započata 2 týdenní diferenciace - indukce diferenciace: kultivace pomocí adipogenního a osteogenního média. Adipogenní medium: DMEM Glutamax obahacen o 1 μm dexametazonu, 10 μm insulinu, 0,5 mm 3- isobutyl-1-methylxantinu a 50 μm indometacinu. Osteogenní medium: DMEM Glutamax obohaceno o 0,1 μm dexametazonu, 0,2 mm askorbové kyseliny, 10 mm β-glycerolfosfátu 10 % FBS - kontrola: kultivace pomocí MSC kultivačního média - výměna medií po 3 dnech 2.6. Zobrazení ASCs Stanovení počtu buněk vaskulární stromální frakce - spočítání na Bürkerově komůrce (10 μl vzorku) 8
53 Stanovení počtu adherovaných buněk - Fixace adherovaných buněk a jejich barvení pomocí fluorescenčního barviva DAPI prvních 5 dnů každý den (obr. 3) - Spočtení buněk a stanovení poměru počtu adherovaných buněk vůči počtu nasazených buněk - Stanovení růstových křivek obr. 3 Barvení jader adherovaných buněk pomocí DAPI 9
54 Charakteristika povrchových CD markerů pomocí fluorescenční mikroskopie - Fixace a imunofluorescence CD31, CD45, CD90, CD105 (obr. 4) CD 90+ CD 105+ CD 31- CD 45- obr. 4 Fenotypizace buněk vaskulární stromální frakce pomocí imonoflorescence CD31, CD45, CD90, CD105 10
55 Barvení na adipogenní a osteogenní buněčné linie (obr. 5) - fixace 4% paraformaldehydem po 2 týdnech (20 min) - barvení Adipo + kontrola: Olejová červeň + Mayerův hematoxylin - barvení Osteo: Alizarinová červeň Barvení: Adipo i Kontrola Olejová červeň + Mayerův hematoxylin Tukové kapky nabarvené Olejovou červení Barvení: Osteo Alizarinová červeň Červená kalciová depozita obr. 5 Průkaz schopnosti ASCs difereciovat do adipogenních a osteogenních buněčných linií 11
56 3. Reference: 1. Carrancio S et al.; Exp Hematol 2008; 36: Dominici M, et al.; Cytotherapy 2006; 8: Badillo AT et al.; Br J Haematol Apr;141(2): Epub 2008 Mar Kastrinaki MC et al.; Curr Stem Cell Res Ther Jan;4(1): Miranville A, et al.; Circulation Jul 20;110(3): Epub 2004 Jul Kanczler JM, Oreffo RO.; Eur Cell Mater May 2;15: Lendeckel S, et al.; J Craniomaxillofac Surg Dec;32(6): Rigotti G et al.; Plast Reconstr Surg Apr 15;119(5): Hernigou P et al.; J Bone Joint Surg Am Jul;87(7): Lee H.B et al.; Veterinarni Medicina, 54, 2009 (4): Sír M et al.; Vnitr Lek Mar;55(3): Czech. 12. Pountos I et al.; J Bone Joint Surg Br Apr;88(4): Yoshimura K et al. Med Mar;4(2):
57 Projekt: OrganoNET partnerství pro vzdělávání a výzkum v oblasti zobrazování tkání a orgánů Registrační číslo: CZ.1.07/2.4.00/ Operační program: Vzdělávání pro konkurenceschopnost In vitro diferenciace a zobrazování kmenových buněk Metodický sborník Autoři: Vladimír Vinarský, Lukáš Kučera, Iva Jelínková
58 Obsah 1. Úvod Praktická část Kultivace myších embryonálních KB Diferenciace myších embryonálních KB Stanovení diferencovaného fenotypu pomocí qrt-pcr Stanovení diferencovaného fenotypu pomocí fluorescenční mikroskopie Stanovení diferencovaného fenotypu pomocí analýzy obrazu tepajících kardiomyocytů Reference
59 1. Úvod Kmenové buňky V současné době je biologie kmenových buněk (KB) intenzivně studována. KB představují důležitý cíl pro terapeutické použití při léčení široké škály lidských onemocnění. KB jsou považovány za cenný zdroj nových buněk, jak pro přímou buněčnou terapii, tak pro podporu přístupů založených na buněčné terapii (Keller 2005; Laird, von Andrian et al. 2008). KB jsou v současné době považovány za důležitý cíl u protinádorových léčebných postupů (Visvader 2012). Kromě specifických rozdílů mezi jednotlivými populacemi KB, jsou všechny KB schopny sebeobnovy spojené se symetrickým dělením a současně také diferenciace díky asymetrickému dělení. To umožňuje KB nejen udržovat nezbytnou sebeobnovující se populaci buněk, ale také tento mechanismus poskytuje organismu diferencující se specifické buňky klíčové pro reparaci tkání. Nediferenciované KB jsou lokalizovány ve specifickém mikroprostředí označovaném jako niche. Toto prostředí se vyznačuje přítomností specifických podmínek, které jsou nezbytné pro správnou funkci a udržení fenotypu KB a zahrnují například nízkou saturaci kyslíkem, nedostatek živin a také metabolitů. Studium KB je považováno za klíčové pro hlubší pochopení jejich funkcí s možností navržení terapeutických postupů napomáhajícím využití KB. Pro studium je nezbytné udržet sebeobnovující se nediferencované KB v in vitro tkáňové kultuře. Avšak udržení KB v in vitro kultuře je velice obtížné a vyžaduje aplikaci celé řady specifických faktorů. Celkově je identifikace a hlubší charakterizace KB udržovaných v in vitro kultuře za různých podmínek a způsoby diferenciace do různých buněčných typů předmětem intenzivního výzkumu posledních let. Kultivace nediferencovaných KB a jejich diferenciace do určitých typů Dlouhodobá kultivace KB s cílem udržení pluripotentního fenotypu je založena především na aplikaci růstových faktorů a podmínek potlačujících jejich spontánní diferenciaci. Ačkoli myší embryonální KB (mekb) byly izolovány poprvé již v roce 1981 (Martin 1981) a lidské již v roce 1998 (Thomson, Itskovitz-Eldor et al. 1998), optimální kultivační podmínky jsou stále ve vývoji. Nedávné studie naznačují, že stav diferenciace embryonálních KB může být ovlivněn působením signální dráhy zprostředkovávající reakce buněk na hypoxii (Mazumdar, Dondeti et al. 2009). V případě lidských ESC, řada autorů ukázala, že snížení parciálního tlaku kyslíku udržuje lidské KB v pluripotentním stavu, zabraňuje jejich diferenciaci a zlepšuje tvorbu a udržení fenotypu indukovaných pluripotentních KB z dospělých buněčných populací (Ezashi, Das et al. 2005, Ramirez, Pericuesta et al. 2011, Prasad, Czepiel et al. 2009; Roitbak, Surviladze et al. 2010; Shimada, Hashimoto et al. 2012; Mathieu, Zhang et al. 2013; Prigione, Rohwer et al. 2013). 3
60 Nicméně v případě myších kmenových buněk je účinek hypoxie na udržení pluripotentního stavu za podmínek buněčné kultivace nejednoznačný (Ramirez, Pericuesta et al. 2011). Klíčovým regulačním faktorem podílejícím se na buněčné odpovědi na změny hladiny kyslíku je hypoxií indukovaný faktor (HIF) (Semenza and Wang 1992). HIF se skládá ze dvou konstitutivně exprimovaných podjednotek α a β (Wang and Semenza 1995). HIF-α podjednotky jsou regulovány kyslíkem na dvou úrovních - stabilita proteinu a aktivita. HIF-α obsahuje dvě domény, které jsou v závislosti na kyslíku hydroxylovány jednak prolyl-hydroxylázami (PHD1-3) (Bruick and McKnight 2001; Epstein, Gleadle et al. 2001) a jednak C-terminální transaktivační domény jsou hydroxylovány faktorem inhibujícím HIF (FIH) (Mahon, Hirota et al. 2001). FIH a PHD tedy hrají klíčovou roli specifických senzorů saturace kyslíkem. Na základě dostupnosti kyslíku, PHD hydroxyluje zbytky prolinu přítomné na HIF-α podjednotce. Proto je HIF-α za normoxických podmínek určen k degradaci prostřednictvím ubikvitin-proteazomové dráhy (Salceda and Caro 1997) zahrnující enzym kódovaný genem podle von Hippel-Lindau (Maxwell, Wiesener et al. 1999, Jaakkola, Mole et al. 2001). Za normoxických podmínek, HIF asparaginyl hydroxyláza FIH negativně reguluje transaktivační doménu HIF-α tím, že brání její interakci se základními koaktivátory CBP/p300 (Mahon, Hirota et al. 2001). Naproti tomu v přítomnosti hypoxických podmínek HIF-α translokuje do jádra (Kallio, Okamoto et al. 1998), kde vytváří heterodimer s HIF- 1β a po interakci s transkripčním koaktivátorem CBP/p300 (Kallio, Okamoto et al. 1998), se váže v promotoru na hypoxii reagujících genů a reguluje jejich expresi (Wang and Semenza 1995). V rámci těchto metodických stáží jsme se zaměřili na charakterizaci diferenciace myších embryonálních KB do kardiomyocytů pomocí zobrazovacích technik, charakterizace tepání a jejich porovnání s dalšími metodami molekulární biologie. 4
61 2. Praktická část 2.1 Kultivace myších embryonálních KB Byly použity myší embryonální KB linie HIF-1α+/+ (R1) a HIF-1α-/- (HIF) (Carmeliet, Dor et al. 1998) kultivované v ES LIF médiu v 5% CO 2 při 37 C. Kultivační médium: LIF médium DMEM high glucose, 2mM L-Glutamin, 16 % fetální bovinní sérum, 0,05 mm 2- merkaptoethanol, 1x NEAA (100x koncentrovaný roztok), 100 u/ml penicilinu, 0,1mg/ml streptomycinu, 5ng/ml LIF (leukemie inhibujícího faktoru) Rozmrazení mekb uložených v dusíku: mekb jsou vysoce citlivé na přítomnost DMSO, proto se způsob rozmrazení liší od ostatních buněčných linií. Potáhnout 60x15mm misku 0,1 % vodného roztoku želatiny Po 2 min odsát roztok želatiny a přidat 4 ml LIF média Přenést suspenzi z kryozkumavky do zkumavky s 10 ml LIF média Centrifugovat 5 min při 200g Odsát médium nad peletem, zbytek peletu rozsuspendovat v 1 ml LIF média Celou suspenzi přenést na připravenou 60x15 mm misku s LIF médiem Další den vyměnit LIF médium (5ml) Zamrazení mekb: Proces zamrazování probíhá podle standardního protokolu Buňky zamrazit v LIF médiu s 10% DMSO nejprve 24 hod při -80 C, poté přenést do tekutého dusíku Pasážování mekb: mekb by neměly přesahovat 80% konfluenci. Jsou rovněž velmi citlivé na dlouhodobou inkubaci v přítomnosti Trypsinu. Misku pokrýt 0,1% vodným roztokem želatiny Buňky 2x opláchnout PBS Přidat Trypsin+EDTA a inkubovat 2-3 min při 37 C 5
62 Neutralizovat přidáním minimálně stejného množství LIF média Přenést 1/6 buněčné suspenze na misku s LIF médiem Vyměnit médium každý druhý den Obr. 1: Ukázka myších embryonálních kmenových buněk v nediferencovaném stavu 2.2 Diferenciace myších embryonálních KB Diferenciace mekb je založena na tvorbě embryoidních tělísek (EBs), což jsou samovolně se shlukující agregáty buněk. Tvorba EBs zvyšuje výtěžek kardiomyocytů. mekb lze do kardiomyocytů diferencovat za použití několika různých protokolů. Nejčastěji se využívá metody visící kapky, suspenzní metody a nově také metody mikrojamkové (mw). Všechny tyto protokoly jsou si velmi podobné, ale zásadně se liší způsobem tvorby EBs. Diferenciační média: ES médium DMEM high glucose, 2mM L-Gluthamin, 16% fetální bovinní sérum, 0,05 mm 2- merkaptoethanol, 1x NEAA (100x koncentrovaný roztok), 100 u/ml penicilinu, 0,1mg/ml streptomycinu ITS médium DMEM/F12, penicilin (100 U/ml), streptomycin (100 µg/ml), L-glutamin (2 mm), 1x ITS (inzulin-transferin-selen) (100x koncentrovaný roztok) 6
63 A) Vysazení mekb na tvorbu EBs s využitím metody visící kapky Tento typ diferenciace mekb poskytuje zisk vysoce homogenních tělísek, co se velikosti EBs týká. Ovšem manuálně se řadí mezi nejnáročnější metody diferenciace. Rovněž vzhledem k nízkému počtu získaných EBs, není vhodný pro analýzy, které vyžadují vysokou koncentraci vstupního materiálu. Protokol: DEN 0: 1. Pasážovat mekb podle předchozího protokolu až do přenosu suspenze na novou misku 2. Spočítat množství buněk na 1 ml v suspenzi 3. Naředit suspenzi na koncentraci 1, buněk na 1 ml 4. Z této suspenze za stálého míchání nanést kapky o objemu 30 µl na krycí víčko 90 mm misky určené pro tkáňové kultury 5. Kapky je vhodné nanášet pomocí multi-pipety, dokud není prostor víčka zaplněn 6. Do misky napipetovat 15 ml PBS 7. Víčko plynule překlopit na misku 8. Inkubovat po dobu následujících 5 dnů v 5% CO 2 při 37 C DEN 5: 9. Pod lupu zkontrolovat kvalitu EBs. jednotlivá EBs by měla být pravidelně kulatá a kompaktní, v každé kapce by mělo být jen jedno, je možno si je označit fixem, EBs na periferii misky nebývají dobře vyvinuta, taková nepoužijeme. 10. Pokrýt 24 jamkovou destičku 0,1% vodným roztokem želatiny 11. Inkubovat 5 minut, odsát želatinu a přidat 400 µl ITS:ES média v poměru 1:1 12. Plynule otočit víčko s EBs 13. Jednotlivé kapky s jedním EB přenést vždy do jedné jamky připravené 24 jamkové desky s médiem 14. Inkubovat v 5% CO 2 při 37 C DEN 6: 15. Vyměnit staré médium za 400 µl ITS média 16. Dále médium vyměnit dle potřeby 17. Inkubovat v 5% CO 2 při 37 C 7
64 B) Vysazení mekb na tvorbu EBs s využitím metody suspenzní Při diferenciaci mekb pomocí této metody lze dostat pouze velikostně vysoce heterogenní tělíska. Tím dochází k velice náročné reprodukovatelnosti jednotlivých experimentů. V závislosti na velikosti EBs, s čím je spojená mimo jiné i dostupnost výživy jednotlivých buněk, dochází k diferenciaci různými směry. Velkou výhodou této metody ovšem je, že se manuálně řadí mezi velice jednoduché metody diferenciace. Příprava misek: a) AGAR (1%): Agar rozpustit v PBS Sterilizovat v autoklávu Do jedné 100x20mm misky nalít 7 ml agaru Nechat tuhnout alespoň 15 minut Misky skladovat dnem vzhůru zabalené v potravinové folii v lednici Protokol: DEN 0: 1. Do misky pokryté 1% agarem přidat 20 ml ES média (dáváme co nejvíc, abychom vypufrovali to PBS) 2. Pasážovat mekb podle předchozího protokolu až do přenosu suspenze na novou misku 3. Spočítat množství buněk v suspenzi na 1 ml 4. Naředit suspenzi na koncentraci 2, buněk na 1 ml v ES médiu 5. Přenést suspenzi (5ml?) na připravenou misku 6. Inkubovat po dobu následujících 5 dnů v 5% CO 2 při 37 C DEN 5: 7. Pokrýt 100x20 mm misku 0,1% vodným roztokem želatiny 8. Po odsátí želatiny přidat 5 ml ITS média 9. Z misek s EBs opatrně odsát médium (ne do sucha), přidat 5 ml ES média a šetrně rozsuspendovat EBs pomocí pipety 10. Přenést celou suspenzi na misku 11. Inkubovat v 5% CO 2 při 37 C DEN 6: 12. Vyměnit staré médium za 10 ml ITS média 13. Médium vyměnit každé dva dny 14. Inkubovat v 5% CO 2 při 37 C 8
65 C) Vysazení mekb na tvorbu EBs s využitím metody mikrojamkové Tato metoda diferenciace mekb spojuje výhody obou předchozích metod. Jednak generuje velikostně stejná tělíska a jednak je tato metoda velice nenáročná. Její nevýhodou je pouze samotná tvorba mikrojamek. V případě výběru komerční cesty jsou desky s těmito jamkami cenově velmi drahé a nelze je používat opakovaně. Matrici si lze ovšem relativně snadno podle těchto desek vyrobit ze silikonu a mikrojamky tak razit do agarosy, která zajistí ostrost jamek i neadherentní povrch. Příprava misek: a) AGAROSA (1,5%): Agarosu na elektroforézu rozpustit v PBS Rozvařit v mikrovlnné troubě (3x) Sterilizovat ve flow boxu přes filtr (0,22 nm) pomocí injekční stříkačky Do jedné jamky 12 jamkové desky nalít 2 ml agarosy a vložit razítko s matricí mikrojamek Jemně přitlačit a nechat tuhnout alespoň 15 minut, poté razítko vyjmout Desku skladovat dnem vzhůru zabalenou v potravinové folii v lednici b) AGAR (1%): Shodný protokol jako u metody suspenzní Protokol: DEN -1: 1. Buňky pasážovat v ES LIF médiu, spočítat 2. Do každé jamky vložit suspenzi buněk o koncentraci 2, doplnit do 1 ml LIF médiem 3. Inkubovat po dobu následujících 24 hodin v 5% CO 2 při 37 C DEN 0: 4. Odsát staré médium a přidat 500 ul ES média (z jedné jamky 12 jamkové desky na jednu misku 100x20 mm pokrytou agarem s 10 ml ES média) 5. Do stejné jamky přidat 500 ul ES média a přenést EBs znovu do 100x20 mm misky 6. Inkubovat po dobu následujících 5 dní v 5% CO 2 při 37 C DEN 5: - Následující části protokolu jsou shodné jako u metody suspenzní (od bodu 7) 9
66 Obr. 2: Vizuální srovnání rozdílů použitých diferenciačních metod 10
67 Obr. 3: Ukázka dat porovnávající genovou expresi genů specifických pro kardiomyocyty v 15 dnu diferenciace při použití suspenzní nebo mikrojamkové metody 2.3 Stanovení diferencovaného fenotypu pomocí qrt-pcr Pro určení směru a stupně diferenciace je nutné ověřit fenotyp buněk. Ten lze stanovit pomocí analýzy genové exprese za použití metody kvantitativní reverzně transkriptázové polymerázové řetězové reakce (qrt-pcr). Na základě přítomnosti a množství jednotlivých genů lze zjistit jaký fenotyp má daná buněčná populace. A) Izolace RNA RNA byla vyizolována z buněčného lyzátu podle protokolu UltraClean Tissue & Cells RNA Isolation Kit (MOBIO Laboratiories, USA) popřípadě podle protokolu RNeasy Plus Mini Kit (QIAGEN, USA). Čistota vyizolované RNA byla změřena na spektrofotometru NanoDrop ND-1000 (Thermo Scientific, USA) pomocí poměru hodnot absorbancí při vlnových délkách 260 nm/280 nm. B) Reverzně transkriptázová-pcr Celková RNA byla přepsána do cdna podle protokolu Transcriptor First Strand cdna Synthesis Kit (ROCHE, Německo). Objem reakční směsi byl 20 µl. Reakce probíhala na PTC-200 Thermo Cycler (MJ Research, USA). Reakční směs: 4 µl reakční pufr, 2 µl náhodných hexamerů, 2 µl dntp mix, 1 µl oligo(dt) 18, 0,5 µl inhibitor RNas, 0,5 µl reverzní transkriptáza, RNA (koncentrace 1 µg) a DEPC H 2O do celkového objemu 20 µl Podmínky reakce: - Extenze primerů: 25 C; 10 min 11
68 - Syntéza cdna: 50 C; 60 min - Ukončení reakce: 85 C; 5 min - Chlazení: 4 C; 20 min C) Kvantitativní PCR Pro kvantitativní PCR (qpcr) byla použita technologie Universal Probe Library (UPL) (ROCHE, Německo). Jedná se o systém 165 hydrolytických sond, které mají na 5 konci navázanou fluorescenční značku fluorescein a na 3 konci navázaný zhášeč. UPL sondy mají délku okolo 8-9 nukleotidů a díky tomu jsou schopny pokrýt celý transkriptom. Navíc sekvence UPL sond obsahuje LNA (Locked Nucleid Acids), které zvyšují jejich specifičnost. Kombinace primerů a sond (tabulka č. 1) byly navržené pomocí softwaru ProbeFinder dostupného na webových stránkách výrobce ( Tab. 1: Primery a sondy gen sekvence primeru 5 3 velikost amplikonu* sonda Rpl13a catgaggtcgggtggaagta 116 nt #25 gcctgtttccgtaacctcaa Nkx2.5 gacgtagcctggtgtctcg 70 nt #53 gtgtggaatccgtcgaaagt MHC-α (Myh6) cgcatcaaggagctcacc 61 nt #6 cctgcagccgcattaagt MHC-β (Myh7) cgcatcaaggagctcacc 60 nt #6 ctgcagccgcagtaggtt α-actinin 2 (Actn2) ccggattctggcttctgat 62 nt #53 gaggcagctctcgacgaa *nt je počet nukleotidů Pro qpcr byl použit DyNAmo Probe qpcr Kit (FINNZYMES, Finsko). Reakce probíhala s využitím přístroje 7300 Real-Time PCR System (Applied Biosystems, USA). Reakční směs: 10 μl master mix F-450, 1 μl přímý primer + 1 μl zpětný primer (10 μm), 0,5 μl sonda, 1 μl cdna, 6,5 μl H 2O 12
69 Podmínky reakce: 1 cyklus: počáteční denaturace: 95 C 15 min 40 cyklů: denaturace: 95 C 15s nasednutí primerů a extenze: 60 C 1 min sběr dat D) Vyhodnocení dat Data byla vyhodnocena metodou relativní kvantifikace, ta popisuje relativní změnu exprese genu vůči vnitřnímu standardu. Jako vnitřní standard byl použit kontrolní gen, jehož hladina exprese je za podmínek experimentu konstantní. Pro výpočet cílového genu ve vztahu ke kontrolnímu genu byla použita srovnávací metoda ct (Cycle Threshold). Hodnota ct byla získána rozdílem hodnot ct cílového genu a kontrolního genu: ct = ct cílový ct kontrolní Množství cílového genu (M) bylo vypočteno pomocí vzorce: M = 2 - ct Pro grafické znázornění celkového množství jednotlivých genů byla hodnota 2 - ct logaritmována. Výsledná úprava má podobu: ln(2 - ct ) ± SEM 13
70 Obr. 4: Příklad získaných dat - analýza exprese genů specifických pro kardiomyocyty v průběhu diferenciace u obou použitých buněčných linií 2.4 Stanovení diferencovaného fenotypu pomocí fluorescenční mikroskopie Kromě analýzy genové exprese lze také pozorovat změny v přítomnosti nebo vnitrobuněčné lokalizaci jednotlivých specifických proteinů. Na základě těchto informací lze posuzovat stupeň zralosti jednotlivých diferencovaných mekb. K tomuto účelu se využívá fluorescenční mikroskopie, díky které je možné detekovat fluorescenčně značenou sekundární protilátku navázanou na cílovém proteinu. Obecný protokol immunocytochemického barvení optimalizovaný a použitý během stáží: 1. fixace buněk Nejprve bylo nutné zjistit optimální způsob fixace buněk. Pro tento účel byly testovány tři různé varianty. Jako nejvhodnější se ukázal protokol, kde byly buňky fixovány pomocí 0,5% formaldehydu Varianta - formaldehydem 4% Oplach PBS Fixace-4% formaldehyd/pbs 20 minut RT 1x oplach PBS 5 min RT Permeabilizace 0,1% Triton-X100/PBS 30 minut RT 2x oplach v PBS 5 minut RT 14
71 Varianta - formaldehydem 0,5% Oplach PBS Fixace-0,5% formaldehyd/pbs 20 minut RT 1x oplach PBS 5 min RT Permeabilizace 0,1% Triton-X100/PBS 30 minut RT Varianta - methanolem Oplach PBS Fixace-methanol (vychlazený na -20 C) 20 minut RT 2x oplach v PBS 5 minut RT 2. blokovaní nespecifické vazby Blokace 5% BSA/PBS-T 45 minut RT 2x oplach v PBS 5 minut RT 3. Značení primární a sekundární protilátkou Primární protilátka/pbs 1: minut 3x oplach PBS 7 minut RT (3. oplach PBS-T) Inkubace sekundární protilátka/pbs 1: minut 2x oplach PBS 8 minut (2. oplach v PBS-T) DAPI 10 minut 300ng/ml v PBS 1 oplach PBS 8 minut 4. Vytvoření trvalého preparátu překrytí Mowiol zakrytí krycím sklíčkem snímání na konfokální mikroskopu LSM Leica SP5 (Leica Microsystems GmbH) 15
72 Obr. 5: Ukázka detekce proteinů specifických pro kardiomyocyty pomocí fluorescenční mikroskopie A) těžké řetězce myozinu B) α-aktinin 16
73 2.5 Stanovení diferencovaného fenotypu pomocí analýzy obrazu tepajících kardiomyocytů Další vhodnou metodou pro stanovení zralosti diferencovaných kardiomyocytů je charakterizace jejich tepání. Pomocí specifického programu CardioAnalyzer lze snadno na základě analýzy obrazu určit frekvenci a výšku a šířku amplitudy tepání. Přístroje Inverzní mikroskop pro tkáňové kultury s objektivy 10x a 20x; Digitální kamera nebo fotoaparát s možností videa připojitelný na výše uvedený mikroskop Software Program CardioAnalyzer pro přehrávání a hodnocení digitálních videozáznamů tepajících kardiomyocytů. Program vytvořil na platformě Matlab dr. Pavel Karas z FI MU. Postup: A) Diferenciace mekb do kardiomyocytů Postup diferenciace mekb je shodný s protokolem: Vysazení mekb na tvorbu EBs s využitím metody visící kapky (kapitola 2.2 A) B) Analýza tepání Od 8-9. dne zahájení diferenciace celkově, lze pozorovat tepající klastry nebo i jednotlivé buňky v rámci kolonie expandující z původních tělísek. Největší četnost tepajících oblastí je možno pozorovat v intervalu dnů diferenciace. Jednotlivé tepající okrsky buněk je nutné ve zvolených dnech diferenciace nahrávat na digitální videozáznam. A ten následně hodnotit programem CardioAnalyzer Program umožňuje přehrát video, vybrat časový interval pro analýzu a vybrat oblast která se má analyzovat. Výsledkem je grafické znázornění frekvence tepání vybrané oblasti ve vybraném časovém intervalu. Výstupnímu hodnotami/parametry je vlastní frekvence, výška jednotlivých píků a šířka jednotlivých píků (vypovídá o rychlosti vlastní kontrakce). 17
74 Obr. 6: Ukázka výstupu dat při analýze tepajících oblastí pomocí programu CardioAnalyzer Obr. 7: Ukázka charakterizace tepání obou použitých buněčných linií 18
75 3. Reference A) Odborné publikace: Bruick, R. K. and S. L. McKnight (2001). "A conserved family of prolyl-4-hydroxylases that modify HIF." Science 294(5545): Carmeliet, P., Y. Dor, J. M. Herbert, D. Fukumura, K. Brusselmans, M. Dewerchin, M. Neeman, F. Bono, R. Abramovitch, P. Maxwell, C. J. Koch, P. Ratcliffe, L. Moons, R. K. Jain, D. Collen and E. Keshert (1998). "Role of HIF-1alpha in hypoxia-mediated apoptosis, cell proliferation and tumour angiogenesis." Nature 394(6692): Epstein, A. C., J. M. Gleadle, L. A. McNeill, K. S. Hewitson, J. O'Rourke, D. R. Mole, M. Mukherji, E. Metzen, M. I. Wilson, A. Dhanda, Y. M. Tian, N. Masson, D. L. Hamilton, P. Jaakkola, R. Barstead, J. Hodgkin, P. H. Maxwell, C. W. Pugh, C. J. Schofield and P. J. Ratcliffe (2001). "C. elegans EGL-9 and mammalian homologs define a family of dioxygenases that regulate HIF by prolyl hydroxylation." Cell 107(1): Ezashi, T., P. Das and R. M. Roberts (2005). "Low O2 tensions and the prevention of differentiation of hes cells." Proc Natl Acad Sci U S A 102(13): Jaakkola, P., D. R. Mole, Y. M. Tian, M. I. Wilson, J. Gielbert, S. J. Gaskell, A. von Kriegsheim, H. F. Hebestreit, M. Mukherji, C. J. Schofield, P. H. Maxwell, C. W. Pugh and P. J. Ratcliffe (2001). "Targeting of HIF-alpha to the von Hippel-Lindau ubiquitylation complex by O2- regulated prolyl hydroxylation." Science 292(5516): Kallio, P. J., K. Okamoto, S. O'Brien, P. Carrero, Y. Makino, H. Tanaka and L. Poellinger (1998). "Signal transduction in hypoxic cells: inducible nuclear translocation and recruitment of the CBP/p300 coactivator by the hypoxia-inducible factor-1alpha." EMBO J 17(22): Keller, G. (2005). "Embryonic stem cell differentiation:emergence of a new era in biology and medicine." Genes & Development 19: Laird, D. J., U. H. von Andrian and A. J. Wagers (2008). "Stem cell trafficking in tissue development, growth, and disease." Cell 132(4): Mahon, P. C., K. Hirota and G. L. Semenza (2001). "FIH-1: a novel protein that interacts with HIF- 1alpha and VHL to mediate repression of HIF-1 transcriptional activity." Genes Dev 15(20): Martin, G. R. (1981). "Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells." Proc Natl Acad Sci U S A 78(12):
76 Mathieu, J., Z. Zhang, A. Nelson, D. A. Lamba, T. A. Reh, C. Ware and H. Ruohola-Baker (2013). "Hypoxia induces re-entry of committed cells into pluripotency." Stem Cells 31(9): Maxwell, P. H., M. S. Wiesener, G. W. Chang, S. C. Clifford, E. C. Vaux, M. E. Cockman, C. C. Wykoff, C. W. Pugh, E. R. Maher and P. J. Ratcliffe (1999). "The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis." Nature 399(6733): Mazumdar, J., V. Dondeti and M. C. Simon (2009). "Hypoxia-inducible factors in stem cells and cancer." J Cell Mol Med 13(11-12): Prasad, S. M., M. Czepiel, C. Cetinkaya, K. Smigielska, S. C. Weli, H. Lysdahl, A. Gabrielsen, K. Petersen, N. Ehlers, T. Fink, S. L. Minger and V. Zachar (2009). "Continuous hypoxic culturing maintains activation of Notch and allows long-term propagation of human embryonic stem cells without spontaneous differentiation." Cell Prolif 42(1): Prigione, A., N. Rohwer, S. Hoffman, B. Mlody, K. Drews, R. Bukowiecki, K. Blumlein, E. E. Wanker, M. Ralser, T. Cramer and J. Adjaye (2013). "HIF1alpha modulates reprogramming through early glycolytic shift and up-regulation of PDK1-3 and PKM2." Stem Cells. Ramirez, M. A., E. Pericuesta, M. Yanez-Mo, A. Palasz and A. Gutierrez-Adan (2011). "Effect of long-term culture of mouse embryonic stem cells under low oxygen concentration as well as on glycosaminoglycan hyaluronan on cell proliferation and differentiation." Cell Prolif 44(1): Roitbak, T., Z. Surviladze and L. A. Cunningham (2010). "Continuous expression of HIF-1alpha in neural stem/progenitor cells." Cell Mol Neurobiol 31(1): Salceda, S. and J. Caro (1997). "Hypoxia-inducible factor 1alpha (HIF-1alpha) protein is rapidly degraded by the ubiquitin-proteasome system under normoxic conditions. Its stabilization by hypoxia depends on redox-induced changes." J Biol Chem 272(36): Semenza, G. L. and G. L. Wang (1992). "A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation." Mol Cell Biol 12(12): Shimada, H., Y. Hashimoto, A. Nakada, K. Shigeno and T. Nakamura (2012). "Accelerated generation of human induced pluripotent stem cells with retroviral transduction and chemical inhibitors under physiological hypoxia." Biochem Biophys Res Commun 417(2): Thomson, J. A., J. Itskovitz-Eldor, S. S. Shapiro, M. A. Waknitz, J. J. Swiergiel, V. S. Marshall and J. M. Jones (1998). "Embryonic stem cell lines derived from human blastocysts." Science 282(5391): Visvader, J. E. (2012). "Cells of origin in cancer." Nature 469(7330):
77 Wang, G. L. and G. L. Semenza (1995). "Purification and characterization of hypoxia-inducible factor 1." J Biol Chem 270(3): B) Použité dostupné internetové zdroje: C) Reference použitých komerčních kitů: UltraClean Tissue & Cells RNA Isolation Kit (MOBIO Laboratiories, USA) RNeasy Plus Mini Kit (QIAGEN, USA) Transcriptor First Strand cdna Synthesis Kit (ROCHE, Německo) DyNAmo Probe qpcr Kit (FINNZYMES, Finsko) Universal ProbeLibrary (ROCHE, Německo). 21
78 Projekt: OrganoNET partnerství pro vzdělávání a výzkum v oblasti zobrazování tkání a orgánů Registrační číslo: CZ.1.07/2.4.00/ Operační program: Vzdělávání pro konkurenceschopnost Komplexní charakterizace buněk výstelky cév a jejich prekurzorů derivovaných z kmenových buněk v mikrofluidních podmínkách in vitro Metodický sborník Autor: Iva Jelínková
79 Obsah 1. Úvod Praktická část... 4 I. Obecný protokol pro kultivaci lidských endoteliálních buněk z pupečníkové žíly (HUVEC)... 4 II. Obecný protokol pro kultivaci myších kmenových buněk (mesc)... 4 III. Kultivace endoteliálních buněk a jejich prekurzorů v průtokových komůrkách... 6 IV. Vliv smykového napětí na morfologii endoteliálních buněk... 7 V. Vliv smykového napětí na genovou expresi endoteliálních buněk... 9 VI. Adheze leukocytů na endoteliální buňky za proudových podmínek VII. Vliv smykového napětí na diferenciace myších embryonálních kmenových buněk do endoteliální buněčné linie Reference
80 1. Úvod Vnitřní výstelka cév kardiovaskulárního systému je tvořena jednou vrstvou endoteliálních buněk (též známé jako endotel), která je v neustálém přímém kontaktu s proudící krví a cirkulujícími krevními buňkami (Félétou 2011). Tato vrstva netvoří pouze bariéru zajišťující tok krve, ale sehrává aktivní roli v mnoha fyziologických procesech. Endotel jako bariéra je semipermeabilní a reguluje transport molekul (Galley and Webster 2004). Kromě toho mají endoteliální buňky důležité metabolizující a endokrinní funkce. Syntetizují a uvolňují NO, který má vasodilatační účinky, metabolity arachidonové kyseliny, různé peptidy (endotelin, urotensin, CNP, adrenomedulin, ), adenosin, puriny, reaktivní metabolity kyslíku atd., které ovlivňují další fyziologické funkce (Félétou 2011). Obecně zle říci, že endoteliální buňky hrají významnou roli v udržení homeostázi. Podílí se na regulaci trombózy, trombolýzy, adhezi krevních buněk a regulaci cévního napětí a toku krve. Endotel svou funkcí napomáhá řídit imunitní odpověď, zánět a angiogenezi. Nekontrolovaná odpověď endoteliálních buněk je zapojena v mnoha chorobných procesech jako například ateroskleróza, hypertenze nebo sepse (Galley and Webster 2004). Jak již bylo zmíněno, endoteliální buňky vystýlající cévní stěnu jsou in vivo v kontaktu s proudící krví, která na povrchu endotelu vytváří smykového napětí (shear stress). Bylo ukázáno, že endoteliální buňky vnímají změny smykového napětí a odpovídají na ně. Dochází u nich ke změně jejich morfologie, k odlišné expresi genů a pozměnění jejich funkcí, tak aby došlo k obnovení nebo udržení homeostazi (Topper and Gimbrone 1999). Trendem posledních několika let je studium vlivu smykového napětí na diferenciaci různých typů prekurzorových buněk. Bylo dokázáno, že smykové napětí ovlivňuje nedospělé i dospělé endoteliální buňky a podporuje diferenciaci endoteliálních progenitorových buněk a embryonálních kmenových buněk do endoteliální buněčné linie (Culver and Dickinson 2010). Je však potřeba dalších studií pro lepší porozumění fyziologických efektů mechanických sil a jejich významu v patogenezi onemocnění. Důkazy o přímém působení mechanických sil na endoteliální struktury a funkce pocházejí v první řadě z in vitro studií, ve kterých byly kultivované monovrstvy endotelových buněk (lidské a zvířecí) vystaveny definovaným proudovým silám za kontrolovaných experimentálních podmínek. Systémy, které jsou schopny generovat reprodukovatelně definované toky in vitro, umožnily výzkumníkům prokázat řadu biologických účinků. Jeden z prvních popsaných účinků je reorganizace morfologie endoteliálních buněk v závislosti na trvalém laminárním smykovém napětí. V tomto případě se endoteliální buňky prodlužují a orientují podél svých dlouhých os ve směru proudění. Tento proces zahrnuje významné změny ve vnitřní struktuře buňky a vyžaduje novou syntézu proteinů, ale nevyžaduje dělení buněk. Jednalo se o klíčové pozorování, protože tyto reakce vyvolané tokem in vitro shrnují mnoho morfologických vlastností, které byly popsány pro endoteliální buňky in vivo (Culver and Dickinson 2010). Kultivace endoteliálních buněk v podmínkách trvalého průtoku tedy přibližuje experimenty k více fyziologickým podmínkám a tím relevantnějším výsledkům. 3
81 2. Praktická část I. Obecný protokol pro kultivaci lidských endoteliálních buněk z pupečníkové žíly (HUVEC) Kultivace a pasážování - pasážovat buňky po dosažení 70 80% konfluence - po odstranění média opláchnout buňky 1x PBS/EDTA - přidat trypsin/edta, nechat cca 2 min v inkubátoru - pro zastavení aktivity trypsinu připipetovat EGM-2 médium (LONZA) - přenést buňky do sterilní zkumavky, centrifugace 250g / 3 min / RT - odstranit trypsin a rozsuspendovat v požadovaném množství média - buňky nasadit v požadované hustotě na desku potaženou kolagenem (50 μg/ml) Obr. 1 Ukázka kultivace HUVEC na běžných kultivačních miskách. II. Obecný protokol pro kultivaci myších kmenových buněk (mesc) Pro experimenty byla použita buněčná linie R1. Kultivace a pasážování - buňky 2x opláchnout PBS - přidat 250 ul trypsin/edta na misku 100 x 20, nechat cca 2 min v inkubátoru - pro zastavení aktivity trypsinu připipetovat 3 ml média vhodného pro kultivaci a udržení pluripotence mesc (ES LIF médium; s přídavkem leukemii inhibující faktor (LIF)) - buňky nasadit v požadované hustotě na desku koutovanou 1% želatinou do celkového objemu 12 ml ES LIF média Vysazení ESC na tvorbu EB (embryoidní tělíska) v nediferencovaném stavu - připravit 1,5% agarosu v PBS, rozpustit v mikrovlnce a sterilně přefiltrovat přes 0,22 um filtr 4
82 - do jamek 12-jamkové desky pipetovat 2 ml takto připravené agarosy a do ní vtisknout razítko s mikrojamkami - nechat zatuhnout cca 45 min - odstranit razítka a misku ponechat v lednici - připravit 1% agar v PBS, nechat 45 min autoklávovat - 7 ml agaru sterilně pipetovat do misek 100 x 20 mm, zatáhnout fólií, uložit do ledničky - zpasážovat mesc a suspenzi (2,5 x 10 6 buněk nebo v jiné hustotě podle potřeby) vysadit do jamek s předtištěnými mikrojamkami - doplnit objem suspenze médiem do celkového objemu 1 ml - po 24 h se buňky v jamce opatrně propipetují tak, aby se EB zvedly z mikrojamek a přenesou se na misku 100 x 20 mm pokrytou agarem s 12 ml ES média Výměna média pro EB - zakroužit miskou, naklonit a nechat tělíska sednout - opatrně odsát většinu média - připipetovat nové ES médium bez přídavku LIF - měnit médium přibližně co pět dní Obr. 2 Ukázka tvorby EB v nediferencovaném stavu. A - tělíska volně v suspenzi, B - formace tělísek v mikrojamkách. A B Homogenizace 10-denních EB a vysazení buněk na adhezi pro fluidní experiment - přenést 20 ml kultivačního média, které obsahuje EBs do zkumavky gentle MACS M a centrifugovat při 300 g / 2 min - odstranit supernatant - přidat 10 ml DPBS do gentlemacs M zkumavky a opatrně resuspendovat EBs - centrifugovat při 300 g / 2 min - odstranit supernatant - přidat 2 ml accutase do zkumavky gentlemacs M a nechat inkubovat při 37 C po dobu 10 minut za nepřetržitého otáčení zkumavky - M zkumavku připojit k disociátoru gentlemacs a zapnout program EB_01 5
83 - po skončení programu odpojit zkumavku a nechat inkubovat při 37 C po dobu 10 minut za nepřetržitého otáčení zkumavky - M zkumavku znovu připojit k disociátoru gentlemacs a nechat proběhnout program EB_02 - po skončení programu odpojit zkumavku a přidat do ní 8 ml kultivačního média nebo DPBS - resuspendovat vzorek a buněčnou suspenzi přefiltrovat přes filtr (70 um), filtr poté opláchnout kultivačním médiem pro EB nebo DPBS - suspenzi buněk centrifugovat při 300 g / 5 min - odstranit supernatant a resuspendovat buňky v přiměřeném množství média - určit buněčnost III. Kultivace endoteliálních buněk a jejich prekurzorů v průtokových komůrkách Koutování mikrokanálků - připravit koutovací roztok (kolagen, 50 μg/ml) - aplikovat koutovací roztok do mikrokanálku (objem roztoku viz Tab. 1) a nechat při pokojové teplotě alespoň 30 min - odsát koutovací roztok a opláchnout PBS - nechat zaschnout při pokojové teplotě Vysazení buněk - připravit buněčnou suspenzi viz kultivace a pasážování - do kanálku aplikovat buněčnou suspenzi o koncentraci viz Tab. 1 - nechat buňky přisednout 1h při 37 C - doplnit médium v rezervoárech a připojit pumpu (vše je nutné provádět sterilně a tak aby se do systému nedostala žádná bublina) - pumpu i s čipem přenést do inkubátoru - nastavit požadované hodnoty smykového napětí a dobu kultivace - měnit médium podle potřeby a délky kultivace Tab. 1 Technické specifikace IBIDI komůrek IBIDI produkty Statické podmínky Proudové podmínky Název produktu Výška kanálku Objem kanálku Plocha pro Plocha pro koutování růst objem Koncentrace buněk objem Koncentrace buněk μ Slide I 0.1 Luer 100 μm 25 μl 5.1 cm cm 2 25 μl x 10 5 cells/ml 25 μl 5 10 x 10 6 cells/ml μ Slide I 0.2 Luer 200 μm 50 μl 5.2 cm cm 2 50 μl 6 14 x 10 5 cells/ml 50 μl x 10 6 cells/ml μ Slide I 0.4 Luer 400 μm 100 μl 5.4 cm cm μl 3 7 x 10 5 cells/ml 100 μl x 10 6 cells/ml μ Slide I 0.6 Luer 600 μm 150 μl 5.6 cm cm μl x 10 5 cells/ml 150 μl x 10 6 cells/ml μ Slide I 0.8 Luer 800 μm 200 μl 5.8 cm cm μl x 10 5 cells/ml 200 μl x 10 6 cells/ml 6
84 Obr. 3 Ukázka kultivace endoteliálních buněk a jejich prekurzorů v průtokových komůrkách. Pro ukázku byl použit mikrofluidní systém od IBIDI. IV. Vliv smykového napětí na morfologii endoteliálních buněk V cévách, ve kterých je tok krve jednosměrný, jsou endoteliální buňky vřetenovitého tvaru vyrovnané s jejich podélnou osou paralelně ve směru toku krve. Zatímco endoteliální buňky, kde je krevní tok turbulentní nebo přerušený, jsou tvarově více zakulacené a nemají jednotnou orientaci. Na základě těchto zjištění se předpokládá, že smykové napětí určuje tvar a orientaci endoteliálních buněk (Ando and Yamamoto 2009). VE-kadheriny jsou hlavní adhezivní proteiny adherentních spojů a jsou typické pro vaskulární endoteliální buňky. Mohou intracelulárně transportovat informace prostřednictvím interakce s cytoskeletem (Resnick, Yahav et al. 2003). Detekované parametry: Tvar buněk Mezibuněčné spoje VE-kadheriny 7
85 Postup: Buněčná linie byla kultivována za statických a proudových podmínek (15 dyne/cm 2 ) po dobu 6 dnů (viz kultivace endoteliálních buněk v průtokových komůrkách) a následně ovlivněna podle požadavků daného experimentu. Obecný protokol pro imunofluorescenční značení: - opláchnout 2x pomocí HBSS - fixovat pomocí 2% formaldehydu v PBS 10 min při pokojové teplotě - opláchnout 1x pomocí PBS - permeabilizovat pomocí 0,1% Triton X-100 v PBS 10 min při pokojové teplotě - opláchnout 1x pomocí PBS - inkubovat s 10% kozím sérem v PBS pro blokování nespecifických vazebných míst 1h při pokojové teplotě - inkubovat s primární protilátkou v příslušném ředění 1h při pokojové teplotě - opláchnout 3x pomocí PBS - inkubovat s příslušnou značenou sekundární protilátkou 1h při pokojové teplotě ve tmě - vizualizovat jádra pomocí inkubace buněk s DAPI 5 min při pokojové teplotě ve tmě - opláchnout 3x pomocí PBS - preparát překrýt pomocí MOWIOL 4-88/DABCO a zakrýt krycím sklem - snímat pomocí konfokálního mikroskopu LSM Leica SP5 nebo fluorescenčního mikroskopu Axio Observer (Zeiss) Ukázka vlivu smykového napětí na morfologii endoteliálních buněk. Obr. 4 Změna tvaru buněk Endoteliální buňky, které jsou za statických podmínek kultivace (Obr. 4 A) polygonální, se prodlužují a orientují ve směru smykového napětí, jestliže jsou během kultivace vystaveny proudovým podmínkám (Obr 4 B). Tato morfologická změna je doprovázena také reorganizací cytoskeletu kdy aktinové filamenty se přeskupují do svazků stresových vláken a zarovnávají se ve směru smykového napětí. A B 8
86 Pro pokus byla použita buněčná linie HUVEC kultivovaná za statických podmínek a proudových podmínek o smykovém napětí 15 dyne/cm 2. Obrázky pořízeny pomocí světelného mikroskopu 10x. Obr. 5 Změna a značení mezibuněčných spojů (VE-kadheriny) pomocí fluorescence HBSS MPO 10 μg/ml MPO 20 μg/ml Statické podmínky Proudové podmínky Pro pokus byla použita buněčná linie HUVEC kultivovaná za statických podmínek a proudových podmínek o smykovém napětí 15 dyne/cm 2 a současně ovlivněná myeloperoxidázou (MPO 0, 10 nebo 20 μg/ml po dobu 10 min při 37 C). HBSS kontrolní podmínky bez ovlivnění, červená VEkadheriny, modrá jádra (DAPI). Obrázky pořízeny pomocí fluorescenčního mikroskopu 20x. V. Vliv smykového napětí na genovou expresi endoteliálních buněk Když dochází ke změně funkce endoteliálních buněk v odpovědi na smykové napětí, obvykle dochází také ke změně exprese souvisejících genů. Smykové napětí reguluje endoteliální genovou expresi jak na úrovni transkripce, tak i post-transkripce (Ando and Yamamoto 2009). Detekované parametry: Postup: a) Genová exprese glypikanu-1 a syndekanů-1,2,4 Vysadit přibližně 150 tis. buněk na jednokanálkový IBIDI slide Nechat buňky dokonale adherovat a poté připojit k pumpě Pěstovat buňky za fluidních podmínek (15 dyne/cm 2 ) nebo statických 7 dní lyzovat buňky ve slidu Izolovat RNA z buněčného lyzátu Provést reverzní tranksripci vybraných markerů do DNA Provést qrt-pcr vybraných markerů (Glypikan-1, Syndekany-1,2,4) 9
87 vyhodnotit vliv proudových podmínek na změnu genové exprese vybraných markerů u HUVEC Obecný protokol přípravy vzorků pro sledování genové exprese: Lyze buněk a izolace RNA připravit lyzační roztok podle návodu k UltraClean Tissue & Cells RNA Isolation Kit (MOBIO Laboratiories, USA), stručně: smíchat b-mercaptoetanolu se Solution TR1 v poměru 1:100 a před použitím zvortexovat odpojit slide od pumpy - 2x vypláchnout kanálek studeným PBS (200 ul) - odsát PBS a pipetovat do kanálku 200 ul lyzačního roztoku, nechat působit asi 2 minuty - odsát lyzát do epinky, izolovaná RNA je stabilní v -80 po dobu dvou měsíců Izolace RNA Vychází z protokolu doporučovaného výrobcem MOBIO kitu. Ve zkratce se jedná o izolaci RNA s využitím kolonkového systému, kdy použitím různých roztoků a elučních pufrů dojde nejprve k zachycení RNA na filtru kolonky a následnému promytí a eluci RNA: - k čerstvému nebo rozmraženému lyzátu přidat stejný objem TR2 Solution jaký byl použit při objem TR1 Solution při zlyzování vzorku a promíchat pipetováním - přenést 300 ul lyzátu na Spin Filter zkumavku a centrifogavat 2 min / g / RT - odstranit supernatant a Spin Filter vrátit do stejné 2ml Collection Tube zkumavky (v případě použití 600 ul Solution TR1 a TR2 zopakovat stejný postup pro 2/2 lyzátu) - promýt Spin Filter 500 ul TR3 Solution - centrifugovat 2 min / g / RT a přenést Spin Filter do nové 2ml Collection Tube zkumavky - promýt Spin Filter 500 ul TR4 Solution - centrifugovat 2 min / g / RT, odstranit supernatant a Spin Filter umístit do stejné zkumavky - opakovat předchozí 2 kroky - centrifugovat Spin Filter do prázdné 2ml Collection Tube zkumavky 2 min / g / RT pro vysušení membrány - přenést Spin filter do nové 2ml Collection Tube zkumavky - k eluaci RNA přidat ul TR5 Solution přímo na membránu Spin Filteru a nechat takto inkubovat 1 min při RT. Centrifugovat 2 min / g / RT - změřit koncentraci RNA (může být zrovna použita pro další průběh experimentu nebo zamražena při -80 nebo -20 C). Čistota vyizolované RNA byla změřena na spektrofotometru NanoDrop ND-1000 (Thermo Scientific, USA) pomocí poměru hodnot absorbancí při vlnových délkách 260 nm/280 nm. Reversní transkripce (Roche Transcriptor First Strand cdna Synthesis Kit) Celková RNA byla přepsána do cdna podle protokolu Transcriptor First Strand cdna Synthesis Kit (ROCHE, Německo). Objem reakční směsi byl 20 µl. Reakce probíhala na PTC-200 Thermo Cycler (MJ Research, USA). Přepis izolované RNA do cdna pomocí reversní transkripce s využitím anchored oligo(dt)18 primerů a random hexamer primerů: 10
88 - rozmrazit všechny reagencie a izolovanou RNA (pokud nebude použita čerstvá). Před použitím reagencie krátký spin a během přípravy reakce uchovávat na ledu - připravit template-primer mixter o objemu 20 ul pro jednu reakci: ul RNA (1 ug) 1 ul oligo(dt) 18 2 ul random hexamer 10 - ul H 2O (do objemu 13 ul) - volitelný krok denaturace: 10 min / 65 C v termálním bloku s nahřívaným víkem, poté umístit zkumavku na led Do reakční směsi dále přidat: 4 ul Reaction Buffer 0,5 ul RNase Inhibitor 2 ul dntp mix 0,5 ul Reverse transcriptase - směs ve zkumavce opatrně promíchat, rychle zcentrifugovat, aby se reagencie dostaly na dno a nezůstaly kapky na stěnách. Zkumavky umístit do termálního bloku s nahřívaným víkem a nastavit program: Primer Extension 25 C - 10 min cdna Synthesis 50 C - 60 min Termination 85 C - 5 min Cooling.. 4 C - hold RT q-pcr vybraných markerů (Finnzymes, PROBE) - byla provedena podle standartního protokolu doporučeného výrobcem. Pro qpcr byl použit DyNAmo Probe qpcr Kit (FINNZYMES, Finsko). Pro kvantitativní PCR (qpcr) byla použita technologie Universal Probe Library (UPL) (ROCHE, Německo). - Reakce probíhala s využitím přístroje 7300 Real-Time PCR System (Applied Biosystems, USA). Data byla vyhodnocena metodou relativní kvantifikace - relativní změna exprese genu vůči vnitřnímu standardu (kontrolní gen, jehož hladina exprese je za podmínek experimentu konstantní). Pro výpočet cílového genu byla použita srovnávací metoda ct (Cycle Threshold). Hodnota ct byla získána rozdílem hodnot ct cílového genu a kontrolního genu: ct = ct cílový ct kontrolní 11
89 Obr. 6 Ukázka vlivu smykového napětí na genovou expresi glypikanu-1 a syndekanů-1,2,4 Pro pokus byla použita buněčná linie HUVEC kultivovaná za statických podmínek a proudových podmínek o smykovém napětí 15 dyne/cm 2 po dobu 6 dnů. VI. Adheze leukocytů na endoteliální buňky za proudových podmínek Obecně je také známo, že místní podmínky průtoku krve ovlivňují adhezivní interakce leukocytů s endoteliálními buňkami. Smykové napětí moduluje adhezi leukocytů na endoteliální buňky změnou exprese adhezních molekul endoteliálních buněk (Ando and Yamamoto 2009). Postup: Buněčná linie byla kultivována za proudových podmínek (15 dyne/cm 2 ) po dobu 6 dnů (viz kultivace endoteliálních buněk v průtokových komůrkách) a následně ovlivněna podle požadavků daného experimentu. Obecný protokol pro sledování rolování a adheze buněk za proudových podmínek: - suspenzi neutrofilů naředit na koncentraci 2 x 10 6 /ml v HBSS % BSA a obarvit pomocí Calcein-AM - připojit pumpu ke kanálkům čipu obsahující přisedlé HUVEC - pomocí pumpy nasát suspenzi neutrofilů o požadovaném smykovém napětí (0.5 dyne/cm 2 ) - snímat vzorky požadovanou dobu (5 min) v několika pozicích podél celého kanálku - snímání: 10 obrázků na pozici pomocí invertního mikroskopu Axio Observer (Zeiss) s vysokorychlostní Hamamatsu kamerou - experimenty provádět při 37 C pomocí termo-modulačního boxu (Oko-lab) 12
90 Obr. 7 Ukázka adheze neutrofilů na endoteliální buňky HUVEC za proudových podmínek. HBSS MPO 10 μg/ml Fluorescence Fázový kontrast Pro pokus byla použita buněčná linie HUVEC kultivovaná za proudových podmínek o smykovém napětí 15 dyne/cm 2 a následně ovlivněná myeloperoxidázou (MPO 0 a 10 μg/ml po dobu 10 min při 37 C). HBSS kontrolní podmínky bez ovlivnění. Data představují adhezi neutrofilů při smykovém napětí 0,5 dyne/cm 2 na stimulované HUVEC pomocí fluorescence (horní obrázky) nebo fázového kontrastu (dolní obrázky) 10x. VII. Vliv smykového napětí na diferenciace myších embryonálních kmenových buněk do endoteliální buněčné linie Bylo prokázané, že vlivem smykového napětí dochází u myších embryonálních kmenových buněk ke zvýšení proliferace a k expresi endoteliálních markerů (například FLK1, VE-kadherin nebo PECAM-1). Smykové napětí má tedy přímo vliv na diferenciaci embryonálních kmenových buněk směrem k endoteliálnímu fenotypu (Ahsan and Nerem 2010). Vysadit přibližně 200 tis. buněk na jednokanálkový IBIDI slide Nechat buňky dokonale adherovat a poté připojit k pumpě Pěstovat buňky za fluidních podmínek (15 dyne/cm 2 ) 24 h Provést analýzu vybraných markerů (VE-kadherin, Tie2, VEGFR2/KDR/FLK1, CD31/PECAM)pomocí průtokové cytometrie nebo RT PCR viz. Obecný protokol přípravy vzorků pro sledování genové exprese Vyhodnotit vliv proudových podmínek na posun diferenciace kmenových buněk do endoteliálních buněk 13
91 Postup pro detekci povrchového endoteliálního markeru CD31 pomocí průtokové cytometrie: - uvolnit buňky z povrchu misky nejprve oplachem PBS + EDTA, poté působením accutasy po dobu asi 5 minut v inkubátoru - resuspendovat buňky v PBS + 1 % FBS - centrifugovat 200 g/5 min/rt - resuspendovat buňky v 1 ml PBS % BSA - spočítat buňky a připravit buněčnou suspenzi o hustotě 2 * 10 6 /ml v PBS % BSA - pipetovat 100 µl suspenze do zkumavek pro průtokovou cytometrii - obarvit buňky 10x ředěnou protilátkou proti myšímu CD31. Inkubovat 30 minut na ledu ve tmě - promýt buňky 4 ml PBS + 1 % FBS a centrifugovat 200 g/5 min/rt - odstranit supernatant a pelet buněk resuspendovat v 200µl PBS + 1 % FBS - obarvené buňky uchovat na ledu - měření na průtokovém cytometru Obr. 8 Ukázka vlivu smykového napětí na diferenciaci myších embryonálních kmenových buněk do endoteliální buněčné linie pomocí průtokové cytometrie a) izotopová kontrola 14
92 b) specifické značení CD31 15
93 3. Reference Ahsan, T. and R. M. Nerem (2010). "Fluid Shear Stress Promotes an Endothelial-Like Phenotype During the Early Differentiation of Embryonic Stem Cells." Tissue Engineering Part A 16(11): Ando, J. and K. Yamamoto (2009). "Vascular Mechanobiology - Endothelial Cell Responses to Fluid Shear Stress -." Circulation Journal 73(11): Culver, J. C. and M. E. Dickinson (2010). "The Effects of Hemodynamic Force on Embryonic Development." Microcirculation 17(3): Félétou, M. (2011). The Endothelium Part 1: Multiple Functions of the Endothelial Cells-Focus on Endothelium-Derived Vasoactive Mediators. COLLOQUIUM SERIES ON INTEGRATED SYSTEMS PHYSIOLOGY: FROM MOLECULE TO FUNCTION TO DISEASE. J. P. G. D. Neil Granger. Galley, H. F. and N. R. Webster (2004). "Physiology of the endothelium." British Journal of Anaesthesia 93(1): Resnick, N., H. Yahav, et al. (2003). "Fluid shear stress and the vascular endothelium: for better and for worse." Progress in Biophysics & Molecular Biology 81(3): Topper, J. N. and M. A. Gimbrone (1999). "Blood flow and vascular gene expression: fluid shear stress as a modulator of endothelial phenotype." Molecular Medicine Today 5(1): Reference použitých komerčních kitů: UltraClean Tissue & Cells RNA Isolation Kit (MOBIO Laboratiories, USA) Transcriptor First Strand cdna Synthesis Kit (ROCHE, Německo) DyNAmo Probe qpcr Kit (FINNZYMES, Finsko) Universal ProbeLibrary (ROCHE, Německo). 16
94 Projekt: OrganoNET partnerství pro vzdělávání a výzkum v oblasti zobrazování tkání a orgánů Registrační číslo: CZ.1.07/2.4.00/ Operační program: Vzdělávání pro konkurenceschopnost Vývoj metodiky analýzy kmenových buněk pomocí konfokální mikroskopie s návazností na komplexní charakterizaci pomocí elektronové mikroskopie a live cell zobrazování Metodický sborník Autoři: Iva Jelínková, Josef Jaroš
95 Obsah: 1. Úvod - Mikroskopické techniky a specifikace Konfokální mikroskopie Zobrazování živých buněk Superrezoluční mikroskopie Mikroskopie se strukturovaným osvětlením (Structured illumination microscopy SIM) Mikroskopie fotoaktivované lokalizace (Photoactivated Localization Microscopy PALM) 7 4. Elektronová mikroskopie Úprava vzorků v komoře skenovacího elektronového mikroskopu Korelativní světelná a elektronová mikroskopie Příprava vzorků pro fluorescenční mikroskopii Elektronová mikroskopie příprava vzorků Závěr Reference
96 1. Úvod - Mikroskopické techniky a specifikace Enormní nárůst aplikací pro biomedicínský výzkum je založen na využití mikroskopických technik pro studium kmenových buněk, a to jak ve fixovaném stavu nebo při pozorování dynamiky procesů živých buněk. Tento rozvoj je umocněn dramatickým rozšířením instrumentace v oblasti konfokální mikroskopie s vysoce citlivými detektory a zdokonalením fluorescenčních sond. Pro zobrazení detailů na submikronové úrovni se častěji využívá elektronová mikroskopie se snahou o kombinaci těchto metod z hlediska návaznosti metodiky zpracování a analýz vzorků. 2. Konfokální mikroskopie Konfokální mikroskopie e optická zobrazovací technika, která se využívá ke zvýšení optického rozlišení a kontrastu obrazů zařazením clony do konfokální roviny čočky. Důsledkem je pak eliminace světla z optických rovin mimo rovinu ostrosti. To poskytuje možnost vytvoření rekonstrukce třírozměrných struktur ze získaných obrazů. Rozlišujeme dva základní typy. Laserový skenovací konfokální mikroskop fokusuje samostatný světelný svazek do bodu na rovinu vzorku a jeho vychylováním je skenovaná oblast zájmu s prostorovou filtrací, která je zajištěna konfokální aperturou. Jeho výhodou je vysoký stupeň konfokality (tenká optická vrstva), avšak za cenu pomalého snímání obrazů. Pro snímání je nezbytná extrémně přesná kontrola soustavy zrcadel, které svazek vychylují, a také omezený počet fotonů, které jsou v daném místě emitovány. Obecně lze určit doba 1 us na jeden pixel, z čehož vyplývá akviziční rychlost 0,5 až 2 vteřiny na 1 zobrazované pole. Pozorování dynamických dějů živých buněk, e.g. změna lokalizace fluoroforu však může být v řádech milisekund a reprezentuje tak mnohem komplexnější oblast výzkumu než tradiční úlohy vztažené k analýze obrazů fixovaných vzorků ač s vysokým rozlišením. Nejvhodnějším řešením je využití konfokálního mikroskopu s rotačním diskem, který poskytuje dosažení vysokorychlostní akvizice fluorescenčních proteinů a syntetických barviv s dostatečným kontrastem obrazu a zároveň minimální vysvěcování vzorku (z angl. photobleaching). Technika je sice známá přes 40 let, ale její plné využití je možné až v současnosti se zlepšením optických parametrů mikroskopu a technologického řešení kamery s nízkou úrovní šumu. V závislosti na použité konfiguraci skenovací jednotky rotačního disku lze dosáhnout rychlosti 5000 až otáček za minutu, což odpovídá nasnímání 1000 až 2000 obrazů za vteřinu. Nevýhodou je nižší konfokalita a změna tloušťky optických řezů pouze manuální výměnou rotačních disků. 3
97 a) b) Obr. 1 Princip konfokální mikroskopie a) laserový konfokální skenovací mikroskop, b) konfokální mikroskop s rotačním diskem. Převzato, upraveno [1] 2.1. Zobrazování živých buněk Podstatou zobrazování živých buněk je vytvoření podmínek takových, aby byly u buněk zachovány jejich biologické funkce. Fluorescenční iluminace, zejména při použití excitace v ultrafialové oblasti, může být v buňkách působit destruktivní poškození jejich DNA, nebo mít fototoxické účinky. V konfokální mikroskopii jsou používány lasery s vysokým výkonem a pro úspěšnou experimentální práci je vždy snahou negativní efekty eliminovat snížením intenzity a doby excitace na minimum, při kterém je možné ještě buňky vizualizovat. Různé typy buněk mají také rozdílnou citlivost na excitační světlo. Pravidlem však je, že delší vlnová délka a krátká doba expozice způsobují nižší míru poškození. Z tohoto důvodu jsou přednostně voleny fluorochromy v zelené až infračervené oblasti emitovaného spektra. Podstatnou část tvoří také inkubační komory mikroskopické sestavy. S ohledem na spotřebu a stabilitu prostředí (teplota, koncentrace CO2) rozlišujeme dva základní typy. Velké komory, které kryjí celý mikroskop, mají výhodu možnosti manipulace se vzorky (např. výměna kultivačního média, přidávání látek v průběhu experimentu, etc.) a ve variabilitě kultivačních nádob. Ta je pak limitována pouze konstrukčním provedením stolku mikroskopu. Nevýhodou je obtížná stabilita teploty a koncentrace CO2 a také jejich energetická náročnost na provoz. 4
98 Obr. 2: Environmentální box udržující konstantní teplotu a koncentraci CO2 v celém objemu. Oproti tomu komůrky, které kryjí pouze zkoumaný vzorek, mají malou spotřebu, ale jsou většinou aplikovatelné pro specifický typ experimentu a jsou vázány na jeden typ kultivační nádoby. Na obrázku 3 jsou uvedeny komory pro podložní sklíčka, petriho misky, vícejamkové podložní sklíčka či vícejamkové kultivační desky. Obr. 3: Komůrky pro pozorování živých buněk a) vyhřívaný držák pro podložní sklíčka, b) komůrka pro vícejamkové podložní skla, c) komůrka pro petriho misku, d) komůrka pro vícejamkové kultivační desky. Převzato, upraveno [2] 5
99 Samostatnou kategorii tvoří komůrky s možností perfúze média. Tyto jsou základní výbavou zejména pro pozorování buněk v 3D prostředí (tkáně, biomateriály). Jsou komerčně dostupné také se specifickým způsobem průtoku média (obr. 4) Obr. 4: Charakterizace průtoku média v komůrkách pro zobrazování živých buněk a) nerovnoměrné proudění, sekundární toky, b), c) graduální expanze toku více rovnoměrné proudění, d) mikroakvadukt vlivem expanze toku v drážkách má tento typ nejrovnoměrnější rozložení toku skrze preparát. Převzato, upraveno [2] 3. Superrezoluční mikroskopie Vyšší rozlišení v konfokální mikroskopii lze zajistit použitím tzv. superrezolučních systémů SIM, PALM. Tyto techniky jsou založeny buď na vzorované iluminaci, nelineárních fluoroforech, či přesné lokalizaci jednotlivých molekul. Tyto techniky umožňují překročit difrakční limity a posunout tak optické rozlišení na molekulární úroveň, což z nich činí současný milník novodobé mikroskopie Mikroskopie se strukturovaným osvětlením (Structured illumination microscopy SIM) Strukturovaná iluminace je technika, u níž se vzorek osvětluje řadou sinusových pruhovaných vzorů vysoké prostorové frekvence. Tento vzor je obvykle generován laserovým svazkem, který prochází přes pohyblivou optickou mřížkou a promítá se přes objektiv na vzorek. (Heintzmann a Cremer, 1999; Gustafsson, 2000). Následně je mřížka pootočena a nasnímán další obraz až dojde k otočení o 360. Následuje zpracování obrazů specifickým algoritmem, přičemž jsou extrahovány data s vysokou prostorovou frekvencí. Laterální rozlišení obrazu je pak přibližně dvakrát vyšší než u běžné světelné mikroskopie, a to 150 až 300 nm. Vzhledem k tomu, že není třeba využívat speciální fotofyziku, prakticky všechny moderní fluorescenční barvy mohou být využity za předpokladu, že jsou dostatečně fotostabilní v dalších expozičních cyklech. 6
100 Obr. 5. Princip mikroskopie se strukturovaným osvětlením. Převzato, upraveno [3] 3.2. Mikroskopie fotoaktivované lokalizace (Photoactivated Localization Microscopy PALM) Je další metodou světelné mikroskopie, která umožňuje pozorovat objekty s rozlišením vyšším než je difrakční (Abbého) limit. Byla publikována spolu s dalšími dvěma podobnými technikami (STORM, FPALM) v roce 2006 nezávisle na sobě. Všechny využívají speciální fluorofory, které je možné uvést do stavu, ve kterém jsou schopné fluorescence (aktivované) a stavu, při kterém nefluoreskují (e.g.pa-gfp, Cy5-Cy3). Tyto stavy lze přepínat světlem určité vlnové délky a, nebo se přepínají stochasticky. V aktivovaném stavu se nachází pouze několik molekul a jejich fluorescence se opakovaně snímá až do vyblednutí. Při snímání pozorovaného pole se ukládá několik tisíc obrazů. Vzhledem k řízené, či spontánní aktivaci a fluorescenci molekul lze jejich pozici přesně lokalizovat pomocí následné analýzy obrazu. Touto metodou je možné dosáhnout rozlišení až jednotek nm. V roce 2014 byly za tyto techniky rozdány Nobelovy ceny za chemii (Eric Betzig, Stefan Hell a William Moerner). 7
101 Obr. 6 Princip mikroskopie fotoaktivované lokalizace. Převzato, upraveno [4] 8
102 4. Elektronová mikroskopie K analýzám biologických struktur v nanometrovém měřítku se často využívá elektronová mikroskopie. Můžeme definovat několik technik, přičemž základní rozdělení je na transmisní a skenovací. U transmisní elektronové mikroskopie prochází svazek elektronů ultratenkým řezem vzorku. Na základě interakcí elektronů se strukturami vzorku je snímán elektrondenzní obraz. Nejnovější transmisní mikroskopy umožňují dosáhnout prostorové rozlišení až desetiny nanometru. Avšak příprava vzorků je netriviální a v současnosti nevhodná pro kombinaci se analýzami ze světelné mikroskopie. V této práci byly optimalizovány metody pro komplexní řešení přípravy vzorků pro světelnou a skenovací elektronovou mikroskopii (SEM). Její rozlišovací schopnost jsou jednotky až desítky nanometrů v závislosti na použitém detektoru. SEM je založen na detekci elektronů odražených od povrchu vzorků, které jsou skenovány v komoře mikroskopu s podtlakem o hodnotách Pa. Proto je nezbytné jejich kompletní vysušení preparátů. Pro zpracování tkáňových kultur kmenových buněk je však výhodnější mít možnost vzorky snímat bez nutnosti vysoušení (environmentální SEM), případně ve zmrzlém stavu (kryo-sem), ačkoliv za cenu horšího rozlišení Úprava vzorků v komoře skenovacího elektronového mikroskopu Intracelulární struktury jsou pro elektronový svazek SEMu nedostupné z důvodu průniku elektronů do subnanometrové vrstvy. Jejich vizualizace je možná dvěmi dostupnými technikami. Implementací mikrotomu do komory elektronového mikroskopu. Poté je snímaný materiál po tenkých vrstvách seřezáván a opětovně snímán. Druhou metodou je využití fokusovaného iontového svazku, který je schopen postupně vymílat, či odprašovat vrstvy vzorku. V komoře takového mikroskopu je navíc zaveden zdroj urychlených iontů galia, kterými je střídavě vzorek okrajován a obraz snímán elektronovým svazkem Korelativní světelná a elektronová mikroskopie Proložení obrazů světelné a elektronové mikroskopie je vhodné k identifikaci, lokalizaci a vizualizaci topografie a složení buněčných struktur s vysokým prostorovým rozlišení. V minulosti byly korelovány obrazy zejména mikroskopie procházejícího světla. Kombinace s fluorescenční mikroskopií je významně obtížnější z důvodu omezeného množství informací v obrazu. V současnosti jsou vyvíjeny fluorescenční sondy, které lze identifikovat také suchém stavu vzorku, nejlépe takové, které vytvářejí zřetelný kontrast v eletronogramu. Vhodnými kandidáty jsou syntetické fluorofory, quantum dots či rostlinné fototropiny. K analýzám bylo používáno softwarové vybavení Coral software module (Tescan Orsay Holding, Czech Republic). Pro tyto techniky byly systematicky vyvíjeny metody přípravy vzorků s ohledem na jejich komplexní analýzy. V následující kapitole jsou uvedeny postupy laboratorní přípravy, které byly optimalizovány. 9
103 5. Příprava vzorků pro fluorescenční mikroskopii Tkáňové kultury jsou v podmínkách in vitro standardně kultivovány na planárním povrchu kultivačního plastu, či krycích sklíčkách. Pro zpracování vzorku se postupuje v závislosti na molekule/struktuře, kterou chceme vizualizovat a na používané metodě. Např. pro zobrazování živých buněk jsou voleny netoxické barvy, které pronikají přes membrány buněk a váží se na specifické molekuly, či části organel (Hoechst, MitoTracker, Draq5, 7-AAD, etc.), nebo genetická modifikace buněk se zabudováním genu fluorescenčních proteinů za gen zájmu. Mikroskopické techniky konfokální, či superreoluční jsou časově a energeticky náročné a docházelo by k poškození živých buněk. Pro prezervaci struktur buněk je tedy nezbytná fixace preparátů. V následujících postupech jsou popsány metody přípravy vzorků pro imunofluorescenční značení a jejich následné převedení pro elektronovou mikroskopii. Fixace Formaldehyd 1. Po oplachu v PBS, fixovat min 4% paraformaldehyd (PFA) v pokojové teplotě (RT), nebo glutaraldehydu příprava roztoků níže. 2. 3x oplach PBS V tomto kroku je možné vzorek uchovat vzorky na 4oC v roztoku 0,02% NaN3 v 0,1M PBS. Pozn Nasycený roztok formalínu (100% formalín) obsahuje 37% formaldehydu. Příprava Formaldehyd Obvykle se používá 2-4% koncentrace. - 1g paraformaldehydu rozpustit při o C ve 22.5 ml dh2o, 1h - přidat 2.5 ml 1M PBS. - 3ul/10ml of 1M NaOH napomáhá rozpuštění PFA - připravený roztok zfiltrovat pomocí 0.25um filtru - úpravit ph na 7.2 pomocí koncentrované HCl titrace by měla začínat okol 10. Dotažení s 1M HCl. - Ochladit na pokojovou teplotu před použitím Glutaraldehyd Při přípravě vzorků pro elektronovou mikroskopii je obvykle používán roztok 1-6,5% glutaraldehydu v 0.2 M kakodylátovém pufru. Nejprve v pokojové teplotě, následně na 4oC přes noc. Některé struktury však mohou tepelně labilní (e.g. mikrotubuly), tedy se jejich fixace v chladu nedoporučuje. Lze ředit také do PBS. Postfixace vzorků se provádí 1% oxidem osmičelým. Ten navíc v EM kontrastuje intracelulární struktury. Jelikož se však jedná o silné fixativum, dochází k zakrytí epitopů a je nevhodný pro některá barvení v imunocytochemii. V některých případech lze tedy použít větší ředění, např. 4% formaldehyd, 1% glutaraldehyd v PBS). Methanol 1. Po oplachu v PBS, fixovat buňky -20 C MeOH po dobu minut na -20 C (např. v mrazáku). 2. Následně je možné buňky a) vysušit na vzduchu a uchovat, nebo rehydratovat pomocí PBS po dobu 10 minut v RT. 10
104 Aceton 1. Po oplachu v PBS, fixovat buňky -20 C acetonem po dobu minut na -20 C (např. v mrazáku). 2. Následně je možné buňky a) vysušit na vzduchu a uchovat, nebo rehydratovat pomocí PBS po dobu 10 minut v RT. Methanol Aceton 1. Po oplachu v PBS, fixovat buňky -20 C vychlazeným roztokem MeOH-Aceton 50/50 % v/v. po dobu minut na -20 C (v mrazáku). 2. Následně je možné buňky a) vysušit na vzduchu a uchovat, nebo rehydratovat pomocí PBS po dobu 10 minut v RT. Methanol Ledová kyselina octová 1. Přidat 1 díl čerstvě naředěného roztoku MeOH-LKO (3:1) k 1 dílu kultivačního média. Inkubovat 5 min v RT. 2. Oplachnout buňky v MeOH-LKO (3:1) a tímto rotokem dále fixovat po dobu 10 min v RT. 3. Oplach dh2o dvakrát po 5 minutách. Methanol-Ethanol 1. Po oplachu v PBS, fixovat buňky -20 C vychlazeným roztokem MeOH-EtOH 50/50 % v/v. po dobu minut na -20 C (v mrazáku). 2. Následně je možné buňky a) vysušit na vzduchu a uchovat, nebo rehydratovat pomocí PBS po dobu 10 minut v RT. Ethanol Fixovat buňky roztokem 95% ethanolu a 5% ledové kyseliny octové po dobu 5-10 minut. Kryofixace Výhoda kryofixace je zejména rychlost zpracování, velmi dobré uchování epitopů antigenů. Proto často využívaná pro IHC a ICC barvení. Nevýhodou je tvorba artefaktů skrze krystaly ledu, nízký kontrast. Většinu kryofixací lze provést dvěma způsoby: a) uložení malých preparátů do isopentanu vychlazeného tekutým dusíkem. b) zalití vzorků do OCT média v plastovém držáku a vychlazení přes suchý led a methylbutan. Permeabilizace Slouží k narušení membrán buněk a otevření přístupu fluorescenčních značek a protilátek. Je nutná zejména při fixaci aldehydy. V drtivé většíně je permeabilizace realizována pomocí detergentů Triton TX-100 a Tween 20. Pro značení membránových struktur je vhodnější použití saponinu, který je méně destruktivní. Obvykle se používají koncentrace detergentů 0,05-0,5 %. 3-5 min 0,1% Triton TX-100 v PBS, RT 3x oplach PBS Blokování Při značení vzorků protilátkami může dojít k jejich nespecifickému navázání na různé epitopy. Abychom tomuto jevu zabránili, využívá se tzv. blokování. V principu lze využít 11
105 jakýkoliv protein, který nemá afinitu k cílovému epitopu, či sondě. V zásadě nelze jednoznačně určit nejvhodnější protein, či jejich směs pro danou techniku značení, proto je nutné jeho empirické testování. Blokovací reagencie se obvykle volí sérum zvířete, ve kterém byly protilátky produkovány, zejména sekundární, nebo roztoky s proteiny e.g. bovinní albumin, želatina, odtučněné mléko, či rybí sérum (pstruh duhový). 1h 1-3% BSA v 0,05% Tween20 v PBS v RT Imunofluorescence Vhodnou technikou je nepřímá imunofluorescence z hlediska její verzatility a citlivosti. Protilátky je důležité po naředění na finální koncentraci stočit po dobu 3 minut na g, čímž se sníží nespecificita a fluorescenční pozadí. Krycí sklíčka lze barvit na kapce (40-60ul) na parafilmu. V 24-jamkové desce dostačuje ul. Primární protilátka 1h 1 Ab (koncentrace dle výrobce) v 0,05% Tween20 v PBS v RT nebo přes noc 1 Ab (koncentrace dle výrobce) v 0,05% Tween20 v PBS v 4 C 2-3x oplach 0,05% Tween20 v PBS Sekundární protilátka 1h 2 Ab (koncentrace dle výrobce) v 0,05% Tween20 v PBS v RT 2-3x oplach 0,05% Tween20 v PBS Barvení jader K dobarvení jader se ve fluorescenční mikroskopii používají barvy, které se váží na nukleové kyseliny. Lze zmínit např. DAPI, Propidium jodid, Draq5, Topro-1, etc. 5min 1/1000 DAPI v PBS Montování preparátů Preparáty určené k dlouhodobému uchování se zalévají do montovacích médií. V podstatě je lze rozdělit na dvě skupiny dle rozpouštědla vodní, či organická rozpouštědla. Nejčastěji využívaná jsou Mowiol, Vectashield, či média na bázi glycerolu, která se nám nejvíce osvědčila pro superrezoluční mikroskopie. 12
106 a) b) c) Obr. 7 Ukázka barvení aktinového cytoskeletu pomocí phaloidin rhodaminu a snímání fluorescenční a superrezoluční mikroskopií. Snímek z epifluorescenční ho mikroskopu a) originál, b) obrazová dekonvoluce. c) Mikroskopie strukturovaným osvětlením. Měřítko značky je 10 um. 6. Elektronová mikroskopie příprava vzorků Narozdíl od tvrdých a suchých materiálů jako je kost, měkké vzorky (e.g. tkáně orgánů, buněčné kultury) musí být zpracovány chemickou fixací pro stabilizaci a konzervaci jejich struktury. K tomu jsou obvykle využívány fixativa jako glutaraldehyd, formaldehyd, optimálně s postfixací oxidem osmičelým. Následně jsou vzorky dehydrovány. Během vysoušení obvykle dochází ke smršťování struktur. Tento jev je minimalizován postupnou dehydratací alkoholovou řadou, či acetonem, které jsou vytěsněny kapalným CO2 a jeho odpařením v kritickém bodě. K optimalizaci metodiky byly použity vzorky mesenchymálních kmenových buněk se značením povrchových povrchových receptorů a histologické preparáty. Vzorky byly upraveny pro fluorescenční mikroskopii s optimalizací na konkrétní použité protilátky a nafoceny v konfokálním mikroskopu. Následně byly vzorky odvodněny vzestupnou alkoholovou řadou (50,70,80,96,100 % EtOH) a vysušeny v kritickém bodě pomocí CO2. Poté byla na povrch preparátů naprášena vrstva zlata o tloušťce 10 nm. K mikroskopickým analýzám byly využity systémy Fluoview 500 CLSM (Olympus) a MIRA3 (Tescan Orsay Holding). Korelace obrazů byla provedena pomocí softwarového modulu Coral (Tescan Orsay Holding). 13
107 Obr. 8 Korelativní mikroskopie. S využitím softwarového modulu Coral byly korelovány obrazy z konfokální a elektronové mikroskopie. Vzorek žaludeční sliznice a přítomnost Helicobater Pylori. 7. Závěr V rámci projektu byla vyvinuta a optimalizována metodika umožňující kombinaci fluorescenční i elektronové mikroskopie a jejich komplexního zobrazení pomocí korelativní techniky zobrazení. Tyto postupy jsou nadále rozvíjeny a testovány v moderních systémech environmentálního SEMu a 3D zobrazení v elektronovém mikroskopu. 8. Reference 1. Confocal Microscope Scanning Systems. Microscopy recource center. [online] [cit ]. Dostupné z: 2. Culture Chambers for Live-Cell Imaging. Microscopy U. [online] [cit ]. Dostupné z: 3. Schermelleh, L., Heintzmann, R. & Leonhardt, H. J. A guide to super-resolution fluorescence microscopy.cell Biol. 190, (2010). 14
108 4. Sam Hess. University of Maine. [online] [cit ]. Dostupné z: 5. Conchello, J.A., J.W. Lichtman. Optical sectioning microscopy. Nat. Methods. 2: 2005, pp Giepmans, B.N., S.R. Adams, M.H. Ellisman, R.Y. Tsien. The fluorescent toolbox for assessing protein location and function. Science. 312, pp
109 Project: OrganoNET partnership for education and research in the field of visualisation of tissues and organs Registration number: CZ.1.07/2.4.00/ Operation program: Education for Competitiveness In vivo vizualizace růstu a invazivity nádorových buněk pomocí vysokofrekvenčního ultrazvuku (In vivo visualization of growth and invasiveness of the tumour cells by means of high-frequency ultrasound) Metodický sborník (Methodical textbook) Author: Anna Černá, František Dráfi
110 Content 1. THEORY INTRODUCTION HIGH FREQUENCY ULTRASOUND IMAGING FUNDAMENTALS AND EXPERIMENTAL APPLICATIONS IN VIVO IMAGING IN CANCER BIOLOGY RESEARCH PRACTICE TUMOUR VISUALIZATION BY MEANS OF NON-LINEAR CONTRAST MODE Non-linear contrast Mode data Analysis Steps to Acquire Non-linear contrast Mode Images TUMOUR VISUALIZATION BY MEANS OF 3D-MODE Technical set up of 3D-Mode Description of 3D-Mode Window Workspace D Mode Tumour Analysis Steps to Acquire 3D Images SUMMARY BIBLIOGRAPHY
111 1. THEORY 1.1. INTRODUCTION In vivo imaging is the preclinical non-invasive visualization of living small animals for research purposes such as in vivo study of biology, drug development, and further clinical application [Kiessling, F., et al., 2011]. Imaging modalities have long been crucial to research in observing changes, either at the organ, tissue, cellular, or molecular level, in animals responding to physiological or environmental changes. Imaging systems can be categorized into morphological/anatomical and molecular imaging techniques [Willmann, J.K., et al., 2008]. Techniques such as High-Frequency Ultrasound (HFU, harmless sound waves), Nuclear Magnetic Resonance Imaging (NMRI, radio-frequency waves), High-Resolution Micro-Tomography (µct, X-rays), are usually used for anatomical imaging, while Optical Imaging (fluorescence: Fluorescence Molecular Tomography FMT and bioluminescence), In vivo Radiotracker Imaging (Positron Emission Tomography PET, electron-positron annihilation, and Single Photon Emission Computed Tomography SPECT, gamma rays) are usually used for molecular visualizations [Willmann, J.K., et al., 2008]. NMRI, CT, PET and SPECT were traditionally associated with cancer research and/or angiogenesis visualization. However, despite their various strengths, many of these systems suffer from disadvantages, including high costs and complicated maintenance associated with radioisotopes. Furthermore, none of the above mentioned imaging modalities are real-time per se, compared to ultrasound, which can capture images at the rate of up to 300 frames per second to study e.g.: blood flow, perfusion, etc. With HFU systems, researchers have the opportunity to visualize small animals in vivo and in real-time. In fact, it has been demonstrated by Loveless et al. that HFU produces images eclipsing to the MRI resolution. Therefore these two imaging systems can be combined to validate each other s results [Loveless, M.E., et al., 2009.] HIGH FREQUENCY ULTRASOUND IMAGING FUNDAMENTALS AND EXPERIMENTAL APPLICATIONS High Frequency Ultrasound works through the generation of harmless sound waves from a transducer into the living system. In our workplace, we use two types of transducers from VisualSonics, i.e.: MS400 (frequency from 18 to 38 MHz) and MS550S (frequency from 32 to 56 MHz). The first one MS400 is optimized for cardiovascular and abdominal study of mice and eye examination in rabbits. The second MS550S is optimized for embryonic, abdominal, vascular, and epidermal imaging as well as for tumour imaging (< 13 mm) in mice with better resolution. As the sound waves propagate through tissue, they are reflected back and picked up by the transducer and sent to a software program. HFU by VisualSonics is specifically developed for small animal research, with frequencies ranging from 15 MHz to 80 MHz, compared to clinical ultrasound systems, which have a range from 3 MHz to 15 MHz [Foster, F.S., et al., 2009]. HFU VEVO 2100 is a state-of-the-art in vivo imaging platform. Its benefits include the ability to support a wide range of cancer biology research methods. A scientist can quantify 3
112 an object (e.g. tumour, kidney, etc.) as in size and shape in two (2D) and/or in three dimensions (3D) to quantify optional volume. Moreover, blood flow speed and direction can be observed through ultrasound. Contrast agents can be injected into the animal to observe real-time tumour perfusion and to quantify vasculature. Because of its real-time nature, ultrasound can also guide micro-injection of drugs, stem cells, etc. into small animals without the need for surgical intervention. Furthermore, ultrasound can be used to detect and quantify cardiotoxicity in response to anti-tumour therapy, since it is the only imaging modality with instantaneous image acquisition [Stuart, I., et al., 2013, Galderisi M., et al., 2007]. In addition, ultrasound proved to be an effective method of gene delivery [Zhi-Yi, Ch., et al., 2013, Deng, C.X., et al., 2004] IN VIVO IMAGING IN CANCER BIOLOGY RESEARCH Ultrasound imaging using high frequency probes and intravenous contrast agents has been regarded as an attractive technique for accessing angiogenic activity and monitoring anti-angiogenic therapy [Cristofanilli, M., et al., 2002]. The majority of research in this area is conducted on mice, because of their wide availability, variety of strains, and ease of handling. Moreover, HFU is suitable for studying mice, as they are the perfect size to take advantage of the maximum resolution the VEVO system offers. Tumour angiogenesis is currently one of the key points in biomedical research. It is based upon the hypothesis laid out by Judah Folkman in 1971 that neo-vasculature is needed to support the growth and metastasis of tumours (see four steps from I. to IV. on the picture below), and thus anti-angiogenic treatment might be an effective way to cure cancer [Folkman, J., 1971]. Neo-angiogenesis event is governed, at least in part, by the balance of positive and negative angiogenic factors, such as VEGF, afgf, bfgf, angiogenin, etc. [Folkman, J., 1995]. Cancer angiogenesis research on animal models has long been hindered by the lack of a fast, portable, high resolution, research oriented, and animal focused imaging system that can visualize 3D tumour volume, neo-angiogenesis, and blood perfusion in vivo, in real-time and, most importantly, non-invasively. Indeed, it took more than 35 years after Folkman s hypothesis for the first anti-angiogenic treatment to be approved by the FDA [Folkman, J., 2006]. In order to ameliorate this problem, VisualSonics has introduced an up-to-date ultrasound system that allows researchers to collect a lot of important data over the lifespan of animals, thereby significantly reducing the number of animals needed. At the same time, 3D tumour volume, tumour vascularity, and tissue perfusion can be quickly quantified. VEVO MicroMarker contrast agents allow visualization of fine vasculature in cancer angiogenesis and the resolution can increase from 30 µm up to 3 µm with injection of micro-bubble contrast agents [Foster, F.S., et al., 2009]. These contrast agents can be conjugated to specific markers such as αvβ3 integrin and vascular endothelial growth factor receptors (VEGFR) in order to provide molecular visualization. Olive et al. reported in Science their findings using the VEVO high resolution system to image normal and diseased tissue in a mouse model of pancreatic cancer [Olive, K.P., et al., 2009]. In addition to measuring 3D tumour volume twice weekly, the researchers were able to make use of the micro-bubbles (VEVO MicroMarker ) to visualize tumour perfusion. With this tool, they were able to determine that KPC (Kip1 ubiquitylation-promoting complex) tumours were poorly perfused within the tumour parenchyma, despite being surrounded by well-perfused tissue [Olive, K.P., et al., 2009]. This group also used ultrasound imaging to detect changes in the tumour while injecting gemcitabine, which caused transient response in the tumour, correlating to high levels of apoptosis [Olive, K.P., et al., 2009]. 4
113 Power and Colour Doppler functionality allows for the identification and measurement of blood flow in and around any organs and tumours [see example of 3D Power Doppler imaging on Fig. 1]. A successful use of Power Doppler Mode was described by Palmowski et al. in Cancer Research in 2008 [Palmowski. M., et al., 2008]. The group published their findings of using high-frequency volumetric Power Doppler ultrasound to capture flowdependant signals. They also assess antiangiogenic effects in a murine A431 model [Palmowski. M., et al., 2008]. The researchers used the VEVO system to visualize the effects of administering SU11248 (currently known as Sunitinib) on tumour volume and vascularity over a period of 9 days [Palmowski. M., et al., 2008]. In addition, the researchers made use of a novel technique: destruction of micro-bubble contrast agents by high-mechanical index ultrasound sonoporation using the VEVO system, to allow for a superior visualization of early antiangiogenic effects. Figure 1: Power Doppler imaging in conjunction with 3D B-Mode provides visual information about the animal organ tested. On the upper image, you can see Cross view while green mesh represents the whole mouse testicle. On the down image, you can see Cube view after using Sculpting Shave Mode. The grey haze is a testicle tissue overlay and the red-orange colour represents major blood flow in vessels within the testicle detected by Power Doppler signal. The pictures were acquired by 3D-Mode on the VEVO 2100 system by means of MS550S transducer. 5
114 2. PRACTICE Software and instruments used for experimental work with high-frequency ultrasound are described in this chapter. The application packages are pre-defined groups of image acquisition settings. They allows the researcher quickly get an optimal image to work with. When one is ready to take measurements, it can be quickly cycle through the predefined measurement protocols for one s application. Understanding the patterns of blood flow is a powerful tool when evaluating the differences between normal and pathological tissues. As a non-invasive imaging system, VEVO2100 performs longitudinal studies that monitor the progression of disease in the same animal over a period of time. Tumour cells cultivation together with tumour induction is briefly described TUMOUR VISUALIZATION BY MEANS OF NON-LINEAR CONTRAST MODE Non-linear contrast Mode produces an image of a blood vessel perfusion. This mode is a high-frequency imaging mode that produces improved sensitivity in microbubble detection and quantification. This mode suppresses the tissue signal while increasing the detection of the contrast agents. During acquisition the system modulates the amplitude of the ultrasound pulses, enabling a non-linear response to microbubbles. Distinguishing non-vascular tissue structures from vascular tissue structures. Identifying vascular structures that can be more difficult to identify in other ultrasound mode image data. The study and quantification of relative perfusion in vivo is an important metric for cancer research and tumour development study and/or general organ perfusion. Vascular architecture and structures can be visualized in tumour models and relative tumour perfusion can be quantified using biomarkers. Non-Targeted MicroMarker Contrast Agents are used to enhance the visualization of blood flow down to the capillary level. They are injected i.v., typically through the tail vein and circulate freely through functional blood vessels. Micro-bubble contrast agents have been used in ultrasound imaging as a means to improve the visualization of blood flow with respect to the surrounding tissue. The microbubbles are 2-3 μm in size and are made up of a phospholipid shell containing a polyethylene glycol outer shell, along with a perfluorobutane/nitrogen gas core [micro-bubble structure see Fig. 2]. Non-targeted contrast agents are used to enhance the visibility of tissue, perfusion and microcirculation. Target-ready contrast agents are used for quantification of biomarker expression in targeted molecular applications. 6
115 Figure 2: Non-target and target-ready contrast agents There are two contrast imaging techniques: Linear and non-linear. In linear contrast agent imaging, the micro-bubble contrast agents are visualized using B-Mode imaging. A reference subtraction algorithm is then applied to add a green contrast overlay on the image to aid in the visualization and quantification of the contrast specific signal. Non-linear contrast agent imaging uses multiple ultrasound pulses in which the amplitude of the pulse is modulated. By performing this type of imaging the non-linear response of the micro-bubbles to ultrasound pulses is utilized. The goal of this type of imaging is to suppress the tissue signal while increasing the ability to detect the contrast agents, providing a much more sensitive imaging technique Non-linear contrast Mode data Analysis A bolus injection of the Non-Targeted MicroMarker Contrast Agents allows for the visualization of the microvasculature within the tumour. Figure 3 shows a time course of the bolus injection from the beginning where no contrast agent was present, through approximately 16 seconds after the bolus arrival at the tumour location. Animals: Analysis were done on a female BALB/c mouse with murine colon tumor cells CT26.WT (ATCC, CRL-2638) subcutaneously implanted into the left flank (1x10 6 cells in Matrigel HC). All the experiments were approved by the National Animal Research Authority and performed by well-trained operator. Materials and method: VEVO 2100 (Visualsonics, Toronto, Canada), the high-frequency ultrasound was used with the MS250 transducer. Non-linear contrast imaging mode and acquisition time of 160 s were applied. Non-Targeted MicroMarker Contrast Agents (Visualsonics, Toronto, Canada) were used Steps to Acquire Non-linear contrast Mode Images Animal Handling: 1. Carefully fix an animal on the heating table as seen on the picture below. 2. Temperature regulation is very important; the temperature should be maintained at C. 7
116 3. Anaesthesia should be maintained at the same level for all animals. By controlling the temperature and anaesthesia, the heart rate and respiration rate can be kept fairly similar within and between imaging sessions in the study. 4. When handling the animals all procedures should be performed as quickly as possible while maintaining proper procedure and protocol. The amount of time under anaesthesia should be minimized. To acquire a Non-Linear Contrast Mode image: 1. Start imaging in B-Mode. Adjust the presets and additional parameters in order to optimize the image for the region of interest. 2. Switch to Non-linear Contrast Mode acquisition by pressing the Contrast key. 3. Select the appropriate preset for the study. 4. Press Scan/Freeze to start acquisition and open the Physio panel by pressing the Physio key on the keyboard. 5. Non-targeted contrast agents should be injected into the vascular system either via a small bolus or a continuous infusion using a syringe pump. 6. The contrast agents are free flowing in the vascular system for a period of time until they are either destroyed with a high-powered ultrasound sequence or are cleared through the system via the kidney or the liver. 7. The system closes the series you are working on and displays the Study Information window. 8. Complete the required fields to define your study. 9. Now you have successfully acquired Non-Linear Contrast Mode image data. 8
117 The original images acquired from VEVO 2100 system are displayed on figure 3. figure 4. Figure 3: The image of a mouse tumour measured in Non-Linear Contrast Mode by means of MS250 transducer shows injecting the contrast agent (1), with a traced measurement, Micro-Marker destruction (2) and re-saturation (3). Nonlinear Contrast Mode graph using the Perfusion analysis - calculated Peak Enhancement and Time to Peak for the time interval selected on the graph. 9
118 Figure 4: Tumour vascular perfusion in Non-Linear Contrast Mode on the VEVO 2100 system by means of MS250 transducer shows a graph displaying the contrast signal during a bolus injection TUMOUR VISUALIZATION BY MEANS OF 3D-MODE. 3D-Mode provides a series of two dimensional slices and assembles them into three dimensional view of an area of interest. The system acquires the 3D data by capturing a rapid series of B-Mode slices and then combining these slices into a 3D image. It can be then used as the analysis tools to manipulate the three dimensional renderings and make volumetric measurements of the structures of interest. Targets (e.g.: tumour growth) can be also segmented and volumetric measured. 3D imaging is available for image data acquired in the frame-based imaging modes: B-Mode, Colour Doppler Mode, Power Doppler Mode, Linear Contrast Mode, and Nonlinear Contrast Mode. VisualSonics 3D imaging tool allows users to apply segmentation algorithms, determine the volume of the orthotopic tumour in vivo and follow the progression or regression of tumour volume longitudinally. The 3D volumes are obtained literally in seconds within the percentage calculation of vessels [Fig. 5]. 10
119 Figure 5: Colour Doppler-Mode imaging of left mouse kidney in 3D cross view via MS550S. The light grey haze represents kidney tissue. Pink mesh represents the kidney volume with numeric calculation. Blue and red haze represents blood flow. PV = percentage of vasculature. The VEVO 2100 system allows for precise and accurate detection of early tumours before they are palpable. There is no need to use callipers thanks to the VEVO system, which allows for exact measurements to be recorded and for the morphology to be precisely outlined Technical set up of 3D-Mode The transducer is mounted on a VEVO Imaging Station equipped with a 3D motor stage. The transducer is attached to a clamp connected to the bottom of the 3D motor stage. The 3D motor stage connects to the mount on the VEVO Imaging Station. 11
120 At each step during experimental imaging, the transducer acquires a two dimensional (2D) slice of the final image [Fig. 6]. Figure 6: The transducer orientation in 3D-Mode. Movement directions and 2D image slices combined into a 3D visualization of an object inside the animal. As shown in the following figure, the long axis of the 3D motor stage must be aligned with the direction that the transducer travels during data acquisition [Fig. 8]. During the 3D data acquisition, the motor stage moves the transducer. The system must be positioned in such 12
121 a way that the transducer is in safe contact with the animal while it is moved by the 3D motor stage Description of 3D-Mode Window Workspace After reviewing the image taken in 3D-Mode, it can be processed as the image in the contrast settings section and loading into 3D has to be adjusted. The system loads the image into the 3D-Mode 4-pane view Quad pane [next illustration]. The system compiles each two-dimensional slice with the next and renders them into a three-dimensional object. You can use the 3D analysis tools to: View and render objects of interest, such as target tumours Segment objects on any plane or across planes Measure lengths, areas and volumes The 3D-Mode window is the workspace you use when visualizing acquired image data in 3D-Mode. Each pane displays a unique view of the 3D image. When you click a different view icon in the image analysis tool bar to change the view, the system visualizes the same slice from a different perspective. 13
122 Area: Description: 1 Cube View: Displays a three dimensional view of the acquired data, constructed from the full set of B-Mode image slices. The cube displays a blue wire-frame by default. 2 Cross View: Displays three single, slidable image slice views presented on the x, y, and z planes. Each plane presents its own colour outline: Blue = x-y plane on the z axis Green = y-z plane on the x axis Red = x-z plane on the y axis 3 Transverse View: Displays a straight-on perspective of the x-y plane image slice, displayed on the Cross view as the plane outlined in blue. 4 Sagittal View: Displays a straight-on perspective of the y-z plane image slice, displayed on the Cross view as the plane outlined in green D Mode Tumour Analysis Semi automated three dimensional imaging can be performed rapidly and reproducibly. This powerful software offers numerous functions, such as: Virtual sections in all directions, x-, y-, z- and arbitrary plane; 3D render illustrating 3D depth; accurate volume measurement. 3D imaging can be performed in B-Mode, Power Doppler Mode and Contrast Mode, providing higher throughput compared to other imaging modalities. Animals: Analysis were done on a female NOD-SCID gamma mouse with human tumour cells H134 (H134-0 and H134-TUSC3). H134-0 cells were subcutaneously implanted into the left flank (5x10 6 cells in PBS) and scrambled H134-TUSC3 tumour cells were subcutaneously implanted into the right flank (5x10 6 cells in PBS). All the experiments were approved by the National Animal Research Authority and performed by well-trained operator. Materials and method: VEVO 2100 (Visualsonics, Toronto, Canada), the high-frequency ultrasound was used with the MS550S and MS400 transducers. B-mode and Power Doppler Mode were applied Steps to Acquire 3D Images Animal Handling: the same as mentioned in Steps to Acquire Non-Linear Contrast Mode Images. To acquire 3D Mode image: 1. From B-Mode, Power Doppler Mode (also allowed from: Linear Contrast Mode, Nonlinear Contrast Mode or the Study Browser) press the 3D key to activate the 3D- Mode acquisition process. 2. The 3D Motor Stage initialization starts. 3. Activate the basic imaging Mode for the type of 3D-Mode images to acquire. 4. Find the colour region-of-interest. 5. Locate the object of interest and centre it as closely as possible relative to the transducer using the platform controls on the VEVO Imaging Station. 6. Define scan distance. 7. Complete the required fields to define your study. 8. Now you have successfully acquired 3D Mode image data. An experimental image of tumour volume quantification by means of VEVO 2100 system can be seen on figure 7 and figure 8. 14
123 Figure 7: The 3D image of a tumour acquired by means of transducer MS400 in Cube view. The following panels are displayed: H134-TUSC3 on left; H134-0 on right. On this picture you can see the volumetric difference of a tumour growth if modified by plasmid TUSC3 on the same animal. 15
124 Figure 8: The 3D image of a tumour acquired by means of transducer MS400 in Cross view. The following panels are displayed: H134-TUSC3 on left; H134-0 on right. On this picture you can see the space of tumours with surrounded tissue. 3. Summary High Frequency Ultrasound has opened up new possibilities for preclinical research in cancer biology on small animal models. The ultrasound system is portable, does not require any dedicated facilities, and is cost-effective compared to other systems. It also does not run the risk of confounding results through side-effects of radiation. The VEVO 2100 system was used to create this methodical textbook and it is used experimentally at the Faculty of Medicine, Masaryk University in Brno, Czech Republic by František Dráfi, PhD. and his colleagues. In summary, HFU Imaging for processes that happen over a period of time, such as angiogenesis and tumour volume changes is currently non-invasive, in vivo and real-time. 16
Principy a instrumentace
 Průtoková cytometrie Principy a instrumentace Ing. Antonín Hlaváček Úvod Průtoková cytometrie je moderní laboratorní metoda měření a analýza fyzikálních -chemických vlastností buňky během průchodu laserovým
Průtoková cytometrie Principy a instrumentace Ing. Antonín Hlaváček Úvod Průtoková cytometrie je moderní laboratorní metoda měření a analýza fyzikálních -chemických vlastností buňky během průchodu laserovým
Analýza buněčných populací pomocí průtokové cytometrie
 Analýza buněčných populací pomocí průtokové cytometrie Skriptum metodických materiálů Autoři: Radek Fedr, Belma Skender, Ján Remšík, Zuzana Pernicová, Šárka Šimečková, Karel Souček Projekt: OrganoNET partnerství
Analýza buněčných populací pomocí průtokové cytometrie Skriptum metodických materiálů Autoři: Radek Fedr, Belma Skender, Ján Remšík, Zuzana Pernicová, Šárka Šimečková, Karel Souček Projekt: OrganoNET partnerství
Nové metody v průtokové cytometrii. Vlas T., Holubová M., Lysák D., Panzner P.
 Nové metody v průtokové cytometrii Vlas T., Holubová M., Lysák D., Panzner P. Průtoková cytometrie Analytická metoda využívající interakce částic a záření. Technika se vyvinula z počítačů částic Počítače
Nové metody v průtokové cytometrii Vlas T., Holubová M., Lysák D., Panzner P. Průtoková cytometrie Analytická metoda využívající interakce částic a záření. Technika se vyvinula z počítačů částic Počítače
Fluorescenční mikroskopie
 Fluorescenční mikroskopie Pokročilé biofyzikální metody v experimentální biologii Ctirad Hofr 1 VYUŽITÍ FLUORESCENCE, PŘÍMÁ FLUORESCENCE, PŘÍMÁ A NEPŘÍMA IMUNOFLUORESCENCE, BIOTIN-AVIDINOVÁ METODA IMUNOFLUORESCENCE
Fluorescenční mikroskopie Pokročilé biofyzikální metody v experimentální biologii Ctirad Hofr 1 VYUŽITÍ FLUORESCENCE, PŘÍMÁ FLUORESCENCE, PŘÍMÁ A NEPŘÍMA IMUNOFLUORESCENCE, BIOTIN-AVIDINOVÁ METODA IMUNOFLUORESCENCE
Fluorescenční mikroskopie
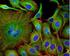 Luminiscence jev, kdy látka vysílá do prostoru světlo chemická reakce chemiluminiscence (např. světluška) světlo fotoluminiscence fluorescence (emisní záření jen krátkou dobu po skončení exitačního záření)
Luminiscence jev, kdy látka vysílá do prostoru světlo chemická reakce chemiluminiscence (např. světluška) světlo fotoluminiscence fluorescence (emisní záření jen krátkou dobu po skončení exitačního záření)
METODY VYŠETŘOVÁNÍ BUNĚČNÉ IMUNITY. Veřejné zdravotnictví
 METODY VYŠETŘOVÁNÍ BUNĚČNÉ IMUNITY Veřejné zdravotnictví METODY VYŠETŘOVÁNÍ BUNĚČNÉ IMUNITY průtoková cytometrie metody stanovení funkční aktivity lymfocytů testy fagocytárních funkcí Průtoková cytometrie
METODY VYŠETŘOVÁNÍ BUNĚČNÉ IMUNITY Veřejné zdravotnictví METODY VYŠETŘOVÁNÍ BUNĚČNÉ IMUNITY průtoková cytometrie metody stanovení funkční aktivity lymfocytů testy fagocytárních funkcí Průtoková cytometrie
Metoda Live/Dead aneb využití fluorescenční mikroskopie v bioaugmentační praxi. Juraj Grígel Inovativní sanační technologie ve výzkumu a praxi
 Metoda Live/Dead aneb využití fluorescenční mikroskopie v bioaugmentační praxi Juraj Grígel Inovativní sanační technologie ve výzkumu a praxi Co je to vlastně ta fluorescence? Některé látky (fluorofory)
Metoda Live/Dead aneb využití fluorescenční mikroskopie v bioaugmentační praxi Juraj Grígel Inovativní sanační technologie ve výzkumu a praxi Co je to vlastně ta fluorescence? Některé látky (fluorofory)
IZOLACE, SEPARACE A DETEKCE PROTEINŮ I. Vlasta Němcová, Michael Jelínek, Jan Šrámek
 IZOLACE, SEPARACE A DETEKCE PROTEINŮ I Vlasta Němcová, Michael Jelínek, Jan Šrámek Studium aktinu, mikrofilamentární složky cytoskeletu pomocí dvou metod: detekce přímo v buňkách - fluorescenční barvení
IZOLACE, SEPARACE A DETEKCE PROTEINŮ I Vlasta Němcová, Michael Jelínek, Jan Šrámek Studium aktinu, mikrofilamentární složky cytoskeletu pomocí dvou metod: detekce přímo v buňkách - fluorescenční barvení
LRR/BUBCV CVIČENÍ Z BUNĚČNÉ BIOLOGIE 3. TESTY ŽIVOTASCHOPNOSTI A POČÍTÁNÍ BUNĚK
 LRR/BUBCV CVIČEÍ Z BUĚČÉ BILGIE 3. TESTY ŽIVTASCHPSTI A PČÍTÁÍ BUĚK TERETICKÝ ÚVD: Při práci s buňkami je jedním ze základních sledovaných parametrů stanovení jejich životaschopnosti (viability). Tímto
LRR/BUBCV CVIČEÍ Z BUĚČÉ BILGIE 3. TESTY ŽIVTASCHPSTI A PČÍTÁÍ BUĚK TERETICKÝ ÚVD: Při práci s buňkami je jedním ze základních sledovaných parametrů stanovení jejich životaschopnosti (viability). Tímto
Zoologická mikrotechnika - FLUORESCENČNÍ MIKROSKOPIE
 Fluorescence Fluorescence je jev, kdy látka absorbuje ultrafialové záření nebo viditelné světlo s krátkou vlnovou délkou a emituje viditelné světlo s delší vlnovou délkou než má světlo absorbované Emitace
Fluorescence Fluorescence je jev, kdy látka absorbuje ultrafialové záření nebo viditelné světlo s krátkou vlnovou délkou a emituje viditelné světlo s delší vlnovou délkou než má světlo absorbované Emitace
F l u o r e s c e n c e
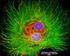 F l u o r e s c e n c e Fluorescenční mikroskopie Luminiscence jev, kdy látka vysílá do prostoru světlo chemická reakce chemiluminiscence světlo fotoluminiscence Vyvolávající záření exitační fluorescence
F l u o r e s c e n c e Fluorescenční mikroskopie Luminiscence jev, kdy látka vysílá do prostoru světlo chemická reakce chemiluminiscence světlo fotoluminiscence Vyvolávající záření exitační fluorescence
Téma: Testy životaschopnosti a Počítání buněk
 LRR/BUBV vičení z buněčné biologie Úloha č. 3 Téma: Testy životaschopnosti a Počítání Úvod: Při práci s buňkami je jedním ze základních sledovaných parametrů stanovení jejich životaschopnosti (viability).
LRR/BUBV vičení z buněčné biologie Úloha č. 3 Téma: Testy životaschopnosti a Počítání Úvod: Při práci s buňkami je jedním ze základních sledovaných parametrů stanovení jejich životaschopnosti (viability).
MTI Cvičení č. 2 Pasážování buněk / Jana Horáková
 MTI Cvičení č. 2 Pasážování buněk 15.11./16.11.2016 Jana Horáková Doporučená literatura M. Vejražka: Buněčné kultury http://bioprojekty.lf1.cuni.cz/3381/sylabyprednasek/textova-verze-prednasek/bunecnekultury-vejrazka.pdf
MTI Cvičení č. 2 Pasážování buněk 15.11./16.11.2016 Jana Horáková Doporučená literatura M. Vejražka: Buněčné kultury http://bioprojekty.lf1.cuni.cz/3381/sylabyprednasek/textova-verze-prednasek/bunecnekultury-vejrazka.pdf
Určení koncentrace proteinu fluorescenční metodou v mikrotitračních destičkách
 Určení koncentrace proteinu fluorescenční metodou v mikrotitračních destičkách Teorie Stanovení celkových proteinů Celkové množství proteinů lze stanovit pomocí několika metod; například: Hartree-Lowryho
Určení koncentrace proteinu fluorescenční metodou v mikrotitračních destičkách Teorie Stanovení celkových proteinů Celkové množství proteinů lze stanovit pomocí několika metod; například: Hartree-Lowryho
CVIČENÍ Z ANALYTICKÉ CYTOMETRIE , BFÚ
 CVIČENÍ Z ANALYTICKÉ CYTOMETRIE 2014 2. 4. 12. 2014, BFÚ Vyučující: Mgr. Karel Souček, Ph.D.; Mgr. Šárka Šimečková; PhamDr. Jan Remšík Skupina A 1. Bečárová, Kristína (učo 393338); PřF N-EXB SPBI (EBZI)
CVIČENÍ Z ANALYTICKÉ CYTOMETRIE 2014 2. 4. 12. 2014, BFÚ Vyučující: Mgr. Karel Souček, Ph.D.; Mgr. Šárka Šimečková; PhamDr. Jan Remšík Skupina A 1. Bečárová, Kristína (učo 393338); PřF N-EXB SPBI (EBZI)
PRŮTOKOVÁ CYTOMETRIE - PERSPEKTIVNÍ ALTERNATIVA V ANALÝZE MIKROBIOLOGICKÝCH UKAZATELŮ KVALITY VOD
 PRŮTOKOVÁ CYTOMETRIE - PERSPEKTIVNÍ ALTERNATIVA V ANALÝZE MIKROBIOLOGICKÝCH UKAZATELŮ KVALITY VOD 1* P. Mikula, 1 B. Maršálek 1 Botanický ústav Akademie věd ČR, Oddělení experimentální fykologie a ekotoxikologie,
PRŮTOKOVÁ CYTOMETRIE - PERSPEKTIVNÍ ALTERNATIVA V ANALÝZE MIKROBIOLOGICKÝCH UKAZATELŮ KVALITY VOD 1* P. Mikula, 1 B. Maršálek 1 Botanický ústav Akademie věd ČR, Oddělení experimentální fykologie a ekotoxikologie,
1. Metodika. Protokol č. F1-4 Metodika: Srovnávací analýza efektivity přípravy rekombinantního proteinu ve fermentoru
 Protokol č.: F1-4 Datum: 20.12.2010 Metodika: analýza efektivity přípravy výběr z výsledků ze zkušebních provozů výroby antigenů. Vypracoval: Ing. Václav Filištein, Mgr. Tereza Chrudimská, Spolupracující
Protokol č.: F1-4 Datum: 20.12.2010 Metodika: analýza efektivity přípravy výběr z výsledků ze zkušebních provozů výroby antigenů. Vypracoval: Ing. Václav Filištein, Mgr. Tereza Chrudimská, Spolupracující
Pokročilé biofyzikální metody v experimentální biologii
 Pokročilé biofyzikální metody v experimentální biologii Ctirad Hofr 1/1 Proč biofyzikální metody? Biofyzikální metody využívají fyzikální principy ke studiu biologických systémů Poskytují kvantitativní
Pokročilé biofyzikální metody v experimentální biologii Ctirad Hofr 1/1 Proč biofyzikální metody? Biofyzikální metody využívají fyzikální principy ke studiu biologických systémů Poskytují kvantitativní
Western blotting. 10% APS 20,28 µl 40,56 µl 81,12 µl 20,28 µl 40,56 µl 81,12 µl
 Western blotting 1. Příprava gelu složení aparatury hustotu gelu volit podle velikosti proteinů příprava rozdělovacího gelu: 10% 12% počet gelů 1 2 4 1 2 4 objem 6 ml 12 ml 24 ml 6 ml 12 ml 24 ml 40% akrylamid
Western blotting 1. Příprava gelu složení aparatury hustotu gelu volit podle velikosti proteinů příprava rozdělovacího gelu: 10% 12% počet gelů 1 2 4 1 2 4 objem 6 ml 12 ml 24 ml 6 ml 12 ml 24 ml 40% akrylamid
Helena Langhansová. 30. listopadu 2011
 VYUŽIT ITÍ PRŮTOKOV TOKOVÉ CYTOMETRIE V IMUNOLOGII Helena Langhansová 30. listopadu 2011 Projekt Vytvoření a rozvoj týmu zaměřeného na výzkum a výuku v oblasti medicínské biologie, reg. č. CZ.1.07/2.2.00/15.0361,
VYUŽIT ITÍ PRŮTOKOV TOKOVÉ CYTOMETRIE V IMUNOLOGII Helena Langhansová 30. listopadu 2011 Projekt Vytvoření a rozvoj týmu zaměřeného na výzkum a výuku v oblasti medicínské biologie, reg. č. CZ.1.07/2.2.00/15.0361,
FLUORESCENČNÍ MIKROSKOP
 FLUORESCENČNÍ MIKROSKOP na gymnáziu Pierra de Coubertina v Táboře Pavla Trčková, kabinet Biologie, GPdC Tábor Co je fluorescence Fluorescence je jev spočívající v tom, že některé látky (fluorofory) po
FLUORESCENČNÍ MIKROSKOP na gymnáziu Pierra de Coubertina v Táboře Pavla Trčková, kabinet Biologie, GPdC Tábor Co je fluorescence Fluorescence je jev spočívající v tom, že některé látky (fluorofory) po
IMUNOFLUORESCENCE. Mgr. Petr Bejdák Ústav klinické imunologie a alergologie Fakultní nemocnice u sv. Anny a Lékařská fakulta MU
 Mgr. Petr Bejdák Ústav klinické imunologie a alergologie Fakultní nemocnice u sv. Anny a Lékařská fakulta MU Luminiscence jev, při kterém látka emituje záření po absorpci excitačního záření (fotoluminiscence)
Mgr. Petr Bejdák Ústav klinické imunologie a alergologie Fakultní nemocnice u sv. Anny a Lékařská fakulta MU Luminiscence jev, při kterém látka emituje záření po absorpci excitačního záření (fotoluminiscence)
Praktický kurz Praktický kurz monitorování apoptózy a autofágie u nádorových prostatických buněk pomocí průtokové cytometrie
 Laboratoř Metalomiky a Nanotechnologií Praktický kurz Praktický kurz monitorování apoptózy a autofágie u nádorových prostatických buněk pomocí průtokové cytometrie Nastavení průtokového cytometru a jeho
Laboratoř Metalomiky a Nanotechnologií Praktický kurz Praktický kurz monitorování apoptózy a autofágie u nádorových prostatických buněk pomocí průtokové cytometrie Nastavení průtokového cytometru a jeho
DODATEČNÉ INFORMACE dle 49 zákona č. 137/2006 Sb., o veřejných zakázkách
 DODATEČNÉ INFORMACE dle 49 zákona č. 137/2006 Sb., o veřejných zakázkách Zadavatel tímto poskytuje dodavatelům v souladu s 49 odst. 4 zákona o veřejných zakázkách dodatečné informace k veřejné zakázce
DODATEČNÉ INFORMACE dle 49 zákona č. 137/2006 Sb., o veřejných zakázkách Zadavatel tímto poskytuje dodavatelům v souladu s 49 odst. 4 zákona o veřejných zakázkách dodatečné informace k veřejné zakázce
Využití a princip fluorescenční mikroskopie
 Využití a princip fluorescenční mikroskopie fyzikálně chemický děj Fluorescence typem luminiscence (elektroluminiscence, fotoluminiscence, radioluminiscence a chemiluminiscenci) patří mezi fotoluminiscenční
Využití a princip fluorescenční mikroskopie fyzikálně chemický děj Fluorescence typem luminiscence (elektroluminiscence, fotoluminiscence, radioluminiscence a chemiluminiscenci) patří mezi fotoluminiscenční
Nastavení metod pro imunofenotypizaci krevních. EXBIO Praha, a.s.
 Nastavení metod pro imunofenotypizaci krevních buněk pomocí průtokové cytometrie Martin Špryngar EXBIO Praha, a.s. Obsah: Porovnání vícebarevné vs. dvoubarevné cytometrie Požadavky průtokové cytometrie
Nastavení metod pro imunofenotypizaci krevních buněk pomocí průtokové cytometrie Martin Špryngar EXBIO Praha, a.s. Obsah: Porovnání vícebarevné vs. dvoubarevné cytometrie Požadavky průtokové cytometrie
Optická konfokální mikroskopie a mikrospektroskopie. Pavel Matějka
 Optická konfokální mikroskopie a Pavel Matějka 1. Konfokální mikroskopie 1. Princip metody - konfokalita 2. Instrumentace metody zobrazování 3. Analýza obrazu 2. Konfokální 1. Luminiscenční 2. Ramanova
Optická konfokální mikroskopie a Pavel Matějka 1. Konfokální mikroskopie 1. Princip metody - konfokalita 2. Instrumentace metody zobrazování 3. Analýza obrazu 2. Konfokální 1. Luminiscenční 2. Ramanova
Výzkumné centrum genomiky a proteomiky. Ústav experimentální medicíny AV ČR, v.v.i.
 Výzkumné centrum genomiky a proteomiky Ústav experimentální medicíny AV ČR, v.v.i. Systém pro sekvenování Systém pro čipovou analýzu Systém pro proteinovou analýzu Automatický sběrač buněk Systém pro sekvenování
Výzkumné centrum genomiky a proteomiky Ústav experimentální medicíny AV ČR, v.v.i. Systém pro sekvenování Systém pro čipovou analýzu Systém pro proteinovou analýzu Automatický sběrač buněk Systém pro sekvenování
VYUŽITÍ PRŮTOKOVÉ CYTOMETRIE PRO DETEKCI ÚČINNOSTI FILTRACE BAKTERIÍ V PROCESECH ČIŠTĚNÍ ODPADNÍCH VOD
 VYUŽITÍ PRŮTOKOVÉ CYTOMETRIE PRO DETEKCI ÚČINNOSTI FILTRACE BAKTERIÍ V PROCESECH ČIŠTĚNÍ ODPADNÍCH VOD P. Mikula a*, J. Lev b,c, L. Kalhotka b, M. Holba a,c, D. Kimmer d, B. Maršálek a, M. Vítězová b a)
VYUŽITÍ PRŮTOKOVÉ CYTOMETRIE PRO DETEKCI ÚČINNOSTI FILTRACE BAKTERIÍ V PROCESECH ČIŠTĚNÍ ODPADNÍCH VOD P. Mikula a*, J. Lev b,c, L. Kalhotka b, M. Holba a,c, D. Kimmer d, B. Maršálek a, M. Vítězová b a)
laboratorní technologie
 Průtoková cytometrie L. Roubalová Metoda průtokové cytometrie je v současné době považována za standardní metodu analýzy částic v suspenzi. Umožňuje kvalitativní a kvantitativní analýzu fyzikálních (optických)
Průtoková cytometrie L. Roubalová Metoda průtokové cytometrie je v současné době považována za standardní metodu analýzy částic v suspenzi. Umožňuje kvalitativní a kvantitativní analýzu fyzikálních (optických)
Izolace nukleových kyselin
 Izolace nukleových kyselin Požadavky na izolaci nukleových kyselin V nativním stavu z přirozeného materiálu v dostatečném množství požadované čistotě. Nukleové kyseliny je třeba zbavit všech látek, které
Izolace nukleových kyselin Požadavky na izolaci nukleových kyselin V nativním stavu z přirozeného materiálu v dostatečném množství požadované čistotě. Nukleové kyseliny je třeba zbavit všech látek, které
DIAGNOSTICKÝ KIT PRO DETEKCI MINIMÁLNÍ REZIDUÁLNÍ CHOROBY U KOLOREKTÁLNÍHO KARCINOMU
 Úvod IntellMed, s.r.o., Václavské náměstí 820/41, 110 00 Praha 1 DIAGNOSTICKÝ KIT PRO DETEKCI MINIMÁLNÍ REZIDUÁLNÍ CHOROBY U KOLOREKTÁLNÍHO KARCINOMU Jednou z nejvhodnějších metod pro detekci minimální
Úvod IntellMed, s.r.o., Václavské náměstí 820/41, 110 00 Praha 1 DIAGNOSTICKÝ KIT PRO DETEKCI MINIMÁLNÍ REZIDUÁLNÍ CHOROBY U KOLOREKTÁLNÍHO KARCINOMU Jednou z nejvhodnějších metod pro detekci minimální
Fluorescence (luminiscence)
 Fluorescence (luminiscence) Patří mezi luminiscenční metody fotoluminiscence. Luminiscence efekt, kdy excitované molekuly či atomy vyzařují světlo při přechodu z excitovaného do základního stavu. Podle
Fluorescence (luminiscence) Patří mezi luminiscenční metody fotoluminiscence. Luminiscence efekt, kdy excitované molekuly či atomy vyzařují světlo při přechodu z excitovaného do základního stavu. Podle
IMUNOCYTOCHEMICKÁ METODA JEJÍ PRINCIP A VYUŽITÍ V LABORATOŘI
 IMUNOCYTOCHEMICKÁ METODA JEJÍ PRINCIP A VYUŽITÍ V LABORATOŘI Radka Závodská, PedF JU v Českých Budějovicích Imunocytochemická metoda - použítí protilátky k detekci antigenu v buňkách (Imunohistochemie-
IMUNOCYTOCHEMICKÁ METODA JEJÍ PRINCIP A VYUŽITÍ V LABORATOŘI Radka Závodská, PedF JU v Českých Budějovicích Imunocytochemická metoda - použítí protilátky k detekci antigenu v buňkách (Imunohistochemie-
Column DNA Lego Kit UNIVERZÁLNÍ SOUPRAVY PRO RYCHLOU IZOLACI ČISTÉ DNA (Katalogové číslo D201 + D202)
 Column DNA Lego Kit UNIVERZÁLNÍ SOUPRAVY PRO RYCHLOU IZOLACI ČISTÉ DNA (Katalogové číslo D201 + D202) Popis Column DNA Lego Kit je základ moderní stavebnicové (Lego) soupravy pro izolaci čisté DNA různého
Column DNA Lego Kit UNIVERZÁLNÍ SOUPRAVY PRO RYCHLOU IZOLACI ČISTÉ DNA (Katalogové číslo D201 + D202) Popis Column DNA Lego Kit je základ moderní stavebnicové (Lego) soupravy pro izolaci čisté DNA různého
Bioscience Imaging Centre
 Bioscience Imaging Centre (Středisko mikroskopie) zajišťujeme moderní mikroskopické zařízení a softwary pro analýzu obrazu poradíme s plánováním experimentů (histologie, detekce proteinů a mrna) pomůžeme
Bioscience Imaging Centre (Středisko mikroskopie) zajišťujeme moderní mikroskopické zařízení a softwary pro analýzu obrazu poradíme s plánováním experimentů (histologie, detekce proteinů a mrna) pomůžeme
Moderní nástroje pro zobrazování biologicky významných molekul pro zajištění zdraví. René Kizek
 Moderní nástroje pro zobrazování biologicky významných molekul pro zajištění zdraví René Kizek 12.04.2013 Fluorescence je fyzikálně chemický děj, který je typem luminiscence. Luminiscence se dále dělí
Moderní nástroje pro zobrazování biologicky významných molekul pro zajištění zdraví René Kizek 12.04.2013 Fluorescence je fyzikálně chemický děj, který je typem luminiscence. Luminiscence se dále dělí
Ústav molekulární a translační medicíny LF UP holografický transmisní mikroskop
 ODŮVODNĚNÍ VEŘEJNÉ ZAKÁZKY ve smyslu ust. 156 zákona č. 137/2006 Sb., ve znění pozdějších předpisů (dále jen zákon ) a v souladu s ust. 2 až 8 vyhlášky č. č. 232/2012 Sb. (dále jen vyhláška) VEŘEJNÁ ZAKÁZKA
ODŮVODNĚNÍ VEŘEJNÉ ZAKÁZKY ve smyslu ust. 156 zákona č. 137/2006 Sb., ve znění pozdějších předpisů (dále jen zákon ) a v souladu s ust. 2 až 8 vyhlášky č. č. 232/2012 Sb. (dále jen vyhláška) VEŘEJNÁ ZAKÁZKA
Makrofágy a parazitární infekce
 Makrofágy a parazitární infekce Funkce makrofágů Profesionální fagocyty https://www.youtube.com/watch?v=w0-0bqoge2e Antigen-prezentující buňky (asociace s MHC II glykoproteiny) Producenti cytokinů (IL-12,
Makrofágy a parazitární infekce Funkce makrofágů Profesionální fagocyty https://www.youtube.com/watch?v=w0-0bqoge2e Antigen-prezentující buňky (asociace s MHC II glykoproteiny) Producenti cytokinů (IL-12,
Jednotné pracovní postupy zkoušení krmiv STANOVENÍ OBSAHU DEKOCHINÁTU METODOU HPLC
 Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU DEKOCHINÁTU METODOU HPLC 1 Rozsah a účel Tato metoda specifikuje podmínky pro stanovení dekochinátu metodou vysokoúčinné kapalinové chromatografie
Národní referenční laboratoř Strana 1 STANOVENÍ OBSAHU DEKOCHINÁTU METODOU HPLC 1 Rozsah a účel Tato metoda specifikuje podmínky pro stanovení dekochinátu metodou vysokoúčinné kapalinové chromatografie
Protokol 04. pšeničná bílkovina. masné výrobky. zkrácená verze
 1 Popis vzorku Podle protokolu č. 04 lze vyšetřit vzorky různých druhů masných výrobků na přítomnost pšeničné bílkoviny. 2 Detekční limit vyšetření Přítomnost pšeničné bílkoviny lze spolehlivě prokázat,
1 Popis vzorku Podle protokolu č. 04 lze vyšetřit vzorky různých druhů masných výrobků na přítomnost pšeničné bílkoviny. 2 Detekční limit vyšetření Přítomnost pšeničné bílkoviny lze spolehlivě prokázat,
ODŮVODNĚNÍ VEŘEJNÉ ZAKÁZKY
 ODŮVODNĚNÍ VEŘEJNÉ ZAKÁZKY s názvem KONFOKÁLNÍ MIKROSKOPIE - CEITEC MU II. ČÁST 2 vyhotovené podle 156 zákona č. 137/2006 Sb., o veřejných zakázkách, v platném znění (dále jen Zákon o VZ) 1. ODŮVODNĚNÍ
ODŮVODNĚNÍ VEŘEJNÉ ZAKÁZKY s názvem KONFOKÁLNÍ MIKROSKOPIE - CEITEC MU II. ČÁST 2 vyhotovené podle 156 zákona č. 137/2006 Sb., o veřejných zakázkách, v platném znění (dále jen Zákon o VZ) 1. ODŮVODNĚNÍ
DIAGNOSTICKÝ KIT PRO DETEKCI MINIMÁLNÍ REZIDUÁLNÍ CHOROBY U KARCINOMU PANKREATU
 Úvod IntellMed, s.r.o., Václavské náměstí 820/41, 110 00 Praha 1 DIAGNOSTICKÝ KIT PRO DETEKCI MINIMÁLNÍ REZIDUÁLNÍ CHOROBY U KARCINOMU PANKREATU Jednou z nejvhodnějších metod pro detekci minimální reziduální
Úvod IntellMed, s.r.o., Václavské náměstí 820/41, 110 00 Praha 1 DIAGNOSTICKÝ KIT PRO DETEKCI MINIMÁLNÍ REZIDUÁLNÍ CHOROBY U KARCINOMU PANKREATU Jednou z nejvhodnějších metod pro detekci minimální reziduální
ONLINE BIOSENZORY PŘI HLEDÁNÍ KONTAMINACE PITNÉ VODY
 ONLINE BIOSENZORY PŘI HLEDÁNÍ KONTAMINACE PITNÉ VODY Ing. Jana Zuzáková Ing. Jana Zuzáková, Doc. RNDr. Jana Říhová Ambrožová, PhD., Ing. Dana Vejmelková, PhD., Ing. Roman Effenberg, RNDr. Miroslav Ledvina
ONLINE BIOSENZORY PŘI HLEDÁNÍ KONTAMINACE PITNÉ VODY Ing. Jana Zuzáková Ing. Jana Zuzáková, Doc. RNDr. Jana Říhová Ambrožová, PhD., Ing. Dana Vejmelková, PhD., Ing. Roman Effenberg, RNDr. Miroslav Ledvina
7. Měření fluorescence při excitaci kontinuálním světlem ( steady-state )
 7. Měření fluorescence při excitaci kontinuálním světlem ( steady-state ) Steady-state měření Excitujeme kontinuálním světlem, měříme intenzitu emise (počet emitovaných fotonů) Obvykle nedetekujeme všechny
7. Měření fluorescence při excitaci kontinuálním světlem ( steady-state ) Steady-state měření Excitujeme kontinuálním světlem, měříme intenzitu emise (počet emitovaných fotonů) Obvykle nedetekujeme všechny
Intracelulární detekce Foxp3
 Intracelulární detekce Foxp3 Ústav imunologie 2.LFUK a FN Motol Daniela Rožková, Jan Laštovička T regulační lymfocyty (Treg) Jsou definovány funkčně svou schopností potlačovat aktivaci a proliferaci CD4+
Intracelulární detekce Foxp3 Ústav imunologie 2.LFUK a FN Motol Daniela Rožková, Jan Laštovička T regulační lymfocyty (Treg) Jsou definovány funkčně svou schopností potlačovat aktivaci a proliferaci CD4+
Technická specifikace předmětu veřejné zakázky
 předmětu veřejné zakázky Příloha č. 1c Zadavatel požaduje, aby předmět veřejné zakázky, resp. přístroje odpovídající jednotlivým částem veřejné zakázky splňovaly minimálně níže uvedené parametry. Část
předmětu veřejné zakázky Příloha č. 1c Zadavatel požaduje, aby předmět veřejné zakázky, resp. přístroje odpovídající jednotlivým částem veřejné zakázky splňovaly minimálně níže uvedené parametry. Část
Izolace genomové DNA ze savčích buněk, stanovení koncentrace DNA pomocí absorpční spektrofotometrie
 Izolace genomové DNA ze savčích buněk, stanovení koncentrace DNA pomocí absorpční spektrofotometrie IZOLACE GENOMOVÉ DNA Deoxyribonukleová kyselina (DNA) představuje základní genetický materiál většiny
Izolace genomové DNA ze savčích buněk, stanovení koncentrace DNA pomocí absorpční spektrofotometrie IZOLACE GENOMOVÉ DNA Deoxyribonukleová kyselina (DNA) představuje základní genetický materiál většiny
Izolace RNA. doc. RNDr. Jan Vondráček, PhD..
 Izolace RNA doc. RNDr. Jan Vondráček, PhD.. Metodiky izolace RNA celková buněčná RNA ( total RNA) zahrnuje řadu typů RNA, které se mohou lišit svými fyzikálněchemickými vlastnostmi a tedy i nároky na jejich
Izolace RNA doc. RNDr. Jan Vondráček, PhD.. Metodiky izolace RNA celková buněčná RNA ( total RNA) zahrnuje řadu typů RNA, které se mohou lišit svými fyzikálněchemickými vlastnostmi a tedy i nároky na jejich
GENOTOXICITA A ZMĚNY V GENOVÉ EXPRESI
 GENOTOXICITA A ZMĚNY V GENOVÉ EXPRESI INDUKOVANÉ PŮSOBENÍM ORGANICKÝCH LÁTEK Z PRACHOVÝCH ČÁSTIC V OVZDUŠÍ Kateřina Hanzalová Oddělení genetické ekotoxikologie Ústav experimentální medicíny AV ČR v.v.i.
GENOTOXICITA A ZMĚNY V GENOVÉ EXPRESI INDUKOVANÉ PŮSOBENÍM ORGANICKÝCH LÁTEK Z PRACHOVÝCH ČÁSTIC V OVZDUŠÍ Kateřina Hanzalová Oddělení genetické ekotoxikologie Ústav experimentální medicíny AV ČR v.v.i.
S filtračními papíry a membránou je nutno manipulovat pinzetou s tupým koncem.
 Western Blotting Příprava blotovacího sendviče... 1 Blotování... 2 Kontrola přenesení proteinů na membránu... 2 Blokování membrány... 2 Aplikace protilátek... 2 Vizualizace... 3 Vyvolání filmu... 4 Chemikálie
Western Blotting Příprava blotovacího sendviče... 1 Blotování... 2 Kontrola přenesení proteinů na membránu... 2 Blokování membrány... 2 Aplikace protilátek... 2 Vizualizace... 3 Vyvolání filmu... 4 Chemikálie
RNA Blue REAGENS PRO RYCHLOU PŘÍPRAVU ČISTÉ A NEDEGRADOVANÉ RNA (katalogové číslo R011, R012, R013)
 RNA Blue REAGENS PRO RYCHLOU PŘÍPRAVU ČISTÉ A NEDEGRADOVANÉ RNA (katalogové číslo R011, R012, R013) Upozornění: RNA Blue obsahuje fenol a další toxické komponenty. Při kontaktu s kůží je nutné omytí velkým
RNA Blue REAGENS PRO RYCHLOU PŘÍPRAVU ČISTÉ A NEDEGRADOVANÉ RNA (katalogové číslo R011, R012, R013) Upozornění: RNA Blue obsahuje fenol a další toxické komponenty. Při kontaktu s kůží je nutné omytí velkým
Studium vybraných buněčných linií pomocí mikroskopie atomárních sil s možným využitím v praxi
 Studium vybraných buněčných linií pomocí mikroskopie atomárních sil s možným využitím v praxi Petr Kolář, Kateřina Tománková, Jakub Malohlava, Hana Kolářová, ÚLB Olomouc 2013 atomic force microscopy mikroskopie
Studium vybraných buněčných linií pomocí mikroskopie atomárních sil s možným využitím v praxi Petr Kolář, Kateřina Tománková, Jakub Malohlava, Hana Kolářová, ÚLB Olomouc 2013 atomic force microscopy mikroskopie
Metody testování humorální imunity
 Metody testování humorální imunity Co je to humorální imunita? Humorální = látková Buněčné produkty Nespecifická imunita příklady:» Lysozym v slinách, slzách» Sérové proteiny (proteiny akutní fáze)» Komplementový
Metody testování humorální imunity Co je to humorální imunita? Humorální = látková Buněčné produkty Nespecifická imunita příklady:» Lysozym v slinách, slzách» Sérové proteiny (proteiny akutní fáze)» Komplementový
Aktuální výzkum kmenových buněk: ze zkumavky k terapeutickému využití
 Od fyziologie k medicíně Aktuální výzkum kmenových buněk: ze zkumavky k terapeutickému využití Tomáš Bárta, Dáša Doležalová, Aleš Hampl, Zuzana Holubcová, Josef Jaroš, Vladimír Vinarský Projekt Od fyziologie
Od fyziologie k medicíně Aktuální výzkum kmenových buněk: ze zkumavky k terapeutickému využití Tomáš Bárta, Dáša Doležalová, Aleš Hampl, Zuzana Holubcová, Josef Jaroš, Vladimír Vinarský Projekt Od fyziologie
COMET ASSAY (SINGLE CELL GEL ELECTROPHORESIS)
 COMET ASSAY (SINGLE CELL GEL ELECTROPHORESIS) OBSAH 1. Princip metody 2. Přístroje a zařízení 3. Příprava vzorků 3.1 Kultivace a sklízení buněk A549 3.2 Výpočet koncentrace buněk 3.3 Hodnocení viability
COMET ASSAY (SINGLE CELL GEL ELECTROPHORESIS) OBSAH 1. Princip metody 2. Přístroje a zařízení 3. Příprava vzorků 3.1 Kultivace a sklízení buněk A549 3.2 Výpočet koncentrace buněk 3.3 Hodnocení viability
Fluorescenční rezonanční přenos energie
 Fluorescenční rezonanční přenos energie Pokročilé biofyzikální metody v experimentální biologii Ctirad Hofr 1 Přenos excitační energie Přenos elektronové energie se uskutečňuje mechanismy zářivými nebo
Fluorescenční rezonanční přenos energie Pokročilé biofyzikální metody v experimentální biologii Ctirad Hofr 1 Přenos excitační energie Přenos elektronové energie se uskutečňuje mechanismy zářivými nebo
BOVINE BLOOD NEUTROPHILS: INFLUENCE OF ISOLATION TECHNIQUES TO SURVIVAL KREVNÍ NEUTROFILY SKOTU: VLIV IZOLAČNÍCH TECHNIK NA ŽIVOTNOST
 BOVINE BLOOD NEUTROPHILS: INFLUENCE OF ISOLATION TECHNIQUES TO SURVIVAL KREVNÍ NEUTROFILY SKOTU: VLIV IZOLAČNÍCH TECHNIK NA ŽIVOTNOST Sláma P. Ústav morfologie, fyziologie a veterinářství, Agronomická
BOVINE BLOOD NEUTROPHILS: INFLUENCE OF ISOLATION TECHNIQUES TO SURVIVAL KREVNÍ NEUTROFILY SKOTU: VLIV IZOLAČNÍCH TECHNIK NA ŽIVOTNOST Sláma P. Ústav morfologie, fyziologie a veterinářství, Agronomická
Imunochemické metody. na principu vazby antigenu a protilátky
 Imunochemické metody na principu vazby antigenu a protilátky ANTIGEN (Ag) specifická látka (struktura) vyvolávající imunitní reakci a schopná vazby na protilátku PROTILÁTKA (Ab antibody) molekula bílkoviny
Imunochemické metody na principu vazby antigenu a protilátky ANTIGEN (Ag) specifická látka (struktura) vyvolávající imunitní reakci a schopná vazby na protilátku PROTILÁTKA (Ab antibody) molekula bílkoviny
PROLIFERACE VIABILITA DIFERENCIACE (APOPTÓZA) Změna cytokinetických parametrů odráží efekt použitých modulátorů signálních drah
 CYTOKINETICKÉ PARAMETRY PROLIFERACE VIABILITA DIFERENCIACE (APOPTÓZA) Změna cytokinetických parametrů odráží efekt použitých modulátorů signálních drah PROLIFERACE Množení buněk mitózou Dostatek živin,
CYTOKINETICKÉ PARAMETRY PROLIFERACE VIABILITA DIFERENCIACE (APOPTÓZA) Změna cytokinetických parametrů odráží efekt použitých modulátorů signálních drah PROLIFERACE Množení buněk mitózou Dostatek živin,
Seminář izolačních technologií
 Seminář izolačních technologií Zpracoval: Karel Bílek a Kateřina Svobodová Podpořeno FRVŠ 2385/2007 a 1305/2009 Úpravy a aktualizace: Pavla Chalupová ÚMFGZ MZLU v Brně 1 Lokalizace jaderné DNA 2 http://www.paternityexperts.com/basicgenetics.html
Seminář izolačních technologií Zpracoval: Karel Bílek a Kateřina Svobodová Podpořeno FRVŠ 2385/2007 a 1305/2009 Úpravy a aktualizace: Pavla Chalupová ÚMFGZ MZLU v Brně 1 Lokalizace jaderné DNA 2 http://www.paternityexperts.com/basicgenetics.html
VÝZNAM REGULACE APOPTÓZY V MEDICÍNĚ
 REGULACE APOPTÓZY 1 VÝZNAM REGULACE APOPTÓZY V MEDICÍNĚ Příklad: Regulace apoptózy: protein p53 je klíčová molekula regulace buněčného cyklu a regulace apoptózy Onemocnění: více než polovina (70-75%) nádorů
REGULACE APOPTÓZY 1 VÝZNAM REGULACE APOPTÓZY V MEDICÍNĚ Příklad: Regulace apoptózy: protein p53 je klíčová molekula regulace buněčného cyklu a regulace apoptózy Onemocnění: více než polovina (70-75%) nádorů
Funkční testy: BasoFlowEx Kit FagoFlowEx Kit
 Mgr. Martin Čonka EXBIO Praha, a.s. Funkční testy: BasoFlowEx Kit FagoFlowEx Kit Funkční testy napodobení biologický procesů in vitro nehrozí nebezpečí ohrožení pacienta v průběhu testování možná analýza
Mgr. Martin Čonka EXBIO Praha, a.s. Funkční testy: BasoFlowEx Kit FagoFlowEx Kit Funkční testy napodobení biologický procesů in vitro nehrozí nebezpečí ohrožení pacienta v průběhu testování možná analýza
Fluorescenční vyšetření rostlinných surovin. 10. cvičení
 Fluorescenční vyšetření rostlinných surovin 10. cvičení Cíl cvičení práce s fluorescenčním mikroskopem detekce vybraných rostlinných surovin Princip nepřímé dvojstupňové IHC s použitím fluorochromu Fluorescenční
Fluorescenční vyšetření rostlinných surovin 10. cvičení Cíl cvičení práce s fluorescenčním mikroskopem detekce vybraných rostlinných surovin Princip nepřímé dvojstupňové IHC s použitím fluorochromu Fluorescenční
Polychromatická cytometrie - setup experimentu
 Polychromatická cytometrie - setup experimentu Polychromatická cytometrie - setup experimentu Cíl: Najít nejlepší kompromis Hladina exprese Intenzita fluorochromu Četnost subsetu buněk Kvalitativní x kvantitativní
Polychromatická cytometrie - setup experimentu Polychromatická cytometrie - setup experimentu Cíl: Najít nejlepší kompromis Hladina exprese Intenzita fluorochromu Četnost subsetu buněk Kvalitativní x kvantitativní
Optické spektroskopie 1 LS 2014/15
 Optické spektroskopie 1 LS 2014/15 Martin Kubala 585634179 mkubala@prfnw.upol.cz 1.Úvod Velikosti objektů v přírodě Dítě ~ 1 m (10 0 m) Prst ~ 2 cm (10-2 m) Vlas ~ 0.1 mm (10-4 m) Buňka ~ 20 m (10-5 m)
Optické spektroskopie 1 LS 2014/15 Martin Kubala 585634179 mkubala@prfnw.upol.cz 1.Úvod Velikosti objektů v přírodě Dítě ~ 1 m (10 0 m) Prst ~ 2 cm (10-2 m) Vlas ~ 0.1 mm (10-4 m) Buňka ~ 20 m (10-5 m)
Stanovení koncentrace (kvantifikace) proteinů
 Stanovení koncentrace (kvantifikace) proteinů Bioanalytické metody Prof. RNDr. Pavel Peč, CSc. Úvod Kritéria výběru metod stanovení koncentrace proteinů jsou založena na možnostech pro vlastní analýzu,
Stanovení koncentrace (kvantifikace) proteinů Bioanalytické metody Prof. RNDr. Pavel Peč, CSc. Úvod Kritéria výběru metod stanovení koncentrace proteinů jsou založena na možnostech pro vlastní analýzu,
Indukovaná pluripotence. Petr Vodička Liběchov 16/11/2016
 Indukovaná pluripotence Petr Vodička Liběchov 16/11/2016 Totipotentní Pluripotentní Lidské ES Myší ES LIF + FBS Feeder = vrstva podpůrných buněk Myší embryonální fibroblasty, SNL, STO bfgf + SR Feeder
Indukovaná pluripotence Petr Vodička Liběchov 16/11/2016 Totipotentní Pluripotentní Lidské ES Myší ES LIF + FBS Feeder = vrstva podpůrných buněk Myší embryonální fibroblasty, SNL, STO bfgf + SR Feeder
Cytometrická detekce intracelulárních signalizačních proteinů
 Cytometrická detekce intracelulárních signalizačních proteinů Proč? Ačkoli značení povrchových antigenů může dobře charakterizovat různé buněčné populace, neposkytuje nám informace o funkční odpovědi buňky
Cytometrická detekce intracelulárních signalizačních proteinů Proč? Ačkoli značení povrchových antigenů může dobře charakterizovat různé buněčné populace, neposkytuje nám informace o funkční odpovědi buňky
Terapeutické klonování, náhrada tkání a orgánů
 Transfekce, elektroporace, retrovirová infekce Vnesení genů Vrstva fibroblastů, LIF Terapeutické klonování, náhrada tkání a orgánů Selekce ES buněk, v nichž došlo k začlenění vneseného genu homologní rekombinací
Transfekce, elektroporace, retrovirová infekce Vnesení genů Vrstva fibroblastů, LIF Terapeutické klonování, náhrada tkání a orgánů Selekce ES buněk, v nichž došlo k začlenění vneseného genu homologní rekombinací
MIKROSKOPIE JAKO NÁSTROJ STUDIA MIKROORGANISMŮ
 Mikroskopické techniky MIKROSKOPIE JAKO NÁSTROJ STUDIA MIKROORGANISMŮ Slouží k vizualizaci mikroorganismů Antoni van Leeuwenhoek (1632-1723) Čočka zvětšující 300x Různé druhy mikroskopů, které se liší
Mikroskopické techniky MIKROSKOPIE JAKO NÁSTROJ STUDIA MIKROORGANISMŮ Slouží k vizualizaci mikroorganismů Antoni van Leeuwenhoek (1632-1723) Čočka zvětšující 300x Různé druhy mikroskopů, které se liší
Přehled histologických barvení včetně imunohistochemie
 Přehled histologických barvení včetně imunohistochemie Výukový materiál pro praktická cvičení z histologie Anna Malečková Vytvořeno v rámci projektu OP VVV Zvýšení kvality vzdělávání na UK a jeho relevance
Přehled histologických barvení včetně imunohistochemie Výukový materiál pro praktická cvičení z histologie Anna Malečková Vytvořeno v rámci projektu OP VVV Zvýšení kvality vzdělávání na UK a jeho relevance
Viková, M. : MIKROSKOPIE V Mikroskopie V M. Viková
 Mikroskopie V M. Viková LCAM DTM FT TU Liberec, martina.vikova@tul.cz Hloubka ostrosti problém m velkých zvětšen ení tloušťka T vrstvy vzorku kolmé k optické ose, kterou vidíme ostře zobrazenou Objektiv
Mikroskopie V M. Viková LCAM DTM FT TU Liberec, martina.vikova@tul.cz Hloubka ostrosti problém m velkých zvětšen ení tloušťka T vrstvy vzorku kolmé k optické ose, kterou vidíme ostře zobrazenou Objektiv
METODY STUDIA PROTEINŮ
 METODY STUDIA PROTEINŮ Mgr. Vlasta Němcová vlasta.furstova@tiscali.cz OBSAH PŘEDNÁŠKY 1) Stanovení koncentrace proteinu 2) Stanovení AMK sekvence proteinu Hmotnostní spektrometrie Edmanovo odbourávání
METODY STUDIA PROTEINŮ Mgr. Vlasta Němcová vlasta.furstova@tiscali.cz OBSAH PŘEDNÁŠKY 1) Stanovení koncentrace proteinu 2) Stanovení AMK sekvence proteinu Hmotnostní spektrometrie Edmanovo odbourávání
Cvičení č. 2: Pasážování buněk. 1) Teoretický základ
 Cvičení č. 2: Pasážování buněk 1) Teoretický základ Kultivace buněk in vitro (ve zkumavce) - Snaha o napodobení podmínek v organismu - Používání jednorázového spotřebního materiálu a speciálních chemikálií
Cvičení č. 2: Pasážování buněk 1) Teoretický základ Kultivace buněk in vitro (ve zkumavce) - Snaha o napodobení podmínek v organismu - Používání jednorázového spotřebního materiálu a speciálních chemikálií
FIA fluorescenční imunoanalýza (fluorescence immuno-assay) CIA chemiluminiscenční imunoanalýza
 FIA a CIA FIA fluorescenční imunoanalýza (fluorescence immuno-assay) CIA chemiluminiscenční imunoanalýza Značky pro antigeny a protilátky: radioizotop enzym fluorescenční sonda luminiscenční sonda kovové
FIA a CIA FIA fluorescenční imunoanalýza (fluorescence immuno-assay) CIA chemiluminiscenční imunoanalýza Značky pro antigeny a protilátky: radioizotop enzym fluorescenční sonda luminiscenční sonda kovové
Ž i v o t n o s t (= životaschopnost = vitalita = viabilita)
 Ž i v o t n o s t (= životaschopnost = vitalita = viabilita) počet živých buněk. 100 = ---------------------------------------- [%] počet všech buněk V y u ž i t í : při kultivaci buněk pro různé účely
Ž i v o t n o s t (= životaschopnost = vitalita = viabilita) počet živých buněk. 100 = ---------------------------------------- [%] počet všech buněk V y u ž i t í : při kultivaci buněk pro různé účely
Ústav molekulární a translační medicíny LF UP - cytometry
 ZADÁVACÍ DOKUMENTACE ve smyslu zákona č. 137/2006 Sb., ve znění pozdějších předpisů (dále jen zákon ) a v souladu s podmínkami pro zadávání veřejných zakázek v rámci Operačního programu Výzkum a vývoj
ZADÁVACÍ DOKUMENTACE ve smyslu zákona č. 137/2006 Sb., ve znění pozdějších předpisů (dále jen zákon ) a v souladu s podmínkami pro zadávání veřejných zakázek v rámci Operačního programu Výzkum a vývoj
ZÁVĚREČNÝ PROTOKOL O TESTOVÁNÍ BIOAKTIVNÍCH VLASTNOSTÍ LÁTKY CYTOPROTECT
 MIKROBIOLOGICKÝ ÚSTAV Akademie věd České republiky Vídeňská 1083, 420 20 Praha 4 Krč Imunologie a gnotobiologie ZÁVĚREČNÝ PROTOKOL O TESTOVÁNÍ BIOAKTIVNÍCH VLASTNOSTÍ LÁTKY CYTOPROTECT Zadání: Na základě
MIKROBIOLOGICKÝ ÚSTAV Akademie věd České republiky Vídeňská 1083, 420 20 Praha 4 Krč Imunologie a gnotobiologie ZÁVĚREČNÝ PROTOKOL O TESTOVÁNÍ BIOAKTIVNÍCH VLASTNOSTÍ LÁTKY CYTOPROTECT Zadání: Na základě
Konstrukční varianty systému pro nekoherentní korelační zobrazení
 Konstrukční varianty systému pro nekoherentní korelační zobrazení Technický seminář Centra digitální optiky Vedoucí balíčku (PB4): prof. RNDr. Radim Chmelík, Ph.D. Zpracoval: Petr Bouchal Řešitelské organizace:
Konstrukční varianty systému pro nekoherentní korelační zobrazení Technický seminář Centra digitální optiky Vedoucí balíčku (PB4): prof. RNDr. Radim Chmelík, Ph.D. Zpracoval: Petr Bouchal Řešitelské organizace:
Specifická imunitní odpověd. Veřejné zdravotnictví
 Specifická imunitní odpověd Veřejné zdravotnictví MHC molekuly glykoproteiny exprimovány na všech jaderných buňkách (MHC I) nebo jenom na antigen prezentujících buňkách (MHC II) u lidí označovány jako
Specifická imunitní odpověd Veřejné zdravotnictví MHC molekuly glykoproteiny exprimovány na všech jaderných buňkách (MHC I) nebo jenom na antigen prezentujících buňkách (MHC II) u lidí označovány jako
Protokoly Transformace plasmidu do elektrokompetentních buněk BL21 Pracovní postup:
 Protokoly Pracovní potřeby, pufry a chemikálie jsou uvedeny na konci protokolu. Pracovní postupy jsou odvozeny od těchto kitů: Champion pet160 Directional TOPO Expression Kit with Lumio Technology (Invitrogen)
Protokoly Pracovní potřeby, pufry a chemikálie jsou uvedeny na konci protokolu. Pracovní postupy jsou odvozeny od těchto kitů: Champion pet160 Directional TOPO Expression Kit with Lumio Technology (Invitrogen)
Fluorescenční mikroskopie. principy a použití
 Fluorescenční mikroskopie principy a použití Luminiscence objekt absorbuje záření určité vlnové délky, které se vnitroatomovým přeskupením změní na záření o delší vlnové délce excitace viditelné světlo,
Fluorescenční mikroskopie principy a použití Luminiscence objekt absorbuje záření určité vlnové délky, které se vnitroatomovým přeskupením změní na záření o delší vlnové délce excitace viditelné světlo,
ONKOLOGIE. Laboratorní příručka Příloha č. 3 Seznam vyšetření imunochemie Verze: 05 Strana 23 (celkem 63)
 ONKOLOGIE NÁZEV : PSA POUŽITÍ : kvantitativní stanovení celkového PSA (volného PSA i PSA v komplexu s alfa-1-antichymotrypsinem) v lidském séru. Společně s digitálním rektálním vyšetřením (DRE) se u mužů
ONKOLOGIE NÁZEV : PSA POUŽITÍ : kvantitativní stanovení celkového PSA (volného PSA i PSA v komplexu s alfa-1-antichymotrypsinem) v lidském séru. Společně s digitálním rektálním vyšetřením (DRE) se u mužů
Veronika Janů Šárka Kopelentová Petr Kučera. Oddělení alergologie a klinické imunologie FNKV Praha
 Veronika Janů Šárka Kopelentová Petr Kučera Oddělení alergologie a klinické imunologie FNKV Praha interakce antigenu s protilátkou probíhá pouze v místech epitopů Jeden antigen může na svém povrchu nést
Veronika Janů Šárka Kopelentová Petr Kučera Oddělení alergologie a klinické imunologie FNKV Praha interakce antigenu s protilátkou probíhá pouze v místech epitopů Jeden antigen může na svém povrchu nést
2) Připravte si 3 sady po šesti zkumavkách. Do všech zkumavek pipetujte 0.2 ml roztoku BAPNA o různé koncentraci podle tabulky.
 CVIČENÍ Z ENZYMOLOGIE 1) Stanovení Michaelisovy konstanty trypsinu pomocí chromogenního substrátu. Aktivita trypsinu se určí změřením rychlosti hydrolýzy chromogenního substrátu BAPNA (Nα-benzoyl-L-arginin-p-nitroanilid)
CVIČENÍ Z ENZYMOLOGIE 1) Stanovení Michaelisovy konstanty trypsinu pomocí chromogenního substrátu. Aktivita trypsinu se určí změřením rychlosti hydrolýzy chromogenního substrátu BAPNA (Nα-benzoyl-L-arginin-p-nitroanilid)
Ing. Martina Almáši, Ph.D. OKH-LEHABI FN Brno, Babákova myelomová skupina při Ústavu patologické fyziologie, LF MU, Brno
 Zpracování a využití biologického materiálu pro výzkumné účely od nemocných s monoklonální gamapatií Ing. Martina Almáši, Ph.D. OKH-LEHABI FN Brno, Babákova myelomová skupina při Ústavu patologické fyziologie,
Zpracování a využití biologického materiálu pro výzkumné účely od nemocných s monoklonální gamapatií Ing. Martina Almáši, Ph.D. OKH-LEHABI FN Brno, Babákova myelomová skupina při Ústavu patologické fyziologie,
DIAGNOSTICKÝ KIT PRO DETEKCI MINIMÁLNÍ REZIUDÁLNÍ CHOROBY MRD EGFR
 Úvod IntellMed, s.r.o., Václavské náměstí 820/41, 110 00 Praha 1 DIAGNOSTICKÝ KIT PRO DETEKCI MINIMÁLNÍ REZIUDÁLNÍ CHOROBY MRD EGFR Jednou z nejvhodnějších metod pro detekci minimální reziduální choroby
Úvod IntellMed, s.r.o., Václavské náměstí 820/41, 110 00 Praha 1 DIAGNOSTICKÝ KIT PRO DETEKCI MINIMÁLNÍ REZIUDÁLNÍ CHOROBY MRD EGFR Jednou z nejvhodnějších metod pro detekci minimální reziduální choroby
MagPurix Viral/Pathogen Nucleic Acids Extraction Kit B
 MagPurix Viral/Pathogen Nucleic Acids Extraction Kit B Kat. č. ZP02012 Doba zpracování: 45-60 minut pro MagPurix 12S 45-65 minut pro MagPurix 24 Použití Souprava MagPurix Viral/Pathogen Nucleic Acids Extraction
MagPurix Viral/Pathogen Nucleic Acids Extraction Kit B Kat. č. ZP02012 Doba zpracování: 45-60 minut pro MagPurix 12S 45-65 minut pro MagPurix 24 Použití Souprava MagPurix Viral/Pathogen Nucleic Acids Extraction
MOLEKULÁRNÍ METODY V EKOLOGII MIKROORGANIZMŮ
 MOLEKULÁRNÍ METODY V EKOLOGII MIKROORGANIZMŮ (EKO/MMEM) FLUORESCENČNÍ MIKROSKOPIE A ANALÝZA OBRAZU Použití fluorescenční mikroskopie je založeno na detekci objektů pomocí fluorochromů látek, jež se specificky
MOLEKULÁRNÍ METODY V EKOLOGII MIKROORGANIZMŮ (EKO/MMEM) FLUORESCENČNÍ MIKROSKOPIE A ANALÝZA OBRAZU Použití fluorescenční mikroskopie je založeno na detekci objektů pomocí fluorochromů látek, jež se specificky
Analýza magnetických mikročástic mikroskopií atomárních sil
 Analýza magnetických mikročástic mikroskopií atomárních sil Zapletalová 1 H., Tvrdíková 2 J., Kolářová 1 H. 1 Ústav lékařské biofyziky, LF UP Olomouc 2 Ústav chemie potravin a biotechnologií, CHF VUT Brno
Analýza magnetických mikročástic mikroskopií atomárních sil Zapletalová 1 H., Tvrdíková 2 J., Kolářová 1 H. 1 Ústav lékařské biofyziky, LF UP Olomouc 2 Ústav chemie potravin a biotechnologií, CHF VUT Brno
ANALYTICKÝ SYSTÉM PHOTOCHEM
 ANALYTICKÝ SYSTÉM PHOTOCHEM Analytický systém Photochem (firmy Analytik Jena, Německo) je vhodný pro stanovení celkové antioxidační kapacity (tj. celkové schopnosti vzorku vychytávat volné radikály) různých
ANALYTICKÝ SYSTÉM PHOTOCHEM Analytický systém Photochem (firmy Analytik Jena, Německo) je vhodný pro stanovení celkové antioxidační kapacity (tj. celkové schopnosti vzorku vychytávat volné radikály) různých
Modul IB. Histochemie. CBO Odd. histologie a embryologie. MUDr. Martin Špaček
 Modul IB Histochemie CBO Odd. histologie a embryologie MUDr. Martin Špaček Histochemie Histologická metoda užívaná k průkazu různých látek přímo v tkáních a buňkách Histochemie Katalytická histochemie
Modul IB Histochemie CBO Odd. histologie a embryologie MUDr. Martin Špaček Histochemie Histologická metoda užívaná k průkazu různých látek přímo v tkáních a buňkách Histochemie Katalytická histochemie
Renáta Kenšová. Název: Školitel: Datum: 24. 10. 2014
 Název: Školitel: Sledování distribuce zinečnatých iontů v kuřecím zárodku za využití moderních technik Monitoring the distribution of zinc ions in chicken embryo using modern techniques Renáta Kenšová
Název: Školitel: Sledování distribuce zinečnatých iontů v kuřecím zárodku za využití moderních technik Monitoring the distribution of zinc ions in chicken embryo using modern techniques Renáta Kenšová
Kmenové buňky, jejich vlastnosti a základní členění
 Kmenové buňky, jejich vlastnosti a základní členění O kmenových buňkách se v současné době mluví velmi často v nejrůznějších souvislostech. Je do nich vkládána naděje, že s jejich pomocí půjde vyléčit
Kmenové buňky, jejich vlastnosti a základní členění O kmenových buňkách se v současné době mluví velmi často v nejrůznějších souvislostech. Je do nich vkládána naděje, že s jejich pomocí půjde vyléčit
Přístroje v hematologické laboratoři
 Přístroje v hematologické laboratoři 1) Koagulometry Dělení podle automatizace Poloautomatické Automatické Dělení dle typu detekce mechanická optická háček kulička plátek optický paprsek Koagulační metody
Přístroje v hematologické laboratoři 1) Koagulometry Dělení podle automatizace Poloautomatické Automatické Dělení dle typu detekce mechanická optická háček kulička plátek optický paprsek Koagulační metody
Princip a využití protilátkových mikročipů RNDr. Zuzana Zákostelská
 Princip a využití protilátkových mikročipů RNDr. Zuzana Zákostelská Laboratoř buněčné a molekulární imunologie Odd. Imunologie a gnotobiologie MBÚ AVČR v.v.i, Praha Konference XXXIII. Imunoanalytické dny
Princip a využití protilátkových mikročipů RNDr. Zuzana Zákostelská Laboratoř buněčné a molekulární imunologie Odd. Imunologie a gnotobiologie MBÚ AVČR v.v.i, Praha Konference XXXIII. Imunoanalytické dny
Jednotné pracovní postupy zkoušení krmiv STANOVENÍ OBSAHU SEMDURAMICINU METODOU HPLC
 Strana 1 STANOVENÍ OBSAHU SEMDURAMICINU METODOU HPLC 1 Rozsah a účel Postup specifikuje podmínky pro stanovení obsahu semduramicinu v krmivech metodou vysokoúčinné kapalinové chromatografie (HPLC) v koncentračním
Strana 1 STANOVENÍ OBSAHU SEMDURAMICINU METODOU HPLC 1 Rozsah a účel Postup specifikuje podmínky pro stanovení obsahu semduramicinu v krmivech metodou vysokoúčinné kapalinové chromatografie (HPLC) v koncentračním
2) Připravte si 7 sad po pěti zkumavkách. Do všech zkumavek pipetujte 0.2 ml roztoku BAPNA o různé koncentraci podle tabulky.
 CVIČENÍ Z ENZYMOLOGIE 1) Stanovení Michaelisovy konstanty trypsinu pomocí chromogenního substrátu. Aktivita trypsinu se určí změřením rychlosti hydrolýzy chromogenního substrátu BAPNA (Nα-benzoyl-L-arginin-p-nitroanilid)
CVIČENÍ Z ENZYMOLOGIE 1) Stanovení Michaelisovy konstanty trypsinu pomocí chromogenního substrátu. Aktivita trypsinu se určí změřením rychlosti hydrolýzy chromogenního substrátu BAPNA (Nα-benzoyl-L-arginin-p-nitroanilid)
TEORETICKÝ ÚVOD. Počítání buněk
 Jméno: Obor: Datum provedení: TEORETICKÝ ÚVOD Počítání buněk Jednou z nezbytných dovedností při práci s biologickým materiálemk je stanovení počtu buněk ve vzorku. V současné době se v praxi k počítání
Jméno: Obor: Datum provedení: TEORETICKÝ ÚVOD Počítání buněk Jednou z nezbytných dovedností při práci s biologickým materiálemk je stanovení počtu buněk ve vzorku. V současné době se v praxi k počítání
