UNIVERZITA KARLOVA V PRAZE FARMACEUTICKÁ FAKULTA V HRADCI KRÁLOVÉ
|
|
|
- Dagmar Křížová
- před 6 lety
- Počet zobrazení:
Transkript
1 UNIVERZITA KARLOVA V PRAZE FARMACEUTICKÁ FAKULTA V HRADCI KRÁLOVÉ KATEDRA FARMAKOLOGIE A TOXIKOLOGIE BAKALÁŘSKÁ PRÁCE 2009 Gabriela Kuzmínová 1
2 UNIVERZITA KARLOVA V PRAZE FARMACEUTICKÁ FAKULTA V HRADCI KRÁLOVÉ Katedra farmakologie a toxikologie BRONCHOALVEOLÁRNÍ LAVÁŽ U ONEMOCNĚNÍ DÝCHACÍCH CEST (bakalářská práce) Vedoucí bakalářské práce: PharmDr. Marie Vopršalová, CSc. Odborný školitel: MUDr. Antonín Krpenský Konzultant: MUDr. Antonín Krpenský Hradec Králové 2009 Gabriela Kuzmínová 2
3 Poděkování PharmDr. Marie Vopršalová, CSc. MUDr. Antonín Krpenský MUDr. Jiří Vlček Za cenné rady a připomínky 3
4 PROHLÁŠENÍ Prohlašuji, že tato práce je mým původním autorským dílem, které jsem vypracovala samostatně. Veškerá literatura a další zdroje, z nichž jsem při zpracování čerpala, jsou uvedeny v seznamu použité literatury a v práci řádně citovány. Gabriela Kuzmínová 4
5 OBSAH ABSTRAKT SEZNAM ZKRATEK 1. ÚVOD 2. TEORETICKÁ ČÁST 2.1 Stavba dýchacího systému 2.2 Mikroskopická anatomie plic 2.3 Cévní zásobení 3. TECHNIKA ODBĚRU 3.1 Místo provedení BAL, personální a věcné vybavení 3.2 Metodika provedení BAL 3.3 Kontraindikace provedení BAL 3.4 Komplikace BAL 3.5 Doporučená opatření při provedení BAL u rizikových nemocných 4. ZPRACOVÁNÍ BAL 4.1 Vyšetření BAL sestrou 4.2 Cytologické vyšetření Barvení Hematoxylin- Eosin Barvení dle May - Grunwald- Giemsy Barvení PAS Barvení alciánovou modří dle Lisona Barvení dle Grama 5
6 4.2.6 Barvení dle Perlse Barvení dle Grocotta 4.3 Základní hodnoty 4.4 Klinické použití 4.5 Další možná využití BAL 5. MIKROBIOLOGICKÉ VYŠETŘENÍ 5.1 Vyšetření vzorku z DDC na nespecifickou mikroflóru mikroskopicky a kultivačně 5.2 Vyšetření vzorku na původce TBC mikroskopicky a kultivačně 5.3 Vyšetření antigenu herpetických virů HSV1 a HSV2 a CMV imunoflorescencí 5.4 Vyšetření vzorků na původce tuberkulosy BacT/ ALERT 3D 5.5 CER test, Influenza A+ B test 5.6 Výstupy mikrobiologických vyšetření 6. ZÁVĚR 7. OBRÁZKOVÁ PŘÍLOHA 8. SEZNAM LITERATURY 6
7 Gabriela Kuzmínová : Bronchoalveolární laváž u onemocnění dýchacích cest ABSTRAKT Východiska práce: Součástí diagnostiky onemocnění plic je metoda BAL ( bronchoalveolární laváž) umožňující získat buněčné i nebuněčné složky obsahu dolních dýchacích cest a alveolů. Jedná se o metodu nenáročnou, šetrnou, bezpečnou a opakovatelnou. Metody vyšetření: Základní metodou je cytologické vyšetření spočívající v celulární diferenciaci tedy určení buněčného typu. Součástí vyšetření je obvykle mikrobiologické vyšetření, kultivační i serologické. Výsledky vyšetření: Poměr jednotlivých buněčných typů je důležitý pro zařazení do jednotlivých skupin intersticiálních plicních onemocnění, výsledek bakteriologického vyšetření je často rozhodující při určení etiologie procesu. Metoda BAL je též velmi důležitá při monitorování průběhu onemocnění, především při posuzování jeho aktivity a odpovědi na léčbu. Závěr: Práce podává přehled indikací k vyšetření BAL, metod vyšetření BAT, cytologických a mikrobiologických výsledků vyšetření BAT. BAL je důležitou součástí komplexní diagnostiky tzv. intersticiálních plicních chorob. 7
8 Gabriela Kuzmínová: The bronchoalveolar lavage in the diagnosis of respiratory tract diseases ABSTRACT Thesis: A technique of the bronchoalveolar lavage (BAL) is one of the diagnostic procedures used in diagnosis of pulmonary diseases. It enables to acquire cellular and non-cellular components of the lower respiratory tract and alveoli. BAL represents a minimally invasive, harmless, safe and repeatable method. Methods: The basic method is the cytological examination which consist on the differencial cell count, precisely a particular cell type designation. It also includes the microbiological examination, cultivation and serology. Results: The accurate representation of the cell types and numbers is important for the clasiffication of intersticial pulmonary diseases. The microbiological examination often unable to determine the etiology of a process. BAL is also very important for monitoring of diseases, especially for evaluation of disease activity and response to therapy. Conclusion: This thesis presents an overview of clinical indications for the performance of bronchoalveolar lavage (BAL), principles of examination techniques for BAL sampling, results of the cytological and microbiological examination of BAL samples. The bronchoalveolar lavage is an important part of complex diagnostics of intersticial pulmonary diseases. 8
9 SEZNAM ZKRATEK ACH ARDS AV BAL BAT bb. DDC Dg. FR - alveolární chodbičky - syndrom dechové tísně dospělých, šoková plíce - alveolární váčky - bronchoalveolární laváž - bronchoalveolární tekutina - buňky - dolní dýchací cesty - diagnóza - fyziologický roztok CHOPN - chronická obstrukční plicní nemoc SP PS PJ IPF PAS HE - segmentální průdušky - plicní segment - Pneumocystis jiroveci( carinii) - Idiopatická plicní fibróza - Periodic Acid Schiff - Hematoxylin- Eosin MEM - minimální esenciální medium HSV CMV KZ - Herpes simplex virus - Cytomegalovirus - kontrolní zóna 9
10 1. ÚVOD Plíce jsou základním orgánem, který zabezpečuje životně důležité funkce a jejich onemocnění přináší často ohrožení života. K velmi častým plicním onemocněním, jejichž incidence se díky civilizačním faktorům stále zvyšuje, patří chronická obstrukční plicní nemoc (CHOPN) se stále narůstající úmrtností. (21) Zatím co od poloviny 20 století zaznamenáváme významný pokles úmrtnosti na koronární choroby, cévní mozkovou příhodu nebo jiná vaskulární onemocnění, úmrtnost na chronickou obstrukční plicní nemoc za posledních padesát let stoupla o 163 procent. V roce 2020 lze předpokládat CHOPN jako nejčastější příčinu úmrtí ve skupině respiračních onemocnění. (19) Z těchto důvodů má diagnostika a léčba plicních nemocí mimořádný význam. V rámci lékařského oboru pneumologie je prováděna komplexní diagnostika a léčba nemocných s plicními chorobami. Hlavní diagnostická a léčebná činnost oboru je zaměřena na zánětlivá onemocnění průdušek a plic, skupinu difusních intersticiálních plicních onemocnění, nádorová onemocnění a diagnostiku tzv. periferních plicních lézí nejasné etiologie. (1) Důležitou součásti oboru je též určení etiologie plicního postižení u imunokompromitovaných nemocných (AIDS, orgánové transplantace, transplantace krvetvorných buněk, intenzivní chemoterapie či radioterapie). (2) Ke stanovení některých diagnóz může významnou mírou přispět i výsledek BAL, jak je tomu při průkazu syndromu alveolární plicní hemoragie, při eozinofilní pneumonii, borelióze, hypersenzitivní pneumonii, azbestóze, sarkoidóze a ostatních formách intersticiálních plicních procesů. Jednoznačný etiologicko- diagnostický význam mají výsledky BAL v průkazu alveolární proteinózy, plicní granulomatózy z Langerhansových buněk a detekci zhoubných nádorů. (1, 2, 3) Bronchoalveolární laváž (BAL) je metoda umožňující získat buněčné i nebuněčné složky z dolních dýchacích cest a alveolů. Vyšetřením bronchoalveolární tekutiny (BAT) tak lze stanovit etiologii celé řady plicních onemocnění. (4,6) Metodika BAL je důležitou součástí monitorování průběhu plicních onemocnění, především k možnosti posouzení aktivity onemocnění a odpovědí na léčbu. Na základě včas provedené BAL a na základě komplexního vyšetření BAT lze v mnoha případech zahájit správnou léčbu. (13, 15) Jedná se o metodu nenáročnou, šetrnou, bezpečnou a opakovatelnou. 10
11 Cílem práce je podat ucelený přehled o indikacích a praktických postupech při zpracování vzorků získaných odběrem bronchoalveolární výplachové tekutiny u pacientů. 2. TEORETICKÁ ČÁST 2.1 STAVBA DÝCHACÍHO SYSTÉMU Dýchací systém se sestává ze základních dvou částí: 1. Dýchací cesty 2. Plíce Dýchací cesty se dělí na horní a dolní. Horní dýchací cesty - dutina nosní - nosohltan - hltan (na hltan se napojuje hrtan) Dolní dýchací cesty - průdušnice - průdušky - bronchiální strom 11
12 Jednotlivé oddíly dýchací trubice: 1. Dutina nosní (cavum nasi) - kostěný základ je tvořen horní čelistí, kostí čelní a čichovou a kůstkami nosními. Dutina nosní je spojena s vedlejšími dutinami nosními uloženými v horní čelisti (sinus maxilaris), v kosti čelní (sinus frontalis) a v kosti čichové a klínové (sinus ethmoidealis a sphenoidealis). (18) 2. Nosohltan (nasopharynx) - je část hltanu, kterým je převáděn vdechnutý vzduch z dutiny nosní do hrtanu. Zvednutí měkkého patra při polykání oddělí dutinu nosní od dutiny ústní. (18) 3. Hrtan (larynx ) - spojuje hltan s průdušnicí. Od hltanu je oddělen příklopkou hrtanovou (epiglottis), která při polykání brání vstupu potravy do dýchacích cest. (18) 4. Průdušnice (trachea) která je pokračováním hrtanu, se rozděluje na dvě průdušky. Průdušnice je trubice vystužená hyalinními chrupavkami prstencovitého tvaru. Chrupavky jsou v zadní části otevřené, spojené tuhou vazivovou blanou a kruhovitě uspořádanými snopečky hladkého svalu. Na vnitřní straně je průdušnice vystlaná sliznicí dýchacích cest s víceřadým cylindrickým epitelem s řasinkami. Ve slizničním vazivu jsou uloženy drobné smíšené žlázky. (18) Průdušnice se na dolním konci rozvětvuje na dvě hlavní průdušky (bronchy) pro pravou a levou plíci. 5. Průdušky (bronchy)- Hlavní průdušky se větví na průdušky druhotné pro jednotlivé laloky plicní, které se pak rozvětvují až na malé průdušinky (bronchioly), vstupující do plicních lalůčků, kde se dále větví ve vyklenuté alveolární váčky (alveoly). Stavba průdušky je prakticky stejná jako průdušnice. U malých průdušek a průdušinek se postupně zmenšují chrupavky, až úplně vymizí. (18) 12
13 Stavba stěny (malé průdušky a průdušinky): 1. Sliznice (mukóza) 2. Svalová vrstva (tunica muscularis) 3. Vazivově elastická vrstva Sliznice Je pokryta víceřadým cylindrickým epitelem s řasinkami, mezi bb.cylindrickými jsou četné pohárkové bb., vylučující hlen. Průdušky se zmenšují a víceřadý cylindrický epitel přechází ve dvouřadý až jednořadý. Pod epitelem je vrstvička slizničního vaziva (lamina propria) s četnými elastickými vlákny a smíšeným typem žlázek. (18) Svalová a vazivově elastická vrstva Je složená z tenkých snopečků hladkého svalstva a kruhovitě uspořádaných elastických vláken. Nejzevnější část stěny průdušky tvoří vrstva vazivově elastická, tvořená elastickým vazivem s velkým množstvím podélně probíhajících elastických vláken. V této vrstvě jsou uloženy drobné hyalinní chrupavky, které u malých průdušek zcela vymizí. (18) 13
14 2.2 MIKROSKOPICKÁ ANATOMIE PLIC Plíce: Jsou párový orgán uložený v dutině hrudní vystlané pohrudnicí. Povrch plic je kryt poplicnicí. Ve štěrbině mezi pohrudnicí a poplicnicí je tlak nižší, než je tlak atmosférický, což je důležité pro mechaniku dýchání. Pravou plíci (pulmo dexter) tvoří tři laloky, levou plíci (pulmo sinister) dva laloky, které jsou dále děleny fisurami (rýhami) na jednotlivé plicní segmenty. (18) Každý lalok je rozdělen na velký počet plicních lalůčků. Rozdělení v lalůčky je dobře patrné na plíci dospělého člověka jako šedo-černé mramorování, podmíněné tím, že se do vaziva mezi lalůčky ukládají částečky prachu a sazí, jež se dostanou do plic s vdechovaným vzduchem. Plicní laloky a lalůčky odpovídají rozvětvení průdušek. (18) Hlavní průduška se rozvětvuje v druhotné průdušky (lalokové) pro jednotlivé laloky plicní (v pravé plíci jsou tří a v levé jsou dvě). Tyto lalokové průdušky se větví na průdušky segmentální (v pravé plíci je deset segmentů a v levé plíci je osm až devět segmentů). Plicní segmenty jsou anatomické jednotky plic (V= 60-80cm 2 ). Segmentální průduška se dělí na subsegmentální průdušky a to opakovaně pokračuje až po 11 generaci. Dále pokračují průdušinky, které vedou vzduch do plicních lalůčků. Plicní lalůček má pyramidový tvar, představuje mikroskopickou jednotku plic (plicních lalůčků je asi podle velikosti plicního segmentu). (18) V plicním lalůčku (lobulus) dochází k dělení na větší počet tzv. koncových průdušinek (terminální bronchioly). Každý terminální bronchiolus se dále dělí ve 2 respirační bronchioly, které se větví na 2 a více alveolárních chodbiček, které svým konečným rozšířením vytvářejí alveolární váčky. Alveolární chodbičky a alveolární váčky se vyklenují v polokulovité plicní sklípky (alveoly). ACH a AV spolu s alveoly, které přísluší jednomu respiračnímu bronchiolu, tvoří útvar podobný hroznu, zvaný acinus. Plicní lalůček je tvořen z velkého počtu acinů,kde dochází k výměně plynů. Stěnu acinů tvoří respirační epitel a retikulárně-elastická blanka, protkaná hustou sítí krevních kapilár. (18) Část epiteliálního krytu alveolů, tzv. granulované pneumocyty obsahují granula (dipalmitát lecitinu), která kontinuálně uvolňují a pokrývají vnitřní stěnu alveolů látkou v podobě velice tenoučkého filmu nazývaného surfaktant nebo linig komplex, který zabraňuje splasknutí plicních sklípků. Do alveolů se v různém počtu odlučují fagocytující buňky (alveolární makrofágy) s černými či hnědými zrnky prachu, nazývající se proto buňky prachové (či koniofágy). (18) 14
15 2.3 CÉVNÍ ZÁSOBENÍ Po vstupu do laloku se plicní tepna (arteria pulmonalis) dělí podél bronchiálního větvení. Její tenčí větve přechází do kapilární sítě alveolárních stěn. Bronchiální tepny vycházejí z aorty nebo interkostálních arterií, nedosahují však až do acinů. Přivádí okysličenou krev a zásobují bronchiální stěnu, uzliny a intralobulární pojivovou tkáň. Bronchiální žíly nejsou do úrovně velkých bronchů dobře ohraničeny a ústí do duté žíly. Mezi bronchiálním a plicním oběhem existují anastomózy (přemostění), což znamená, že 25% krve z obsahu bronchiálních arterií se vrací do pravé síně cestou bronchiálních žil, 75% této krve jde plicními žílami do levé síně. (20) 15
16 3. TECHNIKA ODBĚRU BAT 3.1 MÍSTO PROVEDENÍ BAL, PERSONÁLNÍ A VĚCNÉ VYBAVENÍ Technika BAL je používaná v řadě modifikací. Vyšetření se provádí nejčastěji na bronchoskopickém sálku. V případě těžkého stavu pacienta je možné provedení BAL na lůžku. (10) Vyšetření provádí flexibilním bronchoskopem lékař a nejméně jedna sestra školená v endoskopických výkonech v dolních dýchacích cestách. (17) K výplachu se používá ml fyziologického roztoku (FR), který je temperován na 37 0 C. K temperování FR se nejlépe hodí ohřívač infuzních roztoků, jsou však možná i jiná řešení. Pro bakteriologické vyšetření BAT je nejvhodnější pufrovaný (méně kyselý) FR, ve kterém bakterie déle přežívají. (13) 3.2 METODIKA PROVEDENÍ BAL Premedikace se provádí podle místních zvyklostí. U opakovaně vyšetřovaných pacientů a u neklidných nemocných je vhodné doplnit premedikaci aplikací 1 ml Midazolanu (Dormicum= benzodiazepin, ampule 1ml, lze aplikovat intranasálně) nebo použijeme Mesocain. (7) Lokální anestezie se provádí opět podle místních zvyklostí. Při aplikaci lokálního anestetika kanálem fibrobronchoskopu je nutné zabránit kontaminaci BAT, která by mohla ovlivnit zejména výsledky mikrobiologického vyšetření. Ze stejného důvodu není vhodné iniciální odsávání bronchiálního sekretu a aplikace mukolytik kanálem fibroskopu před zahájením BAL. (12, 13) Poloha nemocného se volí podle jeho klinického stavu. BAL se provádí z té části bronchiálního stromu, která ventiluje nejvíce postiženou oblast plic. V případě difúzního postižení a v případě negativního nálezu na skiagramu hrudníku a na HRCT skenech se vyplachuje oblast ze středního laloku pravé plíce, či linguly plíce levé. Tyto části jsou pro odběr z anatomických důvodů nejpřístupnější a přinášejí o 20 % větší množství buněk v sedimentu, než v případě odběru z dolních laloků. Při postižení více laloků nebo segmentů je doporučeno, pokud to stav pacienta dovolí, provést BAL ze dvou postižených míst. (16) V současné době je při provádění BAL nejčastější užití flexibilního bronchoskopu o průměru 8 mm. Fibrobronchoskop se zavádí do segmentálního nebo subsegmentálního bronchu tak, aby byl vzduchotěsně zaklíněn a aby bylo optikou fibroskopu patrno další bronchiální větvení. 16
17 Aplikace FR se provádí v několika frakcích (20-50 ml), rychlostí přibližně 5 ml za sekundu, vždy s následným zpětným odsátím. Pokud nemocný dobře spolupracuje, vyzveme jej, aby po instilaci FR jednou či dvakrát klidně vdechl. Pak provedeme zpětnou aspiraci. Množství aplikovaného FR se řídí především návratností tekutiny, která by neměla poklesnout pod 50%. Pro vyšetření diferenciálního rozpočtu buněk stačí, při návratnosti větší než 50%, celkové množství 150 ml FR. Obvykle se používá aplikace 4 x 50 ml FR. (12) Po ukončení BAL vyzveme nemocného, aby několikrát lehce zakašlal a odsajeme zbytky lavážní tekutiny. (13, 17) 3.3 KONTRAINDIKACE PROVEDENÍ BAL Jako kontraindikace BAL jsou nejčastěji uváděny následující stavy: 1. Kritický stav nemocného. To znamená takový stav, kdy je jasné, že stanovení etiologie a zahájení správné léčby nepovede k oddálení úmrtí. 2. Krvácivé projevy nezvládnutelné odpovídající léčbou (těžká krvácení z nosu, hemateméza, krvácení ze střev, masivní hemoptoe). Počet trombocytů a hodnoty hemokoagulačních vyšetření nejsou při rozhodování o provedení BAL rozhodující. 3. Čerstvý infarkt myokardu. 4. Těžké nebo čerstvě vzniklé poruchy srdečního rytmu. 5. Přes inhalaci kyslíku přetrvávající těžká hypoxémie pod 6 kpa Jako relativní komplikace jsou označovány bronchiální obstrukce, bronchiální hyperaktivita, nestabilní angina pectoris a urémie. 3.4 KOMPLIKACE BAL BAL je velmi šetrná metoda, ale u malého procenta vyšetřovaných se po BAL mohou obvykle jen přechodně objevit na skiagramu hrudníku prchavé infiltráty, teplota, malé vykašlávání krve, poslechový nález pískotů, vrzotů nebo chrupků na plicích, pokles parciálního tlaku kyslíku v arteriální krvi a změny v hodnotách funkčního vyšetření plic. (15,17) 17
18 3.5 DOPORUČENÁ OPATŘENÍ PŘI PROVEDENÍ BAL U RIZIKOVÝCH NEMOCNÝCH U rizikových nemocných jsou při výkonu doporučena tato opatření: 1. Podávání kyslíku nosní sondou nebo brýlemi. 2. U nemocných s bronchiálním astmatem podání kortikosteroidů 2 hodiny před vyšetřením. 3. Podání beta-sympatomimetik během premedikace u nemocných s asthma bronchiale. 4. Sledování srdečního rytmu pomocí kardiomonitoru u nemocných po opakovaných srdečních infarktech a u nemocných s poruchami srdečního rytmu. 5. Kontinuální sledování sycení krve kyslíkem pulzním oxymetrem. 18
19 4. ZPRACOVÁNÍ BAL 4.1 ZPRACOVÁNÍ BAL SESTROU Pokud je v materiálu makroskopicky přítomen hlen, BAT filtrujeme, např. přes gázu. V případě provedení BAL z více oblastí musíme zpracovat BAT z každé oblasti zvlášť. První porci BAT, reprezentující převážně obsah bronchů vyšetřujeme vždy zvlášť. Další porce se slévají dohromady do sterilní umělohmotné nádoby, ze které se materiál rozděluje do sterilních zkumavek. V indikovaných případech odebíráme pro mikrobiologické vyšetření anaerobní odběr pro kultivační vyšetření anaerobů. Odběr se provádí zvlášť do stříkačky s jehlou zabodnutou do zátky. K mikrobiologickému vyšetření odesíláme vzorek bezprostředně po dokončení výkonu. Ostatní vzorky by měly být vyšetřeny do dvou hodin po odběru, aby nedošlo k rozpadu buněk. Vhodný je transport v polystyrénové přepravce s ledem. Pro mikrobiologické vyšetření je důležitý údaj na žádance, kterými antimikrobiálními léky (především antibiotiky) byl a je nemocný léčen. (3,5,15) 4.2 CYTOLOGICKÉ VYŠETŘENÍ Materiál se zasílá do laboratoře co nejdříve po odběru. V laboratoři se filtrací přes gázu tekutina zbaví hlenu a pěny, ze které se zhotoví samostatný nátěr. Potom změříme celkové množství BAT. Použitá délka centrifugace je určována snahou o minimalizaci mechanického poškození buněk, obvykle tedy centrifugujeme 5 minut při 1500 otáčkách za minutu. (24) Zpracování materiálu pro cytologické vyšetření je nejvhodnější pomocí cytocentrifugy. Dalšími možnostmi jsou sedimentace v cytosedimentační komůrce nebo použití běžné centrifugy. Hodnocení celkového počtu bb. v BAT se provádí pomocí hemocytometru nebo v Bürkerově komůrce. V naší cytologické laboratoři používáme Bürkerovu komůrku. (24) Sediment BAT se pipetou přenese do Bürkerovy komůrky a počítá množství bb. v 25 velkých čtvercích. Toto množství vynásobíme 1000 x a dostaneme celkový počet buněk v 1 ml. Celkové množství BAT v ml násobené počtem buněk v 1 ml pak odpovídá celkovému množství buněk v BAT. Buněčný sediment z centrifugy necháme zaschnout a následně fixujeme metanol-etherem (poměr 1:1) nebo komerčně vyráběným fixativem Concyton ve spreji. (24) Následuje barvení, při kterém se nejčastěji používá barvení dle May- Grünwald- Giemsy a Hematoxylin- Eosin (HE). 19
20 Ve speciálních případech je indikováno použití barvení PAS, nebo kombinované metody PAS-alcian blue, barvení dle Grama nebo stíbřící metody dle Gomoriho či Grocotta (detekující například přítomnost Pneumocystis carinii). Barveni toluidinovou modří je vhodné pro rozpoznání žirných bb., barvení dle Perlse k detekci železa a siderofágů. (24) Při hodnocení buněčného rozpočtu je doporučováno prohlédnout minimálně 300, lépe 600 bb. (24) Metodiky barvení Barvení Hematoxylin Eosin (HE) 1. Mayerův hematoxylín 10 minut 2. Vodovodní voda modrání 10 minut 3. Eosin 3 minuty 4. Oplach vodou 5. Odvodnění v alkoholu 2x 5 minut 6. Projasnění v xylenu 2x 5 minut 7. Montáž do solakrylu Výsledky barvení: Jádra - modře Erytrocyty -oranžovočerveně Vazivo -červeně Sval -červeně Chrupavka -modře (25) 20
21 4.2.2 Barvení dle May - Grünwald- Giemsy 1. May- Grünwald neředěný 7-10 minut 2. Oplach destilovanou vodou 3 minuty 3. Giemsa- Romanovský 20 minut (ředění barvičky: Na 10 ml destilované vody se přidá 15 kapek barvičky) 4. Oplach vodovodní vodou a diferenciace (kontrola pod mikroskopem) 5. Necháme zaschnout 6. Projasnění xylenem 5 minut 7. Montáž do solakrylu Výsledky barvení: Eosinofilní složky - v různých odstínech růžové až červené Basofilní složky - v různých odstínech světle modré až tmavomodré (25) Barvení PAS (Periodic Acid Schiff) - k průkazu polysacharidů 1. Kyselina jodistá 0,6 % 5 minut 2. Oplach destilovanou vodou 3. Schiffovo reagens 5-10 minut 4. Praní ve vodovodní vodě 10 minut 5. Mayerův hematoxylin 7 minut 6. Praní ve vodovodní vodě modrání 10 minut 7. Odvodnění alkoholem 8. Projasnění xylenem 9. Montáž do solakrylu 21
22 Výsledky barvení: Jádra - modře Vazivo - žlutooranžově Erytrocyty - žlutě Polysacharidy - červenofialově (25) Barvení Alciánovou modří dle Lisona průkaz kyselých mukopolysacharidů 1. Weigertův hematoxylin 10 minut 2. Oplach vodou 3. Kyselý alkohol diferenciace 1 minutu 4. Oplach vodou 5. Alciánová modř 10 minut 6. Oplach vodou 7. Kyselina fosfomolibdenová 1% 10 minut 8. Oplach vodou 9. Kyselý fuchsin 1 % 5 minut 10. Odvodnění alkoholem 11. Projasnění xylenem 12. Montáž Výsledky barvení: Mukopolysacharidy, granula žirných bb.- modrozeleně Kolagen, fibrily-červeně 22
23 Svalovina, cytoplasma - žlutě Jádra bb.- modře (25) Barvení dle Grama - průkaz bakterií 1. Suché nátěry 2. Genciánová violeť 1 minutu 3. Oplach Lugolovým roztokem 4. Lugolův roztok 1 minutu 5. Alkohol- aceton 1:1 (oplachování, dokud odtéká modrá barva) 6. Destilovaná voda 1-3 minuty 7. Jádrová červeň 1-3 minuty 8. Destilovaná voda (2xoplach) 9. Nechat zaschnout 10. Odvodnit 11. Projasnit 12. Montáž do solakrylu Výsledky barvení: Jádra - červeně Gram pozitivní bakterie - modře Gram negativní bakterie - červeně Fibrin se nebarví. (25) 23
24 4.2.6 Barvení metodou dle Perlse - průkaz železa 1. Směs 1:1 (ferrokyanid draselný 2% 1díl + HCL 1 díl) 30 minut 2. Vodovodní voda 15 minut 3. Jádrová červeň 5-10 minut 4. Opláchnutí vodou 5. Odvodnění 6. Projasnění 7. Montáž do solakrylu Výsledky barvení: Jádra - červeně Železo - modrozeleně (25) Barvení dle Grocotta impregnační metoda pro detekci plísní 1. Kyselina chromová 5% vodný roztok při pokojové teplotě 1 hodinu 2. Vodovodní voda prát 1 minutu 3. Siřičitan sodný 1% 5 minut 4. Vodovodní voda prát 10 minut 5. Destilovaná voda opláchnutí 3x 6. Impregnační roztok (předehřát a pak v termostatu při 56 0 C v uzavřené kyvetě 60 minut - kontrola pod mikroskopem) 7. Opláchnutí destilovanou vodou 8. Chlorit zlatitý 1% 5 minut 9. Opláchnutí destilovanou vodou 24
25 10. Sirnatan sodný 2% 5 minut 11. Vodovodní voda (praní 5-10 minut) 12. Jádrová červeň 5-10 minut 13. Opláchnutí destilovanou vodou 14. Odvodnění 15. Projasnění 16. Montáž do solakrylu Výsledky barvení: Jádra - červeně Plísně - šedomodře až černě (25) Příprava impregnačního roztoku A- Do 100 ml3% hexamethylentetraaminu přidáme 5 ml 5% dusičnanu stříbrného. Roztok vydrží v lednici měsíc. B- Do 50 ml destilované vody přidáme 4 ml 5% boraxu. K impregnaci použijeme roztok A a B v poměru 1:1. (25) 25
26 4.3 ZÁKLADNÍ HODNOTY Celkové množství bb. v lavážní tekutině je značně variabilní, obvykle se pohybuje v rozmezí 5-10 milionů bb. Větší celkové množství bb. je u kuřáků. Při diferenciaci je nejčastějším buněčným typem makrofág, často s přítomností fagocytovaného pigmentu. Počet makrofágů u dospělého zdravého člověka představuje obvykle 93 +/- 5 % veškeré buněčné populace. Většina makrofágů pochází z krevních monocytů a jen menší část vzniká jejich lokální proliferací. Při diferenciaci mohou být ojedinělé záměny makrofágů za epiteliální bb., pocházející z bronchiolární proliferace. (31) Obvyklý počet lymfocytů není vyšší než 7+/-1 %. Dříve uváděné vyšší hodnoty (do 20 %)byly patrně způsobeny záměnou malých makrofágů a lymfocytů. Za horní hranici normy množství lymfocytů je dnes považováno 15 % celkového počtu bb., většinou však jde o hodnoty podstatně nižší. Při bližší typizaci lymfocytů T a B řady pomocí imunomarkerů je poměr obdobný jako v periferní krvi, tedy 73 % T lymfocytů, 7 % B lymfocytů a zbytek tzv. null cells, nereagujích s žádnou protilátkou. (31) Zvýšené množství lymfocytů v BAT bývá obvyklé u případů aktivní formy sarkoidózy, hypersenzitivní pneumonie( exogenní alergické alveolitis), alveolitid komplikujících virózy, u cytomegalovirové pneumonie a alveolitid různé jiné etiologie (např. revmatoidní nebo polékové). Zvýšení lymfocytů bývá též u tuberkulózy a u některých pneumonií. (31) Počet granulocytů všech typů obvykle nepřesahuje 1 % celkového buněčného množství. Zvýšení jejich počtu je často způsobeno kontaminací obsahem bronchů (současně je zvýšen i počet bronchiálních epitelií), zvýšení je rovněž u kuřáků (až do 4 %) a při zánětlivých onemocněních bronchů. (31) Počet respiračních epitelií nepřekračuje 3 %. Poněkud větší je u chronických bronchitid, kuřáků a bronchiálních kontaminací. 26
27 4.4 KLINICKÉ VYUŽITÍ Nejčastější užití BAL je při komplexní diagnostice tzv. intersticiálních plicních chorob. Jde o širokou skupinu (asi 100 onemocnění) zánětů terminálních částí dýchacích cest, tedy bronchiolů a alveolů různé etiologie, často s progresivním vývojem, při kterém dochází k postupné fibrotizaci sept a dezintegraci plicního parenchymu. U této skupiny onemocnění nebývá obvyklé postižení bronchů a tak hodnoty BAT odráží stav zánětlivého procesu plicního intersticia shodným rozložením zánětlivých a imunokompetentních bb. Průkaz tohoto identického buněčného poměru přinesla řada publikací, porovnávajících poměr různých typů zánětlivých buněk v BAT a plicních biopsiích. Při histologickém vyšetření je obraz alveolitídy charakterizován především zvýšenou buněčností sept zánětlivým infiltrátem a proto kvantitativní hodnocení intenzity celulizace metodou BAL je pro odhad dynamiky průběhu onemocnění velmi přínosné. (31) Základní změnou v sedimentu BAT u onemocnění plicního intersticia je zvýšení celkové buněčnosti (obvykle 2-5x). Analýza zmnožených zánětlivých a imunokompetentních bb. může být pomocníkem při diferenciaci onemocnění této skupiny. Vzhledem k tomu, že u všech onemocnění je obvykle zvýšený počet makrofágů s důležitým faktorem při dělení skupiny stává poměr lymfocytů a neutrofilů. (31) Z tohoto pohledu lze celou skupinu dělit na dvě části: 1. Alveolitidy s vysokým poměrem lymfocytů 2. Alveolitidy s normálním poměrem lymfocytů 27
28 Alveolitidy s vysokým poměrem lymfocytů (Lymfocytárně predominantní skupina) Hlavními představiteli této skupiny jsou sarkoidóza a exogenní alergická alveolitis (hypersenzitivní pneumonie). Jejich histologický obraz je charakterizován tvorbou intersticiálních granulomů a současnou infiltrací intersticia lymfocyty. Zvýšení počtu lymfocytů v lavážní tekutině, vyvolávají především T lymfocyty. U sarkoidózy se současně snižuje jejich počet v krvi. K odlišení sarkoidózy a hypersenzitivních pneumonitid je důležitý poměr mezi dvěma funkčními typy lymfocytů a to helpry(cd4+) a supresory (CD8+), který u zdravých osob činí asi 1,8 : 1. Zatímco u hypersenzitivní pneumonie dochází ke snížení tohoto poměru, u sarkoidózy se poměr zvyšuje, obvykle až na : 1. Různý je pohled na možnost odhadu prognózy sarkoidózy dle intenzity alveolitis (vycházející z výšky procentuálního zastoupení lymfocytů v laváži). Někteří autoři tuto možnost připouštějí, jiní ji nepotvrzují. Vzestup hladiny neutrofilních granulocytů však bývá u pacientů se sarkoidózou obvykle považován za známku progrese fibrózních změn plicního intersticia. Patogeneze sarkoidózy je vysvětlována působením zatím neznámého agens, které vyvolává aktivaci T lymfocytů, uvolňujících chemotaktický faktor, přitahující krevní monocyty do plicního intersticia, kde dochází k jejich transformaci v bb. epiteloidní a vícejaderné. Tyto bb. zde vytvářejí drobné granulomy secernující látky, které poškozují intersticiální bb. a kolagen. Exogenní alergická alveolitis je výsledkem lokální imunitní odpovědi na inhalované prachy u senzibilizovaných jedinců. (31) Jde o širokou skupinu onemocnění, jejichž hlavním představitelem jsou tzv. farmářské plíce, které vznikají vdechováním prachů u pracovníků v zemědělství. V čerstvých fázích onemocnění (v experimentu 24 hodin po expozici antigenu) jsou v sedimentu přítomny také neutrofily. BAL je zde důležitým pomocníkem při tvorbě dg., pro odhad prognózy však význam nemá. 28
29 Alveolitidy bez zvýšení počtu lymfocytů Jsou charakterizovány zvýšením počtu (elevací) neutrofilních granulocytů. Obraz je obvykle nejvýraznější u tzv. idiopatické plicní fibrózy ( IPF), či kryptogenní alergické alveolitis (CAA), kde množství neutrofilů v sedimentu je 20 +/- 5%. Stejný obraz je též u tzv. familiární plicní fibrózy jejíž příznaky se objevují již v mladém věku. Ostatní onemocnění mají rovněž přítomné neutrofily, ale ne v tak velkém množství. (31) Idiopatická plicní fibróza (IPF) Nebo tzv.kryptogenní fibrotizující alveolitis je progredující plicní onemocnění neznámého původu, které končí po různě dlouhé době kompletní přestavbou plic, spojenou s jejich funkční nedostatečností. Patogeneze onemocnění je vysvětlována tak, že dosud neznámý antigen aktivuje plicní B lymfocyty k tvorbě imunoglobulinů, které pak vytvářejí s antigenem imunokomplexy, stimulující makrofágy k uvolňování chemotaktických faktorů. Chemotaktické faktory přitahují neutrofily z alveolárních kapilár a aktivují je k uvolňování proteolytických enzymů (hlavně kolagenázy) poškozujících bb. intersticia a kolagen. Při opakovaném vyšetření BAL u pacientů s IPF může být obraz sedimentu vhodným monitorem terapeutické odezvy. Zvýšení lymfocytů je považováno za pozitivní odpověď. Zvýšení eozinofilů bez lymfocytů je považováno za selhání terapeutické odpovědi. (31) Plicní fibróza spojená s kolagenózami Při těchto onemocněních se vedle poškození kolagenu v kůži či celé řadě jiných orgánů současně objevuje i postižení plicního intersticia. V BAL je obraz lymfocytární či neutrofilní alveolitis různé intenzity. Neutrofilní typ má vyšší riziko pro fibrózní poškození plic. Azbestóza Vzniká inhalací azbestových vláken, ze kterých vznikají tzv. feruginózní tělíska, která se tvoří intracelulárně v cytoplazmě makrofágů, obalením vláken feroproteinovým pláštěm. V BAL kromě feruginosních tělísek se stejně jako u IPF objevuje zvýšení počtu neutrofilů a eozinofilů. 29
30 4.5 DALŠÍ MOŽNÁ VYUŽITÍ BAL Průkaz nádorových bb. v sedimentu u karcinomatosních lymfangiopatií, bronchioloalveolárního ca a plicních lymfomů. Mastocyty (žirné bb) se nacházejí v BAT u některých nemocných s asthma bronchiale, s plicní fibrózou či sarkoidózou III. stádia. Cytoplazmatické inkluze v alveolárních makrofázích bývají u kuřáků hnědé(tzv.hnědé makrofágy), zlatohnědé (oxidy železa u svářečů)a hněděrezivé v siderofázích jako následek krvácení do alveolů. Virové inkluze bývají nukleární i cytoplazmatické při postižení Cytomegalovirem či Herpes simplex virem. (11) Extrabuněčnou lokalizaci mají obvykle azbestová tělíska, kolonie bakterií a mykotické drůzy. Pro diagnózu idiopatické plicní hemosiderózy vznikající jako následek krvácení do alveolů, je charakteristický nález více než 95 % makrofágů s hemosiderinem (siderofágů). Biochemické a imunologické vyšetření BAT jsou prováděna na specializovaných pracovištích a mají v současné době význam spíše experimentální. (12) Vyšetření průtokovým cytometrem slouží k určení poměru subtypů T lymfocytů (CD4/CD8). Zvýšení je udáváno u sarkoidózy, azbestózy, bronchiálního astmatu, vaskulitíd a některých jiných onemocnění. Snížení je popisováno u nemocných s AIDS, hypersenzitivní alveolitidou, silikózou a bronchogenním karcinomem. (3,8) 30
31 5. MIKROBIOLOGICKÉ VYŠETŘENÍ Bronchiální vzorek (první porce BAT) odesíláme a vyšetřujeme zvlášť. Nedílnou součástí cytologického vyšetření je mikrobiologické vyšetření. Nález výše uvedené virové inkluze v makrofázích, stanovit přítomnost Pneumocystis jiroveci (carinii), Toxoplasma gondii či Strongiloides stercoralis. (9) K bakteriologickému vyšetření odesíláme 5 ml BAT. Provádíme kultivační bakteriologické vyšetření s kvalitativním i kvantitativním hodnocením. Pro kvantitativní vyšetření je za signifikantní považována koncentrace bakterií 10 3 /ml ml. Při signifikantním průkazu bakterií vyšetřujeme vždy citlivost na antibiotika. Lze diagnostikovat i postižení plic mykoplazmaty a uroplazmaty. K vyšetření přítomnosti legionel odesíláme ml BAT, podle požadavků vyšetřující laboratoře (PCR vyšetření, kultivační vyšetření za využití imunofluorescence). (9,13) Množství BAT ke stanovení a typizaci mykobakterií je 5-10 ml, vzorek jde vyšetřit mikroskopicky, klasickou kultivací, či některou metodou urychlené kultivace. Podstatné je stanovení citlivosti kmene na antituberkulotika, eventuelně stanovení rozšířené citlivosti při identifikaci mykobakterií jiných než Mycobacterium tuberculosis nebo při podezření na přítomnost rezistentního kmene. (7,9) K vyšetření přítomnosti kvasinek a plísní odesíláme opět 5-10 ml BAT. Vyšetření mikroskopické a kultivační doplňuje vyšetření citlivosti vůči dostupným antimykotikům. K vyšetření přítomnosti Pneumocystis jiroveci (carinii) odesíláme 5 ml BAT. Průkazný je již pozitivní výsledek na cytologické vyšetření. Citlivější stanovení poskytne vyšetření metodou monoklonálních protilátek, případně PCR. Při průkazu PJ (carinii) v BAT, musíme vždy tento nález posuzovat ve vztahu ke klinickému stavu, než s jistotou prohlásíme PJ (carinii) za mikroorganismus, který je příčinou onemocnění a není pouze mikroorganismem kolonizujícím. (14) K virologickému vyšetření posíláme 5-10 ml BAT. Význam je cytologický průkaz např. inkluzí cytomegaloviru v makrofázích. Výsledky klasického kultivačního vyšetření jsou k dispozici za 3-4 týdny. Metody k průkazu virů založené na detekci antigenu (metodou monoklonálních protilátek, pomocí imunofluorescence, PCR) požadujeme vzhledem k jejich nákladnosti pouze v naléhavých případech. (9,16) 31
32 5.1 VYŠETŘENÍ VZORKU Z DDC NA NESPECIFICKOU MIKROFLÓRU MIKROSKOPICKY A KULTIVAČNĚ Touto metodou hledáme patologické agens a provádíme citlivost na ATB. Na krevní agar a Endovu půdu naočkujeme vzorek a kultivujeme12-24 hodin. Kultivací získáme čistou kulturu a podle morfologie kolonií, hemolýzy na krevním agaru a růstu na Endově půdě rozdělíme bakterie do skupin, které potom blíže určíme a otestujeme citlivost na ATB. (26) 5.2 VYŠETŘENÍ VZORKU NA PŮVODCE TBC MIKROSKOPICKY A KULTIVAČNĚ Účelem zkoušky je prokázat v klinickém materiálu přítomnost mykobakterií mikroskopicky a kultivačně. Princip zkoušky Mikroskopie Po obarvení dle Ziehla- Neelsena zjistíme, zda se v preparátu vyskytují acidorezistentní tyčinky. Kultivace Vzorek je nejprve dekontaminován, aby byly zničeny jiné než acidorezistentní bakterie, a poté naočkován na kultivační půdy. Po dlouhodobé kultivaci se pátrá po růstu mykobakterií. Naočkované půdy se kultivují v termostatu při 37 0 C po dobu 9 týdnů. Až na čokoládový agar, který se inkubuje při 32 0 C. (26) Dekontaminace materiálu Ke vzorku přidáme cca trojnásobný objem 1 N NaOH, sterilní špejlí důkladně homogenizujeme a uložíme do termostatu při 37 0 C po dobu 12 minut. Během této doby 2x důkladně protřepeme. Potom vzorek centrifugujeme 20 minut při 2000 otáčkách za minutu. Supernatant slijeme do desinfekčního roztoku 2% roztoku Ortosanu BF 12 a dávkovačem přidáme 15 ml okyselené vody. Po protřepání znovu centrifugujeme 20 minut při 2000 otáčkách za minutu. Supernatant slijeme do Ortosanu, sediment nesuspendujeme v 1 ml sterilní destilované vody a očkujeme na půdy. Očkování Naočkujeme pasterovou pipetou po 0,2 ml vzorku do 2 zkumavek s půdou Šulovou a po 0,2 ml vzorku polijeme povrch půdy Ogywovy, Loewensteinovy a šikmého čokoládového agaru. Tyto půdy 32
33 uzavřeme těsnými gumovými zátkami, označíme číslem vzorku a první 4 zkumavky sepneme gumičkou. Vzorky ukládáme do kovového košíčku pro kultivaci a označíme ho datem začátku kultivace. Mikrobiologické půdy Půda Šulova, Ogawova, vaječná půda Loewensteinova, šikmý čokoládový agar. (26) Provedení zkoušky Mikroskopie Vzorek naneseme bakteriologickou kličkou na podložní mikroskopické sklo, na plochu 1 cm 2 a necháme zaschnout. Barvíme postupně podle Ziehla- Neelsena: 1. Karbolfuchsin 5 minut 2. Přičemž 3 x zahříváme do výstupu par nad plynovým kahanem 3. Oplach pod tekoucí vodou 4. Odbarvujeme kyselým alkoholem 1 minutu 5. Oplach vodou 6. Dobarvování methylenovou modří 1 minutu 7. Oplach tekoucí vodu a osušíme volně na vzduchu 8. Přímo na preparát přidáme kapku imerzního oleje, mikroskopujeme 33
34 Výsledek mikroskopie Při zvětšení 10x 100 pozorujeme 50 zorných polí rovnoměrně po celé ploše preparátu. Hledáme acidorezistentní tyčinky (ART), které jsou červeně zbarvené. Mikroskopický nález se hodnotí takto: 0 tyčinek nenalezený 1-9 tyčinek ojedinělé tyčinek tyčinek ++ Více než 100 tyčinek +++ ART mohou být štíhlé, dlouhé, typické pro Mycobacterium tuberculosis, nebo krátké a silné, které hodnotíme jako pravděpodobně atypická mykobakteria. Epitelie a zbytky vzorku jsou zbarveny modře. Pozitivní preparáty uchováváme do ukončení diagnostiky. (26) Pokus na zvířeti: V některých případech (např. u mimoplicní TBC) zasilatel žádá také pokus na morčeti. 1 ml vzorku očkujeme subkutánně do tříselné krajiny morčete. Naočkované morče je chováno v oddělené kleci. Pojde-li zvíře, provede laborantka pitvu. Nepojde-li, usmrtíme je po 6 týdnech chloroformem a pitváme. Sledujeme místo vpichu, plíce, srdce, slezinu, ledviny, játra. Nenalezneme-li makroskopicky žádné změny, hodnotíme jako negativní. V případě změn odebereme vzorek pro mikroskopii a kultivaci. Kromě toho odebereme vzorek do formalínu pro histologické vyšetření. (26) Kultivace Z podezřelých kolonií připravíme preparáty, které se barví podle Ziehla- Neelsona. Odečet kultivace Odečet po 1 týdnu - nacházíme nejčastěji mikroby, které nebyly zničeny dekontaminací, nebo atypická mykobaktéria (původci TBC tak rychle nenarostou) Odečet po 3 týdnech - postup opakujeme 34
35 Odečet po 6 týdnech - postup opakujeme a zasílateli zašleme výsledek kultivace Odečet po 9 týdnech - vzorky však kultivujeme ještě další 3 týdny, postup opakujeme a zasílateli posíláme jen pozitivní nález. 5.3 VYŠETŘENÍ ANTIGENŮ HERPETICKÝCH VIRŮ HSV1 A HSV2 A CMV IMUNOFLUORESCENCÍ Metoda slouží k průkazu antigenů herpetických virů. Princip zkoušky Průkaz antigenů 1. Přímá imunofluorescence: Na sklíčko s tkáňovou kulturou (TK) se naočkuje vzorek a nechá se inkubovat. Pokud vzorek obsahuje hledané agens, po přidání specifické značné monoklonální protilátky fluoreskuje ve fluorescenčním mikroskopu. 2. Nepřímá imunofluorescence: Na sklíčko s TK se naočkuje vzorek a nechá se inkubovat. Pokud vzorek obsahuje hledané agens, po přidání specifické monoklonální protilátky a následně anti IgG konjugátu, fluoreskuje některý z antigenů ve fluorescenčním mikroskopu. (27,28,29) Provedení zkoušky Zpracování materiálu na rychlou diagnostiku Materiál očkujeme do tří lahviček (HSV1, HSV2, CMV). Lahvičky s TK vyndáme z termostatu, slijeme médium (přísně aseptický v Hansenově skříni) a kyfou naočkujeme cca 1 ml materiálu, do každé lahvičky. Je - li materiálu méně, rozdělíme jej rovnoměrně do všech lahviček. Přidáme 1-2 kapky ATB do každé lahvičky nebo přímo do materiálu. Lahvičky označíme číslem materiálu. Centrifugujeme 30 minut při 2800 až 3500 otáčkách za minutu. Poté v Hansenově skříni odstraníme tekutinu z lahvičky a místo ní aplikujeme 2-3 ml MEM (minimální esenciální médium). Inkubujeme v termostatu při 37 0 C nejméně do druhého dne. Zároveň s materiálem zpracováváme i jednu nenaočkovanou lahvičku jako kontrolu. (27,28,29) 35
36 Barvení CMV lahvičky 1. Slijeme MEM a nahradíme jej metylalkoholem na 10 minut (fixace). Po odsátí vyjmeme kulatá sklíčka pinzetou z lahviček a přilepíme je solakrylem na podložní sklo (buňkami nahoru) 2. Fixace metylalkoholem (10 minut) 3. Nalepit na podložní sklo solakryl 4. 1 kapka speciální monoklonální protilátky R3. Inkubace 3O minut při 37 0 C ve vlhké komůrce. 5. Naředit koncentrovaný roztok PBS= R2 (v soustavě) - 10x. Oplach sklíček ve dvou kyvetách. 6. Osušit fénem 7. 1 kapka fluorescenčního konjugátu R5 (v nové soupravě rozředit 9 ml PBS) 8. Inkubace 3O minut při 37 0 C ve vlhké komůrce. 9. Opláchnout 2x 5 minut v PBS nebo 1x 10 minut. 10. Oplach destilovanou vodou 11. Osušit fénem. 12. Prohlížíme při zvětšení 100x ve fluorescenčním mikroskopu. Barvení HSV lahvičky 1. Fixace metylalkoholem 10 minut. 2. Nalepit na podložní sklíčka. 3. Dát kapku monoklonální protilátky anti HSV1- na 1 sklo 4. Dát kapku monoklonální protilátky anti HSV2- na 2 sklo 5. Inkubace 3O minut při 37 0 C ve vlhké komůrce 6. Oplach v PBS, vysušit fénem a prohlížet ve fluorescenčním mikroskopu při zvětšení 100 x a více. 36
37 Odečet výsledků zkoušky Reakce je považována za pozitivní, je-li nalezena granulární zelenožlutá fluorescence.(27,28,29) 5.4 VYŠETŘENÍ VZORKŮ NA PŮVODCE TUBRKULOSY BacT/ ALERT 3D Systém BacT/ ALERT 3D zajišťuje vhodné kultivační podmínky a prostředí pro detekci mykobakterií běžně izolovaných z jiných vzorků než z krve. Princip zkoušky Systém BacT/ ALERT 3D využívá kolorimetrické činidlo a odrážené světlo k monitorování přítomnosti a tvorby CO 2, který je rozpuštěný v kultivačním mediu. Pokud jsou v testovaném vzorku přítomny mikroorganismy, vytváří se oxid uhličitý tím, jak tyto organismy metabolizují substráty v kultivačním médiu. Barviva indikátoru na dně každé lahvičky se mění z modrozelené na žlutou. Výsledkem světlejší barvy je nárůst intenzity odráženého světla, který je systémem monitorován. Provedení zkoušky Před použitím zkontrolujeme vizuálně kultivační lahvičky, nejsou-li poškozeny nebo kontaminovány. Znakem kontaminace je žluté zbarvení média nebo zákal. Lahvičky musí mít teplotu vyrovnanou na teplotu místnosti - temperujeme 60 minut před inokulací. Příslušnou kultivační lahvičku označíme informací o pacientovi (č. protokolu, jméno, příjmení, druh materiálu). Zátku každé lahvičky desinfikujeme tamponem namočeným v alkoholu. Před inokulací vzorku přidáme sterilní injekční stříkačku do každé kultivační lahvičky, která se má použít ke kultivaci dekontaminovaných vzorku, 0,5 ml rekonstituovaného antibiotického doplňku MB/BacT Antibiotic Supplement. Do každé kultivační lahvičky, která se má použit ke kultivaci sterilních vzorků, 0,5 ml samotné rekonstituční tekutiny MB/BacT Reconstitution Fluid. 37
38 Příprava antibiotického doplňku MB/ BacT Antibiotic Supplement Do lahvičky MB/ BacT Antibiotic Supplement přidáme sterilní stříkačku 10 ml rekonstituční tekutiny MB/ BacT Reconstitucion Fluid. Necháme rozpustit a jemně protřepeme, aby se smísily obsahové složky. Lahvičku označíme datem přípravy. Doba trvanlivosti antibiotického doplňku je 7 dnů skladování při teplotě C. Zbylou rekonstituční tekutinu skladujeme též při C pro pozdější použití pro sterilní vzorky. Inokulace materiálu Vzorek biologického materiálu dekontaminovaný, přidáme asepticky sterilní injekční stříkačkou v množství 0,5 ml do příslušně označené kultivační lahvičky s antibiotickým doplňkem. Horní část lahvičky otřeme tamponem namočeným do alkoholu. Lahvičku uložíme do přístroje BacT/ALERT 3D podle pokynů v provozním manuálu k přístroji. Sterilní biologické vzorky, které se nedekontaminují (punktáty, likvory), očkujeme v množství 0,5 ml do příslušně označené kultivační lahvičky, do které jsme před tím přidali 0,5 ml MB/ BacT Reconstitucion Fluid. Lahvičku vložíme také do přístroje BacT/ ALER 3D. Kultivační lahvičky musí zůstat v přístroji alespoň 42 dnů nebo do té doby, než je přístroj označí jako pozitivní nebo negativní. Odečet výsledku zkoušky Automat hlásí nárůst v lahvičce akustickým signálem a opticky. Z každé pozitivní lahvičky se musí zhotovit mikroskopický nátěr a nabarvit dle Ziehl- Neelsena. Interpretace Nejsou-li v mikroskopickém preparátu nalezeny acidorezistentní tyčinky, hodnotíme výsledek takto: kultivace automatickým systémem - přerůstá nespecifická flóra. Jsou-li acidorezistentní tyčinky nalezeny, odešleme k doručení do ZÚ Brno, Oddělení pro mikrobiologii TBC, Jugoslávská 17, Brno 38
39 5.5 CER TEST INFLUENZA A+ B TEST Použití Cer Test Infuenza je jednokrokový barevný imunochromatografický test pro kvalitativní stanovení antigenu typu A a B viru influenzy. Je určen ke stanovení antigenu z nosních výtěrů, výplachů a aspirátů. Běžné cirkulující typy viru influenzy, které způsobují onemocnění u lidí, lze rozdělit do dvou skupin: A a B. Influenza A má pro lidi důležíté subtypy A ( H3N2) a A (H1N1), které jsou spojovány s některými případy úmrtí. Influenza virus je definován dvěma rozdílnými povrchovými antigeny, které se nazývají hemaglutininy (HA) a neuramidázy (N). (30) Princip testu Cer Test Influenza A+B Test je jednokrokový barevný imunochromatografický test pro kvalitativní stanovení antigenu typu A a B viru influenzy. Na testovaných zónách povrchu klisteru jsou navázány myší monoklonální protilátky proti virovým antigenům. V průběhu testování vzorek reaguje s barevným konjugátem, který byl imobilizovaný na membráně ( anti- type A myší monoklonální protilátky - červená mikrosféra a anti- type B myší monoklonální protilátky- modrá mikrosféra). Směs pak kapilárním efektem vzlíná vzhůru po membráně blisteru. V případě pozitivního výsledku je barevný konjugát zachycen specifickými protilátkami, což se ve výsledkové zóně projeví jako barevná linie. Směs pak vzlíná dále po membráně k imobilizovaným protilátkám v kontrolní zóně, kde se vždy na konci testu objeví zelená linka. (30) Přítomnost zelené linky ověřuje: 1. Použití dostatečného objemu vzorku 2. Správná vzlínavost vzorku 3. Interní kontrola reagencií 39
40 Obr.1 Jednokrokový test pro in vitro diagnostiku viru Influenzy typu A a B z BAT (převzato od výrobce: Cer Test, distributor: VIDIA s.r.o.) Negativní: V kontrolní zóně C se objeví zelená linka. Výsledková zóna T zůstane čistá. Pouze influenza A pozitivní: Kromě zelené linky v KZ C se objeví také červená linka ve výsledkové zóně T. Pouze influenza B pozitivní: Kromě zelené linky v KZ C se objeví také modrá linka ve výsledkové zóně T. Influenza A+ B pozitivní: Kromě zelené linky v KZ C se objeví obě barevné linky- tedy červená a modrá zároveň- ve výsledkové zóně T. Neplatný: Test je neplatný, pokud se v KZ C neobjeví zelená linka bez ohledu na přítomnost červené nebo modré linky ve výsledkové zóně T. Nejčastějšími příčinami selhání testu jsou: nedostatečná koncentrace vzorku, nesprávný pracovní postup nebo poškození reagencie. (30) 40
41 5.6 VÝSTUPY MIKROBIOLOGICKÝCH VYŠETŘENÍ Pro diagnostiku infekčního postižení plic měl donedávna v BAT pozitivní průkaz Pneumocystis jiroveci (carinii), Toxoplazma gondii, Strongyloides, Legionella, Mycobacobacterium tuberculosis, Mycoplasma pneumonie, Respirační syncitiální virus, viry influenzy. Podle posledních informací se v případě průkazu Pneumocystios jiroveci (carinii) může jednat o průkaz mikroorganismu kolonizujícího. Identifikace následujících mikroorganismů v BATnemá jednoznačný diagnostický význam, ale může být přínosem pro stanovení diagnózy či pro upřesnění léčby- Herpes simplex virus, Cytomegalovirus, Aspergilus, kandidy, Cryptococcus a mykobakteria jiná než Mycobacterium tuberculosis. (9,10,14,16) 41
42 6. ZÁVĚR Závěrem uvádím shrnutí indikací k provedení BAL podle významu výsledků vyšetření BAT. Při zvažování indikace k provedení BAL je vždy rozhodující přínos vyšetření BAT pro nemocného. Z tohoto pohledu jsou k provedení BAL indikovány stavy, u nichž je podezření na následující plicní postižení. (3,8) Infekční onemocnění, u kterých má izolace původce z BAT jednoznačný diagnostický význam. Jedná se o infekce způsobené převážně těmito mikroorganismy: Toxoplazma gondii, Strongyloides, Legionella, Mycobacobacterium tuberculosis, Mycoplasma pneumonie, respirační syncitiální virus a viry influenzy. (9) Velmi obezřetný by měl být přístup k průkazu Pneumocystis jiroveci (carinii). Infekční postižení, u kterého nemá izolace původce z BAT jednoznačný diagnostický význam, ale může být přínosem pro stanovení diagnózy a zahájení léčby. Do této indikační skupiny jsou zařazeny infekce, které způsobuje Herpes simplex virus, Cytomegalovirus, Aspergillus, candidy, Cryptococcus a mykobakteria. (12,14) Neinfekční nemoci, u nichž má vyšetření BAT jednoznačný diagnostický význam. Do této skupiny patří alveolární proteináza, granulomatóza z Langerhansových bb.a zhoubné nádory. K neinfekčním nemocem, u nichž může vyšetření BAT přispět ke stanovení diagnózy, patří takzvaný syndrom plicní hemoragie, eozinofilní pneumonie, berylióza, hypersenzitivní pneumonie, azbestóza, sarkoidóza, a některé ostantní intersticiální plicní procesy. Neinfekční nemoci, u nichž může vyšetření BAT přispět k rozhodování o léčbě, představují etiologicky rozlišné intersticiální plicní procesy včetně kolagenózy a sarkoidózy. (12,14) Na závěr bych chtěla jen krátce zmínit postižení plic, u kterých má vyšetření BAT v současné době spíše experimentální význam. Do této skupiny patří studie o asthma bronchiale, ARDS, a také změny chování plicní tkáně po transplantaci. (15) 42
43 7. OBRÁZKOVÁ PŘÍLOHA Obr.2 Feruginózní tělísko (převzato z fotoarchivu MUDr. Antonína Krpenského) Obr.3 Schematické znázornění metody BAL (převzato z fotoarchivu MUDr. Antonína Krpenského) 43
44 Obr.4 Schema plicního intersticia (převzato z fotoarchivu MUDr. Antonína Krpenského) VŠE ZVĚTŠENO 600X (Veškeré obrázky získány z cytologické laboratoře FN u Sv. Anny v Brně) Obr.5 Respirační epitelie (barvení HE) Obr.6 Respirační epitelie (barvení Giemsa) 44
45 Obr.7 Makrofágy (barvení HE) Obr.8 Makrofágy (barvení Giemsa) Obr.9 Lymfocyty (barvení HE) Obr.10 Lymfocyty (barvení Giemsa) Obr.11 Neutrofilní granulocyty (barvení HE) Obr.12 Neutrofilní granulocyty (barvení Giemsa) 45
46 Obr.13 Eozinofilní granulocyty (barvení HE) Obr.14 Eozinofilní granulocyty (barvení Giemsa) Obr.15 Siderofágy (barvení dle Perlse) Obr.16 Siderofágy (barvení HE) Obr.17 Siderofágy ( barvení Giemsa) 46
47 Obr.18 Nádorové bb. hlenotvorného adenokarcinomu Obr.19 Papilární trs nádorových bb. adenokarcinomu 47
Standartní postup při provádění bronchoalveolární laváže (BAL) a vyšetřování bronchoalveolární tekutiny (BAT)
 Standartní postup při provádění bronchoalveolární laváže (BAL) a vyšetřování bronchoalveolární tekutiny (BAT) J. Skřičková 1, R. Kolaříková 2 1 Klinika nemocí plicních a tuberkulózy, LF MU a FN Brno- Bohunice
Standartní postup při provádění bronchoalveolární laváže (BAL) a vyšetřování bronchoalveolární tekutiny (BAT) J. Skřičková 1, R. Kolaříková 2 1 Klinika nemocí plicních a tuberkulózy, LF MU a FN Brno- Bohunice
Variace Dýchací soustava
 Variace 1 Dýchací soustava 21.7.2014 13:15:44 Powered by EduBase BIOLOGIE ČLOVĚKA DÝCHACÍ SOUSTAVA Dýchací systém Dýchání je děj, při kterém organismus získává a spotřebovává vzdušný kyslík a vylučuje
Variace 1 Dýchací soustava 21.7.2014 13:15:44 Powered by EduBase BIOLOGIE ČLOVĚKA DÝCHACÍ SOUSTAVA Dýchací systém Dýchání je děj, při kterém organismus získává a spotřebovává vzdušný kyslík a vylučuje
Střední průmyslová škola a Vyšší odborná škola technická Brno, Sokolská 1
 Střední průmyslová škola a Vyšší odborná škola technická Brno, Sokolská 1 Šablona: Název: Téma: Autor: Číslo: Anotace: Inovace a zkvalitnění výuky prostřednictvím ICT Soustavy člověka Stavba dýchací soustavy
Střední průmyslová škola a Vyšší odborná škola technická Brno, Sokolská 1 Šablona: Název: Téma: Autor: Číslo: Anotace: Inovace a zkvalitnění výuky prostřednictvím ICT Soustavy člověka Stavba dýchací soustavy
Rapid-VIDITEST Adenovirus Resp.
 Rapid-VIDITEST Adenovirus Resp. (Jednokrokový kazetový test pro in vitro diagnostiku Adenoviru z nosních výtěrů, výplachů a aspirátů) Návod k použití soupravy Výrobce: VIDIA spol. s r.o., Nad Safinou II
Rapid-VIDITEST Adenovirus Resp. (Jednokrokový kazetový test pro in vitro diagnostiku Adenoviru z nosních výtěrů, výplachů a aspirátů) Návod k použití soupravy Výrobce: VIDIA spol. s r.o., Nad Safinou II
Mgr. Šárka Vopěnková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VY_32_INOVACE_01_3_19_BI1 DÝCHACÍ SOUSTAVA II.
 Mgr. Šárka Vopěnková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VY_32_INOVACE_01_3_19_BI1 DÝCHACÍ SOUSTAVA II. DÝCHACÍ SOUSTAVA Dolní dýchací cesty Hrtan (larynx) velikost hrtanu ženy 5 cm, muži 7 cm chrupavčitý,
Mgr. Šárka Vopěnková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VY_32_INOVACE_01_3_19_BI1 DÝCHACÍ SOUSTAVA II. DÝCHACÍ SOUSTAVA Dolní dýchací cesty Hrtan (larynx) velikost hrtanu ženy 5 cm, muži 7 cm chrupavčitý,
Anatomie dýchacích cest. Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje
 Anatomie dýchacích cest Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Leden 2011 Mgr. Jitka Fuchsová Související pojmy: Ventilace = výměna vzduchu
Anatomie dýchacích cest Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Leden 2011 Mgr. Jitka Fuchsová Související pojmy: Ventilace = výměna vzduchu
CZ.1.07/1.5.00/34.0437. Člověk a příroda
 GYMNÁZIUM TÝN NAD VLTAVOU, HAVLÍČKOVA 13 Číslo projektu Číslo a název šablony klíčové aktivity Tematická oblast CZ.1.07/1.5.00/34.0437 III/2- Inovace a zkvalitnění výuky prostřednictvím IVT Člověk a příroda
GYMNÁZIUM TÝN NAD VLTAVOU, HAVLÍČKOVA 13 Číslo projektu Číslo a název šablony klíčové aktivity Tematická oblast CZ.1.07/1.5.00/34.0437 III/2- Inovace a zkvalitnění výuky prostřednictvím IVT Člověk a příroda
Rapid-VIDITEST RSV. (Jednokrokový kazetový test pro in vitro diagnostiku Respiračního syncytiálního viru z nosních výtěrů, výplachů a aspirátů)
 Rapid-VIDITEST RSV (Jednokrokový kazetový test pro in vitro diagnostiku Respiračního syncytiálního viru z nosních výtěrů, výplachů a aspirátů) Návod k použití soupravy Výrobce: VIDIA spol. s r.o., Nad
Rapid-VIDITEST RSV (Jednokrokový kazetový test pro in vitro diagnostiku Respiračního syncytiálního viru z nosních výtěrů, výplachů a aspirátů) Návod k použití soupravy Výrobce: VIDIA spol. s r.o., Nad
Kontakt Telefon: 485 313 020 Služba : 485 313 033 ATB : 485 313 029
 Klinický materiál odeslaný do laboratoře je zpracován dle standardních postupů (SOP) a vyšetření je kódováno dle sazebníku zdravotnických. O dalším vyšetřovacím postupu rozhoduje lékař se specializovanou
Klinický materiál odeslaný do laboratoře je zpracován dle standardních postupů (SOP) a vyšetření je kódováno dle sazebníku zdravotnických. O dalším vyšetřovacím postupu rozhoduje lékař se specializovanou
CZ.1.07/1.5.00/34.0437. Člověk a příroda
 GYMNÁZIUM TÝN NAD VLTAVOU, HAVLÍČKOVA 13 Číslo projektu Číslo a název šablony klíčové aktivity Tematická oblast CZ.1.07/1.5.00/34.0437 III/2- Inovace a zkvalitnění výuky prostřednictvím IVT Člověk a příroda
GYMNÁZIUM TÝN NAD VLTAVOU, HAVLÍČKOVA 13 Číslo projektu Číslo a název šablony klíčové aktivity Tematická oblast CZ.1.07/1.5.00/34.0437 III/2- Inovace a zkvalitnění výuky prostřednictvím IVT Člověk a příroda
Dýchací cesty: - horní. - dolní. Respirační oddíl plic
 Dýchací systém Dýchací cesty: - horní - dolní Respirační oddíl plic Dýchací cesty (vedou a upravují vdechovaný vzduch): Dutina nosní Nosohltan Hrtan (larynx) Průdušnice (trachea) Průdušky (bronchy) Průdušinky
Dýchací systém Dýchací cesty: - horní - dolní Respirační oddíl plic Dýchací cesty (vedou a upravují vdechovaný vzduch): Dutina nosní Nosohltan Hrtan (larynx) Průdušnice (trachea) Průdušky (bronchy) Průdušinky
Anatomické členění. Horní cesty dýchací. Dolní cesty dýchací. Nosní dutina Paranasální dutiny Nasopharynx
 DÝCHACÍ SYSTÉM 2011 Anatomické členění Horní cesty dýchací Nosní dutina Paranasální dutiny Nasopharynx Dolní cesty dýchací Larynx Trachea Bronchiální strom Respirační oddíl Vývoj dýchacího systému Plicní
DÝCHACÍ SYSTÉM 2011 Anatomické členění Horní cesty dýchací Nosní dutina Paranasální dutiny Nasopharynx Dolní cesty dýchací Larynx Trachea Bronchiální strom Respirační oddíl Vývoj dýchacího systému Plicní
Dýchací systém - úvod
 Dýchací systém - úvod Pro metabolismus tkání je nutný přísun kyslíku. Při metabolismu vzniká ve tkáních oxid uhličitý a voda, tyto látky se z organismu vylučují dýchacím ústrojím. Správná funkce dýchacího
Dýchací systém - úvod Pro metabolismus tkání je nutný přísun kyslíku. Při metabolismu vzniká ve tkáních oxid uhličitý a voda, tyto látky se z organismu vylučují dýchacím ústrojím. Správná funkce dýchacího
DIAGNOSTIKA INFEKČNÍCH CHOROB KULTIVACE V LABORATORNÍCH PODMÍNKÁCH
 STŘEDNÍ ZDRAVOTNICKÁ ŠKOLA A VYŠŠÍ ODBORNÁ ŠKOLA ZDRAVOTNICKÁ ŽĎÁR NAD SÁZAVOU DIAGNOSTIKA INFEKČNÍCH CHOROB KULTIVACE V LABORATORNÍCH PODMÍNKÁCH MGR. IVA COUFALOVÁ DIAGNOSTIKA INFEKČNÍCH CHOROB KULTIVACE
STŘEDNÍ ZDRAVOTNICKÁ ŠKOLA A VYŠŠÍ ODBORNÁ ŠKOLA ZDRAVOTNICKÁ ŽĎÁR NAD SÁZAVOU DIAGNOSTIKA INFEKČNÍCH CHOROB KULTIVACE V LABORATORNÍCH PODMÍNKÁCH MGR. IVA COUFALOVÁ DIAGNOSTIKA INFEKČNÍCH CHOROB KULTIVACE
Otázky k atestaci z oboru Pneumologie a ftiseologie (verze 2013):
 Otázky k atestaci z oboru Pneumologie a ftiseologie (verze 2013): A) Pneumologie 1. Akutní respirační insuficience - rozdělení, patofyziologie a léčba 2. Chronická respirační insuficience etiopatogeneze,
Otázky k atestaci z oboru Pneumologie a ftiseologie (verze 2013): A) Pneumologie 1. Akutní respirační insuficience - rozdělení, patofyziologie a léčba 2. Chronická respirační insuficience etiopatogeneze,
Odběry vzorků u pacientů s podezřením na infekci krevního řečiště
 Odběry vzorků u pacientů s podezřením na infekci krevního řečiště Eva Krejčí Centrum klinických laboratoří, Zdravotní ústav se sídlem v Ostravě Lékařská fakulta Ostravské univerzity Infekce krevního řečiště
Odběry vzorků u pacientů s podezřením na infekci krevního řečiště Eva Krejčí Centrum klinických laboratoří, Zdravotní ústav se sídlem v Ostravě Lékařská fakulta Ostravské univerzity Infekce krevního řečiště
Mgr. Šárka Vopěnková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VY_32_INOVACE_01_3_18_BI1 DÝCHACÍ SOUSTAVA
 Mgr. Šárka Vopěnková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VY_32_INOVACE_01_3_18_BI1 DÝCHACÍ SOUSTAVA DÝCHACÍ SOUSTAVA Buňky živočišného organismu získávají energii pro životní děje: převážně z biologických
Mgr. Šárka Vopěnková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VY_32_INOVACE_01_3_18_BI1 DÝCHACÍ SOUSTAVA DÝCHACÍ SOUSTAVA Buňky živočišného organismu získávají energii pro životní děje: převážně z biologických
Akutní respirační poruchy spojené s potápěním a dekompresí... Úvod Patofyziologie Klinické projevy Diagnostika Léčba Prognóza postižení Praktické rady
 1 Hemoptýza 1.1 Úvod a definice 1.2 Patofyziologie hemoptýzy 1.3 Příčiny hemoptýzy 1.4 Klasifikace hemoptýzy 1.5 Vyšetřovací metody 1.6 Diagnostické algoritmy 1.7 Diferenciální diagnostika hemoptýzy 1.8
1 Hemoptýza 1.1 Úvod a definice 1.2 Patofyziologie hemoptýzy 1.3 Příčiny hemoptýzy 1.4 Klasifikace hemoptýzy 1.5 Vyšetřovací metody 1.6 Diagnostické algoritmy 1.7 Diferenciální diagnostika hemoptýzy 1.8
STANDARDNÍ POSTUP PŘI PROVÁDĚNÍ BRONCHOALVEOLÁRNÍ LAVÁŽE (BAL) A VYŠETŘOVÁNÍ BRONCHOALVEOLÁRNÍ TEKUTINY (BAT)
 STANDARDNÍ POSTUP PŘI PROVÁDĚNÍ BRONCHOALVEOLÁRNÍ LAVÁŽE (BAL) A VYŠETŘOVÁNÍ BRONCHOALVEOLÁRNÍ TEKUTINY (BAT) [KAP. 9.4] Sekce bronchologická ČPFS prof. MUDr. Jana Skřičková, CSc., MUDr. Renata Kolaříková,
STANDARDNÍ POSTUP PŘI PROVÁDĚNÍ BRONCHOALVEOLÁRNÍ LAVÁŽE (BAL) A VYŠETŘOVÁNÍ BRONCHOALVEOLÁRNÍ TEKUTINY (BAT) [KAP. 9.4] Sekce bronchologická ČPFS prof. MUDr. Jana Skřičková, CSc., MUDr. Renata Kolaříková,
Rapid-VIDITEST RSV-Adenovirus Resp.
 Rapid-VIDITEST RSV-Adenovirus Resp. (Jednokrokový kazetový test pro in vitro diagnostiku Respiračního syncytiálního viru a Adenoviru z nosních výtěrů, výplachů a aspirátů) Návod k použití soupravy Výrobce:
Rapid-VIDITEST RSV-Adenovirus Resp. (Jednokrokový kazetový test pro in vitro diagnostiku Respiračního syncytiálního viru a Adenoviru z nosních výtěrů, výplachů a aspirátů) Návod k použití soupravy Výrobce:
Odběr a transport biologického materiálu do mikrobiologické laboratoře. Jana Juránková OKM FN Brno
 Odběr a transport biologického materiálu do mikrobiologické laboratoře Jana Juránková OKM FN Brno Správný výsledek mikrobiologického vyšetření začíná správným odběrem biologického materiálu a jeho správným
Odběr a transport biologického materiálu do mikrobiologické laboratoře Jana Juránková OKM FN Brno Správný výsledek mikrobiologického vyšetření začíná správným odběrem biologického materiálu a jeho správným
PULMONÁLNÍ (DÝCHACÍ) SOUSTAVA Přednáška. Dýchání děj, při kterém organismus získává a spotřebovává vzdušný kyslík a vylučuje oxid uhličitý a vodu
 PULMONÁLNÍ (DÝCHACÍ) SOUSTAVA Přednáška Mgr. Martina Pokorná Dýchání děj, při kterém organismus získává a spotřebovává vzdušný kyslík a vylučuje oxid uhličitý a vodu Ve tkáních dochází k oxidaci organických
PULMONÁLNÍ (DÝCHACÍ) SOUSTAVA Přednáška Mgr. Martina Pokorná Dýchání děj, při kterém organismus získává a spotřebovává vzdušný kyslík a vylučuje oxid uhličitý a vodu Ve tkáních dochází k oxidaci organických
Rapid-VIDITEST RSV. (Jednokrokový kazetový test pro in vitro diagnostiku Respiračního syncytiálního viru z nosních výtěrů, výplachů a aspirátů)
 Rapid-VIDITEST RSV (Jednokrokový kazetový test pro in vitro diagnostiku Respiračního syncytiálního viru z nosních výtěrů, výplachů a aspirátů) Návod k použití soupravy Výrobce: VIDIA spol. s r.o., Nad
Rapid-VIDITEST RSV (Jednokrokový kazetový test pro in vitro diagnostiku Respiračního syncytiálního viru z nosních výtěrů, výplachů a aspirátů) Návod k použití soupravy Výrobce: VIDIA spol. s r.o., Nad
Části postižených tkání či orgánů / záněty, benigní či
 Zdravotnická laboratoř VELAB s.r.o. LP 01 příloha 1: Seznam vyšetření laboratoře Název vyšetření: Cervikovaginální histologické vyšetření a diagnostika PAP Metoda slouží k záchytu prekanceróz a malignity
Zdravotnická laboratoř VELAB s.r.o. LP 01 příloha 1: Seznam vyšetření laboratoře Název vyšetření: Cervikovaginální histologické vyšetření a diagnostika PAP Metoda slouží k záchytu prekanceróz a malignity
Rapid-VIDITEST RSV Blister
 Rapid-VIDITEST RSV Blister (Jednokrokový blisterový test pro in vitro diagnostiku Respiračního syncytiálního viru z nosních výtěrů, výplachů a aspirátů) Návod k použití soupravy Výrobce: VIDIA spol.s r.o.,
Rapid-VIDITEST RSV Blister (Jednokrokový blisterový test pro in vitro diagnostiku Respiračního syncytiálního viru z nosních výtěrů, výplachů a aspirátů) Návod k použití soupravy Výrobce: VIDIA spol.s r.o.,
Zpracoval: Mgr. Jakub Krček SOŠ PO a VOŠ PO Frýdek Místek
 Zpracoval: Mgr. Jakub Krček SOŠ PO a VOŠ PO Frýdek Místek prostor ohraničený kostěnými výběžky horní čelisti strop tvoří čelní kost s čichovou kostí a nosní kůstky od ústní dutiny je oddělena tvrdým a
Zpracoval: Mgr. Jakub Krček SOŠ PO a VOŠ PO Frýdek Místek prostor ohraničený kostěnými výběžky horní čelisti strop tvoří čelní kost s čichovou kostí a nosní kůstky od ústní dutiny je oddělena tvrdým a
Příprava krevního roztěru
 Příprava krevního roztěru Správně Příliš tlustý Moc krve Nerovnoměrný tah Třásla se ruka Krev se srážela Mastné sklíčko Barvení roztěrů Standardním barvením pro krevní nátěry je tzv. panoptické barvení
Příprava krevního roztěru Správně Příliš tlustý Moc krve Nerovnoměrný tah Třásla se ruka Krev se srážela Mastné sklíčko Barvení roztěrů Standardním barvením pro krevní nátěry je tzv. panoptické barvení
Střední škola stavebních řemesel Brno Bosonohy, Pražská 38 b
 Střední škola stavebních řemesel Brno Bosonohy, Pražská 38 b Šablona: Inovace a zkvalitnění výuky prostřednictvím ICT Název: Dýchací soustava Téma: Základy biologie orgánové soustavy člověka Autor: Mgr.
Střední škola stavebních řemesel Brno Bosonohy, Pražská 38 b Šablona: Inovace a zkvalitnění výuky prostřednictvím ICT Název: Dýchací soustava Téma: Základy biologie orgánové soustavy člověka Autor: Mgr.
Protokol 04. pšeničná bílkovina. masné výrobky. zkrácená verze
 1 Popis vzorku Podle protokolu č. 04 lze vyšetřit vzorky různých druhů masných výrobků na přítomnost pšeničné bílkoviny. 2 Detekční limit vyšetření Přítomnost pšeničné bílkoviny lze spolehlivě prokázat,
1 Popis vzorku Podle protokolu č. 04 lze vyšetřit vzorky různých druhů masných výrobků na přítomnost pšeničné bílkoviny. 2 Detekční limit vyšetření Přítomnost pšeničné bílkoviny lze spolehlivě prokázat,
Anotace: Materiál je určen k výuce přírodopisu v 8. ročníku ZŠ. Seznamuje žáky se základními pojmy a informacemi o stavbě a funkci dýchací soustavy
 Anotace: Materiál je určen k výuce přírodopisu v 8. ročníku ZŠ. Seznamuje žáky se základními pojmy a informacemi o stavbě a funkci dýchací soustavy člověka. Materiál je plně funkční pouze s použitím internetu.
Anotace: Materiál je určen k výuce přírodopisu v 8. ročníku ZŠ. Seznamuje žáky se základními pojmy a informacemi o stavbě a funkci dýchací soustavy člověka. Materiál je plně funkční pouze s použitím internetu.
Intersticiální plicní procesy v otázkách a odpovědích
 Intersticiální plicní procesy v otázkách a odpovědích Martina Vašáková, Martina Šterclová Pneumologická klinika 1.LF UK Thomayerova nemocnice Praha Things we knew, things we did Things we have learnt,
Intersticiální plicní procesy v otázkách a odpovědích Martina Vašáková, Martina Šterclová Pneumologická klinika 1.LF UK Thomayerova nemocnice Praha Things we knew, things we did Things we have learnt,
Diagnostická laboratoř Praha. Laboratorní příručka Příloha č.1. Přehled vyšetření prováděných v Laboratoři klinické mikrobiologie
 Strana č: 1 Kultivační vyšetření výtěrů z horních cest dýchacích Kultivační vyšetření materiálu z dolních cest dýchacích (mimo TBC) B01/LKM B06/LKM B02/LKM Kultivační semikvantitativní vyšetření moče Typ
Strana č: 1 Kultivační vyšetření výtěrů z horních cest dýchacích Kultivační vyšetření materiálu z dolních cest dýchacích (mimo TBC) B01/LKM B06/LKM B02/LKM Kultivační semikvantitativní vyšetření moče Typ
SARS - Severe Acute Respiratory Syndrome (těžký akutní respirační syndrom).
 SARS - Severe Acute Respiratory Syndrome (těžký akutní respirační syndrom). Charakteristika: SARS je závažné respirační onemocnění probíhající převážně jako těžká atypická pneumonie, komplikovaná respirační
SARS - Severe Acute Respiratory Syndrome (těžký akutní respirační syndrom). Charakteristika: SARS je závažné respirační onemocnění probíhající převážně jako těžká atypická pneumonie, komplikovaná respirační
VY_32_INOVACE_11.08 1/8 3.2.11.8 Dýchací soustava Dýchací soustava
 1/8 3.2.11.8 Cíl popsat stavbu a funkci dýchací soustavy - chápat princip dýchání - charakterizovat jednotlivé části dýchací soustavy - objasnit pojmy plicní ventilace, dechová frekvence, kyslíkový dluh,
1/8 3.2.11.8 Cíl popsat stavbu a funkci dýchací soustavy - chápat princip dýchání - charakterizovat jednotlivé části dýchací soustavy - objasnit pojmy plicní ventilace, dechová frekvence, kyslíkový dluh,
Anatomie I přednáška 10. Dýchací soustava.
 Anatomie I přednáška 10 Dýchací soustava. Funkce dýchací soustavy Zprostředkovává výměnu plynů mezi organismem a zevním prostředím. Dýchání (výměna plynů) Dýchání zevní (plicní) výměna O 2 a CO 2 v plicích
Anatomie I přednáška 10 Dýchací soustava. Funkce dýchací soustavy Zprostředkovává výměnu plynů mezi organismem a zevním prostředím. Dýchání (výměna plynů) Dýchání zevní (plicní) výměna O 2 a CO 2 v plicích
CZ.1.07/1.5.00/34.0437. Člověk a příroda
 GYMNÁZIUM TÝN NAD VLTAVOU, HAVLÍČKOVA 13 Číslo projektu Číslo a název šablony klíčové aktivity Tematická oblast CZ.1.07/1.5.00/34.0437 III/2- Inovace a zkvalitnění výuky prostřednictvím IVT Člověk a příroda
GYMNÁZIUM TÝN NAD VLTAVOU, HAVLÍČKOVA 13 Číslo projektu Číslo a název šablony klíčové aktivity Tematická oblast CZ.1.07/1.5.00/34.0437 III/2- Inovace a zkvalitnění výuky prostřednictvím IVT Člověk a příroda
ZÁKLADY OBECNÉ A KLINICKÉ BIOCHEMIE
 ZÁKLADY OBECNÉ A KLINICKÉ BIOCHEMIE 2004 Vyšetření likvoru Kateřina Mrázová kapitola ve skriptech - 4.3.6 Co je to likvor Čirá bezbarvá tekutina V subarachnoidální prostoru (mezi arachnoideou a piou mater)
ZÁKLADY OBECNÉ A KLINICKÉ BIOCHEMIE 2004 Vyšetření likvoru Kateřina Mrázová kapitola ve skriptech - 4.3.6 Co je to likvor Čirá bezbarvá tekutina V subarachnoidální prostoru (mezi arachnoideou a piou mater)
Mikromorfologická diagnostika bronchogenního karcinomu z pohledu pneumologické cytodiagnostiky
 Mikromorfologická diagnostika bronchogenního karcinomu z pohledu pneumologické cytodiagnostiky P. Žáčková Pneumologická klinika 1. LFUK Thomayerova nemocnice Úvod a definice Každá buňka obsahuje informace
Mikromorfologická diagnostika bronchogenního karcinomu z pohledu pneumologické cytodiagnostiky P. Žáčková Pneumologická klinika 1. LFUK Thomayerova nemocnice Úvod a definice Každá buňka obsahuje informace
Implementace laboratorní medicíny do systému vzdělávání na Univerzitě Palackého v Olomouci. reg. č.: CZ.1.07/2.2.00/
 Implementace laboratorní medicíny do systému vzdělávání na Univerzitě Palackého v Olomouci reg. č.: CZ.1.07/2.2.00/28.0088 KLINICKÁ MIKROBIOLOGIE Klinická mikrobiologie je medicínský obor - pojítko mezi
Implementace laboratorní medicíny do systému vzdělávání na Univerzitě Palackého v Olomouci reg. č.: CZ.1.07/2.2.00/28.0088 KLINICKÁ MIKROBIOLOGIE Klinická mikrobiologie je medicínský obor - pojítko mezi
IMUNOFLUORESCENČNÍ SOUPRAVA K DIAGNOSTICE AUTOIMUNITNÍCH ONEMOCNĚNÍ JATER A ŽALUDKU
 IMUNOLOGIE Autoimunitní onemocnění jater a žaludku IMUNOFLUORESCENČNÍ SOUPRAVA K DIAGNOSTICE AUTOIMUNITNÍCH ONEMOCNĚNÍ JATER A ŽALUDKU Mitochondrie Hladké svalstvo Mikrosomy jater a ledvin Parietální buňky
IMUNOLOGIE Autoimunitní onemocnění jater a žaludku IMUNOFLUORESCENČNÍ SOUPRAVA K DIAGNOSTICE AUTOIMUNITNÍCH ONEMOCNĚNÍ JATER A ŽALUDKU Mitochondrie Hladké svalstvo Mikrosomy jater a ledvin Parietální buňky
LABORATORNÍ DIAGNOSTIKA PARAZITŮ PETRA KUBÁČKOVÁ OKM
 LABORATORNÍ DIAGNOSTIKA PARAZITŮ PETRA KUBÁČKOVÁ OKM přímý průkaz makroskopický mikroskopický průkaz antigenu PCR kultivace nepřímý průkaz průkaz protilátek PŘÍMÝ PRŮKAZ materiál: 1. stolice vajíčka červů,
LABORATORNÍ DIAGNOSTIKA PARAZITŮ PETRA KUBÁČKOVÁ OKM přímý průkaz makroskopický mikroskopický průkaz antigenu PCR kultivace nepřímý průkaz průkaz protilátek PŘÍMÝ PRŮKAZ materiál: 1. stolice vajíčka červů,
Dystelektázy plic na JIP tipy a triky
 Dystelektázy plic na JIP tipy a triky Ivo Hanke Kardiochirurgická klinika Lékařské fakulty UK v Hradci Králové a FN Hradec Králové Východiska - Dystelektázy plic na JIP Definice Rozdělení Diagnostika Terapeutické
Dystelektázy plic na JIP tipy a triky Ivo Hanke Kardiochirurgická klinika Lékařské fakulty UK v Hradci Králové a FN Hradec Králové Východiska - Dystelektázy plic na JIP Definice Rozdělení Diagnostika Terapeutické
TRVALÝ PREPARÁT. Zhotovení roztěru
 TRVALÝ PREPARÁT Zhotovení trvalého preparátu zahrnuje usmrcení, fixování a barvení objektu. Podle způsobu zpracování rozeznáváme preparáty celkové (obsahují celý organismus), nátěrové, roztěrové, roztlakové,
TRVALÝ PREPARÁT Zhotovení trvalého preparátu zahrnuje usmrcení, fixování a barvení objektu. Podle způsobu zpracování rozeznáváme preparáty celkové (obsahují celý organismus), nátěrové, roztěrové, roztlakové,
Interpretace výsledků bakteriologických vyšetření
 Interpretace výsledků bakteriologických vyšetření Veškeré nálezy vyšetření je nutno hodnotit vzhledem k diagnóze, věku, zánětlivým parametrům, klinickému stavu pacienta, ev. k dalším důležitým anamnestickým
Interpretace výsledků bakteriologických vyšetření Veškeré nálezy vyšetření je nutno hodnotit vzhledem k diagnóze, věku, zánětlivým parametrům, klinickému stavu pacienta, ev. k dalším důležitým anamnestickým
Vyšetření CSF - technika odběru a interpretace výsledků. Schánilec P. Agudelo C. F. Hájek I.
 Vyšetření CSF - technika odběru a interpretace výsledků Schánilec P. Agudelo C. F. Hájek I. Fyziologie tvorby CSF Fitzmaurice S. N.: Appendix 2 Cerebrospinal fluid and the ventricular systém. In: Fitzmaurice
Vyšetření CSF - technika odběru a interpretace výsledků Schánilec P. Agudelo C. F. Hájek I. Fyziologie tvorby CSF Fitzmaurice S. N.: Appendix 2 Cerebrospinal fluid and the ventricular systém. In: Fitzmaurice
Otázky k atestaci z oboru Pneumologie a ftiseologie (verze 2016):
 Otázky k atestaci z oboru Pneumologie a ftiseologie (verze 2016): A) Pneumologie 1. Akutní respirační insufícience - rozdělení, patofyziologie a léčba 2. Chronická respirační insufícience - etiopatogeneze,
Otázky k atestaci z oboru Pneumologie a ftiseologie (verze 2016): A) Pneumologie 1. Akutní respirační insufícience - rozdělení, patofyziologie a léčba 2. Chronická respirační insufícience - etiopatogeneze,
Rapid-VIDITEST Adenovirus Resp.
 Rapid-VIDITEST Adenovirus Resp. (Jednokrokový kazetový test pro in vitro diagnostiku Adenoviru z nosních výtěrů, výplachů a aspirátů) Návod k použití soupravy Výrobce: VIDIA spol. s r.o., Nad Safinou II
Rapid-VIDITEST Adenovirus Resp. (Jednokrokový kazetový test pro in vitro diagnostiku Adenoviru z nosních výtěrů, výplachů a aspirátů) Návod k použití soupravy Výrobce: VIDIA spol. s r.o., Nad Safinou II
Interpretace serologických výsledků. MUDr. Pavel Adamec Sang Lab klinická laboratoř, s.r.o.
 Interpretace serologických výsledků MUDr. Pavel Adamec Sang Lab klinická laboratoř, s.r.o. Serologická diagnostika EBV Chlamydia pneumoniae Mycoplasma pneumoniae EBV - charakteristika DNA virus ze skupiny
Interpretace serologických výsledků MUDr. Pavel Adamec Sang Lab klinická laboratoř, s.r.o. Serologická diagnostika EBV Chlamydia pneumoniae Mycoplasma pneumoniae EBV - charakteristika DNA virus ze skupiny
Rapid-VIDITEST Influenza A+B
 Rapid-VIDITEST Influenza A+B (Jednokrokový blisterový test pro in vitro diagnostiku viru Influenzy typu A a B z nosních výtěrů, výplachů a aspirátů) Návod k použití soupravy Výrobce: VIDIA spol. s r.o.,
Rapid-VIDITEST Influenza A+B (Jednokrokový blisterový test pro in vitro diagnostiku viru Influenzy typu A a B z nosních výtěrů, výplachů a aspirátů) Návod k použití soupravy Výrobce: VIDIA spol. s r.o.,
Kurz Pneumologie a ftizeologie
 Kurz Pneumologie a ftizeologie 13.2. - 24.2.2017 Po 13. 2. 2017 8,00-8,45 MUDr. Vladimír Koblížek, Ph.D. Příznaky plicních nemocí a jejich fyzikální vyšetření. 8,50-9,35 MUDr. Vladimír Koblížek, Ph.D.
Kurz Pneumologie a ftizeologie 13.2. - 24.2.2017 Po 13. 2. 2017 8,00-8,45 MUDr. Vladimír Koblížek, Ph.D. Příznaky plicních nemocí a jejich fyzikální vyšetření. 8,50-9,35 MUDr. Vladimír Koblížek, Ph.D.
Dýchací soustava lov
 Dýchací soustava člověka Vnější dýchání výměna plynů mezi krví a okolím (vzduchem) kyslík se dostává dýchacími pohyby vdechovaným vzduchem do plicních alveol (plicní ventilace) a odtud difúzí do krevního
Dýchací soustava člověka Vnější dýchání výměna plynů mezi krví a okolím (vzduchem) kyslík se dostává dýchacími pohyby vdechovaným vzduchem do plicních alveol (plicní ventilace) a odtud difúzí do krevního
Rapid-VIDITEST Influenza A+B
 Rapid-VIDITEST Influenza A+B (Jednokrokový blisterový test pro in vitro diagnostiku viru Influenzy typu A a B z nosních výtěrů, výplachů a aspirátů) Návod k použití soupravy Výrobce: VIDIA spol. s r.o.,
Rapid-VIDITEST Influenza A+B (Jednokrokový blisterový test pro in vitro diagnostiku viru Influenzy typu A a B z nosních výtěrů, výplachů a aspirátů) Návod k použití soupravy Výrobce: VIDIA spol. s r.o.,
EUC Laboratoře s.r.o. EUC Laboratoře Praha Palackého 720/5, Praha 1
 Pracoviště zdravotnické laboratoře:. Laboratoř biochemická a hematologická Palackého 70/5, 0 00 Praha. Laboratoř biochemická a hematologická Sokolovská /55,80 00 Praha 8. Laboratoř imunologická a alergologická
Pracoviště zdravotnické laboratoře:. Laboratoř biochemická a hematologická Palackého 70/5, 0 00 Praha. Laboratoř biochemická a hematologická Sokolovská /55,80 00 Praha 8. Laboratoř imunologická a alergologická
Příloha č.5 Seznam PCR vyšetření
 Příloha č.5 Seznam PCR vyšetření Obsah Virus hepatitidy B - kvalitativní průkaz... 2 Virus hepatitidy B - kvantita... 2 Virus hepatitidy C kvalitativní průkaz... 3 Virus hepatitidy C - kvantita... 3 Virus
Příloha č.5 Seznam PCR vyšetření Obsah Virus hepatitidy B - kvalitativní průkaz... 2 Virus hepatitidy B - kvantita... 2 Virus hepatitidy C kvalitativní průkaz... 3 Virus hepatitidy C - kvantita... 3 Virus
PREGRADUÁLNÍ VZDĚLÁVÁNÍ V LÉKAŘSKÉ MIKROBIOLOGII
 PREGRADUÁLNÍ VZDĚLÁVÁNÍ V LÉKAŘSKÉ MIKROBIOLOGII Milan Kolář Lékařská fakulta UP v Olomouci ZÁVĚRY Z PŘEDCHÁZEJÍCÍCH SETKÁNÍ Výuka lékařské mikrobiologie patří k nezbytným předpokladům pro výuku klinických
PREGRADUÁLNÍ VZDĚLÁVÁNÍ V LÉKAŘSKÉ MIKROBIOLOGII Milan Kolář Lékařská fakulta UP v Olomouci ZÁVĚRY Z PŘEDCHÁZEJÍCÍCH SETKÁNÍ Výuka lékařské mikrobiologie patří k nezbytným předpokladům pro výuku klinických
Cíle: Obecné zásady při odběru vzorků pro bakteriologické vyšetření
 Praktikum č. 8: Diagnostika ve veterinární mikrobiologii (odběr, zasílání a zpracování vzorků určených k bakteriologickému vyšetření. Metody kultivačního stanovení koncentrace bakterií. Cíle: 1. Seznámit
Praktikum č. 8: Diagnostika ve veterinární mikrobiologii (odběr, zasílání a zpracování vzorků určených k bakteriologickému vyšetření. Metody kultivačního stanovení koncentrace bakterií. Cíle: 1. Seznámit
Atestační otázky z oboru alergologie a klinická imunologie
 Publikováno z 2. lékařská fakulta Univerzity Karlovy v Praze ( https://www.lf2.cuni.cz) Atestační otázky z oboru alergologie a klinická imunologie Okruh základy imunologie 1. Buňky, tkáně a orgány imunitního
Publikováno z 2. lékařská fakulta Univerzity Karlovy v Praze ( https://www.lf2.cuni.cz) Atestační otázky z oboru alergologie a klinická imunologie Okruh základy imunologie 1. Buňky, tkáně a orgány imunitního
Struktura a skladba potravin Magisterský studijní program. Přednáška 4.
 Struktura a skladba potravin Magisterský studijní program Přednáška 4. Zobrazovací techniky a jejich využití při studiu struktury a skladby potravin. Téma 1. Světelná mikroskopie Přehledné a cílené barvící
Struktura a skladba potravin Magisterský studijní program Přednáška 4. Zobrazovací techniky a jejich využití při studiu struktury a skladby potravin. Téma 1. Světelná mikroskopie Přehledné a cílené barvící
Rapid-VIDITEST Adenovirus Resp.
 Rapid-VIDITEST Adenovirus Resp. (Jednokrokový blisterový test pro in vitro diagnostiku Adenoviru z nosních výtěrů, výplachů a aspirátů) Návod k použití soupravy Výrobce: VIDIA spol. s r.o., Nad Safinou
Rapid-VIDITEST Adenovirus Resp. (Jednokrokový blisterový test pro in vitro diagnostiku Adenoviru z nosních výtěrů, výplachů a aspirátů) Návod k použití soupravy Výrobce: VIDIA spol. s r.o., Nad Safinou
Diagnostické metody v lékařské mikrobiologii
 Diagnostické metody v lékařské mikrobiologii Výuková prezentace z: Lékařské mikrobiologie Jan Smíšek ÚLM 3. LF UK 2009 Princip identifikace Soubor znaků s rozdílnou diskriminační hodnotou Základní problémy
Diagnostické metody v lékařské mikrobiologii Výuková prezentace z: Lékařské mikrobiologie Jan Smíšek ÚLM 3. LF UK 2009 Princip identifikace Soubor znaků s rozdílnou diskriminační hodnotou Základní problémy
ZÁKLADY FUNKČNÍ ANATOMIE
 OBSAH Úvod do studia 11 1 Základní jednotky živé hmoty 13 1.1 Lékařské vědy 13 1.2 Buňka - buněčné organely 18 1.2.1 Biomembrány 20 1.2.2 Vláknité a hrudkovité struktury 21 1.2.3 Buněčná membrána 22 1.2.4
OBSAH Úvod do studia 11 1 Základní jednotky živé hmoty 13 1.1 Lékařské vědy 13 1.2 Buňka - buněčné organely 18 1.2.1 Biomembrány 20 1.2.2 Vláknité a hrudkovité struktury 21 1.2.3 Buněčná membrána 22 1.2.4
V lednici (2 8 C) Do 24 hod dní BK - 50 dnů. Uricult Při pokojové teplotě Do hod dní. Při pokojové teplotě
 Přehled základních odběrů na bakteriologii - KULTIVACE: Laboratoř upozorňuje, že odběr bez transportní půdy je pro delší uchování a transport nevhodný. Při nedodržení postupů preanalytické fáze nemusí
Přehled základních odběrů na bakteriologii - KULTIVACE: Laboratoř upozorňuje, že odběr bez transportní půdy je pro delší uchování a transport nevhodný. Při nedodržení postupů preanalytické fáze nemusí
- Kolaps,mdloba - ICHS angina pectoris - ICHS infarkt myokardu - Arytmie - Arytmie bradyarytmie,tachyarytmie
 NÁHLÁ POSTIŽENÍ OBĚHOVÉHO SYSTÉMU NEODKLADNÁ ZDRAVOTNICKÁ POMOC 27.2.--9.3.2012 BRNO 27.2. POSTIŽENÍ TEPEN - Onemocnění věnčitých tepen věnčité tepny zásobují srdeční sval krví a tedy i kyslíkem - Onemocnění
NÁHLÁ POSTIŽENÍ OBĚHOVÉHO SYSTÉMU NEODKLADNÁ ZDRAVOTNICKÁ POMOC 27.2.--9.3.2012 BRNO 27.2. POSTIŽENÍ TEPEN - Onemocnění věnčitých tepen věnčité tepny zásobují srdeční sval krví a tedy i kyslíkem - Onemocnění
Respirační systém. http://www.vscht.cz/kot/cz/studij ni-materialy.html
 Respirační systém http://www.vscht.cz/kot/cz/studij ni-materialy.html Funkce respiračního systému Úzká spolupráce se srdcem a krví ve snaze extrahovat kyslík z vnějšího prostředí a zbavovat se nežádoucích
Respirační systém http://www.vscht.cz/kot/cz/studij ni-materialy.html Funkce respiračního systému Úzká spolupráce se srdcem a krví ve snaze extrahovat kyslík z vnějšího prostředí a zbavovat se nežádoucích
Patologie výpotků. samotest. Jaroslava Dušková 1-3, Ondřej Sobek 3. Ústav patologie 1.LF UK a VFN, Univerzita Karlova, Praha 2. CGOP s.r.o.
 Patologie výpotků samotest Jaroslava Dušková 1-3, Ondřej Sobek 3 1 Ústav patologie 1.LF UK a VFN, Univerzita Karlova, Praha 2 CGOP s.r.o., Praha 3 Topelex s.r.o., Praha Patologie výpotků samotest V následujících
Patologie výpotků samotest Jaroslava Dušková 1-3, Ondřej Sobek 3 1 Ústav patologie 1.LF UK a VFN, Univerzita Karlova, Praha 2 CGOP s.r.o., Praha 3 Topelex s.r.o., Praha Patologie výpotků samotest V následujících
METODY VYŠETŘOVÁNÍ BUNĚČNÉ IMUNITY. Veřejné zdravotnictví
 METODY VYŠETŘOVÁNÍ BUNĚČNÉ IMUNITY Veřejné zdravotnictví METODY VYŠETŘOVÁNÍ BUNĚČNÉ IMUNITY průtoková cytometrie metody stanovení funkční aktivity lymfocytů testy fagocytárních funkcí Průtoková cytometrie
METODY VYŠETŘOVÁNÍ BUNĚČNÉ IMUNITY Veřejné zdravotnictví METODY VYŠETŘOVÁNÍ BUNĚČNÉ IMUNITY průtoková cytometrie metody stanovení funkční aktivity lymfocytů testy fagocytárních funkcí Průtoková cytometrie
Základní vyšetření likvoru
 Základní vyšetření likvoru 1. určení míry permeability hematolikvorové bariery stanovení koncentrace celkové bílkoviny v likvoru 2. určení energetických poměrů v likvorovém kompartmentu stanovení koncentrací
Základní vyšetření likvoru 1. určení míry permeability hematolikvorové bariery stanovení koncentrace celkové bílkoviny v likvoru 2. určení energetických poměrů v likvorovém kompartmentu stanovení koncentrací
Rapid-VIDITEST. Rota-Adeno Card. (Jednokrokový kazetový test pro in vitro diagnostiku rotavirů a adenovirů) Návod k použití soupravy
 Rapid-VIDITEST Rota-Adeno Card (Jednokrokový kazetový test pro in vitro diagnostiku rotavirů a adenovirů) Návod k použití soupravy Výrobce: VIDIA spol. s r.o., Nad Safinou II č. 365, Vestec, 252 42 Jesenice
Rapid-VIDITEST Rota-Adeno Card (Jednokrokový kazetový test pro in vitro diagnostiku rotavirů a adenovirů) Návod k použití soupravy Výrobce: VIDIA spol. s r.o., Nad Safinou II č. 365, Vestec, 252 42 Jesenice
RESPIRAČNÍ SYSTÉM a jeho detoxikace
 RESPIRAČNÍ SYSTÉM a jeho detoxikace MUDr. Josef Jonáš 1 Funkce dýchacího ústrojí Je to systém zabezpečující dodávku kyslíku do organismu a vyloučení oxidu uhličitého z organismu ven. Dýchání (respirace)
RESPIRAČNÍ SYSTÉM a jeho detoxikace MUDr. Josef Jonáš 1 Funkce dýchacího ústrojí Je to systém zabezpečující dodávku kyslíku do organismu a vyloučení oxidu uhličitého z organismu ven. Dýchání (respirace)
Poslední trendy krevních odběrů. Mgr. Tomáš Grim Mgr. Zuzana Kučerová
 Poslední trendy krevních odběrů Mgr. Tomáš Grim Mgr. Zuzana Kučerová Laboratorní metody Účel: Diagnostický Sledování průběhu nemoci Monitorování léčby Určování prognózy onemocnění Preventivní či screeningové
Poslední trendy krevních odběrů Mgr. Tomáš Grim Mgr. Zuzana Kučerová Laboratorní metody Účel: Diagnostický Sledování průběhu nemoci Monitorování léčby Určování prognózy onemocnění Preventivní či screeningové
Odběr a transport biologického materiálu do mikrobiologické laboratoře. Jana Juránková OKM FN Brno
 Odběr a transport biologického materiálu do mikrobiologické laboratoře Jana Juránková OKM FN Brno Specifika odběrů pro bakteriologická vyšetření Správný výsledek mikrobiologického vyšetření začíná správným
Odběr a transport biologického materiálu do mikrobiologické laboratoře Jana Juránková OKM FN Brno Specifika odběrů pro bakteriologická vyšetření Správný výsledek mikrobiologického vyšetření začíná správným
NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV: VY_32_INOVACE_92_PLÍCE AUTOR: NADĚŽDA ČMELOVÁ ROČNÍK, DATUM: 8., 31.
 NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV: VY_32_INOVACE_92_PLÍCE AUTOR: NADĚŽDA ČMELOVÁ ROČNÍK, DATUM: 8., 31. 12. 2011 VZDĚL. OBOR, TÉMA: PŘÍRODOPIS, DÝCHACÍ SOUSTAVA
NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV: VY_32_INOVACE_92_PLÍCE AUTOR: NADĚŽDA ČMELOVÁ ROČNÍK, DATUM: 8., 31. 12. 2011 VZDĚL. OBOR, TÉMA: PŘÍRODOPIS, DÝCHACÍ SOUSTAVA
Odběry biologického materiálu. Krev Moč Trus Sputum Žaludeční obsah Výtěry, stěry Punkce Biopsie
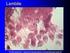 Odběry biologického materiálu Krev Moč Trus Sputum Žaludeční obsah Výtěry, stěry Punkce Biopsie Odběry biologického materiálu Odběr a laboratorní zpracování je důležité pro správné určení diagnózy i pro
Odběry biologického materiálu Krev Moč Trus Sputum Žaludeční obsah Výtěry, stěry Punkce Biopsie Odběry biologického materiálu Odběr a laboratorní zpracování je důležité pro správné určení diagnózy i pro
Srovnávac. vací fyziologie. Ivana FELLNEROVÁ PřF UP Olomouc
 Plicní objemy Srovnávac vací fyziologie Větev plicní žíly (okysličená krev) Větev plicní tepny (odkysličená krev) Terminální průdušinka HLTAN HRTAN JÍCEN PRŮDUŠNICE Pravá plíce Nosní dutina Levá plíce
Plicní objemy Srovnávac vací fyziologie Větev plicní žíly (okysličená krev) Větev plicní tepny (odkysličená krev) Terminální průdušinka HLTAN HRTAN JÍCEN PRŮDUŠNICE Pravá plíce Nosní dutina Levá plíce
LÉKAŘSKÁ VYŠETŘENÍ A LABORATORNÍ TESTY
 LÉKAŘSKÁ VYŠETŘENÍ A LABORATORNÍ TESTY Pokud čtete tento text, pravděpodobně jste v kontaktu s odborníkem na léčbu mnohočetného myelomu. Diagnóza mnohočetného myelomu je stanovena pomocí četných laboratorních
LÉKAŘSKÁ VYŠETŘENÍ A LABORATORNÍ TESTY Pokud čtete tento text, pravděpodobně jste v kontaktu s odborníkem na léčbu mnohočetného myelomu. Diagnóza mnohočetného myelomu je stanovena pomocí četných laboratorních
Rapid-VIDITEST. H. pylori. (Jednokrokový kazetový test pro in vitro diagnostiku Helicobacter pylori ve stolici ) Návod k použití soupravy
 Rapid-VIDITEST H. pylori (Jednokrokový kazetový test pro in vitro diagnostiku Helicobacter pylori ve stolici ) Návod k použití soupravy Výrobce: VIDIA spol. s r.o., Nad Safinou II 365, Vestec, 252 42 Jesenice
Rapid-VIDITEST H. pylori (Jednokrokový kazetový test pro in vitro diagnostiku Helicobacter pylori ve stolici ) Návod k použití soupravy Výrobce: VIDIA spol. s r.o., Nad Safinou II 365, Vestec, 252 42 Jesenice
Dýchací ústrojí a fyziologie dýchání
 Dýchací ústrojí a fyziologie dýchání MUDr.Helena Kazmarová MUDr.Helena Veselská Odborná skupina hygieny ovzduší Centrum hygieny životního prostředí Státní zdravotní ústav h.kazmarova kazmarova@szu.cz http://www.szu.cz/chzp/ovzdusi/index.htm
Dýchací ústrojí a fyziologie dýchání MUDr.Helena Kazmarová MUDr.Helena Veselská Odborná skupina hygieny ovzduší Centrum hygieny životního prostředí Státní zdravotní ústav h.kazmarova kazmarova@szu.cz http://www.szu.cz/chzp/ovzdusi/index.htm
Základní škola praktická Halenkov VY_32_INOVACE_03_03_14. Člověk II.
 Základní škola praktická Halenkov VY_32_INOVACE_03_03_14 Člověk II. Číslo projektu CZ.1.07/1.4.00/21.3185 Klíčová aktivita III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Zařazení učiva v rámci ŠVP
Základní škola praktická Halenkov VY_32_INOVACE_03_03_14 Člověk II. Číslo projektu CZ.1.07/1.4.00/21.3185 Klíčová aktivita III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Zařazení učiva v rámci ŠVP
Akutní stavy v paliativní péči hemoptýza, hemoptoe V. česko-slovenská konference paliativní mediciny Brno, 19.-20.9. 2013
 Akutní stavy v paliativní péči hemoptýza, hemoptoe V. česko-slovenská konference paliativní mediciny Brno, 19.-20.9. 2013 Marcela Tomíšková Klinika nemocí plicních a tuberkulózy Fakultní nemocnice Brno,
Akutní stavy v paliativní péči hemoptýza, hemoptoe V. česko-slovenská konference paliativní mediciny Brno, 19.-20.9. 2013 Marcela Tomíšková Klinika nemocí plicních a tuberkulózy Fakultní nemocnice Brno,
PCT kontrolovaná ATB terapie nosokomiální pneumonie ventilovaných nemocných
 PCT kontrolovaná ATB terapie nosokomiální pneumonie ventilovaných nemocných Pavel Dostál Klinika anesteziologie, resuscitace a intenzivní medicíny Univerzita Karlova v Praze, Lékařská fakulta v Hradci
PCT kontrolovaná ATB terapie nosokomiální pneumonie ventilovaných nemocných Pavel Dostál Klinika anesteziologie, resuscitace a intenzivní medicíny Univerzita Karlova v Praze, Lékařská fakulta v Hradci
Zpracovaly pracovnice KHS Stč. kraje: MUDr. Markéta Korcinová, vedoucí protiepidemického odboru Kateřina Jedličková, referentka protiepidemického
 Zpracovaly pracovnice KHS Stč. kraje: MUDr. Markéta Korcinová, vedoucí protiepidemického odboru Kateřina Jedličková, referentka protiepidemického odboru Datum zpracování: 30/04/2011 VÝROČNÍ ZPRÁVA O EPIDEMIOLOGICKÉ
Zpracovaly pracovnice KHS Stč. kraje: MUDr. Markéta Korcinová, vedoucí protiepidemického odboru Kateřina Jedličková, referentka protiepidemického odboru Datum zpracování: 30/04/2011 VÝROČNÍ ZPRÁVA O EPIDEMIOLOGICKÉ
Příloha č.4 Seznam imunologických vyšetření
 Příloha č.6 Laboratorní příručka Laboratoří MeDiLa, v05 - Seznam imunologických Příloha č.4 Seznam imunologických Obsah IgA... 2 IgG... 3 IgM... 4 IgE celkové... 5 Informační zdroje:... 6 Stránka 1 z 6
Příloha č.6 Laboratorní příručka Laboratoří MeDiLa, v05 - Seznam imunologických Příloha č.4 Seznam imunologických Obsah IgA... 2 IgG... 3 IgM... 4 IgE celkové... 5 Informační zdroje:... 6 Stránka 1 z 6
Biologický materiál je tvořen vzorky tělních tekutin, tělesných sekretů, exkretů a tkání.
 Otázka: Druhy biologického materiálu Předmět: Biologie Přidal(a): moni.ka Druhy biologického materiálu Biologický materiál je tvořen vzorky tělních tekutin, tělesných sekretů, exkretů a tkání. Tělní tekutiny
Otázka: Druhy biologického materiálu Předmět: Biologie Přidal(a): moni.ka Druhy biologického materiálu Biologický materiál je tvořen vzorky tělních tekutin, tělesných sekretů, exkretů a tkání. Tělní tekutiny
1 Popis vzorku. 2 Detekční limit vyšetření. 3 Časová náročnost. 4 Zpracování vzorku. 4.1 Množství vzorku. 4.2 Odběr vzorků
 1 Popis vzorku Podle tohoto postupu se vyšetřují vzorky různých druhů masných výrobků. Pomocí histochemického barvení lze prokázat přítomnost škrobových zrn a na jejich základě vyslovit podezření o použití
1 Popis vzorku Podle tohoto postupu se vyšetřují vzorky různých druhů masných výrobků. Pomocí histochemického barvení lze prokázat přítomnost škrobových zrn a na jejich základě vyslovit podezření o použití
Dýchání (respirace, plícní ventilace) výměna plynů mezi organismem a prostředím.
 Dýchací soustava - Umožňuje okysličování krve a odvod oxidu uhličitého z organismu - Dýchací trubice tvořená hladkou svalovinou s kostěnou (dutina nosní) nebo chrupavčitá výztuž (dýchací trubice, průdušnice),
Dýchací soustava - Umožňuje okysličování krve a odvod oxidu uhličitého z organismu - Dýchací trubice tvořená hladkou svalovinou s kostěnou (dutina nosní) nebo chrupavčitá výztuž (dýchací trubice, průdušnice),
Autoři: Jan Sítař a Dominik Mališ Školitel: MVDr. Jana Petrášová, Ph.D. IVA 2014 FVL/1200/004 Modelové patomechanizmy v interaktivním powerpointu
 Patofyziologické procesy v dýchacím traktu Autoři: Jan Sítař a Dominik Mališ Školitel: MVDr. Jana Petrášová, Ph.D. IVA 2014 FVL/1200/004 Modelové patomechanizmy v interaktivním powerpointu Fyziologie dýchání
Patofyziologické procesy v dýchacím traktu Autoři: Jan Sítař a Dominik Mališ Školitel: MVDr. Jana Petrášová, Ph.D. IVA 2014 FVL/1200/004 Modelové patomechanizmy v interaktivním powerpointu Fyziologie dýchání
máme 2 druhy dýchání: VNĚJŠÍ plicní ventilace + výměna plynů mezi vzduchem a krví VNITŘNÍ výměna plynů mezi krví a tkáněmi + tkáňové dýchání
 je děj, při kterém organismus získává kyslík a spotřebovává vzdušný kyslík a vylučuje oxid uhličitý je složeno z 3 dějů 1. PLICNÍ VENTILACE = výměna vzduchu mezi vnějším prostředím a plícemi 2. VÝMĚNA
je děj, při kterém organismus získává kyslík a spotřebovává vzdušný kyslík a vylučuje oxid uhličitý je složeno z 3 dějů 1. PLICNÍ VENTILACE = výměna vzduchu mezi vnějším prostředím a plícemi 2. VÝMĚNA
III/2- Inovace a zkvalitnění výuky prostřednictvím IVT
 GYMNÁZIUM TÝN NAD VLTAVOU, HAVLÍČKOVA 13 Číslo projektu Číslo a název šablony klíčové aktivity Tematická oblast CZ.1.07/1.5.00/34.0437 III/2- Inovace a zkvalitnění výuky prostřednictvím IVT Člověk a příroda
GYMNÁZIUM TÝN NAD VLTAVOU, HAVLÍČKOVA 13 Číslo projektu Číslo a název šablony klíčové aktivity Tematická oblast CZ.1.07/1.5.00/34.0437 III/2- Inovace a zkvalitnění výuky prostřednictvím IVT Člověk a příroda
Serologické vyšetřovací metody
 Serologické vyšetřovací metody Serologické reakce Přímý průkaz Nepřímý průkaz průkaz antigenu průkaz nukleové kyseliny průkaz protilátek Nepřímý průkaz = průkaz specifických protilátek neboli průkaz serologický
Serologické vyšetřovací metody Serologické reakce Přímý průkaz Nepřímý průkaz průkaz antigenu průkaz nukleové kyseliny průkaz protilátek Nepřímý průkaz = průkaz specifických protilátek neboli průkaz serologický
Nemoci dýchací soustavy
 Nemoci dýchací soustavy EU peníze středním školám Didaktický učební materiál Anotace Označení DUMU: VY_32_INOVACE_BI1.16 Předmět: Biologie Tematická oblast: Biologie člověka Autor: RNDr. Marta Najbertová
Nemoci dýchací soustavy EU peníze středním školám Didaktický učební materiál Anotace Označení DUMU: VY_32_INOVACE_BI1.16 Předmět: Biologie Tematická oblast: Biologie člověka Autor: RNDr. Marta Najbertová
Přehled histologických barvení včetně imunohistochemie
 Přehled histologických barvení včetně imunohistochemie Výukový materiál pro praktická cvičení z histologie Anna Malečková Vytvořeno v rámci projektu OP VVV Zvýšení kvality vzdělávání na UK a jeho relevance
Přehled histologických barvení včetně imunohistochemie Výukový materiál pro praktická cvičení z histologie Anna Malečková Vytvořeno v rámci projektu OP VVV Zvýšení kvality vzdělávání na UK a jeho relevance
Mikrobiologické vyšetření jako podklad pro racionální cílenou antibiotickou terapii. Význam správné indikace vyšetření a dodržování
 Mikrobiologické vyšetření jako podklad pro racionální cílenou antibiotickou terapii. Význam správné indikace vyšetření a dodržování preanalytické fáze Tamara Bergerová Ústav mikrobiologie FN Plzeň Mikrobiologické
Mikrobiologické vyšetření jako podklad pro racionální cílenou antibiotickou terapii. Význam správné indikace vyšetření a dodržování preanalytické fáze Tamara Bergerová Ústav mikrobiologie FN Plzeň Mikrobiologické
LÉČBA VENTILÁTOROVÉ PNEUMONIE SPOLUPRÁCE INTENZIVISTY A MIKROBIOLOGA
 LÉČBA VENTILÁTOROVÉ PNEUMONIE SPOLUPRÁCE INTENZIVISTY A MIKROBIOLOGA Chytra I 1., Bergerová T 2. ARK FN v Plzeň 1 Ústav mikrobiologie, FN Plzeň 2 VAP definice, rozdělení spolupráce intenzivisty a mikrobiologa
LÉČBA VENTILÁTOROVÉ PNEUMONIE SPOLUPRÁCE INTENZIVISTY A MIKROBIOLOGA Chytra I 1., Bergerová T 2. ARK FN v Plzeň 1 Ústav mikrobiologie, FN Plzeň 2 VAP definice, rozdělení spolupráce intenzivisty a mikrobiologa
Rapid-VIDITEST Listeria Card (Jednokrokový kazetový test pro detekci Listeria monocytogenes.)
 Rapid-VIDITEST Listeria Card (Jednokrokový kazetový test pro detekci Listeria monocytogenes.) Návod k použití soupravy Výrobce: VIDIA spol. s r.o., Nad Safinou II č.365, Vestec u Prahy, 252 42 Jesenice,
Rapid-VIDITEST Listeria Card (Jednokrokový kazetový test pro detekci Listeria monocytogenes.) Návod k použití soupravy Výrobce: VIDIA spol. s r.o., Nad Safinou II č.365, Vestec u Prahy, 252 42 Jesenice,
Příloha č.4 Seznam imunologických vyšetření. Obsah. Seznam imunologických vyšetření
 Příloha č.4 Seznam imunologických vyšetření Obsah IgA... 2 IgG... 3 IgM... 4 IgE celkové... 5 Informační zdroje:... 6 Stránka 1 z 6 Název: IgA Zkratka: IgA Typ: kvantitativní Princip: turbidimetrie Jednotky:
Příloha č.4 Seznam imunologických vyšetření Obsah IgA... 2 IgG... 3 IgM... 4 IgE celkové... 5 Informační zdroje:... 6 Stránka 1 z 6 Název: IgA Zkratka: IgA Typ: kvantitativní Princip: turbidimetrie Jednotky:
Rapid-VIDITEST. H. pylori. (Jednokrokový blisterový test pro in vitro diagnostiku Helicobacter pylori ve stolici) Návod k použití soupravy
 Rapid-VIDITEST H. pylori (Jednokrokový blisterový test pro in vitro diagnostiku Helicobacter pylori ve stolici) Návod k použití soupravy Výrobce: VIDIA spol. s r.o., Nad Safinou II 365, Vestec, 252 42
Rapid-VIDITEST H. pylori (Jednokrokový blisterový test pro in vitro diagnostiku Helicobacter pylori ve stolici) Návod k použití soupravy Výrobce: VIDIA spol. s r.o., Nad Safinou II 365, Vestec, 252 42
Cévní mozková příhoda. Petr Včelák
 Cévní mozková příhoda Petr Včelák 12. 2. 2015 Obsah 1 Cévní mozková příhoda... 1 1.1 Příčiny mrtvice... 1 1.2 Projevy CMP... 1 1.3 Případy mrtvice... 1 1.3.1 Česko... 1 1.4 Diagnóza a léčba... 2 1.5 Test
Cévní mozková příhoda Petr Včelák 12. 2. 2015 Obsah 1 Cévní mozková příhoda... 1 1.1 Příčiny mrtvice... 1 1.2 Projevy CMP... 1 1.3 Případy mrtvice... 1 1.3.1 Česko... 1 1.4 Diagnóza a léčba... 2 1.5 Test
Neobvyklý případ plicní mykobakteriózy
 Neobvyklý případ plicní mykobakteriózy Lacina L. 1, Bartošová H. 1, Benková K. 2, Dryák P. 3 1) Klinika pneumologie a hrudní chirurgie FN Bulovka, Praha 2) Oddělení patologie, FN Bulovka, Praha 3) Oddělení
Neobvyklý případ plicní mykobakteriózy Lacina L. 1, Bartošová H. 1, Benková K. 2, Dryák P. 3 1) Klinika pneumologie a hrudní chirurgie FN Bulovka, Praha 2) Oddělení patologie, FN Bulovka, Praha 3) Oddělení
Zánětlivé parametry pro diagnostiku sepse. Mgr. Zuzana Kučerová
 Zánětlivé parametry pro diagnostiku sepse Mgr. Zuzana Kučerová Sepsis - III Sepse je život ohrožující orgánová dysfunkce způsobená dysregulovanou odpovědí hostitelského organismu na přítomnost infekce
Zánětlivé parametry pro diagnostiku sepse Mgr. Zuzana Kučerová Sepsis - III Sepse je život ohrožující orgánová dysfunkce způsobená dysregulovanou odpovědí hostitelského organismu na přítomnost infekce
