ABR a iontového hospodářství
|
|
|
- Kristina Dušková
- před 8 lety
- Počet zobrazení:
Transkript
1 Poruchy acidobazické rovnováhy Patobiochemie a diagnostika poruch ABR a iontového hospodářství
2 Regulace kyselosti vnitřního prostředí CO 2 NH 3 tvorba močoviny glutaminu H + HCO - 3 Martin Vejražka, 2007
3 Hydrogenuhličitanový pufr H 2 O + CO 2 H 2 CO 3 HCO 3 + H +
4 Hendersonova-Hasselbalchova Hasselbalchova rovnice ph = pk + a [ HCO ] log 3 [ H CO ] 2 3 pk a = 6,1 [HCO 3- ] = 24 [ HCO 3 ] = 20 [H 2 CO 3 ] = 1,2 [ H CO ] 2 3
5 Hendersonova-Hasselbalchova Hasselbalchova rovnice ph = pk + a a 3 ] log [ HCO α pco 2 pk a = 6,1 [HCO 3- ] = 24 α = 0,224 / kpa pco 2 = 5,3 kpa
6 Hydrogenuhličitanový pufr tkáň H 2 O + CO 2 H 2 CO 3 HCO 3 + H + plíce ledviny
7 Hydrogenuhličitanový pufr CO 2 H + H 2 CO 3 H 2 O HCO - 3 Pozn.: Velikost krabiček v tomto obrázku nemá stálé měřítko!
8 Hydrogenuhličitanový pufr CO 2 H + H 2 CO 3 H 2 O HCO - 3
9 Hydrogenuhličitanový pufr CO 2 H + H 2 CO 3 H 2 O HCO - 3
10 Hydrogenuhličitanový pufr plíce CO 2 H + H 2 CO 3 H 2 O HCO - 3
11 Hydrogenuhličitanový pufr plíce CO 2 H + H 2 CO 3 H 2 O HCO - 3
12 Hydrogenuhličitanový pufr CO 2 H + H 2 CO 3 H 2 O HCO - 3 Respirační složka Metabolická složka Martin Vejražka, 2007
13 Aktuální a standardní hydrogenuhličitany CO 2 H + H 2 CO 3 H 2 O HCO - 3
14 Aktuální a standardní hydrogenuhličitany CO 2 H + H 2 CO 3 H 2 O HCO - 3 Martin Vejražka, 2007
15 ABR a ionty
16 ABR a draslík Dochází ke směně K + a H + na buněčné membráně acidémie hyperkalémie alkalémie hypokalémie hyperkalémie acidémie hypokalémie alkalémie
17 ABR a vápník Výměna H + a Ca 2+ vázaných na plazmatických bílkovinách acidémie hyperkalcémie alkalémie hypokalcémie
18 ABR a ionty Na + Cl HCO 3 - Musí být zachována elektroneutralita ABR tak ovlivňuje minerálový metabolismus Odchylky koncentrace iontů se nejsnáze kompenzují změnou koncentrace HCO - 3 Ca Mg Ca 2+ Mg 2+ K + prot - SO 2-4, HPO 2-4, laktát, ketokyseliny
19 Hypochloremická alkalóza Na + Nedostatek Cl - je kompenzován zvýšením koncentrace HCO - 3 Cl 3 Cl Změna poměru bikarbonátu a CO 2 vede k alkalóze Doprovází např. zvracení HCO 3 - Ca Mg Ca 2+ Mg 2+ K + prot - SO 2-4, HPO 2-4, laktát, ketokyseliny
20 Hypochloremická alkalóza HCl HCO 3 - CO 2 Cl - H + H 2 CO 3 Chloridy se nahrazují hydrogenuhličitany HCO 3- stoupá, pco 2 se nemění Martin Vejražka, 2007
21 Acidobazická rovnováha Neuvažuj v první řadě o změně koncentrace ale o změně H + nebo OH - koncentrace hlavních iontů změna ph je až druhotná v důsledku změny poměru v HCO 3- / pco 2 Martin Vejražka, 2007
22 Ketoacidóza Na + Cl Nadbytek kyseliny β-hydroxymáselné a acetoctové způsobí pokles koncentrace bikarbonátu Např. dekompenzovaný diabetes mellitus, hladovění HCO 3 - Ca Mg Ca 2+ Mg 2+ K + prot - SO 2-4, HPO 2-4, laktát, ketokyseliny
23 Poruchy ABR Acidémie, alkalémie odchylka ph krve od normy Acidóza, alkalóza přebytek/nedostatek kyselin/bazí
24 Alkalémie Ca 2+ neuromuskulární dráždivosti K + poruchy srdečního rytmu Posun disociační křivky hemoglobinu hypoxie tkání
25 Poruchy ABR Kompenzace Metabolická porucha se kompenzuje respirací a naopak Korekce metabolická porucha se koriguje metabolicky Rozvoj kompenzačních mechanismů: respirace: 12 až 24 hodin ledviny: asi 5 dní
26 Metabolická acidóza (MAC) Laktátová acidóza hypoxie, snížené odbourávání laktátu Ketoacidóza diabetes, hladovění, alkoholismus Renální acidóza hromadění sulfátů, fosfátů Intoxikace
27 MAC ze ztrát HCO - 3 Průjmy a jiné ztráty z GIT Renální tubulární acidóza porucha resorpce HCO 3- v tubulech Diluční acidóza podání většího množství infuzí bez nárazníkového systému (pco 2 konstantní, HCO 3- se rychle naředí)
28 Princip léčby MAC NaHCO 3 soli organických kyselin org. kyseliny se metabolizují v Krebsově cyklu na HCO - 3 Ringerův roztok s laktátem
29 Metabolická alkalóza (MAL) Nadměrné ztráty chloridů zvracení, některá diuretika Dehydratace (koncentrační alkalóza) Hypoproteinémie Hyperaldosteronismus retence Na + na úkor K + a H +
30 Paradoxní acidurie alkalóza EC K + IC H + odpad H + močí (a resorpce HCO 3- ) - prohloubení alkalózy v ledvinách namísto Na + K + se mění Na + H + K +
31 Princip léčby MAL Argininchlorid NaCl doplnění Cl - místo NaH 2 PO 4 se vylučuje Na 2 HPO 4 diluce HCO - 3 KCl navíc i korekce hypokalémie
32 Vyšetření podle Astrupa 7,4 5,3 24,0 24,0 0,0 12,0 98,0 27,0
33 Vyšetření podle Astrupa ph 7,4 5,3 24,0 24,0 0,0 12,0 98,0 27,0 Aktuální ph krve NH: 7,40 ± 0,04
34 Vyšetření podle Astrupa ph pco 2 7,4 5,3 24,0 24,0 0,0 12,0 98,0 27,0 kpa Parciální tlak CO 2 NH: 5,3 ± 0,5 kpa Respirační složka
35 Vyšetření podle Astrupa ph pco 2 HCO - 3- akt. 7,4 5,3 24,0 24,0 0,0 12,0 98,0 27,0 kpa Aktuální hydrogenuhličitany NH: 24 ± 2
36 Vyšetření podle Astrupa ph pco 2 HCO - 3- akt. HCO 3- std. 7,4 5,3 24,0 24,0 0,0 12,0 98,0 27,0 kpa Standardní HCO - 3 kolik by bylo HCO 3- při nasycení krve na 5,3 kpa CO 2 NH: 24 ± 2
37 Vyšetření podle Astrupa ph pco 2 HCO - 3- akt. HCO 3- std. BE 7,4 5,3 24,0 24,0 0,0 12,0 98,0 27,0 kpa Přebytek bazí (base excess) kolik by bylo nutné přidat silné kyseliny při nasycení krve na pco 2 = 5,3 kpa, aby ph = 7,4 NH: 0 ± 2,5 Metabolická složka
38 Vyšetření podle Astrupa ph pco 2 HCO - 3- akt. HCO 3- std. BE po 2 7,4 5,3 24,0 24,0 0,0 12,0 98,0 27,0 kpa kpa Parciální tlak O 2 NH: 10,0-13,3 kpa Podíl respirace na změnách ABR
39 Vyšetření podle Astrupa ph pco 2 HCO - 3- akt. HCO 3- std. BE po 2 sat. O 2 7,4 5,3 24,0 24,0 0,0 12,0 98,0 27,0 kpa kpa % Saturace hemoglobinu kyslíkem NH: % Výhodný pro kontrolu validity výsledků
40 Vyšetření podle Astrupa ph pco 2 HCO - 3- akt. HCO 3- std. BE po 2 sat. O 2 celk. CO 2 7,4 5,3 24,0 24,0 0,0 12,0 98,0 27,0 kpa kpa % Celkové uhličitany, tj. CO 2 + H 2 CO 3 + HCO - 3
41 Vyšetření podle Astrupa Plná heparinizovaná krev kapilární (arterializovaná) arteriální venózní
42 Selhání jater Alkalóza hypoproteinémie hyperaldosteronismus pokles ureosyntézy z amoniaku
43 Selhání ledvin Acidóza pokles eliminace fosfátů a sulfátů nedostatečná acidifikace moči
44 Kombinované poruchy ABR MAC + MAL zvracení + hladovění zvracení + průjem urémie + zvracení hepatorenální selhání MAC + RAL otrava salicyláty
45 Kombinované poruchy ABR 2 MAC dekompenzovaný diabetes mellitus ketoacidóza + hypovolémie laktátová MAC RAC + MAC kardiopulmonální selhání
46 Kazuistika 1 ph pco 2 HCO - 3- akt. HCO 3- std. BE po 2 sat. O 2 celk. CO 2 7,156 4,15 11,1 12,4-15,7 10,1 90,8 12,1 kpa kpa % Na 141 K 6,2 Cl 110 mmol.l -1 CB 58,8 g.l -1
47 Kazuistika 2 ph pco 2 HCO - 3- akt. HCO 3- std. BE po 2 sat. O 2 celk. CO 2 7,378 4,49 19,4 20,7-4,4 8,8 92,4 16,9 kpa kpa % Na 141 K 4,6 Cl 106 mmol.l -1 CB 65,7 g.l -1
48 Kazuistika 3 ph pco 2 HCO - 3- akt. HCO 3- std. BE po 2 sat. O 2 celk. CO 2 7,454 5,0 25,9 26,1 2,6 5,2 76,4 22,4 kpa kpa % Na 137 K 4,6 Cl 107 mmol.l -1 CB 48,8 g.l -1
49 Kazuistika 4 ph pco 2 HCO - 3- akt. HCO 3- std. BE po 2 sat. O 2 celk. CO 2 7,39 3,94 17,5 19,6-5,7 7,1 87,2 15,3 kpa kpa % Na 137 K 5,8 Cl??? mmol.l -1 CB 62,3 g.l -1
50 Poruchy acidobazické rovnováhy Patobiochemie a diagnostika poruch ABR a iontového hospodářství
ABR a iontového hospodářství
 Poruchy acidobazické rovnováhy Patobiochemie a diagnostika poruch ABR a iontového hospodářství Připojte se! Room name: ABR http://b.socrative.com Regulace kyselosti vnitřního prostředí CO 2 NH 3 tvorba
Poruchy acidobazické rovnováhy Patobiochemie a diagnostika poruch ABR a iontového hospodářství Připojte se! Room name: ABR http://b.socrative.com Regulace kyselosti vnitřního prostředí CO 2 NH 3 tvorba
Plasma a většina extracelulární
 Acidobazická rovnováha Tato prezentace je přístupná online Fyziologické ph Plasma a většina extracelulární tekutiny ph = 7,40 ± 0,02 Význam stálého ph Na ph závisí vlastnosti bílkovin aktivita enzymů struktura
Acidobazická rovnováha Tato prezentace je přístupná online Fyziologické ph Plasma a většina extracelulární tekutiny ph = 7,40 ± 0,02 Význam stálého ph Na ph závisí vlastnosti bílkovin aktivita enzymů struktura
Vyšetřování a léčba poruch acidobazické rovnováhy
 Vyšetřování a léčba poruch acidobazické rovnováhy Vladimír Soška Oddělení klinické biochemie Fyziologické hodnoty ABR Parametr Jednotka Normální meze Kritické hodnoty ph 7.35-7.45 < 7.1; > 7.6 pco 2 kpa
Vyšetřování a léčba poruch acidobazické rovnováhy Vladimír Soška Oddělení klinické biochemie Fyziologické hodnoty ABR Parametr Jednotka Normální meze Kritické hodnoty ph 7.35-7.45 < 7.1; > 7.6 pco 2 kpa
Acidobazická rovnováha H+ a ph Vodíkový iont se skládá z protonu, kolem něhož neobíhá žádný elektron. Proto je vodíkový iont velmi malý a je
 Acidobazická rovnováha 14.4.2004 H+ a ph Vodíkový iont se skládá z protonu, kolem něhož neobíhá žádný elektron. Proto je vodíkový iont velmi malý a je extrémně reaktivní. Má proto velmi hluboký vliv na
Acidobazická rovnováha 14.4.2004 H+ a ph Vodíkový iont se skládá z protonu, kolem něhož neobíhá žádný elektron. Proto je vodíkový iont velmi malý a je extrémně reaktivní. Má proto velmi hluboký vliv na
Poruchy vnitřního prostředí. v intenzivní medicíně
 Poruchy vnitřního prostředí v intenzivní medicíně Vnitřní prostředí = extracelulární tekutina (plazma, intersticiální tekutina) Poruchy objemu a osmolality Poruchy iontů (Na, K, Ca, Mg, Cl) Poruchy acidobazické
Poruchy vnitřního prostředí v intenzivní medicíně Vnitřní prostředí = extracelulární tekutina (plazma, intersticiální tekutina) Poruchy objemu a osmolality Poruchy iontů (Na, K, Ca, Mg, Cl) Poruchy acidobazické
Acidobazická rovnováha 11
 Acidobazická rovnováha 11 Iontogram krevní plazmy, AG, SID, BB s, pufrační systémy, hydrogenuhličitanový pufr. Poruchy acidobazické rovnováhy. 1. Jaký je princip měření a? 2. Které kyslíkové parametry
Acidobazická rovnováha 11 Iontogram krevní plazmy, AG, SID, BB s, pufrační systémy, hydrogenuhličitanový pufr. Poruchy acidobazické rovnováhy. 1. Jaký je princip měření a? 2. Které kyslíkové parametry
Jana Fauknerová Matějčková
 Jana Fauknerová Matějčková kyselina (HA) acidóza (acidémie) báze (B ) alkalóza (alkalémie) pufr ph = pk + log cs / ca koncentrace [H + ] v krvi udržována pomocí plic, ledvin a jater okolo 40 nm ph = log
Jana Fauknerová Matějčková kyselina (HA) acidóza (acidémie) báze (B ) alkalóza (alkalémie) pufr ph = pk + log cs / ca koncentrace [H + ] v krvi udržována pomocí plic, ledvin a jater okolo 40 nm ph = log
Produkce kyselin v metabolismu Těkavé: 15,000 mmol/den kyseliny uhličité, vyloučena plícemi jako CO 2 Netěkavé kyseliny (1 mmol/kg/den) jsou vyloučeny
 Vnitřní prostředí a acidobazická rovnováha 13.12.2004 Vnitřní prostředí Sestává z posuzování složení extracelulární tekutiny z hlediska izohydrie (= optimální koncentrace ph) izoionie (= optimální koncentrace
Vnitřní prostředí a acidobazická rovnováha 13.12.2004 Vnitřní prostředí Sestává z posuzování složení extracelulární tekutiny z hlediska izohydrie (= optimální koncentrace ph) izoionie (= optimální koncentrace
Acidobazická rovnováha (ABR)
 Acidobazická rovnováha (ABR) Definice ph ph = log c(h + ) ph = 7,4 c(h + ) = 40 nm (H + ) = ph kyselina látka odštěpující H + (Arrhenius) nebo donor H + (Brönsted) zásada látka odštěpující OH (Arrhenius)
Acidobazická rovnováha (ABR) Definice ph ph = log c(h + ) ph = 7,4 c(h + ) = 40 nm (H + ) = ph kyselina látka odštěpující H + (Arrhenius) nebo donor H + (Brönsted) zásada látka odštěpující OH (Arrhenius)
3.8. Acidobazická regulace
 3.8. Acidobazická regulace Tabulka 3.8. 1: Referenční intervaly Parametr Muži Ženy ph 7,37 7,43 7,37 7,43 pco 2 (kpa) 4,7 6,0 4,3 5,7 - aktuální HCO 3 (mmol/l) 23,6 27,6 21,8 27,2 - standardní HCO 3 (mmol/l)
3.8. Acidobazická regulace Tabulka 3.8. 1: Referenční intervaly Parametr Muži Ženy ph 7,37 7,43 7,37 7,43 pco 2 (kpa) 4,7 6,0 4,3 5,7 - aktuální HCO 3 (mmol/l) 23,6 27,6 21,8 27,2 - standardní HCO 3 (mmol/l)
Diagnostika poruch acidobazické rovnováhy
 Návod do cvičení Diagnostika poruch acidobazické rovnováhy Úvod Stálost tzv. vnitřního prostředí je nezbytnou podmínkou života vyšších organismů. Důležitá je zejména hodnota ph. Na hodnotě ph závisí mimo
Návod do cvičení Diagnostika poruch acidobazické rovnováhy Úvod Stálost tzv. vnitřního prostředí je nezbytnou podmínkou života vyšších organismů. Důležitá je zejména hodnota ph. Na hodnotě ph závisí mimo
tělní buňky tělní tekutiny krev erythrocyty 7.28 thrombocyty 7.0 žaludeční šťáva buňky kosterního svalstva duodenální šťáva
 Acidobazická rovnováha homeostasa H + iontů Regulace vnitřního prostředí Udržování osmotické koncetrace solí, minerálů, eáů, Vztahy acidobazické rovnováhy Stálost = acidobazická rovnováha (stav) Regulace
Acidobazická rovnováha homeostasa H + iontů Regulace vnitřního prostředí Udržování osmotické koncetrace solí, minerálů, eáů, Vztahy acidobazické rovnováhy Stálost = acidobazická rovnováha (stav) Regulace
Acidobazická rovnováha. H. Vaverková
 Acidobazická rovnováha H. Vaverková Acidobazická rovnováha ph arteriální krve a intersticiální tekutiny normálně kolísá v rozmezí 7,35-7,45 ph kompatibilní s životem: 6,8-7,8 ph < 7,35 = acidóza, ph >7,45
Acidobazická rovnováha H. Vaverková Acidobazická rovnováha ph arteriální krve a intersticiální tekutiny normálně kolísá v rozmezí 7,35-7,45 ph kompatibilní s životem: 6,8-7,8 ph < 7,35 = acidóza, ph >7,45
Diagnostika a léčba poruch acidobazické rovnováhy. J. Vymětal 3. interní klinika nefrologická, revmatologická a endokrinologická
 Diagnostika a léčba poruch acidobazické rovnováhy J. Vymětal 3. interní klinika nefrologická, revmatologická a endokrinologická ph alkalita/acidita vnitřního prostředí 7,4 ± 0,04 mmol/l pco 2 respirační
Diagnostika a léčba poruch acidobazické rovnováhy J. Vymětal 3. interní klinika nefrologická, revmatologická a endokrinologická ph alkalita/acidita vnitřního prostředí 7,4 ± 0,04 mmol/l pco 2 respirační
Monitoring vnitřního prostředí pacienta
 Monitoring vnitřního prostředí pacienta MVDr. Leona Raušerová -Lexmaulová, Ph.D. Klinika chorob psů a koček VFU Brno Vnitřní prostředí Voda Ionty Bílkoviny Cukry Tuky Důležité faktory Obsah vody Obsah
Monitoring vnitřního prostředí pacienta MVDr. Leona Raušerová -Lexmaulová, Ph.D. Klinika chorob psů a koček VFU Brno Vnitřní prostředí Voda Ionty Bílkoviny Cukry Tuky Důležité faktory Obsah vody Obsah
Výpočty koncentrací. objemová % (objemový zlomek) krvi m. Vsložky. celku. Objemy nejsou aditivní!!!
 Výpočty koncentrací objemová % (objemový zlomek) Vsložky % obj. = 100 V celku Objemy nejsou aditivní!!! Příklad: Kolik ethanolu je v 700 ml vodky (40 % obj.)? Kolik promile ethanolu v krvi bude mít muž
Výpočty koncentrací objemová % (objemový zlomek) Vsložky % obj. = 100 V celku Objemy nejsou aditivní!!! Příklad: Kolik ethanolu je v 700 ml vodky (40 % obj.)? Kolik promile ethanolu v krvi bude mít muž
Acidobazická rovnováha
 Acidobazická rovnováha Klepnutím lze upravit styl předlohy podnadpisů. MUDr. Jiří Dvorský, NMB Vnitřní prostředí Pod pojmem vnitřní prostředí chápeme extracelulární tekutinu (včetně jejího složení) omývající
Acidobazická rovnováha Klepnutím lze upravit styl předlohy podnadpisů. MUDr. Jiří Dvorský, NMB Vnitřní prostředí Pod pojmem vnitřní prostředí chápeme extracelulární tekutinu (včetně jejího složení) omývající
3 Acidobazické reakce
 3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
Diagnostika a léčba poruch acidobazické rovnováhy. J. Vymětal 3. interní klinika nefrologická, revmatologická a endokrinologická
 Diagnostika a léčba poruch acidobazické rovnováhy J. Vymětal 3. interní klinika nefrologická, revmatologická a endokrinologická ph alkalita/acidita vnitřního prostředí 7,4 ± 0,04 mmol/l pco 2 respirační
Diagnostika a léčba poruch acidobazické rovnováhy J. Vymětal 3. interní klinika nefrologická, revmatologická a endokrinologická ph alkalita/acidita vnitřního prostředí 7,4 ± 0,04 mmol/l pco 2 respirační
Chemické výpočty II. Vladimíra Kvasnicová
 Chemické výpočty II Vladimíra Kvasnicová Převod jednotek pmol/l nmol/l µmol/l mmol/l mol/l 10-12 10-9 10-6 10-3 mol/l µg mg g 10-6 10-3 g µl ml dl L 10-6 10-3 10-1 L Cvičení 12) cholesterol (MW=386,7g/mol):
Chemické výpočty II Vladimíra Kvasnicová Převod jednotek pmol/l nmol/l µmol/l mmol/l mol/l 10-12 10-9 10-6 10-3 mol/l µg mg g 10-6 10-3 g µl ml dl L 10-6 10-3 10-1 L Cvičení 12) cholesterol (MW=386,7g/mol):
Hlavní ukazatele acidobazické rovnováhy
 Hlavní ukazatele acidobazické rovnováhy Pro vyšetření parametrů acidobazické rovnováhy (ABR) se odebírá krev arteriální nebo arterilizovaná. Arteriální krev se odebírá z artérií do heparinizovaných zkumavek
Hlavní ukazatele acidobazické rovnováhy Pro vyšetření parametrů acidobazické rovnováhy (ABR) se odebírá krev arteriální nebo arterilizovaná. Arteriální krev se odebírá z artérií do heparinizovaných zkumavek
3 Acidobazické reakce
 3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
VNITŘNÍ PROSTŘEDÍ. Biochemický ústav LF MU (V.P.) 2007
 1 VNITŘNÍ PROSTŘEDÍ Biochemický ústav LF MU (V.P.) 2007 2 Vnitřní prostředí: Claude Bernard, 1878: Co je vnitřní prostředí? Je to krev, ve skutečnosti však nikoliv celá, nýbrž tekutá část krve, krevní
1 VNITŘNÍ PROSTŘEDÍ Biochemický ústav LF MU (V.P.) 2007 2 Vnitřní prostředí: Claude Bernard, 1878: Co je vnitřní prostředí? Je to krev, ve skutečnosti však nikoliv celá, nýbrž tekutá část krve, krevní
P. Schneiderka, Ústav patologické fyziologie LFUP a OKB FN Olomouc
 P. Schneiderka, Ústav patologické fyziologie LFUP a OKB FN Olomouc Acidobazický stav organismu Verze 27.9. 2012 Úvod Za průkopníka znalostí o acidobazickém stavu organismu (ABS) lze považovat amerického
P. Schneiderka, Ústav patologické fyziologie LFUP a OKB FN Olomouc Acidobazický stav organismu Verze 27.9. 2012 Úvod Za průkopníka znalostí o acidobazickém stavu organismu (ABS) lze považovat amerického
Stewart Fenclův koncept hodnocení poruch ABR
 Stewart Fenclův koncept hodnocení poruch ABR František Duška Klinika anesteziologie a resuscitace a Ústav lék. chemie a biochemie 3. LF UK Motto: Republika nepotřebuje chemiky! Roberspierre při vynášení
Stewart Fenclův koncept hodnocení poruch ABR František Duška Klinika anesteziologie a resuscitace a Ústav lék. chemie a biochemie 3. LF UK Motto: Republika nepotřebuje chemiky! Roberspierre při vynášení
PARENTERÁLNÍ VÝŽIVA 1
 PARENTERÁLNÍ VÝŽIVA 1 2 3 4 5 6 7 8 9 10 Cukr a tuk: 1/ glukosa je (aerobně) metabolizována na acetyl-coa. Jeho nadbytek, neodbouraný v Krebsově cyklu, může být přeměněn na mastné kyseliny (ev. na cholesterol)
PARENTERÁLNÍ VÝŽIVA 1 2 3 4 5 6 7 8 9 10 Cukr a tuk: 1/ glukosa je (aerobně) metabolizována na acetyl-coa. Jeho nadbytek, neodbouraný v Krebsově cyklu, může být přeměněn na mastné kyseliny (ev. na cholesterol)
Acidobazický stav organismu
 Acidobazický stav organismu Doc. MUDr. Petr Schneiderka CSc. Tvorba a ověření e-learningového prostředí pro integraci výuky preklinických a klinických předmětů na LF UP a FZV UP Reg. č.: CZ.1.07/2.2.00/15.0313
Acidobazický stav organismu Doc. MUDr. Petr Schneiderka CSc. Tvorba a ověření e-learningového prostředí pro integraci výuky preklinických a klinických předmětů na LF UP a FZV UP Reg. č.: CZ.1.07/2.2.00/15.0313
KAZUISTIKY Z LABORATORNÍ MEDICÍNY
 KAZUISTIKY Z LABORATORNÍ MEDICÍNY Jaroslav Racek Ústav klinické biochemie a hematologie LF UK a FN v Plzni Dialog 2019, zámek Valeč, 7. 9. 4. 2019 KAZUISTIKA I O T R AVA M E T F O R M I N E M A A C E I
KAZUISTIKY Z LABORATORNÍ MEDICÍNY Jaroslav Racek Ústav klinické biochemie a hematologie LF UK a FN v Plzni Dialog 2019, zámek Valeč, 7. 9. 4. 2019 KAZUISTIKA I O T R AVA M E T F O R M I N E M A A C E I
Jana Fauknerová Matějčková
 Jana Fauknerová Matějčková převody jednotek výpočet ph ph vodných roztoků ph silných kyselin a zásad ph slabých kyselin a zásad, disociační konstanta, pk ph pufrů koncentace 1000mg př. g/dl mg/l = = *10000
Jana Fauknerová Matějčková převody jednotek výpočet ph ph vodných roztoků ph silných kyselin a zásad ph slabých kyselin a zásad, disociační konstanta, pk ph pufrů koncentace 1000mg př. g/dl mg/l = = *10000
Veterinární analyzátor POCT Parametry acidobazické rovnováhy a ionty
 email: inlab@inlab.cz Veterinární analyzátor POCT Parametry acidobazické rovnováhy a ionty Sodík, draslík, chloridy, ionizovaný vápník, ph a pco 2: Prvky jsou měřeny potenciometricky ion selektivními elektrodami.
email: inlab@inlab.cz Veterinární analyzátor POCT Parametry acidobazické rovnováhy a ionty Sodík, draslík, chloridy, ionizovaný vápník, ph a pco 2: Prvky jsou měřeny potenciometricky ion selektivními elektrodami.
Acidobazická rovnováha a její vztahy k iontovému hospodářství. Klinické aplikace.
 Text použit s laskavým svolením autora. Acidobazická rovnováha a její vztahy k iontovému hospodářství. Klinické aplikace. Antonín Jabor Oddělení klinické biochemie Nemocnice Kladno Část 1. Relevantní parametry
Text použit s laskavým svolením autora. Acidobazická rovnováha a její vztahy k iontovému hospodářství. Klinické aplikace. Antonín Jabor Oddělení klinické biochemie Nemocnice Kladno Část 1. Relevantní parametry
Projekt: Digitální učební materiály ve škole, registrační číslo projektu CZ.1.07/1.5.00/34.0527
 Projekt: Digitální učební materiály ve škole, registrační číslo projektu CZ.1.07/1.5.00/34.0527 Příjemce: Střední zdravotnická škola a Vyšší odborná škola zdravotnická, Husova 3, 371 60 České Budějovice
Projekt: Digitální učební materiály ve škole, registrační číslo projektu CZ.1.07/1.5.00/34.0527 Příjemce: Střední zdravotnická škola a Vyšší odborná škola zdravotnická, Husova 3, 371 60 České Budějovice
analyzátor POCT Parametry acidobazické rovnováhy a ionty
 email: inlab@inlab.cz analyzátor POCT Parametry acidobazické rovnováhy a ionty Sodík, draslík, chloridy, ionizovaný vápník, ph a pco 2: Prvky jsou měřeny potenciometricky ion selektivními elektrodami.
email: inlab@inlab.cz analyzátor POCT Parametry acidobazické rovnováhy a ionty Sodík, draslík, chloridy, ionizovaný vápník, ph a pco 2: Prvky jsou měřeny potenciometricky ion selektivními elektrodami.
Acidobazické regulace
 ZÁKLADY OBECNÉ A KLINICKÉ BIOCHEMIE 2004 Acidobazické regulace Antonín Kazda kapitola ve skriptech 3.8 Klasifikace acidobazických ch poruch Porucha ACIDOSA ALKALOSA I. Respirační PCO2 II. Nerespirační
ZÁKLADY OBECNÉ A KLINICKÉ BIOCHEMIE 2004 Acidobazické regulace Antonín Kazda kapitola ve skriptech 3.8 Klasifikace acidobazických ch poruch Porucha ACIDOSA ALKALOSA I. Respirační PCO2 II. Nerespirační
1. Poruchy glomerulární filtrace
 LEDVINY 1. Poruchy glomerulární filtrace 2. Nefrotický syndrom 3. Poruchy činnosti tubulů 4. Oligurie, polyurie 5. Nefrolithiasis 6. Průtok krve ledvinou a jeho poruchy 7. Akutní selhání ledvin 8. Chronické
LEDVINY 1. Poruchy glomerulární filtrace 2. Nefrotický syndrom 3. Poruchy činnosti tubulů 4. Oligurie, polyurie 5. Nefrolithiasis 6. Průtok krve ledvinou a jeho poruchy 7. Akutní selhání ledvin 8. Chronické
Vliv infuzních roztoků na acidobazickou rovnováhu. Antonín Jabor IKEM Praha
 Vliv infuzních roztoků na acidobazickou rovnováhu Antonín Jabor IKEM Praha Fyziologický roztok Fyziologický roztok Incidence hyperchloridemie na konci operace je častá, je spojena s metabolickou acidózou,
Vliv infuzních roztoků na acidobazickou rovnováhu Antonín Jabor IKEM Praha Fyziologický roztok Fyziologický roztok Incidence hyperchloridemie na konci operace je častá, je spojena s metabolickou acidózou,
3 Acidobazické reakce
 3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
Těžká laktátová acidosa. Daniel Nalos, Věra Vondráková, Pavel Neumann. KAPIM Ústí nad Labem
 Těžká laktátová acidosa Daniel Nalos, Věra Vondráková, Pavel Neumann. KAPIM Ústí nad Labem Anamnesa 74 letá paní, žijící ve společné domácnosti s manželem, v chronické medikaci Letrox 1 tbl. Cilkanol 1tbl,
Těžká laktátová acidosa Daniel Nalos, Věra Vondráková, Pavel Neumann. KAPIM Ústí nad Labem Anamnesa 74 letá paní, žijící ve společné domácnosti s manželem, v chronické medikaci Letrox 1 tbl. Cilkanol 1tbl,
Anorganické látky v buňkách - seminář. Petr Tůma některé slidy převzaty od V. Kvasnicové
 Anorganické látky v buňkách - seminář Petr Tůma některé slidy převzaty od V. Kvasnicové Zastoupení prvků v přírodě anorganická hmota kyslík (O) 50% křemík (Si) 25% hliník (Al) 7% železo (Fe) 5% vápník
Anorganické látky v buňkách - seminář Petr Tůma některé slidy převzaty od V. Kvasnicové Zastoupení prvků v přírodě anorganická hmota kyslík (O) 50% křemík (Si) 25% hliník (Al) 7% železo (Fe) 5% vápník
Mendelova zemědělská a lesnická univerzita v Brně Agronomická fakulta Ústav morfologie, fyziologie a genetiky zvířat
 Mendelova zemědělská a lesnická univerzita v Brně Agronomická fakulta Ústav morfologie, fyziologie a genetiky zvířat Ukazatele acidobazické rovnováhy krve jalovic v průběhu výkrmu Bakalářská práce Vedoucí
Mendelova zemědělská a lesnická univerzita v Brně Agronomická fakulta Ústav morfologie, fyziologie a genetiky zvířat Ukazatele acidobazické rovnováhy krve jalovic v průběhu výkrmu Bakalářská práce Vedoucí
Elektrochemie. Předmět elektrochemie: disociace (roztoky elektrolytů, taveniny solí) vodivost. jevy na rozhraní s/l (elektrolýza, články)
 Elektrochemie 1/30 Předmět elektrochemie: disociace (roztoky elektrolytů, taveniny solí) vodivost jevy na rozhraní s/l (elektrolýza, články) Vodiče: vodivost způsobena pohybem elektronů uvnitř mřížky:
Elektrochemie 1/30 Předmět elektrochemie: disociace (roztoky elektrolytů, taveniny solí) vodivost jevy na rozhraní s/l (elektrolýza, články) Vodiče: vodivost způsobena pohybem elektronů uvnitř mřížky:
Acidobazická rovnováha pro pokročilé. František Duška KAR FNKV
 Acidobazická rovnováha pro pokročilé František Duška KAR FNKV Republika nepotřebuje chemiky! Roberspierre při vynášení rozsudku trestu smrti nad Lavoisierem 8. května 1794 28 letý muž, alkoholik. Přichází
Acidobazická rovnováha pro pokročilé František Duška KAR FNKV Republika nepotřebuje chemiky! Roberspierre při vynášení rozsudku trestu smrti nad Lavoisierem 8. května 1794 28 letý muž, alkoholik. Přichází
ZÁKLADNÍ CHEMICKÉ POJMY A ZÁKONY
 ZÁKLADNÍ CHEMICKÉ POJMY A ZÁKONY Klíčová slova: relativní atomová hmotnost (A r ), relativní molekulová hmotnost (M r ), Avogadrova konstanta (N A ), látkové množství (n, mol), molární hmotnost (M, g/mol),
ZÁKLADNÍ CHEMICKÉ POJMY A ZÁKONY Klíčová slova: relativní atomová hmotnost (A r ), relativní molekulová hmotnost (M r ), Avogadrova konstanta (N A ), látkové množství (n, mol), molární hmotnost (M, g/mol),
Chloridy v séru. Patofyziologické mechanismy ovlivňující koncentraci. Příčiny hypochlorémie. Nedostatečný přívod Zcela neslaná dieta
 Chloridy v séru Abstrakt Chloridy jsou hlavním aniontem extracelulární tekutiny, jejich koncentrace v séru je nižší než v arteriální krvi. Stanovení koncentrace chloridů v séru je základem pro interpretaci
Chloridy v séru Abstrakt Chloridy jsou hlavním aniontem extracelulární tekutiny, jejich koncentrace v séru je nižší než v arteriální krvi. Stanovení koncentrace chloridů v séru je základem pro interpretaci
BILANČNÍ PŘÍSTUP K MODELOVÁNÍ ACIDOBAZICKÉ ROVNOVÁHY A PŘENOSU KREVNÍCH PLYNŮ
 BILANČNÍ PŘÍSTUP K MODELOVÁNÍ ACIDOBAZICKÉ ROVNOVÁHY A PŘENOSU KREVNÍCH PLYNŮ Jiří Kofránek, Michal Andrlík, Stanislav Matoušek Anotace Navazujeme na popis našeho přístupu k modelování acidobazické rovnováhy
BILANČNÍ PŘÍSTUP K MODELOVÁNÍ ACIDOBAZICKÉ ROVNOVÁHY A PŘENOSU KREVNÍCH PLYNŮ Jiří Kofránek, Michal Andrlík, Stanislav Matoušek Anotace Navazujeme na popis našeho přístupu k modelování acidobazické rovnováhy
Acidobazická rovnováha a její poruchy
 Kyseliny y vs. báze Acidobazická rovnováha a její poruchy definice: BronstedLowry (192) normální A:B poměr 1:20 Kyselina: H donor Báze: H akceptor síla je definována jako tendence odevzdat (popř. přijmout)
Kyseliny y vs. báze Acidobazická rovnováha a její poruchy definice: BronstedLowry (192) normální A:B poměr 1:20 Kyselina: H donor Báze: H akceptor síla je definována jako tendence odevzdat (popř. přijmout)
Jana Fauknerová Matějčková
 Jana Fauknerová Matějčková po 2 arteriální krev 13,33 kpa (100 mm Hg) venózní krev 5,33 kpa (40 mm Hg) pco 2 arteriální krev 5,33 kpa (40 mm Hg) venózní krev 6,13 kpa (46 mm Hg) Hb váže 4 molekuly kyslíku
Jana Fauknerová Matějčková po 2 arteriální krev 13,33 kpa (100 mm Hg) venózní krev 5,33 kpa (40 mm Hg) pco 2 arteriální krev 5,33 kpa (40 mm Hg) venózní krev 6,13 kpa (46 mm Hg) Hb váže 4 molekuly kyslíku
Metabolismus kyslíku v organismu
 Metabolismus kyslíku v organismu Účinná respirace/oxygenace tkání záleží na dostatečném po 2 ve vdechovaném vzduchu ventilaci / perfuzi výměně plynů v plicích vazbě kyslíku na hemoglobin srdečním výdeji
Metabolismus kyslíku v organismu Účinná respirace/oxygenace tkání záleží na dostatečném po 2 ve vdechovaném vzduchu ventilaci / perfuzi výměně plynů v plicích vazbě kyslíku na hemoglobin srdečním výdeji
MVDr. Kateřina Pavlišová-Dembovská, Ph.D. Tato prezentace je spolufinancována Evropským sociálním fondem a státním rozpočtem České republiky.
 MVDr. Kateřina Pavlišová-Dembovská, Ph.D. Tato prezentace je spolufinancována Evropským sociálním fondem a státním rozpočtem České republiky. Diabetická ketoacidóza (DKA) Akutní život ohrožující stav
MVDr. Kateřina Pavlišová-Dembovská, Ph.D. Tato prezentace je spolufinancována Evropským sociálním fondem a státním rozpočtem České republiky. Diabetická ketoacidóza (DKA) Akutní život ohrožující stav
Autor kapitoly: MUDr.Pavel Pick, Ústav klinické biochemie VFN a 1.LF UK Praha
 Poruchy acidobazické regulace Autor kapitoly: MUDr.Pavel Pick, Ústav klinické biochemie VFN a 1.LF UK Praha 1. Úvod Poruchy acidobazické regulace (ABR) jsou stavy, které vznikají v úzké souvislosti se
Poruchy acidobazické regulace Autor kapitoly: MUDr.Pavel Pick, Ústav klinické biochemie VFN a 1.LF UK Praha 1. Úvod Poruchy acidobazické regulace (ABR) jsou stavy, které vznikají v úzké souvislosti se
Acidobazická rovnováha vývoj interpretace nálezn. lezů. A. Kazda
 Acidobazická rovnováha vývoj interpretace nálezn lezů A. Kazda Vyšet etřování acidobazické rovnováhy před p r. 1956 Bylo měřm ěřeno ph krve a vyšet etřen en celkový CO 2 (Total CO 2 ) např. van Slykeovým
Acidobazická rovnováha vývoj interpretace nálezn lezů A. Kazda Vyšet etřování acidobazické rovnováhy před p r. 1956 Bylo měřm ěřeno ph krve a vyšet etřen en celkový CO 2 (Total CO 2 ) např. van Slykeovým
Existují ideální iontové roztoky pro pacienty se SBS? Michal Žourek DPV Praha
 Existují ideální iontové roztoky pro pacienty se SBS? Michal Žourek DPV Praha 16.11.2007 Osnova Vstřebávání základních látek z GIT Hodnocení ABR Hodnocení změn: Na, K, Cl, Ca, P, Mg SBS a funkční změny
Existují ideální iontové roztoky pro pacienty se SBS? Michal Žourek DPV Praha 16.11.2007 Osnova Vstřebávání základních látek z GIT Hodnocení ABR Hodnocení změn: Na, K, Cl, Ca, P, Mg SBS a funkční změny
Biochemické laboratorní metody. Biochemické vyšetření Funkční zkoušky Vyšetření ledvin a močových cest
 Biochemické laboratorní metody Biochemické vyšetření Funkční zkoušky Vyšetření ledvin a močových cest Ionty I Na 135-144mmol/l hyponatrémie - diluce, hrudní infekce, nedostatek energie hypernatrémie dehydratace,
Biochemické laboratorní metody Biochemické vyšetření Funkční zkoušky Vyšetření ledvin a močových cest Ionty I Na 135-144mmol/l hyponatrémie - diluce, hrudní infekce, nedostatek energie hypernatrémie dehydratace,
Acidobazická rovnováha - jasně a jednoduše
 Acidobazická rovnováha - jasně a jednoduše Michal Horáček KARIM 2. LF UK v FNM Praha ph, resp. a[h + ] rovnice 4. řádu: 3 nezávisle proměnné, 5 rychlostních konstant po zjednodušení: Acidobazická rovnováha
Acidobazická rovnováha - jasně a jednoduše Michal Horáček KARIM 2. LF UK v FNM Praha ph, resp. a[h + ] rovnice 4. řádu: 3 nezávisle proměnné, 5 rychlostních konstant po zjednodušení: Acidobazická rovnováha
Seznam vyšetření biochemie a hematologie
 Seznam vyšetření biochemie a hematologie BIOCHEMICKÁ VYŠETŘENÍ NÁZEV: Glukosa POUŽITÍ: Stanovení koncentrace glukosy v séru (plazmě) a v moči JEDNOTKY KONCENTRACE: mmol/l (sérum, plazma) g% (sbíraná moč)
Seznam vyšetření biochemie a hematologie BIOCHEMICKÁ VYŠETŘENÍ NÁZEV: Glukosa POUŽITÍ: Stanovení koncentrace glukosy v séru (plazmě) a v moči JEDNOTKY KONCENTRACE: mmol/l (sérum, plazma) g% (sbíraná moč)
Soli. ph roztoků solí - hydrolýza
 Soli Soli jsou iontové sloučeniny vzniklé neutralizační reakcí. Např. NaCl je sůl vzniklá reakcí kyseliny HCl a zásady NaOH. Př.: Napište neutralizační reakce jejichž produktem jsou CH 3 COONa, NaCN, NH
Soli Soli jsou iontové sloučeniny vzniklé neutralizační reakcí. Např. NaCl je sůl vzniklá reakcí kyseliny HCl a zásady NaOH. Př.: Napište neutralizační reakce jejichž produktem jsou CH 3 COONa, NaCN, NH
Klasické nebo Stewartovo hodnocení poruch ABR?
 Klasické nebo Stewartovo hodnocení poruch ABR? Neboli naše mezery v acidobazi M. Kratochvíl, KARIM FN Brno Definice ph: záporný dekadický logaritmus koncentrace oxoniových iontů (40 nmol/l) Kyselina: donor
Klasické nebo Stewartovo hodnocení poruch ABR? Neboli naše mezery v acidobazi M. Kratochvíl, KARIM FN Brno Definice ph: záporný dekadický logaritmus koncentrace oxoniových iontů (40 nmol/l) Kyselina: donor
Klinická fyziologie ABR sekce Základy oboru edukační lekce. Michal Horáček KARIM 2. LF UK a FN v Motole Praha
 Klinická fyziologie ABR sekce Základy oboru edukační lekce Michal Horáček KARIM 2. LF UK a FN v Motole Praha Hlavní ukazatel ABR: ph (resp. a[h + ]) ph = pondus hydrogenii, potential of hydrogen = vodíkový
Klinická fyziologie ABR sekce Základy oboru edukační lekce Michal Horáček KARIM 2. LF UK a FN v Motole Praha Hlavní ukazatel ABR: ph (resp. a[h + ]) ph = pondus hydrogenii, potential of hydrogen = vodíkový
Seznam vyšetření biochemie a hematologie
 Seznam vyšetření biochemie a hematologie BIOCHEMIE NÁZEV: Glukosa POUŽITÍ: Stanovení koncentrace glukosy v séru (plazmě) a v moči JEDNOTKY KONCENTRACE: mmol/l (sérum, plazma) g% (sbíraná moč) g (odpad
Seznam vyšetření biochemie a hematologie BIOCHEMIE NÁZEV: Glukosa POUŽITÍ: Stanovení koncentrace glukosy v séru (plazmě) a v moči JEDNOTKY KONCENTRACE: mmol/l (sérum, plazma) g% (sbíraná moč) g (odpad
9. Poruchy metabolismu draslíku 14. Acidózy 15. Alkalózy. Draslík ) Regulace K mezi tělem a zevním prostředím
 9. Poruchy metabolismu draslíku 14. Acidózy 15. Alkalózy Prof. MUDr. Zuzana Kubová, CSc. Ústav patologické fyziologie, Lékařská fakulta UK v Hradci Králové Draslík K hl. ICT kation 160 mmol/l konc. v séru
9. Poruchy metabolismu draslíku 14. Acidózy 15. Alkalózy Prof. MUDr. Zuzana Kubová, CSc. Ústav patologické fyziologie, Lékařská fakulta UK v Hradci Králové Draslík K hl. ICT kation 160 mmol/l konc. v séru
Infúze Homeostáza Tělesné tekutiny: Intracelulární Extracelulární intravaskulární extravaskulární Elektrolyty kationty anionty
 Infúze Tekutiny a minerály pro zdraví člověka nezbytné. Homeostáza = udržována tekutinami a elektrolyty. Narušení při např. vysoké tělesné námaze, průjmech, u malých dětí a starých, vyšší teplota, nedostatečná
Infúze Tekutiny a minerály pro zdraví člověka nezbytné. Homeostáza = udržována tekutinami a elektrolyty. Narušení při např. vysoké tělesné námaze, průjmech, u malých dětí a starých, vyšší teplota, nedostatečná
Hospodaření s vodou a minerály, ledviny, moč. Helena Brodská
 ZÁKLADY OBECNÉ A KLINICKÉ BIOCHEMIE 2004 Hospodaření s vodou a minerály, ledviny, moč Helena Brodská kapitola ve skriptech - 3.7 Tělesná voda-rozložení Celková tělesná voda /CTV/ 55-60% hmotnosti organismu.
ZÁKLADY OBECNÉ A KLINICKÉ BIOCHEMIE 2004 Hospodaření s vodou a minerály, ledviny, moč Helena Brodská kapitola ve skriptech - 3.7 Tělesná voda-rozložení Celková tělesná voda /CTV/ 55-60% hmotnosti organismu.
Pavel Suk ARK, FN u svatéanny v Brně
 Pavel Suk ARK, FN u svatéanny v Brně anamnéza, klinika jaká porucha ABR je nejpravděpodobnější? vyvolávající porucha? jiné příčiny? smíšené poruchy ABR kompenzace? je adekvátní? klinická významnost? dynamika?
Pavel Suk ARK, FN u svatéanny v Brně anamnéza, klinika jaká porucha ABR je nejpravděpodobnější? vyvolávající porucha? jiné příčiny? smíšené poruchy ABR kompenzace? je adekvátní? klinická významnost? dynamika?
2 Roztoky elektrolytů. Osmotický tlak
 Roztoky elektrolytů. Osmotický tlak 1. Doplněním uvedených schémat vyjádřete rozdílné chování různých typů látek po jejich rozpuštění ve vodě. Použijte symboly AB(aq), A + (aq), B - (aq). [s pevná fáze,
Roztoky elektrolytů. Osmotický tlak 1. Doplněním uvedených schémat vyjádřete rozdílné chování různých typů látek po jejich rozpuštění ve vodě. Použijte symboly AB(aq), A + (aq), B - (aq). [s pevná fáze,
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.: sukls40076/2007. Souhrn údajů o přípravku
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.: sukls40076/2007 1. NÁZEV PŘÍPRAVKU Hartmann s solution BP Fresenius Infuzní roztok Souhrn údajů o přípravku 2.SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.: sukls40076/2007 1. NÁZEV PŘÍPRAVKU Hartmann s solution BP Fresenius Infuzní roztok Souhrn údajů o přípravku 2.SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ
Homeostáza vody a iontů
 Homeostáza vody a iontů 1 Homeostasa Je stálost vnitřního prostředí Tělesna teplota distribuce vody ph Koncentrace iontů, glukosy, Základní regulační mechanismus je zpětná vazba 2 3 Voda v lidském těle
Homeostáza vody a iontů 1 Homeostasa Je stálost vnitřního prostředí Tělesna teplota distribuce vody ph Koncentrace iontů, glukosy, Základní regulační mechanismus je zpětná vazba 2 3 Voda v lidském těle
Toxické metabolity glykolaldehyd, kys. glykolová, kys. glyoxylová, kys. štavelová
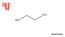 Marek Protuš C 2 H 6 O 2 Alkohol 1,2-ethandiol bezbarvá viskózní tekutina nasládlé chuti netoxický Molární hmotnost 62,068 g/mol Teplota tání 12,9 C Teplota varu 197,3 C Hustota 1,113 g/cm 3 Rozpustnost
Marek Protuš C 2 H 6 O 2 Alkohol 1,2-ethandiol bezbarvá viskózní tekutina nasládlé chuti netoxický Molární hmotnost 62,068 g/mol Teplota tání 12,9 C Teplota varu 197,3 C Hustota 1,113 g/cm 3 Rozpustnost
Vnitřní rozdělení tělních tekutin
 Vnitřní prostředí Spolu s krevním oběhem, plícemi, ledvinami zajišťuje tkáním přísun kyslíku, živin a odsun katabolitů regulace osmolality,, iontového složení, acidobazické rovnováhy a teploty normální
Vnitřní prostředí Spolu s krevním oběhem, plícemi, ledvinami zajišťuje tkáním přísun kyslíku, živin a odsun katabolitů regulace osmolality,, iontového složení, acidobazické rovnováhy a teploty normální
Acido-bázická rovnováha (ABR)
 1 Acido-bázická rovnováha (ABR) Vladimír Kollárik II. klinika anestéziológie a intenzívnej medicíny Fakultná nemocnica s poliklinikou F. D. Roosevelta Banská Bystrica CEEA 2017 Košice, 2 3 Prečo je dôležitý
1 Acido-bázická rovnováha (ABR) Vladimír Kollárik II. klinika anestéziológie a intenzívnej medicíny Fakultná nemocnica s poliklinikou F. D. Roosevelta Banská Bystrica CEEA 2017 Košice, 2 3 Prečo je dôležitý
 Renální tubulární acidózy Akutní selhání ledvin Prerenální syndrom je dán schopností ledvin udržet v organismu sůl a vodu tváří v tvář zaznamenané hypoperfúzi ledvin. Při obnovení renální hemodynamiky
Renální tubulární acidózy Akutní selhání ledvin Prerenální syndrom je dán schopností ledvin udržet v organismu sůl a vodu tváří v tvář zaznamenané hypoperfúzi ledvin. Při obnovení renální hemodynamiky
Infúze. Markéta Vojtová. VOŠZ a SZŠ Hradec Králové
 Infúze Markéta Vojtová VOŠZ a SZŠ Hradec Králové Infúze Podání většího množství tekutin parenterální cestou Tekutiny Léky Elektrolyty Vitamíny Nutrice Úpravy ABR Doplnění cirkulujícího objemu tekutin Vyvolání
Infúze Markéta Vojtová VOŠZ a SZŠ Hradec Králové Infúze Podání většího množství tekutin parenterální cestou Tekutiny Léky Elektrolyty Vitamíny Nutrice Úpravy ABR Doplnění cirkulujícího objemu tekutin Vyvolání
Seznam vyšetření biochemie a hematologie
 Seznam vyšetření biochemie a hematologie BIOCHEMIE NÁZEV: Glukosa POUŽITÍ: Stanovení koncentrace glukosy v séru (plazmě) a v moči JEDNOTKY KONCENTRACE: mmol/l (sérum, plazma) g% (sbíraná moč) g (odpad
Seznam vyšetření biochemie a hematologie BIOCHEMIE NÁZEV: Glukosa POUŽITÍ: Stanovení koncentrace glukosy v séru (plazmě) a v moči JEDNOTKY KONCENTRACE: mmol/l (sérum, plazma) g% (sbíraná moč) g (odpad
Vybrané klinicko-biochemické hodnoty
 Vybrané klinicko-biochemické hodnoty Obecným výsledkem laboratorního vyšetření je naměřená hodnota, která může být fyziologická, zvýšená či snížená. Abychom zjištěnou hodnotu mohli takto zařadit, je třeba
Vybrané klinicko-biochemické hodnoty Obecným výsledkem laboratorního vyšetření je naměřená hodnota, která může být fyziologická, zvýšená či snížená. Abychom zjištěnou hodnotu mohli takto zařadit, je třeba
Zpět k základům: poruchy acidobazické rovnováhy a vnitřního prostředí u komplikovaného pacienta Antonín Jabor, Janka Franeková
 Zpět k základům: poruchy acidobazické rovnováhy a vnitřního prostředí u komplikovaného pacienta Antonín Jabor, Janka Franeková PLM IKEM a 3. LF, UK Praha 7.10. 08:50 7.10 12:17 7.10. 16:44 8.10. 02:00
Zpět k základům: poruchy acidobazické rovnováhy a vnitřního prostředí u komplikovaného pacienta Antonín Jabor, Janka Franeková PLM IKEM a 3. LF, UK Praha 7.10. 08:50 7.10 12:17 7.10. 16:44 8.10. 02:00
Funkční anatomie ledvin Clearance
 Funkční anatomie ledvin Clearance doc. MUDr. Markéta Bébarová, Ph.D. Fyziologický ústav Lékařská fakulta Masarykovy univerzity Tato prezentace obsahuje pouze stručný výtah nejdůležitějších pojmů a faktů.
Funkční anatomie ledvin Clearance doc. MUDr. Markéta Bébarová, Ph.D. Fyziologický ústav Lékařská fakulta Masarykovy univerzity Tato prezentace obsahuje pouze stručný výtah nejdůležitějších pojmů a faktů.
Pufry, pufrační kapacita. Oxidoredukce, elektrodové děje.
 ÚSTAV LÉKAŘSKÉ BIOCHEMIE A LABORATORNÍ DIAGNOSTIKY 1. LF UK Pufry, pufrační kapacita. Oxidoredukce, elektrodové děje. Praktické cvičení z lékařské biochemie Všeobecné lékařství Martin Vejražka, Tomáš Navrátil
ÚSTAV LÉKAŘSKÉ BIOCHEMIE A LABORATORNÍ DIAGNOSTIKY 1. LF UK Pufry, pufrační kapacita. Oxidoredukce, elektrodové děje. Praktické cvičení z lékařské biochemie Všeobecné lékařství Martin Vejražka, Tomáš Navrátil
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls43951/2010
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls43951/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hydrogenuhličitan sodný 4,2% (w/v) - BRAUN infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls43951/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hydrogenuhličitan sodný 4,2% (w/v) - BRAUN infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ
ECT = tekutina mimo buňky ICT = tekutina v buňkách
 DRASLÍ ( i sodík ) VE ZDRAVÍ A NEMOCI seminář pro U3V Ondřej Veselý Ústav patologické fyziologie LF UP Dětská endokrinologická ambulance Svitavy 1 Zastoupení + v organismu 98% draslíku je v buňkách nejvýznamnější
DRASLÍ ( i sodík ) VE ZDRAVÍ A NEMOCI seminář pro U3V Ondřej Veselý Ústav patologické fyziologie LF UP Dětská endokrinologická ambulance Svitavy 1 Zastoupení + v organismu 98% draslíku je v buňkách nejvýznamnější
Hydrochemie Oxid uhličitý a jeho iontové formy, ph, NK
 1 Oxid uhličitý - CO 2 původ: atmosférický - neznečištěný vzduch 0,03 obj. % CO 2 biogenní aerobní a anaerobní rozklad OL hlubinný magma, termický rozklad uhličitanových minerálů, rozklad uhličitanových
1 Oxid uhličitý - CO 2 původ: atmosférický - neznečištěný vzduch 0,03 obj. % CO 2 biogenní aerobní a anaerobní rozklad OL hlubinný magma, termický rozklad uhličitanových minerálů, rozklad uhličitanových
Ztráty minerálů a možnosti ovlivnění eliminačních cest. František Novák 4. interní klinika VFN a 1. LF UK v Praze
 Ztráty minerálů a možnosti ovlivnění eliminačních cest František Novák 4. interní klinika VFN a 1. LF UK v Praze Main Diagnoses in HPN Patients mmol/l Distribuce vody a elektrolytů v lidském těle mmol
Ztráty minerálů a možnosti ovlivnění eliminačních cest František Novák 4. interní klinika VFN a 1. LF UK v Praze Main Diagnoses in HPN Patients mmol/l Distribuce vody a elektrolytů v lidském těle mmol
Cca případu ročně. Zvolit si způsob. Detailně plánovat. Moc se tím nechlubit. Držet se plánu. Soukromí. Štěstí
 Lucky Losers Cca 1 300 případu ročně Zvolit si způsob Detailně plánovat Moc se tím nechlubit Držet se plánu Soukromí Štěstí Příběhy obyčejného šílenství lidí, kteří to přežili, aby to zkusili znovu a
Lucky Losers Cca 1 300 případu ročně Zvolit si způsob Detailně plánovat Moc se tím nechlubit Držet se plánu Soukromí Štěstí Příběhy obyčejného šílenství lidí, kteří to přežili, aby to zkusili znovu a
[ ] d[ Y] rychlost REAKČNÍ KINETIKA X Y
![[ ] d[ Y] rychlost REAKČNÍ KINETIKA X Y [ ] d[ Y] rychlost REAKČNÍ KINETIKA X Y](/thumbs/78/77051926.jpg) REAKČNÍ KINETIKA Faktory ovlivňující rychlost chemických reakcí Chemická povaha reaktantů - reaktivita Fyzikální stav reaktantů homogenní vs. heterogenní reakce Teplota 10 C zvýšení rychlosti 2x 3x zýšení
REAKČNÍ KINETIKA Faktory ovlivňující rychlost chemických reakcí Chemická povaha reaktantů - reaktivita Fyzikální stav reaktantů homogenní vs. heterogenní reakce Teplota 10 C zvýšení rychlosti 2x 3x zýšení
sp.zn. sukls270988/2012
 sp.zn. sukls270988/2012 1. NÁZEV PŘÍPRAVKU Hartmann s solution BP Fresenius Infuzní roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml obsahuje: Léčivé látky: Natrii chloridum
sp.zn. sukls270988/2012 1. NÁZEV PŘÍPRAVKU Hartmann s solution BP Fresenius Infuzní roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml obsahuje: Léčivé látky: Natrii chloridum
FAKULTA ZDRAVOTNICKÝCH STUDIÍ
 FAKULTA ZDRAVOTNICKÝCH STUDIÍ Studijní program: Specializace ve zdravotnictví (B5345) Jakub Draský Studijní obor: Zdravotní laborant (5345R020) OTRAVY OSMOTICKY AKTIVNÍMI LÁTKAMI Bakalářská práce Vedoucí
FAKULTA ZDRAVOTNICKÝCH STUDIÍ Studijní program: Specializace ve zdravotnictví (B5345) Jakub Draský Studijní obor: Zdravotní laborant (5345R020) OTRAVY OSMOTICKY AKTIVNÍMI LÁTKAMI Bakalářská práce Vedoucí
DIAGNÓZA JEDNODUCHÝCH A SMÍŠ ÍŠENÝCH PORUCH ACIDOBAZICKÉ ROVNOVÁHY. A. Kazda. Katedra klinické biochemie, IPVZ Praha UKBLD 1.
 DIAGNÓZA JEDNODUCHÝCH A SMÍŠ ÍŠENÝCH PORUCH ACIDOBAZICKÉ ROVNOVÁHY A. Kazda Katedra klinické biochemie, IPVZ Praha UKBLD 1. LF UK a VFN Záznamový list acidobazické regulace Graf acidobazické regulace (M.
DIAGNÓZA JEDNODUCHÝCH A SMÍŠ ÍŠENÝCH PORUCH ACIDOBAZICKÉ ROVNOVÁHY A. Kazda Katedra klinické biochemie, IPVZ Praha UKBLD 1. LF UK a VFN Záznamový list acidobazické regulace Graf acidobazické regulace (M.
HYPOKALÉMIE, HYPERKALÉMIE A DALŠÍ METABOLICKÉ PŘÍČINY ZÁSTAVY OBĚHU. Jiří Chvojka JIP I.interní kliniky FN a LF UK v Plzni
 HYPOKALÉMIE, HYPERKALÉMIE A DALŠÍ METABOLICKÉ PŘÍČINY ZÁSTAVY OBĚHU Jiří Chvojka JIP I.interní kliniky FN a LF UK v Plzni 4 T? Hypoterm ie? Hypoxi e? Hypovolémi e? Sakra, co tam ještě bylo za H? DRASLÍK
HYPOKALÉMIE, HYPERKALÉMIE A DALŠÍ METABOLICKÉ PŘÍČINY ZÁSTAVY OBĚHU Jiří Chvojka JIP I.interní kliniky FN a LF UK v Plzni 4 T? Hypoterm ie? Hypoxi e? Hypovolémi e? Sakra, co tam ještě bylo za H? DRASLÍK
Biochemická vyšetření krve. Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje
 Biochemická vyšetření krve Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Bc. Hrušková Jindřiška duben 2009 Biochemická vyšetření krve 1. část Biochemická
Biochemická vyšetření krve Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Bc. Hrušková Jindřiška duben 2009 Biochemická vyšetření krve 1. část Biochemická
SCHVÁLENO SL \TN STĺ-\\! PRO kontrolu LĚČ\J. Příloha č. 2 k rozhodnutí o změně registrace sp.zn.suk1s44379/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.suk1s44379/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU SL \TN STĺ-\\! PRO kontrolu LĚČ\J SCHVÁLENO I 2-05- 2010 1. NÁZEV PŘÍPRAVKU Hydrogenuhličitan sodný 8,4% (w/v)
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.suk1s44379/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU SL \TN STĺ-\\! PRO kontrolu LĚČ\J SCHVÁLENO I 2-05- 2010 1. NÁZEV PŘÍPRAVKU Hydrogenuhličitan sodný 8,4% (w/v)
 OBECNÁ CHEMIE František Zachoval CHEMICKÉ ROVNOVÁHY 1. Rovnovážný stav, rovnovážná konstanta a její odvození Dlouhou dobu se chemici domnívali, že jakákoliv chem.
OBECNÁ CHEMIE František Zachoval CHEMICKÉ ROVNOVÁHY 1. Rovnovážný stav, rovnovážná konstanta a její odvození Dlouhou dobu se chemici domnívali, že jakákoliv chem.
Acidobazická rovnováha
 Acidobazická rovnováha... přístupy Motol, 2019-04-16 Jak to vypadá v realitě? pouze arteriální odběry 15 000 nálezů ABL 800 Radiometer BEECT ABIC APH ACO2 7,8 18 7,6 7,4 7,2 16 14 12 10 7,0 8 6,8 6,6 6,4
Acidobazická rovnováha... přístupy Motol, 2019-04-16 Jak to vypadá v realitě? pouze arteriální odběry 15 000 nálezů ABL 800 Radiometer BEECT ABIC APH ACO2 7,8 18 7,6 7,4 7,2 16 14 12 10 7,0 8 6,8 6,6 6,4
Krev přednáška 1 fyzioterapie
 Krev přednáška 1 fyzioterapie Mgr. Helena Smítková Krev I 1 Krev Suspenze formovaných krevních elementů v plasmě (RBC, WBC, TRO) Dospělý 4,5-6 litrů (7-10% hmotnosti) Transport: O2, CO2, živiny glc, AK,
Krev přednáška 1 fyzioterapie Mgr. Helena Smítková Krev I 1 Krev Suspenze formovaných krevních elementů v plasmě (RBC, WBC, TRO) Dospělý 4,5-6 litrů (7-10% hmotnosti) Transport: O2, CO2, živiny glc, AK,
2. PROTOLYTICKÉ REAKCE
 2. PROTOLYTICKÉ REAKCE Protolytické reakce představují všechny reakce spojené s výměnou protonů a jsou označovány jako reakce acidobazické. Teorie Arrheniova (1884): kyseliny disociují ve vodě na vodíkový
2. PROTOLYTICKÉ REAKCE Protolytické reakce představují všechny reakce spojené s výměnou protonů a jsou označovány jako reakce acidobazické. Teorie Arrheniova (1884): kyseliny disociují ve vodě na vodíkový
ĹHÁj 1. NÁZEV PŘÍPRAVKU. .J1JNiUSV Pi<D 10 TCL Llčp (
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn. suklss7lo/009 - a příloha k sp. Zfl. sukls93l 1/008 SOUHRN ÚDAJŮ O PŘÍPRAVKU.J1JNiUSV Pi
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn. suklss7lo/009 - a příloha k sp. Zfl. sukls93l 1/008 SOUHRN ÚDAJŮ O PŘÍPRAVKU.J1JNiUSV Pi
Acidobazická rovnováha pro pokročilé. František Duška KAR FNKV
 Acidobazická rovnováha pro pokročilé František Duška KAR FNKV 28 letý muž, alkoholik. Přichází pro 3 dny trvající zvracení. Zmatený, tachykardie 134/min, jinak ale hemodynamicky stabilní, fyzikální nález
Acidobazická rovnováha pro pokročilé František Duška KAR FNKV 28 letý muž, alkoholik. Přichází pro 3 dny trvající zvracení. Zmatený, tachykardie 134/min, jinak ale hemodynamicky stabilní, fyzikální nález
Autoři: Jan Sítař a Dominik Mališ Školitel: MVDr. Jana Petrášová, Ph.D. IVA 2014 FVL/1200/004 Modelové patomechanizmy v interaktivním powerpointu
 Patofyziologické mechanismy šoku Autoři: Jan Sítař a Dominik Mališ Školitel: MVDr. Jana Petrášová, Ph.D. IVA 2014 FVL/1200/004 Modelové patomechanizmy v interaktivním powerpointu Šok Klinický syndrom projevující
Patofyziologické mechanismy šoku Autoři: Jan Sítař a Dominik Mališ Školitel: MVDr. Jana Petrášová, Ph.D. IVA 2014 FVL/1200/004 Modelové patomechanizmy v interaktivním powerpointu Šok Klinický syndrom projevující
Zásadité versus kyselé - mýty a fakta
 Masarykova univerzita v Brně Lékařská fakulta Zásadité versus kyselé - mýty a fakta Bakalářská práce v oboru Nutriční terapeut Vedoucí bakalářské práce: Mgr. Veronika Březková Autor: Dagmar Pifková Brno
Masarykova univerzita v Brně Lékařská fakulta Zásadité versus kyselé - mýty a fakta Bakalářská práce v oboru Nutriční terapeut Vedoucí bakalářské práce: Mgr. Veronika Březková Autor: Dagmar Pifková Brno
ŘEŠENÍ KONTROLNÍHO TESTU ŠKOLNÍHO KOLA
 Ústřední komise Chemické olympiády 48. ročník 2011/2012 ŠKOLNÍ KOLO kategorie C ŘEŠENÍ KONTROLNÍHO TESTU ŠKOLNÍHO KOLA KONTROLNÍ TEST ŠKOLNÍHO KOLA (60 BODŮ) Úloha 1 Neznámý nerost 21 bodů 1. Barva plamene:
Ústřední komise Chemické olympiády 48. ročník 2011/2012 ŠKOLNÍ KOLO kategorie C ŘEŠENÍ KONTROLNÍHO TESTU ŠKOLNÍHO KOLA KONTROLNÍ TEST ŠKOLNÍHO KOLA (60 BODŮ) Úloha 1 Neznámý nerost 21 bodů 1. Barva plamene:
MODELOVÁNÍ PŘENOSU KREVNÍCH PLYNŮ A ACIDOBAZICKÉ ROVNOVÁHY KRVE
 MODELOVÁNÍ PŘENOSU KREVNÍCH PLYNŮ A ACIDOBAZICKÉ ROVNOVÁHY KRVE Jiří Kofránek, Michal Andrlík, Jan Bruthans Anotace Autoři popisují svůj originální přístup k modelování acidobazické rovnováhy krve a přenosu
MODELOVÁNÍ PŘENOSU KREVNÍCH PLYNŮ A ACIDOBAZICKÉ ROVNOVÁHY KRVE Jiří Kofránek, Michal Andrlík, Jan Bruthans Anotace Autoři popisují svůj originální přístup k modelování acidobazické rovnováhy krve a přenosu
